- Скачать инструкцию медикамента
Торговое название
Тиофлекс
Международное непатентованное название
Тиоколхикозид
Лекарственная форма
Таблетки 8 мг
Состав
Одна таблетка содержит
активное вещество: тиоколхикозид 8 мг;
вспомогательные вещества: микрокристаллическая целлюлоза, лактозы моногидрат, крахмал модифицированный (Прежелатинированный крахмал),
коповидон (Коллидон VA64), магния стеарат, кремния диоксид коллоидный.
Описание
Таблетки желтого цвета, круглой формы, с двояковыпуклой поверхностью, с риской на одной стороне и маркировкой «8» – на другой.
Фармакотерапевтическая группа
Миорелаксанты центрального действия другие.
Код АТХ M03BX05
Фармакологические свойства
Фармакокинетика
После орального применения тиоколхикозид быстро абсорбируется. Он имеет три метаболита. Две главные формы в циркуляции: тиоколхикозид агликон и глюкуронидное производное тиоколхикозида, которое является активным метаболитом. Активное глюкуронидное производное тиоколхикозида также наблюдается после внутримышечного введения.
Тиоколхикозид связывается с белками сыворотки крови человека (13%) слабо, и это не зависит от терапевтической концентрации тиоколхикозида; сывороточный альбумин играет основную роль в связывании белков сыворотки.
Активное глюкуронидное производное быстро наблюдалось в плазме крови со средним Tmax 1 час. После перорального приема 8 мг разовой дозы тиоколхикозида, средняя площадь под кривой линией (AUC), отражающая воздействие позиции тиоколхикозида и активного метаболита глюкуронида на активные компоненты составляет примерно 500 нг.час/мл. После перорального приема 8 мг разовой дозы тиоколхикозида, средняя площадь под кривой линией (AUC), отражающая воздействие позиции активного метаболита глюкуронида на активные компоненты составляет примерно 126 нг.час / мл.
Видимый объем распределения и общий клиренс тиоколхикозида составляют приблизительно 43 л/час и 19 л/час соответственно.
Биотрансформация: Две главные формы в циркуляции: тиоколхикозид агликон и глюкуронидное производное тиоколхикозида, которое является активным метаболитом. Активное глюкуронидное производное тиоколхикозида также наблюдается после внутримышечного введения.
Тиоколхикозид не был определен таким образом после перорального приема у здоровых.
Активный глюкуронид метаболит быстро наблюдается в плазме крови.
У здоровых тиоколхикозид выводится со средним окончательным полувыведением примерно 7 часов после орального применения.
После орального применения C14radioactive тиоколхикозида, 79% принятой дозы обнаружено в фекалиях и 20% в моче.
Фармакодинамика
Тиоколхикозид – активное вещество препарата ТиоФлекс является полусинтетическим веществом натурального псевдоалкалоида колхицина и серы. Оказывает миорелаксирующее действие (мышечный релаксант). Тиоколхикозид связывается только с ГАМК и глицинергическими рецепторами, чувствительными к стрихнину в ин-витро исследованиях. Тиоколхикозид, действующий как антагонист ГАМК-рецептора может оказывать свое эффективное миорелаксирующее действие с помощью регуляторных комплексных механизмов на супраспинальном уровне, однако, его глицинергические механизмы действия не могут быть исключены. Характеристики взаимодействия тиоколхикозида с ГАМК рецепторами, такие же, как и с производным глюкуронида, которое является основным метаболитом в кровотоке в качественном и количественном выражении.
Миорелаксирующие характеристики тиоколхикозида и его главного метаболита были продемонстрированы в нескольких экспериментальных моделях, проведенных in vivo. Отсутствие миорелаксирующего эффекта тиоколхикозида показывает, что это соединение имеет доминантное супраспинальное действие.
Также, электроэнцефалографические исследования показали, что тиоколхикозид и его главный метаболит не вызывают седативного эффекта.
Показания к применению
Тиоколхикозид показан при симптоматическом лечении болезненных мышечных спазмов.
Способ применения и дозы
Взрослым по 1 таблетке (8 мг) два раза в день.
Максимальная суточная доза 16 мг.
Длительность лечения 5 – 7 дней.
Только для перорального применения. Таблетки необходимо принимать на полный желудок, запивая некоторым количеством воды.
Если после перорального применения появилась диарея, дозу следует снизить.
Побочные действия
Редко
— анафилактические реакции как зуд, уртикарий и ангионевротический отек
— сонливость
— вазовагальный обморок, гипотензия
— временная спутанность сознания, возбуждение
— тошнота, рвота, диарея, гастралгия
Очень редко
— анафилактический шок
Противопоказания
— пациентам с повышенной чувствительностью к тиоколхикозиду или другим веществам в составе препарата,
— при вялом параличе и гипотонии мышц
— пациентам с проблемами кровотечения и получающих антикоагулянтное лечение
— беременность и период лактации
— детский возраст до 18 лет
Лекарственные взаимодействия
Совместное использование тиоколхикозида с другими миорелаксантами не рекомендуется, поскольку они могут увеличить эффекты друг друга. По этой же самой причине; при совместном использовании с другими препаратами, эффективными на гладких мускулатурах, необходимо сделать предостережение по случаю вероятности увеличения частоты побочных воздействий, и пациент должен быть проверен.
Тиоколхикозид не должен использоваться вместе с антикоагулянтами.
Особые указания
Если после перорального применения появилась диарея, дозу следует снизить.
— пациенты с редкими наследственными нарушениями непереносимости галактозы, недостатком лактазы Лаппа или с проблемами нарушения всасывания глюкозы—галактозы не должны использовать этот препарат.
Тиоколхикозид может спровоцировать эпилептический припадок у пациентов с эпилепсией или с риском эпилептического припадка.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Рекомендуется соблюдать осторожность при назначении препарата лицам, работа которых ребует быстрой психической и физической реакции.
Передозировка
Данных о передозировке нет.
Симптомы: возможно усиление побочных действий.
Лечение: симптоматическая и поддерживающая терапия.
Форма выпуска и упаковка
По 10 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой.
По 2 контурные упаковки вместе с инструкцией по медицинскому применению на государственном и русском языках в картонную пачку.
Условия хранения
Хранить при температуре не выше 25 0С.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Санта Фарма Илач Санаи А.Ш.
34382 Шишли- Стамбул, Турция
Наименование и страна владельца регистрационного удостоверения
Берксам Илач Тиджарет А.Ш., Турция
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
ТОО «Фармактив»
050010, Республика Казахстан, г. Алматы, ул. Карасай батыра, 1А
Тел/факс: +7 727 291 81 00
e-mail: info@farmaktiv.com
Торговое название
ТИОЗИД® 8
Международное непатентованное название
Тиоколхикозид
Лекарственная форма
Таблетки
Состав
Одна таблетка содержит
Активное вещество – тиоколхикозид 4 мг и 8 мг,
Вспомогательные вещества: коллидон (VA 64), лактозы моногидрат, крахмалпрежелатинизированный, микрокристаллическая целлюлоза РН 102, кремния диоксидколлоидный, натрия стеарил фумарат.
Описание
Круглые, двояковыпуклые таблеткижелтого цвета (для дозировки 4 мг).
Круглые таблетки желтого цвета, сплоской поверхностью, с двухсторонней фаской и с риской на одной стороне(для дозировки 8 мг).
Фармакотерапевтическая группа
Миорелаксанты центрального действия другие. Тиоколхикозид.
Код АТХ М03ВХ05
Фармакологические свойства
Фармакокинетика
Всасывание: При приемевнутрь ТИОЗИД быстро распределяется в крови, пик концентрации в плазме кровидостигается через 15-45 мин. Максимальная концентрация в плазме составляет 61нг/мл.
Распределение: Связываниес белками плазмы крови составляет 13%. Тиоколхикозид связывается с альбумином.
Метаболизм: Периодполувыведения составляет 2,5-5 ч. В процессе метаболизма образуются 3метаболита, 2 из которых определяются в сыворотке крови – агликон и активноеглюкуронизированное производное тиоколхикозида.
Выведение: Приблизительно20% принятой дозы экскретируется с мочой в виде неизмененных метаболитов,75-81% выводится с фекалиями.
Фармакодинамика
ТИОЗИД — полусинтетическиймышечный релаксант, получаемый из натурального гликозида колхикозида.
Препарат проявляет селективнуюаффинность к гамма-аминомасляной кислоте (ГАМК) и глицинергическим рецепторам.Доказательством активности этого мышечного релаксанта можно считать результатпрямой активации рецепторов ГАМК на уровне спинного мозга.
Глициномиметический эффект ТИОЗИДАможно наблюдать на различных уровнях нервной системы, как при спазмах местногохарактера, так и при спастическихспазмах центрального происхождения.
Препарат не оказываеткурареподобного влияния, не вызывает паралич и не угнетает дыхание. Кроме того, препарат не оказывает какого-либо влияния на кардиоваскулярную систему.
Показания к применению
ТИОЗИД показан присимптоматическом лечении болезненных мышечных спазмов
Способ применения и дозы
Взрослым
по 4-8 мг два раза в день послееды.
Максимальная разовая доза 8 мг.
Максимальная суточная доза 16 мг.
Рекомендуемый курс терапии 5-7дней.
Применение в комбинации собезболивающей физиотерапией за 30-40 мин до процедуры оказывает болеевыраженный лечебный эффект.
Предупреждение/предосторожности
При возникновении диареи можноуменьшить дозу до 4 мг в день.
Побочные действия
Редко
— анафилактические реакции какзуд, уртикарий и ангионевротический отек
— сонливость
— вазовагальный обморок,гипотензия
— временная спутанность сознания,возбуждение
— тошнота, рвота, диарея,гастралгия
Очень редко
— анафилактический шок
— временная спутанность сознания,возбуждение, раздражительность
Противопоказания
— повышенная чувствительность к тиоколхикозиду или другому веществу,входящему в состав препарата
— гипотония мышц и вялый паралич/парез
— одновременный прием антикоагулянтов ипредрасположенность к кровоизлияниям
— наследственная непереносимость лактозы, дефицитфермента Lapp-лактазы,мальабсорбция глюкозы-галактозы
— беременностьи период лактации
— детскийвозраст до 18 лет
Лекарственные взаимодействия
Данных олекарственном взаимодействии нет. Однако рекомендуется соблюдать осторожностьпри одновременном приеме с препаратами, имеющими такое же терапевтическоедействие.
Одновременное применениепрепарата ТИОЗИД и препаратов,обладающих угнетающим действием на центральную нервную систему (в том числебарбитураты, транквилизаторы и антигистаминные средства), а также алкоголя,может приводить к усилению этого действия.
Приодновременном применении с антикоагулянтами повышается риск кровотечений.
Особые указания
При нарушении функции печени коррекции дозыТИОЗИДа не требуется, так как препарат не метаболизируется в печени.
При нарушении функции почек рекомендуютсянизкие дозы препарата.
Тиозид может спровоцировать эпилептическийприпадок у пациентов с эпилепсией или с риском эпилептического припадка.
Особенности влияния лекарственного средствана способность управлять транспортным средством или потенциально опаснымимеханизмами
Необходимо соблюдатьосторожность при управлении автотранспортом или механизмами, требующимиконцентрации внимания.
Передозировка
Случаев передозировки приприменении препарата до настоящего времени не зарегистрировано. Можнопредположить, что основными проявлениями передозировки были бы токсическиеэффекты со стороны желудочно-кишечного тракта.
Лечение: симптоматическое. Специфических антидотов не существует.
Форма выпуска и упаковка
По 10 таблеток помещают в контурную ячейковую упаковку из пленкибелой непрозрачной ПВХ/ПЭ/ПВДХ и фольги алюминиевой печатной.
По 1, 2 или 3 контурных упаковок вместе с инструкцией по медицинскомуприменению на государственном и русском языках помещают в пачку картонную сголограммой фирмы – производителя
Условия хранения
Хранить при температуре не выше 25 0С, в сухом, защищенномот света месте.
Хранить в недоступном для детейместе!
Срок хранения
2 года
Не применять после истечениясрока годности.
Условия отпуска из аптек
По рецепту
Производитель
Нобел ИлачСанайи ве Тиджарет А.Ш, СанкакларМах. Эски Акчакожа Кад. № 299 81100/Дудзже/Турция
Тел: +90 (380) 526 30 60
Факс: +90 (380) 526 30 43
Владелец регистрационного удостоверения
Нобел ИлачПаз. ве Сан. ЛТД.ШТИ.
Инкылап Мах., Акчакожа Сок.
№ 10 (34768) Умрание /Стамбул/Турция
Тел: +90 (216) 633 60 00
Факс: + 90 (216) 633 60 01
Адрес организации, принимающей на территорииРеспублики Кыргызстан претензии от потребителей по качеству продукции (товара):
РеспубликаКыргызстан, г. Бишкек, ул. Ибраимова 115 а,
Бизнес Центр «Дордой-Плаза»,
4 этаж, каб. 4-2, тел. + 996 (312) 6205 59
+996 (770) 977 996
Адрес электронной почты: office@nobel.kg
Страна: Турция
Язык: турецкий
Источник: TİTCK (Türkİye İlaç Ve Tibbİ Cİhaz Kurumu)
Купи это сейчас
Активный ингредиент:
tiyokolşikosid
Доступна с:
GENSENTA İLAÇ SANAYİ VE TİC. A.Ş.
код АТС:
M03BX05
ИНН (Международная Имя):
tiyokolsikosid
Тип рецепта:
Normal
Терапевтические области:
intramuskuler
Статус Авторизация:
Pasif
Дата Авторизация:
2011-11-30
тонкая брошюра
1/6
KULLANMA TALİMATI
ADELEKS 8 MG TABLET
AĞIZ YOLUYLA ALINIR.
•
_ETKIN MADDE:_
Her bir tablette 8 mg tiyokolşikosid bulunur.
•
_YARDIMCI MADDELER:_
Laktoz monohidrat (sığır sütünden elde edilen), prejelatinize
nişasta,
mikrokristalin selüloz, magnezyum stearat.
BU KULLANMA TALIMATINDA:
_1._
_ _
_ADELEKS NEDIR VE NE IÇIN KULLANILIR? _
_2._
_ _
_ADELEKS’I KULLANMADAN ÖNCE DIKKAT EDILMESI GEREKENLER _
_3._
_ _
_ADELEKS NASIL KULLANILIR? _
_4._
_ _
_OLASI YAN ETKILER NELERDIR? _
_5._
_ _
_ADELEKS’IN SAKLANMASI _
BAŞLIKLARI YER ALMAKTADIR.
1.
ADELEKS NEDIR VE NE IÇIN KULLANILIR?
ADELEKS, tablet formunda olup 8 mg tiyokolşikosid etkin maddesini
içerir. 10 veya 14 tablet
içeren kutularda bulunmaktadır. Tabletler açık sarı renkli,
tabletin iki eşit parçaya bölünmesini
kolaylaştırmak için
bir yüzü çentikli, yuvarlak tabletler şeklindedir.
ADELEKS esas olarak kas gevşetici etkinliğe sahiptir. ADELEKS,
yetişkinlerde ve 16 yaştan
itibaren ergenlerde ani ortaya çıkan omurilik kaynaklı ağrılı
kas kasılmalarının ek tedavisinde
kullanılır.
2.
ADELEKS’I KULLANMADAN ÖNCE DIKKAT EDILMESI GEREKENLER
ADELEKS’I AŞAĞIDAKI DURUMLARDA KULLANMAYINIZ
Eğer;
•
Tiyokolşikoside veya yardımcı maddelerden herhangi birine karşı
aşırı duyarlılığınız varsa,
•
Kas veya kasların görev yapamaması (kasılamaması) durumu varsa,
•
Gebelik ve emzirme döneminde iseniz,
•
Gebe kalma olasılığınız varsa ve etkili bir doğum kontrol
yöntemi kullanmıyorsanız,
•
16 yaşından küçükseniz.
BU
ILACI
KULLANMAYA
BAŞLAMADAN
ÖNCE
BU
KULLANMA
TALİMATINI
DIKKATLICE
OKUYUNUZ, ÇÜNKÜ SIZIN IÇIN ÖNEMLI BILGILER IÇERMEKTEDIR.
•
_Bu kullanma talimatını saklayınız. Daha sonra tekrar okumaya
ihtiyaç duyabilirsiniz. _
•
_Eğer ilave sorularınız olursa, lütfen doktorunuza veya
eczacınıza danışınız. _
•
_Bu ilaç kişisel olarak sizin için reçete edilmiştir,
başkalarına vermeyiniz. _
•
_Bu ilacın kullanımı sırasında, doktora veya hastaneye
Прочитать полный документ
Характеристики продукта
1/9
KISA ÜRÜN BİLGİSİ
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ADELEKS 8 mg tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
ETKIN MADDE:
Tiyokolşikosid
8 mg
YARDIMCI MADDELER:
Laktoz monohidrat (sığır sütünden elde edilen)
92 mg
Yardımcı maddeler için 6.1’e bakınız.
3. FARMASÖTİK FORM
Tablet
Açık sarı renkli, tabletin iki eşit parçaya bölünmesini
kolaylaştırmak için bir yüzü çentikli,
yuvarlak tabletler.
4. KLİNİK ÖZELLİKLER
4.1 TERAPÖTIK ENDIKASYONLAR
Yetişkinlerde ve 16 yaştan itibaren adolesanlarda, akut spinal
patolojideki ağrılı kas spazmlarının
ek tedavisinde endikedir.
4.2 POZOLOJI VE UYGULAMA ŞEKLI
Ağız yoluyla kullanım içindir.
POZOLOJI:
ADELEKS, yetişkinlerde günde maksimum 16 mg dozunda
kullanılmaktadır.
UYGULAMA SIKLIĞI VE SÜRESI:
Önerilen ve günlük maksimum doz, her 12 saatte bir (günde 2 kez) 1
tablet (8 mg) yani bir günde
en fazla 2 tablet (16 mg tiyokolşikosid/gün)’tir.
Önerilen tedavi süresi 5–7 gündür, toplam tedavi süresi
ardışık 7 gün ile sınırlıdır.
Önerilen dozların aşılmasından veya uzun süreli kullanımdan
kaçınılmalıdır (bkz. Bölüm 4.4).
UYGULAMA ŞEKLI:
Sadece ağızdan kullanım içindir.
Tabletler tok karnına su ile alınmalıdır.
Ağız yolu ile uygulamayı takiben diyare ortaya çıkarsa tedaviye
son verilmelidir.
2/9
ÖZEL POPÜLASYONLARA ILIŞKIN EK BILGILER:
BÖBREK/KARACIĞER YETMEZLIĞI:
ADELEKS’in
böbrek/karaciğer
yetmezliği
olan
hastalardaki
güvenliliği
ve
etkililiği
incelenmemiştir.
PEDIYATRIK POPÜLASYON:
ADELEKS, güvenlik endişeleri nedeniyle 16 yaşın altındaki
çocuklarda kullanılmamalıdır (bkz.
Bölüm 5.3).
GERIYATRIK POPÜLASYON:
ADELEKS’in yaşlı hastalardaki güvenlilik ve etkililiği
incelenmemiştir.
4.3 KONTRENDIKASYONLAR
•
Tiyokolşikoside ya da yardımcı maddelerden herhangi birine aşırı
duyarlılığı olanlarda,
•
Gevşek paralizide; adale hipotonisinde,
•
Tüm gebelik ve laktasyon süresince kullanımı,
•
16 yaş ve altındaki çocuklarda,
�
Прочитать полный документ
Похожие продукты
Поиск оповещений, связанных с этим продуктом
Просмотр истории документов
- Скачать инструкцию медикамента
Торговое название
Тиофлекс
Международное непатентованное название
Тиоколхикозид
Лекарственная форма
Таблетки 8 мг
Состав
Одна таблетка содержит
активное вещество: тиоколхикозид 8 мг;
вспомогательные вещества: микрокристаллическая целлюлоза, лактозы моногидрат, крахмал модифицированный (Прежелатинированный крахмал),
коповидон (Коллидон VA64), магния стеарат, кремния диоксид коллоидный.
Описание
Таблетки желтого цвета, круглой формы, с двояковыпуклой поверхностью, с риской на одной стороне и маркировкой «8» – на другой.
Фармакотерапевтическая группа
Миорелаксанты центрального действия другие.
Код АТХ M03BX05
Фармакологические свойства
Фармакокинетика
После орального применения тиоколхикозид быстро абсорбируется. Он имеет три метаболита. Две главные формы в циркуляции: тиоколхикозид агликон и глюкуронидное производное тиоколхикозида, которое является активным метаболитом. Активное глюкуронидное производное тиоколхикозида также наблюдается после внутримышечного введения.
Тиоколхикозид связывается с белками сыворотки крови человека (13%) слабо, и это не зависит от терапевтической концентрации тиоколхикозида; сывороточный альбумин играет основную роль в связывании белков сыворотки.
Активное глюкуронидное производное быстро наблюдалось в плазме крови со средним Tmax 1 час. После перорального приема 8 мг разовой дозы тиоколхикозида, средняя площадь под кривой линией (AUC), отражающая воздействие позиции тиоколхикозида и активного метаболита глюкуронида на активные компоненты составляет примерно 500 нг.час/мл. После перорального приема 8 мг разовой дозы тиоколхикозида, средняя площадь под кривой линией (AUC), отражающая воздействие позиции активного метаболита глюкуронида на активные компоненты составляет примерно 126 нг.час / мл.
Видимый объем распределения и общий клиренс тиоколхикозида составляют приблизительно 43 л/час и 19 л/час соответственно.
Биотрансформация: Две главные формы в циркуляции: тиоколхикозид агликон и глюкуронидное производное тиоколхикозида, которое является активным метаболитом. Активное глюкуронидное производное тиоколхикозида также наблюдается после внутримышечного введения.
Тиоколхикозид не был определен таким образом после перорального приема у здоровых.
Активный глюкуронид метаболит быстро наблюдается в плазме крови.
У здоровых тиоколхикозид выводится со средним окончательным полувыведением примерно 7 часов после орального применения.
После орального применения C14radioactive тиоколхикозида, 79% принятой дозы обнаружено в фекалиях и 20% в моче.
Фармакодинамика
Тиоколхикозид – активное вещество препарата ТиоФлекс является полусинтетическим веществом натурального псевдоалкалоида колхицина и серы. Оказывает миорелаксирующее действие (мышечный релаксант). Тиоколхикозид связывается только с ГАМК и глицинергическими рецепторами, чувствительными к стрихнину в ин-витро исследованиях. Тиоколхикозид, действующий как антагонист ГАМК-рецептора может оказывать свое эффективное миорелаксирующее действие с помощью регуляторных комплексных механизмов на супраспинальном уровне, однако, его глицинергические механизмы действия не могут быть исключены. Характеристики взаимодействия тиоколхикозида с ГАМК рецепторами, такие же, как и с производным глюкуронида, которое является основным метаболитом в кровотоке в качественном и количественном выражении.
Миорелаксирующие характеристики тиоколхикозида и его главного метаболита были продемонстрированы в нескольких экспериментальных моделях, проведенных in vivo. Отсутствие миорелаксирующего эффекта тиоколхикозида показывает, что это соединение имеет доминантное супраспинальное действие.
Также, электроэнцефалографические исследования показали, что тиоколхикозид и его главный метаболит не вызывают седативного эффекта.
Показания к применению
Тиоколхикозид показан при симптоматическом лечении болезненных мышечных спазмов.
Способ применения и дозы
Взрослым по 1 таблетке (8 мг) два раза в день.
Максимальная суточная доза 16 мг.
Длительность лечения 5 – 7 дней.
Только для перорального применения. Таблетки необходимо принимать на полный желудок, запивая некоторым количеством воды.
Если после перорального применения появилась диарея, дозу следует снизить.
Побочные действия
Редко
— анафилактические реакции как зуд, уртикарий и ангионевротический отек
— сонливость
— вазовагальный обморок, гипотензия
— временная спутанность сознания, возбуждение
— тошнота, рвота, диарея, гастралгия
Очень редко
— анафилактический шок
Противопоказания
— пациентам с повышенной чувствительностью к тиоколхикозиду или другим веществам в составе препарата,
— при вялом параличе и гипотонии мышц
— пациентам с проблемами кровотечения и получающих антикоагулянтное лечение
— беременность и период лактации
— детский возраст до 18 лет
Лекарственные взаимодействия
Совместное использование тиоколхикозида с другими миорелаксантами не рекомендуется, поскольку они могут увеличить эффекты друг друга. По этой же самой причине; при совместном использовании с другими препаратами, эффективными на гладких мускулатурах, необходимо сделать предостережение по случаю вероятности увеличения частоты побочных воздействий, и пациент должен быть проверен.
Тиоколхикозид не должен использоваться вместе с антикоагулянтами.
Особые указания
Если после перорального применения появилась диарея, дозу следует снизить.
— пациенты с редкими наследственными нарушениями непереносимости галактозы, недостатком лактазы Лаппа или с проблемами нарушения всасывания глюкозы—галактозы не должны использовать этот препарат.
Тиоколхикозид может спровоцировать эпилептический припадок у пациентов с эпилепсией или с риском эпилептического припадка.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Рекомендуется соблюдать осторожность при назначении препарата лицам, работа которых ребует быстрой психической и физической реакции.
Передозировка
Данных о передозировке нет.
Симптомы: возможно усиление побочных действий.
Лечение: симптоматическая и поддерживающая терапия.
Форма выпуска и упаковка
По 10 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой.
По 2 контурные упаковки вместе с инструкцией по медицинскому применению на государственном и русском языках в картонную пачку.
Условия хранения
Хранить при температуре не выше 25 0С.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Санта Фарма Илач Санаи А.Ш.
34382 Шишли- Стамбул, Турция
Наименование и страна владельца регистрационного удостоверения
Берксам Илач Тиджарет А.Ш., Турция
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
ТОО «Фармактив»
050010, Республика Казахстан, г. Алматы, ул. Карасай батыра, 1А
Тел/факс: +7 727 291 81 00
e-mail: info@farmaktiv.com
Мендилекс — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛС-001389
Торговое наименование препарата
Мендилекс®
Международное непатентованное наименование
Бипериден
Лекарственная форма
таблетки
Состав
Каждая таблетка содержит:
активное вещество: биперидена гидрохлорид 2,000 мг;
вспомогательные вещества: магния стеарат 2,000 мг, лактозы моногидрат 65,000 мг, целлюлоза микрокристаллическая 131,000 мг.
Описание
Белые, круглые, двояковыпуклые таблетки с риской на одной стороне.
Фармакотерапевтическая группа
Холиноблокатор центральный
Код АТХ
N04AA02
Фармакодинамика:
Мендилекс® (бипериден) — холиноблокирующий препарат центрального действия, с умеренно выраженным периферическим действием. В результате селективной блокады холинергических рецепторов, бипериден приводит к ослаблению признаков паркинсонизма (акатизии, мышечной ригидности, акинезии, дискинетическому дрожанию, окулогирному кризу).
Фармакокинетика:
Бипериден быстро всасывается из желудочно-кишечного тракта, однако его биодоступность составляет 30%, что свидетельствует об экстенсивном метаболизме при «первом прохождении» через печень.
Связывание с белками плазмы составляет 93%, объем распределения 24±4,1 л/кг. Метаболизм биперидена полностью не изучен, однако известно, что он включен в процесс гидроксилирования.
Период полувыведения биперидена из плазмы составляет около 20 ч, поэтому концентрацию препарата в плазме (0,1-0,2 нг/мл) можно определить и через 48 ч после его приема. Выводится почками и желудочно-кишечным трактом.
Показания:
Синдром паркинсонизма (в составе комбинированной терапии), в том числе начальные стадии болезни Паркинсона (монотерапия).
Экстрапирамидные нарушения (тремор, мышечная ригидность, торсионная дистония и локальные формы дистонии, в том числе пароксизмальных дискинезии, гиперкинез хореи, различные формы тиков, миоклонии и гиперкинез, дистония мышц конечностей, туловища, шеи, лица, акинезия, акатизия), вызванные лекарственными средствами (в частности нейролептиками).
Противопоказания:
Гиперчувствительность, миастения, закрытоугольная глаукома, кишечная непроходимость, обструкция мочевыводящих путей, паралитическая непроходимость кишечника или кишечная атония, гастроэзофагеальный рефлюкс, неспецифический язвенный колит, токсический мегаколон, острое кровотечение.
С осторожностью:
Пожилым пациентам и пациентам, страдающим гипертрофией предстательной железы, тахиаритмией, застойной сердечной недостаточностью, ишемической болезнью сердца, артериальной гипертензией, илеостомией/колостомией, эпилепсией.
Детский возраст до 18 лет (эффективность и безопасность применения препарата у детей не установлена).
Беременность и лактация:
Назначение во время беременности возможно в случае, если польза для матери превышает возможный риск для плода.
При назначении в период лактации необходимо прекратить грудное вскармливание. Препарат выделяется с грудным молоком и у ребенка возможно развитие антихолинэргических эффектов.
Способ применения и дозы:
Внутрь.
При болезни Паркинсона и паркинсонизме начальная доза составляет 2 мг в сутки, разделенная на два приема. Дозу постепенно увеличивают до достижения оптимальной суточной дозы, которая для большинства пациентов составляет 3-12 мг (разделенных на 3-4 приема). Максимальная суточная доза составляет 16 мг.
Обычно взрослым при экстрапирамидных нарушениях, вызванных лекарственными средствами (в частности нейролептиками), назначают по 2 мг, 1-3 раза в сутки.
Необходимо избегать внезапного прекращения лечения из-за высокой вероятности появления абстиненции.
Побочные эффекты:
В основном побочные действия развиваются в результате антихолинергического действия препарата.
Чаще всего наблюдаются сухость во рту, мидриаз, парез аккомодации, представляющие собой дозозависимые побочные действия.
Редко — запор, диспепсия, повышенная утомляемость, слабость, головокружение, сонливость, тревога, спутанность сознания, нарушение памяти, галлюцинации, эйфория, дезориентация во времени и пространстве, двигательное возбуждение, каталепсия, задержка мочи, тахикардия, снижение артериального давления, лекарственная зависимость, аллергические реакции (кожная сыпь).
Передозировка:
Симптомы передозировки схожи с симптомами возникающими при отравлении атропином: мидриаз, сухость кожи, гиперемия лица, сухость во рту и верхних дыхательных путей, повышенная температура тела, тахикардия, аритмии сердца, ослабление перистальтики кишечника, задержка мочи, делирий, дезориентация, анксиозность, галлюцинации, спутанность сознания, атаксия, агрессивность и судороги. При тяжелом отравлении возможны ступор, коматозное состояние, остановка дыхания и сердца, летальный исход.
Оказание помощи: промывание желудка, симптоматическая терапия. Рекомендуется назначить физостигмин, в качестве специфического антагониста в дозе 1 мг внутримышечно или путем медленного внутривенного вливания. Данную дозу можно повторять через каждые 20 мин, но общее количество не должно превышать 4 мг в сутки. Так как физостигмин быстро метаболизируется, иногда необходимо дополнительное вливание физостигмина через каждые 1-2 часа. Для детей и пожилых пациентов рекомендуется введение половины стандартной дозы. Пациент должен находиться под контролем врача не менее 8-12 часов после последнего появления симптомов.
Взаимодействие:
Усиливает действие М-холиноблокаторов, антигистаминных, противопаркинсонических и противоэпилептических средств, ослабляет действие метоклопрамида.
Несовместим с этанолом.
Леводопа увеличивает М-холиноблокирующее действие, хинидин повышает риск развития дискинезий.
Особые указания:
Применение биперидена может вызвать нервно-мышечную блокаду, с последующей мышечной слабостью и параличем.
В период лечения бипериденом не следует употреблять алкоголь.
У восприимчивых пациентов наблюдаются спутанность сознания, эйфория, двигательное возбуждение при назначении антихолинергического лекарственного средства в рекомендуемых терапевтических дозах.
Влияние на способность управлять транспортными средствами и механизмами:
Препарат оказывает сильное влияние на психомоторные реакции, в силу чего пациентам, принимающим препарат, следует воздержаться от занятия потенциально опасными видами деятельности, требующими быстрых психических и двигательных реакций.
Форма выпуска/дозировка:
Таблетки, 2 мг.
Упаковка:
По 10 таблеток в блистере из алюминиевой фольги и пленки ПВХ.
Каждые 5 блистеров вместе с инструкцией по применению помещены в картонную пачку.
Условия хранения:
Хранить в защищенном от света месте, при температуре 15-25 °С.
Хранить недоступном для детей месте.
Срок годности:
5 лет.
Не применять по истечении срока годности.
Условия отпуска
По рецепту
Производитель
Алкалоид АО, Blvd. Alexandar Makedonski, 12, 1000 Skopje, Republic of Macedonia, Республика Македония
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Алкалоид АО
Купить Мендилекс в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Амлесса® — это комбинация двух активных компонентов: периндоприла и амлодипина. Периндоприл является ингибитором АПФ (ангиотензин-превращающего фермента). Амлодипин является антагонистом кальция (и принадлежит к классу препаратов, которые называются дигидропиридинами). Они оказывают комбинированное действие, расширяя и расслабляя кровеносные сосуды, что облегчает прохождение и нагнетание крови.
Активными ингредиентами являются периндоприла трет-бутиламин и амлодипин
Таблетки 4 мг/5 мг
: каждая таблетка содержит 4 мг периндоприла эрбумина (что соответствует 3,34 мг периндоприла) и 5 мг амлодипина (в форме бесилата).
Таблетки 4 мг/10 мг
: каждая таблетка содержит 4 мг периндоприла эрбумина (что соответствует 3,34 мг периндоприла) и 10 мг амлодипина (в форме бесилата).
Таблетки 8 мг/5 мг
: каждая таблетка содержит 8 мг периндоприла эрбумина (что соответствует 6,68 мг периндоприла) и 5 мг амлодипина (в форме бесилата).
Таблетки 8 мг/10 мг
: каждая таблетка содержит 8 мг периндоприла эрбумина (что соответствует 6,68 мг периндоприла) и 10 мг амлодипина (в форме бесилата).
Вспомогательные вещества: целлюлоза микрокристаллическая, крахмал прежелатинизированный, натрия крахмалгликолят, кальция хлорид гексагидрат, натрия гидрокарбонат, кремния диоксид коллоидный безводный, магния стеарат.
Амлесса® назначается для лечения повышенного артериального давления (гипертензии) и/или стабильной коронарной болезни сердца (заболевание, когда нагнетание крови к сердцу уменьшено или блокируется). Пациенты, принимающие периндоприл и амлодипин, могут вместо отдельных таблеток принимать препарат Амлесса®, который содержит оба компонента.
Не принимайте Амлессу®:
— если у вас повышенная чувствительность к периндоприла эрбумину (третбутиламину) или любому другому ингибитору АПФ, к амлодипина бесилату или любому другому дигидропиридину или любому другому компоненту препарата Амлесса®;
— если срок вашей беременности превышает 3 месяца. Предпочтительно избегать приема препарата также на ранних сроках беременности (см. раздел о беременности);
— если раньше при приеме других ингибиторов АПФ у вас проявлялись такие симптомы, как свистящее дыхание, отек лица или языка, интенсивный зуд или обширная кожная сыпь, или если такие симптомы возникали у кого-либо из членов вашей семьи (данное явление называется ангиоотеком);
— при кардиогенном шоке (состояние, при котором ваше сердце не может нагнетать кровь в количестве достаточном для организма), при аортальном стенозе (сужение аортального клапана) или при нестабильной стенокардии (боль в груди, которая может возникнуть в состоянии покоя);
— при очень низком артериальном давлении (тяжелой гипотензии);
— при сердечной недостаточности (когда сердце не может должным образом
перекачивать кровь, что в результате приводит к затрудненному дыханию или периферическим отекам) после сердечного приступа.
— если у вас сахарный диабет или нарушение функции почек и вы принимаете
препараты, снижающие артериальное давление, которые содержат алискирен
— если вы находитесь на диализе или любом другом типе фильтрации крови. В зависимости от используемой технологии, Амлесса® может вам не подходить.
— если у вас проблемы с почками с ограниченнием поступления крови в почки (стеноз почечной артерии)
— если вы принимали или принимаете сакубитрил/валсартан, препараты, используемые для лечения хронической сердечной недостаточности, так как риск ангионевротического отека (быстрый подкожный отек в такой области, как горло) возрастает.
Проконсультируйтесь с лечащим врачом прежде, чем начать прием препарата Амлесса®: если вы страдаете гипертрофической кардиомиопатией (заболевание сердечной мышцы) или стенозом почечной артерии (сужение артерии, снабжающей кровью почки), если у вас сердечная недостаточность, если у вас очень высокое артериальное давление (гипертонический криз), если вы страдаете другими заболеваниями сердца, если у вас нарушена функция печени, если у вас нарушена функция почек или если вы проходите диализ, если в вашей крови чрезмерно повышенный уровень гормона альдостерона (первичный гиперальдостеронизм),
— если вы страдаете коллагенозом (системным заболеванием соединительной ткани) типа системной красной волчанки или склеродермии,
— если вы страдаете диабетом.
— если вы соблюдаете диету с пониженным содержанием соли или принимаете заменители соли, содержащие калий (очень важно, чтобы содержание калия в крови было сбалансированным),
— если вы принимаете какие-либо из следующих лекарственных средств, используемых для лечения артериального давления: блокаторы рецепторов ангиотензина 11 (БРА) (также известные как сартаны — например, валсартан, телмисартан, ирбесартан), в частности, если вы страдаете заболеваниями почек, связанными с диабетом; алискирен. Ваш лечащий врач может периодически проверять функцию почек, артериальное давление, количество электролитов (например, калия) в крови.
— если вы принимаете какие-либо из следующих лекарственных средств, риск развития ангиоотека увеличивается: рацекадотрил (используется для лечения диареи); препараты, используемые для предотвращения отторжения пересаженных органов и раковых заболеваний (например, темсиролимус, сиролимус, эверолимус); вилдаглиптип, используемый для лечения диабета;
— если вы представитель негроидной расы, так как у вас может быть более высокий риск ангиоотека и этот препарат может быть менее эффективным, чем для пациентов белой расы.
Ангиоотек.
Ангиоотек (тяжелая аллергическая реакция с отеком лица, губ, языка или горла с затруднением глотания или дыхания) наблюдался у пациентов, принимавших ингибиторы АПФ, включая периндоприл. Это может произойти в любой момент в процессе лечения. Если такие симптомы развивались, необходимо прекратить прием Амлессы® и обратиться к врачу немедленно.
Поставьте своего лечащего врача в известность, если вы думаете, что беременны (или можете забеременеть). Амлесса® не рекомендуется на ранних стадиях беременности. Препарат также не следует принимать, если срок беременности превышает 3 месяца, так как на этом сроке препарат может причинить серьезный вред ребенку (см. раздел «Беременность и кормление грудью»).
При приеме препарата Амлесса®, вы должны также проинформировать своего лечащего врача о следующем:
— если вам предстоит анестезия или серьезная хирургическая операция,
— если у вас недавно наблюдались диарея или рвота,
— если вы проходите аферез ЛПНП (аппаратное выведение холестерина из крови)
— если вы собираетесь пройти курс десенсибилизации, чтобы понизить чувствительность к аллергическому эффекту укусов пчел или ос.
Дети и подростки
Амлесса® не рекомендована для лечения детей и подростков.
Если вы принимаете, недавно принимали или собираетесь принимать другие лекарственные средства, сообщите об этом лечащему врачу.
Избегайте одновременного приема Амлессы® со следующими препаратами:
— литий (используется для лечения маний или депрессии),
— эстрамустин (используется при лечении рака),
— калиевые добавки (включая заменители соли), калийсберегающие диуретики и другие препараты, которые могут повысить количество калия в вашей крови (например, триметоприм и ко-тримоксазол для лечения инфекций, вызванных бактериями; циклоспорин, иммунодепресантный препарат, используемый для предотвращения отторжения пересаженных органов; и гепарин, препарат, применяемый для разжижения крови для предотвращения образования тромбов);
— калийсберегающие препараты, используемые для лечения сердечной недостаточности: эплеренон и спиронолактон в суточных дозах от 12,5 мг до 50 мг.
На терапевтический эффект Амлессы® может повлиять прием других препаратов. Обязательно поставьте в известность своего лечащего врача, если вы принимаете следующие препараты, так как при их приеме следует соблюдать особую осторожность: — другие препараты для лечения повышенного артериального давления, включая диуретики (препараты, увеличивающие объем мочи, выделяемой почками),
— сакубитрил/валсартан (используемые для продолжительного лечения сердечной недостаточности): см. разделы «Не принимайте Амлесса®» и «Особые указания и меры предосторожности»,
— нестероидные противовоспалительные препараты (например, ибупрофен) для снятия боли или высокие дозы ацетилсалициловой кислоты,
— препараты для лечения диабета (например, инсулин),
— препараты для лечения ментальных расстройств, таких как депрессия, тревога, шизофрения и др. (например, трициклические антидепрессанты, антипсихотические препараты, имипраминоподобные препараты, нейролептики),
— иммунодепрессанты (препараты, понижающие защитные механизмы организма), которые используются для лечения аутоиммунных нарушений или после трансплантационных операций (например, циклоспорин, такролимус),
— триметоприм и ко-тримоксазол (для лечения инфекций),
— аллопуринол (для лечения подагры),
— прокаинамид (для лечения нерегулярного сердечного ритма),
— сосудорасширяющие препараты, включая нитраты (препараты, которые расширяют кровеносные сосуды),
— эфедрин, норадреналин или адреналин (препараты, которые используются для лечения пониженного артериального давления, шока или астмы),
— баклофен, который используется для лечения спастичности мышц, наступающей при некоторых заболеваниях, например, при рассеянном склерозе;
— некоторые антибиотики, такие как рифампицин, эритромицин,
— кларитромицин (для лечения инфекций, вызванных бактериями),
— противоэпилептические средства, такие как карбамазепин, фенобарбитал, фенитоин, фосфенитоин, примидон,
— итраконазол, кетоконазол (препараты, применяемые для лечения грибковых инфекций),
— альфа-блокаторы, применяемые при лечении увеличения простаты, такие как празозин, алфузосин, доксазозин, тамсулозин, теразозин,
— амифостин (используется для профилактики или снижения нежелательных реакций, вызванных другими медицинскими препаратами или лучевой терапией, применяемыми при лечении рака),
— кортикостероиды (которые используются для лечения различных состояний, включая тяжелую астму и ревматический артрит),
— золотосодержащие соли, особенно при введении внутривенно (используется для лечения симптомов ревматического артрита),
— лекарственные средства, которые наиболее часто используются для лечения диареи (рацекадотрил) или для предотвращения отторжения трансплантированных органов (сиролимус, эверолимус, темсиролимус и другие препараты, принадлежащие к классу так называемых ингибиторов МРМ). См. раздел «Особые указания и меры
предосторожности »,
— такролимус (используется для контроля иммунного ответа вашего организма, позволяет вашему организму принять пересаженный орган),
— симвастатин (препарат, понижающий уровень холестерина),
— ритонавир, индинавир, нелфинавир (называемые ингибиторами протеазы, используемые для лечения ВИЧ-инфекции),
— зверобой продырявленный (зверобой),
— верапамил, дилтиазем (препараты, влияющие на сердечный ритм),
— дантролен (настой для лечения тяжелых аномалий температуры тела),
Ваш лечащий врач может изменить дозу и/или принять другие меры предосторожности, если вы принимаете блокатор рецепторов ангиотензина-П (БРА) или алискирен. См. раздел «Не принимайте Амлесса®» и «Особые указания и меры предосторожности».
Амлесса® с пищей и напитками
Принимайте Амлессу® перед едой.
Употребление грейпфрута и грейпфрутового сока может привести к увеличению уровня активного компонента амлодипина в крови, что может вызвать непредсказуемое снижение давления от приема Амлессы®. Следовательно употребление грейпфрутового сока и грейпфрута не рекомендовано пациентам, принимающим препарат Амлесса®.
Если вы беременны или кормите грудью, а также подозреваете, что беременны, или планируете беременность, проконсультируйтесь с лечащим врачом или работником аптеки перед тем, как принимать данный препарат.
Беременность
Ваш врач порекомендует вам прекратить принимать препарат Амлесса® до беременности или, если факт беременности подтвердится, и назначит вам другой препарат. Прием препарата Амлесса® не рекомендуется на ранних сроках беременности и противопоказан, если срок беременности превышает 3 месяца, так как прием препарата во втором и третьем триместре беременности может нанести серьезный вред ребенку.
Кормление грудью
Поставьте своего врача в известность, если вы кормите грудью. Прием препарата Амлесса® кормящими матерями не рекомендуется. Ваш врач должен назначить вам другой вид лечения, если вы желаете кормить грудью, особенно, если ваш ребенок новорожденный или родился раньше срока.
Амлесса® не влияет на концентрацию внимания, но вы можете почувствовать сильное головокружение или слабость из-за низкого кровяного давления, что может повлиять на способность управлять транспортными средствами или работать с механизмами.
Если у вас возникли такие нежелательные реакции, не управляйте транспортными средствами и механизмами.
Всегда принимайте препарат в точном соответствии с назначением врача. Проконсультируйтесь с лечащим врачом, если вы не уверены.
Когда и как следует принимать Амлесса®?
Таблетки рекомендуется принимать утром, перед едой, проглатывать целиком, запивая водой, желательно в одно и то же время каждый день. Врач назначит вам подходящую дозу. Обычная доза — 1 таблетка в день. Препарат Амлесса®, как правило, назначают пациентам, уже принимающим периндоприл и амлодипин в виде отдельных таблеток.
Применение у детей и подростков
Данный препарат не рекомендуется принимать детям и подросткам.
Если вы забыли принять препарат Амлесса®
Важно принимать препарат каждый день, так как регулярность приема делает лечение более эффективным. Тем не менее, если вы забыли принять дозу препарата Амлесса®, принимайте следующую дозу в обычное время. Не удваивайте дозу с целью компенсации пропущенной.
Если вы прекратили прием препарата Амлесса ®
Поскольку препарат Амлесса® предназначен для длительного применения, вы должны посоветоваться с лечащим врачом, прежде чем прекращать прием.
Если вы приняли препарата Амлесса® больше, чем следовало
Если вы приняли слишком много таблеток, свяжитесь с ближайшим отделением скорой помощи или немедленно сообщите об этом своему врачу. Наиболее вероятным симптомом в случае передозировки является падение артериального давления, из-за чего вы можете почувствовать головокружение или потерять сознание. Если это случилось, примите горизонтальное положение и поднимите ноги, это может облегчить ваше состояние.
Если у вас возникли дополнительные вопросы касательно приема препарата-, обратитесь к лечащему врачу или работнику аптеки.
Как и все остальные лекарственные средства, Амлесса® может вызывать нежелательные реакции, но не у всех.
Немедленно прекратите принимать препарат и сразу же сообщите лечащему врачу, если вы заметили следующее:
— Неожиданная охриплость, боль в груди, одышка, затрудненное дыхание, — Отек век, лица или губ,
— Отек языка и горла, которые вызывают сильное затруднение дыхания,
— Тяжелые кожные реакции, включая выраженную кожную сыпь, крапивницу, покраснение кожи по всему телу, сильный зуд, волдыри, шелушение и отеки кожи, воспаление слизистых оболочек (Синдром Стивенса-Джонсона, токсический эпидермальный некроз) или другие аллергические реакции
— Сердечный приступ, непривычно быстрое и аномальное сердцебиение, или боль в груди — Воспаление поджелудочной железы, что может привести к сильной боли в животе или спине с очень плохим самочувствием
Частые нежелательные реакции, о которых сообщалось. Если у вас имеются эти признаки и они продолжаются больше недели, свяжитесь со своим лечащим врачом.
Очень частые (могут развиться более чему 1 из 10 человек):
Отечность (задержка воды).
Частые (могут развиться у 1 из 10 человек):
Головная боль, головокружение, сонливость (особенно в начале лечения), онемение или покалывание в конечностях, нарушения зрения (в том числе двоение в глазах), шум в ушах (повышение чувствительности к шуму), сильное сердцебиение (ощущение собственных ударов сердца), румянец, предобморочное состояние из-за низкого кровяного давления, кашель, одышка, тошнота, рвота, боль в животе, искажение вкусовых ощущений, диспепсия или трудности с перевариванием, изменения стула, диарея, запор, аллергические реакции (такие, как кожная сыпь, зуд), мышечные судороги, утомляемость, слабость, припухлость голеностопного сустава (периферический отек).
Другие нежелательные реакции. Если некоторые из них серьезные или вы заметили нежелательные реакции, не перечисленные в этом листке-вкладыше, сообщите об этом лечащему врачу или работнику аптеки.
Нечастые нежелательные реакции (до 1 из 100 человек).
Перепады настроения, беспокойство, депрессия, бессонница, нарушения сна, дрожь, обмороки, потеря болевой чувствительности, нерегулярные сердечные сокращения, ринит (заложенный нос или насморк), выпадение волос, красные пятна на коже, изменение цвета кожи, боль в спине, артралгия (боль в суставах), миалгия (боль в мышцах), боль в груди, нарушение мочеиспускания, учащенное мочеиспускание, в том числе по ночам, боль, плохое самочувствие, бронхоспазм (стеснение в груди, затруднение дыхания, одьппка), сухость во рту, ангионевротический отек (такие симптомы, как хрипы, отек лица или языка), волдыри, проблемы с почками, эректильная дисфункция повышенное потоотделение, избыток эозинофилов (белых кровяных клеток), дискомфорт или увеличение груди у мужчин, увеличение или уменьшение веса, тахикардия, васкулит (воспаление кровеносных сосудов), реакция светочувствительности (повышенная чувствительность кожи к солнцу), лихорадка, ослабление, изменение лабораторных показателей, высокий уровень в крови калия, обратимые при отмене приема препарата, низкий уровень натрия, гипогликемия (очень низкий уровень сахара в крови) у больных диабетом, увеличение содержания мочевины
и креатинина в крови.
Редкие (до 1 из 1000 человек).
Изменения лабораторных показателей: повышение уровня ферментов печени, высокий уровень билирубина в сыворотке крови, потемнение мочи, плохое самочувствие (тошнота) или недомогание (рвота), мышечные спазмы, спутанность сознания, обострение псориаза. Спутанность сознания и судороги (это могут быть симптомы состояния, называемого СНС АДГ (синдром неадекватной секреции антидиуретического гормона)), снижение или отсутствие диуреза, острая почечная
недостаточность.
Очень редкие (до 1 из 10000 человек).
Сердечно-сосудистые заболевания (стенокардия, инфаркт и инсульт), эозинофильная пневмония (редкий тип пневмонии), отек век, лица и губ, отек языка и горла, который вызывает серьезные затруднения дыхания, тяжелые кожные реакции, включая интенсивную кожную сыпь, крапивница, покраснение кожи по всему телу, сильный зуд, волдыри, шелушение и отек кожи, воспаление слизистых оболочек (синдром Стивена- Джонсона), мультиформная эритема (кожная сыпь, которая часто начинается с красных зудящих пятен на лице, руках или ногах), чувствительность к свету, изменения показателей крови, такие, как снижение количества белых кровяных клеток и эритроцитов, снижение гемоглобина, снижение количества тромбоцитов, нарушения крови, воспаление поджелудочной железы, которое может вызывать сильные боли в животе и спине и сопровождается ощущением плохого самочувствия, нарушением функции печени, воспалением печени (гепатитом), пожелтением кожи (желтухой), увеличением ферментов печени, что может влиять на некоторые медицинские анализы, вздутие живота (гастрит), нервное расстройство, которое может вызвать слабость, покалывание или онемение, повышение мышечного напряжения, отек десен, избыток сахара в крови (гипергликемия).
Частота не известна (не может быть оценена по имеющимся данным):
дрожь, повышение тонуса мышц, маскообразное лицо, медленные движения и шарканье, неустойчивая ходьба, изменение цвета, онемение и боль в пальцах рук и ног (феномен Рейно).
Сообщение о нежелательных реакциях
Если у вас возникли какие-либо нежелательные реакции, сообщите об этом лечащему врачу или работнику аптеки. Это относится и к любым возможным нежелательным реакциям, не перечисленным в этом листке-вкладыше. Сообщая о нежелательных реакциях, вы помогаете получить больше сведений о безопасности препарата.
Хранить при температуре не выше 30°С. Хранить в оригинальной упаковке с целью защиты от света и влаги.
Хранить в недоступном для детей месте.
Не выбрасывайте препарат в водопровод или канализацию. Уточните у работника аптеки, как избавиться от препаратов, которые больше не требуются. Эти меры позволят защитить окружающую среду.
: круглые, слегка двояковыпуклые таблетки белого или почти белого цвета со скошенными краями.
Таблетки 4 мг/10 мг
: овальные, двояковыпуклые таблетки белого или почти белого цвета с насечкой на одной стороне. Насечка не предназначена для деления таблетки на равные части, при этом может применяться для разламывания таблетки с целью облегчения ее проглатывания.
Таблетки 8 мг/5 мг
: круглые, двояковыпуклые таблетки белого или почти белого цвета со скошенными краями.
Таблетки 8 мг/10 мг
: круглые, двояковыпуклые таблетки белого или почти белого цвета со скошенными краями и насечкой на одной стороне. Таблетка может быть поделена на равные части.
10 таблеток в блистере (ОПА/А1/ПВХ//алюминиевая фольга). 3 блистера с листком- вкладышем в картонной коробке.
3 года.
Не применяйте препарат после истечения срока годности, указанного на упаковке.
Датой истечения срока годности является последний день месяца.
По рецепту.
Держатель регистрационного удостоверения и производитель
КРКА д.д., Ново место, Шмарьешка цеста 6, 8501 Ново место, Словения
Форма выпуска, состав и упаковка
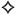
таб. 8 мг+5 мг+2.5 мг: 14 или 30 шт.
Рег. №: 10366/15/15/20/21/22 от 16.06.2020 — Срок действия рег. уд. не ограничен
Таблетки белого или почти белого цвета, круглые, двояковыпуклые.
| 1 таб. | |
| периндоприла эрбумин | 8 мг |
| амлодипин (в форме безилата) | 5 мг |
| индапамид | 2.5 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая (тип 102), целлюлоза микрокристаллическая (тип 112), крахмал прежелатинизированный (тип 1500), натрия крахмала гликолат (тип А), кальция хлорида гексагидрат, натрия гидрокарбонат, кремния диоксид коллоидный безводный, магния стеарат.
7 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (2) — коробки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.
14 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (1) — коробки картонные.
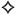
таб. 4 мг+5 мг+1.25 мг: 14 или 30 шт.
Рег. №: 10366/15/15/20/21/22 от 16.06.2020 — Срок действия рег. уд. не ограничен
Таблетки белого или почти белого цвета, круглые, слегка двояковыпуклые, со скошенными краями.
| 1 таб. | |
| периндоприла эрбумин | 4 мг |
| амлодипин (в форме безилата) | 5 мг |
| индапамид | 1.25 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая (тип 102), целлюлоза микрокристаллическая (тип 112), крахмал прежелатинизированный (тип 1500), натрия крахмала гликолат (тип А), кальция хлорида гексагидрат, натрия гидрокарбонат, кремния диоксид коллоидный безводный, магния стеарат.
10 шт. — блистеры из Полиамид/Алюминия/ПВХ-Алюминия (3) — коробки картонные.
14 шт. — блистеры из Полиамид/Алюминия/ПВХ-Алюминия (1) — коробки картонные.
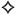
таб. 8 мг+10 мг+2.5 мг: 14 или 30 шт.
Рег. №: 10366/15/15/20/21/22 от 16.06.2020 — Срок действия рег. уд. не ограничен
Таблетки белого или почти белого цвета, круглые, двояковыпуклые, с риской на одной стороне. Риска предназначена исключительно для разламывания таблетки с целью облегчения проглатывания и не обеспечивает деление таблетки на равные части.
| 1 таб. | |
| периндоприла эрбумин | 8 мг |
| амлодипин (в форме безилата) | 10 мг |
| индапамид | 2.5 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая (тип 102), целлюлоза микрокристаллическая (тип 112), крахмал прежелатинизированный (тип 1500), натрия крахмала гликолат (тип А), кальция хлорида гексагидрат, натрия гидрокарбонат, кремния диоксид коллоидный безводный, магния стеарат.
7 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (2) — коробки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.
14 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (1) — коробки картонные.
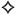
таб. 2 мг+5 мг+0.625 мг: 14 или 30 шт.
Рег. №: 10366/15/15/20/21/22 от 16.06.2020 — Срок действия рег. уд. не ограничен
Таблетки белого или почти белого цвета, овальные, двояковыпуклые, с риской на одной стороне. Риска предназначена исключительно для разламывания таблетки с целью облегчения проглатывания и не обеспечивает деление таблетки на равные части.
| 1 таб. | |
| периндоприла эрбумин | 2 мг |
| амлодипин (в форме безилата) | 5 мг |
| индапамид | 0.625 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая (тип 102), целлюлоза микрокристаллическая (тип 112), крахмал прежелатинизированный (тип 1500), натрия крахмала гликолат (тип А), кальция хлорида гексагидрат, натрия гидрокарбонат, кремния диоксид коллоидный безводный, магния стеарат.
7 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (2) — коробки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.
14 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (1) — коробки картонные.
таб. 4 мг+10 мг+1.25 мг: 14 или 30 шт.
Рег. №: 10366/15/15/20/21/22 от 16.06.2020 — Срок действия рег. уд. не ограничен
Таблетки белого или почти белого цвета, овальные, двояковыпуклые, с риской на одной стороне. Риска предназначена исключительно для разламывания таблетки с целью облегчения проглатывания и не обеспечивает деление таблетки на равные части.
| 1 таб. | |
| периндоприла эрбумин | 4 мг |
| амлодипин (в форме безилата) | 10 мг |
| индапамид | 1.25 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая (тип 102), целлюлоза микрокристаллическая (тип 112), крахмал прежелатинизированный (тип 1500), натрия крахмала гликолат (тип А), кальция хлорида гексагидрат, натрия гидрокарбонат, кремния диоксид коллоидный безводный, магния стеарат.
7 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (2) — коробки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.
14 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (1) — коробки картонные.
Описание лекарственного препарата КО-АМЛЕССА основано на официально утвержденной инструкции по применению препарата и сделано в 2023 году. Дата обновления: 06.04.2023 г.
Фармакологическое действие
Препарат Ко-Амлесса представляет собой комбинацию соли периндоприла трет-бутиламина — ингибитора ангиотензинпревращающего фермента, индапамида — хлорсульфамоилового диуретика и амлодипина — антагониста кальция. Его фармакологическое действие основано на свойствах каждого из компонентов по отдельности, в дополнение к качествам, обусловленным аддитивным синергетическим действием всех трех активных веществ.
Механизм действия и фармакодинамическое действие
Периндоприл
Периндоприл является ингибитором ангиотензинпревращающего фермента (АПФ), который превращает ангиотензин I в ангиотензин II (сосудосуживающее вещество). Кроме того,фермент стимулирует секрецию альдостерона корой надпочечников и распад брадикинина (сосудорасширяющего вещества) до неактивных гептапептидов.
Это приводит к:
— снижению секреции альдостерона,
— повышению активности ренина в плазме крови, тогда как альдостерон не оказывает негативного воздействия,
— снижению общего периферического сосудистого сопротивления благодаря преобладающему влиянию на сосуды мышц и почек. При этом не наблюдается задержки воды и солей и рефлекторной тахикардии при длительном лечении.
Периндоприл снижает уровень артериального давления также у пациентов с нормальным и низким уровнем ренина в плазме крови.
Периндоприл действует через свой активный метаболит периндоприлат. Другие метаболиты являются неактивными.
Периндоприл уменьшает нагрузку на сердце через:
— вазодилататорное воздействие на вены, возможно, вследствие изменений в метаболизме простагландинов: снижение преднагрузки;
— снижение общего периферического сосудистого сопротивления: снижение постнагрузки на сердце.
При проведении исследований пациентов с сердечной недостаточностью установили:
— снижение давления наполнения левого и правого желудочков;
— снижение общего периферического сосудистого сопротивления;
— увеличение сердечного выброса и улучшение сердечного индекса;
— увеличение регионального кровотока в мышцах.
Результаты нагрузочного теста также подтвердили улучшение показателей.
Индапамид
Индапамид — сульфонамидный диуретик с индоловым кольцом, фармакологически родственный тиазидным диуретиками. Индапамид ингибирует реабсорбцию натрия в кортикальном сегменте почек. Это повышает выведение натрия и хлоридов с мочой и в меньшей степени — выведение калия и магния, увеличивая таким образом диурез и обеспечивая гипотензивный эффект.
Амлодипин
Амлодипин является антагонистом кальция и ингибирует приток ионов кальция в сердечную и сосудистую гладкую мышцу. Механизм антигипертензивного эффекта осуществляется благодаря воздействию прямого релаксанта на гладкую мускулатуру сосудов. Точный механизм, которым амлодипин облегчает стенокардию, полностью не установлен, но определяется следующими двумя действиями:
1. Амлодипин расширяет периферические артериолы и, таким образом, снижает общее периферическое сопротивление (постнагрузку) для сердца. Такая разгрузка сердца снижает потребление энергии миокардом и потребность в кислороде.
2. Механизм действия амлодипина также может включать расширение основных коронарных артерий и коронарных артериол. Такое расширение увеличивает поступление кислорода в миокард пациентов с приступом вазоспастической стенокардии.
При артериальной гипертензии разовая доза обеспечивает клинически значимое снижение артериального давления на протяжении 24 ч (в положении лежа и стоя).
Прием амлодипина один раз в день пациентами со стенокардией увеличивает общее время физической нагрузки, время до начала стенокардии и время до депрессии сегмента ST на 1 мм. Амлодипин снижает частоту приступов стенокардии и потребление таблеток глицерина тринитрата.
Амлодипин не был связан с нежелательными метаболическими эффектами или изменениями липидов плазмы и подходит для использования у пациентов с астмой, диабетом и подагрой.
Клиническая эффективность и безопасность
Периндоприл
Периндоприл эффективен для лечения гипертензии любой степени: от легкой до умеренной или тяжелой степени. Наблюдается снижение систолического и диастолического артериального давления в положении лежа и стоя.
Антигипертензивная активность после приема однократной дозы максимальна через 4 — 6 часов после приема препарата и сохраняется в течение 24 часов.
Наблюдается высокая степень остаточного блокирования ангиотензинпревращающего фермента (приблизительно на 80%) через 24 часа.
У пациентов, отвечающих на лечение, артериальное давление нормализуется через один месяц лечения без развития тахифилаксии.
Прекращение лечения не оказывает влияния на гипертензию.
Периндоприл обладает сосудорасширяющим действием, восстанавливает эластичность основных артериальных сосудов, корректирует гистоморфометрические изменения резистивных артерий и снижает гипертрофию левого желудочка.
Добавление тиазидного диуретика приводит к аддитивному синергетическому действию.
Комбинация ингибитора ангиотензинпревращающего фермента с тиазидным диуретиком снижает риск развития гипокалиемии, связанной с приемом диуретика в отдельности.
Двойная блокада системы ренин-ангиотензин-альдостерон (РААС), клинические данные
В рамках двух крупных рандомизированных контролируемых исследований: ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial [продолжающееся международное исследование, направленное на сравнение телмисартана в виде монотерапии и в комбинации с рамиприлом с учетом конечной точки]) и VA NEPHRON-D (The Veterans Affairs Nephropathy in Diabetes [исследование нефропатии при сахарном диабете, проводимое Министерством по делам ветеранов]) проводилось изучение применения комбинации из ингибитора АПФ и блокатора рецепторов ангиотензина II.
Исследование ONTARGET проводилось среди пациентов, анамнез которых включал сердечно-сосудистое или цереброваскулярное заболевание, либо сахарный диабет 2-го типа, сопровождающийся признаками ишемического поражения органов-мишеней.
Исследование VA NEPHRON-D проводилось среди пациентов с сахарным диабетом 2-го типа и диабетической нефропатией. В данных исследованиях не было продемонстрировано какое-либо значительное благоприятное воздействие на почечные и (или) сердечно-сосудистые исходы и показатель смертности, при этом наблюдался более высокий риск развития гиперкалиемии, острой почечной недостаточности и (или) гипотензии по сравнению с монотерапией. Данные результаты также являются значимыми для других ингибиторов АПФ и блокаторов рецепторов ангиотензина II, учитывая их схожие фармакодинамические свойства.
Таким образом, не следует одновременно назначать ингибиторы АПФ и блокаторы рецепторов ангиотензина II пациентам с диабетической нефропатией.
Исследование ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints [исследование применения алискирена при сахарном диабете с использованием конечных точек в виде сердечно-сосудистого и почечного заболевания]) было направлено на изучение пользы от добавления алискирена к стандартной терапии ингибитором АПФ или блокатором рецепторов ангиотензина II у пациентов с сахарным диабетом 2-го типа, а также с хроническим заболеванием почек и (или) сердечно-сосудистым заболеванием. Исследование было завершено досрочно ввиду повышенного риска возникновения неблагоприятных исходов. Смерть по причине сердечно-сосудистого нарушения и инсульт наблюдались чаще (в количественном отношении) в группе, получавшей алискирен, по сравнению с группой, получавшей плацебо, при этом нежелательные явления и серьезные нежелательные явления, представляющие интерес (гиперкалиемия, гипотензия и нарушение функции почек), наблюдались чаще в группе, получавшей алискирен, чем в группе, получавшей плацебо.
Индапамид
Индапамид в качестве монотерапии обладает антигипертензивным действием, которое длится 24 часа. Данный эффект наблюдается при приеме доз, при которых диуретические свойства минимальны.
Его антигипертензивное действие пропорционально улучшению податливости сосудистой стенки и снижению общего и артериолярного периферического сосудистого сопротивления.
Индапамид снижает гипертрофию левого желудочка.
При превышении дозы тиазидного и тиазидоподобного диуретика антигипертензивный эффект достигает плато, а нежелательные реакции продолжают увеличиваться. Если лечение неэффективно, дозу препарата не следует увеличивать.
Кроме того, было установлено, что в краткосрочной, среднесрочной и долгосрочной перспективе у пациентов с артериальной гипертензией индапамид:
— не оказывает влияния на липидный обмен: триглицериды, ЛПНП-холестерин и ЛПВП-холестерин;
— не оказывает влияния на углеводный обмен даже у гипертензивных пациентов с сахарным диабетом.
Амлодипин
Провели антигипертензивную и гиполипидемическую терапию для предотвращения сердечного приступа (ALLHAT) для сравнения более новой лекарственной терапии (амлодипин или ингибитор АПФ в качестве препарата первой линии) с терапией на основе тиазидных диуретиков у пациентов с гипертензией легкой и умеренной степени. Не наблюдалось значительного различия в исходах сердечно-сосудистых заболеваний между терапией на основе амлодипина и терапией на основе тиазидного диуретика.
Периндоприл/индапамид
У пациентов с артериальной гипертензией независимо от возраста периндоприл/индапамид оказывает дозозависимое антигипертензивное действие на диастолическое и систолическое артериальное давление в положении лежа на спине или в положении стоя. Такое антигипертензивное действие длится 24 часа. Снижение артериального давления достигается менее чем за один месяц без развития тахифилаксии; в случае остановки лечения не наблюдается эффекта отмены. В ходе проведения клинических испытаний установили, что одновременный прием периндоприла и индапамида привел к гипотензивному действию синергического характера по отношению к каждому из препаратов, вводимых по отдельности.
В ходе проведения исследования PICXEL (многоцентровое рандомизированное двойное слепое активное контролируемое исследование) оценили влияние комбинации периндоприл/индапамид на ГЛЖ путем проведения эхокардиографии по сравнению с монотерапией эналаприлом.
В исследовании PICXEL пациенты с артериальной гипертензией с ГЛЖ (определяемым как индекс массы левого желудочка (ИМЛЖ) > 120 г/м2 у мужчин и > 100 г/м2 у женщин) были рандомизированы в группу приема периндоприл-трет-бутиламина 2 мг/индапамида 0.625 мг или эналаприла 10 мг один раз в день в течение одного года лечения. Доза была скорректирована в соответствии с артериальным давлением, вплоть до приема периндоприл-трет-бутиламина 8 мг и индапамида 2.5 мг или эналаприла 40 мг один раз в день. Только 34% субъектов остались на лечении периндоприл-трет-бутиламин 2 мг/индапамид 0.625 мг (по сравнению с 20% пациентами, которые принимали эналаприл 10 мг).
В конце лечения ИМЛЖ значительно снизился в группе приема периндоприла/индапамида (-10.1 г/м2) по сравнению с группой приема эналаприла (-1.1 г/м2) во всех рандомизированных группах пациентов. Межгрупповое различие в изменении ИМЛЖ составило -8.3 (ДИ 95% (-11.5, -5.0), р <0.0001).
Лучший эффект на ИМЛЖ достигался при более высокой дозе периндоприла/ индапамида.
Что касается артериального давления, предполагаемые средние межгрупповые различия в рандомизированной популяции составляли: снижение систолического артериального давления на 5.8 мм рт. ст. (95% ДИ (-7.9, -3.7), <р 0.0001) и снижение диастолического артериального давления на 2.3 мм рт. ст. (95% ДИ (-3.6, -0.9), р = 0.0004). Препарат был более эффективен в группе приема периндоприла/индапамида.
Пациенты детского возраста
Периндоприл/индапамид
Нет доступных данных относительно применения периндоприла/индапамида у детей.
Амлодипин
В исследовании с участием 268 детей в возрасте 6 — 17 лет с преимущественно вторичной гипертензией сравнение дозы 2.5 мг и дозы 5.0 мг амлодипина с плацебо показало, что обе дозы снижали систолическое артериальное давление значительно больше, чем плацебо. Различие между двумя дозами было статистически незначительно.
Долгосрочные эффекты амлодипина на рост, половое созревание и общее развитие не изучены. Также не установлена долгосрочная эффективность амлодипина при терапии в детском возрасте для снижения сердечно-сосудистой заболеваемости и смертности в зрелом возрасте.
Фармакокинетика
Периндоприл
Всасывание, биотрансформация
После перорального приема периндоприл всасывается быстро, максимальная концентрация в крови достигается в течение 1 часа. Период полувыведения периндоприла из плазмы составляет 1 час.
Поскольку прием пищи снижает процесс преобразования в периндоприлат а, следовательно, и биодоступность, периндоприл следует принимать перорально в виде одной таблетки в день утром перед приемом пищи.
Распределение
Объем распределения составляет примерно 0.2 л/кг для несвязанного периндоприлата. Связывание периндоприлата с белками плазмы составляет 20%, в основном, с ангиотензинпревращающим ферментом, но зависит от концентрации.
Биотрансформация
Периндоприл является пролекарством. Двадцать семь процентов от введенной дозы периндоприла попадает в систему кровообращения в виде активного метаболита периндоприлата. Помимо активного периндоприлата, периндоприл образует еще пять метаболитов, но все они неактивны. Пиковая концентрация периндоприлата в плазме достигается в течение 3 — 4 часов.
Выведение
Периндоприлат выводится с мочой, а конечный период полураспада несвязанной фракции составляет приблизительно 17 часов. Равновесное состояние достигается в течение 4 дней.
Линейность/нелинейность
Подтверждена линейная зависимость между дозой периндоприла и его содержанием в плазме.
Особые группы пациентов
Выведение периндоприлата снижается у пациентов пожилого возраста, а также у пациентов с сердечной или почечной недостаточностью.
Желательно скорректировать дозу препарата при почечной недостаточности в зависимости от степени нарушения функции почек (клиренса креатинина).
Диализный клиренс периндоприлата составляет 70 мл/мин.
Кинетика периндоприла изменена у пациентов с циррозом печени: печёночный клиренс исходной молекулы снижен вдвое. Однако количество образующегося периндоприлата не уменьшается и, следовательно, не требуется корректировка дозы (см. разделы «Режим дозирования» и «Особые указания»).
Индапамид
Всасывание
Индапамид быстро и полностью всасывается в желудочно-кишечном тракте.
Пиковый уровень в плазме достигается приблизительно через час после перорального приема препарата.
Распределение
Связывание с белками плазмы составляет 79%.
Биотрансформация/выведение
Период полувыведения составляет от 14 до 24 часов (в среднем 18 часов). Повторное введение не приводит к накоплению в организме. Препарат, в основном, выводится с мочой (70% от принятой дозы) и фекалиями (22%) в виде неактивных метаболитов.
Особые группы пациентов
Фармакокинетика не изменяется у пациентов с почечной недостаточностью.
Амлодипин
Всасывание, распределение
После перорального применения терапевтических доз амлодипин хорошо всасывается, с пиковыми уровнями в крови через 6 — 12 часов после приема дозы препарата. Была рассчитана абсолютная биодоступность, которая составила 64% — 80%. Объем распределения составляет примерно 21 л/кг. Биодоступность препарата не изменяется в зависимости от приема пищи. В исследованиях амлодипина in vitro было показано, что приблизительно 97.5% находящегося в системном кровотоке препарата связывается с белками плазмы крови.
Биотрансформация/выведение
Терминальный период полувыведения из плазмы составляет 35 — 50 часов и согласуется с дозированием один раз в сутки.
Амлодипин в значительной степени метаболизируется в печени в неактивные метаболиты. Около 60% введенной дозы препарата выводится с мочой, 10% — в неизменном виде (в виде амлодипина).
Время до достижения пиковых плазменных концентраций амлодипина сравнимо у пожилых пациентов и более молодых субъектов. Клиренс амлодипина имеет тенденцию к снижению с последующим увеличением площади под кривой (AUC) и периода полувыведения у пожилых пациентов. Рекомендуемая схема приема препарата для пожилых пациентов такая же, хотя увеличение дозы следует проводить с осторожностью.
Фармакокинетика индапамида остается неизменной у пациентов с почечной недостаточностью.
Кинетика периндоприла изменена у пациентов с циррозом печени: печёночный клиренс первичной молекулы снижен вдвое. Однако количество образующегося периндоприлата не уменьшается и, следовательно, не требуется корректировка дозы (см. разделы «Режим дозирования» и «Особые указания»).
Как и в случае применения антагонистов кальция, период полувыведения амлодипина удлиняется у пациентов с нарушением функции печени.
Пациенты детского возраста
Популяционное исследование ФК было проведено с участием 74 детей с гипертензией в возрасте от 12 месяцев до 17 лет (34 пациента в возрасте от 6 до 12 лет и 28 пациентов в возрасте от 13 до 17 лет), получавших амлодипин в дозе от 1.25 до 20 мг один или два раза в сутки. У детей в возрасте от 6 до 12 лет и у подростков 13 — 17 лет типичный клиренс при пероральном приеме препарата (CL/F) составлял 22.5 и 27.4 л/ч соответственно у мужчин и 16.4 и 21.3 л/ч соответственно у женщин. Наблюдалась большая вариабельность воздействия между отдельными пациентами. Имеются ограниченные данные по детям младше 6 лет.
Данные доклинической безопасности
Периндоприл
В исследованиях длительной токсичности при пероральном приеме препарата (на крысах и обезьянах) целевым органом являются почки с обратимыми повреждениями.
В исследованиях in vitro или in vivo мутагенности не наблюдалось.
При проведении исследований репродуктивной токсикологии (на крысах, мышах, кроликах и обезьянах) не было выявлено признаков эмбриотоксичности или тератогенности. Однако установили, что ингибиторы ангиотензинпревращающего фермента, как класс, оказывают неблагоприятное воздействие на позднее развитие плода, приводя к гибели плода и развитию врожденных дефектов у грызунов и кроликов: наблюдается поражение почек и увеличение уровня перинатальной и постнатальной смертности. При проведении долгосрочных исследований на крысах и мышах не наблюдалось признаков канцерогенности.
Индапамид
При пероральном введении самых высоких доз различным видам животных (в 40 – 8000 раз превышающих терапевтическую дозу) наблюдалось обострение диуретических свойств индапамида. Основные симптомы отравления во время проведения исследований острой токсичности индапамидом, который вводили внутривенно или внутрибрюшинно, были связаны с фармакологическим действием индапамида, т.е. с развитием брадипноэ и периферической вазодилатации.
При проведении исследований установили, что индапамид не обладает мутагенными и канцерогенными свойствами.
Периндоприл/Индапамид
В исследованиях репродуктивной токсикологии не было выявлено признаков эмбриотоксичности или тератогенности. Также не было ухудшения фертильности.
Амлодипин
Исследования репродуктивности у крыс и мышей показали отложенную дату родов, увеличение длительности родов и уменьшение выживаемости потомства при применении доз приблизительно в 50 раз выше максимальной рекомендованной дозы для человека, на основании мг/кг.
Отсутствует влияние на фертильность у крыс, получавших амлодипин (самцы в течение 64 дней, самки в течение 14 дней до спаривания) в дозах до 10 мг/кг/сутки (в 8 раз* больше рекомендованной дозы для человека 10 мг на основании мг/м2). В другом исследовании, в котором самцы крысы получали амлодипина безилат в течение 30 дней в дозе, сравнимой с дозой для человека на основании мг/кг, было обнаружено снижение плазменного фолликулостимулирующего гормона и тестостерона, как и снижение плотности спермы и количества зрелых сперматид и клеток Сертоли.
Крысы и мыши, получавшие амлодипин в рационе в течение двух лет, в концентрациях, рассчитанных на обеспечение уровней суточной дозы 0.5, 1.25 и 2.5 мг/кг/сутки, не показали признаков канцерогенности. Наивысшая доза (для мышей — близкая к рекомендованной клинической дозе 10 мг на основе мг/м2, а у крыс — в два раза превышающая ее*) была близка к максимально переносимой дозе для мышей, но не для крыс. В результате исследований мутагенности не было выявлено дефектов на уровне генов или хромосом, связанных с лекарственным средством.
* На основании массы пациента 50 кг
Показания к применению
— лечение артериальной гипертензии у пациентов, которые контролируют артериальное давление крови применением периндоприла, индапамида и амлодипина в тех же дозировках.
Реклама
Режим дозирования
Для приема внутрь. Препарат принимают внутрь по 1 таб. 1 раз/сут, предпочтительно утром перед едой.
Комбинированный препарат с фиксированной дозировкой не подходит для начальной терапии.
Если необходимо изменить режим дозирования препарата, это выполняют на индивидуальной основе путем титрования дозы компонентов по отдельности.
Максимальная рекомендуемая доза препарата Ко-Амлесса составляет 8 мг/10 мг/2.5 мг в день.
Выведение периндоприлата снижается у пациентов с почечной недостаточностью. Поэтому обычное медицинское наблюдение включает частый мониторинг уровня креатинина и калия (см. разделы «Особые указания» и «Фармакокинетика»).
Применение препарата противопоказано пациентам с почечной недостаточностью тяжелой степени (КК <30 мл/мин). Препарат с дозировками 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг противопоказан пациентам с умеренными нарушениями функции почек (ниже 60 мл/мин). Ко-Амлессу можно назначать пациентам с клиренсом креатинина ≥ 60 мл/мин. Таким пациентам рекомендован индивидуальный подбор доз отдельно каждого компонента.
Изменения плазменных концентраций амлодипина не коррелируют со степенью почечной недостаточности. Амлодипин не поддается диализу.
Пациентам с тяжелым нарушением функции печени применение препарата противопоказано. Режим дозирования для пациентов с нарушениями функции печени легкой или средней степени тяжести не установлен, при назначении указанной комбинации следует соблюдать осторожность (см. разделы «Особые указания» и «Фармакокинетика»).
У пациентов пожилого возраста выведение периндоприлата замедлено. Поэтому обычное медицинское наблюдение включает частый мониторинг уровня креатинина и калия (см. разделы «Особые указания» и «Фармакокинетика»).
Безопасность и эффективность препарата у детей и подростков не установлены. Данные отсутствуют.
Побочные действия
Общая оценка безопасности
Периндоприл ингибирует систему ренин-ангиотензин-альдостерон и способствует снижению потери калия, вызванной приемом индапамида. Гипокалиемия наблюдалась у 2% пациентов, получавших 2 мг периндоприла/0.625 мг индапамида (уровень калия <3.4 ммоль/л). Гипокалиемия наблюдалась у 4% пациентов, получавших 4 мг периндоприла/1.25 мг индапамида (уровень калия <3.4 ммоль/л). Гипокалиемия наблюдалась у 6% пациентов, получавших 8 мг периндоприла/2.5 мг индапамида (уровень калия <3.4 ммоль/л).
Следующие нежелательные эффекты наблюдались во время проведения клинических испытаний и/или в период пострегистрационного применения и были классифицированы по частоте.
Наиболее частые нежелательные реакции
— связанные с приемом периндоприла: головокружение, головная боль, парестезия, дисгевзия, нарушение зрения, вертиго, тиннитус, гипотензия, кашель, одышка, боль в животе, запор, диспепсия, диарея, тошнота, рвота, зуд, сыпь, мышечные спазмы и астения;
— связанные с приемом индапамида: гипокалиемия, реакции гиперчувствительности, преимущественно дерматологического характера, у субъектов с предрасположенностью к аллергическим и астматическим реакциям и макулопапулезным высыпаниям;
— связанные с приемом амлодипина: сонливость, головокружение, головная боль, учащенное сердцебиение, гиперемия, боль в животе, тошнота, отек лодыжки, отек и усталость.
Классификация частоты развития побочных эффектов согласно ВОЗ: очень часто (≥1/10), часто (≥1/100 до <1/10), нечасто (≥1/1000 до <1/100), редко (≥1/10 000 до <1/1000), очень редко (<1/10 000), частота неизвестна (не может быть оценена по доступным данным).
Сводная таблица нежелательных реакций
|
Побочные эффекты |
Частота |
||
|
Периндоприл |
Индапамид |
Амлодипин |
|
|
Инфекции и инвазии |
|||
|
Ринит |
Очень редко |
— |
Нечасто |
|
Со стороны системы кроветворения и лимфатической системы |
|||
|
Эозинофилия |
Нечасто* |
— |
— |
|
Лейкопения |
Очень редко |
Очень редко |
Очень редко |
|
Нейтропения (см. раздел «Особые указания») |
Очень редко |
— |
— |
|
Агранулоцитоз (см. раздел «Особые указания») |
Очень редко |
Очень редко |
— |
|
Панцитопения |
Очень редко |
— |
— |
|
Тромбоцитопения (см. раздел «Особые указания») |
Очень редко |
Очень редко |
Очень редко |
|
Апластическая анемия |
— |
Очень редко |
— |
|
Гемолитическая анемия |
Очень редко |
Очень редко |
— |
|
Со стороны иммунной системы |
|||
|
Гиперчувствительность (реакции, преимущественно дерматологического характера, у субъектов с предрасположенностью к аллергическим и астматическим реакциям) |
— |
Часто |
Очень редко |
|
Эндокринные нарушения |
|||
|
Синдром неадекватной секреции антидиуретического гормона (SIADH) |
Редко |
— |
— |
|
Со стороны метаболизма и питания |
|||
|
Гипогликемия (см. разделы «Особые указания» и «Лекарственное взаимодействие») |
Нечасто* |
— |
— |
|
Гиперкалиемия, обратимая при отмене препарата (см. разделы «Особые указания») |
Нечасто* |
— |
— |
|
Гипонатриемия (см. разделы «Особые указания») |
Нечасто* |
Нечасто |
— |
|
Гиперкальциемия |
— |
Очень редко |
— |
|
Гипокалиемия (см. раздел «Особые указания») |
— |
Часто |
— |
|
Гипохлоремия |
— |
Редко |
— |
|
Гипомагниемия |
— |
Редко |
— |
|
Психические нарушения |
|||
|
Бессонница |
— |
— |
Нечасто |
|
Изменения настроения |
Нечасто |
— |
Нечасто |
|
Депрессия |
Нечасто |
— |
Нечасто |
|
Расстройства сна |
Нечасто |
— |
— |
|
Спутанность сознания |
Очень редко |
— |
Редко |
|
Со стороны нервной системы |
|||
|
Сонливость |
Нечасто* |
— |
Часто |
|
Головокружение |
Часто |
— |
Часто |
|
Головная боль |
Часто |
Редко |
Часто |
|
Тремор |
— |
— |
Нечасто |
|
Обморочное состояние |
Нечасто* |
Частота неизвестна |
Нечасто |
|
Парестезия |
Часто |
Редко |
Нечасто |
|
Гипестезия |
— |
— |
Нечасто |
|
Дисгевзия |
Часто |
— |
Нечасто |
|
Гипертонус |
— |
— |
Очень редко |
|
Периферическая невропатия |
— |
— |
Очень редко |
|
Экстрапирамидное расстройство |
— |
— |
Частота неизвестна |
|
Инсульт, может быть вторичным по отношению к избыточной гипотензии у пациентов с высоким риском (см. раздел «Особые указания») |
Очень редко |
— |
— |
|
Возможность развития печеночной энцефалопатии при печеночной недостаточности (см. разделы «Противопоказания» и «Особые указания») |
— |
Частота неизвестна |
— |
|
Со стороны органа зрения |
|||
|
Расстройства зрения |
Часто |
Частота неизвестна |
Нечасто |
|
Миопия (см. раздел «Особые указания») |
— |
Частота неизвестна |
— |
|
Нечеткость зрения |
— |
Частота неизвестна |
— |
|
Острая закрытоугольная глаукома |
— |
Частота неизвестна |
— |
|
Хориоидальный выпот |
— |
Частота неизвестна |
— |
|
Со стороны органа слуха и лабиринта |
|||
|
Головокружение |
Часто |
Редко |
— |
|
Тиннитус |
Часто |
— |
Нечасто |
|
Со стороны сердца |
|||
|
Ощущение сердцебиения |
Нечасто* |
— |
Часто |
|
Тахикардия |
Нечасто* |
— |
Нечасто |
|
Стенокардия (см. раздел «Особые указания») |
Очень редко |
— |
— |
|
Инфаркт миокарда, возможно вследствие избыточной гипотензии у пациентов группы высокого риска (см. раздел «Особые указания») |
Очень редко |
— |
Очень редко |
|
Аритмия (включая брадикардию, желудочковую тахикардию и фибрилляцию предсердий) |
Очень редко |
Очень редко |
Нечасто |
|
Желудочковая тахикардия типа «пируэт» (возможно с летальным исходом) (см. разделы «Особые указания» и «Лекарственное взаимодействие») |
— |
Частота неизвестна |
— |
|
Сосудистые нарушения |
|||
|
Приливы жара |
Редко |
— |
Часто |
|
Артериальная гипотензия и связанные с ней эффекты (см. раздел «Особые указания») |
Часто |
Очень редко |
Нечасто |
|
Васкулит |
Нечасто* |
— |
Очень редко |
|
Феномен Рейно |
Частота неизвестна |
— |
— |
|
Со стороны дыхательной системы |
|||
|
Диспноэ |
Часто |
— |
Нечасто |
|
Кашель (см. раздел «Особые указания») |
Часто |
— |
Нечасто |
|
Бронхоспазм |
Нечасто |
— |
— |
|
Эозинофильная пневмония |
Очень редко |
— |
— |
|
Со стороны пищеварительной системы |
|||
|
Гипертрофический гингивит |
— |
— |
Очень редко |
|
Боли в животе |
Часто |
— |
Часто |
|
Запор |
Часто |
Редко |
Часто |
|
Рвота |
Часто |
Нечасто |
Нечасто |
|
Диспепсия |
Часто |
— |
Нечасто |
|
Тошнота |
Часто |
Редко |
Часто |
|
Сухость во рту |
Нечасто |
Редко |
Нечасто |
|
Диарея |
Часто |
— |
Часто |
|
Панкреатит |
Очень редко |
Очень редко |
Очень редко |
|
Гастрит |
— |
— |
Очень редко |
|
Нарушения со стороны печени и желчевыводящих путей |
|||
|
Гепатит (см. раздел «Особые указания») |
Очень редко |
Частота неизвестна |
Очень редко |
|
Желтуха |
— |
— |
Очень редко |
|
Нарушение функции печени |
— |
Очень редко |
— |
|
Со стороны кожи и подкожных тканей |
|||
|
Отек Квинке |
— |
— |
Очень редко |
|
Ангионевротический отек (см. раздел «Особые указания») |
Нечасто |
Очень редко |
Очень редко |
|
Алопеция |
— |
— |
Нечасто |
|
Пурпура |
— |
Нечасто |
Нечасто |
|
Изменение цвета кожи |
— |
— |
Нечасто |
|
Гипергидроз |
Нечасто |
— |
Нечасто |
|
Экзантема |
— |
— |
Нечасто |
|
Зуд |
Часто |
— |
Нечасто |
|
Сыпь |
Часто |
— |
Нечасто |
|
Крапивница (см. раздел «Особые указания») |
Нечасто |
Очень редко |
Нечасто |
|
Эксфолиативный дерматит |
— |
— |
Очень редко |
|
Синдром Стивенса-Джонсона |
— |
Очень редко |
Очень редко |
|
Фотосенсибилизация |
Нечасто* |
Частота неизвестна |
Очень редко |
|
Пемфигоид |
Нечасто* |
||
|
Макулопапулезная сыпь |
— |
Часто |
— |
|
Токсический эпидермальный некролиз |
— |
Очень редко |
Частота неизвестна |
|
Обострение псориаза |
Редко* |
— |
— |
|
Мультиформная эритема |
Очень редко |
— |
Очень редко |
|
Со стороны мышечной, скелетной и соединительной ткани |
|||
|
Отек лодыжки |
— |
— |
Часто |
|
Артралгия |
Нечасто* |
Нечасто |
|
|
Миалгия |
Нечасто* |
— |
Нечасто |
|
Мышечные спазмы |
Часто |
Частота неизвестна |
Часто |
|
Мышечная слабость |
— |
Частота неизвестна |
— |
|
Рабдомиолиз |
— |
Частота неизвестна |
— |
|
Боль в спине |
— |
— |
Нечасто |
|
Со стороны почек и мочевыводящих путей |
|||
|
Болезненные позывы на мочеиспускание, никтурия, учащенное мочеиспускание |
— |
— |
Нечасто |
|
Почечная недостаточность |
Нечасто |
— |
— |
|
Острая почечная недостаточность |
Редко |
Очень редко |
— |
|
Анурия / Олигурия |
Редко |
— |
— |
|
Со стороны репродуктивной системы и молочной железы |
|||
|
Эректильная дисфункция |
Нечасто |
Нечасто |
Нечасто |
|
Гинекомастия |
— |
— |
Нечасто |
|
Общие нарушения и реакции в месте введения |
|||
|
Периферический отек |
Нечасто* |
— |
Очень часто |
|
Патологическая усталость |
— |
Редко |
Часто |
|
Боль в грудной клетке |
Нечасто* |
— |
Нечасто |
|
Астения |
Часто |
— |
Нечасто |
|
Болевые ощущения |
— |
— |
Нечасто |
|
Чувство общего недомогания |
Нечасто* |
— |
Нечасто |
|
Повышение температуры тела |
Нечасто* |
— |
— |
|
Лабораторные показатели и инструментальные данные |
|||
|
Повышение активности печеночных ферментов |
Редко |
Частота неизвестна |
Очень редко** |
|
Повышение уровня билирубина в крови |
Редко |
— |
— |
|
Удлинение интервала QT на ЭКГ (см. разделы «Особые указания» и «показатели и инструментальные данные») |
— |
Частота неизвестна |
— |
|
Снижение уровня гемоглобина, снижение уровня гематокрита (см. раздел «Особые указания») |
Очень редко |
— |
— |
|
Повышение уровня глюкозы в крови |
— |
Частота неизвестна |
Очень редко |
|
Повышение уровня мочевой кислоты в крови |
— |
Частота неизвестна |
— |
|
Повышение уровня мочевины в крови |
Нечасто* |
— |
— |
|
Повышение уровня креатинина в крови |
Нечасто* |
— |
— |
|
Увеличение массы тела, снижение массы тела |
— |
— |
Нечасто |
|
Травмы, интоксикации и осложнения процедур |
|||
|
Падения |
Нечасто* |
— |
— |
* Частота вычислена на основе клинических исследований нежелательных реакций, полученных в спонтанных сообщениях
** В основном в связи с холестазом
Описание отдельных нежелательных реакций
Во время клинических исследований II и III фазы, в которых сравнивали дозы индапамида 1.5 мг и 2.5 мг, анализ содержания калия в плазме крови продемонстрировал дозозависимые эффекты индапамида:
— индапамид 1.5 мг: концентрации калия в плазме крови <3.4 ммоль/л наблюдали у 10% пациентов и <3.2 ммоль/л — у 4% пациентов после 4 – 6 недель лечения. После 12 недель лечения среднее значение падения концентрации калия в плазме крови составило 0.23 ммоль/л;
— индапамид 2.5 мг: концентрации калия в плазме крови <3.4 ммоль/л наблюдали у 25% пациентов и <3.2 ммоль/л — у 10% пациентов после 4 – 6 недель лечения. После 12 недель лечения среднее значение падения концентрации калия в плазме крови составило 0.41 ммоль/л.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях.
Противопоказания к применению
— повышенная чувствительность к периндоприлу или другим ингибиторам АПФ, индапамиду или любым другим сульфонамидам, амлодипину или другим производным дигидропиридина, к любому из вспомогательных веществ;
— ангионевротический отек в анамнезе, связанный с предшествующей терапией ингибиторами АПФ (см. раздел «Особые указания»);
— наследственный или идиопатический ангионевротический отек;
— тяжелая артериальная гипотензия;
— шок, включая кардиогенный шок;
— обструкция выносящего тракта левого желудочка (например, при тяжелом аортальном стенозе);
— гемодинамически нестабильная сердечная недостаточность после острого инфаркта миокарда;
— почечная недостаточность тяжелой степени (КК <30 мл/мин);
— умеренные нарушения функции почек (КК <60 мл/мин) — для дозировок, содержащих 8 мг/2.5 мг периндоприла/индапамида (в т.ч. таблетки 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг);
— печеночная энцефалопатия;
— тяжелые нарушения функции печени;
— гипокалиемия;
— экстракорпоральное лечение, которое приводит к контакту крови с отрицательно заряженными поверхностями (см. раздел «Лекарственное взаимодействие»);
— одновременное применение с препаратами, содержащими алискирен, у пациентов с сахарным диабетом или почечной недостаточностью (СКФ <60 мл/мин/1.73 м2) (см. разделы «Лекарственное взаимодействие» и «Фармакологическое действие»);
— одновременное применение сакубитрила/валсартана. Препарат Ко-Амлесса не следует начинать принимать раньше, чем через 36 часов после приема последней дозы сакубитрила/валсартана (см. также разделы «Особые указания» и «Лекарственное взаимодействие»);
— значительный двусторонний стеноз почечной артерии или стеноз артерии единственной функционирующей почки (см. раздел «Особые указания»);
— II и III триместры беременности (см. разделы «Особые указания» и «Беременность и лактация»);
По причине отсутствия достаточного терапевтического опыта таблетки Ко-Амлесса не следует использовать в следующих случаях:
— пациентам, находящимся на диализе;
— пациентам с декомпенсированной сердечной недостаточностью без лечения.
Применение при беременности и кормлении грудью
БЕРЕМЕННОСТЬ И ЛАКТАЦИЯ
Беременность
Препарат Ко-Амлесса не рекомендуется принимать в течение I триместра беременности. Препарат Ко-Амлесса противопоказан во II и III триместрах беременности.
Периндоприл
Применение ингибиторов АПФ не рекомендуется в I триместре беременности (см. раздел «Особые указания»). Применение ингибиторов АПФ противопоказано во II и III триместрах беременности (см. разделы «Противопоказания» и «Особые указания»).
Эпидемиологические данные о риске проявления тератогенности при приеме ингибиторов АПФ в I триместре беременности не позволяют сделать окончательное заключение, однако некоторое повышение риска не исключается. Кроме тех случаев, когда невозможно произвести замену ингибиторов АПФ на иную альтернативную терапию, пациентки, планирующие беременность, должны быть переведены на терапию лекарственными средствами, у которых профиль безопасности для беременных женщин является хорошо изученным.
При наступлении беременности прием ингибитора АПФ должен быть прекращен незамедлительно, и при необходимости назначена иная терапия. При применении ингибиторов АПФ во II и III триместрах беременности установлено проявление фетотоксического действия (нарушение функции почек, олигогидрамнион, задержка окостенения костей черепа) и неонатальной токсичности (почечная недостаточность, артериальная гипотензия, гиперкалиемия) (см. раздел «Данные доклинической безопасности»).
Если прием ингибитора АПФ проводился со II триместра беременности, рекомендуется провести УЗИ функции почек и костей черепа. У новорожденных, матери которых принимали ингибиторы АПФ, необходимо тщательно контролировать АД для предотвращения возможного развития артериальной гипотензии (см. разделы «Противопоказания» и «Особые указания»).
Индапамид
Нет достаточных данных относительно применения индапамида у беременных (менее 300 исходов беременности). Длительное воздействие тиазида в течение третьего триместра беременности может уменьшить объем плазмы в организме матери, а также маточно-плацентарный кровоток, что может привести к развитию фетоплацентарной ишемии и задержке роста плода.
Результаты исследований на животных не показали наличия прямого или косвенного вредного воздействия на репродуктивную функцию (см. раздел «Данные доклинической безопасности»).
В качестве меры предосторожности рекомендуется избегать применения индапамида во время беременности.
Амлодипин
Безопасность использования амлодипина во время беременности не оценивалась.
Ограниченные данные о приеме препарата во время беременности не подтверждают, что амлодипин или другие антагонисты кальциевых рецепторов оказывают вредное воздействие на плод. Тем не менее, может присутствовать риск удлинения процесса родоразрешения.
В исследованиях на животных наблюдалась репродуктивная токсичность при использовании высоких доз (см. раздел «Данные доклинической безопасности»).
Лактация
Препарат Ко-Амлесса не рекомендован в период грудного вскармливания. Поэтому следует принять решение о прекращении кормления грудью или о прекращении приема препарата Ко-Амлесса, учитывая важность проводимой терапии для матери.
Периндоприл
Информация о применении периндоприла при кормлении грудью отсутствует.
Индапамид
Индапамид выделяется в грудное молоко. Индапамид тесно связан с тиазидными диуретиками, которые в случае их применения в период грудного вскармливания приводят к снижению или даже подавлению процесса лактации. Может возникнуть гиперчувствительность к сульфонамидным препаратам, гипокалиемия и ядерная желтуха. Нельзя исключить риск для новорожденных/младенцев. Индапамид не рекомендован в период грудного вскармливания.
Амлодипин
Амлодипин выделяется в грудное молоко. Доля материнской дозы, полученная младенцем, оценивается с межквартильным размахом 3 – 7%, с максимумом 15%. Влияние амлодипина на вскармливаемых грудным молоком младенцев не изучено. Решение о том, следует ли продолжать/прекращать грудное вскармливание или продолжать/прекращать терапию амлодипином, следует принимать с учетом пользы грудного вскармливания для ребенка и пользы терапии амлодипином для матери.
Влияние на репродуктивную систему
Периндоприл и индапамид
Исследования репродуктивной токсичности не установили влияния препарата на репродуктивную функцию самок и самцов крыс (см. раздел «Данные доклинической безопасности»). Не ожидается никакого воздействия на репродуктивную функцию человека.
Амлодипин
Обратимые биохимические изменения в головке сперматозоидов наблюдались у некоторых пациентов, получавших блокаторы кальциевых каналов. Клинических данных недостаточно относительно потенциального влияния амлодипина на фертильность. В одном исследовании на крысах было обнаружено неблагоприятное влияние на фертильность у самцов (см. раздел «Данные доклинической безопасности»).
Применение при нарушениях функции печени
Пациентам с тяжелым нарушением функции печени применение препарата противопоказано.
Режим дозирования для пациентов с нарушениями функции печени легкой или средней степени тяжести не установлен, при назначении указанной комбинации следует соблюдать осторожность.
Применение при нарушениях функции почек
Противопоказано применение препарата при почечной недостаточности тяжелой степени (КК <30 мл/мин).
Препарат с дозировками 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг противопоказан пациентам с умеренными нарушениями функции почек (КК 30-60 мл/мин).
Применение у пожилых пациентов
У пациентов пожилого возраста выведение периндоприлата замедлено. Лечение данной категории пациентов следует проводить с учетом функции почек.
Применение у детей
Безопасность и эффективность препарата у детей и подростков не установлены.
Особые указания
Нейтропения/агранулоцитоз/тромбоцитопения/анемия
У пациентов, получающих ингибиторы АПФ, возможны случаи развития нейтропении/агранулоцитоза, тромбоцитопении и анемии. У пациентов с нормальной функцией почек при отсутствии других осложнений нейтропения встречается редко. Периндоприл с предельной осторожностью следует назначать пациентам с коллагенозами, применяющим иммуносупрессивное лечение, лечение аллопуринолом или прокаинамидом, особенно при уже существующих нарушениях функции почек. У таких пациентов могут развиваться серьезные инфекции, которые в некоторых случаях не отвечают на интенсивную антибиотикотерапию. В случае назначения периндоприла рекомендовано периодически контролировать количество лейкоцитов; пациенты должны быть проинформированы о том, что при появлении каких-либо признаков инфекционного заболевания (например, боль в горле, лихорадка) необходимо немедленно обратиться к врачу (см. разделы «Лекарственное взаимодействие» и «Побочное действие»).
Повышенная чувствительность/ангионевротический отек
Ангионевротический отек лица, конечностей, губ, языка, голосовой щели и/или гортани редко встречается у пациентов, получающих ингибиторы ангиотензинпревращающего фермента, включая периндоприл (см. раздел «Побочное действие»). Данные явления могут наблюдаться в любое время во время лечения. В таких случаях следует незамедлительно прекратить прием периндоприла, пациент должен находиться под постоянным контролем до полного устранения симптомов. В тех случаях, когда отек наблюдался только в области лица и губ, он обычно проходил без лечения, хотя рекомендуется принимать антигистаминные препараты для облегчения симптомов.
Ангионевротический отек, сопровождающийся отеком гортани, может привести к летальному исходу. При выявлении отека в области языка, глотки или гортани, который может повлечь за собой обструкцию дыхательных путей, должна быть незамедлительно назначена соответствующая терапия, включающая п/к введение раствора эпинефрина 1:1000 (0.3-0.5 мл), и/или приняты меры для обеспечения проходимости дыхательных путей.
Сообщалось, что у чернокожих пациентов, получавших ингибиторы АПФ, частота случаев развития ангионевротического отека была выше, чем у светлокожих пациентов.
У пациентов с ангионевротическим отеком в анамнезе, который не связан с терапией ингибиторами АПФ, может быть повышен риск развития ангионевротического отека во время приема препаратов этой группы (см. раздел «Противопоказания»).
Редко сообщалось о случаях развития ангионевротического отека кишечника у пациентов, получавших ингибиторы АПФ. У таких пациентов отмечалась боль в животе (с тошнотой или рвотой, или без них); в некоторых случаях не было зарегистрировано ангионевротического отека лица в анамнезе, а уровень C-1 эстеразы был в норме. Ангионевротический отек был диагностирован с помощью процедур, включающих КТ брюшной полости, УЗИ или во время проведения операции. Симптомы проходили после прекращения приема ингибитора АПФ. Ангионевротический отек кишечника следует включить в дифференциальную диагностику пациентов, которые принимают ингибиторы АПФ при абдоминальных болях.
Сопутствующее применение ингибиторов АПФ с сакубитрилом/валсартаном противопоказано по причине повышенного риска развития ангионевротического отека. Лечение сакубитрилом/валсартаном не следует начинать ранее, чем через 36 часов после приема последней дозы периндоприла. Периндоприл не следует начинать принимать раньше, чем через 36 часов после приема последней дозы сакубитрила/валсартана (см. также разделы «Противопоказания» и «Лекарственное взаимодействие»).
Сопутствующее применение ингибиторов АПФ с ингибиторами нейтральной эндопептидазы NEP (например, с рацекадотрилом), ингибиторами мишени рапамицина в клетках (например, с сиролимусом, эверолимусом, темсиролимусом) и глиптинами (например, с линаглиптином, саксаглиптином, ситаглиптином, вилдаглиптином) может привести к повышенному риску развития ангионевротического отека (например, отечность дыхательных путей или языка, с нарушением дыхания или без нарушения дыхания) (см. раздел «Лекарственное взаимодействие»). Следует соблюдать осторожность в начале приема рацекадотрила, ингибиторов мишени рапамицина в клетках (например, сиролимуса, эверолимуса, темсиролимуса) и глиптинов (например, линаглиптина, саксаглиптина, ситаглиптина, вилдаглиптина) у пациентов, которые уже принимают ингибиторы АПФ.
Анафилактоидные реакции во время десенсибилизации
Были зарегистрированы отдельные случаи, когда у пациентов отмечались устойчивые анафилактоидные реакции с угрозой для жизни при приеме ингибиторов АПФ во время десенсибилизирующей терапии ядом перепончатокрылых насекомых (пчелы, осы). Ингибиторы АПФ следует использовать с осторожностью у пациентов с аллергией при проведении десенсибилизации, а также следует избегать приема ингибиторов АПФ у пациентов, проходящих иммунотерапию ядами. Однако можно избежать развития данных реакций путем временной отмены ингибиторов АПФ в течение не менее 24 часов до начала процедуры десенсибилизации.
Анафилактоидные реакции во время афереза ЛПНП
У пациентов, получающих ингибиторы АПФ при проведении афереза ЛПНП с использованием сульфата декстрана, отмечены редкие случаи развития угрожающих жизни анафилактоидных реакций. Наступление таких реакций можно предотвратить путем временного прекращения приема ингибиторов АПФ перед каждой процедурой афереза ЛПНП.
Гемодиализ
Известны случаи развития анафилактоидных реакций у пациентов, проходящих гемодиализ с использованием мембран с высокой плотностью потока (например, AN69®) и одновременно находящихся на лечении ингибиторами АПФ. Таким пациентам следует назначать или применение мембран для диализа другого типа, или прием антигипертензивных препаратов другого класса.
Первичный альдостеронизм
Пациенты с первичным гиперальдостеронизмом обычно не отвечают на лечение антигипертензивными лекарственными средствами, воздействующими путем ингибирования ренин-ангиотензиновой системы. Поэтому использование данного препарата не рекомендуется.
Калийсберегающие диуретики, соли калия
Обычно не рекомендуется сочетать периндоприл с калийсберегающими препаратами, добавками калия или калийсодержащими заменителями соли (см. раздел «Лекарственное взаимодействие»).
Печеночная энцефалопатия
Индапамид: при нарушении функции печени тиазидные и тиазидоподобные диуретики могут вызвать, особенно в случае дисбаланса электролитов, печеночную энцефалопатию, которая, прогрессируя, может привести к печеночной коме. В таком случае следует немедленно прекратить прием диуретических средств.
Фоточувствительность
Сообщалось о случаях реакций фотосенсибилизации при применении тиазидных и тиазидоподобных диуретиков (см. раздел «Побочное действие»). При развитии во время терапии явлений фотосенсибилизации, рекомендуется прекращение лечения. Если необходимо повторное введение диуретика, рекомендуется защищать открытые участки кожи от солнца или от искусственного ультрафиолетового излучения.
Беременность и лактация
Ингибиторы АПФ не следует принимать во время беременности. За исключением случаев, когда непрерывная терапия с помощью ингибиторов АПФ считается принципиально необходимой, пациентов, планирующих беременность, следует перевести на альтернативные антигипертензивные препараты с установленным профилем безопасности применения во время беременности. Если беременность диагностирована, следует немедленно прекратить прием ингибиторов АПФ и, при необходимости, начать альтернативную терапию (см. разделы «Противопоказания» и «Беременность и лактация»).
Нарушения функции почек
Применение препарата противопоказано пациентам с тяжелыми нарушениями функции почек (КК <30 мл/мин).
Дозировки, содержащие 8 мг/2.5 мг периндоприла/индапамида (например, таблетки 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг) противопоказаны пациентам с умеренными нарушениями функции почек (КК <60 мл/мин).
Лечение также следует прекратить, если у пациента с артериальной гипертензией без предшествующего выраженного нарушения функции почек в ходе лабораторных исследований крови выявлена функциональная почечная недостаточность. Терапия может быть возобновлена либо в более низкой дозировке, либо только одним из компонентов.
При наблюдении таких пациентов обычно выполняют контроль уровней калия и креатинина через две недели лечения, а затем каждые два месяца в течение периода терапевтической стабильности. Нарушение функции почек отмечалось в основном у пациентов с сердечной недостаточностью тяжелой степени или с уже имеющейся почечной недостаточностью, включая стеноз почечной артерии
Почечная недостаточность отмечалась, главным образом, у пациентов с тяжелой сердечной недостаточностью или предшествующей почечной недостаточностью, включая стеноз почечной артерии.
Как правило, не рекомендуется применять лекарственный препарат при двустороннем стенозе почечной артерии или у пациентов с одной функционирующей почкой.
Тиазидные и тиазидоподобные диуретики эффективны только в случае, когда функция почек в норме или нарушена незначительно (уровень креатинина ниже 25 мг/л, то есть 220 мкмоль/л у взрослых). У пациентов пожилого возраста уровень креатинина в плазме следует корректировать с учетом возраста, массы тела и пола пациента в соответствии с формулой Кокрофта:
clcr = (140 — возраст) x масса тела / 0.814 x уровень креатинина в плазме
где: возраст в годах, масса тела в кг, уровень креатинина в плазме в мкмоль/л
Данная формула пригодна для мужчин пожилого возраста и подлежит корректировке для женщин путем умножения полученного результата на 0.85.
Гиповолемия, которая развивается в результате потери запасов воды и натрия, в связи с приемом диуретических средств в начале лечения, приводит к снижению клубочковой фильтрации. Это может привести к повышению уровня мочевины и креатинина в крови. Такая преходящая функциональная почечная недостаточность не имеет неблагоприятных последствий у пациентов с нормальной функцией почек, но может усугубить нарушение функции почек.
При наблюдении таких пациентов обычно выполняют частый контроль уровня калия и креатинина, через две недели лечения, а затем каждые два месяца в течение периода терапевтической стабильности.
Гипотензия и нарушение водно-электролитного баланса
Имеется риск развития внезапной гипотензии на фоне уже имеющегося снижения содержания натрия (особенно у пациентов, у которых артериальное давление было низким вначале, в случаях стеноза почечной артерии, застойной сердечной недостаточности или цирроза с отеком и асцитом). Поэтому блокада ренин-ангиотензин-альдостероновой системы может вызывать, особенно во время первого введения препарата и в течение первых двух недель лечения, внезапное снижение артериального давления и/или повышение уровня креатинина в плазме, что свидетельствует о развитии функциональной почечной недостаточности. Иногда, хотя и редко, подобное расстройство развивается остро, и начало процесса трудно предугадать.
Поэтому следует проводить систематическую проверку на наличие клинических признаков нарушения водно-электролитного баланса, которые могут возникнуть при интеркуррентном эпизоде диареи или рвоты. У таких пациентов следует проводить регулярный контроль уровня электролитов в плазме крови.
Выраженная гипотензия может потребовать внутривенного введения изотонического физиологического раствора. Преходящая гипотензия не является противопоказанием к продолжению лечения. После восстановления удовлетворительного объема крови и стабилизации артериального давления лечение можно начинать снова либо в уменьшенной дозе, либо с применением только одного из компонентов.
Двойная блокада РААС
Имеются данные, свидетельствующие о том, что сопутствующее применение ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена обуславливает увеличение риска развития гипотензии, гиперкалиемии и сниженной функции почек (включая острую почечную недостаточность). Таким образом, двойная блокада РААС посредством комбинированного применения ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена не рекомендуется (см. разделы «Лекарственное взаимодействие» и «Фармакологическое действие»).
Если терапия на основе двойной блокады считается абсолютно необходимой, ее следует осуществлять исключительно под наблюдением специалиста, а также при условии проведения частого и тщательного мониторинга функции почек, уровня электролитов и артериального давления. Не следует одновременно назначать ингибиторы АПФ и блокаторы рецепторов ангиотензина II пациентам с диабетической нефропатией.
Реноваскулярная гипертензия
Лечение реноваскулярной гипертензии осуществляется путем реваскуляризации. Тем не менее, применение ингибиторов АПФ может быть благоприятным у пациентов с реноваскулярной гипертензией, ожидающих хирургического вмешательства, или у которых проведение такой операции не представляется возможным.
Имеется повышенный риск развития гипотензии и почечной недостаточности, если пациент с двусторонним стенозом почечной артерии или стенозом артерии в одной функционирующей почке принимает ингибиторы АПФ (см. раздел «Противопоказания»). Лечение диуретиками может являться сопутствующим фактором. Утрата функции почек может наблюдаться даже при незначительном изменении уровня креатинина в сыворотке у пациентов с односторонним стенозом почечной артерии.
Если препарат Ко-Амлесса назначают пациентам со стенозом почечной артерии или с подозрением на стеноз почечной артерии, лечение следует начинать в стационаре с низкой дозы препарата. Следует контролировать функцию почек и уровень калия, поскольку у некоторых пациентов развилась функциональная почечная недостаточность, которая прошла при прекращении лечения.
Дозировки 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг не применимы для пациентов с известным или предполагаемым стенозом почечной артерии, поскольку лечение следует начинать в условиях стационара в дозировке ниже 8 мг/5 мг/2.5 мг или 8 мг/10 мг/2.5 мг.
Пациенты с диагностированным атеросклерозом
Риск артериальной гипотензии существует у всех пациентов, но особую осторожность необходимо соблюдать у пациентов с ИБС или недостаточностью мозгового кровообращения. Лечение следует начинать с низких доз.
Сердечная недостаточность
Применять препарат у пациентов с сердечной недостаточностью следует с осторожностью. У пациентов с тяжелой сердечной недостаточностью (класс IV) лечение должно быть начато под наблюдением врача и с более низких доз. Не следует прекращать применение бета-адреноблокаторов у пациентов с артериальной гипертензией и коронарной недостаточностью: ингибиторы АПФ нужно добавить в схему терапии бета-адреноблокаторами.
В продолжительном плацебо-контролируемом исследовании с участием пациентов с тяжелой сердечной недостаточностью (III и IV функциональные классы по NYHA) частота возникновения отека легких в группе амлодипина была выше, чем в группе плацебо (см. раздел «Фармакологическое действие»). Блокаторы кальциевых каналов, в т.ч. амлодипин, следует применять с осторожностью у пациентов с застойной сердечной недостаточностью, поскольку возможно увеличение риска сердечнососудистых осложнений и смертности.
Стеноз аортального или митрального клапана / гипертрофическая кардиомиопатия
Ингибиторы АПФ следует применять с осторожностью у пациентов с обструкцией выходного тракта левого желудочка.
Пациенты с сахарным диабетом
У пациентов с инсулинзависимым сахарным диабетом (опасность спонтанного повышения уровня калия) лечение следует начинать с низких доз и под контролем врача. У пациентов с сахарным диабетом, получающих гипогликемические средства для приема внутрь или инсулин, в течение первого месяца терапии ингибитором АПФ необходимо регулярно контролировать концентрацию глюкозы в крови (см. раздел «Лекарственное взаимодействие»).
Кашель
Сообщалось о случаях появления сухого кашля при использовании ингибиторов ангиотензинпревращающего фермента. Кашель носит стойкий характер, исчезает при прекращении лечения. Следует учитывать ятрогенную этиологию данного симптома. Если назначение ингибитора ангиотензинпревращающего фермента все еще является предпочтительным, можно рассмотреть возможность продолжения лечения.
Хирургические вмешательства/анестезия
Ингибиторы АПФ могут спровоцировать падение АД при проведении анестезии, особенно если используемый анестетик обладает гипотензивным действием. Поэтому лечение ингибиторами АПФ пролонгированного действия, такими как периндоприл, рекомендуется, по возможности, прекратить за 1 день до проведения хирургической операции.
Нарушение функции печени
В редких случаях терапия ингибиторами АПФ сопровождалась синдромом, который начинался с холестатической желтухи, прогрессировал до фульминантного некроза печени и (иногда) заканчивался летальным исходом. Механизм этого синдрома неизвестен. Пациенты, получающие ингибиторы АПФ, у которых развивается желтуха или значительно повышается уровень печеночных ферментов, должны прекратить прием ингибиторов АПФ и пройти медицинское обследование (см. раздел «Побочное действие»).
У пациентов с нарушенной функцией печени пролонгирован Т1/2 амлодипина и повышены значения AUC; рекомендации по дозированию не утверждены. Соответственно, лечение следует начинать с низких доз амлодипина и соблюдать осторожность, как в начале лечения, так и при увеличении дозы препарата. Для пациентов с тяжелым нарушением функции печени могут потребоваться медленное титрование дозы и тщательный мониторинг.
При нарушении функции печени тиазидные и тиазидоподобные диуретики могут приводить к развитию печеночной энцефалопатии. В таком случае следует немедленно прекратить прием диуретических средств.
Водно-электролитный баланс
Уровень натрия
Следует проверить до начала лечения, а затем необходимо проверять через равные промежутки времени. Любое лечение диуретическими препаратами может привести к гипонатриемии, иногда с очень серьезными последствиями. Первоначально снижение уровня натрия может протекать бессимптомно, поэтому необходим контроль данного показателя на регулярной основе. Чаще следует проводить анализ у пациентов пожилого возраста и у пациентов с циррозом печени (см. разделы «Побочное действие» и «Передозировка»).
Гипонатриемия с гиповолемией может являться причиной дегидратации и ортостатической гипотензии. Сопутствующая потеря ионов хлора может привести к вторичному компенсаторному метаболическому алкалозу, частота и степень которого незначительны.
Гиперкалиемия
Ингибиторы АПФ могут вызывать гиперкалиемию, поскольку они ингибируют высвобождение альдостерона. Эффект обычно незначителен у пациентов с нормальной функцией почек. К факторам риска развития гиперкалиемии относятся следующие: почечная недостаточность, ухудшение функции почек, возраст >70 лет, сахарный диабет, гипоальдостеронизм, интеркуррентные явления, в частности дегидратация, острая сердечная недостаточность, метаболический ацидоз и одновременное применение калийсберегающих диуретиков (например, спиронолактон, эплеренон, триамтерен или амилорид), добавок калия или калийсодержащих заменителей солей; а также прием других препаратов, связанных с повышением уровня калия в сыворотке (например, гепарин, триметоприм или ко-тримоксазол, также известный как триметоприм / сульфаметоксазол, и особенно антагонисты альдостерона или блокаторы ангиотензиновых рецепторов, ацетилсалициловая кислота ≥3 г/день, ингибиторы ЦОГ-2 и неселективные НПВП, иммунодепрессанты, такие как циклоспорин или такролимус). Применение добавок калия, калийсберегающих диуретиков или калийсодержащих заменителей солей, особенно у пациентов с нарушением функции почек, может привести к значительному увеличению уровня калия в сыворотке крови. Гиперкалиемия может привести к развитию серьезной аритмии, иногда с летальным исходом. Калийсберегающие диуретики и блокаторы ангиотензиновых рецепторов следует применять с осторожностью пациентам, получающим ингибиторы АПФ, а также следует контролировать уровень калия в сыворотке крови и функцию почек (см. раздел «Лекарственное взаимодействие»).
Гипокалиемия
Снижение уровня калия при гипокалиемии является основным риском, связанным с применением тиазидных и тиазидоподобных диуретиков. Гипокалиемия может вызвать мышечные нарушения. Сообщалось о случаях рабдомиолиза, особенно на фоне тяжелой гипокалиемии. Следует избегать снижения уровня калия (<3.4 ммоль/л) в группах пациентов с высоким риском, а именно у пациентов пожилого возраста и/или у субъектов с недостаточностью питания, независимо от того, принимают ли они несколько препаратов, у пациентов с циррозом печени, отеками и асцитом, у пациентов с коронарной болезнью и сердечной недостаточностью. В таких случаях гипокалиемия способствует увеличению токсического действия сердечных гликозидов на сердце и риска нарушений сердечного ритма.
Пациенты с увеличением интервала QT также относятся к группе риска, независимо от происхождения заболевания: носит ли оно врожденный или ятрогенный характер. Гипокалиемия, как и в случае брадикардии, выступает фактором, который способствует развитию серьезных нарушений ритма, в частности, пируэтной тахикардии, которая может привести к летальному исходу.
Во всех случаях необходимо чаще контролировать уровень калия. Первое измерение уровня калия в плазме крови выполняют в течение первой недели после начала лечения.
При низком уровне калия требуется его корректировка. Гипокалиемия на фоне низких концентраций магния может быть резистентной к лечению до тех пор, пока не будет проведена корректировка содержания магния в сыворотке крови.
Уровень магния
Тиазидные и тиазидоподобные диуретики, включая индапамид, повышают выведение магния с мочой, что может привести к гипомагниемии (см. разделы «Лекарственное взаимодействие» и «Побочное действие»).
Содержание кальция
Тиазидные и тиазидоподобные диуретики могут снизить выведение кальция с мочой и привести к умеренному и кратковременному повышению уровня кальция в плазме. Значительно повышенный уровень кальция может быть связан с развитием недиагностированного гиперпаратиреоза. В таких случаях лечение следует прекратить до исследования функции паращитовидной железы.
Мочевая кислота
У пациентов с гиперурикемией может увеличиваться частота обострения приступов подагры.
Литий
Одновременное применение лития и комбинации периндоприл/индапамид, как правило, не рекомендуется (см. раздел «Лекарственное взаимодействие»).
Спортсмены
Спортсмены должны учитывать, что данный продукт содержит активное вещество (индапамид), которое может давать положительную реакцию в допинг-тестах.
Хориоидальный выпот, острая миопия и вторичная закрытоугольная глаукома
Сульфонамиды или производные сульфонамида, могут вызывать идиосинкразические реакции, приводящие к развитию хориоидального выпота с дефектом поля зрения, острой кратковременной миопии и острой закрытоугольной глаукоме. Симптомы включают потерю остроты зрения или боль в глазах, которые возникают, как правило, в течение нескольких часов или недель после начала приема лекарственного препарата. При отсутствии лечения острая закрытоугольная глаукома может привести к необратимой потере зрения. При проявлении симптомов необходимо как можно скорее прекратить прием препарата. Если внутриглазное давление остается неконтролируемым, может потребоваться неотложное медикаментозное лечение или хирургическое вмешательство. Факторами риска развития острой закрытоугольной глаукомы могут быть аллергические реакции на сульфонамиды или пенициллин в анамнезе.
Расовая принадлежность
Периндоприл (как и другие ингибиторы АПФ) оказывает менее выраженное гипотензивное действие у пациентов негроидной расы по сравнению с представителями других рас, возможно, из-за более высокой распространенности состояний с низким содержанием ренина у данной категории пациентов, страдающих артериальной гипертензией.
Пациенты пожилого возраста
Перед началом лечения следует оценить функцию почек и уровень калия. Начальная доза впоследствии корректируется в соответствии с изменением артериального давления, особенно при наличии водно-электролитных нарушений, чтобы избежать внезапного развития гипотензии. При этом увеличивать дозу препарата следует с осторожностью (см. раздел «Фармакокинетика»).
Использование в педиатрии
Эффективность и переносимость препарата у детей и подростков не установлены.
Натрий
Данный лекарственный препарат содержит менее 1 ммоль натрия (23 мг) в одной таблетке, то есть фактически «не содержит натрия».
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследования влияния препарата Ко-Амлесса на способность к вождению транспортных средств и управлению механизмами не проводились. При вождении транспортных средств или при управлении механизмами следует учитывать, что во время лечения может периодически возникать головокружение или чувство усталости.
Передозировка
Периндоприл/индапамид
Симптомы: наиболее вероятной нежелательной реакцией в случае передозировки является развитие гипотензии и возможно рефлекторной тахикардии, иногда связанной с тошнотой, рвотой, судорогами, головокружением, сонливостью, спутанностью сознания, олигурией, которая может прогрессировать до анурии (вследствие развития гиповолемии). Может возникнуть нарушение водно-солевого баланса (низкий уровень натрия, низкий уровень калия).
Лечение: первые меры, которые необходимо предпринять, заключаются в быстром выведении препарата путем промывания желудка и/или введения активированного угля, затем следует восстановить водно-электролитный баланс в специализированном центре до нормального состояния.
В случае развития выраженной гипотензии пациента кладут в положение лежа с опущенной вниз головой. При необходимости можно выполнить внутривенную инфузию изотонического физиологического раствора или увеличить объем циркулирующей жидкости другим методом.
Периндоприлат — активная форма периндоприла — может быть удален из организма с помощью диализа. Однако в связи с тем, что амлодипин в значительной степени связывается с белками, диализ не является эффективным.
Амлодипин
Опыт применения амлодипина у людей с преднамеренной передозировкой ограничен.
Симптомы: доступные данные предполагают, что сильная передозировка амлодипина может привести к избыточной периферической вазодилатации и возможной рефлекторной тахикардии. Сообщалось о выраженной и стойкой артериальной гипотензии, в том числе с развитием шока и летальным исходом.
Лечение: в случае клинически значимой артериальной гипотензии, вызванной передозировкой амлодипина, необходимо проведение активной сердечно-сосудистой поддерживающей терапии, включая частый мониторинг деятельности сердца и функции дыхания, приподнятые нижние конечности, контроль ОЦК и диуреза.
Вазоконстрикторы могут помочь восстановлению сосудистого тонуса и АД при условии, что применение таких препаратов не противопоказано. Для снятия блокады кальциевых каналов может быть эффективно в/в введение глюконата кальция.
В некоторых случаях целесообразно провести промывание желудка. У здоровых добровольцев применение активированного угля в течение до 2 ч после приема 10 мг амлодипина привело к уменьшению скорости его всасывания. В связи с тем, что амлодипин в значительной степени связывается с белками, диализ не эффективен.
Лекарственное взаимодействие
В клинических исследованиях было продемонстрировано, что двойная блокада ренин-ангиотензин-альдостероновой системы (РААС) посредством комбинированного применения ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена ассоциируется с более высокой частотой развития таких нежелательных явлений, как гипотензия, гиперкалиемия и сниженная функция почек (включая острую почечную недостаточность), по сравнению с монотерапией препаратом, воздействующим на РААС (см. разделы «Противопоказания», «Особые указания» и Фармакологическое действие»).
Гиперкалиемия, вызванная применением лекарственных средств
Хотя содержание калия в сыворотке крови обычно остается в пределах нормы, гиперкалиемия может возникнуть у некоторых пациентов, принимающих Ко-Амлессу. Некоторые лекарственные препараты или терапевтические средства могут увеличивать вероятность развития гиперкалиемии: алискирен, соли калия, калийсберегающие диуретики (например, спиронолактон, триамтерен или амилорид), ингибиторы АПФ, антагонисты рецепторов ангиотензина-II, НПВП, гепарины, иммунодепрессанты, такие как циклоспорин или такролимус, триметоприм и ко-тримоксазол (триметоприм/сульфаметоксазол), поскольку известно, что триметоприм действует как калийсберегающий диуретик, подобно амилориду. Комбинация указанных препаратов увеличивает риск развития гиперкалиемии. В связи с этим, комбинация указанных препаратов с Ко-Амлессой не рекомендуется. Если одновременное применение показано, их следует применять с осторожностью и при частом мониторинге уровня калия в сыворотке крови.
Одновременный прием противопоказан (см. раздел «Противопоказания»)
Алискирен: у пациентов с сахарным диабетом или почечной недостаточностью повышен риск гиперкалиемии, ухудшения функции почек, сердечно-сосудистой заболеваемости и смертности.
Экстракорпоральное лечение: экстракорпоральное лечение, которое приводит к контакту крови с отрицательно заряженными поверхностями, такое как диализ или гемофильтрация, на основе мембран с высокой гидравлической проницаемостью (например, полиакрилонитрильные мембраны) и аферез липопротеинов низкой плотности с декстрана сульфатом повышает риск развития анафилактоидных реакций тяжелой степени (см. раздел «Противопоказания»). В таком случае следует рассмотреть возможность применения диализной мембраны другого типа или антигипертензивного препарата другого класса.
Сакубитрил/валсартан: противопоказано сопутствующее применение ингибиторов АПФ с сакубитрилом/валсартаном, поскольку это увеличивает риск развития ангионевротического отека (см. разделы «Противопоказания» и «Особые указания»).
Одновременный прием не рекомендован
Алискирен: у пациентов, не страдающих сахарным диабетом, или у пациентов без нарушения функции почек, увеличивается риск развития гиперкалиемии, ухудшения функции почек и повышения сердечно-сосудистой заболеваемости и смертности (см. раздел «Особые указания»).
Одновременное применение ингибиторов АПФ и антагонистов рецепторов ангиотензина II: в научной литературе сообщалось, что у пациентов с атеросклеротическим заболеванием, сердечной недостаточностью или с сахарным диабетом с поражением органов-мишеней сопутствующая терапия ингибитором АПФ и блокаторами ангиотензиновых рецепторов приводит к более частому развитию гипотензии, обморока, гиперкалиемии и ухудшению функции почек (включая острую почечную недостаточность) по сравнению с применением одного препарата, действующего на систему ренин-ангиотензин-альдостерон. Двойная блокада (например, путем сочетания ингибитора АПФ с антагонистом рецептора ангиотензина II) может применяться только в отдельных случаях при тщательном контроле функции почек, уровня калия и артериального давления (см. раздел «Особые указания»).
Эстрамустин: риск усиления нежелательных реакций, таких как ангионевротический отек.
Препараты лития: сообщалось о случаях обратимого увеличения концентраций лития в сыворотке крови и развития токсических реакций во время одновременного применения лития и ингибиторов АПФ. Не рекомендуется применять периндоприл в сочетании с индапамидом и препаратами лития, но, если такая комбинация является необходимой, следует тщательно контролировать концентрацию лития в сыворотке крови (см. раздел «Особые указания»).
Калийсберегающие диуретики, добавки калия или калийсодержащие заменители соли: возможна гиперкалиемия (потенциально летальная), в частности у пациентов с почечной недостаточностью (аддитивный гиперкалиемический эффект). Не рекомендуется применять периндоприл в сочетании с указанными лекарственными препаратами (см. раздел «Особые указания»). Если сопутствующее применение препарата тем не менее показано, следует соблюдать осторожность и выполнять частый контроль содержания калия в сыворотке крови. О применении спиронолактона при сердечной недостаточности см. раздел «Сопутствующее применение, требующее особых мер предосторожности».
Ко-тримоксазол (триметоприм/сульфаметоксазол): пациенты, принимающие ко-тримоксазол при сопутствующей терапии (триметоприм/сульфаметоксазол), могут подвергаться повышенному риску развития гиперкалиемии (см. раздел «Особые указания»).
Одновременный прием, при котором требуется особая осторожность
При одновременном применении с баклофеном наблюдается потенцирование антигипертензивного эффекта. Следует контролировать АД и функцию почек, а также, при необходимости, проводить коррекцию дозы антигипертензивного средства.
Одновременное применение ингибиторов АПФ с НПВП (в том числе ацетилсалициловая кислота в дозе ≥3 г/сутки, ингибиторы ЦОГ-2 и неселективные НПВП) может стать причиной снижения гипотензивного эффекта ингибиторов АПФ. Одновременное применение указанных препаратов также повышает риск нарушения функции почек вплоть до развития острой почечной недостаточности и увеличения содержания калия в сыворотке крови, особенно у пациентов с уже существующими нарушениями функции почек. Такую комбинацию следует назначать с осторожностью, особенно лицам пожилого возраста. Пациенты должны получать достаточное количество жидкости, а также рекомендовано осуществлять контроль функции почек до и периодически после начала лечения.
Эпидемиологические исследования свидетельствуют о том, что совместное применение ингибиторов АПФ и противодиабетических препаратов (инсулин, пероральные гипогликемические средства) может вызвать или усиливать гипогликемический эффект с риском развития гипогликемии, что наиболее вероятно у пациентов с почечной недостаточностью и в первые недели терапии.
У пациентов, принимающих диуретики без калийсберегающих свойств, особенно у таковых с гиповолемией и/или дефицитом солей, в начале приема ингибиторов АПФ может развиться избыточное снижение АД. Риск артериальной гипотензии можно уменьшить путем отмены диуретика, повышения употребления жидкости или соли перед началом лечения, а также назначения периндоприла в низких начальных дозах с последующим увеличением.
При артериальной гипертензии, когда возможны гиповолемия и/или дефицит солей вследствие приема диуретика, следует рассмотреть возможность или отмены диуретика до начала приема ингибитора АПФ с его последующим повторным введением, или начала терапии ингибитором АПФ с более низких доз с последующим увеличением.
У пациентов с хронической сердечной недостаточностью, получающих терапию диуретиками, ингибитор АПФ должен быть назначен в очень низкой дозе, по возможности после снижения дозы диуретика.
Во всех случаях на первых неделях терапии ингибитором АПФ следует контролировать функцию почек (содержание креатинина).
Калийсберегающие диуретики — эплеренон или спиронолактон в дозах 12.5 мг и 50 мг/сут и ингибитор АПФ в низких дозах: у пациентов с сердечной недостаточностью (II-IV функциональные классы по NYHA) с фракцией выброса <40%, предварительно получавших ингибиторы АПФ и «петлевые» диуретики, в случаях несоблюдения рекомендаций по применению данной комбинации, существует риск развития гиперкалиемии, потенциально летальной.
До начала приема данной комбинации следует исключить гиперкалиемию и почечную недостаточность.
Следует контролировать содержание калия и креатинина в плазме крови еженедельно на протяжении первого месяца лечения и далее — 1 раз в месяц.
Лекарственные препараты, которые приводят к развитию пируэтной тахикардии
Из-за риска развития гипокалиемии следует соблюдать осторожность при одновременном назначении индапамида и препаратов, вызывающих желудочковую тахикардию типа «пируэт», таких как:
— противоаритмические вещества класса IA (хинидин, гидрохинидин, дизопирамид);
— противоаритмические вещества класса III (амиодарон, дофетилид, ибутилид, бретилий, соталол);
— некоторые нейролептики (хлорпромазин, циамемазин, левомепромазин, тиоридазин, трифлуоперазин), бензамиды (амисульприд, сульпирид, сультоприд, тиаприд), бутирофеноны (дроперидол, галоперидол), другие нейролептики (пимозид);
— другие вещества, такие как бепридил, цизаприд, дифеманил, эритромицин в/в, галофантрин, мизоластин, моксифлоксацин, пентамидин, спарфлоксацин, винкамин в/в, метадон, астемизол, терфенадин.
Рекомендовано: профилактика и устранение гипокалиемии, при необходимости — контроль интервала QT на ЭКГ.
Препараты, снижающие уровень калия (амфотерицин В (в/в), глюко- и минералокортикоиды (для системного применения), тетракозактид, стимулирующие слабительные средства) при одновременном применении с индапамидом повышают риск снижения уровня калия (аддитивный эффект). Рекомендован контроль содержания калия и при необходимости его коррекция. Особое внимание следует уделять пациентам, получающим сердечные гликозиды. Следует применять нестимулирующие слабительные средства.
При гипокалиемии возможно усиление токсического действия препаратов наперстянки. При комбинации с сердечными гликозидами следует контролировать содержание калия и показатели ЭКГ; при необходимости лечение должно быть пересмотрено.
Аллопуринол: сопутствующее применение с индапамидом может повышать частоту реакций гиперчувствительности на аллопуринол.
Одновременное применение, требующее осторожности
Калийсберегающие диуретики (амилорид, спиронолактон, триамтерен): хотя эта комбинация целесообразна у некоторых пациентов, возможно развитие гипокалиемии или гиперкалиемии (в частности, у пациентов с почечной недостаточностью или сахарным диабетом). Необходимо проводить мониторинг уровня калия в плазме крови и ЭКГ, а при необходимости пересмотреть лечение.
На фоне приема метформина при возможной функциональной почечной недостаточности, у пациентов, принимающих диуретики, особенно, «петлевые» диуретики, возможно развитие лактацидоза. Не следует применять метформин, если содержание креатинина в сыворотке превышает 15 мг/л (135 мкмоль/л) у мужчин и 12 мг/л (110 мкмоль/л) у женщин.
В случае дегидратации, вызванной приемом диуретиков, повышается риск развития острой почечной недостаточности, особенно при применении йодсодержащего контрастного средства в высоких дозах. Перед назначением йодсодержащих препаратов следует провести регидратацию.
При одновременном применении с препаратами (солями) кальция имеется риск повышения содержания кальция вследствие снижения его экскреции с мочой.
При одновременном применении с циклоспорином: гиперкалиемия может развиться при одновременном приеме ингибиторов АПФ с циклоспорином. Рекомендуется контролировать уровень калия в сыворотке крови.
Имеется риск повышения уровня креатинина в связи с приемом индапамида без изменения уровня циклоспорина в циркулирующей крови, даже при отсутствии нарушения водно-электролитного баланса.
Не проводилось исследований лекарственного взаимодействия с циклоспорином и амлодипином у здоровых добровольцев и в других популяциях, за исключением пациентов с трансплататом почки, у которых наблюдалось вариабельное повышение минимальной концентрации циклоспорина (в среднем 0 – 40%). Следует контролировать уровни циклоспорина у пациентов с трансплантатом почки, получающих амлодипин, и при необходимости уменьшить дозу циклоспорина.
Гиперкалиемия может развиться при одновременном приеме ингибиторов АПФ с гепарином. Рекомендуется контролировать уровень калия в сыворотке.
Одновременное применение амлодипина и сильных или умеренных ингибиторов CYP3A4 (ингибиторы протеазы, противогрибковые препараты из группы азолов, антибиотики группы макролидов (эритромицин или кларитромицин), верапамил или дилтиазем) может привести к повышению плазменной концентрации амлодипина. Клинические проявления изменения фармакокинетических показателей могут быть более выраженными у пожилых пациентов. При необходимости рекомендовано регулярное медицинское наблюдение и коррекция доз.
Кларитромицин является ингибитором CYP3A4. Существует повышенный риск гипотензии у пациентов, принимающих кларитромицин с амлодипином. Рекомендуется осуществлять тщательное наблюдение пациентов при одновременном применении амлодипина с кларитромицином.
Рацекадотрил: известно, что ингибиторы АПФ (например, периндоприл) могут приводить к развитию ангионевротического отека. Данный риск может быть повышен при его одновременном применении с рацекадотрилом (лекарственный препарат, который применяется при острой диарее).
Ингибиторы mTOR (например, сиролимус, эверолимус, темсиролимус): пациенты, принимающие одновременно ингибиторы mTOR, могут подвергаться повышенному риску развития ангионевротического отека (см. раздел «Особые указания»).
Ингибиторы mTOR являются субстратами CYP3A. Амлодипин является слабым ингибитором CYP3A. При сопутствующем использовании амлодипин может усиливать действие ингибиторов mTOR.
Индукторы CYP3A4: при сопутствующем приеме известных индукторов CYP3A4 концентрация амлодипина в плазме может варьировать. Соответственно, рекомендуется контроль артериального давления и корректировка дозы во время и после одновременного приема сопутствующих препаратов, особенно сильных индукторов CYP3A4 (например, рифампицин, Hypericum perforatum).
Не рекомендуется принимать амлодипин с грейпфрутом или грейпфрутовым соком, так как у некоторых пациентов может увеличиваться биодоступность препарата, что приводит к усилению эффекта снижения артериального давления.
Дантролен (инфузия): у животных наблюдалась фибрилляция желудочков и сердечно-сосудистая недостаточность с летальным исходом в связи с развитием гиперкалиемии после введения верапамила и дантролена в/в. В связи с риском развития гиперкалиемии рекомендуется избегать одновременного введения блокаторов кальциевых каналов, таких как амлодипин, пациентам, восприимчивым к развитию злокачественной гипертермии, а также при лечении злокачественной гипертермии.
Такролимус: имеется риск повышения уровня такролимуса в крови при одновременном применении амлодипина, но фармакокинетический механизм такого взаимодействия до конца не изучен. Чтобы избежать токсичности такролимуса при введении амлодипина, пациенту, получающему такролимус, требуется контролировать уровень такролимуса в крови и, при необходимости, корректировать дозу такролимуса.
Симвастатин: одновременное введение нескольких доз по 10 мг амлодипина и 80 мг симвастатина приводит к увеличению воздействия симвастатина на 77% по сравнению с применением симвастатина в отдельности. Ограничение дозы симвастатина у пациентов, принимающих амлодипин, до 20 мг в сутки.
При проведении клинических исследований взаимодействия установили, что амлодипин не оказывает влияния на фармакокинетику аторвастатина, дигоксина или варфарина.
Антигипертензивные препараты и вазодилататоры: сопутствующее применение данных препаратов может усилить гипотензивное действие периндоприла. Сопутствующее применение с нитроглицерином и другими нитратами или другими вазодилататорами может дополнительно снизить артериальное давление.
Имипраминоподобные антидепрессанты трициклические антидепрессанты, нейролептики: усиление антигипертензивного эффекта и повышение риска развития ортостатической гипотензии (аддитивный эффект).
Кортикостероиды, тетракозактид: уменьшение антигипертензивного эффекта (задержка соли и воды в результате приема кортикостероидов).
Другие антигипертензивные препараты: одновременное применение с препаратом Ко-Амлесса может приводить к дополнительному снижению артериального давления.
Аллопуринол, цитостатики или иммунодепрессанты, системные кортикостероиды или прокаинамид: одновременное применение этих препаратов с ингибиторами АПФ может увеличить риск развития лейкопении (см. раздел «Особые указания»).
Анестетики: ингибиторы АПФ способны усиливать гипотензивный эффект некоторых анестезирующих средств (см. раздел «Особые указания»).
Глиптины (линаглиптин, саксаглиптин, ситаглиптин, вилдаглиптин): риск усиления неблагоприятных эффектов, таких как ангионевротический отек, вследствие снижения активности дипептидилпептидазы-4 (DPP-IV) у пациентов, одновременно принимающих ингибиторы АПФ.
Симпатомиметики могут ослаблять антигипертензивное действие ингибиторов АПФ.
Золото: редко сообщалось о развитии нитритоидных реакций (симптомы включают в себя покраснение лица, тошноту, рвоту и гипотензию) у пациентов, которые проходят терапию инъекционными препаратами золота (натрий ауротиомалат) и сопутствующую терапию ингибиторами АПФ, включая периндоприл.
Условия отпуска из аптек
По рецепту врача *.
* Включен в перечень препаратов, реализуемых без рецепта врача согласно Постановления МЗ РБ №27 от 9 февраля 2023г.
Не все размеры упаковок могут быть доступны для реализации.
Условия хранения препарата
Препарат следует хранить в оригинальной упаковке с целью защиты от света и влаги при температуре не выше 30°C.
Срок годности препарата
Срок годности — 3 года.
Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата или работы с ним
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Контакты для обращений
КРКА д.д., представительство, (Словения)

Представительство АО «KRKA, d.d., Novo mesto» (Словения) в Беларуси
220114 Минск, ул. Филимонова 25Г, оф. 315, 3 этаж
Тел/факс: (375-740) 740-92-30
E-mail: info.by@krka.biz
Эликвис® (Eliquis®) инструкция по применению
📜 Инструкция по применению Эликвис®
💊 Состав препарата Эликвис®
✅ Применение препарата Эликвис®
📅 Условия хранения Эликвис®
⏳ Срок годности Эликвис®
таб. 4 мг+10 мг+1.25 мг: 14 или 30 шт.
Рег. №: 10366/15/15/20/21/22 от 16.06.2020 — Срок действия рег. уд. не ограничен
Таблетки белого или почти белого цвета, овальные, двояковыпуклые, с риской на одной стороне. Риска предназначена исключительно для разламывания таблетки с целью облегчения проглатывания и не обеспечивает деление таблетки на равные части.
| 1 таб. | |
| периндоприла эрбумин | 4 мг |
| амлодипин (в форме безилата) | 10 мг |
| индапамид | 1.25 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая (тип 102), целлюлоза микрокристаллическая (тип 112), крахмал прежелатинизированный (тип 1500), натрия крахмала гликолат (тип А), кальция хлорида гексагидрат, натрия гидрокарбонат, кремния диоксид коллоидный безводный, магния стеарат.
7 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (2) — коробки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.
14 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (1) — коробки картонные.
Описание лекарственного препарата КО-АМЛЕССА основано на официально утвержденной инструкции по применению препарата и сделано в 2023 году. Дата обновления: 06.04.2023 г.
Фармакологическое действие
Препарат Ко-Амлесса представляет собой комбинацию соли периндоприла трет-бутиламина — ингибитора ангиотензинпревращающего фермента, индапамида — хлорсульфамоилового диуретика и амлодипина — антагониста кальция. Его фармакологическое действие основано на свойствах каждого из компонентов по отдельности, в дополнение к качествам, обусловленным аддитивным синергетическим действием всех трех активных веществ.
Механизм действия и фармакодинамическое действие
Периндоприл
Периндоприл является ингибитором ангиотензинпревращающего фермента (АПФ), который превращает ангиотензин I в ангиотензин II (сосудосуживающее вещество). Кроме того,фермент стимулирует секрецию альдостерона корой надпочечников и распад брадикинина (сосудорасширяющего вещества) до неактивных гептапептидов.
Это приводит к:
— снижению секреции альдостерона,
— повышению активности ренина в плазме крови, тогда как альдостерон не оказывает негативного воздействия,
— снижению общего периферического сосудистого сопротивления благодаря преобладающему влиянию на сосуды мышц и почек. При этом не наблюдается задержки воды и солей и рефлекторной тахикардии при длительном лечении.
Периндоприл снижает уровень артериального давления также у пациентов с нормальным и низким уровнем ренина в плазме крови.
Периндоприл действует через свой активный метаболит периндоприлат. Другие метаболиты являются неактивными.
Периндоприл уменьшает нагрузку на сердце через:
— вазодилататорное воздействие на вены, возможно, вследствие изменений в метаболизме простагландинов: снижение преднагрузки;
— снижение общего периферического сосудистого сопротивления: снижение постнагрузки на сердце.
При проведении исследований пациентов с сердечной недостаточностью установили:
— снижение давления наполнения левого и правого желудочков;
— снижение общего периферического сосудистого сопротивления;
— увеличение сердечного выброса и улучшение сердечного индекса;
— увеличение регионального кровотока в мышцах.
Результаты нагрузочного теста также подтвердили улучшение показателей.
Индапамид
Индапамид — сульфонамидный диуретик с индоловым кольцом, фармакологически родственный тиазидным диуретиками. Индапамид ингибирует реабсорбцию натрия в кортикальном сегменте почек. Это повышает выведение натрия и хлоридов с мочой и в меньшей степени — выведение калия и магния, увеличивая таким образом диурез и обеспечивая гипотензивный эффект.
Амлодипин
Амлодипин является антагонистом кальция и ингибирует приток ионов кальция в сердечную и сосудистую гладкую мышцу. Механизм антигипертензивного эффекта осуществляется благодаря воздействию прямого релаксанта на гладкую мускулатуру сосудов. Точный механизм, которым амлодипин облегчает стенокардию, полностью не установлен, но определяется следующими двумя действиями:
1. Амлодипин расширяет периферические артериолы и, таким образом, снижает общее периферическое сопротивление (постнагрузку) для сердца. Такая разгрузка сердца снижает потребление энергии миокардом и потребность в кислороде.
2. Механизм действия амлодипина также может включать расширение основных коронарных артерий и коронарных артериол. Такое расширение увеличивает поступление кислорода в миокард пациентов с приступом вазоспастической стенокардии.
При артериальной гипертензии разовая доза обеспечивает клинически значимое снижение артериального давления на протяжении 24 ч (в положении лежа и стоя).
Прием амлодипина один раз в день пациентами со стенокардией увеличивает общее время физической нагрузки, время до начала стенокардии и время до депрессии сегмента ST на 1 мм. Амлодипин снижает частоту приступов стенокардии и потребление таблеток глицерина тринитрата.
Амлодипин не был связан с нежелательными метаболическими эффектами или изменениями липидов плазмы и подходит для использования у пациентов с астмой, диабетом и подагрой.
Клиническая эффективность и безопасность
Периндоприл
Периндоприл эффективен для лечения гипертензии любой степени: от легкой до умеренной или тяжелой степени. Наблюдается снижение систолического и диастолического артериального давления в положении лежа и стоя.
Антигипертензивная активность после приема однократной дозы максимальна через 4 — 6 часов после приема препарата и сохраняется в течение 24 часов.
Наблюдается высокая степень остаточного блокирования ангиотензинпревращающего фермента (приблизительно на 80%) через 24 часа.
У пациентов, отвечающих на лечение, артериальное давление нормализуется через один месяц лечения без развития тахифилаксии.
Прекращение лечения не оказывает влияния на гипертензию.
Периндоприл обладает сосудорасширяющим действием, восстанавливает эластичность основных артериальных сосудов, корректирует гистоморфометрические изменения резистивных артерий и снижает гипертрофию левого желудочка.
Добавление тиазидного диуретика приводит к аддитивному синергетическому действию.
Комбинация ингибитора ангиотензинпревращающего фермента с тиазидным диуретиком снижает риск развития гипокалиемии, связанной с приемом диуретика в отдельности.
Двойная блокада системы ренин-ангиотензин-альдостерон (РААС), клинические данные
В рамках двух крупных рандомизированных контролируемых исследований: ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial [продолжающееся международное исследование, направленное на сравнение телмисартана в виде монотерапии и в комбинации с рамиприлом с учетом конечной точки]) и VA NEPHRON-D (The Veterans Affairs Nephropathy in Diabetes [исследование нефропатии при сахарном диабете, проводимое Министерством по делам ветеранов]) проводилось изучение применения комбинации из ингибитора АПФ и блокатора рецепторов ангиотензина II.
Исследование ONTARGET проводилось среди пациентов, анамнез которых включал сердечно-сосудистое или цереброваскулярное заболевание, либо сахарный диабет 2-го типа, сопровождающийся признаками ишемического поражения органов-мишеней.
Исследование VA NEPHRON-D проводилось среди пациентов с сахарным диабетом 2-го типа и диабетической нефропатией. В данных исследованиях не было продемонстрировано какое-либо значительное благоприятное воздействие на почечные и (или) сердечно-сосудистые исходы и показатель смертности, при этом наблюдался более высокий риск развития гиперкалиемии, острой почечной недостаточности и (или) гипотензии по сравнению с монотерапией. Данные результаты также являются значимыми для других ингибиторов АПФ и блокаторов рецепторов ангиотензина II, учитывая их схожие фармакодинамические свойства.
Таким образом, не следует одновременно назначать ингибиторы АПФ и блокаторы рецепторов ангиотензина II пациентам с диабетической нефропатией.
Исследование ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints [исследование применения алискирена при сахарном диабете с использованием конечных точек в виде сердечно-сосудистого и почечного заболевания]) было направлено на изучение пользы от добавления алискирена к стандартной терапии ингибитором АПФ или блокатором рецепторов ангиотензина II у пациентов с сахарным диабетом 2-го типа, а также с хроническим заболеванием почек и (или) сердечно-сосудистым заболеванием. Исследование было завершено досрочно ввиду повышенного риска возникновения неблагоприятных исходов. Смерть по причине сердечно-сосудистого нарушения и инсульт наблюдались чаще (в количественном отношении) в группе, получавшей алискирен, по сравнению с группой, получавшей плацебо, при этом нежелательные явления и серьезные нежелательные явления, представляющие интерес (гиперкалиемия, гипотензия и нарушение функции почек), наблюдались чаще в группе, получавшей алискирен, чем в группе, получавшей плацебо.
Индапамид
Индапамид в качестве монотерапии обладает антигипертензивным действием, которое длится 24 часа. Данный эффект наблюдается при приеме доз, при которых диуретические свойства минимальны.
Его антигипертензивное действие пропорционально улучшению податливости сосудистой стенки и снижению общего и артериолярного периферического сосудистого сопротивления.
Индапамид снижает гипертрофию левого желудочка.
При превышении дозы тиазидного и тиазидоподобного диуретика антигипертензивный эффект достигает плато, а нежелательные реакции продолжают увеличиваться. Если лечение неэффективно, дозу препарата не следует увеличивать.
Кроме того, было установлено, что в краткосрочной, среднесрочной и долгосрочной перспективе у пациентов с артериальной гипертензией индапамид:
— не оказывает влияния на липидный обмен: триглицериды, ЛПНП-холестерин и ЛПВП-холестерин;
— не оказывает влияния на углеводный обмен даже у гипертензивных пациентов с сахарным диабетом.
Амлодипин
Провели антигипертензивную и гиполипидемическую терапию для предотвращения сердечного приступа (ALLHAT) для сравнения более новой лекарственной терапии (амлодипин или ингибитор АПФ в качестве препарата первой линии) с терапией на основе тиазидных диуретиков у пациентов с гипертензией легкой и умеренной степени. Не наблюдалось значительного различия в исходах сердечно-сосудистых заболеваний между терапией на основе амлодипина и терапией на основе тиазидного диуретика.
Периндоприл/индапамид
У пациентов с артериальной гипертензией независимо от возраста периндоприл/индапамид оказывает дозозависимое антигипертензивное действие на диастолическое и систолическое артериальное давление в положении лежа на спине или в положении стоя. Такое антигипертензивное действие длится 24 часа. Снижение артериального давления достигается менее чем за один месяц без развития тахифилаксии; в случае остановки лечения не наблюдается эффекта отмены. В ходе проведения клинических испытаний установили, что одновременный прием периндоприла и индапамида привел к гипотензивному действию синергического характера по отношению к каждому из препаратов, вводимых по отдельности.
В ходе проведения исследования PICXEL (многоцентровое рандомизированное двойное слепое активное контролируемое исследование) оценили влияние комбинации периндоприл/индапамид на ГЛЖ путем проведения эхокардиографии по сравнению с монотерапией эналаприлом.
В исследовании PICXEL пациенты с артериальной гипертензией с ГЛЖ (определяемым как индекс массы левого желудочка (ИМЛЖ) > 120 г/м2 у мужчин и > 100 г/м2 у женщин) были рандомизированы в группу приема периндоприл-трет-бутиламина 2 мг/индапамида 0.625 мг или эналаприла 10 мг один раз в день в течение одного года лечения. Доза была скорректирована в соответствии с артериальным давлением, вплоть до приема периндоприл-трет-бутиламина 8 мг и индапамида 2.5 мг или эналаприла 40 мг один раз в день. Только 34% субъектов остались на лечении периндоприл-трет-бутиламин 2 мг/индапамид 0.625 мг (по сравнению с 20% пациентами, которые принимали эналаприл 10 мг).
В конце лечения ИМЛЖ значительно снизился в группе приема периндоприла/индапамида (-10.1 г/м2) по сравнению с группой приема эналаприла (-1.1 г/м2) во всех рандомизированных группах пациентов. Межгрупповое различие в изменении ИМЛЖ составило -8.3 (ДИ 95% (-11.5, -5.0), р <0.0001).
Лучший эффект на ИМЛЖ достигался при более высокой дозе периндоприла/ индапамида.
Что касается артериального давления, предполагаемые средние межгрупповые различия в рандомизированной популяции составляли: снижение систолического артериального давления на 5.8 мм рт. ст. (95% ДИ (-7.9, -3.7), <р 0.0001) и снижение диастолического артериального давления на 2.3 мм рт. ст. (95% ДИ (-3.6, -0.9), р = 0.0004). Препарат был более эффективен в группе приема периндоприла/индапамида.
Пациенты детского возраста
Периндоприл/индапамид
Нет доступных данных относительно применения периндоприла/индапамида у детей.
Амлодипин
В исследовании с участием 268 детей в возрасте 6 — 17 лет с преимущественно вторичной гипертензией сравнение дозы 2.5 мг и дозы 5.0 мг амлодипина с плацебо показало, что обе дозы снижали систолическое артериальное давление значительно больше, чем плацебо. Различие между двумя дозами было статистически незначительно.
Долгосрочные эффекты амлодипина на рост, половое созревание и общее развитие не изучены. Также не установлена долгосрочная эффективность амлодипина при терапии в детском возрасте для снижения сердечно-сосудистой заболеваемости и смертности в зрелом возрасте.
Фармакокинетика
Периндоприл
Всасывание, биотрансформация
После перорального приема периндоприл всасывается быстро, максимальная концентрация в крови достигается в течение 1 часа. Период полувыведения периндоприла из плазмы составляет 1 час.
Поскольку прием пищи снижает процесс преобразования в периндоприлат а, следовательно, и биодоступность, периндоприл следует принимать перорально в виде одной таблетки в день утром перед приемом пищи.
Распределение
Объем распределения составляет примерно 0.2 л/кг для несвязанного периндоприлата. Связывание периндоприлата с белками плазмы составляет 20%, в основном, с ангиотензинпревращающим ферментом, но зависит от концентрации.
Биотрансформация
Периндоприл является пролекарством. Двадцать семь процентов от введенной дозы периндоприла попадает в систему кровообращения в виде активного метаболита периндоприлата. Помимо активного периндоприлата, периндоприл образует еще пять метаболитов, но все они неактивны. Пиковая концентрация периндоприлата в плазме достигается в течение 3 — 4 часов.
Выведение
Периндоприлат выводится с мочой, а конечный период полураспада несвязанной фракции составляет приблизительно 17 часов. Равновесное состояние достигается в течение 4 дней.
Линейность/нелинейность
Подтверждена линейная зависимость между дозой периндоприла и его содержанием в плазме.
Особые группы пациентов
Выведение периндоприлата снижается у пациентов пожилого возраста, а также у пациентов с сердечной или почечной недостаточностью.
Желательно скорректировать дозу препарата при почечной недостаточности в зависимости от степени нарушения функции почек (клиренса креатинина).
Диализный клиренс периндоприлата составляет 70 мл/мин.
Кинетика периндоприла изменена у пациентов с циррозом печени: печёночный клиренс исходной молекулы снижен вдвое. Однако количество образующегося периндоприлата не уменьшается и, следовательно, не требуется корректировка дозы (см. разделы «Режим дозирования» и «Особые указания»).
Индапамид
Всасывание
Индапамид быстро и полностью всасывается в желудочно-кишечном тракте.
Пиковый уровень в плазме достигается приблизительно через час после перорального приема препарата.
Распределение
Связывание с белками плазмы составляет 79%.
Биотрансформация/выведение
Период полувыведения составляет от 14 до 24 часов (в среднем 18 часов). Повторное введение не приводит к накоплению в организме. Препарат, в основном, выводится с мочой (70% от принятой дозы) и фекалиями (22%) в виде неактивных метаболитов.
Особые группы пациентов
Фармакокинетика не изменяется у пациентов с почечной недостаточностью.
Амлодипин
Всасывание, распределение
После перорального применения терапевтических доз амлодипин хорошо всасывается, с пиковыми уровнями в крови через 6 — 12 часов после приема дозы препарата. Была рассчитана абсолютная биодоступность, которая составила 64% — 80%. Объем распределения составляет примерно 21 л/кг. Биодоступность препарата не изменяется в зависимости от приема пищи. В исследованиях амлодипина in vitro было показано, что приблизительно 97.5% находящегося в системном кровотоке препарата связывается с белками плазмы крови.
Биотрансформация/выведение
Терминальный период полувыведения из плазмы составляет 35 — 50 часов и согласуется с дозированием один раз в сутки.
Амлодипин в значительной степени метаболизируется в печени в неактивные метаболиты. Около 60% введенной дозы препарата выводится с мочой, 10% — в неизменном виде (в виде амлодипина).
Время до достижения пиковых плазменных концентраций амлодипина сравнимо у пожилых пациентов и более молодых субъектов. Клиренс амлодипина имеет тенденцию к снижению с последующим увеличением площади под кривой (AUC) и периода полувыведения у пожилых пациентов. Рекомендуемая схема приема препарата для пожилых пациентов такая же, хотя увеличение дозы следует проводить с осторожностью.
Фармакокинетика индапамида остается неизменной у пациентов с почечной недостаточностью.
Кинетика периндоприла изменена у пациентов с циррозом печени: печёночный клиренс первичной молекулы снижен вдвое. Однако количество образующегося периндоприлата не уменьшается и, следовательно, не требуется корректировка дозы (см. разделы «Режим дозирования» и «Особые указания»).
Как и в случае применения антагонистов кальция, период полувыведения амлодипина удлиняется у пациентов с нарушением функции печени.
Пациенты детского возраста
Популяционное исследование ФК было проведено с участием 74 детей с гипертензией в возрасте от 12 месяцев до 17 лет (34 пациента в возрасте от 6 до 12 лет и 28 пациентов в возрасте от 13 до 17 лет), получавших амлодипин в дозе от 1.25 до 20 мг один или два раза в сутки. У детей в возрасте от 6 до 12 лет и у подростков 13 — 17 лет типичный клиренс при пероральном приеме препарата (CL/F) составлял 22.5 и 27.4 л/ч соответственно у мужчин и 16.4 и 21.3 л/ч соответственно у женщин. Наблюдалась большая вариабельность воздействия между отдельными пациентами. Имеются ограниченные данные по детям младше 6 лет.
Данные доклинической безопасности
Периндоприл
В исследованиях длительной токсичности при пероральном приеме препарата (на крысах и обезьянах) целевым органом являются почки с обратимыми повреждениями.
В исследованиях in vitro или in vivo мутагенности не наблюдалось.
При проведении исследований репродуктивной токсикологии (на крысах, мышах, кроликах и обезьянах) не было выявлено признаков эмбриотоксичности или тератогенности. Однако установили, что ингибиторы ангиотензинпревращающего фермента, как класс, оказывают неблагоприятное воздействие на позднее развитие плода, приводя к гибели плода и развитию врожденных дефектов у грызунов и кроликов: наблюдается поражение почек и увеличение уровня перинатальной и постнатальной смертности. При проведении долгосрочных исследований на крысах и мышах не наблюдалось признаков канцерогенности.
Индапамид
При пероральном введении самых высоких доз различным видам животных (в 40 – 8000 раз превышающих терапевтическую дозу) наблюдалось обострение диуретических свойств индапамида. Основные симптомы отравления во время проведения исследований острой токсичности индапамидом, который вводили внутривенно или внутрибрюшинно, были связаны с фармакологическим действием индапамида, т.е. с развитием брадипноэ и периферической вазодилатации.
При проведении исследований установили, что индапамид не обладает мутагенными и канцерогенными свойствами.
Периндоприл/Индапамид
В исследованиях репродуктивной токсикологии не было выявлено признаков эмбриотоксичности или тератогенности. Также не было ухудшения фертильности.
Амлодипин
Исследования репродуктивности у крыс и мышей показали отложенную дату родов, увеличение длительности родов и уменьшение выживаемости потомства при применении доз приблизительно в 50 раз выше максимальной рекомендованной дозы для человека, на основании мг/кг.
Отсутствует влияние на фертильность у крыс, получавших амлодипин (самцы в течение 64 дней, самки в течение 14 дней до спаривания) в дозах до 10 мг/кг/сутки (в 8 раз* больше рекомендованной дозы для человека 10 мг на основании мг/м2). В другом исследовании, в котором самцы крысы получали амлодипина безилат в течение 30 дней в дозе, сравнимой с дозой для человека на основании мг/кг, было обнаружено снижение плазменного фолликулостимулирующего гормона и тестостерона, как и снижение плотности спермы и количества зрелых сперматид и клеток Сертоли.
Крысы и мыши, получавшие амлодипин в рационе в течение двух лет, в концентрациях, рассчитанных на обеспечение уровней суточной дозы 0.5, 1.25 и 2.5 мг/кг/сутки, не показали признаков канцерогенности. Наивысшая доза (для мышей — близкая к рекомендованной клинической дозе 10 мг на основе мг/м2, а у крыс — в два раза превышающая ее*) была близка к максимально переносимой дозе для мышей, но не для крыс. В результате исследований мутагенности не было выявлено дефектов на уровне генов или хромосом, связанных с лекарственным средством.
* На основании массы пациента 50 кг
Показания к применению
— лечение артериальной гипертензии у пациентов, которые контролируют артериальное давление крови применением периндоприла, индапамида и амлодипина в тех же дозировках.
Реклама
Режим дозирования
Для приема внутрь. Препарат принимают внутрь по 1 таб. 1 раз/сут, предпочтительно утром перед едой.
Комбинированный препарат с фиксированной дозировкой не подходит для начальной терапии.
Если необходимо изменить режим дозирования препарата, это выполняют на индивидуальной основе путем титрования дозы компонентов по отдельности.
Максимальная рекомендуемая доза препарата Ко-Амлесса составляет 8 мг/10 мг/2.5 мг в день.
Выведение периндоприлата снижается у пациентов с почечной недостаточностью. Поэтому обычное медицинское наблюдение включает частый мониторинг уровня креатинина и калия (см. разделы «Особые указания» и «Фармакокинетика»).
Применение препарата противопоказано пациентам с почечной недостаточностью тяжелой степени (КК <30 мл/мин). Препарат с дозировками 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг противопоказан пациентам с умеренными нарушениями функции почек (ниже 60 мл/мин). Ко-Амлессу можно назначать пациентам с клиренсом креатинина ≥ 60 мл/мин. Таким пациентам рекомендован индивидуальный подбор доз отдельно каждого компонента.
Изменения плазменных концентраций амлодипина не коррелируют со степенью почечной недостаточности. Амлодипин не поддается диализу.
Пациентам с тяжелым нарушением функции печени применение препарата противопоказано. Режим дозирования для пациентов с нарушениями функции печени легкой или средней степени тяжести не установлен, при назначении указанной комбинации следует соблюдать осторожность (см. разделы «Особые указания» и «Фармакокинетика»).
У пациентов пожилого возраста выведение периндоприлата замедлено. Поэтому обычное медицинское наблюдение включает частый мониторинг уровня креатинина и калия (см. разделы «Особые указания» и «Фармакокинетика»).
Безопасность и эффективность препарата у детей и подростков не установлены. Данные отсутствуют.
Побочные действия
Общая оценка безопасности
Периндоприл ингибирует систему ренин-ангиотензин-альдостерон и способствует снижению потери калия, вызванной приемом индапамида. Гипокалиемия наблюдалась у 2% пациентов, получавших 2 мг периндоприла/0.625 мг индапамида (уровень калия <3.4 ммоль/л). Гипокалиемия наблюдалась у 4% пациентов, получавших 4 мг периндоприла/1.25 мг индапамида (уровень калия <3.4 ммоль/л). Гипокалиемия наблюдалась у 6% пациентов, получавших 8 мг периндоприла/2.5 мг индапамида (уровень калия <3.4 ммоль/л).
Следующие нежелательные эффекты наблюдались во время проведения клинических испытаний и/или в период пострегистрационного применения и были классифицированы по частоте.
Наиболее частые нежелательные реакции
— связанные с приемом периндоприла: головокружение, головная боль, парестезия, дисгевзия, нарушение зрения, вертиго, тиннитус, гипотензия, кашель, одышка, боль в животе, запор, диспепсия, диарея, тошнота, рвота, зуд, сыпь, мышечные спазмы и астения;
— связанные с приемом индапамида: гипокалиемия, реакции гиперчувствительности, преимущественно дерматологического характера, у субъектов с предрасположенностью к аллергическим и астматическим реакциям и макулопапулезным высыпаниям;
— связанные с приемом амлодипина: сонливость, головокружение, головная боль, учащенное сердцебиение, гиперемия, боль в животе, тошнота, отек лодыжки, отек и усталость.
Классификация частоты развития побочных эффектов согласно ВОЗ: очень часто (≥1/10), часто (≥1/100 до <1/10), нечасто (≥1/1000 до <1/100), редко (≥1/10 000 до <1/1000), очень редко (<1/10 000), частота неизвестна (не может быть оценена по доступным данным).
Сводная таблица нежелательных реакций
|
Побочные эффекты |
Частота |
||
|
Периндоприл |
Индапамид |
Амлодипин |
|
|
Инфекции и инвазии |
|||
|
Ринит |
Очень редко |
— |
Нечасто |
|
Со стороны системы кроветворения и лимфатической системы |
|||
|
Эозинофилия |
Нечасто* |
— |
— |
|
Лейкопения |
Очень редко |
Очень редко |
Очень редко |
|
Нейтропения (см. раздел «Особые указания») |
Очень редко |
— |
— |
|
Агранулоцитоз (см. раздел «Особые указания») |
Очень редко |
Очень редко |
— |
|
Панцитопения |
Очень редко |
— |
— |
|
Тромбоцитопения (см. раздел «Особые указания») |
Очень редко |
Очень редко |
Очень редко |
|
Апластическая анемия |
— |
Очень редко |
— |
|
Гемолитическая анемия |
Очень редко |
Очень редко |
— |
|
Со стороны иммунной системы |
|||
|
Гиперчувствительность (реакции, преимущественно дерматологического характера, у субъектов с предрасположенностью к аллергическим и астматическим реакциям) |
— |
Часто |
Очень редко |
|
Эндокринные нарушения |
|||
|
Синдром неадекватной секреции антидиуретического гормона (SIADH) |
Редко |
— |
— |
|
Со стороны метаболизма и питания |
|||
|
Гипогликемия (см. разделы «Особые указания» и «Лекарственное взаимодействие») |
Нечасто* |
— |
— |
|
Гиперкалиемия, обратимая при отмене препарата (см. разделы «Особые указания») |
Нечасто* |
— |
— |
|
Гипонатриемия (см. разделы «Особые указания») |
Нечасто* |
Нечасто |
— |
|
Гиперкальциемия |
— |
Очень редко |
— |
|
Гипокалиемия (см. раздел «Особые указания») |
— |
Часто |
— |
|
Гипохлоремия |
— |
Редко |
— |
|
Гипомагниемия |
— |
Редко |
— |
|
Психические нарушения |
|||
|
Бессонница |
— |
— |
Нечасто |
|
Изменения настроения |
Нечасто |
— |
Нечасто |
|
Депрессия |
Нечасто |
— |
Нечасто |
|
Расстройства сна |
Нечасто |
— |
— |
|
Спутанность сознания |
Очень редко |
— |
Редко |
|
Со стороны нервной системы |
|||
|
Сонливость |
Нечасто* |
— |
Часто |
|
Головокружение |
Часто |
— |
Часто |
|
Головная боль |
Часто |
Редко |
Часто |
|
Тремор |
— |
— |
Нечасто |
|
Обморочное состояние |
Нечасто* |
Частота неизвестна |
Нечасто |
|
Парестезия |
Часто |
Редко |
Нечасто |
|
Гипестезия |
— |
— |
Нечасто |
|
Дисгевзия |
Часто |
— |
Нечасто |
|
Гипертонус |
— |
— |
Очень редко |
|
Периферическая невропатия |
— |
— |
Очень редко |
|
Экстрапирамидное расстройство |
— |
— |
Частота неизвестна |
|
Инсульт, может быть вторичным по отношению к избыточной гипотензии у пациентов с высоким риском (см. раздел «Особые указания») |
Очень редко |
— |
— |
|
Возможность развития печеночной энцефалопатии при печеночной недостаточности (см. разделы «Противопоказания» и «Особые указания») |
— |
Частота неизвестна |
— |
|
Со стороны органа зрения |
|||
|
Расстройства зрения |
Часто |
Частота неизвестна |
Нечасто |
|
Миопия (см. раздел «Особые указания») |
— |
Частота неизвестна |
— |
|
Нечеткость зрения |
— |
Частота неизвестна |
— |
|
Острая закрытоугольная глаукома |
— |
Частота неизвестна |
— |
|
Хориоидальный выпот |
— |
Частота неизвестна |
— |
|
Со стороны органа слуха и лабиринта |
|||
|
Головокружение |
Часто |
Редко |
— |
|
Тиннитус |
Часто |
— |
Нечасто |
|
Со стороны сердца |
|||
|
Ощущение сердцебиения |
Нечасто* |
— |
Часто |
|
Тахикардия |
Нечасто* |
— |
Нечасто |
|
Стенокардия (см. раздел «Особые указания») |
Очень редко |
— |
— |
|
Инфаркт миокарда, возможно вследствие избыточной гипотензии у пациентов группы высокого риска (см. раздел «Особые указания») |
Очень редко |
— |
Очень редко |
|
Аритмия (включая брадикардию, желудочковую тахикардию и фибрилляцию предсердий) |
Очень редко |
Очень редко |
Нечасто |
|
Желудочковая тахикардия типа «пируэт» (возможно с летальным исходом) (см. разделы «Особые указания» и «Лекарственное взаимодействие») |
— |
Частота неизвестна |
— |
|
Сосудистые нарушения |
|||
|
Приливы жара |
Редко |
— |
Часто |
|
Артериальная гипотензия и связанные с ней эффекты (см. раздел «Особые указания») |
Часто |
Очень редко |
Нечасто |
|
Васкулит |
Нечасто* |
— |
Очень редко |
|
Феномен Рейно |
Частота неизвестна |
— |
— |
|
Со стороны дыхательной системы |
|||
|
Диспноэ |
Часто |
— |
Нечасто |
|
Кашель (см. раздел «Особые указания») |
Часто |
— |
Нечасто |
|
Бронхоспазм |
Нечасто |
— |
— |
|
Эозинофильная пневмония |
Очень редко |
— |
— |
|
Со стороны пищеварительной системы |
|||
|
Гипертрофический гингивит |
— |
— |
Очень редко |
|
Боли в животе |
Часто |
— |
Часто |
|
Запор |
Часто |
Редко |
Часто |
|
Рвота |
Часто |
Нечасто |
Нечасто |
|
Диспепсия |
Часто |
— |
Нечасто |
|
Тошнота |
Часто |
Редко |
Часто |
|
Сухость во рту |
Нечасто |
Редко |
Нечасто |
|
Диарея |
Часто |
— |
Часто |
|
Панкреатит |
Очень редко |
Очень редко |
Очень редко |
|
Гастрит |
— |
— |
Очень редко |
|
Нарушения со стороны печени и желчевыводящих путей |
|||
|
Гепатит (см. раздел «Особые указания») |
Очень редко |
Частота неизвестна |
Очень редко |
|
Желтуха |
— |
— |
Очень редко |
|
Нарушение функции печени |
— |
Очень редко |
— |
|
Со стороны кожи и подкожных тканей |
|||
|
Отек Квинке |
— |
— |
Очень редко |
|
Ангионевротический отек (см. раздел «Особые указания») |
Нечасто |
Очень редко |
Очень редко |
|
Алопеция |
— |
— |
Нечасто |
|
Пурпура |
— |
Нечасто |
Нечасто |
|
Изменение цвета кожи |
— |
— |
Нечасто |
|
Гипергидроз |
Нечасто |
— |
Нечасто |
|
Экзантема |
— |
— |
Нечасто |
|
Зуд |
Часто |
— |
Нечасто |
|
Сыпь |
Часто |
— |
Нечасто |
|
Крапивница (см. раздел «Особые указания») |
Нечасто |
Очень редко |
Нечасто |
|
Эксфолиативный дерматит |
— |
— |
Очень редко |
|
Синдром Стивенса-Джонсона |
— |
Очень редко |
Очень редко |
|
Фотосенсибилизация |
Нечасто* |
Частота неизвестна |
Очень редко |
|
Пемфигоид |
Нечасто* |
||
|
Макулопапулезная сыпь |
— |
Часто |
— |
|
Токсический эпидермальный некролиз |
— |
Очень редко |
Частота неизвестна |
|
Обострение псориаза |
Редко* |
— |
— |
|
Мультиформная эритема |
Очень редко |
— |
Очень редко |
|
Со стороны мышечной, скелетной и соединительной ткани |
|||
|
Отек лодыжки |
— |
— |
Часто |
|
Артралгия |
Нечасто* |
Нечасто |
|
|
Миалгия |
Нечасто* |
— |
Нечасто |
|
Мышечные спазмы |
Часто |
Частота неизвестна |
Часто |
|
Мышечная слабость |
— |
Частота неизвестна |
— |
|
Рабдомиолиз |
— |
Частота неизвестна |
— |
|
Боль в спине |
— |
— |
Нечасто |
|
Со стороны почек и мочевыводящих путей |
|||
|
Болезненные позывы на мочеиспускание, никтурия, учащенное мочеиспускание |
— |
— |
Нечасто |
|
Почечная недостаточность |
Нечасто |
— |
— |
|
Острая почечная недостаточность |
Редко |
Очень редко |
— |
|
Анурия / Олигурия |
Редко |
— |
— |
|
Со стороны репродуктивной системы и молочной железы |
|||
|
Эректильная дисфункция |
Нечасто |
Нечасто |
Нечасто |
|
Гинекомастия |
— |
— |
Нечасто |
|
Общие нарушения и реакции в месте введения |
|||
|
Периферический отек |
Нечасто* |
— |
Очень часто |
|
Патологическая усталость |
— |
Редко |
Часто |
|
Боль в грудной клетке |
Нечасто* |
— |
Нечасто |
|
Астения |
Часто |
— |
Нечасто |
|
Болевые ощущения |
— |
— |
Нечасто |
|
Чувство общего недомогания |
Нечасто* |
— |
Нечасто |
|
Повышение температуры тела |
Нечасто* |
— |
— |
|
Лабораторные показатели и инструментальные данные |
|||
|
Повышение активности печеночных ферментов |
Редко |
Частота неизвестна |
Очень редко** |
|
Повышение уровня билирубина в крови |
Редко |
— |
— |
|
Удлинение интервала QT на ЭКГ (см. разделы «Особые указания» и «показатели и инструментальные данные») |
— |
Частота неизвестна |
— |
|
Снижение уровня гемоглобина, снижение уровня гематокрита (см. раздел «Особые указания») |
Очень редко |
— |
— |
|
Повышение уровня глюкозы в крови |
— |
Частота неизвестна |
Очень редко |
|
Повышение уровня мочевой кислоты в крови |
— |
Частота неизвестна |
— |
|
Повышение уровня мочевины в крови |
Нечасто* |
— |
— |
|
Повышение уровня креатинина в крови |
Нечасто* |
— |
— |
|
Увеличение массы тела, снижение массы тела |
— |
— |
Нечасто |
|
Травмы, интоксикации и осложнения процедур |
|||
|
Падения |
Нечасто* |
— |
— |
* Частота вычислена на основе клинических исследований нежелательных реакций, полученных в спонтанных сообщениях
** В основном в связи с холестазом
Описание отдельных нежелательных реакций
Во время клинических исследований II и III фазы, в которых сравнивали дозы индапамида 1.5 мг и 2.5 мг, анализ содержания калия в плазме крови продемонстрировал дозозависимые эффекты индапамида:
— индапамид 1.5 мг: концентрации калия в плазме крови <3.4 ммоль/л наблюдали у 10% пациентов и <3.2 ммоль/л — у 4% пациентов после 4 – 6 недель лечения. После 12 недель лечения среднее значение падения концентрации калия в плазме крови составило 0.23 ммоль/л;
— индапамид 2.5 мг: концентрации калия в плазме крови <3.4 ммоль/л наблюдали у 25% пациентов и <3.2 ммоль/л — у 10% пациентов после 4 – 6 недель лечения. После 12 недель лечения среднее значение падения концентрации калия в плазме крови составило 0.41 ммоль/л.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях.
Противопоказания к применению
— повышенная чувствительность к периндоприлу или другим ингибиторам АПФ, индапамиду или любым другим сульфонамидам, амлодипину или другим производным дигидропиридина, к любому из вспомогательных веществ;
— ангионевротический отек в анамнезе, связанный с предшествующей терапией ингибиторами АПФ (см. раздел «Особые указания»);
— наследственный или идиопатический ангионевротический отек;
— тяжелая артериальная гипотензия;
— шок, включая кардиогенный шок;
— обструкция выносящего тракта левого желудочка (например, при тяжелом аортальном стенозе);
— гемодинамически нестабильная сердечная недостаточность после острого инфаркта миокарда;
— почечная недостаточность тяжелой степени (КК <30 мл/мин);
— умеренные нарушения функции почек (КК <60 мл/мин) — для дозировок, содержащих 8 мг/2.5 мг периндоприла/индапамида (в т.ч. таблетки 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг);
— печеночная энцефалопатия;
— тяжелые нарушения функции печени;
— гипокалиемия;
— экстракорпоральное лечение, которое приводит к контакту крови с отрицательно заряженными поверхностями (см. раздел «Лекарственное взаимодействие»);
— одновременное применение с препаратами, содержащими алискирен, у пациентов с сахарным диабетом или почечной недостаточностью (СКФ <60 мл/мин/1.73 м2) (см. разделы «Лекарственное взаимодействие» и «Фармакологическое действие»);
— одновременное применение сакубитрила/валсартана. Препарат Ко-Амлесса не следует начинать принимать раньше, чем через 36 часов после приема последней дозы сакубитрила/валсартана (см. также разделы «Особые указания» и «Лекарственное взаимодействие»);
— значительный двусторонний стеноз почечной артерии или стеноз артерии единственной функционирующей почки (см. раздел «Особые указания»);
— II и III триместры беременности (см. разделы «Особые указания» и «Беременность и лактация»);
По причине отсутствия достаточного терапевтического опыта таблетки Ко-Амлесса не следует использовать в следующих случаях:
— пациентам, находящимся на диализе;
— пациентам с декомпенсированной сердечной недостаточностью без лечения.
Применение при беременности и кормлении грудью
БЕРЕМЕННОСТЬ И ЛАКТАЦИЯ
Беременность
Препарат Ко-Амлесса не рекомендуется принимать в течение I триместра беременности. Препарат Ко-Амлесса противопоказан во II и III триместрах беременности.
Периндоприл
Применение ингибиторов АПФ не рекомендуется в I триместре беременности (см. раздел «Особые указания»). Применение ингибиторов АПФ противопоказано во II и III триместрах беременности (см. разделы «Противопоказания» и «Особые указания»).
Эпидемиологические данные о риске проявления тератогенности при приеме ингибиторов АПФ в I триместре беременности не позволяют сделать окончательное заключение, однако некоторое повышение риска не исключается. Кроме тех случаев, когда невозможно произвести замену ингибиторов АПФ на иную альтернативную терапию, пациентки, планирующие беременность, должны быть переведены на терапию лекарственными средствами, у которых профиль безопасности для беременных женщин является хорошо изученным.
При наступлении беременности прием ингибитора АПФ должен быть прекращен незамедлительно, и при необходимости назначена иная терапия. При применении ингибиторов АПФ во II и III триместрах беременности установлено проявление фетотоксического действия (нарушение функции почек, олигогидрамнион, задержка окостенения костей черепа) и неонатальной токсичности (почечная недостаточность, артериальная гипотензия, гиперкалиемия) (см. раздел «Данные доклинической безопасности»).
Если прием ингибитора АПФ проводился со II триместра беременности, рекомендуется провести УЗИ функции почек и костей черепа. У новорожденных, матери которых принимали ингибиторы АПФ, необходимо тщательно контролировать АД для предотвращения возможного развития артериальной гипотензии (см. разделы «Противопоказания» и «Особые указания»).
Индапамид
Нет достаточных данных относительно применения индапамида у беременных (менее 300 исходов беременности). Длительное воздействие тиазида в течение третьего триместра беременности может уменьшить объем плазмы в организме матери, а также маточно-плацентарный кровоток, что может привести к развитию фетоплацентарной ишемии и задержке роста плода.
Результаты исследований на животных не показали наличия прямого или косвенного вредного воздействия на репродуктивную функцию (см. раздел «Данные доклинической безопасности»).
В качестве меры предосторожности рекомендуется избегать применения индапамида во время беременности.
Амлодипин
Безопасность использования амлодипина во время беременности не оценивалась.
Ограниченные данные о приеме препарата во время беременности не подтверждают, что амлодипин или другие антагонисты кальциевых рецепторов оказывают вредное воздействие на плод. Тем не менее, может присутствовать риск удлинения процесса родоразрешения.
В исследованиях на животных наблюдалась репродуктивная токсичность при использовании высоких доз (см. раздел «Данные доклинической безопасности»).
Лактация
Препарат Ко-Амлесса не рекомендован в период грудного вскармливания. Поэтому следует принять решение о прекращении кормления грудью или о прекращении приема препарата Ко-Амлесса, учитывая важность проводимой терапии для матери.
Периндоприл
Информация о применении периндоприла при кормлении грудью отсутствует.
Индапамид
Индапамид выделяется в грудное молоко. Индапамид тесно связан с тиазидными диуретиками, которые в случае их применения в период грудного вскармливания приводят к снижению или даже подавлению процесса лактации. Может возникнуть гиперчувствительность к сульфонамидным препаратам, гипокалиемия и ядерная желтуха. Нельзя исключить риск для новорожденных/младенцев. Индапамид не рекомендован в период грудного вскармливания.
Амлодипин
Амлодипин выделяется в грудное молоко. Доля материнской дозы, полученная младенцем, оценивается с межквартильным размахом 3 – 7%, с максимумом 15%. Влияние амлодипина на вскармливаемых грудным молоком младенцев не изучено. Решение о том, следует ли продолжать/прекращать грудное вскармливание или продолжать/прекращать терапию амлодипином, следует принимать с учетом пользы грудного вскармливания для ребенка и пользы терапии амлодипином для матери.
Влияние на репродуктивную систему
Периндоприл и индапамид
Исследования репродуктивной токсичности не установили влияния препарата на репродуктивную функцию самок и самцов крыс (см. раздел «Данные доклинической безопасности»). Не ожидается никакого воздействия на репродуктивную функцию человека.
Амлодипин
Обратимые биохимические изменения в головке сперматозоидов наблюдались у некоторых пациентов, получавших блокаторы кальциевых каналов. Клинических данных недостаточно относительно потенциального влияния амлодипина на фертильность. В одном исследовании на крысах было обнаружено неблагоприятное влияние на фертильность у самцов (см. раздел «Данные доклинической безопасности»).
Применение при нарушениях функции печени
Пациентам с тяжелым нарушением функции печени применение препарата противопоказано.
Режим дозирования для пациентов с нарушениями функции печени легкой или средней степени тяжести не установлен, при назначении указанной комбинации следует соблюдать осторожность.
Применение при нарушениях функции почек
Противопоказано применение препарата при почечной недостаточности тяжелой степени (КК <30 мл/мин).
Препарат с дозировками 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг противопоказан пациентам с умеренными нарушениями функции почек (КК 30-60 мл/мин).
Применение у пожилых пациентов
У пациентов пожилого возраста выведение периндоприлата замедлено. Лечение данной категории пациентов следует проводить с учетом функции почек.
Применение у детей
Безопасность и эффективность препарата у детей и подростков не установлены.
Особые указания
Нейтропения/агранулоцитоз/тромбоцитопения/анемия
У пациентов, получающих ингибиторы АПФ, возможны случаи развития нейтропении/агранулоцитоза, тромбоцитопении и анемии. У пациентов с нормальной функцией почек при отсутствии других осложнений нейтропения встречается редко. Периндоприл с предельной осторожностью следует назначать пациентам с коллагенозами, применяющим иммуносупрессивное лечение, лечение аллопуринолом или прокаинамидом, особенно при уже существующих нарушениях функции почек. У таких пациентов могут развиваться серьезные инфекции, которые в некоторых случаях не отвечают на интенсивную антибиотикотерапию. В случае назначения периндоприла рекомендовано периодически контролировать количество лейкоцитов; пациенты должны быть проинформированы о том, что при появлении каких-либо признаков инфекционного заболевания (например, боль в горле, лихорадка) необходимо немедленно обратиться к врачу (см. разделы «Лекарственное взаимодействие» и «Побочное действие»).
Повышенная чувствительность/ангионевротический отек
Ангионевротический отек лица, конечностей, губ, языка, голосовой щели и/или гортани редко встречается у пациентов, получающих ингибиторы ангиотензинпревращающего фермента, включая периндоприл (см. раздел «Побочное действие»). Данные явления могут наблюдаться в любое время во время лечения. В таких случаях следует незамедлительно прекратить прием периндоприла, пациент должен находиться под постоянным контролем до полного устранения симптомов. В тех случаях, когда отек наблюдался только в области лица и губ, он обычно проходил без лечения, хотя рекомендуется принимать антигистаминные препараты для облегчения симптомов.
Ангионевротический отек, сопровождающийся отеком гортани, может привести к летальному исходу. При выявлении отека в области языка, глотки или гортани, который может повлечь за собой обструкцию дыхательных путей, должна быть незамедлительно назначена соответствующая терапия, включающая п/к введение раствора эпинефрина 1:1000 (0.3-0.5 мл), и/или приняты меры для обеспечения проходимости дыхательных путей.
Сообщалось, что у чернокожих пациентов, получавших ингибиторы АПФ, частота случаев развития ангионевротического отека была выше, чем у светлокожих пациентов.
У пациентов с ангионевротическим отеком в анамнезе, который не связан с терапией ингибиторами АПФ, может быть повышен риск развития ангионевротического отека во время приема препаратов этой группы (см. раздел «Противопоказания»).
Редко сообщалось о случаях развития ангионевротического отека кишечника у пациентов, получавших ингибиторы АПФ. У таких пациентов отмечалась боль в животе (с тошнотой или рвотой, или без них); в некоторых случаях не было зарегистрировано ангионевротического отека лица в анамнезе, а уровень C-1 эстеразы был в норме. Ангионевротический отек был диагностирован с помощью процедур, включающих КТ брюшной полости, УЗИ или во время проведения операции. Симптомы проходили после прекращения приема ингибитора АПФ. Ангионевротический отек кишечника следует включить в дифференциальную диагностику пациентов, которые принимают ингибиторы АПФ при абдоминальных болях.
Сопутствующее применение ингибиторов АПФ с сакубитрилом/валсартаном противопоказано по причине повышенного риска развития ангионевротического отека. Лечение сакубитрилом/валсартаном не следует начинать ранее, чем через 36 часов после приема последней дозы периндоприла. Периндоприл не следует начинать принимать раньше, чем через 36 часов после приема последней дозы сакубитрила/валсартана (см. также разделы «Противопоказания» и «Лекарственное взаимодействие»).
Сопутствующее применение ингибиторов АПФ с ингибиторами нейтральной эндопептидазы NEP (например, с рацекадотрилом), ингибиторами мишени рапамицина в клетках (например, с сиролимусом, эверолимусом, темсиролимусом) и глиптинами (например, с линаглиптином, саксаглиптином, ситаглиптином, вилдаглиптином) может привести к повышенному риску развития ангионевротического отека (например, отечность дыхательных путей или языка, с нарушением дыхания или без нарушения дыхания) (см. раздел «Лекарственное взаимодействие»). Следует соблюдать осторожность в начале приема рацекадотрила, ингибиторов мишени рапамицина в клетках (например, сиролимуса, эверолимуса, темсиролимуса) и глиптинов (например, линаглиптина, саксаглиптина, ситаглиптина, вилдаглиптина) у пациентов, которые уже принимают ингибиторы АПФ.
Анафилактоидные реакции во время десенсибилизации
Были зарегистрированы отдельные случаи, когда у пациентов отмечались устойчивые анафилактоидные реакции с угрозой для жизни при приеме ингибиторов АПФ во время десенсибилизирующей терапии ядом перепончатокрылых насекомых (пчелы, осы). Ингибиторы АПФ следует использовать с осторожностью у пациентов с аллергией при проведении десенсибилизации, а также следует избегать приема ингибиторов АПФ у пациентов, проходящих иммунотерапию ядами. Однако можно избежать развития данных реакций путем временной отмены ингибиторов АПФ в течение не менее 24 часов до начала процедуры десенсибилизации.
Анафилактоидные реакции во время афереза ЛПНП
У пациентов, получающих ингибиторы АПФ при проведении афереза ЛПНП с использованием сульфата декстрана, отмечены редкие случаи развития угрожающих жизни анафилактоидных реакций. Наступление таких реакций можно предотвратить путем временного прекращения приема ингибиторов АПФ перед каждой процедурой афереза ЛПНП.
Гемодиализ
Известны случаи развития анафилактоидных реакций у пациентов, проходящих гемодиализ с использованием мембран с высокой плотностью потока (например, AN69®) и одновременно находящихся на лечении ингибиторами АПФ. Таким пациентам следует назначать или применение мембран для диализа другого типа, или прием антигипертензивных препаратов другого класса.
Первичный альдостеронизм
Пациенты с первичным гиперальдостеронизмом обычно не отвечают на лечение антигипертензивными лекарственными средствами, воздействующими путем ингибирования ренин-ангиотензиновой системы. Поэтому использование данного препарата не рекомендуется.
Калийсберегающие диуретики, соли калия
Обычно не рекомендуется сочетать периндоприл с калийсберегающими препаратами, добавками калия или калийсодержащими заменителями соли (см. раздел «Лекарственное взаимодействие»).
Печеночная энцефалопатия
Индапамид: при нарушении функции печени тиазидные и тиазидоподобные диуретики могут вызвать, особенно в случае дисбаланса электролитов, печеночную энцефалопатию, которая, прогрессируя, может привести к печеночной коме. В таком случае следует немедленно прекратить прием диуретических средств.
Фоточувствительность
Сообщалось о случаях реакций фотосенсибилизации при применении тиазидных и тиазидоподобных диуретиков (см. раздел «Побочное действие»). При развитии во время терапии явлений фотосенсибилизации, рекомендуется прекращение лечения. Если необходимо повторное введение диуретика, рекомендуется защищать открытые участки кожи от солнца или от искусственного ультрафиолетового излучения.
Беременность и лактация
Ингибиторы АПФ не следует принимать во время беременности. За исключением случаев, когда непрерывная терапия с помощью ингибиторов АПФ считается принципиально необходимой, пациентов, планирующих беременность, следует перевести на альтернативные антигипертензивные препараты с установленным профилем безопасности применения во время беременности. Если беременность диагностирована, следует немедленно прекратить прием ингибиторов АПФ и, при необходимости, начать альтернативную терапию (см. разделы «Противопоказания» и «Беременность и лактация»).
Нарушения функции почек
Применение препарата противопоказано пациентам с тяжелыми нарушениями функции почек (КК <30 мл/мин).
Дозировки, содержащие 8 мг/2.5 мг периндоприла/индапамида (например, таблетки 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг) противопоказаны пациентам с умеренными нарушениями функции почек (КК <60 мл/мин).
Лечение также следует прекратить, если у пациента с артериальной гипертензией без предшествующего выраженного нарушения функции почек в ходе лабораторных исследований крови выявлена функциональная почечная недостаточность. Терапия может быть возобновлена либо в более низкой дозировке, либо только одним из компонентов.
При наблюдении таких пациентов обычно выполняют контроль уровней калия и креатинина через две недели лечения, а затем каждые два месяца в течение периода терапевтической стабильности. Нарушение функции почек отмечалось в основном у пациентов с сердечной недостаточностью тяжелой степени или с уже имеющейся почечной недостаточностью, включая стеноз почечной артерии
Почечная недостаточность отмечалась, главным образом, у пациентов с тяжелой сердечной недостаточностью или предшествующей почечной недостаточностью, включая стеноз почечной артерии.
Как правило, не рекомендуется применять лекарственный препарат при двустороннем стенозе почечной артерии или у пациентов с одной функционирующей почкой.
Тиазидные и тиазидоподобные диуретики эффективны только в случае, когда функция почек в норме или нарушена незначительно (уровень креатинина ниже 25 мг/л, то есть 220 мкмоль/л у взрослых). У пациентов пожилого возраста уровень креатинина в плазме следует корректировать с учетом возраста, массы тела и пола пациента в соответствии с формулой Кокрофта:
clcr = (140 — возраст) x масса тела / 0.814 x уровень креатинина в плазме
где: возраст в годах, масса тела в кг, уровень креатинина в плазме в мкмоль/л
Данная формула пригодна для мужчин пожилого возраста и подлежит корректировке для женщин путем умножения полученного результата на 0.85.
Гиповолемия, которая развивается в результате потери запасов воды и натрия, в связи с приемом диуретических средств в начале лечения, приводит к снижению клубочковой фильтрации. Это может привести к повышению уровня мочевины и креатинина в крови. Такая преходящая функциональная почечная недостаточность не имеет неблагоприятных последствий у пациентов с нормальной функцией почек, но может усугубить нарушение функции почек.
При наблюдении таких пациентов обычно выполняют частый контроль уровня калия и креатинина, через две недели лечения, а затем каждые два месяца в течение периода терапевтической стабильности.
Гипотензия и нарушение водно-электролитного баланса
Имеется риск развития внезапной гипотензии на фоне уже имеющегося снижения содержания натрия (особенно у пациентов, у которых артериальное давление было низким вначале, в случаях стеноза почечной артерии, застойной сердечной недостаточности или цирроза с отеком и асцитом). Поэтому блокада ренин-ангиотензин-альдостероновой системы может вызывать, особенно во время первого введения препарата и в течение первых двух недель лечения, внезапное снижение артериального давления и/или повышение уровня креатинина в плазме, что свидетельствует о развитии функциональной почечной недостаточности. Иногда, хотя и редко, подобное расстройство развивается остро, и начало процесса трудно предугадать.
Поэтому следует проводить систематическую проверку на наличие клинических признаков нарушения водно-электролитного баланса, которые могут возникнуть при интеркуррентном эпизоде диареи или рвоты. У таких пациентов следует проводить регулярный контроль уровня электролитов в плазме крови.
Выраженная гипотензия может потребовать внутривенного введения изотонического физиологического раствора. Преходящая гипотензия не является противопоказанием к продолжению лечения. После восстановления удовлетворительного объема крови и стабилизации артериального давления лечение можно начинать снова либо в уменьшенной дозе, либо с применением только одного из компонентов.
Двойная блокада РААС
Имеются данные, свидетельствующие о том, что сопутствующее применение ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена обуславливает увеличение риска развития гипотензии, гиперкалиемии и сниженной функции почек (включая острую почечную недостаточность). Таким образом, двойная блокада РААС посредством комбинированного применения ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена не рекомендуется (см. разделы «Лекарственное взаимодействие» и «Фармакологическое действие»).
Если терапия на основе двойной блокады считается абсолютно необходимой, ее следует осуществлять исключительно под наблюдением специалиста, а также при условии проведения частого и тщательного мониторинга функции почек, уровня электролитов и артериального давления. Не следует одновременно назначать ингибиторы АПФ и блокаторы рецепторов ангиотензина II пациентам с диабетической нефропатией.
Реноваскулярная гипертензия
Лечение реноваскулярной гипертензии осуществляется путем реваскуляризации. Тем не менее, применение ингибиторов АПФ может быть благоприятным у пациентов с реноваскулярной гипертензией, ожидающих хирургического вмешательства, или у которых проведение такой операции не представляется возможным.
Имеется повышенный риск развития гипотензии и почечной недостаточности, если пациент с двусторонним стенозом почечной артерии или стенозом артерии в одной функционирующей почке принимает ингибиторы АПФ (см. раздел «Противопоказания»). Лечение диуретиками может являться сопутствующим фактором. Утрата функции почек может наблюдаться даже при незначительном изменении уровня креатинина в сыворотке у пациентов с односторонним стенозом почечной артерии.
Если препарат Ко-Амлесса назначают пациентам со стенозом почечной артерии или с подозрением на стеноз почечной артерии, лечение следует начинать в стационаре с низкой дозы препарата. Следует контролировать функцию почек и уровень калия, поскольку у некоторых пациентов развилась функциональная почечная недостаточность, которая прошла при прекращении лечения.
Дозировки 8 мг/5 мг/2.5 мг и 8 мг/10 мг/2.5 мг не применимы для пациентов с известным или предполагаемым стенозом почечной артерии, поскольку лечение следует начинать в условиях стационара в дозировке ниже 8 мг/5 мг/2.5 мг или 8 мг/10 мг/2.5 мг.
Пациенты с диагностированным атеросклерозом
Риск артериальной гипотензии существует у всех пациентов, но особую осторожность необходимо соблюдать у пациентов с ИБС или недостаточностью мозгового кровообращения. Лечение следует начинать с низких доз.
Сердечная недостаточность
Применять препарат у пациентов с сердечной недостаточностью следует с осторожностью. У пациентов с тяжелой сердечной недостаточностью (класс IV) лечение должно быть начато под наблюдением врача и с более низких доз. Не следует прекращать применение бета-адреноблокаторов у пациентов с артериальной гипертензией и коронарной недостаточностью: ингибиторы АПФ нужно добавить в схему терапии бета-адреноблокаторами.
В продолжительном плацебо-контролируемом исследовании с участием пациентов с тяжелой сердечной недостаточностью (III и IV функциональные классы по NYHA) частота возникновения отека легких в группе амлодипина была выше, чем в группе плацебо (см. раздел «Фармакологическое действие»). Блокаторы кальциевых каналов, в т.ч. амлодипин, следует применять с осторожностью у пациентов с застойной сердечной недостаточностью, поскольку возможно увеличение риска сердечнососудистых осложнений и смертности.
Стеноз аортального или митрального клапана / гипертрофическая кардиомиопатия
Ингибиторы АПФ следует применять с осторожностью у пациентов с обструкцией выходного тракта левого желудочка.
Пациенты с сахарным диабетом
У пациентов с инсулинзависимым сахарным диабетом (опасность спонтанного повышения уровня калия) лечение следует начинать с низких доз и под контролем врача. У пациентов с сахарным диабетом, получающих гипогликемические средства для приема внутрь или инсулин, в течение первого месяца терапии ингибитором АПФ необходимо регулярно контролировать концентрацию глюкозы в крови (см. раздел «Лекарственное взаимодействие»).
Кашель
Сообщалось о случаях появления сухого кашля при использовании ингибиторов ангиотензинпревращающего фермента. Кашель носит стойкий характер, исчезает при прекращении лечения. Следует учитывать ятрогенную этиологию данного симптома. Если назначение ингибитора ангиотензинпревращающего фермента все еще является предпочтительным, можно рассмотреть возможность продолжения лечения.
Хирургические вмешательства/анестезия
Ингибиторы АПФ могут спровоцировать падение АД при проведении анестезии, особенно если используемый анестетик обладает гипотензивным действием. Поэтому лечение ингибиторами АПФ пролонгированного действия, такими как периндоприл, рекомендуется, по возможности, прекратить за 1 день до проведения хирургической операции.
Нарушение функции печени
В редких случаях терапия ингибиторами АПФ сопровождалась синдромом, который начинался с холестатической желтухи, прогрессировал до фульминантного некроза печени и (иногда) заканчивался летальным исходом. Механизм этого синдрома неизвестен. Пациенты, получающие ингибиторы АПФ, у которых развивается желтуха или значительно повышается уровень печеночных ферментов, должны прекратить прием ингибиторов АПФ и пройти медицинское обследование (см. раздел «Побочное действие»).
У пациентов с нарушенной функцией печени пролонгирован Т1/2 амлодипина и повышены значения AUC; рекомендации по дозированию не утверждены. Соответственно, лечение следует начинать с низких доз амлодипина и соблюдать осторожность, как в начале лечения, так и при увеличении дозы препарата. Для пациентов с тяжелым нарушением функции печени могут потребоваться медленное титрование дозы и тщательный мониторинг.
При нарушении функции печени тиазидные и тиазидоподобные диуретики могут приводить к развитию печеночной энцефалопатии. В таком случае следует немедленно прекратить прием диуретических средств.
Водно-электролитный баланс
Уровень натрия
Следует проверить до начала лечения, а затем необходимо проверять через равные промежутки времени. Любое лечение диуретическими препаратами может привести к гипонатриемии, иногда с очень серьезными последствиями. Первоначально снижение уровня натрия может протекать бессимптомно, поэтому необходим контроль данного показателя на регулярной основе. Чаще следует проводить анализ у пациентов пожилого возраста и у пациентов с циррозом печени (см. разделы «Побочное действие» и «Передозировка»).
Гипонатриемия с гиповолемией может являться причиной дегидратации и ортостатической гипотензии. Сопутствующая потеря ионов хлора может привести к вторичному компенсаторному метаболическому алкалозу, частота и степень которого незначительны.
Гиперкалиемия
Ингибиторы АПФ могут вызывать гиперкалиемию, поскольку они ингибируют высвобождение альдостерона. Эффект обычно незначителен у пациентов с нормальной функцией почек. К факторам риска развития гиперкалиемии относятся следующие: почечная недостаточность, ухудшение функции почек, возраст >70 лет, сахарный диабет, гипоальдостеронизм, интеркуррентные явления, в частности дегидратация, острая сердечная недостаточность, метаболический ацидоз и одновременное применение калийсберегающих диуретиков (например, спиронолактон, эплеренон, триамтерен или амилорид), добавок калия или калийсодержащих заменителей солей; а также прием других препаратов, связанных с повышением уровня калия в сыворотке (например, гепарин, триметоприм или ко-тримоксазол, также известный как триметоприм / сульфаметоксазол, и особенно антагонисты альдостерона или блокаторы ангиотензиновых рецепторов, ацетилсалициловая кислота ≥3 г/день, ингибиторы ЦОГ-2 и неселективные НПВП, иммунодепрессанты, такие как циклоспорин или такролимус). Применение добавок калия, калийсберегающих диуретиков или калийсодержащих заменителей солей, особенно у пациентов с нарушением функции почек, может привести к значительному увеличению уровня калия в сыворотке крови. Гиперкалиемия может привести к развитию серьезной аритмии, иногда с летальным исходом. Калийсберегающие диуретики и блокаторы ангиотензиновых рецепторов следует применять с осторожностью пациентам, получающим ингибиторы АПФ, а также следует контролировать уровень калия в сыворотке крови и функцию почек (см. раздел «Лекарственное взаимодействие»).
Гипокалиемия
Снижение уровня калия при гипокалиемии является основным риском, связанным с применением тиазидных и тиазидоподобных диуретиков. Гипокалиемия может вызвать мышечные нарушения. Сообщалось о случаях рабдомиолиза, особенно на фоне тяжелой гипокалиемии. Следует избегать снижения уровня калия (<3.4 ммоль/л) в группах пациентов с высоким риском, а именно у пациентов пожилого возраста и/или у субъектов с недостаточностью питания, независимо от того, принимают ли они несколько препаратов, у пациентов с циррозом печени, отеками и асцитом, у пациентов с коронарной болезнью и сердечной недостаточностью. В таких случаях гипокалиемия способствует увеличению токсического действия сердечных гликозидов на сердце и риска нарушений сердечного ритма.
Пациенты с увеличением интервала QT также относятся к группе риска, независимо от происхождения заболевания: носит ли оно врожденный или ятрогенный характер. Гипокалиемия, как и в случае брадикардии, выступает фактором, который способствует развитию серьезных нарушений ритма, в частности, пируэтной тахикардии, которая может привести к летальному исходу.
Во всех случаях необходимо чаще контролировать уровень калия. Первое измерение уровня калия в плазме крови выполняют в течение первой недели после начала лечения.
При низком уровне калия требуется его корректировка. Гипокалиемия на фоне низких концентраций магния может быть резистентной к лечению до тех пор, пока не будет проведена корректировка содержания магния в сыворотке крови.
Уровень магния
Тиазидные и тиазидоподобные диуретики, включая индапамид, повышают выведение магния с мочой, что может привести к гипомагниемии (см. разделы «Лекарственное взаимодействие» и «Побочное действие»).
Содержание кальция
Тиазидные и тиазидоподобные диуретики могут снизить выведение кальция с мочой и привести к умеренному и кратковременному повышению уровня кальция в плазме. Значительно повышенный уровень кальция может быть связан с развитием недиагностированного гиперпаратиреоза. В таких случаях лечение следует прекратить до исследования функции паращитовидной железы.
Мочевая кислота
У пациентов с гиперурикемией может увеличиваться частота обострения приступов подагры.
Литий
Одновременное применение лития и комбинации периндоприл/индапамид, как правило, не рекомендуется (см. раздел «Лекарственное взаимодействие»).
Спортсмены
Спортсмены должны учитывать, что данный продукт содержит активное вещество (индапамид), которое может давать положительную реакцию в допинг-тестах.
Хориоидальный выпот, острая миопия и вторичная закрытоугольная глаукома
Сульфонамиды или производные сульфонамида, могут вызывать идиосинкразические реакции, приводящие к развитию хориоидального выпота с дефектом поля зрения, острой кратковременной миопии и острой закрытоугольной глаукоме. Симптомы включают потерю остроты зрения или боль в глазах, которые возникают, как правило, в течение нескольких часов или недель после начала приема лекарственного препарата. При отсутствии лечения острая закрытоугольная глаукома может привести к необратимой потере зрения. При проявлении симптомов необходимо как можно скорее прекратить прием препарата. Если внутриглазное давление остается неконтролируемым, может потребоваться неотложное медикаментозное лечение или хирургическое вмешательство. Факторами риска развития острой закрытоугольной глаукомы могут быть аллергические реакции на сульфонамиды или пенициллин в анамнезе.
Расовая принадлежность
Периндоприл (как и другие ингибиторы АПФ) оказывает менее выраженное гипотензивное действие у пациентов негроидной расы по сравнению с представителями других рас, возможно, из-за более высокой распространенности состояний с низким содержанием ренина у данной категории пациентов, страдающих артериальной гипертензией.
Пациенты пожилого возраста
Перед началом лечения следует оценить функцию почек и уровень калия. Начальная доза впоследствии корректируется в соответствии с изменением артериального давления, особенно при наличии водно-электролитных нарушений, чтобы избежать внезапного развития гипотензии. При этом увеличивать дозу препарата следует с осторожностью (см. раздел «Фармакокинетика»).
Использование в педиатрии
Эффективность и переносимость препарата у детей и подростков не установлены.
Натрий
Данный лекарственный препарат содержит менее 1 ммоль натрия (23 мг) в одной таблетке, то есть фактически «не содержит натрия».
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследования влияния препарата Ко-Амлесса на способность к вождению транспортных средств и управлению механизмами не проводились. При вождении транспортных средств или при управлении механизмами следует учитывать, что во время лечения может периодически возникать головокружение или чувство усталости.
Передозировка
Периндоприл/индапамид
Симптомы: наиболее вероятной нежелательной реакцией в случае передозировки является развитие гипотензии и возможно рефлекторной тахикардии, иногда связанной с тошнотой, рвотой, судорогами, головокружением, сонливостью, спутанностью сознания, олигурией, которая может прогрессировать до анурии (вследствие развития гиповолемии). Может возникнуть нарушение водно-солевого баланса (низкий уровень натрия, низкий уровень калия).
Лечение: первые меры, которые необходимо предпринять, заключаются в быстром выведении препарата путем промывания желудка и/или введения активированного угля, затем следует восстановить водно-электролитный баланс в специализированном центре до нормального состояния.
В случае развития выраженной гипотензии пациента кладут в положение лежа с опущенной вниз головой. При необходимости можно выполнить внутривенную инфузию изотонического физиологического раствора или увеличить объем циркулирующей жидкости другим методом.
Периндоприлат — активная форма периндоприла — может быть удален из организма с помощью диализа. Однако в связи с тем, что амлодипин в значительной степени связывается с белками, диализ не является эффективным.
Амлодипин
Опыт применения амлодипина у людей с преднамеренной передозировкой ограничен.
Симптомы: доступные данные предполагают, что сильная передозировка амлодипина может привести к избыточной периферической вазодилатации и возможной рефлекторной тахикардии. Сообщалось о выраженной и стойкой артериальной гипотензии, в том числе с развитием шока и летальным исходом.
Лечение: в случае клинически значимой артериальной гипотензии, вызванной передозировкой амлодипина, необходимо проведение активной сердечно-сосудистой поддерживающей терапии, включая частый мониторинг деятельности сердца и функции дыхания, приподнятые нижние конечности, контроль ОЦК и диуреза.
Вазоконстрикторы могут помочь восстановлению сосудистого тонуса и АД при условии, что применение таких препаратов не противопоказано. Для снятия блокады кальциевых каналов может быть эффективно в/в введение глюконата кальция.
В некоторых случаях целесообразно провести промывание желудка. У здоровых добровольцев применение активированного угля в течение до 2 ч после приема 10 мг амлодипина привело к уменьшению скорости его всасывания. В связи с тем, что амлодипин в значительной степени связывается с белками, диализ не эффективен.
Лекарственное взаимодействие
В клинических исследованиях было продемонстрировано, что двойная блокада ренин-ангиотензин-альдостероновой системы (РААС) посредством комбинированного применения ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена ассоциируется с более высокой частотой развития таких нежелательных явлений, как гипотензия, гиперкалиемия и сниженная функция почек (включая острую почечную недостаточность), по сравнению с монотерапией препаратом, воздействующим на РААС (см. разделы «Противопоказания», «Особые указания» и Фармакологическое действие»).
Гиперкалиемия, вызванная применением лекарственных средств
Хотя содержание калия в сыворотке крови обычно остается в пределах нормы, гиперкалиемия может возникнуть у некоторых пациентов, принимающих Ко-Амлессу. Некоторые лекарственные препараты или терапевтические средства могут увеличивать вероятность развития гиперкалиемии: алискирен, соли калия, калийсберегающие диуретики (например, спиронолактон, триамтерен или амилорид), ингибиторы АПФ, антагонисты рецепторов ангиотензина-II, НПВП, гепарины, иммунодепрессанты, такие как циклоспорин или такролимус, триметоприм и ко-тримоксазол (триметоприм/сульфаметоксазол), поскольку известно, что триметоприм действует как калийсберегающий диуретик, подобно амилориду. Комбинация указанных препаратов увеличивает риск развития гиперкалиемии. В связи с этим, комбинация указанных препаратов с Ко-Амлессой не рекомендуется. Если одновременное применение показано, их следует применять с осторожностью и при частом мониторинге уровня калия в сыворотке крови.
Одновременный прием противопоказан (см. раздел «Противопоказания»)
Алискирен: у пациентов с сахарным диабетом или почечной недостаточностью повышен риск гиперкалиемии, ухудшения функции почек, сердечно-сосудистой заболеваемости и смертности.
Экстракорпоральное лечение: экстракорпоральное лечение, которое приводит к контакту крови с отрицательно заряженными поверхностями, такое как диализ или гемофильтрация, на основе мембран с высокой гидравлической проницаемостью (например, полиакрилонитрильные мембраны) и аферез липопротеинов низкой плотности с декстрана сульфатом повышает риск развития анафилактоидных реакций тяжелой степени (см. раздел «Противопоказания»). В таком случае следует рассмотреть возможность применения диализной мембраны другого типа или антигипертензивного препарата другого класса.
Сакубитрил/валсартан: противопоказано сопутствующее применение ингибиторов АПФ с сакубитрилом/валсартаном, поскольку это увеличивает риск развития ангионевротического отека (см. разделы «Противопоказания» и «Особые указания»).
Одновременный прием не рекомендован
Алискирен: у пациентов, не страдающих сахарным диабетом, или у пациентов без нарушения функции почек, увеличивается риск развития гиперкалиемии, ухудшения функции почек и повышения сердечно-сосудистой заболеваемости и смертности (см. раздел «Особые указания»).
Одновременное применение ингибиторов АПФ и антагонистов рецепторов ангиотензина II: в научной литературе сообщалось, что у пациентов с атеросклеротическим заболеванием, сердечной недостаточностью или с сахарным диабетом с поражением органов-мишеней сопутствующая терапия ингибитором АПФ и блокаторами ангиотензиновых рецепторов приводит к более частому развитию гипотензии, обморока, гиперкалиемии и ухудшению функции почек (включая острую почечную недостаточность) по сравнению с применением одного препарата, действующего на систему ренин-ангиотензин-альдостерон. Двойная блокада (например, путем сочетания ингибитора АПФ с антагонистом рецептора ангиотензина II) может применяться только в отдельных случаях при тщательном контроле функции почек, уровня калия и артериального давления (см. раздел «Особые указания»).
Эстрамустин: риск усиления нежелательных реакций, таких как ангионевротический отек.
Препараты лития: сообщалось о случаях обратимого увеличения концентраций лития в сыворотке крови и развития токсических реакций во время одновременного применения лития и ингибиторов АПФ. Не рекомендуется применять периндоприл в сочетании с индапамидом и препаратами лития, но, если такая комбинация является необходимой, следует тщательно контролировать концентрацию лития в сыворотке крови (см. раздел «Особые указания»).
Калийсберегающие диуретики, добавки калия или калийсодержащие заменители соли: возможна гиперкалиемия (потенциально летальная), в частности у пациентов с почечной недостаточностью (аддитивный гиперкалиемический эффект). Не рекомендуется применять периндоприл в сочетании с указанными лекарственными препаратами (см. раздел «Особые указания»). Если сопутствующее применение препарата тем не менее показано, следует соблюдать осторожность и выполнять частый контроль содержания калия в сыворотке крови. О применении спиронолактона при сердечной недостаточности см. раздел «Сопутствующее применение, требующее особых мер предосторожности».
Ко-тримоксазол (триметоприм/сульфаметоксазол): пациенты, принимающие ко-тримоксазол при сопутствующей терапии (триметоприм/сульфаметоксазол), могут подвергаться повышенному риску развития гиперкалиемии (см. раздел «Особые указания»).
Одновременный прием, при котором требуется особая осторожность
При одновременном применении с баклофеном наблюдается потенцирование антигипертензивного эффекта. Следует контролировать АД и функцию почек, а также, при необходимости, проводить коррекцию дозы антигипертензивного средства.
Одновременное применение ингибиторов АПФ с НПВП (в том числе ацетилсалициловая кислота в дозе ≥3 г/сутки, ингибиторы ЦОГ-2 и неселективные НПВП) может стать причиной снижения гипотензивного эффекта ингибиторов АПФ. Одновременное применение указанных препаратов также повышает риск нарушения функции почек вплоть до развития острой почечной недостаточности и увеличения содержания калия в сыворотке крови, особенно у пациентов с уже существующими нарушениями функции почек. Такую комбинацию следует назначать с осторожностью, особенно лицам пожилого возраста. Пациенты должны получать достаточное количество жидкости, а также рекомендовано осуществлять контроль функции почек до и периодически после начала лечения.
Эпидемиологические исследования свидетельствуют о том, что совместное применение ингибиторов АПФ и противодиабетических препаратов (инсулин, пероральные гипогликемические средства) может вызвать или усиливать гипогликемический эффект с риском развития гипогликемии, что наиболее вероятно у пациентов с почечной недостаточностью и в первые недели терапии.
У пациентов, принимающих диуретики без калийсберегающих свойств, особенно у таковых с гиповолемией и/или дефицитом солей, в начале приема ингибиторов АПФ может развиться избыточное снижение АД. Риск артериальной гипотензии можно уменьшить путем отмены диуретика, повышения употребления жидкости или соли перед началом лечения, а также назначения периндоприла в низких начальных дозах с последующим увеличением.
При артериальной гипертензии, когда возможны гиповолемия и/или дефицит солей вследствие приема диуретика, следует рассмотреть возможность или отмены диуретика до начала приема ингибитора АПФ с его последующим повторным введением, или начала терапии ингибитором АПФ с более низких доз с последующим увеличением.
У пациентов с хронической сердечной недостаточностью, получающих терапию диуретиками, ингибитор АПФ должен быть назначен в очень низкой дозе, по возможности после снижения дозы диуретика.
Во всех случаях на первых неделях терапии ингибитором АПФ следует контролировать функцию почек (содержание креатинина).
Калийсберегающие диуретики — эплеренон или спиронолактон в дозах 12.5 мг и 50 мг/сут и ингибитор АПФ в низких дозах: у пациентов с сердечной недостаточностью (II-IV функциональные классы по NYHA) с фракцией выброса <40%, предварительно получавших ингибиторы АПФ и «петлевые» диуретики, в случаях несоблюдения рекомендаций по применению данной комбинации, существует риск развития гиперкалиемии, потенциально летальной.
До начала приема данной комбинации следует исключить гиперкалиемию и почечную недостаточность.
Следует контролировать содержание калия и креатинина в плазме крови еженедельно на протяжении первого месяца лечения и далее — 1 раз в месяц.
Лекарственные препараты, которые приводят к развитию пируэтной тахикардии
Из-за риска развития гипокалиемии следует соблюдать осторожность при одновременном назначении индапамида и препаратов, вызывающих желудочковую тахикардию типа «пируэт», таких как:
— противоаритмические вещества класса IA (хинидин, гидрохинидин, дизопирамид);
— противоаритмические вещества класса III (амиодарон, дофетилид, ибутилид, бретилий, соталол);
— некоторые нейролептики (хлорпромазин, циамемазин, левомепромазин, тиоридазин, трифлуоперазин), бензамиды (амисульприд, сульпирид, сультоприд, тиаприд), бутирофеноны (дроперидол, галоперидол), другие нейролептики (пимозид);
— другие вещества, такие как бепридил, цизаприд, дифеманил, эритромицин в/в, галофантрин, мизоластин, моксифлоксацин, пентамидин, спарфлоксацин, винкамин в/в, метадон, астемизол, терфенадин.
Рекомендовано: профилактика и устранение гипокалиемии, при необходимости — контроль интервала QT на ЭКГ.
Препараты, снижающие уровень калия (амфотерицин В (в/в), глюко- и минералокортикоиды (для системного применения), тетракозактид, стимулирующие слабительные средства) при одновременном применении с индапамидом повышают риск снижения уровня калия (аддитивный эффект). Рекомендован контроль содержания калия и при необходимости его коррекция. Особое внимание следует уделять пациентам, получающим сердечные гликозиды. Следует применять нестимулирующие слабительные средства.
При гипокалиемии возможно усиление токсического действия препаратов наперстянки. При комбинации с сердечными гликозидами следует контролировать содержание калия и показатели ЭКГ; при необходимости лечение должно быть пересмотрено.
Аллопуринол: сопутствующее применение с индапамидом может повышать частоту реакций гиперчувствительности на аллопуринол.
Одновременное применение, требующее осторожности
Калийсберегающие диуретики (амилорид, спиронолактон, триамтерен): хотя эта комбинация целесообразна у некоторых пациентов, возможно развитие гипокалиемии или гиперкалиемии (в частности, у пациентов с почечной недостаточностью или сахарным диабетом). Необходимо проводить мониторинг уровня калия в плазме крови и ЭКГ, а при необходимости пересмотреть лечение.
На фоне приема метформина при возможной функциональной почечной недостаточности, у пациентов, принимающих диуретики, особенно, «петлевые» диуретики, возможно развитие лактацидоза. Не следует применять метформин, если содержание креатинина в сыворотке превышает 15 мг/л (135 мкмоль/л) у мужчин и 12 мг/л (110 мкмоль/л) у женщин.
В случае дегидратации, вызванной приемом диуретиков, повышается риск развития острой почечной недостаточности, особенно при применении йодсодержащего контрастного средства в высоких дозах. Перед назначением йодсодержащих препаратов следует провести регидратацию.
При одновременном применении с препаратами (солями) кальция имеется риск повышения содержания кальция вследствие снижения его экскреции с мочой.
При одновременном применении с циклоспорином: гиперкалиемия может развиться при одновременном приеме ингибиторов АПФ с циклоспорином. Рекомендуется контролировать уровень калия в сыворотке крови.
Имеется риск повышения уровня креатинина в связи с приемом индапамида без изменения уровня циклоспорина в циркулирующей крови, даже при отсутствии нарушения водно-электролитного баланса.
Не проводилось исследований лекарственного взаимодействия с циклоспорином и амлодипином у здоровых добровольцев и в других популяциях, за исключением пациентов с трансплататом почки, у которых наблюдалось вариабельное повышение минимальной концентрации циклоспорина (в среднем 0 – 40%). Следует контролировать уровни циклоспорина у пациентов с трансплантатом почки, получающих амлодипин, и при необходимости уменьшить дозу циклоспорина.
Гиперкалиемия может развиться при одновременном приеме ингибиторов АПФ с гепарином. Рекомендуется контролировать уровень калия в сыворотке.
Одновременное применение амлодипина и сильных или умеренных ингибиторов CYP3A4 (ингибиторы протеазы, противогрибковые препараты из группы азолов, антибиотики группы макролидов (эритромицин или кларитромицин), верапамил или дилтиазем) может привести к повышению плазменной концентрации амлодипина. Клинические проявления изменения фармакокинетических показателей могут быть более выраженными у пожилых пациентов. При необходимости рекомендовано регулярное медицинское наблюдение и коррекция доз.
Кларитромицин является ингибитором CYP3A4. Существует повышенный риск гипотензии у пациентов, принимающих кларитромицин с амлодипином. Рекомендуется осуществлять тщательное наблюдение пациентов при одновременном применении амлодипина с кларитромицином.
Рацекадотрил: известно, что ингибиторы АПФ (например, периндоприл) могут приводить к развитию ангионевротического отека. Данный риск может быть повышен при его одновременном применении с рацекадотрилом (лекарственный препарат, который применяется при острой диарее).
Ингибиторы mTOR (например, сиролимус, эверолимус, темсиролимус): пациенты, принимающие одновременно ингибиторы mTOR, могут подвергаться повышенному риску развития ангионевротического отека (см. раздел «Особые указания»).
Ингибиторы mTOR являются субстратами CYP3A. Амлодипин является слабым ингибитором CYP3A. При сопутствующем использовании амлодипин может усиливать действие ингибиторов mTOR.
Индукторы CYP3A4: при сопутствующем приеме известных индукторов CYP3A4 концентрация амлодипина в плазме может варьировать. Соответственно, рекомендуется контроль артериального давления и корректировка дозы во время и после одновременного приема сопутствующих препаратов, особенно сильных индукторов CYP3A4 (например, рифампицин, Hypericum perforatum).
Не рекомендуется принимать амлодипин с грейпфрутом или грейпфрутовым соком, так как у некоторых пациентов может увеличиваться биодоступность препарата, что приводит к усилению эффекта снижения артериального давления.
Дантролен (инфузия): у животных наблюдалась фибрилляция желудочков и сердечно-сосудистая недостаточность с летальным исходом в связи с развитием гиперкалиемии после введения верапамила и дантролена в/в. В связи с риском развития гиперкалиемии рекомендуется избегать одновременного введения блокаторов кальциевых каналов, таких как амлодипин, пациентам, восприимчивым к развитию злокачественной гипертермии, а также при лечении злокачественной гипертермии.
Такролимус: имеется риск повышения уровня такролимуса в крови при одновременном применении амлодипина, но фармакокинетический механизм такого взаимодействия до конца не изучен. Чтобы избежать токсичности такролимуса при введении амлодипина, пациенту, получающему такролимус, требуется контролировать уровень такролимуса в крови и, при необходимости, корректировать дозу такролимуса.
Симвастатин: одновременное введение нескольких доз по 10 мг амлодипина и 80 мг симвастатина приводит к увеличению воздействия симвастатина на 77% по сравнению с применением симвастатина в отдельности. Ограничение дозы симвастатина у пациентов, принимающих амлодипин, до 20 мг в сутки.
При проведении клинических исследований взаимодействия установили, что амлодипин не оказывает влияния на фармакокинетику аторвастатина, дигоксина или варфарина.
Антигипертензивные препараты и вазодилататоры: сопутствующее применение данных препаратов может усилить гипотензивное действие периндоприла. Сопутствующее применение с нитроглицерином и другими нитратами или другими вазодилататорами может дополнительно снизить артериальное давление.
Имипраминоподобные антидепрессанты трициклические антидепрессанты, нейролептики: усиление антигипертензивного эффекта и повышение риска развития ортостатической гипотензии (аддитивный эффект).
Кортикостероиды, тетракозактид: уменьшение антигипертензивного эффекта (задержка соли и воды в результате приема кортикостероидов).
Другие антигипертензивные препараты: одновременное применение с препаратом Ко-Амлесса может приводить к дополнительному снижению артериального давления.
Аллопуринол, цитостатики или иммунодепрессанты, системные кортикостероиды или прокаинамид: одновременное применение этих препаратов с ингибиторами АПФ может увеличить риск развития лейкопении (см. раздел «Особые указания»).
Анестетики: ингибиторы АПФ способны усиливать гипотензивный эффект некоторых анестезирующих средств (см. раздел «Особые указания»).
Глиптины (линаглиптин, саксаглиптин, ситаглиптин, вилдаглиптин): риск усиления неблагоприятных эффектов, таких как ангионевротический отек, вследствие снижения активности дипептидилпептидазы-4 (DPP-IV) у пациентов, одновременно принимающих ингибиторы АПФ.
Симпатомиметики могут ослаблять антигипертензивное действие ингибиторов АПФ.
Золото: редко сообщалось о развитии нитритоидных реакций (симптомы включают в себя покраснение лица, тошноту, рвоту и гипотензию) у пациентов, которые проходят терапию инъекционными препаратами золота (натрий ауротиомалат) и сопутствующую терапию ингибиторами АПФ, включая периндоприл.
Условия отпуска из аптек
По рецепту врача *.
* Включен в перечень препаратов, реализуемых без рецепта врача согласно Постановления МЗ РБ №27 от 9 февраля 2023г.
Не все размеры упаковок могут быть доступны для реализации.
Условия хранения препарата
Препарат следует хранить в оригинальной упаковке с целью защиты от света и влаги при температуре не выше 30°C.
Срок годности препарата
Срок годности — 3 года.
Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата или работы с ним
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Контакты для обращений
КРКА д.д., представительство, (Словения)

Представительство АО «KRKA, d.d., Novo mesto» (Словения) в Беларуси
220114 Минск, ул. Филимонова 25Г, оф. 315, 3 этаж
Тел/факс: (375-740) 740-92-30
E-mail: info.by@krka.biz
Эликвис® (Eliquis®) инструкция по применению
📜 Инструкция по применению Эликвис®
💊 Состав препарата Эликвис®
✅ Применение препарата Эликвис®
📅 Условия хранения Эликвис®
⏳ Срок годности Эликвис®
Описание лекарственного препарата
Эликвис®
(Eliquis®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2022 года.
Дата обновления: 2021.11.24
Лекарственные формы
| Эликвис® |
Таб., покр. пленочной оболочкой, 2.5 мг: 10, 20, 60 или 100 шт. рег. №: ЛП-001475 |
|
|
Таб., покр. пленочной оболочкой, 5 мг: 20, 56, 60 или 100 шт. рег. №: ЛП-002007 |
Форма выпуска, упаковка и состав
препарата Эликвис®
Таблетки, покрытые пленочной оболочкой желтого цвета, круглые, с гравировкой «893» на одной стороне и «2 1/2» на другой стороне.
Вспомогательные вещества: лактоза безводная — 50.25 мг, целлюлоза микрокристаллическая — 41 мг, кроскармеллоза натрия — 4 мг, натрия лаурилсульфат — 1 мг, магния стеарат — 1.25 мг.
Состав пленочной оболочки: Опадрай II Желтый — 4 мг (гипромеллоза 15 cps — 1.48 мг, лактозы моногидрат — 1.24 мг, титана диоксид — 0.8 мг, триацетин — 0.32 мг, краситель железа оксид желтый — 0.16 мг).
10 шт. — блистеры из ПВХ/ПВДХ пленки и алюминиевой фольги (1) — пачки картонные×.
10 шт. — блистеры из ПВХ/ПВДХ пленки и алюминиевой фольги (2) — пачки картонные×.
10 шт. — блистеры из ПВХ/ПВДХ пленки и алюминиевой фольги (6) — пачки картонные×.
10 шт. — блистеры перфорированные из ПВХ/ПВДХ пленки и алюминиевой фольги (2) — пачки картонные×.
10 шт. — блистеры перфорированные из ПВХ/ПВДХ пленки и алюминиевой фольги (6) — пачки картонные×.
10 шт. — блистеры перфорированные из ПВХ/ПВДХ пленки и алюминиевой фольги (10) — пачки картонные×.
Таблетки, покрытые пленочной оболочкой розового цвета, овальные, с гравировкой «894» на одной стороне и «5» на другой стороне.
Вспомогательные вещества: лактоза безводная — 100.5 мг, целлюлоза микрокристаллическая — 82 мг, кроскармеллоза натрия — 8 мг, натрия лаурилсульфат — 2 мг, магния стеарат — 2.5 мг.
Состав пленочной оболочки: Опадрай II Розовый — 8 мг (гипромеллоза 15 cps — 2.96 мг, лактозы моногидрат — 2.48 мг, титана диоксид — 1.87 мг, триацетин — 0.64 мг, краситель железа оксид красный — 0.046 мг).
10 шт. — блистеры из ПВХ/ПВДХ пленки и алюминиевой фольги (2) — пачки картонные×.
10 шт. — блистеры из ПВХ/ПВДХ пленки и алюминиевой фольги (6) — пачки картонные×.
10 шт. — блистеры из ПВХ/ПВДХ пленки и алюминиевой фольги (10) — пачки картонные×.
14 шт. — блистеры из ПВХ/ПВДХ пленки и алюминиевой фольги (4) — пачки картонные×.
10 шт. — блистеры перфорированные из ПВХ/ПВДХ пленки и алюминиевой фольги (2) — пачки картонные×.
10 шт. — блистеры перфорированные из ПВХ/ПВДХ пленки и алюминиевой фольги (6) — пачки картонные×.
10 шт. — блистеры перфорированные из ПВХ/ПВДХ пленки и алюминиевой фольги (10) — пачки картонные×.
× с контролем первого вскрытия или без него.
Фармакологическое действие
Апиксабан представляет собой мощный прямой ингибитор FXa, обратимо и селективно блокирующий активный центр фермента. Препарат предназначен для перорального применения. Для реализации антитромботической активности апиксабана не требуется наличия антитромбина III. Апиксабан ингибирует свободный и связанный FXa, а также активность протромбиназы. Апиксабан не оказывает непосредственного прямого влияния на агрегацию тромбоцитов, но опосредованно ингибирует агрегацию тромбоцитов, индуцированную тромбином. За счет ингибирования активности FXa апиксабан предотвращает образование тромбина и тромбов. В результате подавления FXa изменяются значения показателей системы свертывания крови: удлиняется протромбиновое время, АЧТВ и происходит увеличение МНО. Изменения этих показателей при применении препарата в терапевтической дозе незначительны и в большой степени вариабельны. Поэтому использование их с целью оценки фармакодинамической активности апиксабана не рекомендуется. В тесте генерации тромбина апиксабан снижал эндогенный тромбиновый потенциал — показатель образования тромбина в плазме крови человека.
Ингибирование апиксабаном активности FXa доказано с помощью хромогенного теста с использованием гепарина Rotachrom. Изменение анти-FXa активности прямо пропорционально повышению концентрации апиксабана в плазме крови, при этом максимальные значения активности наблюдаются при достижении максимальной концентрации апиксабана в плазме крови. Линейная зависимость между концентрацией и анти-FXa активностью апиксабана регистрируется в широком диапазоне терапевтических доз препарата. Изменения анти-FXa активности при изменении дозы и концентрации апиксабана более выражены и менее вариабельны, чем показатели свертывания крови.
В таблице 1 показаны предполагаемые равновесные концентрации и анти-FXa активность при применении препарата апиксабан по каждому из показаний. У пациентов, получающих апиксабан после планового эндопротезирования тазобедренного или коленного сустава, отношение максимального и минимального уровня анти-FXа активности в интервале между приемом доз препарата не превышает 1.6. У пациентов, получающих апиксабан по поводу профилактики инсульта и системной тромбоэмболии при неклапанной фибрилляции предсердий, данное отношение составляет менее 1.7, а у пациентов, получающих апиксабан по поводу лечения тромбоза глубоких вен и профилактики рецидивов тромбозов глубоких вен — менее 2.2.
Таблица 1. Предполагаемые равновесные концентрации (нг/мл) и анти-FXa активность (МЕ/мл)
* Коррекция дозы согласно критериям снижения дозы в исследовании ARISTOTLE.
На фоне терапии апиксабаном не требуется проведения рутинного мониторинга его антикоагулянтного эффекта, однако выполнение калиброванного количественного теста анти-FXa активности может быть полезным в ситуациях, когда информация о наличии апиксабана в крови может быть полезна для принятия решения о продолжении терапии. В сравнении с варфарином на фоне применения апиксабана отмечается меньшее число кровотечений, включая внутричерепное кровоизлияние.
Фармакокинетика
Всасывание
При применении апиксабана в дозах до 10 мг его абсолютная биодоступность достигает 50%. Апиксабан быстро всасывается из ЖКТ, Cmax достигается в течение 3-4 ч после перорального приема. Прием пищи не оказывает влияния на значения AUC или Cmax апиксабана. Фармакокинетика апиксабана для доз до 10 мг имеет линейный характер. При приеме апиксабана в дозах выше 25 мг отмечается ограничение всасывания препарата, что сопровождается снижением его биодоступности. Показатели метаболизма апиксабана характеризуются низкой или умеренной меж- и внутрииндивидуальной вариабельностью (соответствующие значения коэффициента вариации составляют приблизительно 20% и 30% соответственно).
После перорального приема апиксабана в дозе 10 мг в виде 2 измельченных таблеток по 5 мг, разведенных в 30 мл воды, экспозиция препарата была сопоставима с таковой после перорального приема 2 целых таблеток апиксабана по 5 мг. После перорального приема апиксабана в дозе 10 мг в виде 2 измельченных таблеток по 5 мг с 30 г яблочного пюре значения Cmax и AUC были на 21% и 16% соответственно ниже, чем после приема 2 целых таблеток по 5 мг.
После введения через назогастральный зонд измельченной таблетки апиксабана в дозе 5 мг, разведенной в 60 мл 5% водного раствора декстрозы (5ДВ), экспозиция апиксабана была сопоставима с таковой, наблюдавшейся в других клинических исследованиях с участием здоровых добровольцев, получивших однократную дозу апиксабана 5 мг внутрь в виде таблетки.
Распределение
Связывание апиксабана с белками плазмы крови человека составляет приблизительно 87%, Vd — приблизительно 21 л.
Метаболизм и выведение
Приблизительно 25% принятой дозы выводится в виде метаболитов. Основной путь выведения — через кишечник. Почечная экскреция апиксабана составляет приблизительно 27% от его общего клиренса.
Общий клиренс апиксабана составляет приблизительно 3.3 л/ч, T1/2 — около 12 ч. О-деметилирование и гидроксилирование по 3-оксопиперидиниловому остатку являются основными путями биотрансформации апиксабана. Апиксабан преимущественно метаболизируется с участием изофермента CYP3A4/5, в меньшей степени — изоферментов CYP1A2, 2С8, 2С9, 2С19 и 2J2. Неизмененный апиксабан является основным веществом, циркулирующим в плазме крови человека, активные циркулирующие в кровотоке метаболиты отсутствуют. Кроме того, апиксабан является субстратом транспортных белков, Р-гликопротеина и белка резистентности рака молочной железы (BCRP).
Фармакокинетика у особых групп пациентов
Нарушение функции почек не оказывает влияния на Cmax апиксабана. Однако отмечалось повышение концентрации апиксабана, коррелировавшее со степенью снижения функции почек, оценивавшейся по значениям КК. У лиц с нарушением функции почек легкой (КК от 51 мл/мин до 80 мл/мин), средней (КК от 30 мл/мин до 50 мл/мин) и тяжелой (КК от 15 мл/мин до 29 мл/мин) степени, значения AUC апиксабана в плазме крови возрастали на 16%, 29% и 44% соответственно, по сравнению с лицами, имевшими нормальные значения КК. При этом нарушение функции почек не оказывало очевидного влияния на взаимосвязь между концентрацией апиксабана в плазме крови и его анти-FXa активностью. Исследования апиксабана у пациентов с КК менее 15 мл/мин или находящихся на диализе не проводились.
Нарушение функции печени. Исследования апиксабана при тяжелой печеночной недостаточности и активной патологии гепатобилиарной системы не проводились. Не было выявлено значимых изменений параметров фармакокинетики и фармакодинамики при однократном приеме апиксабана в дозе 5 мг у пациентов с печеночной недостаточностью легкой и средней степени выраженности (классы A и B по классификации Чайлд-Пью соответственно) по сравнению со здоровыми добровольцами. Изменения анти-FXa активности и МНО у больных с печеночной недостаточностью легкой и средней степени тяжести и здоровых добровольцев были сопоставимы.
У пациентов пожилого возраста (старше 65 лет) отмечались более высокие значения концентрации препарата в плазме крови, чем у более молодых пациентов: среднее значение AUC было приблизительно на 32% выше.
Пол. Экспозиция апиксабана у женщин была на 18% выше, чем у мужчин.
Раса и этническое происхождение. Результаты, полученные в рамках исследований 1 фазы, свидетельствуют об отсутствии значимых различий фармакокинетики апиксабана между представителями европеоидной, монголоидной и негроидной рас. Результаты анализов фармакокинетики в различных популяциях, выполненных в рамках исследований, включавших пациентов, получавших апиксабан после планового эндопротезирования тазобедренного или коленного сустава, соответствуют результатам исследований 1 фазы.
Масса тела. У пациентов с массой тела более 120 кг концентрация апиксабана в плазме крови была приблизительно на 30% ниже, чем у пациентов с массой тела от 65 кг до 85 кг; у пациентов с массой тела менее 50 кг данный показатель был приблизительно на 30% выше.
Зависимость параметров фармакокинетики и фармакодинамики
Зависимость между параметрами фармакокинетики и фармакодинамики (в т.ч. анти-FXa активности, MHO, протромбинового времени, АЧТВ) апиксабана и его концентрацией в плазме крови была изучена для широкого диапазона доз препарата (от 0.5 мг до 50 мг). Было показано, что зависимость между концентрацией апиксабана и активностью FXa наилучшим образом описывается с использованием линейной модели. Зависимость параметров фармакокинетики и фармакодинамики апиксабана, оценивавшаяся у пациентов, получавших апиксабан в клинических исследованиях 2 и 3 фазы, соответствовала таковой у здоровых добровольцев.
Показания препарата
Эликвис®
- профилактика венозной тромбоэмболии у пациентов после планового эндопротезирования тазобедренного или коленного сустава;
- профилактика инсульта и системной тромбоэмболии у взрослых пациентов с неклапанной фибрилляцией предсердий (НКФП), имеющих один или несколько факторов риска (таких как инсульт или транзиторная ишемическая атака в анамнезе, возраст 75 лет и старше, артериальная гипертензия, сахарный диабет, сопровождающаяся симптомами хроническая сердечная недостаточность (ФК II и выше по классификации NYHA)). Исключение составляют пациенты с тяжелым и умеренно выраженным митральным стенозом или с искусственными клапанами сердца;
- лечение тромбоза глубоких вен (ТГВ), тромбоэмболии легочной артерии (ТЭЛА), а также профилактика рецидивов ТГВ и ТЭЛА.
Режим дозирования
Препарат Эликвис® принимают внутрь, независимо от приема пищи.
В случае пропуска приема препарат следует принять как можно скорее, а в дальнейшем продолжить прием 2 раза/сут в соответствии с исходной схемой.
Для пациентов, которые не могут проглотить таблетку целиком, таблетку препарата Эликвис® можно измельчить и развести в воде или 5% водной декстрозе (5ДВ), или яблочном соке, или смешать с яблочным пюре и незамедлительно принять внутрь. В качестве альтернативы таблетку препарата Эликвис® можно измельчить и развести в 60 мл воды или 5ДВ и незамедлительно ввести полученную суспензию через назогастральный зонд.
Лекарственное вещество в измельченных таблетках препарата Эликвис® сохраняет стабильность в воде, 5ДВ, яблочном соке и яблочном пюре до 4 ч.
После планового эндопротезирования тазобедренного или коленного сустава: 2.5 мг 2 раза/сут (первый прием через 12-24 ч после оперативного вмешательства). При принятии решения о времени начала терапии врачам следует принять во внимание потенциальный положительный эффект от ранней антикоагулянтной терапии в профилактике венозной тромбоэмболии наравне с риском развития постоперационного кровотечения. У пациентов, перенесших эндопротезирование тазобедренного сустава, рекомендуемая длительность терапии составляет от 32 до 38 дней, коленного сустава — от 10 до 14 дней.
Пациенты с фибрилляцией предсердий: по 5 мг 2 раза/сут. Дозу препарата снижают до 2.5 мг 2 раза/сут при наличии сочетания двух или более из следующих характеристик – возраст 80 лет и старше, масса тела 60 кг и менее или концентрация креатинина в плазме крови ≥1.5 мг/дл (133 мкмоль/л). Терапию следует продолжать длительное время.
Лечение ТГВ и ТЭЛА: по 10 мг 2 раза/сут в течение 7 дней, затем 5 мг 2 раза/сут. Продолжительность лечения определяется индивидуально с учетом соотношения ожидаемой пользы и риска возникновения клинически значимых кровотечений. Решение о длительности терапии должно основываться на оценке наличия и обратимости факторов, предрасполагающих к рецидивированию (т.е. предшествующее хирургическое вмешательство, травма, период иммобилизации и т.д.), а также проявлений ТГВ и/или ТЭЛА, составляя, как минимум, 3 месяца.
Профилактика рецидивов ТГВ и ТЭЛА: по 2.5 мг 2 раза/сут после, как минимум, 6 месяцев лечения ТГВ или ТЭЛА апиксабаном в дозе 5 мг 2 раза/сут или другим антикоагулянтом, как указано в таблице 2.
Таблица 2
Общую длительность терапии следует подбирать индивидуально после тщательной оценки соотношения пользы от приема препарата и риска развития кровотечения.
Для пациентов с нарушением функции почек легкой или средней степени применимы следующие рекомендации:
- не требуется коррекции дозы при применении апиксабана для профилактики ТГВ у пациентов после планового эндопротезирования тазобедренного или коленного сустава, для лечения ТГВ, для лечения ТЭЛА и профилактики рецидивов ТГВ и ТЭЛА;
- при применении апиксабана у пациентов с фибрилляцией предсердий и концентрацией креатинина ≥1.5 мг/дл (133 мкмоль/л) в плазме крови, в сочетании с возрастом ≥80 лет или массой тела ≤60 кг требуется снижение дозы препарата, как описано выше. При отсутствии соответствия другим критериям для снижения дозы (возраст, масса тела) коррекции терапии не требуется.
У пациентов с нарушением функции почек тяжелой степени (с КК 15-29 мл/мин) применимы следующие рекомендации:
- апиксабан следует применять с осторожностью для профилактики ТГВ у пациентов после планового эндопротезирования тазобедренного или коленного сустава, для лечения ТГВ, для лечения ТЭЛА и профилактика рецидивов ТГВ и ТЭЛА;
- у пациентов с фибрилляцией предсердий следует применять дозу апиксабана 2.5 мг 2 раза/сут.
Нет данных о применении апиксабана у пациентов с КК <15 мл/мин, а также у пациентов, находящихся на диализе. В связи с этим применение препарата Эликвис® у таких пациентов противопоказано.
Препарат Эликвис® противопоказан у пациентов с заболеваниями печени, сопровождающимися нарушениями в системе свертывания крови и клинически значимым риском развития кровотечений. Применение препарата у пациентов с тяжелой печеночной недостаточностью противопоказано.
Следует соблюдать осторожность при приеме препарата Эликвис® пациентами с печеночной недостаточностью легкой и средней степени тяжести (класса A или B по классификации Чайлд-Пью), при этом коррекции дозы не требуется.
Из клинических исследований были исключены пациенты, у которых отмечали повышение активности печеночных ферментов АЛТ/АСТ в 2 раза выше ВГН или общего билирубина в 1.5 и более раз выше ВГН. В связи с этим следует с осторожностью применять апиксабан у пациентов этой группы. Следует оценить функцию печени до начала терапии препаратом Эликвис®.
Коррекции дозы препарата у пациентов пожилого возраста не требуется (исключение составляют пациенты, указанные в пункте «Применение при фибрилляции предсердий»).
Коррекции дозы в зависимости от массы тела пациента не требуется (исключение составляют пациенты, указанные в пункте «Применение при фибрилляции предсердий»).
Коррекции дозы препарата в зависимости от пола пациента не требуется.
Коррекции дозы препарата в зависимости от расы или этнического происхождения пациента не требуется.
Переход с или на терапию парентеральными антикоагулянтами
Перевод с парентеральных антикоагулянтов на препарат Эликвис® и наоборот можно проводить в момент следующего запланированного приема отменяемого препарата (при этом очередная доза отменяемого препарата не принимается).
Переход с или на варфарин или другие антагонисты витамина К
Перевод пациентов с терапии варфарином или другими антагонистами витамина К на терапию препаратом Эликвис® следует проводить при значении МНО у пациента ниже 2.0.
При переводе пациентов с терапии препаратом Эликвис® на варфарин или другие антагонисты витамина К следует продолжать терапию препаратом Эликвис® в течение 48 ч после приема первой дозы варфарина или других антагонистов витамина К. Через 48 ч следует проконтролировать МНО перед приемом следующей дозы препарата Эликвис®. Совместный прием варфарина (или другого антагониста витамина К) и препарата Эликвис® следует продолжать до достижения МНО ≥2.0. При достижении МНО ≥2.0 прием препарата Эликвис® следует прекратить.
Кардиоверсия
Пациенты с фибрилляцией предсердий, которым требуется проведение кардиоверсии, могут начать или продолжить применение препарата Эликвис®.
Пациентам, не проходившим лечение антикоагулянтами, перед проведением кардиоверсии необходимо назначить, по крайней мере, 5 доз препарата Эликвис® по 5 мг 2 раза/сут (по 2.5 мг 2 раза/сут для пациентов, которым требуется уменьшение дозы) для достижения адекватной антикоагуляции.
В случае если проведение кардиоверсии требуется до назначения 5 доз препарата Эликвис®, необходимо принять нагрузочную дозу в 10 мг c последующим приемом 5 мг 2 раза/сут. Следует уменьшить нагрузочную дозу до 5 мг с последующим приемом 2.5 мг 2 раза/сут, если пациент подходит под категорию для снижения дозы. Необходимо принять нагрузочную дозу, по крайней мере, за 2 ч до проведения кардиоверсии.
Перед проведением кардиоверсии необходимо получить подтверждение о надлежащем приеме препарата Эликвис®. При принятии решения о назначении и продолжительности лечения необходимо опираться на установленные рекомендации по применению антикоагулянтов у пациентов, которым требуется проведение кардиоверсии.
При временном перерыве в лечении препаратом (случайном или преднамеренном) возрастает риск тромбоза. Пациенты должны быть проинструктированы о необходимости избегать перерывов в лечении препаратом. При временном прекращении антикоагулянтной терапии по любым причинам она должна быть возобновлена как можно скорее.
Побочное действие
Частыми нежелательными реакциями были кровотечение, кровоподтек, носовое кровотечение и гематома (см. профиль побочных реакций и их частоту по показаниям ниже). Под частотой побочных реакций понимается: часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000).
Применение препарата Эликвис® может быть связано с повышенным риском развития кровотечений (в т.ч. скрытых) из любого органа или ткани, что в свою очередь может приводить к развитию постгеморрагической анемии. Симптомы, признаки и тяжесть будут варьироваться в зависимости от источника кровотечения и степени или распространенности кровотечения.
* Не отмечали случаев генерализованного кожного зуда в исследовании CV185057 (длительная профилактика ВТЭ).
Противопоказания к применению
- повышенная чувствительность к апиксабану или любому компоненту препарата;
- активное клинически значимое кровотечение;
- заболевания печени, сопровождающиеся нарушениями в системе свертывания крови и клинически значимым риском развития кровотечений;
- заболевания или состояния, характеризующиеся значимым риском большого кровотечения:
- существующее в настоящее время или недавнее обострение язвенной болезни ЖКТ;
- наличие злокачественного новообразования с высоким риском кровотечения;
- недавнее повреждение головного или спинного мозга;
- недавно перенесенное оперативное вмешательство на головном или спинном мозге, а также на органе зрения;
- недавно перенесенный геморрагический инсульт;
- установленное или подозреваемое варикозное расширение вен пищевода;
- артериовенозная мальформация;
- аневризма сосудов или выраженные внутриспинальные или внутримозговые изменения сосудов;
- нарушение функции почек с КК менее 15 мл/мин, а также применение у пациентов, находящихся на диализе;
- возраст до 18 лет (данные о применении препарата отсутствуют);
- беременность (данные о применении препарата отсутствуют);
- период грудного вскармливания (данные о применении препарата отсутствуют);
- одновременное применение с любыми другими антикоагулянтными препаратами, включая нефракционированный гепарин (НФГ), низкомолекулярные гепарины (НМГ) (в т.ч. эноксапарин, далтепарин), производные гепарина (в т.ч. фондапаринукс), пероральные антикоагулянты (в т.ч. варфарин, ривароксабан, дабигатран), за исключением тех ситуаций, когда пациент переводится на терапию или с терапии апиксабаном или если нефракционированный гепарин назначается в дозах, необходимых для поддержания проходимости центрального венозного или артериального катетера, или когда нефракционированный гепарин применяется при катетерной аблации фибрилляции предсердий;
- врожденный дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
Применение при беременности и кормлении грудью
Беременность
Данных о применении апиксабана у беременных женщин нет. Во время доклинических исследований не обнаружено прямых или косвенных отрицательных эффектов в отношении репродуктивной функции. Применение апиксабана при беременности противопоказано.
Период грудного вскармливания
Нет сведений о выведении апиксабана или его метаболитов с грудным молоком у человека. Согласно имеющимся данным исследований на животных апиксабан выделяется с грудным молоком. В исследованиях на крысах концентрация препарата в грудном молоке была во много раз выше таковой в плазме крови (Cmax примерно в 8 раз выше, AUC примерно в 30 раз выше), что может свидетельствовать об активном транспорте препарата в грудное молоко. Риск для младенцев, находящихся на грудном вскармливании, не может быть исключен. При необходимости применения препарата Эликвис® следует принять решение об отмене приема препарата или прекращении грудного вскармливания.
Фертильность
Апиксабан не влиял на фертильность в исследованиях на животных.
Применение при нарушениях функции печени
Противопоказано применение препарата при заболеваниях печени, сопровождающихся нарушениями в системе свертывания крови и клинически значимым риском развития кровотечений; у пациентов с тяжелой печеночной недостаточностью.
Следует соблюдать осторожность при приеме препарата Эликвис® пациентами с печеночной недостаточностью легкой и средней степени тяжести (класса A или B по классификации Чайлд-Пью), при этом коррекции дозы не требуется.
Применение при нарушениях функции почек
Противопоказано применение препарата при нарушении функции почек с КК менее 15 мл/мин, а также применение у пациентов, находящихся на диализе.
Для лечения ТГВ, лечения ТЭЛА и профилактики рецидивирующих ТГВ и ТЭЛА (лВТЭ) апиксабан у пациентов с тяжелым нарушением функции почек (КК 15–29 мл/мин) следует применять с осторожностью.
Применение у детей
Противопоказано применение препарата в возрасте до 18 лет.
Применение у пожилых пациентов
Коррекции дозы препарата у пациентов пожилого возраста не требуется (исключение составляют пациенты, указанные в пункте «Применение при фибрилляции предсердий»).
Особые указания
Риск развития кровотечений
Не рекомендуется применение препарата при заболеваниях печени, сопровождающихся нарушениями в системе свертывания крови и клинически значимым риском развития кровотечений. Необходимо прекратить применение препарата при появлении тяжелого кровотечения.
При возникновении осложнения в виде кровотечения, терапия препаратом должна быть остановлена; также необходимо установить источник кровотечения. Среди возможных вариантов остановки кровотечения могут быть рассмотрены хирургический гемостаз или трансфузия свежезамороженной плазмы, при жизнеугрожающих состояниях, которые невозможно контролировать с помощью вышеперечисленных методов, можно рассмотреть возможность введения концентрата протромбинового комплекса (КПК) или рекомбинантного фактора свертывания крови VIIа. У здоровых добровольцев обратимость фармакодинамических эффектов препарата Эликвис® по результатам теста генерации тромбина наблюдалась после инфузии КПК, содержащего 4 фактора свертывания крови. Однако опыт клинического применения КПК, содержащего 4 фактора свертывания крови, с целью остановки кровотечения у пациентов, получающих препарат Эликвис®, отсутствует. Опыт применения рекомбинантного фактора VIIa у пациентов, получающих терапию апиксабаном, на данный момент нет.
Следует соблюдать осторожность при одновременном применении апиксабана с НПВП (в т.ч. с ацетилсалициловой кислотой) в связи с тем, что данные препараты увеличивают риск развития кровотечений.
Одновременное применение препарата Эликвис® и ацетилсалициловой кислоты (АСК) у пожилых пациентов требует осторожности ввиду потенциально более высокого риска кровотечения.
Как и в случае других антикоагулянтов, пациентов, получающих препарат Эликвис®, необходимо тщательно наблюдать на предмет признаков кровотечения. При состояниях с высоким риском развития кровотечений препарат рекомендуется применять с осторожностью. Применение препарата Эликвис® следует прекратить при развитии тяжелого кровотечения.
Хотя терапия апиксабаном не требует постоянного мониторинга его концентрации в крови, иногда может быть целесообразным проведение калиброванного количественного анализа анти-Xa-факторной активности в тех исключительных случаях, когда данные о воздействии апиксабана могут способствовать принятию клинических решений, например, при передозировке и экстренном оперативном вмешательстве.
Взаимодействие с другими лекарственными препаратами, влияющими на гемостаз
В связи с высоким риском возникновения кровотечения одновременное применение с любыми другими антикоагулянтами противопоказано.
Одновременное применение препарата Эликвис® с антиагрегантами повышает риск кровотечения.
Необходимо соблюдать осторожность при одновременном применении препарата Эликвис® с селективными ингибиторами обратного захвата серотонина и ингибиторами обратного захвата серотонина и норэпинефрина (норадреналина) или НПВП, включая АСК.
После хирургического вмешательства не рекомендуется применять одновременно с препаратом Эликвис® другие ингибиторы агрегации тромбоцитов.
В клиническом исследовании у пациентов с фибрилляцией предсердий с ОКС и/или перенесших ЧКВ с запланированным периодом лечения ингибитором P2Y12 с АСК или без нее, было изучено применение пероральных антикоагулянтов (апиксабана или антагониста витамина К — АВК) в течение 6 месяцев. Риск больших кровотечений по критериям Международного общества по тромбозу и гемостазу (International Society on Thrombosis and Haemostasis — ISTH) или клинически значимых небольших кровотечений (КЗНБ) был статистически значимо ниже при применении препарата Эликвис® (24.7% в год) по сравнению с применением АВК (35.8% в год). Сопутствующее применение АСК повышало риск развития больших кровотечений по критериям ISTH или КЗНБ кровотечений с 21.0% в год до 40.5% в год при добавлении антикоагулянта (апиксабана или АВК) к терапии ингибитором P2Y12. В частности, добавление АСК повышало риск развития больших или КЗНБ кровотечений у пациентов, получавших апиксабан и АВК, соответственно с 16.4% до 33.1 % в год и с 26.1% в год до 48.4% в год.
Отмечалось статистически значимое повышение риска кровотечений при применении тройной терапии апиксабаном, АСК и клопидогрелом в клиническом исследовании у пациентов с острым коронарным синдромом без фибрилляции предсердий с высоким риском тромбоза и несколькими сопутствующими сердечными и несердечными заболеваниями.
В другом клиническом исследовании с участием пациентов с фибрилляцией предсердий одновременное применение АСК приводило к повышению риска развития больших кровотечений и на фоне приема апиксабана и на фоне приема варфарина. В этом клиническом исследовании сочетанная терапия двумя антиагрегантами применялась редко.
Применение тромболитических средств для лечения острого ишемического инсульта
Опыт применения тромболитических средств для лечения острого ишемического инсульта у пациентов, получающих апиксабан, весьма ограничен.
Пациенты с искусственными клапанами сердца
Безопасность и эффективность препарата у пациентов с искусственными клапанами сердца с фибрилляцией предсердий и без нее не изучалась. Применение препарата Эликвис® для этой группы пациентов не рекомендуется.
Хирургические и инвазивные процедуры
Применение препарата Эликвис® следует прекратить не менее чем за 48 ч до плановой операции или инвазивной процедуры со средним или высоким риском кровотечения. Сюда относятся вмешательства, при которых вероятность клинически значимого кровотечения не исключена или для которых риск кровотечения неприемлем.
Применение препарата Эликвис® следует прекратить не менее чем за 24 ч до плановой операции или инвазивной процедуры с низким риском кровотечения. Сюда относятся вмешательства, при которых ожидается минимальное, некритическое по локализации или легко контролируемое кровотечение.
Если операцию или инвазивную процедуру нельзя откладывать, их нужно проводить с надлежащей осторожностью, учитывая повышенный риск кровотечения. Следует соотнести риск кровотечения и необходимость экстренного вмешательства. При неклапанной фибрилляции предсердий обычно не требуется применение «терапии моста» в течение 24-48 ч после отмены апиксабана перед хирургическими вмешательствами.
После инвазивной процедуры или хирургического вмешательства применение препарата Эликвис® следует возобновить как можно скорее при условии, что это допускает клиническая ситуация и установился достаточный гемостаз (информация о кардиоверсии приведена в разделе «Режим дозирования»).
У пациентов с фибрилляцией предсердий нет необходимости прекращать терапию препаратом Эликвис® перед катетерной аблацией.
Временное прекращение терапии
Прекращение применения антикоагулянтов, включая препарат Эликвис®, по причине активного кровотечения, плановой операции или инвазивной процедуры увеличивает для пациента риск тромбоза. Перерывов в лечении следует избегать, и если по какой-либо причине требуется временное прекращение антикоагулянтной терапии препаратом Эликвис®, ее следует возобновить как можно скорее.
Лечение ТГВ и ТЭЛА
Не рекомендуется заменять терапию нефракционированным гепарином на препарат Эликвис® в период инициации терапии пациентов с ТЭЛА с нестабильной гемодинамикой, возможным проведением тромболизиса или тромбэктомии легочной артерии, т.к. безопасность и эффективность апиксабана в данных клинических ситуациях не установлены.
Пациенты с онкологическими заболеваниями
Эффективность и безопасность апиксабана при лечении ТГВ, лечении ТЭЛА и профилактике рецидивирующих ТГВ и ТЭЛА (лВТЭ) у пациентов с активно прогрессирующим злокачественным новообразованием не установлены.
Пациенты с почечной недостаточностью
Ограниченные клинические данные показывают, что у пациентов с тяжелым нарушением функции почек (КК 15–29 мл/мин) увеличиваются концентрации апиксабана в плазме, что может повышать риск кровотечения. Для лечения ТГВ, лечения ТЭЛА и профилактики рецидивирующих ТГВ и ТЭЛА (лВТЭ) апиксабан у пациентов с тяжелым нарушением функции почек (КК 15–29 мл/мин) следует применять с осторожностью.
Для профилактики инсульта и системной эмболии у пациентов с НФП, пациентов с тяжелым нарушением функции почек (КК 15–29 мл/мин) и пациентов с уровнем сывороточного креатинина ≥1.5 мг/дл (133 мкмоль/л) в сочетании с возрастом ≥80 лет или массой тела ≤60 кг доза апиксабана должна быть снижена до 2.5 мг 2 раза/сут.
В связи с отсутствием опыта клинического применения апиксабана у пациентов с КК <15 мл/мин или находящихся на диализе прием апиксабана в этой группе пациентов не рекомендуется.
Пожилые пациенты
С возрастом риск кровотечения может повышаться.
Также одновременное применение препарата Эликвис® и АСК у пожилых пациентов требует осторожности ввиду потенциально более высокого риска кровотечения.
Масса тела
При малой массе тела (<60 кг) риск кровотечения может повышаться.
Пациенты с печеночной недостаточностью
Препарат Эликвис® противопоказан пациентам с заболеванием печени, связанным с коагулопатией и клинически значимым риском развития кровотечения.
Препарат не рекомендуется принимать пациентам с тяжелым нарушением функции печени.
Препарат следует применять с осторожностью у пациентов с нарушением функции печени легкой и средней степени тяжести (стадия А или В по классификации Чайлд-Пью).
Пациенты с повышенными уровнями печеночных ферментов АЛТ/АСТ >2×ВГН или общего билирубина ≥1.5×ВГН были исключены из клинических исследований. Поэтому в данной популяции препарат Эликвис® следует применять с осторожностью. Перед началом применения препарата Эликвис® необходимо проверить биохимические показатели функции печени.
Взаимодействие с ингибиторами цитохрома P450 и ингибиторами P-гликопротеина
Не рекомендуется применение препарата Эликвис® у пациентов, получающих одновременно системное лечение мощными ингибиторами изофермента CYP3A4 и P-гликопротеина, такими как антимикотики группы азолов (например, кетоконазол, итраконазол, вориконазол и позаконазол) и ингибиторы протеазы ВИЧ (например, ритонавир). Эти препараты могут повысить экспозицию апиксабана в 2 раза или выше в присутствии дополнительных факторов, которые также увеличивают экспозицию апиксабана (например, тяжелое нарушение функции почек).
Взаимодействие с индукторами изофермента CYP3A4 и P-гликопротеина
Одновременное применение препарата Эликвис® с мощными индукторами изофермента CYP3A4 и индукторами P-гликопротеина (например, рифампицин, фенитоин, карбамазепин, фенобарбитал и препаратами зверобоя продырявленного) может также приводить к снижению концентрации апиксабана в плазме крови (примерно на 50%). В клиническом исследовании с участием пациентов с фибрилляцией предсердий отмечали снижение эффективности и повышенный риск кровотечений при одновременном применении апиксабана и мощных индукторов изофермента CYP3A4 и P-гликопротеина по сравнению с применением апиксабана в качестве монотерапии.
Следующие рекомендации применимы к пациентам, получающим системную терапию мощными ингибиторами изофермента CYP3A4 и P-гликопротеина:
- с целью профилактики венозной тромбоэмболии у пациентов после планового эндопротезирования тазобедренного или коленного сустава, профилактики инсульта и системной тромбоэмболии при неклапанной фибрилляции предсердий, а также для профилактики рецидивов ТГВ и ТЭЛА, апиксабан следует применять с осторожностью;
- для лечения ТГВ и ТЭЛА, апиксабан не следует применять, т.к. эффективность может быть снижена.
Оперативные вмешательства, связанные с переломом шейки бедра
Эффективность и безопасность апиксабана в клинических исследованиях у пациентов после оперативного вмешательства по поводу перелома шейки бедра не оценивались. Поэтому он не рекомендуется для данных пациентов.
Лабораторные параметры
Влияние механизма действия апиксабана на показатели свертываемости крови (например, протромбиновое время (ПВ), МНО и АЧТВ) соответствовало ожидаемому. Наблюдавшиеся изменения этих показателей свертываемости крови при предполагаемой терапевтической дозе были невелики и имели существенную вариабельность.
Информация о вспомогательных веществах
Препарат Эликвис® содержит лактозу. Пациенты с редкими наследственными нарушениями, такими как непереносимость галактозы, лактазная недостаточность lapp или глюкозо-галактозная мальабсорбция, не должны принимать препарат Эликвис®.
Выполнение спинальной, эпидуральной анестезии или пункций у пациентов, получающих препарат Эликвис®
При выполнении спинальной или эпидуральной анестезии либо диагностической пункции данных областей у пациентов, получающих антитромботические средства с целью профилактики тромбоэмболий, имеется риск развития эпидуральных или спинальных гематом, которые, в свою очередь могут являться причиной стойких или необратимых параличей. Данный риск может еще более возрастать при использовании установленного эпидурального катетера в послеоперационном периоде или при параллельном применении других лекарственных средств, влияющих на гемостаз. Установленные эпидуральные или субарахноидальные катетеры должны быть удалены как минимум за 5 ч до введения первой дозы препарата Эликвис®. Риск также может возрастать при травматичных или повторных эпидуральных или спинальных пункциях. Пациентов необходимо часто проверять на предмет проявлений и симптомов неврологического дефицита (например, онемение или слабость в ногах, дисфункция кишечника или мочевого пузыря). При обнаружении неврологического отклонения от нормы необходимо проведение срочной диагностики и лечения. До нейроаксиального вмешательства врачу следует проанализировать соотношение потенциальной пользы и риска для пациентов, которые получают антикоагулянтную терапию или будут получать ее для профилактики тромбоза.
Клинический опыт применения апиксабана у пациентов с установленным интратекальным или эпидуральным катетером отсутствует. В случае необходимости данной ситуации, основываясь на фармакокинетических особенностях апиксабана, следует соблюдать интервал в 20-30 ч (т.е. 2 периода полувыведения) между последней принятой дозой апиксабана и удалением катетера, таким образом, как минимум одна доза апиксабана должна быть пропущена до удаления катетера. Следующую дозу апиксабана можно применять не ранее чем через 5 ч после извлечения катетера. Как и в случае со всеми новыми антикоагулянтными лекарственными препаратами, опыт применения апиксабана при нейроаксиальной блокаде ограничен, и поэтому в такой ситуации следует соблюдать исключительную осторожность.
Пациенты с антифосфолипидным синдромом
Прямые пероральные антикоагулянты (ППОАК), включая препарат Эликвис®, не рекомендуются для применения у пациентов с диагностированным антифосфолипидным синдромом (АФС) и тромбозами в анамнезе, особенно при наличии всех трех положительных тестов (на выявление волчаночного антикоагулянта, антител против кардиолипина и антител против бета-2-гликопротеина I). У этих пациентов применение ПОАК может приводить к повышению частоты рецидивов тромботических явлений по сравнению с антагонистами витамина К. Эффективность и безопасность препарата у пациентов с АФС не установлены.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Эликвис® не влияет или влияет несущественно на способность к управлению транспортными средствами и работе с механизмами.
Передозировка
Симптомы: при передозировке возрастает риск кровотечений. В рамках контролируемых клинических исследований апиксабан принимался перорально здоровыми добровольцами в дозах до 50 мг/сут в течение от 3 до 7 дней (25 мг 2 раза/сут в течение 7 дней или 50 мг 1 раз/сут в течение 3 дней); клинически значимых нежелательных эффектов при этом не отмечалось.
Лечение: в случае передозировки данного препарата можно рассмотреть вопрос о применении активированного угля. При введении здоровым добровольцам активированного угля через 2 и 6 ч после приема апиксабана в дозе 20 мг, AUC для апиксабана уменьшалась на 50% и 27% соответственно (Cmax не изменялась). T1/2 апиксабана уменьшался с 13.4 до 5.3 и 4.9 ч соответственно. Антидот неизвестен. Не ожидается, что применение гемодиализа при передозировке апиксабана будет эффективной мерой.
Лекарственное взаимодействие
Влияние других препаратов на фармакокинетику апиксабана
Ингибиторы изофермента CYP3A4 и Р-гликопротеина
Комбинация апиксабана с кетоконазолом (в дозе 400 мг 1 раз/сут), являющимся мощным ингибитором как изофермента CYP3A4, так и Р-гликопротеина, приводила к повышению среднего значения AUC апиксабана в 2 раза и среднего значения Cmax — в 1.6 раза.
Не рекомендуется применение препарата Эликвис® у пациентов, получающих одновременно системное лечение мощными ингибиторами изофермента CYP3A4 и P-гликопротеина, такими как антимикотики группы азолов (например, кетоконазол, итраконазол, вориконазол и позаконазол) и ингибиторы протеазы ВИЧ (например, ритонавир).
Препараты, не относящиеся к мощным ингибиторам изофермента CYP3A4 и P-гликопротеина (например, дилтиазем, напроксен, кларитромицин, амиодарон, верапамил, хинидин), по-видимому, приведут к повышению концентрации апиксабана в плазме крови в меньшей степени. Коррекции дозы апиксабана при комбинировании с умеренными ингибиторами изофермента CYP3A4 и/или Р-гликопротеина не требуется. Например, дилтиазем (умеренный ингибитор изофермента CYP3A4 и слабый ингибитор P-гликопротеина) в дозе 360 мг 1 раз/сут, приводил к повышению средних значений AUC апиксабана в 1.4 раза и средних значений Cmax – в 1.3 раза. Напроксен (ингибитор Р-гликопротеина, но не изофермента CYP3A4) при применении в дозе 500 мг у здоровых добровольцев вызывал повышение средних значений AUC и Cmax апиксабана в 1.5 и 1.6 раза соответственно. Кларитромицин (ингибитор P-гликопротеина и мощный ингибитор изофермента CYP3A4) в дозе 500 мг 2 раза/сут приводил к повышению средних значений AUC и Cmax апиксабана в 1.6 и 1.3 раза соответственно.
Индукторы изофермента CYP3A4 и Р-гликопротеина
Сочетание апиксабана с рифампицином (мощным индуктором изофермента CYP3A4 и Р-гликопротеина) приводило к снижению средних значений AUC и Cmax апиксабана приблизительно на 54% и 42% соответственно. По-видимому, сочетание апиксабана с другими мощными индукторами изофермента CYP3A4 и Р-гликопротеина (в частности, фенитоином, карбамазепином, фенобарбиталом или препаратами зверобоя продырявленного) может также приводить к снижению концентрации апиксабана в плазме крови (примерно на 50%). Коррекции дозы апиксабана при его комбинировании со средствами данной группы не требуется при назначении по показаниям: профилактика тромбоэмболии после эндопротезирования суставов, профилактика инсультов и системной тромбоэмболии при неклапанной фибрилляции предсердий и профилактика рецидивов тромбоза глубоких вен, тромбоэмболии легочной артерии, однако комбинировать данные средства следует с осторожностью. Во время применения для лечения ТГВ и ТЭЛА совместное применение апиксабана и мощных индукторов изофермента CYP3A4 и P-гликопротеина не рекомендуется, т.к. при этом эффективность может быть снижена.
Антикоагулянты, ингибиторы агрегации тромбоцитов и НПВП
В связи с высоким риском возникновения кровотечения одновременное применение с любыми другими антикоагулянтами противопоказано.
После совместного введения эноксапарина (однократно в дозе 40 мг) и апиксабана (однократно в дозе 5 мг) отмечался аддитивный эффект данных средств на активность FXa.
Признаков фармакокинетического или фармакодинамического взаимодействия апиксабана с АСК (в дозе 325 мг 1 раз/сут) у здоровых людей отмечено не было.
Комбинирование апиксабана с клопидогрелом (в дозе 75 мг 1 раз/сут) или сочетанием клопидогрела (75 мг) и АСК (162 мг 1 раз/сут) или прасугрела (60 мг с последующей дозой 10 мг 1 раз/сут) в 1 фазе клинического исследования не приводило к увеличению времени кровотечения или более выраженному угнетению агрегации тромбоцитов по сравнению с применением этих антиагрегантов в качестве монотерапии. Повышение показателей системы свертывания крови (протромбинового времени, MHO и АЧТВ) соответствовало эффектам апиксабана при применении в монотерапии.
У пациентов с НФП с острым коронарным синдромом (ОКС) и/или перенесшим чрескожное коронарное вмешательство (ЧКВ) терапию препаратом Эликвис® можно назначать в сочетании с антиагрегантами (см. раздел «Особые указания»).
Напроксен (500 мг), который является ингибитором P-гликопротеина, увеличивает средние значения AUC и Cmax апиксабана в 1.5 и 1.6 раза соответственно. При приеме апиксабана наблюдалось соответствующее повышение показателей свертываемости крови. Не наблюдалось никаких изменений влияния напроксена на агрегацию тромбоцитов, индуцированную арахидоновой кислотой, а также не отмечено клинически значимого увеличения длительности кровотечения после совместного применения апиксабана и напроксена. Несмотря на эти данные, у отдельных пациентов может наблюдаться более выраженный фармакодинамический ответ после совместного применения апиксабана с другими антиагрегантами.
Препарат Эликвис® следует с осторожностью применять одновременно с НПВП (включая АСК) или ингибиторами P2Y12, т.к. эти лекарственные препараты обычно повышают риск кровотечения.
Не рекомендуется одновременно применять препараты, действие которых может быть связано с развитием серьезных кровотечений, таких как: тромболитические лекарственные средства, антагонисты рецепторов гликопротеинов IIb/IIIa, дипиридамол, декстран и сульфинпиразон.
Комбинирование с другими лекарственными средствами
Не было выявлено клинически значимого фармакокинетического или фармакодинамического взаимодействия апиксабана с атенололом или фамотидином. Комбинирование апиксабана (в дозе 10 мг) с атенололом (в дозе 100 мг) не приводило к развитию клинически значимых изменений параметров фармакокинетики апиксабана, однако оно сопровождалось снижением средних значений AUC и Cmax апиксабана на 15% и 18% соответственно по сравнению с режимом монотерапии. Назначение апиксабана (в дозе 10 мг) с фамотидином (в дозе 40 мг) не оказывало влияния на значения AUC или Cmax апиксабана.
Влияние апиксабана на фармакокинетику других лекарственных средств
В исследованиях in vitro апиксабан не ингибировал активность изоферментов CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6 или CYP3A4 (ингибирующая концентрация (IC50) >45 мкмоль/л) и в то же время слабо подавлял активность изофермента CYP2C19 (IC50 >20 мкмоль/л) в концентрации, значительно превышающей Cmax препарата в плазме крови при его клиническом применении. Апиксабан не является индуктором изоферментов CYP1A2, CYP2B6, CYP3A4/5 в концентрациях до 20 мкмоль/л. В связи с этим ожидается, что при совместном применении он не будет оказывать влияния на клиренс препаратов, метаболизирующихся этими изоферментами. Кроме того, апиксабан не ингибирует в значимой степени активность P-гликопротеина.
В исследованиях у здоровых добровольцев апиксабан не изменял в значимой степени фармакокинетику дигоксина, напроксена или атенолола.
Дигоксин
При одновременном приеме апиксабана (в дозе 20 мг 1 раз/сут) и дигоксина (в дозе 0.25 мг 1 раз/сут), являющегося субстратом P-gp, показатели AUC или Cmax дигоксина не изменялись. Таким образом, апиксабан не ингибирует транспорт субстратов P-гликопротеина.
Напроксен
Одновременное применение однократных доз апиксабана (10 мг) и напроксена (500 мг), широко применяемого НПВП, не влияло на показатели AUC и Cmax напроксена.
Атенолол
Одновременное применение однократной дозы апиксабана (10 мг) и атенолола (100 мг), широко применяемого бета-адреноблокатора, не изменяло фармакокинетику атенолола.
Активированный уголь
Прием активированного угля уменьшает действие апиксабана.
Условия хранения препарата Эликвис®
Препарат следует хранить в недоступном для детей месте при температуре не выше 30°С.
Срок годности препарата Эликвис®
Срок годности — 3 года. Не применять по окончании срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ПФАЙЗЕР ИННОВАЦИИ ООО
(Россия)
|
123112 Москва, Пресненская наб. 10 |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
