Rec.INN
зарегистрированное ВОЗ
Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Ингибитор фосфодиэстеразы 4 (ФДЭ4), действует внутри клетки, модулируя провоспалительные и противовоспалительные медиаторы. ФДЭ4 — специфическая фосфодиэстераза (ФДЭ) циклического аденозинмонофосфата (цАМФ) и доминирующая ФДЭ в клетках воспаления. При угнетении ФДЭ4 возрастает количество цАМФ, что, в свою очередь, ведет к подавлению воспалительной реакции за счет модуляции экспрессии ФНОα, интерлейкина (ИЛ)-23, ИЛ-17 и других воспалительных цитокинов. цАМФ модулирует также уровни некоторых противовоспалительных цитокинов, например, ИЛ-10. Эти про- и противовоспалительные медиаторы участвуют в патогенезе псориаза и псориатического артрита.
У больных псориатическим артритом апремиласт значительно модулировал, но полностью не ингибировал белки плазмы крови: ИЛ-1 а, ИЛ- 6, ИЛ-8, моноцитарный хемоаттрактный белок-1 (МХБ-1), макрофагальный белок воспаления-1 (3 (МБВ-lp), матриксную металлопротеиназу-3 (ММП-3) и ФНОα. Через 40 недель лечения апремиластом отмечено снижение концентрации ИЛ-17 и ИЛ-23 и повышение концентрации ИЛ-10 в плазме крови.
У больных псориазом апремиласт уменьшал очаговые эпидермальные утолщения пораженных участков кожи, инфильтрацию клетками воспаления и экспрессию провоспалительных генов, включая гены индуцируемой синтазы оксида азота (iNOS), ИЛ-12/ИЛ-23р40, ИЛ-17А, ИЛ-22 и ИЛ-8.
Эффективность лечения апремиластом не различалась у пациентов с псориатичеким артритом, одновременно получавших или не получавших БМЛС, включая метотрексат. У пациентов, принимавших БМЛС или биологические БМЛС до терапии апремиластом, терапевтические эффекты апремиласта были более выражены, чем у тех, кто принимал плацебо. На фоне терапии апремиластом отмечалось существенное, статистически достоверное улучшение функциональной активности.
На фоне терапии апремиластом у пациентов с псориазом средней и тяжелой степени тяжести было отмечено значительное улучшение по сравнению с плацебо. Эффективность апремиласта проявлялась в отношении комплекса клинических проявлений псориаза, включая зуд, поражение ногтей и волосистой части головы, а также качества жизни. Положительный клинический эффект апремиласта не зависел от предшествующей лекарственной терапии псориаза и ее результатов. Ответ на лечение апремиластом был быстрым и выражался в существенном уменьшении симптомов псориаза уже ко второй неделе лечения, по сравнению с плацебо.
Фармакокинетика
После приема внутрь апремиласт хорошо всасывается из ЖКТ, его абсолютная биодоступность составляет примерно 73%. Медиана Tmax составляет приблизительно 2.5 ч. Фармакокинетика апремиласта линейная, с увеличением степени воздействия, пропорциональным дозе (в пределах 10-100 мг/сут). После приема апремиласта 1 раз/сут кумуляция минимальна, а после применения 2 раза/сут составляет примерно 53% у здоровых людей и 68% — у больных псориазом. Биодоступность апремиласта не нарушается при его применении с едой, поэтому его можно принимать вне зависимости от времени приема пищи.
Связывание апремиласта с белками плазмы человека составляет примерно 68%. Средний кажущийся Vd составляет 87 л, что свидетельствует о внесосудистом распределении.
Апремиласт экстенсивно метаболизируется, как с участием изоферментов CYP450, так и путей, не связанных с CYP, включая окисление, гидролиз и конъюгацию. Поэтому ингибирование какого-либо одного из этих путей практически не должно вызвать значимого лекарственного взаимодействия. В окислительном метаболизме апремиласта участвует, главным образом, изофермент CYP3A4 и, в меньшей степени, изоферменты CYP1A2 и CYP2A6. После приема внутрь основной компонент в крови представляет апремиласт. Соединение в значительной степени метаболизируется, и только 3% и 7% от принятого количества препарата выводится в неизмененном виде почками и кишечником соответственно. В крови основной неактивный метаболит — глюкуронидный конъюгат O-деметилированного апремиласта (M12). Т.к. апремиласт является субстратом для изофермента CYP3A4, его воздействие снижается при одновременном применении с рифампицином, сильным индуктором изофермента CYP3A4.
In vitro апремиласт не является ингибитором или индуктором изоферментов CYP450, поэтому при комбинированном применении с субстратами изоферментов CYP450, апремиласт не будет нарушать клиренс или воздействие активных веществ, которые метаболизируются изоферментами CYP450.
In vitro апремиласт является субстратом и слабым ингибитором Р-гликопротеина (IC50>50 мкМ).
In vitro апремиласт незначительно угнетает или не влияет (IC50>10мкМ) на переносчики органических анионов OATIи ОАТЗ, переносчик органических катионов ОСТ2, транспортный полипептид органических анионов (ОАТР)1В1 и ОАТР1ВЗ или на белок устойчивости рака молочной железы (BCRP) и не является субстратом для этих соединений.
У здоровых людей клиренс апремиласта составляет в среднем около 10 л/час и конечный T1/2 — примерно 9 ч. После приема внутрь меченого соединения почками и кишечником выводится соответственно около 58% и 39% радиоактивности, причем приблизительно 3% и 7% дозы — в виде радиоактивного апремиласта.
Экспозиция апремиласта у пожилых (65-85 лет) примерно на 13% выше по показателю площадь под кривой концентрация/время (AUC) и на 6 % выше по Cmax в сравнении с добровольцами в возрасте 18-55 лет.
При тяжелой почечной недостаточности при однократном приеме апремиласта в дозе 30 мг значения AUC и Cmax увеличились приблизительно на 89% и 42% соответственно.
Показания активного вещества
АПРЕМИЛАСТ
Лечение активного псориатического артрита (ПсА) у взрослых в качестве монотерапии или в комбинации с противоревматическими болезнь-модифицирующими средствами (БМЛС) при недостаточном ответе или при непереносимости предшествующей терапии БМЛС.
Лечение бляшечного псориаза средней и тяжелой степени тяжести у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости другой базисной противовоспалительной терапии, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ПУВА-терапией.
Режим дозирования
Лечение может назначать только специалист, имеющий достаточный опыт в диагностике и лечении псориаза и псориатического артрита.
Рекомендуемая доза — по 30 мг внутрь 2 раза/сут. Требуется начальное титрование дозы по специальной схеме.
Побочное действие
Со стороны иммунной системы: нечасто — реакции гиперчувствительности.
Со стороны обмена веществ: часто — снижение аппетита; нечасто — снижение массы тела.
Со стороны нервной системы: часто — мигрень, головная боль напряжения, головная боль, бессонница.
Со стороны дыхательной системы: часто — кашель, бронхит, инфекции верхних дыхательных путей, назофарингит.
Со стороны пищеварительной системы: очень часто — диарея, тошнота; часто — рвота, диспепсия, частый стул, боль в верхних отделах живота, гастроэзофагеальная рефлюксная болезнь.
Со стороны кожи и подкожных тканей: нечасто — сыпь.
Со стороны костно-мышечной системы: часто — боль в спине.
Общие реакции: часто — утомляемость.
Противопоказания к применению
Повышенная чувствительность к апремиласту, беременность; детский возраст до 18 лет.
С осторожностью: у пациентов с почечной недостаточностью тяжелой степени тяжести, у пациентов с недостаточной массой тела.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности.
Апремиласт обнаруживался в молоке мышей. Неизвестно, выделяются ли апремиласт или его метаболиты с грудным молоком у человека. Т.к. нельзя исключить риск нежелательного воздействия на ребенка при грудном вскармливании , то апремиласт не следует применять в период грудного вскармливания.
Применение при нарушениях функции печени
Препарат разрешен для применения при нарушении функции печени
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Применение у пожилых пациентов
Препарат разрешен для применения у пожилых пациентов
Особые указания
У пациентов с почечной недостаточностью тяжелой степени тяжести дозу апремиласта следует уменьшить до 30 мг 1 раз/сут.
У пациентов с недостаточной массой тела в начале курса терапии необходимо регулярно контролировать массу тела в процессе лечения. В случае необъяснимого или клинически значимого снижения массы тела необходимо провести тщательное медицинское обследование пациента и рассмотреть вопрос о прекращении лечения.
Лекарственное взаимодействие
Совместное применение с мощным индуктором изофермента CYP3A4 рифампицином, приводит к ослаблению системного воздействия апремиласта и уменьшению его эффективности. Поэтому не рекомендуется комбинированное применение мощных индукторов изофермента CYP3A4 (например, рифампицин, фенобарбитал, карбамазепин, фенитоин и препараты зверобоя продырявленного) с апремиластом. При одновременном повторном применении апремиласта и рифампицина AUCи Cmax апремиласта уменьшаются, соответственно, на 72 % и 43 %. В условиях комбинированного использования апремиласта с мощными индукторами изофермента CYP3A4 (например, рифампицин) клинический ответ может снижаться.
Регистрационный номер: ЛП-003829-060917
Торговое наименование: ОТЕСЛА
Международное непатентованное наименование: апремиласт
Лекарственная форма
Таблетки, покрытые пленочной оболочкой
СОСТАВ
1 таблетка 10 мг содержит:
действующее вещество: апремиласт 10 мг; вспомогательные вещества: целлюлоза микрокристаллическая 26,25 мг, лактозы моногидрат 60,0 мг, натрия кроскармеллоза 3,0 мг, магния стеарат 0,75 мг. пленочная оболочка (Опадрай II розовый) 4,0 мг .
1 таблетка 20 мг содержит:
действующее вещество: апремиласт 20 мг; вспомогательные вещества: целлюлоза микрокристаллическая 52.5 мг, лактозы моногидрат 120,0 мг. натрия кроскармеллоза 6,0 мг, магния стеарат 1,5 мг, пленочная оболочка (Опадрай II коричневый) 8,0 мг*.
1 таблетка 30 мг содержит:
действующее вещество: апремиласт 30 мг; вспомогательные вещества: целлюлоза микрокристаллическая 78,75 мг, лактозы моногидрат 180,0 мг, натрия кроскармеллоза 9,0 мг, магния стеарат 2,25 мг, пленочная оболочка (Опадрай II бежевый) 12,0 мг*.
Состав пленочной оболочки в % (м/м):
Опадрай II розовый: поливиниловый спирт 40, титана диоксид 24,60, макрогол 20,20, тальк 14.80, краситель железа оксид красный (Е 172) 0.40;
Опадрай II коричневый: поливиниловый спирт 40, титана диоксид 12,13, макрогол 20,20, тальк 14,80, краситель железа оксид красный (Е 172) 1,22, краситель железа оксид желтый (Е 172) 11,65;
Опадрай II бежевый: поливиниловый спирт 40, титана диоксид 22,99, макрогол 20,20, тальк 14,80, краситель железа оксид красный (Е 172) 1,18. краситель железа оксид желтый (Е 172) 0,43, краситель железа оксид черный (Е 172) 0,40.
ОПИСАНИЕ
Таблетки 10 мг: розовые, ромбовидной формы таблетки, покрытые пленочной оболочкой, с гравировками «10» на одной стороне и «APR» на другой стороне;
Таблетки 20 мг: коричневые, ромбовидной формы таблетки, покрытые пленочной оболочкой, с гравировками «20» на одной стороне и «APR» на другой стороне;
Таблетки 30 мг: бежевые, ромбовидной формы таблетки, покрытые пленочной оболочкой, с гравировками «30» на одной стороне и «APR» на другой стороне.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА
Иммунодепрессанты, селективные иммунодепрессанты
Код ATX: L04AA32
ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
Фармакодинамика
Механизм действия
Апремиласт, препарат для приема внутрь, представляет собой малую молекулу — ингибитор фосфодиэстеразы 4 (ФДЭ4), который действует внутри клетки, модулируя провоспалительные и противовоспалительные медиаторы. ФДЭ4 — специфическая фосфодиэстераза (ФДЭ) циклического аденозинмонофосфата (цАМФ) и доминирующая ФДЭ в клетках воспаления. При угнетении ФДЭ4 возрастает количество цАМФ. что, в свою очередь, ведет к подавлению воспалительной реакции за счет модуляции экспрессии фактора некроза опухоли альфа (ФНОа), интерлейкина (ИЛ)-23, ИЛ-17 и других воспалительных цитокинов. цАМФ модулирует также уровни некоторых противовоспалительных цитокинов, например, ИЛ-10. Эти про- и противовоспалительные медиаторы участвуют в патогенезе псориаза и псориатического артрита (ПсА).
Фармакодинамические эффекты
В клинических исследованиях у пациентов с псориатическим артритом (ПсА) апремиласт значительно модулировал, но полностью не ингибировал белки плазмы крови: ИЛ-1α, ИЛ-6, ИЛ-8, моноцитарный хемоаттрактный белок-1 (МХБ-1), макрофагальный белок воспаления-1β (МБВ-1β), матриксную металлопротеиназу-3 (ММП-3) и ФНО-α. Через 40 недель лечения апремиластом отмечено снижение концентрации ИЛ-17 и ИЛ-23 и повышение концентрации ИЛ-10 в плазме крови. У пациентов с псориазом апремиласт уменьшал очаговые эпидермальные утолщения пораженных участков кожи, инфильтрацию клетками воспаления и экспрессию провоспалительных генов, включая гены индуцируемой синтазы оксида азота (iNOS), ИЛ-12/ИЛ-23р40, ИЛ-17А, ИЛ-22 и ИЛ-8.
Апремиласт при назначении в дозах до 50 мг 2 раза в день не удлиняет интервал QT у здоровых субъектов.
В общей сложности, 1493 пациента с активным ПсА (≥ 3 припухших суставов и ≥ 3 болезненных суставов), несмотря на предшествующую терапию базисными противовоспалительными препаратами (БПВП) или биологическими препаратами длительностью не менее 6 месяцев, получали внутрь плацебо, апремиласт 20 мг или апремиласт 30 мг 2 раза в день. Апремиласт применяли в виде монотерапии (34,8 %) или в комбинации со стабильными дозами БПВП (65,2 %). 76,4 % пациентов ранее получали только БПВП, а 22,4 % пациентов лечились ранее биологическими препаратами, среди которых у 7,8 % эта терапия оказалась неэффективной. Средняя длительность ПсА была 5 лет.
Терапия апремиластом привела к существенному улучшению симптомов ПсА по сравнению с плацебо.
Эффективность лечения апремиластом не различалась у пациентов, одновременно получавших или не получавших БПВП, включая метотрексат. У пациентов, принимавших БПВП или биологические препараты до терапии апремиластом, терапевтические эффекты апремиласта были более выражены, чем у тех, кто принимал плацебо. На фоне терапии апремиластом отмечалось существенное, статистически достоверное улучшение функциональной активности.
В общей сложности, 1257 пациентов с бляшечным псориазом средней и тяжелой степени тяжести, которым планировали проведение фототерапии или системной терапии, были рандомизированы в группу плацебо или группу апремиласта (внутрь, 30 мг 2 раза в день). Примерно треть из этих пациентов ранее не получала фототерапии, стандартных системных или биологических препаратов.
На фоне терапии апремиластом у пациентов с псориазом средней и тяжелой степени тяжести было отмечено значительное улучшение по сравнению с плацебо. Эффективность апремиласта проявлялась в отношении комплекса клинических проявлений псориаза, включая зуд, поражение ногтей и волосистой части головы, а также показателей качества жизни.
Клиническая эффективность апремиласта подтверждена в различных подгруппах пациентов, сформированных по исходным демографическим и клиническим характеристикам (включая длительность псориаза и наличие ПсА в анамнезе). Положительный клинический эффект препарата не зависел от предшествующей лекарственной терапии псориаза и ее результатов.
Ответ на лечение апремиластом был быстрым и выражался в существенном уменьшении симптомов псориаза уже ко второй неделе лечения, по сравнению с плацебо.
Фармакокинетика
Всасывание
Апремиласт хорошо всасывается и его абсолютная биодоступность после приема внутрь составляет примерно 73 %. Медиана времени достижения (tmax) максимальной концентрации в плазме крови (Сmax) составляет приблизительно 2,5 часа. Фармакокинетика апремиласта линейная, с увеличением степени воздействия, пропорциональным дозе (в пределах 10-100 мг в сут). После приема апремиласта 1 раз в день кумуляция минимальна, а после применения 2 раза в день составляет примерно 53 % у здоровых людей и 68 % — у пациентов с псориазом. Биодоступность апремиласта не нарушается при его применении с едой, поэтому его можно принимать вне зависимости от времени приема пищи.
Распределение
Апремиласт связывается с белками плазмы крови человека примерно на 68 %. Средний кажущийся объем распределения (Vd) составляет 87 л, что свидетельствует о внесосудистом распределении.
Биотрансформация
Апремиласт экстенсивно метаболизируется, как с участием изоферментов цитохрома 450 (CYP), так и не-CYP путей, включая окисление, гидролиз и конъюгацию. Поэтому ингибирование какого-либо одного из этих путей практически не должно вызвать значимого лекарственного взаимодействия. В окислительном метаболизме апремиласта участвует, главным образом, изофермент CYP3A4 и, в меньшей степени, изоферменты CYP1A2 и CYP2A6. После приема внутрь основной компонент в крови представляет апремиласт. Соединение в значительной степени метаболизируется, и только 3 % и 7 % от принятого количества препарата выводится в неизмененном виде почками и кишечником, соответственно. В крови основной неактивный метаболит — глюкуронидный конъюгат О-деметилированного апремиласта (M12). Так как апремиласт является субстратом для изофермента CYP3A4, его воздействие снижается при одновременном применении с рифампицином, мощным индуктором изофермента CYP3A4.
In vitro апремиласт не является ингибитором или индуктором изоферментов CYP450. Поэтому, при комбинированном применении с субстратами изоферментов CYP450, апремиласт не будет нарушать клиренс или воздействие активных субстанций, которые метаболизируются изоферментами CYP450.
In vitro апремиласт является субстратом и слабым ингибитором Р-гликопротеина (IС50>50мкМ), однако клинически значимые взаимодействия с участием гликопротеина маловероятны.
In vitro апремиласт незначительно угнетает или не влияет (IС50>10мкМ) на переносчики органических анионов ОАТ1 и ОАТЗ, переносчик органических катионов ОСТ2, транспортный полипептид органических анионов (OATP) lBl и ОАТР1ВЗ или на белок устойчивости рака молочной железы (BCRP) и не является субстратом для этих соединений. В связи с этим клинически значимые лекарственные взаимодействия маловероятны при совместном применении апремиласта с субстратами или ингибиторами этих транспортеров.
Выведение
У здоровых людей клиренс апремиласта составляет в среднем около 10 л/час и конечный период полувыведения — примерно 9 часов. После приема внутрь меченого соединения почками и кишечником выводится, соответственно, около 58 % и 39% радиоактивности, причем приблизительно 3 % и 7 % дозы — в виде радиоактивного апремиласта.
Пожилые пациенты
Апремиласт изучали у молодых и пожилых здоровых добровольцев. Экспозиция апремиласта у пожилых (65 — 85 лет) примерно на 13 % выше по показателю площадь под кривой концентрация/время (AUC) и на 6 % выше по Сmах в сравнении с добровольцами в возрасте 18-55 лет. Данные о применении препарата в клинических исследованиях у пациентов старше 75 лет ограничены. У пожилых пациентов нет необходимости в коррекции дозы.
Почечная недостаточность
У пациентов с почечной недостаточностью легкой и средней степени тяжести и у здоровых добровольцев существенных различий в показателях фармакокинетики апремиласта не отмечено. Поэтому при почечной недостаточности легкой или средней степени тяжести изменение дозы не требуется. При тяжелой почечной недостаточности (скорость гломерулярной фильтрации менее 30 мл/мин/1,73 м2 или клиренс креатинина < 30 мл/мин) дозу снижают до 30 мг один раз в день. У 8 пациентов с тяжелой почечной недостаточностью при однократном приеме апремиласта в дозе 30 мг значения AUC и Сmах увеличились приблизительно на 89 % и 42 %, соответственно.
Печеночная недостаточность
Фармакокинетика апремиласта и его основного метаболита М12 не нарушается при печеночной недостаточности средней или тяжелой степени тяжести. При печеночной недостаточности коррекции дозы не требуется.
Результаты доклинического изучения безопасности
Результаты доклинического изучения фармакологии безопасности и токсичности при повторных введениях апремиласта не выявили специфических рисков для человека. Препарат не обладает иммунотоксичностью, фототоксичностью или раздражающим влиянием на кожу.
Фертильность и раннее эмбриональное развитие
Апремиласт не влиял на фертильность у самцов мышей. Дозы препарата, при которых не возникало видимого побочного влияния (NOAEL) на фертильность составляли более 50 мг/кг/сут (в 3 раза выше значения клинической экспозиции).
При комбинированном изучении влияния на фертильность у самок мышей и оценке эмбрио-фетальной токсичности отмечено пролонгирование эстрогенных циклов и увеличение периода спаривания при дозах апремиласта 20 мг/кг/сут и выше. Однако частота беременностей не нарушалась. Доза препарата, при которой не возникало видимого влияния (NOEL) на фертильность самок, составила 10 мг/кг/сут (соответствовала значению клинической экспозиции).
Эмбрио-фетальное развитие
Значение NOEL в отношении эмбрио-фетального развития было 10 мг/кг/сут (в 1,3 раза выше значения клинической экспозиции). У обезьян апремиласт повышал пренатальные потери (аборты) пропорционально дозе при приеме внутрь в дозах 50 мг/кг/сут и выше. В дозе 20 мг/кг/сут (в 1,4 раза выше значения клинической экспозиции) влияния на эмбрио-фетальное развитие не отмечено.
Пре- и постнатальное развитие
У мышей повышение пре- и постнатальной гибели детенышей-сосунков и уменьшение массы их тела обнаружено на первой неделе лактации при дозах ≥ 80 мг/кг/сут (в 4,0 раза и более выше значения клинической экспозиции). Не выявлено влияния апремиласта на дительность беременности, количество беременных мышей в конце периода гестации, количество родивших мышей или на развитие детенышей-сосунков после 7-го постнатального дня.
Все нежелательные эффекты в отношении постнатального развития отмечались в течение первой недели и не проявлялись в последующие периоды. Половое созревание, поведение, спаривание, фертильность и параметры матки не нарушались. Значение NOEL для самок мышей и генерации F1 было 10 мг/кг/сут (в 1,3 раза выше значения клинической экспозиции).
Исследования канцерогенности
Апремиласт не проявлял признаков канцерогенности при изучении у мышей и крыс.
Исследования генотоксичности
Апремиласт не генотоксичен. Апремиласт не вызывал мутаций по результатам теста Эймса или хромосомных аберраций в культуре лимфоцитов периферической крови человека при наличии или отсутствии метаболической активации. Апремиласт не проявлял кластогенной активности на микроядрах мышей in vivo в дозах до 2000 мг/кг/сут.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Псориатический артрит
Лечение активного псориатического артрита (ПсА) у взрослых в монотерапии или в комбинации с базисными противовоспалительными препаратами (БПВП) при недостаточном ответе или при непереносимости предшествующей терапии БПВП.
Псориаз
Лечение бляшечного псориаза средней и тяжелой степени тяжести у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости базисной противовоспалительной терапии, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением (ПУВА).
ПРОТИВОПОКАЗАНИЯ
- Повышенная чувствительность к апремиласту или другим компонентам, входящим в состав препарата;
- Беременность;
- Период грудного вскармливания;
- Детский возраст до 18 лет (недостаточно клинического опыта);
- Редкая наследственная непереносимость галактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции (препарат содержит лактозу).
С ОСТОРОЖНОСТЬЮ
У пациентов, имеющих нарушения психики или указания на наличие таковых в анамнезе, или в случае планируемого приема пациентом иных сопутствующих препаратов, способных вызвать психические нарушения (см. раздел «Особые указания»).
У пациентов с почечной недостаточностью тяжелой степени тяжести (см. раздел «Фармакокинетика», «Способ применения и дозы», «Особые указания»). У пациентов с недостаточной массой тела (см. раздел «Особые указания»).
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ
Женщины, способные к деторождению
До начала лечения необходимо исключить беременность. Женщины, способные к деторождению, должны использовать эффективный метод контрацепции во время терапии.
Беременность
Данные о применении апремиласта у беременных женщин ограничены. Апремиласт противопоказан при беременности. У мышей и обезьян его эффекты заключаются в эмбриофетальных потерях, снижении веса плода и задержке оссификации у мышей при дозах выше, чем максимальные дозы для человека. Если экспозиция у животных составляла 1,3 от значения клинической экспозиции, то негативное действие не развивалось (см. раздел «Фармакологические свойства»).
Период грудного вскармливания
Апремиласт обнаруживался в молоке мышей (см. раздел «Фармакологические свойства»). Неизвестно, поступает ли апремиласт или его метаболиты в молоко человека. Так как нельзя исключить риск нежелательного воздействия на ребенка при грудном вскармливании, то апремиласт не следует применять в период грудного вскармливания.
Фертильность
Данные о влиянии на фертильность у человека отсутствуют. В экспериментах на мышах не обнаружено нежелательного влияния на фертильность самцов при экспозиции апремиласта в 3 раза выше клинической, а у самок — при экспозиции, сравнимой с клинической. Данные по неклиническому изучению фертильности представлены в разделе «Фармакологические свойства».
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Для приема внутрь.
Лечение препаратом Отесла может назначать только специалист, имеющий достаточный опыт в диагностике и лечении псориаза и псориатического артрита.
Покрытые оболочкой таблетки нужно проглатывать целиком, желательно запивая их водой. Принимать вне зависимости от времени приема пищи.
Дозы
Рекомендуемая доза апремиласта — 30 мг внутрь 2 раза в день, утром и вечером, с интервалом примерно 12 часов. Требуется начальное титрование дозы, как показано в Таблице 1. После первичного титрования повторного титрования не требуется.
Таблица 1: Схема титрования дозы
| День 1 | День 2 | День 3 | День 4 | День 5 | День 6 и далее | |||||
| утро | утро | вечер | утро | вечер | утро | вечер | утро | вечер | утро | вечер |
| 10 мг | 10 мг | 10 мг | 10 мг | 20 мг | 20 мг | 20 мг | 20 мг | 30 мг | 30 мг | 30 мг |
Если пациент пропускает прием препарата, то следующую дозу необходимо принять как можно скорее. Если пропуск дозы обнаруживается непосредственно перед временем приема следующей дозы, то пропущенную дозу не принимают и переходят к следующему приему препарата в соответствующее время. Пациент НЕ ДОЛЖЕН принимать две дозы препарата одновременно.
Максимальный терапевтический эффект отмечался в первые 24 недели лечения. Если через 24 недели эффект не достигается, лечение необходимо пересмотреть. Рекомендуется регулярно оценивать реакцию пациента на лечение. Клинических данных о применении препарата свыше 52 недель нет (см. раздел «Фармакодинамика»).
Особые группы пациентов
Дети и подростки
Эффективность и безопасность апремиласта у детей в возрасте 0-18 лет не изучалась.
Пожилые пациенты
Нет необходимости в изменении дозы у пожилых пациентов (см. раздел «Побочное действие» и «Фармакокинетика»).
Нарушения функции почек
У пациентов с почечной недостаточностью легкой или средней степени тяжести нет необходимости в изменении дозы. Дозу апремиласта следует уменьшить до 30 мг один раз в сутки у пациентов с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл/мин при оценке по формуле Кокрофта-Голта). При начальном титровании рекомендуется принимать только утреннюю дозу, как указано в Таблице 1, а вечернюю дозу — пропускать.
Нарушения функции печени
Нет необходимости в изменении дозы у пациентов с печеночной недостаточностью (см. раздел «Фармакокинетика»).
ПОБОЧНОЕ ДЕЙСТВИЕ
Наиболее частыми нежелательными лекарственными реакциями (HЛP) в ходе клинических исследований III фазы были нарушения со стороны ЖКТ — диарея (15,7 %) и тошнота (13,9 %). В основном эти нарушения были легкой или средней степени тяжести и только 0,3 % от каждой из этих HЛP были расценены как тяжелые. Эти HЛP возникали преимущественно в первые 2 недели лечения и обычно разрешались в течение 4 недель. Другими частыми HЛP были инфекции верхних дыхательных путей (8,4 %), головная боль (7,9 %) и головная боль напряжения (7,2 %). В целом, большинство HЛP были легкой или средней степени тяжести.
Наиболее частыми HЛP, ставшими причиной прекращения лечения в первые 16 недель, были диарея (1,7 %) и тошнота (1,5 %). Общая частота серьезных HЛP была низкой, и эти реакции не были специфичными для какой-либо системы органов.
Реакции гиперчувствительности редко регистрировали в ходе клинических исследований апремиласта.
HЛP, наблюдаемые у пациентов на фоне терапии апремиластом, классифицированы в соответствии с поражением органов и систем органов (медицинский словарь для нормативно-правовой деятельности MedDRA).
Такая частота HЛP была зарегистрирована в ходе клинических исследований апремиласта при псориатическом артрите (1945 пациентов) и псориазе (1184 пациента).
Частота HJIP определялась соответственно следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000).
Инфекционные и паразитарные заболевания
Часто: бронхит, инфекции верхних дыхательных путей, назофарингит*.
Нарушения со стороны иммунной системы
Нечасто: реакции гиперчувствительности.
Нарушения со стороны обмена веществ и питания
Часто: снижение аппетита*.
Нарушения психики
Часто: бессонница, депрессия.
Нечасто: суицидальные мысли и поведение #
Нарушения со стороны нервной системы
Часто: мигрень*, головная боль напряжения*, головная боль*.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Часто: кашель.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: диарея*, тошнота*;
Часто: рвота*, диспепсия, частый стул, боль в верхних отделах живота*, гастроэзофагеальный рефлюкс;
Нечасто: желудочно-кишечное кровотечение.
Нарушения со стороны кожи и подкожных тканей
Нечасто: кожная сыпь.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Часто: боль в спине*.
Общие расстройства и нарушения в месте введения
Часто: утомляемость.
Лабораторные и инструментальные данные
Нечасто: снижение массы тела.
*- по меньшей мере, одна из этих НЛР расценена как серьезная.
# В ходе клинических исследований и пострегистрационного применения сообщалось о нечасто встречающихся случаях суицидальных мыслей и поведения; из постмаркетингового опыта известно о завершенной попытке суицида. Пациент и лица, заботящиеся о пациенте, должны сообщать врачу, назначившему препарат, о любых изменениях поведения или настроения пациента и его суицидальных мыслях (см. также разделы «С осторожностью» и «Особые указания»).
Описание отдельных НЛР
Снижение массы тела
Массу тела пациентов регулярно оценивали в ходе клинических исследований. Среднее снижение массы тела на фоне приема апремиласта в течение 52 недель составило 1,99 кг. В целом у 14,3 % пациентов, получавших апремиласт, потеря массы тела составила 5- 10 %, а у 5,7 % — более 10 %. Ни у одного пациента потеря массы тела не сопровождалась клинически значимыми последствиями. В общей сложности, только 0,1 % пациентов прекратили прием апремиласта по причине снижения массы тела как нежелательного явления.
Смотрите дополнительные предосторожности при начале лечения пациентов со сниженной массой тела в разделах «С осторожностью» и «Особые указания».
Особые группы пациентов
Пожилые пациенты
В ходе клинических исследований не выявлено различий в профиле безопасности апремиласта у пожилых пациентов (> 65 лет) и у пациентов в возрасте до 65 лет.
Пациенты с нарушением функции печени
Безопасность апремиласта не оценивали у пациентов с ПсА или псориазом и нарушениями функции печени.
Пациенты с нарушением функции почек
В клинических исследованиях при ПсА и псориазе характеристики безопасности препарата не отличались у пациентов с нормальной функцией почек и с почечной недостаточностью легкой степени тяжести. Безопасность апремиласта не изучали у пациентов с ПсА или псориазом и почечной недостаточностью средней и тяжелой степени тяжести.
ПЕРЕДОЗИРОВКА
Апремиласт изучали на здоровых добровольцах в максимальной суточной дозе 100 мг (по 50 мг 2 раза в день) в течение 4,5 дней без признаков дозолимитирующей токсичности. При передозировке рекомендуется наблюдение за симптомами и признаками НЛР. При необходимости назначают симптоматическое и поддерживающее лечение.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
Совместное применение с мощным индуктором изофермента цитохрома Р450 3А4 (CYP3A4), рифампицином, ведет к ослаблению системного воздействия апремиласта и уменьшению его эффективности. Поэтому не рекомендуется комбинированное применение мощных индукторов изофермента CYP3A4 (например, рифампицина, фенобарбитала, карбамазепина, фенитоина и препаратов Зверобоя продырявленного) с апремиластом. При одновременном повторном применении апремиласта и рифампицина AUC и Сmах апремиласта снижаются, соответственно, на 72 % и 43 %. В условиях комбинированного применения апремиласта с мощными индукторами изофермента CYP3A4 (например, рифампицином) клинический ответ может снижаться. Во время клинических исследований апремиласт комбинировали со средствами местной терапии (включая глюкокортикостероиды, дегтярный шампунь, препараты салициловой кислоты для обработки волосистой части головы) и с УФ-В фототерапией.
Не выявлено клинически значимого лекарственного взаимодействия между кетоконазолом и апремиластом. Апремиласт можно комбинировать с мощными ингибиторами изофермента CYP3A4, такими как кетоконазол.
Не обнаружено фармакокинетического лекарственного взаимодействия между апремиластом и метотрексатом у пациентов с ПсА. Апремиласт можно комбинировать с метотрексатом.
Не отмечено фармакокинетического лекарственного взаимодействия между апремиластом и пероральными контрацептивами, содержащими этинилэстрадиол и норгестимат. Апремиласт можно комбинировать с пероральными контрацептивами.
ОСОБЫЕ УКАЗАНИЯ
Пациентам с редкими наследственными нарушениями в виде непереносимости галактозы, с врожденной недостаточностью лактазы или с нарушениями всасывания глюкозы- галактозы не следует принимать данный препарат.
Нарушения психики
Применение апремиласта ассоциируется с повышенным риском развития нарушений психики, таких как бессонница и депрессия. Случаи появления суицидальных мыслей и поведения, включая суицид, были отмечены у пациентов как с указанием на депрессию в анамнезе, так и без него (см. раздел «Побочное действие»).
Риски и польза начала и продолжения терапии апремиластом должны быть тщательно оценены у тех пациентов, которые сообщают об имеющихся у них нарушениях психики или наличии таковых в анамнезе, или в случае планируемого приема пациентом иных сопутствующих препаратов, способных вызвать психические нарушения. Пациент и лица, заботящиеся о пациенте, должны сообщать врачу, назначившему препарат, о любых изменениях поведения или настроения пациента, а также о появлении у него суицидальных мыслей.
Если у пациента появились новые или обострились уже имевшиеся психиатрические симптомы, обнаруживаются суицидальные мысли или зафиксированы суицидальные попытки, рекомендовано прекратить терапию апремиластом.
Тяжелая почечная недостаточность
У пациентов с почечной недостаточностью тяжелой степени тяжести доза препарата Отесла должна быть снижена до 30 мг 1 раз в день (см. раздел «Фармакокинетика» и «Способ применения и дозы»).
Пациенты с недостаточной массой тела
У пациентов с недостаточной массой тела в начале курса терапии необходимо регулярно контролировать массу тела в процессе лечения. В случае необъяснимого или клинически значимого снижения массы тела необходимо провести тщательное медицинское обследование пациента и рассмотреть вопрос о прекращении лечения.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Апремиласт не влияет или влияет в незначительной степени на способность управлять транспортными средствами или на работу с механизмами.
ФОРМА ВЫПУСКА
Таблетки, покрытые пленочной оболочкой, 10, 20 и 30 мг.
1. 4 таблетки 10 мг, 4 таблетки 20 мг и 5 таблеток 30 мг в одном блистере из ПВХ/алюминиевой фольги; 14 таблеток 30 мг в другом блистере из ПВХ/алюминиевой фольги. 2 блистера с инструкцией по применению в упаковку-конверт картонный с контролем первого вскрытия (специальный стикер).
2. 14 таблеток 30 мг в блистер из ПВХ/алюминиевой фольги. 4 блистера с инструкцией по применению в пачку картонную с контролем первого вскрытия (специальный стикер).
УСЛОВИЯ ХРАНЕНИЯ
Хранить при температуре не выше 30°С. Хранить в недоступном для детей месте.
СРОК ГОДНОСТИ
2 года.
Не применять после даты истечения срока годности.
УСЛОВИЯ ОТПУСКА
Отпускают по рецепту.
ВЛАДЕЛЕЦ РУ и ПРОИЗВОДИТЕЛЬ (все стадии)
Селджен Интернешнл Сарл., Швейцария / Celgene International Sari., Switzerland Рут де Перро, 1, 2017 Бодри, Швейцария / Route de Perreux, 1, 2017 Boudry, Switzerland
При упаковке препарата на ОАО «Фармстандарт-Лексредства»:
ПРОИЗВОДИТЕЛЬ
Селджен Интернешнл Сарл., Швейцария / Celgene International Sari., Switzerland Рут де Перро, 1, 2017 Бодри, Швейцария / Route de Perreux, 1, 2017 Boudry, Switzerland
УПАКОВЩИК
ОАО «Фармстандарт-Лексредства», Россия Россия, 305022, г. Курск, ул. 2-я Агрегатная, д. 1а/18
Организация, принимающая претензии
Представительство корпорации «Селджен Интернэшнл Холдингз Корпорэйшн», США
Россия, 125047, г. Москва, ул. 1-ая Тверская — Ямская, д.21
Эффективность и безопасность апремиласта в лечении псориаза и псориатического артрита
Апремиласт, ингибирующий фосфодиэстеразу 4 типа и подавляющий синтез различных провоспалительных цитокинов, – это низкомолекулярный базисный противовоспалительный препарат таргетного действия, предназначенный для лечения средне-тяжелого и тяжелого бляшечного псориаза и активного псориатического артрита (ПсА). В рандомизированных, плацебо-контролируемых исследованиях 3 фазы, проводившихся в целом у нескольких тысяч больных псориазом (ESTEEM 1, 2) и ПсА (PALACE 1-3, ACTIVE), апремиласт по эффективности достоверно превосходил плацебо. Апремиласт не является белком и, соответственно, не обладает иммуногенностью. В клинических исследованиях апремиласт характеризовался благоприятным профилем безопасности, в частности не вызывал увеличения риска инфекционных осложнений.
Псориаз – это хроническое иммуновоспалительное заболевание кожи, распространенность которого в общей популяции достигает 2% [1]. В настоящее время псориаз рассматривают как системное заболевание, поражающее не только кожу, но и другие ткани, в частности суставы и ногти [2]. Псориатический артрит (ПсА) развивается примерно у каждого третьего больного псориазом и может сопровождаться воспалением энтезисов (энтезит) и сухожилий пальцев кистей и стоп (дактилит, теносиновит), тел позвонков (спондилит) и илиосакральных сочленений (сакроилиит) [3,4]. Для лечения средне-тяжелого и тяжелого бляшечного псориаза и ПсА применяют различные базисные противовоспалительные препараты (БПВП), прежде всего метотрексат, и генно-инженерные биологические препараты (ГИБП), в том числе ингибиторы фактора некроза опухоли-α (ФНО-α), интерлейкинов-12/23 (ИЛ-12/23) и ИЛ-17А, которые оказывают действие на все проявления псориатической болезни [5,6].
Апремиласт – это таблетированный представитель низкомолекулярных БПВП таргетного действия для лечения псориаза и ПсА [7]. Апремиласт оказывает селективное ингибирующее действие на фосфодиэстеразу 4 типа (ФДЭ 4), которая разрушает цикло-аденозинмонофосфат (цАМФ) [8]. Увеличение содержания цАМФ в клетках, экспрессирующих ФДЭ 4, сопровождается подавлением синтеза провоспа лительных цитокинов, в том числе ФНО-α, интерферона-g, интерлейкинов 12, 17, 22, 23, и хемокинов (CXCL9, CXCL10 и CCL4). Таким образом, апремиласт действует на начальном этапе воспалительного каскада и регулирует продукцию многочисленных компонентов воспалительного ответа [9].
В Российской Федерации апремиласт в дозе 30 мг два раза в день зарегистрирован под торговым названием ОТЕСЛА® для лечения активного ПсА у взрослых в виде монотерапии или в комбинации с БПВП при недостаточном ответе или при непереносимости предшествующей терапии БПВП, а также для лечения средне-тяжелого и тяжелого бляшечного псориаза у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости других БПВП, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением. Апремиласт был включен в Российские федеральные рекомендации, рекомендации EULAR (European League Against Rheumatism), GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis), NICE (National Institute for Health and Care Excellence) для лечения пациентов с активным ПсА и псориазом [10-13].
Эффективность апремиласта в лечении псориатического артрита и псориаза
Эффективность и безопасность апремиласта в лечении ПсА изучались в рандомизированных, плацебо-контролируемых клинических исследованиях 3 фазы (программа PALACE), которые проводились по сходным протоколам [14-16]. В целом в эти исследования были включены более 2000 взрослых больных активным ПсА (по крайней мере 3 опухших и болезненных сустава, длительность артрита ≥3 или ≥6 месяцев), которые получали апремиласт в дозах 20 или 30 мг два раза в день или плацебо. В исследования PALACE 1, PALACE 2 и PALACE 3 включали больных, которые ранее принимали стандартные БПВП (72-83% пациентов) или ГИБП (15-28%). Допол ни тель ным критерием включения в исследование PALACE 3 было наличие по крайней мере одной псориатической бляшки размером ≥2 см. Во время исследований допускалась сопутствующая терапия метотрексатом, сульфасалазином, лефлуномидом, глюкокортикостероидами в низких дозах и/или нестероидными противовоспалительными препаратами. Первичной конечной точкой исследований PALACE была частота ответа по критериям Амери канской коллегии ревматологов (АКР 20) через 16 недель, а основной вторичной конечной точкой – изменение индекса нетрудоспособности по вопроснику Health Assessment Questionnaire (HAQ-DI).
По частоте ответа по критерию АКР 20 апремиласт превосходил плацебо как у больных, получавших БПВП (32-41% и 18-19%, соответственно), так и пациентов, которые ранее не принимали БПВП или ГИБП (31% и 16%). К настоящему времени опубликованы результаты долгосрочной терапии апремиластом. Так, через 1 год применения препарата ответ по AКР 20 наблюдался у 61,3% пациентов, через 4 года – у 66,4% [17]. Таким образом, с течением времени отмечалось постепенное стабильное нарастание терапевтического эффекта (рис. 1).
Эффективность апремиласта была подтверждена и при анализе динамики индекса HAQ-DI, который в большей степени снизился при применении исследуемого препарата. Клинически значимое снижение индекса HAQ-DI по крайней мере на 0,35 через 156 недель было достигнуто у 48% больных в исследованиях PALACE 1, 2 и 3. Стоит также отметить, что по данным мета-анализа исследований PALACE 1, 2 и 3, у больных, завершивших 52- и 104-недельную терапию апремиластом, отмечалось снижение индекса утомляемости (FACIT-F) на 4,8 и 5,6 балла, соответственно, а клинически значимое снижение этого показателя в обеих точ ках было достигнуто примерно у половины пациентов.
Во всех трех исследованиях лечение апремиластом привело также к достоверному уменьшению числа болезненных и припухших суставов, индекса DAS28СРБ, а также к уменьшению проявлений энтезитов и дактилитов. По данным анализа исследований PALACE 1, 2 и 3, через 3 года применения апремиласта симптомы дактилита были полностью устранены у 79,6% пациентов, симптомы энтезита – у 55,0% (рис. 2, 3).
Эффективность апремиласта была подтверждена в рандомизированном, двойном слепом, международном исследовании ACTIVE, в которое были включены 219 пациентов с активным ПсА (по крайней мере три болезненных сустава и по крайней мере три припухших сустава) длительностью ≥3 мес [18]. Больные ранее не получали ГИБП, а стандартные БПВП отменяли перед началом исследования, во время которого допускалась только сопутствующая терапия пероральными глюкокортикостероидами в стабильных низких дозах и/или НПВП. Пациентов рандомизировали на группы апремиласта в дозе 30 мг два раза в день или плацебо. Через 16 недель больных, у которых счет болезненных и при суставов не улучшался по крайней мере на 10%, переводили на апремиласт, а через 24 недели исследуемый препарат назначали всем оставшимся пациентам группы плацебо.
Действие монотерапии апремиластом проявлялось быстро. Уже через 2 недели частота ответа по критерию АКР 20 в основной группе достоверно превышала таковую в группе плацебо (16,4% и 6,4%, соответственно; p=0,0252) (рис. 4). При продолжении лечения частота ответа постепенно нарастала и через 16 недель (первичная конечная точка) достигла 38,2% против 20,2% в группе плацебо (p<0,01).
Достигнутый эффект сохранялся в отдаленном периоде. Через 52 недели частота ответа по критерию АКР 20 у больных, продолжавших прием апремиласта (n=171), составила 63,3%. Достоверное преимущество апремиласта перед плацебо было выявлено и при анализе снижения индекса HAQ-DI как через 2 недели (на 0,13 и 0,05, соответственно; p<0,05), так через 16 недель (на 0,21 и 0,06; p<0,05). Лечение апремиластом по сравнению с плацебо привело также к достоверному снижению индекса DAS28-CРБ (p<<0,05) через 2 и 16 недель (табл. 1).
Таким образом, результаты двойных слепых, контролируемых исследований 3 фазы показали, что апремиласт в дозе 30 мг два раза в день по эффективности превосходит плацебо у больных ПсА. Действие препарата проявлялось уже в первые 2 недели, а через 16 недель доля пациентов, ответивших на лечение (АКР 20), составляла 30-40% и достоверно превышала таковую в группе плацебо. Через 3-4 года ответ по критерию АКР 20 наблюдался примерно у 2/3 больных ПсА, продолжавших терапию апремиластом.
Эффективность апремиласта у пациентов со среднетяжелым и тяжелым псориазом изучалась в регистрационных, рандомизированных, двойных слепых, плацебо-контролируемых исследованиях 3 фазы ESTEEM [19,20]. В эти исследования были включены взрослые больные средне-тяжелым или тяжелым бляшечным псориазом кожи (индекс PASI≥12), нуждавшиеся в системной терапии или фототерапии.
Первые результаты лечения отмечались уже через 2 недели применения препарата, а через 16 недель исходное значение индекса PASI уменьшилось по крайней мере на 75% (PASI 75) у трети пациентов. Через 52 недели достигнутый ответ на лечение сохранялся у пациентов, продолживших прием апремиласта.
Особый интерес представляют данные субанализа исследований, отражающие терапевтическую эффективность препарата в отношении проявлений псориаза ногтей и волосистой части головы, которые, в целом, хуже поддаются лечению [21]. В исследовании ESTEEM через 16, 32 и 52 недели индекс NAPSI, который используется для оценки тяжести поражения ногтей, уменьшился на 22,5%, 43,6% и 60,2%, соответственно, а в исследовании ESTEEM 2 – на 29,0%, 60,0% и 59,7%. При этом индекс NAPSI в те же сроки уменьшился по крайней мере в два раза у 33,3%, 45,2% и 63,0% больных, соответственно, в первом исследовании и у 44,6%, 55,4% и 68,6% пациентов во втором исследовании.
Эффективность апремиласта была показана и при анализе динамики поражения волосистой части головы. Так, через 52 недели полное или практически полное разрешение псориаза этой локализации быдо достигнуто у 73,0% пациентов в исследовании ESTEEM 1 и у 62,5% больных в исследовании ESTEEM 2.
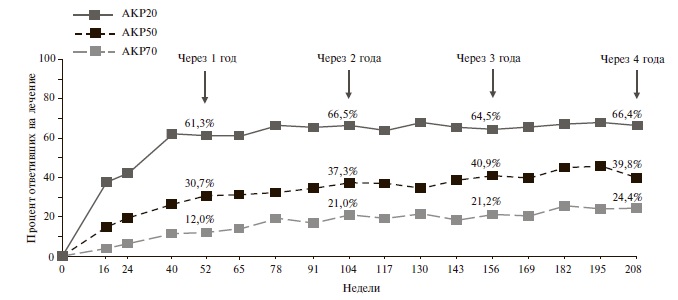
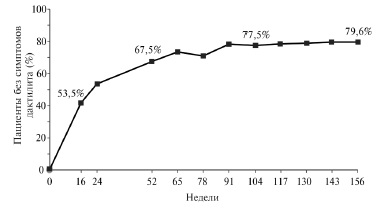
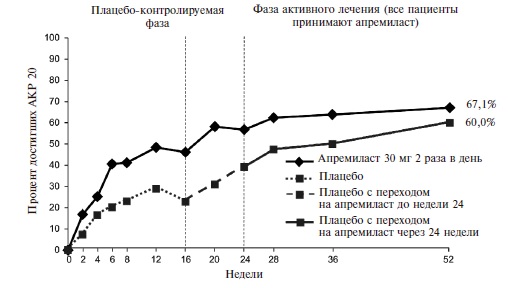
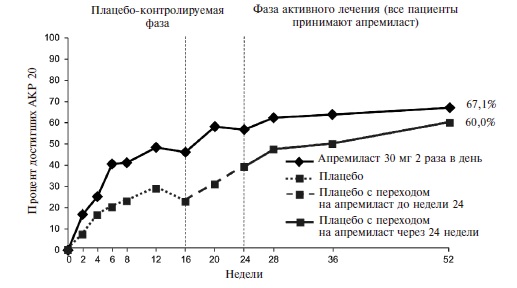
ТАБЛИЦА1. Влияние апремиласта на выраженность симптомов ПсА и функциональную активность пациентов в исследовании ACTIVE
Показатели
Исходно
2 нед
16 нед
52 нед
Частота ответа по АКР20,
—
16,4
38,2
67,1
DAS-28 (СРБ)
4,81
-0,59
-1,07
-1,71
Выраженность энтезита (GEI: 0-6
2,30
-1,10
-1,50
-1,60
Функциональные нарушения (HAQ-DI: 0-3)
1,25
-0,13
-0,21
-0,40
Профиль безопасности апремиласта у больных ПсА и псориазом
Отличительной особенностью апремиласта являются хорошая переносимость и благоприятный профиль безопасности [22,23]. При длительном лечении апремиластом у больных псориазом и ПсА не было выявлено увеличения риска серьезных инфекций, сердечно-сосудистых исходов или злокачественных опухолей, частота которых оставалась очень низкой [7]. Также не было выявлено ни одного случая реактивации латентного туберкулеза.
Все ГИБП представляют собой белки, которые обладают иммуногенностью и вызывают образование антител, в том числе с нейтрализующей активностью. Появление нейтрализующих антител при введении ГИБП может нивелировать эффект лечения. По данным мета-анализа 68 исследований более чем у 14000 пациентов с различными аутоиммунными заболеваниями, получавших ингибиторы ФНО-α, частота образования антител к препаратам этой группы составила в целом 12,7%, а при применении инфликсимаба достигла 25,3% [24]. Риск формирования антительного ответа был ниже при применении ГИБП, представляющих собой человеческие антитела, таких как секукинумаб или устекинумаб. Апремиласт – это низкомолекулярный непептидный препарат, поэтому он не способен вызывать появление антител.
В клинических исследованиях основными нежелательными эффектами препарата были легкие или умеренно выраженные желудочно-кишечные нарушения, в том числе диарея, тошнота и рвота, которые возникали в течение первых 2 недель и проходили в течение 4 недель [25]. У большинства больных желудочно-кишечные расстройства не требовали прекращения приема апремиласта. Кроме того, при лечении апремиластом встречались инфекции верхних дыхательных путей и головная боль, в том числе напряжения [7]. При более длительном применении апремиласта (до 156 недель в исследованиях ESTEEM и до 208 недель в исследованиях PALACE) частота и тяжесть нежелательных явлений не нарастали, а новых значимых нежелательных реакций выявлено не было [26,27].
В клинических исследованиях у больных псориазом и ПсА частота депрессии при лечении апремиластом была несколько выше, чем при приеме плацебо. У пациентов с псориазом депрессия ни в одном случае не потребовала прекращения лечения, в то время как у больных ПсА частота отмены апремиласта из-за депрессии составила 0,2% (3 из 1945 пациентов). Псориаз сам по себе ассоциируется с депрессией. Соот ветственно, депрессивное состояние не является основанием для отказа от лечения, однако в таких случаях следует соблюдать осторожность.
У пациентов с легким или умеренным нарушением функции почек апремиласт применяют в стандартной дозе, в то время как при тяжелой почечной недостаточности (клиренс креатинина <30 мл/мин) дозу снижают до 30 мг один раз в сутки. При нарушении функции печени дозу апремиласта менять не следует.
Заключение
Апремиласт – это таблетированный препарат, который действует на более раннем этапе воспалительного каскада, чем ГИБП, в том числе ингибиторы ФНО-α, ИЛ12/23 и ИЛ-17А, и вызывает подавление продукции различных медиаторов воспаления. Апремиласт применяют в дозе 30 мг два раза в день для лечения ПсА у взрослых в виде монотерапии или в комбинации с БПВП при недостаточном ответе или при непереносимости предшествующей терапии БПВП, а также для лечения средне-тяжелого и тяжелого бляшечного псориаза у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости других БПВП, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением.
В рандомизированных, двойных слепых клинических исследованиях 3 фазы у больных средне-тяжелым и тяжелым бляшечным псориазом и ПсА апремиласт по эффективности достоверно превосходил плацебо, а достигнутый ответ сохранялся в отдаленном периоде. Терапия апремиластом вызывала уменьшение тяжести псориаза ногтей и волосистой части головы, который в целом хуже поддается лечению, а также улучшала качество жизни пациентов с псориазом.
У пациентов с активным ПсА апремиласт оказывал быстрое действие и уменьшал симптомы артрита, энтезита и дактилита. Судить о сравнительной эффективности апремиласта и ГИБП сложно, учитывая отсутствие прямых сравнительных исследований. Преимуществом апремиласта являются возможность приема внутрь и благоприятный профиль безопасности. Лечение этим препаратом не сопровождается повышением риска инфекционных осложнений, в том числе активации латентного туберкулеза, и образованием антител.
Используемые источники
- Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med 2009;361(12):496-509.
- Круглова Л.С., Моисеев С.В. Блокада интерлейкина-17 – новые горизонты эффективности и безопасности в лечении псориаза. Клин фармакол тер 2017;26(2):5-12.
- Коротаева Т.В. Псориатический артрит: классификация, клиническая картина, диагностика, лечение. Научно-практическая ревматология 2014;52(6): 650–9.
- Национальное руководство по ревматологии. Под ред. Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2010, 320 с.
- Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499–510.
- Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis: treatment recommendations for psoriatic arthritis 2015. Arthritis Rheumatol 2016;68:1060–71.
- Keating GM. Apremilast: a review in psoriasis and psoriatic arthritis. Drugs 2017;77(4):459-72.
- Abdulrahim H, Thistleton S, Adebajo AO, et al. Apremilast: a PDE4 inhibitor for the treatment of psoriatic arthritis. Expert Opin Pharmacother 2015;16(7):1099108.
- Haber SL, Hamilton S, Bank M, et al. Apremilast: a novel drug for treatment of psoriasis and psoriatic arthritis. Ann Pharmacother 2016;50(4):282–90.
- Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499–510.
- Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis: treatment recommendations for psoriatic arthritis 2015. Arthritis Rheumatol 2016;68:1060-71.
- Кубанов А.А. Резолюция Совета российских экспертов: “Апремиласт, ингибитор фосфодиэстеразы 4, как представитель нового класса малых молекул: место в лечении среднетяжелого, тяжелого псориаза и псориатического артрита”. Современная ревматология 2017;11(1):87-9.
- NICE Evidence-based recommendations on apremilast (Otezla) for treating active psoriatic arthritis in adults. https://www.nice.org.uk/guidance/ta433.
- Kavanaugh A, Mease PJ, Gomez-Reino JJ, et al. Treatment of psoriatic arthritis in a phase 3 randomised, placebo-controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor. Ann Rheum Dis 2014;73(6):1020-6.
- Cutolo M, Myerson GE, Fleischmann RM, et al. A phase III, randomized, controlled trial of apremilast in patients with psoriatic arthritis: Results of the PALACE 2 trial. J Rheumatol 2016;43(9):1724-34.
- Edwards CJ, Blanco FJ, Crowley J, et al. Apremilast, an oral phosphodiesterase 4 inhibitor, in patients with psoriatic arthritis and current skin involvement: a phase III, randomised, controlled trial (PALACE 3). Ann Rheum Dis 2016;75(6):1065-73.
- Edwards C, Blanco F, Crowley J, et al. Apremilast is associated with long-term (4-YEAR) DAS-28 (CRP) remission and improvements in skin disease: results from a phase III study in DMARD/biologic-experienced patients with active psoriatic arthritis. Ann Rheum Dis 76(Suppl 2):672.1
- Nash P, Ohson K, et al; ACTIVE investigators. Early and sustained efficacy with apremilast monotherapy in biological-naïve patients with psoriatic arthritis: a phase IIIB, randomised controlled trial (ACTIVE). Ann Rheum Dis 2018;77(5): 690-8.
- Papp K, Reich K, Leonardi CL, et al. Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). J Am Acad Dermatol 2015; 73:37-49.
- Paul C, Cather J, Gooderham M, et al. Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate to severe plaque psoriasis over 52 weeks: a phase III, randomized, controlled trial (ESTEEM 2). Br J Dermatol 2015;173:1387-99.
- Nguyen CM, Leon A, Danesh M, et al. Improvement of nail and scalp psoriasis using apremilast in patients with chronic psoriasis: phase 2b and 3, 52-week randomized, placebo-controlled trial results. Drugs Dermatol 2016;15(3):272-6.
- Новиков П.И., Моисеев С.В. Безопасность генно-инженерных биологических препаратов и ингибитора фосфодиэстеразы 4 типа в лечении псориаза и псориатического артрита. Клин фармакол тер 2018;27(1):
- Dattola A, Del Duca E, Saraceno R, et al. Safety evaluation of apremilast for the treatment of psoriasis. Expert Opin Drug Saf 2017;16(3):381-5.
- Thomas SS, Borazan N, Barroso N, et al. Comparative immunogenicity of TNF inhibitors: impact on clinical efficacy and tolerability in the management of autoimmune diseases. A systematic review and meta-analysis. BioDrugs 2015; 29(4):241-58.
- Celgene Corporation. Otezla (apremilast) tablets, for oral use: US prescribing information. 2015. http://www.celgene.com/content/uploads/otezla-pi.pdf.
- Crowley J, Thaçi D, Joly P, et al. Long-term safety and tolerability of apremilast in patients with psoriasis: Pooled safety analysis for ≥156 weeks from 2 phase 3, randomized, controlled trials (ESTEEM 1 and 2). J Am Acad Dermatol 2017; 77(2):310-7.
- Crowley J, Wollenhaupt J, Reich K, et al. Long-term safety in psoriasis and psoriatic arthritis patients treated with apremilast: pooled analysis for C156 weeks in the ESTEEM and PALACE 1-3 phase 3 trials [abstract no. P2052 plus poster]. In: 25th Congress of the European Academy of Dermatology and Venereology. 2016.
Версия на английском языке
| Апремиласт | |
|---|---|
 |
|
 |
|
| Химическое соединение | |
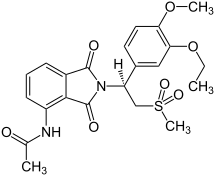
| ИЮПАК | N-{2-[(1S)-1-(3-Ethoxy-4-methoxyphenyl)-2-(methylsulfonyl)ethyl]-1,3-dioxo-2,3-dihydro-1H-isoindol-4-yl}acetamide |
| Брутто-формула | C22H24N2O7S |
| Молярная масса | 460.500 г/моль |
| CAS | 608141-41-9 |
| PubChem | 11561674 |
| DrugBank | DB05676 |
| Состав | |
| Классификация | |
| АТХ | L04AA32 |
| Фармакокинетика | |
| Биодоступн. | 73%;[1] Tmax = ~2.5 hours |
| Связывание с белками плазмы | ~68%[1] |
| Метаболизм | Liver (CYP3A4, with minor contributions from CYP2A6, CYP1A2) |
| Период полувывед. | 6–9 hours[1] |
| Экскреция | Urine (58%), faeces (39%)[1] |
| Способы введения | |
| Oral (tablets) | |
| Другие названия | |
| Otezla | |
Апремиласт — пероральное лекарственное средство, относится к группе избирательных иммунодепрессантов, которые модулируют работу медиаторов воспаления.
Механизм действия[править | править код]
Апремиласт представляет собой малую молекулу. Это ингибитор фосфодиэстеразы 4 (ФДЭ4), который действует внутри клетки, модулируя провоспалительные и противовоспалительные медиаторы. Угнетение ФДЭ4 ведет к снижению воспалительной реакции за счет модуляции экспрессии воспалительных цитокинов — TNF-α, IL-23, IL-17 и других. Эти про- и противовоспалительные медиаторы участвуют в патогенезе псориаза и псориатического артрита.
Фармакокинетические свойства[править | править код]
- Всасывание — апремиласт хорошо всасывается, его абсолютная биодоступность после приема внутрь составляет примерно 73%. Медиана времени достижения (tmax) максимальной концентрации в плазме крови (Cmax) приблизительно 2,5 часа. Фармакокинетика апремиласта линейная, с пропорциональным дозе (в пределах 10-100 мг в сут) увеличением степени воздействия. После приема один раз в день накопление соединения минимально, а после применения дважды в день составляет примерно 53% у здоровых людей и 68% у больных псориазом. Биодоступность апремиласта не нарушается при его применении с едой, поэтому препарат можно использовать вне зависимости от приема пищи.
- Распределение — у человека апремиласт связывается с белками плазмы крови примерно на 68%. Средний объем распределения (Vd) составляет 87 л, что свидетельствует о внесосудистом распространении.
- Элиминация — у здоровых людей конечный период полувыведения апремиласта в среднем 9 часов, с мочой выводится около 58% и 39% — с калом.
Показания к применению[править | править код]
В 2014 году апремиласт одобрен для применения в США[2][3] и Европейском Союзе[4] в монотерапии или в комбинации с противоревматическими средствами для лечения взрослых людей со следующими состояниями:
- Псориатический артрит – при неэффективности или непереносимости предшествующей терапии «противоревматическими средствами, модифицирующими течение заболевания» (ПРСМТЗ).
- Псориаз — воспалительное заболевание кожи, которое может вызывать покраснение, чешуйчатость, утолщение, зуд и боль участков кожи, а также поражать волосистую часть кожи головы и ногти.
- Умеренный или тяжелый бляшковый псориаз – при отсутствии ответа на лечение или наличии противопоказаний или непереносимости к другой системной терапии, включая циклоспорин, метотрексат или псорален и ультрафиолетовое-А облучение (ПУВА).
- Язвы полости рта при болезни Бехчета. Одобрен в 2019 г.[5][3]
С 2018 года входит в Перечень ЖНВЛП.
Дозирование и способ применения[править | править код]
Лечение препаратом апремиласт должно проводиться врачом-специалистом, имеющим достаточный опыт в диагностике и лечении псориаза и псориатического артрита.
Рекомендуемая доза — 30 мг внутрь два раза в день, утром и вечером, с интервалом 12 часов вне зависимости от приема пищи. Рекомендуется начальное титрование дозы.[6] Коррекция дозы у пожилых пациентов, больных с почечной (с умеренной и средней степенью) или печеночной недостаточностью не требуется. У больных с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл/мин при определении по формуле Кокрофта-Голта) дозировку апремиласта следует уменьшить до 30 мг один раз в сутки. Эффективность и безопасность апремиласта у детей в возрасте 0-17 лет не изучалась.
Противопоказания[править | править код]
Гиперчувствительность к активной субстанции или любым вспомогательным веществам.
Беременность.
Взаимодействия с другими медицинскими продуктами и другие виды взаимодействия[править | править код]
Совместное применение с активным индуктором цитохрома P450 3A4 (CYP3A4) рифампицином ведет к ослаблению системного воздействия апремиласта и уменьшению его эффективности. Поэтому не рекомендуется комбинированное использование активных индукторов CYP3A4 (например., рифампицина, фенобарбитала, карбамазепина, фенитоина, продуктов зверобоя) с апремиластом.
Результаты клинических исследований[править | править код]
Псориатический артрит[править | править код]
Безопасность и эффективность апремиласта были изучены в 3-х многоцентровых, рандомизированных, двойных слепых, плацебо контролируемых исследованиях (исследования PALACE 1, PALACE 2 и PALACE 3) со сходным дизайном у взрослых больных активным псориатическим артритом (ПсА) (≥ 3 опухание суставов и ≥ 3 болезненность суставов) вне зависимости от предыдущего лечения препаратами. Всего рандомизировано 1493 больных, которые получали плацебо ± ПРСМТЗ, апремиласт 20 мг или 30 мг два раза в день внутрь ± ПРСМТЗ.
В соответствии с дизайном больные, у которых показатели болезненности и опухлости суставов не снизились более чем на 20% к 16-й неделе, считались неотвечающими на лечение. Пациенты группы плацебо ± ПРСМТЗ, которые также не дали ответа, были повторно рандомизированы в соотношении 1:1 слепым методом и получали апремиласт 20 мг или 30 мг дважды в день. После 24-й недели все оставшиеся больные группы плацебо были переведены на апремиласт 20 мг или 30 мг дважды в день.
Целевым критерием был процент больных с улучшением на 20% (ACR20) на неделе 16 по классификации Американского колледжа ревматологии (American College of Rheumatology: ACR). У больных, которые получали апремиласт 30 мг дважды в день, как минимум “ACR20 ответ” был достигнут у 53,9% пациентов, различия с группой плацебо ± ПРСМТЗ (26,7%) статистически достоверно. Ответы ACR 20/50/70 сохранялись на 24-й неделе. Из 497 больных, первоначально распределенных в группу с апремиластом по 30 мг 2 раза в день, 375 (75%) продолжали лечение препаратом на 52-й неделе. В этот период ответы ACR 20/50/70 зарегистрированы соответственно у 57%, 25% и 11% пациентов.
Физическое состояние определяли по индексу нетрудоспособности вопросника оценки здоровья (HAQ-DI). Апремиласт по сравнению с плацебо ± ПРСМТЗ значительно улучшал состояние здоровья по сравнению с исходным на неделе 16 в исследованиях PALACE 1, PALACE 2 и PALACE 3. Это улучшение сохранялось и на 24-й неделе.
Псориаз[править | править код]
Эффективность и безопасность апремиласта при псориазе изучена в двух многоцентровых, рандомизированных, двойных слепых, плацебо контролируемых исследованиях (исследования ESTEEM 1 и ESTEEM 2) у 1257 больных умеренным или тяжелым бляшковым псориазом со схожим дизайном. Площадь пораженной псориазом поверхности тела (a body surface area; BSA) была ≥ 10%, значение индекса распространеннсти и тяжести псориаза (Psoriasis Area and Severity Index; PASI) ≥ 12, значение статической общей оценки врачом (Physician Global Assessment; PGA) ≥ 3 (умеренная или тяжелая). Все больные были кандидатами на фототерапию или системную терапию.
Больных рандомизировали в соотношении 2:1 в группы с апремиластом 30 мг дважды в день и плацебо в течение 16 недель (плацебо контролируемая фаза). В период с 16 по 32-ю неделю все пациенты получали апремиласт 60 мг/сутки (фаза лечения). Во время рандомизированной фазы отмены лечения (неделя 32-52), больные, которых начинали лечить апремиластом и у которых достигнуто снижение значения PASI не менее, чем на 75% (PASI-75) (ESTEEM 1) или 50% (PASI-50) (ESTEEM 2) на неделе 32 повторно рандомизировали в группу с плацебо или с апремиластом в дозе 60 мг/сутки. В ходе исследований допускалось местное нанесение кортикостероидов на область лица, подмышек и паха или дегтярных шампуней, растворов салициловой кислоты для нанесения на кожу головы. Кроме того, на неделе 32 у больных, у которых не достигнуто значение PASI-75 в исследовании ESTEEM 1 или PASI-50 в исследовании ESTEEM 2, для лечения местных поражений разрешалось использовать препараты для местного лечения псориаза и/или фототерапию в дополнение к апремиласту в дозе 60 мг/сутки.
В обоих исследованиях основным целевым критерием было количество больных, у которых достигнуто значение PASI-75 на неделе 16. Апремиласт значимо улучшал состояние больных умеренным и тяжелым псориазом, о чем свидетельствовало достоверно большее количество больных со значениями PASI-75 на неделе 16 по сравнению с плацебо (28,8 vs. 5,8% в исследовании ESTEEM 1 и 33,1% vs. 5,31% в исследовании ESTEEM II). Кроме того, была показана эффективность апремиласта в отношении комплекса проявлений псориаза, включая зуд, поражения ногтей и волосистой части головы, а также качества жизни.
Нежелательные эффекты[править | править код]
В клинических исследованиях фазы III наиболее частыми нежелательными явлениями (НЯ) были нарушения со стороны ЖКТ — диарея (15,7%) и тошнота (13,9%). В основном эти нарушения были легкой или средней степени тяжести и только в 0,3% случаев диареи и тошноты нежелательные являения были расценены как тяжелые. Эти побочные реакции возникали преимущественно в первые две недели лечения и обычно исчезали через четыре недели. Другими частыми нежелательными явлениями были инфекции верхних дыхательных путей (8,4%), головная боль (7,9%) и головная боль напряжения (7,2%). В целом, большинство побочных реакций классифицированы как легкие или умеренные. Общая частота серьезных нежелательных реакций была низкой. и они не были специфичными для какой-либо системы органов.
Наиболее частыми побочными реакциями, ставшими причиной прекращения лечения в первые 16 недель, были диарея (1,7%) и тошнота (1,5%).
Ссылки[править | править код]
- Апремиласт (Apremilast) — Энциклопедия лекарств и товаров аптечного ассортимента. РЛС Патент. — Действующее вещество.
- Development of analogs of thalidomide
Подробная информация по медицинскому продукту представлена на веб-сайте
Европейского медицинского агентства[7]
Примечания[править | править код]
- ↑ 1 2 3 4 Otezla (aprelimast) dosing, indications, interactions, adverse effects, and more. Medscape Reference. WebMD. Дата обращения: 28 марта 2014. Архивировано 17 октября 2014 года.
- ↑ CDER New Molecular Entity (NME) and Biologic Approvals Calendar Year 2014 (англ.). FDA. Дата обращения: 12 апреля 2020. Архивировано 6 апреля 2017 года.
- ↑ 1 2 OTEZLA- apremilast kit OTEZLA- apremilast tablet, film coated (англ.). DailyMed. U. S. National Library of Medicine.
- ↑ Одобрение в Евросоюзе (англ.). Дата обращения: 8 апреля 2015. Архивировано 2 апреля 2015 года.
- ↑ New Drug Therapy Approvals 2019 (англ.). FDA. Дата обращения: 3 ноября 2020. Архивировано 16 сентября 2020 года.
- ↑ Официальный сайт производителя. Дата обращения: 16 июля 2015. Архивировано 20 июля 2015 года.
- ↑ EMA (англ.). Дата обращения: 15 июля 2015. Архивировано 15 декабря 2020 года.
Содержание
- Состав, форма выпуска
- Инструкция по применению
- Противопоказания
- Побочные эффекты
- Результаты клинических исследований
- Цена, возможность приобрести
- Аналоги
- Отзывы
Для борьбы с таким заболеванием, как псориаз, используется новый препарат «Отезла» (Апремиласт). Клинические испытания смогли доказать его эффективность в сравнении с медикаментозными средствами, которые входят с ним в одну фармацевтическую группу.
Препарат работает в организме человека избирательно, оказывая лечебное действие на очаги поражения, не вызывая нарушения деления клеток.
Состав, форма выпуска
Действующее вещество Otezla — Апремиласт, относится к группе избирательных иммунодепрессантов, является селективным ингибитором фосфодиэстеразы в единственном экземпляре. Он способствует подавлению чрезмерной выработки медиаторов воспаления, которые принимают непосредственное участие в патогенезе псориаза и его осложнения — псориатического артрита.
Производитель препарата Celgene International Sarl, Швейцария. Средство выпускается в виде таблеток и имеет несколько дозировок:
- 10 мг — таблетки ромбовидной формы, окрашенные в розовый цвет с гравировкой «10» с одной стороны и APR — с другой;
- 20 мг — таблетки ромбовидной формы коричневого цвета с гравировкой «20» с одной стороны и APR — с другой;
- 30 мг — таблетки ромбовидной формы бежевого цвета с гравировкой «30» с одной стороны и APR — с другой.
Также существует два типа упаковок, в которых реализуется «Отезла»:
- Препарат для стартового лечения. Включает два блистера. В первом содержится 4 таблетки по 10 мг, 4 таблетки по 20 мг и 5 таблеток по 30 мг. Во втором блистере находится 14 таблеток по 30 мг. Примерная стоимость в России 21 тыс. рублей.
- Препарат для продолжения начатой терапии. Включает 4 блистера по 14 таблеток в номинальной дозировке 30 мг. Приблизительная цена в России составляет от 43 тыс. рублей.
Такие особенности выпуска медикаментозного средства обусловлены схемами лечения, более подробно о которых поговорим далее.
Инструкция по применению
Препарат «Отезла» назначается только в двух ситуациях:
- псориаз средней и тяжелой степени;
- псориатический артрит.
При этом важно учитывать, что данное лекарственное средство может быть использовано в качестве резервного, а не стартового, то есть исключительно в тех случаях, когда традиционные медикаменты, например «Метотрексат» или «Циклоспорин», не оказывают на заболевание должного эффекта.
Таблетки принимают целиком внутрь, запивая водой, независимо от приема пищи. Препарат не следует разжевывать или рассасывать во рту. Курс лечения заключается в титрировании дозировки медикамента, поэтому схему необходимо соблюдать обязательно, начиная терапию с малых доз и медленно их повышая. Рассмотрим, как это выглядит на практике.
Препарат работает в организме человека избирательно, оказывая лечебное действие на очаги поражения, не вызывая нарушения деления клеток.
Состав, форма выпуска
Действующее вещество Otezla — Апремиласт, относится к группе избирательных иммунодепрессантов, является селективным ингибитором фосфодиэстеразы в единственном экземпляре. Он способствует подавлению чрезмерной выработки медиаторов воспаления, которые принимают непосредственное участие в патогенезе псориаза и его осложнения — псориатического артрита.
Производитель препарата Celgene International Sarl, Швейцария. Средство выпускается в виде таблеток и имеет несколько дозировок:
- 10 мг — таблетки ромбовидной формы, окрашенные в розовый цвет с гравировкой «10» с одной стороны и APR — с другой;
- 20 мг — таблетки ромбовидной формы коричневого цвета с гравировкой «20» с одной стороны и APR — с другой;
- 30 мг — таблетки ромбовидной формы бежевого цвета с гравировкой «30» с одной стороны и APR — с другой.
Также существует два типа упаковок, в которых реализуется «Отезла»:
- Препарат для стартового лечения. Включает два блистера. В первом содержится 4 таблетки по 10 мг, 4 таблетки по 20 мг и 5 таблеток по 30 мг. Во втором блистере находится 14 таблеток по 30 мг. Примерная стоимость в России 21 тыс. рублей.
- Препарат для продолжения начатой терапии. Включает 4 блистера по 14 таблеток в номинальной дозировке 30 мг. Приблизительная цена в России составляет от 43 тыс. рублей.
Такие особенности выпуска медикаментозного средства обусловлены схемами лечения, более подробно о которых поговорим далее.
Инструкция по применению
Препарат «Отезла» назначается только в двух ситуациях:
- псориаз средней и тяжелой степени;
- псориатический артрит.
При этом важно учитывать, что данное лекарственное средство может быть использовано в качестве резервного, а не стартового, то есть исключительно в тех случаях, когда традиционные медикаменты, например «Метотрексат» или «Циклоспорин», не оказывают на заболевание должного эффекта.
Таблетки принимают целиком внутрь, запивая водой, независимо от приема пищи. Препарат не следует разжевывать или рассасывать во рту. Курс лечения заключается в титрировании дозировки медикамента, поэтому схему необходимо соблюдать обязательно, начиная терапию с малых доз и медленно их повышая. Рассмотрим, как это выглядит на практике.
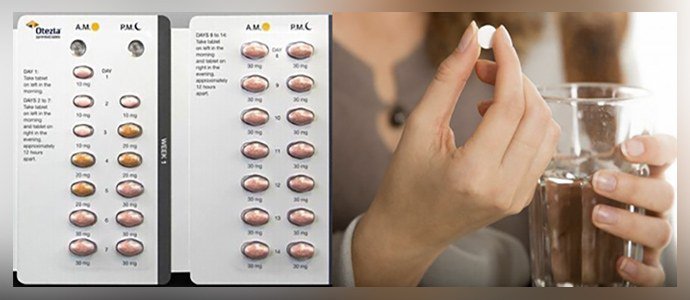
| Дни приема препарата | Утро | Вечер |
|---|---|---|
| Первый | 10 мг | — |
| Второй | 10 мг | 10 мг |
| Третий | 10 мг | 20 мг |
| Четвертый | 20 мг | 20 мг |
| Пятый | 20 мг | 30 мг |
| Шестой день и далее | 30 мг | 30 мг |
Средство принимают 2 раза в сутки — утром и вечером, желательно с соблюдением равных временных интервалов в 12 часов. При пропуске медикамента прием двух таблеток сразу недопустим.
Первые положительные результаты отмечаются спустя 6 месяцев после начала лечения. Если эффективность терапии отсутствует, важно обсудить этот вопрос с врачом и при необходимости пересмотреть целесообразность приема препарата «Отезла» и его дозировку.
Противопоказания
Ввиду избирательного действия на биохимическом уровне внутриклеточных структур препарат имеет небольшой перечень строгих ограничений к применению, что свидетельствует о его относительной безопасности.
Итак, перечислим основные противопоказания к использованию Otezla:
- беременность и грудное вскармливание;
- дети и подростки младше 18 лет;
- индивидуальная непереносимость препарата.
Будущие и кормящие мамы не должны применять данное лекарственное средство, так как на сегодняшний день точной информации о его безопасности для развивающегося плода и новорожденного нет. Клинические исследования подобного рода проведены не были.
Побочные эффекты
Специалисты подчеркивают, что вероятность возникновения нежелательных реакций со стороны организма при лечении препаратом «Отезла» минимальна. Несмотря на это, иногда такие эффекты все же встречались среди пациентов. К ним относятся:
- расстройства пищеварения (15%) — тошнота, рвота, диарея;
- инфекционные поражения верхних дыхательных путей (8%);
- головные боли (7%).
В некоторых случаях отмечалось развитие депрессивного состояния, бессонницы, аллергических реакций в виде отека Квинке и анафилактического шока, а также обострение имеющихся хронических патологий. Дальнейшее применение препарата «Отезла» при развитии побочных эффектов необходимо обсудить с лечащим врачом.
Результаты клинических исследований
Результативность и безопасность препарата доказаны в ходе масштабных клинических исследований, проведенных среди лиц, страдающих средней и тяжелой степенью псориаза и псориатическим артритом. Положительные итоги данной работы помогли зарегистрировать лекарственное средство на территории Российской Федерации.
Назначение Otezla при псориазе и псориатическом артрите качественно сокращает выраженность симптоматики этих патологических состояний, а именно снижает отечность, снимает боль в суставах, устраняет зуд, гиперемию кожных покровов и предупреждает разрастание воспалительных очагов.
Согласно мнению экспертов, в скором будущем именно препарат «Отезла» может занять лидирующие позиции в виде основной медикаментозной терапии псориаза благодаря своим преимуществам:
- удобный выпуск лекарства (таблетки);
- доказанный успех в борьбе с псориазом и псориатическим артритом;
- относительная безопасность средства, минимальное количество побочных эффектов и противопоказаний;
- отсутствие необходимости регулярного мониторинга лабораторных показателей пациента.
Стоит отметить, что высокая результативность и относительная безопасность препарата «Отезла» дали возможность проведения консервативной терапии у особых групп пациентов, которые страдают такими серьезными сопутствующими заболеваниями, как патологии сердца и сосудов, нарушения обмена веществ, сахарный диабет, недостаточность почек печени. Таким образом, эффективность и отсутствие риска являются ключевыми факторами, отличающими данное лекарственное средство от аналогичных препаратов, предназначенных для борьбы с псориазом и псориатическим артритом.
В 2014 году Otezla одобрили для применения в США и Европейском Союзе в качестве монопрепарата или его комбинации с противоревматическими медикаментами для лечения лиц с перечисленными ниже патологическими состояниями:
- псориаз;
- псориатический артрит;
- умеренный или тяжелый бляшковый псориаз.
С 2018 года «Отезла» входит в перечень ЖНВЛП (жизненно необходимые и важнейшие лекарственные средства).
Цена, возможность приобрести
Говоря о применении препарата и прочих особенностях, нельзя не обратить внимание на его стоимость. В России цена за упаковку таблеток держится на уровне более 20 тысяч рублей или 700 долларов, что весьма ощутимо для кошелька многих рядовых потребителей.
В обычных аптеках купить средство практически невозможно, но некоторые пациенты стараются найти выход из сложившейся ситуации и приобретают препарат «Отезла» с помощью интернета. Например, благодаря сайту onko24.com, где можно встретить заменители многих брендовых торговых марок фармакологических средств. По заявлению покупателей, низкая стоимость препаратов не означает их худшее качество, просто речь идет о дженериках, в разработку которых не было вложено дополнительных финансов. Они имеют одинаковые составляющие компоненты, но разное название с оригиналом.
Аналоги
Структурных аналогов у препарата нет. Рассмотрим, чем можно заменить «Апремиласт».
- таблетки «Неотигазон», F.Hoffmann La-Roche (Pateon), Канада. Назначаются при умеренной и тяжелой форме псориаза при условии, что другие лекарственные препараты оказались неэффективны. Средство является системным ретиноидом, действующее вещество — ацитретин. Продолжительность лечебного курса составляет не более 4 месяцев, при необходимости удлинить терапию рекомендуется сделать перерыв, на время заменив пилюли на наружные медикаменты. Стоимость «Неотигазона» составляет от 2200 рублей за упаковку;

- таблетки «Псорилом», ООО «Алкой», Россия. Иммуномодулирующий препарат, который назначается для лечения псориаза и псориатического артрита. Многие пациенты положительно отзываются о лекарственном средстве, подчеркивая, что его эффективность усиливается при одновременном использовании с гелями, спреями и шампунями данного производителя. «Псорилом» быстро устраняет зуд, шелушения и кожные высыпания, характерные для данного заболевания. Его стоимость в аптеках составляет от 570 рублей за упаковку.
Отзывы
Так как препарат «Отезла» относится к новым лекарственным средствам, реальных отзывов о нем еще немного. Специалисты оценивают медикамент с учетом его положительных качеств, в том числе эффективности и безопасности, доказанных в клинических условиях. Они рекомендуют использование препарата своим пациентам при наличии строгих показаний к применению.
Рассмотрим, какие отзывы встречаются от лиц, которые принимали данное средство.
Ольга, 38 лет. «О препарате «Апремиласт» узнала из Сети, прочитав описание к нему. Цена, конечно, кусается, но если есть возможность попробовать вылечить тяжелую форму псориаза, почему бы не рискнуть. Врач в клинике объяснила, что это принципиально новое средство, и подобрала схему терапии. Принимала препарат 3 месяца, только тогда заметила первые результаты, понимаю, что впереди предстоит долгий курс лечения».
Надежда, 35 лет. «Изучала информацию про препарат «Отезла» в течение длительного времени — начиталась много отзывов: и хороших, и плохих. Поняла, что нужно пробовать. Покупала напрямую из-за границы через интернет. Средство мне подошло, уже есть неплохие результаты спустя 6 недель приема препарата. Рекомендую».
«Отезла» применяется для борьбы с псориазом и псориатическим артритом при средней и тяжелой степени данных заболеваний. Медикамент обладает доказанной эффективностью, минимальным количеством побочных реакций и противопоказаний.
