Бетаферон — инструкция по применению
Синонимы, аналоги
Статьи
В настоящее время препарат не числится в Государственном реестре лекарственных средств или указанный регистрационный номер исключен из реестра.
РЕГИСТРАЦИОННЫЙ НОМЕР:
П N012097/01
ТОРГОВОЕ НАИМЕНОВАНИЕ ПРЕПАРАТА:
Бетаферон
МЕЖДУНАРОДНОЕ НЕПАТЕНТОВАННОЕ НАИМЕНОВАНИЕ:
Интерферон бета-1b
ЛЕКАРСТВЕННАЯ ФОРМА:
Лиофилизат для приготовления раствора для подкожного введения
СОСТАВ
Каждый флакон с активным компонентом содержит: Интерферон бета -1b (IFN- бета -1b) — 0,30 мг (соответствует 9,6 млн. МЕ), альбумин человеческий – 15,00 мг, маннитол – 15,00 мг.
В 1 мл приготовленного раствора содержится 0,25 мг (8,0 млн. МЕ) рекомбинантного интерферона бета-1b.
В 1 мл водного растворителя для приготовления раствора для инъекций содержится 5,4 мг натрия хлорида.
ОПИСАНИЕ
Лиофилизат: Лиофилизированная масса белого цвета.
Растворитель: Прозрачный практически бесцветный раствор.
Восстановленный раствор: Раствор от слегка опалесцирующего до опалесцирующего, бесцветный или светло-желтого цвета.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА
Цитокин. Средство для лечения рассеянного склероза.
КОД АТХ: L03AB08
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Интерфероны — белки, принадлежащие к семейству цитокинов и имеющие молекулярную массу от 15000 до 21000 дальтон. Существует три класса интерферонов: интерферон альфа, интерферон бета и интерферон гамма, имеющих различную, но частично совпадающую биологическую активность. Активность интерферона бета-1b является видоспецифичной, поэтому наиболее значимую фармакологическую информацию по интерферону бета-1b можно получить из исследований с культивируемыми человеческими клетками или в исследованиях in vivo у человека.
Активное вещество препарата Бетаферон (интерферон бета-1b) обладает противовирусной и иммуномодулирующей активностью. Механизмы действия интерферона бета-1b при рассеянном склерозе (РС) окончательно не установлены. Однако известно, что биологический эффект интерферона бета-1b опосредуется его взаимодействием со специфическими рецепторами, которые обнаружены на поверхности клеток человека. Связывание интерферона бета-1b с этими рецепторами индуцирует экспрессию ряда веществ, которые рассматриваются в качестве медиаторов биологических эффектов интерферона бета-1b. Содержание некоторых из этих веществ определяли в сыворотке и фракциях клеток крови больных, получавших интерферон бета-1b. Интерферон бета-1b снижает связывающую способность, а также усиливает интернализацию и деградацию рецепторов к гамма-интерферону. Кроме того, интерферон бета-1b повышает супрессорную активность мононуклеарных клеток периферической крови. Отдельные исследования по влиянию препарата Бетаферон на сердечно-сосудистую, дыхательную и эндокринную систему не проводились.
Клинические исследования:
Рецидивирующе-ремиттирующий рассеянный склероз
В клиническом исследовании, проводившемся у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом и способных передвигаться без посторонней помощи (базовое значение EDSS от 0 до 5,5), было показано, что лечение препаратом Бетаферон снижает частоту (на 30 %) и тяжесть клинических обострений болезни, число госпитализаций вследствие заболевания, а также удлиняет продолжительность ремиссии. Информация о влиянии терапии препаратом Бетаферон на продолжительность рецидива или появление симптомов между обострениями, а также на прогрессирование заболевания при рецидивирующе-ремиттирующем рассеянном склерозе отсутствует.
Вторично-прогрессирующий рассеянный склероз:
Было проведено два контролируемых клинических исследования с участием 1657 пациентов с вторично-прогрессирующим РС (базовое значение EDSS от 3 до 6,5, т.е. пациенты способны ходить). Пациенты с легкой степенью заболевания, а также пациенты, не способные передвигаться, в исследования включены не были. Результаты обоих исследований продемонстрировали противоречивые результаты по первичной конечной точке — времени до подтвержденного прогрессирования заболевания – в виде отсрочки прогрессирования нетрудоспособности.
В одном из двух исследований на фоне лечения препаратом Бетаферон была продемонстрирована статистически значимая отсрочка прогрессирования нетрудоспособности (соотношение рисков=0,69, 95 % доверительный интервал (0,55; 0,86), р=0,0010 соответствуют снижению риска на 31 % в результате терапии препаратом Бетаферон) и тяжелой инвалидности (т.е. когда больные вынуждены постоянно пользоваться инвалидным креслом) (соотношение рисков = 0,61, 95 % доверительный интервал (0,44; 0,85), р=0,0036 соответствуют снижению риска на 39 % в результате терапии препаратом Бетаферон). Этот эффект наблюдался на протяжении 33 месяцев у больных с любым индексом инвалидизации независимо от частоты рецидивов. Во втором исследовании с участием пациентов с вторично-прогрессирующим РС не отмечалось отсрочки наступления инвалидности в результате лечения препаратом Бетаферон. Существуют данные, свидетельствующие о том, что пациенты, включенные в данное исследование, находились на менее активной стадии заболевания по сравнению с пациентами, принимавшими участие в первом исследовании.
Данные ретроспективного мета-анализа обоих исследований показали общий статистически значимый эффект терапии (р=0,0076; 8 млн. МЕ препарата Бетаферон в сравнении с пациентами, получавшими плацебо).
Ретроспективный анализ, проведенный в подгруппах, показал, что лечение препаратом Бетаферон с большей вероятностью оказывает влияние на время наступления инвалидности у пациентов, имевших заболевание в активной форме до начала терапии (соотношение рисков 0,72, 95 % доверительный интервал (0,59; 0,88), р=0,0011 соответствуют снижению риска на 28 % в результате терапии препаратом Бетаферон у пациентов с рецидивами или выраженной прогрессией EDSS, 8 млн. МЕ препарата Бетаферон в сравнении с пациентами, получавшими плацебо). Данные ретроспективного анализа позволяют предположить, что рецидивы, а также выраженное прогрессирование по шкале EDSS (EDSS>1 балла или EDSS >0,5 балла для EDSS >6 в предыдущие два года) могут помочь выявить пациентов с активной формой заболевания.
В обоих исследованиях с участием пациентов с вторично-прогрессирующим рассеянным склерозом лечение препаратом Бетаферон снижало частоту клинических обострений на 30 %. Данных о влиянии терапии на продолжительность рецидивов отмечено не было.
Клинически изолированный синдром, позволяющий предположить рассеянный склероз
Было проведено одно контролируемое клиническое исследование у пациентов с клинически изолированным синдромом и результатами магнитно-резонансной томографии головного мозга (МРТ), позволяющими предположить наличие рассеянного склероза (по крайней мере, два очага, не проявляющихся клинически на Т2-взвешенных изображениях МРТ). В исследование включались пациенты с моноочаговым или многоочаговым началом заболевания (т.е. пациенты с клиническими проявлениями одного или, по меньшей мере, двух очагов поражения центральной нервной системы). Пациенты, имеющие симптомы любого заболевания, схожие с симптомами рассеянного склероза, исключались из исследования.
Данное исследование включало 2 фазы: плацебо-контролируемую фазу (плацебо в сравнении с препаратом Бетаферон) и следовавшую за ней заранее запланированную фазу наблюдения. Плацебо-контролируемая фаза продолжалась 2 года или до момента развития клинически достоверного рассеянного склероза (КДРС), в зависимости от того, что наступит раньше. После завершения плацебо-контролируемой фазы исследования пациенты переходили в фазу последующего заранее запланированного наблюдения, чтобы сравнить эффекты от раннего и позднего начала терапии препаратом Бетаферон. Сравнение проводилось у пациентов, первоначально рандомизированных в группу препарата Бетаферон («группа раннего начала терапии препаратом Бетаферон») и в группу плацебо («группа позднего начала терапии»).
Таблица 1.
Результаты первичной эффективности по данным исследования BENEFIT и результаты последующего наблюдения по данным исследования BENEFIT Follow—up.
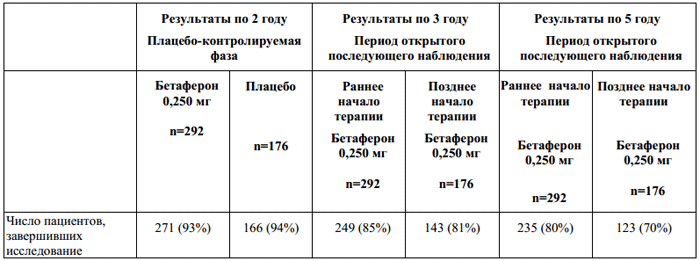
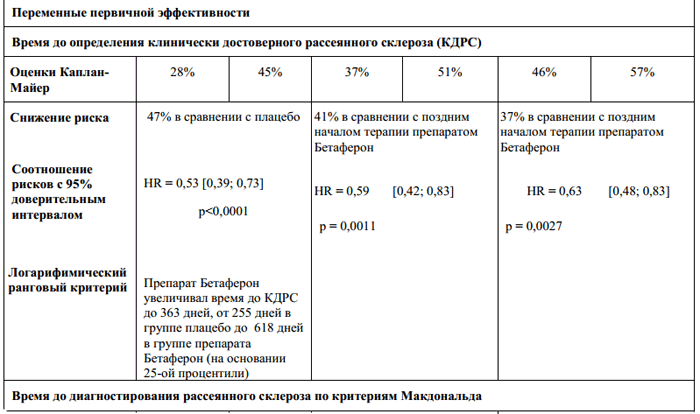
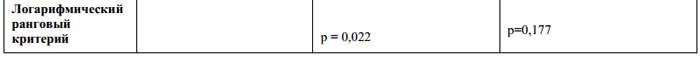
В плацебо-контролируемой фазе исследования препарат Бетаферон замедлял прогрессирование заболевания от первого клинического проявления до клинически достоверного рассеянного склероза. Терапия препаратом Бетаферон вызывала стабильну отсрочку прогрессирования рассеянного склероза по критериям Макдональда (Таблица 1).
Лечение препаратом Бетаферон оказывало эффект в отношении прогрессирования заболевания до КДРС во всех анализируемых подгруппах. У пациентов с моноочаговой формой и, как минимум, девятью очагами на Т2-взвешенных изображениях или Gd-усилением на исходной МРТ головного мозга риск прогрессирования заболевания до КДРС в течение 2-х лет был выше. У пациентов с многоочаговой формой сроки развития заболевания до КДРС не зависели от исходных показателей МРТ, что на осноосновании
клинических наблюдений указывало на высокий риск КДРС вследствие
прогрессирования заболевания. На данный момент не существует четкого определе
ния понятия «высокий риск». Более консервативный подход предполагает выявление, по крайней мере, девяти гиперинтенсивных очагов на Т2-взвешенных изображениях при первоначальном сканировании и, по крайней мере, одного нового очага на Т2-взвешенных изображениях или одного нового очага с Gd-усилением не менее чем через месяц после первоначального сканирования. В любом случае лечение должно назначаться только пациентам с высоким риском.
Высокий процент пациентов, завершивших исследование (93% из группы препарата Бетаферон), указывал на хорошую переносимость лечения препаратом Бетаферон. Для повышения переносимости препарата в начале терапии проводили титрование доз и введение нестероидных противовоспалительных препаратов. Более того, в течение всего исследования большинству пациентов введение препарата осуществлялось с помощью автоинжектора.
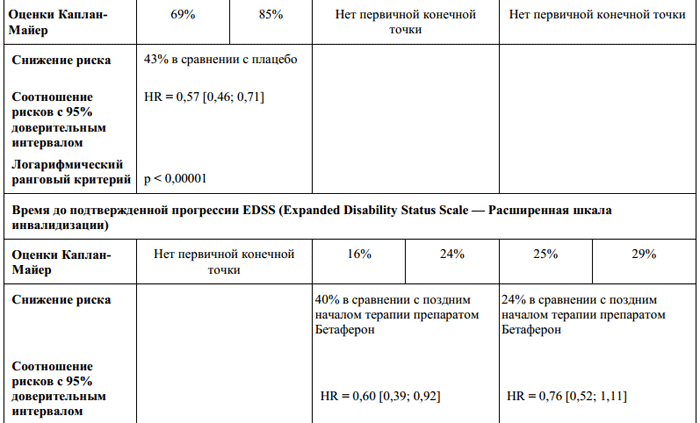
В последующей фазе открытого наблюдения было очевидно влияние терапии через 3 и 5 лет лечения (Таблица 1) даже при условии, что большинство пациентов группы плацебо получали лечение препаратом Бетаферон по крайней мере, начиная со второго года заболевания. В группе с ранним началом терапии препаратом Бетаферон (Таблица 1, выраженный эффект через 3 года, отсутствие значительного эффекта через 5 лет) прогрессирование заболевания по шкале EDSS (подтвержденное увеличение EDSS, как минимум на один бал по сравнению с исходным состоянием) было ниже. У большинства пациентов в обеих группах не наблюдалось прогрессирования нетрудоспособности в течение 5 лет. Для «раннего начала терапии» не было продемонстрировано устойчивого влияния на этот исходный параметр. Не было выявлено никаких преимуществ в отношении качества жизни, определяемого в соответствии с FAMS (Functional Assessment of MS – функциональная оценка рассеянного склероза: индекс лечение, исход), вследствие раннего начала терапии препаратом Бетафероном.
Рецидивирующе-ремиттирующий рассеянный склероз, вторично-прогрессирующий рассеянный склероз и клинически изолированный синдром, позволяющий предположить рассеянный склероз.
Результаты МРТ у пациентов с рассеянным склерозом продемонстрировали эффективность препарата Бетаферон и замедление течения болезни во всех исследованиях. По результатам оценки МРТ взаимосвязь течения рассеянного склероза и клинического исхода в настоящее время не выяснена.
Токсикологическая характеристика
Исследования острой токсичности не проводились. Поскольку грызуны нечувствительны к действию человеческого интерферона бета, оценка риска проводилась на основании исследований токсичности при повторных дозах у макак-резус. Наблюдалась транзиторная гипертермия, наряду с выраженным преходящим повышением концентрации лимфоцитов и преходящим снижением тромбоцитов и сегментоядерных нейтрофилов.
Длительные исследования токсичности не проводились. Исследования репродуктивной токсичности у макак-резус выявили токсичность для матери и увеличение частоты спонтанных абортов. У живого потомства не наблюдалось каких-либо пороков развития. Исследования влияния на фертильность не проводились. Не наблюдалось какого-либо влияния на эстральный цикл обезьян.
В одном отдельном исследовании генотоксичности (тест Амеса), не наблюдалось каких-либо мутагенных эффектов. Исследования канцерогенности не проводились. Тест клеточной трансформации in vitro не выявил какого-либо канцерогенного потенциала.
Фармакокинетика
Концентрацию интерферона бета-1b в плазме у пациентов и добровольцев определяли с помощью специфичного биологического анализа.
После подкожного введения 0,5 мг (16,0 млн. МЕ) интерферона бета-1b максимальная концентрация в плазме достигается через 1-8 часов после инъекции и составляет около 40 МЕ/мл. По данным различных исследований при внутривенном введении интерферона бета-1b клиренс и период его полувыведения из плазмы составляют в среднем 30 мл/мин/кг и 5 часов соответственно.
Введение препарата Бетаферон через день не приводит к повышению концентрации интерферона бета-1b в плазме крови, а его фармакокинетика в течение курса терапии не меняется.
При подкожном введении интерферона бета-1b абсолютная биодоступность составляет приблизительно 50%.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
• Клинически изолированный синдром (КИС) (единственный клинический эпизод демиелинизации, позволяющий предположить рассеянный склероз, при условии исключения альтернативных диагнозов) с достаточной выраженностью воспалительного процесса для назначения внутривенных кортикостероидов – для
замедления перехода в клинически достоверный рассеянный склероз (КДРС) у пациентов с высоким риском развития КДРС.
Общепринятого определения высокого риска нет. По данным исследования к группе высокого риска развития КДРС относятся пациенты с моноочаговым КИС (клиническими проявлениями 1 очага в ЦНС) и ≥ 9 очагов на Т2-взвешенных изображениях на МРТ и/или накапливающим контрастное вещество очагами. Пациенты с многоочаговым КИС (клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска развития КДРС независимо от количества очагов на МРТ.
• Рецидивируще-ремиттирующий рассеянный склероз (РРС) – для уменьшения частоты и тяжести обострений у амбулаторных больных (т.е. пациентов, способных ходить без посторонней помощи) при наличии в анамнезе не менее 2-х обострений за последние два года с последующим полным или неполным восстановлением неврологического дефицита.
• Вторично-прогрессирующий рассеянный склероз с активным течением заболевания, характеризующимся обострениями или выраженным ухудшением неврологических функций в течение последних двух лет – для уменьшения частоты и степени тяжести клинических обострений болезни, а также для замедления темпов прогрессирования заболевания.
ПРОТИВОПОКАЗАНИЯ
- Беременность.
- Грудное вскармливание.
- Реакции гиперчувствительности на природный или рекомбинантный интерферон бета в анамнезе и компоненты, входящие в состав препарата.
- Тяжелая депрессия и/или суицидальные мысли.
- Заболевания печени в стадии декомпенсации.
- Детский возраст до 18 лет (информация об эффективности и безопасности применения интерферона бета-1b у детей ограничена).
С ОСТОРОЖНОСТЬЮ
Препарат Бетаферон следует применять с осторожностью у пациентов со следующими заболеваниями:
- заболевания сердца, в частности, сердечная недостаточность III-IV функционального класса по классификации Нью-Йоркской Кардиологической Ассоциации (NYHA), кардиомиопатия;
- эпилептические припадки в анамнезе;
- моноклональная гаммапатия;
- анемия, тромбоцитопения, лейкопения;
- тяжелая почечная недостаточность.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ
Беременность
Информация о способности препарата Бетаферон вызывать повреждения плода при лечении беременных женщин или влиять на репродуктивную функцию человека ограничена. В контролируемых клинических исследованиях у больных рассеянным склерозом отмечались случаи самопроизвольного аборта. Применение препарата Бетаферон при беременности противопоказано.
Женщинам репродуктивного возраста во время терапии препаратом Бетаферон следует пользоваться надежными методами контрацепции. В случае наступления беременности во время лечения или при планировании беременности пациентка должна быть проинформирована о потенциальном риске для плода. В этом случае рекомендуется отменить применение препарата Бетаферон.
У пациенток с высокой частотой рецидивов в анамнезе перед началом терапии необходимо оценивать риск развития серьезного рецидива после прекращения лечения препаратом при наступлении беременности против возможного риска развития спонтанного аборта.
Период грудного вскармливания
Неизвестно, выделяется ли интерферон бета-1b с грудным молоком. Учитывая теоретическую возможность развития нежелательных реакций на препарат Бетаферон у младенцев, находящихся на грудном вскармливании, необходимо прекратить кормление грудью или отменить препарат.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Терапию препаратом Бетаферон следует начинать под наблюдением врача, имеющего опыт лечения рассеянного склероза.
Рекомендуемую дозу препарата Бетаферон 0,25 мг (8 млн. МЕ), которая содержится в 1 мл приготовленного раствора, вводят подкожно через день.
В начале лечения обычно рекомендуется провести титрование дозы. Лечение следует начинать с введения 0,0625 мг (0,25 мл) подкожно через день, постепенно увеличивая дозу до 0,250 мг (1,0 мл), вводимую также через день. Период титрования дозы может быть изменен в случае возникновения любой значимой нежелательной реакции. Для достижения достаточной эффективности терапии необходимо дозу 0,250 мг (1,0 мл) вводить через день.
Таблица для титрования дозы:
|
День лечения |
Доза в мг |
Объем препарата в мл |
|
1, 3, 5 |
0,0625 |
0,25 |
|
7, 9, 11 |
0,125 |
0,5 |
|
13, 15, 17 |
0,1875 |
0,75 |
|
≥ 19, 21, 23 и далее |
0,250 |
1,0 |
В клинических исследованиях длительность лечения у больных рецидивирующе-ремиттирующим и вторично-прогрессирующим рассеянным склерозом достигала 5 лет и 3 года соответственно.
При рецидивирующе-ремиттирующем рассеянном склерозе эффективность лечения препаратом Бетаферон была продемонстрирована на протяжении первых двух лет терапии. Имеющиеся данные по дополнительному 3-х летнему периоду терапии согласуются с данными по эффективности лечения препаратом Бетаферон на протяжении всего периода лечения.
У пациентов с клинически изолированным синдромом, позволяющим предположить рассеянный склероз, прогрессирование заболевания до КДРС было замедлено на период 5 лет.
Не рекомендуется проводить терапию препаратом Бетаферон у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом, имевшим менее двух рецидивов в течение последних 2-х лет, и у пациентов с вторично-прогрессирующим рассеянным склерозом, у которых не наблюдалось активной фазы заболевания за последние 2 года.
Лечение препаратом Бетаферон следует прекратить, если пациент не отвечает на терапию, например, наблюдается устойчивое прогрессирование заболевания в течение 6 месяцев по шкале EDSS (расширенная шкала инвалидизации) или, несмотря на лечение препаратом Бетаферон, требуется не менее трех курсов терапии АКТГ (адренокортикотропный гормон) или кортикостероидами в течение 1 года.
Приготовление инъекционного раствора
A. Упаковка препарата, содержащая флаконы и предварительно наполненные шприцы:
Для растворения лиофилизированного порошка интерферона бета-1b для инъекций используют прилагаемые готовый шприц с растворителем и иглу.
Б. Упаковка препарата, содержащая флаконы, предварительно наполненные шприцы, адаптер для флакона с иглой и спиртовые салфетки:
Для растворения лиофилизированного порошка интерферона бета-1b для инъекций используют прилагаемые готовый шприц с растворителем и адаптер для флакона с иглой.
Во флакон с препаратом Бетаферон вводят 1,2 мл растворителя (раствор натрия хлорида 0,54 %). Порошок должен раствориться полностью без встряхивания. Перед применением следует осмотреть готовый раствор, который должен быть от слегка опалесцирующего до опалесцирующего, бесцветного или светло-желтого цвета. При наличии частиц или изменении цвета раствора его нельзя применять.
Неиспользованный раствор следует выбросить.
В 1 мл готового раствора содержится 0,25 мг (8 млн. МЕ) интерферона бета-1b.
Необходимое в соответствии с титрованной дозой количество препарата набирают в шприц после приготовления раствора.
Техника самостоятельных инъекций для пациентов
Чтобы самостоятельно приготовить раствор препарата Бетаферон для инъекции и сделать укол, пожалуйста, внимательно прочитайте инструкции и выполняйте их поэтапно. Врач или медсестра ознакомят Вас с процедурой и техникой самостоятельных инъекций и помогут Вам в обучении. Не пытайтесь самостоятельно делать уколы до тех пор, пока Вы не будете уверены в том, что правильно поняли требования по приготовлению раствора, а также технику самостоятельных инъекций.
А. Упаковка препарата, содержащая флаконы и предварительно наполненные шприцы.
- Подготовка к инъекции.
- Введение необходимого объема растворителя (1,2 мл) во флакон с препаратом Бетаферон.
- Набор необходимого объема раствора для инъекции (1,0 мл) в шприц.
Подготовка к инъекции
1. Перед тем как сделать укол, соберите все необходимое для инъекции.
Для этого Вам потребуются:
- заполненный шприц с растворителем препарата Бетаферон (0,54% раствор натрия хлорида)
- флакон с препаратом Бетаферон
- игла 21G
- игла 30G
- спиртовые салфетки
- контейнер для использованных шприцов и игл
2. Тщательно вымойте руки с мылом.
3. Снимите защитный колпачок с флакона с препаратом Бетаферон.
4. Протрите спиртовой салфеткой крышку флакона с препаратом Бетаферон (протирайте в одном направлении и используйте одну салфетку).
ПРИМЕЧАНИЕ: оставьте спиртовую салфетку на крышке флакона и не снимайте ее до тех пор, пока не будете готовы использовать флакон.
Введение необходимого объема растворителя (1,2 мл) во флакон с препаратом Бетаферон
ПРИМЕЧАНИЕ: возьмите флакон с препаратом Бетаферон и выбросьте находящуюся сверху спиртовую салфетку.
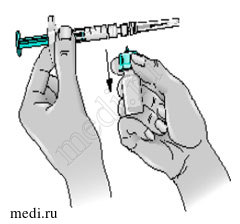
1. Держа руки на устойчивой поверхности, выньте шприц с растворителем из упаковки. Потянув за крышку, снимите ее с основания шприца. Не дотрагивайтесь до открытого кончика шприца. Не надавливайте на поршень.
2. Выньте иглу 21G из упаковки и плотно насадите ее на кончик шприца. Снимите с иглы защитный колпачок. Не дотрагивайтесь до иглы.
3. Установив флакон с препаратом Бетаферон на устойчивой поверхности, медленно введите иглу шприца (содержащего 1,2 мл растворителя) до конца через пробку флакона.
4. Медленно надавливайте на поршень. Игла должна быть направлена в сторону так,
чтобы жидкость стекала по стенке флакона (если ввести растворитель прямо в
порошок, то образуется много пены).
5. Следите за тем, чтобы игла не соприкасалась с порошком или образующимся
раствором.
6. Когда Вы введете все содержимое шприца во флакон с препаратом Бетаферон, удерживайте флакон между большим, указательным и средним пальцами так, чтобы игла и шприц находились на руке.
7. Осторожно повертите флакон в руке для полного растворения порошка препарата Бетаферон. НЕ ВСТРЯХИВАЙТЕ!
8. Внимательно осмотрите раствор (он должен быть прозрачным).
ПРИМЕЧАНИЕ: если смесь содержит частицы или поменяла цвет, вылейте ее и начните всю процедуру с начала.
Набор необходимого объема раствора для инъекций (1,0 мл) в шприц
ПРИМЕЧАНИЕ: перед набором приготовленного раствора полностью выжмите поршень шприца, чтобы удалить воздух, который, возможно, остался внутри шприца.
1. Слегка наклоните флакон с раствором препарата Бетаферон и установите кончик иглы в
самой нижней точке флакона.
ПРИМЕЧАНИЕ: следите за тем, чтобы кончик иглы все время находился в растворе.
2. Потяните поршень и наберите в шприц 1,0 мл жидкости до метки.
3. Переверните флакон вверх дном и держите шприц иглой вверх.
4. Осторожно постучите по шприцу, чтобы пузырьки воздуха переместились в верхнюю часть цилиндра.
5. Осторожно надавите на поршень, чтобы из шприца вышел ТОЛЬКО ВОЗДУХ.
6. Отделите шприц от иглы. Иглу оставьте во флаконе.
7. Положите шприц (без иглы) на ровную поверхность. Следите за тем, чтобы кончик шприца не касался поверхности.
8. Возьмите иглу 30G, выньте ее из упаковки и плотно насадите на кончик шприца.
9. Флакон с остатками раствора и иглой выбросьте.
ПРИМЕЧАНИЕ: Препарат следует вводить подкожно сразу после приготовления раствора. Если инъекция откладывается, то раствор следует хранить в холодильнике и использовать в течение 3 ч. Раствор нельзя замораживать. Теперь Вы готовы сделать инъекцию.
Б. Упаковка препарата, содержащая флаконы, предварительно наполненные шприцы адаптер для флакона с иглой и спиртовые салфетки.
Этапы приготовления раствора:
1 — Перед началом процедуры тщательно вымойте руки с мылом.
2 — Откройте флакон с препаратом Бетаферон — лучше не ногтем, поскольку он может сломаться, а большим пальцем — и поставьте на стол.
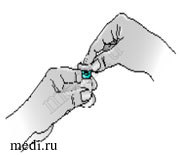
3 — Протрите спиртовой салфеткой крышку флакона. Передвигайте салфетку только в одном направлении, а затем оставьте ее на крышке флакона.
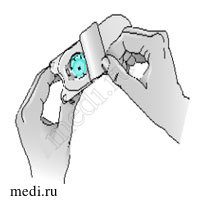
4 – Откройте блистерную упаковку, в которой находится адаптер для флакона, но адаптер оставьте внутри.
Не вынимайте адаптер для флакона из блистерной упаковки.
Кроме того, следите за тем, чтобы не прикасаться к адаптеру для флакона. Важно, чтобы он оставался стерильным.
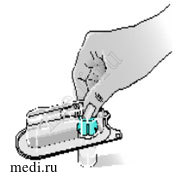
5 – В процессе присоединения адаптера держите флакон на ровной поверхности.
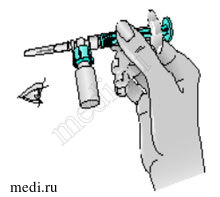
6 — Снимите спиртовую салфетку с крышки флакона препарата Бетаферон. Поместите на крышку флакона блистерную упаковку, в которой содержится приспособление для переноса раствора с адаптером для флакона. Надавите на блистер большим и указательным пальцами или ладонью до щелчка.
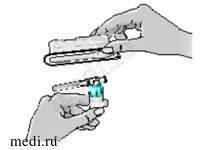
7 — Взяв за края блистерной упаковки, снимите ее с адаптера флакона. Теперь Вы готовы к тому, чтобы присоединить предварительно заполненный шприц с растворителем к приспособлению для переноса раствора.
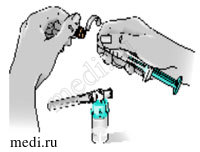
8 — Возьмите шприц. Перекрутите оранжевый колпачок на кончике шприца и, потянув за него, снимите со шприца. Выбросьте колпачок.
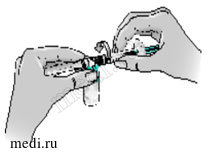
9 — Присоедините шприц к отверстию на боковой стороне адаптера, введя в него кончик шприца и осторожно закрепив путем нажатия с одновременным поворотом по часовой стрелке (как показано стрелкой), чтобы получилась сборная конструкция со шприцем.
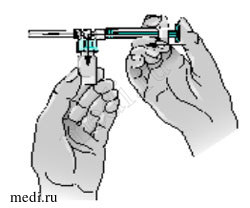
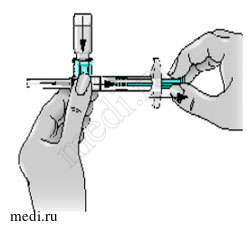
10 — Удерживайте конструкцию со шприцем за дно флакона. Медленно надавите до отказа на поршень шприца, чтобы переместить весь растворитель во флакон. Отпустите поршень. При этом поршень может вернуться в свое первоначальное положение.
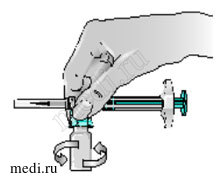
11 — Сделайте несколько острожных вращательных движений флаконом, чтобы сухой порошок препарата Бетаферон полностью растворился. При этом конструкция со шприцем остается все еще присоединенной к флакону.
Не встряхивайте флакон.
12 — Внимательно осмотрите раствор. Он должен быть прозрачным и не содержать никаких частиц. Если
раствор поменял цвет или содержит частицы, вылейте его и начните всю процедуру с начала, взяв новую упаковку принадлежностей. Если появилась пена – что может случиться, если флакон встряхивать или
слишком сильно вращать – дайте флакону постоять, пока пена не осядет.
Подготовка шприца
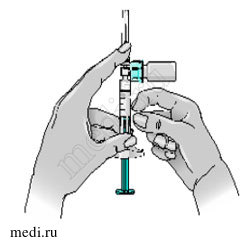
13 — Если поршень вернулся в свое первоначальное положение, снова протолкните его внутрь и зафиксируйте. Для подготовки инъекции переверните конструкцию, так чтобы флакон находился сверху, а крышка флакона была направлена вниз. Это позволит раствору стечь в шприц.
Держите шприц горизонтально.
Медленно оттяните поршень, чтобы набрать весь раствор из флакона в шприц.
14 — Поверните конструкцию со шприцем таким образом, чтобы игла была направлена вверх. Это заставит пузырьки воздуха подняться к поверхности раствора.
15 — Удалите пузырьки воздуха, осторожно постучав по шприцу и переместив поршень к отметке 1 мл или того
объема, который был назначен врачом.
Если вместе с пузырьками воздуха во флакон было вытеснено слишком много раствора, немного оттяните поршень назад, чтобы вновь набрать раствор из флакона обратно в шприц. Делайте это до тех пор, пока весь воздух не будет удален, и в шприце не будет содержаться 1 мл приготовленного раствора.
Важное замечание: Набирая раствор повторно, верните конструкцию со шприцем в горизонтальное положение, при котором флакон находится сверху.
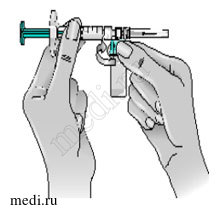
16 — После этого возьмитесь за синий адаптер флакона вместе с присоединенным к нему флаконом,
поверните адаптер на себя, а затем отделите его от шприца.
Отделяя адаптер с флаконом от шприца, беритесь только за синий пластиковый адаптер. Держите шприц в горизонтальном положении; флакон должен находиться под шприцем.
17 — В результате отсоединения флакона и адаптера от шприца обеспечивается вытекание раствора из иглы во время инъекции.
18 — Теперь Вы готовы сделать инъекцию.
ПРИМЕЧАНИЕ: Препарат следует вводить подкожно сразу после приготовления раствора. Если инъекция откладывается, то раствор следует хранить в холодильнике и использовать в течение 3 ч. Раствор нельзя замораживать.
19 — Флакон и оставшийся неиспользованный раствор выбросьте в контейнер для
отходов.
Краткое описание подготовки препарата к инъекции
1. Достаньте содержимое из упаковки.
2. Прикрепите к флакону адаптер для флакона.
3. Присоедините шприц к адаптеру флакона.
4. Надавите на поршень, чтобы переместить растворитель во флакон.
5. Переверните сборную конструкцию со шприцем, затем оттяните поршень.
6. Отделите флакон от шприца – теперь Вы готовы сделать инъекцию.
ПРИМЕЧАНИЕ: Препарат следует вводить подкожно сразу после приготовления раствора. Если инъекция откладывается, то раствор следует хранить в холодильнике и использовать в течение 3 ч. Раствор нельзя замораживать.
Выбор и подготовка места для инъекции и введение раствора препарата
Бетаферон (1,0 мл) подкожно
- Выбор места инъекции
Препарат Бетаферон (интерферон бета-1b) следует вводить подкожно. Для этого лучше всего подходят мягкие места, расположенные вдали от суставов и нервов.
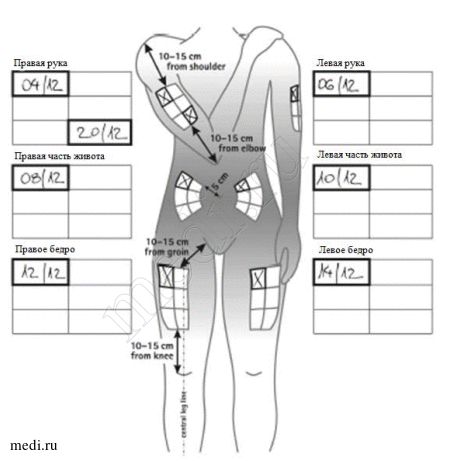
Места инъекции можно выбирать с помощью рисунка. Лучше всего сначала определить место инъекции, а затем готовить шприц.
Если Вам трудно дотянуться до какого-либо места, попросите помощи у человека, который умеет делать уколы.
1 — Выберите место инъекции (см. рисунок «Схема чередования выполненных инъекций» в конце инструкции).
ВАЖНОЕ ПРИМЕЧАНИЕ: Не делайте инъекцию в те места, где присутствуют бугорки, припухлости, твердые узлы или болезненные ощущения. Кроме того, не следует вводить раствор в те участки, где имеются изменения цвета кожи, углубления, корочки, или нарушена целостность кожи. Если Вы обнаружите у себя эти или другие необычные состояния, обратитесь к своему лечащему врачу.
2 — Протрите кожу в месте инъекции спиртовой салфеткой и дождитесь, пока кожа высохнет под воздействием воздуха. Выбросьте салфетку.
Для дезинфекции кожи используйте подходящее дезинфицирующее средство.
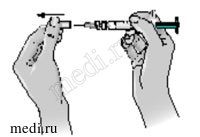
3 — Снимите с иглы защитный колпачок. Потяните за колпачок, а не перекручивайте его.
4 — Осторожно защипните кожу вокруг продезинфицированного участка (чтобы немного приподнять ее).
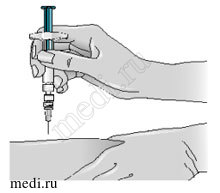
5 — Резким уверенным движением вонзите иглу прямо в кожу под углом 90°. Держите шприц как карандаш или
дротик.
6 — Медленно введите раствор, плавно и непрерывно надавливая на поршень. (Надавливайте на поршень до упора, пока шприц не опустеет).
7- Выбросьте шприц в контейнер для отходов.
- Чередование мест инъекции
Каждый раз необходимо выбирать новое место для инъекции, так как чередование мест инъекции позволяет коже восстановиться, а также помогает предотвратить попадание инфекции. Лучше заранее выбирать место инъекции и только затем готовить шприц. Схема, приведенная на рисунке, поможет Вам правильно чередовать места инъекции. Например, если первую инъекцию Вы сделали в правую половину живота, то вторую сделайте в левую половину, третью – в правое бедро и т.д. в соответствии со схемой до тех пор, пока Вы не используете все возможные участки для инъекций. Записывайте, куда и когда Вы сделали последнюю инъекцию.
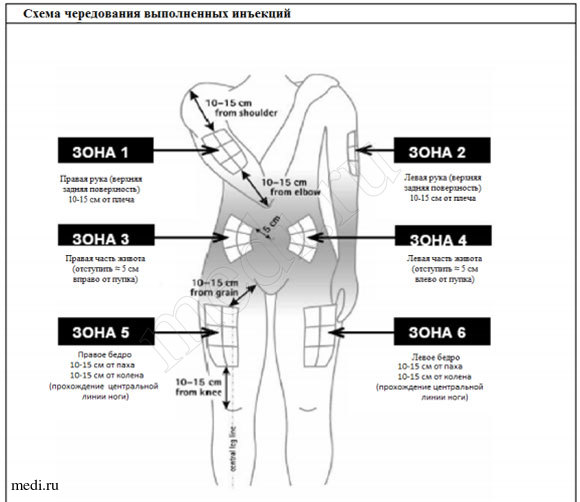
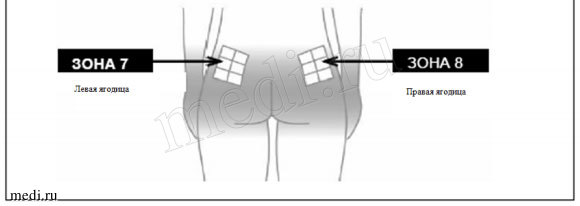
Следуя предложенной схеме, после 8-ой инъекций (через 16 дней) Вы вновь вернетесь к месту первой инъекции (например, правой половине живота). Это называется «циклом чередования». В схеме, приводимой нами в качестве примера, каждая зона в свою очередь разделена на 6 участков для инъекций (что в целом составляет 48 участков для инъекций): левая и правая, верхняя, центральная и нижняя части соответствующей зоны. Когда после одного цикла чередования Вы вернетесь к одной из зон, выбирайте как можно более отдаленный участок для инъекции в этой зоне. Если какая-либо зона стала болезненной, то обсудите с врачом другие возможные места инъекций.
Схема чередования:
С целью помочь себе правильно чередовать места инъекций, рекомендуется записывать, когда и в какой участок была сделана инъекция. Для этого Вы можете использовать следующую схему чередования:
1-ый цикл чередования Первые 8 инъекций делают последовательно с 1-ой зоны по 8-ю зону, используя только верхний левый сегмент каждой зоны.
2-ой цикл чередования Следующие 8 инъекций начинают снова с 1-ой зоны, но делать их нужно в нижний правый сегмент каждой зоны.
3-ий цикл чередования Следующие 8 инъекций в этом цикле начинают с 1-ой зоны и выполняют по очереди в центральные левые сегменты каждой зоны.
При соблюдении этой последовательности у каждой зоны будет возможность полностью восстановиться перед следующей инъекцией.
Регистрация выполненных инъекций
Инструкция по учету мест и дат выполненных инъекций
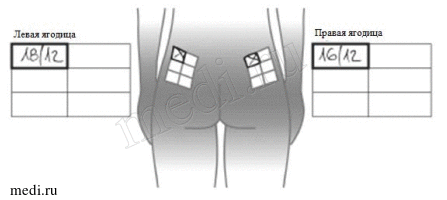
Выберите место инъекции. Если Вы уже пользуетесь препаратом Бетаферон, то начните с той зоны, которая не использовалась в течение последнего цикла чередования, т.е. в течение последних 16 дней.
Сделав инъекцию, запишите использованный участок и дату выполненной инъекции (см. рисунок «Пример регистрации выполненных инъекций» в конце инструкции по применению).
ПОБОЧНОЕ ДЕЙСТВИЕ
Возникновение нежелательных реакций обычно сопутствует началу терапии. Частота их возникновения снижается с течением времени.
Наиболее часто может возникать комплекс гриппоподобных симптомов (лихорадка, озноб, артралгия, общее недомогание, потливость, головная боль или миалгия), обусловленный фармакологическим действием препарата Бетаферон. Рекомендуется проводить титрование дозы в начале лечения. Выраженность гриппоподобных симптомов можно ослабить, применяя нестероидные противовоспалительные препараты.
Часто у пациентов после введения препарата Бетаферон в дозе 0,25 мг (8 млн. МЕ) возникают реакции в месте введения (например, покраснение, отек, изменение цвета кожи, воспаление, боль, гиперчувствительность, некроз и неспецифические реакции).
Частота реакций в месте введения может быть снижена при использовании устройства для автоматического введения препарата.
Неблагоприятные реакции (НР) при применении препарата Бетаферон, наблюдавшиеся в ходе клинических исследований и выявленные в процессе пострегистрационного наблюдения, и частота их встречаемости представлены ниже.
Для описания конкретной реакции, ее синонимов и связанных с нею состояний используется наиболее подходящий термин из Медицинского словаря для регуляторной деятельности (MedDRA).
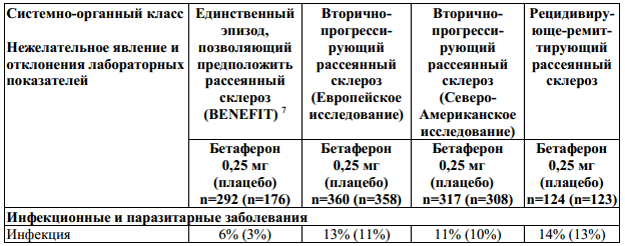
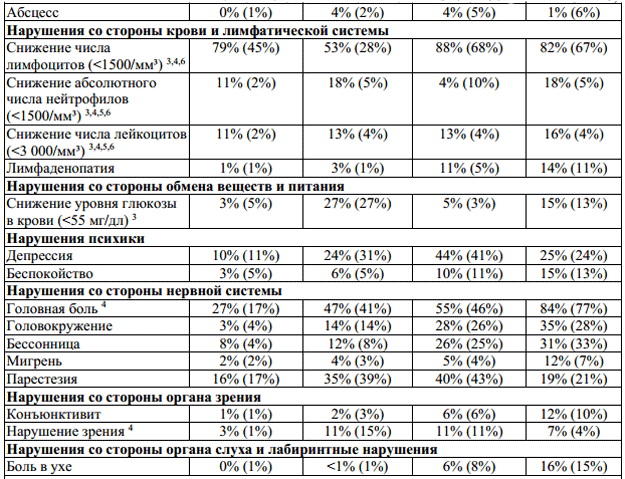
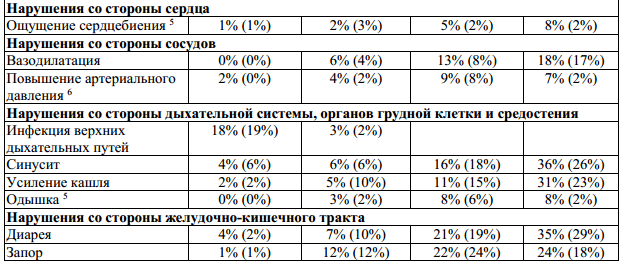
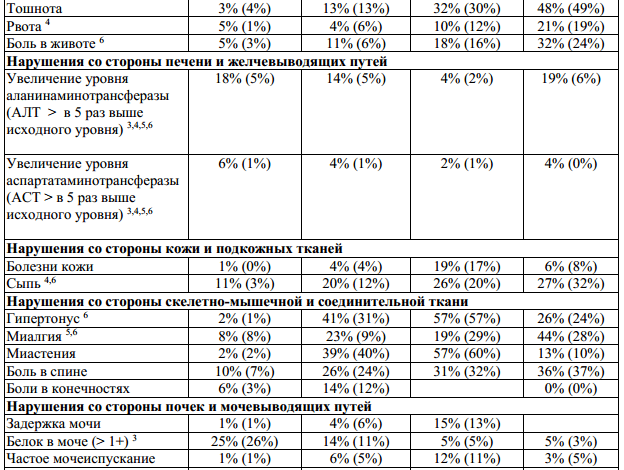
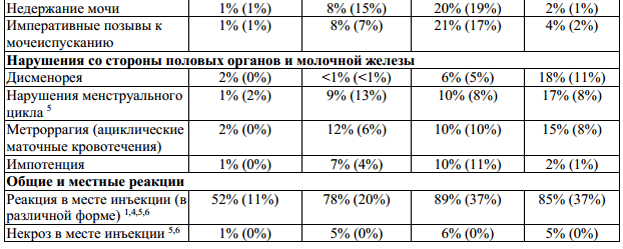
Таблица 1: Неблагоприятные явления и отклонения лабораторных показателей, наблюдавшиеся в ходе клинических испытаний с коэффициентом возникновения ≥ 10% и с соответствующим процентным показателем для группы плацебо. Побочные эффекты с коэффициентом возникновения < 10%, появление которых очевидно связано с применением препарата.
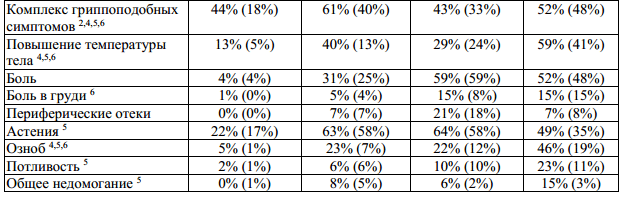
Примечания:
1— все нежелательные явления, возникающие в месте инъекции: кровоподтек,
гиперчувствительность, воспаление, уплотнение в месте инъекции, некроз, боль, реакция
в месте инъекции, отек, атрофия тканей;
2— комплекс гриппоподобных симптомов, обозначенный как гриппоподобный
синдром, включающий, по меньшей мере, два из следующих нежелательных явлений:
лихорадка, озноб, миалгия, недомогание и потливость;
3 — отклонение от нормы лабораторных показателей;
4 — нежелательные явления, в значительной мере связанные с применением препарата
Бетаферон у пациентов с клинически изолированным синдромом, позволяющим
предположить рассеянный склероз, p < 0,05;
5 — нежелательные явления, в значительной мере связанные с применением препарата
Бетаферон у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом,
p < 0,05;
6 — нежелательные явления, в значительной мере связанные с применением препарата
Бетаферон у пациентов с вторично-прогрессирующим рассеянным склерозом, p < 0,05;
7 — в ходе клинического исследования BENEFIT не наблюдалось изменений в профиле
безопасности препарата Бетаферон.
Таблица 2:
Неблагоприятные реакции, выявленные в процессе пострегистрационных наблюдений, и для которых частота встречаемости установлена, определены на основе объединенных данных клинических исследований (N = 1093). Частота встречаемости определена как: «очень часто» (> 1/10) и «часто» (от > 1/100 до < 1/10), «нечасто» (от > 1/1000 до < 1/100), «редко» (от > 1/10000 до < 1/1000). Для НР, выявленных в процессе пострегистрационных наблюдений, и для которых частота встречаемости не установлена, указано «частота неизвестна».
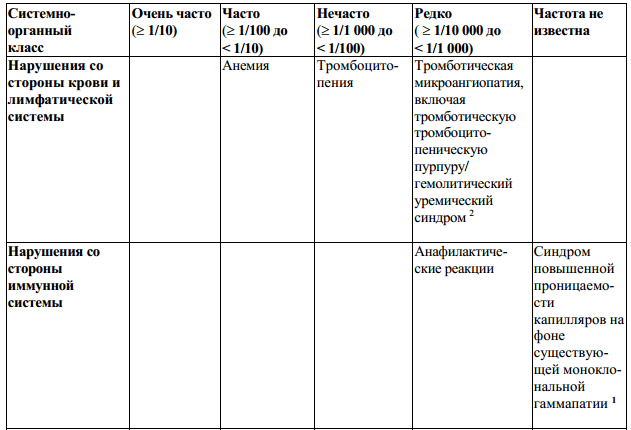
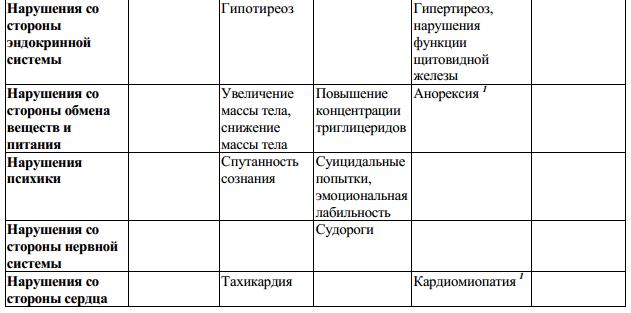
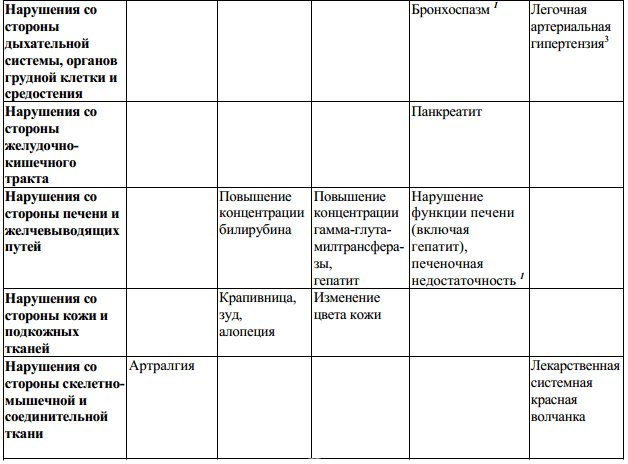

Примечания:
1– неблагоприятные реакции, выявленные только в процессе пострегистрационных
наблюдений;
2 – относится ко всем препаратам, содержащим интерферон бета;
3 – относится ко всем препаратам, содержащим интерферон (см. последующий
комментарий).
Легочная артериальная гипертензия
Имеются сообщения о случаях возникновения легочной артериальной гипертензии (ЛАГ) при применении препаратов с содержанием интерферона бета. Возникновение заболевания отмечалось в различные периоды лечения, в том числе через несколько лет после начала терапии интерфероном бета.
Пациентам и врачам необходимо информировать представительство компании-производителя о подозрении на нежелательные реакции, связанные с применением препарата Бетаферон, с целью отслеживания соотношения пользы и риска.
ПЕРЕДОЗИРОВКА
При введении препарата Бетаферон внутривенно в дозе до 5,5 мг (176 млн. МЕ) три раза в неделю взрослым пациентам с онкологическими заболеваниями не было выявлено серьёзных нежелательных явлений.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ И ДРУГИЕ ФОРМЫ ВЗАИМОДЕЙСТВИЯ
Специальные исследования взаимодействия препарата Бетаферон с другими препаратами не проводились.
Влияние препарата Бетаферон в дозе 0,25 мг (8 млн. МЕ) через день на метаболизм лекарственных средств у больных рассеянным склерозом неизвестен.
На фоне применения препарата Бетаферон глюкокортикостероиды и АКТГ, назначаемыена срок до 28 дней при лечении обострений, переносятся хорошо. Применение препарата Бетаферон одновременно с другими иммуномодуляторами, помимо кортикостероидов или АКТГ, не изучалось и, следовательно, не рекомендуется.
Интерфероны снижают активность печеночных цитохром Р450-зависимых ферментов у человека и животных. Необходимо соблюдать осторожность при назначении препарата Бетаферон в комбинации с лекарственными препаратами, имеющими узкий терапевтический индекс, клиренс которых в значительной степени зависит от печеночной системы цитохрома Р450 (например, противоэпилептические средства). Специальные исследования на совместимость препарата Бетаферон с противоэпилептическими средствами не проводились. Необходимо также соблюдать осторожность при одновременном применении любых препаратов, влияющих на систему кроветворения. Ввиду отсутствия исследований на совместимость данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
ОСОБЫЕ УКАЗАНИЯ
Иммунные нарушения
Применение цитокинов у больных с моноклональной гаммапатией иногда сопровождалось системным повышением проницаемости капилляров с развитием шока и летальным исходом.
Желудочно-кишечные нарушения
В редких случаях на фоне применения препарата Бетаферон наблюдалось развитие панкреатита, в большинстве случаев связанное с наличием гипертриглицеридемии.
Заболевания нервной системы
Следует проявлять осторожность при назначении препарата Бетаферон больным с депрессивными расстройствами в настоящее время или в анамнезе, в особенности пациентам с суицидальными мыслями в анамнезе. Депрессии и суицидальные мысли чаще встречаются у пациентов с рассеянным склерозом, чем в общей популяции, и связаны с применением интерферона.
Пациенты должны быть проинформированы о том, что в случае возникновения депрессии и суицидальных мыслей они должны сообщать об этом лечащему врачу немедленно.
Пациенты, проявляющие депрессию должны находиться под тщательным наблюдением, а терапию препаратом Бетаферон следует соответствующим образом корректировать.
Необходимость продолжения лечения препаратом Бетаферон должна быть пересмотрена. Препарат Бетаферон необходимо применять с осторожностью у пациентов с судорогами в анамнезе и у пациентов, принимающих противосудорожные препараты, в особенности, если контролировать эпилепсию данными препаратами не удается (см. разделы «Побочное действие», «Взаимодействие с другими лекарственными препаратами и другие формы взаимодействия»).
Данный препарат содержит человеческий альбумин, и по этой причине существует весьма незначительный риск передачи вирусных заболеваний. Нельзя исключить риск передачи болезни Крейтцфельдта-Якоба.
Изменения лабораторных показателей
Пациентам с дисфункцией щитовидной железы рекомендуется проверять функцию щитовидной железы регулярно, а в остальных случаях – по клиническим показаниям.
Кроме стандартных лабораторных анализов, назначаемых при ведении пациентов с рассеянным склерозом, перед началом терапии препаратом Бетаферон, а также регулярно во время проведения лечения рекомендуется проводить развернутый анализ крови, включая определение лейкоцитарной формулы, числа тромбоцитов и биохимического анализа крови, а также проверять функцию печени (например, активность аспартат-аминотрансферазы (АСТ), аланин-аминотрансферазы (АЛТ) и гамма-глутамилтрансферазы (γ-ГТ)).
При ведении пациентов с анемией, тромбоцитопенией, лейкопенией (по отдельности или в комбинации) может потребоваться более тщательный мониторинг развернутого анализа крови, включая определение количества эритроцитов, лейкоцитов, тромбоцитов и лейкоцитарной формулы. Пациенты с нейтропенией должны находиться под тщательным наблюдением на предмет повышения температуры или развития инфекции. Имеются сообщения о случаях тромбоцитопении с выраженным снижением числа тромбоцитов.
Нарушения функции печени и желчевыводящих путей
Клинические исследования показали, что терапия препаратом Бетаферон часто может приводить к бессимптомному повышению активности печеночных трансаминаз, которое в большинстве случаев выражено незначительно и носит преходящий характер. Имеются редкие сообщения о случаях тяжелого поражения печени, включая печеночную недостаточность при применении интерферонов бета. Наиболее тяжелые случаи отмечались у пациентов, подвергшихся воздействию гепатотоксичных лекарственных препаратов или веществ, а также при некоторых сопутствующих заболеваниях (например, злокачественные новообразования с метастазированием, тяжелые инфекции и сепсис, злоупотребление алкоголем).
При лечении препаратом Бетаферон необходимо осуществлять мониторинг функции печени (включая оценку клинической картины). Повышение активности трансаминаз в сыворотке крови требует тщательного наблюдения и обследования. При значительном повышении активности трансаминаз в плазме крови или появлении признаков поражения печени (например, желтухи) следует отменить препарат. При отсутствии клинических признаков поражения печени или после нормализации активности «печеночных» ферментов возможно возобновление терапии препаратом Бетаферон с наблюдением за функцией печени.
Нарушения функции почек и мочевыводящих путей
Препарат Бетаферон необходимо применять с осторожностью у больных с тяжелой почечной недостаточностью под тщательным наблюдением.
Нефротический синдром
Имеются сообщения о случаях возникновения нефротического синдрома с различными нефропатиями, включая фокальный сегментарный гломерулосклероз (ФСГС), болезнь минимальных изменений (БМИ), мембранопролиферативный гломерулонефрит (МПГН) и мембранозную нефропатию (МН), при лечении препаратами, содержащими интерферон бета. Возникновение заболевания отмечалось как в различные периоды во время лечения, так и через несколько лет после начала терапии интерфероном бета. Рекомендуется регулярно проверять появление ранних симптомов, таких как отечность, протеинурия и нарушение функции почек, особенно у пациентов, имеющих высокий риск развития заболевания почек. Лечение нефротического синдрома следует назначать на раннем этапе, а необходимость продолжения лечения препаратом Бетаферон должна быть пересмотрена.
Заболевания сердечно-сосудистой системы
Препарат Бетаферон необходимо применять с осторожностью у больных с заболеваниями сердца. Пациенты с тяжелыми заболеваниями сердца, в частности, с клинически выраженной хронической сердечной недостаточностью с отчетливой симптоматикой застоя жидкости, ишемической болезнью сердца или аритмией, должны находиться под контролем врача для своевременного выявления возможного ухудшения состояния, особенно в начале лечения.
Хотя доказательства прямого кардиотоксического действия препарата Бетаферон отсутствуют, гриппоподобные симптомы, обычно возникающие при введении интерферонов бета, могут быть провоцирующим фактором у пациентов с тяжелыми заболеваниями сердца.
В период пострегистрационного применения очень редко сообщалось об ухудшении кардиального статуса у пациентов с тяжелыми заболеваниями сердца, связанном с началом применения препарата Бетаферон. Поступали редкие сообщения о случаях развития кардиомиопатии. Если предполагается, что развитие кардиомиопатии связано с применением препарата, то лечение препаратом Бетаферон следует прекратить.
Тромботическая микроангиопатия (ТМАП)
Имеются сообщения о случаях тромботической микроангиопатии, которая проявлялась в виде тромботической тромбоцитопенической пурпуры (ТТП) или гемолитического уремического синдрома (ГУС), в том числе с летальным исходом, при лечении препаратами с содержанием интерферона бета. Возникновение заболевания отмечалось как в различные периоды лечения, так и через несколько недель и даже лет после начала терапии интерфероном бета. К первым клиническим признакам относятся тромбоцитопения, новый эпизод артериальной гипертензии, лихорадка, симптомы со стороны центральной нервной системы (например, спутанность сознания, парез) и нарушение функции почек. Лабораторные показатели, такие, как снижение количества тромбоцитов, повышение лактатдегидрогеназы (ЛДГ) в плазме позволяют предположить возникновение тромботической микроангиопатии (ТМАП) в связи с активацией гемолиза и обнаружение шизоцитов (фрагменты эритроцитов) в мазке крови. При появлении клинических признаков ТМАП необходимо продолжать тестирование уровня тромбоцитов, лактатдегидрогеназы (ЛДГ) в плазме, мазков крови и функции почек. При диагностировании тромботической микроангиопатии (ТМАП) необходимо начать раннее лечение (в том числе плазмаферез). Терапию препаратом Бетаферон рекомендуется прекратить.
Общие нарушения и нарушения в месте инъекции
Могут наблюдаться серьезные аллергические реакции (редкие, но проявляющиеся в острой и тяжелой форме, такие как бронхоспазм, анафилаксия и крапивница). В случае возникновения тяжелой реакции препарат Бетаферон следует отменить и назначить соответствующее лечение.
У пациентов, получавших препарат Бетаферон, наблюдались случаи некроза в месте инъекции (см. раздел «Побочное действие»). Некроз может быть обширным и
распространяться на мышечные фасции, а также жировую ткань и, как следствие, приводить к образованию рубцов. В некоторых случаях необходимо удаление омертвевших участков или, реже, пересадка кожи. Процесс заживления при этом может занимать до 6 месяцев.
При появлении признаков повреждения целостности кожи (например, истечения жидкости из места инъекции) пациенту следует обратиться к врачу прежде, чем он продолжит выполнение инъекций препарата Бетаферон.
При появлении множественных очагов некроза лечение препаратом Бетаферон следует прекратить до полного заживления поврежденных участков. При наличии одного очага, если некроз не слишком обширен, применение препарата Бетаферон может быть продолжено, поскольку у некоторых пациентов заживление омертвевшего участка в месте инъекции происходило на фоне применения препарата Бетаферон.
С целью снижения риска развития реакции и некроза в месте инъекции, больным следует рекомендовать:
– проводить инъекции, строго соблюдая правила асептики;
– каждый раз менять место инъекции.
Применение автоинжектора способствует снижению распространенности реакций в месте инъекции. В базовом исследовании, во время которого автоинжектор применяли у большинства пациентов с клинически изолированным синдромом, позволяющим предположить рассеянный склероз, случаи возникновения некроза в месте введения отмечались реже, чем в ходе других базовых исследований. Периодически следует контролировать правильность выполнения самостоятельных инъекций, особенно при появлении местных реакций.
Иммуногенность
Как и при лечении любыми другими белковыми препаратами, при применении препарата Бетаферон существует возможность иммуногенности. В ряде контролируемых клинических исследований производился анализ сыворотки крови каждые 3 месяца для выявления антител к препарату Бетаферон.
Было показано, что нейтрализующие антитела к интерферону бета-1b развивались у 23%-41% пациентов с рецидивирующе-ремиттирующим рассеянным склерозом и вторично-прогрессирующим рассеянным склерозом, что подтверждалось как минимум двумя последующими позитивными результатами лабораторных тестов. У 43%-55% из этих пациентов в последующих лабораторных исследованиях было выявлено стабильное отсутствие антител к интерферону бета-1b, что подтверждалось как минимум двумя последующими отрицательными результатами лабораторных тестов.
В этих исследованиях появление нейтрализующей активности было связано со снижением клинической эффективности только в отношении частоты возникновения рецидивов. Результаты некоторых анализов позволяют предположить большую выраженность данного эффекта у пациентов с более высоким титром нейтрализующих антител. В исследовании с участием пациентов с клинически изолированным синдромом, позволяющим предположить рассеянный склероз, нейтрализующая активность, которая измерялась каждые 6 месяцев, обнаруживалась, по крайней мере, один раз у 32% (89) получавших препарат Бетаферон пациентов. На основании лабораторных исследований, проведенных в конце 5-летнего периода, у 60% (53) этих пациентов было выявлено стабильное отсутствие антител к интерферону бета-1b. В ходе данного исследования развитие нейтрализующей активности связывалось со значительным увеличением количества вновь обнаруженных очагов и увеличением объема очагов на Т2-вхвешенных изображениях при магнитно-резонансном исследовании. Маловероятно, что развитие нейтрализующей активности связано со снижением клинической эффективности относительно времени до наступления клинически достоверного рассеянного склероза или прогрессирования по шкале EDSS.
С развитием нейтрализующей активности не связано появление каких-либо новых побочных реакций.
В исследованиях in vitro препарат Бетаферон продемонстрировал перекрестную реактивность с нативным интерфероном бета. Однако ввиду отсутствия исследований in vivo, клиническое значение данного факта не подтверждено.
Существуют малочисленные неубедительные данные о пациентах с развившейся нейтрализующей активностью, которые завершили лечение препаратом Бетаферон. Решение о продолжении или прекращении терапии должно основываться на всех аспектах статуса заболевания, а не только на статусе нейтрализующей активности.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Специальные исследования не проводились. Нежелательные явления со стороны центральной нервной системы (ЦНС) могут влиять на способность управлять автомобилем и работать с механизмами. В связи с этим необходимо соблюдать осторожность при занятии потенциально опасными видами деятельности, требующими повышенного внимания.
ФОРМА ВЫПУСКА
Лиофилизат для приготовления раствора для подкожного введения по 9,6 млн. МЕ препарата во флаконе из стекла типа I (Евр.Фарм.) с пробкой, обкатанной алюминиевым колпачком, с отщелкивающейся крышкой бирюзового цвета.
1) Растворитель (раствор натрия хлорида 0,54 %) по 1,2 мл в шприце из стекла типа I
(Евр.Фарм.) в ячейковой упаковке ПВХ/бумага (блистер).
5 флаконов в пластиковом поддоне и 5 шприцев (каждый в блистере) вместе с инструкцией по применению в картонной коробке или
15 флаконов в пластиковом поддоне и 15 шприцев (каждый в блистере) вместе с
инструкцией по применению в картонной коробке
2) Растворитель (раствор натрия хлорида 0,54 %) по 1,2 мл в шприце из стекла типа I
(Евр.Фарм.).
1 флакон, 1 шприц, 1 адаптер с иглой для флакона и 2 спиртовые салфетки помещают в разовую картонную упаковку, имеющую картонную вклейку и контроль первого вскрытия (перфорация или стикер).
По 5 или по 15 разовых упаковок вместе с инструкцией по применению в картонную коробку, имеющую контроль первого вскрытия (перфорация или стикер).
УСЛОВИЯ ХРАНЕНИЯ
При температуре не выше 25°С. Не замораживать. Хранить в недоступном для детей месте.
СРОК ГОДНОСТИ
Лиофилизат – 2 года. Растворитель – 3 года. Не использовать по истечении срока годности.
УСЛОВИЯ ОТПУСКА
Отпускается по рецепту.
НАИМЕНОВАНИЕ И АДРЕС ЮРИДИЧЕСКОГО ЛИЦА, НА ИМЯ КОТОРОГО ВЫДАНО РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
Байер Фарма АГ, Мюллерштрассе 178, 13353, Берлин, Германия Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany
ПРОИЗВОДИТЕЛЬ
1. Байер Фарма АГ, Мюллерштрассе 178, 13353, Берлин, Германия Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany
2. ЗАО «ФармФирма «Сотекс» 141345, Россия, Московская область, Сергиево-Посадский муниципальный район, сельское поселение Березняковское, пос. Беликово, д.11
За дополнительной информацией и с претензиями обращаться по адресу:
107113 Москва, 3-я Рыбинская ул., д.18, стр.2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Владелец регистрационного удостоверения:
Упаковка и выпускающий контроль качества:
BAYER, AG
(Германия)
Код ATX:
L03AB08
(Интерферон бета-1b)
Лекарственная форма
| Бетаферон |
Лиофилизат д/пригот. р-ра д/п/к введения 9.6 млн.МЕ: фл. 5 или 15 шт. в компл. с растворителем или растворителем, адаптером с иглой д/флакона и спиртовыми салфетками рег. №: П N012097/01 |
Форма выпуска, упаковка и состав
препарата Бетаферон
Лиофилизат для приготовления раствора для п/к введения в виде лиофилизированной массы белого цвета; приложенный растворитель — прозрачный, практически бесцветный раствор; приготовленный раствор от слегка опалесцирующего до опалесцирующего, бесцветный или светло-желтого цвета.
В 1 мл приготовленного раствора содержится 0.25 мг (8 млн.МЕ) рекомбинантного интерферона бета-1b (IFN-бета-1b).
В 1 мл водного растворителя для приготовления раствора для инъекций содержится 5.4 мг натрия хлорида.
Вспомогательные вещества: альбумин человеческий — 15 мг, маннитол — 15 мг.
Растворитель: р-р натрия хлорида 0.54% (1.2 мл).
9.6 млн. МЕ — флаконы из стекла типа I (1) в комплекте с растворителем (шприц 1.2 мл), адаптером с иглой для флакона и спиртовыми салфетками (2 шт.) — упаковки картонные с вклейкой (5) — коробки картонные с контролем первого вскрытия (перфорация или стикер).
9.6 млн. МЕ — флаконы из стекла типа I (1) в комплекте с растворителем (шприц-ампулы), адаптером с иглой для флакона и спиртовыми салфетками (2 шт.) — упаковки картонные с вклейкой (15) — коробки картонные с контролем первого вскрытия (перфорация или стикер).
Фармако-терапевтические группы
Фармакологическое действие
Интерферон. Представляет собой негликолизированную форму человеческого интерферона бета, в позиции 17 имеет серин. Ингибирует репликацию вирусов, снижает образование гамма-интерферона и активизирует функцию T-супрессоров, тем самым, ослабляя действие антител против основных компонентов миелина.
Показания активных веществ препарата
Бетаферон
Рассеянный склероз ремиттирующего течения с целью уменьшения частоты и тяжести обострений заболевания.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
П/к в дозе 8 млн.ЕД через день. Лечение длительное.
Побочное действие
Возможны гриппоподобный синдром, депрессия, умеренная лейкопения; местные — болезненность, гиперемия, редко — истончение подкожно-жировой клетчатки, некрозы.
Противопоказания к применению
Повышенная чувствительность к интерферонам и альбумину; беременность, период грудного вскармливания; детский и подростковый возраст до 18 лет.
Применение при беременности и кормлении грудью
Противопоказан к применению при беременности и в период лактации (грудного вскармливания).
Применение при нарушениях функции печени
С осторожностью применять у пациентов с заболеваниями печени в стадии декомпенсации.
Применение при нарушениях функции почек
С осторожностью применять у пациентов с тяжелой почечной недостаточностью.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Особые указания
В период лечения следует регулярно контролировать картину периферической крови, уровень кальция и активность печеночных ферментов в плазме крови.
Бетаферон®
МНН: Интерферон бета-1b
Производитель: Берингер Ингельхайм Фарма ГмбХ и Ко. КГ
Анатомо-терапевтическо-химическая классификация: Interferon beta-1b
Номер регистрации в РК:
№ РК-ЛС-5№003524
Информация о регистрации в РК:
05.11.2015 — 05.11.2020
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
20 136.13 KZT
- Скачать инструкцию медикамента
Торговое название
Бетаферон®
Международное непатентованное название
Интерферон бета
Лекарственная форма
Лиофилизат для приготовления раствора для подкожного введения 0,3 мг (9,6 млн. МЕ) в комплекте с растворителем
Состав
aктивное вещество – интерферон бета-1b — 0,3 мг (9,6 млн. МЕ)
при расчетном излишке заполнения 20 %,
вспомогательные вещества: альбумин человеческий, маннитол
Растворитель
1,2 мл раствора содержат
aктивное вещество — натрия хлорида 6,48 мг,
вспомогательные вещества — вода для инъекций.
Описание
Лиофилизат: лиофилизат белого цвета
Растворитель: прозрачный раствор, свободный от частиц.
Восстановленный раствор: раствор от слегка опалесцирующего до опалесцирующего, бесцветного до светло-желтого цвета
Фармакотерапевтическая группа
Имуномодуляторы. Иммуномостимуляторы. Интерфероны.
Интерферон бета-1b
Код АТХ L03AB08
Фармакологические свойства
Фармакокинетика
После подкожного введения Бетаферона® в рекомендуемой дозе 0,25 мг сывороточные концентрации интерферона бета-1b низкие или вообще не определяются. В связи с этим сведений о фармакокинетике препарата у больных рассеянным склерозом, получающих Бетаферон® в рекомендуемой дозе, нет.
После подкожного введения 0,5 мг Бетаферона® максимальная концентрация в плазме достигается через 1-8 ч после инъекции и составляет около 40 МЕ/мл. Абсолютная биодоступность Бетаферона® при подкожном введении — около 50 %. При внутривенном применении интерферона бета-1b клиренс и период полувыведения препарата из сыворотки составляют в среднем 30 мл/мин/кг и 5 часов соответственно.
Введение Бетаферона® через день не приводит к повышению уровня препарата в плазме крови, а его фармакокинетика в течение курса терапии не меняется.
При подкожном применении Бетаферона® в дозе 0,25 мг через день уровни маркеров биологического ответа (неоптерин, бета2-микроглобулин и иммуносупрессивный цитокин IL-10) значительно повышаются по сравнению с исходными показателями через 6-12 ч. после введения первой дозы препарата. Они достигают пика через 40-124 ч. и остаются повышенными на протяжении 7-дневного (168 ч) периода.
Фармакодинамика
Интерфероны относятся к цитокинам, которые являются природными белками.
Интерферон бета-1b обладает противовирусной и иммунорегулирующей активностями. Механизмы действия интерферона бета-1b при рассеянном склерозе окончательно не установлены. Однако известно, что биологический эффект интерферона бета-1b опосредуется его взаимодействием со специфическими рецепторами, которые обнаружены на поверхности клеток человека. Связывание интерферона бета-1b с этими рецепторами индуцирует экспрессию ряда веществ, которые рассматриваются в качестве медиаторов биологических эффектов интерферона бета-1b. Интерферон бета-1b снижает связывающую способность и экспрессию рецепторов к гамма-интерферону, усиливает их распад. Кроме того, интерферон бета-1b повышает супрессорную активность мононуклеарных клеток периферической крови.
Как при ремиттирующем, так и при вторично-прогрессирующем рассеянном склерозе лечение Бетафероном® снижает частоту (на 30 %) и тяжесть клинических обострений болезни, число госпитализаций и потребность в лечении стероидами, а также удлиняет продолжительность ремиссии.
У больных с вторично-прогрессирующим рассеянным склерозом (РС) лечение Бетафероном® позволяет задержать дальнейшее прогрессирование заболевания и наступление инвалидности, в том числе тяжелой (т.е. когда больные вынуждены постоянно пользоваться инвалидным креслом) на срок до 12 мес. Этот эффект наблюдается у больных как с обострениями заболевания, так и без обострений, а также с любым индексом инвалидизации (пациенты с оценкой от 3,0 до 6,5 баллов по расширенной шкале инвалидизации EDSS).
Результаты магнитно-резонансной томографии головного мозга больных ремиттирующим и вторично-прогрессирующим рассеянным склерозом на фоне лечения Бетафероном® подтверждают значительное положительное влияние препарата на тяжесть патологического процесса, а также значительное уменьшение образования новых активных очагов.
Лечение Бетафероном® больных после первых клинических проявлений рассеянного склероза (клинико-изолированный синдром) позволяет уменьшить риск развития достоверного рассеянного склероза на 50 %, и увеличить период до развития достоверного рассеянного склероза в среднем на 363 дня.
Показания к применению
— пациенты с первыми проявлениями демиелинизации, с активным воспалительным процессом, в достаточной мере тяжелым для обоснования терапии кортикостероидами для внутривенного применения, при условии исключения альтернативных диагнозов и выявления высокого риска развития достоверного рассеянного склероза (см. раздел Фармакодинамические свойства)
— пациенты с ремиттирующим расcеянным склерозом (РРС) и имеющих не менее 2-х обострений за последние 2 года
— пациенты с вторично-прогрессирующим рассеянным склерозом, с активным течением заболевания, характеризующимся обострениями.
Способ применения и дозы
Лечение Бетафероном® необходимо проводить под наблюдением врача, имеющего опыт лечения рассеянного склероза.
Введение препарата
Способ применения: для подкожных инъекций
Приготовление инъекционного раствора
1 мл приготовленного раствора содержит рекомендованную дозу 0,25 мг (8,0 млн. МЕ) интерферона бета-1b.
Для растворения лиофилизата используют прилагаемые готовый шприц с растворителем и адаптер для флакона с иглой. Во флакон с Бетафероном® вводят 1,2 мл растворителя (раствор натрия хлорида 0,54 %). Лиофилизат должен раствориться полностью без встряхивания.
После растворения наберите 1 мл раствора из флакона в шприц для введения 0,25 мг Бетаферона®.
Перед проведением инъекции отсоедините шприц от флакона и адаптера. Бетаферон® можно вводить с использованием соответствующего автоинжектора.
Нельзя использовать поврежденные флаконы.
Перед применением следует осмотреть готовый раствор. При наличии частиц или изменении цвета раствора его нельзя применять и следует уничтожить.
Препарат следует вводить подкожно сразу после приготовления раствора. Если инъекция откладывается, то раствор следует хранить в холодильнике и использовать в течение 3 ч. Раствор нельзя замораживать.
Рекомендуемую дозу Бетаферона® 0,25 мг (8 млн. МЕ), которая содержится в 1 мл приготовленного раствора, вводят подкожно через день.
Как правило, в начале лечения рекомендуется титрование дозы. Для этой цели существует специальная упаковка для титрования дозы.
Пациентам необходимо начать со стартовой дозы 62,5 мкг (0,25 мл) подкожно через день и медленно увеличивать дозу до 250 мкг (1,0 мл) через день (подробная информация касательно использования упаковки для титрования содержится в приложении).
Продолжительность времени титрования устанавливается в индивидуальном порядке в зависимости от переносимости.
Схема титрования дозы*
|
День лечения |
Доза |
Объем |
|
1, 3, 5 |
62,5 мкг |
0,25 мл |
|
7, 9, 11 |
125 мкг |
0,5 мл |
|
13, 15, 17 |
187,5 мкг |
0,75 мл |
|
≥19 |
250 мкг |
1,0 мл |
*Схему титрования можно корректировать при появлении значительных побочных реакций
Оптимальная доза препарата не определена полностью.
В настоящее время остается нерешенным вопрос о продолжительности терапии Бетафероном®.
В условиях контролируемых наблюдений у пациентов с ремиттирующим рассеянным склерозом курс лечения Бетафероном® составил до 5 лет, а у больных с вторично-прогрессирующим рассеянным склерозом курс составил до 3 лет.
У пациентов с ремиттирующим рассеянным склерозом показана эффективность на протяжении первых 2 лет лечения препаратом. Доступные данные о последующих 3 годах лечения соответствуют данным об эффективности лечения Бетафероном® за весь период продолжительного лечения.
У пациентов с первыми клиническими проявлениями при подозрении на рассеянный склероз значительно замедлялось развитие достоверного рассеянного склероза на протяжении 5 лет лечения Бетафероном®.
Не рекомендуется лечение Бетафероном® у пациентов с ремиттирующим рассеянным склерозом, у которых в анамнезе имеется менее 2 обострений за последние 2 года или у пациентов с вторично-прогрессирующим рассеянным склерозом, у которых не отмечалось обострения заболевания за последние 2 года.
Следует отменить лечение Бетафероном® при отсутствии у пациента ответа на лечение, например при устойчивом прогрессировании симптоматики по шкале EDSS в течение 6 месяцев или в случаях, если была необходимость к назначению минимум 3 курсов терапии адренокортикотропным гормоном (АКТГ) или кортикостероидами в течение одного года.
Побочные действия
В начале лечения побочные реакции встречаются часто, но, как правило, их частота снижается со временем в процессе лечения. Наиболее часто наблюдались такие побочные реакции как, комплекс гриппоподобных симптомов (лихорадка, озноб, артралгии, недомогание, потливость, головные боли, и миалгии), которые главным образом возникают вследствие фармакологических эффектов препарата, а также реакции в месте введения препарата. Реакции в месте введения появляются часто после введения Бетаферона®. Гиперемия, локальный отёк, изменение цвета кожи, воспаление, боль, гиперчувствительность, некроз и неспецифические реакции в значительной степени связаны с лечением Бетаферона® 250 мкг (8 млн МЕ). Для того, чтобы улучшить переносимость Бетаферона®, как правило, в начале лечения рекомендуется титрование дозы. Возникновение гриппоподобных симптомов также может быть снижено назначением нестероидных противовоспалительных препаратов. Использование автоинжектора позволяет снизить частоту возникновения реакций в месте инъекции.
Перечисленные ниже побочные реакции основаны на данных клинических исследований и постмаркетинговых наблюдений. Частота побочных реакций, наблюдавшихся на фоне применения Бетаферона®, приведена ниже в соответствии со следующей градацией: очень частые (1/10) и частые (1/100 до <1/10), нечастые (1/1000 до <1/100, редкие (1/10000 до <1/1000) и очень редкие (1/10000).
Наиболее подходящий термин MedDRA используется для описания определенных реакций и их синонимов и связанных условий.
Tаблица 1: Побочные реакции и отклонения лабораторных показателей с частотой ≥10% и соответствующий процент в группе плацебо; существенные побочные реакции, связанные с применением препарата с частотой <10% основаны на данных клинических исследований
|
Система классификации органов Побочные эффекты и отклонения лабораторных показателей |
Первые проявления при подозрении на Рассеянный склероз (РС) (BENEFIT) # |
Вторично- прогрессиру-ющий Рассеянный склероз (ВПРС) (Европей- ское исследо- вание) |
Вторично- прогрессиру-ющий Рассеянный склероз (ВПРС) (Исследова-ние в Северной Америке) |
Ремиттиру-ющий Рассеянный склероз (РРС) |
|
Бетаферон® 250 мкг (Плацебо) n=292 (n=176) |
Бетаферон® 250 мкг (Плацебо) n=360 (n=358) |
Бетаферон® 250 мкг (Плацебо) n=317 (n=308) |
Бетаферон® 250 мкг (Плацебо) n=124 (n=123) |
|
|
Инфекционные и паразитарные заболевания |
||||
|
Инфекция |
6% (3%) |
13% (11%) |
11% (10%) |
14% (13%) |
|
Абсцесс |
0% (1%) |
4% (2%) |
4% (5%) |
1% (6%) |
|
Нарушения кровеносной и лимфатической системы |
||||
|
Уменьшение количества лимфоцитов (<1,500/мм³) ° |
79% (45%) |
53% (28%) |
88% (68%) |
82% (67%) |
|
Уменьшение абсолютного количества нейтрофилов (<1,500/мм³) * ° |
11% (2%) |
18% (5%) |
4% (10%) |
18% (5%) |
|
Уменьшение количества лейкоцитов (<3,000/мм³) * ° |
11% (2%) |
13% (4%) |
13% (4%) |
16% (4%) |
|
Лимфоаденопатия |
1% (1%) |
3% (1%) |
11% (5%) |
14% (11%) |
|
Нарушения обмена веществ и питания |
||||
|
Снижение уровня глюкозы в крови (<55 мг/дл) |
3% (5%) |
27% (27%) |
5% (3%) |
15 % (13%) |
|
Психиатрические нарушения |
||||
|
Депрессия |
10% (11%) |
24% (31%) |
44% (41%) |
25% (24%) |
|
Тревожность |
3% (5%) |
6% (5%) |
10% (11%) |
15% (13%) |
|
Нарушения нервной системы |
||||
|
Головная боль |
27% (17%) |
47% (41%) |
55% (46%) |
84% (77%) |
|
Головокружение |
3% (4%) |
14% (14%) |
28% (26%) |
35% (28%) |
|
Бессонница |
8% (4%) |
12% (8%) |
26% (25%) |
31% (33%) |
|
Мигрень |
2% (2%) |
4% (3%) |
5% (4%) |
12% (7%) |
|
Парестезия |
16% (17%) |
35% (39%) |
40% (43%) |
19% (21%) |
|
Нарушения со стороны зрения |
||||
|
Конъюнктивит |
1% (1%) |
2% (3%) |
6% (6%) |
12% (10%) |
|
Ухудшение зрения |
3% (1%) |
11% (15%) |
11% (11%) |
7% (4%) |
|
Нарушения со стороны органа слуха и равновесия |
||||
|
Боль в ухе |
0% (1%) |
<1% (1%) |
6% (8%) |
16% (15%) |
|
Нарушения со стороны сердца |
||||
|
Учащенное сердцебиение * |
1% (1%) |
2% (3%) |
5% (2%) |
8% (2%) |
|
Нарушения со стороны сосудов |
||||
|
Вазодилятация |
0% (0%) |
6% (4%) |
13% (8%) |
18% (17%) |
|
Гипертония ° |
2% (0%) |
4% (2%) |
9% (8%) |
7% (2%) |
|
Нарушения со стороны дыхательной системы и органов грудной клетки |
||||
|
Инфекция верхних дыхательных путей |
18% (19%) |
3% (2%) |
||
|
Синусит |
4% (6%) |
6% (6%) |
16% (18%) |
36% (26%) |
|
Усиление кашля |
2% (2%) |
5% (10%) |
11% (15%) |
31% (23%) |
|
Одышка* |
0% (0%) |
3% (2%) |
8% (6%) |
8% (2%) |
|
Нарушения со стороны желудочно-кишечного тракта |
||||
|
Диарея |
4% (2%) |
7% (10%) |
21% (19%) |
35% (29%) |
|
Запор |
1% (1%) |
12% (12%) |
22% (24%) |
24% (18%) |
|
Тошнота |
3% (4%) |
13% (13%) |
32% (30%) |
48% (49%) |
|
Рвота |
5% (1%) |
4% (6%) |
10% (12%) |
21% (19%) |
|
Боль в животе ° |
5% (3%) |
11% (6%) |
18% (16%) |
32% (24%) |
|
Нарушения со стороны печени и желчевыводящих путей |
||||
|
Увеличение аланин аминотрансферазы (АЛТ) > 5 раз от исходного) * ° |
18% (5%) |
14% (5%) |
4% (2%) |
19% (6%) |
|
Увеличение аспартат аминотрансферазы (АСТ)> 5 раз от исходного) * ° |
6% (1%) |
4% (1%) |
2% (1%) |
4% (0%) |
|
Нарушения со стороны кожи и подкожных тканей |
||||
|
Поражение кожи |
1% (0%) |
4% (4%) |
19% (17%) |
6% (8%) |
|
Высыпания ° |
11% (3%) |
20% (12%) |
26% (20%) |
27% (32%) |
|
Нарушения со стороны мышечной и соединительной ткани |
||||
|
Гипертонус° |
2% (1%) |
41% (31%) |
57% (57%) |
26% (24%) |
|
Миалгия * ° |
8% (8%) |
23% (9%) |
19% (29%) |
44% (28%) |
|
Миастения |
2% (2%) |
39% (40%) |
57% (60%) |
13% (10%) |
|
Боль в спине |
10% (7%) |
26% (24%) |
31% (32%) |
36% (37%) |
|
Боль в конечностях |
6% (3%) |
14% (12%) |
0% (0%) |
|
|
Нарушения со стороны почек и мочевыводящих путей |
||||
|
Задержка мочеиспускания |
1% (1%) |
4% (6%) |
15% (13%) |
|
|
Положительный белок в моче (> 1+) |
25% (26%) |
14% (11%) |
5% (5%) |
5% (3%) |
|
Частое мочеиспускание |
1% (1%) |
6% (5%) |
12% (11%) |
3% (5%) |
|
Недержание мочи |
1% (1%) |
8% (15%) |
20% (19%) |
2% (1%) |
|
Сильный позыв на мочеиспускание |
1% (1%) |
8% (7%) |
21% (17%) |
4% (2%) |
|
Нарушения со стороны половых органов и молочной железы |
||||
|
Дисменорея |
2% (0%) |
<1% (<1%) |
6% (5%) |
18% (11%) |
|
Нарушения в менструальном цикле* |
1% (2%) |
9% (13%) |
10% (8%) |
17% (8%) |
|
Метроррагия |
2% (0%) |
12% (6%) |
10% (10%) |
15% (8%) |
|
Импотенция |
1% (0%) |
7% (4%) |
10% (11%) |
2% (1%) |
|
Осложнения общего характера и реакции в месте введения |
||||
|
Реакция в месте инъекции (разные виды) * ° § |
52% (11%) |
78% (20%) |
89% (37%) |
85% (37%) |
|
Некроз в месте инъекции * ° |
1% (0%) |
5% (0%) |
6% (0%) |
5% (0%) |
|
Гриппоподобные симптомы & *° |
44% (18%) |
61% (40%) |
43% (33%) |
52% (48%) |
|
Лихорадка * ° |
13% (5%) |
40% (13%) |
29% (24%) |
59% (41%) |
|
Боль |
4% (4%) |
31% (25%) |
59% (59%) |
52% (48%) |
|
Боль в груди ° |
1% (0%) |
5% (4%) |
15% (8%) |
15% (15%) |
|
Периферические отеки |
0% (0%) |
7% (7%) |
21% (18%) |
7% (8%) |
|
Астения * |
22% (17%) |
63% (58%) |
64% (58%) |
49% (35%) |
|
Озноб * ° |
5% (1%) |
23% (7%) |
22% (12%) |
46% (19%) |
|
Потливость * |
2% (1%) |
6% (6%) |
10% (10%) |
23% (11%) |
|
Нeдомогание * |
0% (1%) |
8% (5%) |
6% (2%) |
15% (3%) |
|
Отклонения лабораторных показателей В значительной степени связанные с лечением Бетафероном® у пациентов с первыми проявлениями заболевания при подозрении на РС, p < 0.05 * В значительной степени связанные с лечением Бетафероном® при РРС, p < 0.05 ° В значительной степени связанные с лечением Бетафероном® при ВПРС, p < 0.05 § Реакции в месте инъекции (разные виды), включают в себя все побочные эффекты в месте инъекции: кровотечение в месте инъекции, гиперчувствительность в месте инъекции, воспаление в месте инъекции, отек в месте инъекции, некроз в месте инъекции, боль в месте инъекции, реакция вместе инъекции и атрофия в месте инъекции & “Гриппоподобный комплекс симптомов” означает симптомы гриппа и/или комбинацию, по крайней мере, 2 побочных эффектов со следующих симптомов: лихорадка, озноб, миалгия, общее недомогание, потливость # В ходе исследования BENEFIT, не наблюдалось никаких изменений в известном профиле риска Бетаферона®. |
Taблица 2: Побочные эффекты, выявленные в ходе постмаркетинговых наблюдений (частота, если известна, рассчитана на основе суммарных х данных клинических исследований N= 1093)
|
Система классифика—ции органов |
Очень часто ( 1/10) 1 |
Часто ( 1/100 to < 1/10) 1 |
Нечасто ( 1/1,000 to < 1/100) 1 |
Редко ( 1/10,000 to < 1/1,000) 1 |
С неизвестной частотой |
|
Нарушения кровеносной и лимфатичес-кой системы |
Анемия |
Тромбоцитопения |
Тромботическая микроангиопатия, в том числе тромботическая тромбоцитопеничес-кая пурпура/ гемолитико-уремический синдром3 |
||
|
Нарушения иммунной системы |
Анафилактические реакции |
Синдром повышенной проницае-мости капилляров при предшество-вавшей моноклональ-ной гаммапатии2 |
|||
|
Нарушения эндокринной системы |
Гипотиреоз |
Гипертиреоз, Заболевания щитовидной железы |
|||
|
Нарушения со стороны обмена веществ и питания |
Увеличение веса, Снижение веса |
Увеличение уровня триглицеридов крови |
Aнорексия2 |
||
|
Психические нарушения |
Спутанность сознания |
Суицидальные попытки, эмоциональная лабильность |
|||
|
Нарушения со стороны нервной системы |
Судороги |
||||
|
Нарушения сердечной деятельности |
Тахикардия |
Кардиомиопатия2 |
|||
|
Нарушения со стороны дыхательной системы и органов грудной клетки |
Бронхоспазм2 |
||||
|
Нарушение со стороны желудочно-кишечного тракта |
Панкреатит |
||||
|
Нарушения со стороны печени и желчевыводящих путей |
Увеличение уровня билирубина крови |
Увеличение уровня гамма-глютамилтранс-феразы, гепатит |
Поражение печени (включая гепатиты), печеночная недостаточность2 |
||
|
Нарушения со стороны кожи и подкожных тканей |
Крапивницa, Зуд, Aлопеция |
Изменение цвета кожи |
|||
|
Нарушения со стороны мышечной и соединительной ткани |
Артрал-гия |
||||
|
Нарушения со стороны почек и мочевыводящих путей |
Нефротический синдром, гломерулосклероз 2 |
||||
|
Нарушения со стороны половых органов и молочной железы |
Меноррагия |
||||
|
1 частота, основанная на обобщенных данных клинических исследований (очень часто ≥1/10, часто ≥1/100 до <1/10, нечасто ≥ 1/1,000 дo < 1/100, редко ≥1/10,000 дo <1/1,000, очень редко < 1/10,000). 2 Побочные эффекты, полученные только в постмаркетинговых исследованиях 3 Информация по препаратам класса интерферон бета (см. раздел «Особые указания»). |
С неизвестной частотой:
— лекарственный волчаночноподобный синдром (эритематоз)
Извещение о подозреваемой побочной реакции
Очень важно извещать о подозреваемой побочной реакции после выхода препарата на рынок. Это позволяет проводить долгосрочный контроль баланса выгоды/риска лекарственного препарата. Специалистам здравоохранения необходимо извещать о любой подозреваемой побочной реакции.
Противопоказания
— начало лечения в период беременности
— реакции гиперчувствительности на природный или рекомбинантный
интерферон-бета или другие вспомогательные вещества препарата в
анамнезе
— наличие в настоящее время тяжелой депрессии и/или суицидальных мыслей
— заболевания печени в стадии декомпенсации
Лекарственные взаимодействия
Специальные исследования взаимодействия Бетаферона® с другими препаратами не проводились.
Влияние Бетаферона® в 250 мкг (8 млн ЕД) через день на метаболизм других препаратов у пациентов с рассеянным склерозом, неизвестно.
На фоне применения Бетаферона® кортикостероиды и АКТГ, назначаемые на срок до 28 дней при лечении обострений, переносятся хорошо.
Ввиду недостаточного клинического опыта у пациентов с рассеянным склерозом не рекомендовано применение Бетаферона® одновременно с другими иммуномодуляторами, помимо кортикостероидов или АКТГ.
Интерфероны снижают активность печеночных цитохром Р450-зависимых ферментов у человека и животных. Поэтому необходимо соблюдать осторожность при назначении Бетаферона® в комбинации с медицинскими препаратами, имеющими узкий терапевтический индекс, клиренс которых в значительной степени зависит от печеночной системы цитохрома Р450 (например, противоэпилептические средства). Необходимо также соблюдать осторожность при одновременном применении любых препаратов, влияющих на систему кроветворения.
Специальные исследования взаимодействия с противоэпилептическими препаратами не проводились.
Особые указания
-
Иммунные нарушения
Применение цитокинов у больных с моноклональной гаммапатией (редким заболеванием иммунной системы, характеризующимся появлением патологических белков в крови) иногда сопровождалось системным повышением проницаемости капилляров с шокоподобными симптомами и летальным исходом.
-
Желудочно-кишечные нарушения
Во время применения Бетаферона® в редких случаях наблюдались случаи выявления панкреатита, часто сопровождаемого гипертриглицеридемией.
-
Нарушения со стороны нервной системы
Бетаферон® следует назначать с осторожностью у пациентов, имеющих депрессивные нарушения в анамнезе или в настоящее время, в частности суицидальные мысли. Как известно, депрессия и суицидальные мысли с большей частотой встречаются в популяции больных рассеянным склерозом, в том числе на фоне лечения интерферонами. Пациентов, которым показано лечение Бетафероном®, следует информировать о том, что при лечении препаратом может быть появление депрессивных нарушений и суицидальных мыслей, о чем незамедлительно следует сообщить лечащему врачу. В редких случаях эти симптомы могут привести к суицидальным попыткам. Пациенты с проявлениями депрессии и суицидальных мыслей должны находиться под тщательным наблюдением врача. При необходимости следует рассмотреть вопрос о прекращении терапии у таких пациентов.
Следует с осторожностью назначать Бетаферон® пациентам с судорожными приступами в анамнезе и пациентам, получающим противоэпилептическое лечение, особенно когда эпилептические приступы недостаточно контролируются противоэпилептическими средствами.
Препарат содержит человеческий альбумин, и по этой причине существует потенциальный риск передачи вирусных заболеваний. Нельзя исключить риск передачи болезни Крейтцфельдта-Якоба. Изменения лабораторных показателей
Пациентам с дисфункцией щитовидной железы рекомендуется проверять функцию щитовидной железы регулярно, а в остальных случаях – в соответствии с клиническими показаниями.
Кроме стандартных лабораторных анализов, назначаемых при ведении пациентов с рассеянным склерозом, перед началом лечения и регулярно в процессе лечения Бетафероном®, а затем периодически при отсутствии клинических симптомов рекомендуется производить развернутый анализ крови, включая определение лейкоцитарной формулы, числа тромбоцитов и химического состава крови, а также проверять функцию печени (например, активность аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и g-гаммаглютамилтрансферразы (ГТ).
При ведении пациентов с анемией, тромбоцитопенией, лейкопенией (одиночной или комбинированной) может потребоваться более тщательный мониторинг развернутого анализа крови, включая дифференциальный анализ и определение количества тромбоцитов.
Нарушения функции печени и желчевыводящих путей
Асимптомные повышения уровней сывороточных трансаминаз, в большинстве случаев легкие и транзиторные, могут возникать во время лечения Бетафероном®.
Как и при лечении другими бета-интерферонами, тяжелые поражения печени (включая печеночную недостаточность) при применении Бетаферона® наблюдаются редко. Большинство тяжелых нарушений функции печени чаще возникает у больных принимающих лекарства или вещества, связанные с гепатотоксичностью или при наличии сопутствующих патологических состояний (например, метастазирующая злокачественная опухоль, выраженные инфекции и сепсис, злоупотребление алкоголем).
При наблюдении пациентов следует обращать внимание на признаки, указывающие на нарушение функции печени. При повышенной активности трансаминаз сыворотки рекомендуется проводить наблюдение и обследование пациента. При значительном повышении активности печеночных ферментов или при сочетании данного повышения с клиническими симптомами, такими как желтуха, следует рассмотреть вопрос о необходимости отмены Бетаферона®. При исчезновении клинических признаков нарушения функции печени и после нормализации уровня печеночных ферментов следует рассмотреть возможность возобновления терапии при соответствующем наблюдении за функцией печени.
-
Нарушения функции почек и мочевыводящих путей
Необходимо соблюдать осторожность и осуществлять тщательный мониторинг при назначении препарата у пациентов с тяжелой почечной недостаточностью.
-
Нефротический синдром
Во время лечения препаратами бета- интерферона сообщалось о случаях развития нефротического синдрома в виде основных нефропатий, включая фокальный сегментарный гломерулосклероз, липоидный нефроз, мембранопролиферативный гломерулонефрит и мембранозную гломерулопатию Данные заболевания отмечались в разное время на протяжении лечения и могут появляться через несколько лет применения препаратов бета-интерферона.
Рекомендовано проводить регулярный мониторинг на выявление ранних признаков или симптомов, таких как отеки, протеинурия или нарушение функции почек, особенно у пациентов с высоким риском заболевания почек. Необходимо провести незамедлительное лечение нефротического синдрома, а также рассмотреть возможность прекращения лечения Бетафероном®
- Заболевания сердечно-сосудистой системы
Бетаферон® следует назначать с осторожностью у пациентов, имеющих серьезные заболевания сердца, такие как застойная сердечная недостаточность, ишемическая болезнь сердца или аритмии. Несмотря на то, что нет доказательств прямого кардиотоксического влияния Бетаферона®, этих пациентов следует наблюдать для выявления ухудшения состояния сердца. Бетаферона® не обладает известным прямым кардиотоксическим действием, однако гриппоподобные симптомы, обычно связанные с применением бета-интерферонов, вызывают нагрузку на сердце за счет лихорадки, озноба, тахикардии. Это может усилить симптоматику у пациентов, имеющих серьезные заболевания сердца. По данным постмаркетингового опыта у пациентов, имеющих серьезные заболевания сердца в редких случаях сообщалось об ухудшении функции сердца во временной взаимосвязи с началом лечения Бетаферона®.
В редких случаях сообщалось о развитии кардиомиопатии. При развитии кардиомиопатии и ее возможной связи с применением Бетаферона®, следует прекратить лечение препаратом.
-
Тромботическая микроангиопатия (ТМА)
На фоне лечения препаратами бета-интерферона сообщалось о случаях развития тромботической микроангиопатии, проявляющейся в виде тромботической тромбоцитопенической пурпуры или гемолитического уремического синдрома, в том числе с летальным исходом.
Данные осложнения отмечались в разное время на протяжении лечения, и могут появляться через несколько недель до нескольких лет после начала лечения бета-интерфероном.
Ранние клинические симптомы заболевания включают тромбоцитопению, внезапное начало артериальной гипертензии, лихорадку, признаки нарушений со стороны центральной нервной системы (например, спутанность сознания, парез) и нарушения почечной функции.
Результаты лабораторных тестов, свидетельствующих о возможности наличия ТМА, включают снижение количества тромбоцитов, повышение уровня лактатдегидрогеназы (ЛДГ) в сыворотке крови вследствие гемолиза и шистоцитов (фрагменты эритроцита) в мазке крови.
Соответственно при выявлении клинических симптомов ТМА рекомендуется провести исследование уровня тромбоцитов и ЛДГ в сыворотке, мазка крови и показателей функции почек. При подтверждении ТМА, необходимо провести незамедлительное лечение (предусматривает проведение плазмафереза), а также рассмотреть возможность незамедлительного прекращения лечения Бетафероном®.
- Общие нарушения и состояние места инъекции
Могут наблюдаться тяжелые реакции гиперчувствительности (выраженные острые реакции, такие как бронхоспазм, анафилаксия и крапивница).
У пациентов, получавших Бетаферон®, наблюдались случаи некроза в месте инъекции. Некроз может быть обширным и распространяться на мышечные фасции, а также жировую прослойку и, как следствие, приводить к образованию шрамов. В некоторых случаях необходимо удаление омертвевших участков или, реже, пересадка кожи. Процесс заживления при этом может занимать до 6 месяцев.
Если у пациента отмечается какое-либо повреждение целостности кожи, которое может быть связано с отеком или истечением жидкости из места инъекции, необходимо обратиться к лечащему врачу, прежде чем продолжить выполнение инъекций Бетаферона®.
При появлении множественных очагов некроза лечение Бетафероном® следует прекратить до полного заживления поврежденных участков. При наличии одного очага, если некроз не слишком обширен, использование Бетаферона® может быть продолжено, поскольку у некоторых пациентов заживление омертвевшего участка в месте инъекции происходило на фоне применения Бетаферона®.
С целью снижения риска развития реакции и некроза в месте инъекции, больным следует рекомендовать:
— проводить инъекции в стерильных условиях;
— каждый раз менять место инъекции;
— вводить препарат строго подкожно.
Периодически следует контролировать правильность выполнения самостоятельных инъекций, особенно при появлении реакций в местах введения препарата.
Частота реакций в месте введения препарата (например, гиперемия, локальный отёк, изменение цвета кожи, воспаление, боль, гиперчувствительность, некроз и неспецифические реакции) со временем при продолжении лечения обычно снижается. Использование автоинжектора позволяет снизить частоту возникновения реакций в месте инъекции.
-
Иммуногенность/нейтрализующие антитела
Как и для других препаратов белковой природы существует вероятность развития иммуногенности. В контролируемых клинических исследованиях отбор образцов сыворотки осуществлялся каждые 3 месяца с целью мониторинга развития антител к Бетаферону®.
В различных контролируемых клинических исследованиях при ремиттирующем рассеянном склерозе и вторично-прогрессирующем рассеянном склерозе, у 23-41% пациентов отмечалось развитие нейтрализующей активности к интерферону бета-1b, что подтверждалось, по крайней мере, двумя последовательными положительными титрами.
У 43 — 55% данных пациентов отмечался переход в стабильный отрицательный статус (основано на двух последовательных отрицательных титрах) в течение последующего наблюдательного периода соответствующего исследования.
Развитие нейтрализующей активности в этих исследованиях связано со снижением клинической эффективности только в отношении обострений.
Полагают, что указанный эффект может отмечаться в большей степени у пациентов с более высокими уровнями титра нейтрализующей активности
В исследовании пациентов с первыми клиническими проявлениями при подозрении на рассеянный склероз, нейтрализующая активность, измеренная каждые 6 месяцев, наблюдалась, по крайней мере, у 32% (89) пациентов, с самого начала получавших лечение Бетафероном®. Из них у 60% (53) наблюдалось возвращение к отрицательному статусу, по данным последней оценки за 5-летний период. В пределах этого периода развитие нейтрализующей активности было связано со значимым увеличением новых активных очагов и объема Т2 очага при проведении магнитно-резонансной томографии. Однако, это не было связано со снижением клинической эффективности (в отношении времени до перехода в достоверный рассеянный склероз), времени до подтвержденного прогрессирования симптоматики по шкале EDSS и частоты рецидивов).
С развитием нейтрализующей активности не связывалось появление каких-либо побочных реакций.
В исследованиях ин-витро показано, что Бетаферон® перекрестно реагирует с интерфероном-бета натурального происхождения. Поскольку исследований ин-виво не проводилось, его клиническое значение не ясно.
Имеются редкие и неубедительные данные по пациентам, у которых развивалась нейтрализующая активность, и которые завершили терапию Бетафероном®.
Решение о продолжении терапии Бетафероном® основывается с учетом всех аспектов статуса заболевания пациента, а не на статусе нейтрализующей активности отдельно.
Применение в педиатрии
Никаких официальных клинических испытаний или фармакокинетических исследований не были проведены у детей и подростков. Тем не менее, ограниченные опубликованные данные свидетельствуют о том, что профиль безопасности у подростков от 12 до 16 лет при применении Бетаферона® 8.0 млн МЕ подкожно через день сходен с профилем безопасности у взрослых. Нет информации об использовании Бетаферона детей в возрасте до 12 лет. Бетаферон не должен использоваться в данной возрастной группе.
Беременность и лактация
Данные о применении Бетаферона® во время беременности ограничены. Сообщалось о случаях возникновения самопроизвольных абортов у женщин, страдающих рассеянным склерозом. Начало терапии во время беременности противопоказано (см. раздел «Противопоказания»)
Женщинам репродуктивного возраста при лечении препаратом следует пользоваться надежными методами контрацепции. В случае наступления беременности во время лечения Бетафероном® или планировании беременности, следует информировать женщину о потенциальном риске и рекомендуется отменить применение препарата. У пациенток с высокой частотой обострений до начала лечения, риск тяжелого обострения после прекращения терапии Бетафероном® при наступлении беременности следует взвесить в сравнении с возможным повышенным риском спонтанного аборта.
Неизвестно, выделяется ли интерферон бета-1b с грудным молоком.
Учитывая теоретическую возможность развития нежелательных реакций на Бетаферон® у младенцев, находящихся на грудном вскармливании, необходимо прекратить кормление грудью или отменить препарат.
Особенности влияния лекарственного средства на способность управлять автотранспортом и потенциально опасными механизмами
Специальные исследования влияния препарата на способность управлять автотранспортом и использовать механизмы не проводились. Развитие побочных реакций со стороны нервной системы на фоне применения Бетаферона® может оказывать влияние на способность управлять автотранспортом и использовать механизмы у восприимчивых пациентов.
Передозировка
Не выявлена. Интерферон бета-1б вводился взрослым онкологическим пациентам в высоких дозах порядка 5500 мкг (176 млн. МЕ) внутривенно три раза в неделю без развития серьезных побочных эффектов, влияющих на жизненные функции.
Форма выпуска и упаковка
Лиофилизат помещают во флакон из стекла тип І с пробкой, обкатанной алюминиевым колпачком, с отщелкивающейся крышкой. Растворитель: по 1.2 мл раствора натрия хлорид 0.54 % в предварительно заполненном шприце из стекла тип І.
По 1 флакону с лиофилизатом, 1 шприцу с растворителем, 1 адаптеру с иглой для флакона и 2 спиртовых салфеток помещают в разовую картонную упаковку.
По 15 разовых упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Условия хранения
Хранить при температуре не выше 25 °С. Не замораживать.
Хранить в недоступном для детей месте!
Срок хранения
Лиофилизат– 2 года
Растворитель – 3 года
Не использовать по истечению срока годности препарата.
Условия отпуска из аптек
По рецепту
Производитель
Берингер Ингельхайм Фарма ГмбХ и Ко. КГ, Германия
88397 Биберах-на- Рисе, Германия
Владелец регистрационного удостоверения
Байер Фарма АГ, Берлин, Германия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукта (товара)
ТОО «Байер КАЗ», ул. Тимирязева, 42, бизнес-центр «Экспо-Сити», пав. 15
050057 Алматы, Республика Казахстан
тел. +7 727 258 80 40, факс: +7 727 258 80 39, e-mail: kz.claims@bayer.com
П р и л о ж е н и е
Техника самостоятельных инъекций
В приводимых ниже инструкциях объясняется, как приготовить раствор Бетаферона® для инъекции и как самостоятельно сделать укол. Пожалуйста, внимательно прочитайте инструкции и выполняйте их поэтапно. Врач или медсестра ознакомят вас с процедурой и техникой самостоятельных инъекций и помогут вам в обучении. Не пытайтесь самостоятельно делать уколы до тех пор, пока вы не будете уверены в том, что правильно поняли требования по приготовлению раствора, а также технику самостоятельных инъекций.
Поэтапный процесс приготовления раствора
|
1 — Перед началом процедуры тщательно вымойте руки с мылом. |
|
|
2 — Откройте флакон с «Бетафероном®» с помощью большого пальца руки — и поставьте на стол. |
|
|
3 — Протрите спиртовой салфеткой крышку флакона. Передвигайте салфетку только в одном направлении, а затем оставьте ее на крышке флакона. |
|
|
4 – Откройте блистерную упаковку, в которой находится адаптер для флакона, но адаптер оставьте внутри. Не вынимайте адаптер для флакона из блистерной упаковки. Кроме того, следите за тем, чтобы не прикасаться к адаптеру для флакона. Важно, чтобы он оставался стерильным. |
|
|
5 – В процессе присоединения адаптера держите флакон на ровной поверхности. 6 — Снимите спиртовую салфетку с крышки флакона «Бетаферона®». Поместите на крышку флакона блистерную упаковку, в которой содержится приспособление для переноса раствора с адаптером для флакона. Надавите на блистер большим и указательным пальцами или ладонью до щелчка. |
|
|
7 — Взяв за края блистерной упаковки, снимите ее с адаптера флакона. Теперь Вы готовы к тому, чтобы присоединить предварительно заполненный шприц с растворителем к приспособлению для переноса раствора. |
|
|
8 — Возьмите шприц. Перекрутите оранжевый колпачок на кончике шприца и, потянув за него, снимите со шприца. Выбросьте колпачок. |
|
|
9 — Присоедините шприц к отверстию на боковой стороне адаптера, введя в него кончик шприца и осторожно закрепив путем нажатия с одновременным поворотом по часовой стрелке (как показано стрелкой), чтобы получилась сборная конструкция со шприцем. |
|
|
10 — Удерживайте конструкцию со шприцем за дно флакона. Медленно надавите до отказа на поршень шприца, чтобы переместить весь растворитель во флакон. Отпустите поршень. При этом поршень может вернуться в свое первоначальное положение. Это относится также к упаковке для титрования |
|
|
11 — Сделайте несколько осторожных вращательных движений флаконом, чтобы сухой порошок «Бетаферона®» полностью растворился. При этом конструкция со шприцем остается все еще присоединенной к флакону. Не встряхивайте флакон. |
|
|
12 Внимательно осмотрите раствор. Он должен быть прозрачным и не содержать никаких частиц. Если раствор поменял цвет или содержит частицы, вылейте его и начните всю процедуру с начала, взяв новую упаковку принадлежностей. Если появилась пена – что может случиться, если флакон встряхивать или слишком сильно вращать – дайте флакону постоять, пока пена не осядет. |
Подготовка шприца
|
13 — Если поршень вернулся в свое первоначальное положение, снова протолкните его внутрь и зафиксируйте. Для подготовки инъекции переверните конструкцию, так чтобы флакон находился сверху, а крышка флакона была направлена вниз. Это позволит раствору стечь в шприц. Держите шприц горизонтально. Медленно оттяните поршень, чтобы набрать весь раствор из флакона в шприц. При использовании упаковки для титрования раствор необходимо набирать только до метки в шприце: 0.25 мл для первых трех инъекций (в 1, 3, 5 день лечения), или 0.5 мл для инъекций в 7, 9, 11 день лечения, или 0.75 мл для инъекций в 13,15,17 день лечения Флакон с неиспользованным раствором следует выбросить. Начиная с 19 дня лечения инъекция должна производиться полной дозой препарата 1,0 мл |
|
|
14 — Поверните конструкцию со шприцем таким образом, чтобы игла была направлена вверх. Это заставит пузырьки воздуха подняться к поверхности раствора. 15 — Удалите пузырьки воздуха, осторожно постучав по шприцу и переместив поршень к отметке 1 мл или того объема, который был назначен врачом. Если вместе с пузырьками воздуха во флакон было вытеснено слишком много раствора, немного оттяните поршень назад, чтобы вновь набрать раствор из флакона обратно в шприц. Делайте это до тех пор, пока весь воздух не будет удален, и в шприце не будет содержаться 1 мл приготовленного раствора. Важное замечание: Набирая раствор повторно, верните конструкцию со шприцем в горизонтальное положение, при котором флакон находится сверху. |
|
|
16 — После этого возьмитесь за синий адаптер флакона вместе с присоединенным к нему флаконом, поверните адаптер на себя, а затем отделите его от шприца. Отделяя адаптер с флаконом от шприца, беритесь только за синий пластиковый адаптер. Держите шприц в горизонтальном положении; флакон должен находиться под шприцем. В результате отсоединения флакона и адаптера от шприца обеспечивается вытекание раствора из иглы во время инъекции. |
|
|
17 — Флакон и оставшийся неиспользованный раствор выбросьте в контейнер для отходов. |
|
|
18 — Теперь Вы готовы сделать инъекцию. Если по каким-либо причинам Вы не можете ввести «Бетаферон®» немедленно, перед использованием разрешается поместить шприц с приготовленным раствором в холодильник не более чем на 3 часа. Не замораживайте раствор и не ждите более 3 часов, прежде чем ввести его. Если прошло более 3 часов, выбросьте раствор и приготовьте новый шприц. Перед инъекцией шприц лучше согреть в ладонях, чтобы избежать болезненных ощущений. Краткий обзор процесса 1. Достаньте содержимое из упаковки. 2. Прикрепите к флакону адаптер для флакона. 3. Присоедините шприц к адаптеру флакона. 4. Надавите на поршень, чтобы переместить растворитель во флакон. 5. Переверните сборную конструкцию со шприцем, затем оттяните поршень. 6. Отделите флакон от шприца – теперь Вы готовы сделать инъекцию. ПРИМЕЧАНИЕ: Инъекцию следует делать немедленно после смешивания компонентов (если инъекция откладывается, поместите раствор в холодильник и введите не позднее чем через 3 часа). Не замораживайте. |
Проведение инъекции
-
Выбор места инъекции
Бетаферон® следует вводить подкожно. Для этого лучше всего подходят мягкие места, расположенные вдали от суставов и нервов. Места инъекции можно выбирать с помощью рисунка. Лучше всего сначала определить место инъекции, а затем готовить шприц. Если вам трудно дотянуться какого-либо места, попросите помощи у человека, который умеет делать уколы.
|
1 — Выберите место инъекции (см. рисунки в конце приложения) и отметьте его в карточке учета инъекций. |
|
|
2 — Протрите кожу в месте инъекции спиртовой салфеткой и дождитесь, пока кожа высохнет под воздействием воздуха. Выбросьте салфетку. Для дезинфекции кожи используйте подходящее дезинфицирующее средство. |
|
|
3 — Снимите с иглы защитный колпачок. Потяните за колпачок, а не перекручивайте его. |
|
|
4- Осторожно защипните кожу вокруг продезинфицированного участка (чтобы немного приподнять ее). |
|
|
5 — Резким уверенным движением вонзите иглу прямо в кожу под углом 90°. Держите шприц как карандаш или дротик. Примите во внимание, что Бетаферон® можно вводить с помощью автоинжектора |
|
|
6 — Медленно введите раствор, плавно и непрерывно надавливая на поршень. (Надавливайте на поршень до упора, пока шприц не опустеет). |
|
|
7- Выбросьте шприц в контейнер для отходов. |
-
Чередование мест инъекции
Каждый раз необходимо выбирать новое место для укола, так как чередование мест инъекции позволяет коже восстановиться, а также помогает предотвратить попадание инфекции. Лучше заранее выбрать место для инъекции и только затем готовить шприц. Схема, приведенная на рисунке, поможет вам правильно чередовать места инъекции. Например, если первую инъекцию вы сделали в правую половину живота, то вторую сделайте в левую половину, третью – в правое бедро и т.д. в соответствии со схемой до тех пор, пока вы не используете все возможные места для инъекции. Записывайте, куда и когда вы сделали последнюю инъекцию. Для этого можно использовать прилагаемую карточку.
Следуя предложенной схеме, после 8 инъекций (через 16 дней) вы вновь вернетесь к месту первой инъекции (например, правой половине живота), так называемый цикл чередования. В предлагаемой схеме каждая зона разделена снова на 6 участков для инъекций (что вместе формирует 48 участков для инъекций), левый, правый, верхний, центральный и нижний сегмент каждой зоны. Как только вы вернулись к участку первой инъекции после завершения одного цикла чередования, инъекцию следует производить как можно дальше от него в пределах этой зоны. Если все участки стали болезненными, то обсудите с врачом другие возможные места инъекций.
Схема чередования:
С целью помочь себе правильно чередовать места инъекций, рекомендуется записывать, когда и в какой участок была сделана инъекция. Для этого Вы можете использовать следующую схему чередования.
Используйте каждый цикл чередования по очереди. Каждый цикл рассчитан на 8 инъекций (в течение 16 дней). Инъекции начинают вводить с зоны 1 до зоны 8 в порядке очередности.
При соблюдении этой последовательности у каждой зоны будет возможность полностью восстановиться перед следующей инъекцией.
Цикл чередования 1: Верхний левый сегмент каждой зоны
Цикл чередования 2: Нижний правый сегмент каждой зоны
Цикл чередования 3: Средний левый сегмент каждой зоны
Цикл чередования 4 Верхний правый сегмент каждой зоны
Цикл чередования 5: Нижний левый сегмент каждой зоны
Цикл чередования 6: Средний правый сегмент каждой зоны
Регистрация выполненных инъекций
Инструкции по учету мест и дат выполненных инъекций
— Выберите место инъекции.
— Протрите кожу в месте инъекции спиртовой салфеткой и дождитесь, пока кожа высохнет
— Сделав инъекцию, укажите использованный участок и дату в таблице на карточке учета инъекций. (см. пример учета мест и дат выполненных инъекций — «Пример регистрации выполненных инъекций»)
Упаковка для титрования дозы
Ваш доктор назначил Вам Бетаферон®.
Переносимость препарата будет лучше, если лечение начать с низкой дозы и затем постепенно увеличивать до полной стандартной дозы препарата. Шприцы в упаковке соответственно промаркированы как соответствующие дозы 0,25; 0,5; 0,75 и 1,0 мл.
Проверка содержимого упаковки
В упаковке для титрования Вы найдете 4 разного цвета упаковки «три в одном», пронумерованные как №1, №2, №3 и №4, каждая из которых содержит:
3 флакона с Бетафероном® (с лиофилизатом для инъекций)
3 стеклянных шприца с растворителем (1,2 мл 0,54 % раствор натрия хлорида)
3 адаптера с иглой для флакона
6 спиртовых салфеток для очищения кожи и флакона
Каждая упаковка «Три в одном» содержит шприцы, которые потребуются для приготовления каждой дозы препарата. Шприцы имеют специальную метку для этой дозы. Пожалуйста, детально следуйте инструкции изложенной снизу. При каждой ступени титрования используйте полную дозу растворителя для растворения лиофилизата, а затем набирайте в шприц необходимое количество дозы.
Лечение начните с упаковки желтого цвета, которая четко пронумерована цифрой «1», расположенной в правом верхнем углу коробки.
Первую упаковку «три в одном» следует использовать в 1, 3, 5 день лечения. Она содержит шприцы, которые специально промаркированы меткой 0,25 мл. Это только с целью помочь Вам ввести необходимую дозу препарата.
После завершения желтой упаковки, начните использовать красную упаковку «три в одном», четко пронумерованную как упаковка «2» в правом верхнем углу коробки. Вторую упаковку следует использовать в 7, 9, 11 день лечения. Она содержит шприцы, которые специально промаркированы меткой 0,5 мл. Это только с целью помочь Вам ввести необходимую дозу препарата.
После завершения красной упаковки, начните использовать зеленую упаковку «три в одном», четко пронумерованную как упаковка «3» в правом верхнем углу коробки. Третью упаковку следует использовать в 13, 15 и 17 день лечения. Она содержит шприцы, которые специально промаркированы меткой 0,75 мл. Это только с целью помочь Вам ввести
необходимую дозу препарата.
Наконец, после завершения зеленой упаковки, начните использовать синюю упаковку «три в одном», четко пронумерованную как упаковка «4» в правом верхнем углу коробки. Последнюю синюю упаковку следует использовать в 19, 21 и 23 день лечения. Она содержит шприцы с меткой 0,25, 0,5, 0,75 и 1,0 мл. С упаковкой «4» Вы сможете ввести себе полную дозу препарата 1,0 мл.
| 665956991477976359_ru.doc | 746.5 кб |
| 597272931477977562_kz.doc | 867.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
активное вещество — интерферон бета-lb — 0,3 мг (9,6 млн. ME)
при расчетном излишке заполнения 20 %, вспомогательные вещества: альбумин человеческий, маннитол Растворитель 1,2 мл раствора содержат активное вещество — натрия хлорида 6,48 мг, вспомогательные вещества — вода очищенная.
Лиофилизат: лиофилизат белого цвета
Растворитель: прозрачный раствор, не содержащий посторонних частиц. Восстановленный раствор: раствор от слегка опалесцирующего до опалесцирующего, бесцветный или светло-желтого цвета
Интерфероны относятся к цитокинам, которые являются природными белками.
Интерферон бета-lb обладает противовирусной и иммунорегулирующей активностями. Механизмы действия интерферона бета-lb при рассеянном склерозе окончательно не установлены. Однако известно, что биологический эффект интерферона бета-lb опосредуется его взаимодействием со специфическими рецепторами, которые обнаружены на поверхности клеток человека. Связывание интерферона бета-lb с этими рецепторами индуцирует экспрессию ряда веществ, которые рассматриваются в качестве медиаторов биологических эффектов интерферона бета-lb. Интерферон бета-lb снижает связывающую способность и экспрессию рецепторов к гамма-интерферону, усиливает их распад. Кроме того, интерферон бета-lb повышает супрессорную активность мононуклеарных клеток периферической крови.
Как при ремиттирующем, так и при вторично-прогрессирующем рассеянном склерозе лечение Бетафероном снижает частоту (на 30 %) и тяжесть клинических обострений болезни, число госпитализаций и потребность в лечении стероидами, а также удлиняет продолжительность ремиссии.
У больных с вторично-прогрессирующим рассеянным склерозом (PC) лечение Бетафероном позволяет задержать дальнейшее прогрессирование заболевания и наступление инвалидности, в том числе тяжелой (т.е. когда больные вынуждены постоянно пользоваться инвалидным креслом) на срок до 12 мес. Этот эффект наблюдается у больных как с обострениями заболевания, так и без обострений, а также с любым индексом инвалидизации (пациенты с оценкой от 3,0 до 6,5 баллов по расширенной шкале инвалидизации EDSS).
Результаты магнитно-резонансной томографии головного мозга больных ремиттирующим и вторично-прогрессирующим рассеянным склерозом на
Лечение Бетафероном больных после первых клинических проявлений рассеянного склероза (клинико-изолированный синдром) позволяет уменьшить риск развития достоверного рассеянного склероза на 50 %, и увеличить период до развития достоверного рассеянного склероза в среднем на 363 дня.
После подкожного введения Бетаферона в рекомендуемой дозе 0,25 мг сывороточные концентрации интерферона бета-lb низкие или вообще не определяются. В связи с этим сведений о фармакокинетике препарата у больных рассеянным склерозом, получающих Бетаферон в рекомендуемой дозе, нет.
После подкожного введения 0,5 мг Бетаферона максимальная концентрация в плазме достигается через 1-8 ч после инъекции и
составляет около 40 МЕ/мл. Абсолютная биодоступность Бетаферона при подкожном введении — около 50 %. При внутривенном применении интерферона бета-lb клиренс и период полувыведения препарата из сыворотки составляют в среднем 30 мл/мин/кг и 5 часов соответственно. Введение Бетаферона через день не приводит к повышению уровня препарата в плазме крови, а его фармакокинетика в течение курса терапии не меняется.
При подкожном применении Бетаферона в дозе 0,25 мг через день уровни маркеров биологического ответа (неоптерин, бета2-микроглобулин и иммуносупрессивный цитокин IL-10) значительно повышаются по сравнению с исходными показателями через 6-12 ч. после введения первой дозы препарата. Они достигают пика через 40-124 ч. и остаются повышенными на протяжении 7-дневного (168 ч) периода.
— первые клинические проявления рассеянного склероза (клинически изолированный синдром) — для замедления развития достоверного рассеянного склероза и развития необратимого неврологического дефицита
— ремиттирующий рассеянный склероз (РРС) — для уменьшения частоты и тяжести обострений у амбулаторных больных (т.е. пациентов, способных передвигаться без посторонней помощи) при наличии в анамнезе не менее 2-х обострений неврологической дисфункции за последние 2 года с последующим полным или неполным восстановлением неврологического дефицита
— вторично-прогрессирующий рассеянный склероз с активным течением заболевания, характеризующегося обострениями или выраженным ухудшением неврологических функций в течение последних двух лет — для уменьшения частоты и степени тяжести клинических обострений болезни, а также для замедления темпов прогрессирования заболевания
реакции гиперчувствительности на природный или рекомбинантный
интерферон-бета или другие вспомогательные вещества препарата в
анамнезе
Сообщалось о случаях возникновения самопроизвольных абортов у женщин, страдающих рассеянным склерозом. С учетом эмбриотоксического действия рекомбинантных человеческих интерферонов бета-1b, что приводит к высокой частоте развития абортов на высоких дозах препарата, женщинам репродуктивного возраста при лечении препаратом следует пользоваться надежными методами контрацепции. В случае наступления беременности во время лечения Бетафероном или планировании беременности, следует информировать женщину о потенциальном риске и рекомендуется отменить применение препарата.
Неизвестно, выделяется ли интерферон бета-1b с грудным молоком.
Учитывая теоретическую возможность развития нежелательных реакций на Бетаферон у младенцев, находящихся на грудном вскармливании, необходимо прекратить кормление грудью или отменить препарат.
Особенности влияния лекарственного средства на способность управлять автотранспортом и потенциально опасными механизмами
Развитие побочных реакций со стороны нервной системы на фоне применения Бетаферона может оказывать влияние на способность управлять автотранспортом и использовать механизмы у восприимчивых пациентов.
Лечение Бетафероном необходимо проводить под наблюдением врача, имеющего опыт лечения рассеянного склероза.
Введение препарата
Способ применения: для подкожных инъекций
Приготовление инъекционного раствора
1 мл приготовленного раствора содержит 0,25 мг (8,0 млн. МЕ) интерферона бета-1b.
Для растворения лиофилизата используют прилагаемые готовый шприц с растворителем и адаптер для флакона с иглой. Во флакон с Бетафероном вводят 1,2 мл растворителя (раствор натрия хлорида 0,54 %). Лиофилизат должен раствориться полностью без встряхивания.
Нельзя использовать поврежденные флаконы.
Перед применением следует осмотреть готовый раствор. При наличии частиц или изменении цвета раствора его нельзя применять и следует уничтожить.
Препарат следует вводить подкожно сразу после приготовления раствора. Если инъекция откладывается, то раствор следует хранить в холодильнике и использовать в течение 3 ч. Раствор нельзя замораживать.
Рекомендуемую дозу Бетаферона 0,25 мг (8 млн. МЕ), которая содержится в 1 мл приготовленного раствора, вводят подкожно через день.
Как правило, в начале лечения рекомендуется титрование дозы. Для этой цели существует специальная упаковка для титрования дозы.
Пациентам необходимо начать со стартовой дозы 62,5 мкг (0,25 мл) подкожно через день и медленно увеличивать дозу до 250 мкг (1,0 мл) через день (подробная информация касательно использования упаковки для титрования содержится в приложении).
В настоящее время остается нерешенным вопрос о продолжительности терапии Бетафероном.
У пациентов при первых клинических проявлениях рассеянного склероза эффективность была показана на протяжении 5 лет лечения.
У больных с ремиттирующим рассеянным склерозом при лечении Бетафероном в течение 5 лет эффективность препарата сохранялась на протяжении всего курса лечения.
У больных вторично-прогрессирующим рассеянным склерозом курс лечения Бетафероном составил более 2 лет, в некоторых случаях продолжительность лечения составила более 3 лет.
Частота побочных эффектов, наблюдавшихся на фоне применения Бетаферона приведена ниже в соответствии со следующей градацией: очень частые (³1/10) и частые (³1/100 до <1/10). Побочные эффекты, выявленные в ходе постмаркетинговых наблюдений перечислены как «с неизвестной частотой».
Очень часто
— лимфоцитопения (<1500/мм3), лейкопения (<3000/мм3), нейтропения
(< 1500/мм3)
— головные боли, бессонница, нарушение координации
— боли в животе
— повышение уровня аланинаминотрансферазы (АЛТ) в крови в 5 раз от
исходного
— сыпь, кожные нарушения
— боли в мышцах, гипертонус
— учащенное мочеиспускание,
— реакции в месте инъекции (различные виды0), комплекс гриппоподобных
симптомов§, боль, лихорадка, озноб, периферические отеки, астения
(слабость)
Часто
— лимфаденопатия
— артериальная гипертензия
— одышка
— повышение уровня аспартатаминотрансферазы (АСТ) в крови в 5 раз от
исходного
— метроррагия*, импотенция**
— некроз в месте инъекции
— боли в груди, общее недомогание
С неизвестной частотой
— анемия, тромбоцитопения
— анафилактические реакции, синдром повышенной капиллярной
проницаемости у больных с ранее существовавшей моноклональной
гаммапатией
— нарушения функции щитовидной железы, гипертиреоз, гипотиреоз
— повышение уровня триглицеридов в плазме крови, анорексия, снижение
массы тела, прибавка массы тела
— депрессия, суицидальные попытки, спутанность сознания, беспокойство,
эмоциональная лабильность
— судороги, головокружение
— кардиомиопатия, тахикардия, сердцебиение
— вазодилатация
— бронхоспазм
— тошнота, рвота, диарея, панкреатит
— повышение уровня билирубина, активности g-глютамилтрансферазы
(g-ГТ) в плазме крови, нарушения печени, в том числе гепатит, печеночная
недостаточность
— алопеция, крапивница, зуд кожи, изменение цвета кожи
— боли в суставах
— нарушения менструального цикла, меноррагия
— потливость
* у женщин в пременопаузе
** у мужчин
0Реакции в месте инъекции (различные) включают все побочные эффекты, возникавшие на месте инъекции (за исключением некроза), например реакция, геморрагия, гиперчувствительность, воспаление, уплотнение, боль, отек, атрофия в месте инъекции
§ Комплекс гриппоподобных симптомов обозначает синдром гриппа и/или комбинацию, по крайней мере, двух нежелательных явлений из перечисленных ниже, таких как лихорадка, озноб, мышечные боли, общее недомогание, потливость.
Специальные исследования взаимодействия Бетаферона с другими препаратами не проводились.
На фоне применения Бетаферона кортикостероиды и адренокортикотропный гормон (АКТГ), назначаемые на срок до 28 дней при лечении обострений, переносятся хорошо.
Применение Бетаферона одновременно с другими иммуномодуляторами, помимо кортикостероидов или АКТГ, не изучалось.
Интерфероны снижают активность печеночных цитохром Р450-зависимых ферментов у человека и животных. Поэтому необходимо соблюдать осторожность при назначении Бетаферона в комбинации с медицинскими препаратами, имеющими узкий терапевтический индекс, клиренс которых в значительной степени зависит от печеночной системы цитохрома Р450 (например, противоэпилептические средства, антидепрессанты). Необходимо также соблюдать осторожность при одновременном применении любых препаратов, влияющих на систему кроветворения.
Для того, чтобы улучшить переносимость Бетаферона, как правило, в начале лечения рекомендуется титрование дозы.
Частота возникновения гриппоподобных симптомов снижается со временем. Возникновение гриппоподобных симптомов также может быть снижено назначением нестероидных противовоспалительных препаратов. Частота реакций в месте введения препарата (например, гиперемия, локальный отёк, изменение цвета кожи, воспаление, боль, гиперчувствительность, некроз и неспецифические реакции) со временем при продолжении лечения обычно снижается. Использование автоинжектора позволяет снизить частоту возникновения реакций в месте инъекции.
Нарушения со стороны нервной системы
Пациентов, которым показано лечение Бетафероном, следует информировать о том, что при лечении препаратом может быть появление депрессивных нарушений и суицидальных мыслей, о чем незамедлительно следует сообщить лечащему врачу. В редких случаях эти симптомы могут привести к суицидальным попыткам. Пациенты с проявлениями депрессии и суицидальных мыслей должны находиться под тщательным наблюдением врача. При необходимости следует рассмотреть вопрос о прекращении терапии у таких пациентов.
Существенных различий частоты развития депрессии и суицидальных мыслей при применении Бетаферона или плацебо выявлено не было.
Тем не менее, поскольку у отдельных пациентов нельзя полностью исключить возможную связь между развитием депрессии и суицидальных мыслей, и терапией Бетафероном, следует проявлять осторожность при назначении Бетаферона больным с депрессивными расстройствами и суицидальными мыслями в анамнезе.
Следует с осторожностью назначать Бетаферон пациентам с судорожными приступами в анамнезе.
Иммунные нарушения
Применение цитокинов у больных с моноклональной гаммапатией (редким заболеванием иммунной системы, характеризующимся появлением патологических белков в крови) иногда сопровождалось системным повышением проницаемости капилляров с шокоподобными симптомами и летальным исходом.
Нейтрализующие антитела
Как и для других препаратов белковой природы существует вероятность развития иммуногенности. При лечении Бетафероном в организме могут вырабатываться так называемые нейтрализующие антитела к действующему компоненту Бетаферона. Не было доказано, что наличие нейтрализующих антител сколько-нибудь значительно влияет на клинические результаты, включая данные МРТ. С развитием нейтрализующей активности не связывалось появление каких-либо побочных реакций. Решение о продолжении терапии Бетафероном основывается с учетом всех аспектов статуса заболевания пациента, а не на статусе нейтрализующей активности отдельно.
Желудочно-кишечные нарушения
Во время применения Бетаферона наблюдались случаи выявления панкреатита, часто сопровождаемого гипертриглицеридемией.
Нарушения функции печени и желчевыводящих путей
Асимптомные повышения уровней сывороточных трансаминаз, в большинстве случаев легкие и транзиторные, могут возникать во время лечения Бетафероном.
Как и при лечении другими бета-интерферонами, тяжелые поражения печени (включая печеночную недостаточность) при применении Бетаферона наблюдаются редко. Большинство тяжелых нарушений функции печени чаще возникает у больных принимающих лекарства или вещества, связанные с гепатотоксичностью или при наличии сопутствующих патологических состояний (например, метастазирующая злокачественная опухоль, выраженные инфекции и сепсис, злоупотребление алкоголем).
При наблюдении пациентов следует обращать внимание на признаки, указывающие на нарушение функции печени. При повышенной активности трансаминаз сыворотки рекомендуется проводить наблюдение и обследование пациента. При значительном повышении активности печеночных ферментов или при сочетании данного повышения с клиническими симптомами, такими как желтуха, следует рассмотреть вопрос о необходимости отмены Бетаферона. При исчезновении клинических признаков нарушения функции печени и после нормализации уровня печеночных ферментов следует рассмотреть возможность возобновления терапии при соответствующем наблюдении за функцией печени.
Заболевания сердечно-сосудистой системы
Бетаферон следует назначать с осторожностью у пациентов, имеющих серьезные заболевания сердца, такие как застойная сердечная недостаточность, ишемическая болезнь сердца или аритмии. Несмотря на то, что нет доказательств прямого кардиотоксического влияния Бетаферона, этих пациентов следует наблюдать для выявления ухудшения состояния сердца. Это в частности, относится к началу лечения Бетафероном, когда гриппоподобные симптомы, обычно связанные с применением бета-интерферонов, вызывают нагрузку на сердце за счет лихорадки, озноба, тахикардии. Это может усилить симптоматику у пациентов, имеющих серьезные заболевания сердца. При развитии кардиомиопатии и ее возможной связи с применением Бетаферона, следует прекратить лечение препаратом.
Общие нарушения и состояние места инъекции
Могут наблюдаться тяжелые реакции гиперчувствительности (выраженные острые реакции, такие как бронхоспазм, анафилаксия и крапивница).
У пациентов, получавших Бетаферон, наблюдались случаи некроза в месте инъекции. Некроз может быть обширным и распространяться на мышечные фасции, а также жировую прослойку и, как следствие, приводить к образованию шрамов. В некоторых случаях необходимо удаление омертвевших участков или, реже, пересадка кожи. Процесс заживления при этом может занимать до 6 месяцев. При появлении множественных очагов некроза лечение Бетафероном следует прекратить до полного заживления поврежденных участков. При наличии одного очага, если некроз не слишком обширен, использование Бетаферона может быть продолжено, поскольку у некоторых пациентов заживление омертвевшего участка в месте инъекции происходило на фоне применения Бетаферона.
С целью снижения риска развития реакции и некроза в месте инъекции, больным следует рекомендовать:
— проводить инъекции в стерильных условиях;
— каждый раз менять место инъекции;
— вводить препарат строго подкожно.
Периодически следует контролировать правильность выполнения самостоятельных инъекций, особенно при появлении реакций в местах введения препарата.
Изменения лабораторных показателей
Кроме стандартных лабораторных анализов, назначаемых при ведении пациентов с рассеянным склерозом, перед началом лечения и регулярно в процессе лечения Бетафероном, а затем периодически при отсутствии клинических симптомов рекомендуется производить развернутый анализ крови, включая определение лейкоцитарной формулы, числа тромбоцитов и химического состава крови, а также проверять функцию печени (например, активность аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и g-гаммаглютамилтрансферразы (ГТ).
Пациентам с дисфункцией щитовидной железы рекомендуется проверять функцию щитовидной железы регулярно, а в остальных случаях – в соответствии с клиническими показаниями.
При ведении пациентов с анемией, тромбоцитопенией, лейкопенией (одиночной или комбинированной) может потребоваться более тщательный мониторинг развернутого анализа крови, включая дифференциальный анализ и определение количества тромбоцитов.
Применение в педиатрии
Эффективность и безопасность Бетаферона у детей и подростков младше 18 лет систематически не исследовалась. Тем не менее, ограниченные данные свидетельствуют о том, что профиль безопасности у подростков старше 12 лет при применении Бетаферона в дозе 250 мкг подкожно через день сходен с профилем безопасности у взрослых.
Ввиду недостаточности данных по применению Бетаферона у детей младше 12 лет, препарат не следует назначать в данной возрастной группе.
1 флакон с лиофилизатом, 1 стеклянный шприц с растворителем (1,2 мл 0,54 % раствор натрия хлорида), 1 адаптер с иглой для флакона и 2 спиртовые салфетки помещают в разовую картонную упаковку. По 15 разовых упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
по 3 флакона с лиофилизатом, 3 стеклянных шприца с растворителем (1,2 мл 0,54 % раствор натрия хлорида), 3 адаптера с иглой для флакона и 6 спиртовых салфеток помещают в картонные упаковки желтого, красного, зеленого и синего цвета, пронумерованные как упаковка №1, №2, №3, №4, соответственно. По 4 коробки вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Хранить при температуре не выше 25°С. Не замораживать.
Хранить в недоступном для детей месте!
Лиофилизат– 2 года
Растворитель – 3 года
· Иммунные нарушения
Применение цитокинов у больных с моноклональной гаммапатией (редким заболеванием иммунной системы, характеризующимся появлением патологических белков в крови) иногда сопровождалось системным повышением проницаемости капилляров с шокоподобными симптомами и летальным исходом.
· Желудочно-кишечные нарушения
Во время применения Бетаферона® в редких случаях наблюдались случаи выявления панкреатита, часто сопровождаемого гипертриглицеридемией.
· Нарушения со стороны нервной системы
Бетаферон® следует назначать с осторожностью у пациентов, имеющих депрессивные нарушения в анамнезе или в настоящее время, в частности суицидальные мысли. Как известно, депрессия и суицидальные мысли с большей частотой встречаются в популяции больных рассеянным склерозом, в том числе на фоне лечения интерферонами. Пациентов, которым показано лечение Бетафероном®, следует информировать о том, что при лечении препаратом может быть появление депрессивных нарушений и суицидальных мыслей, о чем незамедлительно следует сообщить лечащему врачу. В редких случаях эти симптомы могут привести к суицидальным попыткам. Пациенты с проявлениями депрессии и суицидальных мыслей должны находиться под тщательным наблюдением врача. При необходимости следует рассмотреть вопрос о прекращении терапии у таких пациентов.
Следует с осторожностью назначать Бетаферон® пациентам с судорожными приступами в анамнезе и пациентам, получающим противоэпилептическое лечение, особенно когда эпилептические приступы недостаточно контролируются противоэпилептическими средствами.
Препарат содержит человеческий альбумин, и по этой причине существует потенциальный риск передачи вирусных заболеваний. Нельзя исключить риск передачи болезни Крейтцфельдта-Якоба.
Изменения лабораторных показателей
Пациентам с дисфункцией щитовидной железы рекомендуется проверять функцию щитовидной железы регулярно, а в остальных случаях – в соответствии с клиническими показаниями.
Кроме стандартных лабораторных анализов, назначаемых при ведении пациентов с рассеянным склерозом, перед началом лечения и регулярно в процессе лечения Бетафероном®, а затем периодически при отсутствии клинических симптомов рекомендуется производить развернутый анализ крови, включая определение лейкоцитарной формулы, числа тромбоцитов и химического состава крови, а также проверять функцию печени (например, активность аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и g-гаммаглютамилтрансферразы (ГТ).
При ведении пациентов с анемией, тромбоцитопенией, лейкопенией (одиночной или комбинированной) может потребоваться более тщательный мониторинг развернутого анализа крови, включая дифференциальный анализ и определение количества тромбоцитов.
Нарушения функции печени и желчевыводящих путей
Асимптомные повышения уровней сывороточных трансаминаз, в большинстве случаев легкие и транзиторные, могут возникать во время лечения Бетафероном®.
Как и при лечении другими бета-интерферонами, тяжелые поражения печени (включая печеночную недостаточность) при применении Бетаферона® наблюдаются редко. Большинство тяжелых нарушений функции печени чаще возникает у больных принимающих лекарства или вещества, связанные с гепатотоксичностью или при наличии сопутствующих патологических состояний (например, метастазирующая злокачественная опухоль, выраженные инфекции и сепсис, злоупотребление алкоголем).
При наблюдении пациентов следует обращать внимание на признаки, указывающие на нарушение функции печени. При повышенной активности трансаминаз сыворотки рекомендуется проводить наблюдение и обследование пациента. При значительном повышении активности печеночных ферментов или при сочетании данного повышения с клиническими симптомами, такими как желтуха, следует рассмотреть вопрос о необходимости отмены Бетаферона®. При исчезновении клинических признаков нарушения функции печени и после нормализации уровня печеночных ферментов следует рассмотреть возможность возобновления терапии при соответствующем наблюдении за функцией печени.
· Нарушения функции почек и мочевыводящих путей
Необходимо соблюдать осторожность и осуществлять тщательный мониторинг при назначении препарата у пациентов с тяжелой почечной недостаточностью.
· Нефротический синдром
Во время лечения препаратами бета- интерферона сообщалось о случаях развития нефротического синдрома в виде основных нефропатий, включая фокальный сегментарный гломерулосклероз, липоидный нефроз, мембранопролиферативный гломерулонефрит и мембранозную гломерулопатию Данные заболевания отмечались в разное время на протяжении лечения и могут появляться через несколько лет применения препаратов бета-интерферона.
Рекомендовано проводить регулярный мониторинг на выявление ранних признаков или симптомов, таких как отеки, протеинурия или нарушение функции почек, особенно у пациентов с высоким риском заболевания почек. Необходимо провести незамедлительное лечение нефротического синдрома, а также рассмотреть возможность прекращения лечения Бетафероном®
· Заболевания сердечно-сосудистой системы
Бетаферон® следует назначать с осторожностью у пациентов, имеющих серьезные заболевания сердца, такие как застойная сердечная недостаточность, ишемическая болезнь сердца или аритмии. Несмотря на то, что нет доказательств прямого кардиотоксического влияния Бетаферона®, этих пациентов следует наблюдать для выявления ухудшения состояния сердца. Бетаферона® не обладает известным прямым кардиотоксическим действием, однако гриппоподобные симптомы, обычно связанные с применением бета-интерферонов, вызывают нагрузку на сердце за счет лихорадки, озноба, тахикардии. Это может усилить симптоматику у пациентов, имеющих серьезные заболевания сердца. По данным постмаркетингового опыта у пациентов, имеющих серьезные заболевания сердца в редких случаях сообщалось об ухудшении функции сердца во временной взаимосвязи с началом лечения Бетаферона®.
В редких случаях сообщалось о развитии кардиомиопатии. При развитии кардиомиопатии и ее возможной связи с применением Бетаферона®, следует прекратить лечение препаратом.
· Тромботическая микроангиопатия (ТМА)
На фоне лечения препаратами бета-интерферона сообщалось о случаях развития тромботической микроангиопатии, проявляющейся в виде тромботической тромбоцитопенической пурпуры или гемолитического уремического синдрома, в том числе с летальным исходом.
Данные осложнения отмечались в разное время на протяжении лечения, и могут появляться через несколько недель до нескольких лет после начала лечения бета-интерфероном.
Ранние клинические симптомы заболевания включают тромбоцитопению, внезапное начало артериальной гипертензии, лихорадку, признаки нарушений со стороны центральной нервной системы (например, спутанность сознания, парез) и нарушения почечной функции.
Результаты лабораторных тестов, свидетельствующих о возможности наличия ТМА, включают снижение количества тромбоцитов, повышение уровня лактатдегидрогеназы (ЛДГ) в сыворотке крови вследствие гемолиза и шистоцитов (фрагменты эритроцита) в мазке крови.
Соответственно при выявлении клинических симптомов ТМА рекомендуется провести исследование уровня тромбоцитов и ЛДГ в сыворотке, мазка крови и показателей функции почек. При подтверждении ТМА, необходимо провести незамедлительное лечение (предусматривает проведение плазмафереза), а также рассмотреть возможность незамедлительного прекращения лечения Бетафероном®.
· Общие нарушения и состояние места инъекции
Могут наблюдаться тяжелые реакции гиперчувствительности (выраженные острые реакции, такие как бронхоспазм, анафилаксия и крапивница).
У пациентов, получавших Бетаферон®, наблюдались случаи некроза в месте инъекции. Некроз может быть обширным и распространяться на мышечные фасции, а также жировую прослойку и, как следствие, приводить к образованию шрамов. В некоторых случаях необходимо удаление омертвевших участков или, реже, пересадка кожи. Процесс заживления при этом может занимать до 6 месяцев.
Если у пациента отмечается какое-либо повреждение целостности кожи, которое может быть связано с отеком или истечением жидкости из места инъекции, необходимо обратиться к лечащему врачу, прежде чем продолжить выполнение инъекций Бетаферона®.
При появлении множественных очагов некроза лечение Бетафероном® следует прекратить до полного заживления поврежденных участков. При наличии одного очага, если некроз не слишком обширен, использование Бетаферона® может быть продолжено, поскольку у некоторых пациентов заживление омертвевшего участка в месте инъекции происходило на фоне применения Бетаферона®.
С целью снижения риска развития реакции и некроза в месте инъекции, больным следует рекомендовать:
— проводить инъекции в стерильных условиях;
— каждый раз менять место инъекции;
— вводить препарат строго подкожно.
Периодически следует контролировать правильность выполнения самостоятельных инъекций, особенно при появлении реакций в местах введения препарата.
Частота реакций в месте введения препарата (например, гиперемия, локальный отёк, изменение цвета кожи, воспаление, боль, гиперчувствительность, некроз и неспецифические реакции) со временем при продолжении лечения обычно снижается. Использование автоинжектора позволяет снизить частоту возникновения реакций в месте инъекции.
· Иммуногенность/нейтрализующие антитела
Как и для других препаратов белковой природы существует вероятность развития иммуногенности. В контролируемых клинических исследованиях отбор образцов сыворотки осуществлялся каждые 3 месяца с целью мониторинга развития антител к Бетаферону®.
В различных контролируемых клинических исследованиях при ремиттирующем рассеянном склерозе и вторично-прогрессирующем рассеянном склерозе, у 23-41% пациентов отмечалось развитие нейтрализующей активности к интерферону бета-1b, что подтверждалось, по крайней мере, двумя последовательными положительными титрами.
У 43 — 55% данных пациентов отмечался переход в стабильный отрицательный статус (основано на двух последовательных отрицательных титрах) в течение последующего наблюдательного периода соответствующего исследования.
Развитие нейтрализующей активности в этих исследованиях связано со снижением клинической эффективности только в отношении обострений.
Полагают, что указанный эффект может отмечаться в большей степени у пациентов с более высокими уровнями титра нейтрализующей активности
В исследовании пациентов с первыми клиническими проявлениями при подозрении на рассеянный склероз, нейтрализующая активность, измеренная каждые 6 месяцев, наблюдалась, по крайней мере, у 32% (89) пациентов, с самого начала получавших лечение Бетафероном®. Из них у 60% (53) наблюдалось возвращение к отрицательному статусу, по данным последней оценки за 5-летний период. В пределах этого периода развитие нейтрализующей активности было связано со значимым увеличением новых активных очагов и объема Т2 очага при проведении магнитно-резонансной томографии. Однако, это не было связано со снижением клинической эффективности (в отношении времени до перехода в достоверный рассеянный склероз), времени до подтвержденного прогрессирования симптоматики по шкале EDSS и частоты рецидивов).
С развитием нейтрализующей активности не связывалось появление каких-либо побочных реакций.
В исследованиях ин-витро показано, что Бетаферон® перекрестно реагирует с интерфероном-бета натурального происхождения. Поскольку исследований ин-виво не проводилось, его клиническое значение не ясно.
Имеются редкие и неубедительные данные по пациентам, у которых развивалась нейтрализующая активность, и которые завершили терапию Бетафероном®.
Решение о продолжении терапии Бетафероном® основывается с учетом всех аспектов статуса заболевания пациента, а не на статусе нейтрализующей активности отдельно.
Применение в педиатрии
Никаких официальных клинических испытаний или фармакокинетических исследований не были проведены у детей и подростков. Тем не менее, ограниченные опубликованные данные свидетельствуют о том, что профиль безопасности у подростков от 12 до 16 лет при применении Бетаферона® 8.0 млн МЕ подкожно через день сходен с профилем безопасности у взрослых. Нет информации об использовании Бетаферона детей в возрасте до 12 лет. Бетаферон не должен использоваться в данной возрастной группе.
Беременность и лактация
Данные о применении Бетаферона® во время беременности ограничены. Сообщалось о случаях возникновения самопроизвольных абортов у женщин, страдающих рассеянным склерозом. Начало терапии во время беременности противопоказано (см. раздел «Противопоказания»)
Женщинам репродуктивного возраста при лечении препаратом следует пользоваться надежными методами контрацепции. В случае наступления беременности во время лечения Бетафероном® или планировании беременности, следует информировать женщину о потенциальном риске и рекомендуется отменить применение препарата. У пациенток с высокой частотой обострений до начала лечения, риск тяжелого обострения после прекращения терапии Бетафероном® при наступлении беременности следует взвесить в сравнении с возможным повышенным риском спонтанного аборта.
Неизвестно, выделяется ли интерферон бета-1b с грудным молоком.
Учитывая теоретическую возможность развития нежелательных реакций на Бетаферон® у младенцев, находящихся на грудном вскармливании, необходимо прекратить кормление грудью или отменить препарат.
Особенности влияния лекарственного средства на способность управлять автотранспортом и потенциально опасными механизмами
Специальные исследования влияния препарата на способность управлять автотранспортом и использовать механизмы не проводились. Развитие побочных реакций со стороны нервной системы на фоне применения Бетаферона® может оказывать влияние на способность управлять автотранспортом и использовать механизмы у восприимчивых пациентов.
