Актуально на: 13 ноября 2017 г.
0
В должностной инструкции конкретизируется объем обязанностей и работ, которые должно выполнять лицо, занимающее определенную должность. Должностная инструкция в соответствии с Общероссийским классификатором управленческой документации, или ОКУД, ОК 011-93 (утв. Постановлением Госстандарта от 30.12.1993 № 299) отнесена к документации по организационно-нормативному регулированию деятельности организации. К группе таких документов наряду с должностной инструкцией причислены, в частности, правила внутреннего трудового распорядка, положение о структурном подразделении, штатное расписание.
Обязательна ли должностная инструкция?
ТК РФ не обязывает работодателей составлять должностные инструкции. Ведь в трудовом договоре с работником всегда должна быть раскрыта его трудовая функция (работа по должности в соответствии со штатным расписанием, профессии, специальности с указанием квалификации или конкретный вид поручаемой ему работы) (ст. 57 ТК РФ). А потому и привлечь работодателя к ответственности за отсутствие должностных инструкций нельзя.
В то же время именно должностная инструкция обычно является документом, в котором трудовая функция работника конкретизируется. Инструкция содержит перечень должностных обязанностей работника с учетом особенностей организации производства, труда и управления, прав работника и его ответственности (Письмо Роструда от 30.11.2009 № 3520-6-1). Более того, в должностной инструкции обычно не только раскрывается трудовая функция работника, но и приводятся квалификационные требования, которые предъявляются к занимаемой должности или выполняемой работе (Письмо Роструда от 24.11.2008 № 6234-ТЗ).
Наличие должностных инструкций упрощает процесс взаимодействия работника и работодателя по вопросам содержания трудовой функции, прав и обязанностей работника и предъявляемых к нему требований. То есть всех тех вопросов, которые часто возникают во взаимоотношениях как с действующими работниками, так и вновь принимаемыми, а также с претендентами на определенную должность.
Роструд считает, что должностная инструкция необходима в интересах как работодателя, так и работника. Ведь наличие должностной инструкции поможет (Письмо Роструда от 09.08.2007 № 3042-6-0):
- объективно оценить деятельность работника в период испытательного срока;
- обоснованно отказать в приеме на работу (ведь в инструкции могут содержаться дополнительные требования, связанные с деловыми качествами работника);
- распределить трудовые функции между работниками;
- временно перевести работника на другую работу;
- оценить добросовестность и полноту выполнения работником трудовой функции.
Именно поэтому составление должностных инструкций в организации является целесообразным.
Такая инструкция может являться приложением к трудовому договору или утверждаться как самостоятельный документ.
Как составляется должностная инструкция
Должностная инструкция обычно составляется на основе квалификационных характеристик, которые содержатся в квалификационных справочниках (например, в Квалификационном справочнике должностей руководителей, специалистов и других служащих, утвержденном Постановлением Минтруда от 21.08.1998 № 37).
Для работников, которые принимаются на работу по профессиям рабочих, для определения их трудовой функции используются единые тарифно-квалификационные справочники работ и профессий рабочих по соответствующим отраслям. Разработанные на основе таких справочников инструкции обычно называются производственными. Однако в целях унификации и упрощения внутренней документации в организации инструкции для рабочих профессий часто также именуются должностными.
При составлении должностных инструкций организации также руководствуются профессиональными стандартами.
Поскольку должностная инструкция является внутренним организационно-распорядительным документом, работодатель обязан ознакомить с ней работника под роспись при приеме его на работу (до подписания трудового договора) (ч. 3 ст. 68 ТК РФ).
Должностная инструкция инженера по качеству
Приведем пример заполнения должностной инструкции инженера по качеству.
Скачать бланк должностной инструкции инженера по качеству можно
![]()
Скачивать формы могут только подписчики журнала
Вы подписчик?
Войдите на сайт и скачивайте нужные формы
Войти на сайт
Вы не подписчик?
Попробуйте все возможности подписки. Бесплатно на 2 дня
Пробный доступ
Скачать
.
ИНЖЕНЕР ПО КАЧЕСТВУ
Должностные обязанности. Обеспечивает выполнение заданий по повышению качества выпускаемой продукции, выполняемых работ (услуг), осуществляет контроль за деятельностью подразделений предприятия по обеспечению соответствия продукции, работ (услуг) современному уровню развития науки и техники, требованиям потребителей на внутреннем рынке, а также экспортным требованиям и др. Участвует в разработке, совершенствовании и внедрении системы управления качеством, создании стандартов и нормативов качественных показателей, контролирует их соблюдение. Анализирует информацию, полученную на различных этапах производства продукции, работ (услуг), показатели качества, характеризующие разрабатываемую и выпускаемую продукцию, работы (услуги) и принимает меры по предотвращению выпуска продукции, производства работ (услуг), не соответствующих установленным требованиям. Рассматривает и анализирует рекламации и претензии к качеству продукции, работ (услуг), готовит заключения и ведет переписку по результатам их рассмотрения. Изучает причины, вызывающие ухудшение качества продукции (работ, услуг), выпуск брака, участвует в разработке и внедрении мероприятий по их устранению. Подготавливает заключения о соответствии качества поступающих на предприятие сырья, материалов, полуфабрикатов, комплектующих изделий стандартам, техническим условиям и оформляет документы для предъявления претензий поставщикам. Изучает передовой отечественный и зарубежный опыт по разработке и внедрению систем управления качеством. Принимает участие в создании стандартов предприятия по управлению качеством, в работах по подготовке продукции к сертификации и аттестации, в подготовке мероприятий, связанных с внедрением стандартов и технических условий на выпускаемую предприятием продукцию, а также в разработке и внедрении наиболее совершенных систем и методов контроля, предусматривающих автоматизацию и механизацию контрольных операций и создание необходимых для этих целей средств, в том числе средств неразрушающего контроля. Принимает участие в разработке методик и инструкций по текущему контролю качества работ в процессе изготовления продукции, в испытаниях готовых изделий и оформлении документов, удостоверяющих их качество. Разрабатывает и организует выполнение мероприятий по результатам государственного надзора, межведомственного и вневедомственного контроля за внедрением и соблюдением стандартов и технических условий по качеству продукции, подготовке продукции к сертификации и аттестации. Ведет учет и составляет отчетность о деятельности предприятия по управлению качеством продукции.
Должен знать: постановления, распоряжения, приказы, методические и нормативные материалы по управлению качеством продукции; систему государственного надзора, межведомственного и ведомственного контроля за качеством продукции; технологические процессы и режимы производства; основные технологические и конструктивные данные выпускаемой продукции; действующие в отрасли и на предприятии стандарты и технические условия; виды производственного брака, методы его предупреждения и устранения; порядок предъявления и рассмотрения рекламаций по качеству сырья, материалов, полуфабрикатов, комплектующих изделий и готовой продукции; требования, предъявляемые к технической документации, сырью, материалам, полуфабрикатам, комплектующим изделиям и готовой продукции, системы, методы и средства контроля их качества; правила проведения испытаний и приемки продукции; порядок подготовки промышленной продукции к сертификации и аттестации; организацию учета, порядок и сроки составления отчетности о качестве продукции; основы экономики, организации производства, труда и управления; основы трудового законодательства; правила и нормы охраны труда.
Требования к квалификации.
Инженер по качеству I категории: высшее профессиональное (техническое) образование и стаж работы в должности инженера по качеству II категории не менее 3 лет.
Инженер по качеству II категории: высшее профессиональное (техническое) образование и стаж работы в должности инженера по качеству или других инженерно-технических должностях, замещаемых специалистами с высшим профессиональным образованием, не менее 3 лет.
Инженер по качеству: высшее профессиональное (техническое) образование без предъявления требований к стажу работы или среднее профессиональное (техническое) образование и стаж работы в должности техника I категории не менее 3 лет либо других должностях, замещаемых специалистами со средним профессиональным (техническим) образованием, не менее 5 лет.
ДОЛЖНОСТНАЯ ИНСТРУКЦИЯ
главного специалиста по качеству
1. Общие положения
1.1. Настоящая должностная инструкция определяет функциональные, должностные обязанности, права и ответственность главного специалиста по качеству подразделения «Лекарственные технологии» (далее — Главный специалист по качеству) Общероссийская общественная организация «Российский союз промышленников и предпринимателей» (далее Учреждение).
1.2. На должность главного специалиста по качеству назначается лицо, удовлетворяющее следующим требованиям к образованию и обучению:
- Высшее образование — бакалавриат;
- Высшее образование — специалитет, магистратура;
с опытом практической работы:
- Для лиц, ответственных за производство, качество и маркировку, и уполномоченных лиц — в соответствии с требованиями законодательства и нормативных правовых актов Российской Федерации;
- Не менее двух лет работы по специальности при наличии высшего образования по программам магистратуры, специалитета;
- Не менее пяти лет работы по специальности при наличии высшего образования по программам бакалавриата;
Особые условия допуска к работе главного специалиста по качеству :
- Для лиц, ответственных за производство, качество и маркировку — документ о повышении квалификации не реже одного раза в пять летДля уполномоченных лиц — документ о повышении квалификации не реже одного раза в пять лет, аттестация в качестве уполномоченного лица производителя лекарственных средств для медицинского применения;
- Прохождение обязательных предварительных (при поступлении на работу) и периодических медицинских осмотров (обследований), а также внеочередных медицинских осмотров (обследований) в порядке, установленном законодательством Российской Федерации;
1.3. Главный специалист по качеству должен знать:
- Порядок государственной регистрации лекарственных препаратов, выдачи разрешений на проведение клинических исследований лекарственных препаратов и требования к регистрационному досье на лекарственный препарат;
- Фармацевтическая технология в отношении готовой продукции;
- Порядок ввоза в Российскую Федерацию и вывоза из Российской Федерации лекарственных препаратов для проведения клинических исследований;
- Организация технологической и инженерной подготовки производства, вспомогательных инженерных систем;
- Требования Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза, правил надлежащей производственной практики, нормативных правовых актов и стандартов в области системы качества лекарственных средств;
- Принципы обеспечения качества испытаний лекарственных средств, исходного сырья и упаковочных материалов, промежуточной продукции и объектов производственной среды;
- Принципы валидации технологических процессов и аналитических методик, квалификации помещений и оборудования, инженерных систем;
- Методы статистического управления качеством, математической статистики, применяемые при оценке результатов выполненных испытаний и валидации;
- Методы и инструменты управления рисками для качества лекарственных средств;
- Лицензионные требования при производстве лекарственных средств;
- Методы фармакопейного анализа в отношении готовой продукции;
- Этапы проектирования, квалификации и эксплуатации зданий, помещений и инженерных систем фармацевтического производства и требования к ним;
- Регламентирующая и регистрирующая документация фармацевтической системы качества;
- Принципы разработки и постановки на производство новых лекарственных средств;
- Особенности процессов определения вероятностей и причин возникновения отклонений, возможности их устранения;
- Принципы стандартизации и контроля качества лекарственных средств;
- Фармацевтическая микробиология;
- Методы и инструменты проведения аудитов качества (самоинспекции) фармацевтического производства, контрактных производителей, поставщиков исходного сырья и упаковочных материалов;
- Требования санитарного режима, охраны труда, пожарной безопасности, экологии окружающей среды, порядок действий при чрезвычайных ситуациях;
- Делопроизводство, виды и формы документации;
- Оценка рисков при контаминации и перепутывании продукции;
- Элементы планирования клинических исследований, исследований по изучению стабильности лекарственных средств;
- Последствия несоблюдения лицензионных требований;
- Методы поиска причин несоответствий установленным требованиям при производстве лекарственных средств;
- Требования санитарного режима, охраны труда, пожарной безопасности, экологии окружающей среды, порядок действий при чрезвычайных ситуациях;
- Принципы стандартизации и контроля качества лекарственных средств;
- Методы предупреждения контаминации и перепутывания продукции;
- Этапы проектирования, квалификации и эксплуатации зданий, помещений и инженерных систем фармацевтического производства и требования к ним;
- Принципы разработки документации и управления регламентирующей и регистрирующей документацией в соответствии с установленными требованиями;
- Требования к регистрации лекарственных средств;
- Принципы разработки и постановки на производство новых лекарственных средств;
- Методы статистического управления качеством, математической статистики, применяемые при оценке результатов выполненных испытаний и валидации;
- Лицензионные требования при производстве лекарственных средств;
- Делопроизводство, виды и формы документации;
- Принципы валидации технологических процессов и аналитических методик, квалификации помещений и оборудования, инженерных систем;
- Фармацевтическая микробиология;
- Принципы обеспечения качества испытаний лекарственных средств, исходного сырья и упаковочных материалов, промежуточной продукции и объектов производственной среды;
- Последствия несоблюдения лицензионных требований;
- Требования Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза, правил надлежащей производственной практики, нормативных правовых актов и стандартов в области системы качества лекарственных средств;
- Организация технологической и инженерной подготовки производства, вспомогательных инженерных систем;
- Требования надлежащей производственной практики, нормативных правовых актов и стандартов в области системы качества лекарственных средств в отношении персонала;
- Санитарно-гигиенические требования к помещениям и персоналу;
- Трудовое законодательство Российской Федерации;
- Требования санитарного режима, охраны труда, пожарной безопасности, экологии окружающей среды, порядок действий при чрезвычайных ситуациях;
- Нормы делового общения и культуры, профессиональной психологии, этики и деонтологии;
- Локальные акты по направлениям деятельности;
- Виды, правила и периодичность прохождения медосмотров;
- Требования к отчетной документации, структура и состав отчетной документации по кадрам;
- Кадровый менеджмент;
- Виды стимулирования персонала;
- Принципы валидации технологических процессов и аналитических методик, квалификации помещений и оборудования, инженерных систем;
- Методы предупреждения контаминации и перепутывания продукции;
- Требования Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза, правил надлежащей производственной практики, нормативных правовых актов и стандартов в области системы качества лекарственных средств;
- Принципы обеспечения качества испытаний лекарственных средств, исходного сырья и упаковочных материалов, промежуточной продукции и объектов производственной среды;
- Требования к регистрации лекарственных средств;
- Лицензионные требования при производстве лекарственных средств;
- Принципы разработки документации и управления регламентирующей и регистрирующей документацией в соответствии с установленными требованиями;
- Методы статистического управления качеством, математической статистики, применяемые при оценке результатов выполненных испытаний и валидации;
- Этапы проектирования, квалификации и эксплуатации зданий, помещений и инженерных систем фармацевтического производства и требования к ним;
- Фармацевтическая микробиология;
- Принципы стандартизации и контроля качества лекарственных средств;
- Делопроизводство, виды и формы документации;
- Требования санитарного режима, охраны труда, пожарной безопасности, экологии окружающей среды, порядок действий при чрезвычайных ситуациях;
- Принципы разработки и постановки на производство новых лекарственных средств;
- Организация технологической и инженерной подготовки производства, вспомогательных инженерных систем;
- Требования санитарного режима, охраны труда, пожарной безопасности, экологии окружающей среды, порядок действий при чрезвычайных ситуациях;
- Требования Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза, правил надлежащей производственной практики, нормативных правовых актов и стандартов в области системы качества лекарственных средств;
- Делопроизводство, виды и формы документации;
- Формы и методы работы с применением автоматизированных средств управления и информационных систем;
- Последствия несоблюдения лицензионных требований;
- Лицензионные требования при производстве лекарственных средств;
- Методы и инструменты управления рисками для качества лекарственных средств;
- Методы поиска причин несоответствий установленным требованиям при производстве лекарственных средств;
- Регламентирующая и регистрирующая документация фармацевтической системы качества производства лекарственных средств;
- Особенности процессов определения вероятностей и причин возникновения отклонений, возможности их устранения;
- Методы статистического управления качеством, математической статистики, применяемые при оценке результатов выполненных испытаний и валидации;
- Принципы стандартизации и контроля качества лекарственных средств;
1.4. Главный специалист по качеству должен уметь:
- Производить анализ отчетов (обзоров) по качеству лекарственных средств;
- Оформлять решения о выпуске продукции в обращение;
- Оценивать документацию по производству серии продукции в отношении безопасности, эффективности и качества готовых лекарственных препаратов, в том числе и для клинических исследований;
- Оценивать степень значимости выявленных изменений и отклонений на соответствие установленным требованиям;
- Производить анализ состояния фармацевтической системы качества;
- Производить анализ причин выявленных отклонений и несоответствий, анализ рисков для качества готовой продукции;
- Вести переговоры, делегировать полномочия, осуществлять взаимодействие с персоналом других подразделений;
- Применять междисциплинарный подход при анализе рисков для качества лекарственных средств;
- Разрабатывать предложения по улучшению деятельности фармацевтического производства, составлять планы работ и осуществлять их контроль;
- Вести переговоры, делегировать полномочия, осуществлять взаимодействие с персоналом других подразделений;
- Оценивать эффективность фармацевтической системы качества лекарственных средств;
- Разрабатывать процессы фармацевтической системы качества;
- Проводить аудит качества (самоинспекцию) фармацевтического производства;
- Производить анализ отчетов (обзоров) по качеству лекарственных средств;
- Анализировать состояние процессов и подсистем фармацевтической системы качества на соответствие установленным требованиям;
- Принимать решение о повторной обработке или повторном использовании серии или части серии продукции, не соответствующей заданным требованиям;
- Оценивать эффективность мероприятий по обеспечению и улучшению качества;
- Осуществлять управление комплексными научно-техническими проектами;
- Вести переговоры, делегировать полномочия, осуществлять взаимодействие с сотрудниками других подразделений;
- Планировать и определять формы и методы обучения персонала;
- Оценивать потребность в персонале подразделений по обеспечению качества;
- Предупреждать конфликтные ситуации;
- Разрабатывать мероприятия по адаптации персонала;
- Разрабатывать систему эффективной мотивации персонала подразделений по обеспечению качества;
- Согласовывать должностные инструкции персонала подразделений по обеспечению качества;
- Оценивать профессионально-квалификационный уровень персонала подразделений по обеспечению качества;
- Анализировать и оценивать деятельность персонала подразделения на конкретных участках работы;
- Осуществлять контроль соблюдения персоналом санитарных правил, требований охраны труда, правил внутреннего трудового распорядка;
- Производить анализ состояния проверяемых процессов и подсистем и системы документации с позиций соответствия установленным требованиям;
- Вести переговоры, делегировать полномочия, осуществлять взаимодействие с персоналом других подразделений;
- Оценивать эффективность фармацевтической системы качества лекарственных средств;
- Оценивать процессы производства и контроля качества лекарственных средств;
- Разрабатывать планы и контролировать выполнение планов по качеству;
- Управлять групповым обсуждением при проведении расследований по отклонениям, несоответствиям, рекламациям при анализе рисков для качества лекарственных средств;
- Производить анализ отчетов (обзоров) по качеству лекарственных средств;
- Проводить аудит качества (самоинспекцию) фармацевтического производства, контрактных производителей, поставщиков исходного сырья и упаковочных материалов;
- Разрабатывать предложения по улучшению деятельности по качеству, составлять планы работ и осуществлять их контроль;
- Вести переговоры, делегировать полномочия, осуществлять взаимодействие с персоналом других подразделений;
- Применять междисциплинарный подход при анализе рисков по качеству;
- Разрабатывать бизнес-процессы фармацевтической системы качества фармацевтического производства;
- Производить анализ причин отклонений и несоответствий, анализ рисков для качества готовой продукции;
- Производить анализ состояния фармацевтической системы качества на фармацевтическом производстве;
- Анализировать и систематизировать информацию в области фармацевтического качества и фармацевтического производства;
1.5. Главный специалист по качеству назначается на должность и освобождается от должности приказом управляющего директора управления развития квалификаций Учреждения в соответствии с действующим законодательством Российской Федерации.
1.6. Главный специалист по качеству подчиняется управляющему директору управлению развитию квалификациям Учреждения и начальнику подразделения «Лекарственные технологии»
2. Трудовые функции
- 2.1. Оценка досье на серию лекарственного средства с оформлением решения о выпуске в обращение.
- 2.2. Организация, планирование и совершенствование фармацевтической системы качества производства лекарственных средств.
- 2.3. Организация работы персонала подразделений по обеспечению качества лекарственных средств.
- 2.4. Контроль соблюдения установленных требований к производству и контролю качества лекарственных средств на фармацевтическом производстве.
- 2.5. Организация функционирования процессов фармацевтической системы качества производства лекарственных средств.
3. Должностные обязанности
- 3.1. Подготовка предложений для анализа и систематизации информации по фармацевтической системе качества.
- 3.2. Оценка всех факторов, которые могут влиять на качество выпущенной серии лекарственного средства.
- 3.3. Проверка состояния валидации технологических процессов и аналитических методик, использованных при производстве серии лекарственного средства.
- 3.4. Оформление решения о выпуске серии продукции в обращение или для использования в клинических исследованиях.
- 3.5. Оценка соответствия серии лекарственного средства и процесса ее производства установленным требованиям.
- 3.6. Контроль заполнения документации на серию лекарственного средства (досье на серию).
- 3.7. Подтверждение проведения всех аудитов (самоинспекций) в соответствии с фармацевтической системой качества лекарственных средств.
- 3.8. Подтверждение проведения всех необходимых процедур и испытаний лекарственных средств, исходного сырья и упаковочных материалов, промежуточной продукции и объектов производственной среды.
- 3.9. Проверка легитимности разрешенных отклонений от методик контроля или незапланированных изменений технологического процесса их установленным требованиям.
- 3.10. Мониторинг эффективности фармацевтической системы качества лекарственных средств.
- 3.11. Организация мониторинга объектов и процессов фармацевтического производства.
- 3.12. Утверждение документов фармацевтической системы качества.
- 3.13. Согласование (утверждение) документов фармацевтической системы качества.
- 3.14. Мониторинг и утверждение контрактных производителей, поставщиков исходного сырья и упаковочных материалов.
- 3.15. Разработка планов повышения эффективности фармацевтического производства, устранения брака в организации.
- 3.16. Организация работ по изучению и внедрению научно-технических достижений, передового отечественного и зарубежного опыта по производству лекарственных средств.
- 3.17. Разработка и утверждение процессов по улучшению качества готовой продукции и снижению ее себестоимости.
- 3.18. Информирование персонала о фармацевтической системе качества лекарственных средств.
- 3.19. Организация и проведение совещаний по качеству.
- 3.20. Организация подготовки фармацевтического производства к проведению внешних инспекций и аудитов, в том числе по соблюдению установленных требований.
- 3.21. Мониторинг соответствия фармацевтического производства установленным требованиям.
- 3.22. Организация и контроль работы по обеспечению функционирования фармацевтической системы качества лекарственных средств.
- 3.23. Оценка условий труда (в части своих полномочий).
- 3.24. Планирование потребности в персонале подразделений по обеспечению качества.
- 3.25. Организация регулярных медицинских профилактических осмотров персонала подразделений по обеспечению качества.
- 3.26. Распределение задач и работ между персоналом подразделения, контроль их выполнения.
- 3.27. Подбор и адаптация персонала подразделений по обеспечению качества (в части своих полномочий).
- 3.28. Организация обучения и оценки знаний персонала подразделений по обеспечению качества.
- 3.29. Контроль ведения записей в процессе производства и контроля качества лекарственных средств.
- 3.30. Контроль проведения работ по валидации технологических процессов и аналитических методик, квалификации помещений, оборудования и инженерных систем фармацевтического производства лекарственных средств.
- 3.31. Контроль проведения мониторинга условий производственной среды.
- 3.32. Контроль обучения персонала фармацевтического производства и оценка его эффективности.
- 3.33. Контроль испытаний лекарственных средств, исходного сырья и упаковочных материалов, промежуточной продукции и объектов производственной среды.
- 3.34. Контроль соответствующих условий хранения и транспортировки лекарственных средств.
- 3.35. Контроль регламентации всех производственных процессов, оценка их стабильности и эффективности.
- 3.36. Контроль выполнения установленных требований к помещениям и оборудованию фармацевтического производства и их обслуживанию.
- 3.37. Организация аудитов качества (самоинспекций) фармацевтического производства, контрактных производителей, поставщиков исходного сырья и упаковочных материалов.
- 3.38. Организация мониторинга выполнения корректирующих и предупреждающих действий на фармацевтическом производстве.
- 3.39. Организация проведения процессов анализа рисков для качества лекарственных средств.
- 3.40. Организация процессов документооборота фармацевтической системы качества лекарственных средств.
- 3.41. Организация и контроль процессов фармацевтической системы качества лекарственных средств.
- 3.42. Подготовка предложений для анализа и систематизации информации в области фармацевтического качества и фармацевтического производства.
- 3.43. Оценка и мониторинг любых изменений фармацевтической системы качества в соответствии с установленными требованиями.
- 3.44. Управление процессами отзыва с рынка несоответствующей продукции.
- 3.45. Организация процессов расследований по отклонениям, несоответствиям, рекламациям по качеству в соответствии с установленными процедурами.
- 3.46. Организация оценки эффективности процессов в отношении качества лекарственных средств.
Изменить трудовые функции
4. Права
Главный специалист по качеству имеет право:
4.1. Запрашивать и получать необходимую информацию, а так же материалы и документы, относящиеся к вопросам деятельности главного специалиста по качеству .
4.2. Повышать квалификацию, проходить переподготовку (переквалификацию).
4.3. Вступать во взаимоотношения с подразделениями сторонних учреждений и организаций для решения вопросов, входящих в компетенцию главного специалиста по качеству .
4.4. Принимать участие в обсуждении вопросов, входящих в его функциональные обязанности.
4.5. Вносить предложения и замечания по вопросам улучшения деятельности на порученном участке работы.
4.6. Обращаться в соответствующие органы местного самоуправления или в суд для разрешения споров, возникающих при исполнении функциональных обязанностей.
4.7. Пользоваться информационными материалами и нормативно-правовыми документами, необходимыми для исполнения своих должностных обязанностей.
4.8. Проходить в установленном порядке аттестацию.
5. Ответственность
Главный специалист по качеству несет ответственность за:
5.1. Неисполнение (ненадлежащее исполнение) своих функциональных обязанностей.
5.2. Невыполнение распоряжений и поручений управляющего директора управления развития квалификаций Учреждения.
5.3. Недостоверную информацию о состоянии выполнения порученных заданий и поручений, нарушении сроков их исполнения.
5.4. Нарушение правил внутреннего трудового распорядка, правила противопожарной безопасности и техники безопасности, установленных в Учреждении.
5.5. Причинение материального ущерба в пределах, установленных действующим законодательством Российской Федерации.
5.6. Разглашение сведений, ставших известными в связи с исполнением должностных обязанностей.
За вышеперечисленные нарушения главный специалист по качеству может быть привлечен в соответствии с действующим законодательством в зависимости от тяжести проступка к дисциплинарной, материальной, административной, гражданской и уголовной ответственности.
Настоящая должностная инструкция разработана в соответствии с положениями (требованиями) Трудового кодекса Российской Федерации от 30.12.2001 г. № 197 ФЗ (ТК РФ) (с изменениями и дополнениями), профессионального стандарта «Специалист по промышленной фармации в области обеспечения качества лекарственных средств» утвержденного приказом Министерства труда и социальной защиты Российской Федерации от 22 мая 2017 г. № 429н и иных нормативно–правовых актов, регулирующих трудовые отношения.
Скачать в формате MS Word
Поделиться должностной инструкцией в соцсетях:
Общество с ограниченной ответственностью «Бета»
ООО «Бета»
Должностная инструкция специалиста (инженера) по качеству
№ 149-ДИ
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Настоящая Должностная инструкция определяет должностные обязанности, права и ответственность Специалиста по качеству ООО «Бета».
1.2. Специалист по качеству назначается на должность и освобождается от должности приказом генерального директора ООО «Бета» по представлению начальника отдела по управлению качеством.
1.3. Специалист по качеству подчиняется непосредственно начальнику отдела по управлению качеством.
1.4. На должность Специалиста по качеству назначается лицо, имеющее высшее образование – бакалавриат, без предъявления требований к стажу работы.
1.5. Специалист по качеству должен знать:
– национальную и международную нормативную базу в области управления качеством продукции (услуг);
– основные методы определения требований потребителей к продукции (услугам);
– основные методы квалиметрического анализа продукции (услуг):
– при эксплуатации;
– при определении методов контроля продукции (услуг)
– при производстве изделий (оказании услуг)
– основные методы управления качеством при производстве изделий (оказании услуг);
– методы управления документооборотом организации;
– систему государственного надзора, межведомственного и ведомственного контроля за качеством продукции;
– технологические процессы и режимы производства;
– основные технологические и конструктивные данные выпускаемой продукции;
– действующие в отрасли и в ООО «Бета» стандарты и технические условия;
– виды производственного брака, методы его предупреждения и устранения;
– порядок предъявления и рассмотрения рекламаций по качеству сырья, материалов, полуфабрикатов, комплектующих изделий и готовой продукции;
– требования, предъявляемые к технической документации, сырью, материалам, полуфабрикатам, комплектующим изделиям и готовой продукции, системы, методы и средства контроля их качества;
– правила проведения испытаний и приемки продукции;
– порядок подготовки промышленной продукции к сертификации и аттестации;
– организацию учета, порядок и сроки составления отчетности о качестве продукции;
– основы экономики, организации производства, труда и управления;
– основы трудового законодательства;
– правила и нормы охраны труда.
1.6. В своей деятельности Специалист по качеству руководствуется:
– постановлениями, распоряжениями, приказами, методическими и нормативными материалами по управлению качеством продукции;
– локальными нормативными актами ООО «Бета», в том числе Правилами внутреннего трудового распорядка;
– приказами (распоряжениями) генерального директора ООО «Бета» и непосредственного руководителя;
– правилами по охране труда, технике безопасности, производственной санитарии и противопожарной защите;
– настоящей Должностной инструкцией.
1.7. В период временного отсутствия Специалиста по качеству его обязанности возлагаются на должностное лицо, назначаемое приказом генерального директора ООО «Бета».
2. ДОЛЖНОСТНЫЕ ОБЯЗАННОСТИ
Специалист по качеству выполняет следующие должностные обязанности:
2.1. Выполнение работ по управлению качеством эксплуатации продукции:
2.1.1. Определение и согласование требований к продукции (услугам), установленных потребителями, а также требований, не установленных потребителями, но необходимых для эксплуатации продукции (услуг):
– формирование номенклатуры требований к продукции (услугам), установленных потребителями;
– формирование номенклатуры требований, не установленных потребителями, но необходимых для эксплуатации продукции (услуг);
– согласование с потребителем общего реестра требований;
– анализ требований к продукции (услугам) с целью их обеспечения в ООО «Бета».
2.1.2. Анализ рекламаций и претензий к качеству продукции, работ (услуг), подготовка заключений и ведение переписки по результатам их рассмотрения:
– анализ рекламаций и претензий к качеству продукции, работ (услуг);
– подготовка заключений и ведение переписки по результатам их рассмотрения;
– подготовка писем по рекламациям и претензиям к качеству продукции, работ (услуг);
– ведение регистрационного журнала переписки по рекламациям и претензиям к качеству продукции, работ (услуг).
2.1.3. Разработка корректирующих действий по управлению несоответствующей продукцией (услугами) в ходе эксплуатации:
– анализ применяемых методов контроля (качественных и количественных) показателей качества продукции (услуг) в ООО «Бета»;
– разработка предложений по корректированию применяемых и применению новых методов контроля (качественных и количественных) показателей качества продукции (услуг) в ООО «Бета»;
– разработка методик по применению новых методов контроля (качественных и количественных) показателей качества продукции (услуг) в ООО «Бета».
2.2. Выполнение работ по управлению качеством процессов производства продукции и оказания услуг:
2.2.1. Анализ причин, вызывающих снижение качества продукции (работ, услуг), разработка планов мероприятий по их устранению:
– анализ дефектов, вызывающих ухудшение качественных и количественных показателей продукции (услуг) на стадии производства продукции и оказания услуг;
– выявление причин возникновения дефектов, вызывающих ухудшение качественных и количественных показателей продукции (услуг) на стадии производства продукции и оказания услуг;
– разработка корректирующих действий по устранению дефектов, вызывающих ухудшение качественных и количественных показателей продукции (услуг) на стадии производства продукции и оказания услуг;
– анализ результатов проведения корректирующих действий по устранению дефектов, вызывающих ухудшение качественных и количественных показателей продукции (услуг) на стадии производства продукции и оказания услуг;
– представление руководству отчета по анализу результатов проведения корректирующих действий по устранению дефектов, вызывающих ухудшение качественных и количественных показателей продукции (услуг) на стадии производства продукции и оказания услуг.
2.2.2. Разработка методик и инструкций по текущему контролю качества работ в процессе изготовления продукции, в испытаниях готовых изделий и оформлении документов, удостоверяющих их качество:
– анализ данных по испытаниям готовых изделий;
– подготовка нормативной документации для разработки методик и инструкций по текущему контролю качества работ в процессе изготовления продукции;
– формирование методик и инструкций по текущему контролю качества работ в процессе изготовления продукции;
– ведение реестра методик и инструкций по текущему контролю качества работ в процессе изготовления продукции.
3. ПРАВА
Специалист по качеству имеет право:
3.1. Требовать от своего непосредственного руководителя и генерального директора ООО «Бета» содействия в исполнении должностных обязанностей и реализации прав.
3.2. Повышать свою квалификацию.
3.3. Запрашивать лично или по поручению непосредственного руководителя от работников отчеты и документы, необходимые для выполнения должностных обязанностей.
3.4. Знакомиться с проектами решений генерального директора ООО «Бета», касающимися деятельности Специалиста по качеству.
3.5. Представлять на рассмотрение своего непосредственного руководителя и генерального директора ООО «Бета» предложения по вопросам своей деятельности, в том числе ставить вопросы о совершенствовании своей работы, улучшении организационно—технических условий труда, повышении размера зарплаты, оплате сверхурочных работ в соответствии с законодательством и положениями, регламентирующими систему оплаты труда работников ООО «Бета».
3.6. Получать от работников ООО «Бета» информацию, необходимую для ведения своей деятельности.
4. ОТВЕТСТВЕННОСТЬ
Специалист по качеству несет ответственность:
4.1. За неисполнение или ненадлежащее исполнение своих обязанностей, предусмотренных настоящей Должностной инструкцией, – в соответствии с действующим трудовым законодательством.
4.2. За другие правонарушения, совершенные в период ведения своей деятельности (в т. ч. связанные с причинением материального ущерба и ущерба деловой репутации ООО «Бета»), – в соответствии с действующим трудовым, гражданским, административным и уголовным законодательством.
5. УСЛОВИЯ РАБОТЫ
5.1. Режим работы Специалиста по качеству определяется в соответствии с Правилами внутреннего трудового распорядка, установленными в ООО «Бета».
5.2. Работодатель проводит оценку эффективности деятельности Специалиста по качеству в соответствии с Комплексом мероприятий по оценке эффективности, утверждаемым приказом генерального директора ООО «Бета».
Должностная инструкция разработана в соответствии с приказом генерального директора ООО «Бета» № 1-Пр от 23.08.2011.
Должностную инструкцию составила:
Начальник отдела кадров _________________________ Е.В. Васильева
С инструкцией ознакомлен:
________________ Р.Л. Борисов
Юрист _________________________ Н.А. Павлов
ДОЛЖНОСТНАЯ ИНСТРУКЦИЯ МЕНЕДЖЕРА ПО КАЧЕСТВУ
Должностная инструкция менеджера по качеству
УТВЕРЖДАЮ
Генеральный директор
Фамилия И.О. ________________
«________»_____________ ____ г.
1. Общие положения
1.1. Менеджер по качеству относится к категории руководителей.
1.2. На должность менеджера по качеству назначается лицо, имеющее высшее экономическое образование и стаж аналогичной работы не менее года.
1.3. Менеджер по качеству назначается на должность и освобождается от должности в установленном действующим трудовым законодательством порядке приказом генерального директора.
1.4. Менеджер по качеству должен знать:
— постановления, распоряжения, приказы, другие руководящие и нормативные документы, касающиеся работы компании;
— права и обязанности работников и режим их работы;
— правила внутреннего трудового распорядка;
— правила и нормы охраны труда; правила техники безопасности, производственной санитарии и гигиены, противопожарной безопасности.
1.5. Менеджер по качеству руководствуется в своей деятельности:
— законодательными актами РФ;
— Уставом компании, Правилами внутреннего трудового распорядка, другими нормативными актами компании;
— приказами и распоряжениями руководства;
— настоящей должностной инструкцией.
2. Должностные обязанности менеджера по качеству
Менеджер по качеству выполняет следующие должностные обязанности:
2.1. Участвует в подготовке к сертификации на соответствие требованиям ИСО 9001 и последующего периодического инспекционного контроля.
2.2. По поручению начальника производственного отдела участвует во взаимодействии с органами по сертификации и консалтинговыми фирмами по вопросам, связанным с системой менеджмента качества.
2.3. Участвует в подготовке проектов распорядительных и нормативных документов компании (включая документы СМК).
2.4. Участвует в составлении плана внутренних проверок подразделений компании.
2.5. Участвует в составлении программ внутренних проверок, а также доведении программы аудита до заинтересованных сторон.
2.6. Участвует в проведении внутренних аудитов подразделений компании в качестве внутреннего аудитора.
2.7. Готовит проекты отчетов по проведенным аудитам.
2.8. Участвует в сборе и систематизации информации, необходимой для анализа СМК со стороны высшего руководства.
2.9. Участвует в анализе информации и составлении проектов отчетов о функционировании процессов СМК и результативности СМК в целом.
2.10. Обеспечивает выполнение мероприятий по поддержанию компетенции внутренних аудиторов компании.
2.11. По поручению начальника отдела качества участвует в обучении внутренних аудиторов компании.
2.12. Проводит консультационную и методологическую работу с персоналом по процессам СМК и вопросам, установленным начальником отдела.
2.13. По поручению начальника отдела участвует в работе коллегиальных органов, результаты работы которых влияют на работу СМК.
2.14. Выполняет разовые служебные задания, поручения и указания генерального директора, исполнительного директора, входящих в сферу деятельности менеджера по качеству.
3. Права менеджера по качеству
Менеджер по качеству имеет право:
3.1. Получать информацию, в том числе и конфиденциальную, в объеме, необходимом для решения поставленных задач.
3.2. Вносить предложения по совершенствованию работы, связанной с предусмотренными настоящей инструкцией обязанностями.
3.3. В пределах своей компетенции сообщать своему непосредственному руководителю обо всех выявленных в процессе своей деятельности недостатках и вносить предложения по их устранению.
3.4. Требовать от руководства предприятия оказания содействия в исполнении своих должностных обязанностей и прав.
4. Ответственность менеджера по качеству
Менеджер по качеству несет ответственность за:
4.1. Невыполнение и/или несвоевременное, халатное выполнение своих должностных обязанностей.
4.2. Несоблюдение действующих инструкций, приказов и распоряжений по сохранению коммерческой тайны и конфиденциальной информации.
4.3. Нарушение правил внутреннего трудового распорядка, трудовой дисциплины, правил техники безопасности и противопожарной безопасности.
4.4. Правонарушения, совершенные в процессе осуществления своей деятельности — в пределах, определенных действующим административным, уголовным и гражданским законодательством Российской Федерации.
4.5. Причинение материального ущерба — в пределах, определенных действующим трудовым и гражданским законодательством Российской Федерации.

Антикризисное управление персоналом: 4 стратегические ошибки
| Мар 28, 2022 | HR Статьи, Лидерство, Статьи Новое | 0 Comments
Для большинства российских предпринимателей нынешний кризис далеко не первый и, вероятно, не последний. Проблемы бизнеса не исчерпываются падением выручки и задержками поставок: помимо прочего, каждый предприниматель отвечает за тысячи рабочих мест. Директор…

Что делать, если работодатели вас считают «оверквалифайд»? И как таким людям удается найти работу
HR практик | Фев 26, 2022 | HR Статьи, Подбор персонала, Статьи Новое | 0 Comments
Анна Соколова «Вы оверквалифайд для этой позиции», — такой вежливый отказ от рекрутера рискуют услышать те, кто имеет большой опыт работы, ведь он может быть избыточным для вакансии. The Village узнал у специалистов по HR, почему они отказывают слишком…

Что такое one day offer, который набирает популярность в найме: как устроена процедура, какие плюсы и риски
HR практик | Фев 22, 2022 | HR Статьи, Подбор персонала, Статьи Новое | 0 Comments
Алёна Владимирская Самое модное сейчас: one day offer (odo). Суть ясна — кандидата проводят по всем этапам собеседований за один рабочий день, чтобы в конце дня либо выставить оффер, либо отказать. Для кого предназначен Конечно, не для топов. Но для дефицитных…

Что делать топ-менеджеру после увольнения
HR практик | Фев 16, 2022 | HR Статьи, Лидерство, Статьи Новое | 0 Comments
Наталия Шкулова «Вероятно, тебе нужно сменить компанию», «У нас разные взгляды на бизнес, тебе нужно уйти» или ультимативное «Ты уволен!» — эти фразы может услышать любой управленец высшего звена. Как вести себя топ-менеджеру после такого заявления, расскажет Наталия…

Первый в России банк начал эксперимент с четырехдневной рабочей неделей
HR практик | Фев 6, 2022 | HR Статьи, Лидерство | 0 Comments
Юлия Кошкина Совкомбанк допускает введение такого графика «для наиболее продуктивных сотрудников бэк-офиса» Совкомбанк начал эксперимент с укороченной неделей для работающих удаленно сотрудников. Он пока охватит меньше 5% персонала, но банк не исключает его…

«У меня появилось новое хобби»: британец четыре месяца ходит на собеседования, чтобы развлечься. Устраиваться на работу он не намерен
HR практик | Фев 1, 2022 | HR Статьи, Подбор персонала, Статьи Новое | 0 Comments
Пользователь Reddit из Великобритании Рогз (R_o_g_z) поделился с интернет-пользователями своим необычным хобби — ходить на собеседования без намерения устроиться на работу. «У меня вроде как появилось новое хобби. <…> В течение последних четырех месяцев…

ТОП навыки HR-специалиста и как их развить
HR практик | Ноя 1, 2021 | HR Статьи, Подбор персонала, Статьи Новое | 0 Comments
HR-специалист не только занимается отбором персонала, но еще и является связующим звеном между руководством компании и командой. Чтобы стать незаменимым сотрудником и претендовать на более высокие позиции — возможно, возглавить HR-отдел, нужно обладать специфическими…

«Искать людей надо с азартом»: старейший рекрутер Владивостока про необычные вакансии, поиск водолазов и лукизм клиентов
HR практик | Окт 27, 2021 | HR Статьи, Подбор персонала, Статьи Новое | 0 Comments
Сотрудники кадровых агентств ежедневно просматривают десятки резюме и тратят месяцы, пытаясь закрыть вакансию и подобрать подходящих специалистов по запросам клиентов. Порой требования работодателей вызывают у рекрутеров много вопросов: довольно сложно отыскать…

«Тайм-менеджмент больше мне не друг»: три важных открытия об истинной продуктивности
HR практик | Июл 29, 2021 | HR Статьи, Лидерство, Статьи Новое | 0 Comments
Эбби Шипп В 2019 году я поняла, что зашла в тупик. Со стороны моя карьера казалась успешной, семья — счастливой, а я — живущей в сказке. Однако никто не знал, что я кое-как питалась и мучилась от хронической бессонницы, болей из-за защемления шейного нерва и…
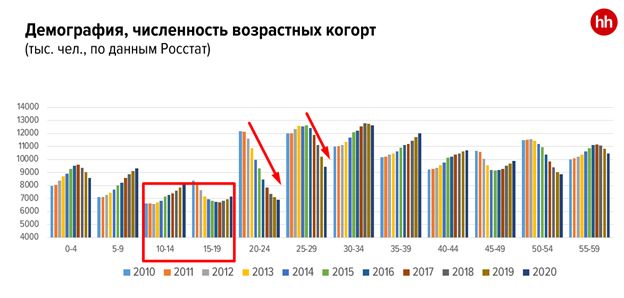
Демография и рынок труда
HR практик | Июл 16, 2021 | HR Статьи, Подбор персонала, Статьи Новое | 0 Comments
Наталья Данина Мы сплошь и рядом встречаемся с кейсами, когда бизнес считает, что HR последнее время стал очень плохо работать (ага, до этого работал хорошо, а потом вдруг раз, и перестал). И уж если нет пророка в своем отечестве, то может к внешнему человеку…
