Показания к применению
Артериальная гипертензия, стенокардия напряжения, вазоспастическая стенокардия.
Действующее вещество:
AMLODIPINE BESILATE
Описание препарата на английском
Treatment of essential hypertension. Duplex is indicated for patients whose blood pressure is not adequately controlled on monotherapy.
| Характеристики | |
| По рецепту | по рецепту |
| Срок годности | 36 мес. |
| Форма употребления | COATED TABLETS |
Ссылка на сайт МинЗдрава Израиля: http://www.old.health.gov.il/units/pharmacy/trufot/PerutTrufa.asp?Reg_Number=152 73 34093 00&safa=e
Аген, Акридипин, Амло, Амловас, Амлодак, Амлодигамма, Амлодил, Амлодипин, Амлодипин Алкалоид, Амлодипин Сандоз, Амлодипин-Биоком, Амлодипин-ЗТ, Амлодипин-Прана, Амлодипин-Тева, Амлодипина бесилат, Амлодифарм, Амлокард-сановель, Амлонг, Амлонорм, Амлорус, Амлотоп, Амплитон, Амплитон форте, Веро-Амлодипин, Дуплекор, Кадуэт, Калчек, Кардилопин, Корвадил, Корди Кор, Норвадин, Норваск, Нормодипин, Омелар кардио, Стамло, Стамло М, Тенокс, Экватор, Эксфорж
Clinical Trials Experience
Because clinical trials are conducted under widely varying conditions, adverse reaction rates observed in the clinical trials of a drug cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice. The adverse reaction information from clinical trials does, however, provide a basis for identifying the adverse events that appear to be related to drug use and for approximating rates.
Studies with Duplex
Duplex has been evaluated for safety in over 2600 patients with hypertension; over 1440 of these patients were treated for at least 6 months and over 540 of these patients were treated for at least 1 year. Adverse reactions have generally been mild and transient in nature and have only infrequently required discontinuation of therapy.
The hazards of valsartan are generally independent of dose; those of amlodipine are a mixture of dose-dependent phenomena (primarily peripheral edema) and dose-independent phenomena, the former much more common than the latter.
The overall frequency of adverse reactions was neither dose-related nor related to gender, age, or race. In placebo-controlled clinical trials, discontinuation due to side effects occurred in 1.8% of patients in the Duplextreated patients and 2.1% in the placebo-treated group. The most common reasons for discontinuation of therapy with Duplex were peripheral edema (0.4%), and vertigo (0.2%).
The adverse reactions that occurred in placebo-controlled clinical trials in at least 2% of patients treated with Duplex but at a higher incidence in amlodipine/valsartan patients (n=1437) than placebo (n=337) included peripheral edema (5.4% vs 3.0%), nasopharyngitis (4.3% vs 1.8%), upper respiratory tract infection (2.9% vs 2.1%) and dizziness (2.1% vs 0.9%).
Orthostatic events (orthostatic hypotension and postural dizziness) were seen in less than 1% of patients.
Other adverse reactions that occurred in placebo-controlled clinical trials with Duplex ( ≥ 0.2%) are listed below. It cannot be determined whether these events were causally related to Duplex.
Blood and Lymphatic System Disorders: Lymphadenopathy
Cardiac Disorders: Palpitations, tachycardia
Ear and Labyrinth Disorders: Ear pain
Gastrointestinal Disorders: Diarrhea, nausea, constipation, dyspepsia, abdominal pain, abdominal pain upper, gastritis, vomiting, abdominal discomfort, abdominal distention, dry mouth, colitis
General Disorders and Administration Site Conditions: Fatigue, chest pain, asthenia, pitting edema, pyrexia, edema
Immune System Disorders: Seasonal allergies
Infections and Infestations: Nasopharyngitis, sinusitis, bronchitis, pharyngitis, gastroenteritis, pharyngotonsillitis, bronchitis acute, tonsillitis
Injury and Poisoning: Epicondylitis, joint sprain, limb injury
Metabolism and Nutrition Disorders: Gout, non-insulin-dependent diabetes mellitus, hypercholesterolemia
Musculoskeletal and Connective Tissue Disorders: Arthralgia, back pain, muscle spasms, pain in extremity, myalgia, osteoarthritis, joint swelling, musculoskeletal chest pain
Nervous System Disorders: Headache, sciatica, paresthesia, cervicobrachial syndrome, carpal tunnel syndrome, hypoesthesia, sinus headache, somnolence
Psychiatric Disorders: Insomnia, anxiety, depression
Renal and Urinary Disorders: Hematuria, nephrolithiasis, pollakiuria
Reproductive System and Breast Disorders: Erectile dysfunction
Respiratory, Thoracic and Mediastinal Disorders: Cough, pharyngolaryngeal pain, sinus congestion, dyspnea, epistaxis, productive cough, dysphonia, nasal congestion
Skin and Subcutaneous Tissue Disorders: Pruritus, rash, hyperhidrosis, eczema, erythema
Vascular Disorders: Flushing, hot flush Isolated cases of the following clinically notable adverse reactions were also observed in clinical trials: exanthema, syncope, visual disturbance, hypersensitivity, tinnitus, and hypotension.
Studies with Amlodipine
Norvasc®* has been evaluated for safety in more than 11000 patients in U.S. and foreign clinical trials. Other adverse events that have been reported < 1% but > 0.1% of patients in controlled clinical trials or under conditions of open trials or marketing experience where a causal relationship is uncertain were:
Cardiovascular: arrhythmia (including ventricular tachycardia and atrial fibrillation), bradycardia, chest pain, peripheral ischemia, syncope, postural hypotension, vasculitis
Central and Peripheral Nervous System: neuropathy peripheral, tremor
Gastrointestinal: anorexia, dysphagia, pancreatitis, gingival hyperplasia
General: allergic reaction, hot flushes, malaise, rigors, weight gain, weight loss
Musculoskeletal System: arthrosis, muscle cramps
Psychiatric: sexual dysfunction (male and female), nervousness, abnormal dreams, depersonalization
Respiratory System: dyspnea
Skin and Appendages: angioedema, erythema multiforme, rash erythematous, rash maculopapular
Special Senses: abnormal vision, conjunctivitis, diplopia, eye pain, tinnitus
Urinary System: micturition frequency, micturition disorder, nocturia
Autonomic Nervous System: sweating increased
Metabolic and Nutritional: hyperglycemia, thirst
Hemopoietic: leukopenia, purpura, thrombocytopenia
Other events reported with amlodipine at a frequency of ≤ 0.1% of patients include: cardiac failure, pulse irregularity, extrasystoles, skin discoloration, urticaria, skin dryness, alopecia, dermatitis, muscle weakness, twitching, ataxia, hypertonia, migraine, cold and clammy skin, apathy, agitation, amnesia, gastritis, increased appetite, loose stools, rhinitis, dysuria, polyuria, parosmia, taste perversion, abnormal visual accommodation, and xerophthalmia. Other reactions occurred sporadically and cannot be distinguished from medications or concurrent disease states such as myocardial infarction and angina.
Adverse reactions reported for amlodipine for indications other than hypertension may be found in the prescribing information for Norvasc.
Studies with Valsartan
Diovan® has been evaluated for safety in more than 4000 hypertensive patients in clinical trials. In trials in which valsartan was compared to an ACE inhibitor with or without placebo, the incidence of dry cough was significantly greater in the ACE inhibitor group (7.9%) than in the groups who received valsartan (2.6%) or placebo (1.5%). In a 129-patient trial limited to patients who had had dry cough when they had previously received ACE inhibitors, the incidences of cough in patients who received valsartan, HCTZ, or lisinopril were 20%, 19%, and 69% respectively (p < 0.001).
Other adverse reactions, not listed above, occurring in > 0.2% of patients in controlled clinical trials with valsartan are:
Body as a Whole: allergic reaction, asthenia
Musculoskeletal: muscle cramps
Neurologic and Psychiatric: paresthesia
Respiratory: sinusitis, pharyngitis
Urogenital: impotence
Other reported events seen less frequently in clinical trials were: angioedema. Adverse reactions reported for valsartan for indications other than hypertension may be found in the prescribing information for Diovan.
Clinical Lab Test Findings
Creatinine: In hypertensive patients, greater than 50% increases in creatinine occurred in 0.4% of patients receiving Duplex and 0.6% receiving placebo. In heart failure patients, greater than 50% increases in creatinine were observed in 3.9% of valsartan-treated patients compared to 0.9% of placebo-treated patients. In post-myocardial infarction patients, doubling of serum creatinine was observed in 4.2% of valsartan-treated patients and 3.4% of captopril-treated patients.
Liver Function Tests: Occasional elevations (greater than 150%) of liver chemistries occurred in Duplextreated patients.
Serum Potassium: In hypertensive patients, greater than 20% increases in serum potassium were observed in 2.8% of Duplex-treated patients compared to 3.4% of placebo-treated patients. In heart failure patients, greater than 20% increases in serum potassium were observed in 10% of valsartan-treated patients compared to 5.1% of placebo-treated patients.
Blood Urea Nitrogen (BUN): In hypertensive patients, greater than 50% increases in BUN were observed in 5.5% of Duplex-treated patients compared to 4.7% of placebo-treated patients. In heart failure patients, greater than 50% increases in BUN were observed in 16.6% of valsartan-treated patients compared to 6.3% of placebo-treated patients.
Neutropenia: Neutropenia was observed in 1.9% of patients treated with Diovan and 0.8% of patients treated with placebo.
Postmarketing Experience
Amlodipine: Gynecomastia has been reported infrequently and a causal relationship is uncertain. Jaundice and hepatic enzyme elevations (mostly consistent with cholestasis or hepatitis), in some cases severe enough to require hospitalization, have been reported in association with use of amlodipine.
Valsartan: The following additional adverse reactions have been reported in postmarketing experience with valsartan:
Blood and Lymphatic: Decrease in hemoglobin, decrease in hematocrit, neutropenia
Hypersensitivity: There are rare reports of angioedema. Some of these patients previously experienced angioedema with other drugs including ACE inhibitors. Duplex should not be re-administered to patients who have had angioedema.
Digestive: Elevated liver enzymes and very rare reports of hepatitis
Renal: Impaired renal function, renal failure
Clinical Laboratory Tests: Hyperkalemia
Dermatologic: Alopecia, bullous dermatitis
Vascular: Vasculitis Rare cases of rhabdomyolysis have been reported in patients receiving angiotensin II receptor blockers.
МНН: Амлодипин, Аторвастатин
Производитель: Гедеон Рихтер Румыния А.О.
Анатомо-терапевтическо-химическая классификация: Аторвастатин и амлодипин
Номер регистрации в РК:
№ РК-ЛС-5№020685
Информация о регистрации в РК:
25.06.2014 — 25.06.2019
- Скачать инструкцию медикамента
Торговое название
Дуплекор®
Международное непатентованное название
Нет
Лекарственная форма
Таблетки, покрытые пленочной оболочкой 10 мг/5 мг, 10 мг/10 мг, 20 мг/5 мг и 20 мг/10 мг
Состав
Одна таблетка содержит
активные вещества: аторвастатин L-лизин 12,628 мг (эквивалентно аторвастатину 10 мг), амлодипина бесилат 6,944 мг (эквивалентно амлодипину 5 мг) для дозировки 10 мг/5 мг; аторвастатин L-лизин 12,628 мг (эквивалентно аторвастатину 10 мг), амлодипина бесилат 13,888 мг (эквивалентно амлодипину 10 мг) для дозировки 10 мг/10 мг; аторвастатин L-лизин 25,256 мг (эквивалентно аторвастатину 20 мг), амлодипина бесилат 6,944 мг (эквивалентно амлодипину 5 мг) для дозировки 20 мг/5 мг; аторвастатин L-лизин 25,256 мг (эквивалентно аторвастатину 20 мг), амлодипина бесилат 13,888 мг (эквивалентно амлодипину 10 мг) для дозировки 20 мг/10 мг
вспомогательные вещества: целлюлоза микрокристаллическая (тип 102), кальция карбонат, крахмал кукурузный частично прежелатинизированный, натрия кроскармеллоза, натрия карбоксикрахмал (тип А), кремния диоксид коллоидный безводный, гидроксипропилцеллюлоза, магния стеарат, полисорбат 80, кальция оксид
состав пленочной оболочки Опадрай II 85F 18422 белый:
спирт поливиниловый, частично гидролизованный, титана диоксид (Е 171), макрогол 4000, тальк
Описание
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой на одной стороне «СЕ3» и диаметром около 9,0 мм (для дозировки 10 мг/5 мг).
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой на одной стороне «СЕ5» и диаметром около 9,0 мм (для дозировки 10 мг/10 мг).
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой на одной стороне «СЕ4» и диаметром около 15,5 х 8 мм (для дозировки 20 мг/5 мг).
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой на одной стороне «СЕ6» и диаметром около 15,5 х 8 мм (для дозировки 20 мг/10 мг).
Фармакотерапевтическая группа
Гиполипидемические препараты. Гиполипидемические средства, комбинации. Ингибитор ГМГ-КоА редуктазы, прочие комбинации. Аторвастатин и амлодипин.
Код АТХ C10BX03
Фармакологические свойства
Фармакокинетика
Аторвастатин
Всасывание: Аторвастатин быстро всасывается после приема внутрь; максимальные концентрации в плазме достигаются в течение 1-2 часов. Степень абсорбции увеличивается в зависимости от дозы аторвастатина. Абсолютная биодоступность аторвастатина составляет приблизительно 12 %, а системная биодоступность ингибирующей активности в отношении ГМГ-КоА-редуктаз — приблизительно 30 %. Низкая системная биодоступность обусловлена пресистемным метаболизмом (всасыванием) в слизистой оболочке желудочно-кишечного тракта и/или метаболизмом при «первичном прохождении» через печень.
Распределение: Средний объем распределения аторвастатина составляет приблизительно 381 л. Аторвастатин более чем на 98 % связывается с белками плазмы крови.
Метаболизм: Аторвастатин метаболизируется с помощью изоферментов системы цитохрома Р450 ЗА4 до орто- и парагидроксилированных производных и различных продуктов бета-окисления. Кроме других путей метаболизма, эти продукты в дальнейшем метаболизируются посредством конъюгации с глюкоронидом. In vitro, ингибирование ГМГ-КоА редуктазы орто- и парагидроксилированными метаболитами эквивалентно ингибированию, наблюдающемуся для аторвастатина. Примерно 70 % снижения активности ГМГ-КоА-редуктазы происходит за счет действия активных циркулирующих метаболитов.
Выведение: Аторвастатин выводится в основном с желчью после печеночного и/или внепеченочного метаболизма. Однако лекарственное средство, по-видимому, не подвергается существенной кишечно-печеночной рециркуляции. Средний период полувыведения аторвастатина из плазмы крови составляет приблизительно 14 часов. Вследствие действия активных метаболитов период половинного снижения ингибирующей активности ГМГ-КоА редуктазы составляет приблизительно 20 — 30 часов.
Особые популяции пациентов
Пациенты пожилого возраста
Концентрации аторвастатина и его метаболитов в плазме крови у пациентов пожилого возраста выше, чем у лиц молодого возраста, хотя гиполипидемические эффекты сопоставимы с таковыми у молодых.
Пол
Концентрация аторвастатина в плазме крови у женщин отличается от таковой у мужчин (максимальная концентрация (Сmах) у женщин примерно на 20 % выше, а площадь под кривой «концентрация-время» (AUC) на 10 % ниже), однако клинически значимых различий влияния препарата на липидный обмен у мужчин и женщин не выявлено.
Пациенты детского возраста
Для данной популяции пациентов фармакокинетичекие данные отсутствуют.
Пациенты с нарушениями функции почек
Заболевания почек не влияют на концентрацию аторвастатина в плазме крови, в связи с этим коррекции дозы у пациентов с нарушением функции почек не требуется.
Пациенты с нарушениями функции печени
Концентрации аторвастатина и его метаболитов в плазме крови значительно повышены (Стах приблизительно в 16 раз, AUC — в 11 раз) у пациентов с хроническим заболеванием печени, вызванным чрезмерным употреблением алкоголя (класс В по классификации Чайлд-Пью).
Амлодипин
Всасывание:
После приема внутрь амлодипин хорошо всасывается, максимальная концентрация в плазме достигается через 6 — 12 часов. Абсолютная биодоступность 64 — 80 %. Биодоступность амлодипина не изменяется при приеме пищи.
Распределение:
Объем распределения составляет приблизительно 21 л/кг. Приблизительно 97 % циркулирующего амлодипина связывается с белками плазмы крови. Равновесные концентрации амлодипина в плазме крови достигаются через 7 — 8 дней регулярного приема лекарственного средства.
Метаболизм и выведение:
Амлодипин метаболизируется в печени с образованием неактивных метаболитов, 10 % неизмененного амлодипина и 60 % метаболитов выводятся почками. Выведение из плазмы крови является двухфазным с конечным периодом полувыведения приблизительно 30 — 50 часов.
Особые популяции пациентов
Возраст, сердечная недостаточность
Время, необходимое для достижения Сmах амлодипина в плазме крови, практически не зависит от возраста. У пациентов пожилого возраста отмечена тенденция к снижению клиренса амлодипина, что приводит к увеличению AUC и периода полувыведения (T½). У пациентов различных возрастных групп с хронической сердечной недостаточностью (ХСН) наблюдалось увеличение AUC и T½. Подобное увеличение AUC отмечалось у пациентов с печеночной недостаточностью.
Нарушения функции почек
Концентрации амлодипина в плазме не зависят от степени почечной недостаточности. Пациенты с нарушениями функции почек могут принимать обычные начальные дозы препарата. Амлодипин не выводится при диализе.
Нарушения функции печени
У пациентов с нарушениями функции печени период полувыведения увеличивается.
Фармакодинамика
Комбинированный препарат: аторвастатин — гиполипидемическое средство, ингибитор ГМГ-КоА (З-гидрокси-3-метилглютарилкоэнзим А) редуктазы, амлодипин — производное дигидропиридина, блокатор «медленных» кальциевых каналов (БМКК). Терапия комбинированным препаратом приводит к дозозависимому снижению систолического и диастолического артериального давления (АД) и концентрации холестерина липопротеинов низкой плотности (ХС ЛПНП).
Аторвастатин
Аторвастатин селективно и конкурентно ингибирует ГМГ-КоА-редуктазу, которая катализирует превращение 3-гидрокси-3-метилглютарилкоэнзима А в мевалоновую кислоту — предшественник стероидов, включая холестерин (ХС). Триглицериды и холестерин в печени включаются в состав холестерина липопротеинов очень низкой плотности (ХС ЛПОНП), поступают в плазму крови и транспортируются к периферическим тканям. Холестерин липопротеинов низкой плотности (ХС ЛПНП) образуются из ХС ЛПОНП в ходе взаимодействия с ХС ЛПНП-рецепторами, характеризующимися высоким сродством к данным липопротеидам.
Аторвастатин снижает концентрации холестерина и липопротеинов в плазме крови путем ингибирования ГМГ-КоА редуктазы и синтеза холестерина в печени и увеличении числа «печеночных» ХС ЛПНП-рецепторов на поверхности клетки, что приводит к усилению захвата и катаболизма ХС ЛПНП. Аторвастатин снижает образование ХС ЛПНП, обеспечивает значительное и стойкое повышение активности ХС ЛПНП-рецепторов, в сочетании с благоприятным изменением качества ЛПНП частиц. Снижает концентрации общего холестерина (30 — 46 %), холестерина ЛПНП (41 — 61 %), аполипопротеина В (34 — 50 %) и триглицеридов (14 — 33 %), при этом приводя к увеличению концентрации холестерина липопротеинов высокой плотности (ХС ЛПВП) и аполипопротеина А1. Данные результаты одинаковы для пациентов с гетерозиготной наследственной гиперхолестеринемией, ненаследственными формами гиперхолестеринемии, а также смешанной гиперлипидемией, включая пациентов с сахарным диабетом 2 типа. Аторвастатин эффективен для снижения концентрации ХС ЛПНП у пациентов с гомозиготной наследственной гиперхолестеринемией, т. е. у популяции, обычно резистентной к терапии другими гиполипидемическими средствами.
Амлодипин
Амлодипин блокирует поступление ионов кальция через мембраны в гладкомышечные клетки миокарда и сосудов. Механизм гипотензивного действия амлодипина обусловлен прямым расслабляющим влиянием на гладкие мышцы сосудов. Точный механизм действия амлодипина при стенокардии окончательно не установлен, но амлодипин уменьшает ишемию следующими двумя путями: амлодипин расширяет периферические артериолы и таким образом снижает общее периферическое сопротивление сосудов (ОПСС), т. е. постнагрузку на сердце. Так как частота сердечных сокращений (ЧСС) не изменяется, уменьшение нагрузки на сердце приводит к снижению потребления энергии и потребности в кислороде. Механизм действия амлодипина, включает в себя расширение главных коронарных артерий и коронарных артериол как в неизмененных, так и в ишемизированных зонах миокарда. Их дилатация увеличивает поступление кислорода в миокард у пациентов с вазоспастической стенокардией (стенокардия Принцметала или вариантная стенокардия). У пациентов с артериальной гипертензией прием амлодипина в разовой суточной дозе обеспечивает клинически значимое снижение АД на протяжении 24 ч как в положении «лежа», так и «стоя». Благодаря медленному началу действия амлодипин не вызывает острую артериальную гипотензию. У пациентов со стенокардией применение амлодипина 1 раз в сутки увеличивает время выполнения физической нагрузки, предотвращает развитие приступа стенокардии и депрессию сегмента ST (на 1 мм), снижает частоту приступов стенокардии и количество принимаемых таблеток короткодействующего нитроглицерина (подъязычного). Амлодипин не оказывает неблагоприятного влияния на обмен веществ и липиды плазмы крови и может применяться у пациентов с сахарным диабетом и подагрой, а также у пациентов с бронхиальной астмой. У пациентов с сердечной недостаточностью II — IV функционального класса (по классификации NYHA) прием амлодипина не приводил к ухудшению клинического состояния (переносимости физической нагрузки, фракции выброса левого желудочка сердца и клинической симптоматики).
Показания к применению
— лечение артериальной гипертензии у пациентов с дислипидемией, состояние которых адекватно контролируется приемом амлодипина и аторвастатина при следующих заболеваниях:
— первичная гиперхолестеринемия, включая семейную гиперхолестеринемию (семейная гетерозиготная гиперхолестеринемия), либо комбинированная (смешанная) гиперлипидемия
-
гомозиготная семейная гиперхолестеринемия
-
гиполипидемическая диета и другие нефармакологические методы лечения дислипидемии оказываются мало- или неэффективными
Препарат рекомендуется применять в тех случаях, когда необходима комбинированная терапия амлодипином и невысокими дозами аторвастатина.
Способ применения и дозы
Внутрь, по 1 таблетке 1 раз в сутки в любое время суток, независимо от времени приема пищи.
Применять Дуплекор® в качестве стартовой монотерапии не рекомендуется, так как дозу препарата Дуплекор® следует определять путем титрования дозы отдельных компонентов препарата с учётом данных о дозах и способах применения амлодипина и аторвастатина.
В соответствии с результатами титрования дозы, рекомендуемой дозой является одна таблетка препарата Дуплекор® 10 мг/5 мг, одна таблетка препарата Дуплекор® 10 мг/10 мг, одна таблетка препарата Дуплекор® 20 мг/5 мг или одна таблетка препарата Дуплекор® 20 мг/10 мг один раз в сутки. Максимальная суточная доза составляет одна таблетка препарата Дуплекор® 20 мг/10 мг один раз в сутки.
Препарат применяют в сочетании с немедикаментозными средствами лечения, включая диету, физические нагрузки, снижение массы тела у пациентов с ожирением, отказ от курения. При применении у пациентов с артериальной гипертензией в дозе 5 мг/10 мг (в начале терапии) необходим контроль АД каждые 2 — 4 недели и, при необходимости, возможно увеличение дозы до 10 мг/10 мг/сутки. При ИБС рекомендуемая доза 10 мг/5 мг один раз в сутки.
Пациенты пожилого возраста
Коррекции дозы препарата Дуплекор® не требуется.
Пациенты с нарушением функции печени
Дуплекор® противопоказан пациентам с заболеваниями печени в активной фазе или со стойким повышением активности «печеночных» ферментов в сыворотке крови, превышающей верхнюю границу нормы (ВГН) в 3 раза
Пациенты с нарушением функции почек
Коррекции дозы препарата не требуется.
Побочные действия
Часто (от ≥ 1/100 до < 1/10)
— головная боль, головокружение, бессонница, сонливость, парестезия, гипестезия, утомляемость
— учащенное сердцебиение, приливы крови к коже лица
— тошнота, диспепсия, диарея, запор, метеоризм, боли в области живота
— миалгия, артралгия, астения, боль в груди и, боль в области поясницы
— отеки, отеки голеностопных суставов
— повышенная чувствительность
— кожная сыпь, зуд
— увеличение уровня аланин-аминотрансаминазы, креатинфосфокиназы в сыворотке крови
Нечасто (от ≥ 1/1000 до <1/100)
— изменение настроения (в т. ч. тревожность), депрессия, амнезия, периферическая невропатия, обморочное состояние, тремор, дисгевзия, общее недомогание
— гипергликемия, гипогликемия
— расстройства зрения (в т.ч. диплопия)
— шум в ушах
— гипотензия
— сухость во рту, рвота
— алопеция, пурпура, нарушение пигментации кожи, гипергидроз, экзантема
— миопатия, мышечные спазмы
— ринит, диспноэ
— нарушение мочеиспускания, никтурия, поллакиурия
— эректильная дисфункция, гинекомастия
— увеличение или снижение массы тела
— тромбоцитопения
Редко (от ≥ 1/10 000 до < 1/1 000)
— психоз
— панкреатит, гепатит, холестатическая желтуха
— миозит, острый некроз скелетных мышц
— периферические отеки
— гипербилирубинемия
Очень редко (< 1/10 000)
— анафилактические реакции, ангионевротический отёк, крапивница, отёк Квинке, буллезная сыпь (включая мультиформную эритему, эксфолиативный дерматит, синдром Стивенса — Джонсона, токсический эпидермальный некролиз), светочувствительность
— инфаркт миокарда, желудочковая тахикардия, брадикардия, фибрилляция предсердий, аритмии, васкулит
— кашель
— гастрит, гипертрофический гингивит, печеночная недостаточность
— мышечный гипертонус, разрыв сухожилия
— лейкопения
Противопоказания
— повышенная чувствительность к амлодипину и другим производным дигидропиридина, аторвастатину или любому компоненту препарата
— выраженная артериальная гипотензия
— шок (включая кардиогенный шок);
— гемодинамически нестабильная сердечная недостаточность после острого инфаркта миокарда, гемодинамически значимый аортальный стеноз, нестабильная стенокардия
— миопатия
— женщины репродуктивного возраста, не пользующиеся адекватными методами контрацепции
— активные заболевания печени или стойкое повышение активности «печеночных» ферментов более чем в 3 раза выше нормы неясной этиологии
— сочетанное применение с итраконозолом, кетоконозолом и телитромицином
— беременность и период лактации
— детский и подростковый возраст до 18 лет (из-за недостаточности данных по безопасности и эффективности)
Лекарственные взаимодействия
Взаимодействие препарата Дуплекор® с другими лекарственными средствами специально не изучалось, но проводились исследования каждого из компонентов в отдельности.
Возможные взаимодействия с амлодипином
Применение следующих комбинаций лекарственных средств не рекомендовано
Инфузионный раствор дантролена: следует избегать одновременного применения амлодипина и дантролена, отмечалась фибрилляция желудочков.
Применение следующих комбинаций следует проводить с особой осторожностью
Баклофен: Усиливается гипотензивный эффект. В данном случае может потребоваться контроль АД и снижение дозы гипотензивного лекарственного средства.
Ингибиторы изофермента CYP3A4: при одновременном применении ингибитора изофермента CYP3A4 эритромицина здоровыми добровольцами молодого возраста и ингибитора изофермента CYP3A4 дилтиазема пациентами пожилого возраста отмечалось увеличение концентрации амлодипина в плазме крови на 22 % и 50 % соответственно.
Однако клиническая значимость этих данных неизвестна. Нельзя исключать, что мощные ингибиторы изофермента CYP3A4 (например, кетоконазол, итраконазол, ритонавир) могут увеличивать концентрации амлодипина в плазме крови в большей степени, нежели дилтиазем.
Индукторы изофермента CYP3A4: противоэпилептические средства (например, карбамазепин, фенобарбитал, фенитоин, фосфенитоин, примидон), рифампицин: из-за индуцирования метаболизма амлодипина можно ожидать снижение концентрации блокаторов «медленных» кальциевых каналов (в частности амлодипина) в плазме крови. В случае приема указанных выше индукторов изофермента CYP3A4 рекомендуется клиническое наблюдение и при необходимости коррекция дозы амлодипина, в противном случае одновременный прием индуктора изофермента CYP3A4 следует прекратить.
Применение следующих комбинаций допустимо
Блокаторы α-1-адренорецепторов (празозин, альфузозин, доксазозин, тамсулозин, теразозин): можно ожидать усиления гипотензивного эффекта с риском развития выраженной ортостатической гипотензии.
Амифостин: усиление гипотензивного эффекта из-за проявления нежелательных явлений амифостина.
Трициклические антидепрессанты / нейролептики: увеличивается риск развития артериальной гипотензии или ортостатической гипотензии (аддитивный эффект).
Бета-адреноблокаторы (бисопролол, карведилол, метопролол): риск развития артериальной гипотензии или сердечной недостаточности в случае латентной или неконтролируемой сердечной недостаточности (отрицательный инотропный эффект бета — адреноблокаторов может усиливаться). В случае одновременного применения амлодипина и бета-адреноблокаторов симпатические рефлекторные реакции, проявляющиеся как результат чрезмерного гемодинамического эффекта, могут ослабевать.
Кортикостероиды, тетракозактид: гипотензивный эффект может ослабевать из-за снижения абсорбции натрия и воды, вызываемого глюкокортикостероидами.
Другие гипотензивные средства: сопутствующий прием гипотензивных средств (бета — адреноблокаторы, антагонисты рецептора ангиотензина II, диуретики, ингибиторы ангиотензинпревращающего фермента (АПФ)) может усиливать гипотензивный эффект амлодипина. Одновременное применение с нитратами или другими сосудорасширяющими средствами может привести к дополнительному снижению АД.
Силденафил: при первичной артериальной гипертензии однократный прием 100 мг силденафила не оказывал влияния на фармакокинетические параметры амлодипина. При приеме амлодипина в комбинации с силденафилом каждое лекарственное средство снижает АД независимо от другого.
Циметидин, аторвастатин, алюминий — или магнийсодержащие антациды, грейпфрутовый сок не оказывают влияния на фармакокинетику амлодипина.
Возможные взаимодействия с аторвастатином
Применение следующих комбинаций противопоказано
Итраконазол, кетоконазол, телитромицин: риск дозозависимых нежелательных явлений, например, рабдомиолиза, увеличивается (снижается метаболизм аторвастатина в печени).
Гемфиброзил и другие производные фиброевой кислоты: риск дозозависимых нежелательных явлений, например, рабдомиолиза, увеличивается (снижается метаболизм аторвастатина в печени).
Применение следующих комбинаций следует осуществлять с особой осторожностью
Ингибиторы изоферментов или системы цитохрома Р450 ЗА4: аторвастатин метаболизируется с помощью изоферментов системы цитохрома Р450, CYP 3A4. Эритромицин, ингибитор CYP 3A4, повышал концентрацию аторвастатина в плазме крови на 40 %. Одновременный прием аторвастатина и ингибиторов CYP 3A4, некоторых макролидных антибиотиков (например, эритромицина, кларитромицина), иммунодепрессантов (циклоспорина), противогрибковых средств, относящихся к азолам (например, итраконазола, кетоконазола), амиодарона, ингибиторов протеаз или антидепрессантов, нефазодона, может привести к взаимодействию, которое приведет к повышению концентрации аторвастатина в плазме крови. Поэтому одновременное применение с указанными препаратами следует осуществлять с осторожностью.
Индукторы изоферментов системы цитохрома Р450 ЗА4: одновременное применение аторвастатина и индукторов изоферментов системы цитохрома Р450 ЗА4 (например, фенитоина, рифампицина) может привести к значительному снижению концентрации аторвастатина в плазме крови. Вследствие наличия двойного механизма взаимодействия рифампицина (индукция ферментов системы цитохрома Р450 ЗА4 и ингибирование переносчика захвата гепатоцита ОАТР1В1), совместное применение аторвастатина и рифампицина приводило к среднему увеличению параметров Сmах и AUC аторвастатина на 12 и 90 %, соответственно. Напротив, прием аторвастатина через некоторое время после приема рифампицина сопровождался значительным снижением (приблизительно на 80 %) концентрации аторвастатина в плазме крови.
Ингибиторы протеазы: Одновременный прием аторвастатина и ингибиторов протеазы, известных ингибиторов цитохрома P450 3A4, сопровождалось двукратным увеличением концентрации аторвастатина в плазме крови.
Варфарин: прием аторвастатина совместно с варфарином может привести к усилению антикоагулянтного эффекта с риском развития кровотечения. Пациенты, получающие варфарин, должны находиться под наблюдением врача, поскольку может потребоваться коррекция дозы антикоагулянта.
Никотиновая кислота: гиполипидемические дозы никотиновой кислоты (более 1г/сут) могут повысить риск развития миопатии при одновременном приеме с ингибиторами ГМГ-КоА редуктазы. Редко, как следствие рабдомиолиза и миоглобинурии, может развиться почечная недостаточность. Поэтому необходимо рассмотреть соотношение «польза — риск» одновременного применения аторвастатина и никотиновой кислоты в липидоснижающих дозах.
Применение следующих комбинаций допустимо
Антациды: одновременный прием внутрь суспензии, содержащей магния и алюминия гидроксиды, снижал концентрацию аторвастатина в плазме крови примерно на 35 %, однако степень уменьшения содержания ХС ЛПНП при этом не менялась.
Грейпфрутовый сок: грейпфрутовый сок содержит один или более компонентов, которые ингибируют CYP3A4 и, поэтому, может приводить к увеличению концентраций в плазме крови лекарственных средств, метаболизм которых протекает с помощью изоферментов системы цитохрома CYP3A4. Потребление одного стакана (240 мл) грейпфрутового сока приводило к увеличению AUC аторвастатина на 37 % и к снижению AUC активного орто-гидрокси- метаболита аторвастатина на 20,4 %. Однако, большие количества грейпфрутового сока (более 1,2 л в сутки в течение 5 дней) увеличивают AUC аторвастатина в 2,5 раза и AUC активных ингибиторов ГМГ-КоА редуктазы (аторвастатин и метаболиты) в 1,3 раза.
Одновременный прием больших количеств грейпфрутового сока и аторвастатина не рекомендуется.
Пероральные контрацептивы: применение аторвастатина совместно с пероральным контрацептивом, содержащим норэтистерон и этинилэстрадиол, приводило к повышению концентраций норэтистерона и этинилэстрадиола в плазме крови. Этот эффект следует учитывать при выборе перорального контрацептива для женщины, получающей аторвастатин.
Колестипол: гиполипидемический эффект комбинации с колестиполом превосходит таковой для каждого препарата в отдельности, несмотря на снижение концентрации аторвастатина на 25 % при его одновременном использовании с колестиполом.
Другие взаимодействия
Антипирин (феназон): одновременный прием многократных доз аторвастатина и феназона выявил незначительный эффект на клиренс феназона, либо отсутствие данного эффекта.
Для аторвастатина не отмечено взаимодействия нестероидными противовоспалительными препаратами, антибиотиками, гипогликемическими препаратами, циметидином, антигипертензивными средствами.
Особые указания
Хроническая сердечная недостаточность
У пациентов с ХСН неишемической этиологии при применении амлодипина существует вероятность возникновения отека легких. Поэтому таким пациентам препарат следует назначать с осторожностью.
Нарушения функции печени
Перед началом лечения аторвастатином и периодически во время лечения необходимо контролировать функцию печени. В случае повышения активности «печеночных» ферментов, превышающих верхнюю границу нормы (ВГН) в 3 раза, рекомендуется снизить дозу препарата или прекратить его прием. У пациентов с нарушениями функции печени период полувыведения амлодипина увеличивается, поэтому препарат Дуплекор® таким пациентам следует назначать с осторожностью.
С осторожностью следует назначать Дуплекор® пациентам, злоупотребляющим алкоголем и/или имеющим заболевания печени в анамнезе.
Действие на скелетные мышцы
У пациентов, получавших аторвастатин, наблюдалась миалгия. Диагноз миопатии следует предполагать у пациентов, принимающих ингибиторы ГМГ-КоА редуктазы, у которых отмечаются необъяснимые симптомы, например, боль или болезненность мышц, мышечная слабость или мышечные судороги. В таких случаях необходим контроль активности креатинфосфокиназы (КФК). Активность КФК не следует измерять после интенсивных физических нагрузок или при наличии вероятной альтернативной причины повышения активности КФК. Если активность КФК значительно превышает норму более чем в 5 раз по сравнению с верхней границей нормы, активность КФК следует определять регулярно в течение 5 — 7 дней для подтверждения результатов.
Перед началом применения препарата Дуплекор®, при приеме аторвастатина в монотерапии, пациентам с факторами риска развития рабдомиолиза следует принимать препарат с осторожностью. Активность КФК необходимо определять перед началом лечения аторвастатином в следующих ситуациях:
— нарушение функции почек
— гипотиреоз
— собственный или семейный анамнез мышечных заболеваний
— наличие в анамнезе миотоксичности на фоне приема других ингибиторов ГМГ-КоА- редуктазы или фибратов
— заболевания печени в анамнезе и/или злоупотребление алкоголем
— у пациентов пожилого возраста (> 65 лет) в случае наличия факторов риска развития рабдомиолиза.
Во время лечения
— рекомендуется проинформировать пациентов о необходимости незамедлительно сообщать врачу о случаях неожиданного появления мышечных болей, мышечной слабости или спазмах, особенно в сочетании с недомоганием или лихорадкой.
— если мышечная боль, слабость или судороги возникают в процессе лечения препаратом Дуплекор®, следует осуществлять контроль активности КФК. Если будет установлено, что активность КФК более чем в 5 раз превысила верхнюю границу нормы лечение, следует прекратить.
— если мышечные симптомы резко выражены и вызывают ежедневный дискомфорт в течение всего дня, даже в том случае, если активность КФК повышена менее чем в 5 раз в сравнении с верхней границей нормы, лечение следует прекратить.
В случае исчезновения симптомов и возвращении к норме активности КФК, следует рассмотреть вопрос о повторном назначении препарата Дуплекор® с меньшей дозой аторвастатина и тщательном наблюдении за пациентом.
Повышение активности КФК следует учитывать при дифференциальной диагностике болей в грудной клетке при оценке вероятности развития инфаркта миокарда. При применении аторвастатина, как и других препаратов этого класса, описаны редкие случаи рабдомиолиза с острой почечной недостаточностью, обусловленной миоглобинурией.
Особенности влияния на способность управлять транспортным средством и потенциально опасными механизмами
Исследования по влиянию препарата на способность к управлению транспортными средствами и использованию механизмов не проводились. Следует соблюдать осторожность при вождении автотранспорта и управлении механизмами при приеме препарата Дуплекор®, учитывая возможное развитие чрезмерного снижения АД, головокружения и обморока.
Передозировка
Сведений о передозировке препарата нет.
Как амлодипин, так и аторвастатин активно связываются с белками плазмы крови, поэтому существенное увеличение клиренса комбинированного препарата при гемодиализе маловероятно.
Симптомы: чрезмерная периферическая вазодилатация, приводящая к рефлекторной тахикардии, и выраженное и стойкое снижение АД, в том числе с развитием шока и летального исхода.
Лечение: прием активированного угля сразу или в течение 2 ч после приема амлодипина в дозе 10 мг приводит к значительной задержке всасывания препарата. В некоторых случаях может быть эффективным промывание желудка. Выраженное снижение АД, вызванное передозировкой амлодипина, требует проведения активных мероприятий, направленных на поддержание функции сердечно-сосудистой системы, включая контроль показателей работы сердца и легких, возвышенного положения конечностей и контроль объема циркулирующей крови и диуреза. Для восстановления тонуса сосудов и АД может быть полезным применение сосудосуживающего препарата, если нет противопоказаний к его назначению, для устранения последствий блокады кальциевых каналов — в/в введение кальция глюконата.
Следует проводить оценку функции печени и определять активность креатинфосфокиназы (КФК) в сыворотке крови.
Форма выпуска и упаковка
По 10 таблеток помещают в контурную ячейковую упаковку из фольги алюминиевой и пленки ПА/Ал/ПВХ.
По 3 контурных упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную пачку.
Условия хранения
В оригинальной упаковке в защищенном от света и влаги месте, при температуре от 15 0С до 25 0С.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не использовать после истечения срока годности!
Условия отпуска из аптек
По рецепту
Наименование и страна организации-производителя
«Гедеон Рихтер Румыния» А.О., Румыния
Наименование и страна владельца регистрационного удостоверения
ОАО «Гедеон Рихтер», Венгрия
Наименование и страна организации упаковщика
«Гедеон Рихтер Румыния» А.О., Румыния
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции:
Представительство ОАО «Гедеон Рихтер» в РК
E-mail: info@richter.kz
Телефон: 8-(727) — 258-26-22, 8-(727) — 258-26-23
| 999796761477976705_ru.doc | 136 кб |
| 332191481477977840_kz.doc | 185.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Форма выпуска, состав и упаковка

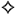
таб., покр. пленочной оболочкой, 5 мг+80 мг: 28, 30 или 60 шт.
Рег. №: 10345/15/20 от 02.07.2020 — Срок действия рег. уд. не ограничен
Таблетки, покрытые пленочной оболочкой коричневато-желтого цвета, с возможными темными вкраплениями, круглые, слегка двояковыпуклые, с фаской.
| 1 таб. | |
| амлодипин (в виде амлодипина безилата) | 5 мг |
| валсартан (в виде гранул валсартана А) | 80 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая, кроскармеллоза натрия, повидон К25, натрия лаурилсульфат, маннит, магния стеарат, кремния диоксид коллоидный безводный, поливиниловый спирт частично гидролизованный, титана диоксид (Е171), макрогол, тальк, железа оксид желтый (Е172).
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — пачки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (6) — пачки картонные.
14 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (2) — пачки картонные.
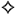
таб., покр. пленочной оболочкой, 5 мг+160 мг: 28, 30 или 60 шт.
Рег. №: 10345/15/20 от 02.07.2020 — Срок действия рег. уд. не ограничен
Таблетки, покрытые пленочной оболочкой коричневато-желтого цвета, с возможными темными вкраплениями, овальные, двояковыпуклые.
| 1 таб. | |
| амлодипин (в форме безилата) | 5 мг |
| валсартан (в виде гранул валсартана А) | 160 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая, кроскармеллоза натрия, повидон К25, натрия лаурилсульфат, маннит, магния стеарат, кремния диоксид коллоидный безводный, поливиниловый спирт частично гидролизованный, титана диоксид (Е171), макрогол, тальк, железа оксид желтый (Е172).
7 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (4) — пачки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — пачки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (6) — пачки картонные.
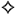
таб., покр. пленочной оболочкой, 10 мг+160 мг: 28, 30 или 60 шт.
Рег. №: 10345/15/20 от 02.07.2020 — Срок действия рег. уд. не ограничен
Таблетки, покрытые пленочной оболочкой светлого коричневато-желтого цвета, овальные, двояковыпуклые.
| 1 таб. | |
| амлодипин (в форме безилата) | 10 мг |
| валсартан | 160 мг |
| (в виде гранул валсартана А) |
Вспомогательные вещества: целлюлоза микрокристаллическая, кроскармеллоза натрия, повидон К25, натрия лаурилсульфат, маннит, магния стеарат, кремния диоксид коллоидный безводный, поливиниловый спирт частично гидролизованный, титана диоксид (Е171), макрогол, тальк, железа оксид желтый (Е172).
7 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (4) — пачки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — пачки картонные.
10 шт. — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (6) — пачки картонные.
Описание лекарственного препарата ВАЛОДИП основано на официально утвержденной инструкции по применению препарата и сделано в 2023 году. Дата обновления: 28.02.2023 г.
Фармакологическое действие
Валодип включает в себя два антигипертензивных соединения с дополнительными механизмами контроля артериального давления у пациентов с артериальной гипертензией: амлодипин относится к классу антагонистов кальция, а валсартан относится к классу блокаторов рецепторов ангиотензина II. Комбинация данных веществ обладает аддитивным антигипертензивным действием.
Амлодипин/Валсартан
Комбинация амлодипина и валсартана вызывает дозозависимое аддитивное снижение артериального давления во всем диапазоне терапевтических доз. Антигипертензивный эффект однократного приема комбинации сохраняется в течение 24 часов.
Плацебо-контролируемые исследования
Более 1400 пациентов с артериальной гипертензией получали амлодипин / валсартан один раз в день в двух плацебо-контролируемых исследованиях. В исследование были включены взрослые с легкой и умеренной неосложненной эссенциальной гипертензией (среднее диастолическое артериальное давление сидя ≥95 и <110 мм рт. ст.). Пациенты с высоким сердечно-сосудистым риском — сердечной недостаточностью, сахарным диабетом I типа и плохо контролируемым диабетом II типа, инфарктом миокарда или инсультом в течение одного года — были исключены.
Активно контролируемые исследования у пациентов, не отвечающих на монотерапию
Мультицентровое рандомизированное двойное слепое исследование с активным контролем в параллельных группах показало нормализацию артериального давления (диастолическое артериальное давление в сидячем положении <90 мм рт. ст. в конце испытания) у пациентов, не получивших адекватного контроля с валсартаном 160 мг, в 75% случаев у пациентов, получавших амлодипин/валсартан 10 мг/160 мг, и 62% — у пациентов, получавших амлодипин/валсартан 5 мг/160 мг, по сравнению с 53% пациентами, оставшихся на лечении валсартаном 160 мг. Добавление амлодипина в дозе 10 мг и 5 мг приводило к дополнительному снижению систолического/диастолического артериального давления на 6.0 / 4.8 мм рт.ст. и 3.9/2.9 мм рт.ст. соответственно по сравнению с пациентами, которые принимали только валсартан 160 мг.
Мультицентровое рандомизированное двойное слепое исследование с активным контролем в параллельных группах показало нормализацию артериального давления (диастолическое артериальное давление в положении сидя <90 мм рт. ст. в конце испытания) у пациентов, не получивших адекватного контроля АД с амлодипином в дозе 10 мг, у 78% пациентов, получавших амлодипин/валсартан 10 мг/160 мг, по сравнению с 67% пациентов, оставшихся на амлодипине 10 мг. Добавление валсартана в дозе 160 мг приводило к дополнительному снижению систолического/диастолического артериального давления на 2.9/2.1 мм рт.ст.
Комбинация амлодипин/валсартан также изучалась в активно контролируемом исследовании у 130 пациентов с гипертонической болезнью со средним диастолическим артериальным давлением в сидячем положении ≥110 мм рт. В этом исследовании (базовое артериальное давление 171/113 мм рт.ст.) схема приема амлодипина/валсартана с титрованием с 5 мг/160 мг до 10 мг/160 мг снижала артериальное давление сидя на 36/29 мм рт.ст. по сравнению с 32/28 мм рт.ст. при схеме приема лизиноприла/гидрохлоротиазида с титрованием с 10 мг/12.5 мг до 20 мг/12.5 мг.
В двух долгосрочных проспективных исследованиях эффект амлодипина/валсартана сохранялся в течение более одного года. Резкое прекращение приема амлодипина/валсартана не приводило к быстрому повышению артериального давления.
Возраст, пол, раса или индекс массы тела (≥30 кг/м2, <30 кг/м2) не влияли на эффект комбинации амлодипин/валсартан.
Амлодипин/валсартан изучался только у групп пациентов с артериальной гипертензией. Валсартан был изучен у пациентов с инфарктом миокарда и сердечной недостаточностью. Амлодипин был изучен у пациентов с хронической стабильной стенокардией, вазоспастической стенокардией и ангиографически подтвержденным заболеванием коронарной артерии.
Амлодипин
Компонент амлодипин препарата амлодипин/валсартан ингибирует трансмембранный вход ионов кальция в сердечную и сосудистую гладкую мышцу. Механизм антигипертензивного действия амлодипина обусловлен прямым расслабляющим воздействием на гладкую мускулатуру сосудов, что вызывает снижение периферического сосудистого сопротивления и артериального давления.
Экспериментальные данные позволяют предположить, что амлодипин связывается с участками связывания дигидропиридина и с недигидропиридина. Сократительные процессы сердечной мышцы и гладкой мускулатуры сосудов зависят от перемещения внеклеточного кальция в клетки через определенные ионные каналы.
После введения терапевтических доз препарата пациентам с гипертензией амлодипин вызывает расширение сосудов, что приводит к снижению артериального давления в положении лежа и стоя. Такое снижение артериального давления не сопровождаются значительным изменением частоты сердечных сокращений или уровня катехоламинов в плазме при длительном приеме препарата.
Концентрация в плазме коррелирует с оказываемым эффектом как у молодых, так и у пожилых пациентов.
У пациентов с артериальной гипертензией и нормальной функцией почек терапевтические дозы амлодипина привели к снижению сосудистого сопротивления почек, увеличению скорости клубочковой фильтрации и эффективному потоку кровотока почек без изменения фракции фильтрации или протеинурии.
Как и в случае применения других блокаторов кальциевых каналов, гемодинамические измерения сердечной функции в состоянии покоя и во время выполнения физических упражнений (или стимуляции) у пациентов с нормальной функцией желудочка, получавших амлодипин, наблюдалось небольшое увеличение сердечного индекса без значительного влияния на dP/dt или на конечное диастолическое давление или объем левого желудочка. При проведении гемодинамических исследований установили, что амлодипин не связан с отрицательным инотропным действием при введении в терапевтических дозах интактным животным и пациентам, а также пациентам при совместном введении с бета-блокаторами.
Амлодипин не изменяет синоатриальную узловую функцию или атриовентрикулярную проводимость у интактных животных или пациентов. В клинических исследованиях, в которых амлодипин вводили в сочетании с бета-блокаторами пациентам с гипертензией или стенокардией, не наблюдалось нежелательного воздействия на электрокардиографические параметры.
Применение у пациентов с гипертензией
Было проведено рандомизированное двойное слепое исследование заболеваемости и смертности под названием «Антигипертензивная и гиполипидемическая терапия для предотвращения сердечного приступа» (ALLHAT) для сравнения более новых методов лечения: при приеме амлодипина 2.5-10 мг / день (блокаторы кальциевых каналов) или лизиноприла 10-40 мг / день (ингибиторы АПФ) в качестве терапии первой линии по сравнению с терапией тиазидными диуретиками, хлорталидоном 12.5-25 мг / день при гипертензии легкой и умеренной степени.
В общей сложности 33 357 пациентов с артериальной гипертензией в возрасте 55 лет и старше были рандомизированы в группы лечения, проводилось их наблюдение в среднем в течение 4.9 лет. У пациентов отмечался по крайней мере один дополнительный фактор риска развития ишемической болезни сердца, в том числе: инфаркт миокарда или инсульт в анамнезе (> 6 месяцев до включения в исследование) или наличие других атеросклеротических сердечно-сосудистых заболеваний (в целом 51.5%), сахарного диабета 2 типа (36.1%), высокий уровень липопротеинов — холестерина <35 мг / дл или <0.906 ммоль / л (11.6%), гипертрофия левого желудочка, диагностированная на основе описания электрокардиограммы или при выполнении эхокардиографии (20.9%), являлись активными курильщиками (21.9%).
Первичной конечной точкой являлась летальная ишемическая болезнь сердца или нелетальный инфаркт миокарда. Не наблюдалось значительной разницы в первичной конечной точке между терапией на основе амлодипина и терапией на основе хлорталидона: отношение риска (ОР) 0,98, ДИ 95% (0.90-1.07) р = 0.65. Среди вторичных конечных точек частота сердечной недостаточности (компонент комбинированной конечной точки развития сердечно-сосудистых заболеваний) была значительно выше в группе приема амлодипина по сравнению с группой приема хлорталидона (10.2% против 7.7%, ОР 1.38, 95% ДИ [1.25-1.52] p <0.001). Тем не менее, не наблюдалось значительной разницы в уровне смертности по любой причине между группами проведения терапии на основе амлодипина и проведения терапиина основе хлорталидона: ОР 0.96 95% ДИ [0.89-1.02] р = 0.20.
Валсартан
Валсартан представляет собой сильнодействующий и специфический блокатор рецепторов ангиотензина II, активный при пероральном применении. Он селективно воздействует на рецепторы подтипа AT1, которые отвечают за известные эффекты ангиотензина II. Следствием блокады АТ1-рецепторов является повышение плазменной концентрации ангиотензина II, который может стимулировать незаблокированные рецепторы подтипа АТ2, что предположительно регулирует эффекты АТ1-рецепторов. Валсартан не имеет агонистической активности в отношении АТ1-рецепторов. Его сродство к рецепторам подтипа АТ1 примерно в 20000 раз больше, чем к рецепторам подтипа АТ2.
Валсартан не ингибирует ангиотензин-превращающий фермент (АПФ), известный также под названием кининаза II, который превращает ангиотензин I в ангиотензин II и разрушает брадикинин. В связи с отсутствием влияния на АПФ не потенцируются эффекты брадикинина и субстанции Р, поэтому при приеме антагонистов ангиотензина II маловероятно развитие сухого кашля. Клинические исследования, в которых валсартан сравнивался с ингибитором АПФ, показали, что частота развития сухого кашля была достоверно (р<0.05) меньше у больных, получавших валсартан по сравнению с больными, получавшими ингибитор АПФ (2.6 % против 7.9 % соответственно). В клинических исследованиях у пациентов с кашлем в анамнезе во время терапии ингибиторами АПФ сухой кашель отмечался у 19.5 %пациентов, переведенных на валсартан и 19.0 % пациентов, получавших тиазидные диуретики по сравнению с 68.5 % пациентов, получавших ингибитор АПФ (р<0.05). Валсартан не связывается и не блокирует другие рецепторы гормонов или ионные каналы, которые, как известно, играют важную роль в регуляции процессов сердечно-сосудистой системы.
Введение валсартана пациентам с гипертензией приводит к снижению артериального давления без какого-либо влияния на частоту пульса.
У большинства пациентов после введения однократной пероральной дозы антигипертензивное действие препарата наступает в течение 2 часов, а максимальное снижение артериального давления достигается спустя 4–6 часов. Антигипертензивный эффект сохраняется в течение 24 часов после введения дозы препарата. При приеме повторной дозы препарата максимальное снижение артериального давления при любой дозе обычно достигается в течение 2-4 недель и сохраняется при проведении длительной терапии.
Другие препараты: двойная блокада ренин-ангиотензин-альдостероновой системы (РААС)
В рамках двух крупных рандомизированных контролируемых исследований (ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial [продолжающееся международное исследование, направленное на сравнение телмисартана в виде монотерапии и в комбинации с рамиприлом с учетом конечной точки]) и VA NEPHRON-D (The Veterans Affairs Nephropathy in Diabetes [исследование нефропатии при сахарном диабете, проводимое Министерством по делам ветеранов])) проводилось изучение применения комбинации из ингибитора АПФ и блокатора рецепторов ангиотензина II.
Исследование ONTARGET проводилось среди пациентов, анамнез которых включал сердечно-сосудистое или цереброваскулярное заболевание, либо сахарный диабет 2-го типа, сопровождающийся признаками ишемического поражения органов-мишеней. Исследование VA NEPHRON-D проводилось среди пациентов с сахарным диабетом 2-го типа и диабетической нефропатией.
В данных исследованиях не было продемонстрировано какое-либо значительное благоприятное воздействие на почечные и (или) сердечно-сосудистые исходы и показатель смертности, при этом наблюдался более высокий риск развития гиперкалиемии, острой почечной недостаточности и (или) гипотензии по сравнению с монотерапией. Данные результаты также являются значимыми для других ингибиторов АПФ и блокаторов рецепторов ангиотензина II, учитывая их схожие фармакодинамические свойства.
Не следует одновременно назначать ингибиторы АПФ и блокаторы рецепторов ангиотензина II пациентам с диабетической нефропатией (см. раздел «Особые указания»).
Исследование ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints [исследование применения алискирена при сахарном диабете с использованием конечных точек в виде сердечно-сосудистого и почечного заболевания]) было направлено на изучение пользы от добавления алискирена к стандартной терапии ингибитором АПФ или блокатором рецепторов ангиотензина II у пациентов с сахарным диабетом 2-го типа, а также с хроническим заболеванием почек и (или) сердечно-сосудистым заболеванием, либо с двумя заболеваниями сразу. Исследование было завершено досрочно ввиду повышенного риска возникновения неблагоприятных исходов. Смерть по причине сердечно-сосудистого нарушения и инсульт наблюдались чаще (в количественном отношении) в группе, получавшей алискирен, по сравнению с группой, получавшей плацебо, при этом нежелательные явления и серьезные нежелательные явления, представляющие интерес (гиперкалиемия, гипотензия и нарушение функции почек), наблюдались чаще в группе, получавшей алискирен, чем в группе, получавшей плацебо.
Фармакокинетика
Линейность
Амлодипин и валсартан имеют линейную фармакокинетику.
Амлодипин/валсартан
После перорального введения амлодипина / валсартана пиковая концентрация амлодипина и валсартана в плазме достигается через 3 и 6-8 часов соответственно. Скорость и степень всасывания амлодипина, валсартана в фиксированной комбинации соответствуют показателям отдельных лекарственных форм.
Амлодипин
Всасывание
После перорального введения терапевтических доз амлодипина в отдельности пиковая концентрация амлодипина в плазме достигается через 6-12 часов. Абсолютная биодоступность составила 64% — 80%. Биодоступность амлодипина не зависит от приема пищи.
Распределение
Объем распределения составляет 21 л/кг. При проведении исследований in vitro амлодипина установили, что примерно 97.5% препарата в кровотоке связывается с белками плазмы.
Биотрансформация
Амлодипин обширно (приблизительно на 90%) метаболизируется в печени до неактивных метаболитов.
Выведение
Выведение амлодипина из плазмы проходит в два этапа с конечным периодом полувыведения примерно от 30 до 50 часов. Устойчивый уровень в плазме крови достигается после непрерывного применения препарата в течение 7-8 дней. Десять процентов исходного амлодипина и 60% метаболитов амлодипина выводятся с мочой.
Валсартан
Всасывание
После перорального приема только одного валсартана пиковая концентрация лекарственного средства в плазме достигается через 2–4 часа. Средняя абсолютная биодоступность составляет 23%. Употребление пищи обуславливает снижение экспозиции валсартана (о чем свидетельствует показатель AUC) приблизительно на 40 % и максимальной концентрации валсартана в плазме крови (Cmax) приблизительно на 50 %, хотя спустя приблизительно 8 часов после введения дозы концентрации валсартана в плазме крови являются аналогичными в группе, получавшей препарат после еды, и группе, получавшей препарат натощак. Тем не менее, подобное снижение показателя AUC не сопровождается каким-либо клинически значимым снижением терапевтического эффекта, в связи с чем применение валсартана можно осуществлять независимо от приема пищи.
Распределение
Объем распределения валсартана в равновесном состоянии после внутривенного введения составляет приблизительно 17 литров; данный показатель свидетельствует о том, что валсартан не распределяется в ткани в значительной степени. Валсартан активно связывается с белками сыворотки крови (94–97 %), главным образом, сывороточным альбумином.
Биотрансформация
Валсартан не биотрансформируется в значительной степени, поскольку лишь 20 % дозы выводится в виде метаболитов. Гидроксиметаболит был обнаружен в плазме крови в низкой концентрации (менее 10 % значения AUC валсартана). Данный метаболит является фармакологически неактивным.
Выведение
Валсартан демонстрирует мультиэкспоненциальную кинетику распада (t1/2α <1 ч, t1/2β приблизительно 9 ч). Валсартан выводится преимущественно с фекалиями (около 83 % введенной дозы), а также с мочой (приблизительно 13 % введенной дозы), главным образом, в неизмененном виде. После внутривенного введения плазменный клиренс валсартана составляет приблизительно 2 л/ч, а его почечный клиренс составляет 0.62 л/ч (приблизительно 30 % общего клиренса). Период полувыведения валсартана составляет 6 часов.
Особые группы пациентов
Пациенты детского возраста (до 18 лет)
Отсутствуют фармакокинетические данные для педиатрической популяции.
Пациенты пожилого возраста (в возрасте 65 лет и старше)
Время достижения пиковой концентрации амлодипина в плазме одинаково у молодых и пожилых пациентов. У пожилых пациентов клиренс амлодипина имеет тенденцию к снижению, приводит к увеличению площади под кривой (AUC) и период полувыведения. Средняя системная площадь под кривой валсартана выше на 70% у пожилых людей, чем у молодых пациентов, поэтому соблюдать осторожность при увеличении дозировки препарата.
Нарушение функции почек
Фармакокинетика амлодипина существенно не зависит от нарушения функции почек. Как и ожидалось для субстанции, почечный клиренс которой составляет лишь 30 % от общего плазменного клиренса, не наблюдалась какая-либо взаимосвязь между функцией почек и уровнем системной экспозиции валсартана.
Нарушение функции печени
Имеются ограниченные клинические данные относительно применения амлодипина у пациентов с нарушением функции печени. У пациентов с нарушением функции печени клиренс амлодипина снизился, в результате чего AUC увеличился примерно на 40–60%. В среднем, у пациентов с хроническим заболеванием печени легкой и средней степени (согласно значениям AUC) воздействие валсартана будет в два раза больше, чем у здоровых добровольцев (сгруппированных по возрасту, полу и массе тела). Следует соблюдать осторожность у пациентов с заболеваниями печени (см. разделы «Режим дозирования» и «Противопоказания»).
5.3 Доклинические данные о безопасности
Амлодипин/Валсартан
Побочные реакции, наблюдаемые в исследованиях на животных с возможной клинической значимостью, были следующими:
Гистопатологические признаки воспаления железистого желудка наблюдались у самцов крыс при воздействии примерно 1.9 (валсартана) и 2.6 (амлодипина) клинических доз 160 мг валсартана и 10 мг амлодипина. При более высоких воздействиях отмечались изъязвления и эрозия слизистой оболочки желудка как у самок, так и у самцов. Подобные изменения также наблюдались в группе, получавшей только валсартан (воздействие в 8.5–11.0 раз превышало клиническую дозу валсартана в 160 мг).
Повышенная частота и тяжесть почечной канальцевой базофилии/гиалинизации, дилатации, а также воспаление интерстициальных лимфоцитов и артериолярная медиальная гипертрофия были обнаружены при воздействии 8–13 (валсартан) и 7–8 (амлодипин) клинических доз 160 мг валсартана и 10 мг амлодипина. Аналогичные изменения были обнаружены в группе с монотерапией валсартаном (воздействие в 8.5–11.0 раз превышало клиническую дозу валсартана в 160 мг).
В исследовании развития эмбриона и плода у крыс было отмечено увеличение числа расширенных мочеточников, деформаций грудины и неоссифицированных фаланг передней лапы при воздействии примерно 12 (валсартан) и 10 (амлодипин) клинических доз 160 мг валсартана и 10 мг амлодипина. Расширение мочеточников было также обнаружено в группе с монотерапией валсартаном (воздействие в 12 раз превышало клиническую дозу валсартана в 160 мг). В этом исследовании продемонстрированы только небольшие признаки токсичности для матери (умеренное снижение массы тела). Предельная недействующая доза для развития эффектов наблюдалась при 3-(валсартан) и 4-(амлодипин) кратном клиническом воздействия (на основе AUC).
Для отдельных компонентов не было доказательств мутагенности, кластогенности или канцерогенности.
Амлодипин
Репродуктивная токсикология
При проведении исследований репродуктивного периода на крысах и мышах было установлено удлинение периода беременности, удлинение продолжительности родов и снижение выживаемости потомства при введении препарата в дозировке, примерно в 50 раз превышающей максимальную рекомендованную дозировку для людей на основе мг / кг.
Снижение репродуктивной функции
Не наблюдалось влияния на репродуктивную функцию крыс, получавших амлодипин (у самцов в течение 64 дней и у самок в течение 14 дней до спаривания) в дозировке до 10 мг / кг / день (8 -кратная* максимальная рекомендуемая доза для человека 10 мг на мг/ м2). В ходе проведения другого исследования на крысах, в котором самцам крыс вводили амлодипина безилат в течение 30 дней в дозировке, сопоставимой с дозой для человека в пересчете на мг / кг, установили снижение уровня фолликулостимулирующего гормона и тестостерона в плазме, а также снижение плотности сперматозоидов и количества зрелых сперматид и фолликулярных клеток яичка.
Канцерогенез, мутагенез
При изучении крыс и мышей, которым вводили амлодипин с пищей в течение двух лет в концентрации, рассчитанной для получения ежедневной дозы 0.5, 1.25 и 2.5 мг / кг / день, не установили каких-либо признаков канцерогенности. Максимальная доза (для мышей, для крыс — в два раза выше* максимальной рекомендуемой клинической дозы 10 мг на мг/м2) была близка к максимально переносимой дозе для мышей, но не для крыс.
При проведении исследований мутагенности не было выявлено эффектов, связанных с лекарственным средством на генном уровне или на уровне хромосом.
* Исходя из массы пациента 50 кг
Валсартан
Неклинические данные не показывают особой опасности для людей на основе обычных исследований фармакологии безопасности, токсичности повторных доз, генотоксичности, канцерогенного потенциала, токсичности для размножения и развития.
У крыс в результате введения препарата в дозах, токсичных для материнского организма (600 мг/кг/сут.), в течение последних дней периода беременности и лактации наблюдались более низкий показатель выживаемости и прироста массы тела, а также задержка развития (отлипание ушной раковины и открытие ушного канала) у потомства (см. раздел «Беременность и лактация»). Данные дозы, использовавшиеся у крыс (600 мг/кг/сут.), приблизительно в 18 раз превышают максимальную рекомендованную дозу для человека, выраженную в мг/м2 (расчеты основываются на пероральной дозе, составляющей 320 мг/сут, и массе тела пациента, составляющей 60 кг).
В доклинических исследованиях безопасности высокие дозы валсартана (200–600 мг/кг массы тела), вводившиеся крысам, обусловили снижение показателей красных кровяных телец (эритроциты, гемоглобин, гематокрит), при этом наблюдались признаки изменения почечной гемодинамики (несколько повышенный уровень мочевины в плазме крови, а также гиперплазия почечных канальцев и базофилия у самцов). Данные дозы, использовавшиеся у крыс (200 и 600 мг/кг/сут.), приблизительно в 6 и 18 раз превышают максимальную рекомендованную дозу для человека, выраженную в мг/м2 (расчеты основываются на пероральной дозе, составляющей 320 мг/сут., и массе тела пациента, составляющей 60 кг).
При использовании аналогичных доз у мартышек изменения были подобными, хотя и носили более тяжелую степень выраженности; в особенности это касается почек, изменения в которых достигли состояния нефропатии, включавшей повышенные уровни мочевины и креатинина.
У обоих видов также наблюдалась гипертрофия почечных юкстагломерулярных клеток. Полагалось, что все изменения были обусловлены фармакологическим действием валсартана, который вызывает длительную гипотензию, особенно у мартышек. Считается, что гипертрофия почечных юкстагломерулярных клеток не имеет какой-либо значимости при использовании терапевтических доз валсартана у человека.
Показания к применению
— первичная артериальная гипертензия. Валодип назначается взрослым пациентам, артериальное давление которых не контролируется должным образом использованием монотерапии амлодипином или валсартаном.
Реклама
Режим дозирования
Способ применения
Препарат принимают внутрь, независимо от приема пищи, запивая водой.
Рекомендуемая доза — 1 таб./сут.
Валодип с содержанием амлодипина/валсартана 5 мг/80 мг рекомендован пациентам, у которых артериальное давление должным образом не контролируется монопрепаратами амлодипина 5 мг или валсартана 80 мг.
Валодип с содержанием амлодипина/валсартана 5 мг/160 мг рекомендован пациентам, у которых артериальное давление должным образом не контролируется монопрепаратами амлодипина 5 мг или валсартана 160 мг.
Валодип с содержанием амлодипина/валсартана 10 мг/160 мг рекомендован пациентам, у которых артериальное давление должным образом не контролируется монопрепаратами амлодипина 10 мг или валсартана 160 мг или препаратом Валодип таблетки, покрытые пленочной оболочкой, 5 мг/160 мг.
При необходимости изменения дозы рекомендуется индивидуальный подбор дозы путем прием амлодипина и валсартана по отдельности.
Пациенты, принимающие валсартан и амлодипин отдельно, могут быть переведены на Валодип с содержанием активных веществ в тех же дозах.
Недостаточно клинических данных о применении препарата у пациентов с тяжелыми нарушениями функции почек. Не требуется коррекции дозы у пациентов с нарушением функции почек легкой или умеренной степени тяжести. При умеренно выраженной почечной недостаточности рекомендован мониторинг уровней калия и креатинина.
Валодип противопоказан пациентам с нарушением функции печени тяжелой степени (см. раздел «Противопоказания»). Осторожность необходима при назначении препарата пациентам с нарушением функции печени или обструктивными нарушениями желчевыводящих путей (см. раздел Особые указания). Максимальная рекомендуемая доза валсартана для пациентов со слабыми или умеренными нарушениями функции печени без холестаза составляет 80 мг. Особых рекомендаций по применению амлодипина у данной категории пациентов не установлено.
При переводе пациентов с артериальной гипертензией (см. раздел «Показания») с нарушениями функции печени на амлодипин или Валодип следует использовать наименьшую доступную дозу амлодипина в виде монотерапии или в составе Валодипа, соответственно.
У пациентов пожилого возраста (65 лет и старше) при увеличении дозы препарата требуется осторожность. При переводе пожилых пациентов с артериальной гипертензией (см. раздел «Показания») на амлодипин или Валодип следует использовать наименьшую доступную дозу амлодипина в виде монотерапии или в составе Валодипа, соответственно.
Безопасность и эффективность препарата для пациентов в возрасте до 18 лет не установлена. Данные не доступны.
Побочные действия
Краткое описание профиля безопасности
Безопасность амлодипина/валсартана была оценена в пяти контролируемых клинических исследованиях с 5175 пациентами, 2613 из которых получали валсартан в сочетании с амлодипином. Следующие побочные реакции были признаны наиболее часто встречающимися или наиболее значительными или тяжелыми: назофарингит, грипп, гиперчувствительность, головная боль, обмороки, ортостатическая гипотензия, отек, пастозность, отек лица, периферические отеки, усталость, приливы, астения.
Классификация частоты развития побочных эффектов: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1 /10 000 до <1/1000), очень редко (от <1/10 000), частота неизвестна (не может быть оценена на основании имеющихся данных).
Амлодипин /валсартан
Инфекционные и инвазии: часто — назофарингит, грипп.
Со стороны иммунной системы: редко — гиперчувствительность.
Со стороны обмена веществ: часто — анорексия, гипокалиемия; нечасто — анорексия, гиперкальциемия, гиперлипидемия, гиперурикемия, гипонатриемия.
Нарушения психики: редко — беспокойство.
Со стороны нервной системы: часто — головная боль; нечасто — нарушение координации, головокружение, постуральное головокружение, парестезия, сонливость.
Со стороны органа зрения: нечасто — расстройство зрения; редко — нарушение зрения.
Со стороны органа слуха и равновесия: нечасто — вертиго; редко — шум в ушах.
Со стороны сердца: нечасто — пальпитация, тахикардия; редко — обморок.
Со стороны сосудов: часто — гипотензия; нечасто — ортостатическая гипотензия.
Со стороны дыхательной системы: нечасто — кашель, боль в глотке и гортани.
Со стороны пищеварительной системы: нечасто — диарея, тошнота, чувство дискомфорта в животе, боль в верхней части живота, запор, сухость слизистой оболочки полости рта.
Со стороны кожи и подкожных тканей: нечасто — эритема, сыпь; редко — экзантема, гипергидроз, зуд.
Со стороны костно-мышечной системы: нечасто — артралгия, боль в спине, отечность суставов, мышечная слабость; редко — мышечные спазмы, чувство тяжести.
Со стороны мочевыделительной системы: редко — поллакиурия, полиурия.
Со стороны репродуктивной системы и молочной железы: редко — эректильная дисфункция.
Общие реакции: часто — астения, повышенная утомляемость, отек лица, ощущение прилива крови к коже лица, отеки, периферические отеки, пастозность.
Амлодипин
Со стороны системы кроветворения и лимфатической системы: очень редко — лейкопения, тромбоцитопения иногда с пурпурой.
Со стороны иммунной системы: очень редко — гиперчувствительность.
Со стороны обмена веществ и питания: очень редко — гипергликемия.
Нарушения психики: нечасто — депрессия, бессонница/нарушения сна, лабильность настроения; редко — спутанность сознания.
Со стороны нервной системы: часто — головокружение, головная боль, сонливость; нечасто — нарушение вкуса, парестезия, обморок, тремор, гипестезия; очень редко — мышечный гипертонус, периферическая нейропатия, нейропатия; частота неизвестна — экстрапирамидные нарушения.
Со стороны органа зрения: нечасто — расстройство зрения, нарушение зрения.
Нарушения со стороны органа слуха и равновесия: нечасто — шум в ушах.
Со стороны сердца: нечасто — пальпитация; очень редко — аритмия (включая брадикардию, желудочковую тахикардию и мерцательную аритмию), инфаркт миокарда.
Со стороны сосудов: часто — приливы жара; нечасто — гипотензия; очень редко — васкулит.
Со стороны дыхательной системы: нечасто — одышка, ринит; очень редко — кашель.
Со стороны пищеварительной системы: часто — тошнота, чувство дискомфорта в животе, боль в верхней части живота; нечасто — изменение ритма опорожнения кишечника, диарея, сухость слизистой оболочки полости рта, диспепсия, рвота; очень редко — гастрит, гипертрофический гингивит, панкреатит
Со стороны печени и желчевыводящих путей: очень редко* — повышение активности печеночных ферментов, повышение концентрации билирубина в плазме крови; очень редко — гепатит, внутрипеченочный холестаз, желтуха.
Со стороны кожи и подкожных тканей: нечасто — алопеция, экзантема, реакции фотосенсибилизации, зуд, гипергидроз, пурпура, сыпь, изменение цвета кожи; очень редко — многоформная эритема, крапивница и другие формы сыпи, эксфолиативный дерматит, синдром Стивенса-Джонсона, ангионевротический отек, отек Квинке; частота неизвестна – токсический эпидермальный некролиз.
Со стороны костно-мышечной системы: часто – отек лодыжек; нечасто — артралгия, боль в спине, мышечные спазмы, миалгия.
Со стороны мочевыделительной системы: нечасто — нарушение мочеиспускания, никтурия, поллакиурия.
Со стороны репродуктивной системы и молочной железы: нечасто — импотенция, гинекомастия.
Общие реакции: часто — отек, усталость; нечасто — астения, дискомфорт, недомогание, некардиогенная боль в груди, боль.
Лабораторные и инструментальные данные: нечасто — уменьшение или увеличение массы тела.
Валсартан
Со стороны системы кроветворения: частота неизвестна — снижение гемоглобина и гематокрита, нейтропения, тромбоцитопения иногда с пурпурой.
Со стороны иммунной системы: очень редко — гиперчувствительность.
Со стороны органа слуха и равновесия: нечасто — вертиго.
Со стороны сосудов: частота неизвестна — васкулит.
Со стороны дыхательной системы: нечасто — кашель.
Со стороны пищеварительной системы: нечасто — чувство дискомфорта в животе, боль в верхней части живота.
Со стороны печени и желчевыводящих путей: частота неизвестна — повышение активности печеночных ферментов, повышение концентрации билирубина в плазме крови.
Со стороны кожи и подкожных тканей: частота неизвестна — ангионевротический отек, буллезный дерматит, зуд, сыпь.
Со стороны костно-мышечной системы: частота неизвестна — миалгия.
Со стороны мочевыделительной системы: частота неизвестна — повышение концентрации креатинина в плазме крови, нарушение функции почек, почечная недостаточность.
Общие реакции: нечасто — усталость.
Лабораторные и инструментальные данные: частота неизвестна — повышение содержания калия в сыворотке крови.
* В основном соответствует развитию холестаза.
Дополнительная информация для комбинации
Периферические отеки, признанный побочный эффект амлодипина, обычно менее часто наблюдался у пациентов, получавших комбинацию амлодипин/валсартан, по сравнению с теми, кто получал только амлодипин. В двойных слепых контролируемых клинических исследованиях частота периферических отеков в зависимости от дозы была следующей:
| % пациентов с периферическим отеком | Валсартан, мг | |||||
| 0 | 40 | 80 | 160 | 320 | ||
| Амлодипин, мг | 0 | 3.0 | 5.5 | 2.4 | 1.6 | 0.90 |
| 2.5 | 8.0 | 2.3 | 5.4 | 2.4 | 3.9 | |
| 5 | 3.1 | 4.8 | 2.3 | 2.1 | 2.4 | |
| 10 | 10.3 | NA | NA | 9.0 | 9.5 |
Средняя частота периферических отеков, равномерно распределенных по всем дозам, составила 5.1% для комбинации амлодипин/валсартан.
Дополнительная информация по отдельным компонентам
Нежелательные реакции, ранее зарегистрированные для отдельного компонента (амлодипин или валсартан), также могут быть потенциальными побочными реакциями для комбинации амлодипин/валсартан, даже если они не наблюдались в клинических испытаниях или в постмаркетинговый период.
Амлодипин
Часто: сонливость, головокружение, ощущение сердцебиения, боль в животе, тошнота, отеки лодыжек.
Нечасто: бессонница, лабильность настроения (в т.ч. тревожность), депрессия, тремор, дисгевзия, обморок, гипестезия, нарушения зрения (в т.ч. диплопия), шум в ушах, гипотензия, одышка, ринит, рвота, диспепсия, алопеция, пурпура, изменение цвета кожи, гипергидроз, зуд, экзантема, миалгия, мышечные спазмы, боль, нарушение мочеиспускания, учащение мочеиспускания, импотенция, гинекомастия, боль в груди, недомогание, увеличение веса, снижение веса.
Редко: спутанность сознания.
Очень редко: лейкопения, тромбоцитопения, аллергические реакции, гипергликемия, мышечный гипертонус, периферическая нейропатия, инфаркт миокарда, аритмии (включая брадикардию, желудочковую тахикардию и фибрилляцию предсердий), васкулит, панкреатит, гастрит, гипертрофический гингивит, гепатит, желтуха, повышение активности печеночных ферментов (чаще всего вследствие холестаза), ангионевротический отек, многоформная эритема, крапивница, эксфолиативный дерматит, синдром Стивенса-Джонсона, отек Квинке, фотосенсибилизация.
Частота неизвестна: экстрапирамидные расстройства.
* В основном соответствует развитию холестаза
Валсартан
Частота неизвестна: снижение гемоглобина и гематокрита, нейтропения, тромбоцитопения, увеличение содержания калия в сыворотке крови, повышение показателей функции печени, повышение концентрации билирубина в сыворотке, повышение концентрации креатинина в плазме крови, нарушение функции почек, включая почечную недостаточность, ангионевротический отек, миалгия, васкулит, гиперчувствительность, включая сывороточную болезнь.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Просим медицинских работников сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях.
.
Противопоказания к применению
— повышенная чувствительность к амлодипину, другим производным дигидропиридинового ряда, валсартану или к другим компонентам препарата;
— печеночная недостаточность тяжелой степени, билиарный цирроз или холестаз;
— тяжелая артериальная гипотензия;
— шок (включая кардиогенный шок);
— обструкция выносящего тракта левого желудочка (в т.ч. гипертрофическая обструктивная кардиомиопатия (ГОКМП) и аортальный стеноз тяжелой степени);
— гемодинамически нестабильная сердечная недостаточность после острого инфаркта миокарда;
— одновременное применение антагонистов рецепторов ангиотензина II, в т.ч. валсартана, или ингибиторов АПФ с алискиреном у пациентов с сахарным диабетом или почечной недостаточностью (СКФ <60 мл/мин/1.73 м2) (см. разделы «Лекарственное взаимодействие» и «Фармакологическое действие»);
— II и III триместры беременности (см. разделы «Особые указания» и «Беременность и лактация»).
Применение при беременности и кормлении грудью
Беременность
Амлодипин
Безопасность применения амлодипина во время беременности у человека не установлена. При проведении исследований на животных наблюдалась репродуктивная токсичность при приеме препарата в высоких дозах (см. раздел «Данные доклинической безопасности»). Рекомендуется использовать при беременности только в том случае, когда отсутствует более безопасная альтернатива, а также когда заболевание связано с высоким риском для матери и плода.
Валсартан
Применение блокаторов рецепторов ангиотензина II (БРА II) не рекомендуется в I триместре беременности (см. раздел «Особые указания»). Применение БРА II противопоказано в течение II и III триместров беременности (см. разделы «Противопоказания» и «Особые указания»).
Подтверждающие эпидемиологические данные, касающиеся риска тератогенности после воздействия ингибиторов АПФ во время I триместра беременности, являются неоднозначными; тем не менее, нельзя исключить небольшое увеличение риска. Хотя в контролируемых эпидемиологических исследованиях не были получены какие-либо данные в отношении риска, связанного с применением блокаторов рецепторов ангиотензина II (БРА II), для данного класса препаратов может существовать аналогичный риск. За исключением случаев, когда непрерывная терапия с помощью БРА II считается принципиально необходимой, пациентов, планирующих беременность, следует перевести на альтернативные антигипертензивные препараты с установленным профилем безопасности применения во время беременности. При наступлении беременности следует немедленно прекратить терапию БРА II и, при необходимости, начать альтернативную терапию.
Известно, что воздействие блокаторов рецепторов ангиотензина II во время II и III триместров беременности вызывает фетотоксичность (снижение функции почек, маловодие, задержка окостенения костей черепа) и неонатальную токсичность (почечная недостаточность, гипотензия, гиперкалиемия) (см. раздел «Данные доклинической безопасности»).
В случае если воздействие БРА II имело место во время второго триместра беременности или позднее, рекомендуется провести ультразвуковое исследование плода с оценкой функции почек и состояния костей черепа.
Младенцы, матери которых получали лечение БРА II, должны находиться под тщательным наблюдением на случай развития гипотензии (см. разделы «Противопоказания» и «Особые указания»).
Препарат противопоказан во II и III триместре беременности (см. разделы «Противопоказания» и «Особые указания»).
Период лактации
Амлодипин выделяется в грудное молоко. Доля дозы матери, получаемой младенцем, оценивалась в диапазоне от 3% до 7%, максимум 15%. Влияние амлодипина на младенцев неизвестно. Нет информации относительно применения амлодипина/валсартана во время кормления грудью, поэтому комбинация амлодипин/валсартан не рекомендуется, и предпочтительны альтернативные методы лечения с установленными показателями безопасности во время кормления грудью, особенно при кормлении новорожденного или недоношенного ребенка.
Фертильность
Клинические исследования влияния комбинации амлодипин/валсартан на репродуктивную систему не проводились.
Валсартан
Негативное воздействие на репродуктивную функцию самок и самцов крыс при пероральном введении в дозе 200 мг/кг/сут не наблюдалось. Эта доза в 6 раз превышает максимально рекомендуемую дозу для человека в пересчете на мг/м2 (предположительный расчет для перорального приема препарата в дозе 320 мг/сут для пациента с массой тела 60 кг).
Амлодипин
Были зарегистрированы обратимые биохимические изменения в головке сперматозоидов у некоторых пациентов, получавших блокаторы кальциевых каналов. Недостаточно клинических данных в отношении потенциального влияния амлодипина на репродуктивную функцию. В одном исследовании на крысах было установлено нежелательное влияние на репродуктивную функцию самцов (см. раздел «Данные доклинической безопасности»).
Применение при нарушениях функции печени
Валодип противопоказан пациентам с нарушением функции печени тяжелой степени (см. раздел «Противопоказания»). Осторожность необходима при назначении препарата пациентам с нарушением функции печени или обструктивными нарушениями желчевыводящих путей (см. раздел Особые указания). Максимальная рекомендуемая доза валсартана для пациентов со слабыми или умеренными нарушениями функции печени без холестаза составляет 80 мг. Особых рекомендаций по применению амлодипина у данной категории пациентов не установлено.
Применение при нарушениях функции почек
Недостаточно клинических данных о применении препарата у пациентов с тяжелыми нарушениями функции почек. Не требуется коррекции дозы у пациентов с с нарушением функции почек легкой или умеренной степени тяжести. При умеренно выраженной почечной недостаточности рекомендован мониторинг уровней калия и креатинина.
Применение у детей
Данные о безопасности и эффективности применения препарата у детей и подростков в возрасте до 18 лет отсутствуют.
Особые указания
Безопасность и эффективность амлодипина при гипертоническом кризе не установлены.
Беременность
Прием блокаторов рецепторов ангиотензина II (БРАII) не следует начинать во время беременности. Если продолжение терапии БРАII не считается необходимым, пациенты, планирующие беременность, должны быть переведены на альтернативные антигипертензивные препараты, которые имеют установленный профиль безопасности для применения во время беременности. Когда беременность установлена, прием БРАII следует немедленно прекратить и, при необходимости, начать альтернативную терапию (см. разделы «Противопоказания» и «Беременность и лактация»).
Пациенты с гипонатриемией и/или уменьшением ОЦК
У пациентов с неосложненной артериальной гипертензией, принимающих комбинацию амлодипин/валсартан, в 0.4 % случаев наблюдалась выраженная артериальная гипотензия. У пациентов с активированной ренин-ангиотензиновой системой (например, у пациентов с дегидратацией и/или гипонатриемией, принимающих диуретики в высоких дозах) при приеме блокаторов ангиотензин-рецепторов, возможно развитие симптоматической артериальной гипотензии. Перед началом лечения рекомендовано восстановить содержание натрия и/или восполнить ОЦК, в частности, путем уменьшения доз диуретиков или начинать терапию под тщательным медицинским наблюдением.
При развитии выраженного снижения АД: следует уложить пациента в горизонтальное положение с приподнятыми ногами и, при необходимости, провести внутривенно инфузию физиологического раствора. Терапию препаратом Валодип можно продолжить после стабилизации показателей гемодинамики.
Гиперкалиемия
При одновременном применении калийсберегающих диуретиков, препаратов калия, биологически активных добавок, содержащих калий или других препаратов, способных повышать содержание калия в плазме крови (например, гепарин) следует соблюдать осторожность. Необходимо регулярно контролировать содержание ионов калия в плазме крови.
Стеноз почечной артерии
Препарат Валодип следует применять с осторожностью у пациентов с артериальной гипертензией на фоне одностороннего или двустороннего стеноза почечной артерии или стеноза артерии единственной почки, учитывая возможность увеличения сывороточных концентраций мочевины и креатинина.
Состояние после трансплантации почки
Безопасность применения комбинации амлодипин/валсартан у пациентов, недавно перенесших трансплантацию почки, не установлена.
Нарушение функции печени
Валсартан преимущественно выводится в неизмененном виде с желчью. У пациентов с нарушением функции печени удлиняется T1/2 и увеличивается AUC. Следует соблюдать осторожность при назначении комбинации валсартан/амлодипин пациентам с легким или умеренным нарушением функции печени или обструктивными заболеваниями желчных путей.
Максимальная рекомендуемая доза валсартана для пациентов со слабыми или умеренными нарушениями функции печени без холестаза составляет 80 мг.
Нарушение функции почек
Коррекция дозы комбинации амлодипин/валсартан у пациентов с легким и умеренным нарушением функции почек (СКФ >30 мл/мин/1.73 м2) не требуется. У пациентов с умеренным нарушением функции почек рекомендуется контроль содержания калия и концентрации креатинина в плазме крови.
Первичный гиперальдостеронизм
Учитывая поражение РААС при первичном гиперальдостеронизме, данным пациентам не следует назначать антагонисты ангиотензина II, в т.ч. валсартан.
Ангионевротический отек
Сообщалось о случаях ангионевротического отека, в том числе, отека гортани и голосовых связок, приводящего к обструкции дыхательных путей, и/или отека лица, губ, глотки и/или языка, у пациентов, получавших валсартан. У некоторых из них ангионевротический отек наблюдался ранее, при приеме других лекарственных средств, в том числе, ингибиторов АПФ. При развитии ангионевротического отека следует немедленно отменить препарат и исключить возможность повторного применения.
Сердечная недостаточность/перенесенный инфаркт миокарда
Следствием ингибирования ренин-ангиотензин-альдостероновой системы могут стать нарушения почечной функции при наличии предрасполагающих факторов. У пациентов, функция почек которых может зависеть от активности ренин-ангиотензин-альдостероновой системы (например, при тяжелой ХСН), терапия ингибиторами АПФ и антагонистами рецепторов ангиотензина сопровождалось олигурией и/или нарастанием азотемии, а в редких случаях – острой почечной недостаточностью и/или летальным исходом. Подобные исходы были описаны при применении валсартана. У пациентов с ХСН или перенесенным инфарктом миокарда всегда следует оценивать функцию почек.
В длительном, плацебо-контролируемом клиническом исследовании (PRAISE-2) применение амлодипина у пациентов с ХСН неишемической этиологии III-IV функционального класса по классификации NYHA сопровождалось увеличением частоты развития отека легких по сравнению с плацебо при отсутствии достоверной разницы частоты ухудшения ХСН между двумя группами.
Блокаторы кальциевых каналов, в том числе амлодипин, следует применять с осторожностью у пациентов с ХСН, так как возможно увеличение риска развития сердечно-сосудистых осложнений и летального исхода.
Стеноз аортального и митрального клапанов
Как и при применении любых вазодилататоров, следует соблюдать осторожность у пациентов с митральным стенозом или аортальным стенозом легкой и умеренной степени.
Двойная блокада РААС
Существуют доказательства того, что одновременный прием ингибиторов АПФ, БРАII или алискирена повышает риск развития гипотонии, гиперкалиемии и нарушения функции почек (включая острую почечную недостаточность).
Поэтому двойная блокада РААС за счет комбинированного использования ингибиторов АПФ, БРАII или алискирена не рекомендуется (см. разделы «Лекарственное взаимодействие» и «Фармакологическое действие»).
Если терапия двойной блокадой считается абсолютно необходимой, она должна проводиться только под наблюдением специалиста и при частом тщательном мониторинге почечной функции, электролитов и артериального давления. Ингибиторы АПФ и БРАII не следует применять одновременно у пациентов с диабетической нефропатией.
Комбинация амлодипин/валсартан изучалась только у пациентов с артериальной гипертензией.
Влияние на способность к вождению автотранспорта и управлению механизмами
При управлении транспортными средствами или работе с механизмами следует принимать во внимание, что при приеме препарата возможно внезапное возникновение головокружения или усталости.
Амлодипин может оказывать легкое или умеренное влияние на способность управлять транспортными средствами или механизмами. Если у пациентов, принимающих амлодипин, отмечается головокружение, головная боль, усталость или тошнота, то способность к быстрому реагированию может быть нарушена.
Передозировка
Симптомы: данные о случаях передозировки в настоящее время отсутствуют. При передозировке валсартана можно ожидать развитие выраженного снижения АД и головокружения. Передозировка амлодипина может привести к чрезмерной периферической вазодилатации и, возможно, к развитию рефлекторной тахикардии. Сообщали о случаях выраженной и потенциально длительной системной гипотензии, включая шок с летальным исходом, в связи с приемом амлодипина.
Лечение: при случайной передозировке следует вызвать рвоту (если препарат был принят недавно) или провести промывание желудка. Применение активированного угля у здоровых добровольцев сразу или в течение 2 ч после приема амлодипина приводило к значительному снижению его всасывания. При выраженном снижении АД на фоне приема препарата необходимо перевести пациента в положение «лежа на спине с приподнятыми ногами», принять активные меры по поддержанию деятельности сердечно-сосудистой системы, включая регулярный контроль функции сердца и дыхательной системы, ОЦК и объема выделяемой мочи. При отсутствии противопоказаний с целью восстановления сосудистого тонуса и АД возможно применение (с осторожностью) сосудосуживающих средств. Для устранения блокады кальциевых каналов возможно в/в введение раствора кальция глюконата.
Выведение валсартана и амлодипина при проведении гемодиализа маловероятно.
Лекарственное взаимодействие
Общие лекарственные взаимодействия для комбинации амлодипин/валсартан
Исследования лекарственного взаимодействия комбинации амлодипин/валсартан c другими лекарственными средствами не проводились.
Амлодипин/валсартан
Одновременное применение, требующее внимания
Другие гипотензивные препараты (например, альфа-адреноблокаторы, диуретики) и лекарственные средства, оказывающие гипотензивное действие (например, трициклические антидепрессанты, альфа-адреноблокаторы для лечения доброкачественной гиперплазии предстательной железы) могут усилить гипотензивный эффект.
Амлодипин
Одновременное применение не рекомендуется
Грейпфрут или грейпфрутовый сок: возможно повышение биодоступности у некоторых пациентов и усиление гипотензивного действия.
Одновременное применение, требующее осторожности
Одновременное применение с сильными или умеренными ингибиторами изофермента CYP3A4 (ингибиторы протеазы ВИЧ, верапамил или дилтиазем, противогрибковые средства из группы азолов, антибиотики из группы макролидов, такие как эритромицин или кларитромицин) может привести к значительному увеличению системной экспозиции амлодипина. У пациентов пожилого возраста эти изменения имеют клиническое значение, поэтому необходимы медицинское наблюдение и коррекция дозы.
Индукторы изофермента CYP3A4 (противосудорожные препараты (например, карбамазепин, фенобарбитал, фенитоин, фосфенитоин, примидон), рифампицин, зверобой продырявленный): при совместном приеме известных индукторов CYP3A4 концентрация амлодипина в плазме может изменяться. Следует контролировать артериальное давление и регулировать дозу как во время, так и после сопутствующего применения, особенно сильных индукторов CYP3A4 (например, рифампицин, зверобой продырявленный).
Одновременное повторное применение амлодипина в дозе 10 мг и симвастатина в дозе 80 мг увеличивает экспозицию симвастатина на 77% по сравнению с таковой при монотерапии симвастатином. Пациентам, получающим амлодипин, рекомендуется применять симвастатин в дозе не более 20 мг/сут.
В экспериментальных исследованиях на животных после введения внутрь верапамила и в/в введения дантролена наблюдались случаи фибрилляции желудочков с летальным исходом и сердечно-сосудистой недостаточностью, ассоциированной с гиперкалиемией. Учитывая риск развития гиперкалиемии, следует избегать одновременного применения блокаторов медленных кальциевых каналов, в т.ч. амлодипина, у пациентов, склонных к развитию злокачественной гипертермии.
Такролимус: существует риск повышения уровня такролимуса в крови при совместном приеме с амлодипином. Чтобы избежать токсичного эффекта такролимуса, введение амлодипина пациенту, получающему лечение такролимусом, требует мониторинга уровней такролимуса в крови и, при необходимости, коррекции дозы такролимуса.
Кларитромицин является ингибитором CYP3A4. Существует повышенный риск развития гипотонии у пациентов, принимающих кларитромицин совместно с амлодипином. При одновременном применении рекомендуется тщательное наблюдение за пациентами.
Механистическая мишень ингибиторов рапамицина (mTOR): ингибиторы mTOR, такие как сиролимус, темсиролимус и эверолимус, являются субстратами CYP3A. Амлодипин является слабым ингибитором CYP3A. При одновременном применении с этими веществами амлодипин может усиливать действие ингибиторов mTOR.
Одновременное применение, требующее внимания
В клинических исследованиях амлодипина не установлено значимого взаимодействия с аторвастатином, дигоксином, варфарином, циклоспорином.
Валсартан
Одновременное применение не рекомендовано
При одновременном применении ингибиторов АПФ или антагонистов рецептора ангиотензина II, включая валсартан, с препаратами лития было зарегистрировано обратимое увеличение концентрации лития в плазме крови и развитие интоксикации. При необходимости одновременного применения следует тщательно контролировать концентрацию лития в плазме крови. При применении в том числе диуретика возможно увеличение риска токсичности лития.
При необходимости одновременного применения с калийсберегающими диуретиками, препаратами калия, калийсодержащими пищевыми добавками и другими лекарственными средствами и веществами, которые могут увеличить содержание калия в сыворотке крови, рекомендуется контролировать содержание калия в сыворотке крови.
Одновременное применение, требующее осторожности
НПВП, в т.ч. селективные ингибиторы ЦОГ-2, ацетилсалициловая кислота в дозе более 3 г/сут и неселективные НПВП: при одновременном применении возможно ослабление гипотензивного эффекта, увеличение риска развития нарушений функции почек и повышение содержания калия в плазме крови. В начале терапии рекомендуется оценить функцию почек, а также скорректировать нарушения водно-электролитного баланса.
Ингибиторы транспортеров обратного захвата (рифампицин, циклоспорин) или эффлюксных транспортеров (ритонавир): по результатам исследования in vitro валсартан является субстратом для белков-переносчиков ОАТР1В1 и MRP2. Одновременный прием ингибиторов транспортеров обратного захвата (рифампицин, циклоспорин) или эффлюксных транспортеров (ритонавир) может усиливать действие валсартана.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС): данные клинических испытаний показали, что двойная блокада РААС за счет комбинированного применения ингибиторов АПФ, БРАII или алискирена связана с более высокой частотой развития нежелательных реакций, таких как гипотензия, гиперкалиемия и снижение функции почек (включая острую почечную недостаточность), по сравнению с монотерапией (см. разделы «Противопоказания», «Особые указания» и «Фармакологическое действие»).
Другие лекарственные средства: при монотерапии валсартаном не выявлено клинически значимых взаимодействий со следующими лекарственными средствами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, гидрохлоротиазид, амлодипин и глибенкламид.
Условия отпуска из аптек
По рецепту врача *.
* Включен в перечень препаратов, реализуемых без рецепта врача согласно Постановления МЗ РБ №27 от 9 февраля 2023г.
Срок годности препарата
Срок годности — 3 года.
Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата или работы с ним
Нет особых требований к утилизации. Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Контакты для обращений
КРКА д.д., представительство, (Словения)

Представительство АО «KRKA, d.d., Novo mesto» (Словения) в Беларуси
220114 Минск, ул. Филимонова 25Г, оф. 315, 3 этаж
Тел/факс: (375-740) 740-92-30
E-mail: info.by@krka.biz
 |
Международное непатентованное название? Амлодипин+Валсартан |
 |
Действующие вещества: амлодипина безилат (амлодипина бесилат) 6,94 мг, эквивалентно амлодипину 5,00 мг.Вспомогательные вещества: маннитол, магния стеарат, кремния диоксид коллоидный. |
 |
Комбинация блокаторов кальциевых каналов и блокаторов рецепторов ангиотензина II |
 |
ПроизводителиКрка-Рус(Россия) |
 |
Показания к применению Вамлосет таблетки 5мг+160мгАртериальная гипертензия (пациентам, которым показана комбинированная терапия). |
 |
Способ применения и дозировка Вамлосет таблетки 5мг+160мгВнутрь, запивая небольшим количеством воды, 1 раз в сутки, независимо от времени приема пищи.Рекомендуемая суточная доза — 1 таблетка препарата Вамлосет содержащая амлодипин/валсартан в дозе 5/80 мг или 5/160 мг, или 10/160 мг, или 5/320 мг, или 10/320 мг.Максимальная суточная доза — 5/320 мг (в пересчете по валсартану) или 10/160 мг (в пересчете по амлодипину) или 10/320 мг.Начинать прием препарата Вамлосет (рекомендовано с дозы 5/80 мг 1 раз в сутки. Увеличивать дозу можно через 1-2 недели после начала терапии.У пациентов старше 65 лет коррекции дозы препарата не требуется. У пациентов данной категории при необходимости возможно уменьшение начальной дозы препарата Вамлосет до содержащей наименьшую дозу амлодипина, т. е. 1 таблетка, содержащая амлодипин/валсартан в дозе 5/80 мг или 5/160 мг.Поскольку данных о безопасности и эффективности препарата Вамлосет у детей и подростков (младше 18 лет) недостаточно, препарат не рекомендуется применять у пациентов данной категории.Для пациентов с нарушениями функции почек легкой и умеренной степени тяжести (КК > 30 мл/мин) коррекции начальной дозы не требуется.Вследствие наличия в составе валсартана и амлодипина препарат Вамлосет следует с осторожностью применять у пациентов с нарушениями функции печени и обструктивными заболеваниями желчных путей. У пациентов данной категории при необходимости возможно уменьшение начальной дозы препарата до содержащей наименьшую дозу амлодипина, т. е. 1 таблетка, содержащая амлодипин/валсартан в дозе 5/80 мг или 5/160 мг. |
 |
Противопоказания Вамлосет таблетки 5мг+160мгПовышенная чувствительность к амлодипину, другим производным дигидропиридинового ряда, валсартану, а также к другим вспомогательным компонентам препарата.Наследственный ангионевротический отек, либо отек у пациентов на фоне предшествующей терапии АРА II.Тяжелая печеночная недостаточность (более 9 балов по шкале Чайлд-Пью), билиарный цирроз и холестаз.Тяжелая почечная недостаточность (КК менее 30 мл/мин), применение у пациентов, находящихся на гемодиализе.Планирование беременности, беременность и период грудного вскармливания.Тяжелая артериальная гипотензия (систолическое АД менее 90 мм рт. ст.), коллапс, шок (включая кардиогенный шок).Обструкция выносящего тракта левого желудочка (в т. ч. аортальный стеноз тяжелой степени).Гемодинамически нестабильная сердечная недостаточность после острого инфаркта миокарда.Первичный гиперальдостеронизм.Одновременное применение с алискиреном и препаратами, содержащими алискирен, у пациентов с сахарным диабетом и/или умеренным или тяжелым нарушением функции почек (скорость клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2 площади поверхности тела).Одновременное применение с ингибиторами АПФ у пациентов с диабетической нефропатией.Безопасность применения препарата Вамлосет у пациентов после перенесенной трансплантации почки, а также у детей и подростков до 18 лет не установлена. |
 |
Фармакологическое действиеФармакодинамика: Комбинированный гипотензивный препарат, содержащий два действующих вещества с дополняющим друг друга механизмом контроля артериального давления (АД). Амлодипин, производное дигидропиридина, относится к классу блокаторов «медленных» кальциевых каналов (БМКК), валсартан — к классу антагонистов рецепторов ангиотензина II. Комбинация этих компонентов обладает взаимно дополняющим антигипертензивным действием, что приводит к более выраженному снижению АД по сравнению с АД при их раздельном применении.Амлодипин — производное дигидропиридина, БМКК, оказывает антиангинальное и антигипертензивное действие. Ингибирует трансмембранное поступление ионов кальция в кардиомиоциты и гладкомышечные клетки сосудов. Механизм антигипертензивного действия амлодипина обусловлен прямым расслабляющим эффектом на гладкие мышцы сосудов, что приводит к снижению общего периферического сосудистого сопротивления (ОПСС) и АД.Экспериментальные данные показывают, что амлодипин связывается как с дигидропиридиновыми, так и с недигидропиридиновыми рецепторами.Амлодипин в терапевтических дозах у пациентов с артериальной гипертензией вызывает расширение кровеносных сосудов, что приводит к снижению АД (в положении «лежа» и «стоя»). Снижение АД не сопровождается существенным изменением частоты сердечных сокращений (ЧСС) и концентрации катехоламинов в плазме крови при длительном применении амлодипина.При артериальной гипертензии у пациентов с нормальной функцией почек амлодипин в терапевтических дозах приводит к уменьшению сопротивления почечных сосудов и повышению скорости клубочковой фильтрации и эффективного почечного кровотока без изменения фильтрационной фракции и степени протеинурии.Амлодипин, как и другие БМКК, у пациентов с нормальной функцией левого желудочка (ЛЖ) вызывает изменение гемодинамических показателей функции сердца в покое и при физической нагрузке (или стимуляции): отмечалось незначительное увеличение сердечного индекса, без существенного влияния на максимальную скорость нарастания давления в ЛЖ (dP/dt) и конечное диастолическое давление и конечный диастолический объем ЛЖ. Гемодинамические исследования у интактных животных и людей показали, что снижение АД при применении амлодипина в диапазоне терапевтических доз не вызывает отрицательного инотропного эффекта, даже при одновременном применении с бета-адреноблокаторами.Амлодипин не изменяет функцию синоатриального узла или атриовентрикулярную проводимость у интактных животных и людей. Применение амлодипина в комбинации с бета-адреноблокаторами у пациентов с артериальной гипертензией или стенокардией не сопровождалось нежелательными изменениями на ЭКГ.Доказана клиническая эффективность амлодипина у пациентов со стабильной стенокардией напряжения, вазоспастической стенокардией и ангиографически подтвержденным поражением коронарных артерий.Валсартан является активным и селективным антагонистом рецепторов ангиотензина II (АРА II) для приема внутрь, небелковой природы.Избирательно блокирует рецепторы подтипа АТ1, которые ответственны за эффекты ангиотензина II. Повышение плазменной концентрации ангиотензина II вследствие блокады АТ1-рецепторов под действием валсартана может стимулировать незаблокированные АТ2-рецепторы, которые противодействуют эффектам при стимуляции АТ]-рецепторов. Валсартан не обладает агонистической активностью в отношении АТ1-рецепторов. Сродство валсартана к рецепторам подтипа АТ1 примерно в 20 000 раз выше, чем к рецепторам подтипа АТ2.Валсартан не ингибирует ангиотензинпревращающий фермент (АПФ), также известный как кининаза II, который превращает ангиотензин I в ангиотензин II и разрушает брадикинин. В связи с отсутствием влияния на АПФ. не потенцируются эффекты брадикинина или субстанции Р, поэтому при приеме АРА II маловероятно развитие сухого кашля.В сравнительных клинических исследованиях валсартана с ингибитором АПФ частота развития сухого кашля была достоверно ниже (р < 0,05) у пациентов, получавших валсартан (у 2,6 % пациентов, получавших валсартан, и у 7,9 % — получавших ингибитор АПФ). В клиническом исследовании, включавшем пациентов, у которых ранее при лечении ингибитором АПФ развивался сухой кашель, при лечении валсартаном это осложнение было отмечено в 19,5 % случаев, при лечении тиазидным диуретиком — в 19,0% случаев. В то же время в группе пациентов, получавших лечение ингибитором АПФ, кашель наблюдался в 68,5 % случаев (р < 0,05).Валсартан не вступает во взаимодействие и не блокирует рецепторы других гормонов или ионные каналы, имеющие важное значение для регуляции функций сердечно-сосудистой системы.При лечении артериальной гипертензии валсартан снижает АД, не влияя на ЧСС.После приема внутрь разовой дозы валсартана антигипертензивный эффект развивается в течение 2 часов у большинства пациентов. Максимальное снижение АД достигается в течение 4-6 часов. Антигипертензивный эффект валсартана сохраняется в течение 24 часов после его приема. При повторном применении валсартана максимальное снижение АД, вне зависимости от принятой дозы, обычно достигается через 2-4 недели и поддерживается на достигнутом уровне в ходе длительной терапии. Внезапное прекращение приема валсартана не сопровождается резким повышением АД или другими нежелательными клиническими последствиями. Применение валсартана у пациентов с хронической сердечной недостаточностью (II-IV функциональные классы по классификации NYHA) приводит к значительному уменьшению числа госпитализаций. Этот эффект максимально выражен у пациентов, не получающих ингибиторы АПФ или (3- адреноблокаторы. При приеме валсартана у пациентов с левожелудочковой недостаточностью (стабильное клиническое течение) или с нарушением функции ЛЖ после перенесенного инфаркта миокарда отмечается снижение сердечно-сосудистой смертности.Комбинация амлодипина и валсартана аддитивно дозозависимо в терапевтическом диапазоне доз снижает АД. При приеме одной дозы комбинации амлодипин/валсартан антигипертензивный эффект сохраняется в течение 24 часов.Доказана клиническая эффективность комбинации амлодипина/валсартана у пациентов с мягкой и умеренной артериальной гипертензией (среднее диастолическое АД (ДАД) > 95 мм рт. ст. и < 110 мм рт. ст.) без осложнений в сравнении с плацебо.Уровень снижения АД в положении «сидя» при артериальной гипертензии с ДАД > 110 мм рт. ст. и < 120 мм рт. ст. сравнимо с применением комбинации ингибитора АПФ и тиазидного диуретика.Антигипертензивный эффект сохраняется длительно. Внезапное прекращение приема препарата не сопровождается резким повышением АД (отсутствует синдром «отмены»). Терапевтическая эффективность не зависит от возраста, пола, расы пациента и индекса массы тела.При применении комбинированной терапии амлодипин/валсартан достигается сопоставимый контроль АД при меньшей вероятности развития периферических отеков у пациентов с ранее достигнутым контролем АД и выраженными периферическими отеками на фоне терапии амлодипином.Фармакокинетика: Фармакокинетика амлодипина и валсартана характеризуется линейностью.После приема внутрь амлодипина в терапевтических дозах максимальная концентрация (Сmах) в плазме крови достигается через 6-12 часов. Абсолютная биодоступность составляет в среднем 64-80 %. Прием пищи не влияет на биодоступность амлодипина.Объем распределения (Vd) составляет примерно 21 л/кг. По данным исследований in vitro показано, что у пациентов с артериальной гипертензией примерно 97,5 %циркулирующего препарата связывается с белками плазмы крови.Концентрация амлодипина в плазме крови коррелирует с клиническим эффектом как у молодых пациентов, так и у пациентов пожилого возраста.Амлодипин интенсивно (около 90 %) метаболизируется в печени с образованием неактивных метаболитов.Выведение амлодипина из плазмы крови носит двухфазный характер с периодом полувыведения (Т1/2) приблизительно от 30 до 50 часов. Равновесные концентрации в плазме крови достигаются после продолжительного применения внутрь в течение 7-8 дней. 10 % неизмененного амлодипина и 60 % амлодипина в виде метаболитов выводится почками.После приема валсартана внутрь Сmах в плазме крови достигается через 2-3 часа. Средняя абсолютная биодоступность составляет 23 %. При приеме валсартана с пищей отмечается снижение биодоступности (по значению площади под кривой «концентрация-время» (AUC)) на 40 %, а Сmах — почти на 50 %, но примерно через 8 часов после приема препарата внутрь плазменные концентрации валсартана в группе пациентов, принимавших его с пищей, и в группе, принимавшей натощак, выравниваются. Уменьшение AUC не сопровождается клинически значимым снижением терапевтического эффекта, поэтому валсартан можно принимать вне зависимости от времени приема пищи.Vd валсартана в период равновесного состояния после внутривенного введения составлял около 17 л, что указывает на отсутствие экстенсивного распределения валсартана в тканях. Валсартан в значительной степени связывается с белками сыворотки крови (94- 97 %), преимущественно альбуминами.Валсартан не подвергается выраженному метаболизму (около 20 % принятой дозы определяется в виде метаболитов). Гидроксильный метаболит определяется в плазме крови в низких концентрациях (менее чем 10 % от AUC валсартана). Этот метаболит фармакологически неактивен.Фармакокинетическая кривая валсартана носит нисходящий мультиэкспоненциальный характер (Т1/2aльфа < 1 часа и T1/2бета около 9 часов). Валсартан выводится в основном в неизмененном виде через кишечник (около 83 %) и почками (около 13 %). После внутривенного введения плазменный клиренс валсартана составляет около 2 л/ч и его почечный клиренс составляет 0,62 л/ч (около 30 % общего клиренса). Т1/2 валсартана составляет 6 часов.После приема внутрь комбинации амлодипин/валсартан Сmах валсартана и амлодипина в плазме крови достигаются через 3 и 6-8 часов, соответственно. Скорость и степень всасывания эквивалентны биодоступности валсартана и амлодипина при приеме каждого из них по отдельности.Нет фармакокинетических данных по применению препарата у детей и подростков <18 лет. У пациентов пожилого возраста (>65 лет) время достижения Сmах амлодипина в плазме крови у молодых пациентов и пациентов пожилого возраста одинаково. У пациентов пожилого возраста клиренс амлодипина незначительно снижен, что приводит к увеличению AUC и Т1/2.У пациентов пожилого возраста средние значения системного воздействия (AUC) валсартана несколько более выражено, чем у пациентов молодого возраста. Однако это не было клинически значимым. Учитывая хорошую переносимость амлодипина и валсартана у пациентов пожилого возраста и более молодого возраста, рекомендуется применять обычные режимы дозирования.У пациентов с нарушением функции почек фармакокинетические параметры амлодипина существенно не изменяются. Не было выявлено корреляции между функцией почек (клиренс креатинина — КК) и системным воздействием (AUC) валсартана у пациентов с различной степенью нарушения функции почек.Не требуется изменений начальной дозы у пациентов с легкими и умеренными нарушениями функции почек.Опыт применения препарата у пациентов с нарушением функции печени ограничен. Пациенты с нарушением функции печени имеют сниженный клиренс амлодипина, что приводит к повышению AUC примерно на 40-60 %. В среднем, у пациентов с нарушением функции печени легкой (5-6 баллов по шкале Чайлд-Пью) и умеренной (7-9 баллов по шкале Чайлд-Пью) степени биодостунность (по значению AUC) валсартана удваивается по сравнению со здоровыми добровольцами (соответствующего возраста, пола и массы тела). Препарат Вамлосет должен применяться с осторожностью у пациентов с нарушениями функции печени, обструктивными заболеваниями желчных путей. |
 |
Побочное действие Вамлосет таблетки 5мг+160мгКлассификация частоты развития побочных эффектов, рекомендуемая Всемирной организацией здравоохранения (ВОЗ): очень часто > 1/10, часто от > 1/100 до < 1/10, нечасто от > 1/1000 до < 1/100, редко от> 1/10000 до < 1/1000, очень редко от < 1/10000, частота неизвестна не может быть оценена на основе имеющихся данных.Инфекционные и паразитарные заболевания: (Амлодипин/Валсартан) часто – назофарингит, грипп.Нарушения со стороны крови и лимфатической системы: (Валсартан) частота неизвестна – снижение гемоглобина и гематокрита, нейтропения, тромбоцитопения иногда с пурпурой; (Амлодипин) очень редко – лейкопения, тромбоцитопения иногда с пурпурой.Нарушения со стороны иммунной системы: (Амлодипин/Валсартан) редко – гиперчувствительность;(Амлодипин) очень редко – гиперчувствительность;(Валсартан) частота неизвестна – гиперчувствительность.Нарушения со стороны обмена веществ и питания: (Амлодипин/Валсартан): нечасто – анорексия, гиперкальциемия, гиперлипидемия, гиперурикемия, гипонатриемия, часто – гипокалиемия.(Амлодипин): очень редко – гипергликемия.Нарушения психики: (Амлодипин/Валсартан): редко – тревожность.(Амлодипин): нечасто – депрессия, бессонница/нарушение сна, лабильностьнастроения; редко – спутанность сознания.Нарушения со стороны нервной системы:(Амлодипин/Валсартан): нечасто – нарушение координации, головокружение, постуральное головокружение, парастезия; бессонница, часто – головная боль.(Амлодипин): часто – головокружение, головная боль, бессонница; нечасто – нарушение вкуса, парастезия, обморок, тремор, гипестензия; частота неизвестна – экстрапирамидные нарушения; очень редко – мышечный гипертонус, периферическая нейропатия, нейропатия.Нарушения со стороны органа зрения:(Амлодипин/Валсартан): редко – ухудшение зрения; нечасто – нарушение зрения.(Амлодипин): нечасто – ухудшения зрения, нарушения зрения.Нарушения со стороны органа слуха и лабиринтные нарушения:(Амлодипин/Валсартан): редко – шум в ушах; нечасто – вертиго.(Амлодипин): нечасто – шум в ушах.(Валсартан): нечасто – вертиго.Нарушения со стороны сердца: (Амлодипин/Валсартан): нечасто – ощущение сердцебиения, тахикардия; редко – обморок.(Амлодипин): часто – ощущение сердцебиения; очень редко – аритмии (включая брадикардию, желудочковую тахикардию и фибрилляцию предсердий), инфаркт миокарда.Нарушения со стороны сосудов: (Амлодипин/Валсартан): редко – выраженное снижение АД; нечасто – ортостатическая гипотензия.(Амлодипин): часто – ощущение «прилива» крови к коже лица, нечасто — выраженное снижение АД; очень редко – васкулит.(Валсартан): частота неизвестна – васкулит.Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:(Амлодипин/Валсартан): нечасто – кашель, одышка, боль в глотке и гортани.(Амлодипин): очень редко – кашель; нечасто – одышка, ринит.(Валсартан): нечасто – кашель.Нарушения со стороны пищеварительной системы:(Амлодипин/Валсартан): нечасто — чувство дискомфорта в животе, боль в верхней части живота, запор, диарея, сухость слизистой оболочки полости рта, тошнота.(Амлодипин): часто — чувство дискомфорта в животе, боль в верхней части живота, тошнота; нечасто – изменение стула, запор, диарея, сухость слизистой оболочки полости рта, диспепсия, рвота; очень редко – гастрит, гиперплазия десен, панкреатит.(Валсартан): нечасто — чувство дискомфорта в животе.Нарушения со стороны печени и желчевыводящих путей:(Амлодипин): очень редко – повышение активности «печеночных» ферментов, повышение концентрации билирубина в плазме крови; гепатит, внутрипеченочный холестаз, желтуха.(Валсартан): частота неизвестна — повышение активности «печеночных» ферментов, повышение концентрации билирубина в плазме крови.Нарушения со стороны кожи и подкожных тканей:(Амлодипин/Валсартан): нечасто – эритема, кожная сыпь; редко – экзантема, гипергидроз, кожный зуд.(Амлодипин): нечасто – алопеция, экзантема, гипергидроз, реакции фоточувствительности, кожный зуд, пурпура, кожная сыпь, изменение цвета кожи; очень редко – ангионевротический отек, многоформная эритема, крапивница, эксфолиативный дерматит, синдром Стивенса-Джонсона, отек Квинке.(Валсартан): частота неизвестна – ангионевротический отек, буллезный дерматит, кожный зуд.Нарушения со стороны скелетно-мышечной системы и соединительной ткани:(Амлодипин/Валсартан): нечасто – артралгия, боль в спине, припухлость суставов; редко – мышечные спазмы, ощущение тяжести во всем теле.(Амлодипин): нечасто – артралгия, боль в спине, мышечные спазмы, миалгия; часто – отек лодыжек.(Валсартан): частота неизвестна – миалгия.Нарушения со стороны почек и мочевыводящих путей:(Амлодипин/Валсартан): редко – поллакиурия, полиурия.(Амлодипин): нечасто – нарушение мочеиспускания, никтурия, поллакиурия.(Валсартан): частота неизвестна – повышение концентрации креатинина в плазме крови, нарушение функции почек, включая почечную недостаточность.Нарушения со стороны половых органов и молочной железы:(Амлодипин/Валсартан): редко – эректильная дисфункция.(Амлодипин): нечасто – импотенция, гинекомастия.Общие расстройства и нарушения в месте введения:(Амлодипин/Валсартан): часто – астения, повышенная утомляемость, отек лица, ощущение «прилива» крови к коже лица, отеки, периферические отеки, пастозность.(Амлодипин): нечасто – астения, дискомфорт, некардиогенная боль в сердце, боль; часто – повышенная утомляемость, отеки.(Валсартан): нечасто – повышенная утомляемость.Лабораторные и инструментальные данные:(Амлодипин): нечасто – увеличение массы тела, снижение массы тела.(Валсартан): частота неизвестна – повышение содержания калия в сыворотке кропи. |
 |
ПередозировкаСимптомы: Данные о случаях передозировки в настоящее время отсутствуют. При передозировке валсартаном можно ожидать развитие выраженного снижения АД и головокружения. Передозировка амлодипином может привести к выраженному снижению АД с возможным развитием рефлекторной тахикардии и чрезмерной периферической вазодилатации (риск развития выраженной и стойкой артериальной гипотензии, в т. ч. с развитием шока и летального исхода).Лечение: Лечение симптоматическое, характер которого зависит от времени, прошедшего с момента приема препарата, и от степени тяжести симптомов. При случайной передозировке следует вызвать рвоту (если препарат был принят недавно) или провести промывание желудка. Применение активированного угля у здоровых добровольцев сразу или в течение 2 часов после приема амлодипина приводило к значительному снижению его всасывания. При выраженном снижении АД на фоне приема препарата Вамлосет необходимо перевести пациента в положение «лежа» на спине с приподнятыми ногами, принять активные меры по поддержанию деятельности сердечно-сосудистой системы, включая регулярный контроль функции сердца и дыхательной системы, ОЦК и объема выделяемой мочи. При отсутствии противопоказаний с целью восстановления сосудистого тонуса и АД возможно применение (с осторожностью) сосудосуживающих средств. Для устранения блокады кальциевых каналов возможно внутривенное введение раствора кальция глюконата.Выведение валсартана и амлодипина при проведении гемодиализа маловероятно. |
 |
Взаимодействие Вамлосет таблетки 5мг+160мгОбщие лекарственные взаимодействия для препарата Вамлосет (амлодинин/валсартан):Другие гипотензивные препараты (например, альфа-адреноблокаторы, диуретики) и лекарственные средства, оказывающие гипотензивное действие (например, трициклические антидепрессанты, альфа-адреноблокаторы для лечения доброкачественной гиперплазии предстательной железы), могут усилить антигипертензивный эффект.Лекарственные взаимодействия для амлодипина:Нежелательное одновременное применение:Грейпфрут или грейпфрутовый сок: Одновременное применение не рекомендуется, учитывая возможность увеличения биодоступносги у некоторых пациентов и усиления антигипертензивного действия.Одновременное применение, требующее осторожности:Одновременное применение с сильными или умеренными ингибиторами изофермента CYP3A4 (ингибиторами протеазы, верапамилом или дилтиаземом, азольными противогрибковыми лекарственными средствами, макролидами, такими как эритромицин или кларитромицин) может привести к значительному увеличению системной экспозиции амлодипина. У пациентов пожилого возраста эти изменения имеют клиническое значение, поэтому необходимы медицинское наблюдение и коррекция дозы.Индукторы изофермента CYP3A4 (противосудорожные препараты (например, карбамазепин, фенобарбитал, фенитоин, фосфенитоин, примидон), рифампицин, растительные препараты, содержащие Зверобой продырявленный) При одновременном применении индукторов изофермента CYP3A4 концентрация амлодипина в плазме крови может варьироваться. Поэтому показан контроль артериальною давления и коррекция дозы амлодипина как во время лечения индукторами изофермента CYP3A4, так и после их отмены, особенно при применении сильных индукторов изоферменга CYP3A4 (например, рифампицина, препаратов, содержащих Зверобой продырявленный).Одновременное повторное применение амлодипина в дозе 10 мг/сут и симвастатина в дозе 80 мг/сут увеличивает экспозицию симвастатина на 77 % по сравнению с таковой при монотерапии симвастатином. Пациентам, получающим амлодипин, рекомендуется применять симвастатин в дозе не более 20 мг/сут.В экспериментах на животных после приема внутрь верапамила и внутривенного введения дантролена наблюдались случаи фибрилляции желудочков с летальным исходом и сердечно-сосудистой недостаточности, ассоциированной с гиперкалиемией. Учитывая риск развития следует избегать одновременного применения блокаторов «медленных» кальциевых каналов, в т. ч. амлодипина, у пациентов, склонных к развитию злокачественной гипертермии.При одновременном применении с амлодипином существует риск повышения концентрации такролимуса в плазме крови, но фармакокинетический механизм данного взаимодействия полностью не изучен. Для предупреждения токсического действия такролимуса при одновременном применении с амлодипином следует контролировать концентрацию такролимуса в плазме крови и корректировать дозу такролимуса при необходимости.Исследования лекарственного взаимодействия с применением циклоспорина и амлодипина у здоровых добровольцев или других групп пациентов не проводились, кроме пациентов, перенесших трансплантацию почки, у которых наблюдались вариабельные минимальные концентрации (средние значения: 0 %-40 %) циклоспорина. При одновременном применении амлодипина у пациентов, перенесших трансплантацию почки, следует контролировать концентрацию циклоспорина в плазме крови, и при необходимости снизить его дозу.Кларитромицин является ингибитором изофермента CYP3A4. При одновременном применении амлодипина и кларитромицина повышен риск развития артериальной гипотензии. Рекомендуется тщательное медицинское наблюдение за пациентами, получающими амлодипин одновременно с кларитромицином.Ингибиторы mTOR, такие как сиролимус, темсиролимус и эверолимус представляют собой субстраты изофермента CYP3A. Амлодипин является слабым ингибитором изофермента CYP3A. При одновременном применении с ингибиторами mTOR амлодипин может повышать их экспозицию.Одновременное применение, требующее внимания:В клинических исследованиях амлодипина нет значимого взаимодействия с тиазидными диуретиками, альфа-адреноблокаторами, бета-адреноблокаторами, ингибиторами АПФ, нитратами длительного действия, нитроглицерином для подъязычного применения, дигоксином, варфарином, аторвастатином, силденафилом, маалоксом (алюминий- или магнийсодержащие антацидные препараты, симетикон), циметидином, нестероидными противовоспалительными препаратами (НПВП), антибиотиками и гипогликемическими средствами для приема внутрь.Одновременный прием амлодипина и этанола не влияет на фармакокинетику последнего.Препараты кальция могут уменьшить эффект БМКК.При одновременном применении БМКК с препаратами лития (для амлодипина данные отсутствуют) возможно усиление проявления их нейротоксичности (тошнота, рвота, диарея, атаксия, тремор, шум в ушах).Снижение антигипертензивного действия (задержка жидкости и ионов натрия в результате действия кортикостероидов).Одновременное применение АРА II, включая валсартан, с алискиреном и препаратами, содержащими алискирен, противопоказано у пациентов с сахарным диабетом и/или умеренным или тяжелым нарушением функции почек (СКФ менее 60 мл/мин/1.73 м2 площади поверхности тела) и не рекомендуется у других пациентов.Одновременное применение АРА II с ингибиторами АПФ противопоказано у пациентов с диабетической нефропатией и не рекомендуется у других пациентов. Одновременное применение с препаратами лития не рекомендуется, т. к. возможно обратимое увеличение концентрации лития в плазме крови и развитие интоксикации. При необходимости одновременного применения с препаратами лития следует тщательно контролировать концентрацию лития в плазме крови. Риск токсических проявлений, связанных с применением препаратов лития, может дополнительно увеличиваться при одновременном применении с препаратом Вамлосет и диуретиками. Калийсберегающие диуретики, препараты катя, калийсодержащие пищевые добавки и другие лекарственные средства и вещества, которые могут увеличивать содержание катя в сыворотке крови (например, гепарин).При необходимости одновременного применения с препаратами, влияющими на содержание калия, рекомендуется контролировать содержание калия в плазме крови.Одновременное применение, требующее осторожности НПВП, в том числе селективные ингибиторы циклооксигеназы-2 (ЦОГ-2), ацетилсалициловая кислота в дозе более 3 г/сут и неселективные НПВП При одновременном применении возможно ослабление антигипертензивного эффекта, увеличение риска развития нарушений функции почек и повышение содержания калия в плазме крови. В начале терапии рекомендуется оценить функцию почек, а также скорректировать нарушения водно-электролитного баланса.По результатам исследования in vitro валсартан является субстратом для белков- переносчиков ОАТР1В1 и MRP2. Одновременное применение валсартана с ингибиторами белка-переносчика OATP1B1 (например, рифампицин, циклоспорин) и ингибитором белка-переносчика MRP2 (например, ритонавир) может увеличить системную экспозицию валсартана (Сmах и AUC). Это следует учитывать в начале и при окончании одновременной терапии. Двойная блокада РААС при применении АРА II, ингибиторов АПФ или алискирена Одновременное применение АРА II с другими препаратами, влияющими на РААС, приводит к увеличению частоты возникновения случаев артериальной гипотензии, гиперкалиемии, нарушения функции почек. Необходимо контролировать показатели артериального давления, функции почек, а также содержание электролитов плазмы крови при применении препарата Вамлосет с другими препаратами, влияющими на РААС.При монотерапии валсартаном не выявлено клинически значимых взаимодействий со следующими лекарственными средствами: циметидин, варфарин, фуросемид, дигоксин, атенолол, индометацин, гидрохлоротиазид, амлодипин и глибенкламид. |
 |
Особые указанияС осторожностью: Нарушение функции печени легкой (5-6 баллов по шкале Чайлд-Пью) и умеренной (7-9 баллов по шкале Чайлд-Пью) степени тяжести, а также при обструктивных заболеваниях желчных путей, односторонний или двусторонний стеноз почечных артерий или стеноз артерии единственной почки, хроническая сердечная недостаточность (ХСН) III-IV функционального класса по классификации NYHA, острый коронарный синдром, после перенесенного острого инфаркта миокарда, гиперкалиемия, гипонатриемия, диета с ограничением потребления поваренной соли, сниженный объем циркулирующей крови (ОЦК) (в т. ч. диарея, рвота).Также как и при применении других вазодилататоров, следует соблюдать особую осторожность при применении у пациентов с митральным или аортальным стенозом легкой и умеренной степени и гипертрофической обструктивной кардиомиопатией (ГОКМП).Применение препарата противопоказано при беременности. Учитывая механизм действия АРА II, нельзя исключить риск для плода при применении препарата в I триместре беременности.Как и любой другой препарат, оказывающий непосредственное влияние на ренин-ангиотензин-альдостероновую систему (РААС), препарат не следует применять во время беременности, а также женщинам, планирующим беременность.При применении средств, воздействующих на РААС, необходимо проинформировать женщин детородного возраста о потенциальном риске отрицательного влияния данных препаратов на плод во время беременности. При планировании беременности рекомендуется пациентку перевести на альтернативную гипотензивную терапию с учетом профиля безопасности. В случае диагностирования беременности следует прекратить прием препарата и, при необходимости, перевести на альтернативную гипотензивную терапию. Препарат Вамлосет, как и другие средства, оказывающие прямое воздействие на РААС, противопоказан во II-III триместрах беременности, поскольку может вызывать фетотоксические эффекты (нарушение функции почек, замедление окостенения костей черепа плода, олигогидрамнион) и неонатальные токсические эффекты (почечную недостаточность, артериальную гипотензию, гиперкалиемию) и гибель плода. Если все же применяли препарат во II-III триместрах беременности, то необходимо провести ультразвуковое исследование почек и костей черепа плода. Новорожденные, матери которых принимали препарат Вамлосет во время беременности, должны находиться под наблюдением, т. к. возможно развитие артериальной гипотензии у новорожденного.Не рекомендуется применять препарат в период грудного вскармливания. При необходимости применения препарата в период лактации грудное вскармливание следует прекратить.Опыт применения амлодипина показывает, что амлодипин выделяется в женское грудное молоко. Среднее соотношение молоко/плазма для концентрации амлодипина составило 0,85 среди 31 кормящей женщины, которые страдали артериальной гипертензией, обусловленной беременностью, и получали амлодипин в начальной дозировке 5 мг в сутки.Дозировка препарата при необходимости корректировалась (в зависимости от средней суточной дозы и веса: 6 мг и 98,7 мкг/кг, соответственно). Предполагаемая суточная доза амлодипина, получаемая младенцем через грудное молоко, составляет 4,17 мкг/кг.У пациентов с неосложненной артериальной гипертензией, принимающих терапию комбинацией амлодипин/валсартан, в 0,4% случаев наблюдалась выраженная артериальная гипотензия.У пациентов с активированной РААС (например, у пациентов с дегидратацией и/или гипонатриемией, принимающих диуретики в высоких дозах) при приеме АРА II возможно развитие симптоматической артериальной гипотензии. Перед началом лечения рекомендовано восстановить содержание натрия и/или восполнить ОЦК, в частности, путем уменьшения доз диуретиков или начинать терапию под тщательным медицинским наблюдением.При развитии выраженного снижения АД следует уложить пациента в горизонтальное положение с приподнятыми ногами и при необходимости провести внутривенно инфузию 0,9 % раствора натрия хлорида. Терапию препаратом Вамлосет можно продолжить после стабилизации показателей гемодинамики.При одновременном применении калийсберегающих диуретиков, препаратов калия, биологически активных добавок, содержащих калий, или других препаратов, способных повышать содержание калия в плазме крови (например, гепарин), следует соблюдать осторожность. Необходимо регулярно контролировать содержание калия в плазме крови.Препарат следует применять с осторожностью у пациентов с артериальной гипертензией на фоне одностороннего или двустороннего стеноза почечной артерии или стеноза артерии единственной почки, учитывая возможность увеличения сывороточных концентраций мочевины и креатинина.Безопасность применения комбинации амлодипин/валсартан у пациентов, недавно перенесших трансплантацию почки, не установлена.Валсартан преимущественно выводится в неизмененном виде с желчью. У пациентов Т1/2 удлиняется, a AUC — увеличивается. Следует соблюдать осторожность при применении препарата Вамлосет пациентам с легким (5-6 баллов по шкале Чайлд-Пью) или умеренным (7-9 баллов по шкале Чайлд-Пью) нарушением функции печени или обструктивными заболеваниями желчных путей.Коррекции дозы препарата Вамлосет у пациентов с легким и умеренным нарушением функции почек не требуется. У пациентов с умеренным нарушением функции почек рекомендуется контроль содержания калия и концентрации креатинина в плазме крови. Одновременное применение АРА II, включая валсартан, или ингибиторов АПФ с алискиреном противопоказано у пациентов с нарушением функции почек (КК менее 60 мл/мин).Учитывая поражение РААС при первичном гиперальдостеронизме, данным пациентам не следует назначать АРА II, в том числе валсартан.Среди пациентов с ангионевротическим отеком (в том числе отек гортани и голосовых связок, вызывающий обструкцию дыхательных путей и/или отек лица, губ, глотки и/или языка) на фоне терапии препаратом Вамлосет, наблюдались случаи развития ангионевротического отека в анамнезе, в том числе и на ингибиторы АПФ. При развитии ангионевротического отека следует немедленно отменить препарат и исключить возможность повторного применения.У пациентов, функция почек которых может зависеть от активности РААС (например, при тяжелой ХСН), терапия ингибиторами АПФ и АРА II сопровождается олигурией и/или нарастанием азотемии, а в редких случаях — острой почечной недостаточностью и/или летальным исходом. Подобные исходы были описаны при применении валсартана. У пациентов с ХСН или перенесенным инфарктом миокарда всегда следует оценивать функцию почек.У пациентов с ХСН неишемической этиологии III-IV функционального класса по классификации NYHA применение амлодипина сопровождалось увеличением частоты развития отека легких по сравнению с плацебо при отсутствии достоверной разницы частоты ухудшения ХСН между двумя группами. Блокаторы «медленных» кальциевых каналов, в т. ч. амлодипин, следует применять с осторожностью у пациентов с ХСН, т. к. возможно увеличение риска развития сердечно-сосудистых осложнений и летального исхода.Как и при применении любых вазодилататоров, следует соблюдать осторожность у пациентов с митральным стенозом и аортальным стенозом легкой и умеренной степени, ГОКМП. Комбинация амлодипин/валсартан изучалась только у пациентов с артериальной гипертензией.При применении препарата необходимо соблюдать осторожность при управлении транспортными средствами и другими техническими устройствами, требующими повышенной концентрации внимания и быстроты психомоторных реакций, т. к. возможно появление головокружения, утомляемости и тошноты. |
 |
Условия храненияХранить в недоступном для детей месте, в оригинальной упаковке при температуре не выше 25 С. |
