Описание препарата Элигард (лиофилизат для приготовления раствора для подкожного введения, 22.5 мг) основано на официальной инструкции, утверждено компанией-производителем в 2011 году
Дата согласования: 14.09.2011
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав и форма выпускa
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Элигард
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Состав и форма выпускa
| Лиофилизат для приготовления раствора для подкожного введения | 2 шприца |
| 1 шприц А | |
| растворитель, состоящий из сополимера поли-D,L-лактид-ко-гликолид и N-метил-2-пирролидона | 330 мг |
| 440 мг | |
| 426 мг | |
| 1 шприц Б | |
| лейпрорелина ацетат* | 10,2 мг |
| 28,2 мг | |
| 58,2 мг | |
| * избыток лейпрорелина ацетата компенсирует потери в шприце и игле | |
| восстановленный раствор (вводимая доза) содержит 7,5; 22,5 или 45 мг лейпрорелина ацетата |
в ячейковой упаковке по 1 шприцу А (в комплекте с поршнем и влагопоглотителем) и 1 шприцу Б (в комплекте с иглой инъекционной и влагопоглотителем); в пачке картонной 2 шприца.
Описание лекарственной формы
Шприц А (растворитель)
Дозировка 7,5 мг: прозрачная, вязкая, от светло-желтого до светло-желтого с коричневатым оттенком цвета жидкость, без видимых посторонних частиц.
Дозировки 22,5 мг и 45 мг: прозрачная, вязкая, от бесцветного до светло-желтого цвета жидкость, без видимых посторонних частиц.
Допускается наличие пузырьков воздуха.
Шприц Б (лиофилизат лейпрорелина ацетата): от белого до почти белого цвета, без видимых посторонних частиц.
Восстановленный раствор
Дозировка 7,5 мг: вязкая, от светло-желтого до светло-желтого с коричневатым оттенком жидкость, без видимых посторонних частиц.
Дозировки 22,5 мг и 45 мг: вязкая, от бесцветного до светло-желтого цвета жидкость, без видимых посторонних частиц.
Допускается наличие пузырьков воздуха.
Фармакологическое действие
Фармакологическое действие
—
противоопухолевое.
Фармакодинамика
Лейпрорелин является синтетическим непептидным аналогом естественного гонадотропин-рилизинг-гормона (ГнРГ), который при длительном применении ингибирует секрецию гипофизарного гонадотропина и подавляет тестикулярный стероидогенез у мужчин. Аналог обладает большей эффективностью, чем естественный гормон, и его воздействие обратимо при прекращении лечения.
Назначение лейпрорелина сначала приводит к повышению уровня циркулирующего ЛГ и ФСГ, в результате чего временно повышается уровень гонадных стероидов, тестостерона и дигидротестостерона у мужчин. При продолжительном применении лейпрорелина уровень ЛГ и ФСГ снижается. У мужчин уровень тестостерона снижается до кастрационного уровня (≤50 нг/дл) в течение 3–5 нед после начала лечения. Средний уровень тестостерона через 6 мес лечения составляет (6,1±0,4) нг/дл для дозировки 7,5 мг; (10,1±0,7) нг/дл — для 22,5 мг и (10,4±0,53) нг/дл — для 45 мг. Эти значения сопоставимы с уровнем тестостерона после выполнения билатеральной орхиэктомии.
Фармакокинетика
После первой инъекции через 4–8 ч Сmах лейпрорелина, определяемая в сыворотке крови, повышается до 25,3; 127 и 82 нг/дл при применении лейпрорелина в дозе 7,5; 22,5 и 45 мг соответственно.
После первоначального повышения (фаза плато составляет от 2 до 28 дней для дозировки 7,5 мг; от 3 до 84 — для 22,5 мг, от 3 до 168 — для 45 мг) уровень лейпрорелина в сыворотке оставался относительно стабильным (0,2–2 нг/мл).
Данные о накоплении вещества при повторных инъекциях отсутствуют.
Связывание с белками плазмы — 43–49%.
При введении 1 мг лейпрорелина ацетата в/в здоровым добровольцам (мужчинам) выяснилось, что при применении двухкамерной модели средний клиренс составил 8,34 л/ч с конечным Т1/2 приблизительно 3 ч.
Исследований по выведению препарата Элигард не проводилось.
Показания
Гормонозависимый рак предстательной железы.
Противопоказания
- повышенная чувствительность к лейпрорелину, другим агонистам ГнРГ или любому вспомогательному веществу, входящему в состав лекарственной формы;
- хирургическая кастрация;
- женщины;
- дети.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
П/к, периодически меняя место инъекции, избегая попадания препарата в артерию или вену.
При дозировке 7,5 мг 1 раз в мес; при дозировке 22,5 мг 1 раз в 3 мес и 1 раз в 6 мес — при дозировке 45 мг.
Введенный раствор образует депо препарата, обеспечивающее постоянное высвобождение лейпрорелина в течение указанного периода времени. Лечение длительное. При повышении уровня простатспецифического антигена (ПСА) на фоне кастрационного уровня тестостерона лечение Элигардом следует прекратить.
Корректировка доз для особых групп пациентов: клинических данных по применению Элигарда у больных с печеночной или почечной недостаточностью нет.
Рекомендации по приготовлению раствора для введения
Содержимое двух заранее наполненных стерильных шприцев должно быть смешано непосредственно перед введением. Приготовление смеси производится следующим образом:
Рисунок 1. Перед использованием следует достать упаковку из холодильника и выдержать при комнатной температуре до тех пор, пока температура упаковки не достигнет комнатной. Извлечь шприц А и шприц Б из упаковок.
Рисунок 2. Вынуть из шприца Б короткий поршень со вторым ограничителем, достать длинный поршень из упаковки со шприцом А и вставить его в шприц Б.
Рисунок 3. Снять крышки со шприца А (растворитель для приготовления раствора) и шприца Б (лиофилизированный лейпрорелина ацетат).
Рисунок 4. Осторожно соединить шприцы. Смешать раствор, попеременно нажимая на поршень шприца А и шприца Б 60 раз для получения однородного раствора. Готовая к применению смесь должна быть бесцветной или светло-желтой.
Рисунок 5. Ввести полученную смесь в шприц Б. Убрать шприц А, продолжая до конца надавливать на его поршень. Вставить в шприц Б стерильную иглу.
Смесь готова для п/к введения. Раствор должен быть немедленно введен после его смешения.
Примечание: могут появиться небольшие пузырьки — это нормальное явление, и оно никак не влияет на образование депо после введения.
Только для одноразового использования. Неиспользованный раствор должен быть уничтожен.
Побочные действия
Побочные эффекты, наблюдаемые при применении Элигарда, в основном обусловлены фармакологическим действием препарата.
Со стороны сердечно-сосудистой системы: приливы жара, повышение или снижение АД, обморок; в отдельных случаях — периферические отеки, эмболия ветвей легочной артерии, сердцебиение, одышка.
Со стороны нервной системы: гипестезия, головокружение, головная боль, бессонница, вкусовые расстройства, расстройство обоняния, непроизвольные движения; в отдельных случаях — нарушение сна, депрессия, периферическое головокружение, амнезия, расстройство зрения и повышенная чувствительность кожи.
Со стороны пищеварительной системы: тошнота/рвота, диарея, диспепсия, запор, сухость во рту, отрыжка, метеоризм.
Со стороны дыхательной системы: ринорея, затрудненное дыхание.
Со стороны мочеполовой системы: дизурия, никтурия, олигурия, инфекция мочевых путей, затрудненное мочеиспускание, спазмы мочевого пузыря, гематурия, острая задержка мочи, атрофия яичек, боль в яичках, бесплодие, импотенция, снижение либидо.
Со стороны эндокринной системы: боль в грудных железах, гинекомастия.
Со стороны костно-мышечной системы: артралгия, боль в спине, боль в конечностях, миалгия, мышечные судороги, мышечная слабость.
У больных с хирургической или медикаментозной кастрацией отмечается снижение плотности костной ткани. Следует иметь в виду, что длительный прием Элигарда также может привести к снижению плотности костной ткани и прогрессированию остеопороза.
Нарушения со стороны лабораторных показателей: снижение количества эритроцитов, уровня гемоглобина и гематокрита, повышение содержания креатинфосфокиназы в крови, увеличение времени свертывания крови, повышенное содержание АЛТ, повышенное содержание триглицеридов в крови, увеличенное ПВ, также отмечались редкие случаи тромбоцитопении и лейкопении.
Местные реакции: жжение/покалывание, боль, покраснение, кровоподтеки и зуд в месте инъекции; редко — уплотнение и изъязвление в месте введения препарата.
Прочие: чувство недомогания, повышенная усталость, слабость, кожная сыпь, алопеция, повышенная потливость, озноб, изменение толерантности к глюкозе, увеличение массы тела. В первые недели после начала терапии Элигардом может наблюдаться обострение симптомов основного заболевания.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Исследований по изучению фармакокинетического взаимодействия препарата Элигард с другими препаратами не проводилось.
О взаимодействии Элигарда с другими лекарственными препаратами не сообщалось.
Передозировка
Данных относительно передозировки у людей не имеется.
Лечение: в случае передозировки — симптоматическое.
Особые указания
Элигард должен применяться под наблюдением врача, имеющего опыт применения противоопухолевой терапии.
Как и другие препараты-агонисты ГнРГ, в течение первой недели лечения Элигард вызывает кратковременное повышение концентрации тестостерона, дигидротестостерона и кислой фосфатазы в сыворотке крови, в связи с чем у пациентов могут усилиться симптомы или возникнуть новые (боль в костях, неврологические расстройства, гематурия, обструкция мочеточника или инфравезикальная обструкция). Эти симптомы обычно проходят при продолжении терапии. При применении агонистов ГнРГ сообщалось также о случаях компрессии спинного мозга. При необходимости следует проводить стандартное лечение этих осложнений.
За пациентами с метастазами в позвоночник и/или головной мозг, а также за пациентами с обструкцией мочевых путей должно вестись тщательное наблюдение в течение первых нескольких недель лечения.
Дополнительное назначение соответствующего антиандрогена за 3 дня до начала терапии Элигардом и продолжение его приема в течение первых 2 или 3 нед лечения предупреждает последствия первоначального повышения уровня тестостерона.
Антиандрогенная терапия повышает риск переломов костей в результате возникновения остеопороза. Помимо продолжительного дефицита тестостерона на развитие остеопороза может влиять преклонный возраст, курение, потребление алкоголя, лишний вес и недостаточные физические нагрузки.
В связи с возможным снижением толерантности к глюкозе, пациенты, страдающие сахарным диабетом, нуждаются в более тщательном наблюдении при лечении препаратом Элигард.
После выполнения кастрации хирургическим путем применение Элигарда не приводит к дальнейшему снижению тестостерона в сыворотке крови.
Влияние на способность водить автомобиль и управлять механизмами
Некоторые побочные действия препарата, такие как повышенная усталость, головокружение, нарушения зрения, могут отрицательно влиять на способность к управлению автомобилем и выполнению потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре 2–8 °C в оригинальной упаковке.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Готовый раствор стабилен химически и физически в течение 30 мин при температуре 25 °C.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Элигард (Eligard) инструкция по применению
📜 Инструкция по применению Элигард
💊 Состав препарата Элигард
✅ Применение препарата Элигард
📅 Условия хранения Элигард
⏳ Срок годности Элигард
Описание лекарственного препарата
Элигард
(Eligard)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2022.04.08
Владелец регистрационного удостоверения:
Производство готовой лекарственной формы/первичная упаковка:
Tolmar, Inc.
(США)
Код ATX:
L02AE02
(Лейпрорелин)
Лекарственные формы
| Элигард |
Лиофилизат д/пригот. раствора для п/к введения 7.5 мг: шприцы 2 шт. в компл. с растворителем, иглой инъекц. и пакетиком с влагопоглотителем рег. №: ЛСР-006156/09 |
|
|
Лиофилизат д/пригот. раствора для п/к введения 22.5 мг: шприцы 2 шт. в компл. с растворителем, иглой инъекц. и пакетиком с влагопоглотителем рег. №: ЛСР-006156/09 |
||
|
Лиофилизат д/пригот. раствора для п/к введения 45 мг: шприцы 2 шт. в компл. с растворителем, иглой инъекц. и пакетиком с влагопоглотителем рег. №: ЛСР-006156/09 |
Форма выпуска, упаковка и состав
препарата Элигард
Лиофилизат для приготовления раствора для п/к введения (шприц Б) от белого до почти белого цвета, без видимых посторонних частиц. Приложенный растворитель (шприц А) — от светло-желтой до светло-желтой с коричневатым оттенком, прозрачная, вязкая жидкость без видимых посторонних частиц; допускается наличие пузырьков воздуха. Восстановленный раствор — вязкая жидкость от светло-желтого до светло-желтого с коричневатым оттенком цвета, без видимых посторонних частиц; допускается наличие пузырьков воздуха.
Растворитель (шприц А): (сополимер поли-D,L-лактид-ко-гликолид: ПЛГХ (50:50) — 117 мг, N-метил-2-пирролидон — 226 мг) — 343 мг.
Шприцы из полипропилена или сополимера циклического олефина [шприц А в комплекте с поршнем для шприца Б и пакетиком с влагопоглотителем, помещенный в контурную ячейковую упаковку из полиэфира, покрытую алюминиевой фольгой ламинированной] (1) и [шприц Б в комплекте с иглой инъекционной и пакетиком с влагопоглотителем, помещенный в упаковку ячейковую контурную из полиэфира, покрытую алюминиевой фольгой ламинированной] (1) — пачки картонные.
Лиофилизат для приготовления раствора для п/к введения (шприц Б) от белого до почти белого цвета, без видимых посторонних частиц. Приложенный растворитель (шприц А) — от бесцветной до светло-желтой, прозрачная, вязкая жидкость без видимых посторонних частиц; допускается наличие пузырьков воздуха. Восстановленный раствор — вязкая жидкость от бесцветной до светло-желтого цвета, без видимых посторонних частиц; допускается наличие пузырьков воздуха.
Растворитель (шприц А): (сополимер поли-D,L-лактид-ко-гликолид: ПЛГ (75:25) — 206 мг, N-метил-2-пирролидон — 251 мг) — 457 мг.
Шприцы из полипропилена или сополимера циклического олефина [шприц А в комплекте с поршнем для шприца Б и пакетиком с влагопоглотителем, помещенный в контурную ячейковую упаковку из полиэфира, покрытую алюминиевой фольгой ламинированной] (1) и [шприц Б в комплекте с иглой инъекционной и пакетиком с влагопоглотителем, помещенный в упаковку ячейковую контурную из полиэфира, покрытую алюминиевой фольгой ламинированной] (1) — пачки картонные.
Лиофилизат для приготовления раствора для п/к введения (шприц Б) от белого до почти белого цвета, без видимых посторонних частиц. Приложенный растворитель (шприц А) — от бесцветной до светло-желтой, прозрачная, вязкая жидкость без видимых посторонних частиц; допускается наличие пузырьков воздуха. Восстановленный раствор — вязкая жидкость от бесцветной до светло-желтого цвета, без видимых посторонних частиц; допускается наличие пузырьков воздуха.
Растворитель (шприц А): (сополимер поли-D,L-лактид-ко-гликолид: ПЛГ (85:15) — 217 мг, N-метил-2-пирролидон — 217 мг) — 434 мг.
Шприцы из полипропилена или сополимера циклического олефина [шприц А в комплекте с поршнем для шприца Б и пакетиком с влагопоглотителем, помещенный в контурную ячейковую упаковку из полиэфира, покрытую алюминиевой фольгой ламинированной] (1) и [шприц Б в комплекте с иглой инъекционной и пакетиком с влагопоглотителем, помещенный в упаковку ячейковую контурную из полиэфира, покрытую алюминиевой фольгой ламинированной] (1) — пачки картонные.
* избыток лейпрорелина ацетата компенсирует потери в шприце и игле. Восстановленный раствор (вводимая доза) содержит 7.5 мг, 22.5 мг или 45 мг лейпрорелина ацетата.
Фармакологическое действие
Лейпрорелин является синтетическим непептидным аналогом естественного гонадотропин-рилизинг гормона (ГнРГ), который при длительном применении ингибирует секрецию гипофизарного гонадотропина и подавляет тестикулярный стероидогенез у мужчин. Аналог обладает большей эффективностью, чем естественный гормон, и его воздействие обратимо при прекращении лечения. Однако время восстановления концентрации тестостерона может варьировать среди пациентов.
Применение лейпрорелина сначала приводит к повышению концентрации циркулирующего ЛГ и ФСГ, в результате чего временно повышается концентрация гонадных стероидов, тестостерона и дигидротестостерона у мужчин. При продолжительном применении лейпрорелина содержание ЛГ и ФСГ снижается. У мужчин содержание тестостерона снижается до кастрационного уровня (≤50 нг/дл) в течение 3-5 недель после начала лечения. Среднее содержание тестостерона через 6 месяцев лечения составляет 6.1 (±0.4) нг/дл для дозировки 7.5 мг; 10.1 (±0.7) нг/дл для дозировки 22.5 мг и 10.4 (±0.53) нг/дл для дозировки 45 мг. Эти значения сопоставимы с содержанием тестостерона после выполнения билатеральной орхиэктомии.
Все пациенты в клиническом исследовании препарата Элигард 7.5 мг достигли кастрационных уровней тестостерона на 6-й неделе лечения; 94% пациентов — к 28 дню и 98% пациентов — к 35 дню. Все пациенты в клиническом исследовании препарата Элигард 22.5 мг достигли кастрационных уровней тестостерона на 5-й неделе; 99% пациентов — к 28 дню. Все пациенты (за исключением одного) в клиническом исследовании препарата Элигард 45 мг достигли кастрационных уровней тестостерона на 4-й неделе. У подавляющего большинства пациентов концентрации тестостерона уменьшались ниже 20 нг/дл, хотя полноценное преимущество данных низких уровней тестостерона пока еще не было установлено.
Концентрации ПСА снизились на 94% через 6 месяцев лечения при применении препарата Элигард 7.5 мг, на 98% — при применении препарата Элигард 22.5 мг, на 97% — при применении препарата Элигард 45 мг.
Длительные исследования показали, что постоянная терапия поддерживает концентрацию тестостерона ниже кастрационного уровня на протяжении до 7 лет и, по всей видимости, на неопределенный срок.
Фармакокинетика
Всасывание
После первой инъекции через 4-8 ч средний уровень концентрации лейпрорелина (Cmax), определяемой в сыворотке крови, повышается до 25.3 нг/дл, 127 нг/дл и 82 нг/дл при применении лейпрорелина в дозе 7.5 мг, 22.5 мг и 45 мг соответственно. После первоначального повышения (фаза плато составляет от 2 до 28 дней для дозировки 7.5 мг; от 3 до 84 дней — для дозировки 22.5 мг, от 3 до 168 дней — для дозировки 45 мг) уровень лейпрорелина в сыворотке оставался относительно стабильным: 0.28-1.67 нг/мл для дозировки 7.5 мг и 0.2-2 нг/мл для дозировок 22.5 и 45 мг. Данные о накоплении вещества при повторных инъекциях отсутствуют.
Распределение
Средний Vd в равновесном состоянии после в/в однократного введения лейпрорелина здоровым добровольцам мужчинам составлял 27 л. По данным исследований in vitro связывание с белками плазмы составляет от 43% до 49%.
Выведение
При введении 1 мг лейпрорелина ацетата в/в здоровым добровольцам мужчинам выяснилось, что при применении двухкамерной модели средний клиренс составил 8.34 л/ч с конечным T1/2 приблизительно 3 ч. Исследований по выведению препарата Элигард не проводилось. Исследований по лекарственному метаболизму препарата Элигард не проводилось.
Показания препарата
Элигард
- гормонозависимый рак предстательной железы.
Режим дозирования
Элигард следует применять только под контролем специалиста здравоохранения, имеющего достаточный опыт для оценки эффективности лечения.
Элигард назначают в виде подкожной инъекции один раз в месяц при дозировке 7.5 мг, 1 раз в 3 месяца при дозировке 22.5 мг и 1 раз в 6 месяцев при дозировке 45 мг. Содержимое двух заранее наполненных стерильных шприцев должно быть смешано непосредственно перед п/к введением препарата Элигард. Введенный раствор образует депо препарата, обеспечивающее постоянное высвобождение лейпрорелина в течение указанного периода.
Как правило, терапия распространенного рака предстательной железы с использованием препарата Элигард предусматривает длительное лечение и не должна прекращаться при наступлении улучшения или ремиссии. Элигард может применяться в качестве неоадъювантной или адъювантной терапии в сочетании с лучевой терапией у пациентов с локализованным раком высокого риска и местно-распространенным раком предстательной железы.
Место инъекции следует периодически менять. Необходимо избегать попадания препарата в артерию или вену.
Ответ на терапию препаратом Элигард необходимо контролировать по клиническим параметрам и измерению концентрации ПСА в сыворотке крови. Результаты клинических исследований показали, что концентрация тестостерона увеличивалась в течение первых 3 дней лечения у большинства пациентов, не подвергавшихся орхиэктомии, а затем снижалась до уровней ниже таковых при медикаментозной кастрации в течение 3-4 недель. После достижения данные показатели остаются неизменными при продолжении терапии лекарственным препаратом (<1.0% случаев прорывного повышения концентраций тестостерона). Если ответ пациента на терапию является недостаточным, необходимо убедиться, что концентрация тестостерона в сыворотке крови достигла или остается на кастрационном уровне. В случае предполагаемой или известной ошибки при смешивании у пациента должна быть определена концентрация тестостерона в связи с тем, что в результате неправильного приготовления, смешивания или введения препарата могут наблюдаться случаи отсутствия клинической эффективности.
У пациентов с метастатическим кастрационно-резистентным раком предстательной железы, не подвергавшихся хирургической кастрации и получающих агонисты ГнРГ, такие как лейпрорелин, лечение агонистами ГнРГ может быть продолжено на фоне применения ингибиторов биосинтеза андрогенов или ингибиторов андрогенных рецепторов.
Коррекция доз для особых популяций пациентов
Клинических данных по применению препарата Элигард у пациентов с печеночной или почечной недостаточностью нет.
В случае предполагаемой или известной ошибки при смешивании у пациента должна быть определена концентрация тестостерона в связи с тем, что в результате неправильного приготовления, смешивания или введения препарата могут наблюдаться случаи отсутствия клинической эффективности.
Рекомендации по приготовлению раствора для введения
Если препарат был приготовлен с нарушением инструкций, его не следует использовать в связи с тем, что при неправильном приготовлении раствора для п/к введения могут наблюдаться случаи отсутствия клинической эффективности.
Сначала рекомендуется подготовить пациента к введению препарата, а затем приступить к приготовлению раствора в соответствии с рекомендациями, представленными ниже.
Упаковку достают из холодильника примерно за 30 мин до использования и выдерживают при комнатной температуре.
После извлечения из холодильника препарат может храниться в оригинальной упаковке при комнатной температуре (не выше 25°С) до 4 недель.
Шаг 1. Извлечь из коробки две контурные ячейковые упаковки и открыть их, потянув за свободный край алюминиевой фольги, извлечь содержимое ячейковых упаковок (рис. 1.1 и 1.2) и положить на чистую поверхность. Следует выбросить пакетики с влагопоглотителем.
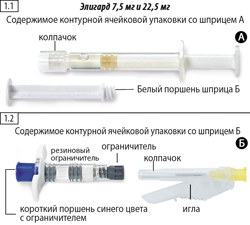
Шаг 2. Взять шприц Б и извлечь из него короткий поршень синего цвета вместе с прикрепленным ограничителем серого цвета (не следует выкручивать поршень из ограничителя), следует выбросить их (рис. 2).

Не следует смешивать содержимое шприцев пока синий короткий поршень с прикрепленным ограничителем серого цвета не будет извлечен из шприца Б.
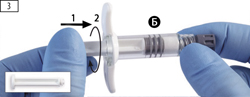
Шаг 3. Взять белый поршень для шприца Б и вставить его в шприц Б со стороны оставшегося серого ограничителя (рис. 3, шаг 1), провернуть поршень по часовой стрелке до ограничителя (рис. 3, шаг 2).
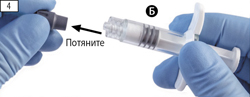
Шаг 4. Снять серый резиновый колпачок со шприца Б и отложить шприц (рис. 4).
Шаг 5. Взять шприц А и, удерживая его в вертикальном положении, чтобы избежать протечки растворителя, открутить прозрачный колпачок со шприца А (рис. 5).
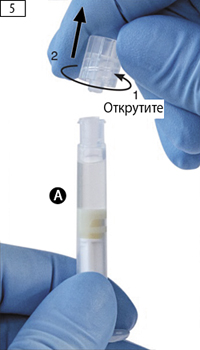
Шаг 6. Соединить два шприца вместе, шприц А снизу, и вкрутить шприц Б в шприц А по часовой стрелке до полной фиксации (рисунки 6а, 6b).
Не следует закручивать шприцы слишком плотно.
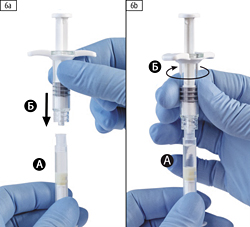
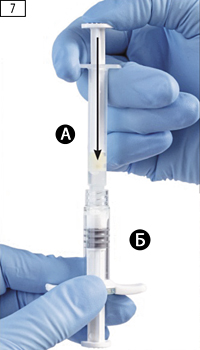
Шаг 7. Перевернуть соединенные шприцы так, чтобы шприц Б оказался снизу, и нажать на поршень шприца А до момента полного ввода содержимого шприца А (растворитель) в шприц Б (содержащий порошок лейпрорелина ацетата), шприцы следует держать вертикально (рис. 7).
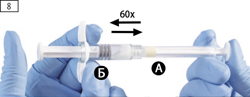
Шаг 8. Держа шприцы в строго горизонтальном положении, тщательно перемешать содержимое обоих шприцев,
поочередно нажимая осторожным движением на поршень то одного, то другого шприца (приблизительно 60 раз, что занимает около 60 секунд), для получения однородного вязкого раствора (рис. 8).
Следует избегать перегиба системы (это может стать причиной протечки, поскольку шприцы могут быть недостаточно плотно закручены).
После тщательного перемешивания получается вязкий раствор от бесцветного до светло-коричневого цвета (могут наблюдаться оттенки белого или светло-желтого цвета).
Важно: необходимо использовать раствор сразу после приготовления, поскольку его вязкость со временем увеличивается. Замораживать готовый продукт запрещено.
Следует помнить о том, что препарат нужно смешивать так, как описано в инструкции; встряхивание не обеспечит надлежащего перемешивания.
Шаг 9. Держать шприцы вертикально, шприц Б — снизу. Шприцы должны быть надежно закреплены. Нажимая на поршень шприца А, и слегка оттягивая вниз поршень шприца Б, переместить все содержимое в шприц Б (рис. 9).
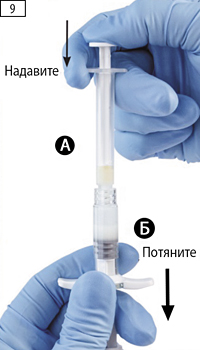
Шаг 10. Открутить шприц А, продолжая нажимать на поршень шприца А (рис. 10). Необходимо убедиться, что содержимое не вытекает из шприца, т.к. не удастся закрепить иглу надлежащим образом в случае утечки.
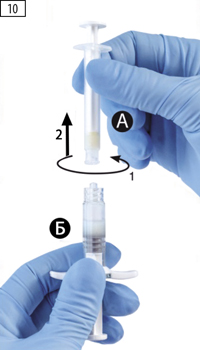
Внимание: в растворе могут присутствовать один большой или несколько маленьких пузырьков воздуха, это допустимо.
Не следует пытаться удалять пузырьки из шприца Б на этом этапе, поскольку это может привести к потере препарата.
Шаг 11
- Держать шприц Б вертикально и оттянуть поршень белого цвета, чтобы не допустить потери препарата.
- Открыть упаковку со стерильной иглой, сняв бумажный клапан, и извлечь безопасную иглу. Не следует удалять откидное защитное устройство.
- Прикрепить безопасную иглу к шприцу Б, удерживая шприц и осторожно закручивая иглу по часовой стрелке приблизительно на три четверти оборота до закрепления иглы (рис. 11).
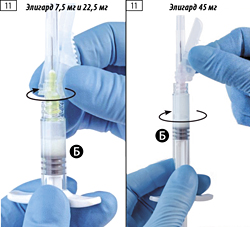
Важно: не перетягивать иглу слишком сильно, так как может треснуть разъем иглы, что приведет к утечке препарата во время инъекции.
В случае если разъем иглы треснул, имеет внешние признаки повреждения или если произошла утечка, препарат не следует использовать. Замена поврежденной иглы на аналогичную недопустима, препарат вводить не следует. Весь препарат следует безопасно утилизировать.
В случае повреждения разъема иглы следует использовать новую дополнительную упаковку препарата.
Шаг 12. Переместить защитное устройство в направлении от иглы и перед введением препарата снять защитный колпачок с иглы (рис. 12).
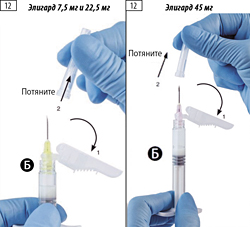
Важно: не следует приводить в действие защитное устройство иглы до введения препарата.
Шаг 13. До начала введения удалить большие пузырьки воздуха из шприца Б. Ввести препарат подкожно, параллельно удерживая защитное устройство на расстоянии от иглы. Необходимо убедиться в том, что введен весь препарат из шприца Б.
Шаг 14. После инъекции необходимо незамедлительно активировать защитное устройство иглы любым из двух способов, описанных ниже.
1 способ. Закрытие на плоской поверхности
Положить шприц с иглой на плоскую поверхность вниз рычагом защитного устройства и нажатием на рычаг активировать защитный механизм (рис. 14.1а).
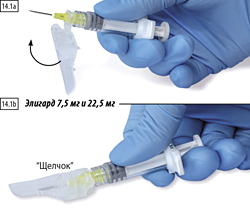
Необходимо убедиться, что рычаг переведен в закрытое положение и кончик иглы полностью закрыт (до характерного щелчка) (рис. 14.1b).
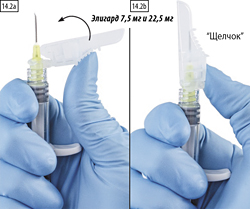
2 способ. Закрытие большим пальцем
Поместить большой палец на защитное устройство (рис. 14.2а), накрыть наконечник иглы и активировать защитный механизм. Необходимо убедиться, что рычаг переведен в закрытое положение и кончик иглы полностью закрыт (до характерного щелчка) (рис. 14.2b).
Шаг 15. После закрытия защитного механизма немедленно поместить иглу и шприц в соответствующий контейнер для острых предметов.
Побочное действие
Нежелательные явления, вызванные приемом препарата Элигард, обусловлены главным образом специфическим фармакологическим действием лейпрорелина, вызывающим увеличение и снижение концентрации гормонов. Самыми распространенными побочными эффектами являлись: «приливы», недомогание, тошнота и слабость, раздражение в месте введения препарата. Слабые или умеренно выраженные «приливы» наблюдались у приблизительно 58% пациентов.
Следующие нежелательные явления были зафиксированы во время проведения клинических исследований препарата Элигард у пациентов с распространенным раком предстательной железы. Частота побочных реакций, приведенных ниже, изложена в соответствии со следующей градацией: очень часто (>1/10), часто (>1/100, <1/10); нечасто (>1/1000, <1/100); редко (>1/10 000, <1/1000); очень редко (<1/10000), неизвестно (невозможно оценить на основании имеющихся данных).
Инфекционные и паразитарные заболевания: часто — назофарингит; нечасто — инфекция мочевыводящих путей, ограниченная инфекция кожных покровов.
Со стороны обмена веществ и питания: нечасто — ухудшение течения сахарного диабета.
Психические нарушения: нечасто — необычные сновидения, депрессия, снижение либидо.
Со стороны нервной системы: нечасто — головокружение, головная боль, гипестезия, бессонница, нарушение вкусовых ощущений, нарушение обоняния, вертиго; редко — непроизвольные патологические движения.
Со стороны сердца: неизвестно — удлинение интервала QT.
Со стороны сосудистой системы: очень часто — «приливы»; нечасто — повышение АД, снижение АД; редко — обморок, коллапс.
Со стороны дыхательной системы, органов грудной клетки и средостения: нечасто — ринорея, диспноэ; неизвестно — интерстициальное заболевание легких.
Со стороны желудочно-кишечного тракта: часто — тошнота, диарея, гастроэнтерит, колит; нечасто — запор, сухость во рту, диспепсия, рвота; редко — метеоризм, отрыжка.
Со стороны кожи и подкожной клетчатки: очень часто — экхимозы, эритема; часто — зуд, ночная потливость; нечасто — холодный пот, повышенное потоотделение; редко — алопеция, кожный зуд.
Со стороны скелетно-мышечной и соединительной ткани: часто — артралгия, боль в конечностях, миалгия, дрожь, слабость; нечасто — боль в спине, мышечные судороги.
Со стороны почек и мочевыводящих путей: часто — нарушение мочеиспускания, затрудненное мочеиспускание, дизурия, никтурия, олигурия; нечасто — спазм мочевого пузыря, гематурия, увеличение частоты мочеиспускания, задержка мочеиспускания.
Со стороны половых органов и молочной железы: часто — болезненность грудных желез, боль в яичках, атрофия яичек, гипертрофия грудных желез, бесплодие, эректильная дисфункция, уменьшение размеров полового члена; нечасто — гинекомастия, импотенция, тестикулярные нарушения; редко — боль в грудной железе.
Общие расстройства и нарушения в месте введения: очень часто — повышенная утомляемость, жжение в месте введения, парестезия в месте введения; часто — недомогание, боль в месте введения, кровоподтек, жжение (ощущение покалывания в месте инъекции); нечасто — зуд в месте введения, уплотнение в месте введения, заторможенность, болевые ощущения, пирексия; редко — образование язвы в месте введения; очень редко — некроз в месте введения.
Со стороны крови и лимфатической системы: часто — гематологические изменения, анемия.
Со стороны показателей лабораторных и инструментальных исследований: часто — повышение активности КФК, увеличение времени коагуляции; нечасто — повышение активности АЛТ, гипертриглицеридемия, увеличение протромбинового времени, увеличение массы тела.
К другим нежелательным явлениям при приеме лейпрорелина ацетата относятся: периферические отеки, эмболия легочной артерии, ощущение сердцебиения, миалгия, мышечная слабость, нарушение кожной чувствительности, озноб, головокружение, кожная сыпь, амнезия и нарушение зрения. При продолжительном применении препаратов данного класса отмечали атрофию мышц. Редко поступали сообщения о случаях возникновения инфаркта, вызванного гипофизарной апоплексией после приема антагонистов ГнРГ краткосрочного и длительного действия. Также были зафиксированы случаи возникновения тромбоцитопении и лейкопении, изменения толерантности к глюкозе.
После введения аналога агониста ГнРГ редко были описаны случаи возникновения судорог.
После введения агониста ГнРГ редко были описаны случаи развития анафилактических/анафилактоидных реакций.
Местные реакции после введения препарата Элигард такие же, как и при п/к введении других препаратов. В целом, местные реакции после введения препарата носят умеренный характер и являются краткосрочными.
Изменение плотности костной ткани
В публикациях отмечалось уменьшение плотности костей у мужчин после орхиэктомии или терапии аналогами ГнРГ. Можно предположить, что долгосрочная терапия лейпрорелином приводит к усилению симптомов остеопороза, что повышает риск переломов.
Усиление симптомов и признаков заболевания
Терапия лейпрорелина ацетатом может привести к усилению симптомов заболевания в течение первых недель лечения. В случае заболеваний с метастазами в позвоночник и/или обструкцией мочевых путей или гематурией возможно возникновение таких неврологических осложнений, как слабость и/или парестезия нижних конечностей или ухудшение симптомов нарушения мочеиспускания.
Противопоказания к применению
- повышенная чувствительность к лейпрорелину, другим агонистам ГнРГ или к любому вспомогательному веществу, входящему в состав лекарственной формы;
- хирургическая кастрация;
- в качестве единственного лечения у пациентов с раком предстательной железы со сдавлением спинного мозга или наличием метастазов в позвоночник.
Противопоказан женщинам и детям.
Применение при беременности и кормлении грудью
Препарат противопоказан женщинам.
Применение при нарушениях функции печени
Клинических данных по применению Элигарда у больных с печеночной недостаточностью нет.
Применение при нарушениях функции почек
Клинических данных по применению Элигарда у больных с почечной недостаточностью нет.
Применение у детей
Препарат противопоказан детям.
Особые указания
При неправильном приготовлении раствора для п/к введения могут наблюдаться случаи отсутствия клинической эффективности.
Элигард должен применяться под наблюдением врача, имеющего опыт проведения противоопухолевой терапии.
Ответ на терапию препаратом Элигард необходимо контролировать по клиническим параметрам и измерению концентрации ПСА в сыворотке крови. Результаты клинических исследований показали, что концентрация тестостерона увеличивается в первые 3 дня лечения у большинства пациентов без орхиэктомии, а затем снижается до уровня медикаментозной кастрации в течение 3-4 недель. Впоследствии данные показатели остаются неизменными при продолжении терапии лекарственным препаратом. В случае, если ответ пациента на терапию является недостаточным, необходимо убедиться, что концентрация тестостерона в сыворотке крови достигла или остается на кастрационном уровне.
Андрогенная депривационная терапия может удлинять интервал QT. Перед назначением препарата Элигард следует оценивать соотношение пользы и риска (включая возникновение желудочковой тахикардии типа «пируэт») у пациентов с указаниями в анамнезе или факторами риска удлинения интервала QT, принимающих препараты, которые могут удлинять интервал QT.
Заболевания сердечно-сосудистой системы
Сообщалось о повышенном риске развития инфаркта миокарда, внезапной сердечной смерти и инсульта при приеме мужчинами препаратов-агонистов ГнРГ. Такой риск не подкреплен достаточным количеством результатов в пределах обобщенного соотношения показателей, поэтому его следует внимательно оценивать вместе с риском развития сердечно-сосудистых заболеваний при принятии решения о выборе метода лечения для пациентов, страдающих раком простаты. Пациенты, принимающие препараты-агонисты ГнРГ, должны проходить обследование на предмет появления симптомов и признаков, свидетельствующих о развитии сердечно-сосудистых заболеваний, а также проходить лечение, основанное на современных принципах клинической практики.
Временное повышение содержания тестостерона
Элигард, как и другие препараты-агонисты ГнРГ, в течение первой недели лечения вызывает кратковременное повышение концентрации тестостерона, дигидротестостерона и кислой фосфатазы в сыворотке крови, в связи с чем у пациентов могут усилиться симптомы или возникнуть новые, такие как боль в костях, неврологические расстройства, гематурия, обструкция мочеточника или инфравезикальная обструкция. Эти симптомы обычно проходят при продолжении терапии.
Дополнительное применение соответствующего антиандрогена за 3 дня до начала терапии препаратом Элигард и продолжение его приема в течение первых 2 или 3 недель лечения предупреждает последствия первоначального повышения концентрации тестостерона.
После выполнения кастрации хирургическим путем применение препарата Элигард не приводит к дальнейшему снижению тестостерона в сыворотке крови.
Изменения плотности костей
В публикациях отмечалось уменьшение плотности костей у мужчин после орхиэктомии или терапии агонистом ГнРГ.
Антиандрогенная терапия значительно повышает риск переломов костей в результате возникновения остеопороза. Информация по данному вопросу в настоящее время ограничена. Переломы, связанные с развитием остеопороза, отмечались у 5% пациентов, получавших антиандрогенную терапию на протяжении 22 месяцев, а также у 4% больных при продолжительности лечения от 5 до 10 лет. В целом, риск переломов костей в результате возникновения остеопороза выше такового для патологических переломов. Помимо продолжительного дефицита тестостерона на развитие остеопороза может влиять преклонный возраст, курение, потребление алкоголя, лишний вес и недостаточные физические нагрузки.
Гипофизарная апоплексия
В течение пострегистрационного периода применения препарата, поступали сообщения о случаях возникновения гипофизарной апоплексии (редко) (клинический синдром, возникающий после инфаркта гипофиза), у большинства пациентов симптомы проявлялись после приема препаратов-агонистов ГнРГ через 2 недели после приема первой дозы, у некоторых — в течение первого часа. В данном случае, гипофизарная апоплексия проявляется в виде таких симптомов как головная боль, рвота, нарушение зрения, офтальмоплегия, изменение психического состояния и сердечно-сосудистой недостаточности, и требует немедленного оказания медицинской помощи.
Гипергликемия и сахарный диабет
Гипергликемия и повышенный риск развития сахарного диабета отмечались у мужчин, принимавших препараты-агонисты ГнРГ. Гипергликемия может свидетельствовать о развитии сахарного диабета или ухудшении гликемического контроля у пациентов с сахарным диабетом. Следует периодически производить мониторинг концентрации глюкозы в крови и/или гликированного гемоглобина (HbA1c) у пациентов, принимающих препараты-агонисты ГнРГ, а также осуществлять подбор необходимых современных методов лечения гипергликемии или сахарного диабета.
Судороги
В течение пострегистрационного периода поступали сообщения о возникновении судорог у пациентов, получавших лечение лейпрорелина ацетатом при наличии или в отсутствие в анамнезе предрасполагающих факторов. При судорогах следует проводить лечение, основанное на современных клинических рекомендациях.
Другие явления
При применении агонистов ГнРГ сообщалось также о случаях возникновения обструкции мочевыводящих путей и компрессии спинного мозга, что может привести к параличу как с развитием фатальных осложнений, так и без них. В случае компрессии спинного мозга или развитии нарушения функции почек следует прибегнуть к стандартной терапии этих осложнений.
За пациентами с метастазами в позвоночник и/или головной мозг, а также за пациентами с обструкцией мочевыводящих путей следует вести тщательное наблюдение в течение нескольких первых недель лечения.
Влияние на способность к управлению транспортными средствами и механизмами
Некоторые побочные реакции препарата, такие как повышенная усталость, головокружение, нарушения зрения, могут отрицательно влиять на способность к управлению автомобилем и выполнению потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Данных относительно передозировки не имеется. В случае передозировки больному следует проводить симптоматическое лечение.
Лекарственное взаимодействие
Исследований по изучению фармакокинетического взаимодействия препарата Элигард с другими препаратами не проводилось. О взаимодействии препарата Элигард с другими лекарственными препаратами не сообщалось.
В связи с тем, что андрогенная депривация может удлинять интервал QT, следует тщательно взвесить одновременное применение препарата Элигард с другими препаратами, удлиняющими интервал QT, или препаратами, способными вызывать желудочковую тахикардию типа «пируэт», такими как антиаритмические препараты класса IА (например, хинидин, дизопирамид) или класса III (например, амиодарон, соталол, дофетилид, ибутилид), метадон, моксифлоксацин, нейролептики и т.д.
Условия хранения препарата Элигард
Препарат следует хранить в оригинальной упаковке в недоступном для детей месте при температуре от 2° до 8°С.
Срок годности препарата Элигард
Срок годности — 2 года. Не использовать препарат по истечении срока годности.
Готовый раствор стабилен химически и физически в течение 30 минут при температуре 25°С.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
РУСФИК ООО, ГРУППА КОМПАНИЙ RECORDATI
(Россия)

|
|
РУСФИК ООО, 123610 Москва, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Введение препарата Элигард должно осуществляться под руководством медицинского работника, имеющего соответствующий опыт для оценки эффекта лечения.
Элигард назначают в виде подкожной инъекции один раз в месяц при дозировке 7,5 мг, один раз в три месяца при дозировке 22,5 мг и один раз в шесть месяцев при дозировке 45 мг. Введенный раствор образует депо препарата, обеспечивающее постоянное высвобождение лейпрорелина в течение указанного периода.
Как правило, терапия распространённого рака предстательной железы с использованием Элигарда предусматривает длительное лечение и не должна прекращаться при наступлении улучшения или ремиссии.
Препарат Элигард можно использовать в качестве неоадъювантной или адъювантной терапии в сочетании с лучевой терапией у пациентов с локализованным раком высокого риска и местно-распространённым раком простаты.
Реакцию на лечение препаратом следует контролировать путем наблюдения за клиническими проявлениями болезни и измерения уровня простатспецифического антигена (ПСА) в сыворотке крови. В клинических исследованиях показано, что в большинстве случаев у пациентов без орхидэктомии уровень тестостерона повышается в течение первых трех дней лечения и затем снижается в течение 3-4 недель ниже уровней медицинской кастрации. Кастрационный уровень тестостерона поддерживается при длительном применении лекарственного средства (достигается уровня тестостерона <1%). Если ответ пациента на лечение недостаточный, желательно проверить, достиг ли уровень тестостерона кастрационного уровня или продолжает находиться на нем.
Отсутствие клинической эффективности может наблюдаться при неправильном приготовлении, восстановлении и введении препарата; в случае предполагаемой или известной ошибки необходимо оценить уровни тестостерона.
У пациентов с метастатическим кастрационно-резистентным раком предстательной железы, не подвергавшихся хирургической кастрации и получающих агонисты ГнРГ, такие как лейпрорелин, лечение агонистами ГнРГ может быть продолжено на фоне применения ингибиторов биосинтеза андрогенов или ингибиторов андрогенных рецепторов.
Педиатрическая популяция
Безопасность и эффективность у детей в возрасте до 18 лет не установлена.
Коррекция доз для особых популяций пациентов
Клинических данных по применению Элигарда у больных с печёночной или почечной недостаточностью нет.
Рекомендации по приготовлению раствора для введения
Важно: При неправильном приготовлении раствора для подкожного введения могут наблюдаться случаи отсутствия клинической эффективности. Перед использованием продукт достают из холодильника и в течение 30 минут выдерживают при комнатной температуре. Сперва подготовьте пациента к введению препарата, а затем приступите к приготовлению раствора в соответствии с ниже представленными рекомендациями.
Важно:
Следующие шаги касаются только дозировок 7,5 мг и 22,5 мг! Шаги для дозировки 45 мг представлены ниже в отдельном разделе.
Шаг 1. Откройте внешнюю упаковку (оторвите фольгу от уголка, место отрыва обозначено) и извлеките содержимое упаковки А (рисунок 1.1) и упаковки Б (рисунок 1.2), положите на стерильную поверхность. Выбросьте пакетики с влагопоглотителем.
Шаг 2. Выньте из шприца Б (не выкручивать) короткий поршень синего цвета со вторым ограничителем серого цвета (рисунок 2).
Не смешивайте продукт с двумя ограничителями внутри шприца.
Шаг 3. Аккуратно выньте белый поршень из упаковки со шприцем А и вставьте его в ограничитель серого цвета шприца Б (рисунок 3).
Шаг 4. Снимите серый резиновый колпачок со шприца Б и отложите шприц (рисунок 4).
Шаг 5. Держите шприц А вертикально, чтобы избежать протечки, а затем открутите прозрачный колпачок со шприца А (рисунок 5).
Шаг 6. Соедините два шприца вместе, надавливая и вкручивая шприц Б в шприц А до полной фиксации (рисунки 6а, 6b). Не закручивайте шприцы слишком плотно.
Шаг 7. Переверните соединённые шприцы и держите шприцы вертикально (шприц Б снизу) до момента полного ввода содержимого лейпрорелина ацетата из шприца А в шприц Б (рисунок 7).
Шаг 8. Тщательно перемешайте содержимое обоих шприцев, держа их в горизонтальном положении и поочередно осторожным движением нажимая на поршень то одного то другого шприца (приблизительно 60 раз, что занимает около 60 секунд), для получения однородного раствора (рисунок 8). Не наклонять шприцы (следует обратить внимание, что это может привести к вытеканию жидкости, поскольку шприцы могут частично открутиться).
После тщательного смешивания вязкий раствор приобретёт цвет от светло-жёлтого до светло-жёлтого с коричневым оттенком (для дозировки7,5 мг) или от бесцветной до светло-жёлтого цвета (для дозировки 22,5 мг).
Важно: Необходимо использовать раствор сразу после приготовления, поскольку его вязкость со временем увеличивается. Замораживать готовый продукт запрещено.
Помните: Продукт нужно смешивать так, как описано в инструкции; встряхивание не обеспечит надлежащего перемешивания.
Шаг 9. Держите шприцы вертикально, шприц Б — снизу. Шприцы должны быть четко закреплены. Нажимая на поршень шприца А, и слегка подтягивая поршень шприца Б, переместите все содержимое в шприц Б (рисунок 9).
Шаг 10. Открутите шприц А, продолжая нажимать на поршень шприца (рисунок 10). Убедитесь, что содержимое не вытекает из шприца, поскольку в данном случае вы не сможете закрепить иглу надлежащим образом.
Помните: наличие маленьких пузырьков воздуха допустимо. Пожалуйста, не пытайтесь удалять пузырьки из шприца Б на этом этапе, поскольку это может привести к потере продукта.
Шаг 11.
•Держите шприц Б вертикально и удерживайте белый поршень во избежание потери препарата
•Откройте упаковку со стерильной иглой (отогнув бумажную этикетку) и извлеките иглу. •Присоедините безопасную иглу к шприцу Б, удерживая шприц и аккуратно поворачивая иглу по часовой стрелке приблизительно на три четверти оборота до полной фиксации (рис. 11).
Не перекручивайте иглу, поскольку это может привести к образованию трещин на переходнике иглы и последующей утечке препарата во время инъекции.
Если переходник иглы сломан, имеет видимые повреждения или протекает, препарат использовать не следует.
Замена повреждённой иглы, а также инъекционное введение препарата недопустимы. Весь препарат необходимо утилизировать с соблюдением мер безопасности.
В случае повреждения переходника иглы необходимо использовать новый препарат.
Шаг 12. Перед инъекцией снимите защитный колпачок с иглы (рисунок 12).
Важно: не используйте иглу до установки на шприц.
Шаг 13. До начала введения удалите большие пузырьки воздуха из шприца Б. Вводите препарат подкожно. Пожалуйста, убедитесь в том, что введен весь препарат из шприца Б.
Шаг 14. После инъекции, закройте защитную крышку в соответствии с рекомендациями, представленными ниже.
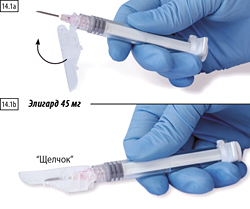
1. Закрытие на плоской поверхности
Нажмите на защитную крышку, рычаг опустите вниз, на плоской поверхности (рисунки 14.1а, b), чтобы закрыть иглу и крышку.
Проверьте плотность закрытия (до характерного щелчка). Кончик иглы будет полностью закрыт (рисунок 14.1b).
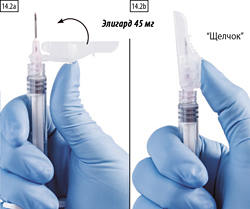
2. Закрытие большим пальцем.
Поместите большой палец на рычаг, слегка нагните его по направлению к кончику иглы (рисунки 14.2а, b), чтобы закрыть иглу и защитную крышку.
Проверьте плотность закрытия (до характерного щелчка). Кончик иглы будет полностью закрыт (рисунок 14.2b).
Шаг 15. Как только вы закрыли защитную крышку, немедленно выбросьте иглу и шприц в соответствующий контейнер для острых предметов.
Важно:
Следующие шаги касаются только дозировки 45 мг!
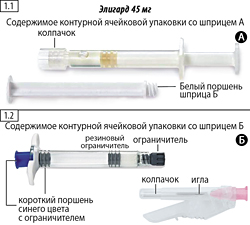
Шаг 1. Откройте внешнюю упаковку (оторвите фольгу от уголка, место отрыва обозначено) и извлеките содержимое упаковки А (рисунок 1.1) и упаковки Б (рисунок 1.2), положите на стерильную поверхность. Выбросьте пакетики с влагопоглотителем.
Шаг 2. Выньте из шприца Б (не выкручивать) короткий поршень синего цвета со вторым ограничителем серого цвета (рисунок 2).
Не смешивайте продукт с двумя ограничителями внутри шприца.
Шаг 3. Аккуратно выньте белый поршень из упаковки со шприцем А и вставьте его в ограничитель серого цвета шприца Б (рисунок 3).
Шаг 4. Снимите серый резиновый колпачок со шприца Б и отложите шприц (рисунок 4).
Шаг 5. Держите шприц А вертикально, чтобы избежать протечки, а затем открутите прозрачный колпачок со шприца А (рисунок 5)
Шаг 6. Соедините два шприца вместе, надавливая и вкручивая шприц Б в шприц А до полной фиксации (рисунки 6а, 6Ь). Не закручивайте шприцы слишком плотно.
Шаг 7. Переверните соединённые шприцы и держите шприцы вертикально (шприц Б снизу) до момента полного ввода содержимого лейпрорелина ацетата из шприца А в шприц Б (рисунок 7).
Шаг 8. Тщательно перемешайте содержимое обоих шприцев, держа их в горизонтальном положении и поочередно осторожным движением нажимая на поршень то одного то другого шприца (приблизительно 60 раз, что занимает около 60 секунд), для получения однородного раствора (рисунок 8). Не наклонять шприцы (следует обратить внимание, что это может стать причиной протечки, поскольку шприцы могут частично открутиться).
После тщательного смешивания вязкий раствор приобретёт цвет от бесцветной до светло-жёлтого цвета.
Важно: Необходимо использовать раствор сразу после приготовления, поскольку его вязкость со временем увеличивается. Замораживать Готовый продукт запрещено.
Помните: Продукт нужно смешивать так, как описано в инструкции; встряхивание не обеспечит надлежащего перемешивания.
Шаг 9. Держите шприцы вертикально, шприц Б — снизу. Шприцы должны быть четко закреплены. Нажимая на поршень шприца А, и слегка подтягивая поршень шприца Б, переместите все содержимое в шприц Б (рисунок 9).
Шаг 10. Открутите шприц А, продолжая нажимать на поршень шприца (рисунок 10). Убедитесь, что содержимое не вытекает из шприца, поскольку вы не сможете закрепить иглу надлежащим образом в случае вытекания.
Помните: наличие маленьких пузырьков воздуха допустимо. Не пытайтесь удалять пузырьки из шприца Б на этом этапе, поскольку это может привести к потере продукта.
Шаг 11.
Держите шприц Б вертикально и удерживайте белый поршень во избежание потери препарата
Откройте упаковку со стерильной иглой (отогнув бумажную этикетку) и извлеките иглу.
•Присоедините безопасную иглу к шприцу Б, удерживая шприц и аккуратно поворачивая иглу по часовой стрелке приблизительно на три четверти оборота до полной фиксации (рис. 11).
Не перекручивайте иглу, поскольку это может привести к образованию трещин на переходнике иглы и последующей утечке препарата во время инъекции.
Если переходник иглы сломан, имеет видимые повреждения или протекает, препарат использовать не следует.
Замена повреждённой иглы, а также инъекционное введение препарата недопустимы. Весь препарат необходимо утилизировать с соблюдением мер безопасности.
В случае повреждения переходника иглы необходимо использовать новый препарат.
Шаг 12. Перед инъекцией снимите защитный колпачок с иглы (рисунок 12).
Важно: не используйте иглу до установки на шприц.
Шаг 13. До начала введения удалите большие пузырьки воздуха из шприца Б. Вводите препарат подкожно. Убедитесь в том, что введен весь препарат из шприца Б.
Шаг 14. После инъекции, закройте защитную крышку в соответствии с рекомендациями, представленными ниже.
1. Закрытие на плоской поверхности
Нажмите на защитную крышку, рычаг опустите вниз, на плоской поверхности (рисунки 14.1а, b), чтобы закрыть иглу и крышку.
Проверьте плотность закрытия (до характерного щелчка). Кончик иглы будет полностью закрыт (рисунок 14.1b).
2. Закрытие большим пальцем.
Поместите большой палец на рычаг, слегка нагните его по направлению к кончику иглы (рисунки 14.2а, b), чтобы закрыть иглу и защитную крышку.
Проверьте плотность закрытия (до характерного щелчка). Кончик иглы будет полностью закрыт (рисунок 14.2b).
Шаг 15. Как только вы закрыли защитную крышку, немедленно выбросьте иглу и шприц в соответствующий контейнер для острых предметов.
Информация для работников здравоохранения
Если раствор был приготовлен неправильно, его не следует вводить, поскольку в связи с неправильным приготовлением раствора может наблюдаться отсутствие клинической эффективности.
Состав
1 шприц А содержит:
активное вещество: нет
вспомогательные вещества: растворитель, состоящий из: Сополимер поли-D,L-лактид-ко-гликолид: ПЛГ (85:15) 217 мг, N-метил-2-пирролидон 217 мг.
1 шприц Б содержит:
активное вещество: лейпрорелина ацетат* 59,2 мг.
вспомогательные вещества: нет
*Избыток лейпрорелина ацетата компенсирует потери в шприце и игле.
Восстановленный раствор (вводимая доза) содержит 45 мг лейпрорелина ацетата.
Фармакокинетика
После первой инъекции через 4-8 часов средний уровень концентрации лейпрорелина (Сmах), определяемой в сыворотке крови, повышается до 25,3 нг/дл, 127 нг/дл и 82 нг/дл при применении лейпрорелина в дозе 7,5 мг, 22,5 мг и 45 мг соответственно.
После первоначального повышения (фаза плато составляет от 2 до 28 дней для дозировки 7,5 мг; от 3 до 84 дней для дозировки 22,5 мг, от 3 до 168 дней для дозировки 45 мг) концентрация лейпрорелина в сыворотке оставался относительно стабильным: 0,28-1,67 нг/мл для дозировки 7,5 мг и 0,2-2 нг/мл для дозировок 22,5 и 45 мг. Данные о накоплении вещества при повторных инъекциях отсутствуют.
Средний объем распределения в равновесном состоянии после внутривенного однократного введения лейпрорелина здоровым добровольцам мужчинам составлял 27 литров. По данным исследований in vitro связь с белками плазмы составляет от 43% до 49%.
При введении 1 мг лейпрорелина ацетата внутривенно здоровым добровольцам мужчинам выяснилось, что при применении двухкамерной модели средний клиренс составил 8,34 л/ч с конечным периодом полувыведения приблизительно 3 часа.
Исследований по выведению препарата Элигард не проводилось.
Исследований по лекарственному метаболизму препарата Элигард не проводилось.
Показания к применению
Гормонозависимый рак предстательной железы.
Противопоказания
-
Повышенная чувствительность к лейпрорелину, другим агонистам ГнРГ или к любому вспомогательному веществу, входящему в состав лекарственной формы.
-
Хирургическая кастрация.
-
Противопоказан женщинам и детям.
-
В качестве единственного лечения у пациентов с раком предстательной железы со сдавлением спинного мозга или наличием метастазов в позвоночник.
Способ применения и дозы
Элигард должен применяться только под контролем специалиста здравоохранения, имеющего достаточный опыт для оценки эффекта лечения.
Элигард назначают в виде подкожной инъекции один раз в месяц при дозировке 7,5 мг, один раз в три месяца при дозировке 22,5 мг и один раз в шесть месяцев при дозировке 45 мг. Содержимое двух заранее наполненных стерильных шприцев должно быть смешано непосредственно перед подкожным введением препарата Элигард. Введенный раствор образует депо препарата, обеспечивающее постоянное высвобождение лейпрорелина в течение указанного периода. Как правило, терапия распространенного рака предстательной железы с использованием Элигарда предусматривает длительное лечение и не должна прекращаться при наступлении улучшения или ремиссии. Элигард может использоваться в качестве неоадъювантной или адъювантной терапии в сочетании с лучевой терапией у пациентов с локализованным раком высокого риска и местно-распространенным раком простаты.
Место инъекции следует периодически менять. Избегать попадания препарата в артерию или вену.
Ответ на терапию препаратом ЭЛИГАРД необходимо контролировать но клиническим параметрам и измерению концентрации простат-специфического антигена (ПСА) в сыворотке крови. Результаты клинических исследований показали, что концентрация тестостерона увеличивалась в течение первых 3 дней лечения у большинства пациентов, не подвергавшихся орхиэктомии, а затем снижалась до уровней ниже таковых при медикаментозной кастрации в течение 3-4 недель. После достижения данные показатели остаются неизменными при продолжении терапии лекарственным препаратом (<1,0% случаев прорывного повышения концентраций тестостерона). Если ответ пациента на терапию является недостаточным, необходимо убедиться, что концентрация тестостерона в сыворотке крови достигла или остается на кастрационном уровне. В случае предполагаемой или известной ошибки при смешивании у пациента должна быть определена концентрация тестостерона в связи с тем, что в результате неправильного приготовления, смешивания или введения препарата могут наблюдаться случаи отсутствия клинической эффективности.
У пациентов с метастатическим кастрационно-резистентным раком предстательной железы, не подвергавшихся хирургической кастрации и получающих агонисты ГнРГ, такие как лейпрорелин, лечение агонистами ГнРГ может быть продолжено на фоне применения ингибиторов биосинтеза андрогенов или ингибиторов андрогенных рецепторов.
Коррекция доз для особых популяций пациентов
Клинических данных по применению Элигарда у больных с печеночной или почечной недостаточностью нет.
В случае предполагаемой или известной ошибки при смешивании у пациента должна быть определена концентрация тестостерона в связи с тем, что в результате неправильного приготовления, смешивания или введения препарата могут наблюдаться случаи отсутствия клинической эффективности.
РЕКОМЕНДАЦИИ ПО ПРИГОТОВЛЕНИЮ РАСТВОРА ДЛЯ ВВЕДЕНИЯ
Если препарат был приготовлен с нарушением инструкций, он не должен использоваться в связи с тем, что при неправильном приготовлении раствора для подкожного введения могут наблюдаться случаи отсутствия клинической эффективности.
Сначала рекомендуется подготовить пациента к введению препарата, а затем приступить к приготовлению раствора в соответствии с рекомендациями, представленными ниже.
Упаковку достают из холодильника примерно за 30 минут до использования и выдерживают при комнатной температуре.
После извлечения из холодильника препарат может храниться в оригинальной упаковке при комнатной температуре (не выше 25 °С) до 4 недель.
Условия хранения
При температуре от 2 °С до 8 °С, в оригинальной упаковке.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не использовать препарат по истечении срока годности.
Готовый раствор стабилен химически и физически в течение 30 минут при температуре 25 °С.
Особые указания
При неправильном приготовлении раствора для подкожного введения могут наблюдаться случаи отсутствия клинической эффективности.
Элигард должен применяться под наблюдением врача, имеющего опыт применения противоопухолевой терапии.
Ответ на терапию препаратом Элигард необходимо контролировать по клиническим параметрам и измерению концентрации простат-специфического антигена (ПСА) в сыворотке крови. Результаты клинических исследований показали, что концентрация тестостерона увеличивается в первые 3 дня лечения у большинства пациентов без орхиэктомии, а затем снижается до уровня медикаментозной кастрации в течение 3-4 недель. Впоследствии данные показатели остаются неизменными при продолжении терапии лекарственным препаратом. В случае, если ответ пациента на терапию является недостаточным, необходимо убедиться, что концентрация тестостерона в сыворотке крови достигла или остается на кастрационном уровне.
Андрогенная депривационная терапия может удлинять интервал QТ. Перед назначением препарата Элигард врачи должны оценивать соотношение пользы и риска (включая возникновение желудочковой тахикардии типа «пируэт») у пациентов с анамнезом или факторами риска удлинения интервала QT, принимающих препараты, которые могут удлинять интервал QT.
Заболевания сердечно-сосудистой системы:
Сообщалось о повышенном риске развития инфаркта миокарда, внезапной сердечной смерти и инсульта при приеме мужчинами препаратов-агонистов ГнРГ. Такой риск не подкреплен достаточным количеством результатов в пределах обобщенного соотношения показателей, поэтому его следует внимательно оценивать вместе с риском развития сердечно-сосудистых заболеваний при принятии решения о выборе метода лечения для пациентов, страдающих раком простаты. Пациенты, принимающие препараты-агонисты ГнРГ, должны проходить обследование на предмет появления симптомов и признаков, свидетельствующих о развитии сердечно-сосудистых заболеваний, а также проходить лечение, основанное на современных принципах клинической практики.
Временное повышение содержания тестостерона:
Элигард, как и другие препараты-агонисты ГнРГ, в течение первой недели лечения вызывает кратковременное повышение концентрации тестостерона, дигидротестостерона и кислой фосфатазы в сыворотке крови, в связи с чем у пациентов могут усилиться симптомы или возникнуть новые, такие как боль в костях, неврологические расстройства, гематурия, обструкция мочеточника или инфравезикальная обструкция. Эти симптомы обычно проходят при продолжении терапии. Дополнительное применение соответствующего антиандрогена за три дня до начала терапии
Элигардом и продолжение его приема в течение первых двух или трех недель лечения предупреждает последствия первоначального повышения концентрации тестостерона.
После выполнения кастрации хирургическим путем применение Элигарда не приводит к дальнейшему снижению тестостерона в сыворотке крови.
Изменения плотности костей:
В публикациях отмечалось уменьшение плотности костей у мужчин после орхиэктомии или терапии агонистом ГнРГ.
Антиандрогенная терапия значительно повышает риск переломов костей в результате возникновения остеопороза. Информация по данному вопросу в настоящее время ограничена. Переломы, связанные с развитием остеопороза, отмечались у 5% пациентов, получавших антиандрогенную терапию на протяжении 22 месяцев, а также у 4% больных при продолжительности лечения от 5 до 10 лет. В целом, риск переломов костей в результате возникновения остеопороза выше такового для патологических переломов. Помимо продолжительного дефицита тестостерона на развитие остеопороза может влиять преклонный возраст, курение, потребление алкоголя, лишний вес и недостаточные физические нагрузки.
Гипофизарная апоплексия:
В течение пострегистрационного периода применения препарата, поступали сообщения о случаях возникновения гипофизарной апоплексии (редко) (клинический синдром, возникающий после инфаркта гипофиза), у большинства пациентов симптомы проявлялись после приема препаратов-агонистов ГнРГ через 2 недели после приема первой дозы, у некоторых — в течение первого часа. В данном случае гипофизарная апоплексия проявляется в виде таких симптомов как головная боль, рвота, нарушение зрения, офтальмоплегия, изменение психического состояния и сердечно-сосудистой недостаточности и требует немедленного оказания медицинской помощи.
Гипергликемия и сахарный диабет:
Гипергликемия и повышенный риск развития сахарного диабета отмечались у мужчин, принимавших препараты-агонисты ГнРГ. Гипергликемия может свидетельствовать о развитии сахарного диабета или ухудшении гликемического контроля у пациентов с сахарным диабетом. Следует периодически производить мониторинг концентрации глюкозы в крови и/или гликированного гемоглобина (HbA1c) у пациентов, принимающих препараты-агонисты ГнРГ, а также осуществлять подбор необходимых современных методов лечения гипергликемии или сахарного диабета.
Судороги:
В течение пострегистрационного периода поступали сообщения о возникновении судорог у пациентов, получавших лечение лейпрорелина ацетатом при наличии или в отсутствие в анамнезе предрасполагающих факторов. При судорогах следует проводить лечение, основанное на современных клинических рекомендациях.
Другие явления:
При применении агонистов ГнРГ сообщалось также о случаях возникновения обструкции мочевыводящих путей и компрессии спинного мозга, что может привести к параличу как с развитием осложнений со смертельным исходом, так и без них. В случае компрессии спинного мозга или развитии нарушения функции почек следует назначать стандартную терапию этих осложнений.
За пациентами с метастазами в позвоночнике и/или головном мозге, а также за пациентами с обструкцией мочевыводящих путей следует вести тщательное наблюдение в течение нескольких первых недель лечения.
Описание
Противоопухолевое средство — гонадотропин-рилизинг гормона аналог.
Фармакодинамика
Лейпрорелин является синтетическим непептидным аналогом естественного гонадотропин- рилизинг-гормона (ГнРГ), который при длительном применении ингибирует секрецию гипофизарного гонадотропина и подавляет тестикулярный стероидогенез у мужчин. Аналог обладает большей эффективностью, чем естественный гормон и его воздействие обратимо при прекращении лечения. Однако время восстановления концентрации тестостерона может варьировать среди пациентов.
Применение лейпрорелина сначала приводит к повышению концентрации циркулирующего лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ), в результате чего временно повышается концентрация гонадных стероидов, тестостерона и дигидротестостерона у мужчин. При продолжительном применении лейпрорелина содержание ЛГ и ФСГ снижается. У мужчин содержание тестостерона снижается до кастрационного уровня (< 50 нг/дл) в течение 3-5 недель после начала лечения. Среднее содержание тестостерона через 6 месяцев лечения составляет 6,1 (± 0,4) нг/дл для дозировки 7,5 мг; 10,1 (± 0,7) нг/дл для дозировки 22,5 мг и 10,4 (± 0,53) нг/дл для дозировки 45 мг. Эти значения сопоставимы с содержанием тестостерона после выполнения билатеральной орхиэктомии.
Все пациенты в клиническом исследовании Элигарда 7,5 мг достигли кастрационных уровней тестостерона на 6 неделе лечения; 94% пациентов — к 28 дню и 98% пациентов — к 35 дню. Все пациенты в клиническом исследовании Элигарда 22,5 мг достигли кастрационных концентраций тестостерона на 5 неделе; 99% пациентов — к 28 дню. Все пациенты (за исключением одного) в клиническом исследовании Элигарда 45 мг достигли кастрационных концентраций тестостерона на 4 неделе. У подавляющего большинства пациентов концентрации тестостерона уменьшались ниже 20 нг/дл, хотя полноценное преимущество данных низких концентраций тестостерона пока еще не было установлено.
Концентрации ПСА снизились на 94% через 6 месяцев лечения при использовании Элигарда 7,5 мг, на 98% — при использовании Элигарда 22,5 мг, на 97% — при использовании Элигарда 45 мг. Длительные исследования показали, что постоянная терапия поддерживает концентрацию тестостерона ниже касграционного уровня на протяжении до 7 лет и по всей видимости на неопределенный срок.
Побочные действия
Нежелательные явления, вызванные приемом препарата Элигард, обусловлены главным образом специфическим фармакологическим действием лейпрорелина, вызывающим увеличение и снижение концентрации гормонов. Самыми распространенными побочными эффектами являлись: «приливы», недомогание, тошнота и слабость, местное раздражение в месте введения препарата. Слабые или умеренные «приливы» наблюдались у приблизительно 58% пациентов.
Следующие нежелательные явления были зафиксированы во время проведения клинических исследований препарата Элигард у пациентов с распространенным раком предстательной железы: (частота побочных реакций, приведенных ниже, изложена в соответствии со следующей градацией: очень часто (≥1/10), часто (≥ 1/100, < 1/10); нечасто (≥ 1/1000, < 1/100); редко (≥1/10000, <1/1000); очень редко (< 1/10000), неизвестно (невозможно оценить на основании имеющихся данных)).
|
Инфекционные и паразитарные заболевания |
|
|
часто |
назофарингит |
|
нечасто |
инфекция мочевыводящих путей, ограниченная инфекция кожных покровов |
|
Нарушения со стороны обмена веществ и питания |
|
|
нечасто |
ухудшение течения сахарного диабета |
|
Нарушения психики |
|
|
нечасто |
необычные сновидения, депрессия, снижение либидо |
|
Нарушения со стороны нервной системы |
|
|
нечасто |
головокружение, головная боль, гипестезия, бессонница, нарушение вкусовых ощущений, нарушение обоняния, вертиго |
|
редко |
непроизвольные патологические движения |
|
Нарушения со стороны сердца |
|
|
неизвестно |
удлинение интервала QT |
|
Нарушения со стороны сосудистой системы |
|
|
очень часто |
«приливы» |
|
нечасто |
повышение артериального давления, снижение артериального давления |
|
редко |
обморок, коллапс |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
нечасто |
ринорея, диспноэ |
|
неизвестно |
интерстициальное заболевание легких |
|
Нарушения со стороны желудочно-кишечного тракта |
|
|
часто |
тошнота, диарея, гастроэнтерит/колит |
|
нечасто |
запор, сухость во рту, диспепсия, рвота |
|
редко |
метеоризм, отрыжка |
|
Нарушения со стороны кожи и подкожных тканей |
|
|
очень часто |
экхимозы, эритема |
|
часто |
зуд, ночная потливость |
|
нечасто |
холодный пот, повышенное потоотделение |
|
редко |
алопеция, кожная сыпь |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
|
|
часто |
артралгия, боль в конечностях, миалгия, дрожь, слабость |
|
нечасто |
боль в спине, мышечные судороги |
|
Нарушения со стороны почек и мочевыводящих путей |
|
|
часто |
нарушение мочеиспускания, затрудненное мочеиспускание, дизурия, никтурия, олигурия |
|
нечасто |
спазм мочевого пузыря, гематурия, увеличение частоты мочеиспускания, задержка мочеиспускания |
|
Нарушения со стороны половых органов и молочной железы |
|
|
часто |
болезненность грудных желез, боль в яичках, атрофия яичек, гипертрофия грудных желез, бесплодие, эректильная дисфункция, уменьшение размеров полового члена |
|
нечасто |
гинекомастия, импотенция, тестикулярные нарушения |
|
редко |
боль в грудной железе |
|
Общие расстройства и нарушения в месте введения |
|
|
очень часто |
повышенная утомляемость, жжение в месте введения, парестезия в месте введения |
|
часто |
недомогание, боль в месте введения, кровоподтек, жжение (ощущение покалывания в месте инъекции) |
|
нечасто |
зуд в месте введения, уплотнение в месте введения, заторможенность, болевые ощущения, пирексия |
|
редко |
образование язвы в месте введения |
|
очень редко |
некроз в месте введения |
|
Нарушения со стороны крови и лимфатической системы |
|
|
часто |
гематологические изменения, анемия |
|
Лабораторные и инструментальные данные |
|
|
часто |
повышение активности креатининфосфокиназы, увеличение времени свертываемости крови |
|
нечасто |
повышение активности аланинаминотрансферазы, гипертриглицеридемия, увеличение протромбинового времени, повышение массы тела |
К другим нежелательным явлениям при приеме лейпрорелина ацетата относятся: периферические отеки, эмболия легочной артерии, ощущение сердцебиения, миалгия, мышечная слабость, нарушение кожной чувствительности, озноб, головокружение, кожная сыпь, амнезия и нарушение зрения.
При продолжительном применении препаратов данного класса отмечали атрофию мышц.
Редко поступали сообщения о случаях возникновения инфаркта, вызванного гипофизарной апоплексией после приема антагонистов ГнРГ краткосрочного и длительного действия.
Также были зафиксированы случаи возникновения тромбоцитопении и лейкопении, изменения толерантности к глюкозе.
После введения аналога агониста ГнРГ редко были описаны случаи возникновения судорог.
После введения агониста ГнРГ редко были описаны случаи развития анафилактических/анафилактоидных реакций.
Местные реакции после введения препарата Элигард такие же, как и при подкожном введении других препаратов.
В целом, местные реакции после введения препарата носят умеренный характер и являются краткосрочными.
Изменения в плотности костей
В публикациях отмечалось уменьшение плотности костей у мужчин после орхиэктомии или терапии аналогами ГнРГ. Можно предположить, что долгосрочная терапия лейпрорелином приводит к усилению симптомов остеопороза, что повышает риск переломов.
Усиление симптомов и признаков заболевания
Терапия лейпрорелина ацетатом может привести к усилению симптомов заболевания в течение первых недель лечения. В случае заболеваний с метастазами в позвоночник и/или обструкцией мочевых путей или гематурией, возможно возникновение таких неврологических осложнений, как слабость и/или парестезия нижних конечностей или ухудшение симптомов нарушения мочеиспускания.
Взаимодействие
Исследований по изучению фармакокинетического взаимодействия препарата Элигард с другими препаратами не проводилось. О взаимодействии Элигарда с другими лекарственными препаратами не сообщалось.
В связи с тем, что андрогенная депривация может удлинять интервал QT, должно быть тщательно взвешено одновременное применение препарата Элигард с другими препаратами, удлиняющими интервал QT, или препаратами, способными вызывать желудочковую тахикардию типа «пируэт», такими как антиаритмические препараты класса IA (например, хинидин, дизопирамид) или класса III (например, амиодарон, соталол, дофетилид, ибутилид), метадон, моксифлоксацин, нейролептики и т.д.
Передозировка
Данных относительно передозировки у людей не имеется.
В случае передозировки больному следует назначить симптоматическое лечение.
Влияние на способность к вождению автотранспорта и управлению механизмами
Некоторые побочные действия препарата, такие как повышенная усталость, головокружение, нарушения зрения, могут отрицательно влиять на способность к управлению автомобилем и выполнению потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций.
Элигард® (45 мг)
МНН: Лейпрорелин
Производитель: Толмар Инк.
Анатомо-терапевтическо-химическая классификация: Leuprorelin
Номер регистрации в РК:
№ РК-ЛС-5№018819
Информация о регистрации в РК:
25.10.2017 — 25.10.2022
Информация о реестрах и регистрах
- Скачать инструкцию медикамента
Торговое название
Элигард®
Международное непатентованное название
Лейпрорелин
Лекарственная форма
Лиофилизат для приготовления раствора для подкожного введения 7,5 мг, 22,5 мг, 45 мг в комплекте с растворителем
Состав
1 шприц с препаратом (шприц Б) содержит, в миллиграммах
активное вещество: лейпрорелина ацетат 10.6* 29.2* 59.2*
(7.5) (22.5) (45)
1 шприц с растворителем (шприц А) содержит, в миллиграммах
Для Для Для
дозировки дозировки дозировки
7,5 мг 22,5 мг 45 мг
Сополимер поли-D,L-лактид-гликолид:
PLGH (50: 50) 117* — —
PLG (75: 25) — 206* —
PLG (85: 15) — — 217*
N-метил-2-пирролидон 226* 251* 217*
*Избыток веществ компенсирует потери в шприце и игле
Описание
Лиофилизат для приготовления раствора (шприц Б). Содержимое шприца: порошок от белого до почти белого цвета, без признаков оплавления.
Растворитель (шприц А). Вязкая прозрачная жидкость от светло-жёлтого до светло-жёлтого с коричневатым оттенком цвета (для дозировки 7.5 мг). Вязкая прозрачная жидкость от бесцветного до светло-жёлтого цвета (для дозировок 22.5 мг и 45 мг).
Приготовленный раствор. Вязкая прозрачная жидкость от светло-жёлтого до светло-жёлтого с коричневатым оттенком цвета (для дозировки 7.5 мг). Вязкая прозрачная жидкость от бесцветного до светло-жёлтого цвета (для дозировок 22.5 мг и 45 мг.
Фармакотерапевтическая группа
Противоопухолевые гормональные препараты. Гормоны и их производные. Гонадотропин – рилизинг гормона аналоги. Лейпрорелин.
Код АТХ L02AE02
Фармакологические свойства
Фармакокинетика
Абсорбция
После подкожного введения любой из форм депо Элигарда® отмечается первоначальная фаза подъема, которая характеризуется высокой концентрацией лейпрорелина в сыворотке крови. Она сменяется фазой плато, в ходе которой сывороточные концентрации лейпрорелина остаются относительно
постоянными в течение всего оставшегося временного промежутка между инъекциями. После повторного введения признаки кумуляции не выявлены: профиль Элигарда® в сыворотке крови одинаков как после первого, так и каждого последующего введения.
Фармакокинетические свойства Элигарда® у пациентов с прогрессирующим раком предстательной железы были изучены: для Элигарда® в дозе 22,5, 30 и 45 мг за два временных промежутка между введениями, для Элигарда® в дозе 7,5 мг – за три временных промежутка между введениями. Профиль лейпрорелина в сыворотке крови на фоне повторного введения Элигарда® пациентам с прогрессирующим раком предстательной железы через определенные временные интервалы соответствовал таковому для других существующих форм депо лейпрорелина. В редких случаях концентрация лейпрорелина в сыворотке крови в фазу плато оказывалась ниже порога чувствительности лабораторных тест-систем, что не влияло на подавление уровня тестостерона. Для каждой формы Элигарда® фармакокинетический профиль замедленного высвобождения действующего вещества соответствовал непрерывному подавлению уровня тестостерона почти у 100% пациентов в течение месячного, трёхмесячного, четырёхмесячного или шестимесячного интервала между введениями препарата.
Средняя концентрация лейпрорелина в сыворотке крови после первоначальной инъекции увеличилась до 25,3 нг/мл (Сmax) в среднем через 5 часов после введения. После первоначального повышения на фоне каждой инъекции сывороточные концентрации лейпрорелина оставались относительно стабильными (0,28-2,00 нг/мл).
Распределение
Средний равновесный объем распределения после внутривенного введения составляет 27 л. Связь с белками плазмы составляет 43 — 49 %.
Метаболизм
После внутривенного введения 1 мг лейпрорелина, системный клиренс
составляет 8,34 л/ч с периодом полувыведения приблизительно 3 часа. Исследования по метаболизму Элигарда® не проводились. Лейпрорелина ацетат подвергается метаболической деградации, главным образом до более коротких неактивных пептидов – пентапептида (метаболит I), трипептида (метаболиты II и III) и дипептида (метаболит IV). Концентрация основного метаболита М-1 достигает максимального уровня в течение 2-6 часов и составляет 6 % от максимального уровня лейпрорелина. Через неделю после инъекции средняя концентрация М- I в плазме составляет 20 % от средней концентрации лейпрорелина.
Выведение
Через 27 дней после назначения лейпрорелина ацетата 3,75 мг в моче определялось менее 5 % дозы родительского вещества и метаболита М- I.
Фармакокинетика у пациентов с почечной и печеночной недостаточностью не определялась.
Фармакодинамика
Лейпрорелин — активное вещество препарата Элигард® является синтетическим нонапептидным агонистом гонадотропин-рилизинг гормона (ГнРГ).
После первоначального введения лейпрорелина ацетат вызывает повышение уровней циркулирующего лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ), что приводит к временному повышению уровней половых стероидов (тестостерона и дигидротестостерона у мужчин). Последующее введение препарата в терапевтических дозах угнетает выработку гипофизарных гонадотропинов и подавляет тестикулярный и овариальный стероидогенез. У мужчин содержание тестостерона снижается до кастрационного уровня (<50 нг/дл) в течение 3 – 5 недель после начала лечения.
Средний уровень тестостерона через 6 месяцев лечения составляет 6.1 (± 0.4) нг/дл для дозировки 7.5 мг; 10.1 (± 0.7) нг/дл для дозировки 22.5 мг и 10.4 (± 0.53) нг/дл для дозировки 45 мг. Эти значения сопоставимы с уровнем тестостерона после выполнения билатеральной орхиэктомии.
Показания к применению
— распространённый гормонозависимый рак предстательной железы.
Способ применения и дозы
Перед использованием температура препарата должна достичь комнатной. Препарат необходимо ввести в течение 30 минут после смешивания. Содержимое двух стерильных предварительно заполненных шприцев необходимо смешать непосредственно перед инъекцией. Препарат вводится подкожно в область с достаточным количеством подкожно-жировой клетчатки (например, в переднюю брюшную стенку), где отсутствует выраженная пигментация, узелки, патологические изменения кожи или волосы. Места инъекций необходимо периодически менять.
Элигард® не следует вводить в руку.
Два шприца соединяются, а их содержимое смешивается путем перемещения из одного шприца в другой (см. ниже) до получения гомогенной смеси. Далее следует разъединить шприцы, и надеть иглу непосредственно перед инъекцией. Элигард® необходимо вводить под наблюдением медицинского работника.
Элигард® в дозе 7,5 мг рекомендуется вводить один раз в месяц.
Элигард® в дозе 22,5 мг рекомендуется вводить один раз каждые три месяца. Элигард® в дозе 45 мг рекомендуется вводить один раз каждые шесть месяцев.
Только для одноразового применения. Неиспользованный раствор должен быть уничтожен.
После вскрытия ячейковой упаковки или внешней упаковки из алюминиевой фольги, необходимо сразу же смешать лиофилизат и растворитель для получения инъекционного раствора и ввести его в организм пациента.
Несмотря на то, что химическая стабильность готового к применению раствора сохраняется в течение 30 минут при температуре 25°C, вязкость растворенного препарата с течением времени увеличивается. Поэтому препарат следует вводить непосредственно после приготовления рабочего раствора.
-
Расположив упаковку на чистой рабочей поверхности, вскрыть все защитные оболочки (фольгу следует снимать от угла, помеченного небольшим вздутием) и достать ее содержимое. Удалить пакетик (и) с влагопоглощающим веществом.
-
Вынуть из шприца Б короткий шток-поршень с голубым наконечником (не выворачивать) и прикрепленный к нему ограничитель и выбросить. Аккуратными закручивающими движениями прикрепить длинный белый заместительный шток-поршень к серому основному ограничителю, который остался в шприце Б.
-
Отвинтить защитную крышку со шприца А, держа его в вертикальном положении, чтобы убедиться в отсутствии утечки растворителя. Удалить серую каучуковую крышку со шприца Б.
-
Плотно соединить два шприца вместе путем поступательно-вращательных движений. Избегать чрезмерного закручивания элементов шприцев. При утечке какого-либо количества растворителя невозможно будет должным образом закрепить иглу.
-
Ввести жидкое содержимое шприца А в шприц Б, содержащий лейпрорелина ацетат. В горизонтальном положении тщательно смешать компоненты препарата, попеременно нажимая на поршни обоих шприцев (всего около 60 раз), для получения однородного раствора (суспензии Элигард® в дозе 45 мг). Избегать перегибов системы шприцев. При правильном смешивании раствор (суспензия Элигард® 45 мг) представляется собой: для Элигард® 7,5 мг – светло-желтую или желтоватую с коричневым оттенков жидкость; для Элигард® 22,5/45 мг – бесцветную или белую, или бледно-желтую жидкость. Важно помнить, что препарат следует смешивать только согласно данной инструкции; взбалтывание не обеспечивает достаточного смешивания компонентов препарата.
-
Держать шприцы вертикально; при этом шприц Б находится внизу. Соединение шприцев должно быть прочным. Ввести весь готовый препарат в шприц Б (короткий широкий шприц), нажимая на поршень шприца А и аккуратно оттягивая поршень шприца Б назад. Отсоединить шприц А, продолжая нажимать на его поршень. Важно помнить: готовый препарат может содержать небольшие пузырьки, что не влияет на его действие. (Применимо к препарату, укомплектованному иглой инъекционной).
-
Расположить шприц Б вертикально. Удалить колпачок с основания стерильного картриджа иглы, поворачивая его. Прикрепить картридж иглы к концу шприца Б, толкая его и поворачивая иглу, пока она прочно не встанет на место. Не навинчивайте иглу на шприц до снятия упаковки. Перед введением препарата снимите защитный колпачок с картриджа иглы.
(Применимо к препарату, укомплектованному безопасной иглой инъекционной).
Процедура введения
ВАЖНО: Перед использованием дайте препарату нагреться до комнатной температуры. После смешивания препарат должен быть введён в течение 30 минут.
-
Выбрать соответствующее место для инъекции на передней брюшной стенке, в верхнем ягодичном квадранте или любом другом участке с достаточным количеством подкожной жировой клетчатки, где отсутствует выраженная пигментация, узелки, патологические изменения кожи или волосы. Поскольку зоны подкожного введения препарата необходимо периодически менять, то следует выбирать именно те участки кожи, куда инъекция еще не проводилась.
-
Протереть место инъекции смоченным в спирте ватным тампоном.
-
С помощью большого и указательного пальцев недоминантной (нерабочей) руки собрать складку кожи в месте проведения инъекции.
-
Доминантной (рабочей) рукой быстро воткните иглу под углом 90. Примерный угол, используемый Вами, будет зависеть от количества и полноты подкожной ткани и длины иглы. После введения иглы освободить кожную складку, собранную нерабочей рукой.
-
Введите препарат медленным равномерным толчком. Нажимайте на поршень, пока шприц не опустеет.
-
Быстро выньте иглу под тем же углом, под которым она была вставлена.
-
Сразу после того, как игла будет вынута, приведите в действие защитный щиток на игле большим пальцем руки (Рисунок 1) или пальцем (Рисунок 2) или плоской поверхностью (Рисунок 3), чтобы сдвинуть защитный щиток вперёд, пока он полностью не закроет кончик иглы и не защелкнется на место. Слышимый и ощутимый “щелчок” свидетельствует о том, что защитный щиток находится в зафиксированном положении (Рисунок 4). [Шаг 7 применим только к препарату, укомплектованному безопасной иглой инъекционной]
ИЛИ ИЛИ
Рисунок 1 Рисунок 2
Рисунок 3
Рисунок 4
-
Все элементы инъекционной системы следует выбросить в соответствующую емкость для биологически опасных материалов. Только для одноразового применения. Неиспользованный раствор должен быть уничтожен.
-
Снять перчатки и вымыть руки. Зафиксировать процесс введения препарата и реакцию пациента на инъекцию.
Побочные действия
Частота нежелательных явлений классифицируется как: очень частые (>1/10), частые (>1/100, <1/10), нечастые (>1/1,000, <1/100), редкие (>1/10,000, <1/1,000) и очень редкие (<1/10,000).
Очень часто
— приливы a b; чувство жара d
— обморок и острая сосудистая недостаточность a b d
— экхимозы, эритема a b d
— ощущение жжения и парестезии в месте введения препарата a b d, общее недомогание и повышенная утомляемость d
Часто
— одышка, кровохарканье, эмфизема легких
— назофарингит d
— гипестезия a b
— зуд кожи a b d, ночная потливость d
— задержка мочеиспусканий, затруднение мочеиспусканий, дизурия, никтурия, олигурия a b d
— болезненность грудных желез, бесплодие, гипертрофия грудных желез a b d, атрофия яичек, боли в яичках a b d, эректильная дисфункция, уменьшение размеров полового члена a b d
— слабость a b d, повышенная утомляемость a b, общее недомогание d, боли и кровоподтеки в месте введения препарата a b d, покалывание в месте инъекции d, ознобы a b d
— уменьшение количества эритроцитов, снижение гематокрита и гемоглобина, гематологические изменения a b d
— повышение уровня креатинфосфокиназы, удлинение времени свертывания крови a b d
— боли в костях , артралгии, миалгии a b d
— поллакиурия, гематурия a b d
Нечасто
— ринорея a b d, диспноэ d
— инфекция мочевыводящих путей a b, местная инфекция кожи a b
— ухудшение течения сахарного диабета a b d
— необычные сновидения, депрессия, снижение полового влечения a b d
— головокружение, головная боль, бессонница, нарушение вкуса, нарушение обоняния, вестибулярное головокружение a b d
— гипертензия, гипотония a b d
— запоры, сухость во рту a b d, диспепсия d, рвота d
— повышенная общая потливость и потливость ладоней, ночная потливость a b d
— боли в спине a b d, судороги в мышцах, тремор, мышечная атрофия a b
— спазм мочевого пузыря, чрезмерно учащение мочеиспусканий, задержка мочи a b d
— гинекомастия, импотенция, нарушение функции яичек a b d
— зуд в месте введения препарата a b d, заторможенность, боли, лихорадка, индурация в месте введения препарата a b d
— повышение уровня аланинаминотрансферазы, триглицеридов сыворотки крови, удлинение протромбинового времени, увеличение массы тела a b d
Редко
— гипестезия d
— патологические непроизвольные движения a b d
— метеоризм, отрыжка a b d; боли в животе на фоне вздутия a
— алопеция, кожные высыпания b d
— боли в грудных железах a b d
— образование язв в месте введения препарата d
Очень редко
— некроз тканей в месте введения препарата d
а Элигард в дозе 7,5 мг, b Элигард в дозе 22,5 мг, d Элигард в дозе 45 мг
К ожидаемым последствиям фармакологического подавления выработки тестостерона относятся приливы жара, повышенная потливость/ночная потливость, потеря/снижение полового влечения, импотенция, гинекомастия, болезненность/чувствительность грудных желез, атрофия яичек, эректильная дисфункция, уменьшение размеров полового члена, нарушение функции полового члена.
Кровоизлияние в гипофиз: в ходе пострегистрационных наблюдений появлялись сообщения о редких случаях кровоизлияния в гипофиз (клинический синдром, возникающий на фоне инфаркта гипофиза), которое развивалось после введения агонистов гонадотропин-рилизинг гормона.
Чаще всего это явление возникало в течение двух недель после первого введения, а в некоторых случаях – в течение нескольких часов. Клиническая картина кровоизлияния в гипофиз представлена внезапной головной болью, рвотой, нарушением зрения, параличом глазодвигательных мышц, иногда – острой сердечно-сосудистой недостаточностью. При этом состоянии требуется немедленное медицинское вмешательство.
Также сообщалось о развитии анафилактических/анафилактоидных реакций на введение агонистов ГнРГ.
Судороги: в ходе пострегистрационных наблюдений были отмечены случаи судорог у некоторых пациентов, получавших лечение аналогами агонистов гонадотропин-рилизинг гормона.
Противопоказания
-
повышенная чувствительность к активному веществу или любому другому компоненту препарата, в том числе к полисорбату 80
-
исходное число нейтрофилов <1500/мкл
-
выраженные нарушения функции печени
-
гормононезависимый рак предстательной железы
-
хирургическая кастрация
-
женщины и дети
-
наличие компрессии спинного мозга, наличие метастазов в спинной мозг
Лекарственные взаимодействия
Исследований по изучению фармакокинетического взаимодействия препарата Элигард® с другими препаратами не проводилось.
О взаимодействии Элигарда® с другими лекарственными препаратами не сообщалось.
Особые указания
Элигард® должен применяться под наблюдением врача, имеющего опыт применения противоопухолевой терапии.
Как и другие агонисты ГнРГ, Элигард®в первую неделю лечения вызывает кратковременное повышение концентрации тестостерона в сыворотке крови.
В связи с этим в течение первой недели лечения пациенты могут отметить усиление симптомов или появление новых признаков и симптомов, таких как боли в костях, неврологическая симптоматика, гематурия или обструкция выходного отверстия мочевого пузыря. При паллиативном лечении прогрессирующего рака предстательной железы с помощью агонистов ГнРГ наблюдались отдельные случаи обструкции мочеточника и/или компрессии спинного мозга, которая может привести к развитию паралича с возможными осложнениями и летальным исходом. Пациенты с метастатическими поражениями позвоночника и/или обструкцией мочевыводящих путей нуждаются в тщательном наблюдении в течение первых нескольких недель лечения. При развитии компрессии спинного мозга или нарушении функции почек необходимо провести стандартное лечение данных осложнений.
Включение в терапию нестероидных антиандрогенов и их одновременное введение с Элигардом® доказано снижает остроту реакций на препарат (то есть, усиление симптомов в ответ на кратковременное повышение тестостерона сыворотки крови) у пациентов из группы риска (а именно, при наличии выпячивания мозговых оболочек, что создает риск компрессии спинного мозга, или у пациентов с обструкцией выходного отверстия мочевого пузыря). За три дня до первой инъекции Элигарда® следует начать дополнительное введение соответствующего антиандрогена, которое должно продолжаться в течение первых двух-трех недель лечения. Это позволяет предотвратить последствия первоначального подъёма уровня тестостерона сыворотки крови.
Следует контролировать ответ на лечение Элигардом® путем периодических измерений концентрации тестостерона и простатспецифического антигена (ПСА) в сыворотке крови. Результаты измерений уровня тестостерона зависят от методики исследования. Для принятия правильных клинических и терапевтических решений рекомендуется учитывать вид и точность методики лабораторного исследования.
У пациентов мужского пола применение Элигарда® после хирургической кастрации не приводит к дальнейшему снижению уровня тестостерона сыворотки крови.
У некоторых пациентов опухоль оказывается нечувствительной к гормональному лечению. Диагностическим критерием данного состояния является отсутствие клинического улучшения, несмотря на достаточное подавление уровня тестостерона. Дальнейшее применение Элигарда® у таких пациентов бесполезно.
Влияние на эндокринную систему и метаболизм.
Изменение минеральной плотности костей: потеря костной ткани является частью естественного процесса старения, а также возникает на фоне гипоандрогенного состояния при длительном применении лейпрорелина ацетата. У пациентов с высоким риском снижения минеральной плотности костей и/или массы костной ткани, например, при наличии в семейном анамнезе остеопороза, при длительном использовании кортикостероидов или противосудорожных препаратов, при злоупотреблении алкоголем или табаком, применение Элигарда® может внести дополнительный риск. У данных пациентов перед началом лечения с помощью лейпрорелина ацетата следует очень внимательно оценить соотношение «риск-польза».
Длительное применение Элигарда® вызывает подавление гипофизарных гонадотропинов и выработки половых гормонов, что приводит к развитию симптомов гипогонадизма. Отмечено, что после прекращения лечения эти изменения подвергаются обратному развитию. Тем не менее, до сих пор точно не установлено, у всех ли пациентов купируются клинические симптомы гипогонадизма.
Применение антиандрогенов существенно увеличивает риск развития переломов на фоне остеопороза. Данные по этому вопросу крайне ограничены. Переломы на фоне остеопороза наблюдались у 5% пациентов через 22 месяца фармакологического подавления активности андрогенов и у 4% пациентов через 5-10 лет лечения. Риск переломов на фоне остеопороза в целом выше риска возникновения патологических переломов.
У некоторых пациентов, получающих лечение агонистами ГнРГ, возникают изменения толерантности к глюкозе. Поэтому на фоне лечения рекомендуется более частое наблюдение за пациентами с сахарным диабетом.
Сердечно-сосудистые заболевания.
Сообщается о повышенном риске развития инфаркта миокарда, внезапной смерти и инсульта, связанных с применением агонистов ГнРГ. Следует тщательно взвешивать соотношение имеющихся у пациента факторов сердечно-сосудистого риска при назначении лечения рака простаты агонистами ГнРГ. Пациенты, получающие лечение агонистами ГнРГ, должны находиться под наблюдением врача.
Было зарегистрировано удлинение интервала QT при длительном подавлении андрогенов. Врач должен оценить соотношение польза/риск при длительном подавлении андрогенов у пациенов с врожденным синдромом удлинения интервала QT, у пациентов с нарушением уровня электролитов в крови или у пациентов с застойной сердечной недостаточностью, а также у пациентов, получающих антиаритмические препараты класса IА (напр. гуанидин, прокаинамид) или класса III (напр. амиодарон, соталол).
Применение у пожилых пациентов
Возраст большинства пациентов (около 70%), которые участвовали в клинических исследованиях, соответствовал 70 годам и старше.
Почечная/Печеночная недостаточность
Фармакокинетические свойства Элигарда® у пациентов с печеночной или почечной недостаточностью не установлены. Все клинические исследования и оценка кинетики препарата проводились с участием пациентов с нормальной функцией печени и почек.
В постмаркетинговой практике сообщалось о судорогах у пациентов женского пола, детей, которые получали терапию лейпрорелина ацетатом. Эти случаи наблюдались у пациентов с судорогами, эпилепсией, цереброваскулярными расстройствами в анамнезе, аномалиями или новообразованиями центральной нервной системы, у пациентов с сопутствующей терапией, которая была ассоциирована с судорогами, например, бупропионом и ингибиторами обратного захвата серотонина. О судорогах также сообщалось у пациентов, у которых отсутствовали состояния, перечисленные выше.
Особенности влияния лекарственного средства на способность управлять транспортными средствами или потенциально опасными механизмами
Учитывая побочные эффекты препарата (головокружение, головная боль, расстройства зрения) следует соблюдать осторожность при управлении транспортом или другими потенциально опасными механизмами.
Передозировка
Симптомы: данных относительно передозировки не имеется.
Возможно усиление побочных эффектов.
Лечение: симптоматическая и поддерживающая терапия.
Форма выпуска и упаковка
По 343 мг (для дозировки 7.5 мг), по 457 мг (для дозировки 22.5 мг) или по 434 мг (для дозировки 45 мг) растворителя в полипропиленовый шприц с поршнем и навинчивающейся крышкой (шприц А). По 1 шприцу А вместе с поршнем для шприца Б и пакетиком с влагопоглотителем в поддон и пластиковую ячейковую упаковку, покрытую алюминиевой ламинированной фольгой.
По 10.6 мг (для дозировки 7.5 мг), по 29.2 мг (для дозировки 22.5 мг), или по 59.2 мг (для дозировки 45 мг) лейпрорелина ацетата в полипропиленовый шприц (шприц Б). По 1 шприцу Б вместе с иглой инъекционной в пенале из прозрачного пластика или безопасной иглой инъекционной с колпачком из прозрачного пластика, помещённой в пластиковую ячейковую упаковку, покрытую ламинированной бумагой, вместе с пакетиком с влагопоглотителем в поддон, или без поддона, и пластиковую ячейковую упаковку, покрытую алюминиевой ламинированной фольгой.
По 1 ячейковой упаковке со шприцем А в комплекте с поршнем и пакетиком с влагопоглотителем и по 1 ячейковой упаковке со шприцем Б в комплекте с иглой инъекционной или безопасной иглой инъекционной и пакетиком с влагопоглотителем вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Условия хранения
Хранить при температуре от 2 ºС до 8 ºС.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
«Толмар Инк.», США
Адрес: 701 Центр Авеню, Форт Коллинс, Колорадо 80526 США
Владелец регистрационного удостоверения
«Толмар Инк.», США
Адрес: 701 Центр Авеню, Форт Коллинс, Колорадо 80526 США
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции:
ИП Тлеубергенова Г.С., Республика Казахстан, 010000, Акмолинская область, г. Астана, ул. Бозинген, д.8.
aldoninakbar@mail.ru
| 426513371477977101_ru.doc | 409.5 кб |
| 376716441477978259_kz.doc | 326.74 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники

