Фармакологическое действие
Гиполипидемическое средство. Эволокумаб избирательно соединяется с PCSK9 и предупреждает связывание циркулирующей PCSK9 с рецептором ЛПНП на поверхности клеток печени, таким образом предотвращая РС8К9-опосредованный распад Р-ЛПНП. Как результат, повышение экспрессии Р-ЛПНП в печени приводит к снижению сывороточной концентрации холестерина ЛПНП.
У пациентов с первичной гиперхолестеринемией и смешанной дислипидемией лекарственное средство снижает концентрации несвязанной PCSK9, ХС-ЛПНП, общего холестерина (ОХ), аполипопротеина В (АпоВ), холестерина нелипопротеинов высокой плотности (ХС не-ЛПВП), холестерина ЛПОНП, ТГ и липопротеина(а) (Лп[а]), повышает концентрации ХС-ЛПВП и аполипопротеина А1 (AпoA1), улучшая соотношение ОХ/ХС-ЛПВП, АпоВ/ аполипопротеин А1 (AпoA1).
Однократное п/к введение 140 или 420 мг эволокумаба приводит к максимальной супрессии циркулирующей несвязанной PCSK9 через 4 ч, что сопровождается снижением ХС-ЛПНП, достигающего среднего надира к 14 и 21 дню, соответственно. Изменения концентрации несвязанной PCSK9 и сывороточных липопротеинов обратимы после отмены эволокумаба. Не отмечено повышения концентраций несвязанной PCSK9 или ХС-ЛПНП выше исходного уровня, что указывает на то, что компенсаторный механизм увеличения продукции PCSK9 и ХС-ЛПНП не возникает во время лечения.
При режиме дозирования 140 мг эволокумаба каждые две недели или 420 мг эволокумаба раз в месяц максимальное снижение ХС-ЛПНП достигало от -72% до -57% от начальных значений по сравнению с плацебо. Режимы дозирования эквивалентны в отношении среднего снижения ХС-ЛПНП (среднее между неделями 10 и 12).
Аналогичное снижение ХС-ЛПНП наблюдалось как при применении эволокумаба в монотерапии, так и в составе комбинированной терапии с другими гиполипидемическими лекарственными средствами.
Фармакокинетика
Медианная максимальная сывороточная концентрация достигалась в течение 3-4 дней после однократной подкожной инъекции эволокумаба 140 мг или 420 мг здоровым добровольцам. Среднее значение максимальной концентрации (Cmax[SD]) составило 13 (10.4) мкг/мл после введения однократной подкожной дозы 140 мг. AUClast [SD] составила 96/5 (78/7) сутки•мкг/мл. Аналогичные значения Cmax (SD) и AUClast (SD) составили 46 (17/2) мкг/мл и 842 (333) сутки•мкг/мл, соответственно, после введения дозы 420 мг. Три подкожные дозы 140 мг были биоэквивалентны подкожной дозе 420 мг. Абсолютная биодоступность была определена как 72% по сравнению с фармакокинетическими моделями после подкожного введения.
Средний Vd в равновесном состоянии составил 3.3 (0.5) л после введения однократной дозы 420 мг эволокумаба внутривенно, что предполагает ограниченное распределение эволокумаба в ткани.
Предполагается, что метаболизм и выведение лекарственного средства происходит стандартными путями расщепления иммуноглобулинов, результатом которых является распад до малых пептидов и отдельных аминокислот.
Расчетный эффективный T1/2 эволокумаба составил от 11 до 17 дней.
У пациентов с первичной гиперхолестеринемией или смешанной дислипидемией, получающих высокие дозы статинов, значение системной экспозиции эволокумаба было несколько ниже, чем у пациентов, получающих статин в низкой или средней дозе (отношение AUClast 0.74 [90% ДИ: 0.29-1.9]). Ускорение клиренса приблизительно на 20% частично обусловлено увеличением концентрации PCSK9, которое, в свою очередь, вызвано статинами, что, тем не менее, не оказывает негативного влияния на фармакодинамику эволокумаба в отношении липидов. Фармакокинетический анализ в популяциях не выявил значимых различий в сывороточных концентрациях эволокумаба у пациентов с гиперхолестеринемией, включая семейную, при одновременном приеме статинов.
Показания активного вещества
ЭВОЛОКУМАБ
Взрослым с диагностированными сердечно-сосудистыми заболеваниями, обусловленными атеросклерозом (инфаркт миокарда, инсульт или заболевания артерий нижних конечностей) с целью снижения риска сердечно-сосудистых осложнений посредством снижения концентрации ХС-ЛПНП, в дополнение к коррекции других факторов риска: в комбинации с максимально переносимой дозой статина, или в комбинации с максимально переносимой дозой статина и другой гиполипидемической терапией, в монотерапии или в комбинации с другой гиполипидемической терапией у пациентов с непереносимостью статинов или имеющих противопоказания к их применению; гиперхолестеринемия и смешанная дислипидемия: в комбинации со статином или в комбинации со статином и другой гиполипидемической терапией у пациентов, не достигающих целевых уровней ХС-ЛПНП при максимально переносимой дозе статина, или в монотерапии или в комбинации с другой гиполипидемической терапией у пациентов с непереносимостью статинов, или имеющих противопоказания к их применению; гомозиготная семейная гиперхолестеринемия.
Режим дозирования
Подкожно.
Первичная гиперхолестеринемия и смешанная дислипидемия у взрослых
Рекомендуемая доза составляет или 140 мг каждые 2 недели, или 420 мг ежемесячно.
Гомозиготная семейная гиперхолестеринемия у взрослых и подростков в возрасте от 12 лет
Первоначальная рекомендуемая доза составляет 420 мг раз в месяц. После 12 недель лечения частота дозирования может быть увеличена до 420 мг раз в 2 недели, если клинически значимого ответа не наблюдается.
Диагностированное сердечно-сосудистое заболевание атеросклеротического генеза у взрослых
Рекомендуемая доза составляет 140 мг раз в 2 недели или 420 мг раз в месяц.
Побочное действие
Инфекционные и паразитарные заболевания: часто — грипп, назофарингит, инфекции верхних дыхательных путей.
Со стороны иммунной системы: часто — кожная сыпь; нечасто — крапивница.
Со стороны ЖКТ: часто — тошнота.
Со стороны костно-мышечной системы: часто — боль в спине, артралгия.
Местные реакции: часто — реакции в месте введения.
Противопоказания к применению
Возраст до 18 лет при первичной гиперхолестеринемии и при смешанной дислипидемии; детский возраст до 12 лет при гомозиготной семейной гиперхолестеринемии.
С осторожностью
Тяжелая почечная недостаточность, тяжелая печеночная недостаточность (класс С по Чайлд-Пью), беременность и период грудного вскармливания.
Применение при беременности и кормлении грудью
Применение при беременности возможно только в том случае, когда предполагаемая польза для матери превосходит потенциальный риск для плода.
Решение об отмене лекарственного средства или прекращении грудного вскармливания должно приниматься на основании оценки потенциальной пользы продолжения терапии для матери или возможного риска негативного влияния на новорожденного.
Применение у детей
Применение противопоказано в детском возрасте до 18 лет при первичной гиперхолестеринемии и при смешанной дислипидемии.
Применение противопоказано в детском возрасте до 12 лет при гомозиготной семейной гиперхолестеринемии.
Особые указания
У пациентов с тяжелой почечной недостаточностью лекарственное средство должно применяться с осторожностью.
У пациентов со средней степенью печеночной недостаточности отмечалось снижение воздействия эволокумаба, что потенциально может привести к снижению эффекта в отношении ХС-ЛПНП. Поэтому у таких пациентов требуется тщательный мониторинг. У пациентов с тяжелой печеночной недостаточностью лекарственное средство должно применяться с осторожностью.
Колпачок иглы стеклянного предварительно заполненного шприца изготовлен из сухого натурального каучука (производное латекса), который может вызывать аллергические реакции.
Данное лекарственное средство содержит менее 1 ммоль натрия (23 мг) на одну дозу, т.е. фактически может считаться как «не содержащее натрий».
Лекарственное взаимодействие
Фармакокинетическое взаимодействие между статинами и эволокумабом оценивали в программах клинических исследований. Отмечалось увеличение клиренса эволокумаба приблизительно на 20% при одновременном применении со статинами. Увеличенный клиренс обусловлен повышением концентрации PCSK9, опосредованным статинами, что тем не менее, не влияло на фармакодинамический эффект эволокумаба в отношении липидов. Не требуется коррекции доз статинов при одновременном назначении с эволокумабом.
Поскольку исследований совместимости не проводилось, эволокумаб не следует смешивать с другими лекарственными средствами.
Механизм действия
Эволокумаб является полностью человеческим моноклональным иммуноглобулином G2 (IgG2), ингибирующим пропротеин конвертазу субтилизин/кексин типа 9 (PCSK9). Эволокумаб селективно и с высокой степенью аффинности связывается с PCSK9 и ингибирует связывание циркулирующей PCSK9 с рецептором липопротеинов низкой плотности (Р-ЛПНП) на поверхности клеток печени, таким образом предотвращая PCSK9-опосредованный распад Р-ЛПНП. Как результат, повышение экспрессии Р-ЛПНП в печени приводит к снижению сывороточной концентрации холестерина липопротеинов низкой плотности (ХС-ЛПНП).
Фармакодинамические свойства
Было показано, что у пациентов с первичной гиперлипидемией и смешанной дислипидемией эволокумаб снижает концентрации несвязанной PCSK9, ХС-ЛПНП, общего холестерина (ОХ), аполипопротеина B (АпоВ), холестерина липопротеинов невысокой плотности (ХС не-ЛПВП), холестерина липопротеинов очень низкой плотности (ХС-ЛПОНП), триглицеридов и липопротеина(а) (Лп[а]), повышает концентрации холестерина липопротеинов высокой плотности\0009(Хс-ЛПВП) и аполипопротеина A1(АпоА1), улучшая соотношение ОС/Хс-ЛПВП, АпоВ/аполипопротеин А1 (АпоА1).
Однократное подкожное введение 140 или 420 мг эволокумаба приводит к максимальной супрессии цикрулирующей несвязанной PCSK9 через 4 часа, что сопровождается снижением ХС-ЛПНП, достигающего среднего надира к 14 и 21 дню, соответственно. Изменения концентрации несвязанной PCSK9 и сывороточных липопротеинов обратимы после отмены эволокумаба. Не отмечено компенсаторного увеличения продукции PCSK9 и ХС-ЛПНП во время лечения, равно как и после выведения эволокумаба не отмечено повышения концентраций несвязанной PCSK9 или ХС-ЛПНП (нет «синдрома рикошета»). При режиме дозирования 140 мг эволокумаба каждые две недели или 420 мг эволокумаба раз в месяц максимальное снижение ХС-ЛПНП достигало от -72% до -57% от начальных значений по сравнению с плацебо. Режимы дозирования эквивалентны в отношении среднего снижения ХС-ЛПНП (среднее на неделях 10 и 12).
Аналогичное снижение ХС-ЛПНП наблюдалось как при применении эволокумаба в монотерапии, так и в составе комбинированной терапии с другими гиполипидемическими препаратами. Эффект в отношении снижения ХС-ЛПНП стабилен, максимальная продолжительность терапии в настоящий момент составляет 112 недель.
Внешние и внутренние факторы, такие как демографические характеристики, одновременно применяемая терапия, вариабельность лабораторных показателей и статус заболевания не влияют на ответ на терапию эволокумабом (см. раздел «Режим дозирования»).
Иммуногенность
Как и в случае любых других терапевтических протеинов, существует потенциальный риск развития иммуногенности.Иммуногенность определяли с помощью
иммунохемилюминисцентного связывания с целью обнаружения антител к эволокумабу. В случае выявления у пациентов при иммунологическом скрининге антител к эволокумабу дополнительно проводили биологический анализ для оценки того, являются ли эти антитела нейтрализующими.
В клинических исследованиях у 0.1% пациентов (7 из 4846 пациентов с первичной гиперхолестеринемией и смешанной дислипидемией и ни у одного из 80 пациентов с гомозиготной семейной гиперхолестеринемией [ГоСГХС]), получивших как минимум 1 дозу эволокумаба, обнаружены связывающие антитела (у 4 пациентов — транзиторные антитела). Для этих пациентов проводили дополнительный анализ на нейтрализующие антитела. Нейтрализующих антител не обнаружено ни у одного из пациентов. Обнаруженные связывающие антитела не приводили к изменению фармакокинетических параметров препарата, не влияли на терапевтический ответ или безопасность препарата. Клиническая эффективность и безопасность
Результаты клинических исследований эволокумаба доказывают, что ингибирование активности PCSK9 эволокумабом обеспечивает снижение концентрации ХС-ЛПНП в сыворотке и улучшение других показателей липидного обмена. Данные результаты демонстрируют стабильную эффективность эволокумаба в отношении улучшения показателей липидного обмена у пациентов с первичной гиперлипидемией (гетерозиготной семейной и несемейной) и смешанной дислипидемией и ГоСГХС во всех популяциях и с любым дизайном исследований.
Режимы дозирования 140 мг эволокумаба раз в две недели (Q2W) и 420 мг (QM) эволокумаба раз в месяц являются клинически эквивалентными у пациентов с первичной гиперхолестеринемией и смешанной дислипидемией в отношении снижения ХС-ЛПНП, общего холестерина, АпоB, ХС не-ЛПВП, ХС-ЛПОНП, триглицеридов и Лп(а); повышения концентрации ХС-ЛПВП и АпоA1 и улучшения соотношения общий холестерин/ХС-ЛПВП, АпоB/АпоA1.
В результате терапии эволокумабом было достигнуто снижение концентрации ХС-ЛПНП приблизительно на 55-75%, которое сохранялось на протяжении всего периода проведения долгосрочной терапии. Максимальный ответ достигался, как правило, через 12 недели после введения 140 мг раз Q2W и 420 мг QM, соответственно. У 80-85% пациентов, получавших эволокумаб в любой дозировке, наблюдалось снижение концентрации ХС-ЛПНП на более чем 50% в среднем к 10 — 12 неделям применения. Эволокумаб превосходил эзетимиб в отношении снижения концентрации ХС-ЛПНП, Применение эволокумаба 140 мг Q2W и 420 мг QM было эффективным во всех подгруппах, относящихся к плацебо и эзетимибу, при этом каких-либо значимых различий между подгруппами, определенными такими характеристиками пациентов как возраст, расовая принадлежность, пол, регион происхождения, индекс массы тела (ИМТ), степень риска по Национальной образовательной программе по холестерину (NCEP), доза и интенсивность статинов, статус курения, исходный риск развития ишемической болезни сердца (ИБС), ранняя ИБС в семейном анамнезе, переносимость или непереносимость глюкозы (т.е. сахарный диабет 2 типа, метаболический синдром или ни то, ни другое), артериальная гипертензия, исходная несвязанная PCSK9, исходная концентрация ХС-ЛПНП и исходная концентрация триглицеридов, не наблюдалось.
Результаты общего анализа эффективности в исследованиях ГоСГХС свидетельствуют о том, что эволокумаб эффективно снижал концентрации ХС-ЛПНП, общего холестерина, АпоB и ХС-неЛПВП у пациентов с ГоСГХС.
При долгосрочном лечении эволокумабом в дозах 420 мг QM и 420 мг Q2W наблюдался продолжительный терапевтический эффект, что подтверждается снижением концентрации ХС-ЛПНП приблизительно на 20% — 30% у пациентов c ГоСГХС, не получавших лечения аферезом, и приблизительно у 15% — 25% пациентов с ГоСГХС, получавших аферез. В целом, каких-либо различий в отношении безопасности или эффективности эволокумаба между группами в возрасте 12 лет и старше и взрослых пациентов с ГоСГХС не наблюдалось.
Соотношение пациентов с нежелательными явлениями было в целом сбалансированным между группами в течение всех 3 периодов сбора комплексного массива данных по безопасности, а также между подгруппами и схемами лечения. Не отмечалось каких-либо связанных с безопасностью проблем в отношении нежелательных явлений, сообщавшихся для других видов гиполипидемической терапии (т.е. эпизодов сахарного диабета, а также осложнений со стороны печени и мышечной ткани), а также явлений, которые теоретически могут быть сопряжены с ингибированием PCSK9/повышением экспрессии рецепторов ЛПНП (т.е. эпизоды развития гепатита С). Каких-либо признаков, свидетельствующих о риске развития нейрокогнитивных осложнений при применении эволокумаба, не наблюдалось. Нейрокогнитивные осложнения в исследованиях с контролем плацебо или активными контролями были сходными.
Виды и количество нежелательных явлений во всех исследованиях были сопоставимыми, как при применении эволокумаба в качестве монотерапии, так и в составе комбинированной терапии (со статинами в сочетании с эзетимибом или без него) или у пациентов с непереносимостью статинов.
Не было выявлено новых сигналов, касающихся безопасности препарата, при сравнительном изучении данных о нежелательных явлениях, развившихся в ходе исследований пациентов с ГоСГХС и данных о нежелательных явлениях, развившихся в исследованиях первичной гиперлипидемии (гетерозиготной семейной и несемейной) и смешанной дислипидемии.
Фармакокинетика
Фармакокинетика эволокумаба после подкожного введения демонстрирует нелинейный характер.
Всасывание
Медианная максимальная сывороточная концентрация достигалась в течение 3 — 4 дней с расчетной абсолютной биодоступностью 72% после однократной подкожной инъекции эволокумаба 140 мг или 420 мг здоровым добровольцам. Среднее значение максимальной концентрации (Cmax mean (SD)) составило 18.6 (7.3) мкг/мл после введения дозы 140 мг. Конечная площадь под кривой «концентрация-время» (AUClast) составила 188 (98.6) сутки»мкг/мл. Аналогичные значения Cmax и AUClast составили 59.0 (17.2) мкг/мл и 924 (346) сутки»мкг/мл, соответственно, после введения дозы 420 мг.
Распределение
Средний расчетный объем распределения в равновесном состоянии составил 3.3 (0.5) л после введения однократной дозы 420 мг эволокумаба внутривенно, что предполагает ограниченное распределение эволокумаба в ткани.
Метаболизм
Рассчитанное среднее системного клиренса составило 12 (2) мл/ч после внутривенного введения однократно 420 мг эволокумаба. Повторное подкожное введение эволокумаба на протяжении 12 недель в клинических исследованиях приводило к дозопропорциональному увеличению экспозиции для режимов дозирования 140 мг и больше. Приблизительно двух- и трехкратная кумуляция наблюдалась при минимальной сывороточной концентрации (Cmin [SD]) 7.21 [6.6]) при режимах дозирования 140 мг каждые 2 недели или 420 мг раз в месяц (Cmin [SD] 11.2 [10.8]). Минимальная сывороточная концентрация достигала состояния равновесия к 12 неделе дозирования. Расчетный эффективный период полувыведения эволокумаба составил от 11 до 17 дней. Не было отмечено изменений сывороточных концентраций эволокумаба в течение 124 недель, связанных со временем.
Выведение
Поскольку эволокумаб представляет собой полностью человеческое моноклональное антитело IgG2, клиренс эволокумаба обусловлен специфическим связыванием и образованием комплекса с целевым лигандом, PCSK9, равно как и стандартными путями клиренса IgG в ретикуло-эндотелиальной системе. Эволокумаб распадается до малых пептидов и аминокислот посредством этих путей катаболизма.
Увеличение клиренса приблизительно на 20% отмечено при комбинированном применении со статинами. Это увеличение частично обусловлено вызванным статинами увеличением концентраций PCSK9 и не оказывает негативного эффекта на фармакодинамику эволокумаба в отношении липидов. Фармакокинетический анализ в популяциях не выявил значимых различий в сывороточных концентрациях эволокумаба у пациентов с гиперхолестеринемией (семейной и несемейной), при одновременном приеме статинов.
Отдельные группы пациентов
Согласно результатам фармакокинетического анализа в популяциях не требуется коррекции дозы в зависимости от возраста, расы или пола. Масса тела влияет на фармакокинетику эволокумаба, однако значимо не влияет на гиполипидемический эффект эволокумаба. Следовательно, коррекции режима дозирования в зависимости от массы тела не требуется.
Фармакокинетический анализ в популяциях по объединенным данным клинических исследований не выявил различий в фармакокинетике препарата у пациентов с нарушениями функции почек слабой и умеренной степени по сравнению с пациентами с нормальной функцией почек.
Препарат вводили в виде одной подкожной инъекции 140 мг 8 пациентам со слабой степенью нарушения функции печени, 8 пациентам с умеренной степенью нарушения и 8 здоровым добровольцам. Экспозиция к эволокумабу снижалась на 40% — 50% по сравнению со здоровыми добровольцами. Тем не менее, базовые концентрации PCSK9, равно как и степень и время нейтрализации PCSK9 оставались схожими во всех трех группах. Таким образом, отмечался сходный эффект на снижение ХС-ЛПНП.
Прогнозный экономический эффект применения алирокумаба у пациентов с гиперхолестеринемией и высоким сердечно-сосудистым риском
Оценка экономической целесообразности включения алирокумаба в государственные программы возмещения для льготных категорий граждан.
На основании результатов опубликованных исследований проведена сравнительная оценка влияния на бюджет медицинских технологий с добавлением алирокумаба к терапии статинами и эзетимибом и стандартной терапии статинами и эзетимибом для вторичной профилактики после острого коронарного синдрома (ОКС) с горизонтом времени 2 года. Использовали Марковское моделирование и расчет прямых медицинских затрат. Для проверки устойчивости результатов проведен анализ чувствительности в отношении изменения стоимости алирокумаба. Стоимость болезни рассчитывали как совокупность прямых медицинских затрат (препараты, лечение сердечно-сосудистых заболеваний, аферез) и непрямых затрат (потери валового внутреннего продукта вследствие временной нетрудоспособности, сердечно-сосудистого заболевания или смертельного исхода).
Включение алирокумаба в программу государственного возмещения позволяет уменьшить нагрузку на бюджет на 49,05% у больных высокого сердечно-сосудистого риска, в том числе у больных семейной гиперхолестеринемией и рефрактерностью к стандартной гиполипидемической терапии. Экономия возникает в том числе за счет меньшей потребности в аферезе липидов плазмы крови при применении алирокумаба. Уменьшение финансового бремени болезни более чем на 50% в расчете на трудоспособное население при использовании алирокумаба ожидается за 2 года. Анализ чувствительности подтвердил устойчивость полученных результатов при искусственном увеличении цены препарата в 2,84 раза. Применение алирокумаба позволяет снизить бремя заболевания на 56,49%, или 7,78 млрд руб., в год для целевой группы за 2 года терапии по сравнению с текущей практикой лечения (с учетом непрямых затрат).
Полученные результаты позволяют считать включение алирокумаба в программы государственного (страхового) возмещения для вторичной профилактики после перенесенного ОКС экономически оправданным.
Многочисленные популяционные исследования свидетельствуют о том, что при применении гиполипидемических препаратов в реальной клинической практике необходимый (безопасный) уровень липидов крови не достигается у большинства пациентов [1-3]. Особое внимание уделяется тому факту, что даже у пациентов группы самого высокого риска, у которых должна проводиться наиболее «жесткая» вторичная профилактика, например, после острого коронарного синдрома (ОКС), стандартная гиполипидемическая терапия часто не обеспечивает целевой уровень холестерина липопротеидов низкой плотности (ЛНП) [4]. Как подчеркивают исследователи, одной из причин неэффективности вторичной профилактики статинами является возможная непереносимость высоких доз этих препаратов. Так, в клинических исследованиях частота миопатии, вызванной статинами, достигала 5%, а в обычной клинической практике это осложнение при использовании оптимальных доз статинов встречалось еще чаще [5,6]. Снижению эффективности вторичной профилактики сердечнососудистых событий, включая преждевременную смерть, может способствовать невыполнение больными врачебных рекомендаций, касающихся терапии статинами [7]. Более половины пациентов, нуждающихся в статинах, в первую очередь для профилактики повторных событий, получают субоптимальные дозы или вообще не принимают эти препараты [8], а среди оставшихся велика доля пациентов с высоким риском сердечно-сосудистой смерти (SCORE>20%) и низкой приверженностью к терапии статинами [9].
Не лучше обстоят дела с приемом гиполипидемических препаратов и у больных, перенесших первый ОКС. Перед выпиской из стационара таким пациентам практически всегда рекомендуют лечение статинами, однако через несколько лет эти препараты продолжают принимать не более 41% больных, да и то в низких, а, следовательно, малоэффективных, суточных дозах [10]. В европейских странах в течение года после выписки из стационара 40–75% пациентов, перенесших ОКС, также перестают принимать статины [11]. На приверженность к лечению влияют различные факторы, среди которых центральную роль играет поведение больного, который, сталкиваясь с побочными эффектами статинов или опасаясь их потенциальной токсичности, прекращает лечение или самостоятельно снижает дозу препарата. Опрос врачей свидетельствует о том, что и специалисты подвержены определенной инерции в принятии решения о терапии и нередко рекомендуют дозы, явно недостаточные для достижения целевого уровня липидов [12].
Особое внимание следует уделять больным сахарным диабетом 2 типа (СД), у которых чаще развиваются тяжелые сердечно-сосудистые события [13]. Так, вероятность ишемической болезни сердца (ИБС) у больных СД 2 типа по сравнению с другими категориями пациентов повышена в 2,0-3,0 раза, инфаркта миокарда – в 2,4-3,3 раза, инсульта – в 2,0 раза, а сердечно-сосудистой смерти — в 1,14 раза [14-16]. Такие больные нуждаются в эффективной гиполипидемической терапии, но около трети из них самостоятельно отказываются от приема статинов в течение года после назначения [17]. Кроме того, больным СД 2 типа почти в 3 раза чаще требуется повторная реваскуляризация коронарных артерий, которая ассоциируется с более высоким риском тяжелых осложнений [18,19].
Принципиально новым подходом к лечению дислипидемии является применение моноклональных антител, блокирующих фермент PCSK9, который регулирует деградацию (разрушение) рецептора к ЛНП [20]. Одним из таких препаратов является алирокумаб [21]. В рандомизированных клинических исследованиях лечение алирокумабом в дополнение к статинам и эзетимибу или в качестве альтернативы другим гиполипидемическим средствам вызывало значительное снижение уровня ЛНП и позволяло достичь целевых значений липидов крови [22]. Приверженность к лечению в течение как минимум 71 недели была почти 100%. При этом отклонение от интервала введения (раз в две недели) на 3 дня не сказывалось на терапевтическом эффекте [23]. По данным мета-анализа, снижение риска сердечнососудистых событий при лечении ингибиторами PCSK9, добавленными к комбинированной терапии статинами и эзетимибом, составило 51%, а при стандартной терапии статинами и эзетимибом – только 6% [24]. Соответственно, при оценке технологий в здравоохранении с применением этих схем коэффициенты числа возможных событий в течение 2 лет после ОКС составили 0,94 при стандартной фармакотерапии и 0,49 при применении алирокумаба [25]. Два препарата этого класса – алирокумаб и эволокумаб – с 2018 г. включены в Перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) [26].
Существенное увеличение доступности препаратах этой группы в нашей стране возможно на условиях государственного (страхового) возмещения. Ранее проведенный анализ [25] показал экономическую целесообразность включения алирокумаба в Перечень ЖНВЛП. Целью данного исследования была оценка экономической целесообразности включения алирокумаба в Перечень лекарственных препаратов для льготных категорий граждан (Перечень ОНЛС) для лечения пациентов высокого сердечно-сосудистого риска.
Материал и методы
В качестве целевой группы выбраны пациенты с семейной гиперхолестеринемией, перенесшие ОКС и реваскуляризацию миокарда в течение последнего года, рефрактерные к применению статинов и эзетимиба в максимальных переносимых дозах и нуждающиеся в аферезе липидов [27]. Расчетные данные показывают, что такие больные составляют не менее 19,4% от общего числа больных, перенесших ОКС [9]. Отечественные данные об интенсификации липидснижающей терапии у пациентов высокого сердечнососудистого риска отсутствуют, поэтому для проведения расчетов использовали данные, полученные в США [27].
Горизонт анализа составил 2 года в соответствии с принятой методикой [28] и данными клинических исследований алирокумаба [27]. При определении прямых затрат учитывали режимы применения анализируемых препаратов, указанные в соответствующих исследованиях [29,30] и в официальных инструкциях по медицинскому применению (табл. 1) [31]. В качестве препарата сравнения при оценке затрат на стандартную гиполипидемическую терапию рассматривали аторвастатин в максимальной дозе 80 мг/сут (включенный в Перечень ОНЛС) [26] в комбинации с эзетимибом в дозе 10 мг в сутки (не включен в ЖНВЛП).
| Препарат | Режим применения | Стоимость упаковки с 10% НДС (руб.) |
|---|---|---|
| Алирокумаб (Пралуэнт) (раствор для подкожного введения 75 или 150 мг/мл №2) | 1 инъекция каждые 2 нед. | 29 260,81 |
| Эзетимиб (Эзетрол) (таблетки 10 мг № 28) | 10 мг/сут длительно | 1 784,94 |
| Аторвастатин (Липримар) (таблетки 80 мг №30 | 80 мг/сут длительно | 1 095,50 |
Средняя стоимость эзетимиба (Эзетрол) рассчитана с учетом оптовой цены за вычетом максимальной оптовой надбавки и с учетом НДС [32]. Стоимости алирокумаба (Пралуэнт) и аторвастатина (Липримар) определены на основании Регистра предельных отпускных цен с учетом НДС [33].
Анализ «влияние на бюджет». Анализ влияния на бюджет при включении алирокумаба в режимы фармакотерапии у пациентов целевой популяции проводили согласно утвержденным правилам [34] по сравнению с препаратами, уже включенными в Перечень ОНЛС. С использованием моделирования сравнивали две альтернативные медицинские технологии:
- текущий режим терапии с использованием статина в максимальных переносимых дозах и эзетемиба (целевых уровней ХС ЛНП достичь не удается);
- добавление к статинам и эзетимибу алирокумаба.
При недостаточной эффективности лечения показан аферез липидов плазмы крови, который проводится один раз в 2 недели. Модель Маркова, описывающая применение анализируемых технологий в рамках проводимого анализа, представлена на рис. 1.
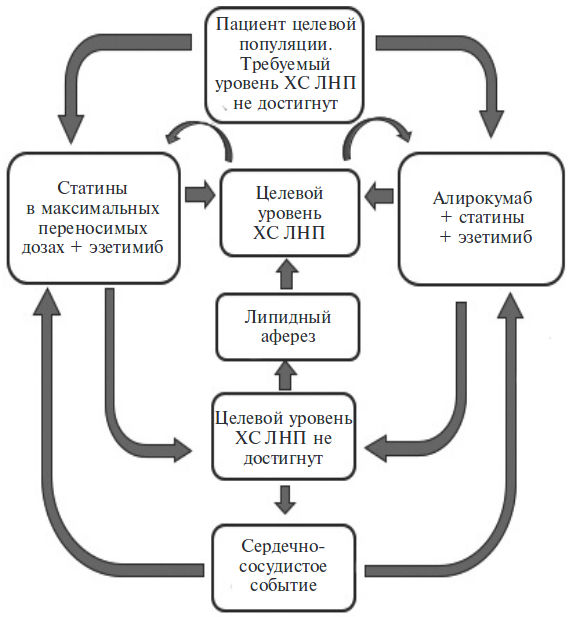
Для анализа влияния на бюджет учитывали прямые затраты на лекарственные препараты и аферез и прямые затраты на лечение сердечно-сосудистых событий.
В табл. 2. приведены данные о частоте применения афереза у пациентов, получающих алирокумаб и плацебо (т.е. только на фоне стандартной терапии) [35]. Согласно Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 г. [36] стоимость одного дня лечения аферезом липидов плазмы крови в условиях дневного стационара за счет средств ОМС составляет 14 619,50 руб. Согласно КСГ №34 «Лечение наследственных атерогенных нарушений липидного обмена с применением афереза (липидная фильтрация, афинная и иммуносорбция липопротеидов) в случае отсутствия эффективности базисной терапии» предусмотрен коэффициент затрат 5,07, что составляет в сумме 74 120,86 руб./1 сеанс [37].
| Процент выполненных процедур афереза от необходимого числа | Средневзвешенный процент пациентов, получающих аферез, принятый для расчета | Частота афе реза в группе алиро кумаба, % | Частота афе реза в группе сравнения (%) |
|---|---|---|---|
| Аферез не проводится | 0 | 63,4 | 0 |
| >0% — ≤25% | 12,5 | 17,1 | 0 |
| >25% — ≤50% | 37,5 | 12,2 | 14,3 |
| >50% — ≤75% | 62,5 | 2,4 | 23,8 |
| >75% — ≤100 | 87,5 | 2,4 | 33,3 |
| 100% | 100 | 2,4 | 28,6 |
При оценке частоты сердечно-сосудистых событий учитывали базовую вероятность их наступления в группе, экстраполированную на целевую группу с глобальной модели по оценке влияния на бюджет при включении препарата алирокумаб в схему лечения (табл. 3).
| Событие | Вероятность наступления в год, % | Стоимость законченного случая (руб.) |
|---|---|---|
| Примечание: *Среднее между осложненной и неосложненной формой.**Средняя стоимость при равной частоте осложнений: тромбоэмболии легочной артерии, фибрилляции предсердий (с оперативным пособием и без), сердечно-легочная недостаточность | ||
| Нефатальный инфаркт миокарда | 9 | 52 520,14* |
| Нестабильная стенокардия | 1 | 80 374,94** |
| Реваскуляризация миокарда | 36 | 207 418,08 |
| Нефатальный инсульт | 2 | 120 297,40 |
| Сердечно-сосудистая смерть | 4 | — |
По данным мета-анализа М. Silverman и соавт. [38], снижение риска сердечно-сосудистых событий при использовании ингибиторов PCSK9 составляет 51%, а при лечении статином и эзетемибом – 6%. Эти показатели учитывали при расчете частоты сердечно-сосудистых событий в группах пациентов, получающих стандартную терапию и алирокумаб. Затраты на лечение сердечно-сосудистых событий рассчитывали, исходя из стоимости лечения одного законченного случая согласно тарифному соглашению ОМС по Москве 2017 г. (табл. 3) [39].
При расчете затрат на терапию учитывали смертность пациентов, в связи с которой они выбывали из исследования. Было сделано допущение, что число случаев смерти распределяется равномерно в течение года. Анализ чувствительности проводили для проверки устойчивости полученных результатов основного сценария к изменению входного параметра – стоимости препарата алирокумаб. Анализ «стоимости болезни» включал кроме вышеперечисленных затрат оценку непрямых расходов (недополучение валового внутреннего продукта – ВВП). Непрямые затраты в виде потери ВВП по причине смерти пациентов на период дожития до возраста завершения экономической активности (72 года) рассчитывали в соответствии с требованиями нормативных документов [40]. Расчет проводили для группы из 1000 пациентов с последующим перерасчетом на 1 пациента.
Размер недополученного ВВП рассчитывали путем деления годового ВВП страны на численность работоспособного населения и число рабочих дней в году. ВВП за 2016 г. составил 85 880,6 млрд руб, занятое население – 72 392 600 человек, число рабочих дней в году – 247. Для анализа были приняты следующие сроки временной нетрудоспособности при наступлении сердечно-сосудистых событий (согласно стандартам оказания медицинской помощи): нефатальный инфаркт миокарда – 80 дней, реваскуляризация миокарда – 30 дней, нефатальный инсульт – 80 дней [25]. Непрямые расходы, связанные с оплатой временной нетрудоспособности, получены умножением стоимости одного дня на соответствующее количество дней. Недополученный ВВП вследствие стойкой утраты трудоспособности или преждевременной смерти определен как отношение ВВП к трудоспособному населению. В 2016 г. он составил 488 782 руб. на человека трудоспособного возраста [41]. Эти показатели, как и соответствующий параметр при ОКС [42], отнесены к непрямым расходам.
Анализ минимизации затрат. Алирокумаб сравнивали с другим ингибитором PCSK9, зарегистрированным в России, – эволокумабом, применяющимся по сходным показаниям [43]. При отсутствии различий в эффекте должен применяться вариант анализа «затраты-эффект» – анализ минимизации затрат (CMA – Cost Minimization Analysis). Стоимость эволокумаба (Репата, Амджен Мэньюфэкчуринг Лимитед, Пуэрто-Рико, США), 140 мг/мл, шприцы 1 мл, рассчитана согласно методике определения предельной отпускной цены производителя [44], поскольку препарат включен в Перечень ЖНВЛП на 2018 г. (на момент анализа цена еще не была зарегистрирована). Минимальная цена определена в Словакии и составляет 386 евро за 2 шприца по 140 мг [45] или 579 евро в месяц (с учетом необходимости 3 шприцов), что по курсу ЦБ РФ на момент анализа (69,64 руб.) [46] соответствует 40 321,56 руб. С учетом таможенных сборов в 3,2% стоимость месяца лечения составляет 41 611,84 руб, а с учетом НДС (10%) – 45 773,03 руб.
Определяли показатель минимизации затрат CMR (Cost Minimization Ratio), показывающий, на сколько применение менее затратной медицинской технологии позволяет снизить затраты на лечение пациента [47]. Также оценивали показатель упущенных возможностей Q, характеризующий объем терапии, который мог бы быть обеспечен при использовании менее затратной медицинской технологии. Упомянутые показатели рассчитывали по формулам: CMR=DC2-DC1 и Q=CMR/DC1 × 100%,где CMR – показатель минимизации затрат; DC1 – прямые затраты при применении менее дорогой медицинской технологии; DC2 – прямые затраты при более дорогой медицинской технологии; Q – показатель упущенных возможностей.
Результаты
Определение целевой группы пациентов. В России ежегодно диагностируют в среднем 520 000 случаев ОКС [42]. Среди них расчетная доля больных с семейной гиперхолестеринемией составляет 19,4% (100 880 человек). ОКС с давностью 1 год и проведенной реваскуляризацией можно ожидать у 36% (на основании опроса врачей кардиологов), или 36 317 пациентов. Экстраполируя данные по частоте приема статинов пациентами с ОКС (88%) на эту группу пациентов, можно ее ограничить до 31 959 человек. Согласно данным модели интенсификации липидснижающей терапии у пациентов высокого сердечно-сосудистого риска [23], назначение алирокумаба потребуется примерно 14% из этих пациентов. Таким образом, размер целевой группы был ограничен 4 474 пациентами с семейной гиперхолестеринемией, перенесшими ОКС в течение последнего года и рефрактерными к терапии статинами. Частоту сердечнососудистых событий рассчитывали в целевой группе пациентов в рамках горизонта исследования 2 года. Результаты оценки прямых медицинских затрат на лечение пациентов целевой группы приведены в табл. 4.
| Показатели | Статин + эзетимиб | Алирокумаб + статин+эзетимиб |
|---|---|---|
| Первый год | ||
| Лекарственные затраты | 160,50 | 1 877,82 |
| Затраты на аферез | 6 463,67 | 1 848,94 |
| Затраты на лечение сердечнососудистых событий | 59,01 | 30,64 |
| Суммарно за первый год | 6 683,18 | 3 729,82 |
| Второй год | ||
| Лекарственные затраты | 154,52 | 1 812,93 |
| Затраты на аферез | 6 022,85 | 1 008,64 |
| Затраты на лечение сердечнососудистых событий | 57,00 | 30,15 |
| Суммарно за второй год | 6 234,37 | 2 851,72 |
| Суммарные затраты за 2 года | ||
| Прямые медицинские затраты | 12 917,55 | 6 581,54 |
| Разница (%) | — | Разница (%) |
Результаты анализа влияния на бюджет свидетельствуют о снижении суммарных прямых затрат на лечение пациентов целевой группы при добавлении алирокумаба к липидснижающей терапии на 48,6%. Это обусловлено преимущественно снижением частоты назначения дорогостоящей процедуры афереза при включении алирокумаба в схему лечения. Результаты анализа показали, что включение алирокумаба в Перечень ОНЛС экономически обосновано.
Анализ чувствительности. Наибольший вклад в суммарные прямые затраты при стандартном варианте терапии вносят затраты на липидный аферез, в то время как затраты на лекарственную терапию не превышают 2,5% от общей суммы. При добавлении к терапии алирокумаба затраты на его применение также начинают вносить значимый вклад в общие затраты. Как было отмечено выше, стоимость процедуры липидного афереза регламентируется тарифным соглашением по программе ОМС на 2018 г. В связи с этим единственным входным параметром, способным значимо повлиять на результат, является цена алирокумаба. Кроме того, выше было показано, что добавление алирокумаба в схему терапии позволяет снизить затраты. В связи с этим анализ чувствительности проводили для проверки устойчивости полученных результатов основного сце нария к однонаправленному изменению входного параметра: повышению стоимости алирокумаба. Полу ченный результат оказался устойчивым к возрастанию цены на алирокумаб (табл. 5). Предлагаемый режим терапии с применением алирокумаба остается менее затратным при увеличении цены на алирокумаб в 2,84 раза (на 184%).
| Увеличение цены алирокумаба | Разница затрат при использовании алирокумаба по сравнению с текущим вариантом терапии | |
|---|---|---|
| млн руб. | % | |
| 0% | -6 278,2 | -48,61 |
| +50% | -4 579,58 | -35,45 |
| +100% | -2 880,35 | -22,30 |
| +150% | -1 181,11 | -9,14 |
| +184% | -25,63 | -0,20 |
Анализ стоимости болезни. Учитывали прямые и непрямые затраты. Как указано выше, размер недополученного ВВП при невыходе пациента на работу в 2016 г. равнялся 4 802,90 руб. Средний возраст пациентов в клинических исследованиях составил 60-62 года (61 год) [23]. При расчетах было сделано допущение, что только 20% пациентов целевой группы относились к занятым в данной возрастной категории. При оценке недополученного ВВП за период дожития до 72 лет рассчитывали потери ВВП по причине смерти пациентов в течение первого и второго года исследования, а также за период дожития, т.е. в течение 9 лет. Включение алирокумаба в схемы терапии пациентов целевой группы позволит снизить бремя заболевания на 7,73 млрд руб, или на 56,1%, за 2 года терапии (табл. 6).
| Показатели | Статин + эзетимиб | Алирокумаб + статин + эзетимиб |
|---|---|---|
| Первый год | ||
| Прямые медицинские затраты | 6 683,18 | 3 729,82 |
| Недополученный ВВП, в связи с временной потерей трудоспособност | 39,50 | 20,52 |
| Недополученный ВВП в результате смерти в рамках горизонта исследования | 19,61 | 9,99 |
| Второй год | ||
| Прямые медицинские затраты | 6 234,37 | 6 234,37 |
| Недополученный ВВП, в связи с временной потерей трудоспособности | 38,07 | 20,19 |
| Недополученный ВВП в результате смерти в рамках горизонта исследования | 58,46 | 30,48 |
| Потери ВВП за годы дожития | ||
| Недополученный ВВП за годы дожития до возраста потери экономической активности (72 года) | 702,54 | 369,42 |
| Суммарные затраты за 2 года | ||
| Стоимость болезни | 13 775,73 | 6 050,53 |
| Разница (%) | — | -56,49 |
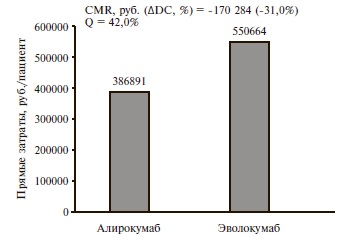
Анализ минимизации затрат. Исходя из обоснованного научного предположения об одинаковой эффективности (доля пациентов, достигающих целевых значений ХС ЛНП) алирокумаба и еще одного зарегистрированного в России препарата этого класса – эволокумаба – мы проводили анализ минимизации затрат. При этом стоимость статинов и эзетимиба не учитывали, поскольку считается, что дозировки и эффекты этих препаратов одинаковы в выделенных нами гипотетических группах алирокумаба и эволокумаба. Согласно официальным инструкциям у пациентов с семейной гиперхолестеринемией алирокумаб применяется в дозе 150-300 мг в месяц (2 инъекции), а эволокумаб – в дозе 280 мг (2 инъекции) или 420 мг в месяц (3 инъекции). Исходя из этого были рассчитаны лекарственные затраты на 52-недельную терапию сравниваемыми препаратами с последующим определением показателей минимизации затрат и упущенных возможностей. Результаты сравнения приведены в рис. 2. Расчетные данные показывают, что терапия алирокумабом по сравнению эволокумабом у пациентов рассматриваемой целевой группы позволит снизить затраты на 170 284 руб. на 1 пациента в год (-31,0%) или пролечить с тем же эффектом на 42,0% больше больных.
Обсуждение
При проведении анализа минимизации затрат сравнивали два ингибитора PCSK9, зарегистрированные в РФ: алирокумаб и эволокумаб. Этот вид анализа использовался потому, что нам не удалось обнаружить в доступной литературе результатов прямых сравнительных клинических исследований этих препаратов. Непрямое же сравнение не позволяет выявить достоверных различий между их клиническим эффектом, оцениваемым по доле пациентов, достигающих целевых уровней липидов крови. Опубликованный систематизированный обзор, показавший преимущество эволокумаба перед алирокумабом по степени снижения уровня холестерина ЛНП [48], не может быть использован для фармакоэкономического анализа, по нескольким причинам:
1. В мета-анализ не были включены некоторые исследования, в частности, RUTHERFORD и RUTHER
FORD-2 [49,50], что могло исказить результат непрямого сравнения в пользу эволокумаба. В группе плацебо не наблюдалось значительного повышения уровня холестерина ЛНП, поэтому включение исследований RUTHERFORD в сетевой мета-анализ могло повлиять на оценку общей эффективности эволокумаба по сравнению с плацебо.
2. В анализе не учтено изменение эффективности при титровании дозы алирокумаба.
3. В группах плацебо в исследованиях эволокумаба, включенных в мета-анализ, отмечалось выраженное повышение содержания холестерина ЛНП (почти на 13%) [51], в то время как в исследованиях алирокумаба уровни холестерина ЛНП в группах плацебо были стабильными или менялись очень незначительно [52,53].
4. Выбор временных интервалов для оценки эффективности не позволяет сравнить эффективность алирокумаба в этом анализе. Так, в программе ODYSSEY эффективность алирокумаба оценивали через 24 недели терапии [51]. Поскольку все данные по эффективности эволокумаба приведены для периода 10-12 недель, он теоретически получает дополнительные преимущества перед алирокумабом, так как для него не учитывается эффективность на большем временном горизонте.
5. В рассматриваемых исследованиях пациенты получали различную базовую терапию и значительно отличались по клинико-демографическим характеристикам, что не позволяет достоверно судить о сравнительной эффективности анализируемых препаратов.
6. В мета-анализе изменения уровня холестерина ЛНП сравнивали с контролем, а не с исходным уровнем, как это было сделано при оценке первичных конечных точке в анализируемых исследованиях.
Выводы
1. Включение алирокумаба в Перечень ОНЛС экономически обосновано. За 2 года применение алирокумаба должно снизить нагрузку на бюджет на 49,05% при лечении пациентов высокого сердечно-сосудистого риска, в том числе с семейной гиперхолестеринемией и рефрактерностью к гиполипидемической терапии по сравнению с лечением статинами и эзетимибом.
2. Полученный результат является устойчивым к росту цены на алирокумаб на 184% (в 2,89 раза).
3. Применение алирокумаба позволяет снизить бремя заболевания на 56,49%, или 7,78 млрд руб, в целевой группе за 2 года терапии по сравнению с текущей практикой лечения.
4. Курсовая стоимость лечения алирокумабом на 31,0% ниже таковой эволокумабом, что может позволить снизить затраты на лечение 1 пациента на 170 284 руб. в год и пролечить дополнительно 42% пациентов.
Используемые источники
- Bongard V, Dallongeville J, Arveiler D. et al. Attainment of low-density lipoprotein cholesterol target in the French general population according to levels of cardiovascular risk: insights from the MONA LISA study. Arch Cardiovasc Dis 2013;106(2):93–102.
- Bruckert E, Ferrières J. Evidence supporting primary prevention of cardiovascular diseases with statins: gaps between updated clinical results and actual practice. Arch Cardiovasc Dis 2014;107(3):188–200.
- Antiochos P, Marques-Vidal P, Waeber G, Vollenweider P. Five year trends in dyslipidaemia prevalence and management in Switzerland: the CoLaus study. Nutr Metab Cardiovasc Dis 2015;25(11):1007–15.
- Yan AT, Yan RT, Tan M, et al. Contemporary management of dyslipidemia in high-risk patients: targets still not met. Am J Med 2006;119(8):676–83.
- Joy TR, Hegele R. A. Narrative review: statin-related myopathy. Ann Intern Med 2009;150(12):858–68.
- Fernandez G, Spatz E. S, Jablecki C, Phillips PS. Statin myopathy: a common dilemma not reflected in clinical trials. Cleve Clin J Med 2011;78(6):393–403.
- Nielsen SF, Nordestgaard BG. Negative statin-related news stories decrease statin persistence and increase myocardial infarction and cardiovascular mortality: a nationwide prospective cohort study. Eur Heart J 2016;37(11):908-16.
- Bittner V, Deng L, Rosenson RS, et al. Trends in the use of nonstatin lipid-lowering therapy among patients with coronary heart disease: a retrospective cohort study in the medicare population 2007 to 2011. J Am Coll Cardiol 2015;66(17): 1864–72.
- Gamboa CM, Safford MM, Levitan EB, et al. Statin underuse and low prevalence of LDL-C control among US adults at high risk of coronary heart disease. Am J Med Sci 2014;348(2):108–14.
- Толпыгина С.Н., Марцевич С.Ю. Изучение динамики частоты приема основных классов лекарственных препаратов, показанных при лечении пациентов с хронической ишемической болезнью сердца, с 2004 по 2014 г. данные регистра прогноз ИБС. Клиницист 2016;10(1): 29-35.
- Vonbank A, Agewall S, Kjeldsen KP, et al. Comprehensive efforts to increase adherence to statin therapy. Eur Heart . 2017 Jan 10. pii: ehw628.
- Krempf M, Simpson RJ, Ramey DR, et al. Patient and physician factors influence decision-making in hypercholesterolemia: a questionnaire-based survey. Lipids Health Dis 2015;14(1):45-7.
- Burggraaf B, Castro Cabezas M. Interventions in type 2 diabetes mellitus and cardiovascular mortality-An overview of clinical trials. Eur J Intern Med 2017;42:1-15.
- Дедов И.И., Александров А.A. Проблемы острого инфаркта миокарда у больных сахарным диабетом. Сахарный диабет 2008;1:4-10.
- Какорин С.В., Тулякова Э.В., Воронкова К.В., Мкртумян А.М. Острое нарушение мозгового кровообращения у больных сахарным диабетом 2 типа. Сахарный диабет 2013; (1):63–70.
- Sarwar N, Gao P, Seshasai SR, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010;375:2215–22.
- Simpson SH, Lin M, Eurich DT. Community pharmacy-based inducement programs associated with better medication adherence: a cohort study. Ann Pharmacother 2017;51(8):630-9.
- Ярбеков Р.Р., Чигогидзе Н.А., Сигаев И.Ю., Керен М.А. Ближайшая и отдаленная эффективность чрескожного коронарного вмешательства у больных ИБС с многососудистым поражением коронарных артерий и сахарным диабетом II типа. Анналы хирургии 2014; 5:21-26.
- Голухова Е.З., Кузнецова Е.В. Реваскуляризация миокарда у больных ИБС в сочетании с сахарным диабетом 2 типа: обзор современных технологий. Сахарный диабет 2016; 19(5):406-13.
- Wong ND, Rosenblit PD, Greenfield RS. Advances in dyslipidemia management for prevention of atherosclerosis: PCSK9 monoclonal antibody therapy and beyond. Cardiovasc Diagn Ther 2017;7 (Suppl 1):S11-20.
- Robinson JG, Farnier M, Krempf M. et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372(16):1489–99.
- El Shahawy M, Cannon CP, Blom DJ, et al. Efficacy and safety of Alirocumab versus ezetimibe over 2 years (from ODYSSEY COMBO II). Am J Cardiol 2017;17:31031-7.
- Farnier M, Colhoun HM, Sasiela WJ, et al. Long-term treatment adherence to the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab in 6 ODYSSEY Phase III clinical studies with treatment duration of 1 to 2 years. J Clin Lipidol 2017:S1933-2874.
- Silverman MG, Ference BA, Im K. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions. A systematic review and meta-analysis. JAMA 2016; 316(12):1289-97.
- Зырянов С.К., Дьяков И.Н. Клинико-экономическая экспертиза алирокумаба при рефрактерности к стандартной гиполипидемической терапии. Качественная клиническая практика 2016;4:4-13.
- Распоряжение Правительства Российской Федерации No2323-р от 23.10.2017.
- Farnier M, Gaudet D, Valcheva V, et al. Efficacy of alirocumab in high cardiovascular risk populations with or without heterozygous familial hypercholesterolemia: Pooled analysis of eight ODYSSEY Phase 3 clinical program trials. Intern J Cardiol 2016;223:750–7.
- Методические рекомендации по оценке влияния на бюджет в рамках реализации программы государственных гарантий бесплатного оказания гражданам медицинской помощи. М, ФГБУ “Центр экспертизы и контроля качества медицинской помощи”, 2016, 27С.
- Landmesser U, Chapman MJ, Farnier M, et al. on behalf of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). European Society of Cardiology/European Atherosclerosis Society Task Force consensus statement on proprotein convertase subtilisin/kexin type 9 inhibitors: practical guidance for use in patients at very high cardiovascular risk. Eur Heart J 2016;0:1–11. doi:10. 1093/eurheartj/ehw480.
- Nanchen D, Gencer B, Auer R. et al. Prevalence and management of familial hypercholesterolaemia in patients with acute coronary syndromes. Europ Heart J 2015;36:2438–45.
- Инструкция по медицинскому применению лекарственного препарата Пралуэнт.
- http://pharmindex. ru, дата обращения 13.12.2017.
- http://grls. rosminzdrav. ru, дата обращения к ресурсу 19.01.2018.
- Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи. Постановление Правительства РФ от 28.08.2014 N871.
- Moriarty PM, Parhofer KG, Babirak SP, et al. Alirocumab in patients with heterozygous familial hypercholesterolaemia undergoing lipoprotein apheresis: the ODYSSEY ESCAPE trial. Eur Heart J 2016;37(48):3588-95.
- О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 год и на плановый период 2019 и 2020 годов. Постановление Правительства РФ No1492 от 08.12.2017.
- Методические рекомендации по способам оплаты медицинской помощи за счет средств обязательного медицинского страхования. Минздрав России, Федеральный ФОМС. Утверждены на заседании рабочей группы МЗ РФ, протокол заседания No55/11/19 от 14.11.2017; http://www. ttfoms. tomsk. ru/document/ обращение к ресурсу 11.12.2017.
- Silverman MG, Ference BA, Im K, et al. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions: a systematic review and meta-analysis. JAMA 2016;316(12):1289-97.
- Тарифное соглашение на оплату медицинской помощи, оказываемой по территориальной программе обязательного медицинского страхования города Москвы на 2017 год от 29 декабря 2016 г.
- Приказ Минэкономразвития России No192, Минздравсоцразвития России No323н, Минфина России No 45н, Росстата No113 от 10. 04. 2012 «Об утверждении методологии расчета экономических потерь от смертности, заболеваемости и инвалидизации населения».
- Дедов И.И., Концевая А.В., Шестакова М.В. и др. Экономические затраты на сахарный диабет 2 типа и его основные сердечно-сосудистые осложнения в Российской Федерации. Сахарный диабет 2016;19(6):518-27.
- Концевая А.В., Калинина А.М., Колтунов И.Е., Оганов Р.Г. Социальноэкономический ущерб от острого коронарного синдрома в Pоссийской Федерации. РФК 2011;7(2):158-66.
- Инструкция по медицинскому применению лекарственного препарата Репата.
- Правила государственной регистрации и перерегистрации устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в Перечень ЖНВЛП. Утверждены Постановлением Правительства РФ No865 от 29.10.2010 в редакции Постановления No979 от 15.09.2015.
- http://www. health. gov. sk/Clanok?zuuc-201712-lieky; обращение к ресурсу 11.12.2017.
- http://www. cbr. ru/currency_base/daily. aspx?date_req=11.12.2017; обращение к ресурсу 11.12.2017.
- Фармакоэкономика и фармакоэпидемиология – практика примемлемых решений. Ред. В.Б.Герасимов, А.Л.Хохлов, О.И.Карпов. М.: Медицина, 2005, 352 с.
- Toth PP, Worthy G, Gandra SR, et al. Systematic review and network meta-analysis on the efficacy of evolocumab and other therapies for the management of lipid levels in hyperlipidemia. J Am Heart Assoc 2017;6(10).
- Raal F, Scott R, Somaratne R, et al. Low-density lipoprotein cholesterol-lowering effects of AMG 145, a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease in patients with heterozygous familial hypercholesterolemia: the Reduction of LDL-C with PCSK9 Inhibition in Heterozygous Familial Hypercholesterolemia Disorder (RUTHERFORD) randomized trial. Circulation 2012;126:2408–17.
- Raal FJ, Stein EA, Dufour R, et al. RUTHERFORD-2 Investigators. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. Lancet 2015;385:331–40.
- Robinson JG, Nedergaard BS, Rogers WJ, et al; for the LAPLACE-2 Investigators. Effect of evolocumab or ezetimibe added to moderateor high-intensity statin therapy on LDL-C lowering in patients with hypercholesterolemia: the LAPLACE-2 randomized clinical trial. JAMA 2014;311:1870–82.
- Kereiakes DJ, Robinson JG, Cannon CP, et al. Efficacy and safety of the PCSK9 inhibitor alirocumab among high cardiovascular risk patients on maximally tolerated statin therapy: the ODYSSEY COMBO I study. Am Heart J 2015;169: 906e915e13.
- Robinson JG, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372(16):148
Версия на английском языке
Инструкция по применению Репата
- Состав
- Показания к применению
- Противопоказания к применению
- Рекомендации по применению
- Применение при беременности и кормлении грудью
- Фармакологическое действие
- Побочные действия
- Особые указания
- Передозировка
- Лекарственное взаимодействие
- Условия отпуска
Состав
Активное вещество: 140 мг эволокумаба.
Вспомогательные вещества: пролин — 25 мг, уксусная кислота ледяная — 1,2 мг, Полисорбат 80 — 0,1 мг, натрия гидроксид — в количестве, необходимом для доведения pH до 5,0, вода для инъекций в количестве, необходимом для доведения объема до 1 мл.
Показания к применению Репата
-Первичная гиперлипидемия и смешанная дислипидемия
Репата назначается взрослым с первичной гиперлипидемией (гетерозиготной семейной и несемейной) и со смешанной дислипидемией (типы IIa, IIb, IV по классификации Фредриксона) в качестве дополнения к диете для снижения ХС-ЛПНП, общего в сочетании со статином или в сочетании со статином и другой гиполипидемической терапией (например, эзетимибом), или
-в монотерапии или в сочетании с другой гиполипидемической терапией у пациентов с непереносимостью статинов, или
-в монотерапии или в сочетании с другой гиполипидемической терапией у пациентов, у которых применение статинов считается нецелесообразным с клинической точки зрения.
-Гомозиготная семейная гиперхолестеринемия (ГоСГХС)
Репата показана для применения у взрослых пациентов и подростков в возрасте 12 лет и старше с ГоСГХС (тип IIa по классификации Фредриксона) для снижения концентраций ХС-ЛПНП, ОХ, АпоВ, и ХС не-ЛПВП в сочетании с другой гиполипидемической терапией (например, статинами, аферезом ЛПНП).
Противопоказания к применению Репата
-повышенная чувствительность к любому из компонентов препарата;
-беременность и период грудного вскармливания;
-возраст до 18 лет при первичной гиперлипидемии (гетерозиготной семейной и несемейной) и при смешанной дислипидемии;
-возраст до 12 лет при гомозиготной семейной гиперхолестеринемии.
С ОСТОРОЖНОСТЬЮ
Имеющиеся клинические данные у пациентов с перечисленными ниже заболеваниями в настоящий момент ограничены. Решение о назначении препарата Репата таким пациентам должно основываться на индивидуальной оценке потенциальной пользы применения препарата у таких пациентов и возможного риска (см. также раздел «ОСОБЫЕ УКАЗАНИЯ»):
-тяжелая печеночная недостаточность (класс С по классификации Чайлд-Пью);
-повышение активности креатинфосфокиназы (более чем в 3 раза по сравнению с верхней границей нормы);
-неконтролируемые нарушения функции щитовидной железы (повышение тиреотропного гормона (ТТГ) > 1.5 выше нормы и ниже нормы);
-нестабильная стенокардия;
-тяжелые аритмии (например, пароксизмальная желудочковая тахикардия, мерцание предсердий с быстрым вентрикулярным ответом, наджелудочковая тахикардия, неконтролируемая медикаментозно);
-неконтролируемая артериальная гипертензия (систолическое артериальное давление > 180 мм ртутного столба или диастолическое артериальное давление > 110 мм ртутного столба в покое);
-хроническая сердечная недостаточность (III и IV функциональные классы по классификации NYHA или фракция выброса левого желудочка менее30%);
-сахарный диабет 1 типа.
Рекомендации по применению
Перед началом терапии пациенты должны перейти к соответствующей гипохолестеринемичекой диете и соблюдать эту диету во время всего периода терапии препаратом Репата.
Первичная гиперлипидемия и смешанная дислипидемия
Взрослые: рекомендуемая доза препарата Репата составляет одна подкожная инъекция 140 мг каждые 2 недели или 420 мг ежемесячно. Обе дозы являются клинически эквивалентными. Один предварительно заполненный шприц (ПЗШ) или одна предварительно заполненная шприц-ручка (ПЗШР) содержат одну дозу 140 мг для режима дозирования раз в две недели. Три ПЗШ или три ПЗШР должны вводится последовательно в течение 30 минут для доставки дозы 420 мг при режиме дозирования раз в месяц.
Гомозиготная семейная гиперхолестеринемия
Взрослые и дети старше 12 лет: рекомендуемая доза препарата Репата составляет 420 мг раз в две недели или раз в месяц подкожно. Пациенты, получающие аферез, могут начать лечение с 420 мг каждые две недели в соответствии с графиком афереза. Три ПЗШ или три ПЗШР должны вводится последовательно в течение 30 минут для доставки дозы 420 мг при режимах дозирования раз в две недели или раз в месяц.
Особые группы пациентов
Пациенты с нарушениями функции почек
Не требуется коррекции режима дозирования (см. раздел «Фармакокинетика»).
Пациенты с нарушениями функции печени
Не требуется коррекции режима дозирования у пациентов с нарушениями функции печени слабой или умеренной степеней (классы А и В по классификации Чайлд-Пью т.е. не более 9 баллов по шкале Чайлд-Пью). Пациентов с тяжелыми нарушениями функции печени (класс С по классификации Чайлд-Пью) не включали в клинические исследования (см. раздел «ОСОБЫЕ УКАЗАНИЯ»).
Пожилые пациенты
Не отмечалось различий в эффективности и безопасности препарата у пожилых пациентов. Не требуется коррекции режима дозирования.
Дети
Эффективность и безопасность препарата Репата не изучалась у детей с первичной гиперлипидемией и смешанной дислипидемией. Четырнадцать подростков в возрасте 12 лет и старше были включены в исследования Го-СГХС. Не отмечено различий в эффективности и безопасности препарата у этих подростков и взрослых.
Инструкция по использованию
Следует оценить раствор перед введением на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении или изменении цвета, содержании мутных или окрашенных включений. Не встряхивать. Чтобы избежать дискомфорта в месте введения, следует согреть раствор до комнатной температуры (до 25°C) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца или предварительно заполненной шприц-ручки. ПЗШ или ПЗШР с остатками препарата выбросить. Любые количества неиспользованного препарата или неиспользованные материалы должны быть уничтожены в соответствии с местными требованиями.
Применение Репата при беременности и кормлении грудью
Беременность
Контролируемых исследований эволокумаба, включавших беременных, не проводилось, поэтому применение препарата Репата при беременности не рекомендуется. При диагностировании беременности прием препарата должен быть прекращен. В доклинических исследованиях на яванских макаках не отмечено влияния на эмбриофетальное или постнатальное развитие (вплоть до возраста 6 месяцев) при введении эволокумаба в течение беременности и экспозиции в 12 раз превышавшую достигнутую у пациентов при введении 420 мг ежемесячно.
Неизвестно, возможно ли негативное воздействие на плод у человека, поэтому препарат Репата может применяться только если потенциальная польза лечения для беременной превосходит возможный риск для плода. При комбинированной терапии со статинами или другими гиполипидемическими средствами (например, эзетимибом) у женщин детородного возраста, следует учитывать предосторожности, изложенные в одобренных инструкциях этих препаратов.
Грудное вскармливание
Неизвестно, выделяется ли эволокумаб с грудным молоком. Решение об отмене препарата или прекращении грудного вскармливания должно приниматься на основании оценки потенциальной пользы продолжения терапии для матери или возможного риска негативного влияния на новорожденного.
Фармакологическое действие
Механизм действия
Эволокумаб является полностью человеческим моноклональным иммуноглобулином G2 (IgG2), ингибирующим пропротеин конвертазу субтилизин/кексин типа 9 (PCSK9). Эволокумаб селективно и с высокой степенью аффинности связывается с PCSK9 и ингибирует связывание циркулирующей PCSK9 с рецептором липопротеинов низкой плотности (Р-ЛПНП) на поверхности клеток печени, таким образом предотвращая PCSK9-опосредованный распад Р-ЛПНП. Как результат, повышение экспрессии Р-ЛПНП в печени приводит к снижению сывороточной концентрации холестерина липопротеинов низкой плотности (ХС-ЛПНП).
Фармакодинамические свойства
Было показано, что у пациентов с первичной гиперлипидемией и смешанной дислипидемией эволокумаб снижает концентрации несвязанной PCSK9, ХС-ЛПНП, общего холестерина (ОХ), аполипопротеина B (АпоВ), холестерина липопротеинов невысокой плотности (ХС не-ЛПВП), холестерина липопротеинов очень низкой плотности (ХС-ЛПОНП), триглицеридов и липопротеина(а) (Лп[а]), повышает концентрации холестерина липопротеинов высокой плотности\0009(Хс-ЛПВП) и аполипопротеина A1(АпоА1), улучшая соотношение ОС/Хс-ЛПВП, АпоВ/аполипопротеин А1 (АпоА1).
Однократное подкожное введение 140 или 420 мг эволокумаба приводит к максимальной супрессии цикрулирующей несвязанной PCSK9 через 4 часа, что сопровождается снижением ХС-ЛПНП, достигающего среднего надира к 14 и 21 дню, соответственно. Изменения концентрации несвязанной PCSK9 и сывороточных липопротеинов обратимы после отмены эволокумаба. Не отмечено компенсаторного увеличения продукции PCSK9 и ХС-ЛПНП во время лечения, равно как и после выведения эволокумаба не отмечено повышения концентраций несвязанной PCSK9 или ХС-ЛПНП (нет «синдрома рикошета»). При режиме дозирования 140 мг эволокумаба каждые две недели или 420 мг эволокумаба раз в месяц максимальное снижение ХС-ЛПНП достигало от -72% до -57% от начальных значений по сравнению с плацебо. Режимы дозирования эквивалентны в отношении среднего снижения ХС-ЛПНП (среднее на неделях 10 и 12).
Аналогичное снижение ХС-ЛПНП наблюдалось как при применении эволокумаба в монотерапии, так и в составе комбинированной терапии с другими гиполипидемическими препаратами. Эффект в отношении снижения ХС-ЛПНП стабилен, максимальная продолжительность терапии в настоящий момент составляет 112 недель.
Внешние и внутренние факторы, такие как демографические характеристики, одновременно применяемая терапия, вариабельность лабораторных показателей и статус заболевания не влияют на ответ на терапию эволокумабом (см. раздел «Режим дозирования»).
Иммуногенность
Как и в случае любых других терапевтических протеинов, существует потенциальный риск развития иммуногенности.Иммуногенность определяли с помощью
иммунохемилюминисцентного связывания с целью обнаружения антител к эволокумабу. В случае выявления у пациентов при иммунологическом скрининге антител к эволокумабу дополнительно проводили биологический анализ для оценки того, являются ли эти антитела нейтрализующими.
В клинических исследованиях у 0.1% пациентов (7 из 4846 пациентов с первичной гиперхолестеринемией и смешанной дислипидемией и ни у одного из 80 пациентов с гомозиготной семейной гиперхолестеринемией [ГоСГХС]), получивших как минимум 1 дозу эволокумаба, обнаружены связывающие антитела (у 4 пациентов — транзиторные антитела). Для этих пациентов проводили дополнительный анализ на нейтрализующие антитела. Нейтрализующих антител не обнаружено ни у одного из пациентов. Обнаруженные связывающие антитела не приводили к изменению фармакокинетических параметров препарата, не влияли на терапевтический ответ или безопасность препарата. Клиническая эффективность и безопасность
Результаты клинических исследований эволокумаба доказывают, что ингибирование активности PCSK9 эволокумабом обеспечивает снижение концентрации ХС-ЛПНП в сыворотке и улучшение других показателей липидного обмена. Данные результаты демонстрируют стабильную эффективность эволокумаба в отношении улучшения показателей липидного обмена у пациентов с первичной гиперлипидемией (гетерозиготной семейной и несемейной) и смешанной дислипидемией и ГоСГХС во всех популяциях и с любым дизайном исследований.
Режимы дозирования 140 мг эволокумаба раз в две недели (Q2W) и 420 мг (QM) эволокумаба раз в месяц являются клинически эквивалентными у пациентов с первичной гиперхолестеринемией и смешанной дислипидемией в отношении снижения ХС-ЛПНП, общего холестерина, АпоB, ХС не-ЛПВП, ХС-ЛПОНП, триглицеридов и Лп(а); повышения концентрации ХС-ЛПВП и АпоA1 и улучшения соотношения общий холестерин/ХС-ЛПВП, АпоB/АпоA1.
В результате терапии эволокумабом было достигнуто снижение концентрации ХС-ЛПНП приблизительно на 55-75%, которое сохранялось на протяжении всего периода проведения долгосрочной терапии. Максимальный ответ достигался, как правило, через 12 недели после введения 140 мг раз Q2W и 420 мг QM, соответственно. У 80-85% пациентов, получавших эволокумаб в любой дозировке, наблюдалось снижение концентрации ХС-ЛПНП на более чем 50% в среднем к 10 — 12 неделям применения. Эволокумаб превосходил эзетимиб в отношении снижения концентрации ХС-ЛПНП, Применение эволокумаба 140 мг Q2W и 420 мг QM было эффективным во всех подгруппах, относящихся к плацебо и эзетимибу, при этом каких-либо значимых различий между подгруппами, определенными такими характеристиками пациентов как возраст, расовая принадлежность, пол, регион происхождения, индекс массы тела (ИМТ), степень риска по Национальной образовательной программе по холестерину (NCEP), доза и интенсивность статинов, статус курения, исходный риск развития ишемической болезни сердца (ИБС), ранняя ИБС в семейном анамнезе, переносимость или непереносимость глюкозы (т.е. сахарный диабет 2 типа, метаболический синдром или ни то, ни другое), артериальная гипертензия, исходная несвязанная PCSK9, исходная концентрация ХС-ЛПНП и исходная концентрация триглицеридов, не наблюдалось.
Результаты общего анализа эффективности в исследованиях ГоСГХС свидетельствуют о том, что эволокумаб эффективно снижал концентрации ХС-ЛПНП, общего холестерина, АпоB и ХС-неЛПВП у пациентов с ГоСГХС.
При долгосрочном лечении эволокумабом в дозах 420 мг QM и 420 мг Q2W наблюдался продолжительный терапевтический эффект, что подтверждается снижением концентрации ХС-ЛПНП приблизительно на 20% — 30% у пациентов c ГоСГХС, не получавших лечения аферезом, и приблизительно у 15% — 25% пациентов с ГоСГХС, получавших аферез. В целом, каких-либо различий в отношении безопасности или эффективности эволокумаба между группами в возрасте 12 лет и старше и взрослых пациентов с ГоСГХС не наблюдалось.
Соотношение пациентов с нежелательными явлениями было в целом сбалансированным между группами в течение всех 3 периодов сбора комплексного массива данных по безопасности, а также между подгруппами и схемами лечения. Не отмечалось каких-либо связанных с безопасностью проблем в отношении нежелательных явлений, сообщавшихся для других видов гиполипидемической терапии (т.е. эпизодов сахарного диабета, а также осложнений со стороны печени и мышечной ткани), а также явлений, которые теоретически могут быть сопряжены с ингибированием PCSK9/повышением экспрессии рецепторов ЛПНП (т.е. эпизоды развития гепатита С). Каких-либо признаков, свидетельствующих о риске развития нейрокогнитивных осложнений при применении эволокумаба, не наблюдалось. Нейрокогнитивные осложнения в исследованиях с контролем плацебо или активными контролями были сходными.
Виды и количество нежелательных явлений во всех исследованиях были сопоставимыми, как при применении эволокумаба в качестве монотерапии, так и в составе комбинированной терапии (со статинами в сочетании с эзетимибом или без него) или у пациентов с непереносимостью статинов.
Не было выявлено новых сигналов, касающихся безопасности препарата, при сравнительном изучении данных о нежелательных явлениях, развившихся в ходе исследований пациентов с ГоСГХС и данных о нежелательных явлениях, развившихся в исследованиях первичной гиперлипидемии (гетерозиготной семейной и несемейной) и смешанной дислипидемии.
Фармакокинетика
Фармакокинетика эволокумаба после подкожного введения демонстрирует нелинейный характер.
Всасывание
Медианная максимальная сывороточная концентрация достигалась в течение 3 — 4 дней с расчетной абсолютной биодоступностью 72% после однократной подкожной инъекции эволокумаба 140 мг или 420 мг здоровым добровольцам. Среднее значение максимальной концентрации (Cmax mean (SD)) составило 18.6 (7.3) мкг/мл после введения дозы 140 мг. Конечная площадь под кривой «концентрация-время» (AUClast) составила 188 (98.6) сутки»мкг/мл. Аналогичные значения Cmax и AUClast составили 59.0 (17.2) мкг/мл и 924 (346) сутки»мкг/мл, соответственно, после введения дозы 420 мг.
Распределение
Средний расчетный объем распределения в равновесном состоянии составил 3.3 (0.5) л после введения однократной дозы 420 мг эволокумаба внутривенно, что предполагает ограниченное распределение эволокумаба в ткани.
Метаболизм
Рассчитанное среднее системного клиренса составило 12 (2) мл/ч после внутривенного введения однократно 420 мг эволокумаба. Повторное подкожное введение эволокумаба на протяжении 12 недель в клинических исследованиях приводило к дозопропорциональному увеличению экспозиции для режимов дозирования 140 мг и больше. Приблизительно двух- и трехкратная кумуляция наблюдалась при минимальной сывороточной концентрации (Cmin [SD]) 7.21 [6.6]) при режимах дозирования 140 мг каждые 2 недели или 420 мг раз в месяц (Cmin [SD] 11.2 [10.8]). Минимальная сывороточная концентрация достигала состояния равновесия к 12 неделе дозирования. Расчетный эффективный период полувыведения эволокумаба составил от 11 до 17 дней. Не было отмечено изменений сывороточных концентраций эволокумаба в течение 124 недель, связанных со временем.
Выведение
Поскольку эволокумаб представляет собой полностью человеческое моноклональное антитело IgG2, клиренс эволокумаба обусловлен специфическим связыванием и образованием комплекса с целевым лигандом, PCSK9, равно как и стандартными путями клиренса IgG в ретикуло-эндотелиальной системе. Эволокумаб распадается до малых пептидов и аминокислот посредством этих путей катаболизма.
Увеличение клиренса приблизительно на 20% отмечено при комбинированном применении со статинами. Это увеличение частично обусловлено вызванным статинами увеличением концентраций PCSK9 и не оказывает негативного эффекта на фармакодинамику эволокумаба в отношении липидов. Фармакокинетический анализ в популяциях не выявил значимых различий в сывороточных концентрациях эволокумаба у пациентов с гиперхолестеринемией (семейной и несемейной), при одновременном приеме статинов.
Отдельные группы пациентов
Согласно результатам фармакокинетического анализа в популяциях не требуется коррекции дозы в зависимости от возраста, расы или пола. Масса тела влияет на фармакокинетику эволокумаба, однако значимо не влияет на гиполипидемический эффект эволокумаба. Следовательно, коррекции режима дозирования в зависимости от массы тела не требуется.
Фармакокинетический анализ в популяциях по объединенным данным клинических исследований не выявил различий в фармакокинетике препарата у пациентов с нарушениями функции почек слабой и умеренной степени по сравнению с пациентами с нормальной функцией почек.
Препарат вводили в виде одной подкожной инъекции 140 мг 8 пациентам со слабой степенью нарушения функции печени, 8 пациентам с умеренной степенью нарушения и 8 здоровым добровольцам. Экспозиция к эволокумабу снижалась на 40% — 50% по сравнению со здоровыми добровольцами. Тем не менее, базовые концентрации PCSK9, равно как и степень и время нейтрализации PCSK9 оставались схожими во всех трех группах. Таким образом, отмечался сходный эффект на снижение ХС-ЛПНП.
Побочные действия Репата
Заключение по профилю безопасности.
Данные, приведенные в таблице, описывают нежелательные реакции, о которых сообщалось в II и III фазах клинических исследований у пациентов с первичной гиперхолестеринемией и смешанной дислипидемией и гомозиготной семейной гиперхолестеринемией.
Следующая градация была использована для классификации нежелательных реакций: очень часто (> 1/10), часто (> 1/100, < 1/10), нечасто (> 1/1,000, < 1/100), редко (> 1/10,000, < 1/1,000) и очень редко (< 1/10,000), основываясь на частоте сообщений. В каждой группе частот и систем органов нежелательные явления приведены в порядке убывания серьезности.
Профиль безопасности в популяции Го-СГХС аналогичен таковому у пациентов с первичной гиперлипидемией и смешанной дислипидемией.
Инфекции и инвазии Грипп Часто
Назофарингит Часто
Инфекции верхних дыхательных путей Часто\0009\0009\0009
Со стороны системы пищеварения Тошнота Часто
Со стороны кожи и подкожных тканей Кожная сыпь Часто, Крапивница Нечасто
Со стороны мышечно-скелетной системы и соединительной ткани Боль в спине Часто, Артралгия Часто.
Общие нарушения и реакции в месте введения препарата Реакции в месте введения Часто,(боль, покраснение,гематома)\0009\0009
Особые указания
Перед началом терапии препаратом Репата следует оценить возможные вторичные причины гиперлипидемии или смешанной дислипидемии (например, сахарный диабет, гипотиреоз, нефротический синдром) и предпринять меры для адекватного контроля ассоциированных заболеваний.
Печеночная недостаточность
У пациентов с печеночной недостаточностью умеренной степени отмечалось снижение экспозиции к эволокумабу, что потенциально может привести к снижению эффекта в отношении ХС-ЛПНП. Пациенты с тяжелой печеночной недостаточностью (класс C по классификации Чайлд-Пью) не включались в клинические исследования.
Увеличение активности креатинфосфокиназы
Пациенты с активностью креатинфосфокиназы выше, чем в 3 раза по сравнению с верхней границей нормы, не включались в клинические исследования. Однако, в клинических исследованиях не обнаружено сигналов безопасности в виде нежелательных явлений со стороны мышц или повышения активности креатинфосфокиназы.
Нарушения функции щитовидной железы
Пациенты с неконтролируемыми нарушениями функции щитовидной железы (ТТГ > 1.5 выше и ниже нормы) не включались в клинические исследования до достижения адекватного контроля над заболеванием. Во время клинических исследований нежелательные явления гипотиреоза или гипертиреоза сообщались с приблизительно одинаковой частотой из всех групп лечения — менее 0,3%.
Нестабильная стенокардия
Пациенты с нестабильной стенокардией не включались в клинические исследования. Долгосрочные данные по безопасности применения эволокумаба из открытых фаз исследований показали, что риски основных сердечно-сосудистых событий и госпитализаций по поводу нестабильной стенокардии и сердечной недостаточности не увеличились (соотношение рисков 0,5 (95% ДИ 0.29, 0.86)).
Тяжелые аритмии
Пациенты с тяжелыми нарушениями сердечного ритма не включались в клинические исследования. Отдельная оценка нежелательных реакций со стороны сердца показала, что частота вновь возникших отклонений на электрокардиограммах была сравнима между группами эволокумаба и контрольными группами в исследованиях и сообщения о нежелательных явлениях со стороны сердца поступали редко. Сходные результаты получены при отдельном анализе нежелательных реакций, потенциально ассоциируемых с увеличением реполяризации. Проведенный анализ не выявил какого-либо влияния эволокумаба на интервал QT/QTc.
Артериальная гипертензия
Пациенты с неконтролируемой артериальной гипертензией (систолическое артериальное давление > 180 мм ртутного столба или диастолическое артериальное давление > 110 мм ртутного столба в покое) не включались в клинические исследования. Анализ средних изменений от исходных значений систолического и диастолического артериального давления не выявил каких-либо существенных различий в группах эволокумаба или контрольных группах в клинических исследованиях.
Хроническая сердечная недостаточность
Пациенты с хронической сердечной недостаточностью (III и IV функциональные классы по классификации NYHA) не включались в клинические исследования. Во время клинических исследований о нежелательных явлениях сердечной недостаточности или хронической сердечной недостаточности сообщалось с приблизительно одинаковой частотой из всех групп лечения — менее 0,3%. Долгосрочные данные по безопасности применения эволокумаба из открытых фаз исследований показали, что риски основных сердечно-сосудистых событий и госпитализаций по поводу нестабильной стенокардии и сердечной недостаточности не увеличились (соотношение рисков 0,5 (95% ДИ 0.29, 0.86)).
Сахарный диабет
Пациенты с сахарным диабетом 1 типа или декомпенсированным сахарным диабетом 2 типа (HbA1c > 8.5%) не включались в клинические исследования. Отдельная оценка нежелательных реакций показала, что изменения показателей гликозилированного гемоглобина и глюкозы натощак были сравнимыми во всех группах исследований. Не обнаружено клинически значимых отличий при анализе безопасности в подгруппе пациентов с сахарным диабетом 2 типа.
Применение в составе комбинированной терапии
При одновременном назначении препарата Репата с другими гиполипидемическими препаратами (например, эзетимиб, статины), следует учитывать противопоказания и особые указания, приведенные в одобренных инструкциях по применению других препаратов.
Влияние на способности к вождению автомобиля и работе с механизмами
Не проводилось исследований влияния на способности к управлению автотранспортными средствами и работе с механизмами, требующими повышенной концентрации внимания.
Колпачок для иглы ПЗШ и ПЗТТТР состоит из натуральной резины, полученной из латекса. Сообщите Вашему врачу, если у Вас аллергия на латекс.
Передозировка
Не сообщалось о случаях передозировки препарата, эффекты при передозировке неизвестны. Не существует специфического антидота при передозировке препарата. В случае передозировки — лечение-симптоматическое, поддерживающая терапия при необходимости.
Лекарственное взаимодействие
Изучения лекарственных взаимодействий не проводилось. Фармакокинетическое взаимодействие между статинами и эволокумабом оценивали в программе клинических исследований. Отмечалось приблизительно 20% увеличение клиренса эволокумаба при одновременном применении со статинами. Увеличенный клиренс обусловлен опосредованным статинами повышением концентрации PCSK9, что тем не менее не влияло на фармакодинамический эффект эволокумаба в отношении липидов. Не требуется коррекции доз статинов при одновременном назначении с препаратом Репата.
ФАРМАЦЕВТИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ
Лекарственный препарат не следует смешивать с другими лекарственными препаратами.
Условия отпуска
Отпускается по рецепту
По материалам Evolocumab [From the Medical Letter]. JAMA. doi: 10. 1001/jama. 2015. 14772. Sullivan D, Olsson AG, Scott R, et al. JAMA. 2012;308 (23): 2497-2506.
Shrank WH, Barlow JF, Brennan TA. JAMA. 2015;314 (14): 1443-1444.
Stein EA, Raal FJ. Curr Cardiol Rep. 2015;17 (11): 104.
Centers for Disease Control and Prevention
Новый тип лекарств для снижения уровня холестерина -ингибиторы PCSK9 (Evolocumab (INN, trade name Repatha)
Холестерин и сердечно-сосудистые заболевания
В кровотоке встречается несколько видов холестерина, к самым важным из них относятся: холестерин липопротеинов низкой плотности (ЛПНП), так называемый «плохой» холестерин, и холестерин липопротеинов высокой плотности (ЛПВП), который считают «хорошим». Высокая концентрация холестерина в крови обычно связана с высокой концентрацией ЛПНП. Высокая концентрация ЛПНП повышает риск появления бляшек внутри кровеносных сосудов, то есть заболевания под названием атеросклероз. Атеросклероз сосудов сердца или мозга может быть причиной инфарктов и инсультов, которые представляют собой 2 вида сердечно-сосудистых заболеваний). В настоящее время сердечно-сосудистые заболевания являются главной причиной смерти людей в США.
Снижение уровня холестерина за счет изменения образа жизни и приема соответствующих лекарств помогает уменьшить риск развития сердечно-сосудистых заболеваний и смерти от таких заболеваний. Некоторым людям будет достаточно здоровой диеты и регулярной физической нагрузки, другим могут потребоваться лекарства. Наиболее распространенные лекарства, применяемые для снижения уровня холестерина — статины, но у некоторых людей с высоким уровнем холестерина они не обеспечивают необходимого снижения уровня. Другие пациенты не могут принимать статины из-за побочных эффектов таких, как мышечная боль и проблемы с печенью.
Ингибиторы PCSK9: Новое лечение
Ингибиторы PCSK9 —это моноклональные антитела, белки, разработанные и созданные в лаборатории специально для распознавания другого белка и связывания с ним. Мишенью ингибиторов PCSK9 является белок, называемый PCSK9, который повышает концентрации ЛПНП. Когда ингибитор PCSK9 связывается с белком PCSK9, он останавливает его работу и снижает уровень ЛПНП.
Клинические испытания показали, что ингибиторы PCSK9 эффективно снижают концентрации ЛПНП. Три исследования, опубликованные в апреле 2015 г. , показали, что у пациентов, получавших стандартную терапию статинами для снижения уровня холестерина, при добавлении ингибитора PCSK9 уровень ЛПНП снижался на 60 %. В настоящее время Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration) США разрешено применение двух ингибиторов PCSK9: алирокумаба и эволокумаба. Их вводят под кожу каждые 2-4 недели, в форме таблеток для перорального применения они недоступны. Эти препараты значительно дороже, чем другие лекарства для снижения уровня холестерина.
Применение новых препаратов крайне ограничено. Ингибиторы PCSK9 можно применять вместе со статинам у людей с сердечно-сосудистыми заболеваниями с очень высоким риском инсульта или инфаркта, у которых не удается снизить уровень ЛПНП одними статинами. Также их можно применять вместо статинов при лечении пациентов, страдающих от серьезных побочных эффектов статинов. Кроме того, их можно применять у людей с очень высоким уровнем ЛПНП из-за генетического заболевания под названием семейная гиперхолестеринемия.
Будущие направления
Хотя снижение уровня ЛПНП и полезно, важно знать, способны ли ингибиторы PCSK9 улучшать результаты лечения сердечно-сосудистых заболеваний, то есть способны ли они снижать частоту инфарктов и инсультов и предотвращать развитие сердечной недостаточности. На данный момент утвердительные клинические данные отсутствуют. Сейчас проводятся исследования, делающие акцент на долгосрочных результатах лечения сердечно-сосудистых заболеваний, и результаты этих исследований в последующие несколько лет можно будет важны для определения того, станут ли ингибиторы PCSK9 применяться более широко в составе схем для снижения высокого уровня холестерина.
22 декабря 2015 г.
