Фириалта — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер: ЛП-№(002030)-(РГ-RU) от 23.03.2023
Листок-вкладыш – информация для пациента
Firialta®, 10 мг, таблетки, покрытые пленочной оболочкой
Фириалта®, 20 мг, таблетки, покрытые пленочной оболочкой
Действующее вещество: финеренон микронизированный
▼ Лекарственный препарат подлежит дополнительному мониторингу, который способствует быстрому выявлению новых сведений о безопасности. Вы можете помочь, сообщая информацию о любых нежелательных реакциях, которые возникли в период применения лекарственного препарата (в том числе и о случаях его неэффективности). Способ сообщения о нежелательных реакциях описан в разделе 4 листка-вкладыша.
Перед приемом препарата полностью прочитайте листок-вкладыш, поскольку в нем содержатся важные для Вас сведения.
- Сохраните этот листок-вкладыш. Возможно, Вам потребуется прочитать его еще раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к Вашему лечащему врачу или работнику аптеки.
- Препарат назначен именно Вам. Не передавайте его другим людям. Он может навредить им, даже если симптомы их заболевания совпадают с Вашими.
- Если у Вас возникли какие-либо нежелательные реакции, обратитесь к Вашему лечащему врачу или работнику аптеки. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в разделе 4 листка-вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат Фириалта®, и для чего его применяют
- О чем следует знать перед приемом препарата Фириалта®
- Прием препарата Фириалта®
- Возможные нежелательные реакции
- Хранение препарата Фириалта®
- Содержимое упаковки и прочие сведения
1. Что из себя представляет препарат Фириалта®, и для чего его применяют
Препарат Фириалта® содержит действующее вещество финеренон – блокатор рецепторов гормона альдостерона.
Показания к применению
Препарат Фириалта® применяется для лечения хронической болезни почек (стадия 3 и 4 с повышенным количеством белка альбумина в моче) у взрослых с сахарным диабетом 2 типа.
Хроническая болезнь почек – это заболевание почек, которое протекает длительное время и которое связано с тем, что почки не выполняют должным образом свои функции, а именно все хуже выводят продукты обмена веществ и жидкость из организма.
Сахарный диабет 2 типа – это заболевание, при котором организм не может поддерживать нормальную концентрацию сахара в крови. Ваш организм не вырабатывает достаточного количества гормона инсулина или он не оказывает необходимого действия. Это приводит к высокому содержанию сахара в крови.
Способ действия препарата Фириалта®
Действующее вещество препарата Фириалта® – финеренон – блокирует действие определенных гормонов (минералокортикоиды), которые могут повредить Ваши почки и сердце.
Если улучшение не наступило или Вы чувствуете ухудшение, необходимо обратиться к врачу.
2. О чем следует знать перед приемом препарата Фириалта®
Противопоказания
Не принимайте препарат Фириалта®. если:
- у Вас аллергия на финеренон или любой другой из компонентов состава данного лекарственного препарата (перечисленные в разделе 6).
- Вы принимаете лекарства, которые относятся к группе мощных ингибиторов CYP3A4, например:
- итраконазол или кетоконазол (для лечения грибковых инфекций),
- ритонавир, нелфинавир или кобицистат (для лечения ВИЧ-инфекции),
- кларитромицин, телитромицин (для лечения бактериальных инфекций),
- нефазодон (для лечения депрессии).
- у Вас болезнь Аддисона (когда Ваше тело не вырабатывает достаточное количество гормонов кортизола и альдостерона).
Если Вы считаете, что любое из перечисленного относится к Вам, сообщите об этом Вашему лечащему врачу.
Особые указания и меры предосторожности
Перед приемом препарата Фириалта® проконсультируйтесь с лечащим врачом или работником аптеки. Обязательно предупредите Вашего лечащего врача, если что-либо из нижеуказанных пунктов относится к Вам:
- высокая концентрация калия в крови или если этот факт имел место быть у Вас ранее,
- тяжелое снижение функции почек или почечная недостаточность,
- умеренные или тяжелые заболевания печени,
- легкая, умеренная или тяжелая сердечная недостаточность. Сердечная недостаточность – серьезное заболевание, при котором сердце не справляется со своей функцией. Это означает, что кровь не доставляет органам и тканям столько кислорода и питательных веществ, сколько требуется для их нормальной работы.
Анализы крови
Анализы крови позволяют оценить концентрацию калия и то, как работают Ваши почки. Ваш лечащий врач назначит Вам анализы крови, чтобы по их результатам принять решение о возможности начала приема препарата Фириалта®.
После 4 недель приема препарата Фириалта® Вам назначат дополнительные анализы крови. Также Ваш лечащий врач может назначить дополнительные анализы крови, чтобы оценить концентрацию калия и то, как работают Ваши почки из-за приема других препаратов.
Дети и подростки
Не давайте препарат Фириалта® детям от 0 до 18 лет, поскольку безопасность и эффективность применения лекарственного препарата Фириалта® у детей и подростков не установлены. Данные отсутствуют.
Другие препараты и препарат Фириалта®
Сообщите Вашему лечащему врачу или работнику аптеки, если Вы принимаете в настоящее время, принимали недавно или можете начать принимать какие-либо другие лекарственные препараты. Ваш лечащий врач решит, какие лекарственные препараты Вы можете принимать. Для этого Ваш лечащий врач может снова проверить Вашу кровь.
Вам не следует принимать препараты, которые относятся к группе мощных ингибиторов CYP3A4, во время приема препарата Фириалта® (см. раздел 2 «Не принимайте препарат Фириалта®»).
Особенно важно сообщить своему лечащему врачу или работнику аптеки о приеме следующих препаратов:
- амилорид или триамтерен (для выведения лишней воды из организма с мочой),
- эплеренон, эсаксеренон, спиронолактон или канренон (лекарственные препараты, схожие с финереноном),
- триметоприм или комбинация триметоприма и сульфаметоксазола (для лечения бактериальных инфекций),
- добавки калия, включая некоторые заменители соли, или другие лекарственные препараты, которые могут повышать концентрацию калия в Вашей крови. Это может быть небезопасно для Вас.
Также обязательно сообщите врачу, что Вы принимаете:
- эритромицин (для лечения бактериальных инфекций),
- верапамил (для лечения высокого артериального давления, загрудинной боли и учащенного сердцебиения),
- флувоксамин (для лечения депрессии и обсессивно-компульсивного расстройства),
- рифампицин (для лечения бактериальных инфекций),
- карбамазепин, фенитоин или фенобарбитал (для лечения эпилепсии),
- зверобой (растительный препарат, используемый для лечения депрессии),
- эфавиренз (для лечения ВИЧ-инфекции), или другие лекарственные препараты, которые принадлежат к тем же группам лекарств (определенные «ингибиторы CYP3 А4» и «индукторы»). У Вас может быть больше нежелательных реакций, или препарат Фириалта® может работать не так, как ожидалось.
Если Вы принимаете другие препараты для снижения артериального давления, врачу может потребоваться контролировать Ваше артериальное давление.
Препарат Фириалта® с пищей и напитками
Не употребляйте грейпфрут и грейпфрутовый сок во время приема препарата Фириалта®, так как у Вас может оказаться слишком много финеренона в крови и могут возникнуть нежелательные реакции (которые перечислены в разделе 4 «Возможные нежелательные реакции»).
Беременность, грудное вскармливание и фертильность
Если Вы беременны или кормите грудью, думаете, что забеременели, или планируете беременность, перед началом применения препарата проконсультируйтесь с Вашим лечащим врачом или работником аптеки.
Беременность
Препарат Фириалта® не следует применять во время беременности, поскольку данное лекарственное средство может нанести вред еще не родившемуся ребенку.
При необходимости применения препарата во время беременности Ваш лечащий врач обсудит это с Вами.
Исследования эмбриофетотоксичности на животных показали, что финеренон оказывает токсическое влияние на плод при воздействии доз, значимо превышающих рекомендованные для человека. Вам следует использовать надежные противозачаточные средства. Ваш лечащий врач объяснит Вам, какие противозачаточные средства Вам следует использовать.
Грудное вскармливание
Вы не должны кормить грудью, пока принимаете этот лекарственный препарат. Это может навредить Вашему ребенку.
Фертильность
Нет данных о влиянии финеренона на фертильность (способность к деторождению) человека.
Исследования на животных показали снижение фертильности самок при воздействии, значимо превышающем максимально рекомендованное инструкцией воздействие на человека, что указывает на низкое клиническое значение.
Управление транспортными средствами и работа с механизмами
Препарат Фириалта® не оказывает влияния на Вашу способность управлять транспортными средствами или работать с механизмами.
Препарат Фириалта® содержит лактозы моногидрат
Если у вас непереносимость некоторых сахаров, обратитесь к лечащему врачу перед приемом данного лекарственного препарата.
Препарат Фириалта® содержит натрий
Данный препарат содержит менее 1 ммоль (23 мг) натрия на одну таблетку, то есть практически не содержит натрия.
3. Прием препарата Фириалта®
Всегда принимайте препарат Фириалта® в полном соответствии с рекомендациями лечащего врача или работника аптеки. При появлении сомнений проконсультируйтесь с лечащим врачом или работником аптеки.
Рекомендуемая доза
Рекомендованная максимальная суточная доза составляет 1 таблетка 20 мг.
- Всегда принимайте по 1 таблетке один раз в день. Каждая таблетка содержит 10 мг или 20 мг финеренона.
- Начальная доза препарата зависит от того, насколько хорошо работают Ваши почки. Чтобы проверить это, Вашему лечащему врачу необходимо оценить Ваши анализы крови. Результаты анализов помогут врачу решить, можете ли Вы начать с 1 таблетки 20 мг или 1 таблетки 10 мг один раз в день.
- Спустя 4 недели лечащий врач снова проверит Ваши анализы крови и примет решение о корректировке дозы. Это может быть 1 таблетка 20 мг или 1 таблетка 10 мг один раз в день. Ваш лечащий врач может также порекомендовать Вам прервать или прекратить прием препарата Фириалта®.
Ваш лечащий врач может принять решение об изменении Вашего лечения по результатам анализа крови. См. «Анализы крови» в разделе 2 «О чем следует знать перед приемом препарата Фириалта®» для получения дополнительной информации.
Способ применения
Препарат Фириалта® предназначен для приема внутрь. Принимайте препарат Фириалта® каждый день в одно и то же время. Так Вам будет легче запомнить порядок приема.
Глотайте таблетку целиком.
- Можно запивать стаканом воды.
- Вы можете принимать таблетку вне зависимости от приема пищи.
- Не принимайте таблетку с грейпфрутовым соком или грейпфрутом. См. «Препарат Фириалта® с пищей и напитками» в разделе 2 «О чем следует знать перед приемом препарата Фириалта®» для дополнительной информации.
Если Вы не можете проглотить таблетку целиком, ее можно измельчить. Смешайте измельченную таблетку с водой или мягкой пищей, например, с яблочным пюре и сразу же примите.
Продолжительность применения
Продолжительность применения препарата Фириалта® определяется лечащим врачом на основании результатов анализов крови.
Если Вы приняли препарата Фириалта® больше, чем следовало
Проконсультируйтесь со своим лечащим врачом или работником аптеки, если Вы приняли слишком большую дозу препарата.
Если Вы забыли принять препарат Фириалта®
Если Вы забыли принять таблетку препарата и вспомнили об этом в этот же день, то примите ее сразу, как только заметили.
Если Вы забыли принять таблетку препарата и вспомнили об этом на следующий день, то примите одну таблетку в Ваше обычное время.
Не принимайте две таблетки в один день, чтобы восполнить пропущенную таблетку.
Если Вы прекратили прием препарата Фириалта®
Не прекращайте применение препарата Фириалта® без предварительной консультации с Вашим лечащим врачом.
Ваш лечащий врач может принять решение о прекращении приема препарата после оценки Вашего анализа крови.
При наличии вопросов по применению препарата обратитесь к лечащему врачу или работнику аптеки.
4. Возможные нежелательные реакции
Описание нежелательных реакций
Подобно всем лекарственным препаратам препарат Фириалта® может вызывать нежелательные реакции, однако они возникают не у всех.
Нежелательные реакции, которые определяются врачом по результатам анализа крови:
Очень часто (могут возникать более чем у 1 человека из 10):
- высокая концентрация калия (гиперкалиемия).
Возможные признаки высокой концентрации калия в крови могут включать в себя слабость или утомляемость, тошноту, онемение рук и губ, мышечные судороги, снижение частоты пульса.
Часто (могут возникать менее чем у 1 человека из 10):
- низкая концентрация натрия (гипонатриемия).
Возможные признаки низкой концентрации натрия в крови: тошнота, усталость, головная боль, спутанность сознания; мышечная слабость, спазмы или судороги. - снижение фильтрационной функции почек (снижение скорости клубочковой фильтрации).
Нечасто (могут возникать менее чем у 1 человека из 100):
- снижение концентрации белка (гемоглобина), который содержится в клетках крови.
Другие нежелательные реакции:
Часто (могут возникать у менее чем 1 человека из 10):
- низкое кровяное давление (гипотензия),
Возможные признаки низкого кровяного давления могут включать в себя головокружение, дурноту, обмороки. - зуд.
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом или работником аптеки. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую (см. ниже). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
Адрес: 109012, Москва, Славянская площадь, д. 4, стр. 1, Россия
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
https: //roszdravnadzor. gov.ru/
Республика Казахстан
Адрес: 010000, г. Астана, район Байконыр, ул. А. Иманова, 13 (БЦ «Нурсаулет 2»), Казахстан
«Национальный центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан
ndda.kz
Республика Беларусь
Адрес: 220037, г. Минск, Товарищеский пер., 2а, Беларусь
РУП «Центр экспертиз и испытаний в здравоохранении»
rceth.by
Республика Армения
Адрес: 0051, г. Ереван, пр. Комитаса 49/5, Армения
АОЗТ «Научный центр экспертизы лекарств и медицинских технологий им. академика Э. Габриеляна» М3 РА
pharm.am
5. Хранение препарата Фириалта®
Храните препарат в недоступном для ребенка месте так, чтобы ребенок не мог увидеть его.
Не применяйте препарат после истечения срока годности, указанного на этикетке блистера и упаковке после слов «Годен до:». Датой истечения срока годности является последнее число указанного месяца.
Лекарственный препарат не требует специальных условий хранения.
Не выбрасывайте какие-либо препараты в канализацию или с бытовыми отходами. Уточните у работника аптеки, как следует утилизировать (уничтожать) препарат, который больше не потребуется. Эти меры позволят защитить окружающую среду.
6. Содержимое упаковки и прочие сведения
Препарат Фириалта® содержит:
Действующим веществом является финеренон микронизированный.
Фириалта®, 10 мг, таблетки, покрытые пленочной оболочкой
Каждая таблетка содержит 10 миллиграмм финеренона микронизированного.
Прочими ингредиентами (вспомогательными веществами) являются целлюлоза микрокристаллическая, натрия кроскармеллоза, гипромеллоза 5 сР, лактозы моногидрат, магния стеарат, натрия лаурилсульфат; пленочная оболочка: лак светло-розовый или альтернативно: железа оксид красный (Е 172), гипромеллоза 5 сР, тальк, титана диоксид.
Фириалта®, 20 мг, таблетки, покрытые пленочной оболочкой
Каждая таблетка содержит 20 миллиграмм финеренона микронизированного.
Прочими ингредиентами (вспомогательными веществами) являются целлюлоза микрокристаллическая, натрия кроскармеллоза, гипромеллоза 5 сР, лактозы моногидрат, магния стеарат, натрия лаурилсульфат; пленочная оболочка: лак светло-желтый или альтернативно: железа оксид желтый (Е 172), гипромеллоза 5 сР, тальк, титана диоксид.
См. «Препарат Фириалта® содержит лактозы моногидрат» и «Препарат Фириалта® содержит натрий» в разделе 2 для получения дополнительной информации.
Внешний вид препарата Фириалгга® и содержимое упаковки
Таблетки, покрытые пленочной оболочкой.
Фириалта®, 10 мг, таблетки, покрытые пленочной оболочкой:
Препарат представляет собой розовые, овально-продолговатые таблетки, покрытые пленочной оболочкой, с маркировкой «10» на одной стороне и «FI» на другой стороне. На поперечном разрезе однородная масса белого цвета, окруженная оболочкой розового цвета.
Фириалта®, 20мг, таблетки, покрытые пленочной оболочкой:
Препарат представляет собой коричневато-желтые, овально-продолговатые таблетки, покрытые пленочной оболочкой, с маркировкой «20» на одной стороне и «FI» на другой стороне. На поперечном разрезе однородная масса белого цвета, окруженная оболочкой коричневато-желтого цвета.
По 14 или по 10 таблеток в ПВХ/ПВДХ/Ал блистер. По 1, 2 или 7 блистеров по 14 таблеток или 10 блистеров по 10 таблеток вместе с листком-вкладышем в картонную пачку, имеющую контроль первого вскрытия.
Держатель регистрационного удостоверения
Байер АГ, Кайзер-Вильгельм-Аллее, 1, 51373 Леверкузен, Германия
Bayer AG, Kaiser-Wilhelm-Allee, 1, 51373 Leverkusen, Germany
Производитель
Байер АГ, Кайзер-Вильгельм-Аллее, 51368 Леверкузен, Германия
Bayer AG, Kaiser-Wilhelm-Allee, 51368 Leverkusen, Germany
Для получения любой информации о лекарственном препарате, а также в случаях возникновения претензий следует обращаться к местному представителю держателя регистрационного удостоверения:
Российская Федерация:
АО «БАЙЕР»
107113 Москва, 3-я Рыбинская ул., д. 18, стр. 2.
www.bayer.ru
Республика Казахстан:
ТОО «Байер К АЗ»
050057 .Алматы, ул. Тимирязева, 42, пав. 15, офис 301
www.bayer.ru
Республика Армения
ООО ‘’ЭМ ДЖИ ЭФ Груп”, агент Байер АГ
0002 г. Ереван, ул. Туманяна 23, офис 10
www.bayer.ru
В случаях возникновения претензий на территории Республики Беларуси следует обращаться:
Республика Беларусь
220089 г. Минск, пр. Дзержинского 57, помещение 54
www.bayer.ru
Листок-вкладыш пересмотрен
Прочие источники информации
Подробные сведения о данном препарате содержатся на веб-сайте Союза (eec.eaeunion.org). Листок-вкладыш доступен на всех языках Союза на веб-сайте Союза.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Таблетки, покрытые пленочной оболочкой розового цвета, овально-продолговатые, с маркировкой «10» на одной стороне и «FI» на другой стороне; на поперечном разрезе однородная масса белого цвета, окруженная оболочкой розового цвета.
Вспомогательные вещества: целлюлоза микрокристаллическая, натрия кроскармеллоза, гипромеллоза 5 cP, лактозы моногидрат, магния стеарат, натрия лаурилсульфат; пленочная оболочка: лак светло-розовый или альтернативно: железа оксид красный (E172), гипромеллоза 5 cP, тальк, титана диоксид.
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (2) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (7) — пачки картонные с контролем первого вскрытия.
Таблетки, покрытые пленочной оболочкой коричневато-желтого цвета, овально-продолговатые, с маркировкой «20» на одной стороне и «FI» на другой стороне; на поперечном разрезе однородная масса белого цвета, окруженная оболочкой коричневато-желтого цвета.
Вспомогательные вещества: целлюлоза микрокристаллическая, натрия кроскармеллоза, гипромеллоза 5 cP, лактозы моногидрат, магния стеарат, натрия лаурилсульфат; пленочная оболочка: лак светло-желтый или альтернативно: железа оксид желтый (E172), гипромеллоза 5 cP, тальк, титана диоксид.
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (2) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (7) — пачки картонные с контролем первого вскрытия.
Финеренон
Finerenone
Фармакологическое действие
Финеренон — мощный и селективный нестероидный антагонист минералокортикоидных рецепторов (MRA) Ⅲ поколения. Подавление сверхактивности MRA, вызванной альдостероном и гидрокортизоном, приводит к сдерживанию патологических процессов воспаления, фиброза, роста артериального давления, желудочковой гипертрофии.
В отличие от всех существующих MRA-блокаторов, таких как спиронолактон, эплеренон или канренон, финеренон характеризуется уникальным фармакологическим профилем:
- финеренон не затрагивает глюкокортикоидные, андрогеновые, прогестероновые и эстрогеновые рецепторы, тем самым приводит к меньшему количеству побочных эффектов, таких как гинекомастия, импотенция, снижение либидо;
- финеренон не относится к стероидным средствам (он является производным дигидропиридина), что позволяет ему с высокой аффинностью связываться с MRA и более эффективно подавлять транскрипционные коактиваторы, участвующие в экспрессии гипертрофических и профиброзных генов;
- финеренон относительно равномерно распределяется между сердечной и почечной тканями.
Фармакокинетика
Всасывание
Биодоступность при пероральном применении составляет 44 %. Максимальная концентрация в плазме крови (Cmax) — 160 мкг/л. Время достижения максимальной плазменной концентрации (TCmax) — 0,5–1,25 часа. AUC (Area under the plasma drug concentration-time curve — площадь под кривой «концентрация-время») 686 мкг/л.
Распределение
Связь с белками плазмы — 92 % (в основном с альбумином). Объём распределения (Vd
Биотрансформация
В первую очередь метаболизируется CYP3A4 (90%) и в меньшей степени CYP2C8 (10 %) до неактивных метаболитов.
Выведение
Период полувыведения (T½) — 2–3 часа. Элиминация — 80 % с мочой (<1 % в неизменённом виде), около 20 % с фекалиями (<0,2 % в неизменённом виде).
Показания
Для уменьшения риска снижения функции почек, почечной недостаточности, смерти от сердечно-сосудистых заболеваний, нефатальных сердечных приступов и госпитализации по поводу сердечной недостаточности у взрослых с хроническим заболеванием почек, связанным с диабетом 2 типа.
Противопоказания
- Гиперчувствительность;
- болезнь Аддисона;
- одновременное применение с сильными ингибиторами CYP3A4;
- надпочечниковая недостаточность;
- одновременный приём грейпфрута или грейпфрутового сока;
- отсутствие адекватных методов контрацепции;
- беременность;
- лактация;
- возраст до 18 лет.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и хорошо контролируемых исследований о возможности применения финеренона у беременных женщин не проведено.
Исследования проведённые на животных выявили признаки токсичности для плод при воздействии доз, примерно в 4 раза превышающих максимально рекомендованную для человека, клиническое значение этих данных неясно.
Применение противопоказано.
Женщины с сохранённой детородной функцией
Перед началом лечения необходимо проверить статус беременности у женщин репродуктивного возраста.
Женщины с сохранённой детородной функцией должны использовать надёжные методы контрацепции во время терапии финереноном.
Применение в период грудного вскармливания
Специальных исследований о возможности применения финеренона в период грудного вскармливания не проведено.
Неизвестно, выделяется ли финеренон в грудное человеческое молоко. Рекомендуется избегать грудного вскармливания в течение применения и как минимум в течение 1 дня после последней дозы препарата.
Фертильность
Данные о возможном влиянии финеренона на фертильность у человека отсутствуют.
Исследования на животных показали снижение фертильности самок при воздействии, значимо превышающем максимально рекомендованное инструкцией воздействие на человека, что указывает на низкое клиническое значение.
Применение в детском возрасте
Эффективность и безопасность у детей и подростков не установлены.
Способ применения и дозы
Перорально (внутрь).
20 мг 1 раз в стуки.
Побочные действия
Определение частоты побочных эффектов: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1 000 и <1/100); редко (≥1/10 000 и <1/1 000); очень редко (<1/10 000, включая отдельные случаи).
Очень часто — гиперкалиемия (18,3 %).
Часто — гипотония (4,8 %), гипонатриемия (1,4 %).
Нечасто — анемия.
Меры предосторожности
Финеренон может вызвать гиперкалиемию.
Рекомендуется проведение мониторинга сывороточного калия перед началом и в период терапии.
Влияние на способность к вождению автотранспорта и управлению механизмами
Данные о неблагоприятном воздействии финеренона на способность управлять транспортными средствами и механизмами отсутствуют.
Классификация
-
АТХ
C03DA05
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Финеренон предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Финеренон, содержатся в инструкции производителя, прилагаемой к упаковке.
Сердечно-сосудистые заболевания (ССЗ) – ведущая причина смерти в мире. Сочетание ССЗ с сахарным диабетом (СД) и поражением почек во много раз утяжеляет состояние больных и увеличивает риск смерти. Обязательными для таких пациентов являются изменение образа жизни, назначение гипотензивной терапии, а также терапии, корректирующей гиперлипидемию и гликемию.
В последние годы привлекают внимание и другие патогенетические механизмы поражения органов-мишеней, на которые можно воздействовать. Установлено, что минералокортикоидные рецепторы (МКР) и их высокая активность вносят серьезный вклад в развитие и прогрессирование хронической болезни почек (ХБП) и ССЗ при СД 2 типа за счет стимулирования процессов воспаления и фиброза.
Применение антагонистов МКР (АМКР) в лечении ХБП у пациентов с СД 2 типа патогенетически обоснованно, однако имеет ряд серьезных практических ограничений. Разработка и внедрение препаратов нового класса селективных нестероидных АМКР (нсАМКР) нацелены на преодоление существующих барьеров, характерных для стероидных АМКР.
На данный момент времени финеренон является первым и единственным нсАМКР с надежной доказательной базой в отношении пациентов с ХБП и СД 2 типа, что делает его безальтернативным препаратом для воздействия на патофизиологический путь гиперактивации МКР с целью кардионефропротекции.

Рис. 1. Эволюция взглядов на вовлеченность альдостерона и МКР в физиологические и патологические процессы
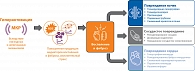
Рис. 2. Последствия гиперактивации МКР в отношении формирования КРС у пациентов с СД 2 типа
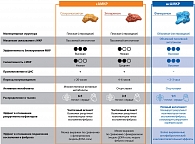
Рис. 3. Различие основных фармакокинетических и фармакодинамических характеристик нсАМКР (финеренона) и сАМКР (спиронолактона, эплеренона)

Рис. 4. Рекомендации ADA 2023 г. по кардионефропротекции у пациентов с ХБП и СД 2 типа
Тесная связь функционирования эндокринной системы с деятельностью почек и сердца хорошо известна. Сердце является метаболически активным органом, чувствительным к изменению водно-электролитного баланса и объема циркулирующей крови. Работа почек зависит от адекватной перфузии и гормонального статуса. Это симбиотическое взаимодействие трех систем определяет гомеостаз функционирования. Неудивительно, что сахарный диабет (СД) 2 типа часто сопряжен с сердечно-сосудистыми заболеваниями (ССЗ) и хронической болезнью почек (ХБП). Менее чем у 10% пациентов имеет место изолированный СД 2 типа, то есть без ССЗ или ХБП. В большинстве случаев наблюдается сочетанная патология [1, 2].
Безусловно, СД 2 типа является пусковым фактором поражения почек и сердечно-сосудистой системы, двунаправленная связь между которыми определяет взаимоотягощающий характер поражения данных органов-мишеней. Связь сердца и почек, при которой нарушение в одном органе может приводить к дисфункции другого, определена как кардиоренальный синдром (КРС). В настоящее время выделяют пять типов КРС: первый и третий типы характеризуют острые нарушения, второй и четвертый типы описывают хронические состояния, пятый тип – одновременное поражение органов вследствие острых или хронических системных нарушений, таких как сепсис или амилоидоз. В случае поражения почек и сердца вследствие СД 2 типа имеет место КРС второго и четвертого типов, то есть нарушения в работе сердечно-сосудистой системы обусловливают нарушение функционирования почек, а развитие ХБП потенцирует поражение сердца и ССЗ [3, 4].
Интерес к КРС определяется не только практической актуальностью проблемы, но и появлением новых препаратов, обладающих потенциалом воздействия на патофизиологические процессы, лежащие в основе взаимного поражения и утяжеления течения ХБП и ССЗ у пациентов c СД 2 типа.
Патологическая гиперактивация ренин-ангиотензин-альдостероновой системы (РААС) и минералокортикоидных рецепторов (МКР) рассматривается как один из механизмов развития КРС. Блокирование данного патофизиологического пути у пациентов с ХБП и СД 2 типа способно разорвать порочный круг взаимоотягощающего поражения почек и сердца [1, 5].
Ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы рецепторов ангиотензина (БРА) – альтернативные опции, вошедшие в клиническую практику более двух десятилетий назад и в настоящее время являющиеся стандартной терапией у пациентов с КРС вследствие СД. Появление первого представителя класса селективных нестероидных антагонистов минералокортикоидных рецепторов (нсАМКР) финеренона для одновременной нефро- и кардиопротекции ознаменовало новую веху в терапии пациентов с ХБП, развившейся на фоне СД 2 типа [1, 6].
Патофизиология ренин-ангиотензин-альдостероновой системы
Основными механизмами старения организма, метаболических нарушений и хронических заболеваний являются хроническое воспаление и окислительный стресс. Эти процессы находятся в тесной связи. Известно, что окислительный стресс характеризуется повышенной продукцией свободных радикалов, нарушением окислительно-восстановительного баланса, повреждением клетки и даже ее гибелью.
Долгое время РААС представлялась как система, предназначенная для контроля водного и солевого гомеостаза в организме. Научные исследования доказали роль РААС в качестве одного из главных источников хронического воспаления и окислительного стресса [7–9].
Функционирование РААС ранее описывалось как линейный каскад реакций, финальным этапом которого была регуляция секреции альдостерона. Клетками юкстагломерулярного аппарата почек синтезируется ренин, необходимый для превращения ангиотензиногена – белка, синтезируемого клетками печени, в ангиотензин 1 (АТ-1). АТ-1 обладает слабым вазоконстрикторным эффектом. Под влиянием АПФ, который синтезируется и секретируется клетками почечных канальцев и интерстициальными клетками легочной ткани, АТ-1 превращается в мощный вазоконстриктор – ангиотензин 2 (АТ-2), который стимулирует секрецию альдостерона клубочковой зоной коры надпочечников [10, 11]. Однако важно помнить, что АТ-2 не является единственным триггером секреции альдостерона. В качестве стимуляторов синтеза альдостерона также выступают лептин, адренокортикотропный гормон, допамин, эндотелин, серотонин, вазопрессин, ацетилхолин, ионы калия. Повышение уровня калия всего на 2 промилле приводит к увеличению уровня альдостерона на 25% [12, 13]. Секретируемый в кровь альдостерон практически не связывается с белками плазмы и циркулирует в свободном виде. При исследовании уровня альдостерона в крови необходимо учитывать, что на результат анализа могут влиять количество натрия, потребленного с пищей, положение тела, время суток. Уровень гормона минимален утром и в положении лежа, максимален – во второй половине дня и в вертикальном положении (сидя, стоя). С возрастом нормальный уровень альдостерона в плазме может уменьшиться [12, 14].
В последние годы понимание о путях функционирования РААС расширилось. Установлены альтернативные пути, которые обходят как ренин, так и АПФ и стимулируют выработку ангиотензинов в тканях и клетках. Наличие данных механизмов, а также множества дополнительных стимуляторов выработки альдостерона объясняет феномен ускользания альдостерона, наблюдаемый при применении иАПФ или БРА.
Таким образом, ингибированием начальных звеньев каскада РААС невозможно полностью предотвратить все последствия ее избыточной активации. Для практической медицины это означает, что снижение риска, продемонстрированное в клинических исследованиях иАПФ или БРА, составляет лишь небольшую часть остаточного риска сердечно-сосудистых и почечных событий [13, 15].
Минералокортикоидные рецепторы
Альдостерон, как и другие гормоны, реализует свои эффекты за счет взаимодействия со специфическими белковыми структурами – МКР. Минералокортикоидные рецепторы относятся к семейству стероидных ядерных рецепторов, в которое также входят глюкокортикоидные рецепторы и рецепторы прогестерона и андрогенов [16]. МКР представлены практически во всех тканях организма. Особенно высокая их плотность определяется в клетках почечных канальцев, кардиомиоцитах, клетках эндотелия, клетках нервной системы, фибробластах, миелоидных клетках (макрофагах, нейтрофилах). Минералокортикоидный эффект оказывают и другие гормоны коры надпочечников, такие как дезоксикортикостерон (ДОК), 18-оксикортикостерон, кортикостерон, кортизол. Гормоны пучкового слоя надпочечников, обладая высоким минералокортикоидным воздействием, в норме его не проявляют, так как дезактивируются специфическими ферментами [9, 13, 16].
Вследствие локализации МКР в различных органах и тканях, таких как почки, сердце, сосуды, сетчатка, центральная нервная система (ЦНС), они способны контролировать гомеостаз и регулировать большое количество биологических процессов. При этом могут быть вовлечены и во множество патофизиологических механизмов повреждения органов-мишеней, которые происходят параллельно, определяя коморбидность у пациентов, в том числе при КРС. Это делает МКР актуальным объектом фундаментальных научных исследований, имеющих непосредственное клиническое значение [9, 15, 17].
До 1990 г. считалось, что МКР экспрессируются только в почках и их основной функцией является регуляция водно-электролитного гомеостаза. При этом полагали, что альдостерон является единственным лигандом МКР и имеет решающее значение для жидкостного, электролитного и гемодинамического гомеостаза. Попадая в кровоток, альдостерон взаимодействует с МКР эпителиальных клеток дистальных канальцев и собирательных трубочек нефрона, что, с одной стороны, приводит к увеличению реабсорбции натрия и задержке жидкости, с другой – к усилению экскреции калия и магния. Натрий-задерживающий эффект альдостерона необходим для поддержания гомеостаза в условиях гиповолемии. Понимание роли альдостерона и МКР в регуляции физиологических процессов и патологических процессах существенно расширилось только в последние 30 лет (рис. 1) [9, 13, 18].
На сегодняшний день получены неоспоримые доказательства того, что спектр действия альдостерона лежит далеко за пределами почечных эффектов. Системная или локальная гиперпродукция гормона вызывает целый ряд патологических реакций, затрагивающих весь организм. Данные патологические эффекты альдостерона реализуются через соответствующие рецепторы гормона, вследствие чего можно говорить о патологических эффектах гиперактивации МКР [9, 19].
В патологических условиях гиперактивация МКР является следствием не только повышения продукции альдостерона, но и активации лиганд-независимых путей стимулирования рецепторов в результате гипергликемии, окислительного стресса, высокой солевой нагрузки, Rac-1 и т.д.
Таким образом, не только избыточная продукция альдостерона, но и другие механизмы гиперактивации МКР, а также увеличение экспрессии самих рецепторов приводят к широкому спектру нарушений, способствующих полиорганному повреждению [20, 21].
В отличие от других видов рецепторов ядерные рецепторы, к которым относятся МКР, преимущественно расположены внутри клеток и способны напрямую взаимодействовать с геномной ДНК, регулируя экспрессию генов, тем самым осуществлять контроль различных биологических процессов в организме. В своей цитоплазматической неактивной форме МКР связаны с белками-шаперонами и различными иммунофилинами. Активация МКР происходит лигандным путем при взаимодействии с альдостероном и другими гормонами или нелигандным путем, после чего реализуются классические медленные (геномные) и быстрые (негеномные) эффекты стимуляции рецепторов [22, 23].
Негеномные эффекты МКР не связаны с проникновением комплекса «гормон – рецептор» в ядро. Они предназначены для быстрого реагирования организма на изменяющиеся условия с целью поддержания гомеостаза. Быстрый путь проведения клеточного сигнала опосредован взаимодействием активированного МКР с системой вторичных мессенджеров. Эффект развивается в течение нескольких минут после взаимодействия. Примером негеномного эффекта МКР может служить контроль водно-электролитного гомеостаза. Альдостерон может повысить активность эпителиальных натриевых каналов в почках в течение двух минут за счет негеномных эффектов МКР. При этом активация геномного пути с вовлечением соответствующих генов и синтезом натриевых каналов занимает более 30 минут. К быстрым эффектам МКР, ответственным за поддержание гомеостаза, также относятся регуляция тонуса сосудов (за счет продукции оксида азота (NO)), контроль электрической и сократительной активности миокарда [23, 24].
За счет быстрых негеномных эффектов МКР-сигнальный путь представляет собой высокоадаптивный и мощный механизм контроля гомеостаза.
Геномные эффекты стимуляции МКР требуют значительного времени для транскрипции генов и последующей трансляции белков, однако обеспечивают долгосрочное поддержание гомеостаза [23].
В патофизиологических условиях, например у пациентов с СД 2 типа, может происходить гиперактивация МКР, при которой баланс функционирования МКР-сигнального пути смещается в сторону геномных эффектов, запуская повреждение органов-мишеней и нарушение их функции за счет каскада патологических процессов [24, 25]:
- нарушение водно-электролитного гомеостаза;
- повышение продукции медиаторов воспаления;
- поляризация макрофагов по провоспалительному М1-фенотипу, активация Т-клеток и увеличение образования молекул адгезии;
- повышение продукции медиаторов фиброза и стимуляция пролиферации фибробластов;
- усиление образования коллагена;
- индукция окислительного стресса: увеличение образования активных форм кислорода, экспрессии и активности НАДФ-оксидазы;
- эндотелиальная дисфункция: ухудшение эндотелий-зависимой вазодилатации, снижение активности NO-синтазы;
- нарушение толерантности к глюкозе.
Множественные патологические процессы приводят к структурным изменениям и функциональным нарушениям на уровне тканей и органов [9, 26]:
- повреждению клеток и трансформации белков;
- кальцификации сосудов, увеличению жесткости сосудистой стенки, гемодинамическим нарушениям, повышению артериального давления (АД);
- гипертрофии, диастолической дисфункции левого желудочка;
- нарушению сократимости миокарда и сердечного ритма;
- повышению уровня липидов и атеросклерозу;
- замещению нормальных анатомических структур фиброзом;
- инсулинорезистентности.
Вследствие локализации МКР в различных органах и тканях их гиперактивация может характеризоваться полиорганным поражением, которое, в частности, выражается в патологическом ремоделировании сердца и почек с развитием КРС у пациентов с СД 2 типа (рис. 2) [24–26]. Значимая вовлеченность МКР в развитие и прогрессирование повреждения органов-мишеней позволяет предполагать, что системное блокирование гиперактивации МКР в разных органах способно оказать большой спектр положительных терапевтических эффектов. При этом ввиду комплексности строения МКР и МКР-сигнального пути эффекты блокирования рецепторов будут также зависеть от механизма связывания препарата с рецептором, который различается у существующих стероидных и нестероидных АМКР (сАМКР и нсАМКР) [15, 25, 27].
Блокирование гиперактивации МКР и кардионефропротекция
История разработки и применения АМКР первоначально была историей антагонистов альдостерона, поскольку при изучении первых препаратов в 1950-х гг. ставилась цель синтезировать ингибитор почечных эффектов именно этого гормона. В то время основной ролью альдостерона признавался контроль почечной экскреции натрия и калия. Позднее стало ясно, что изучаемые антагонисты альдостерона блокируют специфический рецепторный белок, который обладает высоким сродством не только с альдостероном, но и с рядом других гормонов. Именно поэтому данный класс препаратов получил название АМКР [28].
Вовлеченность дезоксикортикостерон ацетата (ДОКА) – предшественника альдостерона в патологические процессы в почках и сердце была описана еще в 1942 г. в работах H. Selye [29]. Определение ДНК рецептора альдостерона в 1987 г. позволило получить первое представление о молекулярном механизме действия МКР и роли его гиперактивации в процессах фиброза и воспаления [30]. Впоследствии было проведено большое количество доклинических исследований возможности блокирования эффектов МКР с целью оценки потенциала применения АМКР в клинической практике для предотвращения патологического ремоделирования почек и сердца [28].
Воспалительные изменения и замещение нормальных анатомических структур фиброзом являются анатомической основой ХБП, которая может быть следствием или сопровождаться острым повреждением почек (ОПП).
Острое повреждение почек считается независимым фактором риска как развития, так и прогрессирования ХБП. Каждый эпизод ОПП у пациентов с ХБП и СД вносит значительный вклад в прогрессирование ХБП вплоть до терминальной почечной недостаточности (ТПН) [31].
Экспериментальные исследования, проведенные J. Barrera-Chimal и соавт., показали, что один эпизод ишемического ОПП может вызвать ХБП у крыс, подвергнутых двусторонней ишемии или реперфузии почек. Наблюдение за крысами, перенесшими эпизод ОПП, в течение девяти месяцев выявило характерные для ХБП протеинурию, дисфункцию почек и тяжелые структурные повреждения. Инфильтрация макрофагами, наблюдаемая при ОПП, определяет тяжесть повреждения почечной ткани. МКР макрофагов (миелоидные МКР) могут быть вовлечены в процессы регуляции воспаления и фиброза при ОПП и ХБП и стимулировать поляризацию макрофагов по провоспалительному М1-фенотипу [32, 33].
В одном из экспериментов на модели мыши с ОПП (с двусторонней ишемией или реперфузией) J. Barrera-Chimal и соавт. отметили эффект нсАМКР (финеренона) в предотвращении развития ХБП. Профилактическое введение финеренона характеризовалось отсутствием повышения выработки медиаторов фиброза, в том числе трансформирующего фактора роста β (TGF-β), а также протеинурии, фиброза почек и отложения коллагена. Нефропротективный эффект финеренона, вероятно, был обусловлен уменьшением провоспалительной инфильтрации макрофагов и стимулированием поляризации макрофагов до фенотипа М2 (противовоспалительных макрофагов). М2-фенотип представляет собой ранозаживляющий фенотип в острой фазе после ишемического повреждения. Ингибирование MКР способствовало поляризации макрофагов М2 за счет увеличения экспрессии и активации рецептора интерлейкина 4 макрофагов [33].
Значимый вклад в нефропротективный эффект финеренона у мышей с ОПП, вероятно, могло внести и блокирование МКР гладкомышечных клеток. Гиперактивация МКР гладкомышечных клеток, происходящая вследствие лиганд-независимого пути Rac-1 при ОПП, характеризовалась индукцией окислительного стресса, что успешно подавлялось применением нсАМКР [34].
Еще один предполагаемый механизм нефропротективного эффекта блокирования МКР может быть опосредован рецепторами эндотелина В. В опытах на той же модели мышей с ишемическим ОПП было установлено, что почечная ишемия сопровождается усиленным окислительным повреждением, ведущим к окислению цистеиновых остатков до сульфеновой кислоты, модифицирующей рецептор эндотелина В, с последующим подавлением активации эндотелиальной NO-синтазы. Таким образом, в условиях почечного повреждения и ишемии рецептор эндотелина В эндотелиальных клеток не способен стимулировать продукцию NO. Сниженная продукция NO, вазоконстрикция и нарушение перфузии почек приводят к повреждению почечных структур вследствие ишемии. Было показано, что данный патофизиологический путь, опосредованный модификацией рецептора эндотелина В, блокируется нсАМКР [34, 35].
Трансформирующий фактор роста β является важным цитокином, стимулирующим рост фибробластов, дифференцировку и пролиферацию, активирует синтез и отложение коллагена и ингибирует матриксную металлопротеиназу коллагеназы. У крыс с протеинурией продукция TGF-β из интерстициальных макрофагов коррелировала с воспалительной инфильтрацией.
Уровень TGF-β увеличивается при введении альдостерона и снижается при применении АМКР. У пациентов с СД 2 типа и ХБП отмечается аналогичная корреляционная зависимость между повышением концентрации TGF-β и выраженностью альбуминурии – с повышением альбуминурии наблюдается увеличение уровня TGF-β, определяемое как в сыворотке крови, так и в моче. У пациентов с тяжелой альбуминурией фиксируется трехкратное повышение экспрессии мРНК почечного TGF-β [36]. В регуляцию экспрессии медиаторов фиброза, в том числе TGF-β, вовлечены именно МКР, которые в случае гиперактивации способны усиливать экспрессию эффекторных профибротических генов-мишеней [36, 37].
Повышение продукции медиаторов фиброза при гиперактивации МКР не ограничивается почками, а может затрагивать все органы, в клетках которых локализуются данные рецепторы [27]. В более ранних доклинических исследованиях было продемонстрировано, что активация МКР может способствовать апоптозу кардиомиоцитов и развитию фиброза, приводя к патологическому ремоделированию миокарда и снижению функции сердца.
С появлением нсАМКР возникает вопрос о существовании различий в эффектах блокирования МКР разными препаратами-антагонистами, речь, в частности, идет о сАМКР спиронолактоне и эплереноне и нсАМКР финереноне [27, 38].
Одно из доклинических исследований, в котором сравнивались эффекты разных классов АМКР, было выполнено на мышиной модели кардиального фиброза, вызванного изопротеренолом. Для изучения антифибротических эффектов финеренон и эплеренон брали в эквинатрийуретических дозах, то есть данные дозы препаратов характеризовались сопоставимыми эффектами в отношении влияния на водно-электролитный гомеостаз. Согласно результатам исследования, финеренон в дозе 10 мг/кг значимо снижал выраженность фиброза в сердце и инфильтрацию сердца макрофагами, тогда как аналогичный эффект для эплеренона в дозе 100 мг/кг не наблюдался. В рамках данного исследования были также продемонстрированы значимые различия между финереноном и сАМКР в отношении влияния на профибротические гены. Финеренон в отличие от эплеренона и спиронолактона значимо снижал экспрессию гена TNX, который кодирует гликопротеины внеклеточного матрикса и способствует откладыванию коллагена. Финеренон также значимо уменьшал экспрессию генов TGF-β, коллагена 1 и галектина 3. При этом эффекты сАМКР в отношении сокращения экспрессии данных генов были менее выраженными [38].
Еще одно из недавних доклинических исследований, в котором оценивались антифибротические механизмы действия финеренона и сравнивались эффекты разных АМКР, было проведено на крысах Спрег-Доули с нефрэктомией одной почки (классическая модель ДОКА-соль). Эта модель крыс с индуцированным дезоксикортикостероном ацетатом повреждением сердца и почек. Финеренон оказывал более выраженное влияние на уменьшение фиброза и альбуминурии и менее выраженное – на концентрацию калия в сыворотке крови по сравнению со спиронолактоном. Нефропротективный эффект финеренона проявлялся в меньшей выраженности патологических структурных изменений в почках – менее выраженном гломерулосклерозе и тубулоинтерстициальном фиброзе [39].
Таким образом, первоначальная стратегия терапии АМКР (исключительно с целью снижения объема циркулирующей крови) с годами существенно расширилась, в том числе благодаря проведенным фундаментальным доклиническим исследованиям. Лучшее понимание ключевой роли МКР в развитии фиброза и воспаления, а также практические ограничения применения сАМКР (риск гиперкалиемии, нежелательные явления со стороны половой системы) привели к созданию нсАМКР (препарата финеренон), так называемых полных АМКР, с более выраженным влиянием на воспаление и фиброз. При этом сАМКР (спиронолактон, эплеренон), также обладающих антифибротическим и антивоспалительным эффектами, называют частичными агонистами из-за особенности связывания с МКР, в результате которого влияние рецептора на воспаление и фиброз блокируется лишь частично (рис. 3) [40–42]. Разный механизм действия, разные фармакокинетические и фармакодинамические характеристики и разные клинические эффекты определяют необходимость разделения стероидных и нестероидных АМКР на два разных класса [27, 40]. И, как отмечено в авторитетных практических руководствах, данные в отношении одного класса АМКР не могут быть экстраполированы на другой [43].
Кардионефропротективный потенциал нсАМКР у пациентов с ХБП и СД 2 типа
Использование АМКР в клинической практике представляет особый интерес. АМКР рассматриваются в качестве терапевтической стратегии при ХБП, для замедления ухудшения почечной функции и снижения сопутствующих сердечно-сосудистых рисков.
В ряде опубликованных небольших непродолжительных клинических исследований сообщалось о нефропротективном эффекте сАМКР, выражавшемся в антипротеинурическом действии у лиц с ХБП.
Согласно результатам двух метаанализов, сАМКР способны уменьшать протеинурию при использовании в комбинации с иАПФ или БРА.
В восьми исследованиях добавление спиронолактона к иАПФ или БРА у пациентов с ХБП и СД привело к снижению 24-часовой экскреции альбумина или белка с мочой, в трех – к более выраженному уменьшению соотношения «альбумин/креатинин» (А/Кр) в моче. Следует отметить, что также сообщалось о значительном снижении АД, поэтому нельзя исключать возможность уменьшения протеинурии, опосредованной снижением АД. Важно также подчеркнуть, что авторами данных метаанализов была установлена высокая степень гетерогенности наблюдаемых терапевтических эффектов сАМКР и низкий или очень низкий уровень доказательности [44, 45]. Вследствие этого, как отмечено в рекомендациях KDIGO 2022 г. по ведению пациентов с ХБП и СД, у cАМКР отсутствует надежная доказательная база для применения с целью кардионефропротекции [46]. Другим фактором, препятствующим широкому назначению сАМКР, особенно у пациентов со скомпрометированной функцией почек, является высокий риск развития гиперкалиемии. У пациентов с ХБП риск возникновения гиперкалиемии при добавлении сАМКР к блокаторам ренин-ангиотензиновой системы может возрастать в 3,0–4,3 раза по сравнению с монотерапией иАПФ или БРА [47, 48].
Разработка и изучение финеренона, как первого представителя нового класса селективных нсАМКР, была нацелена на преодоление барьеров, характерных для сАМКР, и получение надежных доказательств для его применения у пациентов с ХБП и СД 2 типа с целью кардионефропротекции.
Отсутствие нежелательных явлений со стороны половой системы и меньшее влияние на концентрацию калия в крови может обусловливать более благоприятный профиль безопасности финеренона по сравнению с сАМКР.
Завершенные рандомизированные клинические исследования финеренона в популяции пациентов с СД 2 типа и широким спектром ХБП – от первой до четвертой стадии позволяют сделать вывод, что это единственный на сегодняшний день АМКР с надежными доказательствами наличия выраженного кардионефропротективного эффекта в соответствующей популяции [6, 41, 49].
Первым крупным исследованием финеренона у пациентов с ХБП и СД 2 типа стало исследование фазы II ARTS-DN (n = 823). Оно было нацелено на оценку эффективности и профиля безопасности разных доз финеренона по сравнению с плацебо на фоне базовой терапии иАПФ или БРА. Терапия финереноном ассоциировалась с выраженным дозозависимым снижением альбуминурии [50]. Альбуминурия, ее выраженность и персистенция являются общепризнанными и ценными для клинической практики маркерами тяжести течения ХБП, прогноза дальнейшего снижения почечной функции и развития сердечно-сосудистых осложнений. Альбуминурия также является одной из потенциальных причин снижения почечной функции за счет прямого повреждающего воздействия на клубочки и канальцы [51, 52]. Необходимость снижения альбуминурии с целью замедления темпов прогрессирования ХБП рекомендована в гайдлайнах Американской диабетической ассоциации (American Diabetes Association – ADA) 2023 г. В них отмечено, что снижение соотношения А/Кр до < 300 мг/г или на > 30% относительно исходного уровня ассоциировано с улучшением почечных и сердечно-сосудистых исходов, что может предполагать необходимость достижения максимально возможного уменьшения данного показателя при терапии ХБП [43]. Ведущие организации, такие как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, Национальный почечный фонд, Европейское агентство лекарственных средств, признали изменение альбуминурии надежным суррогатным параметром для оценки эффективности нефропротективной терапии [53].
Согласно результатам ряда наблюдений, сАМКР способны уменьшать альбуминурию, однако данные препараты не изучались в крупных рандомизированных исследованиях с участием пациентов с поздними стадиями ХБП из-за высокого риска развития гиперкалиемии.
Финеренон характеризуется более низким риском возникновения гиперкалиемии по сравнению с сАМКР, вероятно, благодаря более короткому периоду полувыведения, отсутствию активных метаболитов, равномерному распределению между почками и сердцем, а также различиям во влиянии на экспрессию генов (см. рис. 3) [27, 41]. Данные особенности препарата позволили провести крупное рандомизированное клиническое исследование FIDELIO-DKD в популяции пациентов с СД 2 типа и ХБП преимущественно третьей и четвертой стадий [6]. Так, общее количество участников составило 5734.
FIDELIO-DKD – рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование фазы III. В данное исследование включали лиц с СД 2 типа и ХБП при условии, что соотношение А/Кр в моче составляло 30– < 300 мг/г, расчетная скорость клубочковой фильтрации (рСКФ) – ≥ 25– < 60 мл/мин/1,73 м2 или соотношение А/Кр – ≥ 300 – ≤ 5000 мг/г, рСКФ – ≥ 25– < 75 мл/мин/1,73 м2. У всех пациентов отмечалось выраженное снижение почечной функции. У 88,4% пациентов рСКФ была < 60 мл/мин/1,73 м2 (среднее значение рСКФ – 44,3 мл/мин/1,73 м2), у 87,4% регистрировалось резкое повышение альбуминурии (соотношение А/Кр в моче – ≥ 300 мг/г со средним значением 851 мг/г). Длительность СД 2 типа в среднем составляла 16,6 года. На момент рандомизации уровень гликированного гемоглобина (HbA1c) в среднем достигал 7,7%. У включенных в исследование пациентов регистрировался удовлетворительный контроль АД со средним значением систолического АД 138 мм рт. ст., что позволило оценить нефропротективный эффект финеренона, минимизировав вклад в конечный результат влияния препарата на снижение АД [6].
Финеренон снижал риск развития событий первичной почечной конечной точки (время до развития ТПН, устойчивого снижения СКФ на ≥ 40% от исходного уровня или смерти от почечных причин) на 18% (относительный риск (ОР) 0,82 при 95%-ном доверительном интервале (ДИ) 0,73–0,93; р = 0,001). Обращает на себя внимание выраженное и стойкое снижение альбуминурии на фоне терапии финереноном, которое сохранялось на протяжении всего периода терапии и наблюдения (в среднем 2,6 года). Уменьшение соотношения А/Кр в моче относительно плацебо в группе терапии финереноном составило 31% уже к четвертому месяцу [6].
Финеренон также снижал риск развития событий основной вторичной сердечно-сосудистой конечной точки (время до развития смерти от сердечно-сосудистых причин, нефатального инфаркта миокарда, нефатального инсульта или госпитализации по причине сердечной недостаточности) на 14% (ОР 0,86 (95% ДИ 0,75–0,99); р = 0,03).
Таким образом, результаты исследования FIDELIO-DKD продемонстрировали выраженный кардионефропротективный эффект финеренона у пациентов с СД 2 типа и ХБП с высоким и очень высоким исходным риском прогрессирования ХБП до ТПН, развития неблагоприятных сердечно-сосудистых событий и смерти от сердечно-сосудистых причин [6].
Финеренон характеризовался умеренным и предсказуемым влиянием на динамику концентрации калия в крови. Максимальная разница в концентрации ионов калия в крови между исследуемыми группами финеренона и плацебо наблюдалась на четвертом месяце и составила 0,23 ммоль/л. Финеренон отличался низкой частотой прекращения терапии или госпитализации вследствие гиперкалиемии, независимо от исходной рСКФ. Прекращение лечения исследуемым препаратом вследствие гиперкалиемии зафиксировано у 64 (2,3%) пациентов в группе финеренона и 25 (0,9%) пациентов в группе плацебо. Госпитализация вследствие гиперкалиемии – у 40 (1,4%) и 8 (0,3%) больных соответственно. Важно обратить внимание на то, что в данное исследование включали пациентов с выраженным снижением функции почек, а значит, высоким риском развития гиперкалиемии. У 88,4% участников исследования рСКФ была < 60 мл/мин/1,73 м2. Фармакокинетические и фармакодинамические особенности финеренона (см. рис. 3), вероятно, обусловили возможность контроля гиперкалиемии путем регулярного мониторинга и временного прекращения терапии [6].
Актуальные рекомендации по кардионефропротекции у пациентов с СД
Подход к ведению пациентов с КРС, который зачастую сочетается и является следствием СД, должен носить комплексный характер. В клинических рекомендациях, как зарубежных, так и отечественных, подчеркнута необходимость реализации на практике в отношении каждого пациента с СД полного спектра лечебно-профилактических мероприятий, направленных на контроль факторов риска развития и прогрессирования осложнений диабета. Так называемая многофакторная терапевтическая стратегия одновременно должна включать множество подходов, основанных на фактических доказательствах благоприятного клинического эффекта: контроль гликемии, АД, липидного обмена и специфическую таргетную кардионефропротективную терапию. В сочетании с изменением образа жизни они являются фундаментальными для глобального снижения риска развития и темпов прогрессирования КРС при СД [43, 51, 52].
Достижение и поддержание целевых значений гликемии и АД уже давно признаны необходимым стандартом ведения пациентов с СД. В рекомендациях ADA 2023 г. по оказанию помощи при СД были указаны новые пороговые значения АД для инициации антигипертензивной терапии – ≥ 130/80 мм рт. ст. Целевым значением АД считается < 130/80 мм рт. ст. при возможности его безопасного достижения. При определении персонализированных целевых уровней HbA1c и АД у пациентов с СД необходимо учитывать множество факторов, влияющих на безопасность их достижения. Так, следует учитывать ожидаемую продолжительность жизни, длительность заболевания, наличие или отсутствие микро- и макрососудистых осложнений, факторов риска развития ССЗ, сопутствующих заболеваний, гипогликемии, а также когнитивный и психологический статус пациента [54].
У лиц с ХБП может быть затруднен контроль HbA1c вследствие снижения функции почек, а также повышен риск возникновения гипогликемии. При этом интенсификация гликемического контроля, снижая риск развития ХБП, не уменьшает риск прогрессирования поражения почек и может повышать риск смерти от ССЗ у пациентов с ХБП и СД [43, 55].
Потенциальные нежелательные явления антигипертензивной терапии (гипотензия, синкопе, острое повреждение почек, нарушение электролитного гомеостаза) также следует учитывать при определении целевых значений АД. Для пациентов с ХБП, выраженной коморбидностью, ортостатической гипотензией характерен повышенный риск развития нежелательных явлений. В данной популяции могут быть предпочтительными более высокие целевые значения АД в связи с более благоприятным соотношением «польза – риск» и лучшим качеством жизни [54].
Коморбидность – важный фактор, определяющий возможность безопасного достижения целевой гликемии и АД. Поражение почек и сердечно-сосудистой системы на фоне СД, выражающееся в развитии КРС, само по себе характеризуется высоким риском смерти и вносит значительный вклад в увеличение рисков, связанных с трудностями контроля сахарного диабета и артериальной гипертензии (АГ). В связи со сказанным ранее возрастает важность таргетной кардионефропротекции как одного из столпов многофакторной терапевтической стратегии для снижения риска развития и прогрессирования осложнений СД [43, 54, 55].
С появлением новых препаратов с доказанным благоприятным эффектом в отношении почек и сердца в клинических рекомендациях и практических алгоритмах по ведению пациентов с ХБП и СД 2 типа начали обозначаться три столпа кардионефропротекции: иАПФ или БРА, ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2), нсАМКР (финеренон). В рекомендациях ADA 2023 г. указано, что данные препараты должны быть назначены совместно, а не рассматриваться как альтернатива друг другу при неэффективности предшествующей терапии (рис. 4) [43, 56, 57]. Терапевтический путь воздействия на разные звенья патогенеза ХБП и ССЗ может способствовать синергизму эффектов в отношении замедления прогрессирования ХБП и снижения риска развития сердечно-сосудистых осложнений [43, 54, 58]. Таким образом, для максимизации терапевтического эффекта пациентам с ХБП и СД 2 типа необходимо назначить все три класса препаратов [43, 56].
Заключение
Современная кардиология и нефрология тесно связаны между собой, что обусловлено достижениями науки и практики в отношении вопросов, касающихся общих факторов риска развития заболеваний почек и сердечно-сосудистой системы, универсальных патогенетических механизмов, взаимоотягощающего прогноза и терапевтической стратегии нефро- и кардиопротекции. Такая связь сердца и почек, при которой нарушение в одном органе может приводить к дисфункции другого, определено понятием КРС. Заболевания метаболической и нейрогуморальной этиологии зачастую являются причиной развития КРС, образуют порочный круг взаимоотягощающего влияния полиорганных нарушений и делают междисциплинарный подход к ведению таких пациентов неотъемлемым [4, 5].
Этиология и патогенетические механизмы повреждения почек у пациентов с КРС многофакторны и неоднозначны. Гемодинамический дисбаланс, нейрогормональная активация, симпатическая активность, фармакологические вмешательства, воспаление наряду с окислительным стрессом могут быть вовлечены в патогенез острого повреждения почек при КРС. Гиповолемия, вызванная снижением сердечного выброса или чрезмерно быстрой сосудосуживающей терапией, может привести к нарушению почечной перфузии [3, 21].
Гиперактивация МКР – одно из недавно определенных общих звеньев поражения почек и сердца, а значит, и формирования КРС у пациентов с СД 2 типа. МКР в гиперактивированном состоянии способны запускать каскад патологических реакций, что приводит к развитию воспаления, фиброза и окислительного стресса. Локализация МКР во множественных клетках, органах и тканях обусловливает полиорганный характер повреждений при нарушении их функционирования. Множественность путей гиперактивации МКР определяет комплексность РААС и объясняет необходимость блокирования именно МКР для максимизации положительного эффекта терапии [24, 27].
На сегодняшний день лишь финеренон, являющийся единственным представителем нсАМКР с надежными доказательствами благоприятного эффекта в отношении почек и сердца при СД 2 типа, может применяться у пациентов с ХБП и СД 2 типа для кардионефропротекции, что делает данный препарат безальтернативным для воздействия на патологический путь гиперактивации МКР.
Финеренон включен в ведущие зарубежные рекомендации для замедления темпов прогрессирования ХБП и улучшения сердечно-сосудистых исходов у пациентов с ХБП и СД 2 типа с наивысшим уровнем доказательств [43, 55].
Финеренон зарегистрирован в Российской Федерации весной 2023 г. на основании результатов исследования FIDELIO-DKD и показан для применения у взрослых пациентов с СД 2 типа и ХБП (третья и четвертая стадии с альбуминурией). Можно также ожидать его включение в федеральные клинические рекомендации при их обновлении.
Существующие в настоящее время препараты для кардионефропротекции у лиц с ХБП и СД 2 типа представляют независимые столпы терапии, которые должны быть назначены в рамках многофакторной стратегии вместе, а не в качестве альтернативы друг другу [43, 56, 57].
Конфликт интересов
Публикация подготовлена при поддержке АО «Байер».
Компания «Байер» поддерживала техническую редакцию статьи.
Главное
«Керендия» (Kerendia, финеренон) — новый препарат, предназначенный взрослым пациентам с хронической болезнью почек, ассоциированной с сахарным диабетом 2-го типа, и показанный для снижения следующих рисков: стабильного уменьшения расчетной скорости клубочковой фильтрации, развития терминальной стадии болезни почек, сердечно-сосудистой смерти, нелетального инфаркта миокарда, госпитализации по поводу сердечной недостаточности.
«Керендия», одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в июле 2021 года, разработан «Байер» (Bayer).
В феврале 2022 года Европейское агентство по лекарственным средствам (EMA) выдало «Керендия» маркетинговое разрешение: финеренон разрешен для лечения взрослых пациентов с хронической болезнью почек (на стадии 3 и 4 с альбуминурией), ассоциированной с диабетом 2-го типа.
«Керендия» займет должное место в фармакологическом арсенале борьбы с диабетической болезнью почек. Согласно прогнозам отраслевых наблюдателей, к 2026 году финеренон станет бестселлером, выйдя на уровень ежегодных продаж в 1,2 млрд долларов.

Хроническая болезнь почек и диабет
Сахарный диабет 2-го типа является основной причиной хронической болезни почек (ХБП) во всём мире. [1] Насчитывается свыше 200 млн пациентов, которые одновременно страдают ХБП и диабетом [2] [3] [4], и в паре эти заболевания сокращают продолжительность жизни на 16 лет. [5] До 40% диабетиков в конечном итоге заболевают ХБП. [6]
Международные рекомендации по лечению ХБП у пациентов с диабетом 2-го типа рекомендуют контролировать гипертонию и гипергликемию, а также использовать блокаторы ренин-ангиотензиновой системы (РАС), такие как ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы ангиотензиновых рецепторов (БРА). Недавно добавились рекомендации по применению ингибиторов натрий-глюкозного котранспортера 2 (SGLT2). [7] [8]. Тем не менее, несмотря на рекомендованное лечение, риск прогрессирования ХБП сохраняется [9], и потому необходимы новые методы лечения.
«Керендия»: механизм действия финеренона
Финеренон (finerenone, BAY 94-8862) — пероральный низкомолекулярный высокоселективный нестероидный антагонист минералокортикоидного рецептора (MR).
Данные свидетельствуют о патофизиологической роли чрезмерной активации минералокортикоидных рецепторов при кардиоренальных заболеваниях, включая ХБП и диабет: опосредованные ею воспаление и фиброз приводят к прогрессирующей дисфункции почек и сердечно-сосудистой системы. [1] [2] [3] [4]
Подавление сверхактивности MR, вызванной альдостероном и кортизолом, приводит к сдерживанию патологических процессов воспаления, фиброза, роста артериального давления, желудочковой гипертрофии.
В отличие от всех существующих MR-блокаторов, таких как спиронолактон (spironolactone), эплеренон (eplerenone) или канренон (canrenone), финеренон характеризуется уникальным фармакологическим профилем. [5]
Во-первых, финеренон никак не затрагивает глюкокортикоидные, андрогеновые, прогестероновые и эстрогеновые рецепторы, тем самым избавляя от расхожих при назначении MR-антагонистов побочных реакций вроде гинекомастии, импотенции, снижения либидо.
Во-вторых, финеренон не относится к стероидным средствам (он является производным дигидропиридина), что позволяет ему с высокой аффинностью связываться с MR и более эффективно подавлять транскрипционные коактиваторы, участвующие в экспрессии гипертрофических и профиброзных генов.
В-третьих, финеренон относительно равномерно распределяется между сердечной и почечной тканями.
В доклинических моделях финеренон оказывал более мощное противовоспалительное и антифибротическое действие, чем стероидные MR-антагонисты. [6] [7] [8] [9]
Финеренон снижал соотношение альбумина и креатинина в моче у пациентов с хронической болезнь почек, получающих блокаторы ренин-ангиотензиновой системы, при этом он оказывал меньшее влияние на уровень калия в сыворотке крови, чем спиронолактон. [10] [11]
«Керендия»: эффективность и безопасность финеренона для лечения диабетической болезни почек
«Байер» осуществила две масштабных клинических проверки финеренона при диабетической нефропатии. Одно клиническое испытание изучило препарат «Керендия» среди страдающих сахарным диабетом 2-го типа с запущенной хронической болезнью почек (ХБП): главным образом на стадии 3 или 4 и с тяжелой альбуминурией. Второе исследование протестировало «Керендия» среди диабетиков с ХБП в менее запущенной форме: либо на стадии 2–4 и с умеренной альбуминурией, либо на стадии 1–2 и с тяжелой альбуминурией.
FIDELIO-DKD
Клиническое исследование FIDELIO-DKD (NCT02540993) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) пригласило взрослых пациентов (n=5674) с диабетической нефропатией, характеризующейся персистирующей высокой альбуминурией.
Среди основных критериев включения:
- сахарный диабет 2-го типа;
- хроническая болезнь почек;
- либо стойкая высокая альбуминурия (соотношение альбумина и креатинина в моче [UACR] в пределах 30–300 мг/г), расчетная скорость клубочковой фильтрации (eGFR) в диапазоне 25–60 мл/мин/1,73 м2 и диабетическая ретинопатия, либо стойкая очень высокая альбуминурия (UACR ≥ 300 мг/г) и eGFR в диапазоне 25–75 мл/мин/1,73 м2;
- предшествовавшее лечение ингибиторами ангиотензинпревращающего фермента (иАПФ) и/или блокаторами ангиотензиновых рецепторов (БРА);
- уровень калия в сыворотке ≤ 4,8 ммоль/л.
Среди основных характеристик испытуемых:
- средний возраст 66 лет, 70% мужчин;
- средняя eGFR 44 мл/мин/1,73 м2, у 55% eGFR ниже 45 мл/мин/1,73 м2;
- медиана UACR 852 мг/г (межквартильный размах [IQR] 446–1634);
- у 46% атеросклеротическое сердечно-сосудистое заболевание в анамнезе;
- 99,8% получали иАПФ или БРА;
- 97% проходили противодиабетическую терапию: 64% получали инсулин, 44% метформин, 7% агонисты рецептора глюкагоноподобного пептида 1 (GLP-1), 5% ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT2);
- 74% принимали статины, 57% антиагреганты.
Участники ежедневно получали плацебо или финеренон поверх стандартной терапии, предполагавшей назначение гипогликемических лекарственных средств и максимально переносимой дозы иАПФ или БРА.
В ходе наблюдений медианных 2,6 года финеренон замедлил прогрессирование хронической болезни почек, обеспечив статистически значимую отсрочку времени до наступления первого случая почечной недостаточности, стабильного снижения eGFR (на 40% и более за период минимум 4 недель подряд) или смерти из-за отказа почек. Уменьшение вероятности указанного композитного риска составило 18% по сравнению с плацебо: отношение риска (hazard ratio, HR) 0,82 (95% ДИ: 0,73–0,93; p=0,001).
Если говорить об уменьшении рисков отдельных событий, то для почечной недостаточности оно получилось равным 13% (HR 0,87 [95% ДИ: 0,72–1,05]), а для стабильного снижения eGFR — 19% (HR 0,81 [95% ДИ: 0,72–0,92]).
Финеренон статистически значимым образом ослабил композитный риск сердечно-сосудистых событий: сердечно-сосудистой смерти, нелетального инфаркта миокарда, нелетального инсульта или госпитализации по причине сердечной недостаточности: на 14% относительно плацебо (HR 0,86 [95% ДИ: 0,75–0,99; p=0,034]).
При этом частота отдельных событий была ниже при применении финеренона, чем плацебо, за исключением нелетального инсульта, частота которого была одинаковой в обеих группах. Так, отношение риска для сердечно-сосудистой смерти, нелетального инфаркта миокарда, нелетального инсульта и госпитализации по причине сердечной недостаточности вышло к следующим показателям: 0,86 (95% ДИ: 0,68–1,08), 0,80 (95% ДИ: 0,58–1,09), 1,03 (95% ДИ: 0,76–1,38) и 0,86 (95% ДИ: 0,68–1,08).
Среди наиболее распространенных побочных реакций в ответ на назначение препарата «Керендия»: гиперкалиемия (у 18,3% пациентов — против 9,0% в группе плацебо), гипотония (4,8% против 3,4%), гипонатриемия (1,4% против 0,7%). Гиперкалиемия обусловила полное прекращение лечения 2,3% испытуемых — против 0,9%. С госпитализацией по причине гиперкалиемии столкнулись 1,4% пациентов, получавших финеренон, — против 0,3% в контрольной группе.
FIGARO-DKD
Клиническое исследование FIGARO-DKD (NCT02545049) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) пригласило взрослых пациентов (n=7352) с диабетической нефропатией, характеризующейся персистирующей высокой альбуминурией.
Основные критерии включения идентичны таковым в FIDELIO-DKD, разве что было одно отличие:
- либо стойкая высокая альбуминурия (UACR в пределах 30–300 мг/г) и eGFR в диапазоне 25–90 мл/мин/1,73 м2, либо стойкая очень высокая альбуминурия (UACR ≥ 300 мг/г) и eGFR минимум 60 мл/мин/1,73 м2.
Среди основных характеристик испытуемых:
- средний возраст 64 года, 69% мужчин;
- средняя eGFR 68 мл/мин/1,73 м2, у 62% eGFR ≥ 60 мл/мин/1,73 м2, у 83% eGFR ≥ 45 мл/мин/1,73 м2;
- медиана UACR 308 мг/г (IQR 108–740);
- 99,9% получали иАПФ или БРА;
- 98% проходили противодиабетическую терапию: 54% получали инсулин, 8% агонисты GLP-1, 8% ингибиторы SGLT2;
- 71% принимали статины, 48% диуретики.
Участники ежедневно получали плацебо или финеренон поверх стандартной терапии, предполагавшей назначение гипогликемических лекарственных средств и максимально переносимой дозы иАПФ или БРА.
В ходе наблюдений медианных 3,4 года финеренон статистически значимым образом снизил риск выхода к композитной конечной точке, представленной одним из сердечно-сосудистых событий, таких как сердечно-сосудистая смерть, нелетальный инфаркт миокарда, нелетальный инсульт, госпитализация по причине сердечной недостаточности. Уменьшение вероятности указанного композитного риска составило 13% по сравнению с плацебо: HR 0,87 (95% ДИ: 0,76–0,98; p=0,03).
Частота отдельных событий была ниже при применении финеренона, чем плацебо: HR для сердечно-сосудистой смерти, нелетального инфаркта миокарда, нелетального инсульта и госпитализации по причине сердечной недостаточности вышло к следующим показателям: 0,90 (95% ДИ: 0,74–1,09), 0,99 (95% ДИ: 0,76–1,31), 0,97 (95% ДИ: 0,74–1,26) и 0,71 (95% ДИ: 0,56–0,90).
Финеренон на 13% уменьшил вероятность композитного риска, составленного из таких событий, как почечная недостаточность, стабильное снижение eGFR (на 40% и более за период минимум 4 недель подряд) или смерть из-за отказа почек: HR 0,87 (95% ДИ: 0,76–1,01).
Снижение риска (HR) отдельных событий оказалось следующим: почечная недостаточность 0,72 (95% ДИ: 0,49–1,05), терминальная стадия болезни почек 0,64 (95% ДИ: 0,41–0,995), стабильное снижение eGFR до < 15 мл/мин/1,73 м2 0,71 (95% ДИ: 0,43–1,16), стабильное снижение eGFR на ≥ 40% 0,87 (95% ДИ: 0,75–1,00), стабильное снижение eGFR на ≥ 57% 0,76 (95% ДИ: 0,58–1,00).
Среди наиболее распространенных побочных реакций в ответ на назначение препарата «Керендия»была гиперкалиемия (у 10,8% пациентов — против 5,3% в группе плацебо). Уровень сывороточного калия свыше 5,5 ммоль/л зарегистрирован у 13,5% против 6,4%, свыше 6,0 ммоль/л — у 2,3% против 1,2%. Гиперкалиемия обусловила полное прекращение лечения 1,2% испытуемых против 0,4%. С госпитализацией по причине гиперкалиемии столкнулись 0,6% пациентов, получавших финеренон, — против 0,1% в контрольной группе.
Финеренон: что дальше
«Байер» продолжает изучение финеренона в следующих клинических испытаниях фазы III:
- FIND-CKD (NCT05047263) среди взрослых пациентов (n=1580) с хронической болезнью почек (ХБП), не связанной с сахарным диабетом: по силам ли финеренону замедлить прогрессирование ХБП.
- FINEARTS-HF (NCT04435626) среди взрослых пациентов (n=5500) с сердечной недостаточностью с умеренно сниженной или сохраненной фракцией выброса левого желудочка (≥ 40%): сможет ли финеренон уменьшить число сердечно-сосудистых событий и смертей.
- FIONA (NCT05196035) среди педиатрических (возраст от 6 месяцев до 17 лет) пациентов (n=219) с ХБП: справится ли финеренон с замедлением прогрессирования ХБП.
Финеренон: экспертные комментарии
Хроническая болезнь почек (ХБП) усугубляет сердечно-сосудистый риск, ассоциированный с сахарным диабетом 2-го типа. [1] Риск сердечно-сосудистых событий и впервые возникшей сердечной недостаточности возрастает по мере того, как соотношение альбумина и креатинина в моче (UACR) превышает 10 мг/г, а расчетная скорость клубочковой фильтрации (eGFR) падает ниже 75 мл/мин/1,73 м2. [1] [2] [3] [4] У большинства пациентов с ХБП риск развития сердечно-сосудистых событий выше, чем риск развития почечной недостаточности [5]. Вот почему важно выявлять и лечить ХБП, чтобы снизить высокое бремя сердечно-сосудистых заболеваний и сердечной недостаточности, связанное с ХБП у пациентов с сахарным диабетом 2-го типа. [1] [6]
Тем не менее пациенты с высоким показателем UACR, но нормальной eGFR не всегда выявляются из-за того, что анализ UACR не проводится на регулярной основе, хотя и является золотым стандартом для идентифицирования повреждения почек. И это проблема как для больных, которых должным образом не лечат, так и для «Байер», которая заинтересована в продвижении финеренона.
Долгосрочные клинические испытания финеренона, запущенные в 2015 году, проводились в тот момент, когда ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT2) начали выходить за пределы лечения исключительно диабета. Так, в конце сентября 2019 года «Инвокана» (Invokana, канаглифлозин), за которым стоит «Янссен» (Janssen) в составе «Джонсон энд Джонсон» (Johnson & Johnson), был одобрен для снижения риска развития терминальной стадии болезни почек, удвоения уровня сывороточного креатинина, сердечно-сосудистой смерти и госпитализации по поводу сердечной недостаточности у взрослых пациентов с сахарным диабетом 2-го типа и диабетической нефропатией с альбуминурией.
Затем, в конце апреля 2021 года, «Фарсига»/«Форсига» (Farxiga/Forxiga, дапаглифлозин), предлагаемый «АстраЗенека» (AstraZeneca), был разрешен для уменьшения риска стойкого снижения eGFR, развития терминальной стадии ХБП, смерти от сердечно-сосудистых осложнений, госпитализации по поводу сердечной недостаточности у взрослых пациентов с ХБП и риском ее прогрессирования.
Указанные SGLT2-ингибиторы установили высокую планку терапевтической эффективности при ХБП, и перешагнуть ее финеренон не смог. Если сравнить соответствующие клинические исходы препаратов «Керендия», «Инвокана» и «Фарсига»/«Форсига», всё свидетельствует не в пользу финеренона. Следует, впрочем, понимать, что подобные сравнения зачастую методологически некорректны ввиду различий в популяциях пациентов и протоколов клинических испытаний.
Есть мнение, что благодаря разным механизмам действия финеренон уместно применять совместно с SGLT2-ингибиторами или агонистами рецептора глюкагоноподобного пептида 1 (GLP-1), к примеру «Оземпиком» (Ozempic, семаглутид) или «Трулисити» (Trulicity, дулаглутид), которые разработали «Ново Нордиск» (Novo Nordisk) и «Илай Лилли» (Eli Lilly) и которые несут явную сердечно-сосудистую пользу. «Байер», однако, вряд ли согласится на клинические исследования подобных комбинаций: нужные огромные суммы денег, чтобы выявить, возможно, не столь значительный аддитивный эффект, притом что патентная защита финеренона истекает в 2029 году.






