Тремфея — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-005686
Торговое наименование
Тремфея
Международное непатентованное наименование
гуселькумаб
Лекарственная форма
раствор для подкожного введения
Состав
1 мл раствора содержит: действующее вещество: гуселькумаб – 100 мг; вспомогательные вещества: сахароза – 79 мг, L-гистидин – 0,6 мг, L-гистидина гидрохлорида моногидрат – 1,5 мг, полисорбат 80 – 0,5 мг, вода для инъекций – до 1,0 мл.
Описание
Прозрачная или слегка опалесцирующая, бесцветная жидкость или жидкость с коричневатым или коричневато-желтоватым или желтоватым оттенком, которая может содержать незначительное количество маленьких прозрачных или белых частиц белка.
Фармакотерапевтическая группа
иммуносупрессоры, ингибиторы интерлейкина
Код ATX
L04AC16
Фармакологические свойства
Фармакодинамика
Механизм действия
Гуселькумаб – это моноклональное человеческое антитело типа IgGR, которое селективно связывается с белком интерлейкина 23 (ИЛ-23) с высокой специфичностью и аффинностью. ИЛ-23 – это регуляторный цитокин, который влияет на дифференцировку, распространение и жизнеспособность субпопуляций Т-клеток (например, Th17 и Тс17) и незрелых субпопуляций иммунных клеток, являющихся источником эффекторных цитокинов, включая ИЛ-17А, ИЛ-17F и ИЛ-22, способствующих развитию воспалительных заболеваний. В исследованиях у людей было показано, что селективная блокада ИЛ-23 нормализует выработку этих цитокинов.
Концентрация ИЛ-23 повышена в коже у пациентов с бляшечным псориазом. В исследованиях in vitro было показано, что гуселькумаб подавляет биологическую активность ИЛ-23 путем блокирования его взаимодействия с рецептором ИЛ-23 на поверхности клеток с последующим нарушением опосредованных ИЛ-23 сигнальных, активирующих и цитокиновых каскадов.
Клинические эффекты гуселькумаба при бляшечном псориазе связаны с блокадой цитокинового пути ИЛ-23.
Фармакодинамика
В ходе исследования 1 фазы было показано, что терапия гуселькумабом приводит к снижению экспрессии генов пути ИЛ-23/Th17 и изменению профиля экспрессии генов, ассоциированных с псориазом. Это было продемонстрировано при помощи сравнения результатов анализа матричной РНК, полученной из биопсийного материала пораженной кожи пациентов с псориазом на 12-ой неделе исследования, с исходными данными. В ходе того же исследования 1 фазы, терапия гуселькумабом приводила к улучшению гистологических показателей на 12-ой неделе, включая снижение толщины эпидермального слоя кожи и уменьшение удельного количества Т-клеток. Кроме того, в ходе исследований II фазы и III фазы было показано снижение плазменных концентраций ИЛ-17А, ИЛ-17F и ИЛ-22 в группе пациентов, получавших терапию гуселькумабом, по сравнению с группой плацебо. Эти результаты соотносятся с положительным клиническим эффектом, наблюдаемым при применении гуселькумаба у пациентов с бляшечным псориазом.
Иммуногенность
Так же, как и другие белковые препараты, гуселькумаб обладает потенциальной иммуногенностью. При объединенном анализе исследований II и III фазы образование антител к гуселькумабу было отмечено у 5,5% пациентов, получавших терапию препаратом Тремфея в течение срока вплоть до 52-х недель. Среди пациентов, у которых было выявлено образование антител к препарату, примерно у 7% антитела были классифицированы как нейтрализующие, что составляет 0,4% от общего числа пациентов, получавших препарат Тремфея. Образование антител к препарату не было ассоциировано с более низкой его эффективностью или с развитием реакций в месте введения препарата.
Фармакокинетика
Всасывание
У здоровых добровольцев после однократной подкожной инъекции в дозе 100 мг средняя максимальная концентрация гуселькумаба в плазме крови (Сmax) составляла 8,09±3,68 мкг/мл и достигалась примерно через 5,5 дней от момента введения.
Равновесная плазменная концентрация гуселькумаба достигалась к 20-ой неделе после подкожного введения 100 мг гуселькумаба на 0-ой и 4-ой неделях с последующими введениями каждые 8 недель. В ходе 2 клинических исследований III фазы среднее значение равновесной плазменной концентрации гуселькумаба составило соответственно 1,15±0,73 мкг/мл и 1,23±0,84 мкг/мл.
Абсолютная биодоступность гуселькумаба после одной подкожной инъекции в дозе 100 мг у здоровых добровольцев составляла около 49%.
Распределение
В ходе различных исследований средний объем распределения в конечной фазе (Vz) после однократного внутривенного введения препарата здоровым добровольцам составлял от 7 до 10 л.
Метаболизм
Точный путь метаболизма гуселькумаба не определен. Предполагается, что гуселькумаб, как человеческое моноклональное антитело класса IgG, должен разрушаться до небольших пептидов и аминокислот через различные катаболические пути так же, как и другие эндогенные антитела класса IgG.
Выведение
Средний системный клиренс (CL) после однократного внутривенного введения у здоровых добровольцев составлял в различных исследованиях от 0,288 до 0,479 л/сутки.
Средний период полувыведения (Т1/2) гуселькумаба составлял в различных исследованиях около 17 суток у здоровых добровольцев и от 15 до 18 суток у пациентов с бляшечным псориазом.
Линейность дозы
Системная экспозиция гуселькумаба (Сmax и площадь под кривой «концентрация-время» (AUC)) после однократного подкожного введения в дозах от 10 мг до 300 мг здоровым добровольцам и пациентам с бляшечным псориазом увеличивалась примерно пропорционально дозе.
Особые группы пациентов
Дети (в возрасте до 18 лет)
Безопасность и эффективность применения гуселькумаба у детей в возрасте до 18 лет не установлены.
Пожилые пациенты (в возрасте от 65 лет и старше)
Не проводилось специальных исследований у пожилых пациентов. Среди 1384 пациентов с бляшечным псориазом, получавших терапию препаратом Тремфея и включенных в популяционный фармакокинетический анализ, 70 пациентов были в возрасте от 65 лет и старше, включая 4-х участников в возрасте от 75 лет и старше. Популяционный фармакокинетический анализ показал отсутствие существенных изменений параметров CL/F среди пациентов в возрасте от 65 лет и старше в сравнении с пациентами в возрасте младше 65 лет, что предполагает отсутствие необходимости коррекции дозы у пациентов пожилого возраста.
Пациенты с нарушением функции почек
Не проводилось специальных исследований для оценки влияния нарушения функции почек на фармакокинетику гуселькумаба.
Пациенты с нарушением функции печени
Не проводилось специальных исследований для оценки влияния нарушения функции печени на фармакокинетику гуселькумаба.
Показания к применению
Препарат Тремфея показан для терапии бляшечного псориаза средней и тяжелой степени у взрослых пациентов, которым показана системная терапия.
Противопоказания
- тяжелая степень гиперчувствительности к гуселькумабу или любому вспомогательному веществу препарата;
- клинически значимые активные инфекции (например, активный туберкулез);
- детский возраст до 18 лет.
Применение при беременности и в период грудного вскармливания
Способные к деторождению женщины
Способные к деторождению женщины должны использовать эффективные методы контрацепции во время терапии препаратом Тремфея и на протяжении как минимум 12 недель после ее отмены.
Беременность
Данные о применении гуселькумаба у беременных женщин отсутствуют. В исследованиях у животных не наблюдалось прямого или косвенного неблагоприятного влияния гуселькумаба на беременность, развитие эмбриона/плода, родоразрешение и постнатальное развитие. В качестве меры предосторожности желательно избегать применения препарата Тремфея во время беременности.
Период грудного вскармливания
В настоящее время неизвестно, происходит ли экскреция гуселькумаба в грудное молоко человека. Поскольку иммуноглобулины экскретируются в грудное молоко человека, то нельзя исключать риск для младенца, находящегося на грудном вскармливании. Решение о прекращении грудного вскармливания во время терапии препаратом Тремфея и в течение срока вплоть до 12 недель после применения последней дозы или о прекращении терапии должно приниматься с учетом пользы грудного вскармливания для младенца и пользы препарата для здоровья матери.
Фертильность
Влияние препарата Тремфея на фертильность у человека не оценивалось. В исследованиях у животных не наблюдалось прямого или косвенного неблагоприятного влияния гуселькумаба на фертильность.
Способ применения и дозы
Способ применения
Препарат Тремфея предназначен для подкожных инъекций.
Дозы
Рекомендуемая доза препарата Тремфея составляет 100 мг в виде подкожной инъекции.
Вторая инъекция осуществляется через 4 недели после первой, с последующими введениями 1 раз каждые 8 недель.
Следует рассмотреть прекращение терапии у пациентов с отсутствием ответа на терапию после 16 недель применения препарата.
Общие указания по применению препарата
Препарат Тремфея предназначен для применения под контролем и наблюдением врача. Введение препарата может осуществляться медицинским работником или пациентом самостоятельно, после обучения технике выполнения подкожных инъекций.
Каждый шприц предназначен только для однократного использования.
Особые группы пациентов
Дети (в возрасте до 18 лет)
Эффективность и безопасность применения препарата Тремфея у детей не установлены. Рекомендации по применению препарата у детей отсутствуют.
Пожилые пациенты (в возрасте от 65 лет и старше)
Коррекция дозы не требуется.
Информация о применении у пациентов в возрасте от 65 лет и старше ограничена.
Пациенты с нарушением функции почек
Исследований препарата Тремфея у пациентов с нарушением функции почек не проводилось. Рекомендации по дозированию отсутствуют.
Пациенты с нарушением функции печени
Исследований препарата Тремфея у пациентов с нарушением функции печени не проводилось. Рекомендации по дозированию отсутствуют.
Указания по введению препарата
Перед инъекцией
После инъекции
Для инъекции потребуются:
- спиртовая салфетка/тампон
- ватный тампон или марлевая салфетка
- пластырь
- контейнер для острых предметов (см. этап 3)
Этап 1. Подготовка к инъекции
Осмотр упаковки препарата
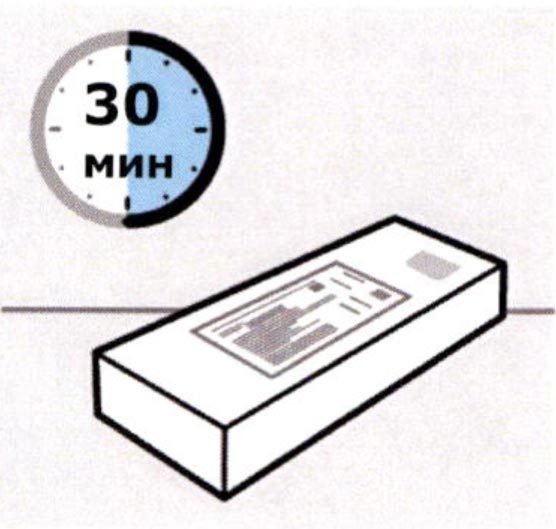
Препарат в картонной пачке достают из холодильника, помещают на ровную поверхность и выдерживают при комнатной температуре в течение как минимум 30 мин перед использованием. Не допускается нагревание препарата каким-либо другим способом.
Необходимо проверить срок годности на картонной пачке препарата.
Нельзя применять препарат по истечении срока годности.
Нельзя применять препарат если картонная пачка уже была вскрыта ранее.
Выбор места введения инъекции
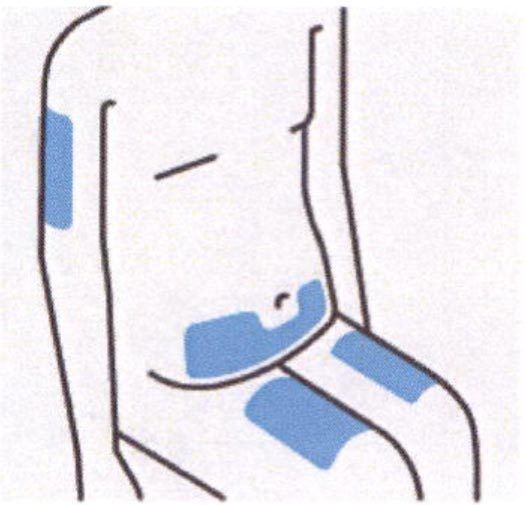
Необходимо выбрать из следующих возможных мест введения инъекции:
-передняя сторона бедра (рекомендуется)
-нижняя часть живота
Нельзя вводить инъекцию на расстоянии ближе 5 см от пупка.
-задняя поверхность плеча (если инъекции вводится не самостоятельно)
Нельзя вводить инъекцию в области болезненной кожи, синяков и кожи, пораженной псориазом.
Нельзя вводить инъекцию в области шрамов и растяжек кожи.
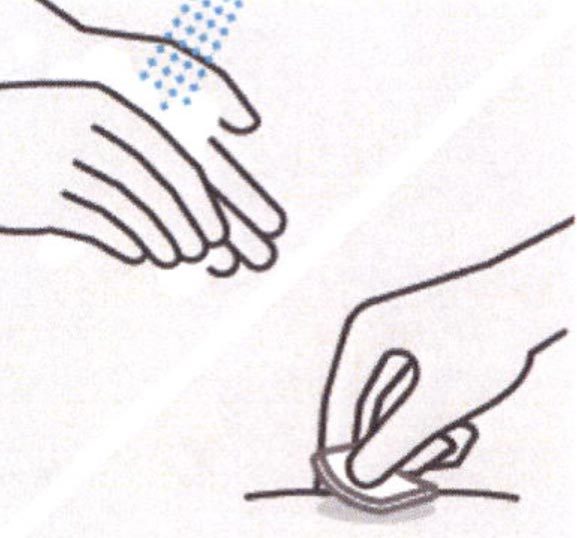
Очищение места введения инъекции
Необходимо тщательно вымыть руки мылом и теплой водой.
Выбранное место введения инъекции протирают спиртовой салфеткой/тампоном и дают высохнуть.
Нельзя трогать или дуть на место введения инъекции после его очищения.
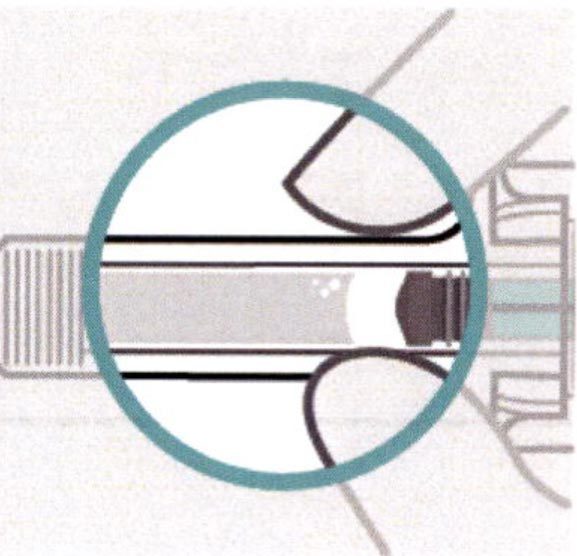
Осмотр раствора
Шприц извлекают из пачки картонной.
Осматривают раствор через смотровое окно. Раствор должен быть прозрачным, бесцветным или желтоватым, и может содержать маленькие прозрачные или белые частицы. Также могут видны пузырьки воздуха.
Нельзя вводить инъекцию, если раствор помутнел, изменил цвет или содержит крупные частицы.
Этап 2. Введение инъекции
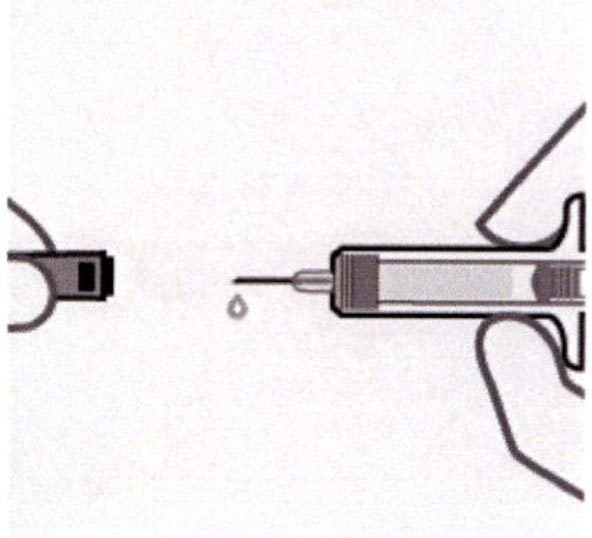
Снятие колпачка иглы
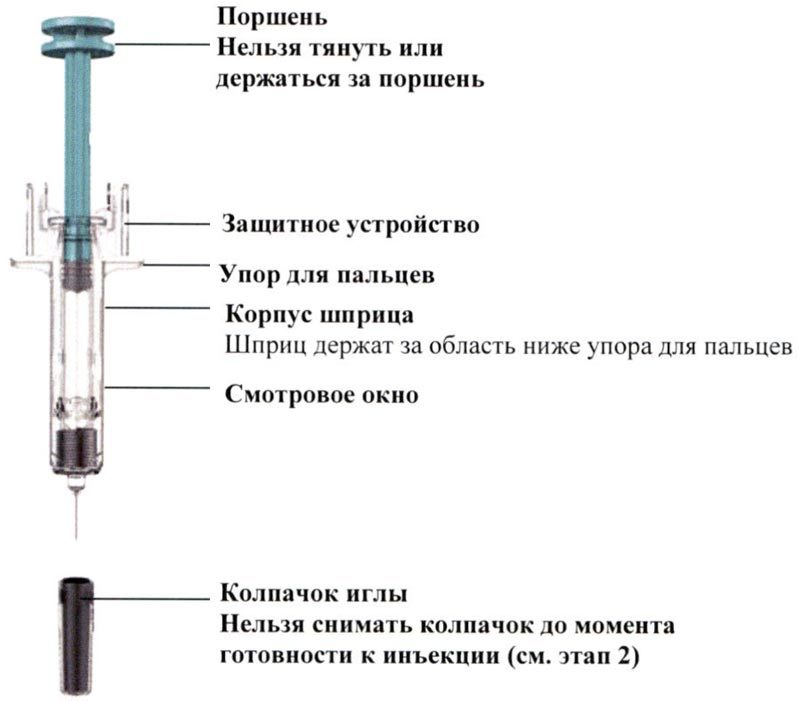
Держа шприц за корпус, быстро снимают колпачок иглы. После снятия колпачка возможно появление капель раствора на игле.
Инъекция должна быть введена в течение 5 мин после снятия колпачка.
Нельзя повторно надевать колпачок на иглу, так как при этом возможно повреждение иглы.
Нельзя трогать иглу руками или дотрагиваться иглой до какой-либо поверхности.
Нельзя использовать препарат в случае падения шприца.
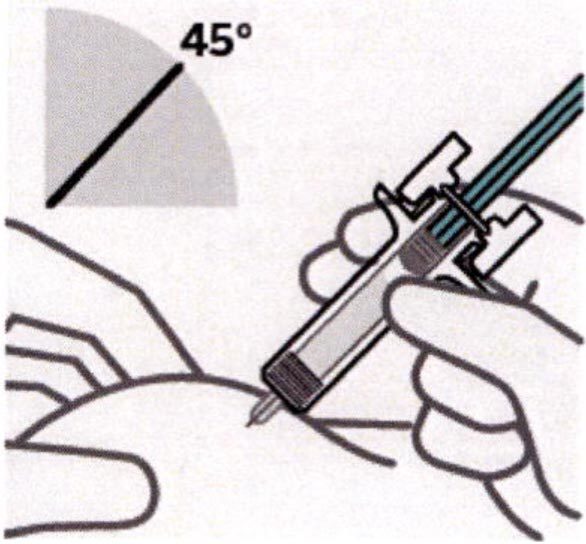
Расположение пальцев и введение иглы
Большой, указательный и средний пальцы руки необходимо разметить на шприце в области ниже упора для пальцев, как показано на рисунке.
Нельзя трогать поршень или область выше упора для пальцев, так как это может привести к преждевременной активации защитного устройства.
Второй рукой захватывают складку кожи на выбранном месте введения инъекции. Располагают шприц под углом около 45° к поверхности кожи.
Очень важно захватить достаточно кожи для введения инъекции подкожно, а не внутримышечно.
Вводят иглу быстрым движением.
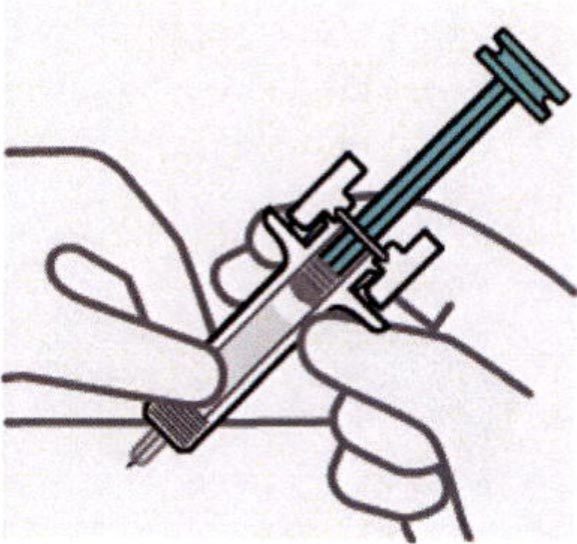
Освобождение складки кожи и изменение положения руки
Второй рукой захватывают корпус шприца.
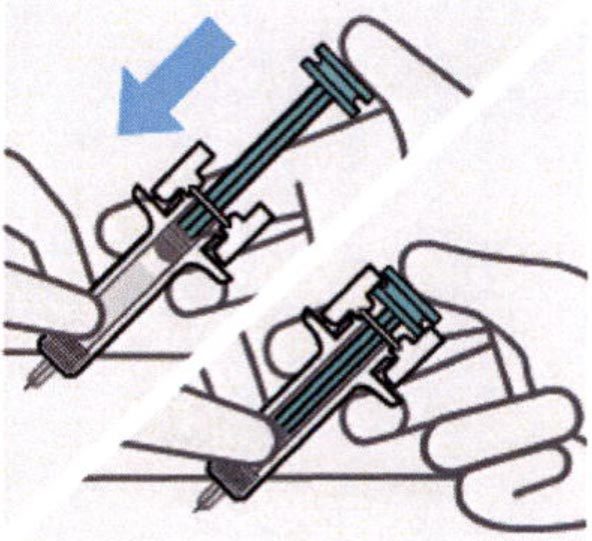
Нажатие на поршень
Помещают большой палец руки на поршень и нажимают на него до тех пора, пока он не остановится.
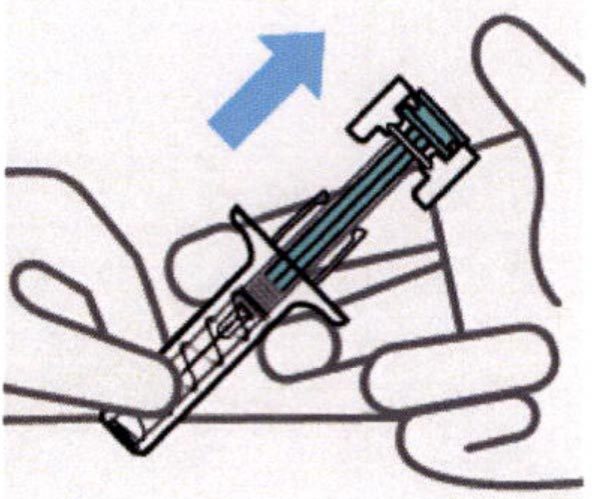
Снятие давления с поршня
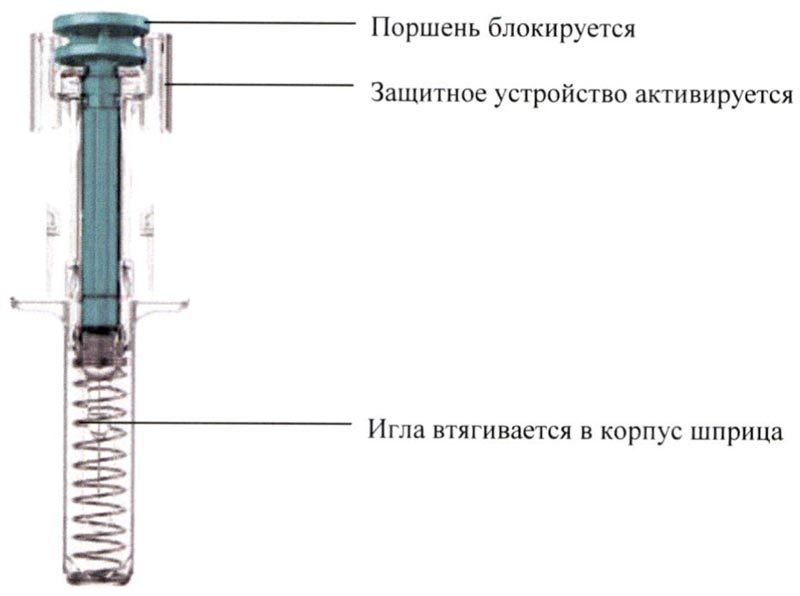
Защитное устройство закрывает и блокирует иглу, удаляя ее из кожи.
Этап 3. После введения инъекции
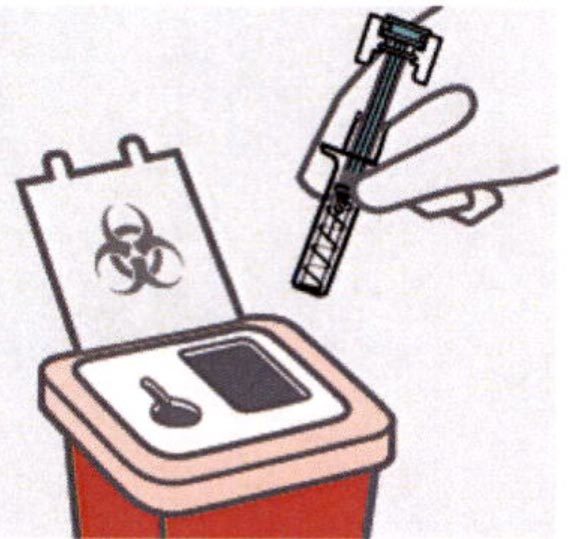
Утилизация использованных шприцев
Использованные шприцы утилизируют в контейнеры для острых предметов.
Проверка места введения инъекции
На месте введения инъекции может появится небольшое количество крови или жидкости.
Следует надавить на кожу ватным тампоном или марлевой салфеткой до остановки кровотечения.
Нельзя растирать место введения инъекции.
При необходимости место инъекции заклеивают пластырем.
Побочное действие
Клинические исследования у взрослых пациентов с псориазом
Профиль безопасности препарата Тремфея у пациентов с псориазом средней и тяжелой степени основан на данных, полученных в ходе клинических исследований II и III фазы). Из 1748-ми пациентов, получавших терапию препаратом Тремфея, 1393-м пациентам препарат вводился как минимум на протяжении 6-ти месяцев (24 недели), и 728-ми пациентам препарат вводился как минимум на протяжении 1-го года (т.е. вплоть до 48-ой недели).
Побочные действия
Побочные действия препарата Тремфея представлены в Таблице 1. Частота их возникновения рассчитана по итогам терапии препаратом Тремфея (доза 100 мг, подкожное введение) 823-х пациентов с псориазом средней и тяжелой степени в ходе плацебо-контролируемого периода исследований продолжительностью 16 недель. Побочные действия приведены в соответствии с системно-органной классификацией и в порядке убывания их частоты с использованием следующих обозначений: очень часто (≥1/10 случаев), часто (≥1/100 и <1/10 случаев), нечасто (≥1/1000 и <1/100 случаев) и редко (≥1/10000 и <1/1000 случаев).
Таблица 1: Побочные действия, отмеченные в ходе клинических исследований
| Инфекции и инвазии | Очень часто: инфекции верхних дыхательных путей |
| Часто: гастроэнтерит, грибковые инфекции кожи, инфекции, вызываемые вирусом простого герпеса | |
| Нарушения со стороны иммунной системы | Нечасто: гиперчувствительность |
| Нарушения со стороны нервной системы | Часто: головная боль |
| Нарушения со стороны желудочно-кишечного тракта | Часто: диарея |
| Нарушения со стороны кожи и подкожной клетчатки | Часто: крапивница |
| Нечасто: сыпь | |
| Нарушения со стороны опорно¬двигательного аппарата и соединительной ткани | Часто: артралгия |
| Общие нарушения и реакции в месте введения препарата | Часто: покраснение кожи в месте инъекции |
| Нечасто: боль в месте инъекции |
Передозировка
Однократное внутривенное введение препарата Тремфея в дозах вплоть до 987 мг (10 мг/кг) у здоровых добровольцев и однократное подкожное введение препарата Тремфея в дозах вплоть до 300 мг у пациентов с псориазом в ходе клинических исследований не вызывали токсичности, требующей ограничения дозы. В случае возникновения передозировки следует наблюдать пациента на предмет жалоб или симптомов побочных действий препарата, и в случае необходимости немедленно начать симптоматическую терапию.
Взаимодействие с другими лекарственными препаратами
Взаимодействия с субстратами изоферментов CYP450
В исследованиях I фазы у пациентов с псориазом средней и тяжелой степени при однократном введении гуселькумаба изменения системной экспозиции (Сmax и AUCinf) мидазолама, S-варфарина, омепразола, декстрометорфана и кофеина не являлись клинически значимыми, что свидетельствует о малой вероятности возникновения лекарственного взаимодействия гуселькумаба и субстратов различных изоферментов CYP (CYP3А4, CYP2C9, СYP2C19, CYP2D6 и CYP1A2). При совместном применении с субстратами изоферментов CYP450 коррекция дозы гуселькумаба не требуется.
Живые вакцины/терапевтические инфекционные агенты
Живые вакцины не должны применяться у пациентов, получающих терапию препаратом Тремфея.
Сопутствующая иммуносупрессивная терапия или фототерапия
Эффективность и безопасность применения препарата Тремфея в комбинации с иммуносупрессорами, включая биологические препараты, или в комбинации с фототерапией, не изучались.
Особые указания
Инфекции
Применение препарата Тремфея может увеличивать риск возникновения инфекций.
Не следует начинать терапию препаратом Тремфея у пациентов с наличием какой-либо клинически значимой активной инфекцией до момента ее разрешения или до начала адекватной терапии инфекции.
Пациенты, получающие терапию препаратом Тремфея, должны быть проинформированы о том, что при появлении каких-либо признаков хронической или острой инфекции им следует обратиться за медицинской помощью. В случае развития у пациента клинически значимой или серьезной инфекции или при отсутствии ответа на стандартную терапию инфекции, следует проводить тщательное наблюдение за пациентом и отменять терапию препаратом Тремфея до момента разрешения инфекции.
Выявление туберкулеза до начала терапии
Перед началом терапии препаратом Тремфея необходимо обследовать пациентов на предмет наличия туберкулеза. Пациенты, получающие терапию препаратом Тремфея, должны наблюдаться на предмет возникновения признаков и симптомов активного туберкулеза как во время, так и после терапии. Не следует применять препарат Тремфея у пациентов с активным туберкулезом. Следует рассмотреть целесообразность проведения противотуберкулезной терапии перед началом лечения препаратом Тремфея у пациентов с латентным или активным туберкулезом в анамнезе, для которых отсутствует подтверждение проведения адекватного курса терапии туберкулеза.
Реакции гиперчувствительности
Реакции гиперчувствительности тяжелой степени отмечались в пострегистрационном периоде применения препарата Тремфея. В некоторых случаях такие реакции возникали в первые дни после применения гуселькумаба, в том числе крапивница и одышка. При возникновении реакций гиперчувствительности тяжелой степени должно быть немедленно прекращено применение препарата Тремфея и инициирована соответствующая терапия.
Вакцинация
Следует рассмотреть необходимость выполнения всех полагающихся по возрасту пациента прививок, в соответствии с календарем прививок, до начала терапии препаратом Тремфея. У пациентов, получающих терапию препаратом Тремфея, живые вакцины не должны применяться (отсутствуют данные об ответе на введение живых или инактивированных вакцин).
В случае необходимости введения живой вирусной или бактериальной вакцины применение препарата Тремфея должно быть приостановлено на срок не менее 12 недель после введения последней дозы и может быть возобновлено не ранее, чем через 2 недели после вакцинации.
Влияние на способность управлять транспортными средствами и механизмами
Не проводилось исследований по оценке влияния применения препарата Тремфея на способность управлять транспортными средствами и механизмами.
Форма выпуска
Раствор для подкожного введения, 100 мг/мл; по 1 мл раствора в шприце из стекла 1 типа с устройством защиты иглы. По 1 шприцу вместе с инструкцией по применению в пачке картонной.
Условия хранения
При температуре от 2 до 8 °С в защищенном от света месте.
Не замораживать. Не встряхивать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
По рецепту.
Производитель
Силаг АГ
Хохштрассе 201, 8200 Шаффхаузен, Швейцария
Владелец регистрационного удостоверения/органнзация, принимающая претензии потребителей:
ООО «Джонсон & Джонсон», Россия, 121614, г. Москва, ул. Крылатская, д. 17, корп. 2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакологическое действие
Моноклональное человеческое антитело типа IgG1λ, которое селективно связывается с белком интерлейкина 23 (ИЛ-23) с высокой специфичностью и аффинностью. ИЛ-23 — это регуляторный цитокин, который влияет на дифференцировку, распространение и жизнеспособность субпопуляций Т-клеток (например, Th17 и Тс17) и незрелых субпопуляций иммунных клеток, являющихся источником эффекторных цитокинов, включая ИЛ-17А, ИЛ-17F и ИЛ-22, способствующих развитию воспалительных заболеваний. В исследованиях у людей было показано, что селективная блокада ИЛ-23 нормализует выработку этих цитокинов. Концентрация ИЛ-23 повышена в коже у пациентов с бляшечным псориазом. В исследованиях in vitro было показано, что гуселькумаб подавляет биологическую активность ИЛ-23 путем блокирования его взаимодействия с рецептором ИЛ-23 на поверхности клеток с последующим нарушением опосредованных ИЛ-23 сигнальных, активирующих и цитокиновых каскадов
Клинические эффекты гуселькумаба при бляшечном псориазе связаны с блокадой цитокинового пути ИЛ-23.
Показано, что терапия гуселькумабом приводит к снижению экспрессии генов пути ИЛ-23/Th17 и изменению профиля экспрессии генов, ассоциированных с псориазом.Терапия гуселькумабом приводила к улучшению гистологических показателей, включая снижение толщины эпидермального слоя кожи и уменьшение удельного количества Т-клеток. Кроме того, у пациентов, получавших терапию гуселькумабом было показано снижение плазменных концентраций ИЛ-17А, ИЛ-17F и ИЛ-22 в группе пациентов, получавших терапию гуселькумабом, по сравнению с группой плацебо. Эти результаты соотносятся с положительным клиническим эффектом, наблюдаемым при применении гуселькумаба у пациентов с бляшечным псориазом.
Гуселькумаб обладает потенциальной иммуногенностью. Среди пациентов, у которых было выявлено образование антител к препарату, примерно у 7% антитела были классифицированы как нейтрализующие, что составляет 0.4% от общего числа пациентов, получавших гуселькумаб. Образование антител к гуселькумабу не было ассоциировано с более низкой его эффективностью или с развитием реакций в месте введения.
Фармакокинетика
У здоровых добровольцев после однократной п/к инъекции в дозе 100 мг средняя Cmax гуселькумаба в плазме крови составляла 8.09±3.68 мкг/мл и достигалась примерно через 5.5 дней от момента введения. Плазменная Css гуселькумаба достигалась к 20 неделе после п/к введения гуселькумаба в дозе 100 мг на 0-й и 4-й неделях с последующими введениями каждые 8 недель. Абсолютная биодоступность гуселькумаба после одной п/к инъекции в дозе 100 мг у здоровых добровольцев составляла около 49%. В ходе различных исследований средний Vd в конечной фазе после однократного в/в введения здоровым добровольцам составлял от 7 до 10 л. Точный путь метаболизма гуселькумаба не определен. Предполагается, что гуселькумаб, как человеческое моноклональное антитело класса IgG, должен разрушаться до небольших пептидов и аминокислот через различные катаболические пути так же, как и другие эндогенные антитела класса IgG. Средний системный клиренс после однократного в/в введения у здоровых добровольцев составлял в различных исследованиях от 0.288 до 0.479 л/сут. Средний T1/2 гуселькумаба составлял в различных исследованиях около 17 сут у здоровых добровольцев и от 15 до 18 сут у пациентов с бляшечным псориазом. Системная экспозиция гуселькумаба (Cmax и AUC) после однократного п/к введения в дозах от 10 мг до 300 мг здоровым добровольцам и пациентам с бляшечным псориазом увеличивалась примерно пропорционально дозе.
Показания активного вещества
ГУСЕЛЬКУМАБ
Лечение бляшечного псориаза средней и тяжелой степени у взрослых пациентов, которым показана системная терапия.
Режим дозирования
Предназначен для применения под контролем и наблюдением врача.
Для п/к инъекций.
Рекомендуемая доза составляет 100 мг в виде п/к инъекции. Вторая инъекция осуществляется через 4 недели после первой, с последующими введениями 1 раз каждые 8 недель.
Следует рассмотреть прекращение терапии у пациентов с отсутствием ответа на терапию после 16 недель применения.
Побочное действие
Инфекции и инвазии: очень часто — инфекции верхних дыхательных путей; часто — гастроэнтерит, грибковые инфекции кожи, инфекции, вызываемые вирусом простого герпеса.
Со стороны иммунной системы: нечасто — повышенная чувствительность.
Со стороны нервной системы: часто — головная боль.
Со стороны пищеварительной системы: часто — диарея.
Аллергические реакции: часто — крапивница.
Со стороны костно-мышечной системы: часто — артралгия.
Местные реакции: боли и покраснение в месте инъекции.
Противопоказания к применению
Тяжелая степень гиперчувствительности к гуселькумабу;
клинически значимые активные инфекции (например, активный туберкулез); детский возраст до 18 лет.
Применение при беременности и кормлении грудью
Данные о применении гуселькумаба у беременных женщин отсутствуют. В исследованиях у животных не наблюдалось прямого или косвенного неблагоприятного влияния гуселькумаба на беременность, развитие эмбриона/плода, родоразрешение и постнатальное развитие. В качестве меры предосторожности желательно избегать применения гуселькумаба при беременности.
Женщины детородного возраста должны использовать эффективные методы контрацепции в период лечения и в течение не менее 12 недель после его отмены.
В настоящее время неизвестно, выделяется ли гуселькумаб с грудным молоком у человека. Решение о прекращении грудного вскармливания во время лечения гуселькумабом и в течение 12 недель после применения последней дозы или о прекращении терапии следует принимать с учетом пользы грудного вскармливания для младенца и пользы терапии для матери.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Особые указания
Не следует начинать терапию гуселькумабом у пациентов с наличием какой-либо клинически значимой активной инфекции до момента ее разрешения или до начала адекватной терапии инфекции.
В случае развития у пациента клинически значимой или серьезной инфекции или при отсутствии ответа на стандартную терапию инфекции, следует проводить тщательное наблюдение за пациентом и отменить терапию гуселькумабом до момента разрешения инфекции.
Не следует применять гуселькумаб у пациентов с активным туберкулезом. Следует рассмотреть целесообразность проведения противотуберкулезной терапии перед началом лечения гуселькумабом у пациентов с латентным или активным туберкулезом в анамнезе, для которых отсутствует подтверждение проведения адекватного курса терапии туберкулеза.
При возникновении реакций гиперчувствительности тяжелой степени должно быть немедленно прекращено применение гуселькумаба и инициирована соответствующая терапия.
Передозировка
Следует рассмотреть необходимость выполнения всех полагающихся по возрасту пациента прививок, в соответствии с календарем прививок, до начала терапии гуселькумабом. У пациентов, получающих терапию гуселькумабом, не следует применять живые вакцины (отсутствуют данные об ответе на введение живых или инактивированных вакцин).
В случае необходимости введения живой вирусной или бактериальной вакцины применение гуселькумаба следует приостановить на срок не менее 12 недель после введения последней дозы и может быть возобновлено не ранее, чем через 2 недели после вакцинации.
Актуальность
Препарат гуселькумаб, человеческое антитело, ингибитор интерлейкина-23, одобрен в июле 2020 года американским Food and Drug Administration для лечения взрослых пациентов с активным псориатическим артритом.
Отметим, что ранее в 2017 году препарат был одобрен для терапии бляшечного псориаза.
Одобрение препарата стало возможно после получения положительных результатов исследований DISCOVER-1 и DISCOVER-2.
Клинические исследования
- В исследования DISCOVER-1 и DISCOVER-2. были включены 1120 пациентов с активным псориатическим артритом, которые ранее не получали биологическую терапию или имели неполный ответ на 1 или 2 ингибитора фактора некроза опухоли альфа (примерно 30% пациентов).
- До включения в исследования пациенты получали апремиласт, болезнь-модифицирующий противоревматический препарат (почти 58% пациентов получали метотрексат) или НПВП.
Препарат использовали в дозе 100 мг подкожно каждые 8 недель, стартовая доза 100 мг на 0 и 4 неделе.
- Согласно результатам анализа, на фоне гуселькумаба достигалось 20% улучшение ответа по шкале American College of Rheumatology на 24 неделе. Частота ответа составила 52% в исследовании DISCOVER-1 и 64% в исследовании DISCOVER-2, в то время как в группе плацебо этот показатель составил 22% и 33%, соответственно.
- Показано, что терапия гуселькумабом улучшала такие показатели как кожные проявления псориаза, энтезит, дактилит и слабость.
Анализ безопасности
- Анализ безопасности препарата продемонстрировал, что у пациентов может повышаться риск развития бронхита и снижаться число нейтрофилов.
- В числе прочих нежелательных явлений отмечались инфекции верхних дыхательных путей, головная боль, реакция в месте инъекции, артралгия, диарея, гастроэнтерит, тинеа и инфекция herpes simplex.
Источник: Jeff Evans. FDA Approves Tremfya (Guselkumab) for Psoriatic Arthritis. Medscape. July 15, 2020.
Generic name: guselkumab
Brand name: Tremfya
Dosage form: subcutaneous injection
Drug class: Interleukin inhibitors
What is guselkumab?
Guselkumab is an injectable medication used to treat two inflammatory, autoimmune conditions called plaque psoriasis and psoriatic arthritis.
Guselkumab is a type of biological drug called a human immunoglobulin G1 lambda (IgG1λ) monoclonal antibody. It works by blocking the action of interleukin-23 (IL-23) at its receptor. IL-23 is a naturally occurring small protein called a cytokine, which plays a role in your normal inflammatory and immune responses. By blocking the action of IL-23, guselkumab inhibits the release of small proteins called chemokines and cytokines that cause inflammation.
Guselkumab was first approved by the US Food and Drug Administration (FDA) in 2017. It comes in the form of a prefilled syringe and a One-Press injector.
No biosimilars of guselkumab have been approved. Biosimilars are highly similar versions of a biological drug that are designed to work in the same was as the original version of the drug, but they are not identical.
What is guselkumab used for?
Guselkumab is a prescription medicine used to treat adults:
- with moderate to severe plaque psoriasis who may benefit from taking injections or pills (systemic therapy) or phototherapy (treatment using ultraviolet or UV light)
- with active psoriatic arthritis (PsA).
It is not known if guselkumab is safe and effective in children under 18 years of age.
Important information
Guselkumab may cause serious side effects, including:
- Serious allergic reactions. Stop using guselkumab and get emergency medical help right away if you develop any of the following symptoms of a serious allergic reaction:
- fainting, dizziness, feeling lightheaded (low blood pressure)
- swelling of your face, eyelids, lips, mouth, tongue or throat
- trouble breathing or throat tightness
- chest tightness
- skin rash, hives
- itching
- Infections. Guselkumab is a medicine that may lower the ability of your immune system to fight infections and may increase your risk of infections. Your healthcare provider should check you for infections and tuberculosis (TB) before starting treatment with guselkumab and may treat you for TB before you begin treatment with guselkumab if you have a history of TB or have active TB. Your healthcare provider should watch you closely for signs and symptoms of TB during and after treatment with guselkumab.
Tell your healthcare provider right away if you have an infection or have symptoms of an infection, including:
- fever, sweats, or chills
- cough
- shortness of breath
- blood in your phlegm (mucus)
- muscle aches
- warm, red, or painful skin or sores on your body different from your psoriasis
- weight loss
- diarrhea or stomach pain
- burning when you urinate or urinating more often than normal
See «What are the side effects of guselkumab?» below for more information about side effects.
Who should not use guselkumab?
Do not use guselkumab if you have had a serious allergic reaction to guselkumab or any of the other ingredients in guselkumab. See below for a complete list of ingredients in guselkumab.
What should I tell my doctor before using guselkumab?
Before using guselkumab, tell your healthcare provider about all of your medical conditions, including if you:
- have any of the conditions or symptoms listed in the section «Important information» above.
- have an infection that does not go away or that keeps coming back.
- have TB or have been in close contact with someone with TB.
- have recently received or are scheduled to receive an immunization (vaccine). You should avoid receiving live vaccines during treatment with guselkumab.
How should I use guselkumab?
- Use guselkumab exactly as your healthcare provider tells you to use it.
- See the detailed «Instructions for Use» that comes with guselkumab for information on how to prepare and inject a dose of guselkumab, and how to properly throw away (dispose of) used guselkumab prefilled syringes or One-Press injectors.
- Prepare for your injection
- Remove your guselkumab prefilled syringe or One-Press injector carton from the refrigerator.
- Keep the prefilled syringe or One-Press injector in the carton and let it sit on a flat surface at room temperature for at least 30 minutes before use.
- Do not warm the prefilled syringe or One-Press injector any other way.
- Check the expiration date (‘EXP’) on the back panel of the carton.
- Do not use your prefilled syringe or One-Press injector if the expiration date has passed.
- Do not inject guselkumab if the perforations on the carton are broken. Call your healthcare provider or pharmacist for a refill.
- Choose injection site
- Select from the following areas for your injection:
- Front of thighs (recommended)
- Lower stomach area (lower abdomen), except for a 2-inch area right around your navel (belly-button)
- Back of upper arms (only if someone else is giving you the injection)
Do not inject into skin that is tender, bruised, red, hard, thick, scaly or affected by psoriasis.
- Select from the following areas for your injection:
- Clean injection site
- Wash your hands well with soap and warm water.
- Wipe your chosen injection site with an alcohol swab and allow it to dry.
- Do not touch, fan, or blow on the injection site after you have cleaned it.
- Inspect liquid
- Take your guselkumab prefilled syringe or One-Press injector out of the carton.
- Check the guselkumab prefilled syringe or One-Press injector liquid in the viewing window. It should be clear to slightly yellow and may contain tiny white or clear particles. You may also see one or more air bubbles. This is normal.
- Do not inject if the liquid is cloudy or discolored, or has large particles. Call your healthcare provider or pharmacist for a refill.
- Inject. guselkumab
- Using prefilled syringe
- Remove needle cover.
- Hold your prefilled syringe by the body and pull needle cover straight off. It is normal to see a drop of liquid.
- Inject guselkumab within 5 minutes of removing the needle cover.
- Do not put needle cover back on, as this may damage the needle or cause a needle stick injury.
- Do not touch needle or let it touch any surface.
- Do not use a guselkumab prefilled syringe if it is dropped. Call your healthcare provider or pharmacist for a refill.
- Position fingers and insert needle.
- Place your thumb, index and middle fingers directly under the finger flange, as shown.
- Do not touch plunger or area above finger flange as this may cause the needle safety device to activate.
- Use your other hand to pinch skin at the injection site. Position syringe at about a 45 degree angle to the skin.
- It is important to pinch enough skin to inject under the skin and not into the muscle.
- Insert needle with a quick, dart-like motion.
- Release pinch and reposition hand
- Use your free hand to grasp the body of the prefilled syringe.
- Press plunger
- Place thumb from the opposite hand on the plunger and press the plunger all the way down until it stops.
- Release pressure from plunger
- The safety guard will cover the needle and lock into place, removing the needle from your skin.
- Using a One-Press injector
- Twist and pull off bottom cap
- Keep hands away from the needle guard after the cap is removed.
- Inject guselkumab within 5 minutes of removing the cap.
- Do not put the cap back on, this could damage the needle.
- Do not use a One-Press injector if it is dropped after removing the cap. Call your healthcare provider or pharmacist for a new One-Press injector.
- Place on skin
- Position the One-Press injector straight onto the skin (about 90 degrees relative to injection site).
- Push handle straight down
- Medication injects as you push. Do this at a speed that is comfortable for you.
- Do not lift the One-Press injector during the injection. The needle guard will lock and the full dose will not be delivered.
- Complete injection
- Injection is complete when the handle is pushed all the way down, you hear a click, and the teal body is no longer visible.
- Lift straight up
- The yellow band indicates that the needle guard is locked.
- Using prefilled syringe
- After your injection
- Dispose of your prefilled syringe or One-Press injector
- Put your used guselkumab prefilled syringe or One-Press injector in an FDA-cleared sharps disposal container right away after use.
- Do not throw away (dispose of) your guselkumab prefilled syringe or One-Press injector in your household trash.
- Do not recycle your used sharps disposal container.
- For more information, see «How should I dispose of the used prefilled syringe or One-Press injector? under Storage below.
- Check injection site
- There may be a small amount of blood or liquid at the injection site. Hold pressure over your skin with a cotton ball or gauze pad until any bleeding stops.
- Do not rub the injection site.
- If needed, cover injection site with a bandage.
What happens if I miss a dose?
If you miss your guselkumab dose, inject a dose as soon as you remember. Then, take your next dose at your regular scheduled time. Call your healthcare provider if you are not sure what to do.
What happens if I overdose?
If you inject more guselkumab than prescribed, call your healthcare provider right away.
Dosing information
In patients with plaque psoriasis and psoriatic arthritis the recommended dose of guselkumab is 100 mg administered by subcutaneous injection at Week 0, Week 4 and every 8 weeks thereafter. In patients with psoriatic arthritis, guselkumab can be used alone or in combination with a conventional disease-modifying antirheumatic drugs (DMARDs) such as methotrexate.
See full prescribing information for further information about guselkumab dosing.
What are the side effects of guselkumab?
Guselkumab may cause serious side effects including:
- See «Important information» above.
The most common side effects of guselkumab include:
- upper respiratory infections
- joint pain (arthralgia)
- fungal skin infections
- headache
- diarrhea
- herpes simplex infections
- injection site reactions
- stomach flu (gastroenteritis)
- bronchitis
These are not all the possible side effects of guselkumab. Call your doctor for medical advice about side effects. You may report side effects to FDA at 1-800-FDA-1088.
Interactions
Tell your healthcare provider about all the medicines you take, including prescription and over-the-counter medicines, vitamins, and herbal supplements.
Pregnancy and breastfeeding
Tell your doctor if you are pregnant or plan to become pregnant. It is not known if guselkumab can harm your unborn baby.
Tell your doctor if you are breastfeeding or plan to breastfeed. It is not known if guselkumab passes into your breast milk.
Storage
- Store guselkumab in refrigerator at 36° to 46°F (2° to 8°C).
- Do not freeze guselkumab prefilled syringes or One-Press injector.
- Do not shake your guselkumab prefilled syringe or One-Press injector.
- Keep guselkumab prefilled syringe or One-Press injector in the original carton to protect from light and physical damage.
Keep guselkumab prefilled syringe or One-Press injector and all medicines out of reach of children.
How should I dispose of the used prefilled syringe or One-Press injector?
If you do not have an FDA-cleared sharps disposal container, you may use a household container that is:
- made of a heavy-duty plastic
- can be closed with a tight-fitting, puncture-resistant lid, without sharps being able to come out
- upright and stable during use
- leak-resistant
- properly labeled to warn of hazardous waste inside the container
When your sharps disposal container is almost full, you will need to follow your community guidelines for the right way to dispose of your sharps disposal container. There may be state or local laws about how you should throw away used needles and syringes.
For more information about safe sharps disposal, and for specific information about sharps disposal in the state that you live in, go to the FDA’s website at: www.fda.gov/safesharpsdisposal
What are the ingredients in guselkumab?
Active ingredient: guselkumab
Inactive ingredients: L-histidine, L-histidine monohydrochloride monohydrate, polysorbate 80, sucrose and water for injection
Not made with natural rubber latex.
Guselkumab is manufactured under the brand name Tremfya by Janssen Biotech, Inc., Horsham, PA 19044, U.S.
Popular FAQ
Yes, Tremfya is a biological medicine approved to treat adults with moderate-to-severe plaque psoriasis and psoriatic arthritis. A biological medicine is a large complex molecule made from living organisms using specialized technology. Tremfya works by blocking interleukin 23 (IL-23). Continue reading
More FAQ
- What are the new drugs for plaque psoriasis?
- How does Tremfya work to treat plaque and psoriatic arthritis?
Further information
Always consult your healthcare provider to ensure the information displayed on this page applies to your personal circumstances.
Medical Disclaimer
Препарат Тремфея (гуселькумаб) – это первый одобренный биологический препарат, избирательно блокирующий интерлейкин (ИЛ) -23
«Янссен», подразделение фармацевтических товаров ООО «Джонсон & Джонсон», объявляет о регистрации в России препарата Тремфея (гуселькумаб), который показан для лечения бляшечного псориаза средней и тяжелой степени у взрослых пациентов, которым показана системная терапия[1].
Гуселькумаб – первый биологический препарат, который избирательно блокирует интерлейкин (ИЛ) -23, ключевой цитокин в воспалительной реакции иммунной системы при псориазе[2],[3],[4],[5]. Терапия с использованием гуселькумаба предполагает две инициирующие инъекции на неделе 0 и 4, затем поддерживающие инъекции 1 раз в 2 месяца1.
Катерина Погодина, управляющий директор «Янссен» Россия и СНГ, генеральный директор ООО «Джонсон & Джонсон», прокомментировала: «Мы гордимся тем, что наш инновационный препарат для лечения псориаза получил одобрение регуляторных органов России и в скором времени будет доступен пациентам в нашей стране. Псориаз – тяжелое системное заболевание, которое откладывает серьёзный негативный отпечаток в первую очередь на качество жизни пациентов[6]. Ключевой показатель успешности терапии псориаза – достижение полного очищения кожи, а также снижение негативного влияния коморбидных состояний на здоровье пациента[7]. Гуселькумаб призван помочь пациентам с тяжелыми формами заболевания, помогая им сохранять достойное качество жизни, социальную активность и трудоспособность3,4,5».
Решение о государственной регистрации было принято Министерством здравоохранения РФ на основе ряда клинических исследований, подтвердивших эффективность и безопасность препарата Тремфея1. В частности, был достигнут высокий уровень очищения кожи, значительное снижение площади распространенности и тяжести течения псориаза, в том числе «проблемной» локализации у пациентов, находящихся на терапии гуселькумабом3, 4.
Алексей Алексеевич Кубанов, Председатель Российского общества дерматовенерологов и косметологов, член-корреспондент РАН, профессор, отметил: «Несколько лет назад Всемирная организация здравоохранения признала псориаз социально значимым заболеванием. Псориаз приносит много страданий пациентам, в том числе и психологических. Регистрация в России новых препаратов для системного лечения значительно расширяет возможности терапии для пациентов, страдающих тяжелыми, часто рецидивирующими формами псориаза. В отношении гуселькумаба можно сказать, что мы ожидаем, что данные об эффективности и безопасности препарата, полученные в ходе клинических исследований, будут продемонстрированы и при широком использовании препарата в ежедневной клинической практике в медицинских организациях дерматологического профиля3,4,5».
В 2017 году препарат Тремфея был одобрен Европейским медицинским агентством на основании данных, полученных в ходе трех клинических исследований фазы III8. Исследования VOYAGE 1 и 2, в ходе которых гуселькумаб сравнивался с плацебо и препаратом адалимумаб, показали высокий уровень очищения кожи уже через 16 недель терапии с 90-процентным снижением Индекса распространённости и тяжести псориаза (PASI 90) у 73,3% и 70,0% пациентов, получавших гуселькумаб (p<0,001 в сравнении с плацебо)3,4. К 24 неделе терапии достижение PASI 90 отмечалось у 80,2% и 75,2% пациентов получавших гуселькумаб по сравнению с 49,7% и 46,8% пациентов, получавших адалимумаб соответственно (P <0,001)3, 4. Высокий результат терапии гуселькумабом сохраняется: спустя 3 года 97,4% пациентов имеет ответ по индеку PASI 75 (значительное очищение кожи)[8].
В исследование NAVIGATE были включены пациенты, у которых не произошло полного или почти полного очищения кожи (по шкале IGA (Общая оценка состояния пациента исследователем) 0 или 1) к 16-й неделе терапии препаратом Стелара ® (устекинумаб), и которые затем были рандомизированы и переключены либо на терапию гуселькумабом, либо остались на терапии устекинумабом4. Среди пациентов, рандомизированных в группу терапии гуселькумаба, доля больных, достигших полного либо почти полного очищения кожи, у которых значение показателя IGA составило 0 или 1, показала значительно более высокое среднее число пациентов, а также показала по крайней мере 2-балльное улучшение индекса в период с 28-й по 40-ю неделю (по отношению к 16-й неделе) была значимо выше по сравнению с группой устекинумаба (1,5 против 0,7, P <0,001)5.
Программа клинических исследований гуселькумаба для лечения псориаза не выявила отчетливых данных о повышении рисков развития злокачественных новообразований, кардиоваскулярных или рисков развития серьезных инфекций, включая туберкулез и реактивацию латентного туберкулеза на фоне приема препарата3,4,5.
Пресс-релиз
[1] Государственный реестр лекарственных средств [Электронный ресурс], URL: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=06e7fa3a-e993-4bad-aa90-f28b2de029d3&t= Дата обращения: 08.08.2019
[2] Blauvelt A and Papp K.A et al. J Am Acad Dermatol 2017;76(3):405–17.
[3] Reich K and Armstrong A.W et al. J Am Acad Dermatol 2017;76(3):418–31
[4] Langley RG et al. Br J Dermatol 2018; 178: 114−123
[5] Bachelez H. The Lancet 2017;390:208–10.
[6] Kerdel F. The Importance of Early Treatment in Psoriasis and Management of Disease Progression. J Drugs Dermatol. 2018 Jul 1;17(7):737-742.
[7] Strober BE et al Clinical Goals and Barriers to Effective Psoriasis Care Dermatol Ther (Heidelb). 2019 Mar;9(1):5-18
[8] C.E.M Griffiths at al. Presented at Fall Clinical Dermatology congress, 18-21 October 2018, Las Vegas Nevada
