Халавен® (Halaven)
💊 Состав препарата Халавен®
✅ Применение препарата Халавен®
Описание активных компонентов препарата
Халавен®
(Halaven)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.07.03
Владелец регистрационного удостоверения:
Лекарственная форма
| Халавен® |
Р-р д/в/в введения 0.5 мг/1 мл: фл. 2 мл 1 или 6 шт. рег. №: ЛП-001782 |
Форма выпуска, упаковка и состав
препарата Халавен®
Раствор для в/в введения прозрачный, бесцветный.
Вспомогательные вещества: этанол — 0.05 мл, хлористоводородная кислота и натрия гидроксид — до pH 6.0-9.0, вода д/и — до 1 мл.
2 мл — флаконы бесцветного стекла (1) — пачки картонные.
2 мл — флаконы бесцветного стекла (6) — пачки картонные.
Фармакологическое действие
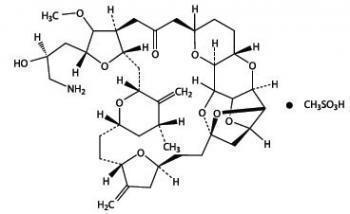
Противоопухолевое средство галихондриновой группы, ингибитор динамики микротрубочек нетаксанового ряда. По своей структуре препарат представляет собой упрощенный синтетический аналог галихондрина В, натурального вещества, выделенного из морской губки Halichondria okadai.
Эрибулин тормозит фазу роста микротрубочек, не влияя на фазу укорачивания, что приводит к формированию тубулиновых агрегатов, не обладающих функциональной активностью. Противоопухолевое действие эрибулина реализуется через тубулин-опосредованный антимитотический механизм, ведущий к блокаде клеточного цикла в фазах G2/M и нарушению формирования митотических веретен, что, в итоге, приводит к апоптотической гибели клетки в результате длительной блокировки митоза.
Эрибулин также влияет на микроокружение опухоли и ее фенотип с помощью механизмов, которые не связаны с его антимитотическим эффектом. Эти дополнительные эффекты эрибулина включают: (I) ремоделирование сосудистого русла опухоли, при котором улучшается перфузия центральной части опухоли и снижается ее гипоксия, и (II) фенотипический переход более агрессивных мезенхимальных фенотипов в менее агрессивные эпителиальные посредством инверсии эпителиально-мезенхимального перехода.
Фармакокинетика
Фармакокинетические параметры эрибулина не зависят от дозы или времени в интервале от 0.22 до 3.53 мг/м2.
Фармакокинетика эрибулина характеризуется быстрой фазой распределения, сменяемой продолжительной фазой выведения с конечным T1/2, в среднем, около 40 ч. Препарат имеет большой Vd (в среднем от 43 до 114 л/м2).
При концентрациях в плазме человека от 100 до 1000 нг/мл связывание эрибулина с белками плазмы составляет от 49% до 65%.
После введения пациентам 14С-меченого эрибулина фракция неизмененного препарата в плазме была подавляющей. Концентрации метаболитов соответствовали менее 0.6% исходного эрибулина, подтверждая тот факт, что значимых метаболитов эрибулина в организме человека не образуется.
Клиренс эрибулина составляет в среднем от 1.16 до 2.42 л/ч/м2. При еженедельном введении эрибулина значимой кумуляции не наблюдается.
Выводится эрибулин, главным образом, с желчью. Транспортный белок, отвечающий за экскрецию препарата с желчью, в настоящее время неизвестен. Доклинические исследования указывают на участие в этом процессе Р-гликопротеина. Однако показано, что в клинически значимых концентрациях эрибулин не является ингибитором P-гликопротеина in vitro.
In vivo сопутствующее введение кетоконазола, являющего ингибитором P-гликопротеина, не оказывает влияния на фармакокинетические параметры эрибулина (AUC и Cmax).
Исследования in vitro показали, что эрибулин не является субстратом транспортера органических катионов (ОСТ1).
После введения пациентам 14C-меченного эрибулина примерно 82% дозы выводилось с калом и 9% — с мочой. Большую часть радиоактивной метки в кале и моче составляет неизмененный эрибулин.
У пациентов с печеночной недостаточностью легкой (класс А по шкале Чайлд-Пью) или средней (класс В по шкале Чайлд-Пью) степени тяжести, связанной с образованием метастазов в печени, экспозиция эрибулина была выше, соответственно, в 1.8 и 3 раза по сравнению с пациентами с нормальной функцией печени.
Применение эрибулина в дозе 1.1 мг/м2 у пациентов с легкой печеночной недостаточностью и в дозе 0.7 мг/м2 — у пациентов с умеренной печеночной недостаточностью обеспечивало примерно ту же экспозицию, что и при применении 1.4 мг/м2 у пациентов с нормальной функцией печени.
У пациентов с почечной недостаточностью средней и тяжелой степени наблюдалось увеличение AUC с поправкой на дозу в 1.5 раза.
Показания активных веществ препарата
Халавен®
Местно-распространенный или метастатический рак молочной железы у пациентов, получавших ранее не менее одного режима химиотерапии по поводу распространенного заболевания. Предшествующая терапия должна включать антрациклины и таксаны в адъювантном режиме или в условиях метастатической формы заболевания (за исключением тех пациентов, которым не могли назначаться данные препараты).
Неоперабельная липосаркома у пациентов, получавших ранее химиотерапию антрациклинами по поводу распространенного или метастатического заболевания (за исключением тех пациентов, которым не могли назначаться данные препараты).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Вводят в/в.
Рекомендуемая доза препарата составляет 1.4 мг/м2 в 1-й и 8-й дни каждого 21-дневного цикла.
При развитии проявлений токсичности требуется коррекция дозы эрибулина.
После снижения дозы эрибулина ее обратное повышение в последующих циклах не рекомендуется.
Побочное действие
Определение категорий частоты нежелательных явлений: очень часто (≥1/10 случаев); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100) и редко (≥1/10 000, <1/1000).
Инфекционные и паразитарные заболевания: часто — инфекция мочевыводящих путей, пневмония, кандидоз полости рта, герпес слизистой оболочки полости рта, инфекция верхних дыхательных путей, назофарингит, ринит, опоясывающий лишай; нечасто — сепсис, нейтропенический сепсис, септический шок.
Со стороны крови и лимфатической системы: очень часто — нейтропения, лейкопения, анемия; часто — лимфопения, фебрильная нейтропения, тромбоцитопения; редко — диссеминированное внутрисосудистое свертывание крови.
Со стороны обмена веществ: очень часто — снижение массы тела; часто — гипокалиемия, гипомагниемия, обезвоживание, гипергликемия, гипофосфатемия.
Со стороны нервной системы: очень часто — периферическая невропатия, головная боль; часто — бессонница, депрессия, головокружение, гипестезия, летаргия, нейротоксичность.
Со стороны органов чувств: часто — повышение слезоотделения, конъюнктивит, вертиго, звон в ушах.
Со стороны сердечно-сосудистой системы: часто — тахикардия, «приливы», тромбоэмболия легочной артерии; нечасто — тромбоз глубоких вен.
Со стороны дыхательной системы: очень часто — диспноэ, кашель; часто — орофарингеальная боль, носовое кровотечение, ринорея; нечасто — интерстициальные заболевания легких.
Со стороны пищеварительной системы: очень часто — снижение аппетита, тошнота, запор, диарея, рвота; часто — боль в животе, стоматит, сухость ротовой полости, диспепсия, гастроэзофагеальная рефлюксная болезнь, вздутие живота, дисгевзия; нечасто — язвенное поражение слизистой оболочки ротовой полости, панкреатит.
Со стороны печени и желчевыводящих путей: часто — повышение активности АСТ, АЛТ, ГГТ, гипербилирубинемия; нечасто — гепатотоксичность.
Со стороны кожи и подкожных тканей: очень часто — алопеция; часто — сыпь, зуд, поражение ногтей, ночная потливость, сухость кожи, эритема, гипергидроз, ладонно-подошвенная эритродизестезия; частота неизвестна — синдром Стивенса-Джонсона/токсический эпидермальный некролиз.
Аллергические реакции: нечасто — ангионевротический отек.
Со стороны костно-мышечной системы: очень часто — артралгия и миалгия, боль в спине, боль в конечностях; часто — боль в костях, мышечный спазм, мышечно-скелетная боль и боль в груди, мышечная слабость.
Со стороны мочевыделительной системы: часто — дизурия; нечасто — гематурия, протеинурия, почечная недостаточность.
Общие реакции: очень часто — утомляемость/астения, лихорадка; часто — мукозиты, периферические отеки, боль, озноб, боль в груди, гриппоподобный синдром.
Противопоказания к применению
Беременность, период лактации (грудного вскармливания); возраст до 18 лет; повышенная чувствительность к эрибулину.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Женщины фертильного возраста должны быть проинформированы о необходимости применения контрацептивных средств в период лечения эрибулином, или в период лечения их партнеров, а также в течение 3 месяцев после его завершения.
В доклинических исследованиях наблюдалась тестикулярная токсичность препарата. До начала лечения пациентам мужского пола следует обратиться за консультацией по поводу консервации спермы, поскольку при лечении эрибулином существует вероятность развития необратимого бесплодия.
Применение у пожилых пациентов
Препарат противопоказан для применения у пожилых пациентов
Особые указания
С осторожностью следует применять при синдроме врожденного удлинения интервала QT; заболеваниях сердца (сердечная недостаточность, брадиаритмия); электролитном дисбалансе (например, гипокалиемия, гипомагниемия); одновременном приеме лекарственных средств, удлиняющих интервал QT (в т.ч. антиаритмических IA и III классов); одновременном приеме лекарственных средств, обладающих узким терапевтическим диапазоном и метаболизирующихся преимущественно изоферментом CYP3A4; при тяжелой печеночной недостаточности и нарушении функции печени, связанном с циррозом (применение препарата у данной группы пациентов не изучалось); почечной недостаточности средней и тяжелой степени.
У каждого пациента перед введением любой дозы эрибулина следует проводить клинический анализ крови. Лечение эрибулином можно начинать только при значении АЧН выше 1.5×109/л и числе тромбоцитов выше 100×109/л.
При развитии фебрильной нейтропении, а также при тяжелой нейтропении или тромбоцитопении, следует скорректировать лечение.
При активности АЛТ или АСТ, превышающей ВГН более чем в 3 раза, повышается риск развития нейтропении 4 степени и фебрильной нейтропении. При значениях билирубина, превышающих ВГН более чем в 1.5 раза, также повышается риск развития нейтропении 4 степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены.
При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог.
Следует вести постоянное наблюдение за возможными признаками периферической моторной или сенсорной невропатии у пациентов. Развитие тяжелой периферической невропатии требует задержки введения или уменьшения дозы.
В период лечения мониторинг ЭКГ рекомендуется проводить у пациентов с сердечной недостаточностью и брадиаритмиями, а также при одновременном приеме лекарственных средств, удлиняющих интервал QT (в т.ч. антиаритмических IA и III классов). До начала лечения следует скорректировать электролитный дисбаланс (например, гипокалиемию, гипомагниемию), а на фоне лечения мониторировать содержание этих электролитов в крови.
Лекарственное взаимодействие
Согласно исследованиям in vitro, эрибулин может быть слабым ингибитором изофермента CYP3A4. Данные in vivo не доступны. При одновременном применении с лекарственными средствами, обладающими узким терапевтическим диапазоном и метаболизирующимися преимущественно изоферментом CYP3A4 (например, алфентанил, циклоспорин, эрготамин, фентанил, пимозид, хинидин, сиролимус, такролимус) следует проявлять осторожность и вести наблюдение за нежелательными явлениями.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Немного фактов
Препарат Халавен противораковое средство, которое используется в терапии липосарком и недоброкачественных новообразований в молочной железе. Содержит в себе эрибулин, который относится к синтетическим кетоновым аналогам halichondrin B. Мощный митотический ингибитор препятствует образованию микротрубочек в атипичных клетках, что приводит к активации программы их самоуничтожения.
Международная классификация болезней (МКБ-10)
Лекарственный препарат применяется в терапии онкологических заболеваний II класса таких подгрупп:
- C49.9 недоброкачественные опухоли, локализующиеся в мягких тканях;
- C50 недоброкачественные новообразования в молочной железе.
Биохимический состав и форма выпуска
Халавен производится в виде раствора для в/в, в котором содержатся:
- эрибулина мезилат;
- метилкарбинол;
- хлористый водород;
- едкий натр;
- очищенная вода.
Выпускается в стеклянных пузырьках емкостью по 2 мл. В картонной белой пачке содержится 1 пузырек с лекарственным препаратом и инструкцией по его использованию.
Фармакотерапевтическое действие
Халавен препятствует формированию нетаксановых микротрубочек, что в дальнейшем приводит к нарушению митотического цикла в атипичных клетках. В лекарстве содержится эрибулин цитостатическое веществ, которое принадлежит к галихондриновой подгруппе противораковых средств. По структуре синтетический цитостатик практически не отличается от галихондрина В, извлеченного из Halichondria okadai.
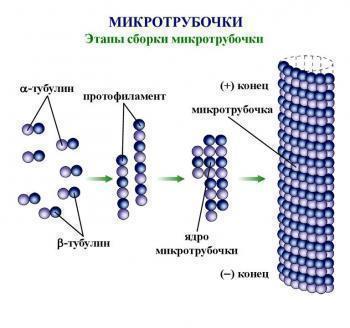
Активные компоненты лекарственного препарата приостанавливают фазу роста и сборки микротрубочек. За счет этого происходит образование тубулиновых агрегатов, которые не обладают необходимой для митоза функциональностью. Противораковое действие Халавена реализуется через антимитотические реакции, которые приводят к торможению клеточного цикла, а также нарушению биосинтеза митотических верен.
Курсовое применение эрибулина сопровождается апоптотической гибелью раковых клеток, что обусловлено продолжительной и практически необратимой блокадой митоза. Метаболиты препарата воздействуют и на фенотип недоброкачественных новообразований при помощи реакций, которые никак не связаны с антимитотическим действием.
Согласно результатам экспериментов, эрибулин обладает несколькими видами функциональной активности: ремоделирование капиллярного русла карцином, за счет которого снижается гипоксия новообразований и улучшается перфузия их центральных областей, а также перевод агрессивных мезенхимальных видов карцином и липосарком в менее агрессивные фенотипы эпителиальных новообразований.
Данные медицинских испытаний
Результативность Халавен в отношении локализованной и диссеминированной опухоли в молочной железе подтверждена в процессе рандомизированных испытаний. В них приняли участие более 1800 пациенток, у которых диагностировали раковое заболевание. Итоговыми точками оценки результативности противоопухолевого препарата являлись показатели выживаемости больных без прогрессирования новообразований.

В процессе двух клинических исследований II фазы, а также рандомизированных испытаний III фазы при участии около 500 пациентов оценивалась эффективность Халавена в терапии прогрессирующей и/или неоперабельной липосаркомы. Согласно результатам, эрибулин проявляет высокую фармакологическую активность в отношении раковых клеток, локализующихся в соединительнотканных и эпителиальных структурах. В связи с этим он может применяться в лечении не только липосарком, но и лейомиосарком.
Показания к применению
Противораковый препарат может использоваться как в монотерапии, так и в общей схеме комбинированного лечения недоброкачественных новообразований. Абсолютными показаниями к применению цитостатического средства считаются:
- фармакотерапия локализованного и диссеминированного рака железистых тканей у пациенток, ранее получавших 1 или 2 курса химиотерапии по причине развития распространенной злокачественной опухоли;
- фармакотерапия неоперабельных форм липосарком у пациентов, которые ранее проходили лечение антрациклиновыми антибиотиками по поводу локализованного или прогрессирующего ракового заболевания.
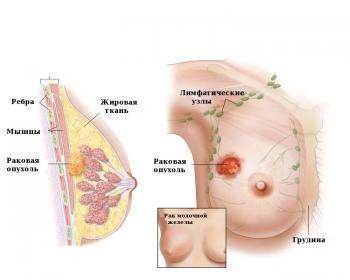
При карциноме, локализующейся в железистых тканях, Халавен назначается только в том случае, если больные предварительно проходили интенсивную терапию таксанами и антрациклиновыми антибиотиками в условиях прогрессирующей формы патологии или адъювантного режима.
Дозировочный режим
Препарат Халавен может использоваться только под контролем врача-онколога, имеющего практический опыт применения цитостатических лекарств. До начала фармакотерапии рекомендуется провести премедикацию противорвотными глюкокортикостероидами во избежание дегидратации организма.
Оптимальная доза эрибулина составляет 1.4 мг/м2. Раствор вводится только внутривенно на протяжении 3-5 минут. Лекарство используется только в первый и восьмой день 21-дневного цикла противоопухолевой терапии.
Рекомендуется на время прекратить лечение в случае возникновения одного из нижеперечисленных осложнений:
- концентрация тромбоцитов менее 75×109/л;
- концентрация нейтрофильных лейкоцитов менее 1×109/л;
- 3 или 4 степень негематологической токсичности.
Введение раствора на восьмой день терапии можно отложить только на 7 суток. Если в течение двух недель концентрация нейтрофилов и тромбоцитов не увеличилась, а степень негематологической токсичности не понизилась, необходимо пропустить очередную дозу противоопухолевого препарата.
Коррекция дозировки у особых групп пациентов
При дисфункции печени, спровоцированной метастазами, рекомендуется уменьшить дневную дозу эрибулина. При относительно несерьезных сбоях в функционировании паренхимы Халавен назначают в дозировке до 1.1 мг/м2, а при среднетяжелой степени патологии 0.7 мг/м2. В случае развития тяжелой формы недостаточности печени препарат не использования, но ожидается, что при нарушении фильтрующей функции паренхимы доза уменьшится минимум в 1.5 раза.
В случае использования цитостатического средства у больных с дисфункцией наблюдается увеличение экспозиции действующих веществ. Чтобы предотвратить развитие токсического синдрома, рекомендуется на протяжении всего курса фармакотерапии контролировать работу почек и уровень в крови креатинина.
Согласно инструкции по применению, противораковый раствор не используется в педиатрии. До настоящего момента безвредность и результативность цитостатика у больных до 18 лет не изучалась.
Возрастные изменения в организме не влияют на скорость метаболизации эрибулина в органах детоксикации или на период его полувыведения. Поэтому при назначении лекарства пациентам от 60 лет дозировку не корректируют.
Период вынашивания плода и лактация
Достаточной информации о применении противоопухолевого раствора у женщин во время беременности нет. Согласно данным доклинических испытаний, эрибулин обладает выраженной тератогенностью, фето- и эмбриотоксичностью. Поэтому Халавен не назначается женщинам в период вынашивания плода.
При сохранении репродуктивной активности пациентки должны быть проинформированы о необходимости использования надежных противозачаточных средств в процессе фармакотерапии. Также рекомендуется использовать контрацептивы еще в течение 2-3 месяцев после окончательного завершения курса.
Длительное лечение онкопатологий эрибулином чревато развитием у мужчин необратимого бесплодия. Препарат Халавен может проявлять тестикулярную активность, поэтому до начала терапии липосарком у мужчин нужно проконсультироваться по поводу возможного консервирования спермы.
Компоненты лекарства не экскретируются с грудным молоком, но риск возникновения побочных реакций у новорожденных не может быть исключен. Поэтому при назначении препарата в период лактации следует отменить грудное вскармливание.
Совместимость с алкоголем
На протяжении всего курса лечения нежелательно употреблять напитки, в которых содержится этанол. Это может привести к резкому обострению побочных эффектов и изменению фармакологических свойств эрибулина.
Взаимодействие с медикаментами
Инструкцией не рекомендуется смешивать раствор с другими медикаментами для парентерального введения. Перед использованием лекарство не разводят с 5% раствором глюкозы, т.к. это может привести к денатурации белков, которые содержатся в крови.

Более 70% компонентов противоракового средства экскретируются с желчью. При этом транспортные белки, ответственные за транспортировку молекул эрибулин, не были выявлены. Полная остановка транспорта метаболитов лекарства может сопровождаться увеличением плазменной концентрации в 2.5-3 раза. По этой причине нежелательно комбинировать Халавен с:
- Хинином;
- ингибиторами MRPs и OATPs;
- Лопинавиром;
- Циклоспорином;
- Дизопирамидом.
При лечении не следует использовать медикаменты, которые потенциально способны снизить уровень эрибулина в крови. К их числу относится Рифампицин, Карбамазепин и другие индукторы CYP3A4. В терапевтической концентрации медпрепарат не влияет на выделение таких ферментов как CYP2E1, CYP2C8, CYP2C19, CYP1A2 и CYP2D6.
Согласно данным испытаний in vitro, Халавен может угнетать секрецию печеночных ферментов, в частности изоэнзима CYP3A4. По этой причине не рекомендуется комбинировать раствор с медикаментами, которые метаболизируются за счет упомянутых ферментов. К их числу можно отнести Такролимус, Алфентанил, Эрготамин, Сиролимус и т.д.
Передозировка
При ошибочном введении высокой дозы эрибулин, превышающей норму в 4 раза, у больных развивается нейтропения и токсический синдром. Для облегчения симптоматики следует проводить паллиативную терапию в условиях стационара. После нормализации состояния терапию продолжают при условии постоянного контроля гемодинамических показателей и особенностей функционирования органов детоксикации.
Побочные эффекты
Чаще всего препарат Халавен приводит к угнетению функций органов кроветворения, в особенности костного мозга. В связи с этим у больных возникают осложнения в виде агранулоцитоза, тромбоцитопении, лейкопении и т.д. Не исключено возникновение симптомов периферической нейропатии.

На фоне длительного использования цитостатического раствора может развиться гастроинтестинальная токсичность, о чем свидетельствуют тошнота, анорексия, нарушение стула, стоматит, снижение аппетита. Сопутствующие побочные реакции могут включать в себя хроническую утомляемость, облысение, мышечно-скелетные боли, обострение инфекций.
В медицинских испытаниях II и III фазы Халавен вызывал такие нежелательные эффекты (перечислены в порядке убывания частоты возникновения):
- воспаление легких;
- абдоминальная боль;
- частые запоры;
- облысение;
- нейротоксичность;
- тахикардия;
- кровотечения из носа;
- инфекции уретрального канала;
- обострение герпетической болезни;
- кандидоз полости рта;
- ринофарингит;
- фебрильная нейтропения;
- гипергликемия.
;
Примерно у 2% больных во время фармакотерапии наблюдалось снижение массы тела на 10-11%. Чаще всего это связано с нарушением функций ЖКТ и развитием астенического синдрома.
Противопоказания
Цитостатический раствор не используют при лечении беременных и пациентов до 18 лет. Во избежание системной аллергии не следует принимать медпрепарат при гиперчувствительности к эрибулину.
Аналоги
К числу групповых аналогов Халавена относятся:
- Рефнот;
- Арглабин;
- Цитостазан;
- Кипролис;
- Бартизар;
- Газива;
- Бортезол.
Условия продажи и хранения
Противораковый раствор продается при наличии рецепта от врача. Хранится в недоступном для маленьких детей месте при соблюдении температурного режима в 15-30 градусов Цельсия. Максимальный срок годности 4 года.
Цены на Халавен в Москве

Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 22 500 руб.
Сертификаты и лицензии
 |
Фармакологическое действиеЭрибулин относится к ингибиторам динамики микротрубочек, принадлежащим к галихондриновой группе противоопухолевых средств. По своей структуре препарат представляет собой упрощенный синтетический аналог галихондрина В, натурального вещества, выделенного из морской губки Halichondria okadai.Эрибулин тормозит фазу роста микротрубочек, не влияя на фазу укорачивания, что приводит к формированию тубулиновых агрегатов, не обладающих функциональной активностью. Противоопухолевое действие эрибулина реализуется через тубулин-опосредованный антимитотический механизм, ведущий к блокаде клеточного цикла в фазах G2/M и нарушению формирования митотических веретен, что, в итоге, приводит к апоптотической гибели клетки в результате длительной необратимой блокировки митоза.Эрибулин также влияет на микроокружение опухоли и ее фенотип с помощью механизмов, которые не связаны с его антимитотическим эффектом. Эти дополнительные эффекты эрибулина включают: ремоделирование сосудистого русла опухоли, при котором улучшается перфузия центральной части опухоли и снижается ее гипоксия, и фенотипический переход более агрессивных мезенхимальных фенотипов в менее агрессивные эпителиальные посредством инверсии эпителиальномезенхимального перехода.Клиническая эффективность. Рак молочной железы: эффективность препарата при лечении местно-распространенного или метастатического рака молочной железы была подтверждена в двух рандомизированных сравнительных исследованиях третьей фазы с участием более 1800 пациентов, в которых конечными точками оценки эффективности были общая выживаемость и выживаемость без прогрессирования.Саркомы мягких тканей: эффективность препарата при лечении сарком мягких тканей была подтверждена в ходе двух исследований второй фазы и одного рандомизированного исследования третьей фазы в сравнении с дакарбазином с участием 452 пациентов с местно-распространенными неоперабельными и/или метастатическими саркомами мягких тканей одного из следующих подтипов — лейомиосаркома или липосаркома. Конечной точкой оценки эффективности была общая выживаемость. Применение в комбинации: применение эрибулина в комбинации с трастузумабом и капецитабином изучено в ходе двух исследований второй фазы. Фармакокинетика: фармакокинетика эрибулина характеризуется быстрой фазой распределения, сменяемой продолжительной фазой выведения с конечным периодом полувыведения (Т1/2), в среднем, около 40ч. Препарат имеет большой объем распределения (в среднем от 43 до 114л/м2).Эрибулин слабо связывается с белками плазмы. При концентрациях в плазме человека от 100 до 1000нг/мл, доля связанного с белками плазмы эрибулина составляет от 49% до 65%.После введения пациентам 14С-меченного эрибулина, фракция неизмененного препарата в плазме была подавляющей. Концентрации метаболитов соответствовали менее 0,6% исходного эрибулина, подтверждая тот факт, что значимых метаболитов эрибулина в организме человека не образуется. Эрибулин обладает низким значением клиренса (в среднем, варьирующимся от 1,16 до 2,42 л/ч/м2). При еженедельном введении эрибулина значимой кумуляции не наблюдается. Фармакокинетические параметры эрибулина не зависят от дозы или времени в интервале от 0,22 до 3,53мг/м2.Выводится эрибулин, главным образом, с желчью. Транспортный белок, отвечающий за экскрецию препарата с желчью, в настоящее время неизвестен.Доклинические исследования указывают на участие в этом процессе Р-гликопротеина. Однако показано, что в клинически значимых концентрациях эрибулин не является ингибитором Р-гликопротеина in vitro.In vivo сопутствующее введение кетоконазола, являющего ингибитором Р-гликопротеина, не оказывает влияния на фармакокинетические параметры эрибулина (AUC и Cmax).Исследования in vitro показали, что эрибулин не является субстратом транспортера органических катионов (ОСТ1).После введения пациентам 14С-мечеиного эрибулина примерно 82% дозы выводилось с калом и 9% — с мочой, что говорит о том, что почечный клиренс не является значимым путем выведения препарата. Большую часть радиоактивной метки в кале и моче представлял неизмененный эрибулин.Фармакокинетика при печеночной недостаточности: оценка фармакокинетики эрибулина у пациентов с печеночной недостаточностью легкой (класс А по Чайлд-Пью) или средней (класс В по Чайлд-Пью) степени тяжести, связанной с образованием метастазов в печени, по сравнению с пациентами с нормальной функцией печени (n=6), показала, что экспозиция эрибулина в первых двух группах пациентов была выше, соответственно, в 1,8 и 3 раза.Применение препарата в дозе 1,1мг/м2 пациентам с легкой печеночной недостаточностью и в дозе 0,7мг/м2 -пациентам с печеночной недостаточностью средней степени тяжести обеспечивало примерно ту же экспозицию, что и при применении 1,4мг/м2 пациентам с нормальной функцией печени.Применение препарата у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью), а также с печеночной недостаточностью, связанной с циррозом, не изучалось. Фармакокинетика при почечной недостаточности: у некоторых пациентов с почечной недостаточностью средней и тяжелой степени тяжести наблюдалось увеличение экспозиции эрибулина с высокой степенью вариабельности. Фармакокинетика эрибулина у пациентов с нормальной функцией почек (клиренс креатинина (КК) более 80мл/мин), с почечной недостаточностью средней (КК 30-50мл/мин) и тяжелой (КК 15-30мл/мин) степени тяжести изучалась в исследовании Фазы I. Величина КК оценивалась по формуле Кокрофта-Голта. У пациентов с почечной недостаточностью средней и тяжелой степени тяжести наблюдалось увеличение AUC с поправкой на дозу в 1,5 раза. |
 |
Побочное действие Халавен раствор для инъекций 0,5мг/мл 2млК наиболее часто встречающимся побочным реакциям при терапии препаратом относят подавление функции костного мозга, выражающееся в нейтропении, лейкопении, анемии и тромбоцитопении с сопутствующими инфекциями. Также сообщалось о новых проявлениях или ухудшении ранее имевшейся периферической нейропатии. Гастроинтестинальная токсичность, проявляющаяся в виде анорексии, тошноты, рвоты, диареи, запоров и стоматита также относится к побочным эффектам при терапии препаратом. Прочие побочные эффекты включают утомляемость, алопецию, повышение активности печеночных ферментов, сепсис и мышечно-скелетную боль. Профиль безопасности комбинации препарата с трастузумабом или капецитабином соответствует известному профилю безопасности каждого из данных препаратов в отдельности.Далее представлена частота возникновения побочных эффектов, наблюдаемых у пациентов с раком молочной железы и саркомами мягких тканей, которые получали рекомендованную дозу препарата в монотерапии в клинических исследованиях Фазы II и III.Для обозначения частоты нежелательных явлений используется следующая классификация: очень часто (более 1/10 случаев); часто (более 1/100, но менее 1/10); нечасто (более 1/1000, но менее 1/100) и редко (более 1/10000, но менее 1/1000). В пределах каждой группы побочные эффекты представлены в порядке убывания частоты. Если применимо, приведены общая и суммарная по побочным эффектам 3 и 4 степени частота встречаемости. Инфекционные и паразитарные заболевания: часто — инфекция мочевыводящих путей (8,5%) (G3/4 0,7%), пневмония (1,6%) (G3/4 1,0%), кандидоз полости рта, герпес слизистой оболочки полости рта, инфекция верхних дыхательных путей, назофарингит, ринит, опоясывающий лишай; нечасто — Сепсис (0,5%) (G3/4 0,5%), нейтропенический сепсис (0,2%) (G3/4 0,2%), септический шок (0,2%) (G3/4 0,2%).Нарушения со стороны крови и лимфатической системы: очень часто — нейтропения (53,6%) (G3/4 46,0%), лейкопения (27,9%) (G3/4 17,0%), анемия (21,8%) (G3/4 3,0%); часто — лимфопения (5,7%) (G3/4 2,1%), фебрильная нейтропения (4,5%) (G3/4 4,4%), тромбоцитопения (4,2%) (G3/4 0,7%); редко или частота неизвестна — диссеминированное внутрисосудистое свёртывание крови.Нарушения обмена веществ и питания: очень часто — снижение аппетита (22,5%) (G3/4 0,7%); часто — гипокалиемия (6,8%) (G3/4 2,0%), гипомагниемия (2,8%) (G3/4 0,3%), обезвоживание (2,8%) (G3/4 0,5%), гипергликемия, гипофосфатемия, гипокальциемия.Нарушения психики: часто — бессонница, депрессия.Нарушения со стороны нервной системы: очень часто — периферическая нейропатия (35,9%) (G3/4 7,3%), головная боль (17,5%) (G3/4 0,7%); часто — дисгевзия, головокружение (9,0%) (G3/4 0,4%), гипестезия, летаргия, нейротоксичность.Нарушения со стороны органа зрения: часто — повышение слезоотделения (5,8%) (G3/4 0,l%), конъюнктивит.Нарушения со стороны органа слуха и лабиринтные нарушения: часто — вертиго, звон в ушах.Нарушения со стороны сердца: тахикардия.Нарушения со стороны сосудов: часто — «Приливы», тромбоэмболия легочной артерии (1,3%) (G3/4 1,1%); нечасто — тромбоз глубоких вен.Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — диспноэ (15,2%) (G3/4 3,5%), кашель (15,0%) (G3/4 0,5%); часто — орофарингеальная боль, носовое кровотечение, ринорея; нечасто — интерстициальные заболевания легких (0,2%) (G3/4 0,1%).Нарушения со стороны желудочно-кишечного тракта: очень часто — тошнота (35,7%) (G3/4 1,1%), запор (22,3%) (G3/4 0,7%), диарея (18,7%) (G3/4 0,8%), рвота (18,1%) (G3/4 1,0%); часто — Боль вживоте: стоматит (11,1%)(G3/4l,0%), сухость ротовой полости, диспепсия (6,5%) (G3/4 0,3%), гастроэзофагеальная рефлюксы болезнь, вздутие живота; нечасто — изъязвление слизистой оболочки ротовой полости, панкреатит.Нарушения со стороны печени и желчевыводящих путей: часто — повышение активности аспартатаминотрансферазы (ACT) (7,7%) (G3/4 1,4%), повышение активности аланинаминотрансферазы (АЛТ) (7,6%) (G3/4 1,9%), повышение активности гаммаглутамилтрансферазы (1,7%) (G3/4 0,9%), гипербилирубинемия (1,4%) (G3/4 0,4%); нечасто — гепатотоксичность (0,8%) (G3/4 0,6%).Нарушения со стороны кожи и подкожных тканей: очень часто — алопеция; часто — сыпь (4,9%) (G3/4 0,1%), зуд (3,9%) (G3/4 0,l%), поражение ногтей, ночная потливость, сухость кожи, эритема, гипергидроз, ладонно-подошвенная эритродизестезия (1,0%) (G3/4 0,1 %); нечасто — ангионевротический отек; редко или частота неизвестна — синдром Стивенса-Джонсона токсический эпидермальный некролиз.Нарушения со стороны скелетно-мышечной и соединительной ткани: очень часто — артралгия и миалгия (20,4%) (G3/4 1,0%), боль в спине (12,8%) (G3/4 1,5%), боль в конечностях (10,0%) (G3/4 0,7%); часто — боль в костях (6,7%) (G3/4 1,2%), мышечный спазм (5,3%) (G3/4 0,l%), мышечно-скелетная боль и боль в груди, мышечная слабость.Нарушения со стороны почек и мочевыводящих путей: часто — дизурия; нечасто — гематурия, протеинурия, почечная недостаточность.Общие расстройства и нарушения в месте введения: Общие расстройства и нарушения в месте введения: очень часто — утомляемость/астения (53,2%) (G3/4 7,7%), лихорадка (21,8%) (G3/4 0,7%); часто — воспаление слизистых оболочек (6,4%) (G3/4 0,9%), периферический отек, боль, озноб, боль в груди, гриппоподобный синдром.Лабораторные и инструментальные данные: очень часто — снижение массы тела (11,4%) (G3/4 0,4%).Нейтропения: наблюдавшаяся нейтропения была обратимой и некумулятивной. Среднее время до ожидаемого минимума числа нейтрофилов (надир) составляло 13 дней, а среднее время до восстановления после тяжелой нейтропении (АЧН менее 0,5 раз выше 10%) составило 8 дней.В исследовании EMBRACE снижение числа нейтрофилов до значений менее 500/мкл, длящееся более 7 дней, встречалось в 13% случаев.При саркомах мягких тканей сообщения о нейтропении, возникшей в ходе лечения встречались реже (37,4% случаев), чем при раке молочной железы (57,9% случаев). Всего нейтропения вместе с патологически измененными нейтрофилами встречалась с частотой 76% и 84,3% соответственно. Медиана длительности терапии составила 12,0 недель для пациентов с саркомами мягких тканей и 15,9 недель для пациентов с раком молочной железы.Сообщалось о случаях фебрильной нейтропении, нейтропенического сепсиса, сепсиса и септического шока с летальным исходом. Среди 1963 пациентов с саркомами мягких тканей и раком молочной железы, получавших эрибулин в рекомендованных дозах в ходе клинических исследований наблюдалось по одному летальному случаю нейтропенического сепсиса (0,1%) и фебрильной нейтропении (0,1%), а также 3 летальных случая сепсиса (0,2%) и один случай септического шока (0,1%).При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог. В двух клинических исследованиях Фазы 3 (Исследование 305 и 301) Г-КФС получали 18% и 13% пациентов соответственно. В исследовании фазы 3 у пациентов с саркомами мягких тканей Г-КСФ получали 26% пациентов. Нейтропения приводила к прекращению участия в исследовании менее 1% пациентов, получающих эрибулин. Диссеминированное внутрисосудистое свёртывание крови: сообщалось о случаях развития диссеминированного внутрисосудистого свёртывания крови, обычно ассоциированного с нейтропенией и/или сепсисом.Периферическая нейропатия: среди 1559 пациентов с раком молочной железы наиболее частым побочным явлением, приводящим к отмене терапии эрибулином, была периферическая нейропатия (3,4%). Медиана до появления периферической нейропатии 2 степени составила 12,6 недель (после 4 циклов). У 2 из 404 пациентов с саркомами мягких тканей периферическая нейропатия привела к отмене терапии эрибулином. Медиана до появления периферической нейропатии 2 степени составила 18,4 недель.Развитие периферической нейропатии степени 3 и 4 возникало у 7,4% пациентов с раком молочной железы и у 3,5% пациентов с саркомами мягких тканей. В клинических исследованиях было показано, что у пациентов с нейропатией, имевшейся до начала терапии препаратом, не было большего риска развития новых или ухудшения уже имеющихся ее симптомов, в отличие от пациентов, не имевших периферической нейропатии до начала терапии препаратом.У пациентов с раком молочной железы с предшествующей периферической нейропатией 1 или 2 степени частота возникновения периферической нейропатии 3 степени при лечении препаратом составляла 14%. Гепатотоксичность: у некоторых пациентов наблюдалось увеличение активности печеночных ферментов в начале лечения эрибулином (чаще всего в 1-2 циклах). Хотя это происходило, скорее всего, вследствие адаптации печени к лечению эрибулином, о гепатотоксичности также сообщалось.Дополнительная информация по безопасности в особых группах пациентов: пациенты пожилого возраста: среди 1559 пациентов с раком молочной железы, получавших эрибулин в рекомендованных дозах 283 (18,2%) были старше 65 лет. В исследовании на 404 пациентах с саркомами, 90 пациентов (22,3%), получавших эрибулин были старше 65 лет. Профиль безопасности эрибулина у пожилых пациентов (старше 65 лет) аналогичен профилю безопасности препарата у более молодой популяции за исключением утомляемости и астении, которые усиливались с возрастом. Специальных рекомендаций по снижению дозы у пожилых пациентов нет.Пациенты с печеночной недостаточностью: при активности АЛТ или ACT, превышающей верхнюю границу нормы более чем втрое, у пациента повышается риск развития нейтропении 4 степени и фебрильной нейтропении. При значениях билирубина, превышающих верхнюю границу нормы более чем в полтора раза, также повышается риск развития нейтропении 4 степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены.Извещение о нежелательных реакциях: крайне важно извещать о нежелательных реакциях, возникших во время пострегистрационного применения лекарственного средства. Это позволит контролировать соотношение пользы и риска лекарственного средства. Просьба медицинским работникам извещать о возникновении любых нежелательных реакций по адресу, указанному в данной инструкции. |
 |
Особые указанияС осторожностью: синдром врожденного удлинения интервала QT.Заболевания сердца (сердечная недостаточность, брадиаритмия). Электролитный дисбаланс (например, гипокалиемия, гипомагниемия). Одновременный прием лекарственных средств, удлиняющих интервал QT (в том числе антиаритмических IA и III классов). Одновременный прием лекарственных средств, обладающих узким терапевтическим диапазоном и метаболизирующимися преимущественно изоферментом CYP3A4.Тяжелая печеночная недостаточность и нарушение функции печени, связанное с циррозом (применение препарата у данной группы пациентов не изучалось).Почечная недостаточность средней и тяжелой степени тяжести.Беременность: данных о применении препарата у беременных нет. В доклинических исследованиях эрибулин оказывал эмбриотоксическое, фетотоксическое и тератогенное действие. Халавен не следует применять при беременности.Женщины фертильного возраста должны быть проинформированы о необходимости предохранения от беременности при использовании ими или их партнерами препарата, а также об обязательном применении эффективных методов контрацепции в период лечения препаратом и в течение 3 месяцев после его завершения.Лактация: данных о проникновении эрибулина или его метаболитов в грудное молоко человека или животных нет. Поскольку риск для новорожденных и грудных детей не может быть исключен, Халавен не следует применять в период грудного вскармливания.Фертильность: в доклинических исследованиях наблюдалась тестикулярная токсичность препарата. До начала лечения пациентам мужского пола следует обратиться за консультацией по поводу консервации спермы, поскольку при лечении препаратом существует вероятность развития необратимого бесплодия.Гематологические: миелосупрессия является дозозависимой и, в первую очередь, выражается в виде нейтропении. У каждого пациента перед введением любой дозы препарата следует провести клинический анализ крови. Лечение препаратом можно начинать только при АЧН выше 1500/мкл и числе тромбоцитов выше 100000/мкл.Менее чем у 5% пациентов, получающих Халавен, наблюдалась фебрильная нейтропения. При развитии у пациента фебрильной нейтропении, а также при тяжелой нейтропении или тромбоцитопении, следует скорректировать лечение в соответствии с рекомендациями, приведенными в разделе.При активности АЛТ или ACT, превышающей верхнюю границу нормы более чем втрое, у пациента повышается риск развития нейтропении 4 степени и фебрильной нейтропении. При значениях билирубина, превышающих верхнюю границу нормы более чем в полтора раза, также повышается риск развития нейтропении 4 степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены.Сообщалось о случаях фебрильной нейтропении. нейтропенического сепсиса, сепсиса и септического шока с летальным исходом.При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог.Периферическая нейропатия: следует вести постоянное наблюдение за возможными признаками периферической моторной или сенсорной нейропатии у пациентов. Развитие тяжелой периферической нейропатии требует задержки введения или уменьшения дозы. Пациенты с предшествующей периферической нейропатией более чем 2 степени тяжести не включались в клинические исследования. Тем не менее, у пациентов с предшествующей нейропатией 1 или 2 степени тяжести не наблюдался больший риск развития новых или ухудшения уже имеющихся ее симптомов в сравнении с пациентами, включенными в исследование без данного состояния. Удлинение интервала QT: в неконтролируемом открытом исследовании ЭКГ на 26 пациентах, удлинение интервала QT отмечалось на 8-й день, независимо от концентрации эрибулина и при нормальных значениях интервала в 1-й день. На фоне лечения препаратом мониторинг ЭКГ рекомендуется проводить у пациентов с сердечной недостаточностью и брадиаритмиями, а также при одновременном приеме лекарственных средств, удлиняющих интервал QT (в том числе антиаритмических IA и III классов). До начала лечения препаратом рекомендуется устранить электролитный дисбаланс (например, гипокалиемию, гипомагниемию), а на фоне лечения мониторировать содержание этих электролитов в крови.Не рекомендуется назначать препарат пациентам, имеющим синдром врожденного удлинения интервала QT. Использование в комбинациях: установлено, что применение эрибулина в комбинации с анти-HER2 терапией и капецитабином является безопасным. Вспомогательные вещества Халавен содержит небольшое количество этанола (менее 100мг на дозу). Специальные меры предосторожности при утилизации и использовании: подготовка и введение препарата может осуществляться исключительно лицами, имеющими соответствующий опыт работы с цитостатиками.Халавен представляет собой цитотоксический противоопухолевый препарат, и при работе с ним, как и с другими токсичными веществами, следует проявлять осторожность. Рекомендуется использовать перчатки, защитные очки и защитную одежду. В случае попадания раствора препарата на кожу, необходимо сразу же тщательно промыть этот участок кожи водой с мылом. При контакте препарата со слизистыми оболочками, место контакта необходимо тщательно промыть водой. При беременности не следует работать с препаратом. Хранение вскрытой упаковки: с микробиологической точки зрения Халавен следует использовать немедленно после вскрытия. Если препарат не применяется сразу же после вскрытия упаковки, за сроки и условия его хранения отвечает лицо, работающее с препаратом. Если Халавен не применяется сразу же после вскрытия упаковки в виде неразведенного раствора, максимальный срок хранения при 25°С на рассеянном свету составляет 4 ч, а в условиях холодильника (2-8°С) — 24ч. Разведенный раствор препарата (в концентрациях от 0,02мг/мл до 0,2мг/мл в 0,9% растворе натрия хлорида для инъекций) может храниться не более 24ч при температуре 2-8°С, за исключением тех ситуаций, когда разведение исходного раствора осуществлялось в стандартизованных контролируемых асептических условиях.Неиспользованные остатки препарата и использованные материалы следует утилизировать согласно действующим в РФ требованиям.Влияние на способность управлять транспортными средствами и работать с механизмами: при приеме препарата могут наблюдаться такие побочные эффекты как усталость или головокружение, которые могут оказывать слабое или умеренное воздействие на возможность управлять автомобилем или работать с механизмами. Пациентов следует информировать о том, что при появлении чувства усталости или головокружения им нельзя управлять автомобилем или работать с механизмами. |
Инструкция по применению Халавен
- Состав
- Показания к применению
- Противопоказания к применению
- Рекомендации по применению
- Фармакологическое действие
- Условия хранения
- Условия отпуска
Состав
Активное вещество: Эрибулин 0,5;
Вспомогательные вещества: этанол 0.05 мл, хлористоводородная кислота или натрия гидроксид до pH 6.0-9.0, вода д/и до 1 мл.
Показания к применению Халавен
Монотерапия у пациентов с местно-распространенным или метастатическим раком молочной железы, получивших ранее не менее двух различных режимов химиотерапии по поводу распространенного заболевания. Предшествующая терапия должна включать антрациклины и таксаны, исключением тех пациентов, которым не могли назначаться данные препараты.
Противопоказания к применению Халавен
- гиперчувствительность к эрибулину или какому-либо из вспомогательных веществ;
- тяжелая печеночная недостаточность (отсутствие данных по применению);
- тяжелая почечная недостаточность (отсутствие данных по применению);
- беременность и период грудного вскармливания;
- возраст до 18 лет.
С осторожностью: при синдроме врожденного удлинения интервала Q-T, заболеваниях сердца (сердечная недостаточность, инфаркт миокарда, брадикардия), электролитном дисбалансе (например, гипокалиемия, гипомагниемия), при одновременном приеме лекарственных средств, удлиняющих интервал Q-T (в том числе антиаритмических LA и III классов).
Рекомендации по применению
Внутривенно. Лечение препаратом Халавен следует проводить только под контролем врача, имеющего соответствующий опыт применения цитотоксических лекарственных препаратов. Противорвотные средства рекомендуются в случае возникновения у пациента тошноты и рвоты. Рекомендуемая доза препарата Халавен составляет 1,4 мг/м2. Данная доза вводится внутривенно в течение 2-5 минут в 1-й и 8-й дни каждого 21-дневного цикла.
Фармакологическое действие
Эрибулин относится к ингибиторам динамики микротрубочек нетаксанового ряда, принадлежащим к галихондриновой фуппе противоопухолевых средств. По своей структуре препарат представляет собой упрощенный синтетический аналог галихондрина В, натурального вещества, выделенного из морской губки Halichondriaokadai.
Эрибулин тормозит фазу роста микротрубочек, не влияя на фазу укорачивания, что приводит к формированию тубулиновых агрегатов, не обладающих функциональной активностью. Противоопухолевое действие эрибулина реализуется через тубулин-опосредованный алтимитотический механизм, ведущий к блокаде клеточного цикла в фазах G2/M (стадии клеточного цикла GAP 2/митоза) и нарушению формирования митотических веретен, что, в итоге, приводит к апоптотической гибели клетки в результате длительной блокировки митоза.
Фармакокинетика
Распределение
Фармакокинетика эрибулина характеризуется быстрой фазой распределения, сменяемой продолжительной фазой выведения с конечным T1/2, в среднем, около 40 ч. Препарат имеет большой объем распределения (в среднем, варьирующим от 43 до 114 л/м2).
Эрибулин слабо связывается с белками плазмы. При концентрациях в плазме человека от 100 до 1000 нг/мл, доля связанного с белками плазмы эрибулина составляет от 49% до 65%.
Метаболизм
В первичной культуре гепатоцитов человека не было обнаружено индуцирующего потенциала эрибулина в отношении изоферментов 1А или ЗА (в концентрациях до 5 μМ), а также 2С9 или 2С19 (до 10 μМ) цитохрома Р450.
После введения пациентам 14С-меченного эрибулина, фракция неизмененного препарата в плазме была подавляющей. Концентрации метаболитов соответствовали менее 0.6% исходного эрибулина, подтверждая тот факт, что значимых метаболитов эрибулина в организме человека не образуется.
Выведение
Эрибулин обладает низким значением клиренса (в среднем, варьирующим от 1,16 до 2,42 л/ч/м2). При еженедельном введении эрибулина значимой кумуляции не наблюдается. Фармакокинетические параметры эрибулина не зависят от дозы или времени в интервале от 0,22 до 4,0 мг/м2.
Выводится эрибулин, главным образом, с желчью. Транспортный белок, отвечающий за экскрецию препарата с желчью, в настоящее время неизвестен. Доклинические исследования указывают на участие в этом процессе Р-гликопротеина. После введения пациентам 14С-меченного эрибулина примерно 82% дозы выводилось с калом и 9% — с мочой, что говорит о том, что почечный клиренс не является значимым путем выведения препарата. Большую часть радиоактивной метки в кале и моче представлял неизмененный эрибулин.
Фармакокинетика при печеночной недостаточности
Оценка фармакокинетики эрибулина у пациентов с легкой (класс А по Чайдд-Пью) или умеренной (класс В по Чайлд-Пью) печеночной недостаточностью, по сравнению с пациентами с нормальной функцией печени (n=6), показала, что экспозиция эрибулина в первых двух группах пациентов была выше, соответственно, в 1,8 и 2,5 раза. Применение препарата Халавен в дозе 1,1 мг/м2 пациентам с легкой печеночной недостаточностью и в дозе 0,7 мг/м2 — пациентам с умеренной печеночной недостаточностью обеспечивало примерно ту же экспозицию, что и при применении 1,4 мг/м2 пациентам с нормальной функцией печени.
Халавен не изучался у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью).
Фармакокинетика при почечной недостаточности
Специальных исследований фармакокинетики эрибулина у больных с почечной недостаточностью не проводилось. Согласно доступным данным предполагается, что среднегеометрические значения показателей системной экспозиции, нормализованных по дозе, у больных с легкими нарушениями функции почек (клиренс креатинина — КК, 50-80 мл/мин) будут соответствовать значениям у пациентов с нормальной функцией почек. Тем не менее, у больных с умеренными нарушениями функции почек (КК 30-50 мл/мин) среднегеометрические значения показателей системной экспозиции, нормализованных по дозе, увеличивались вдвое в сравнении с данными пациентов с нормальной функцией почек.
Влияние возраста, пола или расы на фармакокинетику
Данные популяционного анализа продемонстрировали отсутствие клинически значимого влияния возраста, пола или расы на фармакокинетические параметры эрибулина
Условия хранения
Хранить при температуре от 8 до 25°С. Не замораживать и не хранить в холодильнике. Хранить в недоступном для детей месте. Срок годности: 3 года
Условия отпуска
Отпускается по рецепту
К наиболее часто встречающимся побочным реакциям при терапии препаратом Халавен® относят подавление функции костного мозга, выражающееся в нейтропении, лейкопении, анемии и тромбоцитопении с сопутствующими инфекциями. Также сообщалось о новых проявлениях или ухудшении ранее имевшейся периферической нейропатии. Гастроинтестинальная токсичность, проявляющаяся в виде анорексии, тошноты, рвоты, диареи, запоров и стоматита также относится к побочным эффектам при терапии препаратом Халавен®. Прочие побочные эффекты включают утомляемость, алопецию, повышение активности печеночных ферментов, сепсис и мышечно-скелетную боль.
Профиль безопасности комбинации препарата Халавен® с трастузумабом или капецитабином соответствует известному профилю безопасности каждого из данных препаратов в отдельности.
Ниже представлена частота возникновения побочных эффектов, наблюдаемых у пациентов с раком молочной железы и саркомами мягких тканей, которые получали рекомендованную дозу препарата Халавен® в монотерапии в клинических исследованиях II и III фазы.
Для обозначения частоты нежелательных явлений используется следующая классификация: очень часто (≥1/10 случаев); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000). В пределах каждой группы побочные эффекты представлены в порядке убывания частоты. Если применимо, приведена общая и суммарная по побочным эффектам 3-й и 4-й степени частота встречаемости
Инфекционные и паразитарные заболевания: часто — инфекция мочевыводящих путей (8,5%) (G3/4: 0,7%); пневмония (1,6%) (G3/4: 1%), кандидоз полости рта, герпес слизистой оболочки полости рта, инфекция верхних дыхательных путей, назофарингит, ринит, опоясывающий лишай; нечасто — сепсис (0,5%) (G3/4: 0,4%)1; нейтропенический сепсис (0,2%) (G3/4: 0,1%).
Со стороны крови и лимфатической системы: очень часто — нейтропения (53,6%) (G3/4: 46%), лейкопения (27,9%) (G3/4: 16,9%), анемия(21,8%) (G3/4: 3%); часто — лимфопения (5,7%) (G3/4: 2,1%). фебрильная нейтропения (4,5%) (G3/4: 4,3%)1, тромбоцитопения (4,2%) (G3/4: 0,7%); редко — диссеминированное внутрисосудистое свертывание крови2.
Со стороны обмена веществ и питания: очень часто — снижение аппетита (22,5%) (G3/4: 0,7%)3; часто — гипокалиемияя (6,8%) (G3/4: 2%), гипомагниемия (2,8%) (G3/4: 0,3%), обезвоживание (2,8%) (G3/4: 0,5%)3, гипергликемия, гипофосфатемия.
Нарушения психики: часто — бессонница, депрессия.
Со стороны нервной системы: очень часто — периферическая нейропатия3 (35,9%) (G3/4: 7,3%), головная боль (17,5%) (G3/4: 0,7%); часто — дисгевзия, головокружение (9%) (G3/4: 0,4%)3, гипестезия, летаргия, нейротоксичность.
Со стороны органа зрения: часто — повышение слезоотделения (5,8%) (G3/4: 0,1%)3, конъюнктивит.
Со стороны органа слуха и лабиринтные нарушения: часто — вертиго, звон в ушах.
Со стороны сердца: часто — тахикардия.
Со стороны сосудов: часто — приливы, ТЭЛА (1,3%) (G3/4: 1,1%)1; нечасто — тромбоз глубоких вен.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — диспноэ (15,2%) (G3/4: 3,6%)1, кашель (15%) (G3/4: 0,5%)3; часто — орофарингеальная боль носовое кровотечение, ринорея; нечасто — интерстициальные заболевания легких (0,2%) (G3/4: 0,1%).
Со стороны ЖКТ: очень часто — тошнота (35,7%) (G3/4: 1,1%)4, запор (22,3%) (G3/4: 0,7%)4, диарея (18,7%) (G3/4: 0,8%), рвота (18,1%) (G3/4: 1%); часто — боль в животе, стоматит (11,1%) (G3/4: 1%)4, сухость ротовой полости, диспепсия (6,5%) (G3/4: 0,3%)4 ГЭРБ, вздутие живота; нечасто — изъязвление слизистой оболочки ротовой полости, панкреатит (0,1%)
Со стороны печени и желчевыводящих путей: часто — повышение активности АСТ (7,7%) (G3/4: 1,4%)4, АЛТ (7,6%) (G3/4: 1,9%)4, ГГТ (1,7%) (G3/4: 0,9%)4, гипербилирубинемия (1,4%) (G3/4: 0,4%); нечасто — гепатотоксичность (0,8%) (G3/4: 0,6%).
Со стороны кожи и подкожных тканей: очень часто — алопеция; часто — сыпь (4,9%) (G3/4: 0,1%), зуд (3,9%) (G3/4: 0,1%)4, поражение ногтей, ночная потливость, сухость кожи, эритема, гипергидроз, ладонно-подошвенная эритродизестезия (1%) (G3/4: 0,1%)4; нечасто — ангионевротический отек (0,1%).
Со стороны скелетно-мышечной и соединительной ткани: очень часто — артралгия и миалгия (20,4%) (G3/4: 1%), боль в спине (12,8%) (G3/4: 1,5%), боль в конечностях (10%) (G3/4: 0,7%)4; часто — боль в костях (6,7%) (G3/4: 1,2%), мышечный спазм (5,3%) (G3/4: 0,1%)4, мышечно-скелетная боль и боль в груди, мышечная слабость.
Со стороны почек и мочевыводящих путей: часто — дизурия; нечасто — гематурия, протеинурия, почечная недостаточность.
Общие расстройства и нарушения в месте введения: очень часто — утомляемость/астения (53,2%) (G3/4: 7,7%), лихорадка (21,8%) (G3/4: 0,7%); часто — воспаление слизистых оболочек (6,4%) (G3/4: 0,9%), периферический отек, боль, озноб, боль в груди, гриппоподобный синдром.
Лабораторные и инструментальные данные: очень часто — снижение массы тела (11,4%) (G3/4: 0,4%)4.
1 Включая 1 или 2 случая 5-й степени.
2 Спонтанные сообщения.
3 Включая термины: периферическая нейропатия, периферическая моторная нейропатия, полинейропатия, парестезия, периферическая сенсорная нейропатия, периферическая сенсомоторная нейропатия и демиелинизирующая полинейропатия.
4 Только 3-й степени.
В целом, препарат Халавен® имеет схожий профиль безопасности при применении при раке молочной железы и при саркомах мягких тканей.
Дополнительная информация по некоторым побочным эффектам
Нейтропения. Наблюдавшаяся нейтропения была обратимой и некумулятивной. Среднее время до ожидаемого минимума числа нейтрофилов (надир) составляло 13 дней, а среднее время до восстановления после тяжелой нейтропении (АЧН <0,5·109/л) составило 8 дней.
В исследовании EMBRACE снижение числа нейтрофилов до значений <0,5·109/л, длящееся более 7 дней, встречалось в 13% случаев.
При саркомах мягких тканей нейтропения наблюдалась реже (37,4% случаев), чем при раке молочной железы (57,9% случаев).
При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог.
Нейтропения приводила к прекращению участия в исследовании менее 1% пациентов, получающих эрибулин.
Диссеминированное внутрисосудистое свертывание крови. Сообщалось о случаях развития диссеминированного внутрисосудистого свертывания крови, обычно ассоциированного с нейтропенией и/или сепсисом.
Периферическая нейропатия. Среди 1559 пациентов с раком молочной железы наиболее частым побочным явлением, приводящим к отмене терапии эрибулином, была периферическая нейропатия (3,4%). Медиана до появления периферической нейропатии 2-й степени составила 12,6 нед (после 4 циклов). У 2 из 404 пациентов с саркомами мягких тканей периферическая нейропатия привела к отмене терапии эрибулином. Медиана до появления периферической нейропатии 2-й степени составила 18,4 нед.
Развитие периферической нейропатии 3-й и 4-й степени возникало у 7,4% пациентов с раком молочной железы и у 3,5% пациентов с саркомами мягких тканей. В клинических исследованиях было показано, что у пациентов с нейропатией, имевшейся до начала терапии препаратом Халавен®, не было большего риска развития новых или ухудшения уже имеющихся ее симптомов, в отличие от пациентов, не имевших периферической нейропатии до начала терапии препаратом Халавен®.
У пациентов с раком молочной железы с предшествующей периферической нейропатией 1-й или 2-й степени частота возникновения периферической нейропатии 3-й степени при лечении препаратом Халавен® составляла 14%.
Гепатотоксичность. У некоторых пациентов наблюдалось увеличение активности печеночных ферментов в начале лечения эрибулином (чаще всего в 1–2-м циклах). Хотя это происходило, скорее всего, вследствие адаптации печени к лечению эрибулином, о гепатотоксичности также сообщалось.
Дополнительная информация по безопасности в особых группах пациентов
Пациенты пожилого возраста. Профиль безопасности эрибулина у пожилых пациентов (старше 65 лет) аналогичен профилю безопасности препарата у более молодой популяции за исключением утомляемости и астении, которые усиливались с возрастом. Специальных рекомендаций по снижению дозы у пожилых пациентов нет.
Пациенты с печеночной недостаточностью. При активности АЛТ или АСТ, превышающей ВГН более чем втрое, у пациента повышается риск развития нейтропении 4-й степени и фебрильной нейтропении. При значениях билирубина, превышающих ВГН более чем в полтора раза, также повышается риск развития нейтропении 4-й степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены.
Извещение о нежелательных реакциях
Крайне важно извещать о нежелательных реакциях, возникших во время пострегистрационного применения ЛС. Это позволит контролировать соотношение пользы и риска лекарственного средства. Просьба медицинским работникам извещать о возникновении любых нежелательных реакций по адресу, указанному в данном описании.
