Тбилиси (139 Апт.)
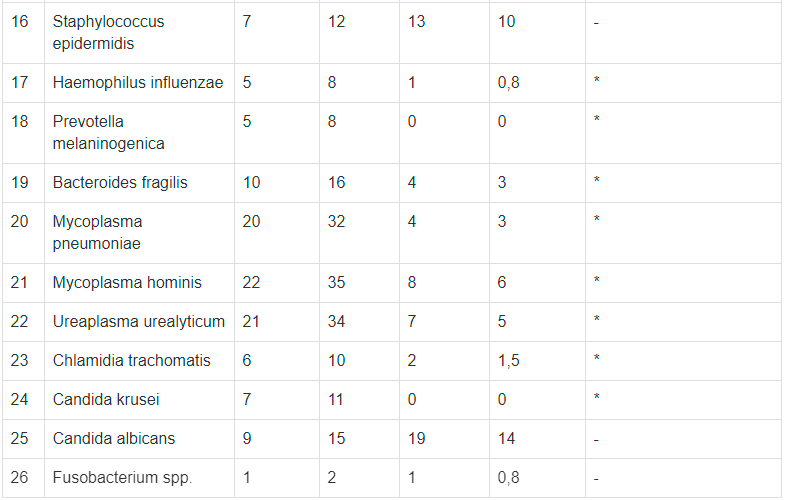
Аверси 3
237 30 11
ул. Казбеги №5
Срок годности: 2025-09-01
Аверси 19
231-61-46
пр. Важа-пшавела. Квартал III, корпус №9
Срок годности: 2025-09-01
Аверси 21 (24Ч)
231-18-34
пр. Важа-пшавела №39
Срок годности: 2025-09-01
Аверси 23
236-57-55
пр. Пекина №2
Срок годности: 2025-09-01
Аверси 33
237-54-09
пр. Пекина №45
Срок годности: 2025-09-01
Аверси 34 (24Ч)
238-14-17
Ул. Цинцадзе №1
Срок годности: 2025-09-01
Аверси 39
236-21-78
ул. Бахтриони №20
Срок годности: 2025-09-01
Аверси 41
237-54-08
пр. Казбеги №8
Срок годности: 2025-09-01
Аверси 46
231-94-61
ул. Нуцубидзе №179
Срок годности: 2025-09-01
Аверси 65
236-34-51
ул. Долидзе №24
Срок годности: 2025-09-01
Аверси 78
259-67-04
ул. Петрици № 5
Срок годности: 2025-09-01
Аверси 89
2-506-506 (3089)
пр. Важа-пшавела №27 б
Срок годности: 2025-09-01
Аверси 91 (24Ч)
210-47-03
пр. Важа-пшавела №27 б
Срок годности: 2025-09-01
Аверси 94
218-18-23
ул Цинцадзе №9
Срок годности: 2025-09-01
Аверси 120
238-36-75
пр. Важа-пшавела №6
Срок годности: 2025-09-01
Аверси 150
2-51-96-35
Пр. Важа-Пшавела, IV квартал, территория, прилегающая к корпусу №1
Срок годности: 2025-09-01
Аверси 153
2-506-506 (3153)
пр. Казбеги №16
Срок годности: 2025-09-01
Аверси 154
2-506-506 (3154)
Ул. Асланидзе №3 /Ул. Бербуки №8
Срок годности: 2025-09-01
Аверси 157
2 506-506 (3157)
ул. Шартава №4/6
Срок годности: 2025-09-01
Аверси 158
2-506-506 (3158)
ул. Мириан мефе №75
Срок годности: 2025-09-01
Аверси 160
2-506-506 (3160)
2-ой микрорайон Нуцубидзе, первый квартал, д. 3д
Срок годности: 2025-09-01
Аверси 165
2-506-506 (3165)
ул. Фанаскертели №20
Срок годности: 2025-09-01
Аверси 166
2 506-506 (3166)
Деревня дигоми, ул. Агмашенебели №124
Срок годности: 2025-09-01
Аверси 172
2-506-506 (3172)
ул. Ташкенти №27
Срок годности: 2025-09-01
Аверси 177
2 506-506 (3177)
Ул. Годзиашвили №17
Срок годности: 2025-09-01
Аверси 178
2 506-506 (3178)
ул. Мириан мефе №96
Срок годности: 2025-09-01
Аверси 180
2-506-506 (3180)
Миндели 11
Срок годности: 2025-09-01
Аверси 181
2-506-506 (3181)
M.Мачавариани 65
Срок годности: 2025-09-01
Аверси 182
2-506-506 (3182)
Simon Chikovani 45
Срок годности: 2025-09-01
Аверси 187
2-506-506 (3187)
С Канделаки 59
Срок годности: 2025-09-01
Аверси 192
0322506506 (3192)
В.Бочоришвили 24
Срок годности: 2025-09-01
Аверси 194 (24Ч)
2506506 (3194)
Диди Дигоми, ул. Тинатини №1
Срок годности: 2025-09-01
Аверси 197
0322506506 (3197)
Диди Дигоми, 4 микрорайон, 25
Срок годности: 2025-09-01
Аверси 200
0322506506 (3200)
Улица Мириан Мефе 11Г
Срок годности: 2025-09-01
Аверси 202
0322506506 (8202)
Срок годности: 2025-09-01
1 г крема содержит
действующие вещества: 0,5мг бетаметазона (в виде бетаметазона дипропионата – 0,643мг); 10,0 мг клотримазола; 1,0 мг гентамицина (в виде гентамицина сульфата);
вспомогательные вещества, парафин жидкий, парафин белый мягкий, спирт цетостеариловый, пропиленгликоль, макрогола цетостеариловый эфир, спирт бензиловый, натрия дигидрофосфат дигидрат, кислота фосфорная, натрия гидроксид, вода очищенная.
Мягкой консистенции белый или почти белый однородный крем, не содержащий посторонних включений.
Кортикостероиды для наружного применения в дерматологии. Кортикостероиды высокоактивные в комбинации с другими средствами.
Код АТС D07XC01.
Механизм действия
Тридерм объединяет в себе следующие механизмы действия:
противовоспалительное действие бетаметазона дипропионата, антибактериальное действие гентамицина и противогрибковое действие клотримазола.
Фармакодинамика
Бетаметазон в форме дипропионата является сильнодействующим кортикостероидом (класс действия III) с противовоспалительным, противоаллергическим и противозудным действием.
Гентамицин является аминогликозидным антибиотиком с антибактериальным действием. Его действие основывается на подавлении синтеза белков чувствительных микроорганизмов. Гентамицин воздействует на многие аэробные грамотрицательные и некоторые грамположительные бактерии. In vitro гентамицин в концентрациях 1–8 мкг/мл подавляет рост большинства чувствительных штаммов Escherichia coli (кишечной палочки), Haemophilus influenzae (гемофильной палочки), Moraxella lacunata (палочки Моракса-Аксенфельда), Neisseria (нейссерий), индолположительного и индолотрицательного протея, Pseudomonas (псевдомонад) (в том числе большинства штаммов Pseudomonas aeruginosa (синегнойной палочки), Staphylococcus aureus (золотистого стафилококка), Staphylococcus epidermidis (эпидермального стафилококка) и Serratia (серраций). Различные виды и различные штаммы одних и тех же видов могут демонстрировать большие различия в чувствительности в условиях in vitro. Кроме того, чувствительность in vitro не всегда соотносится с чувствительностью in vivo. Гентамицин не эффективен против большинства анаэробных бактерий, грибов и вирусов. Гентамицин оказывает лишь минимальное воздействие на стрептококки.
Резистентность к гентамицину может развиваться как у грамотрицательных, так и грамположительных бактерий.
Клотримазол является синтетическим противогрибковым средством – производным имидазола. Спектр действия охватывает ряд грибов, являющихся патогенными для человека и животных.
Клотримазол является эффективным против дерматофитов, дрожжевых и плесневых грибов. Во время анализов in vitro клотримазол оказался эффективным против грибков Trichophyton rubrum, Trichophyton mentagrophytes, Epidermophyton floccosum, Microsporum canis и грибков рода Candida, в том числе Candida albicans. В соответствии с имеющимися на сегодняшний день знаниями противогрибковый эффект клотримазола объясняется подавлением синтеза эргостерола. Эргостерол является жизненно важным компонентом клеточной мембраны грибов.
Фармакокинетика
Данные о фармакокинетике препарата Тридерм отсутствуют.
Бетаметазон
В нормальных условиях при местном применении в системный кровоток поступает лишь часть бетаметазона. Доля проникновения и всасывания зависит от участка тела, состояния кожи, лекарственной формы, возраста и способа нанесения.
Гентамицин
При нанесении гентамицина на неповрежденную кожу всасывания вряд ли следует ожидать. При повреждении кератинового слоя, воспалениях, применении под окклюзионной повязкой или нанесении на обширную площадь следует ожидать усиленного чрескожного всасывания. Клотримазол
Большая часть нанесенного клотримазола остается в роговом слое, а всасывание в системный кровоток является незначительным. Через 6 часов после нанесения 1% радиоактивного клотримазола на здоровую кожу, а также на кожу с острым воспалением, можно было определить следующие концентрации: роговой слой – 100 мкг/см3, ретикулярный слой – 0,5-1 мкг/см3, подкожная клетчатка – 0,1 мкг/см3.
Тридерм показан для лечения чувствительных к терапии кортикостероидами дерматозов, при которых инфекция, вызванная бактериями и/или грибками, либо уже существует, либо ее возникновения следует опасаться. Прежде всего, препарат подходит для применения на стадиях заболевания с мокнущими поражениями.
Кожные инфекции (вирусного, бактериального [в т.ч. туберкулез], а также грибкового происхождения), реакции на вакцины, кожные язвы и акне являются противопоказаниями для использования кортикостероидов, предназначенных для местного применения. При наличии розацеа или периорального дерматита от нанесения крема на лицо следует отказаться.
Повышенная чувствительность к одному из активных или вспомогательных веществ препарата, к другим аминогликозидным антибиотикам (перекрестная аллергия с гентамицином) или производными имидазола (перекрестная аллергия с клотримазолом).
Тридерм не предусмотрен для применения под окклюзионной повязкой.
Тридерм нельзя наносить на слизистые оболочки, кожу вокруг глаз или вблизи глаз.
Подростки и взрослые
2 раза в день (утром и вечером) нанести тонкий слой на пораженные участки кожи и легко втереть, причем следует охватить как весь пораженный участок, так и окружающую его здоровую поверхность кожи.
Длительность лечения зависит от результатов как клинического осмотра, так и микробиологического исследования, а также от ответа на лечение.
При микозе стоп может рассматриваться необходимость более длительного лечения (2-4 недели).
Дети от 2 до 12 лет
Наносить небольшое количество только на пораженные участки кожи и осторожно втирать. Применять не чаще двух раз в день, делая между нанесениями крема перерыв, минимум в 6-12 часов. Наносить крем на лицо, шею, кожу головы, область гениталий, ректальную область и участки опрелости следует под наблюдением врача. Длительность лечения ограничивается 5-7 днями.
Смотрите разделы «Меры предосторожности» и «Применение у пациентов детского возраста».
В начале лечения
Кожа
Редко: раздражения, жжение, кожный зуд, сухость, реакции повышенной чувствительности на какой-либо из ингредиентов препарата и изменения цвета кожи.
При применении на обширных площадях, под окклюзионной повязкой и/или при более длительном применении
При применении на обширных площадях, под окклюзионной повязкой и/или при более длительном применении возможны местные изменения кожи. При нанесении крема на обширные площади существует вероятность системного воздействия (подавление функции коры надпочечников).
Следует учитывать, что из-за пониженной местной сопротивляемости инфекциям существует повышенный риск возникновения вторичных инфекций.
Кожа
Местные изменения кожи, такие как атрофии (особенно на лице), телеангиэктазии, стрии, полосовидная атрофия кожи, кожные геморрагии, пурпура, стероидные акне, розацеаподобный или периоральный дерматит, гипертрихоз, а также изменения цвета кожи. Неизвестно, являются ли изменения цвета кожи обратимыми.
Иногда: контактная гиперчувствительность к гентамицину.
У некоторых пациентов наблюдалась вероятная светочувствительность, которая, однако, при повторном нанесении гентамицина с последующим воздействием ультрафиолетового излучения не возобновлялась.
Эндокринная система
Подавление синтеза эндогенных кортикостероидов, гиперкортицизм с отеками.
Обмен веществ
Сахарный диабет (проявление ранее скрытой формы).
Ухо, внутреннее ухо/почки
Во время лечения с нанесением крема на обширные площади или применения на поврежденной коже при одновременном системном применении аминогликозидных антибиотиков следует ожидать кумулятивной ототоксичности/нефротоксичности.
Мышечно-скелетная система
Остеопороз, замедление роста (у детей).
При применении местных кортикостероидов также сообщалось о системных побочных реакциях, например, нечеткость зрения.
В случае появления перечисленных побочных реакций, а также реакции, не указанной в инструкции по применению, необходимо обратиться к врачу.
Симптомы: при длительном или чрезмерном применении местных глюкокортикостероидов возможно угнетение гипофизарно-адреналовой функции с развитием вторичной адреналовой недостаточности и появление симптомов гиперкортицизма, в том числе синдрома Кушинга.
Не предполагается, что одноразовая передозировка гентамицина вызовет развитие каких-либо симптомов. Чрезмерное или длительное применение гентамицина может привести к избыточному росту нечувствительных к антибиотику микроорганизмов.
Применение клотримазола под окклюзионной повязкой в течение 6 часов не приводило к развитию симптомов передозировки.
Лечение:
назначают соответствующую симптоматическую терапию. Симптомы острого гиперкортицизма обычно обратимы. При необходимости, проводят коррекцию электролитного баланса. В случае хронического токсического действия рекомендуется постепенная отмена кортикостероидов. При избыточном росте резистентных микроорганизмов рекомендуется прекратить лечение препаратом Тридерм и назначить необходимую терапию.
При появлении раздражений или сенсибилизации вследствие применения Тридерм лечение следует прекратить и начать соответствующую терапию.
Всасывание активных веществ, предназначенных для местного применения, в системный кровоток может усиливаться, если Тридерм наносится на большую площадь, в частности при долгосрочном применении или применении на поврежденной коже. В этих условиях возможно возникновение нежелательных эффектов в таком виде, в каком они проявляются после системного применения активных веществ. При применении у детей в таких случаях рекомендуется проявлять особую осторожность.
В случае одновременного системного применения аминогликозидных антибиотиков, при повышенном чрескожном всасывании, следует ожидать кумулятивное токсическое воздействие (ототоксичность, нефротоксичность).
Следует учитывать вероятность проявления возможной перекрестной аллергии на другие аминогликозидные антибиотики.
При длительном лечении препаратами, содержащими антибиотики, могут появляться нечувствительные микроорганизмы.
В таком случае или при возникновении суперинфекции следует начать соответствующую терапию.
Высокодозированное, обширное нанесение или применение под окклюзионной повязкой сильнодействующего или очень сильнодействующего кортикостероида должно осуществляться только под регулярным наблюдением врача, особенно с учетом подавления выработки эндогенных кортикостероидов и возможного метаболического действия.
Следует избегать применения на открытых ранах и поврежденных участках кожи.
Срок непрерывного применения, по возможности, не должен превышать 2-3 недели.
Кортикостероиды очень сильного, сильного и умеренного действия применять на лице и в области гениталий следует с исключительной осторожностью и не дольше 1 недели.
Вблизи глаз применяются в принципе только кортикостероиды слабого действия (из-за риска развития глаукомы).
Кортикостероиды могут маскировать симптомы аллергической кожной реакции на ингредиенты препарата.
Препарат содержит пропиленгликоль и спирт цетостеариловый в качестве вспомогательных компонентов. При наружном применении пропиленгликоль может вызвать раздражение кожи, а спирт цетостеариловый – кожные реакции (например, контактный дерматит).
Пациенту следует дать указания применять препарат только для лечения его текущего заболевания кожи и не давать препарат другим лицам.
При применении кортикостероидов системного и местного действия (включая интраназальное, ингаляционное и внутриглазное введение) могут возникать нарушения зрения. Если возникают такие симптомы, как нечеткость зрения или другие нарушения со стороны зрения, пациенту следует пройти обследование у офтальмолога для оценки возможных причин нарушения зрения, которые могут включать катаракту, глаукому или такие редкие заболевания, как центральная серозная хориоретинопатия, о чем сообщалось после применения кортикостероидов системного и местного действия.
Применение у пациентов детского возраста
Это лекарственное средство не рекомендуется применять у детей в возрасте до 2 лет. У пациентов детского возраста возможно проявление большей, чем у взрослых пациентов, чувствительности к подавлению гипоталамо-гипофизарно-надпочечниковой оси и активности экзогенных кортикостероидов, вызываемому кортикостероидами для местного применения, поскольку из-за большего отношения площади поверхности кожи к массе тела всасывание является более интенсивным.
О подавлении гипоталамо-гипофизарно-надпочечниковой оси, синдроме Кушинга, замедлении линейного роста, замедлении увеличения веса и повышении внутричерепного давления сообщалось при применении топических кортикостероидов у детей. Симптомами подавления работы надпочечников у детей являются, среди прочего, низкий уровень кортизола в плазме крови и отсутствие реакции после стимуляции адренокортикотропного гормона (АКГТ). Симптомами повышения внутричерепного давления, среди прочего, являются выбухание родничка, головные боли и двусторонний отек диска зрительного нерва.
Беременность
Во время исследований на животных местное применение кортикостероидов оказывало тератогенное действие. Данных о применении у беременных нет.
Аминогликозиды проникают через плацентарный барьер и могут нанести вред плоду, если их будут принимать беременные женщины. Поступали сообщения о полной необратимой двусторонней врожденной глухоте у детей, матери которых в период беременности принимали аминогликозиды, в том числе гентамицин. Достаточных данных о местном применении гентамицина у беременных нет.
Достаточных данных о применении клотримазола у беременных нет.
Результаты исследований на животных не обнаружили никаких рисков для плода.
Тридерм следует применять только в тех случаях, когда в этом есть абсолютная необходимость.
Тридерм не следует применять на большой площади, в больших количествах или в течение длительного времени.
Грудное вскармливание
Данных о выделении гентамицина, клотримазола и кортикостероидов для местного применения в грудное молоко нет, но кортикостероиды, проникающие в системный кровоток, попадают и в грудное молоко.
При нанесении Тридерм на молочные железы грудное вскармливание противопоказано.
Как правило, препарат не влияет на быстроту реакции при управлении автотранспортом или работе с другими механизмами.
Из-за содержания в составе белого мягкого парафина и парафина жидкого может снижаться прочность на разрыв и, следовательно, безопасность использования презервативов из латекса, это следует учитывать при использовании мази в области гениталий или анальной области.
При местном применении клотримазол может оказывать антагонистическое действие по отношению к амфотерицину и другим полиеновым антибиотикам.
2 года. Не применять препарат после окончания срока годности, указанного на упаковке.
Хранить в недоступном для детей месте при температуре не выше 25°C.
По 15 г в алюминиевых тубах. По одной тубе вместе с инструкцией по применению в картонной коробке.
По рецепту.
Производитель
Шеринг-Плау Лабо Н.В., Индустриепарк 30, Хейст-оп-ден-Берг, 2220, Бельгия.
Schering-Plough Labo N.V., Industriepark 30, Heist-op-den-Berg, 2220, Belgium.
Владелец регистрационного удостоверения
Органон Сентрал Ист ГмбХ, Вейштрассе 20, 6006 Люцерн, Швейцария.
Organon Central East GmbH, Weystrasse 20, 6006 Luzern, Switzerland.

07.11.2022

07.11.2022
Описание препарата Тридерм® (крем для наружного применения, 0.05%+0.1%+1%) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 07.11.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Крем для наружного применения | 1 г |
| действующие вещества: | |
| бетаметазона дипропионат микронизированный | 0,643 мг |
| (эквивалентно 0,5 мг бетаметазона) | |
| гентамицина сульфат | 1,690 мг* |
| (в эквиваленте 1 мг (1000 МЕ) гентамицина основания) | |
| клотримазол микронизированный | 10,000 мг |
| вспомогательные вещества: парафин белый мягкий — 150,000 мг; пропиленгликоль — 100,000 мг; цетостеариловый спирт — 72,000 мг; парафин жидкий — 60,000 мг; макрогола цетостеариловый эфир — 22,500 мг; бензиловый спирт — 10,000 мг; натрия дигидрофосфат дигидрат — 2,995 мг; фосфорная кислота концентрированная — 0,030 мг; фосфорная кислота или натрия гидроксид (теоретическое значение, реальное значение зависит от активности субстанции гентамицина сульфата; используются для регулирования значения рН) — q.s.; вода очищенная — q.s. | |
| * Теоретическое значение, реальное значение зависит от активности субстанции гентамицина сульфата |
Описание лекарственной формы
Крем для наружного применения: гладкий однородный, от белого до почти белого цвета, не содержащий посторонних включений.
Фармакологическое действие
Фармакологическое действие
—
противовоспалительное, антибактериальное, противогрибковое, противозудное, противоаллергическое, антиэкссудативное.
Фармакодинамика
Комбинированный препарат для наружного применения.
Крем Тридерм® сочетает в себе противовоспалительный, противозудный, противоаллергический и антиэкссудативный эффект бетаметазона дипропионата с противогрибковой активностью клотримазола и антибактериальным действием широкого спектра гентамицина сульфата.
Гентамицин является антибиотиком широкого спектра действия из группы аминогликозидов. Действует бактерицидно и обеспечивает высокоэффективное местное лечение первичных и вторичных бактериальных инфекций кожи. Активен в отношении грамотрицательных бактерий: Pseudomonas aeruginosa, Aerobacter aerogenes, Escherichia coli, Proteus vulgaris и Klebsiella pneumoniae; грамоположительных бактерий: Staphylococcus aureus (коагулозаположительные, коагулазоотрицательные и некоторые штаммы, продуцирующие пенициллиназу).
Клотримазол оказывает противогрибковое действие за счет нарушения синтеза эргостерина, являющегося составной частью клеточной мембраны грибов. Активен в отношении Trichophyton rubrum, Trichophyton mentagrophytes, Epidermophyton floccosum, Microsporum canis, Candida albicans, Pityrosporum orbiculare (Malassezia furtur).
Показания
- дерматозы, осложненные инфекциями, вызванными чувствительными к препарату возбудителями, или при подозрении на такие инфекции;
- простой и аллергический дерматиты;
- атопический дерматит (в т.ч. диффузный нейродермит);
- ограниченный нейродермит;
- экзема;
- дерматомикозы (дерматофитии, кандидоз, разноцветный лишай), особенно при локализации в паховой области и крупных складках кожи;
- простой хронический лишай (ограниченный нейродермит).
Противопоказания
- повышенная чувствительность к какому-либо из компонентов препарата;
- туберкулез кожи;
- кожные проявления сифилиса;
- ветряная оспа;
- простой герпес;
- кожные поствакцинальные реакции;
- возраст до 2 лет.
С осторожностью: беременность (особенно в I триместре); детский возраст (>2 лет); длительное лечение, применение на больших участках кожи или при нарушении целостности кожных покровов, использование окклюзионных повязок (особенно у детей).
Применение при беременности и кормлении грудью
Беременность. Применение крема Тридерм® во время беременности возможно только в том случае, когда предполагаемая польза для матери превосходит потенциальный риск для плода. У беременных не следует применять препарат на больших участках кожи или в течение длительного периода времени.
Лактация. Неизвестно, выделяются ли компоненты препарата с грудным молоком. Поэтому при назначении Тридерм® в период лактации следует решить вопрос о прекращении грудного вскармливания.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Наружно.
Наносить тонким слоем на всю пораженную поверхность кожи и окружающую ткань 2 раза в день (утром и на ночь). Для обеспечения эффективности лечения крем Тридерм® необходимо применять регулярно.
Продолжительность терапии зависит от размера и локализации поражения, а также реакции пациента.
Если клиническое улучшение не наступает после 3–4 нед лечения, это может служить поводом для уточнения диагноза.
Побочные действия
Очень редко при применении препарата Тридерм® отмечаются чувство жжения, эритема, экссудация, нарушение пигментации и зуд.
Побочные реакции, встречающиеся при применении ГКС для наружного применения (особенно при применении окклюзионных повязок): чувство жжения, зуд, сухость кожи, фолликулит, гипертрихоз, угри, гипопигментация, периоральный дерматит, аллергический контактный дерматит, мацерация кожи, развитие вторичной инфекции, атрофия кожи, стрии, потница, а также системные реакции (нечеткость зрения).
Побочные реакции, обусловленные гентамицином: преходящее раздражение кожи (эритема, зуд), обычно не требующее прекращения лечения.
Побочные реакции, обусловленные клотримазолом: эритема, ощущение покалывания, появление волдырей, шелушение, локальный отек, зуд, крапивница, раздражение кожи.
Если у пациента отмечаются побочные эффекты, указанные в описании, или они усугубляются, или пациент заметил любые другие побочные эффекты, не указанные в описании, следует сообщить об этом врачу.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Какого-либо взаимодействия препарата Тридерм® крем с другими ЛС не зарегистрировано.
Передозировка
Симптомы: при длительном применении местных ГКС в высоких дозах возможно подавление функции надпочечников с развитием вторичной надпочечниковой недостаточности и симптомов гиперкортицизма, включая синдром Кушинга.
При однократной передозировке гентамицина появления каких-либо симптомов также не ожидается. Длительное лечение гентамицином в повышенных дозах может привести к росту нечувствительной флоры.
Передозировка клотримазола при местном его применении не ведет к появлению каких-либо симптомов.
Лечение: симптоматическое. Острые симптомы гиперкортицизма обычно обратимы. При необходимости проводят коррекцию электролитного дисбаланса. В случае хронической ГКС-токсичности рекомендуется постепенная отмена ГКС.
Особые указания
Крем Тридерм® не предназначен для применения в офтальмологии. Пациенты, применяющие системные ГКС или ГКС для наружного применения, сообщали о нарушениях зрения. Если у пациента наблюдается нечеткость зрения или другие зрительные нарушения, следует обратиться к офтальмологу для оценки возможных причин, которые могут включать катаракту, глаукому, серозную хориоретинопатию.
Продолжительное наружное применение антибиотиков иногда может приводить к росту резистентной микрофлоры. В этом случае, а также при развитии раздражения, сенсибилизации или суперинфекции при применении препарата Тридерм®, лечение следует прекратить и назначить соответствующую терапию. Наблюдались перекрестные аллергические реакции с аминогликозидными антибиотиками. Любые побочные эффекты, встречающиеся при применении системных ГКС, включая угнетение функции коры надпочечников, могут отмечаться и при применении ГКС для наружного применения, в особенности у детей.
Системная абсорбция ГКС или гентамицина при местном применении будет выше, если лечение будет проводиться на больших участках кожи или при использовании окклюзионных повязок, особенно при длительном лечении или нарушении целостности кожных покровов. Необходимо избегать нанесения гентамицина и бетаметазона на открытые раны и поврежденную кожу. В противном случае возможно появление побочных эффектов, характерных для гентамицина и бетаметазона при системном применении. Следует соблюдать соответствующие меры предосторожности в таких случаях, особенно при лечении детей. При длительном использовании препарата его отмену рекомендуется проводить постепенно.
Применение в педиатрии
Дети более подвержены риску угнетения функции ГГНС вследствие применения ГКС для наружного применения, чем взрослые, из-за большего соотношения у них площади поверхности тела и веса и, соответственно, повышенной абсорбции препарата. У детей это определяется низким уровнем кортизола в плазме крови и отсутствием ответа на стимуляцию АКТГ. Возможно возникновение синдрома Иценко-Кушинга, нарушение роста и развития, замедление прибавки веса, повышение ВЧД, проявляющегося головными болями, двусторонним отеком диска зрительного нерва. Длительное применение препарата у детей должно проводиться по строгим показаниям и под контролем врача. У детей чаще, чем у взрослых, возникают атрофические изменения кожи при наружном применении ГКС. Курс лечения должен ограничиться 5 днями. Окклюзионные повязки не должны применяться.
Влияние на способность управлять транспортными средствами и работать с механизмами. Не выявлено какого-либо влияния препарата Тридерм® на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Крем для наружного применения, 0,05+0,1+1%. По 15 или 30 г крема в тубе алюминиевой, покрытой защитным лаком (эпоксидное покрытие), с горловиной с винтовой резьбой, покрытой мембраной и колпачком из ПЭВП. Открытый конец заполненной тубы имеет кольцо холодного запечатывания и закрыт механическим обжимом. На колпачке имеется острие для открытия мембраны. По 1 тубе вместе с инструкцией по применению в картонной пачке.
Производитель
Фамар А.В.Е., завод Авлон, 49-й км национальной дороги Афины-Ламия, г. Авлона, Аттика, 19011, Греция.
Владелец регистрационного удостоверения: АО «БАЙЕР», Россия.
Организация, принимающая претензии потребителей: АО «БАЙЕР», Россия. 107113, Москва, 3-я Рыбинская ул., 18, стр. 2.
Тел.: (495) 231-12-00.
www.bayer.ru
Условия отпуска из аптек
Без рецепта.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Нейпоген — инструкция по применению
Синонимы, аналоги
Статьи
В настоящее время препарат не числится в Государственном реестре лекарственных средств или указанный регистрационный номер исключен из реестра.
Регистрационный номер:
П N011221/01, П N011221/02
Торговое название:
Нейпоген / Neupogen
Международное непатентованное название:
филграстим
Лекарственная форма:
раствор для подкожного введения, раствор для внутривенного и подкожного введения
Состав
Один предварительно заполненный шприц 0,5 мл содержит:
Активное вещество: 0,30 мг филграстима (30 млн ЕД)
Вспомогательные вещества: уксусная кислота — 0,3 мг, натрия гидроксид — для коррекции pH, сорбитол — 25 мг, полисорбат 80 — 0,02 мг, вода для инъекций до 0,5 мл.
Один предварительно заполненный шприц 0,5 мл содержит:
Активное вещество: 0,48 мг филграстима (48 млн ЕД)
Вспомогательные вещества: уксусная кислота — 0,3 мг, натрия гидроксид — для коррекции pH, сорбитол — 25 мг, полисорбат 80 — 0,02 мг, вода для инъекций до 0,5 мл.
Один флакон 1 мл содержит:
Активное вещество: 0,30 мг филграстима (30 млн ЕД)
Вспомогательные вещества: уксусная кислота — 0,6 мг, натрия гидроксид — для коррекции pH, сорбитол — 50 мг, полисорбат 80 — 0,04 мг, вода для инъекций до 1,0 мл.
Описание
Прозрачный, бесцветный раствор, свободный от механических включений.
Фармакотерапевтическая группа
Иммуностимуляторы, колониестимулирующий фактор, лейкопоэза стимулятор.
Код ATX:
L03AA02
Фармакологические свойства
Фармакодинамика
Филграстим — высокоочищенный негликозилированный белок, состоящий из 175 аминокислот. Филграстим вырабатывается в лабораторных условиях штаммом бактерии Escherichia coli, в геном которой введен ген гранулоцитарного колониестимулирующего фактора. Человеческий гранулоцитарный колониестимулирующий фактор (Г-КСФ) -гликопротеин, регулирующий функционирование и выработку нейтрофилов, и их выход в кровь из костного мозга. В течение 24 часов после применения филграстима, отмечается выраженное увеличение число нейтрофилов в периферической крови с небольшим увеличением числа моноцитов. При применении рекомендуемых доз, повышение числа нейтрофилов носит дозозависимый характер. Нейтрофилы, вырабатываемые в ответ на филграстим, обнаруживают нормальную или повышенную функциональную активность, что было выявлено с помощью определения хемотаксической и фагоцитирующей активности нейтрофилов. После окончания терапии филграстимом число циркулирующих нейтрофилов снижается на 50% в течение 1-2 дней и возвращается к нормальному уровню в течение 1-7 дней.
Применение филграстима как самостоятельно, так и после химиотерапии, мобилизует гемопоэтические клетки-предшественники в периферической крови.
Как и другие гемопоэтические факторы роста, Г-КСФ стимулирует человеческие эндотелиальные клетки in vitro.
Клиническая эффективность
Филграстим показал свою безопасность и эффективность в ускорении восстановления числа нейтрофилов после различных схем химиотерапии. Согласно результатам клинических исследований, терапия филграстимом приводит к уменьшению тяжести нейтропении и снижению частоты госпитализации и применения внутривенных антибактериальных средств, а также предупреждает инфекцию, проявляющуюся фебрильной нейтропенией.
Фармакокинетика
После подкожного (п/к) введения, филграстим быстро всасывается и через 2-8 часов достигает своей максимальной концентрации в сыворотке крови. Период полувыведения после внутривенного (в/в) и п/к введения обычно составляет от 2 до 4 часов. Клиренс и период полувыведения зависят от дозы препарата и числа нейтрофилов. Ввиду насыщения нейтрофил-опосредованного клиренса при высоких концентрациях филграстима и его снижения при нейтропении можно говорить о преобладании линейного характера клиренса и о линейном характере фармакокинетики. Абсолютная биодоступность филграстима после п/к введения составляет 62% при дозе 375 мкг и 72% при дозе 750 мкг. После прекращения введения филграстима, его концентрация снижается до эндогенных значений в течение 24 часов.
У здоровых лиц и пациентов с онкологическими заболеваниями, перед проведением химиотерапии было показано уменьшение концентрации филграстима в сыворотке крови при его многократном введении. Такое увеличение клиренса филграстима является дозозависимым, и степень этого увеличения, по-видимому, тесно связана со степенью нейтрофилии у реципиентов, что согласуется с данными о повышении нейтрофил-опосредованного клиренса при увеличении пула нейтрофилов. У пациентов, получающих филграстим после химиотерапии, концентрация препарата в плазме оставалась на одном уровне вплоть до начала восстановления гемопоэза. При п/к и в/в введении филграстима наблюдается линейная корреляция между введенной дозой и концентрацией в сыворотке крови. После п/к введения терапевтических доз, его концентрация превышает 10 нг/мл в течение 8-16 часов. Объем распределения составляет 150 мл/кг.
Дети: У детей после проведения химиотерапии фармакокинетика филграстима сходна с таковой у взрослых лиц, получающих с учетом массы тела те же дозы препарата, что позволяет сделать вывод о независимости фармакокинетики филграстима от возраста.
Пациенты пожилого возраста: Фармакокинетические данные у пациентов пожилого возраста (> 65 лет) отсутствуют.
Нарушения функции почек и печени: В исследованиях по применению филграстима у пациентов с тяжелыми нарушениями функций почек и печени было показано, что фармакокинетика и фармакодинамика аналогичны таковым у здоровых лиц. Поэтому в этих случаях коррекции дозы не требуется. У пациентов с терминальной стадией почечной недостаточности, отмечалась тенденция к увеличению системной экспозиции филграстима по сравнению со здоровыми лицами и пациентами с клиренсом креатинина 30-60 мл/мин.
Показания к применению
Взрослые и дети. Нейтропения, фебрильная нейтропения у больных, получающих интенсивную миелосупрессивную цитотоксическую химиотерапию по поводу злокачественных заболеваний (за исключением хронического миелолейкоза и миелодиспластического синдрома); Нейтропения и ее клинические последствия у больных, получающих миелоаблативную терапию с последующей аллогенной или аутологичной трансплантацией костного мозга, с повышенным риском развития продолжительной и тяжелой нейтропении; Нейтропения у пациентов с острым миелолейкозом, получающих индукционную или консолидирующую химиотерапию, для сокращения ее продолжительности и клинических последствий; Мобилизация аутологичных периферических стволовых клеток крови (аутологичные ПСКК), в том числе после миелосупрессивной терапии, а также, мобилизация периферических стволовых клеток крови у здоровых доноров (аллогенные ПСКК); Тяжелая врожденная, периодическая или идиопатическая нейтропения (абсолютное число нейтрофилов (АЧН) ≤ 0,5 х 109/л) у пациентов с тяжелыми или рецидивирующими инфекциями в анамнезе для увеличения числа нейтрофилов, а также, для уменьшения частоты и продолжительности инфекционных осложнений; Стойкая нейтропения (АЧН ≤ 1,0х109/л) у пациентов с развернутой стадией ВИЧ-инфекции для снижения риска бактериальных инфекций при невозможности использования других способов лечения.
Противопоказания
Гиперчувствительность к белкам, получаемым с использованием Е. coli, филграстиму или к любому другому компоненту препарата.
Гиперчувствительность к филграстиму или пэгфилграстиму.
Тяжелая врожденная нейтропения, свидетельствующая о развитии лейкемии или доказывающая эволюцию лейкемии.
Нейпоген не должен быть использован с целью увеличения доз цитотоксических химиотерапевтических препаратов выше рекомендованных.
С осторожностью
Необходимо соблюдать осторожность при назначении препарата пациентам с серповидноклеточной анемией, заболеваниями костей (включая остеопороз), наследственной непереносимостью фруктозы (препарат содержит сорбитол), острым вторичным миелолейкозом (ввиду ограниченных данных по безопасности и эффективности), у пациентов, получавших высокодозную химиотерапию.
Применение при беременности и в период грудного вскармливания
Доступных достаточных данных по опыту применения филграстима у беременных женщин нет. Исследования на животных показали репродуктивную токсичность. В научной литературе описано, что филграстим проникает через плаценту при его введении беременным самкам крыс в последний период беременности и кажущийся трансплацентарный перенос филграстима, при его введении беременным женщинам за ≤30 часов до преждевременных родов (≤ 30 недель беременности). Потенциальный риск, связанный с влиянием на эмбрион или плод человека, неизвестен. Филграстим следует применять у беременных женщин только в том случае, если потенциальная польза превышает потенциальный риск для плода или эмбриона.
Неизвестно, выделяется ли филграстим с грудным молоком. Ввиду того, что с грудным молоком выделяется большое количество лекарственных средств, применять филграстим для терапии кормящих женщин следует с осторожностью. При необходимости применения препарата в период лактации, следует принять решение о прекращении грудного вскармливания или применения препарата на основании оценки потенциальной пользы грудного вскармливания для ребенка и потенциальной пользы терапии для матери.
Способ применения и дозы
Взрослые и дети:
1) Стандартные схемы цитотоксической химиотерапии и острый миелоидный лейкоз:
Рекомендуемая доза: 5 мкг/кг/сут.
- Способ применения: один раз в сутки ежедневно в виде п/к болюсных инъекций, коротких в/в инфузий (15-30-минутных) или продолжительной в/в инфузии на 5% растворе глюкозы.
Филграстим следует применять минимум через 24 часа после проведения цитотоксической химиотерапии. Ежедневное введение филграстима необходимо продолжать до тех пор, пока число нейтрофилов не превысит ожидаемый минимум и не восстановится до нормальных значений (т.е., АЧН 10 х 109/л).
После проведения стандартных схем химиотерапии по поводу солидных опухолей, лимфом и лимфоидной лейкемии, ожидаемая длительность терапии до достижения такого эффекта составляет до 14 дней [как правило, 11 дней].
После индукционной и консолидирующей терапии острого миелолейкоза, продолжительность применения препарата может значительно увеличиваться (до 38 дней).
У пациентов, получающих цитотоксическую химиотерапию, переходящее увеличение числа нейтрофилов наблюдается обычно через 1-2 дня после начала лечения Нейпогеном. Тем не менее, для достижения стабильного терапевтического эффекта необходимо продолжать терапию Нейпогеном до тех пор, пока число нейтрофилов не перейдет ожидаемого минимума и не достигнет нормальных значений. Не рекомендуется отменять лечение Нейпогеном преждевременно, до перехода числа нейтрофилов через ожидаемый минимум. Лечение прекращают, если абсолютное число нейтрофилов после надира достигло 1,0 х 109/л.
2) Миелоаблативная терапия с последующей трансплантацией костного мозга:
Рекомендуемая начальная доза: 10 мкг/кг/сут.
- Способ применения: в/в капельно или в течение 30 мин или 24 ч на 5% растворе глюкозы или путем непрерывной п/к инфузии в течение 24 ч.
Первую дозу филграстима следует вводить не ранее, чем через 24 ч после цитотоксической химиотерапии, а при трансплантации костного мозга — не ранее, чем через 24 часа после инфузии костного мозга. Длительность терапии не более 28 дней.
После максимального снижения числа нейтрофилов (надир), суточную дозу Нейпогена корректируют в зависимости от динамики числа нейтрофилов следующим образом:
|
Число нейтрофилов |
Коррекция дозы Нейпогена |
|
>1,0×109/л в течение 3 дней подряд |
Уменьшают до 0,5 млн ЕД/кг/сут |
|
Затем, если АЧН превышает 1,0 х 109/л в течение 3 дней подряд |
Нейпоген отменяют |
|
Если в период лечения АЧН снижается менее 1,0 х 109/л, дозу Нейпогена вновь увеличивают в соответствии с приведенной схемой. |
АЧН — абсолютное число нейтрофилов
3) Мобилизация ПКПГ:
A) Онкологические пациенты:
Рекомендуемая доза при использовании для мобилизации периферических стволовых клеток крови (ПСКК) у пациентов после миелосупрессивной или миелоаблятивной терапии с последующей аутологичной трансфузией ПСКК с (или без) трансплантацией(-и) костного мозга: 10 мкг/кг/сут в течение 5-7 последовательных дней.
- Способ применения: один раз в сутки ежедневно в виде п/к инъекций или непрерывных 24-часовых п/к инфузий.
Рекомендуемая доза после миелосупрессивной химиотерапии: 5-10 мкг/кг/ сутки ежедневно, начиная через 24 часа после завершения химиотерапии и до тех пор, пока количество нейтрофилов не перейдет через ожидаемый минимум и не восстановится до нормальных значений.
- Способ применения: п/к инъекция.
Как только число нейтрофилов перейдет через ожидаемый минимум, суточную дозу филграстима титруют в зависимости от наблюдаемого ответа нейтрофилов.
B) Здоровые доноры:
Рекомендуемая доза: 10 мкг/кг/сут в течение 4-5 последовательных дней.
- Способ применения: п/к инъекция.
Лейкаферез начинают в день 5 и продолжают, при необходимости, до дня 6 для получения 4 х 106 CD34+ клеток/кг массы тела пациента.
4) Пациенты с ТХН:
A) Врожденная нейтропения:
Рекомендуемая начальная доза: 12 мкг/кг/сут в виде однократной дозы или с разделением на несколько введений.
- Способ применения: п/к инъекция.
B) Идиопатическая или периодическая нейтропения:
Рекомендуемая начальная доза: 5 мкг/кг/сутки в виде однократной дозы или с разделением на несколько введений.
- Способ применения: п/к инъекция.
Коррекция дозы: филграстим вводят ежедневно до сохранения значений числа нейтрофилов на уровне от 1,5 х 109/л до 10 х 109/л. После достижения эффекта, следует определить минимальную эффективную дозу для поддержания этого уровня. Для поддержания приемлемого числа нейтрофилов требуется длительное ежедневное введение препарата. Через одну-две недели лечения начальную дозу можно удвоить или сократить на 50%, в зависимости от реакции пациента на терапию. Впоследствии каждые 1-2 нед можно производить индивидуальную коррекцию дозы для поддержания числа нейтрофилов в диапазоне от 1,5 до 10 х 109/л. При тяжелых инфекциях можно применить схему с более быстрым увеличением дозы. В клинических исследованиях, у 97% пациентов, положительно отреагировавших на лечение, полный терапевтический эффект наблюдался при назначении доз до 24 мкг/кг/сут. Безопасность Нейпогена не установлена у пациентов с ТХН при введении доз выше 24 мкг/кг/сут.
5) Пациенты с ВИЧ-инфекцией:
A) Для инвертирования нейтропении
Рекомендуемая начальная доза: 1-4 мкг/кг/сут однократно.
- Способ применения: п/к инъекция до нормализации числа нейтрофилов (АЧН ≥ 2,0 х 10%). В клинических исследованиях, более 90% пациентов ответили на терапию при указанных дозах, нейтропения угасала в среднем в течении 2 дней. Максимальная суточная доза — 10мкг/кг. После достижения терапевтического эффекта, поддерживающая доза — 300 мкг/сут 3 раза в неделю. Впоследствии может потребоваться индивидуальная коррекция дозы и длительное назначение препарата для поддержания числа нейтрофилов более 2 х 109/л.
B) Для поддержания нормального числа нейтрофилов
По достижении эффекта инвертирования нейтропении, следует определить минимальную эффективную дозу для поддержания числа нейтрофилов на нормальном уровне.
Коррекция начальной дозы в качестве альтернативы дневной дозы: 300 мкг/день. Впоследствии может потребоваться индивидуальная коррекция дозы, определяемая по АЧН, для поддержания числа нейтрофилов более 2 х 109/л.
- Способ применения: п/к инъекция.
Особые группы пациентов
Пациенты пожилого возраста
Клинические исследования Нейпогена включали небольшое количество пациентов пожилого возраста, но отдельные исследования в данной группе не проводились, поэтому особые рекомендации по дозированию не могут быть приведены.
Пациенты с почечной недостаточностью
Исследования Нейпогена у пациентов с тяжелой почечной недостаточностью показывают фармакокинетические и фармакодинамические профили схожие со здоровыми добровольцами. Коррекция дозы не требуется в данной группе пациентов.
Дети с ТХН и онкологией
Шестьдесят пять процентов пациентов, в программе клинического исследования ТХН были младше 18 лет. Эффективность лечения была очевидной в данной возрастной группе, включающей большинство пациентов с врожденной нейтропенией. Различий в профиле безопасности у детей, получающих терапию для лечения ТХН, не наблюдалось. Данные клинических исследований у детей свидетельствуют о том, что безопасность и эффективность Нейпогена схожа у детей и у взрослых, получающих цитотоксическую химиотерапию.
Рекомендации по дозированию у детей такие же, как и у взрослых, получающих миелосупрессивную цитотоксическую химиотерапию.
Инструкции по применению, обращению и уничтожению
При необходимости, Нейпоген может быть разведен в 5% растворе глюкозы.
Разведение препарата до конечной концентрации менее, чем 0,2 млн ЕД (2 мкг) на мл не рекомендуется ни при каких условиях.
Перед использованием раствор препарата следует осмотреть. Допускается использование только прозрачного раствора без наличия посторонних видимых частиц. Для пациентов, получающих разведенный до 1,5 млн ЕД (15 мкг) на мл филграстим, к раствору препарата должен быть добавлен человеческий сывороточный альбумин до получения конечной концентрации 2 мг/мл.
Нейпоген не содержит консервантов. С точки зрения возможного риска микробной контаминации, флаконы Нейпогена используются исключительно для однократного применения.
При разведении в 5% растворе глюкозы, Нейпоген не взаимодействует со стеклом и различными типами пластиков, включая ПВХ, полиолефин (ко-полимер полипропилена и полиэтилена) и полипропилен.
Любые остатки препарата или отходы должны быть утилизированы в соответствии с местными требованиями.
Побочное действие
В таблице ниже приведены нежелательные реакции, зарегистрированные в клинических исследованиях, а также выявленные в рутинной клинической практике (спонтанные сообщения). В каждой группе, сформированной по частоте развития нежелательных реакций, соответствующие реакции приведены в порядке убывания их серьезности. Данные приводятся отдельно для пациентов с онкологическими заболеваниями, здоровых доноров при мобилизации ПКПГ, пациентов с ТХН и пациентов с ВИЧ, отражающие различные профили нежелательных реакций у данных групп лиц.
Нежелательные реакции приведены в соответствии со следующей градацией частоты их возникновения: очень часто (≥ 1/10), часто (≥ 1/100 до < 1/10), нечасто (≥ 1/1000 до < 1/100), редко (≥ 1/10 000 до < 1/1000) и очень редко (< 1/10 000).
Пациенты с онкологическими заболеваниями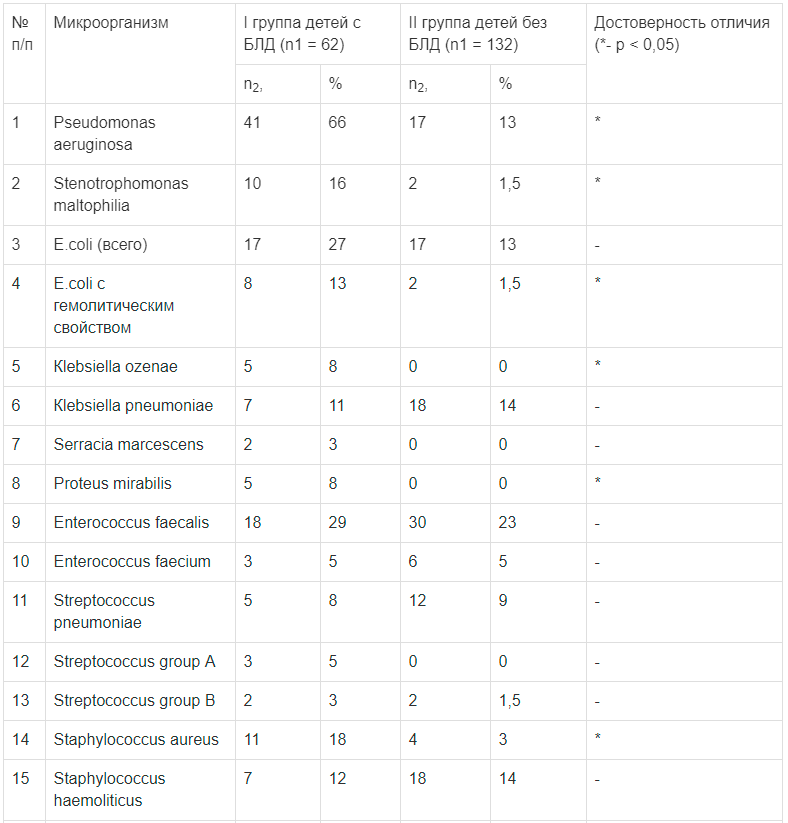
 а см. раздел «Описание выделенных побочных реакций».
а см. раздел «Описание выделенных побочных реакций».
b Отмечались случаи реакции «трансплантат против хозяина» и случаи с летальным исходом у пациентов после аллогенной трансплантации костного мозга (см. раздел «Описание выделенных побочных реакций»).
с Включает боль в костях, боль в спине, артралгию, миалгию, боль в конечностях, скелетно-мышечную боль, скелетно-мышечную боль в груди, боль в шее.
d Случаи из рутинной клинической практики у пациентов с трансплантацией костного мозга или ПКПГ мобилизацией.
е Случаи из клинических исследований.
Здоровые доноры (мобилизация ПКПГ)
 асм. раздел «Описание выделенных побочных реакций».
асм. раздел «Описание выделенных побочных реакций».
b Включает боль в костях, боль в спине, артралгию, миалгию, боль в конечностях, скелетно-мышечную боль, скелетно-мышечную боль в груди, боль в шее.
Пациенты с ТХН асм. раздел «Описание выделенных побочных реакций».
асм. раздел «Описание выделенных побочных реакций».
b Включает боль в костях, боль в спине, артралгию, миалгию, боль в конечностях, скелетно-мьшечную боль, скелетно-мышечную боль в груди, боль в шее.
Пациенты с ВИЧ-инфекцией асм. раздел «Описание выделенных побочных реакций».
асм. раздел «Описание выделенных побочных реакций».
b Включает боль в костях, боль в спине, артралгию, миалгию, боль в конечностях, скелетно-мьшечную боль, скелетно-мьшечную боль в груди, боль в шее.
Описание выделенных побочных реакций
Отмечались случаи реакции «трансплантат против хозяина» и случаи с летальным исходом у пациентов, получающих Г-КСФ после аллогенной трансплантации костного мозга (см. раздел «Особые указания»).
В рутинной клинической практике наблюдались случаи синдрома повышенной проницаемости капилляров при применении Г-КСФ. Данный синдром обычно встречался у пациентов с опухолью на поздней стадии, сепсисом, принимающих несколько цитотоксических химиотерапевтических средств или находящихся на аферезе (см. раздел «Особые указания»).
Пациенты с онкологическими заболеваниями
В рандомизированных, плацебо-контролируемых клинических исследованиях, применение Нейпогена не повышало частоту возникновения побочных реакций, связанных с цитотоксической химиотерапией. В указанных клинических исследованиях побочные реакции возникали с одинаковой частотой у пациентов, получавших лечение Нейпоген/химиотерапия и плацебо/химиотерапия, и включали тошноту и рвоту, алопецию, диарею, слабость, анорексию (снижение аппетита), воспаление слизистой, головную боль, кашель, сыпь, боль в груди, астению, боль во рту и горле, запор и боль.
В рутинной клинической практике у пациентов, получавших Нейпоген, сообщалось о возникновении кожного васкулита. Механизм возникновения кожного васкулита у пациентов, получавших Нейпоген, неизвестен. По данным клинических исследований, частота возникновения отнесена к категории «нечасто».
В рутинной клинической практике сообщались случаи проявления синдрома Свита (острый фебрильный дерматоз). По данным клинических исследований, частота возникновения отнесена в категорию «нечасто».
В клинических исследованиях и рутинной клинической практике сообщалось о побочных реакциях со стороны легких, включая интерстициальную болезнь легких, отек легких и легочные инфильтраты, в некоторых случаях с исходом в виде респираторной недостаточности и острого респираторного дистресс-синдрома, которые могут привести к летальному исходу (см. раздел «Особые указания»).
Нечасто сообщалось о случаях спленомегалии и разрыва селезенки после применения филграстима. В некоторых случаях разрывы селезенки приводили к летальному исходу (см. раздел «Особые указания»).
В клинических исследованиях и рутинной клинической практике сообщалось о реакциях гиперчувствительности, включая анафилаксию, сыпь, крапивницу, ангионевротический отек, одышку и гипотензию, возникающие при начальной или последующей терапии. В общем, сообщения были более частыми после в/в введения. В некоторых случаях симптомы возникали повторно с осложнениями, показывая причинно-следственную связь. При возникновении серьезных аллергических реакций, применение Нейпогена должен быть прекращено.
В рутинной клинической практике сообщалось об отдельных случаях возникновения серповидно-клеточного криза у пациентов с серповидно-клеточной анемией (см. раздел «Особые указания»). По данным клинических исследований, частота возникновения отнесена к категории «нечасто».
У онкологических пациентов, получавших Нейпоген, сообщалось о случаях возникновения псевдоподагры. По данным клинических исследований, частота отнесена к категории «нечасто».
Здоровые доноры (мобилизация ПКПГ)
У здоровых доноров и пациентов после введения филграстима сообщалось о частых, но зачастую асимптоматичных случаях возникновения спленомегалии и нечастых случаях разрыва селезенки. В некоторых случаях разрыв селезенки приводил к летальному исходу (см. раздел «Особые указания»).
Сообщалось о возникновения побочных реакций со стороны легких (гемоптизис, легочное кровотечение, легочные инфильтраты, одышка и гипоксия) (см. раздел «Особые указания»).
Нечасто наблюдалось обострение симптомов артрита.
После применения Нейпогена наблюдался лейкоцитоз (количество лейкоцитов >50х109/л) у 41% доноров и транзиторная тромбоцитопения (число тромбоцитов < 100 х 109/л), лейкаферез у 35% доноров (см. раздел «Особые указания»).
Пациенты с ТХН
Возникавшие побочные реакции включают спленомегалию, которая может прогрессировать в редких случаях, разрыв селезенки и тромбоцитопению (см. раздел «Особые указания»).
Реакция в месте введения, головная боль, увеличение печени, артралгия, алопеция, остеопороз и сыпь являются побочными реакциями, возможно связанными с лечением Нейпогеном и обычно возникающими у менее, чем 2% пациентов с ТХН.
У 2% пациентов с ТХН при длительном лечении сообщалось о возникновении кожного васкулита.
Пациенты с ВИЧ-инфекцией
Сообщалось о возникновении спленомегалии у менее 3% пациентов, получающих Нейпоген. Во всех случаях при физикальном осмотре спленомегалия была слабой или умеренной и со слабым клиническим течением; ни одному пациенту не был поставлен диагноз гиперспленизм, и ни у одного пациента не было спленэктомии. Взаимосвязь лечения Нейпогеном с данными заболеваниями не установлена, учитывая распространенность спленомегалии у пациентов с ВИЧ-инфекцией и наличия различных степеней спленомегалии у большинства пациентов с синдромом приобретенного иммунодефицита (см. раздел «Особые указания»).
Дети
Данные клинических исследований у детей показывают, что эффективность и безопасность Нейпогена схожи у детей и у взрослых, получающих цитотоксическую химиотерапию, и отсутствие возрастных различий в фармакокинетике филграстима. Скелетно-мышечная боль была единственным постоянно сообщаемым побочным действием, как и у взрослых.
Для дальнейшей оценки применения Нейпогена у детей не достаточно данных.
Другие особые группы пациентов
Пациенты пожилого возраста
Особых различий в безопасности и эффективности между пациентами старше 65 лет и взрослыми пациентами (старше 18 лет), получающими цитотоксическую химиотерапию, не наблюдалось; в клинической практике не было различий в терапевтическом ответе между пациентами пожилого возраста и взрослыми пациентами. По другим одобренным показаниям недостаточно данных для оценки применения Нейпогена у пациентов пожилого возраста.
Дети с ТХН
У детей с тяжелой хронической нейтропенией, получающих лечение Нейпогеном, сообщалось о случаях снижения плотности кости и остеопорозе. Частота возникновения в клинических исследованиях отнесена к категории «часто».
Передозировка
Последствия передозировки филграстимом не установлены. В исследованиях по трансплантации костного мозга, пациентам вводились дозы до 138 мкг/кг в сутки без развития токсических эффектов. В случае передозировки прекращение применения Нейпогена приводило к снижению числа циркулирующих нейтрофилов на 50% через 1-2 дня после отмены препарата, которое возвращалось к норме через 1-7 дней.
Взаимодействие с другими лекарственными препаратами
Цитотоксическая химиотерапия
Ввиду чувствительности быстроделящихся миелоидных клеток к миелосупрессивной цитотоксической химиотерапии следует соблюдать интервал в 24 ч до или после назначения миелосупрессивных препаратов. Предварительные данные применения Нейпогена в комбинации с 5-фторурацилом у небольшой группы пациентов показывают, что фторурацил усиливает тяжесть нейтропении.
Визуализация костей
На фоне применения Г-КСФ отмечались транзиторные положительные изменения при визуализации костей, которые могут обуславливаться возросшей гемопоэтической активностью костного мозга в ответ на терапию факторами роста.
Литий
Возможность фармакодинамического взаимодействия с литием, который также способствует высвобождению нейтрофилов, специально не исследовали. Нет подтверждения, что данное взаимодействие может быть опасным.
Особые указания
Нейпоген не должен быть использован с целью увеличения доз цитотоксических химиотерапевтических препаратов выше рекомендованных.
Нейпоген не рекомендуется применять у пациентов с тяжелой врожденной нейтропенией, свидетельствующей о развитии лейкемии или доказывающей эволюцию лейкемии.
Отмечались случаи гиперчувствительности, включая анафилактические реакции, возникающие на фоне начальной или последующей терапии Нейпогеном.
Нейпоген не следует применять у пациентов с реакциями повышенной чувствительности к филграстиму или пэгфилграстиму в анамнезе.
Как и со всеми терапевтическими белками, возможно проявление иммуногенности. Частота появления антител к филграстиму как правило низкая. Связывающие антитела образуются, как и следует ожидать, со всеми биологическими препаратами; однако они не ассоциируются с нейтрализующей активностью.
Рост миелоидных клеток
Гранулоцитарный колониестимулирующий фактор может стимулировать рост миелоидных клеток in vitro и аналогичные эффекты могут наблюдаться in vitro и в отношении некоторых немиелоидных клеток.
Безопасность и эффективность применения Нейпогена у пациентов с миелодиспластическим синдромом и хроническим миелолейкозом не установлены, поэтому при этих заболеваниях он не показан. Особое внимание следует обращать на дифференциальный диагноз между острым миелолейкозом и бластным кризом хронического миелолейкоза.
Необходимо с осторожностью применять Нейпоген у пациентов с вторичным острым миелолейкозом, ввиду ограниченных данных по безопасности и эффективности в данном случае.
Безопасность и эффективность применения Нейпогена у пациентов с острым миелолейкозом de novo младше 55 лет в случаях прогностически благоприятных цитогенетических факторов (транслокации t (8;21), t (15; 17) и inv (16)) не установлены.
Прочие особые указания
Пациентам с остеопорозом, получающим непрерывное лечение Нейпогеном в течение более 6 месяцев, показан контроль плотности костного вещества.
После введения Г-КСФ возникали побочные реакции со стороны дыхательной системы, в частности интерстициальное заболевание легких. Пациенты с недавними случаями легочных инфильтратов или пневмонией, могут быть подвержены наибольшему риску. При возникновении симптомов, таких как кашель, повышение температуры и диспноэ, в сочетании с рентгенологическими данными в виде наличия легочных инфильтратов и ухудшением легочной функции, можно предполагать развитие респираторного дистресс-синдрома взрослых. В этом случае терапию Нейпогеном следует отменить и назначить соответствующее лечение.
После введения Г-КСФ наблюдались случаи синдрома повышенной проницаемости капилляров, характеризующиеся гипотензией, гипоальбуминемией, отеком и сгущением крови. Пациентам с данным синдромом необходим более тщательный контроль и стандартное симптоматическое лечение, которое может включать необходимость в интенсивной терапии (см. раздел «Побочное действие»).
Колпачок иглы предварительно заполненного шприца состоит из натуральной обезвоженной резины (производное латекса), которая может быть причиной возникновения аллергических реакций.
Особые указания у онкологических пациентов
Нечасто сообщалось о случаях спленомегалии и разрыва селезенки после применения филграстима. Некоторые из этих случаев были с летальным исходом. Пациентов, получающих филграстим и жалующихся на боль в верхней левой части живота и/или в верхней части левого плеча, следует обследовать на наличие спленомегалии или разрыва селезенки.
Лейкоцитоз
Менее чем у 5% пациентов, получающих Нейпоген в дозах более 0.3 млн ЕД/кг/сут (3 мкг/кг/сут), число лейкоцитов увеличивалось до 100 х 109/л и более. Не сообщалось о каких-либо побочных реакциях, непосредственно связанных с таким лейкоцитозом. Однако, учитывая возможный риск, связанный с высоким лейкоцитозом, во время лечения Нейпогеном следует регулярно определять число лейкоцитов. Если после прохождения ожидаемого минимума, число лейкоцитов превысит 50 х 109/л, Нейпоген следует немедленно отменить. Однако, если Нейпоген применяется для мобилизации ПСКК, его дозу следует снизить или полностью отменить, когда число лейкоцитов превысит 70×109%.
Риск, связанный с высокодозной химиотерапией
Особую осторожность следует проявлять при лечении пациентов, получающих высокодозную химиотерапию, поскольку улучшения исхода злокачественного новообразования не отмечено, в то время как повышенные дозы химиопрепаратов обладают более выраженной токсичностью, включая кожные реакции и побочные эффекты со стороны сердечно-сосудистой, нервной и дыхательной систем (см. инструкции по применению конкретных химиопрепаратов).
Монотерапия препаратом Нейпоген не предотвращает тромбоцитопению и анемию, обусловленные миелосупрессивной химиотерапией. Из-за возможности применения более высоких доз химиопрепаратов (например, полные дозы в соответствии со схемами), пациент может подвергаться большему риску тромбоцитопении и анемии. Рекомендуется регулярно проводить анализ крови и определять число тромбоцитов и гематокрит. Особую осторожность следует проявлять при применении однокомпонентных или комбинированных химиотерапевтических схем, способных вызывать тяжелую тромбоцитопению.
Было показано, что применение Нейпогена для мобилизации ПСКК приводит к уменьшению степени и продолжительности тромбоцитопении, развившейся вследствие миелосупрессивной или миелоаблативной химиотерапии.
Прочие особые указания
Действие Нейпогена у пациентов со значительно сниженным количеством миелоидных клеток-предшественников изучено не было. Нейпоген увеличивает число нейтрофилов путем воздействия, прежде всего, на клетки-предшественники нейтрофилов. Поэтому у пациентов с пониженным содержанием клеток-предшественников (например, подвергшихся интенсивной лучевой терапии или химиотерапии, или инфильтрацией костного мозга) степень повышения числа нейтрофилов может быть ниже.
У пациентов, получавших высокие дозы химиотерапии с последующей аутологичной пересадкой костного мозга, сообщалось о сосудистых нарушениях, включая веноокклюзионную болезнь и нарушения, связанные с изменением содержания жидкости в организме.
Отмечались случаи развития реакции «трансплантат против хозяина» и случаи с летальным исходом у пациентов, получавших Г-КСФ после аллогенной трансплантации костного мозга (см. раздел «Побочное действие»).
Возросшая гемопоэтическая активность костного мозга в ответ на терапию факторами роста приводит к транзиторным положительным изменениям при визуализации костей. Это следует принимать во внимание при интерпретации результатов.
Особые указания у больных, проходящих мобилизацию ПСКК
Мобилизация
Сравнение двух рекомендуемых методов мобилизации (только Нейпоген или в комбинации с миелосупрессивной химиотерапией) на одном и том же контингенте пациентов не проводилось. Непосредственное сравнение результатов различных исследований затруднено вследствие индивидуальных различий между пациентами, а также вследствие различий между значениями CD34+, полученными с помощью лабораторных анализов. Поэтому достаточно сложно рекомендовать какой-либо оптимальный метод мобилизации. Выбор метода мобилизации следует проводить в зависимости от общих целей лечения данного пациента.
Предшествующее лечение цитотоксическими средствами
У пациентов, которым в прошлом проводилась активная миелосупрессивная терапия, может не происходить достаточного увеличения ПСКК до рекомендуемого минимального уровня (≥ 2.0 х 106 СD34+-клеток/кг) или ускорения нормализации числа тромбоцитов.
Некоторые цитостатики обладают особой токсичностью по отношению к клеткам-предшественникам гемопоэза и могут отрицательно влиять на их мобилизацию. Применение таких препаратов, как мелфалан, кармустин и карбоплатин на протяжении длительного периода до начала мобилизации может уменьшать степень ее выраженности. Однако, применение мелфалана, карбоплатина или кармустина вместе с Нейпогеном эффективно при активации ПСКК. Если планируется трансплантация ПСКК, рекомендуется запланировать их мобилизацию на ранней стадии курса лечения. Особое внимание следует обратить на число клеток-предшественников, активированных у таких больных до высокодозной химиотерапии. Если результаты мобилизации в соответствии с вышеприведенными критериями недостаточны, следует рассмотреть альтернативные виды лечения, не требующие использования клеток-предшественников.
Оценка количества периферических стволовых клеток крови
Оценивая число ПСКК, мобилизованных у пациентов с помощью Нейпогена, следует уделить особое внимание методу количественного определения. Результаты проточного цитометрического анализа числа СD34+-клеток различаются в зависимости от конкретной методологии, и нужно с осторожностью относиться к рекомендациям по их числу, основанным на исследованиях, проведенных в других лабораториях.
Существует сложная, но стабильная статистическая зависимость между числом введенных в реинфузию СD34+-клеток и скоростью нормализации числа тромбоцитов после высокодозной химиотерапии.
Минимальное количество ПСКК, равное или превышающее 2.0 х 106 СD34+-клеток/кг, приводит к достаточному восстановлению гематологических показателей. Количество, превосходящее это значение, по-видимому, сопровождается более быстрой нормализацией, количество менее указанного — более медленной нормализацией картины крови.
Мобилизация ПСКК у здоровых доноров
Процедура мобилизации ПСКК не несет непосредственной пользы для здоровых доноров и должна проводиться только в целях аллогенной трансплантации.
Мобилизация ПСКК возможна только при условии соответствия лабораторных параметров, особенно, гематологических показателей донора, критериям выбора, также особое внимание следует обратить на наличие инфекционных заболеваний.
Оценка безопасности и эффективности Нейпогена у здоровых доноров младше 16 и старше 60 лет не проводилась.
Очень часто у пациентов, проходящих лечение Нейпогеном, наблюдалась тромбоцитопения. В связи с этим подсчету тромбоцитов следует уделять особое внимание.
Преходящая тромбоцитопения (количество тромбоцитов менее 100 х 109/л) после назначения филграстима и проведения лейкафереза наблюдается у 35% доноров. Кроме того, отмечено 2 случая тромбоцитопении менее 50 х 109/л после проведения процедуры лейкафереза.
Если требуется проведение более одного лейкафереза, необходимо контролировать количество тромбоцитов перед каждой процедурой афереза, особенно, если число тромбоцитов меньше 100 х 109/л. Проведение лейкафереза не рекомендуется, если число тромбоцитов менее 75 х 109/л, при назначении антикоагулянтов или известных нарушениях гемостаза.
Нейпоген должен быть отменен или его доза должна быть снижена, если количество лейкоцитов более 70 х 109/л.
У здоровых доноров, получающих Г-КСФ для мобилизации ПСКК, необходимо регулярно контролировать все показатели анализа крови до их нормализации.
У здоровых доноров наблюдались переходящие цитогенетические нарушения на фоне приема Г-КСФ. Значимость данных нарушений не известна. Тем не менее, нельзя исключить риск появления клона злокачественных опухолевых клеток. В центре афереза рекомендуется проводить систематический мониторинг отдаленной безопасности применения препарата у здоровых доноров в течение не менее 10 лет.
После введения Г-КСФ, у здоровых доноров (и пациентов) часто сообщалось о бессимптомных случаях спленомегалии и нечасто о случаях разрыва селезенки. Некоторые случаи разрыва селезенки приводили к летальному исходу. Поэтому рекомендуется тщательно контролировать размеры селезенки (пальпация, ультразвуковое исследование). Подозрение на разрыв селезенки должно быть диагностировано у здоровых доноров и/или пациентов с болью в левой верхней части живота или в верхней части левого плеча.
У здоровых доноров часто возникала одышка, а остальные симптомы со стороны органов дыхания (гемоптизис, легочное кровотечение, инфильтраты в легких, гипоксия) — нечасто. В случае подозрения или подтверждения побочных реакций со стороны органов дыхания необходимо прекратить лечение Нейпогеном и оказать соответствующую медицинскую помощь.
Особые указания для реципиентов аллогенных ПСКК, полученных с помощью Нейпогена
Имеющиеся данные показывают, что применение аллогенного трансплантата ПСКК может ассоциироваться с увеличением риска развития острой или хронической реакции «трансплантат против хозяина» по сравнению с трансплантацией костного мозга.
Особые указания для пациентов с ТХН
Формула крови
Очень часто у пациентов, получающих Нейпоген, сообщалось о возникновении тромбоцитопении. Необходимо тщательно контролировать число тромбоцитов, особенно в течение первых нескольких недель лечения Нейпогеном. Если у пациента появляется тромбоцитопения (число тромбоцитов стабильно ниже 100 х 109/л), следует рассмотреть вопрос о временной отмене препарата или уменьшении дозы.
Наблюдаются также и другие изменения формулы крови, требующие ее тщательного контроля, в том числе анемия и преходящее увеличение количества миелоидных клеток-предшественников.
Трансформация в лейкоз или миелодиспластический синдром
Особую осторожность следует проявлять при диагностике ТХН, и дифференцировать ее от других гематологических заболеваний, таких как апластическая анемия, миелодисплазия и миелолейкоз. До начала лечения следует провести развернутый анализ крови с определением лейкоцитарной формулы и числа тромбоцитов, а также исследовать морфологическую картину костного мозга и кариотип.
У небольшого числа (около 3%) пациентов с тяжелой врожденной нейтропенией, получавших Нейпоген в клинических исследованиях, наблюдался миелодиспластический синдром или лейкоз. Миелодиспластический синдром и лейкоз — естественные осложнения этого заболевания и их связь с лечением Нейпогеном неясна. Примерно у 12% пациентов с исходно нормальной цитогенетикой при повторном обследовании обнаруживались аномалии, в том числе моносомия 7. Пока еще не ясно, предрасполагает ли длительное лечение Нейпогеном пациентов с тяжелой врожденной нейтропенией к развитию цитогенетических аномалий, миелодиспластического синдрома и лейкоза. Пациентов рекомендуется регулярно (приблизительно каждые 12 мес.) проводить морфологические и цитогенетические исследования костного мозга.
Прочие особые указания
Следует исключить такие причины преходящей нейтропении, как вирусные инфекции.
Очень часто сообщалось о случаях разрыва селезенки после применения филграстима. Пациентов, получающих филграстим и жалующихся на боль в верхней левой части живота и/или в верхней части левого плеча, следует обследовать на наличие спленомегалии или разрыва селезенки.
Увеличение селезенки является прямым следствием лечения Нейпогеном. Во время клинических исследований у 31% пациентов с ТХН при пальпации обнаруживалась спленомегалия. При рентгенографии увеличение объема выявляется вскоре после начала лечения и имеет тенденцию к стабилизации. Уменьшение дозы замедляет или останавливает увеличение размера селезенки; спленэктомия может потребоваться у 3% пациентов. Размеры селезенки нужно контролировать регулярно путем пальпации.
У небольшого числа пациентов наблюдались гематурия и протеинурия. Для контроля этих показателей следует регулярно делать анализ мочи.
Безопасность и эффективность применения препарата у новорожденных и больных с аутоиммунной нейтропенией не установлены.
Особые указания для ВИЧ-пациентов
Часто сообщалось о случаях разрыва селезенки после применения Нейпогена. Пациентов, получающих филграстим и жалующихся на боль в верхней левой части живота и/или в верхней части левого плеча, следует обследовать на наличие спленомегалии или разрыва селезенки.
Формула крови
При лечении Нейпогеном, особенно в первые несколько недель, необходимо регулярно проводить подсчет АЧН. При очень быстром положительном ответе на терапию возможно значительное увеличение числа нейтрофилов после введения начальных доз Нейпогена. При лечении Нейпогеном необходимо регулярно проводить подсчет АЧН, ежедневно в течение первых 2-3 дней, затем не менее двух раз в неделю в течение первых двух недель и каждую неделю или через неделю во время поддерживающей терапии. При проведении поддерживающей терапии 300 млн ЕД (300 мкг)/сут по альтернирующей схеме возможны значительные колебания числа нейтрофилов. С учетом колебаний значения АЧН, для определения истинного максимального снижения АЧН (надир) забор крови необходимо проводить сразу перед назначением следующей дозы препарата.
Риск, связанный с увеличением дозы миелосупрессивных химиопрепаратов
Терапия препаратом Нейпоген не предотвращает тромбоцитопению и анемию, обусловленные миелосупрессивной химиотерапией. Из-за возможности применения более высоких доз химиопрепаратов (например, полные дозы в соответствии со схемами) или их большего количества в составе комбинированной терапии, пациент может подвергаться большему риску тромбоцитопении и анемии. Рекомендуется регулярно проводить анализ форменных элементов (см. выше).
Инфекции и опухоли, приводящие к миелосупрессии
У пациентов с инфекционными заболеваниями и инфильтрацией костного мозга инфекционными возбудителями (например, комплексом Mycobacterium avium) или с опухолевым поражением костного мозга (лимфома) терапию филграстимом проводят одновременно с терапией, направленной против этих состояний. Эффективность Нейпогена при лечении нейтропении, обусловленной инфильтрацией костного мозга инфекционными возбудителями (остеомиелитом) или опухолевым поражением, не установлена.
Особые указания при серповидно-клеточной аномалии и серповидно-клеточной анемии
Имеются сообщения о развитии серповидно-клеточного криза, в некоторых случаях с летальным исходом, при применении филграстима у пациентов с серповидно-клеточной аномалией эритроцитов или серповидно-клеточной анемией. Пациентам с серповидноклеточной аномалией эритроцитов или серповидно-клеточной анемией, филграстим должен назначаться с осторожностью.
Все пациенты
Нейпоген содержит сорбитол. Препарат не следует вводить пациентам с редкой наследственной непереносимостью фруктозы.
Нейпоген содержит менее 1 ммоль (23 мг) натрия в 0,6 мг/мл, т.е. практически свободен от натрия.
Влияние на способность управлять транспортными средствами, механизмами
Влияние на способность управлять транспортными средствами и механизмами не изучалось.
Форма выпуска
Нейпоген упаковывают в шприцы или флаконы.
Раствор для подкожного введения, 30 млн ЕД, 48 млн ЕД
По 0,5 мл препарата (30 млн ЕД, 48 млн ЕД) в инъекционном шприце вместимостью 1 мл из стекла I гидролитического класса со встроенной иглой 27G, эластомерным колпачком и плунжером, ламинированным фторполимером. Колпачок иглы шприца состоит из натуральной обезвоженной резины (производное латекса).
Один предварительно заполненный шприц (ПЗШ) вместе с инструкцией по применению помещают в картонную пачку, снабженную картонным фиксатором или один ПЗШ помещают в контурную ячейковую упаковку. Одну контурную ячейковую упаковку вместе с инструкцией по применению помещают в картонную пачку. На каждую пачку наклеивают прозрачные защитные этикетки для контроля первого вскрытия, имеющие продольную цветную полосу.
Раствор для внутривенного и подкожного введения 30 млн ЕД
По 1,0 мл препарата (30 млн ЕД) во флакон из стекла I гидролитического класса с 13 мм эластомерной пробкой, алюминиевым колпачком и отламывающимся полипропиленовым колпачком. 5 флаконов помещают в пачку картонную, снабженную картонным фиксатором, вместе с инструкцией по применению.
На каждую пачку наклеивают прозрачные защитные этикетки контроль первого вскрытия, имеющие продольную цветную полосу.
Условия хранения
Хранить при температуре от 2 — 8°С.
Не замораживать.
, Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте!
Срок годности
2,5 года.
Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту.
Владелец регистрационного удостоверения
Амджен Европа Б.В., Нидерланды Минервум 7061 NL-4817 ZK Бреда
Производитель
Производитель готовой лекарственной формы /фасовщик (первичная упаковка)
Амджен Мэньюфэкчуринг Лимитед, Роуд 31, Км 24.6, Джанкос, Пуэрто-Рико, 00777, США.
Упаковщик (вторичная (потребительская) упаковка)
Амджен Европа Б.В., Минервум 7061, NL-4817 ZK Бреда, Нидерланды или ООО «Добролек», Россия, 115446, Москва, Коломенский проезд, 13А.
Выпускающий контроль качества
Амджен Европа Б.В., Минервум 7061, NL-4817 ZK Бреда, Нидерланды или ООО «Добролек», Россия, 115446, Москва. Коломенский проезд, 13А.
Организация, принимающая претензии от потребителей
ООО «Амджен»
123112, Москва; Пресненская набережная, д.8. строение 1; 7 этаж
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Гепариновая мазь при наружном применении оказывает умеренное противовоспалительное действие, косвенно улучшает микроциркуляцию, что способствует процессу рассасывания гематом и тромбов и уменьшению отечности тканей.
Содержание
- Показания к применению
- Действие на организм
- Формы препарата
- Инструкция по применению
- При беременности
- Особые указания и меры предосторожности
- Взаимодействия и противопоказания
- Передозировка
- Список аналогов
Показания к применению
Гепариновая мазь предназначена строго для наружного применения. Средство содержит три активных компонента, оказывающих комплексное действие:
- Гепарин – уменьшает выраженность воспалительной реакции, предупреждает и замедляет образования тромбов.
- Бензокаин – обладает локальным анестезирующим эффектом.
- Бензилникотинат – проявляет сосудорасширяющее действие, что усиливает всасывание гепарина.
Мазь гепариновая– для чего применяется препарат:
- С целью устранения отека, уменьшения тромбообразования при поверхностных заболеваниях вен. Средство назначается при тромбофлебите – воспалении и тромбозе, флебите – воспалении стенок вен.
- Для уменьшения выраженности воспаления после внутримышечных или внутривенных инъекций в случае развития осложнений.
- При воспалении геморроидальных узлов средство оказывает комплексное действие – обезболивает, предупреждает тромбирование, снижает активность воспаления, способствует заживлению.
- С целью уменьшения и скорейшего рассасывания гематомы (синяка после ушиба, разрыва сосуда на поверхности кожи).
Действие на организм
Основное действие гепариновой мази направлено на следующие механизмы:
- Растворение тромбов и предупреждение тромбообразования в сосудах, расположенных близко к поверхности кожи. Данный эффект достигается за счет активации специального белка – антитромбина III, который обладает противосвертывающей активностью – тормозит 5 факторов свертывания и два химических соединения, поддерживающих тромбообразование.
- Торможение воспаления. Во-первых, такое влияние приводит к уменьшению отека, устранения избыточной жидкости, что влечет за собой снижение давления на ткани и уменьшение болевого синдрома.
- Уменьшение воспаления в стенке сосуда, что снижает скорость образования тромбов и атеросклеротических бляшек.
- Улучшение питания тканей и снабжения их кислородом за счет ускорения микроциркуляции. если есть во-первых, должно быть во вторых
Бензокаин блокирует проведение сигналов от болевых рецепторов по нервным волокнам, поэтому применение гепариновой мази дает анестезирующий эффект.
Формы препарата
Гепариновая мазь выпускается в металлических тубах по 25 г, упакованных в картонную коробку. В каждую упаковку вкладывается инструкция-вкладыш. Состав:
- гепарин натрия – 2500 ME;
- бензокаин – 1000,0 мг;
- бензилникотинат – 20,0 мг.
В качестве вспомогательных веществ, необходимых для равномерного смешения активных компонентов и сохранения нужной консистенции, в состав включены вода, глицерин, парафин, подсолнечное масло очищенное, и прочие соединения.
Внешние признаки гепариновой мази:
- средняя вязкость;
- белый цвет с оттенком желтого;
- характерный запах отсутствует.
Инструкция по применению
Точные объемы применения назначает врач с учетом объема тромба, размера гематомы, наличия сопутствующих заболеваний и факторов риска.
Имеются противопоказания. Необходима консультация специалиста.
Гепариновая мазь – инструкция по применению с указанием средних дозировок и кратности нанесения в зависимости от патологии:
- Воспаление и тромбообразование в поверхностных венах (тромбофлебит). Средство наносится тонким слоем на область поражения в объеме до 1 г на участок площадью 5 см., втирается в кожу.
- Воспаление вен(флебит) на фоне введения препаратов с помощью инъекций. Аналогично тромбофлебиту.
- Воспаление наружных геморроидальных узлов. Гепариновая мазь от геморроя наносится на прокладки из марли или бязи, затем ткань накладывается на проблемный участок и фиксируется повязкой. Прокладку можно заменить тампоном, пропитанным мазью, и введенным в задний проход.
- Гепариновая мазь от синяков, начиная со вторых суток после получения травмы. За счет уменьшения отека и ускорения рассасывания тромбов препарат эффективно устраняет гематомы. Средство накладывается на область ушиба при условии сохранения целостности кожи вокруг синяка. Кратность нанесения – до 3 раз в день, длительность применения – около недели. Максимальная дозировка в сутки не должна превышать 25 г.
С косметической целью препарат не имеет официального назначения, но при этом гепариновая мазь активно используется для лица в следующих случаях:
- Для устранения мешков под глазами. Образование мешков на лице вызвано нарушением кровообращения, скоплением жидкости в подкожно-жировой клетчатке. Кожа под глазами очень тонкая, легко растягивается, при этом приобретает синюшный вид. Гепариновая мазь накладывается под глаза, избегая попадания на слизистую, иначе могут быть сильное раздражение и ожог. Частота нанесения – один раз в сутки, для лучшего впитывания кожу легко похлопывают кончиками пальцев. Препарат можно наносить на ватные диски, которые затем накладывать под глаза.
- Уменьшение морщин. Средство наносится тонким слоем на лицо, тем самым улучшая микроциркуляцию в тканях. Важно не допустить попадания препарата в глаза, иначе возникнет раздражение слизистой с покраснением, жжением, слезотечением. В зоне вокруг глаз не стоит прикладывать усилить при втирании, чтобы не растягивать кожу. Для достижения лучшего результата следует чередовать нанесение гепариновая мазь от морщин с натуральными маслами – персиковым, миндальным, оливковым.
- Противовоспалительный эффект позволяет наносить гепариновую мазь на кожу для избавления от прыщей. Средство накладывается тонким слоем и втирается в нужный участок кожи не менее трех раз в день.
Гепариновая мазь не может устранить причину появления прыщей или мешков под глазами – использование препарата с косметическими целями означает уменьшение симптомов, но не лечение.
При беременности
Гепарин не проникает через плаценту в организм плода, не попадает в грудное молоко, но данных о безопасности использования мази во время гестации или лактации нет. Как и для любого препарата для гепариновой мази действует правило – по возможности не применять в первые два триместра.
Применение гепариновой мази во время беременности возможно, если ожидаемая польза превышает риски для плода.
Особые указания и меры предосторожности
Гепариновая мазь не назначается в следующих заболеваниях и состояниях:
- тромбоз глубоких вен;
- наличие тромбоэмболии в анамнезе – ранее перенесенный эпизод закупорки сосуда;
- открытые раны, поврежденные кожные покровы, гнойное отделяемое;
- принимаются препараты, изменяющие работу свертывающей или противосвертывающей системы
Длительное применение, обширные участки нанесения мази, женский пол в возрасте старше 65 лет, беременность могут являться основанием для определения количественных показателей и оценки коагулограммы – анализа, показывающего готовность крови к свертыванию.
Мазь наносится только на неповрежденную кожу. Попадание на слизистые оболочки может повлечь за собой выраженное раздражение и ожог. В такой ситуации необходимо срочно промыть глаза прохладной (не холодной) проточной водой.
При нанесении препарата могут возникнуть местные реакции аллергического характера – гиперемия, онемение, зуд, сыпь, волдыри. В таком случае применение препарата следует прекратить, на область раздражения нанести антигистаминный крем или гель.
Если больной по каким-либо причинам пропустил время нанесения средства, то необходимо сделать это при первом удобном случае. При этом важно убедиться, что внеочередное применение гепариновой мази не нарушает общей кратности использования в сутки – не более трех нанесений.
Взаимодействия и противопоказания
Химические вещества в основе препарата могут вступать в реакции с другими соединениями. Действие гепарина усиливают следующие препараты:
- Тормозящие образование тромбов – антикоагулянты и антиагреганты.
- Нестероидные противовоспалительные средства или НПВС.
Совместное использование повышает риск кровотечения.
Эффективность гепариновой мази уменьшается при совместном применении с лекарственными средствами, содержащими в своем составе следующие компоненты:
- тироксин (назначается при патологиях щитовидной железы);
- тетрациклин (антибактериальный препарат);
- противоаллергического свойства;
- никотиновую кислоту;
- алкалоиды спорыньи.
Можно ли использовать гепариновую мазьу детей и подростков? Применение гепариновой мази противопоказано в возрасте до 2 лет.
Передозировка
Случаев передозировки при местном использовании гепариновой мази не наблюдалось.
Список аналогов
Аналоги гепариновой мази:
- Лавенум. Гепарин натрия в форме геля для наружного применения. Менее жирная текстура.
- Тромблесс. Комплексное средство, в состав которого входит гепарин натрия. Обладает смягчающим, заживляющим, противовоспалительным и антикоагулянтным эффектами.
- Гепатромбин Г. Ректальные свечи, содержащие гепарин и гормон преднизолон, из-за чего имеют высокую противовоспалительную и противоотечную активность. Используется в проктологии.
- Венитан форте. Гель, назначаемый для устранения синяков, отеков, а также облегчения состояния при заболеваниях вен. Содержит гепарин и заживляющие компоненты.
Лучшая гепариновая мазь – это мазь с ненарушенным сроком годности, которая хранилась в холодильнике. При таких условиях любой препарат с действующим веществом в виде гепарина натрия будет эффективен.
Источники
- Гепариновая мазь // Справочник лекарственных средств Vidal // 2022;
- Гепариновая мазь // Энциклопедия лекарственных препаратов РЛС // 2022.
Информация представлена в ознакомительных целях и не является медицинской консультацией или руководством к лечению со стороны uteka.ru. Не занимайтесь самолечением, при появлении симптомов заболевания обратитесь к врачу.
Средний рейтинг 5 из 5 на основе 3 голосов

