Топ 20 лекарств с такими-же компонентами:
Топ 20 лекарств с таким-же применением:
Название медикамента

Описание Название медикамента Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Hipersar
Состав

Описание Состав Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Олмесартан Медоксомил
Терапевтические показания

Описание Терапевтические показания Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Лечение эссенциальной гипертонии.
Лечение гипертонии у детей и подростков от 6 до 18 лет.
Способ применения и дозы

Описание Способ применения и дозы Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Дозировка
Взрослые
Рекомендуемая начальная доза Hipersar составляет 10 мг один раз в день. У пациентов, у которых артериальное давление не контролируется адекватно при этой дозе, доза Hipersar может быть увеличена до 20 мг один раз в день в качестве оптимальной дозы. Если требуется дополнительное снижение артериального давления, доза Hipersar может быть увеличена максимум до 40 мг в день или может быть добавлена терапия гидрохлоротиазидом.
Антигипертензивный эффект Hipersar в основном присутствует в течение 2 недель после начала терапии и максимален примерно через 8 недель после начала терапии. Это следует иметь в виду при рассмотрении вопроса об изменении режима дозирования для любого пациента.
Пожилые люди (65 лет и старше)
Обычно не требуется корректировка дозировки у пожилых людей (см. Ниже рекомендации по дозировке у пациентов с почечной недостаточностью). Если требуется повышенная титрование до максимальной дозы 40 мг в день, следует внимательно следить за артериальным давлением.
Почечная недостаточность
Максимальная доза для пациентов с почечной недостаточностью легкой и средней степени тяжести (клиренс креатинина 20-60 мл / мин) составляет 20 мг гиперсара один раз в день из-за ограниченного опыта более высоких доз в этой группе пациентов. Использование Hipersar у пациентов с тяжелой почечной недостаточностью (клиренс креатинина <20 мл / мин) не рекомендуется, поскольку в этой группе пациентов опыт ограничен.
Печеночная недостаточность
Для пациентов с легкой печеночной недостаточностью корректировка рекомендаций по дозировке не требуется. У пациентов с умеренной печеночной недостаточностью рекомендуется начальная доза 10 мг гиперсара один раз в день, а максимальная доза не должна превышать 20 мг один раз в день. Тщательный мониторинг артериального давления и почечной функции рекомендуется пациентам с нарушениями функции печени, которые уже получают диуретики и / или другие антигипертензивные средства. У пациентов с тяжелой печеночной недостаточностью опыт применения гиперсара отсутствует, поэтому его применение не рекомендуется в этой группе пациентов. Hipersar не следует использовать у пациентов с обструкцией желчевыводящих путей.
Детская популяция
Дети и подростки от 6 до 18 лет
Рекомендуемая начальная доза Hipersar у детей от 6 до менее 18 лет составляет 10 мг Hipersar один раз в день. У детей, у которых артериальное давление не контролируется адекватно при этой дозе, доза Hipersar может быть увеличена до 20 мг один раз в день. Если требуется дополнительное снижение артериального давления, у детей весом> 35 кг доза Hipersar может быть увеличена максимум до 40 мг. У детей весом менее 35 кг суточная доза не должна превышать 20 мг.
Другая детская популяция
Безопасность и эффективность Hipersar у детей и в возрасте от 1 до 5 лет еще не установлены. 1 и 5.2, но никакие рекомендации по позологии не могут быть сделаны.
Hipersar не следует использовать у детей младше 1 года из-за проблем безопасности и отсутствия данных в этой возрастной группе.
Способ применения:
Чтобы обеспечить соблюдение, рекомендуется принимать Hipersar примерно в одно и то же время каждый день, с едой или без, например, во время завтрака. Таблетку следует проглатывать с достаточным количеством жидкости (например,. один стакан воды). Таблетку не следует жевать.
Противопоказания

Описание Противопоказания Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Второй и третий триместры беременности.
Билиарная обструкция.
Одновременный прием Hipersar с алискиренсодержащими продуктами противопоказан пациентам с сахарным диабетом или почечной недостаточностью (СКФ <60 мл / мин / 1,73 м2).
Особые предупреждения и меры предосторожности

Описание Особые предупреждения и меры предосторожности Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Внутрисосудистый объем истощения:
Симптоматическая гипотензия, особенно после первой дозы, может возникать у пациентов с объемом и / или истощением натрия в результате интенсивной диуретической терапии, ограничения содержания диетической соли, диареи или рвоты. Такие условия должны быть исправлены до администрации Hipersar.
Другие условия со стимуляцией системы ренин-ангиотензин-альдостерон
У пациентов, у которых сосудистый тонус и почечная функция зависят преимущественно от активности ренин-ангиотензинальдостероновой системы (например,. пациенты с тяжелой застойной сердечной недостаточностью или лежащей в основе почечной недостаточностью, включая стеноз почечной артерии), лечение другими лекарственными средствами, влияющими на эту систему, было связано с острой гипотензией, азотемией, олигурией или, редко, острой почечной недостаточностью. Возможность подобных эффектов не может быть исключена с антагонистами рецептора ангиотензина II.
Реноваскулярная гипертензия:
Существует повышенный риск тяжелой гипотонии и почечной недостаточности, когда пациенты с двусторонним стенозом почечной артерии или стенозом артерии в одной функционирующей почке получают лекарственные средства, которые влияют на систему ренин-ангиотензинальдостерон.
Почечная недостаточность и трансплантация почки:
Когда Hipersar используется у пациентов с нарушенной функцией почек, рекомендуется периодический мониторинг уровня калия и креатинина в сыворотке. Использование Hipersar не рекомендуется у пациентов с тяжелой почечной недостаточностью (клиренс креатинина <20 мл / мин). Нет опыта введения Hipersar у пациентов с недавней трансплантацией почки или у пациентов с терминальной стадией почечной недостаточности (т.е. клиренс креатинина <12 мл / мин).
Печеночная недостаточность:
Гиперкалиемия
Использование лекарственных препаратов, которые влияют на систему ренин-ангиотензин-альдостерон, может вызвать гиперкалиемию.
Риск, который может быть смертельным, увеличивается у пожилых людей, у пациентов с почечной недостаточностью и у пациентов с диабетом, у пациентов, одновременно получающих другие лекарственные средства, которые могут повышать уровень калия, и / или у пациентов с интеркуррентными событиями.
Прежде чем рассматривать сопутствующее использование лекарственных препаратов, которые влияют на систему ренин ангиотензин — альдостерон, следует оценить соотношение риска и других альтернатив. (см. также раздел «Двойная блокада системы ренинангиотензин-альдостерон (RAAS)»).
Основными факторами риска гиперкалиемии, которые следует учитывать, являются:
— диабет, почечная недостаточность, возраст (> 70 лет)
— Комбинация с одним или несколькими другими лекарственными средствами, которые влияют на систему ренин-ангиотензин-альдостерон и / или добавки калия. Некоторые лекарственные средства или терапевтический класс лекарственных средств могут вызывать гиперкалиемию: заменители соли, содержащие калий, калийсберегающие диуретики, ингибиторы АПФ, антагонисты рецепторов ангиотензина II, нестероидные противовоспалительные препараты (включая селективные ингибиторы ЦОГ-2), гепарин, иммунодепрессатор в виде циклоспорин или такролимус, триметоприм.
— интеркуррентные события, в частности обезвоживание, острая сердечная декомпенсация, метаболический ацидоз, ухудшение почечной функции, внезапное ухудшение почечной недостаточности (например,. инфекционные заболевания), клеточный лизис (например, острая ишемия конечностей, рабдомиолиз, длительная травма).
Рекомендуется тщательный мониторинг уровня калия в сыворотке крови у пациентов с риском.
Двойная блокада системы ренин-ангиотензин-альдостерон (RAAS):
Существуют доказательства того, что одновременное использование ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена увеличивает риск гипотонии, гиперкалиемии и снижения почечной функции (включая острую почечную недостаточность). Поэтому не рекомендуется двойная блокада RAAS за счет комбинированного использования ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена.
Если двойная блокадная терапия считается абсолютно необходимой, это должно происходить только под наблюдением специалиста и при условии частого тщательного контроля почечной функции, электролитов и артериального давления.
Ингибиторы АПФ и блокаторы рецепторов ангиотензина II не следует использовать одновременно у пациентов с диабетической нефропатией.
Литий:
Как и в случае с другими антагонистами рецепторов ангиотензина-II, комбинация лития и гиперсара не рекомендуется.
Стеноз аортального или митрального клапана; обструктивная гипертрофическая кардиомиопатия:
Как и в случае с другими вазодилататорами, особая осторожность проявляется у пациентов, страдающих стенозом аортального или митрального клапанов или обструктивной гипертрофической кардиомиопатией.
Первичный альдостеронизм:
Пациенты с первичным альдостеронизмом, как правило, не реагируют на антигипертензивные препараты, действующие посредством ингибирования системы ренин-ангиотензин. Поэтому использование Hipersar не рекомендуется у таких пациентов.
Эластичная энтеропатия
В очень редких случаях у пациентов, принимавших ольмесартан через несколько месяцев или лет после начала приема препарата, отмечалась хроническая диарея со значительной потерей веса, что могло быть вызвано локализованной реакцией гиперчувствительности с задержкой. Кишечная биопсия пациентов часто демонстрирует атрофию ворсин. Если у пациента развиваются эти симптомы во время лечения олмесартаном и при отсутствии других явных этиологий, лечение олмесартаном следует немедленно прекратить и не следует возобновлять. Если диарея не улучшается в течение недели после прекращения, дальнейший специалист (например,. гастроэнтеролог) совет должен быть рассмотрен.
Этнические различия:
Как и у всех других антагонистов ангиотензина II, эффект снижения артериального давления у Hipersar несколько меньше у чернокожих пациентов, чем у не чернокожих, возможно, из-за более высокой распространенности статуса низкого ренина в популяции черной гипертоники.
Беременность:
Антагонисты ангиотензина II не следует начинать во время беременности. Если продолжение терапии антагонистами ангиотензина II не считается необходимым, пациенты, планирующие беременность, должны быть заменены альтернативными антигипертензивными препаратами, которые имеют установленный профиль безопасности для использования во время беременности. Когда диагностируется беременность, лечение антагонистами ангиотензина II следует немедленно прекратить и, при необходимости, начать альтернативную терапию.
Другой:
Как и в случае любого антигипертензивного средства, чрезмерное снижение артериального давления у пациентов с ишемической болезнью сердца или ишемическим цереброваскулярным заболеванием может привести к инфаркту миокарда или инсульту.
Этот лекарственный препарат содержит лактозу. Пациенты с редкими наследственными проблемами непереносимости галактозы, дефицита лапп-лактазы или мальабсорбции глюкозы-галактозы не должны принимать этот лекарственный препарат.
Влияние на способность управлять и использовать машины

Описание Влияние на способность управлять и использовать машины Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Hipersar оказывает незначительное или умеренное влияние на способность управлять автомобилем и пользоваться машиной. Головокружение или усталость могут иногда возникать у пациентов, принимающих антигипертензивную терапию, которая может ухудшить способность реагировать.
Побочные эффекты

Описание Побочные эффекты Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Краткое описание профиля безопасности:
Наиболее частыми побочными реакциями во время лечения таблетиками Hipersar являются головная боль (7,7%), гриппоподобные симптомы (4,0%) и головокружение (3,7%).
В плацебо-контролируемых исследованиях монотерапии единственной побочной реакцией на лекарство, которая была однозначно связана с лечением, было головокружение (2,5% заболеваемость гиперсаром и 0,9% плацебо).
Частота также была несколько выше на Hipersar по сравнению с плацебо для гипертриглицеридемии (2,0% против 1,1%) и для повышенной креатинфосфокиназы (1,3% против 0,7%).
Табличный список побочных реакций:
Побочные реакции Hipersar в клинических испытаниях, исследования безопасности после авторизации и спонтанные сообщения обобщены в таблице ниже.
Следующие терминологии были использованы для классификации возникновения очень распространенных побочных реакций (> 1/10); общий (> 1/100, <1/10); необычно (> 1/1000, <1/100); редко (> 1/10000, <1/1000); очень редко (<1/10,0.
|
MedDRA Системный Органный Класс |
Побочные реакции |
Частота |
|
Расстройства крови и лимфатической системы |
Тромбоцитопения |
Нечасто |
|
Расстройства иммунной системы |
Анафилактическая реакция |
Нечасто |
|
Нарушения обмена веществ и питания |
Гипертриглицеридемия |
Общие |
|
Гиперурикемия |
Общие |
|
|
Гиперкалиемия |
Rare |
|
|
Расстройства нервной системы |
Головокружение |
Общие |
|
Головная боль |
Общие |
|
|
Расстройства уха и лабиринта |
Головокружение |
Нечасто |
|
Сердечные расстройства |
Ангина грудная |
Нечасто |
|
Сосудистые нарушения |
Гипотония |
Rare |
|
Респираторные, грудной и средостения расстройства |
Бронхит |
Общие |
|
Фарингит |
Общие |
|
|
Кашель |
Общие |
|
|
Ринит |
Общие |
|
|
Желудочно-кишечные расстройства |
Гастроэнтерит |
Общие |
|
Диарея |
Общие |
|
|
Боль в животе |
Общие |
|
|
Тошнота |
Общие |
|
|
Диспепсия |
Общие |
|
|
Рвота |
Нечасто |
|
|
Эластичная энтеропатия |
Очень редко |
|
|
Расстройства кожи и подкожной клетчатки |
Exanthema |
Нечасто |
|
Аллергический дерматит |
Нечасто |
|
|
Urticaria |
Нечасто |
|
|
Сыпь |
Нечасто |
|
|
Зуд |
Нечасто |
|
|
Ангиодистрофия |
Rare |
|
|
Опорно-двигательный аппарат и соединительная ткань |
Артрит |
Общие |
|
Боль в спине |
Общие |
|
|
Скелетная боль |
Общие |
|
|
Миалгия |
Нечасто |
|
|
Мышечный спазм |
Rare |
|
|
Почечные и мочевые расстройства |
Гематурия |
Общие |
|
Инфекция мочевыводящих путей |
Общие |
|
|
Острая почечная недостаточность |
Rare |
|
|
Почечная недостаточность |
Rare |
|
|
Общие расстройства и условия сайта администрации |
Боль |
Общие |
|
Боль в груди |
Общие |
|
|
Периферический отек |
Общие |
|
|
Гриппоподобные симптомы |
Общие |
|
|
Усталость |
Общие |
|
|
Отек лица |
Нечасто |
|
|
Астения |
Нечасто |
|
|
Недомогание |
Нечасто |
|
|
Lethargy |
Rare |
|
|
Расследования |
Печеночные ферменты увеличились |
Общие |
|
Мочевина крови увеличилась |
Общие |
|
|
Кровь креатинфосфокиназы увеличилась |
Общие |
|
|
Креатинин крови увеличился |
Rare |
Сообщалось о единичных случаях рабдомиолиза во временной связи с приемом блокаторов рецепторов ангиотензина II.
Дополнительная информация о специальных группах населения
Детская популяция
Безопасность олмезартана контролировалась у 361 ребенка и подростка в возрасте от 1 до 17 лет в течение 2 клинических испытаний. Хотя характер и серьезность нежелательных явлений аналогичны таковым у взрослых, частота следующих случаев выше у детей:
— Носовое кровотечение является распространенным побочным эффектом у детей (т.е. > От 1/100 до <1/10), о котором не сообщалось у взрослых.
— В течение 3 недель двойного слепого исследования частота возникновения головокружения и головной боли у детей в возрасте от 6 до 17 лет почти удвоилась в группе с высокой дозой олмезартана.
Общий профиль безопасности олмесартана у детей существенно не отличается от профиля безопасности у взрослых.
Пожилые люди (возраст 65 лет и старше)
У пожилых людей частота гипотонии немного увеличивается от редких до необычных.
Сообщение о предполагаемых побочных реакциях
Сообщение о предполагаемых побочных реакциях после разрешения лекарственного средства имеет важное значение. Это позволяет продолжать мониторинг баланса пользы / риска лекарственного средства.
Медицинским работникам предлагается сообщать о любых предполагаемых побочных реакциях через веб-сайт схемы Yellow Card национальной системы отчетности: www.mhra.gov.uk/yellowcard
Передозировка

Описание Передозировка Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Доступна только ограниченная информация о передозировке у людей. Наиболее вероятным эффектом передозировки является гипотония. В случае передозировки пациент должен тщательно контролироваться, а лечение должно быть симптоматическим и поддерживающим.
Нет информации относительно диализуемости Olmesartan.
Фармакодинамика

Описание Фармакодинамика Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Фармакотерапевтическая группа: антагонисты ангиотензина II, код ATC: C09CA08
Механизм действия / Фармакодинамические эффекты
Хиперсар является мощным, перорально активным, селективным рецептором ангиотензина II (тип AT1) антагонист. Ожидается, что он заблокирует все действия ангиотензина II, опосредованного АТ1 рецептор, независимо от источника или пути синтеза ангиотензина II. Селективный антагонизм ангиотензина II (AT1) рецепторы приводят к повышению уровня ренина в плазме и концентрации ангиотензина I и II, а также к некоторому снижению концентрации альдостерона в плазме.
Ангиотензин II является первичным вазоактивным гормоном системы ренин-ангиотензин-альдостерон и играет значительную роль в патофизиологии гипертонии через тип 1 (AT1) рецептор.
Клиническая эффективность и безопасность
При гипертонии гиперсар вызывает зависимое от дозы длительное снижение артериального давления. Не было никаких признаков гипотонии первой дозы, тахифилаксии во время длительного лечения или гипертонии отскока после прекращения терапии.
Дозировка Hipersar один раз в день обеспечивает эффективное и плавное снижение артериального давления в течение 24-часового интервала дозы. Один раз в день дозировка приводила к аналогичному снижению артериального давления при дозировке два раза в день при той же общей суточной дозе.
При непрерывном лечении максимальное снижение артериального давления достигается через 8 недель после начала терапии, хотя значительная часть эффекта снижения артериального давления уже наблюдается через 2 недели лечения. При использовании вместе с гидрохлоротиазидом снижение артериального давления является аддитивным, и совместное введение хорошо переносится.
Влияние ольмезартана на смертность и заболеваемость пока неизвестно.
Рандомизированное исследование по профилактике микроальбуминурии при ольмезартане и диабете (ROADMAP) у 4447 пациентов с диабетом 2 типа, нормоальбуминурией и, по крайней мере, одним дополнительным сердечно-сосудистым фактором риска, исследовало, может ли лечение олмезартаном задержать начало микроальбуминурии. В течение средней продолжительности наблюдения 3,2 года пациенты получали олмесартан или плацебо в дополнение к другим антигипертензивным агентам, кроме ингибиторов АПФ или АРБ.
Что касается первичной конечной точки, исследование продемонстрировало значительное снижение риска времени до начала микроальбуминурии в пользу олмесартана. После корректировки на различия BP это снижение риска больше не было статистически значимым. У 8,2% (178 из 2160) пациентов в группе олмесартана и у 9,8% (210 из 2139) в группе плацебо развилась микроальбуминурия.
Для вторичных конечных точек сердечно-сосудистые события произошли у 96 пациентов (4,3%) с олмесартаном и у 94 пациентов (4,2%) с плацебо. Частота сердечно-сосудистой смертности была выше при приеме олмесартана по сравнению с лечением плацебо (15 пациентов (0,7%) против. 3 пациента (0,1%), несмотря на аналогичные показатели для нефатального инсульта (14 пациентов (0,6%) против. 8 пациентов (0,4%), нефатальный инфаркт миокарда (17 пациентов (0,8%) против. 26 пациентов (1,2%) и не сердечно-сосудистая смертность (11 пациентов (0,5%) против. 12 пациентов (0,5%)). Общая смертность от олмезартана была численно увеличена (26 пациентов (1,2%) против. 15 пациентов (0,7%)), что было обусловлено главным образом большим количеством смертельных сердечно-сосудистых событий.
Ольмесартан, снижающий частоту почечной недостаточности на конечной стадии в исследовании диабетической нефропатии (ОРИЕНТ), исследовал влияние олмесартана на почечные и сердечно-сосудистые исходы у 577 рандомизированных пациентов с диабетом 2 типа в Японии и Китае с явной нефропатией. В течение медианного периода наблюдения 3,1 года пациенты получали олмесартан или плацебо в дополнение к другим антигипертензивным препаратам, включая ингибиторы АПФ.
Первичная составная конечная точка (время до первого события удвоения креатинина в сыворотке, терминальная почечная недостаточность, смерть от всех причин) произошла у 116 пациентов в группе олмесартана (41,1%) и у 129 пациентов в группе плацебо (45,4%) (HR 0,97 (95% ДИ от 0,75 до 1,24); р =). Составная вторичная сердечно-сосудистая конечная точка возникла у 40 пациентов, получавших олмесартан (14,2%) и 53 пациентов, получавших плацебо (18,7%). Эта составная сердечно-сосудистая конечная точка включала сердечно-сосудистую смертность у 10 (3,5%) пациентов, получавших олмезартан, по сравнению с 3 (1,1%), получавших плацебо, общую смертность 19 (6,7%) против 20 (7,0%), нефатальный инсульт 8 (2,8%) против 11 (3,9%) и нефатальный инфаркт миокарда (3).
Детская популяция
Антигипертензивные эффекты Hipersar в педиатрической популяции были оценены в рандомизированном двойном слепом плацебо-контролируемом исследовании у 302 пациентов с гипертонической болезнью в возрасте от 6 до 17 лет. Исследуемая популяция состояла из полностью черной когорты из 112 пациентов и смешанной расовой когорты из 190 пациентов, включая 38 чернокожих. Этиология гипертонии была преимущественно эссенциальной гипертензией (87% черной когорты и 67% смешанной когорты). Пациенты, которые весили от 20 до <35 кг, были рандомизированы до 2,5 мг (низкая доза) или 20 мг (высокая доза) Hipersar один раз в день, а пациенты, которые весили> 35 кг, были рандомизированы до 5 мг (низкая доза) или 40 мг (высокая доза). ) Хиперсара один раз в день. Гиперсар значительно снижал как систолическое, так и диастолическое артериальное давление с поправкой на вес в зависимости от дозы. Гиперсар как в низких, так и в высоких дозах значительно снижал систолическое артериальное давление на 6,6 и 11,9 мм рт. Ст. От исходного уровня соответственно. Этот эффект также наблюдался в течение 2 недель рандомизированной фазы абстиненции, при которой как среднее систолическое, так и диастолическое артериальное давление продемонстрировали статистически значимый отскок в группе плацебо по сравнению с группой олмесартана. Лечение было эффективным как у детей с первичной, так и вторичной гипертензией. Как отмечалось у взрослых популяций, снижение артериального давления было меньше у чернокожих пациентов.
В том же исследовании 59 пациентов в возрасте от 1 до 5 лет, которые весили> 5 кг, получали 0,3 мг / кг Hipersar один раз в день в течение трех недель в открытой фазе, а затем были рандомизированы для получения Hipersar или плацебо в двойной слепой фазе. В конце второй недели отмены среднее систолическое / диастолическое артериальное давление в корыте было на 3/3 мм рт.ст. ниже в группе, рандомизированной в Hipersar; эта разница в артериальном давлении не была статистически значимой (95% C.I. -2-7 / -1-7).
Другая информация:
Два крупных рандомизированных контролируемых исследования (ONTARGET (Ongoing Telmisartan Alone и в сочетании с Ramipril Global Endpoint Trial) и VA NEPHRON-D (Нефропатия по делам ветеранов при диабете)) исследовали использование комбинации ингибитора АПФ с блокатор рецептора ангиотензина II.
ONTARGET — это исследование, проведенное у пациентов с сердечно-сосудистыми или цереброваскулярными заболеваниями в анамнезе или сахарным диабетом 2 типа, сопровождаемое признаками повреждения конечного органа. VA NEPHRON-D был исследованием у пациентов с сахарным диабетом 2 типа и диабетической нефропатией.
Эти исследования не показали значительного положительного влияния на почечные и / или сердечно-сосудистые исходы и смертность, в то время как наблюдался повышенный риск гиперкалиемии, острого повреждения почек и / или гипотонии по сравнению с монотерапией. Учитывая их сходные фармакодинамические свойства, эти результаты также актуальны для других ингибиторов АПФ и блокаторов рецепторов ангиотензина II.
Поэтому ингибиторы АПФ и блокаторы рецепторов ангиотензина II не следует применять одновременно у пациентов с диабетической нефропатией.
ALTITUDE (Испытание алискиреном при диабете 2 типа с использованием сердечно-сосудистых и почечных заболеваний) было исследование, предназначенное для проверки преимуществ добавления алискирена к стандартной терапии ингибитором АПФ или блокатором рецептора ангиотензина II у пациентов с сахарным диабетом 2 типа и хроническим заболеванием почек, сердечно-сосудистые заболевания, или оба. Исследование было прекращено на ранней стадии из-за повышенного риска неблагоприятных исходов. Сердечно-сосудистая смерть и инсульт были численно более частыми в группе алискирена, чем в группе плацебо, и побочные эффекты и серьезные побочные эффекты (гиперкалиемия, гипотония и почечная дисфункция) чаще регистрировались в группе алискирена, чем в группе плацебо.
Фармакокинетика

Описание Фармакокинетика Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Поглощение и распределение
Хиперсар — пролекарство. Он быстро превращается в фармакологически активный метаболит, олмесартан, эстераз в слизистой оболочке кишечника и в портальной крови во время всасывания из желудочно-кишечного тракта.
В плазме или экскрементах не было обнаружено ни одного неповрежденного фрагмента мопексара или неповрежденной боковой цепи. Средняя абсолютная биодоступность ольмезартана из состава таблеток составила 25,6%.
Средняя пиковая концентрация в плазме (CМаксимум) ольмезартана достигается в течение примерно 2 часов после перорального приема гиперсара, а концентрации олмезартана в плазме увеличиваются приблизительно линейно с увеличением однократных пероральных доз примерно до 80 мг.
Пища оказала минимальное влияние на биодоступность ольмезартана, поэтому Hipersar можно вводить с пищей или без нее.
Клинически значимых гендерных различий в фармакокинетике ольмесартана не наблюдалось.
Олмесартан тесно связан с белком плазмы (99,7%), но вероятность клинически значимых взаимодействий связывания белка между олмесартаном и другими сильно связанными совместно вводимыми препаратами низкая (что подтверждается отсутствием клинически значимого взаимодействия между гиперсаром и варфарином). Связывание олмезартана с клетками крови незначительно. Средний объем распределения после внутривенного введения низок (16 — 29 л).
Биотрансформация и элиминация
Общий клиренс плазмы обычно составлял 1,3 л / ч (CV, 19%) и был относительно медленным по сравнению с печеночным кровотоком (около 90 л / ч). После однократного перорального приема 14Hipersar с маркировкой C, 10 — 16% введенной радиоактивности выводится с мочой (подавляющее большинство в течение 24 часов после введения дозы), а остальная часть восстановленной радиоактивности выводится с калом. Исходя из системной доступности 25,6%, можно рассчитать, что абсорбированный олмесартан очищается как почечной экскрецией (около 40%), так и гепато-билиарной экскрецией (около 60%). Вся восстановленная радиоактивность была идентифицирована как олмесартан. Никакого другого значительного метаболита обнаружено не было. Энтерогепатическая рециркуляция олмесартана минимальна. Поскольку большая часть олмесартана выводится через желчевыводящие пути, применение у пациентов с обструкцией желчи противопоказано.
Конечный период полувыведения олмесартана варьировался от 10 до 15 часов после многократного перорального приема. Устойчивое состояние было достигнуто после первых нескольких доз, и дальнейшее накопление не было очевидным после 14 дней повторного дозирования. Почечный клиренс составлял приблизительно 0,5-0,7 л / ч и не зависел от дозы.
Фармакокинетика в особых группах населения
Детская популяция:
Фармакокинетика олмесартана была изучена у детей с гипертонической болезнью в возрасте от 1 до 16 лет. Клиренс олмесартана у детей был аналогичен клиренсу у взрослых пациентов при корректировке по массе тела.
Фармакокинетическая информация отсутствует у детей с нарушениями функции почек.
Пожилые люди (возраст 65 лет и старше):
У пациентов с гипертонической болезнью AUC в стационарном состоянии был увеличен примерно на 35% у пожилых пациентов (65–75 лет) и примерно на 44% у очень пожилых пациентов (> 75 лет) по сравнению с более молодой возрастной группой. Это может быть, по крайней мере, частично связано со средним снижением почечной функции в этой группе пациентов.
Почечная недостаточность:
У пациентов с почечной недостаточностью AUC в устойчивом состоянии увеличился на 62%, 82% и 179% у пациентов с легкой, умеренной и тяжелой почечной недостаточностью, соответственно, по сравнению со здоровым контролем.
Печеночная недостаточность:
После однократного перорального введения значения AUC олмезартана были на 6% и 65% выше у пациентов с легкой и умеренной гепатической недостаточностью, соответственно, чем у соответствующих им здоровых контролей. Несвязанная фракция олмесартана через 2 часа после введения дозы у здоровых людей, у пациентов с легкой печеночной недостаточностью и у пациентов с умеренной печеночной недостаточностью составила 0,26%, 0,34% и 0,41% соответственно. После повторного введения дозы у пациентов с умеренной печеночной недостаточностью среднее значение AUC по олмезартану снова было примерно на 65% выше, чем при соответствующем здоровом контроле. олмесартан означает CМаксимум значения были одинаковыми у лиц с нарушениями функции печени и здоровья. Гиперсар не был оценен у пациентов с тяжелой печеночной недостаточностью.
Наркотиков взаимодействий
Секвестр желчной кислоты colesevelam :
Одновременный прием 40 мг гидрохлорида гиперсара и 3750 мг колесевелама у здоровых людей привел к снижению Cmax на 28% и снижению AUC олмесартана на 39%. Меньшие эффекты, снижение Cmax и AUC на 4% и 15% соответственно, наблюдались при введении Hipersar за 4 часа до гидрохлорида колесевелама. Период полувыведения олмесартана был снижен на 50-52% независимо от того, вводили ли он одновременно или за 4 часа до гидрохлорида колесевелама.
Фармокологическая группа

Описание Фармокологическая группа Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Антагонисты ангиотензина II, код ATC: C09CA08
Доклинические данные по безопасности

Описание Доклинические данные по безопасности Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
В исследованиях хронической токсичности на крысах и собаках Hipersar показал эффекты, аналогичные другим AT1 антагонисты рецепторов и ингибиторы АПФ: повышенная мочевина в крови (BUN) и креатинин (из-за функциональных изменений почек, вызванных блокированием AT1 рецепторы); снижение массы сердца; снижение параметров эритроцитов (эритроциты, гемоглобин, гематокрит); гистологические признаки повреждения почек (регенеративные поражения почечного эпителия, утолщение базальной мембраны, дилатация канальцев). Эти неблагоприятные эффекты, вызванные фармакологическим действием Hipersar, также имели место в доклинических исследованиях на других AT1 антагонисты рецепторов и ингибиторы АПФ и могут быть уменьшены путем одновременного перорального введения хлорида натрия.
У обоих видов наблюдалась повышенная активность ренина в плазме и гипертрофия / гиперплазия юкстагломерулярных клеток почки. Эти изменения, которые являются типичным эффектом класса ингибиторов АПФ и других АТ1 антагонисты рецепторов, по-видимому, не имеют клинической значимости.
Как и другие AT1 Было обнаружено, что антагонисты рецепторов Hipersar увеличивают частоту разрывов хромосом в клеточных культурах in vitro Никаких соответствующих эффектов не наблюдалось у нескольких. in vivo исследования с использованием Hipersar в очень высоких пероральных дозах до 2000 мг / кг. Общие данные комплексного тестирования на генотоксичность показывают, что олмесартан вряд ли будет оказывать генотоксическое действие в условиях клинического применения.
Гиперсар не был канцерогенным ни у крыс в двухлетнем исследовании, ни у мышей при тестировании в двух 6-месячных исследованиях канцерогенности с использованием трансгенных моделей.
В репродуктивных исследованиях на крысах Hipersar не влиял на фертильность, и не было никаких признаков тератогенного эффекта. Как и у других антагонистов ангиотензина II, выживаемость потомства снижалась после воздействия Hipersar, и расширение таза почки наблюдалось после воздействия плотин в конце беременности и лактации. Как и другие антигипертензивные средства, было показано, что Hipersar более токсичен для беременных кроликов, чем для беременных крыс, однако признаков фтотоксического эффекта не было.
Взаимодействие

Описание Взаимодействие Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Непригодный
Особые меры предосторожности при утилизации и другой обработке

Описание Особые меры предосторожности при утилизации и другой обработке Hipersarявляется автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Нет особых требований к утилизации.
Любой неиспользованный лекарственный препарат или отходы должны быть утилизированы в соответствии с местными требованиями.
Hipersar цена
У нас нет точных данных по стоимости лекарства.
Однако мы предоставим данные по каждому действующему веществу
Средняя стоимость Olmesartan Medoxomil 40 mg за единицу в онлайн аптеках от 0.44$ до 1.61$, за упаковку от 26$ до 105$.
Средняя стоимость Olmesartan Medoxomil 10 mg за единицу в онлайн аптеках от 0.31$ до 1.43$, за упаковку от 24$ до 114$.
Средняя стоимость Olmesartan Medoxomil 20 mg за единицу в онлайн аптеках от 0.31$ до 1.61$, за упаковку от 23$ до 85$.
Источники:
- https://www.drugs.com/search.php?searchterm=hipersar
- https://pubmed.ncbi.nlm.nih.gov/?term=hipersar
Доступно в странах
Найти в стране:
А
Б
В
Г
Д
Е
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ч
Ш
Э
Ю
Я
Top 20 medicines with the same components:
Top 20 medicines with the same treatments:
Name of the medicinal product

The information provided in Name of the medicinal product of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Name of the medicinal product in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Hipersar
Qualitative and quantitative composition

The information provided in Qualitative and quantitative composition of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Qualitative and quantitative composition in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Olmesartan Medoxomil
Therapeutic indications

The information provided in Therapeutic indications of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Therapeutic indications in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Treatment of essential hypertension.
Treatment of hypertension in children and adolescents from 6 to less than 18 years of age.
Dosage (Posology) and method of administration

The information provided in Dosage (Posology) and method of administration of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Dosage (Posology) and method of administration in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Posology
Adults
The recommended starting dose of Hipersar is 10 mg once daily. In patients whose blood pressure is not adequately controlled at this dose, the dose of Hipersar may be increased to 20 mg once daily as the optimal dose. If additional blood pressure reduction is required, Hipersar dose may be increased to a maximum of 40 mg daily or hydrochlorothiazide therapy may be added.
The antihypertensive effect of Hipersar is substantially present within 2 weeks of initiating therapy and is maximal by about 8 weeks after initiating therapy. This should be borne in mind when considering changing the dose regimen for any patient.
Elderly (65 years or older)
No adjustment of dosage is generally required in older people (see below for dose recommendations in patients with renal impairment). If up-titration to the maximum dose of 40mg daily is required, blood pressure should be closely monitored.
Renal impairment
The maximum dose in patients with mild to moderate renal impairment (creatinine clearance of 20 — 60 mL/min) is 20 mg Hipersar once daily, owing to limited experience of higher dosages in this patient group. The use of Hipersar in patients with severe renal impairment (creatinine clearance < 20 mL/min) is not recommended, since there is only limited experience in this patient group.
Hepatic impairment
No adjustment of dosage recommendations is required for patients with mild hepatic impairment. In patients with moderate hepatic impairment, an initial dose of 10 mg Hipersar once daily is recommended and the maximum dose should not exceed 20 mg once daily. Close monitoring of blood pressure and renal function is advised in hepatically-impaired patients who are already receiving diuretics and/or other antihypertensive agents. There is no experience of Hipersar in patients with severe hepatic impairment, therefore use is not recommended in this patient group. Hipersar should not be used in patients with biliary obstruction.
Paediatric population
Children and adolescents from 6 to less than 18 years of age
The recommended starting dose of Hipersar in children from 6 to less than 18 years of age is 10 mg Hipersar once daily. In children whose blood pressure is not adequately controlled at this dose, the dose of Hipersar may be increased to 20 mg once daily. If additional blood pressure reduction is required, in children who weigh > 35 kg, the Hipersar dose may be increased to a maximum of 40 mg. In children who weigh < 35 kg, the daily dose should not exceed 20 mg.
Other paediatric population
The safety and efficacy of Hipersar in children and aged 1 to 5 years old have not yet been established.1 and 5.2 but no recommendation on a posology can be made.
Hipersar should not be used in children below 1 years of age because of safety concerns and lack of data in this age group.
Method of administration:
In order to assist compliance, it is recommended that Hipersar be taken at about the same time each day, with or without food, for example at breakfast time. The tablet should be swallowed with a sufficient amount of fluid (e.g. one glass of water). The tablet should not be chewed.
Contraindications

The information provided in Contraindications of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Contraindications in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Second and third trimesters of pregnancy.
Biliary obstruction.
The concomitant use of Hipersar with aliskiren-containing products is contraindicated in patients with diabetes mellitus or renal impairment (GFR < 60 ml/min/1.73 m2).
Special warnings and precautions for use

The information provided in Special warnings and precautions for use of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Special warnings and precautions for use in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Intravascular volume depletion:
Symptomatic hypotension, especially after the first dose, may occur in patients who are volume and/or sodium depleted by vigorous diuretic therapy, dietary salt restriction, diarrhoea or vomiting. Such conditions should be corrected before the administration of Hipersar.
Other conditions with stimulation of the renin-angiotensin-aldosterone system
In patients whose vascular tone and renal function depend predominantly on the activity of the renin-angiotensinaldosterone system (e.g. patients with severe congestive heart failure or underlying renal disease, including renal artery stenosis), treatment with other drugs that affect this system has been associated with acute hypotension, azotaemia, oliguria or, rarely, acute renal failure. The possibility of similar effects cannot be excluded with angiotensin II receptor antagonists.
Renovascular hypertension:
There is an increased risk of severe hypotension and renal insufficiency when patients with bilateral renal artery stenosis or stenosis of the artery to a single functioning kidney are treated with medicinal products that affect the renin-angiotensinaldosterone system.
Renal impairment and kidney transplantation:
When Hipersar is used in patients with impaired renal function, periodic monitoring of serum potassium and creatinine levels is recommended. Use of Hipersar is not recommended in patients with severe renal impairment (creatinine clearance < 20 mL/min). There is no experience of the administration of Hipersar in patients with a recent kidney transplant or in patients with end-stage renal impairment (ie creatinine clearance <12 mL/min).
Hepatic impairment:
Hyperkalaemia
The use of medicinal products that affect the renin-angiotensin-aldosterone system may cause hyperkalaemia.
The risk, that may be fatal, is increased in older people, in patients with renal insufficiency and in diabetic patients, in patients concomitantly treated with other medicinal products that may increase potassium levels, and/or in patients with intercurrent events.
Before considering the concomitant use of medicinal products that affect the rennin angiotensin — aldosterone system, the benefit risk ratio should be evaluated and other alternatives considered. (see also below section “Dual blockade of the reninangiotensin-aldosterone system (RAAS)â€).
The main risk factors for hyperkalaemia to be considered are:
— Diabetes, renal impairment, age (> 70 years)
— Combination with one or more other medicinal products that affect the renin-angiotensin- aldosterone system and/or potassium supplements. Some medicinal products or therapeutic class of medicinal products may provoke a hyperkalaemia: salt substitutes containing potassium, potassium-sparing diuretics, ACE inhibitors, angiotensin II receptors antagonists, non steroidal anti-inflammatory drugs (including selective COX-2 inhibitors), heparin, immunosuppressor as ciclosporin or tacrolimus, trimethoprim.
— Intercurrent events, in particular dehydration, acute cardiac decompensation, metabolic acidosis, worsening of renal function, sudden worsening of the renal condition (e.g. infectious diseases), cellular lysis (e.g, acute limb ischemia, rhabdomyolysis, extended trauma).
Close-monitoring of serum potassium in at risk patients is recommended.
Dual blockade of the renin-angiotensin-aldosterone system (RAAS):
There is evidence that the concomitant use of ACE-inhibitors, angiotensin II receptor blockers or aliskiren increases the risk of hypotension, hyperkalaemia and decreased renal function (including acute renal failure). Dual blockade of RAAS through the combined use of ACE-inhibitors, angiotensin II receptor blockers or aliskiren is therefore not recommended.
If dual blockade therapy is considered absolutely necessary, this should only occur under specialist supervision and subject to frequent close monitoring of renal function, electrolytes and blood pressure.
ACE-inhibitors and angiotensin II receptor blockers should not be used concomitantly in patients with diabetic nephropathy.
Lithium:
As with other angiotensin-II receptor antagonists, the combination of lithium and Hipersar is not recommended.
Aortic or mitral valve stenosis; obstructive hypertrophic cardiomyopathy:
As with other vasodilators, special caution is indicated in patients suffering from aortic or mitral valve stenosis, or obstructive hypertrophic cardiomyopathy.
Primary aldosteronism:
Patients with primary aldosteronism generally will not respond to antihypertensive drugs acting through inhibition of the renin-angiotensin system. Therefore, the use of Hipersar is not recommended in such patients.
Sprue-like enteropathy:
In very rare cases severe, chronic diarrhoea with substantial weight loss has been reported in patients taking Olmesartan few months to years after drug initiation, possibly caused by a localized delayed hypersensitivity reaction. Intestinal biopsies of patients often demonstrated villous atrophy. If a patient develops these symptoms during treatment with olmesartan, and in the absence of other apparent etiologies, olmesartan treatment should be immediately discontinued and should not be restarted. If diarrhoea does not improve during the week after the discontinuation, further specialist (e.g. a gastro-enterologist) advice should be considered.
Ethnic differences:
As with all other angiotensin II antagonists, the blood pressure lowering effect of Hipersar is somewhat less in black patients than in non-black patients, possibly because of a higher prevalence of low-renin status in the black hypertensive population.
Pregnancy:
Angiotensin II antagonists should not be initiated during pregnancy. Unless continued angiotensin II antagonists therapy is considered essential, patients planning pregnancy should be changed to alternative anti-hypertensive treatments which have an established safety profile for use in pregnancy. When pregnancy is diagnosed, treatment with angiotensin II antagonists should be stopped immediately and, if appropriate, alternative therapy should be started.
Other:
As with any antihypertensive agent, excessive blood pressure decrease in patients with ischaemic heart disease or ischaemic cerebrovascular disease could result in a myocardial infarction or stroke.
This medicinal product contains lactose. Patients with rare hereditary problems of galactose intolerance, the Lapp-lactase deficiency or glucose-galactose malabsorption should not take this medicinal product.
Effects on ability to drive and use machines

The information provided in Effects on ability to drive and use machines of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Effects on ability to drive and use machines in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Hipersar has minor or moderate influence on the ability to drive and use machines. Dizziness or fatigue may occasionally occur in patients taking antihypertensive therapy, which may impair the ability to react.
Undesirable effects

The information provided in Undesirable effects of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Undesirable effects in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Summary of the safety profile:
The most commonly reported adverse reactions during treatment with Hipersar Tablets are headache (7.7%), influenza-like symptoms (4.0%) and dizziness (3.7%).
In placebo-controlled monotherapy studies, the only adverse drug reaction that was unequivocally related to treatment was dizziness (2.5% incidence on Hipersar and 0.9% on placebo).
The incidence was also somewhat higher on Hipersar compared with placebo for hypertriglyceridaemia (2.0% versus 1.1%) and for raised creatine phosphokinase (1.3% versus 0.7%).
Tabulated list of adverse reactions:
Adverse reactions from Hipersar in clinical trials, post-authorisation safety studies and spontaneous reporting are summarized in the below table.
The following terminologies have been used in order to classify the occurrence of adverse reactionsvery common (>1/10); common (>1/100, <1/10); uncommon (>1/1,000, <1/100); rare (>1/10,000, <1/1,000); very rare (<1/10,000).
|
MedDRA System Organ Class |
Adverse reactions |
Frequency |
|
Blood and lymphatic system disorders |
Thrombocytopenia |
Uncommon |
|
Immune system disorders |
Anaphylactic reaction |
Uncommon |
|
Metabolism and nutrition disorders |
Hypertriglyceridaemia |
Common |
|
Hyperuricaemia |
Common |
|
|
Hyperkalaemia |
Rare |
|
|
Nervous system disorders |
Dizziness |
Common |
|
Headache |
Common |
|
|
Ear and labyrinth disorders |
Vertigo |
Uncommon |
|
Cardiac disorders |
Angina pectoris |
Uncommon |
|
Vascular disorders |
Hypotension |
Rare |
|
Respiratory, thoracic and mediastinal disorders |
Bronchitis |
Common |
|
Pharyngitis |
Common |
|
|
Cough |
Common |
|
|
Rhinitis |
Common |
|
|
Gastrointestinal disorders |
Gastroenteritis |
Common |
|
Diarrhoea |
Common |
|
|
Abdominal pain |
Common |
|
|
Nausea |
Common |
|
|
Dyspepsia |
Common |
|
|
Vomiting |
Uncommon |
|
|
Sprue-like enteropathy |
Very rare |
|
|
Skin and subcutaneous tissue disorders |
Exanthema |
Uncommon |
|
Allergic dermatitis |
Uncommon |
|
|
Urticaria |
Uncommon |
|
|
Rash |
Uncommon |
|
|
Pruritus |
Uncommon |
|
|
Angioedema |
Rare |
|
|
Musculoskeletal and connective tissue disorders |
Arthritis |
Common |
|
Back pain |
Common |
|
|
Skeletal pain |
Common |
|
|
Myalgia |
Uncommon |
|
|
Muscle spasm |
Rare |
|
|
Renal and urinary disorders |
Haematuria |
Common |
|
Urinary tract infection |
Common |
|
|
Acute renal failure |
Rare |
|
|
Renal insufficiency |
Rare |
|
|
General disorders and administration site conditions |
Pain |
Common |
|
Chest pain |
Common |
|
|
Peripheral oedema |
Common |
|
|
Influenza-like symptoms |
Common |
|
|
Fatigue |
Common |
|
|
Face oedema |
Uncommon |
|
|
Asthenia |
Uncommon |
|
|
Malaise |
Uncommon |
|
|
Lethargy |
Rare |
|
|
Investigations |
Hepatic enzymes increased |
Common |
|
Blood urea increased |
Common |
|
|
Blood creatine phosphokinase increased |
Common |
|
|
Blood creatinine increased |
Rare |
Single cases of rhabdomyolysis have been reported in temporal association with the intake of angiotensin II receptor blockers.
Additional information on special populations
Paediatric population
The safety of olmesartan was monitored in 361 children and adolescents, aged 1-17 years old during 2 clinical trials. Whilst the nature and severity of the adverse events are similar to that of the adults, the frequency of the following is higher in the children:
— Epistaxis is a common adverse event in children (i.e. > 1/100 to < 1/10) that has not been reported in adults.
— During the 3 weeks of double blind study, the incidence of treatment emergent dizziness and headache nearly doubled in children 6-17 years of age in the high olmesartan dose group.
The overall safety profile for olmesartan in paediatric patients does not differ significantly from the safety profile in adults.
Elderly (age 65 years or over)
In elderly people the frequency of hypotension is slightly increased from rare to uncommon.
Reporting of suspected adverse reactions
Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product.
Healthcare professionals are asked to report any suspected adverse reactions via the national reporting system Yellow Card Scheme Website: www.mhra.gov.uk/yellowcard
Overdose

The information provided in Overdose of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Overdose in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Only limited information is available regarding overdosage in humans. The most likely effect of overdosage is hypotension. In the event of overdosage, the patient should be carefully monitored and treatment should be symptomatic and supportive.
No information is available regarding the dialysability of Olmesartan.
Pharmacodynamic properties

The information provided in Pharmacodynamic properties of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Pharmacodynamic properties in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Pharmacotherapeutic group: Angiotensin II antagonists, ATC code: C09CA08
Mechanism of action / Pharmacodynamic effects
Hipersar is a potent, orally active, selective angiotensin II receptor (type AT1) antagonist. It is expected to block all actions of angiotensin II mediated by the AT1 receptor, regardless of the source or route of synthesis of angiotensin II. The selective antagonism of the angiotensin II (AT1) receptors results in increases in plasma renin levels and angiotensin I and II concentrations, and some decrease in plasma aldosterone concentrations.
Angiotensin II is the primary vasoactive hormone of the renin-angiotensin-aldosterone system and plays a significant role in the pathophysiology of hypertension via the type 1 (AT1) receptor.
Clinical efficacy and safety
In hypertension, Hipersar causes a dose-dependent, long-lasting reduction in arterial blood pressure. There has been no evidence of first-dose hypotension, of tachyphylaxis during long-term treatment, or of rebound hypertension after cessation of therapy.
Once daily dosing with Hipersar provides an effective and smooth reduction in blood pressure over the 24 hour dose interval. Once daily dosing produced similar decreases in blood pressure as twice daily dosing at the same total daily dose.
With continuous treatment, maximum reductions in blood pressure are achieved by 8 weeks after the initiation of therapy, although a substantial proportion of the blood pressure lowering effect is already observed after 2 weeks of treatment. When used together with hydrochlorothiazide, the reduction in blood pressure is additive and co administration is well tolerated.
The effect of Olmesartan on mortality and morbidity is not yet known.
The Randomised Olmesartan and Diabetes Microalbuminuria Prevention (ROADMAP) study in 4447 patients with type 2 diabetes, normo-albuminuria and at least one additional cardiovascular risk factor, investigated whether treatment with olmesartan could delay the onset of microalbuminuria. During the median follow-up duration of 3.2 years, patients received either olmesartan or placebo in addition to other antihypertensive agents, except ACE inhibitors or ARBs.
For the primary endpoint, the study demonstrated a significant risk reduction in the time to onset of microalbuminuria, in favour of olmesartan. After adjustment for BP differences this risk reduction was no longer statistically significant. 8.2% (178 of 2160) of the patients in the olmesartan group and 9.8% (210 of 2139) in the placebo group developed microalbuminuria.
For the secondary endpoints, cardiovascular events occurred in 96 patients (4.3%) with olmesartan and in 94 patients (4.2%) with placebo. The incidence of cardiovascular mortality was higher with olmesartan compared to placebo treatment (15 patients (0.7%) vs. 3 patients (0.1%)), despite similar rates for non-fatal stroke (14 patients (0.6%) vs. 8 patients (0.4%)), non-fatal myocardial infarction (17 patients (0.8%) vs. 26 patients (1.2%)) and non cardiovascular mortality (11 patients (0.5%) vs. 12 patients (0.5%)). Overall mortality with olmesartan was numerically increased (26 patients (1.2%) vs. 15 patients (0.7%)), which was mainly driven by a higher number of fatal cardiovascular events.
The Olmesartan Reducing Incidence of End-stage Renal Disease in Diabetic Nephropathy Trial (ORIENT) investigated the effects of olmesartan on renal and cardiovascular outcomes in 577 randomized Japanese and Chinese type 2 diabetic patients with overt nephropathy. During a median follow-up of 3.1 years, patients received either olmesartan or placebo in addition to other antihypertensive agents including ACE inhibitors.
The primary composite endpoint (time to first event of the doubling of serum creatinine, end-stage renal disease, allcause death) occurred in 116 patients in the olmesartan group (41.1%) and 129 patients in the placebo group (45.4%) (HR 0.97 (95% CI 0.75 to 1.24); p=0.791). The composite secondary cardiovascular endpoint occurred in 40 olmesartan-treated patients (14.2%) and 53 placebo-treated patients (18.7%). This composite cardiovascular endpoint included cardiovascular death in 10 (3.5%) patients receiving olmesartan versus 3 (1.1%) receiving placebo, overall mortality 19 (6.7%) versus 20 (7.0%), non-fatal stroke 8 (2.8%) versus 11 (3.9%) and non-fatal myocardial infarction 3 (1.1%) versus 7 (2.5%), respectively.
Paediatric population
The antihypertensive effects of Hipersar in the paediatric population were evaluated in a randomized, double-blind, placebo-controlled study in 302 hypertensive patients aged 6 to 17 years. The study population consisted of an all black cohort of 112 patients and a mixed racial cohort of 190 patients, including 38 blacks. The aetiology of the hypertension was predominantly essential hypertension (87% of the black cohort and 67% of the mixed cohort). Patients who weighed 20 to <35 kg were randomized to 2.5 mg (low dose) or 20 mg (high dose) of Hipersar once daily and patients who weighed >35 kg were randomized to 5 mg (low dose) or 40 mg (high dose)of Hipersar once daily. Hipersar significantly reduced both systolic and diastolic blood pressure in a weight-adjusted dose-dependent manner. Hipersar at both low and high doses significantly reduced systolic blood pressure by 6.6 and 11.9 mmHg from the baseline, respectively. This effect was also observed during the 2 weeks randomized withdrawal phase, whereby both mean systolic and diastolic blood pressures demonstrated a statistically significant rebound in the placebo group compared to olmesartan group. The treatment was effective in both, paediatric patients with primary and secondary hypertension. As observed in adult populations, the blood pressure reductions were smaller in black patients.
In the same study, 59 patients aged 1 to 5 years who weighed >5 kg received 0.3 mg/kg of Hipersar once daily for three weeks in an open label phase and then were randomized to receiving Hipersar or placebo in a double-blind phase. At the end of the second week of withdrawal, the mean systolic/diastolic blood pressure at trough was 3/3 mmHg lower in the group randomized to Hipersar; this difference in blood pressure was not statistically significant (95% C.I. -2 to 7/-1 to 7).
Other information:
Two large randomised, controlled trials (ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) and VA NEPHRON-D (The Veterans Affairs Nephropathy in Diabetes)) have examined the use of the combination of an ACE-inhibitor with an angiotensin II receptor blocker.
ONTARGET was a study conducted in patients with a history of cardiovascular or cerebrovascular disease, or type 2 diabetes mellitus accompanied by evidence of end-organ damage. VA NEPHRON-D was a study in patients with type 2 diabetes mellitus and diabetic nephropathy.
These studies have shown no significant beneficial effect on renal and/or cardiovascular outcomes and mortality, while an increased risk of hyperkalaemia, acute kidney injury and/or hypotension as compared to monotherapy was observed. Given their similar pharmacodynamic properties, these results are also relevant for other ACE-inhibitors and angiotensin II receptor blockers.
ACE-inhibitors and angiotensin II receptor blockers should therefore not be used concomitantly in patients with diabetic nephropathy.
ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints) was a study designed to test the benefit of adding aliskiren to a standard therapy of an ACE-inhibitor or an angiotensin II receptor blocker in patients with type 2 diabetes mellitus and chronic kidney disease, cardiovascular disease, or both. The study was terminated early because of an increased risk of adverse outcomes. Cardiovascular death and stroke were both numerically more frequent in the aliskiren group than in the placebo group and adverse events and serious adverse events of interest (hyperkalaemia, hypotension and renal dysfunction) were more frequently reported in the aliskiren group than in the placebo group.
Pharmacokinetic properties

The information provided in Pharmacokinetic properties of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Pharmacokinetic properties in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Absorption and distribution
Hipersar is a prodrug. It is rapidly converted to the pharmacologically active metabolite, olmesartan, by esterases in the gut mucosa and in portal blood during absorption from the gastrointestinal tract.
No intact Hipersar or intact side chain medoxomil moiety have been detected in plasma or excreta. The mean absolute bioavailability of Olmesartan from a tablet formulation was 25.6%.
The mean peak plasma concentration (Cmax) of Olmesartan is reached within about 2 hours after oral dosing with Hipersar, and olmesartan plasma concentrations increase approximately linearly with increasing single oral doses up to about 80 mg.
Food had minimal effect on the bioavailability of Olmesartan and therefore Hipersar may be administered with or without food.
No clinically relevant gender-related differences in the pharmacokinetics of Olmesartan have been observed.
Olmesartan is highly bound to plasma protein (99.7%), but the potential for clinically significant protein binding displacement interactions between olmesartan and other highly bound coadministered drugs is low (as confirmed by the lack of a clinically significant interaction between Hipersar and warfarin). The binding of olmesartan to blood cells is negligible. The mean volume of distribution after intravenous dosing is low (16 — 29L).
Biotransformation and elimination
Total plasma clearance was typically 1.3 L/h (CV, 19%) and was relatively slow compared to hepatic blood flow (ca 90 L/h). Following a single oral dose of 14C-labelled Hipersar, 10 — 16% of the administered radioactivity was excreted in the urine (the vast majority within 24 hours of dose administration) and the remainder of the recovered radioactivity was excreted in the faeces. Based on the systemic availability of 25.6%, it can be calculated that absorbed olmesartan is cleared by both renal excretion (ca 40%) and hepato-biliary excretion (ca 60%). All recovered radioactivity was identified as olmesartan. No other significant metabolite was detected. Enterohepatic recycling of olmesartan is minimal. Since a large proportion of olmesartan is excreted via the biliary route, use in patients with biliary obstruction is contraindicated.
The terminal elimination half life of olmesartan varied between 10 and 15 hours after multiple oral dosing. Steady state was reached after the first few doses and no further accumulation was evident after 14 days of repeated dosing. Renal clearance was approximately 0.5 — 0.7 L/h and was independent of dose.
Pharmacokinetics in special populations
Paediatric population:
The pharmacokinetics of olmesartan was studied in paediatric hypertensive patients aged 1 to 16 years. The clearance of olmesartan in paediatric patients was similar to that in adult patients when adjusted by the body weight.
There is no pharmacokinetic information available in renally impaired paediatric subjects.
Elderly (age 65 years or older):
In hypertensive patients, the AUC at steady state was increased by ca 35% in elderly patients (65 — 75 years old) and by ca 44% in very elderly patients (> 75 years old) compared with the younger age group. This may be at least in part related to a mean decrease in renal function in this group of patients.
Renal impairment:
In renally impaired patients, the AUC at steady state increased by 62%, 82% and 179% in patients with mild, moderate and severe renal impairment, respectively, compared to healthy controls.
Hepatic impairment:
After single oral administration, olmesartan AUC values were 6% and 65% higher in mildly and moderately hepatically impaired patients, respectively, than in their corresponding matched healthy controls. The unbound fraction of olmesartan at 2 hours post-dose in healthy subjects, in patients with mild hepatic impairment and in patients with moderate hepatic impairment was 0.26%, 0.34% and 0.41%, respectively. Following repeated dosing in patients with moderate hepatic impairment, olmesartan mean AUC was again about 65% higher than in matched healthy controls. olmesartan mean Cmax values were similar in hepatically-impaired and healthy subjects. Hipersar has not been evaluated in patients with severe hepatic impairment.
Drug interactions
Bile acid sequestering agent colesevelam:
Concomitant administration of 40 mg Hipersar and 3750 mg colesevelam hydrochloride in healthy subjects resulted in 28% reduction in Cmax and 39% reduction in AUC of olmesartan. Lesser effects, 4% and 15% reduction in Cmax and AUC respectively, were observed when Hipersar was administered 4 hours prior to colesevelam hydrochloride. Elimination half life of olmesartan was reduced by 50 — 52% irrespectively of whether administered concomitantly or 4 hours prior to colesevelam hydrochloride.
Pharmacotherapeutic group

The information provided in Pharmacotherapeutic group of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Pharmacotherapeutic group in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Angiotensin II antagonists, ATC code: C09CA08
Preclinical safety data

The information provided in Preclinical safety data of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Preclinical safety data in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
In chronic toxicity studies in rats and dogs, Hipersar showed similar effects to other AT1 receptor antagonists and ACE inhibitors: raised blood urea (BUN) and creatinine (through functional changes to the kidneys caused by blocking AT1 receptors); reduction in heart weight; a reduction of red cell parameters (erythrocytes, haemoglobin, haematocrit); histological indications of renal damage (regenerative lesions of the renal epithelium, thickening of the basal membrane, dilatation of the tubules). These adverse effects caused by the pharmacological action of Hipersar have also occurred in preclinical trials on other AT1 receptor antagonists and ACE inhibitors and can be reduced by simultaneous oral administration of sodium chloride.
In both species, increased plasma renin activity and hypertrophy/hyperplasia of the juxtaglomerular cells of the kidney were observed. These changes, which are a typical effect of the class of ACE inhibitors and other AT1 receptor antagonists, would appear to have no clinical relevance.
Like other AT1 receptor antagonists Hipersar was found to increase the incidence of chromosome breaks in cell cultures in vitro. No relevant effects were observed in several in vivo studies using Hipersar at very high oral doses of up to 2000 mg/kg. The overall data of a comprehensive genotoxicity testing suggest that Olmesartan is very unlikely to exert genotoxic effects under conditions of clinical use.
Hipersar was not carcinogenic, neither in rats in a 2 year study nor in mice when tested in two 6 month carcinogenicity studies using transgenic models.
In reproductive studies in rats, Hipersar did not affect fertility and there was no evidence of a teratogenic effect. In common with other angiotensin II antagonists, survival of offspring was reduced following exposure to Hipersar and pelvic dilatation of the kidney was seen after exposure of the dams in late pregnancy and lactation. In common with other antihypertensive agents, Hipersar was shown to be more toxic to pregnant rabbits than to pregnant rats, however, there was no indication of a fetotoxic effect.
Incompatibilities

The information provided in Incompatibilities of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Incompatibilities in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
Not applicable
Special precautions for disposal and other handling

The information provided in Special precautions for disposal and other handling of Hipersar
is based on data of another medicine with exactly the same composition as the Hipersar.
. Be careful and be sure to specify the information on the section Special precautions for disposal and other handling in the instructions to the drug Hipersar directly from the package or from the pharmacist at the pharmacy.
more…
No special requirements for disposal.
Any unused medicinal product or waste material should be disposed of in accordance with local requirements.
Hipersar price
We have no data on the cost of the drug.
However, we will provide data for each active ingredient
The approximate cost of Olmesartan Medoxomil 40 mg per unit in online pharmacies is from 0.44$ to 1.61$, per package is from 26$ to 105$.
The approximate cost of Olmesartan Medoxomil 10 mg per unit in online pharmacies is from 0.31$ to 1.43$, per package is from 24$ to 114$.
The approximate cost of Olmesartan Medoxomil 20 mg per unit in online pharmacies is from 0.31$ to 1.61$, per package is from 23$ to 85$.
Available in countries
Find in a country:
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.Высокое давлениеГоворящие тонометрыМанжеты для тонометровНагнетатели для тонометровНизкое давлениеТаблеткиТаблеткиТонометры автоматическиеТонометры механическиеТонометры на запястьеТонометры на плечоТонометры полуавтоматЭлектронные тонометры
Содержание статьи
- Механизм действия «Гипосарта»
- От чего помогают таблетки «Гипосарт»?
- Противопоказания к приему «Гипосарта»
- Побочные действия «Гипосарта»
- «Гипосарт» не помогает: чем заменить?
- Что лучше – «Гипосарт» или «Атаканд»?
- Что лучше – «Гипосарт» или «Престариум А»?
- Что лучше – «Гипосарт» или «Телзап»?
- Что лучше – «Гипосарт» или «Ордисс»?
- «Гипосарт» и «Небилет»: совместимость
Артериальная гипертензия является одной из главных проблем, провоцирующих тяжелые сердечно-сосудистые заболевания и критические состояния. Тесная взаимосвязь между гипертонической болезнью и сердечно-сосудистой летальностью заставляет врачей сосредоточивать внимание на постоянном контроле над уровнями давления у пациентов из группы риска. На помощь им приходят специальные антигипертензивные средства, одним из которых является «Гипосарт».
Механизм действия «Гипосарта»
Таблетки от давления «Гипосарт» содержат в своем составе активное вещество — кандесартан. Вспомогательными компонентами служат стеарат магния, гипролоза, макрогол, кукурузный крахмал и лактоза.
Кандесартан относится к селективным антагонистам рецепторов ангиотензина II. Ангиотензин II — это вещество, которое связывается с рецепторами и вызывает спазм сосудов. Таким образом оно повышает давление. «Гипосарт» блокирует рецепторы ангиотензина II, тормозя спазм сосудов и предотвращая повышение давления.
От чего помогают таблетки «Гипосарт»?
Таблетки «Гипосарт» назначают для контроля и лечения артериальной гипертензии. Также препарат помогает при хронической сердечной недостаточности. В этом случае его комбинируют с бета-адреноблокаторами и ингибиторами АПФ.
Вам может быть интересно: Памятка по измерению артериального давления
Противопоказания к приему «Гипосарта»
Прием «Гипосарта» противопоказан при таких состояниях, как:
- Повышенная чувствительность к компонентам препарата
- Беременность и период лактации
- Детский возраст до 18 лет
- Тяжелые нарушения функции печени
Существуют и другие ограничения, а также меры предосторожности к применению «Гипосарта». Обсудите лечение с врачом.
Побочные действия «Гипосарта»
«Гипосарт» часто провоцирует такие побочные эффекты:
- Головокружение и головная боль
- ОРЗ
- Выраженное снижение артериального давления
- Нарушение функции почек
Обычно «Гипосарт» хорошо переносится пациентами.
«Гипосарт» не помогает: чем заменить?
Заменять препарат самостоятельно нельзя. Обратитесь к доктору за переназначением. Врач учтет индивидуальные особенности и потребности, определит реальную динамику лечения и подберет оптимальную терапевтическую схему. Возможно, вы нуждаетесь в больших дозировках лекарства, либо подключении других лекарств для достижения терапевтического эффекта.
Что лучше – «Гипосарт» или «Атаканд»?
«Атаканд» состоит из того же действующего вещества, что и «Гипосарт». Он содержит кандесартан в тех же концентрациях (8 мг, 16 мг и 32 мг). Имеет те же показания и противопоказания. Однако «Гипосарт» почти в 6 раз дешевле, чем «Атаканд». Препараты являются взаимозаменяемыми. Если вам назначили «Атаканд», но стоимость «Гипосарта» для вас предпочтительнее, вы можете заменить препарат. Врач выписывает лекарство по действующему веществу. Пациент сам вправе выбрать препарат от любого производителя.
Что лучше – «Гипосарт» или «Престариум А»?
Активным компонентом «Престариум А» является периндоприл. Он имеет другой механизм действия. Он назначается при артериальной гипертензии (АГ), хронической сердечной недостаточности (ХСН), стабильной ишемической болезни сердца (ИБС). Его также применяют к пациентам, перенесшим ишемический инсульт для профилактики рецидива. «Престариум А» работает иначе, нежели «Гипосарт». Определение целесообразности приема того или иного лекарства определяет врач. Иногда препараты комбинируются для достижения выраженного и стойкого терапевтического эффекта.
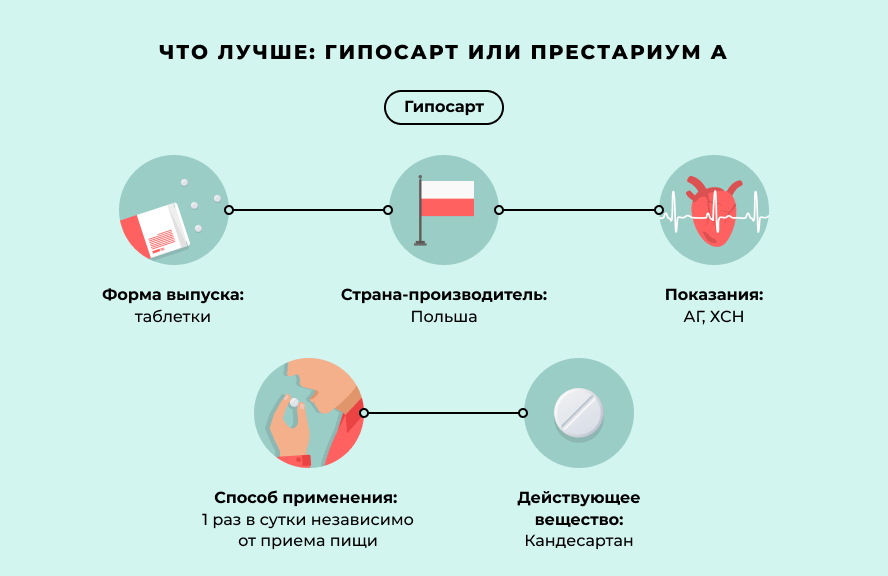
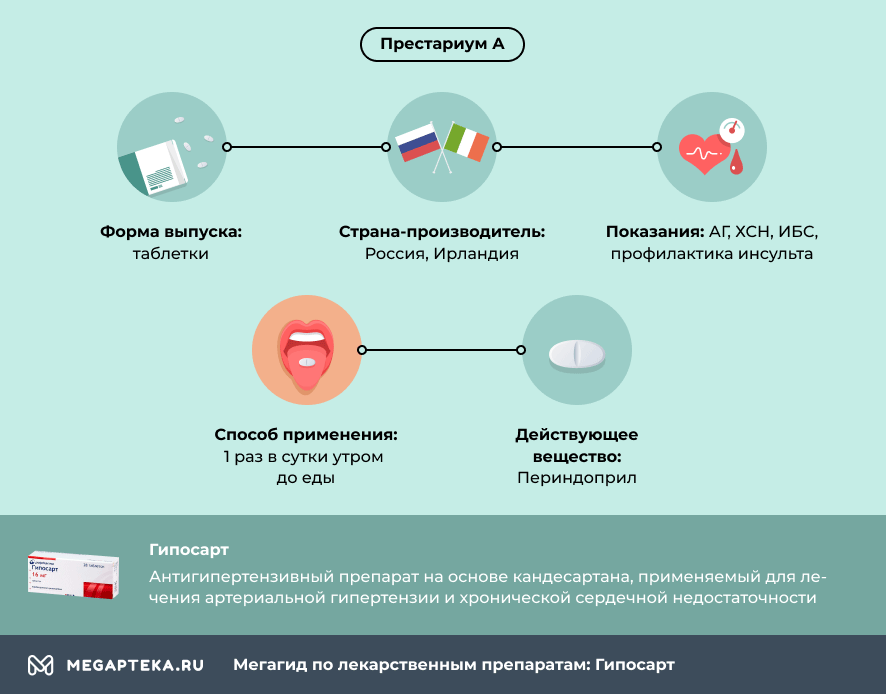
Что лучше – «Гипосарт» или «Телзап»?
В основе «Телзапа» – другое действующее вещество. А именно, телмисартан. Концентрация действующего вещества в таблетках варьируется от 40 мг до 80 мг. Несмотря на сходство показаний и механизма действия, лекарства должны подбираться врачом на основании диагностических показателей, индивидуальных особенностей, эффективности прошлого лечения и других критериев.
Что лучше – «Гипосарт» или «Ордисс»?
«Ордисс» состоит из того же действующего вещества, что и «Гипосарт». Дозировки также вариативны. «Ордисс» производится израильским концерном «ТЕВА». Однако стоимость препаратов практически идентична.
«Гипосарт» и «Небилет»: совместимость
«Небилет» относится к категории бета-адреноблокаторов. Сочетание двух препаратов способно оказать выраженное гипотензивное действие. Указанная комбинация может повышать уровни креатинина и мочевины в крови. Совместное применение лекарств допустимо, но только с назначения врача и при исключении факторов риска.
«Гипосарт» – эффективное антигипертензивное средство, которое может помочь контролировать уровень артериального давления и не допускать его критического повышения. Он имеет меньшее число противопоказаний и ограничений, чем многие другие препараты против повышенного давления, однако принимать его следует только под контролем врача. Будьте благоразумны, берегите здоровье и доверяйте терапию профессионалам.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Описание препарата Гипосарт (таблетки, 16 мг) основано на официальной инструкции, утверждено компанией-производителем в 2021 году
Дата согласования: 26.08.2021
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
Фотографии упаковок

26.08.2021
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки | 1 табл. |
| активное вещество: | |
| кандесартана цилексетил | 8/16/32 мг |
| вспомогательные вещества: лактозы моногидрат — 197,9/87/174 мг; крахмал кукурузный — 40/20/40 мг; гипролоза* — 4/2/4 мг; гипролоза** — 4/2/4 мг; макрогол 6000 — 5,2/2,6/5,2 мг; магния стеарат — 0,8/0,4/0,8 мг; краситель железа оксид красный (Е172) — 0,1/-/- мг | |
| * Вязкость, вода, 25 °C (5%) 75–150 сПз | |
| ** Вязкость, вода, 25 °C (5%) 1500–3000 сПз |
Описание лекарственной формы
Таблетки 8 мг: круглые, двояковыпуклые, с делительной риской с одной стороны и гравировкой «8» с другой стороны, светло-розового цвета.
Таблетки 16 мг: круглые, двояковыпуклые, с делительной риской с одной стороны, белого цвета.
Таблетки 32 мг: круглые, плоские, с фаской с двух сторон, делительной риской с одной стороны и гравировкой «32» с другой стороны, белого цвета.
Фармакологическое действие
Фармакологическое действие
—
блокирующее рецепторы АТII, гипотензивное.
Фармакодинамика
Ангиотензин II — основной фермент ренин-ангиотензин-альдостероновой системы (РААС), принимающий участие в патогенезе артериальной гипертензии, сердечной недостаточности и других сердечно-сосудистых заболеваний.
Кандесартан является селективным антагонистом рецепторов ангиотензина II, подтипа 1 (AT1-рецепторы). Не проявляет свойств агониста (не влияет на ангиотензинпревращающий фермент (АПФ) и не приводит к накоплению брадикинина или субстанции Р, не связывается с рецепторами других гормонов, не влияет на состояние ионных каналов, участвующих в регуляции деятельности сердечно-сосудистой системы. В результате блокирования AT1-рецепторов ангиотензина II происходит компенсаторное дозозависимое повышение активности ренина, концентрации ангиотензина I, ангиотензина II и снижение концентрации альдостерона в плазме крови.
Артериальная гипертензия
Прием кандесартана внутрь обеспечивает дозозависимое, плавное снижение артериального давления (АД) за счет уменьшения общего периферического сосудистого сопротивления (ОПСС) без рефлекторного увеличения частоты сердечных сокращений. Нет данных о развитии выраженной артериальной гипотензии после приема первой дозы или развитии синдрома отмены после прекращения терапии.
Начало антигипертензивного действия после приема первой дозы препарата обычно развивается в течение 2 ч, длительность эффекта — 24 ч. На фоне продолжающейся терапии кандесартаном в фиксированной дозе максимальное снижение АД обычно достигается в течение 4 недель и сохраняется на протяжении всего лечения. Добавление тиазидного диуретика гидрохлоротиазида к кандесартану усиливает его антигипертензивный эффект.
Возраст и пол пациента не влияют на эффективность препарата. Кандесартан увеличивает почечный кровоток и не изменяет или повышает скорость клубочковой фильтрации (СКФ), тогда как почечное сосудистое сопротивление и фильтрационная фракция снижаются.
Кандесартан оказывает менее выраженный антигипертензивный эффект у пациентов негроидной расы (популяция с преимущественно низкой активностью ренина в плазме крови).
Отсутствуют данные о влиянии кандесартана на прогрессирование диабетической нефропатии. У пациентов с артериальной гипертензией и сахарным диабетом типа 2 кандесартан не оказывает негативного влияния на концентрацию глюкозы в крови и липидный профиль.
Сердечная недостаточность
Терапия кандесартаном уменьшает показатель смертности и частоту госпитализации у пациентов с хронической сердечной недостаточностью (ХСН) вне зависимости от возраста, пола и сопутствующей терапии, приводит к уменьшению функционального класса ХСН по классификации NYHA.
Кандесартан эффективен у пациентов, принимающих одновременно бета-адреноблокаторы в сочетании с ингибиторами АПФ, при этом эффективность его не зависит от дозы ингибитора АПФ. У пациентов с ХСН и сниженной систолической функцией левого желудочка (фракция выброса левого желудочка (ФВЛЖ) менее 40%) кандесартан уменьшает ОПСС и давление заклинивания в легочных капиллярах.
Фармакокинетика
Кандесартана цилексетил является пролекарством. Кандесартана цилексетил после приема внутрь быстро превращается в активное вещество — кандесартан, посредством эфирного гидролиза. При всасывании из пищеварительного тракта прочно связывается с AT1-рецепторами и медленно диссоциирует, не имеет свойств агониста.
Всасывание и распределение. Абсолютная биодоступность кандесартана составляет примерно 40% после приема внутрь. Относительная биодоступность составляет примерно 34%. Максимальная концентрация (Cmax) в сыворотке крови достигается через 3–4 ч после приема внутрь. Концентрация в плазме крови возрастает линейно при увеличении дозы в терапевтическом интервале (до 32 мг). Связь с белками плазмы крови высокая (более 99%). Объем распределения кандесартана составляет 0,13 л/кг. Фармакокинетические параметры кандесартана не зависят от возраста, пола пациента и времени приема пищи.
Метаболизм и выведение. Кандесартан в основном выводится из организма почками и через кишечник в неизмененном виде. Незначительно метаболизируется в печени (20–30%) при участии изофермента CYP2C9 с образованием неактивного производного. Период полувыведения (T1/2) кандесартана составляет примерно 9 ч. Не кумулирует. Общий клиренс — около 0,37 мл/мин/кг, при этом почечный клиренс препарата — 0,19 мл/мин/кг. После приема внутрь 14С-меченного кандесартана цилексетила 26% дозы выводилось почками в форме кандесартана и 7% — в форме неактивного метаболита, в то же время 56% дозы выводится через кишечник с желчью в форме кандесартана и 10% — в форме неактивного метаболита. После однократного приема внутрь в течение 72 ч выводится более 90% дозы.
Особые группы пациентов
Пожилой возраст. У пожилых пациентов (старше 65 лет) Cmax и площадь под кривой «концентрация-время» (AUC) кандесартана увеличиваются по сравнению с пациентами молодого возраста примерно на 50 и 80% соответственно. Однако реакция со стороны АД и возможные побочные эффекты при применении кандесартана не зависят от возраста пациентов.
Нарушение функции почек. У пациентов с легким или умеренным нарушением функции почек Cmax и AUC кандесартана увеличиваются примерно на 50 и 70% соответственно, при этом T1/2 не изменяется по сравнению с пациентами с сохранной функцией почек. Фармакокинетика у пациентов, находящихся на гемодиализе, аналогична таковой у пациентов с тяжелыми нарушениями функции почек. У пациентов с тяжелыми нарушениями функции почек Cmax и AUC увеличиваются на 50 и 110% соответственно, а T1/2 препарата увеличивается в 2 раза.
Нарушение функции печени. У пациентов с легкой или умеренной степенью печеночной недостаточности среднее значение AUC кандесартана увеличивалось примерно на 20% в одном исследовании и 80% — в другом исследовании. Нет опыта применения у пациентов с тяжелыми нарушениями функции печени.
Показания
- артериальная гипертензия;
- хроническая сердечная недостаточность и нарушение систолической функции левого желудочка (ФВЛЖ ≤40%) в качестве дополнительной терапии к ингибиторам АПФ или при их непереносимости.
Противопоказания
- повышенная чувствительность к кандесартану или другим компонентам препарата;
- непереносимость лактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции;
- тяжелые нарушения функции печени и/или холестаз;
- одновременное применение с алискиреном и алискиренсодержащими препаратами, у пациентов с сахарным диабетом и/или умеренными или тяжелыми нарушениями функции почек (СКФ <60 мл/мин/1,73 м2);
- одновременное применение с ингибиторами АПФ у пациентов с диабетической нефропатией;
- беременность;
- период грудного вскармливания;
- детский и подростковый возраст до 18 лет (эффективность и безопасность не установлены).
С осторожностью: тяжелые нарушения функции почек (клиренс креатинина <30 мл/мин); гемодиализ; двусторонний стеноз почечных артерий или стеноз артерии единственной почки; гемодинамически значимый стеноз аортального и/или митрального клапана; гипертрофическая обструктивная кардиомиопатия; состояние после трансплантации почки; цереброваскулярные нарушения ишемического генеза и ишемическая болезнь сердца; гиперкалиемия у пациентов со сниженным объемом циркулирующей крови (ОЦК); проведение общей анестезии и хирургических вмешательств (риск развития артериальной гипотензии вследствие блокады РААС); первичный гиперальдостеронизм.
Применение при беременности и кормлении грудью
Препарат Гипосарт противопоказан к применению во время беременности, т.к. он оказывает прямое воздействие на РААС и может вызывать нарушения развития плода (в особенности во II и III триместрах беременности) или оказывать негативное влияние на новорожденного, вплоть до летального исхода, если препарат применялся во время беременности.
Известно, что терапия антагонистами рецепторов ангиотензина II (АРА II) может вызывать нарушения развития плода (нарушение функции почек, олигогидрамнион, замедление оссификации костей черепа) и развитие осложнений у новорожденного (почечная недостаточность, артериальная гипотензия, гиперкалиемия). При установлении факта беременности препарат Гипосарт необходимо отменить как можно быстрее.
При планировании беременности необходимо перевести пациентку на адекватную альтернативную терапию.
Неизвестно, проникает ли кандесартан в грудное молоко, но известно, что он проникает в молоко лактирующих крыс. Во время лечения препаратом Гипосарт грудное вскармливание необходимо прекратить.
Новорожденные, матери которых принимали во время беременности Гипосарт, должны находиться под тщательным медицинским наблюдением из-за вероятности развития артериальной гипотензии.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Внутрь, вне зависимости от времени приема пищи, 1 раз в сутки.
Артериальная гипертензия
Рекомендуемая начальная и поддерживающая доза препарата Гипосарт составляет 8 мг/сут. При необходимости дозу можно увеличить до 16 мг/сут. Максимальный антигипертензивный эффект достигается в течение 4 недель терапии. Максимальная суточная доза — 32 мг.
Если на фоне максимальной суточной дозы не достигается адекватный контроль АД, рекомендуется добавить к терапии тиазидный диуретик.
Пациенты со сниженным ОЦК. У пациентов с риском развития артериальной гипотензии терапию рекомендуется начинать с начальной дозы 4 мг.
Пациенты с нарушением функции почек. У пациентов с легким или умеренным нарушением функции почек (клиренс креатинина 30–80 мл/мин/1,73 м2), включая пациентов, находящихся на гемодиализе, начальная доза препарата составляет 4 мг. Дозу следует титровать в зависимости от терапевтического эффекта. Клинический опыт применения препарата у пациентов с тяжелыми нарушениями функции почек или терминальной стадией почечной недостаточности (клиренс креатинина <15 мл/мин) ограничен (см. «Особые указания»).
Пациенты с нарушением функции печени. Начальная суточная доза препарата у пациентов с заболеваниями печени легкой и средней степени тяжести составляет 4 мг. Возможно увеличение дозы при необходимости. Клинический опыт применения препарата у пациентов с тяжелыми нарушениями функции печени и/или холестазом отсутствует (см. «Противопоказания»).
Сопутствующая терапия. Применение препарата Гипосарт одновременно с тиазидными диуретиками (например, гидрохлоротиазид) может усилить антигипертензивный эффект препарата.
ХСН
Рекомендуемая начальная доза препарата Гипосарт составляет 4 мг/сут. Увеличение до максимальной суточной дозы 32 мг или максимально переносимой дозы проводится путем удвоения дозы с интервалом не менее 2 недель.
Пациенты пожилого возраста, пациенты с нарушением функции почек или печени. Пациентам пожилого возраста и пациентам с нарушениями функции почек или печени не требуется коррекции начальной дозы препарата.
Дети и подростки. Безопасность и эффективность применения препарата Гипосарт у детей и подростков в возрасте до 18 лет не установлены.
Сопутствующая терапия. Препарат Гипосарт можно одновременно применять с другими препаратами для лечения ХСН, включая ингибиторы АПФ, бета-адреноблокаторы, диуретики, сердечные гликозиды или комбинации этих лекарственных средств.
Побочные действия
Артериальная гипертензия
Побочные эффекты в ходе клинических исследований носили умеренный и преходящий характер и были сопоставимы по частоте с группой плацебо. Общая частота возникновения неблагоприятных реакций на фоне приема кандесартана не зависела от дозы препарата и возраста пациента. Частота случаев прекращения терапии в связи с побочными эффектами была сходной при использовании кандесартана (3,1%) и плацебо (3,2%).
В ходе объединенного анализа данных проведенных исследований сообщалось о следующих побочных эффектах, часто (>1/100) встречавшихся на фоне приема кандесартана. Описанные неблагоприятные реакции наблюдались с частотой хотя бы на 1% больше, чем в группе плацебо. По этому определению наиболее часто отмечали головокружение/вертиго, слабость, головную боль и респираторные инфекции.
В таблице ниже представлены побочные эффекты, отмеченные в клинических исследованиях и при постмаркетинговом применении. Частота возникновения побочных реакций в таблицах раздела представлена в следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000).
| Класс системы органов | Частота | Нежелательная реакция |
| Инфекционные и паразитарные заболевания | Часто | Респираторные инфекции |
| Нарушения со стороны крови и лимфатической системы | Очень редко | Лейкопения, нейтропения и агранулоцитоз |
| Нарушения со стороны обмена веществ и питания | Очень редко | Гиперкалиемия, гипонатриемия |
| Нарушения со стороны нервной системы | Часто | Головокружение/вертиго, головная боль |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Очень редко | Кашель |
| Нарушения со стороны желудочно-кишечного тракта | Очень редко | Тошнота |
| Неизвестно | Диарея | |
| Нарушения со стороны печени и желчевыводящих путей | Очень редко | Повышение активности печеночных ферментов, нарушение функции печени или гепатит |
| Нарушения со стороны кожи и подкожных тканей | Очень редко | Ангионевротический отек, кожная сыпь, крапивница, кожный зуд |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | Часто | Боль в спине |
| Очень редко | Артралгия, миалгия | |
| Нарушения со стороны почек и мочевыводящих путей | Очень редко | Нарушение функции почек, включая почечную недостаточность у предрасположенных пациентов (см. «Особые указания») |
| Общие расстройства и нарушения в месте введения | Часто | Слабость |
Лабораторные показатели. В целом при применении кандесартана не было отмечено клинически значимых изменений стандартных лабораторных показателей. Как и при применении других средств, влияющих или действующих на РААС, может наблюдаться небольшое снижение уровня гемоглобина. Наблюдалось увеличение концентрации креатинина и мочевины, содержания калия и уменьшение содержания натрия. Повышение активности аланинаминотрансферазы было отмечено несколько чаще при применении кандесартана в сравнении с плацебо (1,3 против 0,5%). При применении кандесартана обычно не требуется регулярного контроля лабораторных показателей. Однако у пациентов с нарушением функции почек рекомендуется периодически контролировать содержание калия и креатинина в сыворотке крови.
ХСН
Побочные реакции, выявленные на фоне применения кандесартана у пациентов с сердечной недостаточностью, соответствовали фармакологическим свойствам препарата и зависели от состояния пациента. В ходе клинических исследований CHARM проводилось сравнение кандесартана в дозах до 32 мг (n=3,803) с плацебо (n=3,796), 21% пациентов из группы, получавшей кандесартан, и 16,1% пациентов из группы, получавшей плацебо, прекратили лечение из-за возникновения побочных реакций. Наиболее часто встречавшимися побочными эффектами были гиперкалиемия, выраженное снижение АД и нарушение функции почек. Эти явления были более частыми у пациентов старше 70 лет, у пациентов с сахарным диабетом или у пациентов, получающих другие препараты, влияющие на РААС, в частности ингибиторы АПФ и/или спиронолактон.
В таблице ниже представлены побочные эффекты, отмеченные в клинических исследованиях и при постмаркетинговом применении.
| Класс системы органов | Частота | Нежелательный эффект |
| Нарушения со стороны крови и лимфатической системы | Очень редко | Лейкопения, нейтропения и агранулоцитоз |
| Нарушения со стороны обмена веществ и питания | Часто | Гиперкалиемия |
| Очень редко | Гипонатриемия | |
| Нарушения со стороны нервной системы | Очень редко | Головокружение, головная боль |
| Нарушения со стороны сосудов | Часто | Выраженное снижение АД |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Очень редко | Кашель |
| Нарушения со стороны желудочно-кишечного тракта | Очень редко | Тошнота |
| Неизвестно | Диарея | |
| Нарушения со стороны печени и желчевыводящих путей | Очень редко | Повышение активности печеночных ферментов, нарушение функции печени или гепатит |
| Нарушения со стороны кожи и подкожных тканей | Очень редко | Ангионевротический отек, кожная сыпь, крапивница, кожный зуд |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | Очень редко | Боль в спине, артралгия, миалгия |
| Нарушения со стороны почек и мочевыводящих путей | Часто | Нарушение функции почек, включая почечную недостаточность у пациентов с предрасположенностью (см. «Особые указания») |
| Общие расстройства и нарушения в месте введения | Очень редко | Слабость |
Лабораторные показатели. Наблюдалось повышение концентрации креатинина и мочевины, содержания калия. Рекомендуется контролировать концентрацию креатинина и содержание калия в сыворотке крови.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Применение кандесартана одновременно с препаратами, содержащими алискирен, противопоказано у пациентов с сахарным диабетом и/или умеренной или тяжелой почечной недостаточностью (СКФ <60 мл/мин/1,732) и не рекомендуется у других пациентов (см. «Противопоказания»).
Изучено одновременное применение кандесартана с гидрохлоротиазидом, варфарином, дигоксином, пероральными контрацептивами (этинилэстрадиол/левоноргестрел), глибенкламидом, нифедипином и эналаприлом. Клинически значимого фармакокинетического взаимодействия не отмечено.
Кандесартан в незначительной степени метаболизируется в печени (с помощью изофермента CYP2C9). Не выявлено влияния на изоферменты CYP2C9 и CYP3A4; эффект в отношении других изоферментов цитохрома Р450 в настоящее время неизвестен.
Гипотензивные средства потенцируют антигипертензивный эффект кандесартана. Опыт применения других лекарственных средств, действующих на РААС, показывает, что одновременное применение препарата и калийсберегающих диуретиков (спиронолактон, эплеренон, триамтерен, амилорид), препаратов калия, заменителей соли, содержащих калий, или других средств, способных повышать содержание калия в сыворотке крови (в т.ч. гепарин), может привести к развитию гиперкалиемии.
При одновременном применении препаратов лития и ингибиторов АПФ были отмечены случаи транзиторного повышения концентрации лития в сыворотке крови и развития токсических эффектов. Аналогичный эффект возможен при одновременном применении препаратов лития и АРА II, что требует периодического контроля концентрации лития в сыворотке крови при комбинированном применении этих препаратов.
При одновременном применении АРА II и нестероидных противовоспалительных препаратов (НПВП), включая селективные ингибиторы ЦОГ-2 и неселективные НПВП (в т.ч. ацетилсалициловая кислота более 3 г/сут) может уменьшаться антигипертензивное действие кандесартана.
Как и в случае с ингибиторами АПФ, одновременное применение АРА II и НПВП повышает риск снижения функции почек, вплоть до развития почечной недостаточности, что приводит к гиперкалиемии у пациентов с нарушением функции почек. Эта комбинация должна применяться с осторожностью, особенно у пациентов пожилого возраста. Все пациенты должны получать достаточное количество жидкости. Необходимо контролировать функцию почек в начале терапии и в дальнейшем.
Двойная блокада РААС
Одновременное применение АРА II с ингибиторами АПФ противопоказано у пациентов с диабетической нефропатией и не рекомендуется у других пациентов.
Передозировка
Симптомы: выраженное снижение АД, головокружение, тахикардия. Описаны отдельные случаи передозировки препарата (до 672 мг кандесартана цилексетила), закончившиеся выздоровлением пациентов без тяжелых последствий.
Лечение: при выраженном снижении АД перевести пациента в положение лежа на спине, ноги приподнять; далее следует провести мероприятия, направленные на увеличение ОЦК (введение 0,9% раствора натрия хлорида внутривенно). В случае необходимости могут быть назначены симпатомиметические препараты. Проведение симптоматической терапии. Гемодиализ неэффективен.
Особые указания
Этнические особенности. Антигипертензивный эффект кандесартана у пациентов негроидной расы менее выражен по сравнению с пациентами других рас, в связи с чем чаще требуется увеличение дозы препарата Гипосарт, а также сочетание с другими гипотензивными препаратами.
Нарушение функции почек. Опыт применения препарата у пациентов с тяжелой почечной недостаточностью или находящихся в терминальной стадии почечной недостаточности (клиренс креатинина <15 мл/мин) ограничен. У таких пациентов необходим строгий подбор дозы препарата Гипосарт под тщательным контролем АД. У пациентов с ХСН, особенно старше 75 лет, и пациентов с нарушениями функции почек необходимо периодически контролировать функцию почек. В период подбора дозы препарата Гипосарт рекомендуется контролировать концентрацию креатинина и калия в сыворотке крови.
Комбинированная терапия с ингибитором АПФ при ХСН. При применении препарата Гипосарт в комбинации с ингибитором АПФ может возрастать риск развития побочных эффектов — нарушение функции почек и гиперкалиемия. В этих случаях необходимо тщательное наблюдение и контроль соответствующих лабораторных показателей.
Гемодиализ. Во время проведения гемодиализа АД может быть особенно чувствительно к блокаде AT1-рецепторов в результате уменьшения ОЦК и активации РААС. Поэтому пациентам, находящимся на гемодиализе, необходим контроль АД и индивидуальный подбор дозы препарата Гипосарт.
Стеноз почечной артерии. Препараты, оказывающие влияние на РААС, в т.ч. ингибиторы АПФ, могут вызывать гиперурикемию и гиперкреатининемию у пациентов с двусторонним стенозом почечных артерий или стенозом артерии единственной почки. Аналогичный эффект может развиться при применении АРА II.
Трансплантация почки. Опыт применения препарата у пациентов, недавно перенесших трансплантацию почки, отсутствует.
Артериальная гипотензия. У пациентов с ХСН, получающих препарат Гипосарт, может развиться артериальная гипотензия. Также возможно развитие артериальной гипотензии у пациентов со сниженным ОЦК, например получающих большие дозы диуретиков. В начале терапии необходимо соблюдать осторожность и при необходимости компенсировать ОЦК.
Общая анестезия/хирургические вмешательства. При проведении хирургических вмешательств под общей анестезией у пациентов, принимающих АРА II, может развиться артериальная гипотензия вследствие блокады РААС. Очень редко артериальная гипотензия может быть выраженной и потребовать внутривенного введения жидкости и/или вазопрессоров.
Стеноз аортального и/или митрального клапанов, ГОКМП. Препарат Гипосарт необходимо с осторожностью применять у пациентов с гемодинамически значимым стенозом аортального и/или митрального клапанов или ГОКМП.
Первичный гиперальдостеронизм. Пациенты с первичным гиперальдостеронизмом резистентны к гипотензивным препаратам, влияющим на РААС, поэтому у таких пациентов применение препарата Гипосарт не рекомендуется.
Гиперкалиемия. Одновременное применение препарата Гипосарт и калийсберегающих диуретиков, препаратов калия, заменителей соли, содержащих калий, или других средств, способных повышать содержание калия в сыворотке (в т.ч. гепарин), может привести к развитию гиперкалиемии у пациентов с артериальной гипертензией. Гиперкалиемия может развиться и у пациентов с ХСН, принимающих Гипосарт. На фоне терапии препаратом Гипосарт у пациентов с ХСН рекомендуется проводить периодический контроль содержания калия в сыворотке крови, особенно при одновременном применении ингибиторов АПФ и калийсберегающих диуретиков (спиронолактон, эплеренон, триамтерен, амилорид).
Общие. Пациенты, у которых сосудистый тонус и функция почек преимущественно зависят от активности РААС (например, пациенты с тяжелой декомпенсированной ХСН или сопутствующим заболеванием почек, в т.ч. односторонний стеноз почечной артерии), терапия другими препаратами, влияющими на РААС, может сопровождаться развитием артериальной гипотензии, азотемией, олигурией и реже — острой почечной недостаточностью. Это нельзя исключить и для АРА II. Чрезмерное снижение АД у пациентов с ИБС или цереброваскулярными заболеваниями ишемического генеза может привести к развитию инфаркта миокарда или инсульта.
Двойная блокада РААС при применении препаратов, содержащих алискирен. Не рекомендуется двойная блокада РААС путем одновременного применения кандесартана и алискирена ввиду увеличения риска развития артериальной гипотензии, гиперкалиемии и нарушения функции почек. Одновременное применение АРА II с препаратами, содержащими алискирен, противопоказано у пациентов с сахарным диабетом и/или умеренной или тяжелой почечной недостаточностью (СКФ <60 мл/мин/1,73 м2) и не рекомендуется у других пациентов (см. «Противопоказания»).
Одновременное применение АРА II с ингибиторами АПФ противопоказано у пациентов с диабетической нефропатией и не рекомендуется у других пациентов.
Влияние на способность управлять автотранспортом и работать со сложными механизмами. Влияние препарата Гипосарт на управление автотранспортом и работу со сложными механизмами не изучалось, но фармакодинамические свойства препарата указывают на то, что подобное влияние отсутствует. Необходимо соблюдать осторожность при управлении автотранспортом и занятиях потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, в связи с риском развития головокружения.
Форма выпуска
Таблетки 8 мг, 16 мг, 32 мг. По 14 таблеток в блистере из фольги A1/PVC/PVDC. 1, 2 или 4 блистера вместе с инструкцией по медицинскому применению помещают в картонную пачку.
Производитель
Фармацевтический завод «ПОЛЬФАРМА» АО, Польша, ул. Пельплиньска 19, 83-200 Старогард Гданьски, Польша.
Организация, принимающая претензии потребителей: Акционерное общество «Химико-фармацевтический комбинат «АКРИХИН» (АО «АКРИХИН»), Россия 142450, Московская область, Ногинский район, г. Старая Купавна, ул. Кирова, 29.
Тел.: (495) 702-95-03.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.


от
366 руб.
Стоимость без учета доставки в РФ
Артикул:
8699832090185
Доступность:
Под заказ
Количество:
+
−
В один клик
Описание
HIPERSAR PLUS 20/25 MG FILM KAPLI TABLET (28 TABLET) (баркод – 8699832090185) из Турции.
Есть вопрос? Задайте его любым удобным способом на странице контактов.
Характеристики
Где применяется:
Сердечно-сосудистая система
Действующее вещество:
olmesartan medoksomil + hidroklorotiazid
Производитель:
MENARİNİ İLAÇ SANAYİ VE TİCARET A.Ş.

