
05.06.2023

05.06.2023

05.06.2023
Описание препарата ХОНДРОГАРД® (раствор для внутримышечного и внутрисуставного введения, 100 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2023 году
Дата согласования: 05.06.2023
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для внутримышечного и внутрисуставного введения | 1 амп./1 шприц |
| действующее вещество: | |
| хондроитина сульфат натрия | 100/200 мг |
| вспомогательные вещества, наличие которых надо учитывать: натрия метабисульфит — 1 мг/мл | |
| вспомогательные вещества: бензиловый спирт; натрия метабисульфит; натрия гидроксид; вода для инъекций |
Описание лекарственной формы
Раствор: прозрачный бесцветный или со слегка желтоватым оттенком, с запахом бензилового спирта.
Фармакологическое действие
Фармакологическое действие
—
регенерирующее, хондростимулирующее.
Фармакодинамика
Механизм действия и фармакодинамические эффекты
Высокомолекулярный мукополисахарид, влияющий на обменные процессы в гиалиновом хряще. Уменьшает дегенеративные изменения в хрящевой ткани суставов, ускоряет процессы ее восстановления, стимулирует синтез протеогликанов.
При лечении препаратом уменьшается болезненность и улучшается подвижность пораженных суставов. При лечении дегенеративных изменений суставов с развитием вторичного синовита положительный эффект может наблюдаться уже через 2–3 нед после начала введения препарата: уменьшается боль в суставах, исчезают клинические проявления реактивного синовита, увеличивается объем движений в пораженных суставах. Терапевтический эффект сохраняется длительное время после окончания курса лечения.
Клинические данные по эффективности и безопасности
Безопасность и эффективность препарата ХОНДРОГАРД® была оценена в открытом многоцентровом рандомизированном клиническом исследовании у пациентов с закрытым переломом лучевой кисти. В исследование было включено 200 пациентов обоего пола с установленным диагнозом — закрытым переломом лучевой кости. Средний возраст пациентов составил (43,5±13,0) лет (от 20 до 72 лет). Средняя масса тела составила (70,9±11,8) кг (от 45 до 101 кг), а средний рост пациентов — (169,0±9,35) см (от 150 до 198 см). Пациенты были рандомизированы в основную группу, получающую терапию препаратом ХОНДРОГАРД®, и контрольную группу со стандартной базовой терапией.
Терапия в обеих группах проводилась в течение 4 нед, пациент получал стандартную базовую терапию или инъекции препарата ХОНДРОГАРД®. Препарат назначали по 100 мг через 1 день в/м, начиная с 4-й инъекции (7-й день исследования) вплоть до завершения исследования — 200 мг через день в/м. В рамках исследования было проведено 14 инъекций препарата ХОНДРОГАРД®.
Основным критерием эффективности терапии являлась оценка частоты формирования костной мозоли. Дополнительным критерием эффективности был показатель скорости формирования костной мозоли. По показателю частоты формирования фиброзно-хрящевой мозоли на визите 1 ни у одного пациента в исследуемой и контрольной группе не произошло формирования данной структуры; на визите 2 она образовалась у 92% пациентов в исследуемой группе (в контрольной группе — 69%); к визиту 3 этот процент составил 95% (в контрольной группе — 90%), а к визиту 4 — 100% в обеих группах. Разница между визитами 3 и 2 по показателю частоты формирования фиброзно-хрящевой мозоли в исследуемой группе составила 3% (в контрольной группе — 21%), а между визитами 4 и 3 — 5% (в контрольной группе — 10%). Таким образом, после проведенного анализа выявлены статистически значимые различия между исследуемой и контрольной группами по показателю частоты и скорости формирования фиброзно-хрящевой мозоли.
На визите 1 и 2 у всех пациентов в обеих группах минерализации фиброзно-хрящевой мозоли не наблюдалось, на визите 3 этот процесс начался у 68% пациентов исследуемой группы (в контрольной группе — 61%), к визиту 3 этот процент составил 94% (в контрольной группе — 85%). Разница между визитами 4 и 3 по показателю частоты начала минерализации фиброзно-хрящевой мозоли в исследуемой группе составила 26% (контрольной группе — 24%). Таким образом, после проведенного анализа установлены значимые различия между исследуемой и контрольной группой по показателю частоты и скорости минерализации фиброзно-хрящевой мозоли.
Показатель скорости формирования мозоли в исследуемой группе у 92% пациентов составил 14 дней, у 3% — 21 день и у 5% — 8 дней. В контрольной группе данный показатель составил у 69% пациентов — 14 дней, у 21% — 21 день и у 10% — 28 дней. Время начала минерализации (скорость минерализации) фиброзно-хрящевой мозоли в исследуемой группе у 68% пациентов составила 21 день, у 26% — 28 дней (в контрольной группе у 61% пациентов — 21 день, у 24% — 28 дней). Таким образом, проведенный анализ может свидетельствовать об эффективности исследуемого препарата при лечении пациентов с закрытыми переломами лучевой кости.
Клинически значимых отклонений лабораторных показателей крови не было выявлено. За весь период исследования у 12 пациентов были отмечены нежелательные явления (по 6 в каждой группе): головная боль, головокружение, носовое кровотечение, боль в месте инъекции, тошнота, общая слабость, метеоризм. Связь всех нежелательных явлений с приемом препарата была расценена врачами-исследователями как маловероятная. В контрольной группе кроме этого у 3% пациентов наблюдалось вторичное смещение отломков. В ходе проведения данного клинического исследования серьезных нежелательных явлений не наблюдалось.
Было проведено клиническое исследование безопасности и переносимости препарата у пациентов с остеоартрозом коленного сустава при однократном в/с и в/м введении.
В исследование было включено 20 пациентов мужского и женского пола в возрасте от 18 до 75 лет с верифицированным диагнозом «остеоартроз коленного сустава» (гонартроз). Средний возраст пациентов составил 56,7 лет (возрастной диапазон 49–69 лет), средний рост — 163,30 см (рост варьировал от 156 до 173 см), средняя масса тела — 86,95 кг (масса тела пациентов варьировалась в диапазоне 50–115 кг). Общая продолжительность исследования для пациента составила от 12 до 19 дней.
После в/с введения препарата ни в одном из случаев не выявлено наличие визуализируемого количества жидкости по УЗИ. В результате анализа показателей безопасности при в/м и в/с введении было обнаружено значимое взаимодействие факторов при сравнении групп по следующим показателям: ПВ, креатинин, уровень лимфоцитов, уровень тромбоцитов.
Все зарегистрированные изменения значений лабораторных показателей укладывались в границы клинической нормы, т.е. отрицательной динамики обнаружено не было, и выявленные различия не имеют клинического значения.
Таким образом, в/с введение в сравнении с разрешенным в/м введением не оказывало значимого влияния на показатели безопасности. Препарат характеризовался хорошей переносимостью и высоким уровнем безопасности. На основании значений параметров биодоступности (в/с введение относительно в/м введения) сделано заключение о том, что при в/с введении наблюдается удерживание хондроитина сульфата в тканях сустава и его постепенный выход в системный кровоток.
Фармакокинетика
Абсорбция. После в/м введения Cmax препарата в плазме достигается через 1 ч, затем постепенно снижается в течение 2 сут.
При однократном в/с введении в дозе 200 мг Cmax хондроитина сульфата в плазме наблюдается через 1–2 ч и составляет 52,5–86,9 нг/мл.
Распределение. После в/м введения хондроитина сульфат быстро распределяется. Уже через 30 мин после инъекции он обнаруживается в крови в значительных концентрациях.
Хондроитина сульфат накапливается главным образом в хрящевой ткани суставов.
Синовиальная оболочка не является препятствием для проникновения препарата в полость сустава. В экспериментах показано, что через 15 мин после в/м инъекции хондроитина сульфат обнаруживается в синовиальной жидкости, затем проникает в суставной хрящ, где его Cmax достигается через 48 ч.
При в/с введении наблюдается удерживание хондроитина сульфата в тканях сустава и его постепенный выход в кровоток.
Элиминация. T1/2 при в/с введении составляет 2,5 ч.
Данные доклинической безопасности
Острая и субхроническая токсичность. Острая токсичность хондроитина сульфата исследовалась на мышах и крысах при различных способах введения препарата.
Мыши были разделены на две группы: первая группа получала препарат ХОНДРОГАРД®, вторая — препарат сравнения. Препараты вводили в хвостовую вену в различных объемах, от 0,15 до 0,8 мл, скорость введения составляла 0,1 мл/с. Оба препарата вводились в дозах 2000, 2500, 3000, 3500, 4000 мг/кг в пересчете на 20 г массы соответственно, дозы составляли 40, 50, 60, 70 и 80 мг/мышь.
Величина средней смертельной дозы (ЛД50) препарата ХОНДРОГАРД® у мышей при в/в введении составила 62,4 (58,5–66,6) мг/мышь или 3120 (2925–3330) мг/кг и статистически не отличалась от аналогичного показателя для препарата сравнения.
Значение этого показателя позволило отнести исследуемый препарат к VI классу — «Относительно безвредные вещества».
Исследование острой токсичности на крысах. В острых опытах было показано, что белые крысы обоего пола переносят в/м введение сравниваемых препаратов в дозе 500 и 1000 мг/кг без каких-либо признаков интоксикации, за исключением некоторой реакции болезненности на инъекцию. В течение всего срока наблюдения не было зарегистрировано гибели подопытных животных или появления у них признаков интоксикации. Они сохраняли нормальный внешний вид, не имели изменений в шерстном покрове, характере выделений, поведенческих реакциях, динамике прироста массы тела.
В/в введение препарата в указанных дозах вызывало у животных признаки интоксикации, которые включали одышку, судороги, нарушение координации движений. Полученные данные позволили сделать заключение, что токсические дозы, вызывающие признаки интоксикации как испытуемым препаратом, так и препаратом сравнения при в/м введении значительно превышают дозу 1000 мг/кг.
В субхроническом эксперименте на белых крысах обоего пола сравниваемые препараты испытывали в двух дозах, которые превышали в 10 и 20 раз величину дозы, эквивалентную при пересчете по поверхности тела максимальной суточной дозе для человека — 200 мг хондроитина сульфата, которая рекомендована в инструкции по медицинскому применению. Белым крысам обоего пола с исходной массой тела 180–200 г вводили в/м исследуемые препараты один раз в день ежедневно в течение 14 дней. В течение всего эксперимента наблюдение за подопытными животными не выявило у них отклонений во внешнем виде, состоянии шерстного покрова, характере выделений, поведенческих реакциях, динамике прироста массы тела, пищевой активности по сравнению с аналогичными показателями для животных контрольных групп.
При оценке детоксицирующей функции печени было обнаружено, что после курса введения исследуемых препаратов в дозе 200 мг/кг длительность гексеналового сна у подопытных крыс не изменялась, а после курса введения в дозе 400 мг/кг была статистически достоверно выше по сравнению с соответствующими контрольными величинами. Между собой указанные показатели для подопытных животных, которым вводили испытуемый препарат и препарат сравнения, статистически не различались.
В крови у подопытных животных, которым вводили исследуемые препараты в обеих дозах, не было обнаружено каких-либо отклонений в уровнях определяемых биохимических показателей по сравнению с контрольными величинами.
Изучение гематологических показателей крови у белых крыс после курса введения им исследуемых препаратов в сравнении с аналогичными показателями крови у контрольных животных не показало существенных различий.
Морфометрический анализ не обнаружил отличий в относительной массе внутренних органов животных, получавших препараты в обеих дозах, по сравнению с аналогичными показателями у контрольных животных. Патогистологическое исследование также не выявило существенных изменений в изученных органах и тканях животных, получавших исследуемые препараты, по сравнению таковыми у животных в контрольной группе.
При гистологическом изучении, проведенном в опытах на белых крысах, было обнаружено, что исследуемые препараты при многократном в/м введении оказывали значительное местнораздражающее действие на мышечную ткань. В то же время не было выявлено различий в степени выраженности этого действия для испытуемого препарата по отношению к препарату сравнения.
Изучение острой токсичности препарата на белых беспородных крысах (самцах и самках) при в/с, паравертебральном и в/м введениях. В/с введение проводили в дозах 2,5; 5,0; 10,0; 15,0 и 20,0 мл/кг (по готовой лекарственной форме) или 0,25; 0,5; 1,0; 1,5; 2,0 г/кг (по действующему веществу) белым беспородным крысам однократно. Препарат вводили по 1 мл единовременно (по 0,5 мл в правый и 0,5 мл в левый коленный сустав). Введение повторяли 4-кратно с периодом в 1 ч в течение 4 ч. Суммарная максимальная доза составила 4 мл на одну крысу (20 мл/кг).
Паравертебральное введение проводили в дозах 5,0; 10,0; 15,0; 20,0 и 25,0 мл/кг (по готовой лекарственной форме) или 0,5; 1,0; 1,5; 2,0; 2,5 г/кг (по действующему веществу) белым беспородным крысам. Препарат вводили однократно (одну половину максимального объема (2,5 мл) вводили в правую, вторую половину (2,5 мл) в левую паравертебральную область).
В/м введение проводили в дозах 5,0, 10,0, 15,0, 20,0 и 25,0 мл/кг (по готовой лекарственной форме) или 0,5; 1,0; 1,5; 2,0; 2,5 мл/кг (по действующему веществу) белым беспородным крысвм. Однократная доза 25 мл/кг по лекарственной форме или 2,5 мл/кг по действующему веществу является максимально возможной для в/м введения, т.к. максимально возможный объем для в/м введения крысам составляет 5 мл.
При введении препарата в максимально возможных для введения дозах (в/с — 2,0 г/кг, паравертебрально и в/м — 2,5 г/кг, что больше терапевтической дозы для человека в 702 и 877 раз соответственно) ЛД50 не была достигнута, не отмечалось видимых различий в двигательном и пищевом поведении животных, состоянии внешних покровов и видимых слизистых, реакциях на внешние раздражители в сравнении друг с другом и контрольной группой. Различий в приросте массы тела по сравнению с контрольной группой не выявлено.
В результате проведенных исследований на белых беспородных крысах установлено, что при однократном в/с, паравертебральном и в/м способах введения препарат является относительно безвредным веществом.
Препарат не оказывал местнораздражающего действия при однократном в/с, паравертебральном и в/м способах введения.
Изучение хронической токсичности препарата проводились в условиях 60-дневного в/с и в/м введения препарата в эквитерапевтических дозах и дозах, превышающих терапевтические для человека в 15 и 30 раз. При в/с введении препарат вводили 2 раза в неделю, при паравертебральном — ежедневно в дозах 8,5,128, 255 мг/кг. При в/м введении препарат вводился через 1 день в течение 60 дней в дозах 17, 255, 510 мг/кг.
На протяжении всего периода наблюдения в течение 60 дней в группах, получавших в/с, паравертебрально и в/м исследуемый препарат, не было отмечено статистически значимых различий в приросте массы тела, потреблении воды, пищи, изменении ректальной температуры и показателей теста «Открытое поле» по сравнению с контролем.
Показатели сердечно-сосудистой системы (уровни АД, ЧСС, показатели ЭКГ исследования ( QRS, PQ, T), функция почек (общий анализ мочи) также оставались без изменений при терапии препаратом в сравнении с контрольной группой.
Результаты изучения хронической токсичности исследуемого препарата показали, что его многократное в/с, паравертебральное и в/м применение в эквитерапевтических дозах и дозах, значительно превышающих терапевтические, в течение 2 мес не вызывало структурных нарушений основных органов и систем организма.
Не выявлено местнораздражающего действия в области однократного и многократного в/с, паравертебрального и в/м введения исследуемого препарата.
В экспериментальных исследованиях на животных не выявлено тератогенного, мутагенного, эмбриотоксического действия препарата.
Показания
Препарат показан к применению у взрослых при следующих заболеваниях (состояниях):
- дегенеративно-дистрофические заболевания суставов и позвоночника:
— остеоартроз периферических суставов;
— межпозвонковый остеохондроз и остеоартроз;
- ускорение формирования костной мозоли при переломах.
Противопоказания
- гиперчувствительность к препарату или его компонентам;
- кровотечения и склонность к кровоточивости;
- тромбофлебиты;
- наличие активных воспалительных или инфекционных процессов в суставе (при внутрисуставном введении), наличие активного заболевания кожи или кожной инфекции в области предполагаемой инъекции;
- беременность (данные о безопасности применения препарата в настоящее время отсутствуют);
- период лактации (данные о безопасности применения препарата в настоящее время отсутствуют);
- детский возраст до 18 лет.
Применение при беременности и кормлении грудью
Данные о безопасности применения препарата в настоящее время отсутствуют. Противопоказано применять ХОНДРОГАРД® во время беременности и в период грудного вскармливания.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
В/м, в/с. В/с введение препарата осуществляется в асептических условиях специалистом, прошедшим обучение технике в/с введения. После в/с введения препарата место прокола смазывают спиртовой салфеткой.
По 100 мг через день. При хорошей переносимости дозу увеличивают до 200 мг, начиная с 4-й инъекции. Курс лечения — 25–30 инъекций. При необходимости через 6 мес возможно проведение повторного курса лечения.
При остеоартрозе крупных суставов возможно сочетание в/с и в/м способов введения. Проводят до 5 в/с инъекций по 200 мг с перерывом 3 дня между введениями и 16 в/м инъекций по 200 мг с интервалом 1 день между введениями (через день). В зависимости от размера сустава, в суставную полость можно ввести до 2 мл препарата ХОНДРОГАРД®.
Для формирования костной мозоли курс лечения составляет 3–4 нед (10–14 инъекций в/м через день).
Дети. Препарат ХОНДРОГАРД® противопоказан у детей в возрасте до 18 лет.
Побочные действия
Резюме нежелательных реакций
Нежелательные реакции распределены по системно-органным классам с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100); редко (≥1/10000, но <1/1000); очень редко (<1/10000), частота неизвестна (на основании имеющихся данных оценить невозможно).
Нарушения со стороны иммунной системы: частота неизвестна — аллергические реакции (кожный зуд, эритема, крапивница, дерматит).
Общие нарушения и реакции в месте введения: частота неизвестна — геморрагии в месте инъекции.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения польза/риск лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные систмы сообщения о нежелательных реакциях государств — членов Евразийского экономического союза.
Республика Беларусь. Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении». 220037, Минск, Товарищеский пер., 2а.
Тел: (375-17) 299-55-14; факс: (375-17) 299-53-58.
e-mail: rcpl@rceth.by
Российская Федерация. Федеральная служба по надзору в сфере здравоохранения (РОСЗДРАВНАДЗОР). 109012, Москва, Славянская пл., 4, стр. 1.
Тел.: (495) 698-45-38; факс: (495) 698-15-74.
e-mail: npr@гоszdravnadzor.gov.ru
Интернет: www.rоszdravnadzor.gov.ru
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Возможно усиление действия непрямых антикоагулянтов, антиагрегантов, фибринолитиков, что требует более частого контроля показателей свертывания крови при совместном применении.
Передозировка
В настоящее время о случаях передозировки хондроитина сульфата не сообщалось.
Особые указания
В состав препарата входит натрия метабисульфит. В отдельных случаях, особенно у предрасположенных пациентов с бронхиальной астмой при повышенной чувствительности к сульфитам, возможно развитие тяжелых реакций гиперчувствительности и бронхоспазма.
Влияние на способность управлять транспортными средствами и работать с механизмами. ХОНДРОГАРД® не оказывает влияния на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Раствор для внутримышечного и внутрисуставного введения, 100 мг/мл. По 1 или 2 мл в ампулах бесцветного нейтрального стекла с цветным кольцом разлома или цветной точкой и насечкой. На ампулы дополнительно наносят 1, 2 или 3 цветных кольца или без дополнительных цветных колец.
По 5 амп. в контурной ячейковой упаковке из пленки ПВХ и фольги алюминиевой или пленки многослойной, или без фольги и пленки. 1 или 2 контурные ячейковые упаковки по 1 или 2 мл; 5 контурных ячейковых упаковок по 2 мл вместе с листком-вкладышем в пачке из картона.
По 1 или 2 мл в шприцах стеклянных стерильных, градуированных или без градуировки; с иглой, защитным колпачком или без иглы, с защитной пробкой и дополнительным колпачком или без дополнительного колпачка, или с дополнительным колпачком с контролем первого вскрытия. Шприцы с иглой могут комплектоваться дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца. По 1 или 2 шприца в контурной ячейковой упаковке из пленки ПВХ или ПЭТ и пленки многослойной или полипропиленовой, или ПЭ, или бумаги упаковочной с полимерным покрытием, или бумаги для упаковывания медицинских изделий, или фольги алюминиевой. 5 контурных ячейковых упаковок вместе с листком-вкладышем в пачке из картона. В пачку со шприцами без игл может дополнительно вкладываться комплект из 5 или 10 игл.
Производитель
ЗАО «ФармФирма «Сотекс». 141345, Московская обл., Сергиево-Посадский муниципальный р-н, сельское поселение Березняковское, пос. Беликово, 11.
Тел./факс: (495) 956-29-30.
Владелец регистрационного удостоверения: ЗАО «ФармФирма «Сотекс».
Претензии потребителей направлять по адресу владельца регистрационного удостоверения.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
раствор для внутримышечного и внутрисуставного введения 100 мг/мл ампула — 3 года.
раствор для внутримышечного и внутрисуставного введения 100 мг/мл шприц — 2 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Хондрогард уколы инструкция по применению
Дата публикации: 07.02.2023

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.АртрозБоль в суставахБоль в суставах и мышцахВоспаление суставовДля суставов и связокНа лучезапястный суставОстеохондроз
Автор статьи
Диплом о фармацевтическом образовании: 105924 1197876, рег. номер 30353
Все авторы
Содержание статьи
- Хондрогард: состав
- Хондрогард таблетки
- Что лучше: Алфлутоп или Хондрогард?
- Румалон или Хондрогард: что лучше?
- Мукосат или Хондрогард: что эффективнее
- Драстоп или Хондрогард: что лучше
- Задайте вопрос эксперту по теме статьи
Остеоартроз молодеет во всем мире. Еще в прошлом веке заболевание связывали в основном с «изнашиванием» суставов. Это, в принципе, подтверждает и статистика: после 65 лет распространенность остеоартроза достигает 90%. Но, кроме неизбежного старения, развитию болезни способствуют травмы, ожирение, вредные привычки, несбалансированное питание, сидячий образ жизни и отсутствие физической активности. Врачи обеспокоены тем, что артрозом все чаще страдают молодые люди, подростки и даже дети.
Лечение остеоартроза (ОА) включает ограничение нагрузок, физиотерапию, лечебную физкультуру и медикаментозное лечение. В крайних случаях прибегают к замене разрушенных крупных суставов эндопротезами.
Если говорить о лекарствах, то в российские клинические рекомендации по терапии остеоартроза включены хондропротекторы. Это средства медленного действия, необходимые для построения и обновления суставного хряща. Провизор рассказывает о препарате Хондрогард и сравнивает его с аналогами: Алфлутоп, Румалон, Мукосат и Драстоп.
Хондрогард: состав
Российский препарат Хондрогард выпускают в виде раствора для внутримышечного и внутрисуставного введения. Действующее вещество — хондроитина сульфат в количестве 100 мг на 1 мл.
Хондроитина сульфат представляет собой высокомолекулярное белково-углеводное вещество — мукополисахарид, которое вместе с коллагеном является основой хряща. Введение хондроитина уменьшает разрушение хрящевой ткани и помогает ее восстановлению. Хондрогард уколы снимают боль и улучшают подвижность суставов.
Хондрогард таблетки
Компания ФармФирма «Сотекс» производит Хондрогард только в ампулах и шприцах для инъекционного введения. Пероральные формы не выпускаются.
Что лучше: Алфлутоп или Хондрогард?
Алфлутоп — оригинальный препарат природного происхождения. В его составе очищенный биоактивный концентрат, который получают из мелкой морской рыбы. Концентрат содержит хондроитина сульфат, аминокислоты, пептиды и ионы натрия, калия, магния, кальция, железа, меди и цинка.
Алфлутоп также, как и Хондрогард, защищает и восстанавливает хрящевую ткань. В отличие от Хондрогарда у него нет данных, с какой скоростью проникает в полость сустава и как выводится из организма, так как действующее вещество — биоконцентрат.
В России было проведено исследование* на тему: «Алфлутоп или Хондрогард — что эффективнее при остеоартрите коленных суставов». Выборка пациентов была недостаточной, условия не соответствовали международным стандартам. Исследование показало, что значимых различий в действии двух препаратов нет.
Показания к применению, побочные действия и противопоказания у Алфлутопа схожи с таковыми у Хондрогарда. Оба препарата вводятся внутримышечно или в полость сустава, отпускаются по рецепту и назначить их может только лечащий врач с учетом всех индивидуальных особенностей пациента.
Румалон или Хондрогард: что лучше?
Румалон — комбинированный препарат животного происхождения. Это один из самых первых хондропротекторов в медицине. Содержит гликозаминогликан-пептидный комплекс. который стимулирует синтез мукополисахаридов и коллагена, восстанавливает хрящ, а также снижает активность разрушающих хрящ ферментов. Как и в случае с Алфлутопом, у него тоже нет данных по метаболизму в организме.
Область применения у препаратов одинаковая, но Румалон используют только для внутримышечного введения. Хондрогард обладает обезболивающим действием и восстанавливает подвижность суставов. Подобные свойства Румалона в инструкции не отмечены. Противопоказаний больше у Хондрогарда: его нельзя ставить пациентам с тромбофлебитами и склонностью к кровотечениям. Но Румалон за счет животных белков может вызвать сильную аллергическую реакцию.
Румалон не подходит для внутрисуставного применения, которое считается более эффективным (активные вещества попадают сразу внутрь пораженного сустава). Но при внутримышечном применении курс лечения Румалоном составляет порядка 20 инъекций в течение 6 недель, а Хондрогардом — 25-30 инъекций в течение 8 недель.
Однозначно ответить на вопрос: «Румалон или Хондрогард — что эффективнее?» нельзя. Для быстрого купирования боли и восстановления подвижности сустава лучше подойдет Хондрогард. Лечащий врач подбирает терапию индивидуально исходя из показаний, стадии заболевания, сопутствующих болезней пациента. Препараты отпускают по рецепту и консультация врача обязательна.
Мукосат или Хондрогард: что эффективнее
Мукосат — линейка хондропротекторов, которая производится в России и Сербии. Включает лекарственные формы (раствор для инъекций и мазь для наружного применения) и БАДы (капсулы и шипучие таблетки).
Состав инъекционной формы идентичен составу Хондрогарда, действующее вещество — хондроитина сульфат, показания, противопоказания, побочные эффекты — те же. Отличия только в том, что для производства Хондрогарда используют только испанскую субстанцию хондроитина, а для Мукосата — из России, Аргентины и Испании.
Мукосат или Хондрогард — что лучше? Возможно, при комплексном использовании Мукосата внутрь, наружно и инъекционно эффективность лечения будет выше. Но назначить терапевтическую схему может только врач.
Драстоп или Хондрогард: что лучше
Драстоп — инъекционный хондропротектор из Турции, содержащий хондроитина сульфат. Выпускают в растворе только по 2 мл (200 мг) для внутримышечного применения. Субстанцию для производства Драстопа используют аргентинскую.
Препараты можно заменять, если врач назначил внутримышечные уколы в дозе 200 мг. Если надо ставить инъекции в сустав или в дозе 100 мг — подойдет только Хондрогард. В одинаковой дозе и фасовке Драстоп имеет более низкую цену по сравнению с Хондрогардом.
Провизор напоминает: «Хондропротекторы не способны полностью вылечить пораженные суставы. Их назначают на ранних стадиях развития болезни. Если хрящ сильно разрушен, то лекарства не помогут».
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Цены на товар Хондрогард:
Мегаптека,
Цены на Хондрогард в Санкт-Петербурге, Цены на Хондрогард в Новосибирске, Цены на Хондрогард в Екатеринбурге, Цены на Хондрогард в Казани, Цены на Хондрогард в Нижнем Новгороде, Цены на Хондрогард в Челябинске, Цены на Хондрогард в Самаре, Цены на Хондрогард в Уфе, Цены на Хондрогард в Ростове-на-Дону, Цены на Хондрогард в Омске, Цены на Хондрогард в Красноярске, Цены на Хондрогард в Воронеже, Цены на Хондрогард в Перми, Цены на Хондрогард в Волгограде, Цены на Хондрогард в Краснодаре, Цены на Хондрогард в Тюмени, Цены на Хондрогард в Саратове, Цены на Хондрогард в Тольятти, Цены на Хондрогард в Ижевске, Цены на Хондрогард в Барнауле
Гид по аналогам за подписку
подпишитесь на соцсети и напишите в сообщения «аналоги»
Состав
На 1 мл препарата содержится действующего вещества сульфата натрия хондроитина в количестве 100 мг.
Вспомогательные вещества: бензиловый спирт, гидроксид натрия, дисульфит натрия, вода очищенная.
Форма выпуска
Ампулы с прозрачным бесцветным или же слегка желтоватым раствором, по 1 и 2 мл, 5 или 10 штук в упаковке. Жидкость имеет специфический запах бензилового спирта.
Фармакологическое действие
Стимулятор процессов регенерации в тканях.
Фармакодинамика и фармакокинетика
Действующее вещество лекарства – сульфат хондроитина способствует восстановлению хрящевой ткани и уменьшению дегенеративных изменений в суставах путем стимуляции синтеза протеогликанов. Происходит стимуляция синтеза глюкозаминогликанов, незаменимых для хрящевой ткани.
Уменьшаются боли в суставах, восстанавливается фосфорно-кальциевый обмен, снижается скорость протекания воспаления синовиальной оболочки сустава и следовательно, разрушения хряща.
Через полчаса после введения препарата он достигает своей максимальной концентрации в плазме крови. Выводится действующее вещество в течение двух суток.
Показания к применению
Уколы Хондрогарда назначают при остеохондрозе и остеоартрозе позвоночника или же суставов на периферии.
Противопоказания
- склонность к возникновению кровотечений;
- тромбофлебит;
- аллергия на компоненты;
- беременные и кормящие женщины и дети.
Побочные действия
Возможны аллергические реакции на коже и воспаления в месте инъекции.
Инструкция по применению Хондрогарда (Способ и дозировка)
Уколы производят внутримышечно. Суточная доза составляет 0,1 г. Между первыми инъекциями делают перерыв в один день. При необходимости, уже в 4-ого укола можно увеличить дозу до 0,2 г.
Инъекции лекарства производят от 25 до 30 штук. Повторять курс целесообразно через полгода.
Улучшения в состоянии наступают через 2 недели, после начала курса.
Передозировка
Не было зарегистрировано случаев передозировки.
Взаимодействие
Не происходит или не наблюдалось.
Условия продажи
По рецепту врача.
Условия хранения
В темном, прохладном месте.
Срок годности
2 года.
Аналоги Хондрогарда
Совпадения по коду АТХ 4-го уровня:
- Артрин
- Мукосат
- Хондролон
- Артра
- Картилаг витрум
- Структум
- Хондроитин сульфат
- Хондроксид
- Хондролайф
- Хонсурид
- Румалон
- Афлутоп
- Дона
- Эльбона
Отзывы на уколы Хондрогард
На форумах отзывы в основном хорошие. Некоторые пишут, что уже после первого укола наступают улучшения, исчезает боль и уменьшается воспаление. Часто курс препарата повторяют, т.к. довольны результатом после первого же опыта применения. Из побочных эффектов редко возникают высыпания на коже и прочие аллергические реакции.
Препарат часто назначают при остеоартрозах, артритах и различных травмах суставов. Улучшения в состоянии наступают быстро, а эффект остается надолго.
Что лучше: Афлутоп или Хондрогард?
Афлутоп содержит вытяжку из морских водорослей и в связи с этим, может вызвать аллергию у людей с непереносимостью морепродуктов, также легко может наступить передозировка средством. По эффективности препарата Хондрогард несколько выше, чем у его аналога. Зато аналог содержит, в основном, натуральные компоненты.
Цена Хондрогарда (где купить)
Цена уколов Хондрогард намного ниже, чем его аналогов. Однако это абсолютно никак не сказывается на его эффективности.
Купить 10 ампул препарата по 1 мл в России стоит около 700-800 рублей. Такое же количество средства, объемом по 2 мл, обойдется примерно в 1500 рублей.
Цена Хондрогарда в Украине – 500 грн. за 10 ампул по 1 мл. Цена ампул по 2 мл – 900 грн. за 10 штук.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Хондрогард раствор для в/м и в/суст. введ. 100мг/мл амп. 2мл 25штЗАО «ФармФирма «Сотекс»
-
Хондрогард раствор для в/м и в/суст. введ. 100мг/мл амп. 1мл 10штЗАО «ФармФирма «Сотекс»
-
Хондрогард раствор для в/м и в/суст.введ. 100мг/мл амп. 2мл 10штЗАО «ФармФирма «Сотекс»
Аптека Диалог
-
Хондрогард ампулы 100мг/мл 2мл №25Сотекс
-
Хондрогард (амп. 100мг/мл 1мл №10)Сотекс
-
Хондрогард ампулы 100мг/мл 2мл №10Сотекс
-
Хондрогард ампулы 100мг/мл 1мл №10Сотекс
показать еще
Описание лекарственного препарата
Хондрогард®
(Chondroguard)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2022 года.
Дата обновления: 2021.11.22
Код ATX:
M01AX25
(Хондроитина сульфат)
Лекарственные формы
| Хондрогард® |
Р-р д/в/м и внутрисуставного введения 100 мг/1 мл: амп. 5 или 10 шт.; шприцы 1 или 2 шт. рег. №: ЛП-(000042)-(РГ-RU) |
|
|
Р-р д/в/м и внутрисуставного введения 200 мг/2 мл: амп. 5, 10 или 25 шт.; шприцы 1 или 2 шт. рег. №: ЛП-(000042)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Хондрогард®
Раствор для в/м и внутрисуставного введения прозрачный, бесцветный или со слегка желтоватым оттенком, с запахом бензилового спирта.
Вспомогательные вещества: бензиловый спирт — 9 мг, натрия метабисульфит — 1 мг, натрия гидроксид — до рН 6.0-7.5, вода д/и — до 1 мл.
1 мл — ампулы бесцветного нейтрального стекла с цветным кольцом разлома или с цветной точкой и насечкой (5) — упаковки ячейковые контурные (1) — пачки картонные×.
1 мл — ампулы бесцветного нейтрального стекла с цветным кольцом разлома или с цветной точкой и насечкой (5) — упаковки ячейковые контурные (2) — пачки картонные×.
1 мл — шприцы бесцветного нейтрального стекла градуированные или без градуировки* (1) — упаковки ячейковые контурные (5) — пачки картонные×.
1 мл — шприцы бесцветного нейтрального стекла градуированные или без градуировки* (2) — упаковки ячейковые контурные (5) — пачки картонные×.
Раствор для в/м и внутрисуставного введения прозрачный, бесцветный или со слегка желтоватым оттенком, с запахом бензилового спирта.
Вспомогательные вещества: бензиловый спирт — 18 мг, натрия метабисульфит — 2 мг, натрия гидроксид — до рН 6.0-7.5, вода д/и — до 2 мл.
2 мл — ампулы бесцветного нейтрального стекла с цветным кольцом разлома или с цветной точкой и насечкой (5) — упаковки ячейковые контурные (1) — пачки картонные×.
2 мл — ампулы бесцветного нейтрального стекла с цветным кольцом разлома или с цветной точкой и насечкой (5) — упаковки ячейковые контурные (2) — пачки картонные×.
2 мл — ампулы бесцветного нейтрального стекла с цветным кольцом разлома или с цветной точкой и насечкой (5) — упаковки ячейковые контурные (5) — пачки картонные×.
2 мл — шприцы бесцветного нейтрального стекла градуированные или без градуировки* (1) — упаковки ячейковые контурные (5) — пачки картонные×.
2 мл — шприцы бесцветного нейтрального стекла градуированные или без градуировки* (2) — упаковки ячейковые контурные (5) — пачки картонные×.
× пачка с двух сторон с наклейками из самоклеящегося материала для контроля вскрытия или без наклеек.
* шприцы с иглой, с защитным колпачком или без иглы, с защитной пробкой и дополнительным колпачком или без дополнительного колпачка, или с дополнительным колпачком с контролем первого вскрытия.
Шприцы с иглой могут комплектоваться дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца.
В пачку со шприцами без игл может дополнительно вкладываться комплект из 5 или 10 игл.
Фармакологическое действие
Высокомолекулярный мукополисахарид, влияющий на обменные процессы в гиалиновом хряще. Уменьшает дегенеративные изменения в хрящевой ткани суставов, ускоряет процессы ее восстановления, стимулирует синтез протеогликанов.
При лечении препаратом уменьшается болезненность и улучшается подвижность пораженных суставов. При лечении дегенеративных изменений суставов с развитием вторичного синовита, положительный эффект может наблюдаться уже через 2-3 недели после начала введения препарата: уменьшается боль в суставах, исчезают клинические проявления реактивного синовита, увеличивается объем движений в пораженных суставах. Терапевтический эффект сохраняется длительное время после окончания курса лечения.
Фармакокинетика
Всасывание
После в/м введения Cmax хондроитина сульфата в плазме достигается через 1 ч, затем постепенно снижается в течение 2 сут. При однократном внутрисуставном введении препарата в дозе 200 мг Cmax хондроитина сульфата в плазме наблюдается через 1-2 ч и составляет 52.5-86.9 нг/мл.
Распределение
После в/м введения хондроитина сульфат быстро распределяется. Уже через 30 мин после инъекции он обнаруживается в крови в значительных концентрациях.
Хондроитина сульфат накапливается, главным образом, в хрящевой ткани суставов. Синовиальная оболочка не является препятствием для проникновения препарата в полость сустава. В экспериментах показано, что через 15 мин после в/м инъекции хондроитина сульфат обнаруживается в синовиальной жидкости, затем проникает в суставной хрящ, где его Cmax достигается через 48 ч.
При внутрисуставном введении наблюдается удерживание хондроитина сульфата в тканях сустава и его постепенный выход в кровоток.
Выведение
Т1/2 при внутрисуставном введении составляет 2.5 ч.
Показания препарата
Хондрогард®
Дегенеративно-дистрофические заболевания суставов и позвоночника:
- остеоартроз периферических суставов;
- межпозвонковый остеохондроз и остеоартроз.
Для ускорения формирования костной мозоли при переломах.
Режим дозирования
Препарат назначают в/м по 100 мг через день. При хорошей переносимости дозу увеличивают до 200 мг, начиная с 4-й инъекции.
Курс лечения — 25-30 инъекций. При необходимости через 6 мес возможно проведение повторного курса лечения.
При остеоартрозе крупных суставов возможно сочетание внутрисуставного и в/м способов введения. Проводят до 5 внутрисуставных инъекций по 200 мг с перерывом 3 дня между введениями и 16 в/м инъекций по 200 мг с интервалом 1 день между введениями (через день). В зависимости от размера сустава в суставную полость можно ввести до 2 мл препарата Хондрогард®.
Для формирования костной мозоли курс лечения составляет 3-4 недели (10-14 инъекций в/м через день).
Способ применения
Внутрисуставное введение препарата осуществляется в асептических условиях специалистом, прошедшим обучение технике внутрисуставного введения. После внутрисуставного введения препарата место прокола смазывают спиртовой салфеткой, накладывают бактерицидный пластырь.
Побочное действие
Со стороны иммунной системы: аллергические реакции (кожный зуд, эритема, крапивница, дерматит).
Местные реакции: геморрагии в месте инъекции.
Противопоказания к применению
- повышенная чувствительность к хондроитина сульфату или любому из вспомогательных веществ препарата;
- кровотечения и склонность к кровоточивости;
- тромбофлебиты;
- при внутрисуставном введении наличие активных воспалительных или инфекционных процессов в суставе, наличие активного заболевания кожи или кожной инфекции в области предполагаемой инъекции;
- детский и подростковый возраст до 18 лет;
- беременность (данные о безопасности применения препарата в настоящее время отсутствуют);
- период лактации (данные о безопасности применения препарата в настоящее время отсутствуют).
Применение при беременности и кормлении грудью
Данные о безопасности применения препарата в настоящее время отсутствуют. Противопоказано применять препарат во время беременности и в период грудного вскармливания.
Применение у детей
Противопоказан к применению в возрасте до 18 лет.
Особые указания
В состав препарата входит натрия метабисульфит, который может вызывать тяжелые реакции гиперчувствительности и бронхоспазм.
Использование в педиатрии
Отсутствуют данные по безопасности и эффективности применения препарата в педиатрической практике.
Влияние на способность к управлению транспортными средствами и механизмами
Хондрогард® не оказывает влияния на способность управлять транспортными средствами и работать с механизмами.
Передозировка
В настоящее время о случаях передозировки хондроитина сульфата не сообщалось.
Лекарственное взаимодействие
Возможно усиление действия непрямых антикоагулянтов, антиагрегантов, фибринолитиков, что требует более частого контроля показателей свертываемости крови при одновременном применении.
Условия хранения препарата Хондрогард®
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре не выше 25°С.
Срок годности препарата Хондрогард®
Срок годности раствора в ампулах — 3 года, в шприцах — 2 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.
Исследование эффективности, переносимости и безопасности препарата Хондрогард у пациентов с остеоартрозом
Статьи
Опубликовано в журнале:
«ФАРМАТЕКА»; № 7; 2013; стр. 60-64.
Л.И. Алексеева, С.Г. Аникин, Е.М. Зайцева, Н.Г. Кашеварова, Т.А. Короткова, Е.П. Шарапова, Н.В. Чичасова, Г.Р. Имаметдинова, Н.В. Бадокин, С.А. Колова
ФГБУ НИИР РАМН, Москва
Представлены результаты исследования по оценке эффективности, переносимости и безопасности внутримышечного введения хондроитина сульфата (ХС) больным остеоартрозом (ОА) коленных суставов. В 2-месячном проспективном исследовании приняли участие 70 человек, 67 (96 %) женщин и 3 (4 %) мужчины в возрасте 45-70 лет с первичным ОА коленных суставов II (79 %) и III (21 %) рентгенологических стадий по Kellgren-Lawrence, нуждавшихся в приеме нестероидных противовоспалительных средств (НПВС). Препарат ХС Хондрогарт вводили внутримышечно через день (всего 30 инъекций), исследование завершили 66 (94 %) человек. Результаты исследования показали, что терапевтический эффект наступал в среднем на 23-й день от начала лечения. Таким образом, Хондрогард обладает достоверным симптоматическим эффектом, уменьшая боль, скованность и улучшая функциональные показатели. Преимуществом препарата являются быстрое наступление эффекта, возможность отмены или снижения дозы НПВС на фоне лечения и хорошая переносимость. Препарат Хондрогард может быть рекомендован лицам, страдающим ОА, в качестве первого средства, дающего более быстрый эффект с последующей заменой его на пероральные формы.
Ключевые слова: остеоартроз, нестероидные противовоспалительные средства, хондроитина сульфат
The results of the study aimed to evaluation the efficacy, tolerability and safety of intramuscular administration of chondroitin sulfate (CS) in patients with osteoarthrosis (OA) of the knee are presented. The 2-month prospective study involved 70 patients, 67 (96 %) women and 3 (4 %) men aged 45-70 years with primary OA of knee joints II (79 % ) and III (21 %) radiographic stages by Kellgren-Lawrence, who were in need of administration of nonsteroidal anti-inflammatory drugs (NSAIDs). The drug Chondrogard was administered intramuscularly each alternate day (a total of 30 injections); 66 (94 %) patients have completed the study. The results showed that the therapeutic effect occurred at the 23th day of treatment on average. Thus, Chondrogard has significant symptomatic effect, reducing pain, stiffness, and improving functional performance. The advantages include the rapid onset of drug effect, potential for the withdrawal or reducing the NSAID dose during treatment, and good tolerability. The drug Chondrogard can be recommended to the OA patients as a first-line drug with a more immediate effect, with subsequent replacement by oral forms of drug.
Key words: osteoarthrosis, nonsteroidal anti-inflammatory drugs, chondroitin sulfate
Введение
Остеоартроз (ОА) — заболевание суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникаютттих при макро- и микроповреждениях, которые активируют ненормальные адаптивные процессы восстановления, включая провоспалительные реакции иммунной системы, костного ремоделирования и образования остеофитов [1]. Основными клиническими проявлениями ОА являются боль различной степени выраженности, как правило механического стартового характера, умеренно выраженная непродолжительная скованность в суставах и нарушение функции. Терапия ОА носит комплексный характер и зависит от выраженности воспалительной реакции, степени функциональной недостаточности, структурных изменений и наличия сопутствующих заболеваний. В клинической практике наиболее часто для купирования симптомов ОА применяют нестероидные противовоспалительные средства (НПВС). Однако их применение может оказывать токсическое действие на органы желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы, почек и печени. Российские, Европейские и Американские руководства рекомендуют использовать НПВС короткими курсами в минимальных эффективных дозах [2, 3]. В 2003 г. Европейская антиревматическая лига (EULAR — The European League Against Rheumatism) отдельно выделила группу лекарственных средств, определяемых как препараты замедленного действия для симптоматической терапии ОА (SYSADOA — symptomatic slow acting drugs for osteoarthritis). К настоящему времени накоплен большой научный и клинический опыт, позволивший сделать предварительные выводы и о возможном наличии структурно-модифицирующего эффекта, присущего этим препаратам.
ХС является типичным представителем группы лекарственных средств замедленного действия. Несмотря на то что ХС используется в медицине уже более 30 лет, до настоящего времени не утихают споры о месте и роли этого препарата в терапии пациентов с ОА, что, впрочем, относится ко всей группе лекарственных средств замедленного действия. Отражением этих споров, в частности, являются рекомендации Американской коллегии ревматологов, где авторы условно не рекомендуют использовать ХС и глюкозамин в качестве терапии пациентов с ОА [4]. Тем не менее в большинстве национальных рекомендаций, включая и таких авторитетных организаций, как Международное общество по изучению ОА (OARSI — Osteoarthritis Research Society International) и EULAR, ХС включен в качестве терапевтического средства для лечения пациентов с ОА.
Фармакокинетика и биологическая активность ХС в значительной степени определяются массой молекулы и степенью сульфатирования [10]. В качестве исходного сырья для получения ХС используется хрящевая ткань крупного рогатого скота, свиней, цыплят или рыб [11-14]. Разные источники получения ХС определяют особенности молекулярной структуры ХС, что в свою очередь помимо степени очистки оказывает влияние на эффективность применения того или иного препарата.
Большая часть ХС выпускается в виде форм для перорального применения. При попадании в ЖКТ происходит разрушение большинства молекул ХС, и в системный кровоток, как правило, попадают низкомолекулярные дериваты, обладающие небольшой терапевтической активностью. По некоторым данным, доля нативных молекул в системном кровотоке при пероральном приеме составляет всего 10 %. Максимальная концентрация препарата в крови достигается через 3-4 часа после приема, а в синовиальной жидкости — через 4-5 часов. В целом же биодоступность ХС при пероральном приеме составляет в среднем от 10 до 20 % [15-17].
При внутримышечном введении ХС выявляется в значительных концентрациях в системном кровотоке уже через 30 минут, а максимальная концентрация достигается через час. В синовиальной жидкости препарат выявляется через 15 минут после внутримышечной инъекции, а максимальная концентрация в хрящевой ткани достигается через 48 часов [18]. Внутримышечный способ введения ХС увеличивает биодоступность и долю нативных молекул в системном кровотоке, благодаря чему может повышаться как эффективность проводимой терапии, так и более быстрое развитие симптоматического эффекта.
Целью исследования явилась оценка эффективности, переносимости и безопасности ХС (Хондрогарда) для пациентов с ОА коленных суставов при внутримышечном применении.
Материал и методы
В 2-месячное проспективное когортное исследование были включены 70 человек с диагнозом ОА коленных суставов, среди них были 67 (96 %) женщин и 3 (4 %) мужчины. Диагноз остеоартроза устанавливался на основе классификационных критериев Американской коллегии ревматологов (АКР) 1986 г. [5].
Критерии включения:
В исследование не включали лиц с вторичным гонартрозом, внутрисуставным введением любых препаратов за последние 6 недель до начала исследования, наличием хондрокальциноза, асептического некроза мыщелков бедренных и большеберцовых костей, оперативных вмешательств на коленном суставе, а также с известной повышенной чувствительностью к ХС, тяжелыми сопутствующими заболеваниями, язвой желудка или двенадцатиперстной кишки в течение последнего месяца, кровотечениями в анамнезе, тромбофлебитами, беременностью и периодом лактации, принимавшими препараты с симптоматическими и структурно-модифицирующими свойствами. Разрешалось использование НПВС, которые пациенты принимали на момент включения в исследование. Не допускались внутрисуставные инъекции, в т. ч. глюкокортикоидов и препаратов гиалуроновой кислоты, прием антикоагулянтов, антиагрегантов, фибринолитиков, проведение физиотерапевтических процедур.
В исследование вошли лица в возрасте от 45 до 70 лет, средний возраст составил 61,0 ± 6,4 года, рост — 1,63 ± 0,06 м, масса тела — 81,6 ± 12,9 кг, индекс массы тела (ИМТ) — 31 ± 4,6 кг/м2, медиана длительности заболевания — 9 лет (25-й, 75-й процентили -5 и 12 лет), медиана длительности последнего обострения — 2 месяца (25й, 75-й процентили — 1,4 и 4,0 месяца). Наиболее выраженная симптоматика на момент включения в исследование, как правило, отмечалась в правом коленном суставе (64 %) по сравнению с левым (36 %). При этом большинство (79 %) лиц имели ОА II рентгенологической стадии и 21 % — ОА III стадии.
Характеристика участников исследования представлена в табл. 1.
Таблица 1
Характеристика участников исследования
| Параметры | Мин. | Макс. | Среднее | SD |
| Возраст, годы | 45 | 70 | 61 | 6,4 |
| Рост, м | 1,5 | 1,77 | 1,63 | 0,06 |
| Масса тела, кг | 54 | 110 | 81,6 | 12,9 |
| ИМТ, кг/м2 | 22 | 40 | 31 | 4,6 |
| Длительность болезни |
Медиана — 9 лет, 25-й процентиль — 5 лет, 75-й процентиль — 12 лет |
|||
| Длительность обострения |
Медиана — 2 месяца, 25-й процентиль — 1,4 месяца, 75-й процентиль — 4 месяца |
|||
|
Пол: Ж — 67 (96 %), М — 3 (4 %) |
||||
|
Суставы: правый — 64 %, левый — 36 % |
||||
|
Рентгенологическая стадия: II — 79 %, III — 21 % |
В качестве показателей эффективности использовали динамику индекса WOMAC (Western Ontario and McMaster University) в целом, а также отдельных параметров: значение боли, скованность и функциональная недо статочность (ФН). Оценивали динамику изменений скорости ходьбы на 15 метров, потребность в НПВС на протяжении исследования и общую оценку эффекта пациентом в конце исследования. Также оценивали частоту и характер нежелательных явлений (НЯ), их связь с исследуемым препаратом.
Всем пациентам через день внутримышечно вводили ХС на протяжении 2 месяцев (№ 30). Первые три инъекции выполнялись в дозе 1 мл (100 мг), последующие — в дозе 2 мл (200 мг). В случае необходимости пациенты продолжали терапию НПВС, при этом применения другого НПВС на протяжении исследования не допускалось.
Статистическая обработка данных проведена с помощью программы SPSS 16.0. Результаты представлены в виде среднего значения и стандартного отклонения или медианы и 25-й и 75-й процентилей. Нормальность распределения оценивали с помощью теста Колмогорова-Смирнова. Оценка изменений проведена с помощью однофакторного дисперсионного анализа с повторными измерениями и парного t-теста.
Результаты исследования
Всего в исследовании приняли участие 70 человек, среди них 67 (96 %) женщин и 3 (4 %) мужчины. Полностью завершили исследование 66 (94 %) человек, 4 (6 %) пациента выбыли: трое — в результате появления НЯ и один — из-за отсутствия эффекта от проводимой терапии.
Терапия ХС в виде внутримышечных инъекций была эффективной для большинства больных. Были выявлены статистически значимые улучшения как отдельных показателей: боль, скованность, ФН, так: и WOMAC в целом. Результаты представлены на рис. 1.
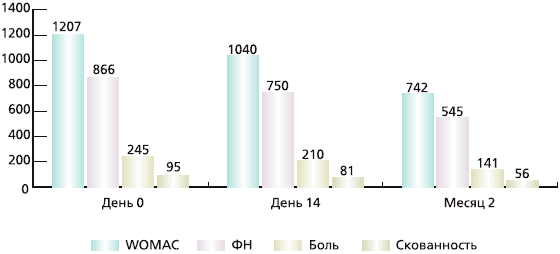
Рис 1. Динамика показателей WOMAC, боли, скованности функциональной недостаточности (указаны средние значения), р < 0,001 для всех показателей
Показатели WOMAC значимо уменьшились уже через две недели, в среднем на 167 (14 %) мм (95 % доверительный интервал [ДИ] — 112—219; р < 0,001), а через 2 месяца — на 465 (39 %) мм (95 % ДИ — 387— 569; р < 0,001).
На фоне лечения препаратом Хондрогард отмечено статистически значимое уменьшение боли по шкале WOMAC через две недели на 14 %, или в абсолютных значениях — на 35 мм (95 % ДИ — 21—49; р < 0,001). При продолжении терапии ко второму месяцу положительная динамика достигла 43 %, что соответствовало снижению боли в среднем на 104 мм (95 % ДИ — 85—124; р < 0,001).
Скованность в оцениваемом коленном суставе через 2 недели статистически значимо уменьшилась на 14 мм (95 % ДИ — 8—22; р < 0,001), 15 %, через два месяца — на 39 мм (95 % ДИ —31—51; р < 0,001), 41 %. Отмечено статистически значимое улучшение функциональных показателей через 2 недели на 13 % и снижение ФН на 116 мм (95 % ДИ —78—154; р < 0,001), ко второму месяцу терапии улучшение достигло 37 %, а показатели ФН снизились на 321 мм (95 % ДИ — 265—393; р < 0,001; табл. 2).
Таблица 2
Динамика показателей WOMAC, боли, скованности ФН в процессе лечения
| Параметры | День 0 | 14-й день | 2-й месяц | р |
| WOMAC | 1207 (350) | 1040 (404), 14 % | 742 (412), 39 % | < 0,001 |
| Боль | 245 (65) | 210 (86), 14 % | 141 (87), 43 % | < 0,001 |
| Скованность | 95 (37) | 81 (38), 15 %, 14 мм | 56 (40), 39 мм, 41% | < 0,001 |
| ФН | 866 (265) | 750(297) | 545 (297), 321, 37 % | < 0,001 |
Примечание. Указаны средние значения, в скобках абсолютные значения в мм.
Через две недели терапии достигнуто незначительное увеличение скорости прохождения дистанции 15 метров, время прохождения дистанции снизилось на 0,75 секунды (95 % ДИ — 0,12— 1,38, р = 0,021), 5 %; через 2 месяца — на 1,88 секунды (95 % ДИ — 1,25—2,51, р < 0,001), 13 %.
Из 63 пациентов, отметивших положительный эффект от проводимой терапии, полностью прекратили прием НПВС 28 (44 %) человек, или 40 % от общего числа участников исследования. Уменьшили дозу в 2 раза или стали принимать НПВС не чаще 1 раза в 3 дня 21 (33 %) участник, или 30 % от общего их числа. Отметили улучшение состояния, но продолжали принимать прежнюю дозу НПВС 14 (22 %), или 20 % от общего числа участников. Два человека прекратили прием НПВС, но отметили усиление симптоматики и в дальнейшем выбыли из исследования.
В среднем на 23 ± 10-й день пациенты отмечали эффект от лечения. Из 70 участников исследования эффективность препарата оценили 68 человек (двое выбыли и не принимали участие в общей оценке). Из оставшихся 68 пациентов полностью закончили исследование 66 и 2 выбыли, но также принимали участие в оценке эффективности. Хороший эффект препарата отметил 41 (59 %) пациент, удовлетворительный — 22 (31 %) и 5 (7 %) человек не заметили какого-либо эффекта (рис. 2).
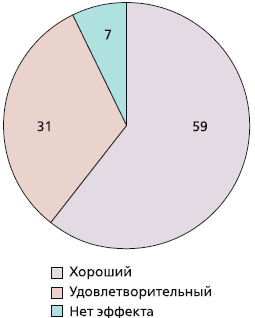
Рис. 2. Общая оценка пациентами эффективности терапии ХС, %
В ходе исследования были выявлены следующие НЯ: небольшие гематомы в месте введения препарата — 8 (11%) пациентов; кожный зуд, папулезную сыпь — 4 (6 %); болезненные уплотнения в месте инъекции — 2 (3 %); чувство жара после инъекции — 1 (1 %); тошноту, диарею — 1 (1%). Серьезные НЯ отсутствовали.
Из-за НЯ выбыли 3 (4 %) человека и 1 — из-за неэффективности лечения. При этом у двоих отмечены папулезная сыпь и кожный зуд, что было расценено исследователями как реакция, связанная с препаратом; у одного пациента — тошнота и диарея, которые купировались после прекращения введения препарата. Эта реакция также была расценена исследователями как связанная с применением препарата.
Обсуждение
ХС относится к группе препаратов замеленного действия для симптоматической терапии ОА, препарат обладает большим спектром биологической активности, оказывая влияние почти на все ключевые моменты патогенеза ОА. Литература располагает массой работ, в которых оценивался симптомагический эффект ХС. В некоторых мета-анализах был выявлен значимый эффект ХС на боль, скованность и ФН. Так, у 372 больных ОА Leeb и соавт. [6] отметили положительный эффект ХС на боль 0,9 (95 % ДИ 0,8—1,0) и функцию суставов 0,74 (95 % ДИ -0,65-0,85). По данным мета-анализа 15 рандомизированных контролируемых исследований (РКИ) McAlindon и соавт. [7] обнаружили достаточно выраженный эффект ХС. Размер общего терапевтического эффекта составил 0,78 (95 % ДИ — 0,6-0,95). Согласно общепринятому подходу, эффект менее 0,2 рассматривается как незначительный, 0,5 — как средний и более 0,8 -как выраженный. Однако при учете только крупномасштабных исследований или исследований, характеризующихся высоким качеством, показатели размера эффекта снижались. Проведя мета-анализ 20 РКИ влияния ХС на боль у 3846 больных ОА коленных и тазобедренных суставов, Reichenbach и соавт. [8] тоже выявили довольно высокие показатели эффективности проведенной терапии — 0,75 (-0,99 до -0,5).
В представленной работе, которая имела дизайн открытого проспективного исследования, авторы выявили статистически значимое улучшение показателей боли, скованности, ФН и общего WOMAC по сравнению с исходными данными уже через две недели, хотя изменения и не достигли уровня клинической значимости (улучшение показателя более чем на 20 %). Однако уже ко второму месяцу терапии все значения индекса WOMAC (боль, скованность, ФН) снизились на 43 %, 41 и 37 % соответственно. Эффект от проводимой терапии отмечен 90 % пациентов, в 3 % случаев присутствовал положительный эффект, однако после отмены НПВС этот эффект исчезал. В РКИ, проведенном в США (n = 1583) [9], авторы в целом не обнаружили клинически значимого влияния ХС и глюкозамина на показатели боли (эффект считался клинически значимым при снижении уровня боли на 20 %) по сравнению с плацебо. Однако комбинированное применение ХС и глюкозамина лицами с умеренными и выраженными болями оказалось более эффективным по сравнению с плацебо (79,2 против 54,3 % соответственно; р = 0,002).
Недостаточная эффективность применения ХС может быть обусловлена различными причинами: особенностью самого препарата, его химической структурой, степенью очистки, способом введения препарата, а также активностью заболевания и степенью деструктивных изменений в суставе.
Следует отметить, что ХС обладает высоким профилем безопасности. Ни в одном из проведенных клинических исследований не было выявлено каких-либо значимых побочных эффектов, в т. ч. и при длительном применении. EULAR рассматривает ХС в качестве одного из самых безопасных лекарственных препаратов терапии ОА. При использовании внутримышечных форм отмечено увеличение числа локальных побочных эффектов по сравнению с пероральными. В нашем исследовании в 8 (11 %) случаях были выявлены небольшие гематомы в месте введения препарата, что указано в инструкции по применению Хондрогарда; кожный зуд; папулезная сыпь — в 4 (6 %); болезненные уплотнения в месте инъекции — в 2 (3 %); чувство жара после инъекции — в 1 (1 %); тошнота, диарея — в 1 (1 %) случае. Серьезные НЯ отсутствовали.
Таким образом, препарат Хондрогард, представляющий собой раствор ХС натрия для внутримышечного применения, обладает достоверным симптоматическим эффектом, уменьшая боль, скованность и улучшая функциональные показатели. Преимущество препарата состоит в быстром наступлении эффекта при внутримышечном применении, возможности отмены или снижения дозы НПВС на фоне лечения и хорошей переносимости. Препарат Хондрогард может быть рекомендован в качестве терапии лицам, страдающим ОА, как первое средство, дающее более быстрый эффект с последующей заменой его на пероральные формы.
ЛИТЕРАТУРА
1. Lane NE, Brandt K, Hawker G и соавт. OARSIFDA initiative: defining the disease state of osteoarthritis. Osteoarthritis Cartilage 2011;19(5):478-82.
2. Клинические рекомендации. Ревматология / Под ред. Е.Л. Насонова. М., 2010. 326 с.
3. Zhang W, Nuki G, Moskowitz RW, et al. OARSI recommendations for the Management of hip and knee osteoarthritis Part III: changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage 2010;18(4): 476-99.
4. Hochberg MC, Altman RD, April KT, et al. American college of Rheumatology 2012 Recommendations for the Use of Nonpharmacologic and Pharmacologic Therapies in Osteoarthritis of the Hand, Hip and Knee. Arthritis Care & Res 2012;64(4):465-74.
5. Клинические рекомендации. Ревматология / Под ред. Е.Л. Насонова. М.,2010. 329 с.
6. Leeb BF, Schweitzer H, Montag K, et al. A metaanalysis of chondroitin sulfate in the treatment of osteoarthritis. J Rheumatol 2000;27(1): 205-11.
7. McAlindon TE, LaValley MP, Gulin JP, Felson DT. Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and meta-analysis. JAMA 2000;283(11):1469-75.
8. Reichenbach S, Sterchi R, Scherer M, et al. Meta-analysis: chondroitin for osteoarthritis of the knee or hip. Ann Intern Med 2007;146(8): 580-90.
9. Clegg DO, Reda DJ, Harris CL, et al. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N Engl J Med 2006;354(8):795-808.
10. Volpi N, ed. Chondroitin sulfate: structure, role and pharmacological activity. Amsterdam: Academic Press, 2006.
11. Fuentes EP, Diaz VB. Oligosaccharide mapping of chondroitin sulfate obtained from different animal sources. Acta Farm Bonaerense 1998;17:135-42.
12. Luo XM, et al. Chicken keel cartilage as a source of chondroitin sulfate. Poult Sci 2002;81: 1086-89.
13. Sugahara K, et al. Structural analysis of unsaturated hexasaccharides isolated from shark cartilage chondroitin sulfate D that are substrates for the exolytic action of chondroitin ABC lyase. Eur J Biochem 1996;239:871-80.
14. Lignot B, Lahogue V, Bourseau P. Enzymatic extraction of chondroitin sulfate from skate cartilage and concentration-desalting by ultra filtration. J Biotechnol 2003;103:281-84.
15. Volpi N. Quality of different chondroitin sulfate preparations in relation to their therapeutic activity. J Pharm Pharmacol 2009;61(10): 1271-80.
16. Volpi N. Oral absorption and bioavailability of ichthyic origin chondroitin sulfate in healthy male volunteers. Osteoarthritis Cartilage 2003;11(6):433-41.
17. Volpi N. Oral bioavailability of chondroitin sulfate (Condrosulf) and its constituents in healthy male volunteers. Osteoarthritis Cartilage 2002;10(10):768-77.
18. Ronca F, Palmieri L, Panicucci P, Ronca G. Antiinflammatory activity of chondroitin sulfate. Osteoarthritis Cartilage 1998;6 Suppl A:14-21.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)

