Выбор описания
| Лек. форма | Дозировка |
|---|---|
|
таблетки |
500 МЕ 1000 МЕ |
|
таблетки быстрорастворимые |
2000 МЕ 5000 МЕ |
таблетки быстрорастворимые
Витамин D3 (таблетки, 500 МЕ), листок-вкладыш для РУ № ЛП-№(000108)-(РГ-RU)
Дата последнего изменения: 30.12.2020
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Что из себя представляет препарат, и для чего его применяют
- О чем следует знать перед приемом препарата
- Прием препарата
- Возможные нежелательные реакции
- Хранение препарата
- Содержимое упаковки и прочие сведения
- Производитель
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Что из себя представляет препарат, и для чего его применяют
Препарат
Витамин D3 содержит действующее вещество — колекальциферол. Относится к
фармакотерапевтической группе «витамин D и его аналоги», играет важную
роль в регуляции кальциево-фосфорного обмена.
Действующее
вещество препарата идентично колекальциферолу, который образуется в организме
человека. Витамин D поступает с пищей, а также вырабатывается в коже после
пребывания на солнце. Дефицит витамина В может возникнуть, когда Ваш
рацион питания или образ жизни не обеспечивают Вас достаточным количеством
витамина D, или когда Вашему организму требуется больше витамина D.
Показания к применению
—
Профилактика
дефицита витамина D у взрослых, детей и подростков в возрасте от 6 до 18 лет с
выявленным высоким риском дефицита.
—
Лечение дефицита
витамина D у взрослых и подростков в возрасте от 12 до 18 лет.
—
В комплексной
терапии остеопороза у взрослых, в том числе менопаузального, с дефицитом
витамина D или выявленным высоким риском дефицита.
О чем следует знать перед приемом препарата
Противопоказания
Не принимайте препарат Витамин D3, если у Вас:
—
имеется аллергия
на витамин D (колекальциферол) или на другие компоненты данного препарата
(перечислены в разделе 6 листка-вкладыша);
—
высокое
содержание кальция в крови (гиперкальциемия) и/или в моче (гиперкальциурия);
—
нарушение
функции почек тяжелой степени;
—
высокое
содержание витамина D в крови (гипервитаминоз витамина D);
—
имеются камни в
почках или отложения кальция в почках (нефролитиаз или нефрокальциноз).
Если
любое из перечисленных утверждений относится к Вам, обязательно сообщите об
этом врачу.
Особые указания и меры предосторожности
Перед
началом приема препарата Витамин D3 проконсультируйтесь с лечащим врачом
или работником аптеки.
Риск
повышения содержания кальция в крови и/или моче (гиперкальциемия и/или
гиперкальциурия) может возрастать в том случае, если:
—
у Вас имеется
заболевание почек легкой или средней степени тяжести;
—
у Вас имеется
тенденция к образованию кальцийсодержащих камней в почках;
—
у Вас имеется
нарушение выведения кальция и фосфатов почками;
—
Вы принимаете
тиазидные диуретики (препараты, способствующие увеличению количества выделяемой
мочи) или производные бензотиадиазина;
—
Вы прикованы к
постели (иммобилизованы);
—
у Вас имеется
саркоидоз (нарушения иммунной системы, которые могут влиять на печень, легкие,
кожу и лимфатические узлы), так как действие препарата Витамин D3 может
быть слишком сильным.
Повышение
уровня кальция в плазме крови и моче может приводить к избыточному накоплению
кальция в организме, которое способствует образованию камней в почках и
ухудшению их функции, поэтому врач может назначить Вам определение содержания
кальция в плазме крови и моче во время лечения, чтобы убедиться, что он не
слишком высокий.
Вы
не должны принимать препарат Витамин D3 при наличии псевдогипопаратиреоза
(нарушение выделения паратиреоидного гормона). Возможен риск длительной
передозировки, так как с течением времени может измениться потребность в
витамине D. Врач может назначить другой лекарственный препарат с аналогичным
механизмом действия.
Вы
не должны принимать какие-либо другие лекарственные препараты или пищевые
добавки, содержащие витамин D или кальций, если врачом не указано иное. В таких
случаях врач может контролировать содержание кальция в крови и моче. Если Вы
уже принимаете другие лекарственные препараты, содержащие витамин D, сообщите
об этом лечащему врачу.
При
долгосрочной терапии препаратом Витамин D3 в суточных дозах, превышающих 1000 ME,
потребуется контроль содержания кальция в крови и моче, а также функции почек.
Это особенно важно, если Вы:
—
принимаете
сердечные гликозиды (лекарства, применяемые для лечения определенных нарушений
со стороны сердца) или диуретики (препараты, оказывающие действие на почки);
—
склонны к
образованию камней в почках;
—
относитесь к
старшей возрастной группе.
Если
содержание кальция в крови или моче увеличивается, или имеются какие-либо
признаки нарушения функции почек, врач может принять решение снизить дозу
препарата Витамин D3 или отменить его.
Не
следует превышать рекомендованную суточную дозу, поскольку возможна
передозировка.
Дети и подростки
Рекомендуется
соблюдать осторожность при применении у детей в возрасте от 6 до 12 лет,
поскольку они не всегда могут проглотить целую таблетку.
Другие препараты и препарат Витамин D3
Сообщите
лечащему врачу о том, что Вы принимаете, недавно принимали или планируете
начать принимать какие-либо другие препараты.
Нижеперечисленные
препараты могут ослаблять эффект витамина D:
—
фенитоин
(применяется для лечения эпилепсии);
—
барбитураты
(применяются для лечения бессонницы);
—
глюкокортикостероиды
(лекарственные средства с антиаллергическим, противовоспалительным и
иммуносупрессивным действием, например, преднизолон);
—
рифампицин или
изониазид (применяются в лечении туберкулеза);
—
колестирамин или
орлистат (применяются для снижения содержания липидов в крови);
—
слабительные
средства (применяются для лечения запора), например, вазелиновое масло.
В
подобных случаях Ваш врач должен принять решение о том, необходимо ли Вам
принимать препарат Витамин D3 в более высокой дозе, или о том, нужно ли
назначить Вам другие препараты.
При
одновременном применении препарата Витамин D3 с нижеперечисленными
лекарственными средствами следует соблюдать особую осторожность:
—
тиазидные
диуретики (препараты, способствующие увеличению количества выделяемой мочи),
например, гидрохлоротиазид, могут уменьшать выведение кальция почками и,
следовательно, приводить к повышению содержания кальция в крови. При
долгосрочной терапии необходимо контролировать содержания кальция в крови и
моче;
—
сердечные гликозиды
(применяются для лечения нарушений со стороны сердца), например, дигоксин,
могут увеличивать риск развития нарушения сердечного ритма (вызывать аритмию).
Врач будет контролировать содержания кальция в крови и моче, а также функцию
сердца с помощью электрокардиографии (ЭКГ). При необходимости также будет
проведен контроль концентрации препарата, применяемого в лечении заболеваний
сердца;
—
производные
витамина D (например, кальцитриол): одновременно применять препараты этой
группы с препаратом Витамин D3 следует только в исключительных случаях. В
таких ситуациях необходимо контролировать содержания кальция в крови;
—
антациды
(препараты, применяемые для лечения изжоги), содержащие алюминий: следует
избегать длительного применения этих препаратов в связи с возможным повышением
концентрации алюминия в крови;
—
антациды,
содержащие магний: следует избегать длительного применения этих препаратов в
связи с возможным повышением концентрации магния в крови;
—
одновременный
прием препарата Витамин D3 с лекарственными препаратами, содержащими
высокие дозы кальция или фосфора, может увеличивать риск повышения содержания
кальция в крови (гиперкальциемии).
Беременность и грудное вскармливание
Если
Вы беременны или кормите грудью, или думаете, что забеременели, или планируете беременность,
перед началом приема препарата проконсультируйтесь с лечащим врачом.
Беременность
Препарат
Витамин D3 следует принимать только по рекомендации врача.
Нет
известных рисков, связанных с приемом витамина D в рекомендуемых
дозах 500 ME
(12,5 мкг колекальциферола) в сутки. Вы не должны превышать назначенную
Вам дозу, так как передозировка витамина D может нанести
вред Вашему ребенку (риск физической и умственной отсталости, а также
заболеваний сердца и глаз).
Лактация
Колекальциферол
и его метаболиты проникают в грудное молоко; это необходимо учитывать, если Ваш
ребенок дополнительно получает витамин D.
Симптомы
передозировки у детей на грудном вскармливании, чьи матери получали
колекальциферол, не отмечались.
Управление транспортными средствами и работа с механизмами
Препарат
Витамин D3 не влияет или влияет в незначительной степени на способность к
управлению транспортными средствами и механизмами.
Препарат Витамин D3 содержит сахарозу,
натрий.
Сахароза
Если
у Вас непереносимость некоторых сахаров, обратитесь к лечащему врачу перед
приемом данного лекарственного препарата.
Натрий
1 таблетка
(500 ME
или 1000 ME)
содержит менее 1 ммоль натрия (23 мг), т. е., препарат Витамин D3
фактически не содержит натрия.
Прием препарата
Всегда
принимайте данный препарат в полном соответствии с данным листком-вкладышем или
с рекомендациями лечащего врача или работника аптеки. При появлении сомнений
посоветуйтесь с лечащим врачом или работником аптеки.
Рекомендованная доза
Применение у взрослых
Профилактика
дефицита витамина D у взрослых с выявленным высоким риском дефицита
Рекомендуемая суточная доза для взрослых, включая лиц пожилого возраста,
составляет от 500 ME до 1000 ME витамина D (12,5–25 мкг или
0,0125–0,025 мг колекальциферола). Это соответствует приему 1–2 таблеток
препарата Витамин D3 500 ME или 1 таблетки препарата Витамин D3
1000 ME в сутки.
Лечение дефицита витамина D у взрослых
По
данному показанию лечение должно проходить под наблюдением врача.
Дозу
следует определять в зависимости от тяжести заболевания, необходимой
концентрации 25‑гидроксиколекальциферола и индивидуального ответа
пациента на проводимую терапию.
Если
врач не назначил другую схему лечения, то обычно начальную терапию дефицита
витамина D у взрослых проводят в дозе 4000 ME в сутки в течение 6–12 недель,
а затем переходят к поддерживающей терапии в дозах 1500–2000 ME в сутки.
Режим дозирования, который следует соблюдать в подобных ситуациях, представлен
в таблицах ниже. Дозу колекальциферола должен определять лечащий врач с учетом
нижеуказанных правил дозирования.
Начальная терапия (от 6 до 12 недель)
|
Возрастная |
Суточная |
Доза |
|
|
Таблетки, |
Таблетки, |
||
|
Взрослые |
4000 |
8 |
4 |
Поддерживающая терапия
|
Возрастная |
Суточная |
Доза |
|
|
Таблетки, |
Таблетки, |
||
|
Взрослые |
1500–2000 ME витамина D (37,5–50 мкг или |
3-4 |
2 |
Комплексная терапия остеопороза у взрослых, в том числе
менопаузального, с дефицитом витамина D или выявленным высоким риском дефицита
Рекомендуемая
суточная доза составляет 1000 ME витамина D (25 мкг или 0,025 мг
колекальциферола), что соответствует приему 2 таблеток препарата Витамин D3 500 ME
или 1 таблетки препарата Витамин D3 1000 ME в сутки.
Применение у детей
Профилактика дефицита витамина D у детей и подростков в
возрасте от 6 до 18 лет с выявленным высоким риском дефицита
Рекомендуемая
суточная доза для детей и подростков в возрасте от 6 до 18 лет составляет
от 500 ME до 1000 ME витамина D (12,5–25 мкг или 0,0125–0,025 мг
колекальциферола). Это соответствует приему 1–2 таблеток препарата Витамин D3 500 ME
или 1 таблетки препарата Витамин D3 1000 ME в сутки.
Лечение дефицита витамина D у подростков в возрасте от 12 до
18 лет
По
данному показанию лечение должно проходить под наблюдением врача.
Дозу
следует определять в зависимости от тяжести заболевания, необходимой
концентрации 25‑гидроксиколекальциферола и индивидуального ответа
пациента на проводимую терапию.
Если
врач не назначил другую схему лечения, то обычно начальную терапию дефицита
витамина D у подростков в возрасте от 12 до 18 лет проводят в дозе
2000 ME в сутки в течение 6–12 недель, а затем переходят к
поддерживающей терапии в дозах 500–1000 ME в сутки. Режим дозирования,
который следует соблюдать в подобных ситуациях, представлен в таблицах ниже.
Дозу колекальциферола должен определять лечащий врач с учетом нижеуказанных
правил дозирования.
Начальная терапия (от 6 до 12 недель)
|
Возрастная |
Суточная |
Доза |
|
|
Таблетки, |
Таблетки, |
||
|
Подростки |
2000 ME витамина D (50 мкг или 0,05 мг |
4 таблетки |
2 таблетки |
Поддерживающая
терапия
|
Возрастная |
Суточная |
Доза |
|
|
Таблетки, |
Таблетки, |
||
|
Подростки |
500-1000 витамина |
1–2 |
1 |
Путь и/или способ введения
Внутрь.
Таблетку
следует принимать, запивая достаточным количеством воды, предпочтительно с
основным приемом пищи.
Если Вы приняли препарата Витамин D3 больше, чем
следовало
Если
вы случайно приняли несколько лишних таблеток, немедленно проконсультируйтесь с
врачом.
Симптомы
передозировки витамина D не являются специфическими: усталость, мышечная
слабость, потеря массы тела (анорексия), тошнота, рвота, запор, диарея,
полиурия, никтурия, повышенное потоотделение, головная боль, жажда, сонливость,
головокружение, адинамия, спутанность сознания. Может повышаться содержание
кальция в крови и моче. Возможна кальцификация мягких тканей, вызывающая
повреждение почек, кровеносных сосудов и сердца. Тяжелая интоксикация может
вызывать нерегулярное сердцебиение, чрезвычайно высокое содержание кальция в
крови может привести к коме и даже к смертельному исходу. Дети более
восприимчивы к токсическим эффектам витамина D.
Если Вы забыли принять препарат Витамин D3
Если
Вы забыли принять таблетки, примите их сразу, как только сможете, затем примите
следующую дозу в надлежащее время в соответствии с рекомендациями Вашего врача.
Однако если время приема следующей дозы почти наступило, не принимайте
пропущенную дозу, а продолжайте обычный прием.
Не
принимайте двойную дозу препарата, чтобы восполнить пропущенный прием таблетки.
При наличии вопросов по применению препарата Витамин D3
проконсультируйтесь с Вашим лечащим врачом.
Возможные нежелательные реакции
Подобно
всем лекарственным препаратам препарат Витамин D3 может вызывать
нежелательные реакции, однако они возникают не у всех.
Возможные
нежелательные реакции при приеме препарата Витамин D3 указаны в категории
встречаемости «частота неизвестна» (частоту их возникновения на основании
имеющихся данных определить невозможно):
—
боль в животе;
—
запор
(констипация);
—
скопление газов
в кишечнике (метеоризм);
—
тошнота;
—
диарея;
—
аллергические
реакции, такие как кожная сыпь, кожный зуд или крапивница;
—
высокое
содержание кальция в крови (гиперкальциемия);
—
высокое
содержание кальция в моче (гиперкальциурия).
Повышение
уровня кальция в плазме крови и моче может приводить к избыточному накоплению
кальция в организме, которое способствует образованию камней в почках и
ухудшению их функции, поэтому врач может назначить Вам определение содержания
кальция в плазме крови и моче во время лечения, чтобы убедиться, что он не
слишком высокий.
Сообщение о нежелательных реакциях
Если
у Вас возникли какие-либо нежелательные реакции, проконсультируйтесь с врачом
или работником аптеки. Данная рекомендация распространяется на любые возможные
нежелательные реакции, в том числе и на не перечисленные в данном
листке-вкладыше.
Вы
также можете сообщить о нежелательных реакциях напрямую через:
Pharmacovigilance.RU@krka.biz
Сообщая
о нежелательных реакциях. Вы помогаете получить больше сведений о безопасности
препарата.
Хранение препарата
Храните
препарат в недоступном для ребенка месте так, чтобы ребенок не мог увидеть его.
Не применяйте препарат по истечении срока годности (срока хранения), указанного
на упаковке, после слов «Годен до:…».
Датой
истечения срока годности является последний день данного месяца.
Хранить
при температуре не выше 25 °C,
в оригинальной упаковке (блистер).
Не
выбрасывайте препарат в водопровод или канализацию. Уточните у работника
аптеки, как следует уничтожить препарат, который больше не потребуется. Эти
меры позволят защитить окружающую среду.
Содержимое упаковки и прочие сведения
Препарат Витамин D3 содержит
Действующим
веществом препарата является колекальциферол.
Витамин D3, 500 ME, таблетки
Каждая
таблетка содержит 500 ME
колекальциферола, что соответствует 5 мг
колекальциферола концентрата (эквивалентно 0,0125 мг
колекальциферола).
Витамин D3, 1000 ME, таблетки
Каждая
таблетка содержит 1000 ME
колекальциферола, что соответствует 10 мг
колекальциферола концентрата (эквивалентно 0,025 мг
колекальциферола).
Прочими ингредиентами (вспомогательными веществами)
являются:
натрия
аскорбат, альфа-токоферол, крахмал модифицированный, сахароза, триглицериды
среднецепочечные, кремния диоксид коллоидный, безводный, маннитол,
карбоксиметилкрахмал натрия (тип А), крахмал кукурузный, целлюлоза
микрокристаллическая (тип 102), тальк, магния стеарат.
Внешний вид и содержимое упаковки
Препарат
Витамин D3, таблетки, 500 ME:
круглые,
слегка двояковыпуклые таблетки белого или почти белого цвета, с гравировкой «1
D» на одной стороне таблетки.
Препарат
Витамин D3, таблетки, 1000 ME:
круглые,
слегка двояковыпуклые таблетки белого или почти белого цвета, с гравировкой «2
D» на одной стороне таблетки.
По
10 таблеток в блистере из комбинированного материала ОПА/Ал/ПВХ и фольги
алюминиевой.
По
3, 6, 9 или 20 блистеров вместе с листком-вкладышем помещают в пачку картонную.
Производитель
Держатель регистрационного удостоверения и производитель
АО
«КРКА, д.д., Ново место» / KRKA, d.d., Novo mesto
Шмарьешка
цеста 6, 8501 Ново место, Словения / Smarjeska cesta 6, 8501 Novo mesto,
Slovenia
За
любой информацией о препарате, а также в случаях возникновения претензий
следует обращаться к представителю держателя регистрационного удостоверения
Россия
ООО
«КРКА-РУС»
143500,
Россия, Московская обл., г. Истра, ул. Московская, д. 50
Тел.:
+7 (495) 994-70-70
Факс:
+7 (495) 994-70-78
Адрес
эл. почты: krka-rus@krka.biz
Данный
листок-вкладыш пересмотрен
Прочие
источники информации
Подробные
сведения о лекарственном препарате содержатся на веб-сайте Союза:
http://www.eurasiancommission.org.
Дата обновления: 18.07.2023
Заказ в аптеках
Выбор региона:
| Название препарата | Цена за упак., руб. | Аптеки |
|---|---|---|
|
Витамин D3, таблетки, |
||
|
649.00 |
|
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Форма выпуска, состав и упаковка
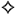
таб., покр. плен. оболоч., 8 мг+2.5 мг+10 мг: 30 шт.
Рег. №: 10936/21 от 02.04.2021 — Действующее
Таблетки, покрытые пленочной оболочкой светло-розового цвета, круглые, слегка двояковыпуклые,таблетки со скошенными краями и выгравированной отметкой PIR3 на одной стороне.
| 1 таб. | |
| периндоприла эрбумин | 8 мг |
| индапамид | 2.5 мг |
| розувастатин (в форме кальциевой соли) | 10 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая тип 200 низкой влажности, целлюлоза микрокристаллическая тип 112, кросповидон (тип A), кремния диоксид коллоидный безводный, магния стеарат.
Состав пленочной оболочки: смесь для покрытия (поливиниловый спирт, макрогол 3350, титана диоксид (Е171), тальк, железа оксид красный (Е172)).
10 шт. из ОПА/Ал/ПВХ пленки и алюминиевой фольги — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.
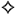
таб., покр. плен. оболоч., 8 мг+2.5 мг+20 мг: 30 шт.
Рег. №: 10936/21 от 02.04.2021 — Действующее
Таблетки, покрытые пленочной оболочкой бледного розовато-коричневого цвета, круглые, слегка двояковыпуклые,таблетки со скошенными краями и выгравированной отметкой PIR4 на одной стороне.
| 1 таб. | |
| периндоприла эрбумин | 8 мг |
| индапамид | 2.5 мг |
| розувастатин (в форме кальциевой соли) | 20 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая тип 200 низкой влажности, целлюлоза микрокристаллическая тип 112, кросповидон (тип A), кремния диоксид коллоидный безводный, магния стеарат.
Состав пленочной оболочки: смесь для покрытия (поливиниловый спирт, макрогол 3350, титана диоксид (Е171), тальк, железа оксид красный (Е172), железа оксид черный (Е172), железа оксид желтый (Е172)).
10 шт. из ОПА/Ал/ПВХ пленки и алюминиевой фольги — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.

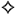
таб., покр. плен. оболоч., 4 мг+1.25 мг+10 мг: 30 шт.
Рег. №: 10936/21 от 02.04.2021 — Действующее
Таблетки, покрытые пленочной оболочкой красновато-коричневого цвета, круглые, слегка двояковыпуклые, со скошенными краями и выгравированной отметкой PIR1 на одной стороне.
| 1 таб. | |
| периндоприла эрбумин | 4 мг |
| индапамид | 1.25 мг |
| розувастатин (в форме кальциевой соли) | 10 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая тип 200 низкой влажности, целлюлоза микрокристаллическая тип 112, кросповидон (тип A), кремния диоксид коллоидный безводный, магния стеарат.
Состав пленочной оболочки: смесь для покрытия (поливиниловый спирт, макрогол 3350, титана диоксид (Е171), тальк, железа оксид красный (Е172), железа оксид черный (Е172), железа оксид желтый (Е172))
10 шт. из ОПА/Ал/ПВХ пленки и алюминиевой фольги — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.
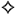
таб., покр. плен. оболоч., 4 мг+1.25 мг+20 мг: 30 шт.
Рег. №: 10936/21 от 02.04.2021 — Действующее
Таблетки, покрытые пленочной оболочкой розового с сероватым оттенком цвета, круглые, слегка двояковыпуклые,со скошенными краями и выгравированной отметкой PIR2 на одной стороне.
| 1 таб. | |
| периндоприла эрбумин | 4 мг |
| индапамид | 1.25 мг |
| розувастатин (в форме кальциевой соли) | 20 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая тип 200 низкой влажности, целлюлоза микрокристаллическая тип 112, кросповидон (тип A), кремния диоксид коллоидный безводный, магния стеарат.
Состав пленочной оболочки: смесь для покрытия (поливиниловый спирт, макрогол 3350, титана диоксид (Е171), тальк, железа оксид красный (Е172), железа оксид черный (Е172), железа оксид желтый (Е172)).
10 шт. из ОПА/Ал/ПВХ пленки и алюминиевой фольги — блистеры ОПA/Al/ПВХ пленка и алюминиевая фольга (3) — коробки картонные.
Описание лекарственного препарата РОКСАТЕНЗ-ИНДА основано на официально утвержденной инструкции по применению препарата и сделано в 2023 году. Дата обновления: 10.02.2023 г.
Фармакологическое действие
Препарат Роксатенз-инда представляет собой комбинацию соли периндоприла трет-бутиламина, ингибитора ангиотензинпревращающего фермента, индапамида, хлорсульфамоилового диуретика и розувастатина, селективного и конкурентного ингибитора ГМГ-КоА-редуктазы. Его фармакологическое действие основано на свойствах каждого из компонентов в отдельности, в дополнение к свойствам, обусловленным аддитивным синергетическим действием периндоприла и индапамида
Механизм действия
Связанный с периндоприлом
Периндоприл — это ингибитор ангиотензин превращающего фермента (ингибитор АПФ), который превращает ангиотензин I в ангиотензин II, который относится к сосудосуживающим веществам; кроме того, фермент стимулирует секрецию альдостерона корой надпочечников и стимулирует распад брадикинина, относящегося к сосудорасширяющим веществам, до неактивных гептапептидов.
Это приводит к:
— снижению секреции альдостерона,
— повышению активности ренина в плазме из-за снижения влияния альдостерона на отрицательную обратную связь,
— снижению общего периферического сопротивления с преимущественным действием на сосудистое русло в мышцах и почках, без сопутствующей задержки воды и солей или рефлекторной тахикардии при постоянном лечении.
Антигипертензивное действие периндоприла также проявляется у пациентов с низкой или нормальной концентрацией ренина.
Периндоприл действует посредством активного метаболита, периндоприлата. Другие метаболиты неактивны.
Периндоприл снижает нагрузку на сердце:
— путем сосудорасширяющего действия на вены, возможно вызванного изменением метаболизма простагландинов: снижение преднагрузки,
— путем уменьшения общего периферического сопротивления: снижение постнагрузки.
Исследования, проведенные на пациентах с сердечной недостаточностью, выявили:
— уменьшение давления наполнения левого и правого желудочка;
— уменьшение общего периферического сосудистого сопротивления;
— увеличение сердечного выброса и улучшение индекса работы сердца;
— увеличение регионарного кровотока в мышце.
Результаты теста на физическую нагрузку также показывали улучшение.
Связанный с индапамидом
Индапамид это производное сульфамида с индольным кольцом, фармакологически относящийся к группе тиазидных диуретиков. Индапамид ингибирует реабсорбцию натрия в кортикальном сегменте. Он повышает экскрецию натрия и хлоридов с мочой и, по меньшей мере, экскрецию калия и магния, тем самым повышает диурез и обладает антигипертензивным действием.
Связанный с розувастатином
Розувастатин является селективным и конкурентным ингибитором ГМГ-КоА-редуктазы, скорость-лимитирующего фермента, который преобразует 3-гидрокси-3-метилглутарил кофермент А в мевалонат, прекурсор холестерина. Основным местом действия розувастатина является печень, являющаяся органом-мишенью для снижения уровня холестерина.
Розувастатин повышает количество печеночных рецепторов ЛПНП на поверхности клетки, усиливая поглощение и катаболизм ЛПНП, и подавляет печеночный синтез ЛПОНП, тем самым уменьшая общее число частиц ЛПОНП и ЛПНП.
Фармакодинамическое действие
Связанное с комбинацией периндоприла и индапамида
У пациентов, имеющих повышенное артериальное давление независимо от возраста, препарат оказывает дозозависимое антигипертензивное действие на диастолическое и систолическое артериальное давление и в положении лежа на спине и в положении стоя.
Это антигипертензивное действие продолжается в течение 24 часов. Снижение артериального давления достигается менее, чем за один месяц без тахифилаксии. Прекращение лечения не вызывает синдрома отмены. Во время клинических исследований одновременное назначение периндоприла и индапамида вызывало антигипертензивный эффект синергетической природы относительно каждого препарата, назначенного отдельно.
PICXEL, многоцентровое, рандомизированное, двойное слепое, активно контролируемое исследование, в котором оценивалось по данным эхокардиографии действие комбинации периндоприла/индапамида на ГЛЖ в сравнении с монотерапией эналаприлом.
В PICXEL, пациенты, имеющие повышенное артериальное давление с ГЛЖ (определяемая как индекс массы левого желудочка (ИМЛЖ) > 120 г/м2 у мужчин и > 100 г/м2 у женщин) были рандомизированы либо для лечения периндоприлом 2 мг/индапамидом 0.625 мг или для лечения эналаприлом 10 мг один раз в день в течение одного года. Дозировка подбиралась согласно контролю артериального давления до 8 мг периндоприла и 2.5 мг индапамида или до 40 мг эналаприла один раз в день. Только 34% лиц продолжили лечение периндоприлом 2 мг/индапамидом 0.625 мг (в сравнении 20% эналаприлом 10 мг).
В конце лечения ИМЛЖ уменьшился значительно больше в группе периндоприла/индапамида (-10.1 г/м2) чем в группе эналаприла (-1.1 г/м2) во всех рандомизированных группах пациентов. Разница в изменении ИМЛЖ между группами была -8.3 (95% CI (-11.5, -5.0), p <0.0001).
Лучший эффект на ИМЛЖ был достигнут с периндоприл 8 мг/ индапамид 2.5 мг.
Относительно артериального давления, оцененные средние межгрупповые различия у рандомизированных групп составили -5.8 мм. рт. ст. (95% CI (-7.9, -3.7), p <0.0001) для систолического артериального давления и -2.3 мм. рт. ст. (95% CI (-3.6, -0.9), p = 0.0004) для диастолического артериального давления соответственно, предпочтительно в группе периндоприла/индапамида.
Фармакодинамическое действие, связанное с периндоприлом
Периндоприл активен на всех стадиях гипертензии: легкой, умеренной, или тяжелой. Снижение систолического и диастолического артериального давления наблюдается и в положении лежа и в положении сидя. Антигипертензивная активность после однократной дозы максимальна от 4 до 6 часов и сохраняется в течение 24 часов. Высокая степень остаточного блокирования ангиотензин превращающего фермента через 24 часа составляет приблизительно 80%. У чувствительных пациентов нормальное артериальное давление достигается после месяца лечения и поддерживается без тахифилаксии.
Прекращение приема препарата не вызывает синдрома отмены.
Периндоприл обладает сосудорасширяющими свойствами и восстанавливает эластичность основных артериальных стволов, корректирует гистоморфометрические изменения сопротивляемости артерий и вызывает уменьшение гипертрофии левого желудочка. При необходимости дополнение тиазидным диуретиком приводит к дополнительному синергизму.
Комбинация ингибитора ангиотензин превращающего фермента с тиазидным диуретиком снижает риск развития гипокалиемии связанного с приемом диуретика отдельно.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС).
Данные клинических исследований
Два крупных рандомизированных контролируемых исследования (ONTARGET (Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) и VA NEPHRON-D (The Veterans Affairs Nephropathy in Diabetes)) изучили использование ингибиторов АПФ в комбинации с блокаторами рецепторов ангиотензина II.
Исследование ONTARGET было проведено с участием пациентов, страдающих сердечно-сосудистыми заболеваниям и заболеваниями сосудов головного мозга, или сахарным диабетом 2 типа, сопровождавшихся признаками повреждения органов — мишеней.
VA NEPHRON-D исследование было проведено с участием пациентов, страдающих сахарным диабетом 2 типа и диабетической нефропатией.
По сравнению с монотерапией эти исследования не показали значимого положительного влияния на функции почек и/или исход сердечно-сусудистых заболеваний и смертность, в то время как наблюдался повышенный риск гиперкалиемии, острой почечной недостаточности и/или гипотонии. В связи с аналогичными фармакодинамическими свойствами эти результаты имеют отношение и к другим иАПФ и блокаторам рецепторов ангиотензина II.
Поэтому иАПФ и блокаторы рецепторов ангиотензина II не должны одновременно использоваться у больных диабетической нефропатией.
ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints) исследование было предназначено для выявления преимуществ добавления алискирена к стандартной терапии иАПФ или к блокаторам рецепторов ангиотензина II у пациентов с сахарным диабетом 2 типа, хронической почечной недостаточностью, сердечно-сосудистыми заболеваниями. Исследование было прекращено досрочно из-за повышенного риска неблагоприятных исходов. Инсульт и смертность от сердечно-сосудистых заболеваний наблюдались чаще в группе пациентов, принимавших алискирен, чем в группе плацебо. Также в группе, принимавшей алискирен, чаще наблюдались нежелательные побочные реакции (гиперкалиемия, гипотензия, почечная дисфункция).
Фармакодинамическое действие, связанное с индапамидом
Индапамид в форме монотерапии оказывает антигипертензивный эффект, который длится в течение 24 часов. Этот эффект возникает в дозе, при которой диуретическая активность минимальна.
Его антигипертензивное действие пропорционально улучшениям эластичности артерий и снижению общего периферического сосудистого сопротивления артериол. Индапамид уменьшает гипертрофию левого желудочка.
При превышении дозировки тиазидного или тиазидоподобного диуретика антигипертензивный эффект достигает плато, в то время как побочные эффекты препарата продолжают возрастать. Если лечение не эффективно дозировка не должна повышаться.
Кроме того, было показано, что при кратком, умеренном и длительном лечении индапамид не оказывает эффекта на метаболизм липидов: триглицеридов, холестерина ЛПНП и холестерина ЛПВП, не оказывает эффекта на метаболизм углеводов, даже у пациентов с гипертензией и сахарным диабетом.
Фармакодинамическое действие, связанное с розувастатином
Розувастатин снижает повышенный уровень холестерина ЛПНП, общий холестерин и триглицериды и повышает холестерин ЛПВП. Он также снижает уровень аполипопротеина B (АпоB), холестерина не-ЛПВП (ХС не-ЛПВП), холестерина ЛПОНП (ХС ЛПОНП), триглицеридов ЛПОНП (ТГ ЛПОНП) и увеличивает уровень аполипопротеина А1 (АпоA-I) (см. Таблицу ниже). Кроме того, розувастатин снижает соотношение ХС ЛПНП/ХС ЛПВП, общий ХС/ХС ЛПВП и ХС не-ЛПВП/ХС ЛПВП, а также АпоB/АпоA-I.
Таблица: Зависимость «доза–эффект» у пациентов с первичной гиперхолестеринемией (типа IIa и IIb) (скорректированное среднее процентное изменение по сравнению с исходным значением)
| Плацебо | Доза 5 мг | Доза10 мг | Доза 20 мг | Доза 40 мг | |
| Количество пациентов | 13 | 17 | 17 | 17 | 18 |
| Хс-ЛПНП | -7 | -45 | -52 | -55 | -63 |
| Общий Хс | -5 | -33 | -36 | -40 | -46 |
| Хс-ЛПВП | 3 | 13 | 14 | 8 | 10 |
| ТГ | -3 | -35 | -10 | -23 | -28 |
| Хс-неЛПВП | -7 | -44 | -48 | -51 | -60 |
| АпоВ | -3 | -38 | -42 | -46 | -54 |
| АпоА-I | 0 | 4 | 4 | 5 | 0 |
Терапевтический эффект достигается в течение одной недели после начала лечения, при этом 90% максимальной величины отклика наблюдается через 2 недели. Как правило, максимальный эффект достигается спустя 4 недели и в дальнейшем поддерживается.
Розувастатин эффективен у взрослых субъектов с гиперхолестеринемией, в сопровождении гипертриглицеридемии или без таковой, независимо от расы, пола или возраста, а также в особых группах пациентов (например, страдающих сахарным диабетом) или у пациентов с семейной гиперхолестеринемией.
Согласно объединенным данным из исследований фазы III, розувастатин продемонстрировал эффективность при лечении большинства пациентов с гиперхолестеринемией типа IIa и IIb (среднее исходное значение ХС ЛПНП составляло приблизительно 4.8 ммоль/л) вплоть до достижения общепризнанных целевых уровней, рекомендованных Европейским обществом по изучению атеросклероза (EAS; 1998); приблизительно 80% пациентов, получавших лечение с помощью дозы 10 мг, достигли целевых значений EAS, установленных в отношении уровня ХС ЛПНП (< 3 ммоль/л).
В рамках крупного исследования 435 пациентов с гетерозиготной семейной гиперхолестеринемией получали розувастатин в дозе от 20 мг до 80 мг по схеме принудительного подбора дозы. В случае всех доз было продемонстрировано благоприятное влияние на липидные параметры и на целевые показатели, предусмотренные стратегией «treatment to target» (корректировка лечения по мере необходимости для достижения поставленной терапевтической цели). После увеличения суточной дозы до 40 мг (12 недель лечения) уровень ХС ЛПНП снизился на 53%. 33% пациентов достигли целевого уровня ХС ЛПНП, рекомендованного EAS (< 3 ммоль/л).
В открытом исследовании с принудительным подбором дозы проводилась оценка отклика 42 пациентов с гомозиготной семейной гиперхолестеринемией на терапию розувастатином в дозе 20-40 мг. Среднее снижение уровня ХС ЛПНП в пределах общей популяции пациентов составило 22%.
В клинических исследованиях с участием небольшого количества пациентов розувастатин продемонстрировал аддитивную эффективность в снижении уровня триглицеридов при применении в комбинации с фенофибратом и в увеличении уровня ХС ЛПВП при применении в комбинации с ниацином (см. раздел «Особые указания»).
В многоцентровом двойном слепом плацебо-контролируемом клиническом исследовании (METEOR) 984 пациента в возрасте от 45 до 70 лет с низким риском развития ишемической болезни сердца (определен как риск по Фрамингемской шкале, составляющий 10% в ближайшие 10 лет), со средним уровнем ХС ЛПНП 4.0 ммоль/л (154.5 мг/дл), однако с субклиническим атеросклерозом (выявлен по показателю толщины интимо-медиального комплекса сонных артерий (CIMT)), были рандомизированы на получение 40 мг розувастатина один раз в сутки либо на получение плацебо в течение 2 лет. Розувастатин значительно замедлил скорость прогрессирования максимального значения CIMT для 12 участков сонных артерий по сравнению с плацебо на -0.0145 мм/год [95% доверительный интервал -0.0196, -0.0093; p <0.0001]. Изменение по сравнению с исходным значением составило -0.0014 мм/год (-0.12%/год (незначимое)) в группе, получавшей розувастатин, и +0.0131 мм/год (1.12%/год (p <0.0001)) в группе, получавшей плацебо. Какая-либо прямая взаимосвязь между снижением CIMT и уменьшением риска развития сердечно-сосудистых явлений так и не была продемонстрирована. Популяция, изучавшаяся в исследовании METEOR, характеризуется низким риском развития ишемической болезни сердца и не является репрезентативной по отношению к целевой популяции пациентов, которым показано лечение розувастатином в дозе 40 мг. Дозу 40 мг следует назначать лишь пациентам с тяжелой гиперхолестеринемией, которые находятся в группе высокого сердечно-сосудистого риска (см. раздел «Режим дозирования»).
В исследовании JUPITER (Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin [обоснование применения статинов для первичной профилактики: интервенционное исследование, направленное на оценку розувастатина]) с участием 17 802 мужчин (в возрасте ≥ 50 лет) и женщин (в возрасте ≥ 60 лет) проводилась оценка влияния розувастатина на частоту развития значительных осложнений, характерных для атеросклеротического сердечно-сосудистого заболевания.
Участники исследования были рандомизированы на получение плацебо (n = 8901) либо розувастатина 20 мг один раз в сутки (n = 8901); период последующего наблюдения в среднем составлял 2 года.
Уровень холестерина ЛПНП снизился на 45% (p <0.001) в группе, получавшей розувастатин, по сравнению с группой, получавшей плацебо.
В рамках апостериорного анализа подгруппы субъектов с высоким уровнем риска, у которых исходная оценка риска по Фрамингемской шкале составляла > 20% (1558 субъектов), наблюдалось значительное снижение показателя комбинированной конечной точки, включавшей смерть по причине сердечно-сосудистого заболевания, инсульт и инфаркт миокарда (p = 0.028), при лечении розувастатином по сравнению с плацебо. Абсолютное снижение риска для показателя частоты явлений на 1000 пациенто-лет составило 8.8. Показатель общей смертности в данной группе субъектов с высоким уровнем риска не изменился (p = 0.193). В рамках апостериорного анализа подгруппы субъектов с высоким уровнем риска (в целом 9302 субъекта), у которых исходная оценка риска по шкале SCORE составляла ≥5% (экстраполирована для включения субъектов в возрасте старше 65 лет), наблюдалось значительное снижение показателя комбинированной конечной точки, включавшей смерть по причине сердечно-сосудистого заболевания, инсульт и инфаркт миокарда (p = 0.0003), при лечении розувастатином по сравнению с плацебо. Абсолютное снижение риска для показателя частоты явлений составило 5.1 на 1000 пациенто-лет.
Показатель общей смертности в данной группе субъектов с высоким уровнем риска не изменился (p = 0.076).
В исследовании JUPITER 6.6% субъектов, получавших розувастатин, и 6.2% субъектов, получавших плацебо, досрочно прекратили лечение исследуемым препаратом по причине развития нежелательного явления. К наиболее частым нежелательным явлениям, которые привели к досрочному прекращению лечения, относились миалгия (0,3% розувастатин, 0.2% плацебо), боль в животе (0.03% розувастатин, 0.02% плацебо) и сыпь (0.02% розувастатин, 0.03% плацебо). К наиболее частым нежелательным явлениям, частота развития которых была не ниже, чем в группе, получавшей плацебо, относились инфекция мочевыводящих путей (8.7% розувастатин, 8.6% плацебо), назофарингит (7.6% розувастатин, 7.2% плацебо), боль в спине (7.6% розувастатин, 6.9% плацебо) и миалгия (7.6% розувастатин, 6.6% плацебо).
Использование в педиатрической популяции
Нет доступных данных относительно применения препарата Роксатенз-инда у детей.
Фармакокинетика
Связанные с периндоприлом
Всасывание и биодоступность
После приема внутрь периндоприл быстро всасывается и достигает пика концентрации в течение 1 часа. Период полувыведения составляет 1 час.
Распределение
Объем распределения составляет примерно 0.2 л/кг для несвязанного периндоприлата. Связывание белка периндоприлата с белками плазмы составляет 20%, в основном, с ангиотензинпревращающим ферментом, но зависит от концентрации.
Метаболизм
Периндоприл является пролекарством. 27% принятой дозы периндоприла достигает кровотока в виде активного метаболита периндоприлата. Кроме активного периндоприлата периндоприл образует пять неактивных метаболитов. Пик концентрации периндоприлата в плазме достигается через 3-4 часа.
Так как прием пищи уменьшает превращение периндоприла в периндоприлат, а, следовательно, и его биодоступность, то периндоприл терт-бутиламин рекомендуется принимать внутрь один раз в день утром до приема пищи.
Выведение
Периндоприлат выводится с мочой. Конечный период полувыведения несвязанной фракции составляет приблизительно 17 часов. Состояние равновесия достигается в течение 4 дней.
Линейность/нелинейность
Было показано, что связь между дозой периндоприла и его экспозицией в плазме является линейной.
Особые группы пациентов
Пожилые пациенты
Выведение периндоприлата снижено у пожилых лиц, а также у пациентов с сердечной или почечной недостаточностью.
Пациенты с нарушением функции почек
Подбор дозы пациентам с почечной недостаточностью зависит от степени нарушения почечной функции (клиренс креатинина). Диализный клиренс периндоприлата равен 70 мл/мин.
Пациенты с циррозом
Кинетика периндоприла меняется у пациентов с циррозом: печеночный клиренс исходной молекулы снижен наполовину. Однако количество образующегося периндоприлата не снижается и, следовательно, корректировка дозы не требуется (см. разделы «Режим дозирования» и «Особые указания»).
Связанные с индапамидом
Всасывание
Индапамид быстро и полностью всасывается из пищеварительного тракта. Максимальная концентрация (Cmax) в плазме у человека достигается приблизительно через один час после приема препарата перорально.
Распределение:
Связывание с белками плазмы составляет 79%.
Метаболизм и выведение
Период полувыведения включает в себя от 14 до 24 часов (в среднем 18 часов). Повторный прием препарата не приводит к его накоплению в организме. Выводится главным образом с мочой (70% дозы) и фекалиями (22%) в форме неактивных метаболитов.
Особые группы пациентов
Пациенты с нарушением функции почек
Фармакокинетика не изменяется у пациентов с почечной недостаточностью.
Связанные с розувастатином
Всасывание
Cmax розувастатина в плазме крови достигается спустя приблизительно 5 часов после перорального применения. Абсолютная биодоступность составляет приблизительно 20%.
Распределение
Розувастатин в значительной степени захватывается печенью, которая является основным участком синтеза холестерина и клиренса ХС ЛПНП. Объем распределения розувастатина составляет приблизительно 134 л. Приблизительно 90% розувастатина связано с белками плазмы, главным образом с альбумином.
Метаболизм
Розувастатин подвергается ограниченному метаболизму (приблизительно 10%). Исследования метаболизма in vitro с использованием гепатоцитов человека свидетельствуют о том, что розувастатин является непрофильным субстратом для метаболизма ферментами системы цитохрома P450. CYP2C9 являлся основным задействованным изоферментом, при этом изоферменты 2C19, 3A4 и 2D6 были вовлечены в меньшей степени. Главными идентифицированными метаболитами являются N-десметил и лактон. Метаболит N-десметил приблизительно на 50% менее активен, чем розувастатин, в то время как лактоновая форма считается клинически неактивной. На долю розувастатина приходится более 90% активности по ингибированию циркулирующей ГМГ-КоА-редуктазы.
Выведение
Приблизительно 90% дозы розувастатина выводится в неизмененном виде с калом (включает абсорбированное и неабсорбированное действующее вещество), а остальная часть выделяется с мочой. Приблизительно 5% дозы препарата выводится в неизмененном виде с мочой. Период полувыведения из плазмы составляет приблизительно 20 часов. Период полувыведения не увеличивается при использовании более высоких доз. Среднее геометрическое значение плазменного клиренса составляет приблизительно 50 л/ч (коэффициент вариации составляет 21.7%). Как и в случае других ингибиторов ГМГ-КоА-редуктазы, в захвате розувастатина печенью участвует мембранный транспортер OATP-C. Данный транспортный белок играет важную роль в выведении розувастатина печенью.
Линейность/нелинейность
Системная экспозиция розувастатина увеличивается пропорционально дозе. При применении препарата несколько раз в сутки какие-либо изменения фармакокинетических параметров не наблюдаются.
Возраст и пол
Не наблюдалось какое-либо клинически значимое влияние возраста и пола на фармакокинетику розувастатина у взрослых субъектов. Фармакокинетика розувастатина у детей и подростков с гетерозиготной семейной гиперхолестеринемией была аналогична или ниже таковой у взрослых добровольцев (см. подзаголовок «Педиатрическая популяция» ниже).
Раса
Фармакокинетические исследования показали приблизительно 2-кратное увеличение медианы AUC и Cmax среди субъектов монголоидной расы (японцы, китайцы, филиппинцы, вьетнамцы и корейцы) по сравнению с субъектами европеоидной расы; у индийцев наблюдается увеличение медианы AUC и Cmax приблизительно в 1.3 раза. На основании популяционного фармакокинетического анализа не были выявлены какие-либо клинически значимые различия в фармакокинетике между субъектами европеоидной расы и субъектами негроидной расы.
Пациенты с нарушением функции почек
В исследовании, в котором принимали участие субъекты с нарушением функции почек различной степени, нарушение функции почек легкой или умеренной степени не оказало какого-либо влияния на концентрацию розувастатина или его метаболита N-десметила в плазме крови. У субъектов с нарушением функции почек тяжелой степени (клиренс креатинина <30 мл/мин) концентрация розувастатина в плазме крови была в 3 раза выше, а метаболита N-десметила — в 9 раз выше, чем у здоровых добровольцев. Концентрации розувастатина в плазме крови в равновесном состоянии у гемодиализных субъектов были приблизительно на 50% выше по сравнению со здоровыми добровольцами.
Пациенты с нарушением функции печени
В исследовании, в котором принимали участие субъекты с нарушением функции печени различной степени, не было продемонстрировано какое-либо увеличение экспозиции розувастатина у субъектов с оценкой 7 или ниже по шкале Чайлда–Пью. Тем не менее, у двух субъектов с оценками 8 и 9 по шкале Чайлда–Пью наблюдалось увеличение системного воздействия не менее, чем в 2 раза по сравнению с субъектами с более низкими оценками по шкале Чайлда–Пью. Отсутствует какой-либо опыт применения препарата у пациентов с оценкой более 9 по шкале Чайлда–Пью.
Генетические полиморфизмы
В фармакокинетике ингибиторов ГМГ-КоА-редуктазы, включая розувастатин, участвуют белки-транспортеры OATP1B1 и BCRP. Для пациентов с генетическими полиморфизмами SLCO1B1 (OATP1B1) и (или) ABCG2 (BCRP) существует риск повышенной экспозиции розувастатина. Индивидуальные полиморфизмы SLCO1B1 c.521CC и ABCG2 c.421AA ассоциируются с более высокой экспозицией розувастатина (AUC) по сравнению с генотипами SLCO1B1 c.521TT или ABCG2 c.421CC. Данное специфическое генотипирование не является общепринятым в клинической практике, однако, для пациентов, у которых заведомо имеются данные конкретные типы полиморфизмов, рекомендуется назначать более низкую суточную дозу розувастатина.
Педиатрическая популяция
Фармакокинетические параметры в педиатрической популяции с гетерозиготной семейной гиперхолестеринемией в возрасте от 10 до 17 лет не изучены в полной мере. В рамках небольшого фармакокинетического исследования розувастатина (в форме таблеток) с участием 18 пациентов детского возраста было продемонстрировано, что экспозиция препарата у пациентов детского возраста сопоставима с экспозицией у взрослых пациентов. Кроме того, полученные результаты свидетельствуют о том, что какое-либо значительное отклонение от дозопропорциональной зависимости не ожидается.
Данные доклинической безопасности
Связанные с периндоприлом/индапамидом
Комбинация периндоприла и индапамида несколько повысила токсичность по сравнению с отдельными компонентами. У крыс увеличения почечной токсичности не наблюдалось, но комбинация вызывала желудочно-кишечную токсичность у собак. Токсическое воздействие на материнский организм, по-видимому, увеличивается у крыс (по сравнению с одним только периндоприлом).
Тем не менее, эти неблагоприятные эффекты проявились при введении доз с очень высокой границей безопасности, по сравнению с используемыми терапевтическими дозами.
Доклинические исследования отдельно с периндоприлом и индапамидом не подтвердили генотоксического, канцерогенного или тератогенного действия субстанций.
Связанные с розувастатином
На основании доклинических данных розувастатина, полученных в рамках традиционных исследований фармакологической безопасности, генотоксичности и канцерогенного потенциала, какие-либо особые риски для человека не выявлены. Какие-либо конкретные испытания с целью оценки воздействия на hERG (ген специфических калиевых каналов сердца) не проводились. Далее перечислены нежелательные реакции, которые отсутствовали в клинических исследованиях, однако наблюдались у животных при уровнях воздействия препарата, аналогичных таковым в клинических исследованиях: В исследованиях токсичности многократных доз гистопатологические изменения печени, вероятно, обусловленные фармакологическим действием розувастатина, наблюдались у мышей и крыс, а также, в меньшей степени, в желчном пузыре у собак, но не у обезьян. Кроме того, у обезьян и собак наблюдалась тестикулярная токсичность при использовании более высоких доз. Признаки репродуктивной токсичности наблюдались у крыс — отмечались сниженные показатели размера помета, массы помета и выживаемости потомства в случае использования доз, токсичных для материнского организма, при которых показатель системного воздействия был в несколько раз выше уровня терапевтического воздействия.
Показания к применению
— в качестве заместительной терапии у взрослых пациентов, состояние которых адекватно контролируется принимаемыми по отдельности периндоприлом, индапамидом и розувастатином в тех же дозах, что и в комбинации для лечения первичной артериальной гипертензии и одного из следующих сопутствующих состояний: первичная гиперхолестеринемия (тип IIa, включая гетерозиготную семейную гиперхолестеринемию), смешанная дислипидемия (тип IIb) или гомозиготная семейная гиперхолестеринемия.
Реклама
Режим дозирования
Режим дозирования
Рекомендуемая доза препарата Роксатенз-инда — 1 таблетка в день, которую желательно принимать утром перед едой.
Комбинированный препарат с фиксированными дозами не подходит для начальной терапии.
Перед переводом пациента на препарат Роксатенз-инда требуется достичь контроля состояния пациента с помощью стабильных доз отдельных компонентов, которые пациент получает одновременно. Доза препарата Роксатенз-инда должна быть основана на дозах отдельных компонентов комбинации на момент перевода.
Если по какой-либо причине требуется изменить дозу любого из действующих веществ комбинированного препарата (например, диагностировано новое связанное заболевание, наблюдается изменение состояния пациента либо имеет место взаимодействие лекарственных средств), следует вернуться к применению отдельных компонентов с целью определения подходящей дозы.
Особые группы пациентов
Пациенты пожилого и старческого возраста
Препарат назначают после оценки функции почек и реакции со стороны артериального давления.
Пациенты с нарушением функции почек
При нарушении функции почек тяжелой степени (клиренс креатинина ниже 30 мл/мин) лечение противопоказано. Препарат Роксатенз-инда не подходит для пациентов с клиренсом креатинина <60 мл/мин. Таким пациентам рекомендуется титрование доз отдельных компонентов на индивидуальной основе (см. раздел «Особые указания»).
У пациентов с клиренсом креатинина большим или равным 60 мл/мин коррекция дозы не требуется.
Обычное медицинское наблюдение включает частый мониторинг уровней креатинина и калия.
Пациенты с нарушением функции печени
При тяжелом нарушении функции печени лечение противопоказано.
Роксатенз-инда противопоказан пациентам с заболеваниями печени в стадии обострения (см. раздел «Противопоказания»).
Пациентам с нарушением функции печени умеренной степени изменение дозы не требуется.
Отсутствовало какое-либо увеличение системной экспозиции розувастатина у субъектов с оценкой 7 или ниже по шкале Чайлд–Пью. Тем не менее, повышенная экспозиция наблюдалась у субъектов с оценками 8 и 9 по шкале Чайлд–Пью (см. раздел «Фармакокинетика»). Для таких пациентов следует рассмотреть необходимость проведения оценки функции почек (см. раздел «Особые указания»). Отсутствует какой-либо опыт применения препарата у пациентов с оценкой более 9 по шкале Чайлд–Пью.
Раса
У азиатов наблюдалась повышенная экспозиция (см. разделы «Противопоказания», «Особые указания» и «Фармакокинетика»).
Генетические полиморфизмы
Известны конкретные типы генетических полиморфизмов, которые могут обуславливать повышение экспозиции розувастатина (см. раздел «Фармакокинетика»). Для пациентов, у которых заведомо имеются данные конкретные типы полиморфизмов, рекомендуется назначать более низкую суточную дозу розувастатина.
Сопутствующая терапия
Розувастатин является субстратом различных транспортных белков (например, OATP1B1 (полипептид, транспортирующий органические анионы 1B1) и BCRP (белок резистентности рака молочной железы)). Риск развития миопатии (включая рабдомиолиз) повышен в том случае, когда розувастатин вводится одновременно с определенными лекарственными средствами, которые могут вызвать увеличение концентрации розувастатина в плазме крови ввиду взаимодействия с данными транспортными белками (например, циклоспорин и определенные ингибиторы протеазы, в том числе комбинации ритонавира с атазанавиром, лопинавиром и (или) типранавиром; см. разделы «Особые указания» и «Лекарственное взаимодействие»). По мере возможности следует рассматривать вариант применения альтернативных лекарственных средств, а также, в случае необходимости, следует рассмотреть вариант временного прекращения терапии розувастатином. В случаях, когда применение данных лекарственных средств одновременно с розувастатином является неизбежным, следует провести тщательную оценку пользы/риска сопутствующей терапии, а также рассмотреть необходимость корректировки дозы розувастатина «Лекарственное взаимодействие»).
Педиатрическая популяция
Препарат Роксатенз-инда не следует назначать детям и подросткам, так как эффективность и переносимость препарата для данных категорий пациентов не установлены.
Способ применения
Для приема внутрь.
Побочные действия
Общая оценка безопасности
Чаще всего наблюдались следующие нежелательные реакции:
— связанные с периндоприлом: головокружение, головная боль, парестезия, дисгевзия, нарушения зрения, вертиго, звон в ушах, гипотензия, кашель, одышка, боль в животе, запор, диспепсия, диарея, тошнота, рвота, зуд, сыпь, мышечные судороги и астения.
— связанные с индапамидом: реакции повышенной чувствительности, в основном дерматологического характера, у пациентов с предрасположенностью к аллергическим и астматическим реакциям и макулопапулезная сыпь.
Нежелательные эффекты, которые могут возникнуть при лечении, классифицированы по частоте следующим образом: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000); очень редко (<1/10000); частота неизвестна (невозможно оценить на основании имеющихся данных).
Ниже представлено резюме нежелательных реакций
Класс системы органов MedDRA
Периндоприл:
Инфекции и инвазии: очень редко — ринит.
Нарушения со стороны крови и лимфатической системы: нечасто — эозинофилия*; очень редко — агранулоцитоз (см. раздел «Особые указания»), панцитопения, лейкопения, нейтропения (см. раздел «Особые указания»), гемолитическая анемия, тромбоцитопения (см. раздел «Особые указания»).
Нарушения со стороны обмена веществ и питания: нечасто* — гипогликемия (см. разделы «Особые указания» и «Лекарственное взаимодействие»), гиперкалиемия, обратимая при прекращении лечения (см. раздел «Особые указания»); гипонатриемия (см. раздел «Особые указания»).
Нарушения со стороны психики: нечасто — перепады настроения, нарушения сна; очень редко — спутанность сознания. Нарушения со стороны нервной системы: часто — головная боль, головокружение, дисгевзия, парестезии; нечасто* — сонливость, обморок; очень редко — инсульт, возможно вызванный чрезмерной гипотензией у пациентов группы высокого риска (см. раздел «Особые указания»).
Нарушения со стороны органа зрения: часто — нарушения зрения.
Нарушения со стороны органа слуха и лабиринтные нарушения: часто — вертиго, звон в ушах.
Нарушения со стороны сердца: нечасто* — сердцебиение, тахикардия; очень редко — стенокардия (см. раздел «Особые указания»), аритмия (в том числе брадикардия, желудочковая тахикардия, фибрилляция предсердий), инфаркт миокарда, возможно вызванный чрезмерной гипотензией у пациентов группы высокого риска (см. раздел «Особые указания»).
Нарушения со стороны сосудов: часто — гипотензия (и эффекты, связанные с гипотензией) (см. раздел «Особые указания»); нечасто* — васкулит; частота неизвестна — синдром Рейно.
Нарушения со стороны дыхательной системы: часто — кашель (см. раздел «Особые указания»), одышка; нечасто — бронхоспазм; очень редко — эозинофильная пневмония.
Нарушения со стороны желудочно-кишечного тракта: часто — боль в животе, запор, диспепсия, тошнота, диарея, рвота; нечасто — сухость во рту; очень редко — панкреатит.
Нарушения со стороны печени и желчевыводящих путей: очень редко — гепатит (см. раздел «Особые указания»).
Нарушения со стороны кожи и подкожных тканей: часто — сыпь, зуд; нечасто — крапивница (см. раздел «Особые указания»), ангионевротический отек (см. раздел «Особые указания»), гипергидроз, реакция фоточувствительности*, пемфигоид*; редко — обострение псориаза*; очень редко — мультиформная эритема.
Нарушения со стороны костно-мышечной системы: часто — мышечные судороги; нечасто* — миалгия, артралгия.
Нарушения со стороны почек и мочевыделительной системы: нечасто — почечная недостаточность; очень редко — острая почечная недостаточность.
Нарушения со стороны репродуктивной системы и молочной железы: нечасто — эректильная дисфункция.
Общие расстройства и нарушения в месте введения: часто — астения; нечасто* — боль в груди, недомогание, периферический отек, гипертермия.
Результаты лабораторных и инструментальных исследований: нечасто*— повышение концентрации мочевины в крови, повышение концентрации креатинина в крови; редко — повышение концентрации билирубина в крови, повышение активности ферментов печени; очень редко — снижение уровня гемоглобина и гематокрита (см. раздел «Особые указания»).
Травмы, отравления и осложнения процедуры: нечасто*— падение.
Индапамид:
Нарушения со стороны крови и лимфатической системы: очень редко — агранулоцитоз (см. раздел «Особые указания»), апластическая анемия, лейкопения, гемолитическая анемия, тромбоцитопения (см. раздел «Особые указания»).
Нарушения со стороны иммунной системы: часто — реакции гиперчувствительности (в основном дерматологического характера, у пациентов с предрасположенностью к аллергическим и астматическим реакциям).
Нарушения со стороны обмена веществ и питания: частота неизвестна — гипонатриемия (см. раздел «Особые указания»), снижение содержания калия с гипокалиемией, особенно значительное у групп с высоким риском (см. раздел «Особые указания»); очень редко — гиперкальциемия;
Нарушения со стороны нервной системы: редко — головная боль, парестезия; частота неизвестна — обморок, возможность развития печеночной энцефалопатии в случае печеночной недостаточности (см. разделы «Противопоказания» и «Особые указания»).
Нарушения со стороны органа зрения: частота неизвестна — нарушения зрения, миопия (см. раздел «Особые указания»), нечеткость зрения, хориоидальный выпот.
Нарушения со стороны органа слуха и лабиринтные нарушения: редко — вертиго.
Нарушения со стороны сердца: очень редко — аритмия (в том числе брадикардия, желудочковая тахикардия, фибрилляция предсердий); частота неизвестна — желудочковая тахикардия типа «пируэт» (потенциально летальная) (см. разделы «Лекарственное взаимодействие» и «Особые указания»).
Нарушения со стороны сосудов: очень редко — гипотензия (и эффекты, связанные с гипотензией) (см. раздел «Особые указания»).
Нарушения со стороны желудочно-кишечного тракта: редко — запор, тошнота, сухость во рту; нечасто — рвота; очень редко — панкреатит.
Нарушения со стороны печени и желчевыводящих путей: частота неизвестна — гепатит (см. раздел «Особые указания»); очень редко — нарушение функции печени.
Нарушения со стороны кожи и подкожных тканей: часто — макулопапуллезная сыпь; очень редко — крапивница (см. раздел «Особые указания»), ангионевротический отек «Особые указания»), токсический эпидермальный некролиз, синдром Стивенса-Джонсона; нечасто – пурпура; частота неизвестна – реакции светочувствительности.
Нарушения со стороны костно-мышечной системы: частота неизвестна — возможное ухудшение течения имеющейся острой диссеминированной волчанки.
Нарушения со стороны почек и мочевыделительной системы: очень редко — острая почечная недостаточность.
Общие расстройства и нарушения в месте введения: редко — усталость.
Результаты лабораторных и инструментальных исследований: частота неизвестна — повышение активности ферментов печени, повышение концентрации глюкозы в крови, повышение концентрации мочевой кислоты в крови, удлинение интервала QT на электрокардиограмме (см. разделы «Особые указания» и «Лекарственное взаимодействие»).
Розувастатин:
Нарушения со стороны крови и лимфатической системы: редко — тромбоцитопения (см. раздел «Особые указания»).
Нарушения со стороны иммунной системы: редко — реакции гиперчувствительности (в основном дерматологического характера, у пациентов с предрасположенностью к аллергическим и астматическим реакциям).
Нарушения со стороны эндокринной системы: часто — сахарный диабет1.
Нарушения со стороны психики: частота неизвестна — нарушения сна, депрессия.
Нарушения со стороны нервной системы: часто — головная боль, головокружение; частота неизвестна — периферическая невропатия; очень редко — полинейропатия, потеря памяти.
Нарушения со стороны дыхательной системы: частота неизвестна — кашель (см. раздел «Особые указания»), одышка.
Нарушения со стороны желудочно-кишечного тракта: часто — боль в животе, запор, тошнота; редко — панкреатит; частота неизвестна — диарея.
Нарушения со стороны печени и желчевыводящих путей: очень редко — гепатит (см. раздел «Особые указания»), желтуха..
Нарушения со стороны кожи и подкожных тканей: нечасто — кожная сыпь, зуд, крапивница (см. раздел «Особые указания»); частота неизвестна — синдром Стивенса-Джонсона, реакция на лекарственные препараты с эозинофилией и системными симптомами (DRESS).
Нарушения со стороны костно-мышечной системы: часто — миалгия (включая миозит); редко — миопатия, миозит, рабдомиолиз, волчаночный синдром, разрыв мышцы; очень редко — артралгия; частота неизвестна — нарушения со стороны сухожилий, иногда осложненные разрывом, иммуно-опосредованная некротизирующая миопатия (см. раздел «Особые указания»).
Нарушения со стороны почек и мочевыделительной системы: очень редко — гематурия.
Нарушения со стороны репродуктивной системы и молочной железы: очень редко — гинекомастия.
Общие расстройства и нарушения в месте введения: часто – астения; частота неизвестна — периферический отек.
Результаты лабораторных и инструментальных исследований: часто — повышение концентрации глюкозы в крови; редко — повышение активности ферментов печени.
* Оценка частоты нежелательных реакций, выявленных по спонтанным сообщениям, проведена на основании результатов клинических испытаний.
1 Частота зависит от наличия или отсутствия факторов риска (уровень глюкозы в крови натощак ≥5.6 ммоль/л, ИМТ > 30 кг/м2, повышенный уровень триглицеридов, гипертензия в анамнезе).
Были зарегистрированы случаи неадекватной секреции антидиуретического гормона (СНС АДГ) при приеме других ингибиторов АПФ. Таким образом, СНС АДГ можно рассматривать как очень редкое, но возможное осложнение, связанное с терапией ингибиторами АПФ, в том числе и периндоприлом.
Как и в случае других ингибиторов ГМГ-КоА-редуктазы, частота развития нежелательных лекарственных реакций, как правило, является дозозависимой.
Дополнительная информация, относящаяся к розувастатину
Описание выборочных нежелательных реакций
Влияние на почки: Протеинурия, выявленная с помощью тест-полоски и имеющая, главным образом, канальцевое происхождение, наблюдалась у пациентов, получавших лечение розувастатином. Изменение содержания белка в моче от отсутствия или наличия следов до значения ++ и выше наблюдалось у <1% пациентов в определенный момент лечения с помощью дозы 10 мг и 20 мг, а также приблизительно у 3% пациентов, получавших лечение с помощью дозы 40 мг. Незначительное увеличение частоты случаев изменения данного показателя от отсутствия или наличия следов до значения + наблюдалось при применении дозы 20 мг. В большинстве случаев степень выраженности протеинурии снижается либо протеинурия исчезает спонтанно при продолжении терапии. На основании анализа данных из клинических исследований и данных пострегистрационного применения, имеющихся к настоящему времени, не выявлена какая-либо причинно-следственная связь между протеинурией и острым или прогрессирующим заболеванием почек.
Гематурия наблюдалась у пациентов, получавших лечение розувастатином; данные клинических исследований свидетельствуют о том, что частота ее развития является низкой.
Влияние на скелетную мускулатуру
Сообщалось о развитии воздействия на скелетную мускулатуру (например, в виде таких явлений, как миалгия, миопатия (включая миозит) и, в редких случаях, рабдомиолиз) с или без острой почечной недостаточности у пациентов, получавших лечение всеми дозами розувастатина, особенно при использовании доз >20 мг.
Дозозависимое увеличение уровней креатинкиназы (КК) наблюдалось у пациентов, получавших лечение розувастатином; большинство случаев имело легкую степень выраженности, а также носило бессимптомный и временный характер. В случае если уровни креатинкиназы являются повышенными (> 5-кратного ВПН), лечение следует прекратить (см. раздел «Особые указания»).
Влияние на печень
Как и в случае других ингибиторов ГМГ-КоА-редуктазы, дозозависимое увеличение уровня трансаминаз наблюдалось у небольшого количества пациентов, получавших лечение розувастатином; большинство случаев имело легкую степень выраженности, а также носило бессимптомный и временный характер.
Сообщалось о случаях развития нижеуказанных нежелательных явлений при применении некоторых статинов:
— Нарушение половой функции.
— Единичные случаи интерстициального заболевания легких, особенно при длительной терапии (см. раздел «Особые указания»).
Частота предоставления сообщений о рабдомиолизе, серьезных явлениях со стороны почек и серьезных явлениях со стороны печени (главным образом о повышенном уровне печеночных трансаминаз) является более высокой в случае приема дозы 40 мг.
Педиатрическая популяция
В рамках 52-недельного клинического исследования увеличение уровня креатинкиназы до > 10-кратного ВПН и мышечные симптомы после физической нагрузки или повышенной физической активности наблюдались чаще у детей и подростков, нежели у взрослых (см. раздел «Особые указания»). В остальном профиль безопасности розувастатина у детей и подростков был аналогичен профилю безопасности у взрослых.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Просим медицинских работников сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях.
Противопоказания к применению
Связанные с периндоприлом
— гиперчувствительность к периндоприлу или любым другим ингибиторам АПФ;
— ангионевротический отек (отек Квинке), связанный с предшествующей терапией ингибиторами АПФ в анамнезе;
— наследственный или идиопатический ангионевротический отёк;
— второй и третий триместры беременности;
— совместный прием Роксатенз-инда с препаратами, содержащими алискирен, противопоказано у пациентов с сахарным диабетом или почечной недостаточностью (СКФ <60 мл/мин/1.73 м2) (см. разделы «Лекарственное взаимодействие» и «Фармакологическое действие»);
— совместный прием с препаратами сакубитрил/валсартан. Прием препарата Роксатенз-инда не должен начинаться ранее 36 часов после последней дозы сакубитрила/валсартана (см. также разделы «Лекарственное взаимодействие» и «Особые указания»);
— экстракорпоральная терапия, приводящая к контакту крови с отрицательно заряженными поверхностями (см. раздел «Лекарственное взаимодействие»);
— двусторонний обширный стеноз почечной артерии или стеноз почечной артерии одной функционирующей почки (см. раздел «Особые указания»).
Связанные с индапамидом
— гиперчувствительность к индапамиду или любым другим сульфонамидам;
— печеночная энцефалопатия;
— тяжелое нарушение функции печени;
— гипокалиемия;
— как правило, препарат не рекомендуется применять в комбинации с противоаритмическими средствами, вызывающими желудочковую тахикардию типа «пируэт» (см. раздел «Лекарственное взаимодействие»);
— период лактации (см. раздел «Беременность и лактация»).
Связанные с розувастатином
— гиперчувствительность к розувастатину;
— заболевание печени в активной фазе, включая необъяснимое и стойкое увеличение уровня трансаминаз в сыворотке крови, а также увеличение уровня любого показателя трансаминазы в сыворотке крови, значение которого более чем в 3 раза превышает верхний предел нормы (ВПН);
— миопатия;
— сопутствующее применение с софосбувиром/велпатасвиром/воксилапревиром «Лекарственное взаимодействие»);
— одновременное применение циклоспорина;
— период беременности и грудного вскармливания; препарат также противопоказан женщинам, способным к деторождению, которые не используют надлежащие методы контрацепции.
Связанные с препаратом Роксатенз-инда
— все противопоказания для каждого монокомпонента, как указано выше, должны относиться также к препарату Роксатенз-инда;
— гиперчувствительность к любому из вспомогательных веществ, указанных в разделе «Состав»);
— тяжелое нарушение функции почек (клиренс креатинина менее 30 мл/мин).
По причине отсутствия достаточного терапевтического опыта препарат Роксатенз-инда не следует использовать:
— пациентам, проходящим диализ;
— пациентам с декомпенсированной сердечной недостаточностью без лечения.
Применение при беременности и кормлении грудью
Роксатенз-инда противопоказан при беременности и грудном вскармливании.
Беременность
Применение ингибиторов АПФ не рекомендуется в первом триместре беременности (см. раздел «Особые указания»). Применение ингибиторов АПФ противопоказано во втором и третьем триместрах беременности (см. разделы «Противопоказания» и «Особые указания»).
Эпидемиологические данные о риске проявления тератогенности при приеме ингибиторов АПФ в первом триместре беременности не позволяют сделать окончательное заключение, однако некоторое повышение риска не исключается. Кроме тех случаев, когда невозможно произвести замену ингибиторов АПФ на иную альтернативную терапию, пациентки, планирующие беременность, должны быть переведены на терапию лекарственными средствами, у которых профиль безопасности для беременных женщин является хорошо изученным. При наступлении беременности прием ингибитора АПФ должен быть прекращен незамедлительно, и при необходимости назначена иная терапия. При применении ингибиторов АПФ во втором и третьем триместрах беременности установлено проявление фетотоксического действия (нарушение функции почек, олигогидроамниоз, задержка окостенения костей черепа) и неонатальной токсичности (почечная недостаточность, гипотензия, гиперкалиемия) (см. раздел «Данные доклинической безопасности»). В случае если прием ингибитора АПФ осуществлялся со второго триместра беременности, рекомендуется провести УЗИ функции почек и костей черепа плода. У новорожденных, матери которых принимали ингибиторы АПФ, необходимо тщательно контролировать АД для предотвращения возможного развития гипотензии (см. разделы «Противопоказания» и «Особые указания»).
Данные по применению индапамида у беременных женщин отсутствуют или ограничены (менее 300 исходов беременности). Продолжительный прием тиазидных диуретиков в третьем триместре беременности может привести к сокращению объема материнской плазмы, а также к уменьшению маточно-плацентарного кровотока, что может стать причиной фето-плацентарной ишемии и задержки роста плода. Исследования на животных не выявили прямого или косвенного вредного влияния в отношении репродуктивной токсичности (см. раздел «Данные доклинической безопасности»). В качестве меры предосторожности рекомендуется избегать применения индапамида во время беременности.
Женщины, способные к деторождению, должны использовать надлежащие методы контрацепции.
Поскольку холестерин и другие продукты биосинтеза холестерина необходимы для развития плода, потенциальный риск, связанный с ингибированием ГМГ-КоА-редуктазы, является более значительным, чем выгода подобного лечения во время беременности. В исследованиях на животных был получен ограниченный объем данных, свидетельствующих о репродуктивной токсичности (см. раздел «Данные доклинической безопасности»). В случае, если во время применения данного препарата пациентка забеременела, лечение следует немедленно прекратить.
Период грудного вскармливания
Роксатенз-инда противопоказан при грудном вскармливании.
Ввиду отсутствия информации о применении периндоприла в период лактации назначение препарата пациентам данной категории не рекомендовано; предпочтительными являются альтернативные виды лечения с установленным профилем безопасности применения во время кормления грудью, особенно новорожденных или недоношенных младенцев.
Данных о проникновении индапамида и его метаболитов в женское молоко недостаточно. Возможно возникновение повышенной чувствительности к производным сульфонамида и гипокалиемии. Нельзя исключить риск для новорожденных и младенцев. Индапамид тесно связан с тиазидными диуретиками, которые при грудном вскармливании ассоциировались со снижением или даже подавлением секреции молока. Может возникнуть гиперчувствительность к сульфонамидным препаратам, гипокалиемия и ядерная желтуха.
Розувастатин выделяется с грудным молоком у крыс. Отсутствуют какие-либо данные, касающиеся выделения препарата с грудным молоком у человека (см. раздел «Противопоказания»).
Фертильность
Общие указания для периндоприла и индапамида
В исследованиях репродуктивной токсичности выявлено отсутствие влияния на фертильность у самок и самцов крыс (см. раздел «Данные доклинической безопасности»). Влияние на фертильность у человека не предполагается.
Применение при нарушениях функции печени
При тяжелом нарушении функции печени лечение противопоказано.
Роксатенз-инда противопоказан пациентам с заболеваниями печени в стадии обострения (см. раздел «Противопоказания»).
Пациентам с нарушением функции печени умеренной степени изменение дозы не требуется.
Применение при нарушениях функции почек
При нарушении функции почек тяжелой степени (клиренс креатинина ниже 30 мл/мин) лечение противопоказано. Препарат Роксатенз-инда не подходит для пациентов с клиренсом креатинина <60 мл/мин. Таким пациентам рекомендуется титрование доз отдельных компонентов на индивидуальной основе (см. раздел «Особые указания» ).
У пациентов с клиренсом креатинина большим или равным 60 мл/мин коррекция дозы не требуется.
Обычное медицинское наблюдение включает частый мониторинг уровней креатинина и калия.
Особые указания
Литий
Обычно сочетание препаратов лития и комбинации периндоприла и индапамида не рекомендовано (см. раздел «Лекарственное взаимодействие»).
Нейтропения / агранулоцитоз / тромбоцитопения / анемия
У пациентов, получающих ингибиторы АПФ, возможны случаи развития нейтропении / агранулоцитоза / тромбоцитопении и анемии. У пациентов с нормальной функцией почек в отсутствие других осложнений нейтропения встречается редко. Периндоприл с предельной осторожностью следует назначать пациентам с коллагенозами, применяющим иммуносупрессивное лечение, лечение аллопуринолом или прокаинамидом или с комбинацией данных осложняющих факторов, особенно при уже существующих нарушениях почечной функции. У таких пациентов могут развиваться серьезные инфекции, которые в некоторых случаях не отвечают на интенсивную антибиотикотерапию. В случае назначения периндоприла таким пациентам рекомендовано периодически контролировать количество лейкоцитов; пациенты должны быть проинформированы о том, что при появлении каких-либо признаков инфекционного заболевания (боль в горле, лихорадка) необходимо немедленно обратиться к врачу (см. разделы «Лекарственное взаимодействие» и «Побочное действие»).
Вазоренальная гипертензия
У пациентов с двусторонним обширным стенозом почечной артерии или стенозом почечной артерии одной функционирующей почки, принимающих ингибиторы АПФ, риск гипотонии и почечной недостаточности повышается (см. раздел «Противопоказания»). Лечение диуретиками может быть одним из способствующих факторов. Снижение функции почек может проявляться в виде незначительных изменений количества креатинина в сыворотке крови, в том числе и у пациентов с односторонним стенозом почечной артерии.
Гиперчувствительность / ангионевротический отек
Известны случаи ангионевротического отека лица, конечностей, губ, языка, глотки и/или гортани у пациентов, проходивших лечение ингибиторами АПФ, включая периндоприл. Эти реакции могут наступить в любой момент терапии. В таких случаях следует немедленно прекратить прием препарата и установить соответствующий контроль состояния пациента до подтверждения полного исчезновения симптомов. В случаях, когда отек затрагивает только лицо и губы, его проявления обычно проходят без специального лечения, однако для облегчения симптомов можно применять антигистаминные препараты.
Ангионевротический отек, сопровождающийся отеком гортани, может привести к летальному исходу. Отек языка, глотки или гортани может привести к обструкции дыхательных путей. В таком случае должна быть незамедлительно назначена соответствующая терапия, которая может включать подкожное введение раствора эпинефрина 1:1000 (0.3 мл — 0.5 мл) и/или меры для обеспечения проходимости дыхательных путей.
Установлена более высокая частота встречаемости ангионевротического отека у чернокожих пациентов, получающих ингибиторы АПФ.
У пациентов с ангионевротическим отеком в анамнезе, который не связан с терапией ингибиторами АПФ, может быть повышен риск развития ангионевротического отека во время приема препаратов этой группы (см. раздел «Противопоказания»).
Редко сообщалось о развитии ангионевротического отека кишечника у пациентов, принимающих ингибиторы АПФ. У этих пациентов наблюдалась боль в животе (как изолированный симптом или в сочетании с тошнотой и рвотой); в некоторых случаях не было предшествующего отека лица, и уровень С1-эстеразы был в норме. Данный ангионевротический отек был диагностирован с помощью КТ брюшной полости, ультразвукового исследования или хирургической операции, при этом симптомы проходили после прекращения приема ингибиторов АПФ. Ангионевротический отек кишечника должен быть включен в дифференциальную диагностику у пациентов с болью в животе, принимающих ингибиторы АПФ.
Одновременное применение периндоприла с комбинацией сакубитрил/валсартан противопоказано из-за повышенного риска ангиодистрофии. Прием комбинации сакубитрил/валсартан следует начинать только через 36 часов после приема последней дозы периндоприла. Если лечение комбинацией сакубитрил/валсартан закончено, то прием периндоприла следует начинать только через 36 часов после приема последней дозы комбинации сакубитрил/валсартан (см. разделы «Противопоказания» и «Лекарственное взаимодействие»).
Одновременное применение ингибиторов АПФ с рацекадотрилом, ингибиторами mTOR (например, сиролимус, эверолимус, темсиролимус) и вилдаглиптином может приводить к увеличению риска возникновения ангионевротического отека (отек дыхательных путей или глотки, с или без нарушения дыхательной функции) (см. раздел «Лекарственное взаимодействие»). Необходимо соблюдать осторожность в начале приема рацекадотрила, ингибиторов mTOR (например, сиролимус, эверолимус, темсиролимус) и вилдаглиптина у пациентов, уже принимающих ингибиторы АПФ.
Анафилактоидные реакции во время десенсибилизации
Имеются отдельные сообщения о развитии стойкой, угрожающей жизни анафилактоидной реакции у пациентов, принимающих ингибиторы АПФ во время десенсибилизирующей терапии ядом перепончатокрылых насекомых (пчелы, осы). Ингибиторы АПФ следует назначать с осторожностью пациентам, склонным к аллергическим реакциям и проходящим курс десенсибилизации; следует избегать назначения препарата пациентам, проходящим иммунотерапию ядами перепончатокрылых насекомых. В случаях, когда пациенту требуется и лечение ингибиторами АПФ, и десенсибилизация, наступление таких реакций можно предотвратить путем временной отмены ингибитора АПФ как минимум за 24 часа до начала курса десенсибилизирующей терапии.
Анафилактоидные реакции во время ЛПНП-афереза
У пациентов, получающих ингибиторы АПФ при проведении ЛПНП–афереза с использованием сульфата декстрана, отмечены редкие случаи развития угрожающих жизни анафилактоидных реакций. Наступление таких реакций можно предотвратить путем временного прекращения приема ингибиторов АПФ перед каждой процедурой афереза ЛПНП.
Гемодиализ
Известны случаи появления анафилактоидных реакций у пациентов, проходящих гемодиализ с использованием мембран с высокой плотностью потока (например, AN 69®) и одновременно находящихся на лечении ингибиторами АПФ. Таким пациентам следует назначать или применение мембран для диализа другого типа, или прием антигипертензивных препаратов другого класса.
Первичный альдостеронизм
Антигипертензивная терапия путем ингибирования ренин-ангиотензиновой системы обычно оказывается неэффективной для пациентов с первичным гиперальдостеронизмом, поэтому её использование для этих пациентов не рекомендуется.
Уровень калия
Снижение уровня калия с гипокалиемией является основным риском, связанным с применением тиазидных и тиазидоподобных диуретиков. Следует предотвратить снижение уровня калия (<3.4 ммоль/л) в некоторых группах пациентов с высоким риском, а именно у пациентов пожилого возраста и/или у субъектов с недостаточностью питания, независимо от того, принимают ли они несколько препаратов, у пациентов с циррозом печени, отеками и асцитом, у пациентов с коронарной болезнью и у пациентов с сердечной недостаточностью. В таких случаях гипокалиемия способствует увеличению токсического действия сердечных гликозидов на сердце и риск возникновения аритмий.
Комбинация периндоприла и индапамида не предотвращает развитие гипокалиемии, особенно у пациентов с сахарным диабетом или у пациентов с нарушением функции почек. Как и в случае применения любого гипотензивного средства в сочетании с диуретиком, следует регулярно выполнять контроль уровня калия в плазме.
Калийсберегающие диуретики, соли калия
Совместное применение периндоприла и калийсберегающих диуретиков, а также солей калия обычно не рекомендуется (см. раздел «Лекарственное взаимодействие»).
Гиперкалиемия
Ингибиторы АПФ могут вызывать гиперкалиемию за счет ингибирования выведения альдостерона. Данный эффект обычно незначителен у пациентов с нормальной функцией почек. Факторы риска гиперкалиемии включают почечную недостаточность, ухудшение функции почек, возраст > 70 лет, сахарный диабет, некоторые сопутствующие состояния (снижение ОЦК, острая сердечная недостаточность в стадии декомпенсации, метаболический ацидоз), одновременный прием калийсберегающих диуретиков (например, спиронолактон, эплеренон, триамтерен или амилорид), препаратов калия или калийсодержащих заменителей соли или других препаратов, увеличивающих уровень калия в сыворотке (например, гепарин, триметоприм и ко-тримоксазол (триметоприм/сульфаметоксазол) и, особенно, антагонисты альдостерона или блокаторы ангиотензин-рецепторов, ацетилсалициловая кислота в дозе ≥ 3 г/сут, ингибиторы ЦОГ-2 и нестероидные противовоспалительные препараты (НПВП), иммуносупрессанты (например циклоспорин или такролимус)). Использование препаратов калия, калийсберегающих диуретиков или калийсодержащих заменителей соли, особенно у пациентов с нарушением функции почек, может привести к значительному увеличению калия в сыворотке крови. Гиперкалиемия может стать причиной серьезных, иногда фатальных аритмий. Если сопутствующее назначение вышеуказанных препаратов считается необходимым, то их прием должен осуществляться с осторожностью и сопровождаться частым мониторингом содержания калия в сыворотке крови (см. раздел «Лекарственное взаимодействие»).
Беременность
Терапию ингибиторами АПФ не следует инициировать во время беременности. Если продолжение терапии ингибитором АПФ не считается необходимым, пациентки, планирующие беременность, должны быть переведены на альтернативные антигипертензивные методы лечения, которые имеют установленный профиль безопасности для использования во время беременности. Когда диагностируется беременность, лечение ингибиторами АПФ следует немедленно прекратить, и, при необходимости, следует начать альтернативную терапию (см. разделы «Противопоказания» и «Беременность и лактация»).
Фоточувствительность
Известны случаи проявления реакций фоточувствительности на фоне приема тиазидных и тиазидоподобных диуретиков (см. раздел «Побочное действие»). При развитии таких реакций прием препарата рекомендуется прекратить. При необходимости повторного назначения диуретиков следует защищать открытые участки кожи от прямого воздействия солнечных лучей или искусственного УФ излучения.
Нарушение функции почек
При нарушении функции почек тяжелой степени (клиренс креатинина ниже 30 мл/мин) лечение противопоказано. Препарат Роксатенз-инда не подходит для пациентов с клиренсом креатинина ниже 60 мл/мин. Таким пациентам рекомендуется титрование дозы отдельных компонентов на индивидуальной основе (см. раздел «Режим дозирования»).
У пациентов с артериальной гипертензией без ранее выявленного поражения почек, у которых при биохимическом анализе крови была установлена функциональная почечная недостаточность, лечение следует прекратить. Возобновление лечения возможно либо при приеме низкой дозы препарата, либо только при приеме одного компонента.
При наблюдении таких пациентов обычно выполняют частый контроль уровня калия и креатинина через две недели лечения, а затем каждые два месяца в течение периода терапевтической стабильности. Нарушение функции почек отмечается в основном у пациентов с сердечной недостаточностью тяжелой степени или основной почечной недостаточностью, включая стеноз почечной артерии. Прием данного препарата обычно не рекомендуется пациентам с билатеральным стенозом почечной артерии или пациентам со стенозом артерии единственной почки.
Протеинурия, выявленная с помощью тест-полоски и имеющая, главным образом, канальцевое происхождение, наблюдалась у пациентов, получавших лечение более высокими дозами розувастатина, в частности, 40 мг, при этом в большинстве случаев она носила временный или прерывистый характер. Было установлено, что протеинурия не является прогностическим фактором острого или прогрессирующего заболевания почек (см. раздел «Побочное действие»).
Функция почек и диуретики
Тиазидные и тиазидоподобные диуретики максимально эффективны в тех случаях, когда почечная функция находится в норме или нарушена незначительно (для взрослых пациентов уровень креатинина ниже ≈ 25 мг/л, т.е. 220 мкмоль/л). У пожилых пациентов показатели содержания креатинина в плазме должны корректироваться с учетом возраста, массы тела и пола пациента по формуле Кокрофта:
Clcr = (140 – возраст в годах) x масса тела в кг / 0.814 x уровень креатина в плазме в мкмоль/л. Эта формула выведена для пожилых мужчин и может быть адаптирована для женщин путем умножения результата на 0.85.
В начале лечения гиповолемия, вызванная потерей воды и натрия на фоне приема диуретиков, может приводить к снижению скорости клубочковой фильтрации и сопровождаться повышением концентрации креатинина и мочевины в плазме крови. Эта транзиторная функциональная почечная недостаточность не приводит к нежелательным последствиям у пациентов с неизмененной функцией почек, однако у больных с почечной недостаточностью может вызывать ухудшение состояния.
Гипотензия и нарушение водно-электролитного баланса
При пониженном содержании натрия, особенно у пациентов со стенозом почечной артерии, существует риск внезапного падения артериального давления. Поэтому следует проводить систематический анализ для выявления у пациента клинических признаков дефицита воды и электролитов, например, после диареи или рвоты. У таких пациентов необходимо проводить регулярный контроль содержания электролитов в плазме.
В случае выраженной гипотензии может понадобиться внутривенное введение изотонического раствора. Преходящая гипотензия не является противопоказанием для продолжения лечения. После восстановления удовлетворительного объема крови и артериального давления лечение может быть возобновлено либо с более низкой дозировкой лекарственного средства, либо только одним из его компонентов.
Риск артериальной гипотензии и/или почечной недостаточности (в случае сердечной недостаточности, нарушения водно-солевого баланса и др.)
При существенной потере воды и электролитов (строгая бессолевая диета или длительное лечение диуретиками), особенно у пациентов с изначально низким артериальным давлением, при стенозе почечной артерии, застойной сердечной недостаточности или циррозе печени, сопровождающемся отеками и асцитом, происходит выраженная стимуляция ренин-ангиотензин-альдостероновой системы. Следовательно, угнетение этой системы при приеме ингибиторов АПФ может вызвать (наиболее вероятно при первом приеме лекарственного средства или в течение первых двух недель лечения) резкое падение артериального давления и/или повышение содержания креатинина в плазме, что свидетельствует о функциональной почечной недостаточности. В отдельных, хотя и редких случаях эти симптомы могут развиваться остро и с различным временем начала их появления. В таких случаях лечение периндоприлом может быть возобновлено с более низкой дозы, постепенно ее увеличивая.
Реноваскулярная гипертензия
Лечение реноваскулярной гипертензии осуществляется путем реваскуляризации. Однако применение ингибиторов АПФ может быть благоприятным у пациентов с реноваскулярной гипертензией, ожидающих хирургического вмешательства, или при отсутствии возможности такого лечения.
Лечение пациентов с установленным или предполагаемым стенозом почечной артерии комбинацией периндоприл/индапамид следует начинать в условиях стационара.
Стеноз аортального или митрального клапана / гипертрофическая кардиомиопатия
Следует соблюдать осторожность при использовании ингибиторов АПФ у пациентов с обструкцией выходного тракта левого желудочка.
Кашель
Прием ингибиторов АПФ может вызвать появление сухого кашля, который носит персистирующий характер и исчезает после отмены препарата. Этот симптом может иметь ятрогенную этиологию. Если назначение ингибитора АПФ является предпочтительным, то следует рассмотреть возможность продолжения лечения.
Интерстициальное заболевание легких
Сообщалось о единичных случаях развития интерстициального заболевания легких при применении некоторых статинов, особенно в случае длительной терапии (см. раздел «Побочное действие»). Первичные симптомы могут включать одышку, непродуктивный кашель и ухудшение общего состояния здоровья (патологическая усталость, снижение массы тела и лихорадка). Если имеется подозрение на то, что у пациента развилось интерстициальное заболевание легких, терапию статинами следует прекратить.
Печеночная недостаточность
В редких случаях терапия ингибиторами АПФ сопровождалась синдромом, который начинался с холестатической желтухи, прогрессировал до фульминантного некроза печени и (иногда) заканчивался летальным исходом. Механизм этого синдрома не известен. Пациенты, получающие ингибиторы АПФ, у которых развивается желтуха или значительно повышается уровень печеночных ферментов, должны прекратить прием ингибиторов АПФ и пройти тщательное медицинское обследование (см. раздел «Побочное действие»).
Печеночная энцефалопатия
При нарушении функции печени тиазидные диуретики и тиазидоподобные диуретики могут приводить к развитию печеночной энцефалопатии. В таком случае следует немедленно прекратить прием диуретиков.
Уровень натрия
Необходимо контролировать уровень натрия до начала приема индапамида, а затем через равные промежутки времени. Любое лечение диуретиками может привести к снижению уровня натрия, что может иметь серьезные последствия. Первоначально снижение уровня натрия может протекать бессимптомно, поэтому необходимо выполнять анализ на регулярной основе. Чаще следует проводить проверку у пациентов пожилого возраста и у пациентов с циррозом печени (см. разделы «Побочное действие» и «Передозировка»).
Гипонатриемия с гиповолемией может являться причиной дегидратации и ортостатической гипотензии. Сопутствующая потеря ионов хлорида может привести к вторичному компенсаторному метаболическому алкалозу: частота и степень такого действия незначительны.
Удлинение интервала QT
К группе повышенного риска относятся также пациенты с врожденным или ятрогенным увеличением интервала QT. Гипокалиемия, как и брадикардия, является фактором риска для развития серьезных нарушений сердечного ритма, особенно желудочковой тахикардии типа «пируэт», которые могут привести к летальному исходу.
Во всех описанных случаях следует регулярно контролировать уровень калия. Первое определение содержания калия в плазме необходимо провести в течение первой недели после начала лечения. В случае снижения уровня калия необходимо провести коррекцию.
Содержание кальция
Тиазидные и тиазидоподобные диуретики могут уменьшать выведение кальция с мочой, приводя к незначительному и временному повышению содержания кальция в плазме крови. Значительное повышение уровня кальция может быть следствием скрытого гиперпаратиреоза. В этом случае лечение следует прекратить, пока не будет исследована функция паращитовидной железы.
Мочевая кислота
Приступы подагры могут участиться у пациентов с гиперурикемией.
Пожилые пациенты
Перед началом лечения следует оценить функцию почек и уровень калия. Во избежание резкого снижения артериального давления начальную дозу препарата подбирают в зависимости от степени снижения артериального давления, особенно в случае нарушения водно-электролитного баланса.
Пациенты с установленным атеросклерозом
Риск гипотензии существует у всех пациентов, но особую осторожность необходимо соблюдать у пациентов с ишемической болезнью сердца или недостаточностью мозгового кровообращения. Лечение следует начинать с низких доз.
Пациенты, страдающие сахарным диабетом
У пациентов с инсулинозависимым сахарным диабетом (спонтанная тенденция к повышению уровня калия) лечение следует начинать под наблюдением врача с уменьшенной начальной дозы препарата.
Следует контролировать уровень гликемии у пациентов с сахарным диабетом, ранее получавших пероральные противодиабетические препараты или инсулин, а именно в течение первого месяца лечения ингибитором АПФ.
Имеются данные, свидетельствующие о том, что статины как класс препаратов обуславливают увеличение уровня глюкозы в крови, а у некоторых пациентов, для которых существует высокий риск возникновения диабета в будущем, статины могут привести к развитию гипергликемии такого уровня, при котором необходимо проведение надлежащей сахароснижающей терапии. Тем не менее, данный риск компенсируется за счет снижения сосудистого риска посредством применения статинов и, таким образом, не должен являться основанием для прекращения терапии статинами. Для пациентов, находящихся в зоне риска (уровень глюкозы натощак 5.6–6.9 ммоль/л, ИМТ (индекс массы тела) >30 кг/м2, повышенный уровень триглицеридов, гипертензия), следует осуществлять клинический и биохимический мониторинг в соответствии с национальными руководящими документами.
В исследовании JUPITER сообщалось о том, что общая частота развития сахарного диабета составляла 2.8% в группе, получавшей розувастатин, и 2.3% в группе, получавшей плацебо, главным образом, среди пациентов, у которых уровень глюкозы в крови натощак находился в пределах 5.6–6.9 ммоль/л.
Уровень глюкозы в крови
Важно контролировать уровень глюкозы в крови у пациентов с сахарным диабетом, особенно когда уровень калия низкий.
Сердечная недостаточность/острая сердечная недостаточность
У пациентов с выраженной сердечной недостаточностью (степень IV) или у пациентов с инсулинозависимым сахарным диабетом (опасность спонтанного повышения уровня калия) лечение следует начинать с низких доз и под контролем врача. Пациенты с артериальной гипертензией и коронарной недостаточностью не должны прекращать лечение бета-блокаторами: ингибитор АПФ следует принимать совместно с бета-блокаторами.
Расовая принадлежность
Как и в случае применения других ингибиторов АПФ, периндоприл, судя по всему, менее эффективен в снижении артериального давления у афроамериканцев, чем у представителей других рас, возможно, в связи с более высоким показателем распространения низких уровней ренина у афроамериканцев.
В фармакокинетических исследованиях продемонстрирован увеличенный показатель воздействия розувастатина на азиатов по сравнению с субъектами европеоидной расы (см. раздел «Режим дозирования», «Противопоказания» и «Фармакокинетика»).
Хирургические вмешательства / анестезия
Ингибиторы АПФ могут спровоцировать падение артериального давления при проведении анестезии, особенно если используемый анестетик обладает гипотензивным действием. Поэтому лечение ингибиторами АПФ пролонгированного действия, такими как периндоприл, рекомендуется, по возможности, прекратить за один день до проведения хирургической операции.
Спортсмены
Препарат содержит активное вещество, которое может дать положительную реакцию при проведении допинг-контроля.
Хориоидальный выпот, острая миопия и вторичная закрытоугольная глаукома
Сульфаниламиды и производные сульфонамида могут вызывать идиосинкразию, приводящую к хориоидальному выпоту с нарушением поля зрения, транзиторной миопии и острой закрытоугольной глаукоме. Симптомы включают острое начало снижения остроты зрения или боль в глазах и обычно возникают в течение нескольких часов или недель после начала приема препарата. Острая закрытоугольная глаукома без лечения может привести к перманентной потере зрения. Первичное лечение состоит в прекращении применении препарата как можно скорее. Если внутриглазное давление остается неконтролируемым, возможно, потребуется оперативное медикаментозное или хирургическое лечение. Факторы риска развития острой закрытоугольной глаукомы могут включать аллергию на сульфаниламиды или пенициллин в анамнезе.
Влияние на скелетную мускулатуру
Сообщалось о влиянии на скелетную мускулатуру (например, миалгия, миопатия и, в редких случаях, рабдомиолиз) у пациентов, получавших лечение всеми дозами розувастатина, особенно при использовании доз >20 мг. В очень редких случаях сообщалось о развитии рабдомиолиза при применении эзетимиба в комбинации с ингибиторами ГМГ-КоА- редуктазы. Вероятность фармакодинамического взаимодействия не может быть исключена (см. раздел «Лекарственное взаимодействие»), в связи с чем следует соблюдать осторожность при комбинированном применении данных препаратов. Как и в случае других ингибиторов ГМГ-КоА-редуктазы, частота предоставления сообщений о рабдомиолизе, связанном с розувастатином, в условиях пострегистрационного применения является более высокой в случае дозы 40 мг.
Измерение уровня креатинкиназы
Уровень креатинкиназы (КК) не следует измерять после интенсивной физической нагрузки или при наличии альтернативной причины увеличения уровня креатинкиназы, поскольку это может исказить интерпретацию результатов. В случае если уровни креатинкиназы значительно увеличены в исходный момент времени (> 5-кратного ВПН), в течение 5–7 дней следует провести подтверждающий анализ. Если результаты повторного анализа свидетельствуют о том, что исходный уровень креатинкиназы составляет > 5-кратного ВПН, лечение начинать не следует.
Перед лечением розувастатином
Как и в случае других ингибиторов ГМГ-КоА-редуктазы, следует соблюдать осторожность при назначении розувастатина пациентам, у которых имеются факторы, предрасполагающие к развитию миопатии/рабдомиолиза. К таким факторам относятся:
— нарушение функции почек;
— гипотиреоз;
— наличие наследственных мышечных нарушений в личном или семейном анамнезе;
— наличие в анамнезе мышечных токсических реакций, обусловленных применением другого ингибитора ГМГ-КоА-редуктазы или фибрата;
— злоупотребление алкоголем;
— возраст >70 лет;
— ситуации, которые могут привести к увеличению уровней препарата в плазме крови (см. разделы «Режим дозирования», «Лекарственное взаимодействие» и «Фармакокинетика»);
— сопутствующее применение фибратов.
Для таких пациентов следует провести оценку риска с учетом возможной пользы лечения; кроме того, рекомендуется осуществлять клинический мониторинг. В случае если уровни креатинкиназы значительно увеличены в исходный момент времени (> 5-кратного ВПН), лечение начинать не следует.
Во время лечения
Следует предупредить пациентов о необходимости немедленно сообщать о необъяснимых мышечных болях, слабости или спазмах, особенно если данные явления имеют место на фоне плохого самочувствия или лихорадки. Следует выполнить измерение уровня креатинкиназы у таких пациентов. Терапию следует прекратить в том случае, если уровни креатинкиназы заметно увеличены (> 5-кратного ВПН) или если мышечные симптомы являются тяжелыми и вызывают ежедневный дискомфорт (даже если уровни креатинкиназы составляют ≤ 5-кратного ВПН). В случае если симптомы разрешаются, а уровень креатинкиназы возвращается к нормальному, следует рассмотреть вариант возобновления терапии розувастатином или альтернативным ингибитором ГМГ-КоА-редуктазы с использованием наименьшей дозы, осуществляя при этом тщательный мониторинг. Необходимость в проведении планового мониторинга уровней креатинкиназы у бессимптомных пациентов отсутствует. Сообщалось об очень редких случаях развития иммуноопосредованной некротизирующей миопатии (ИОНМ) во время или после лечения статинами, включая розувастатин. Для клинической картины ИОНМ характерны слабость проксимальных мышц и повышенный уровень креатинкиназы в сыворотке крови, которые сохраняются, несмотря на отмену лечения статинами.
В клинических исследованиях с участием небольшого количества пациентов, которые получали розувастатин и сопутствующую терапию, не были получены какие-либо доказательства увеличения частоты возникновения явлений со стороны скелетной мускулатуры. Тем не менее, наблюдалось увеличение частоты развития миозита и миопатии у пациентов, которые получали другие ингибиторы ГМГ-КоА-редуктазы одновременно с производными фибровой кислоты (включая гемфиброзил), циклоспорином, никотиновой кислотой, азольными противогрибковыми средствами, ингибиторами протеазы и макролидными антибиотиками. Гемфиброзил увеличивает риск развития миопатии в случае его применения одновременно с некоторыми ингибиторами ГМГ-КоА-редуктазы. Таким образом, комбинированное применение розувастатина и гемфиброзила не рекомендуется. Следует провести тщательную оценку выгоды дальнейшей корректировки уровня липидов посредством комбинированного применения розувастатина и фибратов или ниацина с учетом потенциальных рисков применения подобных комбинаций. Дозы розувастатина 30 мг и 40 мг противопоказаны при сопутствующем применении фибрата (см. разделы «Лекарственное взаимодействие» и «Побочное действие»).
Розувастатин не следует назначать пациентам с острым и серьезным нарушением, которое указывает на миопатию или предрасполагает к развитию почечной недостаточности на фоне рабдомиолиза (например, сепсис, гипотензия, обширное хирургическое вмешательство, травма, тяжелые метаболические, эндокринные и электролитные нарушения; неконтролируемые припадки).
Препарат Роксатенз-инда не должен применяться совместно с системными формами фузидовой кислоты или в течение 7 дней после прекращения приема фузидовой кислоты. Для тех пациентов, у которых применение системной фузидовой кислоты считается принципиально необходимым, терапию статинами следует прекратить на весь период лечения фузидовой кислотой. Сообщалось о случаях развития рабдомиолиза (включая несколько случаев со смертельным исходом) у пациентов, получающих фузидовую кислоту и статины в комбинации (см. раздел «Лекарственное взаимодействие»). Следует предупредить пациентов о необходимости немедленно обратиться за медицинской помощью в случае развития у них любых симптомов, которые характеризуются мышечной слабостью, болями или болезненной чувствительностью.
Терапия статинами может быть возобновлена спустя семь дней после введения последней дозы фузидовой кислоты.
В исключительных случаях, когда необходимо длительное системное применение фузидовой кислоты, например, для лечения тяжелых инфекций, решение о совместном применении препарата Роксатенз-инда и фузидовой кислоты следует принимать только в индивидуальном порядке под тщательным медицинским наблюдением.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС)
Имеются данные, свидетельствующие о том, что сопутствующее применение ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена увеличивает риск развития гипотензии, гиперкалиемии и снижения функции почек (включая острую почечную недостаточность). Таким образом, двойная блокада РААС посредством комбинированного применения ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена не рекомендуется (см. разделы «Лекарственное взаимодействие» и «Фармакологическое действие»).
Если терапия на основе двойной блокады считается абсолютно необходимой, ее следует осуществлять исключительно под наблюдением специалиста, а также при условии проведения частого и тщательного мониторинга функции почек, уровня электролитов и артериального давления.
Не следует одновременно назначать ингибиторы АПФ и блокаторы рецепторов ангиотензина II пациентам с диабетической нефропатией.
Ингибиторы протеазы
Повышенная системная экспозиция розувастатина наблюдалась у субъектов, получающих розувастатин одновременно с различными ингибиторами протеазы в комбинации с ритонавиром. Следует принимать во внимание пользу липидоснижающей терапии розувастатином у пациентов с ВИЧ, получающих ингибиторы протеазы, и риск увеличения концентраций розувастатина в плазме крови в момент начала терапии розувастатином и при повышении его дозы у пациентов, получающих лечение ингибиторами протеазы. Сопутствующее применение ингибиторов протеазы не рекомендуется, если только не проведена корректировка дозы розувастатина (см. разделы «Режим дозирования» и «Лекарственное взаимодействие»).
Тяжелые кожные нежелательные реакции
При применении розувастатина сообщалось о тяжелых кожных нежелательных реакциях, включая синдром Стивенса-Джонсона и реакцию на лекарственные препараты с эозинофилией и системными симптомами (DRESS), которые могли быть опасными для жизни или фатальными. При назначении препарата пациенты должны быть проинформированы о признаках и симптомах тяжелых кожных реакций и находиться под тщательным наблюдением. При появлении признаков и симптомов, указывающих на данную реакцию, прием препарата Роксатенз-инда следует немедленно прекратить и рассмотреть альтернативное лечение. Если при приеме Роксатенз-инда у пациента развились тяжелые реакции, такие как синдром Стивенса-Джонсона или DRESS-синдром, нельзя больше когда-либо возобновлять прием препарата.
Влияние на способность управлять транспортными средствами и работать с механизмами
Роксатенз-инда не оказывает непосредственного влияния на способность управлять автомобилем и работать с потенциально опасными механизмами. Однако у некоторых пациентов, особенно в начале лечения или при сочетании с другими гипотензивными средствами, препарат может вызвать индивидуальные реакции, связанные со снижением артериального давления.
Исследования влияния розувастатина на способность к вождению транспортных средств и управлению механизмами не проводились. Тем не менее, исходя из фармакодинамических свойств, маловероятно, что розувастатин может оказать влияние на данную способность. При вождении транспортных средств или управлении механизмами следует учитывать, что во время лечения может возникать головокружение. Как следствие, способность к управлению транспортными средствами и работе с механизмами может быть нарушена.
Данные доклинической безопасности
Связанные с периндоприлом/индапамидом
Комбинация периндоприла и индапамида несколько повысила токсичность по сравнению с отдельными компонентами. У крыс увеличения почечной токсичности не наблюдалось, но комбинация вызывала желудочно-кишечную токсичность у собак. Токсическое воздействие на материнский организм, по-видимому, увеличивается у крыс (по сравнению с одним только периндоприлом).
Тем не менее, эти неблагоприятные эффекты проявились при введении доз с очень высокой границей безопасности, по сравнению с используемыми терапевтическими дозами.
Доклинические исследования отдельно с периндоприлом и индапамидом не подтвердили генотоксического, канцерогенного или тератогенного действия субстанций.
Связанные с розувастатином
На основании доклинических данных розувастатина, полученных в рамках традиционных исследований фармакологической безопасности, генотоксичности и канцерогенного потенциала, какие-либо особые риски для человека не выявлены. Какие-либо конкретные испытания с целью оценки воздействия на hERG (ген специфических калиевых каналов сердца) не проводились. Далее перечислены нежелательные реакции, которые отсутствовали в клинических исследованиях, однако наблюдались у животных при уровнях воздействия препарата, аналогичных таковым в клинических исследованиях: В исследованиях токсичности многократных доз гистопатологические изменения печени, вероятно, обусловленные фармакологическим действием розувастатина, наблюдались у мышей и крыс, а также, в меньшей степени, в желчном пузыре у собак, но не у обезьян. Кроме того, у обезьян и собак наблюдалась тестикулярная токсичность при использовании более высоких доз. Признаки репродуктивной токсичности наблюдались у крыс — отмечались сниженные показатели размера помета, массы помета и выживаемости потомства в случае использования доз, токсичных для материнского организма, при которых показатель системного воздействия был в несколько раз выше уровня терапевтического воздействия.
Передозировка
Симптомы
Наиболее вероятной нежелательной реакцией в случае передозировки является гипотензия, иногда сопровождающаяся тошнотой, рвотой, мышечными судорогами, головокружением, сонливостью, нарушением сознания, олигурией, которая может усугубиться до анурии (вследствие гиповолемии). Возможны нарушения водно-электролитного баланса (низкое содержание натрия и калия).
Лечение
В случае передозировки специальное лечение отсутствует. Проводят симптоматическое лечение пациента; при необходимости используют поддерживающие меры. Первые меры, которые необходимо предпринять, заключаются в быстром выведении проглатываемого (-ых) продукта (-ов) путем промывания желудка и/или введения активированного угля, затем следует восстановить водно-электролитный баланс в специализированном учреждении до нормального состояния. Если развивается явная гипотензия, то пациент должен быть помещен в положении лежа на спине с опущенной головой. При необходимости можно выполнить внутривенную инфузию изотонического физиологического раствора или иного подходящего раствора. Следует осуществлять наблюдение функции печени и уровня креатинкиназы.
Периндоприлат, активная форма периндоприла, может быть подвергнут процессу диализа (см. раздел «Фармакокинетика»). В отношении розувастатина, польза от проведения гемодиализа маловероятна.
Лекарственное взаимодействие
Общие для периндоприла и индапамида
Одновременное применение не рекомендуется
Литий: отмечены случаи обратимого повышения концентрации лития в сыворотке крови и случаи токсичности при комбинированном назначении лития и ингибиторов АПФ. Сопутствующий прием тиазидных диуретиков может способствовать повышению уровня лития и усиливать риск развития литиевой токсичности, развившихся на фоне приема ингибиторов АПФ. Совместный прием комбинации периндоприла с индапамидом и препаратов лития не рекомендуется, но если он необходим, то следует проводить тщательный контроль содержания лития в сыворотке крови (см. раздел «Особые указания»).
Одновременное применение, требующее особой осторожности
Баклофен: потенцирование антигипертензивного эффекта. Следует осуществлять контроль артериального давления и функции почек, а также, при необходимости, проводить корректировку дозы антигипертензивного средства.
Нестероидные противовоспалительные препараты (включая ацетилсалициловую кислоту в высоких дозах): одновременное применение ингибиторов АПФ с нестероидными противовоспалительными препаратами (ацетилсалициловая кислота в дозах, оказывающих противовоспалительное действие, ингибиторы ЦОГ-2 и неселективные НПВС) может стать причиной снижения гипотензивного эффекта ингибиторов АПФ. Одновременное применение ингибиторов АПФ и НПВС также повышает риск нарушения функции почек, вплоть до развития острой почечной недостаточности, и увеличения содержания калия в сыворотке крови, особенно у пациентов с уже существующими нарушениями функции почек. Такую комбинацию следует назначать с осторожностью, особенно у пациентов пожилого возраста. Пациенты должны получать достаточное количество жидкости, а также рекомендовано осуществлять контроль функции почек до и после начала совместного лечения.
Одновременное применение, требующее некоторой осторожности
Имипрамино–подобные антидепрессанты (трициклические), нейролептики: усиление гипотензивного эффекта и повышение риска развития ортостатической гипотензии (аддитивный эффект).
Связанные с периндоприлом
Данные клинических испытаний показали, что двойная блокада ренин-ангиотензин-альдостероновой системы (РААС) посредством комбинированного использования ингибиторов АПФ, блокаторов рецепторов ангиотензина II или алискирена связана с более высокой частотой побочных эффектов, таких как гипотензия, гиперкалиемия и снижение почечной функции (в том числе острой почечной недостаточности) по сравнению с использованием одного препарата, воздействующего на РААС (см разделы «Противопоказания», «Особые указания» и «Фармакологическое действие»).
Лекарственные средства, провоцирующие развитие гиперкалиемии
Некоторые лекарственные препараты или терапевтические группы лекарственных препаратов могут повысить вероятность развития гиперкалиемии: алискирен, калиевые соли, калийсберегающие диуретики, ингибиторы АПФ, блокаторы рецепторов ангиотензина II, НПВС, гепарин, иммунодепрессанты, такие как циклоспорин и такролимус, триметоприм. Комбинированный прием этих препаратов повышает риск возникновения гиперкалиемии.
Совместное применение противопоказано:
Алискирен: у пациентов, страдающих сахарным диабетом или почечной недостаточностью, повышается риск возникновения гиперкалиемии, ухудшения почечной функции, развития сердечно-сосудистых заболеваний и смертности от сердечно-сосудистых заболеваний.
Экстракорпоральные методы лечения: Экстракорпоральные методы лечения, приводящие к контакту крови с отрицательно заряженными поверхностями, такие как диализ или гемофильтрация через некоторые типы высокопроницаемых мембран (например, мембраны из полиакрилонитрила), и методы афереза липопротеинов низкой плотности с декстан-сульфатом противопоказаны вследствие повышенного риска развития анафилактоидных реакций (см. раздел «Противопоказания»). Если такое лечение требуется, то следует рассмотреть возможность использования другого типа диализной мембраны или другого класса антигипертензивного средства.
Сакубитрил/валсартан: Одновременное применение ингибиторов АПФ с комбинацией сакубитрил/валсартан противопоказано, поскольку возможно повышение риска развития ангионевротического отека (см. разделы «Противопоказания» и «Особые указания»).
Совместное применение не рекомендуется:
Алискирен: у пациентов, не страдающих сахарным диабетом или почечной недостаточностью, повышается риск возникновения гиперкалиемии, ухудшения почечной функции, развития сердечно-сосудистых заболеваний и смертности от сердечно-сосудистых заболеваний (см. раздел «Особые указания»).
Комбинированная терапия ингибитором АПФ и блокатором рецепторов ангиотензина: в литературных данных указывается, что у пациентов с установленным атеросклеротическим заболеванием, сердечной недостаточностью или сахарным диабетом с поражением органа-мишени комбинированная терапия ингибитором АПФ и блокатором ангиотензиновых рецепторов сопровождается более высокой частотой развития гипотензии, обморока, гиперкалиемии и ухудшения почечной функции (включая острую почечную недостаточность) в сравнении с приемом одного препарата, воздействующего на ренинангиотензин-альдостероновую систему. Двойная блокада (например, путем комбинирования ингибитора АПФ с блокатором рецепторов ангиотензина II) должна ограничиваться отдельно взятыми случаями и сопровождаться тщательным мониторингом почечной функции, уровня калия и артериального давления (см. раздел «Особые указания»).
Эстрамустин: риск усиления нежелательных реакций, таких как ангионевротический отек (ангиоотек).
Калийсберегающие диуретики (спиронолактон, триамтерен, по отдельности или в комбинации), добавки калия или калийсодержащие соли: хотя уровень калия в сыворотке обычно остается в пределах нормы, у некоторых пациентов, принимающих периндоприл, может возникнуть гиперкалиемия. Калийсберегающие диуретики, например, спиронолактон, триамтерен или амилорид, добавки калия или калийсодержащие заменители соли могут привести к значительному повышению уровня калия в сыворотке. Следует также соблюдать осторожность при одновременном назначении периндоприла с другими препаратами, повышающими уровень калия в сыворотке крови, такими как триметоприм и котримоксазол (триметоприм / сульфаметоксазол), поскольку известно, что триметоприм действует как калийсберегающий диуретик, такой как амилорид. Поэтому комбинация периндоприла с вышеуказанными препаратами не рекомендуется. Если сопутствующее использование назначено в случае документированной гипокалиемии, их следует использовать с осторожностью и с частым мониторингом уровня калия в сыворотке крови.
Котримоксазол (триметоприм/сульфаметоксазол): повышенный риск гиперкалиемии (см. раздел «Особые указания»).
Одновременное применение, требующее особой осторожности
Противодиабетические средства (инсулин, гипогликемические сульфаниламиды (при приеме с каптоприлом и эналаприлом): эпидемиологические исследования показали, что комбинированный прием ингибиторов АПФ и противодиабетических препаратов (инсулины, пероральные гипогликемические препараты) может привести к усилению гипогликемического действия с риском наступления гипогликемии. Наступление таких событий наиболее вероятно в первые недели комбинированного лечения и у пациентов с нарушением функции почек.
Диуретики без калийсберегающих свойств: у пациентов, принимающих диуретики, особенно у пациентов с пониженным ОЦК или дефицитом солей, может наблюдаться значительное снижение артериального давления в начале терапии ингибитором АПФ. Вероятность гипотензивного эффекта может быть снижена путем прекращения приема диуретиков, повышения ОЦК или потребления соли перед началом терапии периндоприлом в низкой дозе с ее последующим постепенным увеличением.
При артериальной гипертензии, когда предшествующая терапия диуретиками могла вызвать понижение солей/ОЦК, прием диуретика должен быть прекращен до начала применения ингибитора АПФ (в этом случае может быть повторно введен не калийсберегающий диуретик), либо прием ингибитора АПФ начинают с низкой дозировки и постепенно увеличивают.
При застойной сердечной недостаточности, требующей приема диуретиков, прием ингибитора АПФ следует начинать с очень низкой дозы, по возможности после предварительного снижения дозы сопутствующего диуретика без калийсберегающих свойств. Во всех случаях в течение первых нескольких недель после начала терапии ингибитором АПФ необходимо проводить тщательный мониторинг функции почек (уровень креатинина).
Калийсберегающие диуретики (эплеренон, спиронолактон): при приеме эплеренона или спиронолактона в дозах от 12.5 мг/сутки до 50 мг/сутки и низких доз ингибиторов АПФ.
При лечении сердечной недостаточности класса II-IV (по классификации NYHA) с фракцией выброса 40%, с предшествующей терапией ингибиторами АПФ и петлевыми диуретиками существует риск развития гиперкалиемии с потенциальным летальным исходом, особенно в случае несоблюдения рекомендаций по назначению данной комбинации препаратов. Прежде чем назначать данную комбинацию препаратов, следует убедиться в отсутствии гиперкалиемии и почечной недостаточности у пациента.
В течение первого месяца терапии один раз в неделю, а затем один раз в месяц рекомендуется проводить мониторинг калиемии и креатинемии.
Рацекадотрил: известно, что ингибиторы АПФ (например, периндоприл) могут вызывать отек Квинке. Этот риск повышается при одновременном применении с рацекадотрилом (средство для лечения острой диареи).
Ингибиторы mTOR (например, сиролимус, эверолимус, темсиролимус): одновременное применение ингибиторов мишени рапамицина млекопитающих (mTOR) повышает риск отека Квинке (см. раздел «Особые указания»).
Одновременное применение, требующее некоторой осторожности
Гипотензивные и сосудорасширяющие препараты: комбинированный прием этих препаратов может привести к усилению гипотензивного эффекта периндоприла. Сопутствующий прием нитроглицерина и других нитратов или других сосудорасширяющих средств может привести к дальнейшему снижению артериального давления.
Аллопуринол, цитостатики или иммунодепрессанты, системные кортикостероиды или прокаинамид: одновременное применение этих препаратов с ингибиторами АПФ может увеличить риск развития лейкопении.
Анестетики: ингибиторы АПФ могут усиливать гипотензивный эффект некоторых анестезирующих средств.
Препараты золота: в редких случаях были отмечены нитритоидные реакции (симптомы: гиперемия лица, тошнота, рвота и гипотензия) у пациентов, получающих инъекционные препараты золота (ауротиомалат натрия) и ингибиторы АПФ, в том числе периндоприл.
Глиптины (линаглиптин, саксаглиптин, ситаглиптин, вилдаглиптин): у пациентов, принимающих ингибиторы АПФ, повышается риск развития ангионевротического отека вследствие снижения активности дипептидилпептидазы IV (ДПП-1У), связанного с приемом глиптинов.
Симпатомиметики: симпатомиметики могут снижать гипотензивный эффект ингибиторов АПФ.
Циклоспорин: гиперкалиемия может возникнуть при одновременном применении ингибиторов АПФ с циклоспорином. Рекомендуется мониторинг калия в сыворотке.
Гепарин: гиперкалиемия может возникнуть при одновременном применении ингибиторов АПФ с гепарином. Рекомендуется мониторинг калия в сыворотке.
Связанные с индапамидом
Одновременное применение, требующее особой осторожности
Препараты, вызывающие желудочковую тахикардию типа «пируэт»: из-за риска развития гипокалиемии следует соблюдать осторожность при одновременном назначении индапамида и препаратов, вызывающих желудочковую тахикардию типа «пируэт», таких как: противоаритмические вещества класса IA (хинидин, гидрохинидин, дизопирамид); противоаритмические вещества класса III (амиодарон, дофетилид, ибутилид, бретилий, соталол); некоторые нейролептики (хлорпромазин, циамемазин, левомепромазин, тиоридазин, трифлуоперазин), бензамиды (амисульприд, сульпирид, сультоприд, тиаприд), бутирофеноны (дроперидол, галоперидол), другие нейролептики (пимозид); другие вещества, такие как бепридил, цисаприд, дифеманил, эритромицин в/в, галофантрин, мизоластин, моксифлоксацин, пентамидин, спарфлоксацин, винкамин в/в, метадон, астемизол, терфенадин. Следует проводить профилактику гипокалиемии, при необходимости — осуществлять коррекцию и контролировать интервал QT на ЭКГ.
Препараты, снижающие уровень калия: амфотерицин B (в/в путь введения), глюко- и минералокортикоиды (системный путь введения), тетракозактид, стимулирующие слабительные средства увеличивают риск снижения уровня калия (аддитивный эффект). Необходим контроль содержания калия, в случае необходимости — проведение коррекции. Особое внимание следует уделять пациентам, получающим сердечные гликозиды. Следует применять нестимулирующие слабительные средства.
Сердечные гликозиды: низкий уровень калия может усиливать токсическое действие сердечных гликозидов. Следует контролировать содержание калия и показатели ЭКГ; при необходимости лечение должно быть пересмотрено.
Одновременное применение, требующее некоторой осторожности
Метформин: лактоацидоз за счет приема метформина, вызываемый возможной функциональной почечной недостаточностью, связан с диуретиками и в особенности «петлевыми» диуретиками. Не следует применять метформин, если уровень креатинина в плазме превышает 15 мг/л (135 мкмоль/л) у мужчин и 12 мг/л (110 мкмоль/л) у женщин.
Йодсодержащие контрастные средства: в случае дегидратации, вызванной приемом диуретиков, повышается риск развития острой почечной недостаточности, особенно при применении йодсодержащего контрастного средства в высоких дозах. Перед назначением йодсодержащих препаратов следует провести регидратацию.
Препараты (соли) кальция: риск повышения содержания кальция вследствие снижения его экскреции с мочой.
Циклоспорин, такролимус: риск повышения уровня креатинина в плазме без изменения уровня циркулирующего циклоспорина, даже в случае отсутствия снижения содержания воды и электролитов.
Кортикостероиды, тетракозактид (системный путь введения): уменьшают гипотензивное действие (задержка соли и воды, вызванная действием кортикостероидов).
Связанные с розувастатином
Влияние совместно назначаемых лекарственных средств на розувастатин
Ингибиторы транспортного белка: розувастатин является субстратом для определенных транспортных белков, включая транспортер печеночного захвата OATP1B1 и эффлюксный транспортер BCRP. Применение розувастатина одновременно с лекарственными средствами, которые являются ингибиторами данных транспортных белков, может привести к увеличению концентраций розувастатина в плазме крови, а также повысить риск развития миопатии (см. разделы «Режим дозирования», «Особые указания» и «Лекарственное взаимодействие», Таблица ниже).
Циклоспорин: во время сопутствующей терапии розувастатином и циклоспорином значения AUC розувастатина были в среднем в 7 раз выше значений, наблюдавшихся у здоровых добровольцев (см. Таблицу ниже). Розувастатин противопоказан пациентам, получающим сопутствующее лечение циклоспорином (см. раздел«Противопоказания»). Одновременное введение не оказало влияния на концентрацию циклоспорина в плазме крови.
Ингибиторы протеазы: хотя точный механизм взаимодействия неизвестен, сопутствующее применение ингибитора протеазы может привести к значительному увеличению экспозиции розувастатина (см. Таблицу ниже). Например, в фармакокинетическом исследовании совместное введение 10 мг розувастатина и комбинированного препарата, включающего два ингибитора протеазы (атазанавир 300 мг/ритонавир 100 мг), здоровым добровольцам ассоциировалось с приблизительно трехкратным и семикратным увеличением показателей AUC и Cmax розувастатина в равновесном состоянии соответственно. Вариант совместного применения розувастатина и некоторых комбинаций ингибиторов протеазы может быть рассмотрен после тщательной оценки возможности корректировки дозы розувастатина с учетом ожидаемого увеличения экспозиции розувастатина (см. см. разделы «Режим дозирования», «Особые указания» и «Лекарственное взаимодействие», Таблицу ниже).
Гемфиброзил и другие липидоснижающие препараты: совместное применение розувастатина и гемфиброзила привело к 2-кратному увеличению показателей Cmax и AUC розувастатина (см. раздел «Особые указания»).
Принимая во внимание данные отдельных исследований взаимодействия, какое-либо взаимодействие с фенофибратом, значимое с фармакокинетической точки зрения, не ожидается, однако может иметь место взаимодействие фармакодинамического характера. Гемфиброзил, фенофибрат, другие фибраты, а также липидоснижающие дозы (≥ 1 г/сут.) ниацина (никотиновая кислота) увеличивают риск развития миопатии при введении одновременно с ингибиторами ГМГ-КоА-редуктазы, вероятно, по причине того, что они способны провоцировать развитие миопатии в случае их применения в виде монотерапии. Дозы 30 мг и 40 мг противопоказаны при сопутствующем применении фибрата (см. раздел «Особые указания»). Данные пациенты также должны начинать лечение с дозы 5 мг.
Эзетимиб: совместное применение 10 мг розувастатина и 10 мг эзетимиба привело к 1.2-кратному увеличению AUC розувастатина у субъектов с гиперхолестеринемией (Таблица ниже). Тем не менее, фармакодинамическое взаимодействие (в контексте нежелательных явлений) между розувастатином и эзетимибом не может быть исключено (см. раздел «Особые указания»).
Антациды: одновременное введение розувастатина и антацидной суспензии, содержащей алюминия гидроксид и магния гидроксид, привело к снижению концентрации розувастатина в плазме крови приблизительно на 50%. Данный эффект был нивелирован при введении антацида спустя 2 часа после введения розувастатина. Клиническая значимость данного вида взаимодействия не изучалась.
Эритромицин: совместное применение розувастатина и эритромицина привело к снижению AUC розувастатина на 20% и к снижению Cmax розувастатина на 30%. Данное взаимодействие может быть обусловлено усилением перистальтики кишечника, которое вызвано введением эритромицина.
Ферменты семейства цитохрома P450: результаты исследований in vitro и in vivo свидетельствуют о том, что розувастатин не является ни ингибитором, ни индуктором изоферментов семейства цитохрома P450. Кроме того, розувастатин является непрофильным субстратом для данных изоферментов. Таким образом, лекарственное взаимодействие, вызванное метаболизмом, опосредованным цитохромом P450, не ожидается. Какое-либо клинически значимое взаимодействие между розувастатином и флуконазолом (ингибитор изоферментов CYP2C9 и CYP3A4) или кетоконазолом (ингибитор изоферментов CYP2A6 и CYP3A4) не наблюдалось.
Тикагрелор: тикагрелор может вызвать почечную недостаточность и может повлиять на выведение розувастатина почками, увеличивая риск накопления розувастатина. В некоторых случаях совместное применение тикагрелора и розувастатина приводило к снижению функции почек, повышению уровня КФК и рабдомиолизу. При одновременном применении тикагрелора и розувастатина рекомендуется контроль функции почек и КФК.
Взаимодействие, при котором требуется корректировка дозы розувастатина (см. также Таблицу ниже): В случаях, когда необходимо введение розувастатина одновременно с другими лекарственными средствами, которые обуславливают увеличение экспозиции розувастатина, следует скорректировать дозу розувастатина. Лечение начинают с дозы 5 мг розувастатина один раз в сутки, если ожидается увеличение экспозиции (AUC) приблизительно в 2 раза или больше. Максимальную суточную дозу розувастатина следует скорректировать таким образом, чтобы ожидаемый уровень экспозиции розувастатина не превысил уровень экспозиции, который наблюдается при применении суточной дозы 40 мг розувастатина, вводимого без взаимодействующих лекарственных средств: например, доза 20 мг розувастатина совместно с гемфиброзилом (1.9-кратное увеличение) и доза 10 мг розувастатина совместно с комбинацией атазанавир/ритонавир (3.1-кратное увеличение).
Если наблюдается увеличение AUC розувастатина менее чем в 2 раза, начальную дозу снижать не нужно, но следует соблюдать осторожность при увеличении дозы розувастатина выше 20 мг.
Таблица: Влияние совместно назначаемых лекарственных средств на экспозицию розувастатина (AUC; в порядке уменьшения величины) согласно опубликованным результатам клинических исследований
| 2-кратное или более чем 2-кратное увеличение AUC розувастатина | ||
| Схема дозирования взаимодействующего препарата | Схема дозирования розувастатина (мг) | Изменение AUC* розувастатина |
| Софосбувир/велпатасвир/воксилапревир (400 мг/100 мг/100 мг) + воксилапревир (100 мг) один раз в сутки в течение 15 дней | 10 мг, разовая доза | ↑ в 7.4 раза |
| Циклоспорин от 75 мг BID до 200 мг BID, 6 месяцев | 10 мг OD, 10 дней | ↑ в 7.1 раза |
| Даролутамид 600 мг BID, 5 дней | 5 мг, разовая доза | ↑ в 5.2 раза |
| Регорафениб 160 мг, OD, 14 дней | 5 мг, разовая доза | ↑ в 3.8 раза |
| Атазанавир 300 мг/ритонавир 100 мг OD, 8 дней | 10 мг, разовая доза | ↑ в 3.1 раза |
| Велпатасвир 100 мг OD | 10 мг, разовая доза | ↑ в 2.7 раза |
| Омбитасвир 25 мг/паритапревир 150 мг/Ритонавир 100 мг OD/дазабувир 400 мг BID, 14 дней | 5 мг, разовая доза | ↑ в 2.6 раза |
| Гразопревир 200 мг/эльбасвир 50 мг OD, 11 дней | 10 мг, разовая доза | ↑ в 2.3 раза |
| Глекапревир 400 мг/пибрентасвир 120 мг OD, 7 дней | 5 мг OD, 7 дней | ↑ в 2.2 раза |
| Лопинавир 400 мг/ритонавир 100 мг BID, 17 дней | 20 мг OD, 7 дней | ↑ в 2.1 раза |
| Клопидогрел 300 мг нагрузочная доза, затем 75 мг спустя 24 ч Гемфиброзил 600 мг BID, 7 дней |
20 мг, разовая доза
80 мг, разовая доза |
↑ в 2.0 раза ↑ в 1.9 раза |
| Менее чем 2-кратное увеличение AUC розувастатина | ||
| Элтромбопаг 75 мг OD, 5 дней | 10 мг, разовая доза | ↑ в 1.6 раза |
| Дарунавир 600 мг/ритонавир 100 мг BID, 7 дней | 10 мг OD, 7 дней | ↑ в 1.5 раза |
| Типранавир 500 мг/ритонавир 200 мг BID, 11 дней | 10 мг, разовая доза | ↑ в 1.4 раза |
| Дронедарон 400 мг BID | Не применимо | ↑ в 1.4 раза |
| Итраконазол 200 мг OD, 5 дней | 10 мг, разовая доза | ↑ в 1.4 раза** |
| Эзетимиб 10 мг OD, 14 дней | 10 мг OD, 14 дней | ↑ в 1.2 раза** |
| Снижение AUC розувастатина | ||
| Эритромицин 500 мг QID, 7 дней | 80 мг, разовая доза | ↓ 20% |
| Байкалин 50 мг TID, 14 дней | 20 мг, разовая доза | ↓ 47% |
* Данные, указанные в виде изменения в количество раз, отражают простое соотношение между совместным применением препаратов и монотерапией розувастатином. Данные, указанные в виде процентного (%) изменения, отражают процентную разницу по сравнению с монотерапией розувастатином. Увеличение обозначается как «↑», снижение как «↓».
**Было проведено несколько исследований взаимодействия с использованием различных доз розувастатина; в таблице указан наиболее значимый показатель.
OD = один раз в сутки; BID = два раза в сутки; TID = три раза в сутки; QID = четыре раза в сутки.
Следующие лекарственные препараты/комбинации не оказали клинически значимого влияния на AUC розувастатина при одновременном применении: Алеглитазар 0.3 мг при приеме 7 дней; Фенофибрат 67 мг 7 дней 3 раза в сутки; Флуконазол 200 мг, прием внутрь 11 дней; Фосампренавир 700 мг/ритонавир 100 мг 8 дней 2 раза в сутки; Кетоконазол 200 мг 7 дней два раза в день; Рифампицин 450 мг, прием внутрь 7 дней; Силимарин 140 мг 5 дней 3 раза в сутки.
Влияние розувастатина на совместно вводимые лекарственные средства
Антагонисты витамина K: как и в случае других ингибиторов ГМГ-КоА-редуктазы, начало терапии розувастатином или повышение его дозы у пациентов, одновременно получающих лечение с помощью антагонистов витамина K (например, варфарин или другой кумариновый антикоагулянт), может привести к увеличению международного коэффициента нормализации (МКН). Отмена розувастатина или уменьшение его дозы может привести к снижению показателя МКН. В таких случаях целесообразно осуществлять надлежащий мониторинг показателя МКН.
Пероральные контрацептивы/гормонозаместительная терапия (ЗГТ): cовместное применение розувастатина и перорального контрацептива привело к увеличению показателя AUC этинилэстрадиола и норгестрела на 26% и 34% соответственно. Подобное увеличение уровней в плазме следует учитывать при подборе дозы перорального контрацептива. Отсутствуют какие-либо фармакокинетические данные в отношении субъектов, одновременно получающих розувастатин и ЗГТ, в связи с чем аналогичный эффект не может быть исключен. Тем не менее, данная комбинация широко использовалась у женщин в рамках клинических исследований и характеризовалась хорошей переносимостью.
Другие лекарственные средства
Дигоксин: cогласно данным отдельных исследований взаимодействия, какое-либо клинически значимое взаимодействие с дигоксином не ожидается.
Фузидовая кислота: риск развития миопатии, включая рабдомиолиз, может быть повышен в случае применения системной фузидовой кислоты одновременно со статинами. Механизм данного взаимодействия (фармакодинамический, фармакокинетический либо сочетание двух) по-прежнему неизвестен. Сообщалось о случаях развития рабдомиолиза (включая несколько случаев со смертельным исходом) у пациентов, получающих данную комбинацию.
В случае если необходимо лечение системной фузидовой кислотой, терапию розувастатином следует прекратить на весь период лечения фузидовой кислотой. Также см. раздел «Особые указания».
Педиатрическая популяция
Степень взаимодействия для педиатрической популяции неизвестна.
Условия отпуска из аптек
По рецепту врача *.
* Включен в перечень препаратов, реализуемых без рецепта врача согласно Постановления МЗ РБ №27 от 9 февраля 2023г.
Срок годности препарата
Срок годности: 3 года.
Хранить в оригинальной упаковке при температуре не выше 30 °С. Хранить в недоступном для детей месте.
Несовместимость: не применимо.
Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата или работы с ним.
Нет особых требований к утилизации.
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Контакты для обращений
КРКА д.д., представительство, (Словения)

Представительство АО «KRKA, d.d., Novo mesto» (Словения) в Беларуси
220114 Минск, ул. Филимонова 25Г, оф. 315, 3 этаж
Тел/факс: (375-740) 740-92-30
E-mail: info.by@krka.biz
Продукт: инду 5000 — дезинфицирующее средство с моющим эффектом в форме раствора, предназначенное для дезинфекции объектов ветнадзора и профилактики инфекционных болезней животных и птиц. фасовка: по 10кг, 25кг, 220 кг.
- 👉 Узнать больше об изготовителе: инду 5000 — дезинфицирующее средство…
- 👉 Производитель: страна, название, адрес производства
- 📗 Разрешения и протоколы, сертификаты, документация
- 👉 Орган выдавший декларацию РОСС DE.ОС16.Д00616
- 🔖 Проверить наличие скана декларация соответствия в нашей базе
- 💰Стоимость на декларацию или сертификат
- 🔎 Поиск производителя
- 👉Другие декларации от компании EWABO Chemikalien GmbH
- 👉Похожие декларации о соответствии на текущую продукцию
Кто декларант?

Производитель контакты

Продукция и предоставленные документы

Кем осуществлялась сертификация?

Информация о документе
Получить консультацию от эксперта
Бесплатная консультация от эксперта Кизьяков Анатолий Петрович, старший специалист органа по сертификации Получить консультацию
Экcпорт Емкость 5000 литров из России
Компания осуществляющие экспорт Емкость 5000 литров из России, включая, таможенные платежи, логистику до Азии, Европы, США — ЭкспортВ
Проверить наличие скан копии для декларации РОСС DE.ОС16.Д00616
Запустить проверку проверка. Примерно время проверки 2 минуты
Подбор поставщика: логистика и таможня
👉 https://buroimporta.ru
Осуществляют таможню и логистику под «ключ». Ввоз под свой контаркт

Ирина
ИМПОРТР
👉 https://import-v-rossiu.ru
Самая дешевая логистика и таможня

Воронцов Сергей
Б2Б ПОСТАВКИ
👉 https://b2b-postavki.ru
Поиск поставщиков для покупки и продажи товаров импорт/экспорт

ИРИНА
КОДТНВЭД.РУ
👉 https://kodtnved.ru
Полная база по подбору Кода ТН ВЭД
Цены на декларацию соответствия ТР ТС
- Консультация по необходимым документам
Популярная
- Декларация соответствия
- Скан
- Курьерские услуги
- Гарантии
- Декларация
- Протокол испытаний
- Курьер
- Скан
Отзывы об изготовлении декларации соответствия ТР ТС

Анна Герман
Технолог ООО «Повидло России»
Мы заказывали на нашу продукцию декларацию сроком на 5 лет. Сделали очень быстро. Остались довольные результатом

Михаил Терехов
ООО «Русимпорт»
Ввозим для наших клиентов оборудование из Китая. Для нас главное чтобы быстро делали документы. Все супер

Алексей Ершов
Производитель КПП
Мы занимаемся производством кабелей и проводников. Нам постоянно требуется декларации и сертификаты. Довольный результатом.

Маша Вершагина
производство товаров для новорожденных
Не возможно заниматься продажами без документов для детской продукции за этим особенно следят. Все протоколы испытаний и декларации получили вовремя. Остались довольны сотрудничеством
— Больший размер
— Поддержка опорно-двигательного аппарата
— Помогает сохранять кости крепкими
— Поддерживает иммунную систему
— Без ГМО
— Пищевая добавка
— Кошерный продукт, содержит желатин
— Витамины
— Семейное предприятие, основанное в 1968 году
— Имеет регистрацию GMP
Принимать по 1 капсуле раз в 2 дня с жиросодержащей едой или в соответствии с рекомендациями врача. Ингредиенты Капсула (бычий желатин, вода, глицерин) и оливковое масло холодного отжима. При производстве не используются дрожжи, пшеницы, глютена, сои, кукурузы, молока, яиц, рыба и моллюски. Производится на предприятии, имеющем регистрацию надлежащей производственной практики (GMP), где обрабатываются другие ингредиенты, содержащие эти аллергены.
— Продукт может естественным образом менять цвет.
— После вскрытия упаковки хранить в сухом и прохладном месте.
-Только для взрослых.
— Не следует превышать рекомендуемую дозировку.
— Перед применением во время беременности, лактации, приема лекарств (особенно препаратов для лечения псориаза для местного применения или тиазидных диуретиков) или при наличии каких-либо заболеваний (особенно гиперкальциемии, заболеваний почек или гиперпаратиреоза) следует проконсультироваться с врачом.
Хранить в недоступном для детей месте.
Каждая таблетка, покрытая пленочной оболочкой, содержит:
Активные ингредиенты: 5000 ME витамина D3 (эквивалентно 125 мкг холекальциферола) 50 мг;
Вспомогательные ингредиенты: микрокристаллическая целлюлоза РН102, кремния диоксид коллоидный гидратированный, дикальция фосфат безводный, магния стеарат, кроскармеллоза натрия;
Оболочка: Сепифилм LP014 прозрачный (гидроксипропилметилцеллюлоза, микрокристаллическая целлюлоза, стеариновая кислота), Сеписперс сухой 5047 красный (гидроксипропилметилцеллюлоза, микрокристаллическая целлюлоза, титана диоксид Е171, железа оксид красный Е172).
Витамины. Витамин D и аналоги.
Код ATX: А11СС05
Фармакодинамика
Холекальциферол (витамин D3) формируется в коже под действием ультрафиолетового облучения и превращается в биологически активную форму, 1,25-гидроксихолекальциферол, в два этапа гидроксилирования: первый происходит в печени (положение 25), второй — в почках (положение 1). Наряду с паратгормоном и кальцитонином 1,25-гидроксихолекальциферол оказывает значительное влияние на регуляцию кальций-фосфорного обмена. В своей биологически активной форме витамин D усиливает всасывание кальция в кишечнике, встраивание кальция в остеоид и выход кальция из костной ткани. При дефиците витамина D не происходит кальцификации скелета (что приводит к развитию рахита) или наблюдается декальцификация костей (что приводит к остеомаляции). Дефицит кальция и/или витамина D вызывает обратимое увеличение секреции паратгормона. Подобный вторичный гиперпаратиреоз становится причиной усиления метаболизма в костной ткани, что в свою очередь может привести к возникновению хрупкости костей и переломам.
В соответствии с продукцией, физиологической регуляцией и механизмом действия витамин D может расцениваться в качестве прекурсора стероидного гормона. В дополнение к холекальциферолу, образующемуся в физиологических условиях в коже, его дополнительные количества могут поступать в организм с пищей или в форме лекарственных средств. Поскольку в последнем случае ингибирования образования синтеза витамина D не происходит, возможно развитие передозировки и симптомов интоксикации. Эргокальциферол (витамин D2) синтезируется растениями. Человеческий организм метаболизирует его в активную форму способом, аналогичным активации холекальциферола. Он обладает такими же количественными и качественными характеристиками.
Фармакокинетика
В дозах, поступающих с пищей, витамин D почти полностью всасывается вместе с алиментарными липидами. При более высоких дозах всасывается примерно две трети витамина D. Кожа под действием ультрафиолетового облучения синтезирует витамин D из 7-дегидрохолестерола. Витамин D переносится в печень специфическим транспортным белком. В печени он метаболизируется микросомальной гидроксилазой до 25-гидроксихолекальциферола. Витамин D и его метаболиты выводятся из организма с желчью и калом.
Витамин D накапливается в мышечной и жировой ткани и поэтому имеет длительный биологический период полувыведения. После приема высоких доз витамина D концентрация 25-гидроксивитамина D в плазме крови может оставаться повышенной в течение нескольких месяцев. Гиперкальциемия, вызванная передозировкой витамина D, может сохраняться несколько недель (также см. раздел «Передозировка»).
Фармацевтические свойства
Фармацевтические непереносимости
Отсутствуют.
— Профилактика и лечение дефицита витамина D у взрослых и подростков (с 12 до 18 лет);
— В качестве дополнения к специфической терапии остеопороза у пациентов с риском дефицита витамина D, предпочтительно в сочетании с кальцием.
Лекарственное средство принимается внутрь, во время еды.
Профилактика и лечение дефицита витамина D у взрослых и подростков (с 12 до 18 лет).
— Профилактическая доза витамина D определяется индивидуально врачом с учетом возраста, поступления витамина D из других источников (пища, инсоляция), избыточной массы тела (ожирения) пациента, приема лекарственных средств, влияющих на метаболизм витамина D. Обычно рекомендуемая доза составляет 500-1000 ME витамина D в сутки.
— Лечебная доза витамина D и продолжительность лечения определяется индивидуально врачом с учетом исходной степени тяжести дефицита витамина D, подтвержденной лабораторно, возраста, поступления витамина D из других источников (пища, инсоляция), избыточной массы тела (ожирения) пациента, приема лекарственных средств, влияющих на метаболизм витамина D. Обычно рекомендуемая доза составляет 5000 — 6000 ME витамина D в сутки. Продолжительность лечения — до 6-8 недель с последующим лабораторным контролем концентрации 25-(ОН) D в крови и решением вопроса о продолжительности приема или переходе на прием профилактической дозы. Более высокие дозы могут быть назначены индивидуально по усмотрению врача с учетом соотношения польза-риск.
В качестве дополнения к специфической терапии остеопороза у пациентов с риском дефицита витамина D: рекомендуемая доза витамина D составляет 800-2000 ME витамина D в сутки. Для пожилых пациентов, которые особенно подвержены риску переломов, рекомендуемая доза составляет 2000 ME витамина D в сутки. Пациенты должны получать дополнительно кальций, если его потребление с пищей недостаточно.
Определенные группы пациентов с высоким риском дефицита витамина D могут нуждаться в более высоких дозировках, при этом необходимо проводить контроль концентрации 25-(ОН) D в крови:
• лица, страдающие алкоголизмом
• институционализированные или госпитализированные лица
• темнокожие
• пациенты с заболеваниями гепатобилиарной системы — нарушение печеночной функции, цирроз, обструктивная желтуха
• пациенты с нарушением всасывания, в т.ч. страдающие мальабсорбцией, воспалительными заболеваниями кишечника и глютеновой энтеропатией
• лица с недостаточной инсоляцией из-за защитной одежды либо постоянного использования солнцезащитного крема
• лица, страдающие от ожирения
• лица с диагностированным остеопорозом
• лица, принимающие сопутствующие лекарственные препараты (например, противосудорожные препараты, глюкокортикоиды)
• лица, проходившие терапию дефицита витамина D, которым необходима поддерживающая терапия
• лица с ограниченным воздействием солнца, в том числе и дети.
Дозировка при печеночной недостаточности
Корректировка дозы не требуется.
Дозировка при почечной недостаточности
Витамин D не следует применять у пациентов с тяжелой почечной недостаточностью.
Младенцы и дети (0 -12 лет)
Не рекомендуется детям до 12 лет.
Пожилой возраст
В пожилом возрасте потребность в витамине D может возрастать вследствие уменьшения абсорбции витамина D, снижения способности кожи синтезировать провитамин D, уменьшения времени инсоляции, возрастания частоты возникновения почечной недостаточности. Доза лечения дефицита витамина D у пожилых людей определяется индивидуально врачом в зависимости от течения и тяжести заболевания.
Если Вы забыли принять лекарственное средство Д-Bит Ламира, не принимайте удвоенную дозу для компенсации пропущенной!
Не прекращайте прием лекарственного средства без предварительной консультации с лечащим врачом!
Если у Вас возникли сомнения или вопросы, обратитесь к своему лечащему врачу.
— Гиперчувствительность к витамину D или компонентам препарата.
— Гипервитаминоз D.
— Почечная остеодистрофия с гиперфосфатемией.
— Гиперкальциемия и/или гиперкальциурия.
— Мочекаменная болезнь.
— Тяжелая почечная недостаточность.
— Детский возраст до 12 лет.
С осторожностью:
— Беременность
— Саркоидоз
До начала лечения витамином D необходимо оценить уровень кальция и фосфатов в крови. Для обеспечения эффективности лечения необходимо обеспечить адекватное потребление кальция с пищей. Пациенты должны получать дополнительно кальций, если потребление из пищи недостаточно.
При выборе дозы витамина D необходимо учесть количество его потребления из других источников (в продуктах питания, БАД и от солнечного воздействия). Дозировку выбирают индивидуально.
Во время терапии витамином D большое значение для достижения эффекта имеет уровень потребления кальция и фосфора.
Всем пациентам, принимающим фармакологические дозировки витамина D, следует регулярно проверять концентрацию кальция в плазме при каждом случае рвоты.
Вследствие вариации индивидуальной чувствительности к витамину D, его дозировка может быть скорректирована в зависимости от клинической эффективности.
Наблюдение за пациентами
Следующие показатели могут быть полезны при наблюдении за пациентами (при необходимости, в зависимости от состояния пациента могут потребоваться показатели других тестов):
— Концентрация кальция в крови или уровень ионизированного кальция плазмы. Из-за узкого терапевтического диапазона рекомендуется определение этих показателей по крайней мере 1 раз в неделю в ранний период лечения, затем — периодически во время лечения. При наличии возможности стоит определять концентрацию как свободного, так и связанного кальция в крови.
— Уровень алкалиновой (щелочной) фосфатазы в плазме крови, концентрация фосфатов в крови, концентрация кальция в 24-х часовой моче, соотношение кальция и креатинина в моче. Рекомендуется определение этих показателей каждые 1-3 месяца во время терапии.
— Азот мочевины плазмы крови и креатинин плазмы. Рекомендуется периодическое определение у пациентов, получающих терапевтические дозы.
Чтобы избежать гиперкальциемии лечение необходимо проводить под врачебным контролем.
Кальциевые добавки необходимо применять под врачебным контролем и отслеживать уровни кальция и фосфатов. Следует также учитывать риск кальциноза мягких тканей. Абсорбция кальция может быть уменьшена оральным применением сульфата натрия либо парентеральным применением магния сульфата.
Витамин D следует применять с осторожностью у пациентов с нарушенной функцией почек, а во время приема препарата рекомендуется контроль уровня кальция и фосфатов. Следует учитывать риск кальцификации мягких тканей. Так как у пациентов с тяжелой почечной недостаточностью витамин D в виде холекальциферола не может нормально метаболизироваться, таким пациентам следует назначать другие формы витамина D (см. раздел «Противопоказания»).
Следует соблюдать осторожность при применении витамина D у пациентов с сердечно-сосудистыми заболеваниями, получающих лечение соответствующими препаратами (сердечные гликозиды, диуретики).
Следует избегать одновременного применения мультивитаминных препаратов и диетических добавок, содержащих витамин D.
Имеются сообщения о том, что пероральный прием высоких доз витамина D (500 000 ME однократно болюсно) приводил к увеличению риска переломов у пожилых людей, наибольшее увеличение имело место в течение первых 3 месяцев после приема препарата.
Лечение витамином D может выявить ранее недиагностированный первичный гиперпаратиреоз. Скорректированные уровни кальция в сыворотке крови должны быть проверены через 1 месяц после завершения нагрузочного режима или после начала добавки витамина D в случае выявления первичного гиперпаратиреоза.
Таблетки не следует принимать в случае псевдогипопаратиреоза (потребность в витамине D может быть уменьшена иногда нормальной чувствительностью к витамину D с риском передозировки при длительном приеме). В таких случаях доступны другие производные витамина D.
В случае гиперкальциурии (более 300 мг (7,5 ммоль) /24 часа), либо при наличии признаков нарушений функций почек доза должна быть уменьшена или лечение прекращено.
Холекальциферол следует назначать с осторожностью пациентам с саркоидозом вследствие риска повышенного метаболизма витамина D в его активную форму. У таких пациентов необходим мониторинг содержания кальция в сыворотке крови и моче.
Аналогичный контроль необходим для детей, чьи матери получали лечение витамином D в фармакологических дозах. Некоторые дети могут реагировать повышенной чувствительностью к воздействию витамина D.
Имеются ограниченные данные о применении холекальциферола у беременных женщин. Исследования на животных показали его репродуктивную токсичность. Также у беременных женщин следует избегать передозировки витамина D, так как длительная гиперкальциемия иногда ассоциировалась с замедлением физического и умственного развития, надклапанным аортальным стенозом и ретинопатией у ребенка.
Рекомендуемая ежедневная дозировка для беременных и кормящих женщин составляет 400 ME, однако более высокая дозировка (до 2000 МЕ/день) может быть необходима для женщин с дефицитом витамина D. Во время беременности женщины должны следовать рекомендациям лечащего врача, т.к. требования по применению зависят от тяжести заболевания и клинического ответа.
Витамин D и его метаболиты экскретируются в грудное молоко; однако, у младенцев не зафиксировано случаев передозировки, вызванных содержанием витамина D в молоке матери.
При назначении витамина D ребенку врачу следует учитывать дополнительную дозировку витамина D, который принимает кормящая мать ребенка.
Одновременное применение противосудорожных препаратов (например, фенитоина), гидантоина, примидона или барбитуратов (и, возможно, других средств, которые вызывают индукцию печеночных ферментов) может уменьшить эффект витамина D за счет метаболической инактивации.
Одновременное применение глюкокортикоидов может уменьшить эффект витамина D.
Системные кортикостероиды подавляют всасывание кальция.
Длительный прием кортикостероидов может компенсироваться влиянием витамина D.
В случаях лечения препаратами, содержащими дигиталис, или другими сердечными гликозидами, одновременное применение витамина D может увеличить риск токсичности сердечных гликозидов (аритмии). Необходим строгий врачебный контроль, а также мониторинг концентрации кальция в сыворотке крови и ЭКГ — в случае необходимости.
Одновременный прием ионообменных смол, таких как холестирамин, или слабительных средств, таких как парафиновое масло, может уменьшить желудочно-кишечную абсорбцию витамина D.
Тиазидные диуретики уменьшают экскрецию кальция с мочой. Прием большого количества витамина D вместе с диуретиками может привести к избытку кальция в организме. В случаях одновременного лечения с тиазидными диуретиками, которые снижают выведение кальция с мочой, рекомендуется мониторинг концентрации кальция в сыворотке крови.
Цитотоксический агент актиномицин и противогрибковые средства имидазола при взаимодействии с витамином D ингибируют превращение 25-гидроксивитамина D в 1,25-дигидроксивитамин D под действием фермента почек, 25-гидроксивитаминД-1-гидроксилазы.
Использование кальцийсодержащих продуктов в больших дозах может увеличить риск гиперкальциемии.
Не следует использовать растворы фосфатов для снижения гиперкальциемии при гипервитаминозе D из-за риска метастатического кальциноза.
Следует избегать приема продуктов, содержащих магний (например, антацидов), поскольку это может привести к риску гипермагниемии. Витамин D увеличивает абсорбцию препаратов, содержащих фосфор, и риск возникновения гиперфосфатемии.
Одновременное применение кальцитонина, этидроната, нитрата галлия, памидроната, пликамицина с витамином D может антагонизировать влияние этих лекарственных средств при лечении гиперкальциемии.
Д-Вит Ламира не влияет на способность к управлению автотранспортом и на работу с механизмами.
Побочные эффекты перечислены по классу системы органов и частоте. Частота определяется как: иногда (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000) либо неизвестно (невозможно оценить по имеющейся информации).
Нарушения иммунной системы
Неизвестно: реакции гиперчувствительности, такие как ангиоэдема, отек гортани
Нарушения со стороны обмена веществ и питания
Иногда: гиперкальциемия и гиперкальциурия
Нарушения со стороны кожи и подкожной ткани
Редко: зуд, сыпь и крапивница
У детей возможна задержка роста, особенно после приёма холекальциферола в течение длительного периода времени в дозе 45 мкг (1800 единиц) в день. Ранние симптомы гипервитаминоза витамина D, обусловленные гиперкальциемией:
Запор, как правило, чаще у детей и подростков; диарея; сухость во рту; длительная головная боль; усиливающаяся жажда; увеличение частоты мочеиспускания, особенно в ночное время, или увеличение объёма выделяемой мочи; потеря аппетита; металлический привкус во рту; тошнота или рвота (чаще у детей и подростков); необычная усталость или общая слабость.
Поздние симптомы гипервитаминоза витамина D, обусловленные гиперкальциемией: боли в костях, помутнение мочи, артериальная гипертензия, фоточувствительность или раздражение глаз, аритмия, зуд кожи, вялость (сонливость), мышечные боли, тошнота или рвота, панкреатит (сильная боль в животе), психоз, перемена настроения или изменения психики, быстрая потеря веса.
При появлении перечисленных побочных реакций, а также реакций, не указанных в инструкции, пациенту рекомендуется обратиться к своему лечащему врачу.
Сообщение о побочных реакциях
Если у Вас появились нежелательные реакции, сообщите об этом своему лечащему врачу. Это также относится к любым нежелательным реакциям, которые не указаны в данной инструкции. Вы можете сообщить о нежелательных реакциях в информационную базу данных по нежелательным реакциям (действиям) на лекарственные препараты, включая сообщения о неэффективности лекарственных препаратов, выявленным в Республике Беларусь (УП «Центр экспертиз и испытаний в здравоохранении» Министерства здравоохранения Республики Беларусь», www.rceth.by). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Чрезмерное потребление витамина D приводит к развитию гиперкальциемии и связанным с ней эффектам, в том числе к гиперкальциурии, эктопической кальцификации, повреждениям почек и сердечно-сосудистым повреждениям. Симптомы передозировки включают: анорексию, усталость, тошноту и рвоту, диарею, полиурию, потливость, головную боль, жажду и головокружение, боль в костях, аритмии, кому и даже смерть (при тяжелой гиперкальциемии), необратимые повреждения почек (при персистирующей гиперкальциемии). Индивидуальная непереносимость витамина D значительно варьируется; новорожденные и дети, как правило, более чувствительны к его токсическим эффектам.
Рекомендуемое лечение:
Гипервитаминоз витамина D лечится отменой витаминов, диетой с низким содержанием кальция и обильным потреблением жидкости. Если гиперкальциемия сохраняется, можно перейти на диету с низким содержанием кальция и начать введение преднизолона. Тяжелую форму гиперкальциемии можно лечить кальцитонином, этидронатом, памидронатом или нитратом галлия. Гиперкальциемический криз требует интенсивной гидратации физиологическим раствором хлорида натрия, чтобы увеличить выведение кальция, с применением петлевых диуретиков или без таковых. Сердечные аритмии можно лечить малыми дозами калия с непрерывным кардиомониторингом.
Канцерогенность, мутагенность, нарушение репродуктивной функции.
Установлено, что холекальциферол в высоких дозах (в 4-15 раз, превышающих допустимую для человека дозу) обладает тератогенным эффектом у животных. У потомства беременных самок кроликов, получавших высокие дозы витамина D, имелись анатомические повреждения, идентичные тем, которые бывают при надклапанном аортальном стенозе, а у особей потомства, не имевших признаков таких изменений, наблюдалась васкулотоксичность, подобная той, которая имела место у взрослых особей, при острой интоксикации витамином D.
3 года
Не использовать после истечения срока годности, указанного на упаковке.
Хранить в защищенном от влаги месте при температуре не выше 30°С.
Хранить в недоступном для детей месте.
15 таблеток, покрытых пленочной оболочкой, в ПВХ/ПВДХ-алюминий блистере, по 1 или 2 блистера вместе с инструкцией по медицинскому применению для пациентов упаковано в картонную пачку.
30 таблеток, покрытых пленочной оболочкой, в ПВХ/ПВДХ-алюминий блистере, по 1 или 2 блистера вместе с инструкцией по медицинскому применению для пациентов упаковано в картонную пачку.
Информация о производителе
Ламира ЛЛП, Великобритания.
1-й этаж, 14 Боулинг Грин Лэйн, Лондон EC1R 0BD, Великобритания.
E-mail: info@lamyra.org
Сайт: www.lamyra.org, www.lamyra.by
Произведено: Квест Витаминз Мидл Ист ФЗЕ, Дубай, ОАЭ.

