Фармакологическое действие
Инотузумаб озогамицин представляет собой конъюгат моноклонального антитела и химического препарата (ADC), обладающий специфичностью к CD22. В качестве антитела используется гуманизированное антитело lgG4, которое специфически связывается с CD22 человека. Небольшая молекула, N-ацетил-гамма-калихеамицин, является цитотоксическим полусинтетическим натуральным веществом. N-ацетил-гамма-калихеамицин ковалентно связан с антителом с помощью линкера.
Противоопухолевая активность инотузумаба озогамицина обусловлена связыванием ADC с опухолевыми клетками, экспрессирующими CD22, с последующей интернализацией комплекса ADC-CD22 и высвобождением внутри клетки N-ацетил-гамма-калихеамицина диметилтиазида в результате гидролитического расщепления линкера. Активация N-ацетил-гамма-калихеамицина диметилтиазида индуцирует разрыв двухцепочечной ДНК, что в последующем приводит к остановке клеточного цикла и апоптотической гибели опухолевой клетки.
В период лечения фармакодинамический ответ к инотузумабу озогамицину был охарактеризован уменьшением количества CD-22 позитивных лейкозных клеток.
Фармакокинетика
У пациентов с рецидивирующим или рефрактерным острым лимфобластным лейкозом воздействие в равновесном состоянии было достигнуто к циклу 4. Средняя Cmax инотузумаба озогамицина составила 308 нг/мл. Средняя симулированная общая AUC на цикл составила 100000 нг×ч/мл.
In vitro связывание N-ацетил-гамма-калихеамицина диметилгидразида с белками плазмы крови человека составило примерно 97%. Общий Vd инотузумаба озогамицина — приблизительно 12 л.
После многократного введения препарата к циклу 4 отмечено 5.3-кратное накопление инотузумаба озогамицина.
In vitro N-ацетил-гамма-калихеамицин диметилгидразид в основном метаболизировался путем неферментного расщепления. У человека сывороточные уровни N-ацетил-гамма- калихеамицина диметилгидразида обычно находились ниже порога количественного определения. In vitro N-ацетил-гамма-калихеамицина диметилгидразид является субстратом Р-гликопротеина (P-gp).
Фармакокинетика инотузумаба озогамицина была хорошо описана двухкомпартментной моделью с линейными и зависимыми от времени компонентами клиренса. У 234 пациентов с рецидивирующим или рефрактерным ОЛЛ клиренс инотузумаба озогамицина в равновесном состоянии составил 0.0333 л/ч, а конечный Т1/2 составил 12.3 дней.
Площадь поверхности тела в значительной мере влияет на распределение инотузумаба озогамицина. Доза инотузумаба озогамицина назначалась по расчету на площадь поверхности тела.
Показания активного вещества
ИНОТУЗУМАБ ОЗОГАМИЦИН
В качестве монотерапии для лечения взрослых пациентов с рецидивирующим или рефрактерным CD22-положительным В-клеточным острым лимфобластным лейкозом из клеток-предшественников, в т.ч. у взрослых пациентов с положительным по филадельфийской хромосоме (Ph+) В-клеточным острым лимфобластным лейкозом из клеток-предшественников после неудачной терапии как минимум одним ингибитором тирозинкиназы.
Режим дозирования
Применяют в/в, в виде инфузий. Инотузумаб озогамицин вводят в течение 3- или 4-недельных циклов.
Доза и продолжительность лечения инотузумабом озогамицином зависит от клинической ситуации.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто — инфекция, включая сепсис и бактериемию, грибковые инфекции, инфекции нижних дыхательных путей, инфекции верхних дыхательных путей, бактериальные инфекции, вирусные инфекции, инфекции ЖКТ, кожные инфекции.
Со стороны системы кроветворения: очень часто — фебрильная нейтропения, нейтропения, тромбоцитопения, лейкопения, лимфопения, анемия; часто — панцитопения.
Со стороны иммунной системы: часто — реакции гиперчувствительности.
Со стороны обмена веществ: часто — гиперурикемия.
Со стороны нервной системы: очень часто — головная боль.
Со стороны сосудов: очень часто — кровотечение, включая кровотечение в ЦНС, кровотечение из верхних отделов ЖКТ, кровотечение из нижних отделов ЖКТ, носовое кровотечение.
Со стороны пищеварительной системы: очень часто — пониженный аппетит, боль в животе, рвота, диарея, тошнота, стоматит, запор, гипербилирубинемия, повышение активности трансаминаз, повышение активности ЩФ, ГГТ; часто — асцит, вздутие живота, веноокклюзионная болезнь печени (синусоидальный обструкционный синдром).
Прочие: очень часто — инфузионная реакция, пирексия, повышенная утомляемость, озноб; часто — синдром лизиса опухоли.
Со стороны лабораторных и инструментальных исследований: часто — удлинение интервала QT на ЭКГ, повышение активности амилазы, повышение активности липазы.
Противопоказания к применению
Повышенная чувствительность к инотузумабу озогамицину; веноокклюзионная болезнь печени/синдром синусоидальной обструкции, в т.ч. в анамнезе; тяжелые заболевания печени (например, цирроз, узловая регенеративная гиперплазия печени, гепатит в активной стадии); терминальная стадия почечной недостаточности; беременность, период грудного вскармливания; возраст до 18 лет.
С осторожностью следует назначать инотузумаб озогамицин пациентам пожилого возраста с трансплантацией гемопоэтических стволовых клеток в анамнезе, получающим терапию «спасения» последующих линий или имеющим заболевание печени и/или гепатит в анамнезе; пациентам с удлинением интервала QT в анамнезе или с предрасположенностью к его удлинению, которые получают лекарственные препараты, обладающие известной способностью удлинять интервал QT, и пациентам с электролитными нарушениями.
Применение при беременности и кормлении грудью
Противопоказано применение инотузумаба озогамицина во время беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Противопоказано применение при тяжелых заболеваниях печени (например, цирроз, узловая регенеративная гиперплазия печени, гепатит в активной стадии).
Применение при нарушениях функции почек
Пациентам с терминальной стадией почечной недостаточности противопоказано применение инотузумаба озогамицина.
Применение у детей
Противопоказано применение у пациентов в возрасте до 18 лет.
Применение у пожилых пациентов
Коррекция начальной дозы у пациентов пожилого возраста не требуется.
С осторожностью следует назначать инотузумаб озогамицин пациентам пожилого возраста с трансплантацией гемопоэтических стволовых клеток в анамнезе, получающим терапию «спасения» последующих линий или имеющим заболевание печени и/или гепатит в анамнезе.
Особые указания
В связи с риском веноокклюзионной болезни печени/синдрома синусоидальной обструкции, особенно после трансплантации гемопоэтических стволовых клеток, пациентов следует тщательно наблюдать на предмет развития признаков и симптомов веноокклюзионной болезни печени/синдрома синусоидальной обструкции, к которым могут относиться повышение уровня общего билирубина, гепатомегалия (которая может сопровождаться болевым синдромом), быстрое увеличение массы тела и асцит. Мониторинг только уровня общего билирубина может не выявить всех пациентов с риском веноокклюзионной болезни печени/синдрома синусоидальной обструкции. У всех пациентов следует осуществлять мониторинг биохимических показателей функции печени, включая ACT, АЛТ, общий билирубин и ЩФ, до и после введения каждой дозы инотузумаба озогамицина. Для пациентов, у которых возникают отклонения от нормы биохимических показателей функции печени, рекомендуется более частый мониторинг этих показателей и клинических признаков и симптомов гепатотоксичности. У пациентов, которым выполняется последующая трансплантация гемопоэтических стволовых клеток, рекомендуется тщательно контролировать биохимические показатели функции печени в ходе первого месяца после трансплантации гемопоэтических стволовых клеток, а затем менее часто согласно стандартной медицинской практике.
При повышении активности печеночных ферментов может потребоваться временное прекращение применения, снижение дозы или полная отмена инотузумаба озогамицина.
В связи с риском развития веноокклюзионной болезни печени, для пациентов, которым планируется выполнение трансплантации гемопоэтических стволовых клеток, рекомендуемая продолжительность лечения инотузумабом озогамицином составляет 2 цикла; 3 цикл терапии может быть назначен тем пациентам, у которых не была достигнута полная ремиссия/полная ремиссия с неполным гематологическим восстановлением или не достигнут отрицательный показатель минимальной остаточной болезни после 2 цикла. Следует избегать применения режимов кондиционирования для трансплантации гемопоэтических стволовых клеток, включающих 2 алкилирующих средства.
При возникновении веноокклюзионной болезни печени/синдрома синусоидальной обструкции лечение следует полностью прекратить. При возникновении тяжелых веноокклюзионной болезни печени/синдрома синусоидальной обструкции следует проводить лечение согласно стандартной медицинской практике.
Следует определять показатели общего анализа крови перед введением каждой дозы инотузумаба озогамицина и наблюдать пациентов на предмет признаков и симптомов инфекции во время лечения и после трансплантации гемопоэтических стволовых клеток, кровотечения/кровоизлияния или других проявлений миелосупрессии в ходе лечения инотузумабом озогамицином. В соответствующих случаях проводят профилактическую противоинфекционную терапию и выполняют контрольные анализы в ходе лечения инотузумабом озогамицином и после его окончания. При лечении пациентов с тяжелой инфекцией, кровотечением/кровоизлиянием или другими проявлениями миелосупрессии, включая тяжелую нейтропению или тромбоцитопению, может потребоваться временное прекращение, снижение дозы или полное прекращение применения инотузумаба озогамицина.
Пациентов следует тщательно наблюдать во время инфузии и по меньшей мере в течение 1 ч после ее окончания на предмет потенциального возникновения инфузионных реакций, которые могут сопровождаться такими симптомами, как гипотензия, приливы крови, сыпь или нарушение дыхания. При возникновении инфузионной реакции следует прекратить инфузию и начать соответствующую терапию. В зависимости от тяжести инфузионной реакции следует рассмотреть вопрос о прекращении инфузии или введении стероидов либо антигистаминных препаратов. При тяжелых или угрожающих жизни инфузионных реакциях лечение инотузумабом озогамицином следует полностью прекратить.
Пациентов следует наблюдать на предмет признаков и симптомов синдрома лизиса опухоли и лечить их согласно стандартной медицинской практике.
Инотузумаб озогамицин следует вводить с осторожностью пациентам с удлинением интервала QT в анамнезе или с предрасположенностью к его удлинению, которые получают лекарственные препараты, обладающие известной способностью удлинять интервал QT, и пациентам с электролитными нарушениями. До начала лечения и в ходе лечения пациентам следует выполнять ЭКГ и определять уровень электролитов в крови.
Рекомендуется осуществлять мониторинг увеличения активности амилазы и липазы у пациентов. Следует оценивать возможность развития заболеваний печени и желчевыводящих путей и проводить лечение в соответствии со стандартной медицинской практикой.
Не рекомендуется проводить вакцинацию живыми вирусными вакцинами по крайней мере за 2 недели до начала лечения инотузумабом озогамицином, во время лечения и до восстановления уровня В-лимфоцитов после последнего цикла лечения.
Влияние на способность к управлению транспортными средствами и механизмами
Инотузумаб озогамицин может влиять на способность управлять автотранспортными средствами и работать с механизмами. У пациентов может возникать повышенная утомляемость во время лечения инотузумабом озогамицином, поэтому при управлении автотранспортными средствами или работе с механизмами пациентам следует соблюдать осторожность.
Лекарственное взаимодействие
При совместном применении инотузумаба озогамицина с лекарственными препаратами, обладающими известной способностью удлинять интервал QT или вызывать желудочковую пароксизмальную тахикардию типа «пируэт», следует контролировать интервал QT.
Биспонса — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005883
Торговое наименование препарата:
Биспонса
Международное непатентованное наименование:
Инотузумаб озогамицин
Лекарственная форма:
лиофилизат для приготовления концентрата для приготовления раствора для инфузий
Состав:
Действующее вещество: инотузумаб озогамицин 1 мг
Вспомогательные вещества: трометамол 10 мг, сахароза 200 мг, полисорбат 80 0,4 мг, натрия хлорид 2,4 мг.
Описание
Белая или почти белая пористая масса или порошок
Фармакотерапевтическая группа:
противоопухолевые препараты, антитела моноклональные
Код ATX:
L01XC26
Фармакологические свойства
Фармакодинамика
Механизм действия
Инотузумаб озогамицин представляет собой коньюгат моноклонального антитела и химического препарата (ADC), обладающий специфичностью к CD22. В качестве антитела используется гуманизированное антитело lgG4, которое специфически связывается с CD22 человека. Небольшая молекула, N-ацетил-гамма-калихеамицин, является цитотоксическим полусинтетическим натуральным веществом. N-ацетил-гамма-калихеамицин ковалентно связан с антителом с помощью линкера. Данные, полученные в доклинических исследованиях, свидетельствуют о том, что противоопухолевая активность инотузумаба озогамицина обусловлена связыванием ADC с опухолевыми клетками, экспрессирующими CD22, с последующей интернализацией комплекса ADC-CD22 и высвобождением внутри клетки N-ацетил-гамма-калихеамицина диметилтиазида в результате гидролитического расщепления линкера. Активация N-ацетил-гамма-калихеамицина диметилтиазида индуцирует разрыв двухцепочечной ДНК, что в последующем приводит к остановке клеточного цикла и апоптотической гибели опухолевой клетки.
Фармакодинамические эффекты
В период лечения фармакодинамический ответ к инотузумабу озогамицину был охарактеризован уменьшением количества CD-22 позитивных лейкозных клеток.
Фармакокинетика
У пациентов с рецидивирующим или рефрактерным острым лимфобластным лейкозом (ОЛЛ) воздействие в равновесном состоянии было достигнуто к циклу 4. Средняя максимальная наблюдаемая концентрация (Сmax) инотузумаба озогамицина составила 308 нг/мл. Средняя симулированная общая площадь под кривой «концентрация-время» (AUC) на цикл составила 100 000 нг·ч/мл.
Распределение
In vitro связывание N-ацетил-гамма-калихеамицина диметилгидразида с белками плазмы крови человека составило примерно 97%. In vitro N-ацетил-гамма-калихеамицина диметилгидразид является субстратом Р-гликопротеина (P-gp). У человека общий объем распределения инотузумаба озогамицина составил примерно 12 л.
Метаболизм
In vitro N-ацетил-гамма-калихеамицин диметилгидразид в основном метаболизировался путем неферментного расщепления. У человека сывороточные уровни N-ацетил-гамма-калихеамицина диметилгидразида обычно находились ниже порога количественного определения.
Выведение
Фармакокинетика инотузумаба озогамицина была хорошо описана двухкомпартментной моделью с линейными и зависимыми от времени компонентами клиренса. У 234 пациентов с рецидивирующим или рефрактерным ОЛЛ клиренс инотузумаба озогамицина в равновесном состоянии составил 0,0333 л/ч, а конечный период полувыведения (t1/2) составил 12,3 дней.
После многократного введения препарата к циклу 4 отмечено 5,3-кратное накопление инотузумаба озогамицина.
По результатам анализа фармакокинетики в популяции, выполненного на 765 пациентах, выяснено, что площадь поверхности тела в значительной мере влияет на распределение инотузумаба озогамицина. Доза инотузумаба озогамицина назначалась по расчету на площадь поверхности тела (см. раздел «Способ применения и дозы»).
Взаимодействие с другими лекарственными препаратами
Влияние других препаратов на инотузумаб озогамицин
In vitro N-ацетил-гамма-калихеамицин диметилгидразид в основном метаболизируется путем неферментного расщепления. Следовательно, одновременное назначение инотузумаба озогамицина с ингибиторами или индукторами изоферментов цитохрома Р450 (CYP) или уридиндифосфатглюкуронозилтрансфераза (УГT), метаболизирующими лекарственные препараты, вряд ли способно повлиять на воздействие N-ацетил-гамма-калихеамицина диметилгидразида.
По результатам фармакокинетического анализа в популяции, выполненного на 736 пациентах, сопутствующее применение циторедуктивных препаратов, включая гидроксимочевину, гранулоцитарных колониестимулирующих факторов, включая филграстим или ленограстим, и ингибиторов P-gp не оказало видимого эффекта на клиренс инотузумаба озогамицина.
Влияние инотузумаба озогамицина па другие лекарственные препараты
Влияние на субстраты CYP
In vitro N-ацетил-гамма-калихеамицина диметилгидразид и инотузумаб озогамицин проявляли низкий потенциал к ингибированию активности изоферментов CYPIA2, CYP2A6 (испытано только с инотузумабом озогамицином), CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 и CYP3A4/5 и индукция активности изоферментов CYP1A2, CYP2B6 и CYP3A4 в клинически значимых концентрациях.
Влияние на субстраты УГТ
In vitro N-ацетил-гамма-калихеамицина диметилгидразида обладал низким потенциалом к ингибированию активности UGT1А1, UGT1A4, UGT1A6, UGT1A9 и UGT2B7 в клинически значимых концентрациях.
Влияние на субстраты переносчиков лекарственных веществ
In vitro N-ацетил-гамма-калихеамицина диметилгидразид обладал низким потенциалом к ингибированию активности P-gp, белка устойчивости рака молочной железы (BCRP), органического переносчика анионов (ОАТ)1 и ОАТЗ, органического переносчика катионов (ОСТ)2 и органического полипептидного переносчика анионов (ОАТР)1В1 и ОАТР1ВЗ в клинически значимых концентрациях.
Фармакокинетика в особых группах испытуемых или пациентов
Возраст, раса и пол
По данным фармакокинетического популяционного анализа возраст, раса и иол не влияли в значительной мере на распределение инотузумаба озогамицина.
Нарушение функции печени
Официальных фармакокинетических исследований инотузумаба озогамицина у пациентов с нарушением функции печени не проводилось.
По результатам фармакокинетического популяционного анализа, выполненного на 765 пациентах, у пациентов с нарушением функции печени категории B1 по определению Рабочей группы по дисфункции органов Национального института онкологии США (NCI ODWG) (общий билирубин ≤ верхняя граница нормы (ВГН) и аспартатаминотрансфераза (АСТ) > ВГН; n=133) или В2 (общий билирубин >1,0-1,5 × ВГН и любой уровень ACT; n=17) клиренс инотузумаба озогамицина оказался таким же, как и у пациентов с нормальной функцией печени (общий билирубин/АСТ ≤ ВГН; n=611) (см. раздел «Способ применения и дозы»). У 3 пациентов с нарушением функции печени, определенной как категория С по NCI ODWG (общий билирубин >1,5-3 × ВГН и любой уровень ACT), и у 1 пациента с нарушением категории D по NCI ODWG (общий билирубин >3 × ВГН и любой уровень АСТ) клиренс инотузумаба озогамицина также остался неизменным.
Нарушение функции почек
Официальных фармакокинетических исследований инотузумаба озогамицина у пациентов с нарушением функции почек не проводилось.
По результатам фармакокинетического анализа, выполненного на 765 пациентах, у пациентов с легким нарушением функции почек (клиренс креатинина (CLcr) 60-89 мл/мин; n=237), умеренным нарушением (CLcr 30-59 мл/мин; n=122) или тяжелым нарушением (CLcr 15-29 мл/мин; n=4) клиренс оказался аналогичным клиренсу у пациентов с нормальной функцией почек (СLcr ≥90 мл/мин; n=402) (см. раздел «Способ применения и дозы»). Безопасность и эффективность применения инотузумаба озогамицина пациентами, находящимися на терминальной стадии болезни почек, не изучались (см. раздел «Способ применения и дозы»).
Электрофизиология сердца
По результатам фармакокинетического анализа зависимости ответа от воздействия, выполненного на 250 пациентах с рецидивирующим или рефрактерным ОЛЛ или иным гематологическим онкологическим заболеванием, которые получали инотузумаб озогамицин в дозе 1,8 мг/м²/цикл в виде 3 раздельных доз, введенных в дни 1 (0,8 мг/м²), 8 (0,5 мг/м²) и 15 (0,5 мг/м²) цикла длительностью от 21 до 28 дней, или в дозе 1,8 мг/м²/цикл с введением препарата один раз в 4 недели соответственно, медиана интервала QT скорректированного по частоте сердечных сокращений по формуле Фридеричиа (QTcF) возросла на 2,53 миллисекунд (мсек) от исходного уровня (97,5-й процентиль: 4,92 мсек) при средней максимальной концентрации (Сmax), рассчитанной для пациентов с рецидивирующим или рефрактерным ОЛЛ (371 нг/мл) и на 3,87 мсек от исходного уровня (97,5-й процентиль: 7,54 мсек) при концентрации, превышавшей в 1,5 раз среднюю Сmax (569 нг/мл).
В рандомизированном клиническом исследовании у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование I) у 4/162 пациентов группы инотузумаба озогамицина (3%) и у 3/124 пациентов (2%) группы химиотерапии на выбор исследователя отмечено увеличение интервала QTcF ≥60 мсек от исходного уровня. Увеличения QTcF >500 мсек не отмечены ни у одного из пациентов группы инотузумаба озогамицина и у 1/124 пациентов (1%) группы химиотерапии на выбор исследователя. Среднее максимальное (90% доверительный интервал (ДИ)) изменение QTcF от исходного уровня составило 16,5 мсек (14,3-18,7) в группе инотузумаба озогамицина и 10,8 мсек (8,0-13,6) в группе химиотерапии на выбор исследователя. Анализ основных тенденций изменения длительности интервала QTcF от исходного уровня показал, что наибольшая верхняя граница 2-стороннего 90% ДИ QTcF составила 21,1 мсек (отмечена в ходе цикла 4/день 1/1 час) в группе инотузумаба озогамицина и 21,2 мсек (отмечена в ходе цикла 2/день 1/1 час) в группе химиотерапии на выбор исследователя (см. раздел «Особые указания»).
Показания к применению
Инотузумаб озогамицин показан в качестве монотерапии для лечения взрослых пациентов с рецидивирующим или рефрактерным СD22-положительным В-клеточным острым лимфобластным лейкозом (ОЛЛ) из клеток-предшественников. В том числе, у взрослых пациентов с положительным по филадельфийской хромосоме (Ph+) В-клеточным ОЛЛ из клеток-предшественников после неудачной терапии как минимум одним ингибитором тирозинкиназы (НТК).
Противопоказания
- Гиперчувствительность к действующему веществу или любому вспомогательному веществу препарата
- Пациенты, у которых ранее была выявлена или отмечается на данный момент венооклюзионная болезнь печени / синдром синусоидальной обструкции (ВБП/СОС)
- Пациенты с тяжелым заболеванием печени (например, цирроз, узловая регенеративная гиперплазия печени, гепатит в активной стадии)
- Пациенты с терминальной стадией почечной недостаточности
- Беременность и период грудного вскармливания
- Детский возраст до 18 лет
С осторожностью
Следует проявлять особую осторожность при назначении инотузумаба озогамицина пациентам более пожилого возраста, имеющим трансплантацию гемопоэтических стволовых клеток (ТГСК) в анамнезе, получающим терапию «спасения» последующих линий или имеющим заболевание печени и (или) гепатит в анамнезе.
Инотузумаб озогамицин следует вводить с осторожностью пациентам с удлинением интервала QT в анамнезе или с предрасположенностью к его удлинению, которые получают лекарственные препараты, обладающие известной способностью удлинять интервал QT, и пациентам с электролитными нарушениями.
Применение при беременности и в период грудного вскармливания
Женщины, способные к деторождению/контрацепция у мужчин и женщин
Женщины, способные к деторождению, должны избегать беременности во время лечения инотузумабом озогамицином.
Женщинам следует рекомендовать использовать эффективные методы контрацепции во время лечения инотузумабом озогамицином и по меньшей мере в течение 8 месяцев после получения последней дозы препарата. Мужчины, имеющие партнерш, способных к деторождению, должны использовать эффективные методы контрацепции во время лечения инотузумабом озогамицином и по меньшей мере в течение 5 месяцев после получения последней дозы препарата.
Беременность
Данные о применении инотузумаба озогамицина у беременных женщин отсутствуют. На основании данных по безопасности, полученных в доклинических исследованиях, инотузумаб озогамицин может причинить вред эмбриону и плоду при введении беременным женщинам. Исследования на животных выявили репродуктивную токсичность препарата.
Инотузумаб озогамицин не следует применять во время беременности. Беременным женщинам или пациенткам, забеременевшим в ходе лечения инотузумабом озогамицином, а также получавшим препарат мужчинам, чьи партнерши забеременели, следует сообщить о потенциальной опасности лечения для плода.
Грудное вскармливание
Данные о присутствии инотузумаба озогамицина или его метаболитов в грудном молоке, его воздействии на находящегося на грудном вскармливании младенца или выработку грудного молока отсутствуют. Нельзя исключить риск для новорожденного/грудного ребенка. В связи с возможностью развития нежелательных реакций у новорожденных, находящихся на грудном вскармливании, женщинам не следует кормить грудью во время лечения инотузумабом озогамицином и по меньшей мере в течение 2 месяцев после получения последней дозы препарата.
Репродуктивная функция
На основании данных, полученных в доклинических исследованиях, можно сделать вывод о том, что репродуктивная функция у мужчин и женщин может нарушаться в результате лечения инотузумаба озогамицином. И мужчинам, и женщинам следует получить рекомендации по сохранению репродуктивной функции до начала лечения.
Способ применения и дозы
Для пациентов с большой опухолевой массой до введения первой дозы препарата рекомендуется проведение циторедуктивной терапии комбинацией гидроксимочевины, стероидов и (или) винкристина для снижения количества бластов в периферической крови до ≤10 000/мм³.
До введения препарата рекомендуется проведение премедикации кортикостероидами, жаропонижающими и антигистаминными препаратами (см. раздел «Особые указания»).
Пациентов следует наблюдать во время инфузии препарата и, по меньшей мере, в течение 1 часа после ее окончания на предмет симптомов инфузионных реакций (см. раздел «Особые указания»).
Режим дозирования
Инотузумаб озогамицин вводят в течение 3- или 4-недельных циклов.
Для пациентов, которым планируется ТГСК, рекомендуемая длительность лечения инотузумабом озогамицином составляет 2 цикла. Третий цикл следует рассматривать для пациентов, у которых не была достигнута полная ремиссия (ПP) или полная ремиссия с неполным гематологическим восстановлением (ПРНГВ), а также у которых не было достигнуто отсутствия признаков минимальной остаточной болезни (МОБ) после 2 циклов терапии (см. раздел «Особые указания»).
Пациентам, которым не планируется выполнение ТГСК, может проводиться максимум до 6 циклов терапии.
У любых пациентов, у которых не была достигнута ПР или ПРНГВ в течение 3 циклов, лечение должно быть прекращено.
В таблице 1 показаны рекомендуемые режимы дозирования.
Для первого цикла рекомендуемая общая доза инотузумаба озогамицина для всех пациентов составляет 1,8 мг/м² на цикл, при этом общую дозу деляг на 3 дозы, которые вводят в дни 1 (0,8 мг/м²), 8 (0,5 мг/м²) и 15 (0,5 мг/м²). Продолжительность цикла 1 составляет 3 недели, но может быть увеличена до 4 недель, если у пациента не была достигнута ПР или ПРНГВ и (или) для разрешения токсических реакций.
Для последующих циклов рекомендуемая общая доза инотузумаба озогамицина составляет 1,5 мг/м² на цикл для пациентов, у которых была достигнута ПР или ПРНГВ, при этом общую дозу делят на 3 дозы, которые вводят в дни 1 (0,5 мг/м²), 8 (0,5 мг/м²) и 15 (0,5 мг/м²), или 1,8 мг на цикл для пациентов, у которых не была достигнута ПР или ПРНГВ, при этом общую дозу делят на 3 дозы, которые вводят в дни 1 (0,8 мг/м²), 8 (0,5 мг/м²) и 15 (0,5 мг/м²). Длительность последующих циклов составляет 4 недели.
Таблица 1. Режим дозирования для цикла 1 и последующих циклов в зависимости от ответа на лечение
| День 1 | День 8а | День 15а | |
| Режим дозирования для цикла 1 | |||
| Все пациенты | |||
| Доза (мг/м²)б | 0,8 | 0,5 | 0,5 |
| Продолжительность цикла | 21 деньв | ||
| Режим дозировании для последующих циклов в зависимости от ответа на лечение | |||
| Пациенты, у которых была достигнута ПРг или ПРНГВд | |||
| Доза (мг/м²)б | 0,5 | 0,5 | 0,5 |
| Продолжительность цикла | 28 днейе | ||
| Пациенты, у которых не была достигнута ПРв или ПРНГВг | |||
| Доза (мг/м²)б | 0,8 | 0,5 | 0,5 |
| Продолжительность цикла | 28 днейе |
Сокращения: ПР – полная ремиссия; ПPHГВ – полная ремиссия с неполным гематологическим восстановлением.
а ±2 дня (поддержание интервала не менее 6 дней между дозами).
б Дозы основаны на площади поверхности тела пациента (м²).
в Для пациентов, у которых была достигнута ПР или ПРНГВ, и (или) для разрешения токсических реакций, продолжительность цикла может быть увеличена до 28 дней (т. е. 7-дневный период без лечения, начиная с дня 21).
г ПР определяется как количество лейкозных бластных клеток в костном мозге <5% и их отсутствие в периферической крови, полное восстановление гематологических показателей (количество тромбоцитов ≥100×109/л и абсолютное количество нейтрофилов [АКН] ≥1×109/л) и исчезновение любых проявлений экстрамедуллярных поражений.
д ПРНГВ определяется как количество лейкозных бластных клеток в костном мозге <5% и их отсутствие в периферической крови, неполное восстановление гематологических показателей (количество тромбоцитов <100×109/л и (или) АКН <1×109/л) и исчезновение любых проявлений экстрамедуллярных поражений.
е 7-дневный интервал без лечения, начиная с дня 21.
Модификация дозы
Модификация дозы инотузумаба озогамицина может требоваться на индивидуальной основе с учетом его безопасности и переносимости (см. раздел «Особые указания»). Для лечения некоторых нежелательных реакций может потребоваться временное прекращение применения и (или) снижение дозы инотузумаба озогамицина либо его полная отмена (см. разделы «Особые указания» и «Побочное действие»). Если дозу инотузумаба озогамицина снижают по причине опосредованной этим препаратом токсичности, ее нельзя повышать повторно.
В таблице 2 и таблице 3 приведены рекомендации по модификации дозы при гематологических и негематологических токсических реакциях соответственно. Временное прекращение применения инотузумаба озогамицина в ходе цикла лечения (т. е. дни 8 и (или) 15) по причине нейтропении или тромбоцитопении не требуется, однако временное прекращение применения препарата в ходе цикла рекомендуется при негематологических токсических реакциях.
Таблица 2. Модификация дозы при гематологических токсических реакциях
| Гемагологическая токсичность | Модификация дозы |
| Если до начала лечения инотузумабом озогамицином: | |
| АКН составляло ≥1×109/л | Если АКН снижается, то следует воздержаться от проведения следующего цикла лечения до восстановления АКН до величины ≥1×109/л. |
| Количество тромбоцитов составляло ≥50×109/ла | Если количество тромбоцитов снижается, то следует воздержаться от проведения следующего цикла лечения до восстановления количества тромбоцитов до величины ≥50×109/ла. |
| АКН составляло <1×109/л и (или) количество тромбоцитов составляло <50×109/ла | Если АКН и (или) количества тромбоцитов снижается, то следует воздержаться от проведения следующего цикла лечения до возникновения одного из указанного ниже: — АКН или количество тромбоцитов восстанавливается по меньшей мере до исходных значений, имевшихся до начала цикла; или — АКН восстанавливается до величины ≥1×109/л и количество тромбоцитов восстанавливается до величины ≥50×109/ла; или — стабильное течение или улучшение течения заболевания (на основании последнего исследования костного мозга) и снижение АКН и количества тромбоцитов считается обусловленным основным заболеванием (не считается токсической реакцией, обусловленной инотузумабом озогамицином). |
Сокращения: АКН – абсолютное количество нейтрофилов.
а Количество тромбоцитов, используемое для определения режима дозирования, следует определять независимо от гемотрансфузий.
Таблица 3. Модификация дозы при негематологических токсических реакция
| Негематологическая токсичность | Модификация дозы |
| ВБП/СОС или другая серьезная гепатотоксичность | Полное прекращение лечения (см. раздел «Особые указания»). |
| Уровень общего билирубина >1,5×ВГН и уровень АСТ/АЛТ >2,5×ВГН | Временное прекращение применения препарата до снижения уровня общего билирубина до величины ≤1,5×ВГН и уровня АСТ/АЛТ до величины ≤2,5×ВГН до введения каждой дозы, если только повышение указанных показателей не обусловлено синдромом Жильбера или гемолизом. Полное прекращение лечения, если уровень общего билирубина не снижается до величины ≤1,5×ВГН или уровень АСТ/АЛТ не снижается до величины ≤2,5×ВГН (см. раздел «Особые указания»). |
| Инфузионная реакция | Следует приостановить инфузию и начать соответствующую терапию. В зависимости от тяжести инфузионной реакции следует рассмотреть вопрос о прекращении инфузии или введении стероидов либо антигистаминных препаратов. При тяжелых или угрожающих жизни инфузионных реакциях лечение должно быть полностью прекращено (см. раздел «Особые указания»). |
| Негематологические токсические реакции степени тяжести ≥2а (связанные с инотузумабом озогамицином) | Следует приостановить лечение до разрешения реакции до степени тяжести 1 или до имевшейся до начала лечения степени тяжести до введения каждой дозы. |
Сокращения: АЛТ – аланинаминотрансфераза; ACT – аспартатаминотрансфераза; ВГН – верхняя граница нормы; ВБП/СОС – веноокклюзионная болезнь печени/синусоидальный обструктивный синдром.
а Тяжесть реакций определяли с помощью Общих терминологических критериев для нежелательных явлений Национального института онкологии США (NCI-CTCAE) версии 3.0.
B таблице 4 приведены рекомендации по изменению дозы в зависимости от длительности временного прекращения применения препарата по причине токсичности.
Таблица 4. Модификация дозы в зависимости ог длительности временного прекращения лечения по причине токсичности
| Длительность временного прекращения лечения по причине токсичности | Модификация дозы |
| <7 дней (в ходе цикла) | Приостановка введения следующей дозы (поддержание интервала не менее 6 дней между дозами). |
| ≥7 дней | Пропуск следующей дозы в пределах цикла. |
| ≥14 дней | После адекватного разрешения реакции снижают общую дозу на 25% для последующего цикла. При необходимости дополнительной модификации дозы снижают количество доз до 2 на цикл для последующих циклов. Если при снижении общей дозы на 25% с последующим снижением количества доз до 2 доз на цикл пациент не переносит препарат, то лечение полностью отменяют. |
| >28 дней | Следует рассмотреть вопрос о полном прекращении лечения. |
Особые группы пациентов
Пациенты пожилого возраста
Корректировка начальной дозы в зависимости от возраста не требуется (см. раздел «Фармакокинетика»).
Нарушение функции печени
У пациентов с нарушением функции печени, которое определяется как уровень общего билирубина ≤1,5 × верхняя граница нормы (ВГН) и уровень АСТ/АЛТ ≤2,5×ВГН, корректировка начальной дозы препарата не требуется (см. раздел «Фармакокинетика»).
Имеется ограниченная информация по безопасности применения препарата у пациентов с уровнем общего билирубина >1,5×ВГН и уровнем АСТ/АЛТ >2,5×ВГН до введения дозы. Следует приостановить лечение до снижения уровня билирубина до величины ≤1,5×ВГН и снижения уровня АСТ/АЛТ до величины ≤2,5×ВГН до введения каждой дозы, если только повышение указанных показателей не обусловлено синдромом Жильбера или гемолизом.
Полностью прекращают лечение, если уровень общего билирубина не снижается до величины ≤1,5×ВГН или уровень АСТ/АЛТ не снижается до величины ≤2,5×ВГН (см. таблицу 3 и раздел «Особые указания»).
Нарушение функции почек
У пациентов с легким, умеренным или тяжелым нарушением функции почек (клиренс креатинина [CLcr] 60-89 мл/мин, 30-59 мл/мин или 15-29 мл/мин соответственно) корректировка начальной дозы препарата не требуется (см. раздел «Фармакокинетика»). Безопасность и эффективность инотузумаба озогамицина у пациентов с терминальной стадией почечной недостаточности не изучались.
Пациенты детского возраста
Безопасность и эффективность инотузумаба озогамицина у пациентов детского возраста (<18 лет) не установлены.
Способ применения
Инотузумаб озогамицин предназначен для внутривенного введения. Инфузию следует проводить в течение 1 часа.
Инотузумаб озогамицин не следует вводить внутривенно струйно или болюсно.
Инотузумаб озогамицин следует восстанавливать и разбавлять перед введением.
Инструкции по восстановлению, разведению и введению препарата
Используйте соответствующую асептическую методику для восстановления и разведения препарата. Инотузумаб озогамицин (плотность которого составляет 1.02 г/мл при температуре 20 °С) чувствителен к действию света и его следует защищать от воздействия ультрафиолетовых лучей во время восстановления, разведения и введения.
Максимальное время от восстановления до окончания введения препарата должно составлять ≤8 часов, при этом между восстановлением и разведением должно пройти ≤4 часов.
Восстановление
Рассчитывают дозу (мг) и требуемое количество флаконов инотузумаба озогамицина. Восстанавливают содержимое флакона массой 1 мг с помощью 4 мл стерильной воды для инъекций для получения раствора для однократного применения, содержащего 0,25 мг/мл инотузумаба озогамицина.
• Аккуратно вращают флакон круговыми движениями для растворения содержимого. Не встряхивают.
• Проверяют восстановленный раствор на предмет механических включений и изменения цвета. Восстановленный раствор должен быть прозрачным или слегка мутным, бесцветным и должен практически не содержать видимых механических включений.
• Инотузумаб озогамицин не содержит бактериостатических консервантов. Восстановленный раствор следует использовать немедленно. Если восстановленный раствор нельзя использовать немедленно, его можно хранить в холодильнике (2-8 °С) до 4 часов. Защищать от воздействия света и не замораживать.
Разведение
• Рассчитывают требуемый объем восстановленного раствора, необходимый для получения соответствующей дозы согласно площади поверхности тела пациента. Извлекают рассчитанный объем из флакона(-ов) с помощью шприца. Защищают от воздействия света. Утилизируют все неиспользованный восстановленный раствор, оставшийся во флаконе.
• Добавляют восстановленный раствор в инфузионный контейнер, содержащий раствор хлорида натрия для инъекций концентрацией 9 мг/мл (0,9%) для получения общего номинального объема 50 мл. Итоговая концентрация должна быть в промежутке 0.01 мг/мл и 0.1 мг/мл. Защищают от воздействия света. Рекомендуется использовать инфузионный контейнер, изготовленный из поливинилхлорида (ПВХ) (содержащего или не содержащего ди(2-этилгексил)фталат [ДЭГФ]), полиолефинов (полипропилен и (или) полиэтилен) или этиленвинилацетата (ЭВА).
• Аккуратно переворачивают инфузионный контейнер для перемешивания разведенного раствора. Не встряхивать.
• Разбавленный раствор следует использовать немедленно или хранить при комнатной температуре (20-25 °С) либо в холодильнике (2-8 °С). Максимальное время от восстановления до окончания введения препарата должно составлять ≤8 часов, при этом между восстановлением и разведением должно пройти ≤4 часов. Защищать от воздействия света и не замораживать.
Введение
• Если разведенный раствор хранится в холодильнике (2-8 °С), ему следует дать постоять при комнатной температуре (20-25 °С) приблизительно в течение 1 часа перед введением.
• Фильтрование разведенного раствора не требуется. Однако, если разведенный раствор фильтруется, рекомендуется использовать фильтры, изготовленные из полиэфирсульфона (ПЭС), поливинилиденфторида (ПВДФ) или гидрофильного полисульфона (ГПС). Не следует использовать фильтры, изготовленные из нейлона или смешанных эфиров целлюлозы (СЭЦ).
• На время введения инфузионный контейнер следует защищать от воздействия ультрафиолетовых лучей, закрывая его защитным материалом (например, янтарные, темные коричневые, или зеленые мешки или алюминиевую фольгу). Защиты системы капельного введения, через которую происходит инфузия, не требуется.
• Разведенный раствор следует вводить путем инфузии в течение 1 часа со скоростью 50 мл/ч при комнатной температуре (20-25 °С). Раствор следует защищать от воздействия света. Рекомендуется использовать инфузионные системы, изготовленные из ПВХ (содержащие или не содержащие ДЭГФ), полиолефинов (полипропилена и (или) полиэтилена) или полибутадиена.
Инотузумаб озогамицин не следует смешивать или вводить методом инфузии вместе с другими лекарственными препаратами.
В таблице 5 представлена информация о времени хранения и условия для восстановления, разведения и введения инотузумаба озогамицина.
Таблица 5. Время хранения и условия для восстановления и разведения инотузумаба озогамицина
| Максимальное время от восстановления до окончания введения препарата составляет ≤8 часова | ||
| Восстановленный раствор | Разведенный раствор | |
| После начала разведения | Введение | |
| Используют восстановленный раствор немедленно или после хранения в холодильнике (2-8 °С) в течение 4 часов. Защищать от воздействия света. Не замораживать. | Используют разбавленный раствор немедленно или после хранения при комнатной температуре (20-25 °С) либо в холодильнике (2-8 °С). Максимальное время от восстановления до окончания введения препарата должно составлять ≤8 часов, при этом между восстановлением и разведением должно пройти ≤4 часов. Защищать от воздействия света. Не замораживать. | Если разведенный раствор хранится в холодильнике (2-8 °С), ему следует дать постоять при комнатной температуре (20-25 °С) приблизительно в течение 1 часа перед введением. Вводят разведенный раствор путем инфузии в течение 1 часа со скоростью 50 мл/ч при комнатной температуре (20-25 °С). Защищать от воздействия света. |
а Период ≤ 4 часов между восстановлением и разведением препарата.
Утилизация
Инотузумаб озогамицин предназначен только для однократного применения. Неиспользованный препарат или отходы материалов следует утилизировать в соответствии с местными требованиями.
Побочное действие
Краткие сведения о профиле безопасности
У пациентов, получавших инотузумаб озогамицин, наиболее частыми (≥20%) нежелательными реакциями были громбоцитопения (51%), нейтропения (49%), инфекции (48%), анемия (36%), лейкопения (35%), повышенная утомляемость (35%), кровотечение (33%), пирексия (32%), тошнота (31%), головная боль (28%), фебрильная нейтропения (26%), повышенная активность трансаминаз (26%), боль в животе (23%), повышенный уровень гамма-глутамилтрансферазы (21%) и гипербилирубинемия (21%).
У пациентов, получавших инотузумаб озогамицин, наиболее частыми (≥2%) серьезными нежелательными реакциями были инфекция (23%), фебрильная нейтропения (11%), кровотечение (5%), боль в животе (3%), пирексия (3%), ВБП/СОС (2%) и повышенная утомляемость (2%).
Список нежелательных реакций в виде таблицы
В таблице 6 представлены нежелательные реакции, зарегистрированные у пациентов с рецидивирующим или рефрактерным ОЛЛ, получавших инотузумаб озогамицин.
Эти нежелательные реакции представлены по системно-органным классам (СОК) и частоте возникновения. В пределах каждого СОК нежелательные реакции представлены по следующей классификации: очень часто (≥1/10), часто (≥1/100, < 1/10), нечасто (≥1/1,000, <1/100), редко (≥1/10,000, <1/1,000), очень редко (<1/10,000), неизвестно (невозможно установить частоту на основании имеющихся данных). В каждой группе частоты возникновения нежелательные реакции представлены в порядке уменьшения степени их серьезности.
Таблица 6. Нежелательные реакции, зарегистрированные у пациентов с рецидивирующим или рефрактерным В-клеточным ОЛЛ из клеток-предшественников, получавших инотузумаб озогамицин
| Системно¬-органный класс | Очень часто | Часто |
| Инфекционные и паразитарные заболевания | Инфекция (48%)а (включая сепсис и бактериемию 117%], грибковые инфекции [9%], инфекции нижних дыхательных путей [12%], инфекции верхних дыхательных путей [12%]. бактериальные инфекции [1%], вирусные инфекции [7%], инфекции желудочно-кишечного тракта [4%], кожные инфекции [4%]) | |
| Нарушения со стороны системы крови и лимфатической системы | Фебрильная нейтропения (26%) Нейтропения (49%) Тромбоцитопения (51%) Лейкопения (35%) Лимфопения (18%) Анемия (36%) |
Панцитопения (2%)б |
| Нарушения со стороны иммунной системы | Гиперчувствительность (1%) | |
| Нарушения обмена веществ и питания | Пониженный аппетит (12%) | Синдром лизиса опухоли (2%) Гиперурикемия (4%) |
| Нарушения со стороны нервной системы | Головная боль (28%) | |
| Нарушения со стороны сосудов | Кровотечение (33%)в (включая кровотечение в центральной нервной системе [1%], кровотечение из верхних отделов желудочно-кишечного тракта [6%], кровотечение из нижних отделов желудочно-кишечного тракта [4%], носовое кровотечение [15%]) | |
| Нарушения со стороны желудочно-кишечного тракта | Боль в животе (23%) Рвота (15%) Диарея (17%) Тошнота (31%) Стоматит (13%) Запор (17%) |
Асцит (4%) Вздутие живота (6%) |
| Нарушения со стороны печени и желчевыводящих путей | Гипербилирубинемия (21%) Повышение активности трансаминаз (26%) Повышение активности гамма-глутамилтрансферазы (21%) |
Веноокклюзионная болезнь печени (синусоидальный обструкционный синдром) (3% [пре-ТГСК]г |
| Общие расстройства и нарушения в месте введения | Пирексия (32%) Повышенная утомляемость (35%) Озноб (11%) |
|
| Лабораторные и инструментальные данные | Повышение активности щелочной фосфатазы (13%) | Удлинение интервала QT на электрокардиограмме (1%) Повышение активности амилазы (5%) Повышение активности липазы (9%) |
| Травмы, интоксикации и осложнения процедур | Инфузионная реакция (10%) |
К нежелательным реакциям относились возникшие после начала лечения явления любой причинной обусловленности, развившиеся в день 1 цикла 1 или после него в течение 42 дней после получения последней дозы инотузумаба озогамицина, но до начала новой противоопухолевой терапии (включая ТГСК).
Предпочтительные термины были взяты из Медицинского словаря терминологии для регуляторной деятельности (MedDRA) редакции 19.1.
Сокращения: ОЛЛ – острый лимфобластный лейкоз; ТГСК – трансплантация гемопоэтических стволовых клеток.
а Термин «инфекция» также включает другие виды инфекций. Примечание: у пациентов могли выявить > 1 типа инфекций.
б Термин «панцитопения» включает следующие зарегистрированные предпочтительные термины: недостаточность костного мозга, фебрильная аплазия костного мозга и панцитопения.
в Термин «кровотечение» также включает другие типы кровотечений. Примечание: у пациентов могли выявить >1 типа кровотечений.
г ВБП/СОС включают 1 дополнительного пациента с венооклюзионной болезнью печени, развитие которой произошло в день 56 без проведения ТГСК. Случаи ВБП/СОС были зарегистрированы также у 18 пациентов после проведения последующей ТГСК.
Описание отдельных нежелательных реакций
Гепатотоксичность, включая веноокклюзионную болезнь печени/синусоидальный обструктивный синдром (ВБП/СОС)
В опорном клиническом исследовании (N = 164) ВБП/СОС было зарегистрировано у 23 (14%) пациентов, включая 5 (3%) пациентов во время исследуемой терапии или в последующем наблюдении без проведения ТГСК. Среди 79 пациентов, которые перешли на последующую ТГСК (8 из которых получили дополнительную терапию «спасения» после лечения инотузумабом озогамицином до проведения ТГСК), ВБП/СОС было зарегистрировано у 18 (23%) пациентов. Пять из 18 случаев ВБП/СОС, которые произошли после выполнения ТГСК, имели летальный исход.
О случаях ВБП/СОС сообщалось в течение 56 дней после последней дозы инотузумаба озогамицина без проведения ТГСК. Среднее время от выполнения ТГСК до появления ВБП/СОС составляло 15 дней (диапазон: 3-57 дней). Из 5 пациентов, которые перенесли ВБП/СОС во время лечения инотузумабом озогамицином, но без выполнения промежуточной ТГСК, 2 пациента также перенесли ТГСК до лечения инотузумабом озогамицином.
Среди пациентов, которым выполняли ТГСК после лечения инотузумабом озогамицином, ВБП/СОС было зарегистрировано у 5/11 (46%) пациентов, которые перенесли ТГСК до или после лечения инотузумабом озогамицином, и у 13/68 (19%) пациентов, которые перенесли ТГСК после лечение инотузумабом озогамицином.
Что касается других факторов риска, ВБП/СОС было зарегистрировано у 6/11 (55%) пациентов, которые получали режим, улучшающий состояние при ТГСК, содержащий 2 алкилирующих препарата, и 9/53 (17%) пациентов, которые получали режим, улучшающий состояние при ТГСК, содержащий 1 алкилирующий препарат, 7/17 (41%) пациентов в возрасте ≥55 лет и 11/62 (18%) пациентов в возрасте <55 лет, и 7/12 (58%) пациентов с уровнем сывороточного билирубина ≥ВГН до ТГСК и у 11/67 (16%) пациентов с уровнем сывороточного билирубина <ВГН до ТГСК.
В опорном исследовании (N = 164) гипербилирубинемия и увеличение трансаминаз были зарегистрированы у 35 (21%) и 43 (26%) пациентов, соответственно. Гипербилирубинемия степени тяжести ≥3 и повышение уровня трансаминаз были зарегистрированы у 9 (6%) и 11 (7%) пациентов, соответственно. Среднее время начала гипербилирубинемии и повышения уровня трансаминаз составляло 73 дня и 29 дней, соответственно.
Информацию о клиническом ведении гепатотоксичности, включая ВБП/СОС см. в разделе «Особые указания».
Миелосупрессия/цитопения
В опорном исследовании (N = 164) тромбоцитопения и нейтропения были зарегистрированы у 83 (51%) и 81 (49%) пациентов, соответственно. Тромбоцитопения и нейтропения 3 степени тяжести были зарегистрированы у 23 (14%) и 33 (20%) пациентов, соответственно. Тромбоцитопения и нейтропения 4 степени тяжести были зарегистрированы у 46 (28%) и 45 (27%) пациентов, соответственно. Фебрильная нейтропения, которая может представлять угрозу для жизни, была зарегистрирована у 43 (26%) пациентов.
Информацию о клиническом ведении миелосупрессии/цитопении см. в разделе «Особые указания».
Инфекции
В опорном исследовании (N = 164) инфекции, включая серьезные инфекции, некоторые из которых представляли угрозу для жизни или закончились летальным исходом, были зарегистрированы у 79 (48%) пациентов. Наблюдалась следующая частота специфических инфекций: сепсис и бактериемия (17%), инфекции нижних дыхательных путей (12%), инфекции верхних дыхательных путей (12%), грибковые инфекции (9%), вирусные инфекции (7%), желудочно-кишечные инфекции (4%), кожные инфекции (4%) и бактериальные инфекции (1%). Инфекции с летальным исходом, включая пневмонию, нейтропенический сепсис, сепсис, септический шок и псевдомональный сепсис, были зарегистрированы у 8 (5%) пациентов.
Информацию о клиническом ведении инфекций см. в разделе «Особые указания».
Кровотечение/кровоизлияние
В опорном клиническом исследовании (N = 164) явления кровотечения / кровоизлияния, в основном легкой степени тяжести, были зарегистрированы у 54 / (33%) пациентов. Наблюдалась следующая частота специфических явлений кровотечения / кровоизлияния: носовое (15%), кровотечение из верхних отделов желудочно-кишечного тракта (6%), кровотечение из нижних отделов желудочно-кишечного тракта (4%) и кровоизлияние в центральную нервную систему (ЦНС) (1%). У 8/164 (5%) пациентов отмечались явления кровотечения / кровоизлияния 3/4 степени тяжести. Сообщалось об одном кровотечении / геморрагическом событии 5 степени тяжести (внутрибрюшное кровотечение).
Информацию о клиническом ведении явлений кровотечения / кровоизлияния см. в разделе «Особые указания».
Инфузионные реакции
В опорном исследовании (N=164), реакции, связанные с инфузией были зарегистрированы у 17 (10%) пациентов. Все случаи имели степень тяжести ≤2. Инфузионные реакции главным образом происходили в цикле 1 и спустя короткое время после завершения инфузии инотузумаба озогамицина и разрешались спонтанно или после соответствующего лечения.
Информацию о клиническом ведении инфузионных реакций см. в разделе «Особые указания».
Синдром лизиса опухоли (CЛQ)
В опорном исследовании (N = 164) СЛО, который может представлять угрозу для жизни или закончится летальным исходом, был зарегистрирован у 4/164 (2%) пациентов. Степень тяжести СЛО 3/4 была отмечена у 3 (2%) пациентов. СЛО возникал вскоре после окончания инфузии инотузумаба озогамицина и разрешался после соответствующего лечения.
Информацию о клиническом ведении СЛО см. в разделе «Особые указания».
Удлинение интервала QT
В опорном исследовании (N = 164) максимальное удлинение интервала QTcF ≥30 мсек и ≥60 мсек от исходного уровня было зарегистрировано у 30/162 (19%) и 4/162 (3%) пациентов, соответственно. Увеличение значений интервала QTcF > 450 мсек наблюдалось у 26/162 (16%) пациентов. Ни у одного из пациентов не было зарегистрировано увеличение значений интервала QTcF > 500 мсек. Удлинение интервала QT степени тяжести 2 было зарегистрировано у 2/164 (1%) пациентов. Удлинения интервала QT степени тяжести ≥3 или случаев веретенообразной желудочковой пароксизмальной тахикардии не было зарегистрировано ни у одного из пациентов.
Информацию о периодическом мониторинге ЭКГ и уровня электролитов см. в разделе «Особые указания».
Увеличение активности амилазы и липазы
В опорном исследовании (N = 164) увеличение активности амилазы и липазы было зарегистрировано у 8 (5%) и 15 (9%) пациентов, соответственно. Увеличения активности амилазы и липазы ≥3 степени тяжести отмечалось у 3 (2%) и 7 (4%) пациентов, соответственно.
Информацию о периодическом мониторинге увеличения активности амилазы и липазы см. в разделе «Особые указания».
Иммуногенность
В клинических исследованиях инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ иммуногенность инотузумаба озогамицина оценивалась с использованием иммуноанализа с электрохемилюминесценцией для определения антител к инотузумабу озогамицину. Пациентам, у которых в сыворотке крови были выявлены антитела к инотузумабу озогамицину, был выполнен клеточный анализ для выявления нейтрализующих антител.
В клинических исследованиях инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ у 7/236 (3%) пациентов были выявлены антитела к инотузумабу озогамицину. Ни у одного из пациентов не были выявлены нейтрализующие антитела к инотузумабу озогамицину. По результатам популяционного фармакокинетического анализа у пациентов с положительным результатом анализа на антитела к инотузумабу озогамицину наличие таких антител не влияло на клиренс препарата. Небольшое количество пациентов не позволило оценивать воздействие антител к инотузумабу озогамицину на эффективность и безопасность препарата.
Передозировка
Специфическая терапия или антидот при передозировке инотузумаба озогамицина отсутствует. Лечение передозировки инотузумаба озогамицина должно включать общие поддерживающие мероприятия.
Взаимодействие с другими лекарственными препаратами
Клинические исследования межлекарственных взаимодействий инотузумаба озогамицина не проводились (см. раздел «Фармакокинетика»).
На основании данных in vitro одновременное применение инотузумаба озогамицина с ингибиторами или индукторами изоферментов цитохрома Р450 (CYP) или уридиндифосфатглюкуронозилтрансфераза (УГТ), метаболизирующими лекарственные препараты, вряд ли может изменить экспозицию N-ацетил-гамма-калихеамицина диметилгидразида.
Кроме того, вероятность того, что инотузумаб озогамицин и N ацетил гамма калихеамицин диметилгидразид способны изменить уровень воздействия субстратов изоферментов CYP, а N-ацетил-гамма-калихеамицин диметилгидразид способен изменить уровень воздействия субстратов ферментов УГТ или основных переносчиков лекарственных препаратов, крайне мала.
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) были зарегистрированы случаи удлинения интервала QT (см. разделы «Особые указания» и «Фармакодинамика»). В связи с этим вопрос о совместном применении инотузумаба озогамицина с лекарственными препаратами, обладающими известной способностью удлинять интервал QT или вызывать веретенообразную желудочковую пароксизмальную тахикардию, должен тщательно рассматриваться. При совместном применении инотузумаба озогамицина с такими лекарственными препаратами следует контролировать интервал QT (см. раздел «Особые указания»).
Особые указания
Гепатотоксичность, включая веноокклюзионную болезнь печени/синусоидальный обструктивный синдром (ВБП/СОС)
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) были зарегистрированы случаи гепатотоксичности, в том числе тяжелые, угрожающие жизни и, в некоторых случаях, эпизоды ВБП/СОС с летальным исходом, а также случаи повышения биохимических показателей функции печени (см. раздел «Побочное действие»).
Случаи ВБП/СОС были зарегистрированы в течение периода длительностью до 56 дней после введения последней дозы исследуемого препарата или в ходе периода последующего наблюдения без выполнения ТГСК. Медиана времени от выполнения ТГСК до возникновения ВБП/СОС составляла 15 дней (диапазон: 3-57 дней).
У некоторых пациентов может быть увеличен риск возникновения ВБП/СОС.
У пациентов, у которых в прошлом наблюдались ВБП/СОС или имеются серьезные заболевания печени (например, цирроз, узловая регенеративная гиперплазия, активный гепатит), может быть увеличен риск ухудшения течения заболевания печени, в том числе развития ВБП/СОС после лечения инотузумабом озогамицином.
ТГСК в анамнезе может быть связана с повышенным риском ВБП/СОС. Из 5 пациентов, у которых развились ВБП/СОС в ходе лечения инотузумабом озогамицином, но которым не была выполнена ТГСК, 2 пациента также перенесли ТГСК до лечения инотузумабом озогамицином. Среди пациентов, которым была в последующем выполнена ТГСК, ВБП/СОС были зарегистрированы после ТГСК, выполненной после лечения инотузумабом озогамицином у 5/11 (46%) пациентов, которым была выполнена ТГСК и до, и после лечения инотузумаба озогамицином, и у 13/68(19%) пациентов, которым ТГСК была выполнена только после лечения инотузумабом озогамицином.
Среди пациентов, которым была в последующем выполнена ТГСК, применение режимов кондиционирования для ТГСК, включавших 2 алкилирующих агента, и последний определенный уровень общего билирубина ≥ВГН до последующей ТГСК были в значительной степени связаны с повышенным риском ВБП/СОС после ТГСК. К другим факторам, которые могут быть связаны с повышенным риском ВБП/СОС после ТГСК, относятся пожилой возраст, заболевания печени и (или) гепатит в анамнезе до начала лечения, применение в последующем терапии «спасения» и большее количество циклов лечения.
В связи с риском ВБП/СОС, особенно после ТГСК, пациентов следует тщательно наблюдать на предмет развития признаков и симптомов ВБП/СОС, к которым могут относиться повышение уровня общего билирубина, гепатомегалия (которая может сопровождаться болевым синдромом), быстрое увеличение массы тела и асцит. Мониторинг только уровня общего билирубина может не выявить всех пациентов с риском ВБП/СОС. У всех пациентов следует осуществлять мониторинг биохимических показателей функции печени, включая ACT, АЛТ, общий билирубин и щелочную фосфатазу, до и после введения каждой дозы инотузумаба озогамицина. Для пациентов, у которых возникают отклонения от нормы биохимических показателей функции печени, рекомендуется более частый мониторинг этих показателей и клинических признаков и симптомов гепатотоксичности. У пациентов, которым выполняется последующая ТГСК, рекомендуется тщательно контролировать биохимические показатели функции печени в ходе первого месяца после ТГСК, а затем менее часто согласно стандартной медицинской практике.
При повышении уровня печеночных ферментов может потребоваться временное прекращение применения, снижение дозы или полная отмена инотузумаба озогамицина (см. раздел «Способ применения и дозы»).
Следует тщательно учитывать соотношение пользы и риска до назначения инотузумаба озогамицина пациентам с ВБП/СОС в анамнезе или пациентам с серьезным заболеванием печени (например, циррозом, узловой регенеративной гиперплазией, активным гепатитом). Если эти пациенты получают лечение инотузумабом озогамицином, их следует тщательно наблюдать на предмет признаков и симптомов ВБП/СОС и полностью отменять препарат при возникновении этих состояний (см. раздел «Способ применения и дозы»).
Следует проявлять особую осторожность при назначении инотузумаба озогамицина пациентам более пожилого возраста, имеющим ТГСК в анамнезе, получающим терапию «спасения» последующих линий или имеющим заболевание печени и (или) гепатит в анамнезе. В связи с риском развития ВВП, для пациентов, которым планируется выполнение ТГСК, рекомендуемая продолжительность лечения инотузумабом озогамицином составляет 2 цикла; 3 цикл терапии может быть назначен тем пациентам, у которых не была достигнута ПР/ПРНГВ или не достигнут отрицательный показатель минимальной остаточной болезни (МОБ) после 2 цикла (см. раздел «Способ применения и дозы»). Следует избегать применения режимов кондиционирования для ТГСК, включающих 2 алкилирующих средства.
При возникновении ВБП/СОС лечение следует полностью прекратить (см. раздел «Способ применения и дозы»). При возникновении тяжелых ВБП/СОС следует проводить лечение согласно стандартной медицинской практике.
Миелосупрессия/цитопения
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) были зарегистрированы случаи нейтропении, тромбоцитопении, анемии, лейкопении, фебрильной нейтропении, лимфопении и панцитопении, некоторые из которых угрожали жизни (см. раздел «Побочное действие»). Осложнения, связанные с нейтропенией и тромбоцитопенией (включая инфекции и явления кровотечения/кровоизлияния соответственно), были зарегистрированы у некоторых пациентов (см. раздел «Побочное действие»).
Инфекции, включая серьезные инфекции, некоторые из которых угрожали жизни или закончились летальным исходом, были зарегистрированы у 79/164 (48%) пациентов. Инфекции с летальным исходом, включая пневмонию, нейтропенический сепсис, сепсис, септический шок и сепсис, вызванный синегнойной палочкой, были зарегистрированы у 8/164 (5%) пациентов. Были зарегистрированы бактериальные, вирусные и грибковые инфекции.
Следует определять показатели общего анализа крови перед введением каждой дозы инотузумаба озогамицина и наблюдать пациентов на предмет признаков и симптомов инфекции во время лечения и после ТГСК, кровотечения/кровоизлияния или других проявлений миелосупрессии в ходе лечения инотузумабом озогамицином. В соответствующих случаях проводят профилактическую противоинфекционную терапию и выполняют контрольные анализы в ходе лечения инотузумабом озогамицином и после его окончания. При лечении пациентов с тяжелой инфекцией, кровотечением/кровоизлиянием или другими проявлениями миелосупрессии, включая тяжелую нейтропению или тромбоцитопению, может потребоваться временное прекращение, снижение дозы или полное прекращение применения инотузумаба озогамицина (см. раздел «Способ применения и дозы»).
Инфузионная реакция
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) инфузионные реакции (все имели степень тяжести 2 или ниже) были зарегистрированы у 17/164 (10%) пациентов (см. раздел «Побочное действие»). Инфузионные реакции возникали во время 1 цикла терапии вскоре после окончания инфузии инотузумаба озогамицина и разрешались спонтанно или с использованием медикаментозной помощи.
До введения препарата рекомендуется проведение премедикации кортикостероидами, жаропонижающими и антигистаминными препаратами (см. раздел «Способ применения и дозы»).
Пациентов следует тщательно наблюдать во время инфузии и по меньшей мере в течение 1 часа после ее окончания на предмет потенциального возникновения инфузионных реакций, которые могут сопровождаться такими симптомами, как гипотензия, приливы крови, сыпь или нарушение дыхания. При возникновении инфузионной реакции следует прекратить инфузию и начать соответствующую терапию. В зависимости от тяжести инфузионной реакции следует рассмотреть вопрос о прекращении инфузии или введении стероидов либо антигистаминных препаратов. При тяжелых или угрожающих жизни инфузионных реакциях лечение инотузумабом озогамицином должно быть полностью прекращено (см. раздел «Способ применения и дозы»).
Синдром лизиса опухоли
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) синдром лизиса опухоли (СЛО), который может угрожать жизни или закончиться летальным исходом, был зарегистрирован у 4/164 (2%) пациентов (см. раздел «Побочное действие») СЛО степени тяжести 3/4 был зарегистрирован у 3/164 (2%) пациентов. СЛО возникал вскоре после окончания инфузии инотузумаба озогамицина и разрешался после соответствующей терапии.
Пациентов следует наблюдать на предмет признаков и симптомов СЛО и лечить их согласно стандартной медицинской практике.
Удлинение интервала QT
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) удлинение интервала QTcF, ≥60 мсек относительно исходного значения было зарегистрировано у 4/162 (3%) пациентов. Ни у одного из пациентов не было зарегистрировано значений интервала QTcF >500 мсек. Удлинение интервала QT степени тяжести 2 было зарегистрировано у 2/164 (1%) пациентов. Удлинения интервала QT степени тяжести ≥3 или веретенообразной желудочковой пароксизмальной тахикардии не было зарегистрировано ни у одного из пациентов (см. разделы «Побочное действие» и «Фармакокинетика»).
Инотузумаб озогамицин следует вводить с осторожностью пациентам с удлинением интервала QT в анамнезе или с предрасположенностью к его удлинению, которые получают лекарственные препараты, обладающие известной способностью удлинять интервал QT, и пациентам с электролитными нарушениями (см. раздел «Взаимодействие с другими лекарственными препаратами»). До начала лечения и в ходе лечения пациентам следует выполнять электрокардиографию и определять у них уровень электролитов в крови.
Увеличение активности амилазы и липазы
У пациентов, принимающих инотузумаб озогамицин, было зарегистрировано увеличение активности амилазы и липазы (см. раздел «Побочное действие»).
Рекомендуется осуществлять мониторинг увеличения активности амилазы и липазы у пациентов. Следует оценивать возможность развития заболеваний печени и желчевыводящих путей и проводить лечение в соответствии со стандартной медицинской практикой.
Иммунизация
Безопасность иммунизации живыми вирусными вакцинами во время или после проведения терапии инотузумабом озогамицином не изучена. Не рекомендуется проводить вакцинацию живыми вирусными вакцинами по крайней мере за 2 недели до начала лечения инотузумабом озогамицином, во время лечения и до восстановления уровня В лимфоцитов после последнего цикла лечения.
Влияние на способность управлять транспортными средствами, механизмами
Инотузумаб озогамицин может влиять на способность управлять автотранспортными средствами и работать с механизмами. У пациентов может возникать повышенная утомляемость во время лечения инотузумабом озогамицином (см. раздел «Побочное действие»). В связи с этим при управлении автотранспортными средствами или работе с механизмами пациентам следует соблюдать осторожность.
Форма выпуска
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий 1 мг.
Лиофилизат во флаконе из боросиликатного янтарного стекла (тип I), укупоренном бутиловой пробкой и обжимным колпачком со съёмной крышкой из алюминия.
1 флакон вместе с инструкцией по применению в картонной пачке.
Срок годности
3 года
Не применять по истечении срока годности, указанного на упаковке.
Условия хранения
Хранить при температуре 2-8 °С. Не замораживать.
Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту.
Держатель РУ:
Пфайзер Инк., США
235 Ист 42 Стрит, Нью-Йорк, штат Нью-Йорк 10017, США
Производитель:
Вайет Фармасьютикалз Дивижн оф Вайет Холдингз ЭлЭлСи, США
401 Норт Миддлтаун Роуд, Перл Ривер, Нью-Йорк 10965, США
Выпускающий контроль качества:
Фармация и Апджон Кампами ЭлЭлСи, США
7000 Портейдж Роуд, Каламазу, МИ49001, США
Претензии потребителей направлять по адресу ООО «Пфайзер Инновации»:
123112 Москва, Пресненская наб., д. 10 ВЦ «Башня на набережной» (Блок С)
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Гепатотоксичность, включая веноокклюзионную болезнь печени/синусоидальный обструктивный синдром (ВБП/СОС)
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) были зарегистрированы случаи гепатотоксичности, в том числе тяжелые, угрожающие жизни и, в некоторых случаях, эпизоды ВБП/СОС с летальным исходом, а также случаи повышения биохимических показателей функции печени (см. раздел «Побочное действие»).
Случаи ВБП/СОС были зарегистрированы в течение периода длительностью до 56 дней после введения последней дозы исследуемого препарата или в ходе периода последующего наблюдения без выполнения ТГСК. Медиана времени от выполнения ТГСК до возникновения ВБП/СОС составляла 15 дней (диапазон: 3-57 дней).
У некоторых пациентов может быть увеличен риск возникновения ВБП/СОС.
У пациентов, у которых в прошлом наблюдались ВБП/СОС или имеются серьезные заболевания печени (например, цирроз, узловая регенеративная гиперплазия, активный гепатит), может быть увеличен риск ухудшения течения заболевания печени, в том числе развития ВБП/СОС после лечения инотузумабом озогамицином.
ТГСК в анамнезе может быть связана с повышенным риском ВБП/СОС. Из 5 пациентов, у которых развились ВБП/СОС в ходе лечения инотузумабом озогамицином, но которым не была выполнена ТГСК, 2 пациента также перенесли ТГСК до лечения инотузумабом озогамицином. Среди пациентов, которым была в последующем выполнена ТГСК, ВБП/СОС были зарегистрированы после ТГСК, выполненной после лечения инотузумабом озогамицином у 5/11 (46%) пациентов, которым была выполнена ТГСК и до, и после лечения инотузумаба озогамицином, и у 13/68(19%) пациентов, которым ТГСК была выполнена только после лечения инотузумабом озогамицином.
Среди пациентов, которым была в последующем выполнена ТГСК, применение режимов кондиционирования для ТГСК, включавших 2 алкилирующих агента, и последний определенный уровень общего билирубина ≥ВГН до последующей ТГСК были в значительной степени связаны с повышенным риском ВБП/СОС после ТГСК. К другим факторам, которые могут быть связаны с повышенным риском ВБП/СОС после ТГСК, относятся пожилой возраст, заболевания печени и (или) гепатит в анамнезе до начала лечения, применение в последующем терапии «спасения» и большее количество циклов лечения.
В связи с риском ВБП/СОС, особенно после ТГСК, пациентов следует тщательно наблюдать на предмет развития признаков и симптомов ВБП/СОС, к которым могут относиться повышение уровня общего билирубина, гепатомегалия (которая может сопровождаться болевым синдромом), быстрое увеличение массы тела и асцит. Мониторинг только уровня общего билирубина может не выявить всех пациентов с риском ВБП/СОС. У всех пациентов следует осуществлять мониторинг биохимических показателей функции печени, включая ACT, АЛТ, общий билирубин и щелочную фосфатазу, до и после введения каждой дозы инотузумаба озогамицина. Для пациентов, у которых возникают отклонения от нормы биохимических показателей функции печени, рекомендуется более частый мониторинг этих показателей и клинических признаков и симптомов гепатотоксичности. У пациентов, которым выполняется последующая ТГСК, рекомендуется тщательно контролировать биохимические показатели функции печени в ходе первого месяца после ТГСК, а затем менее часто согласно стандартной медицинской практике.
При повышении уровня печеночных ферментов может потребоваться временное прекращение применения, снижение дозы или полная отмена инотузумаба озогамицина (см. раздел «Способ применения и дозы»).
Следует тщательно учитывать соотношение пользы и риска до назначения инотузумаба озогамицина пациентам с ВБП/СОС в анамнезе или пациентам с серьезным заболеванием печени (например, циррозом, узловой регенеративной гиперплазией, активным гепатитом). Если эти пациенты получают лечение инотузумабом озогамицином, их следует тщательно наблюдать на предмет признаков и симптомов ВБП/СОС и полностью отменять препарат при возникновении этих состояний (см. раздел «Способ применения и дозы»).
Следует проявлять особую осторожность при назначении инотузумаба озогамицина пациентам более пожилого возраста, имеющим ТГСК в анамнезе, получающим терапию «спасения» последующих линий или имеющим заболевание печени и (или) гепатит в анамнезе. В связи с риском развития ВВП, для пациентов, которым планируется выполнение ТГСК, рекомендуемая продолжительность лечения инотузумабом озогамицином составляет 2 цикла; 3 цикл терапии может быть назначен тем пациентам, у которых не была достигнута ПР/ПРНГВ или не достигнут отрицательный показатель минимальной остаточной болезни (МОБ) после 2 цикла (см. раздел «Способ применения и дозы»). Следует избегать применения режимов кондиционирования для ТГСК, включающих 2 алкилирующих средства.
При возникновении ВБП/СОС лечение следует полностью прекратить (см. раздел «Способ применения и дозы»). При возникновении тяжелых ВБП/СОС следует проводить лечение согласно стандартной медицинской практике.
Миелосупрессия/цитопения
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) были зарегистрированы случаи нейтропении, тромбоцитопении, анемии, лейкопении, фебрильной нейтропении, лимфопении и панцитопении, некоторые из которых угрожали жизни (см. раздел «Побочное действие»). Осложнения, связанные с нейтропенией и тромбоцитопенией (включая инфекции и явления кровотечения/кровоизлияния соответственно), были зарегистрированы у некоторых пациентов (см. раздел «Побочное действие»).
Инфекции, включая серьезные инфекции, некоторые из которых угрожали жизни или закончились летальным исходом, были зарегистрированы у 79/164 (48%) пациентов. Инфекции с летальным исходом, включая пневмонию, нейтропенический сепсис, сепсис, септический шок и сепсис, вызванный синегнойной палочкой, были зарегистрированы у 8/164 (5%) пациентов. Были зарегистрированы бактериальные, вирусные и грибковые инфекции.
Следует определять показатели общего анализа крови перед введением каждой дозы инотузумаба озогамицина и наблюдать пациентов на предмет признаков и симптомов инфекции во время лечения и после ТГСК, кровотечения/кровоизлияния или других проявлений миелосупрессии в ходе лечения инотузумабом озогамицином. В соответствующих случаях проводят профилактическую противоинфекционную терапию и выполняют контрольные анализы в ходе лечения инотузумабом озогамицином и после его окончания. При лечении пациентов с тяжелой инфекцией, кровотечением/кровоизлиянием или другими проявлениями миелосупрессии, включая тяжелую нейтропению или тромбоцитопению, может потребоваться временное прекращение, снижение дозы или полное прекращение применения инотузумаба озогамицина (см. раздел «Способ применения и дозы»).
Инфузионная реакция
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) инфузионные реакции (все имели степень тяжести 2 или ниже) были зарегистрированы у 17/164 (10%) пациентов (см. раздел «Побочное действие»). Инфузионные реакции возникали во время 1 цикла терапии вскоре после окончания инфузии инотузумаба озогамицина и разрешались спонтанно или с использованием медикаментозной помощи.
До введения препарата рекомендуется проведение премедикации кортикостероидами, жаропонижающими и антигистаминными препаратами (см. раздел «Способ применения и дозы»).
Пациентов следует тщательно наблюдать во время инфузии и по меньшей мере в течение 1 часа после ее окончания на предмет потенциального возникновения инфузионных реакций, которые могут сопровождаться такими симптомами, как гипотензия, приливы крови, сыпь или нарушение дыхания. При возникновении инфузионной реакции следует прекратить инфузию и начать соответствующую терапию. В зависимости от тяжести инфузионной реакции следует рассмотреть вопрос о прекращении инфузии или введении стероидов либо антигистаминных препаратов. При тяжелых или угрожающих жизни инфузионных реакциях лечение инотузумабом озогамицином должно быть полностью прекращено (см. раздел «Способ применения и дозы»).
Синдром лизиса опухоли
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) синдром лизиса опухоли (СЛО), который может угрожать жизни или закончиться летальным исходом, был зарегистрирован у 4/164 (2%) пациентов (см. раздел «Побочное действие») СЛО степени тяжести 3/4 был зарегистрирован у 3/164 (2%) пациентов. СЛО возникал вскоре после окончания инфузии инотузумаба озогамицина и разрешался после соответствующей терапии.
Пациентов следует наблюдать на предмет признаков и симптомов СЛО и лечить их согласно стандартной медицинской практике.
Удлинение интервала QT
В рандомизированном клиническом исследовании инотузумаба озогамицина у пациентов с рецидивирующим или рефрактерным ОЛЛ (исследование 1) удлинение интервала QTcF, ≥60 мсек относительно исходного значения было зарегистрировано у 4/162 (3%) пациентов. Ни у одного из пациентов не было зарегистрировано значений интервала QTcF >500 мсек. Удлинение интервала QT степени тяжести 2 было зарегистрировано у 2/164 (1%) пациентов. Удлинения интервала QT степени тяжести ≥3 или веретенообразной желудочковой пароксизмальной тахикардии не было зарегистрировано ни у одного из пациентов (см. разделы «Побочное действие» и «Фармакокинетика»).
Инотузумаб озогамицин следует вводить с осторожностью пациентам с удлинением интервала QT в анамнезе или с предрасположенностью к его удлинению, которые получают лекарственные препараты, обладающие известной способностью удлинять интервал QT, и пациентам с электролитными нарушениями (см. раздел «Взаимодействие с другими лекарственными препаратами»). До начала лечения и в ходе лечения пациентам следует выполнять электрокардиографию и определять у них уровень электролитов в крови.
Увеличение активности амилазы и липазы
У пациентов, принимающих инотузумаб озогамицин, было зарегистрировано увеличение активности амилазы и липазы (см. раздел «Побочное действие»).
Рекомендуется осуществлять мониторинг увеличения активности амилазы и липазы у пациентов. Следует оценивать возможность развития заболеваний печени и желчевыводящих путей и проводить лечение в соответствии со стандартной медицинской практикой.
Иммунизация
Безопасность иммунизации живыми вирусными вакцинами во время или после проведения терапии инотузумабом озогамицином не изучена. Не рекомендуется проводить вакцинацию живыми вирусными вакцинами по крайней мере за 2 недели до начала лечения инотузумабом озогамицином, во время лечения и до восстановления уровня В лимфоцитов после последнего цикла лечения.
Влияние на способность управлять трансп. ср. и мех.:
Инотузумаб озогамицин может влиять на способность управлять автотранспортными средствами и работать с механизмами. У пациентов может возникать повышенная утомляемость во время лечения инотузумабом озогамицином (см. раздел «Побочное действие»). В связи с этим при управлении автотранспортными средствами или работе с механизмами пациентам следует соблюдать осторожность.
Generic name: inotuzumab ozogamicin [ IN-oh-TOOZ-ue-mab-OH-zoe-ga-MYE-sin ]
Brand name: Besponsa
Dosage form: intravenous powder for injection (0.9 mg)
Drug class: Miscellaneous antineoplastics
What is inotuzumab ozogamicin?
Inotuzumab ozogamicin is a monoclonal antibody linked to a chemotherapy drug. Monoclonal antibodies are made to target and destroy only certain cells in the body. This may help to protect healthy cells from damage.
Inotuzumab ozogamicin is used to treat a certain type of acute lymphocytic leukemia that has come back or has not responded after prior chemotherapy.
Inotuzumab ozogamicin may also be used for purposes not listed in this medication guide.
Inotuzumab ozogamicin side effects
Get emergency medical help if you have signs of an allergic reaction: hives; difficult breathing; swelling of your face, lips, tongue, or throat.
Some side effects may occur during or shortly after the injection. Tell your caregiver right away if you feel cold, itchy, feverish, or short of breath. These symptoms could also occur up to 1 hour after your inotuzumab ozogamicin injection.
Inotuzumab ozogamicin may cause serious side effects. Call your doctor at once if you have:
-
fever, weakness, cold or flu symptoms;
-
cough, trouble breathing;
-
swollen gums, mouth sores;
-
pale skin, easy bruising, skin sores;
-
a headache with chest pain and severe dizziness, fainting, fast or pounding heartbeats;
-
signs of liver problems—upper stomach pain, jaundice (yellowing of the skin or eyes), or rapid weight gain, swelling in your arms or legs, painful swelling in your midsection; or
-
unusual bleeding—bleeding gums, abnormal vaginal bleeding, blood in your urine or stools, coughing up blood or vomit that looks like coffee grounds.
Your cancer treatments may be delayed or permanently discontinued if you have certain side effects.
Common side effects of inotuzumab ozogamicin may include:
-
fever;
-
feeling tired;
-
nausea, stomach pain;
-
headache; or
-
abnormal laboratory tests.
This is not a complete list of side effects and others may occur. Call your doctor for medical advice about side effects. You may report side effects to FDA at 1-800-FDA-1088.
Warnings
inotuzumab ozogamicin may cause serious or life-threatening liver problems, including veno-occlusive disease (blocked blood vessels in the liver that can lead to liver damage).
Call your doctor at once if you have signs of liver problems, such as upper stomach pain, jaundice (yellowing of the skin or eyes), rapid weight gain, or painful swelling in your midsection.
Before taking this medicine
Tell your doctor if you have ever had:
-
liver problems;
-
a stem cell transplant;
-
long QT syndrome (in you or a family member); or
-
an electrolyte imbalance (such as low levels of potassium or magnesium in your blood).
You may need to have a negative pregnancy test before starting this treatment.
Inotuzumab ozogamicin can harm an unborn baby. Use effective birth control to prevent pregnancy while you are using this medicine, whether you are a man or a woman. Men should use condoms. Inotuzumab ozogamicin use by either parent may cause birth defects.
If you are a woman, keep using birth control for at least 8 months after your last dose of inotuzumab ozogamicin. If you are a man, keep using condoms for at least 5 months after your last dose. Tell your doctor right away if a pregnancy occurs while either the mother or the father is using inotuzumab ozogamicin.
This medicine may affect fertility (ability to have children) in both men and women. However, it is important to use birth control to prevent pregnancy because inotuzumab ozogamicin may harm the baby if a pregnancy does occur.
You should not breastfeed while using this medicine and for at least 2 months after your last dose.
How is inotuzumab ozogamicin given?
Inotuzumab ozogamicin is given as an infusion into a vein. A healthcare provider will give you this injection.
You may be given other medicines to help prevent certain side effects of inotuzumab ozogamicin. Take these medicines for the full prescribed length of time.
Inotuzumab ozogamicin is given in a 21-day or 28-day treatment cycle. You may need to use the medicine only on certain days of each cycle. Your doctor will determine how long to treat you with inotuzumab ozogamicin.
Inotuzumab ozogamicin may cause serious or life-threatening liver problems, including veno-occlusive disease (blocked blood vessels in the liver that can lead to liver damage). Your liver function will need to be checked.
Inotuzumab ozogamicin can also weaken (suppress) your immune system, and you may get an infection or bleed more easily. Your blood will need to be tested often. Your cancer treatments may be delayed based on the results.
Your heart function may need to be checked using an electrocardiograph or ECG (sometimes called an EKG).
What happens if I miss a dose?
Call your doctor for instructions if you miss an appointment for your inotuzumab ozogamicin injection.
What happens if I overdose?
Since inotuzumab ozogamicin is given by a healthcare professional in a medical setting, an overdose is unlikely to occur.
What should I avoid while receiving inotuzumab ozogamicin?
Follow your doctor’s instructions about any restrictions on food, beverages, or activity.
What other drugs will affect inotuzumab ozogamicin?
Inotuzumab ozogamicin can cause a serious heart problem. Your risk may be higher if you also use certain other medicines for infections, asthma, heart problems, high blood pressure, depression, mental illness, cancer, malaria, or HIV.
Other drugs may affect inotuzumab ozogamicin, including prescription and over-the-counter medicines, vitamins, and herbal products. Tell your doctor about all your current medicines and any medicine you start or stop using.
Further information
Remember, keep this and all other medicines out of the reach of children, never share your medicines with others, and use this medication only for the indication prescribed.
Always consult your healthcare provider to ensure the information displayed on this page applies to your personal circumstances.
Medical Disclaimer
Copyright 1996-2023 Cerner Multum, Inc. Version: 3.02.
1. Henze G., v Stackelberg A., Eckert C. ALL-REZ BFM-The consecutive trials for children with relapsed acute lymphoblastic leukemia. Klin Padiatr 2013; 225 Suppl 1: S73–8.
2. Möricke A., Zimmermann M., Reiter A., Henze G., Schrauder A. Gadner H., et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia 2010; 24 (2): 265–84.
3. Oskarsson T., Söderhäll S., Arvidson J., Forestier E., Montgomery S., Bottai M., et al. Relapsed childhood acute lymphoblastic leukemia in the Nordic countries: prognostic factors, treatment and outcome. Haematologica 2016; 101 (1): 68–76.
4. Parker C., Waters R., Leighton C., Hancock J., Sutton R., Moorman A.V., et al. Effect of mitoxantrone on outcome of children with first relapse of acute lymphoblastic leukaemia (ALL R3): an open-label randomized trial. Lancet 2010; 376 (9757): 2009–17.
5. Ko R.H., Ji L., Barnette P., Bostrom B., Hutchinson R., Raetz E., et al. Outcome of patients treated for relapsed or refractory acute lymphoblastic leukemia: a Therapeutic Advances in Childhood Leukemia Consortium study. J Clin Oncol 2010; 28 (4): 648–54.
6. Mejstríková E., Hrusak O., Borowitz M.J., Whitlock J.A., Brethon B., Trippett T.M., et al. CD19-negative relapse of pediatric B-cell precursor acute lymphoblastic leukemia following blinatumomab treatment. Blood Cancer J 2017; 7 (12): 659.
7. Dourthe M.E., Rabian F., Yakouben K., Chevillon F., CabannesHamy A., Méchinaud F., et al. Determinants of CD19-positive vs CD19-negative relapse after tisagenlecleucel for B-cell acute lymphoblastic leukemia. Leukemia 2021; 35 (12): 3383–93.
8. DiJoseph J.F., Armellino D.C., Boghaert E.R., Khandke K., Dougher M.M., Sridharan L., et al. Antibody-targeted chemotherapy with CMC-544: A CD22-targeted immunoconjugate of calicheamicin for the treatment of B-lymphoid malignancies. Blood 2004; 103 (5): 1807–14.
9. De Vries J.F., Zwaan C.M., De Bie M., Voerman J.S.A., den Boer M.L., van Dongen J.J.M., et al. The novel calicheamicin-conjugated CD22 antibody inotuzumab ozogamicin (CMC-544) effectively kills primary pediatric acute lymphoblastic leukemia cells. Leukemia 2012; 26 (2): 255–64.
10. Kantarjian H.M., DeAngelo D.J., Stelljes M., Liedtke M., Stock W., Gökbuget N., et al. Inotuzumab ozogamicin versus standard of care in relapsed or refractory acute lymphoblastic leukemia: Final report and long-term survival follow-up from the randomized, phase 3 INOVATE study. Cancer 2019; 125 (14): 2474–87.
11. Lanza F., Maffini E., Rondoni M., Massari E., Faini A.C., Malavasi F. CD22 expression in b-cell acute lymphoblastic leukemia: Biological significance and implications for inotuzumab therapy in adults. Cancers 2020; 12 (2): 303.
12. Iwamoto S., Deguchi T., Ohta H., Kiyokawa N., Tsurusawa M., Yamada T., et al. Flow cytometric analysis of de novo acute lymphoblastic leukemia in childhood: Report from the Japanese Pediatric Leukemia/Lymphoma Study Group. Int J Hematol 2011; 94 (2): 185–92.
13. Shah N.N., Stevenson M.S., Yuan C.M., Richards K., Delbrook C., Kreitman R.J., et al. Characterization of CD22 expression in acute lymphoblastic leukemia. Pediatr Blood Cancer 2015; 62 (6): 964–9.
14. Bhojwani D., Sposto R., Shah N.N., Rodriguez V., Yuan C., Stetler-Stevenson M., et al. Inotuzumab ozogamicin in pediatric patients with relapsed/refractory acute lymphoblastic leukemia. Leukemia 2019; 33 (4): 884–92.
15. Calvo C., Cabannes-Hamy A., Adjaoud D., Bruno B., Blanc L., Boissel N., et al. Inotuzumab ozogamicin compassionate use for French paediatric patients with relapsed or refractory CD22-positive B-cell acute lymphoblastic leukaemia. Br J Haematol 2020; 190 (1): e53–6. DOI: 10.1111/bjh.16732
16. Brivio E., Locatelli F., LopezYurda M., Malone A., Diaz de Heredia C., Bielorai B., et al. A Phase I study of inotuzumab ozogamicin in pediatric relapsed/refractory acute lymphoblastic leukemia (ITCC-059 study). Blood 2021; 137 (12): 1582–90.
17. O’Brien M.M., Ji L., Shah N.N., Rheingold S.R., Bhojwani D., Yuan C.M., et al. Phase II Trial of Inotuzumab Ozogamicin in Children and Adolescents With Relapsed or Refractory B-Cell Acute Lymphoblastic Leukemia: Children’s Oncology Group Protocol AALL1621. J Clin Oncol 2022; 40 (9): 956–67.
18. [Electronic resource]. URL: https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_5x7.pdf (accessed 20.02.2023).
19. Pennesi E., Michels N., Brivio E., van der Velden V.H.J., Jiang Y., Thano A., et al. Inotuzumab ozogamicin as single agent in pediatric patients with relapsed and refractory acute lymphoblastic leukemia: results from a phase II trial. Leukemia 2022; 36 (6): 1516–24.
20. Brivio E., Chantrain C.F., Gruber T.A., Thano A., Rialland F., Contet A., et al. Inotuzumab ozogamicin in infants and young children with relapsed or refractory acute lymphoblastic leukaemia: a case series. Br J Haematol 2021;193 (6): 1172–7.
21. Маркова И.В., Бондаренко С.Н., Паина О.В., Бабенко Е.В., Гиндина Т.Л., Бархатов И.М. и др. Эффективность и безопасность терапии анти-CD22-моноклональным антителом при рецидивах и рефрактерных формах В-линейного острого лимфобластного лейкоза у детей и взрослых. Педиатрия. Журнал им. Г.Н. Сперанского 2020; 99 (4): 27–34.
Острый лимфобластный лейкоз (ОЛЛ) — самый частый тип лейкоза в детском возрасте. Это заболевание имеет хороший прогноз: выживаемость без рецидивов составляет около 90%. Однако у части пациентов болезнь имеет устойчивую к лечению (рефрактерную) форму. Также в ряде случаев развивается рецидив заболевания.
Один из возможных методов лечения для таких пациентов — иммунотерапия. В этой статье описаны существующие возможности иммунотерапии детского ОЛЛ. Про общие принципы иммунотерапии написано в другой нашей статье.
На сегодняшний день разработаны иммунопрепараты для лечения ОЛЛ у детей — блинатумомаб и инотузумаб озогамицин. Эти препараты показали свою высокую эффективность.
Блинатумомаб
Существует несколько типов лейкоцитов, одним из них являются лимфоциты. При ОЛЛ опухолевые клетки представлены молодыми формами лимфоцитов – лимфобластами. Лимфоциты дополнительно делятся на В- и Т-лимфоциты. В зависимости от принадлежности опухолевых клеток выделяют В- и Т-линейный ОЛЛ.
На всех лейкоцитах находятся специальные вещества — антигены. По набору разных антигенов можно узнать точный тип лейкоцита и степень его зрелости. На В-лимфоцитах, в том числе, на опухолевых лимфобластах находится антиген CD19. На Т-лимфоцитах, которые способны уничтожать мутировавшие клетки, находится антиген CD3.
Блинатумомаб — лекарственный препарат из группы моноклональных антител, который может распознавать антиген CD19 на поверхности опухолевых В-лимфоцитов и антиген CD3 на поверхности Т-лимфоцитов. Когда препарат находит эти антигены, он связывается с ними и активирует Т-лимфоциты для уничтожения опухолевых В-лимфоцитов.
Блинатумомаб продемонстрировал хорошую эффективность в лечении детей с рецидивом и устойчивой к лечению формой В-ОЛЛ. В крупном клиническом исследовании было проведено сравнение эффективности и токсичности двух подходов к лечению: иммунотерапии с применением блинатумомаба и стандартной химиотерапии у детей с рецидивом В-ОЛЛ перед проведением аллогенной трансплантации костного мозга (ТКМ). По результатам исследования пациенты, которые получали блинатумомаб, чаще достигали МОБ-негативной ремиссии, у них реже развивался рецидив заболевания, было зарегистрировано меньше тяжелых осложнений.
На сегодняшний день препарат одобрен и может быть использован у детей и взрослых с CD19-позитивным В-линейным ОЛЛ при рецидиве или рефрактерной, то есть устройчивой к лечению форме болезни (CD-19 позитивный ОЛЛ — форма ОЛЛ, при которой на поверхности опухолевых клеток есть антиген CD19.) Иммунотерапия с применением блинатумомаба повышает шансы пациента с такой формой заболевания достигнуть полной ремиссии или уменьшить уровень МОБ. Попытка достижения МОБ-негативной ремиссии перед ТКМ очень важна. Поэтому иммунотерапию еще называют «мостиком» к ТКМ. Пациенты, которые находятся в МОБ-негативной ремиссии, имеют более высокие шансы на успешный результат ТКМ и выздоровление.
Препарат не может быть использован у пациентов с Т-линейным ОЛЛ, поскольку на Т-лимфоцитах отсутствует антиген CD19. Иногда на В-лимфобластах также отсутствует данный антиген, что исключает возможность использования блинатумомаба. Такое редко бывает при первичном ОЛЛ, но может встречаться у пациентов с рецидивом заболевания, которые уже получали иммунотерапию блинатумомабом и/или CAR-T-клеточную терапию.
Курс лечения блинатумомабом представляет собой постоянное внутривенное введение препарата в течение 28 дней. Может потребоваться от одного до четырех курсов иммунотерапии – в зависимости от результатов лечения.
Наиболее частые побочные эффекты: лихорадка, головная боль, инфекционные осложнения, снижение показателей общего анализа крови (лейкоцитов, тромбоцитов, эритроцитов и гемоглобина), повышение ферментов печени. Наиболее серьезное осложнение — синдром выброса цитокинов, который проявляется лихорадкой с ознобом, одышкой, чувством слабости и головокружением, отеками. Осложнения могут возникать на любом этапе терапии, поэтому во время курса блинатумомаба ребенок обычно находится в стационаре, где проводится наблюдение за его состоянием и контроль анализов.
Инотузумаб озогамицин
Другой антиген, который находится на поверхности В-лимфоцитов — CD22. Инотузумаб озогамицин (IO) — препарат, который состоит из 2-х частей: моноклонального антитела, нацеленного на антиген CD22, и противоопухолевого лекарства — калихеамицина. При введении в организм препарат IO находит антиген CD22 на поверхности В-лимфобластов, связывается с ним и проникает внутрь опухолевой клетки. Таким образом препарат доставляет в нее калихеамицин, который повреждает ДНК лимфобласта. В результате этого опухолевая клетка умирает.
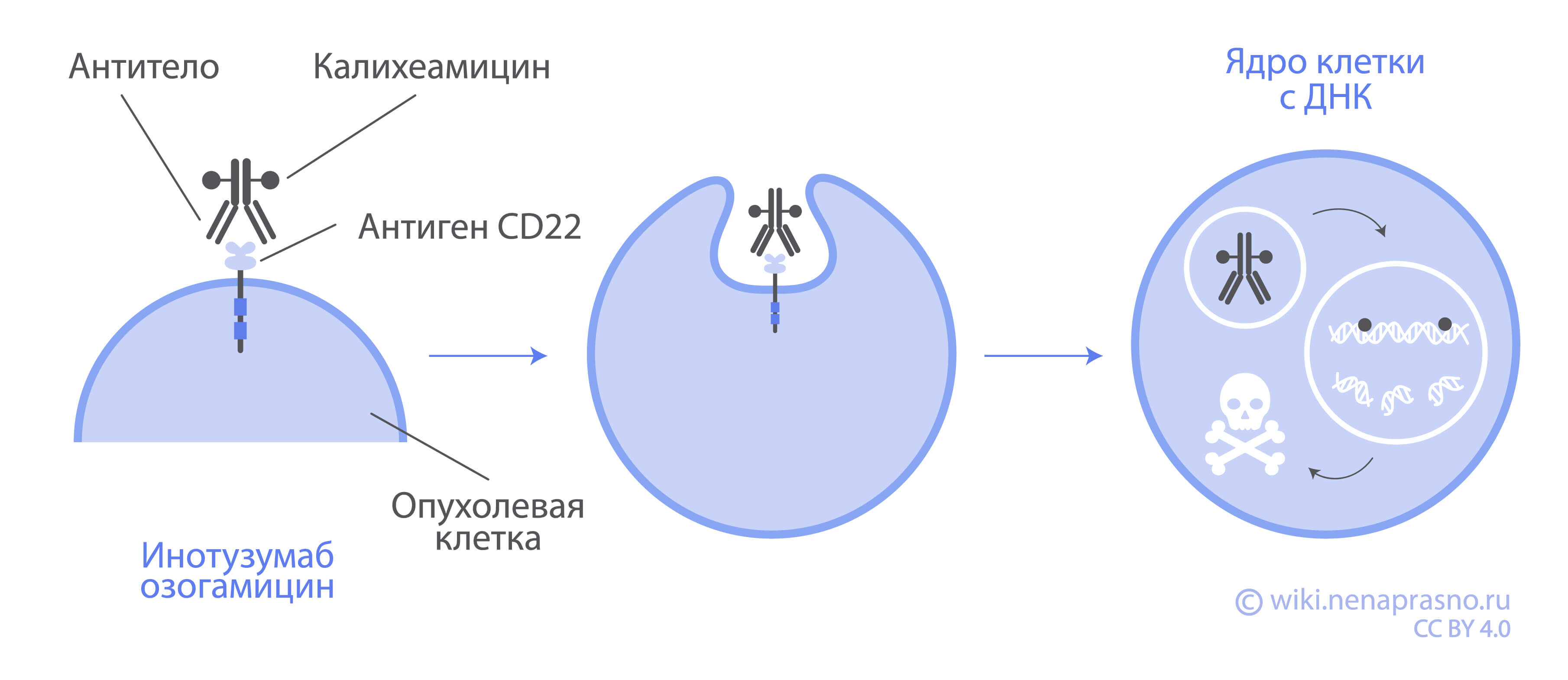
На сегодняшний день IO одобрен для лечения взрослых пациентов с рецидивом или рефрактерной формой CD22-позитивного ОЛЛ. По данным исследований IO также эффективен в лечении таких форм ОЛЛ у пациентов детского возраста. Применение IO у детей с рецидивом или рефрактерной формой ОЛЛ повышает шансы достигнуть полной клинико-гематологической ремиссии, МОБ-негативной ремиссии, а также позволяет снизить уровень МОБ перед планируемой ТКМ.
Курс IO представляет собой внутривенное введение препарата один раз в неделю в течение трех недель. Количество курсов терапии может варьировать от одного до пяти – в зависимости от результатов лечения.
Самые частые побочные эффекты: повышение температуры, инфекционные осложнения, повышение ферментов печени, снижение показателей общего анализа крови. Кроме того, у части пациентов, которые получили терапию IO и прошли ТКМ, развивалось тяжелое поражение печени. Поэтому назначение лечения пациентам, которым впоследствии планируется проведение ТГСК, требует тщательного планирования.
Так же, как и блинатумомаб, IO не может быть использован у пациентов с T-линейным ОЛЛ или CD22-негативным ОЛЛ, при которых на В-лимфобластах отсутствует антиген CD22. В этих случаях на опухолевых клетках нет мишени для препарата.
Иммунотерапия в лечении первичного ОЛЛ
В настоящее время блинатумомаб и IO не используются рутинно в лечении первичного, то есть не рецидивного и не рефрактерного ОЛЛ. Это связано с тем, что эффективность иммунопрепаратов у детей с первичным ОЛЛ не была подтверждена в клинических исследованиях. Кроме того, имеет значение и высокая стоимость препаратов. Однако в некоторых ситуациях допускается применение блинатумомаба у детей с первичным ОЛЛ: например, у пациентов с тяжелой токсичностью на фоне химиотерапии, из-за чего продолжение стандартной терапии невозможно. Также проводятся исследования по примению блинатумомаба в качестве консолидирующей терапии у пациентов с первичным ОЛЛ.
Пациенты с повторными рецидивами ОЛЛ
Наиболее сложную группу представляют собой пациенты с сохраняющейся МОБ или рецидивом заболевания после проведенной ТКМ, CAR-T-клеточной терапии, иммунотерапии. Стандартов лечения для таких пациентов не существует, и схема лечения для них должна подбираться индивидуально. Возможными вариантами являются повторные курсы иммунотерапии, повторная ТКМ, а также совместное применение блинатумомаба с трансфузией донорских лимфоцитов.
Выводы
- На сегодняшний день разработаны эффективные иммунопрепараты для лечения В-линейного ОЛЛ у детей: блинатумомаб и инотузумаб озогамицин.
- Несмотря на высокую эффективность и относительно невысокую токсичность, на сегодняшний день эти препараты используются преимущественно у детей с рецидивом или рефрактерной формой В-ОЛЛ.
- Использование иммунопрепаратов позволяет достичь ремиссии ОЛЛ, в том числе, МОБ-негативной – это делает возможным проведение трансплантации костного мозга.
- Самые частые осложнения иммунотерапии ОЛЛ — повышение температуры, изменение лабораторных показателей крови, инфекционные осложнения
Что еще почитать и посмотреть?
- Наглядное видео о механизме работы блинатумомаба от Американского общества клинической онкологии (на английском языке).
- Про иммунотерапию детского ОЛЛ от Американского онкологического общества (на английском языке).
| Инотузумаб озогамицин | |
|---|---|
 |
|
| Химическое соединение | |
| CAS | 635715-01-4 |
| DrugBank | DB05889 |
| Состав | |
| Классификация | |
| АТХ | L01XC26 |
| Другие названия | |
| CMC-544; Besponsa |
Инотузумаб озогамицин — конъюгат антитело-препарат для лечения острого лимфобластного лейкоза. Одобрен для применения: США (2017)[1][2].
Механизм действия[править | править код]
Конъюгат анти-CD22 моноклонального антитела и препарата класса (калихеамицин[en]) (озогамицин[en]).
Показания[править | править код]
рецидивирующий или рефрактерный пре-В-клеточный острый лимфобластный лейкоз[3]
Способ применения[править | править код]
Внутривенная инфузия.
Беременность[править | править код]
Женщины детородного возраста во время лечения и 8 мес. после него должны использовать методы контрацепции[3].
Мужчины во время лечения и 5 мес. после него должны использовать методы контрацепции[3].
Побочные эффекты[править | править код]
На этикетке препарата инотузумаб озагамицин в США имеется предупреждение FDA о риске токсичности печени, в частности, печеночной вено-окклюзионной болезни.
Наиболее распространёнными серьёзными побочными реакциями у людей, принимавших препарат в клинических испытаниях, которые привели к его одобрению, были инфекции (23%), потеря нейтрофилов с лихорадкой (11%), кровотечение (5%), боль в животе (3%), лихорадка (3%), печёночная вено-окклюзионная болезнь (2%) и усталость (2%).
Более чем у 20% людей наблюдались следующие побочные реакции: потеря тромбоцитов (51%), потеря нейтрофилов (49%), инфекции (48%), анемия (36%), лейкопения (35%), усталость (35%), кровотечение (33%), лихорадка (32%), тошнота (31%), головная боль (28%), потеря нейтрофилов с лихорадкой (26%), повышение уровня трансаминаз (26%), боль в животе (23%) и желтуха (21%).
От 10% до 20% людей также страдали потерей аппетита, рвотой, диареей, язвами во рту, запорами, ознобом и реакциями в месте инъекции.
Примечания[править | править код]
- ↑ Novel Drug Approvals for 2017 (англ.). FDA. Дата обращения: 4 марта 2022. Архивировано 29 июня 2017 года.
- ↑ Inotuzumab Ozogamicin: First Global Approval (англ.) // Drugs. : journal. — 2017. — doi:10.1007/s40265-017-0802-5. — PMID 28819740.
- ↑ 1 2 3 BESPONSA- inotuzumab ozogamicin injection, powder, lyophilized, for solution (англ.). DailyMed. U. S. National Library of Medicine.
