
Азотная кислота — одноосновное сильное соединение в форме маслянистой бесцветной жидкости со специфическим запахом. Хорошо растворяется в воде.
Область применения
Применяется в быту для очистки столового серебра и ювелирных серебряных изделий от налета.
Инструкция
Для очистки серебряных изделий с помощью азотной кислоты потребуются дистиллированная вода и стеклянная миска или стакан вместимостью 100-500 мл). Последовательность действий, следующая:
- разбавить азотную кислоту водой до достижения концентрации 30-35% (при приготовлении раствора нужно учитывать размеры серебряных изделий);
- погрузить ювелирные изделия или столовое серебро в раствор и ждать, пока раствор окрасится в голубой (при наличии в изделии меди) или зеленоватый (при присутствии солей железа) цвет;
- после прекращения выделения газа слить раствор в емкость. Изделие промыть дистиллированной водой и просушить.
Внимание! Концентрированная азотная кислота негативно воздействует на кожу и органы зрения. Все работы с ней необходимо проводить в средствах индивидуальной защиты (перчатки, защитные очки, респиратор).
Товары, упоминаемые в статье
Азотная кислота HNO3 — одна из важнейших неорганических кислот. Как ключевой компонент удобрений, она является одним из наиболее часто производимых химических сырьевых материалов в мире. По мнению аналитиков Fortune Business Insights, в ближайшие десятилетия спрос на нее будет продолжать расти.

Азотная кислота — свойства
Самые ранние записи об азотной кислоте относятся к 14 веку и первым смелым алхимическим опытам. В то время она использовалась для получения так называемой королевской воды (aqua regia) — раствора, способного растворять золото и платину. На самом деле, HNO3 обладает высокой коррозионной и химической активностью.
Азотная кислота (V) — это бесцветная жидкость с очень резким запахом и едкими свойствами. При длительном хранении под воздействием температуры меняет цвет на желтый в результате самопроизвольного разложения на оксиды азота и воду. Она легко вступает в реакцию со многими веществами, а при растворении в воде выделяет тепло. Значительная часть реакций с ее участием даже взрывоопасна.
Как сама азотная кислота, так и ее соли являются сильными окислителями. Этот факт объясняет бурную реакцию с металлами, в результате которой выделяется водород. Реакциям с HNO3 также подвержены неактивные металлы и некоторые неметаллы, например сера, фосфор и углерод в форме графита. Последние окисляются с образованием кислот.
Концентрированная азотная кислота представляет собой вещество, очень опасное для здоровья. При попадании на кожу вызывает сильные ожоги и даже некроз. В виде пара она поражает дыхательные пути, вызывая отек и пневмонию. Случайное употребление HNO3 может привести к смерти из-за перфорации желудка или стенки кишечника.

Азотную кислоту можно получить в результате реакции диоксида азота с водой. В коммерческих целях основным методом производства является так называемый процесс Оствальда. Речь идет о каталитическом окислении аммиака до оксида азота, которое с помощью специальных абсорбционных башен позволяет получить концентрированную кислоту HNO3. Для коммерческих целей наиболее желательна концентрация 65-68%.
В лабораторных условиях альтернативным методом производства является реакция нитрата калия с серной кислотой, в результате чего получается чистая азотная кислота (V).
Применение азотной кислоты
В результате нейтрализации азотной кислоты аммиаком образуется нитрат аммония — важнейший компонент минеральных удобрений, используемых во всем мире. Он обеспечивает культурные и декоративные растения азотом, необходимым для роста, в высоких легкоусвояемых дозах. Кроме того, кислоту HNO3 можно использовать в садоводстве для подкисления почвы.
В химической промышленности азотная кислота (V) это в первую очередь прекурсор органических азотных соединений, таких как нитробензолы. В сочетании с ароматическими соединениями он дает вещества, используемые в производстве взрывчатых веществ, такие как тротил (TNT) или нитроглицерин.
Еще одно важное применение — ракетное топливо. Для этого готовят смесь HNO3, тетроксида диазота и перекиси водорода, также известную как красная дымящаяся азотная кислота. Его использование в космической промышленности зависит от возможности эффективного хранения сырья.
Также стоит отметить потенциал азотной кислоты в производстве пластмасс. В результате ее окисления образуется адипиновая кислота, которая используется в производстве синтетических волокон, таких как нейлон.
Другие, более нишевые области применения азотной кислоты (V) включают:
- производство органических красок и лаков;
- фармацевтическую промышленность;
- производство фунгицидов;
- очистку и травление металлических поверхностей;
- аффинаж драгоценных металлов в ювелирной промышленности;
- искусственное старение древесины для получения желаемого оттенка;
- производство чистящих средств для бытового использования;
- обнаружение следов металлов в исследуемых в лаборатории веществах.

Концентрированная азотная кислота и меры предосторожности
Из-за взрывоопасного характера реакций и образующихся смесей, а также исключительной опасности для здоровья, азотная кислота (V) требует особой осторожности при хранении и использовании. В соответствии с правилами ДОПОГ по перевозке опасных грузов, ее следует перевозить в алюминиевых цистернах или автоцистернах с соответствующей маркировкой.
Для хранения азотной кислоты используются специальные резервуары, устойчивые к ее воздействию. Они должны быть надлежащим образом закрыты и храниться вдали от прямых солнечных лучей при температуре ниже 20°C. Рядом не должно быть металлов или легковоспламеняющихся веществ. Само помещение должно хорошо проветриваться.
Концентрированная азотная кислота также требует использования средств индивидуальной защиты при работе с сырьем. Каждый человек, контактирующий с кислотой, обязан носить респиратор, защитные очки, кислотостойкую одежду и перчатки. После работы рекомендуется тщательно вымыть руки и лицо и покрыть кожу барьерным кремом.
Как азотная кислота (V) влияет на окружающую среду?
Случайный выброс кислоты HNO3 в окружающую среду представляет угрозу для людей, животных и растений. Поэтому утечку кислоты в поверхностные и грунтовые воды необходимо предотвращать любой ценой. Возможные разливы должны быть немедленно устранены с помощью абсорбирующих материалов или путем откачки.
Азотная кислота является широко используемым сырьем и играет ключевую роль в производстве удобрений, взрывчатых веществ и синтетических пластмасс. Однако преимущества, связанные с его использованием, не должны перевешивать потенциальные риски. Ответственное соблюдение действующих правил — лучшая форма предотвращения опасных для жизни несчастных случаев.
ХимЭксперт осуществляет оптовые продажи азотной кислоты с возможностью доставки заказываемого химического реагента в различные регионы России. Купить азотную кислоту оптом по видам и концентрации по ценам от производителя возможно в компании Химэксперт. К товару прилагается обязательная сертификация продукции завода изготовителя. Чтобы купить азотную кислоту оптом по безналичному расчёту, свяжитесь с нашим специалистом, или отправьте заявку на электронный адрес компании. Химэксперт предлагает к продаже азотную кислоту разбавленную, концентрированную, химически чистую по ГОСТам. Также в наличии и другие виды химической продукции и химреактивов.
Условия транспортировки и хранения азотной кислоты
Растворы азотной кислоты перевозятся железнодорожным и автомобильным транспортом в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта. Цистерны должны быть заполнены не более чем на 90% их вместимости.
Неконцентрированную азотную кислоту хранят в герметичных резервуарах-хранилищах, изготовленных из кислотостойких материалов, на открытых площадках. Неконцентрированную азотную кислоту, упакованную в тару, хранят в крытых складских помещениях при температуре не более 40°С. Не допускается совместное хранение и транспортирование неконцентрированной азотной кислоты с органическими веществами, легковоспламеняющимися и горючими веществами
Применение азотной кислоты
Основным индустриальным направлением, в котором может использоваться данный химикат, является получение его нитратов. И азотная кислота, как производная для их синтеза, востребована в производстве минеральных удобрений, взрывчатых веществ, пиротехники и так далее. Кроме этого, данный реактив может эксплуатироваться в некоторых прикладных отраслях химического производства. В частности, в изготовлении широкой номенклатуры лакокрасочных материалов, лекарственных средств. Востребована, как присадка к реактивному топливу. А также может использоваться, как сырьё для получения широчайшего спектра азотосодержащих химических веществ: анилин, нитроцеллюлоза, алканы и прочие.
В зависимости от концентрации азотная кислота применяется в различных отраслях:
- производство широкого спектра азотных удобрений;
- травление печатных форм в станковой графике;
- подкисление тонирующих растворов при производстве фотографии;
- изготовление лекарственных средств;
- производство отравляющих и взрывчатых веществ;
- производство ракетного топлива;
- растворение, травление, гравировка металлов, гальванизация и многое другое
Азотная кислота. Применение, свойства и характеристики Что такое азотная кислота?
Азотная кислота – это неорганическая сильная кислота. Внешне выглядит, как прозрачная, жидкость с насыщенным желтоватым оттенком. Химическая формула соединения HNO3 Физические свойства азотной кислоты В естественных условиях, будучи помещённой в любой открытый сосуд, азотная кислота создаёт ощущение постоянно дымящей жидкости в силу изобилия исходящих от неё испарений. Вещество превосходно смешивается с водой, по этой причине в технических целях редко используется в чистом виде, чаще применяются водные растворы кислоты. Не растворяет и не взаимодействует со стеклом и фторопластом-4. Температура плавления — 41°С, температура кипения в стандартных условиях +82,6°С, кипение сопровождается некоторым распадом вещества. В результате кристаллизации водных растворов данный химикат способен образовывать кристаллогидраты. Азотная кислота – это тяжёлая жидкость. Обусловлено это повышенной плотностью вещества. Удельный вес кислоты в полтора раза выше аналогичного показателя у воды. Смешивается с другими неорганическими кислотами. Смесь азотной кислоты и серной называется «меланж». Смесь азотной и соляной кислоты в пропорции 1:3 называется «царской водкой», эта смесь обладает уникальными свойствами, в числе которых способность растворять некоторые инертные металлы и прочее.
Химические свойства азотной кислоты
Вещество обладает набором свойств, характерным для своего класса, то есть, азотная кислота взаимодействует с широчайшей номенклатурой соединений и химических элементов. Способна взаимодействовать с основаниями, с солями других кислот, вытесняя при этом более слабые кислоты из образованных ими солей. Обладая свойствами сильного окислителя, реагирует с неметаллами, образовывая кислоты: при реакции с серой образовывает серную кислоту, с фосфором – фосфорную и так далее. Вступает во взаимодействие с органическими веществами, при этом, некоторые из них при такой реакции воспламеняются. Примеры: скипидар, амины и прочие химикаты. Взаимодействие азотной кислоты с металлами — азотная кислота не реагирует с инертными (благородными – золото, платина, тантал и другие) металлами ни будучи в концентрированном виде, ни в водном растворе любой пропорции. С остальными же металлами (их оксидами) данный химикат вступает в классическую реакцию замещения, образовывая соли азотной кислоты – нитраты. Нитраты по-другому называются селитрами и являются одной из наиболее распространённых разновидностей удобрений. Известен также нитрат, образованный при взаимодействии с неметаллом – аммониевая селитра с формулой NH4NO3. Сильные окислительные свойства, присущие азотной кислоте, присущи также и её солям. Селитры, как правило, являются взрывоопасными и горючими веществами, что существенно повлияло на область их применения в производственно-хозяйственных целях.
Получение азотной кислоты
Современный промышленный способ синтеза этого химиката основан на, так называемом, методе Оствальда. Данный метод состоит в окислении синтетического аммиака с применением платино-родиевых катализаторов. На первом этапе образуется окись азота, которая при последующей переработке преобразуется в диоксид азота, трансформирующийся в результате окислительной реакции и насыщении водой в водный раствор азотной кислоты с концентрацией вещества 45-58%.
Виды азотной кислоты и маркировка
Синтезированный реактив в зависимости от условий, в которых он был получен, включает в себя некоторое количество воды, и в дальнейшем может подвергаться обработке с целью придания ему необходимых свойств. Таким образом, различные разновидности этого химиката:
Азотная кислота ХЧ – это водный раствор с концентрацией основного вещества 65%. Химически чистая кислота, применяемая для различных производственных нужд, в том числе, для лабораторной практики, травильных работ и прочих отраслей индустрии. Азотная кислота тех – это водный раствор с концентрацией основного вещества 56%. Азотная кислота ОСЧ – водный раствор с концентрацией основного вещества не менее 70%. Особо чистая кислота с широчайшей областью использования в производстве.
Азотная кислота ЧДА – это водный раствор с концентрацией основного вещества на уровне 57%. Чистая для анализа кислота, применяемая в исследовательских работах и в прочих направлениях хозяйственной деятельности.
Азотная кислота. Класс опасности — 2 основной, 8 — дополнительный
Данный реактив принадлежит к числу опасных химических веществ. Его непосредственное соприкосновение с кожными покровами человеческого тела оставляет на коже сильный химический ожог, незаживающий на протяжении длительного времени. Опасны также и испарения азотной кислоты. При вдыхании они поражают слизистые оболочки органов дыхательной системы. Концентрированная кислота крайне нестабильна по причине повышенной химической активности и в результате распада образовывает отравляющее вещество – диоксид азота, газ бурого цвета, крайне опасный для здоровья человека. Поэтому азотная кислота должна храниться в плотно закупоренных сосудах, при работе с ней необходимо использовать индивидуальные средства защиты. Обязательным является наличие в рабочих помещениях эффективной вентиляционной системы, и соблюдение правил техники безопасности при работе с химикатом.
Стоит отметить, что оперируют двумя ГОСТами при определении класса опасности. Согласно ГОСТу 12.1.007-76 СИСТЕМА СТАНДАРТОВ БЕЗОПАСНОСТИ ТРУДА ВРЕДНЫЕ ВЕЩЕСТВА КЛАССИФИКАЦИЯ И ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ, азотная кислота относится ко 2-му классу опасности. Данный ГОСТ распространяется на вредные вещества, содержащиеся в сырье, продуктах, полупродуктах и отходах производства, и устанавливает общие требования безопасности при их производстве, применении и хранении. Стандарт не распространяется на вредные вещества, содержащие радиоактивные и биологические вещества (сложные биологические комплексы, бактерии, микроорганизмы и т.п.). По степени воздействия на организм вредные вещества подразделяют на четыре класса опасности: 1-й — вещества чрезвычайно опасные; 2-й — вещества высокоопасные; 3-й — вещества умеренно опасные; 4-й — вещества малоопасные.
А по ГОСТу 19433-88 азотная кислота относится к 8 классу опасности, стандарт определяет классификацию перевозки опасных грузов (ADR), и распространяется на опасные грузы и устанавливает: классификацию; номенклатуру показателей и критерии для отнесения грузов к опасным и их классификации; методы определения показателей для классификации опасных грузов; маркировку и правила ее нанесения на грузовые единицы с опасными грузами, в том числе поставляемыми на экспорт. Классификация опасных грузов (отнесение к классу, подклассу, категории и группе) производится в зависимости от вида и степени опасности груза. 1.1.2. Установлены следующие классы опасных грузов: класс 1 — взрывчатые материалы (ВМ); класс 2 — газы сжатые, сжиженные и растворенные под давлением; класс 3 — легковоспламеняющиеся жидкости (ЛВЖ); класс 4 — легковоспламеняющиеся твердые вещества (ЛВТ); самовозгорающиеся вещества (СВ); вещества, выделяющие воспламеняющиеся газы при взаимодействии с водой; класс 5 — окисляющие вещества (ОК) и органические пероксиды (ОП); класс 6 — ядовитые вещества (ЯВ) и инфекционные вещества (ИВ); класс 7 — радиоактивные материалы (РМ); класс 8 — едкие и (или) коррозионные вещества (ЕК); класс 9 — прочие опасные вещества.
Азотная кислота
 Азотная кислота это бесцветная или слегка желтоватая жидкость с едким запахом, плотностью 1, 52 г/см3, температура кипения 84°С, при температуре -41°С затвердевает в бесцветное кристаллическое вещество. Обычно применяемая на практике, концентрированная азотная кислота содержит 65 — 70% HNO3 (максимальная плотность 1, 4 г/см3); с водой кислота смешивается в любых соотношениях. Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества.
Азотная кислота это бесцветная или слегка желтоватая жидкость с едким запахом, плотностью 1, 52 г/см3, температура кипения 84°С, при температуре -41°С затвердевает в бесцветное кристаллическое вещество. Обычно применяемая на практике, концентрированная азотная кислота содержит 65 — 70% HNO3 (максимальная плотность 1, 4 г/см3); с водой кислота смешивается в любых соотношениях. Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества.
Кислота Азотная неконцентрированная
ГОСТ Р5789-2010 сорт высший
|
Наименование показателя |
Высший сорт |
Первый сорт |
Второй сорт |
|
Внешний вид |
Бесцветная или слегка желтоватая прозрачная жидкость без механических примесей |
||
|
Азотной кислоты, не менее |
57 |
56 |
46 |
|
Оксидов азота (в пересчете на N2O4), не более |
0,07 |
0,1 |
0,2 |
|
Остатка после прокаливания, не более |
0,004 |
0,02 |
0,05 |
Кислота азотная специальная, высший сорт
ОСТ 113-03-256-90
|
Наименование показателя |
Норма по ГОСТ |
Фактический |
|
Внешний вид |
Бесцветная или слегка желтоватая прозрачная |
Соответствует |
|
Массовая доля Азотной кислоты, %, не менее |
72 |
74 |
|
Массовая доля Хлоридов, %, не более |
0,0003 |
0,0003 |
|
Массовая доля Оксидов азота (в пересчете на N2O4), %, не более |
0,1 |
0,03 |
|
Массовая доля железа, %, не более |
0,0005 |
0,0005 |
|
Массовая доля прокаленного остатка, %, не более |
0,005 |
0,003 |
По желанию заказчика предоставляем азотную кислоту с концентрацией азотной кислоты от 10% до 57% с предоставлением сертификатов подтверждающих качество данной продукции.
Применение Азотной кислоты:
Применяют азотную кислоту в виде водных растворов, является одной из составных частей царской водки, содержится в пробирных кислотах. В промышленности применяют для получения комбинированных азотных удобрений, для растворения руд и концентратов, в производстве серной кислоты, различных органических нитропродуктов, в ракетной технике как окислитель горючего. В качестве сырья в производстве аммиачной селитры, в процессах травления металлов, для разделения золота и серебра. Также азотная кислота нашла применение в производстве взрывчатых веществ, производстве полупродуктов для получения синтетических красителей и других химикатов пищевой и не пищевой промышленности для мытья технологического оборудования (баки, трубопроводы, конвейерные линии и т.д.), а так же устранения остатков сырья (молочные камни, и др.). В электронной и радиоэлектронной промышленности и др.
Класс опасности Азотной кислоты:
Концентрированная азотная кислота — негорючая пожароопасная жидкость по ГОСТ 12.1.044, сильный окислитель. При контакте со многими материалами вызывает их самовозгорание, сильно дымит на воздухе, выделяя оксиды азота и пары азотной кислоты, которые образуют с влагой воздуха туман, неограниченно растворяется в воде. Пары азотной кислоты в 2,2 раза тяжелее воздуха.
1. При попадании на кожу концентрированная азотная кислота вызывает тяжелые ожоги.
2. Пары азотной кислоты и оксидов азота раздражают верхние дыхательные пути, вызывают конъюнктивиты и поражают роговицы глаз.
3. Концентрированная азотная кислота и оксиды азота по токсичности относятся к умеренно опасным веществам (3-й класс опасности по ГОСТ 12.1.007). Предельно допустимая концентрация (ПДК) паров азотной кислоты и оксидов азота в воздухе рабочей зоны производственных помещений — 2 мг/м по ГОСТ 12.1.005.
4. Помещения, в которых проводят работы с концентрированной азотной кислотой, должны быть оборудованы приточно-вытяжной вентиляцией.
5. Средствами индивидуальной защиты являются фильтрующий противогаз с коробкой марок В, М, БКФ с фильтром для защиты от тумана азотной кислоты по ГОСТ 12.4.121, защитные очки с резиновой полумаской или защитный щиток из оргстекла, или шлем от противогаза, резиновые кислотозащитные перчатки, специальная кислотозащитная одежда в соответствии с типовыми отраслевыми нормами, утвержденными в установленном порядке.
Меры предосторожности при работе с Азотной кислотой
Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках. В то же время обращение с азотной кислотой менее опасно, чем, например, с серной, она быстро испаряется и не остаётся в неожиданных местах. Брызги азотной кислоты следует смывать большим количеством воды, а ещё лучше смачивать раствором соды.
Дымящая азотная кислота при хранении под действием теплоты и на свету частично разлагается, чем выше температура и чем концентрированнее кислота, тем быстрее идёт разложение. В связи с этим хранят её в прохладном и тёмном месте. Выделяющийся диоксид азота растворяется в кислоте и придаёт ей бурую окраску. Разбавленную кислоту легко приготовить, выливая концентрированную кислоту в воду.
Разбавленную азотную кислоту хранят и перевозят в таре из хромистой стали, концентрированную – в алюминиевой таре, т.к. концентрированная кислота пассивирует алюминий, железо и хром из-за образования нерастворимых плёнок оксидов: небольшие количества хранят в стеклянных бутылках. Азотная кислота сильно разъедает резину. Поэтому бутылки должны быть с притёртыми или полиэтиленовыми пробками.
Упаковка:
Налив производится в железнодорожные цистерны и автоцистерны из нержавеющей стали, стеклянные бутыли в деревянной или полиэтиленовой обрешетке, специальные бочки из нержавеющей стали, канистры из полимерного материала.
Транспортировка:
Осуществляется железнодорожным транспортом в цистернах, крытых вагонах, а также автомобильным транспортом в соответствии с правилами перевозки грузов, действующими на транспорте данного вида.
Азотная кислота относится к сильным  минеральным кислотам. Ее формула HNO3. В нормальных условиях представляет собой густую бесцветную или слегка буроватую жидкость с удушающим запахом. Характерно «дымит» на воздухе, гигроскопична, смешивается с водой в любых пропорциях, чувствительна к свету. Для простоты реагент с концентрацией 95% – 98% называют «дымящим», а с концентрацией в пределах от 60% до 70% — концентрированной азотной кислотой.
минеральным кислотам. Ее формула HNO3. В нормальных условиях представляет собой густую бесцветную или слегка буроватую жидкость с удушающим запахом. Характерно «дымит» на воздухе, гигроскопична, смешивается с водой в любых пропорциях, чувствительна к свету. Для простоты реагент с концентрацией 95% – 98% называют «дымящим», а с концентрацией в пределах от 60% до 70% — концентрированной азотной кислотой.
Вещество отличается химической активностью. Взаимодействует с металлами, оксидами, солями, неметаллами, щелочами и многими другими соединениями. Причем некоторые орг. соединения, например, скипидар, амины, уголь, бумага возгораются при контакте с ним. С золотом, танталом, платиной и металлами ее группы не реагирует.
Получение
Азотная кислота производится сотнями миллионов тонн, это один из самых востребованных химикатов в мире. Ее изготавливают из аммиака. Процесс окисления NH3 протекает в несколько этапов и при участии катализаторов. В результате растворения в воде полученной смеси оксидов азота образуется водный раствор искомого продукта.
Концентрированная азотная кислота получается двумя методами:
• проведением последнего этапа синтеза (растворение оксидов в воде) под давлением до 50 атмосфер;
• добавлением в раствор разбавленного реактива серной кислоты и дальнейшей перегонкой (испаряется исключительно HNO3).
Применение в промышленности
 Химически чистая азотная кислота востребована в:
Химически чистая азотная кислота востребована в:
• фармацевтике;
• химпроме для получения орг. нитросоединений, различных хим. реактивов, полимеров, синтетических волокон;
• лакокрасочной индустрии;
• производстве водорастворимых и легкоусваиваемых растениями удобрений;
• военном деле;
• ракетной области, как окислитель для топлива;
• ювелирном и банковском деле для определения качества золота.
Техника безопасности
Азотная кислота и ее пары токсичны, относятся к веществам III категории опасности для человека. Капли жидкости вызывают на коже болезненные химические ожоги, язвы; пары раздражают и разрушают слизистые органов дыхания, разрушают зубы и роговицу глаз.
При работе с реактивом следует использовать средства защиты: респираторы, защитные очки, спецодежду и спецобувь, перчатки. Рабочая зона должна располагаться в помещении со встроенной системой вентиляции. Необходимо постоянно мониторить состав воздуха на предмет превышения в нем содержания паров.
В лабораториях все работы следует проводить в вытяжном шкафу.
Условия хранения
Пары азотной кислоты коррозионноопасны почти для всех веществ. Капли разрушают органику (бумагу, ткани, кожу), резину, пары ядовиты. Поэтому реагент хранят в герметичных непрозрачных емкостях из:
• кварцевого стекла,
• алюминия или алюминиевого сплава;
• нержавеющей стали особых марок;
• фторопласта-4;
• непластифицированного ПВХ;
• поливинилиденфторида (PVDF);
• этиленхлортрифторэтилена (ECTFE).
Большие объемы хранят в резервуарах-хранилищах, изготовленных из кислотоустойчивых материалов, как правило с внутренним стойким покрытием. Стеклянные бутыли или канистры закрывают притертыми стеклянными, тефлоновыми или полиэтиленовыми пробками (резиновые прокладки и уплотнения быстро теряют эластичность и герметизирующие свойства).
Вещество с концентрацией ниже 50% можно хранить в емкостях из хромистой нержавеющей стали.
Склады для хранения оснащаются системой термоконтроля, t не должна превышать +40 °С. Помещение должно быть крытым, темным, отдельным, в нем нельзя хранить органические вещества и пожароопасные реактивы.
Как приобрести
Заказать реактив проще всего на странице  товара на сайте pcgroup.ru. Кроме этого предусмотрены следующие варианты:
товара на сайте pcgroup.ru. Кроме этого предусмотрены следующие варианты:
• заказ обратного звонка;
• по телефонам в шапке сайта;
• через мессенджеры WhatsApp и Telegram +7(929) 635 82 73;
• по электронной почте info@pcgroup.ru.
В магазине «ПраймКемикалсГрупп» продается азотная кислота разной степени очистки и в разных концентрациях. Организована доставка в регионы страны. Для жителей Москвы и Подмосковья доступен самовывоз со склада в г. Мытищи.
Азотная кислота является одной из самых узнаваемых кислот. Это вещество имеет широкий спектр применения, интересные химические свойства и, самое главное, обладает высокой коррозионной активностью. Рассказываем, как производится это вещество и какие опасности могут быть связаны с его использованием.Читать далее →
Содержание:
- Определение
- Химические и физические свойства азотной кислоты
- Производство
- Применение
- Опасность для здоровья
- Хранение
Азотная кислота является одной из самых узнаваемых кислот. Это вещество имеет широкий спектр применения, интересные химические свойства и, самое главное, обладает высокой коррозионной активностью. Рассказываем, как производится это вещество и какие опасности могут быть связаны с его использованием.
Определение
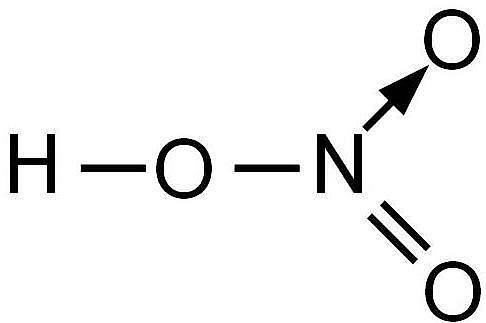
Азотная кислота (лат. acidum nitricum) с химической формулой HNO3 — неорганическое химическое соединение, относящееся к сильнейшим известным оксикислотам. Имеет кислотный остаток в виде нитратной группы, содержащей азот в пятой степени окисления. В концентрированном виде обладает сильным коррозионным действием.
Это интересно! В результате смешивания азотной кислоты с соляной в соотношении 1:3 образуется так называемый царская водка, способная растворять даже драгоценные металлы (даже золото).
В коммерческом применении азотная кислота применяется в виде водного раствора (также отсутствует дымящий эффект, возникающий при концентрации выше 86%).
Химические и физические свойства азотной кислоты
Чистая азотная кислота представляет собой бесцветную жидкость, хорошо растворимую в воде. Имеет резкий и удушающий запах. На открытом воздухе можно заметить легкий коричневый дым, вызванный оксидом азота (IV), который очень ядовит. Поэтому даже кратковременное вдыхание паров азотной кислоты может вызвать раздражение органов дыхания, слезотечение или кашель. Азотная кислота при длительном хранении подвергается частичному разложению и приобретает желтую или коричневую окраску. Такое окрашивание происходит из-за разложения азотной кислоты на оксиды азота и воды. Этот процесс протекает быстрее при наличии света и повышенной температуры.
Концентрированный раствор азотной кислоты химически очень активен. С некоторыми веществами он может реагировать очень бурно. Благодаря вышеперечисленным свойствам он может воспламенять легковоспламеняющиеся материалы. При растворении в воде выделяется большое количество тепла (экзотермическая реакция).
Как сама азотная кислота, так и ее соли обладают сильным окислительным действием. Это заставляет его бурно реагировать с металлами, не вытесняющими водород (медь, серебро). Эта кислота способна растворять даже некоторые неметаллы. Алюминий, хром и железо пассивируются при контакте с концентрированной азотной кислотой.
|
Формула азотной кислоты |
HNO3 |
|
Молярная масса |
63,01 г/моль |
|
Вид |
Прозрачная бесцветная жидкость |
|
Плотность |
1,5129 г/см³ (20 °C) |
|
Кислотность |
−1,4 пК а |
|
Точка кипения |
83 °С |
|
Температура плавления |
−41,6 ° С |
|
Давление газа |
48 мм рт.ст. (20°C) |
Производство
Техническая азотная кислота концентрацией от 52 до 68% производится по методу Оствальда. Вкратце, он заключается в каталитическом окислении аммиака на платиновой или платинородиевой сетке (требуется высокая температура 227°С и высокое давление до 9 атм.). В свою очередь, сам аммиак для целей этого процесса получают путем прямого синтеза водорода и азота (реакция Габера и Боша). Первым образуется оксид азота (II), который окисляется до оксида азота (IV) в присутствии воздуха. Затем полученный таким образом оксид азота подвергают диспропорционированию в воде, в результате чего получают азотную кислоту и азотистую кислоту. Из-за того, что азотистая кислота не обладает высокой стабильностью, происходит ее дальнейшее диспропорционирование.
Водный раствор азотной кислоты окончательно получают перегонкой всего отвара до уровня 68%. Его концентрат можно получить обезвоживанием концентрированной серной кислотой.
Применение

Азотная кислота является важным промежуточным звеном в производстве удобрений и других химических соединений, например, фосфорной кислоты, щавелевой кислоты, коллодия, аминов, красителей или лекарств. Это также сырье для производства взрывчатых веществ, таких как нитроглицерин.
Азотная кислота также используется в:
- производство нитратов, сложных эфиров и нитросоединений (таких как тротил);
- обнаружение белков в ксантопротеиновой реакции (аналитическая химия);
- очистка металлических поверхностей;
- быстрое травление печатных плат;
- производство красителей, лаков, удобрений и пластмасс;
- окисление топлива — в том числе гиперголических ракетных топлив, которые самовозгораются в результате смешения компонентов.
Цены на азотную кислоту обычно колеблются в районе 600 рублей за 1 литр 55-65% водного раствора. Купить азотную кислоту можно в нашем интернет-магазине.
Опасность для здоровья
Как азотная кислота в жидком виде, так и ее пары очень вредны для организма человека. Вдыхание азотной кислоты приводит к отеку и пневмонии. Пролитая на кожу, она вызывает трудно поддающиеся лечению ожоги, которые обычно заканчиваются некрозом. Более обширные ожоги азотной кислотой могут даже привести к коллапсу или шоку и могут представлять серьезную опасность для жизни. Наибольшую опасность вызывает попадание в организм азотной кислоты, что нередко приводит к смерти человека (прожигаются стенки желудка и кишечника).
Хранение
Из-за своих высококоррозийных свойств азотную кислоту следует хранить в соответствующей таре (кислотостойкой) и хранить в хорошо проветриваемых помещениях без доступа света. Следует строго избегать хранения азотной кислоты вблизи легковоспламеняющихся или взрывоопасных материалов.
Азотная кислота HNO3 – это неорганическая одноосновная кислота. Жидкость не имеет цвета и дымится на воздухе. Перемешивается с водой в любых количествах, частично распадается при свете. Азотную кислоту также называют сильной водкой и селитряной кислотой.
Мы предлагаем азотную кислоту купить в Интернет-магазине ЗАО «РЕАКТИВ». Цена азотной кислоты может быть различна в зависимости от типа продукта. На сайте представлены разные виды азотной кислоты и цены:
Азотная кислота 57% 20л (28кг) ГОСТ Р 53789-2010 сорт высший, Азотная кислота осч 18-4,фас 1,2, (кг), Азотная кислота техн 20л, Азотная кислота хч, фас 1,3, Азотная кислота чда 20л (27кг) (А), Азотная кислота чда 20л (27кг) (К), Азотная кислота чда, фас (п/эт 1,3)
Химические характеристики
Азотная кислота относится к сильным кислотам. Валентность азотной кислоты — IV.
Качественные характеристики HNO3:
- азотная кислота целиком растворяется в воде;
- кислота вступает в обменные процессы с амфотерными оксидами и гидроксидами, основаниями;
- HNO3 вытесняет углекислую соль, сульфиды, сульфиты из их солей;
- азотная кислота отчасти распадается под влиянием тепла и света;
- HNO3 активно взаимодействует с металлами, но при этом не выделяет водород;
- взаимодействует с неметаллами.
В природе азотная кислота не встречается, ее изготавливают в лабораторных условиях несколькими способами.
Первый способ — азотная кислота образуется в процессе химической реакции серной кислоты, взаимодействующей с нитратами металлов.
Второй способ — в промышленных масштабах для получения HNO3 используют аммиак. Процесс получения делится на 3 стадии: сначала аммиак окисляют, получая оксид азота II и далее до окиси азота IV, в финале — диоксид азота поглощается водой при избытке кислорода.
Сферы применения азотной кислоты
Области, где применяют HNO3, обширны — это:
- медицина — используется для удаления кожных наростов;
- фармакология — одна из составляющих препаратов для лечения кожи;
- сельское хозяйство — изготовление минеральных удобрений и селитры;
- химическое производство — изготовление взрывчатых веществ, искусственных красителей, пластмассы, искусственных волокон и т.д.;
- металлургия — используется для работы с металлами;
- военная промышленность — используется для производства взрывчатых веществ;
- ракетно-космическая индустрия — кислота входит в состав топлива для военной техники;
- ювелирное производство — используется для определения сплавов драгоценных металлов.
Техника безопасности и правила хранения
При работе с азотной кислотой каждый сотрудник лаборатории или лица, имеющие доступ к этому сильному и токсичному реактиву должны соблюдать технику безопасности, поскольку кислота относится к 3 классу опасности. Обязательное условие — это защита тела, органов дыхания и зрения. В случае несоблюдения правил безопасности, можно получить ожоги, язвы, повреждение органов дыхания и даже отек легких.
Поскольку селитряная кислота разъедает резину и вступает в агрессивную реакцию со многими металлами, то хранить ее лучше в стеклянной или керамической таре. Еще одно главное условие — хранить азотную кислоту нужно в прохладном темном месте.
Азотную кислоту купить в Иркутске, Иркутской области, Владивостоке возможно на предприятии ЗАО «РЕАКТИВ» — крупнейшем поставщике промышленной химии.
Хотите получить индивидуальные цены?
