Кардиостимулятор сердца: когда требуется установка, а когда противопоказана операция по возрасту
Статья о возможности установки кардиостимулятора сердца и ограничениях по возрасту при проведении данной операции. Узнайте, какие показания и противопоказания имеются для установки кардиостимулятора и какие особенности могут сопровождать операцию.
Установка кардиостимулятора сердца – это специальный имплантируемый устройство, которое помогает поддерживать правильный ритм сердечных сокращений. Хотя этот метод лечения является эффективным и безопасным, некоторые возрастные ограничения и противопоказания могут возникнуть.
В первую очередь, кардиостимуляторы поставляются только больным старше 18 лет и необходимым для поддержания жизни пациентам. Однако, возраст сам по себе не является противопоказанием для установки кардиостимулятора.
С другой стороны, существуют некоторые возрастно-связанные заболевания, которые также могут ограничить установку кардиостимулятора. Возрастные изменения в сердечной мышце и артериях могут привести к обструкции проводимой системы в сердце, что может увеличить риск развития инфекционных заболеваний.
Кроме того, многие пациенты старшего возраста могут иметь и другие заболевания, такие как диабет, которые могут осложнить установку кардиостимулятора. В этих случаях, необходимо тщательно оценить и преодолеть все противопоказания, чтобы обеспечить безопасную и эффективную установку кардиостимулятора для пациента.
В данной статье мы рассмотрим основные противопоказания к установке кардиостимулятора и как их преодолеть с учетом возраста пациента.
Установка кардиостимулятора сердца
Установка кардиостимулятора сердца – это процедура, в ходе которой в нижнюю полость сердца устанавливается имплантируемый аппарат, способствующий регуляции работы сердца. Данная процедура проводится пациентам, которые страдают от нарушений ритма сердца. Важно понимать, что установка кардиостимулятора сердца имеет определенные противопоказания, особенно по возрасту.
Противопоказания к установке кардиостимулятора сердца связаны, прежде всего, с возрастом пациента. Как правило, данная процедура не проводится у детей младше 2-х лет, а также у людей старше 85 лет. Кроме того, установка кардиостимулятора сердца может быть противопоказана при наличии тяжелой патологии внутренних органов, таких как почки, печень, легкие.
Если у пациента имеются противопоказания к установке кардиостимулятора сердца, необходимо обратиться к квалифицированному кардиологу для выбора альтернативных методов лечения. В случае, если противопоказания можно преодолеть, то процедура установки кардиостимулятора сердца должна проходить с предельной осторожностью и под постоянным контролем узкопрофильного специалиста.
Таким образом, установка кардиостимулятора сердца – это эффективный способ борьбы с нарушениями ритма сердца, который может быть применен при соблюдении определенных медицинских противопоказаний. В любом случае, перед принятием решения о необходимости данной процедуры, необходимо пройти полное обследование и консультацию у специалиста.
Что такое кардиостимулятор сердца?
Кардиостимулятор сердца (КС) – это медицинский инструмент, который используется для контроля сердечного ритма у пациентов с нарушениями сердечного проводимости и ритма. Кардиостимулятор помогает поддерживать нормальное сердечное давление и устраняет сердечные аритмии, что сохраняет здоровье и предотвращает возможные осложнения.
КС работает через импульсы электростимуляции, которые отправляются от устройства через электроды в сердце пациента. Импульсы регулируют ритм сердцебиения и сохраняют его в нормальном диапазоне. Кардиостимулятор сердца может быть установлен как временно, так и постоянно, в зависимости от очага нарушения сердечного ритма.
Кардиостимулятор сердца рассматривается как один из наиболее эффективных методов лечения сердечных заболеваний, а также блокады сердечного ритма и может значительно улучшить качество жизни пациентов, которые страдают от сердечных проблем.
Как работает кардиостимулятор сердца?
Кардиостимулятор сердца — это устройство, которое помогает нормализовать ритм сердца путем генерации электрических импульсов. Основная задача кардиостимулятора — обеспечить постоянную стимуляцию сердца и подавление аритмий.
Кардиостимулятор состоит из генератора импульсов и проводников, которые передают импульсы в сердечную мышцу. Генератор импульсов располагается под кожей, обычно в области грудной клетки. Электроды, которые соединяют генератор и сердце, также имеются под кожей.
Кардиостимуляторы бывают разных типов, например, однокамерные, двухкамерные и многокамерные. Они отличаются по количеству электродов и способу стимуляции сердца.
Когда ритм сердца нарушается, кардиостимулятор начинает генерировать электрические импульсы, которые передаются через электроды в сердечную мышцу. Это помогает нормализовать ритм сердца и избежать возможных осложнений.
Кардиостимуляторы обычно имеют функции диагностики аритмий и программирования частоты стимуляции. Также многие модели имеют функцию синхронизации, когда кардиостимулятор определяет естественный ритм сердца и стимулирует его в соответствии с этим ритмом.
Кардиостимуляторы — это наиболее эффективный способ лечения сердечных аритмий, их установку проводят при условии соблюдения всех противопоказаний и рекомендаций врачей. При правильной установке и настройке кардиостимулятора, возможно значительное улучшение качества жизни у пациентов с сердечными заболеваниями.
Когда назначают установку кардиостимулятора сердца?
Установка кардиостимулятора сердца (КС) может назначаться при наличии серьезных проблем со здоровьем. Он является эффективным соединением между сердцем и мозгом, ускоряет сердечный ритм и поддерживает его в норме.
Установка КС происходит, когда пациенты страдают от сердечных аритмий и сердечной недостаточности. Если другие методы лечения не сработали, то кардиолог может назначить установку КС. Большинство людей, которым был установлен КС, имеют показательную историю сердечных заболеваний, таких как нарушение проводимости, брадикардия, хроническая недостаточность сердца и другие проблемы.
Но принять решение о установке КС не так просто. КС имеет определенные показания, при которых он назначается. Как правило, потенциальными кандидатами на установку КС становятся пациенты, старше 65 лет. Однако старикам бывает сложно переносить ситуации, связанные с операцией и реабилитацией. Именно поэтому кандидатов на установку КС выбирают осторожно, учитывая возраст и уровень жизненной активности.
Если пациент моложе 65 лет, дополнительные проблемы могут вызвать процесс назначения КС. Например, у ребенка сердце еще находится в стадии развития, поэтому установка КС может привести к сильным физическим и эмоциональным стрессам. Поэтому решение установки КС принимается совместно с детским кардиологом, который учитывает все факторы и вносит рекомендации в процесс назначения КС.
Противопоказания для установки кардиостимулятора сердца

Возрастные ограничения
Установка кардиостимулятора сердца не рекомендуется пожилым пациентам старше 85 лет, так как риск осложнений увеличивается с возрастом. Однако, в зависимости от общего состояния здоровья, возможно проведение данной процедуры и при более высоком возрасте.
Ограничения при наличии заболеваний
Установка кардиостимулятора сердца запрещена при наличии определенных заболеваний, таких как онкологические заболевания, тяжелое заболевание легких или почек, аутоиммунные заболевания и другие заболевания, которые могут ухудшить состояние пациента.
Преодоление противопоказаний

Если у пациента есть противопоказания для установки кардиостимулятора сердца, необходимо обсудить вопрос с кардиологом. В некоторых случаях, при проведении дополнительных исследований и лечения, возможно преодоление противопоказаний и проведение данной процедуры.
Важно не заниматься самолечением и не принимать решение об установке кардиостимулятора самостоятельно, так как это может привести к нежелательным последствиям.
Проблемы, связанные с возрастом при установке кардиостимулятора сердца
Возраст является одним из факторов, влияющих на установку кардиостимулятора сердца. С возрастом у человека могут возникать различные заболевания и состояния, которые могут противопоказывать установку кардиостимулятора.
Например, у пожилых людей могут быть проблемы с функцией почек и печени, что может влиять на применение лекарственных препаратов, необходимых для настройки и поддержания работы кардиостимулятора.
Также возраст может влиять на физиологические параметры сердца, такие как скорость сердечных сокращений и выпуск крови. Это может требовать более тщательного подхода при установке кардиостимулятора.
В любом случае, возраст не является абсолютным противопоказанием для установки кардиостимулятора. Однако врач должен учитывать возраст пациента и его физическое состояние при выборе оптимальной стратегии лечения.
Решение возрастных проблем для установки кардиостимулятора сердца
Установка кардиостимулятора сердца (КС) является эффективным методом лечения нарушений сердечного ритма и сердечной недостаточности. Однако, при возрасте пациента могут возникнуть определенные противопоказания.
Один из главных возрастных противопоказаний для установки КС — это превышение определенного возраста. Но это не значит, что установка КС невозможна для пожилых пациентов. Врачи должны оценить общее состояние здоровья и выявить противопоказания для каждого отдельного случая.
Кроме того, позитивный эффект КС у пациентов пожилого возраста может быть нестоль выражен по сравнению с молодыми пациентами, тем не менее, установка КС может значительно улучшить качество жизни пациента.
Для преодоления возрастных проблем при установке КС, врачи должны учитывать не только возраст пациента, но и здоровье его сердечно-сосудистой системы, сопутствующие заболевания и другие факторы. Таким образом, пациенты пожилого возраста могут быть подходящими кандидатами для установки КС, если их общие результаты оценки показывают, что процедура не будет иметь отрицательного эффекта на здоровье пациента.
Как проходит операция установки кардиостимулятора сердца?
Подготовка к операции

До операции установки кардиостимулятора сердца врачи проводят ряд обследований, которые позволяют определить показания к проведению операции. Важно знать, что перед операцией необходимо соблюдать ряд рекомендаций, включая отказ от пищи и жидкости в определенное время, а также соблюдение гигиенических требований.
Операция установки кардиостимулятора сердца

Операция установки кардиостимулятора сердца происходит под местной анестезией. Врач делает небольшое разрезание на грудной клетке и вводит электроды через вены в сердце. Затем кардиостимулятор устанавливается под кожу над грудиной и соединяется с электродами.
Послеоперационный период
После операции пациенту рекомендуется оставаться в стационаре на несколько дней для наблюдения за состоянием здоровья. Важно знать, что в первое время после установки кардиостимулятора могут быть некоторые ощущения дискомфорта и боли в месте операции. Поэтому необходимо соблюдать рекомендации врача относительно режима дня, физических нагрузок и ухода за местом операции.
Вывод
Установка кардиостимулятора сердца – это серьезная операция, которая помогает людям, страдающим нарушениями сердечного ритма, справиться с этой проблемой. Как и все медицинские процедуры, она имеет свои риски и противопоказания. Поэтому важно обсуждать с пациентом все возможности и риски, связанные с установкой кардиостимулятора, и принимать решение о проведении этой операции только после тщательного анализа его состояния и причин, по которым кардиостимулятор нужен.
Жизнь после установки кардиостимулятора сердца
Установка кардиостимулятора сердца помогает людям с сердечными проблемами продолжать вести активную жизнь. После операции пациенты часто возвращаются к привычным занятиям и радуются возможности полноценного функционирования органа.
Однако, необходимо учитывать, что жизнь после установки кардиостимулятора требует определенных ограничений. Пациентам не рекомендуется подвергаться воздействию магнитных полей, а также поддерживать близкий контакт с мощными источниками электромагнитного излучения.
Несмотря на это, многие пациенты после установки кардиостимулятора продолжают заниматься спортом, путешествовать и работать, при необходимости поддерживая контакт с врачом и соблюдая рекомендации по режиму дня и тяжелых физических нагрузках.
В целом, жизнь после установки кардиостимулятора сердца может быть несколько более ограниченной, но при правильной заботе о здоровье и соблюдении предписаний врачей, пациенты могут наслаждаться активной и насыщенной жизнью в полной мере.
- Необходимость периодической проверки и обследования. После установки кардиостимулятора пациентам необходимо регулярно проходить обследования и контрольную проверку у врача. Это поможет своевременно выявить возможные проблемы и внести корректировки в режим устройства.
- Избегать сильных магнитных полей. Людям с кардиостимуляторами не рекомендуется находиться вблизи мощных магнитных полей, таких как микроволновые печи, магниты и т.д.
- Соблюдение режима дня и правильное питание. Как правило, врачи рекомендуют пациентам с кардиостимуляторами следить за режимом дня, уделять время физическим упражнениям и правильно питаться, чтобы поддерживать здоровье сердца и укреплять организм в целом.
Влияние возраста на длительность жизни после установки кардиостимулятора сердца

Установка кардиостимулятора сердца является эффективным методом лечения сердечных заболеваний. Однако, длительность жизни после его установки может зависеть от возраста пациента.
По данным исследований, у пожилых людей, старше 80-ти лет, риск смерти после установки кардиостимулятора сердца выше, чем у более молодых пациентов. Однако, даже в этой возрастной группе кардиостимулятор может повысить качество жизни за счет улучшения сердечной функции и предотвращения блуждания сердечного ритма.
Для пожилых пациентов существует некоторый риск осложнений после установки кардиостимулятора, так как процедура может потребовать общей анестезии и непосредственного воздействия на сердце. Однако, современные технологии и методы позволяют минимизировать риски и достичь положительных результатов.
В целом, возраст не является противопоказанием к установке кардиостимулятора сердца. Каждый случай индивидуален и требует тщательного анализа и оценки рисков и пользы.
Практика преодоления возрастных противопоказаний при установке кардиостимулятора сердца
Когда возраст становится противопоказанием для установки кардиостимулятора сердца, врачи прибегают к различным креативным решениям.
Одним из способов преодоления возрастных противопоказаний является установка маленького кардиостимулятора, который может быть укреплен непосредственно на сердце без необходимости проводить множественные операции.
Еще одним методом является использование беспроводных кардиостимуляторов, которые позволяют избежать необходимости удалять их из тела в будущем.
Даже при наличии возрастных противопоказаний, пациенты могут быть кандидатами на установку кардиостимулятора если они в целом здоровы и способны выдержать операцию. Врачи могут также рассмотреть индивидуальные факторы риска пациента и принять решение в пользу установки кардиостимулятора в случае необходимости.
- Таким образом, возраст не является абсолютной противопоказанием для установки кардиостимулятора сердца.
- Врачи выбирают наиболее оптимальный метод установки с учетом возраста пациента и его общего состояния.
- Пациенты могут быть кандидатами на установку кардиостимулятора даже при наличии возрастных противопоказаний, если их общее состояние позволяет.
Советы для повседневной жизни для лучшей работы кардиостимулятора сердца

1. При контактах с электроникой
Избегайте непосредственного контакта с магнитными полами, которые могут нарушить работу кардиостимулятора сердца, такие как магниты на холодильнике, смартфоны и ноутбуки. В случае нахождения в близком радиусе от таких источников, держите устройства на расстоянии от кардиостимулятора не менее 15-20 см.
2. При физических нагрузках
Возможно, ваш кардиостимулятор сердца будет периодически срабатывать во время физических нагрузок, например, при подъеме по лестнице или занятиях спортом. Чтобы избежать этого, не забывайте принимать рекомендуемые лекарства и следить за своей физической активностью.
3. При поездках
Если вы планируете долгую поездку, не забудьте взять с собой ваше медицинское удостоверение и объясните летного персоналу или проводникам, что у вас стоит кардиостимулятор сердца. Это поможет избежать недопонимания и предотвратить некоторые проблемы.
4. Регулярный контроль
Рекомендуется регулярно проходить медицинские обследования врачом-кардиологом для контроля работы кардиостимулятора сердца и индивидуальной настройки его параметров. Не забывайте записывать все симптомы и изменения в своей жизни, чтобы дать максимально полную информацию врачу на приеме.
Осложнения после установки кардиостимулятора сердца
Установка кардиостимулятора является эффективной мерой лечения сердечных ритмических нарушений. Однако, как и любая медицинская процедура, она может иметь некоторые осложнения.
Одним из наиболее распространенных осложнений является инфекция. Это может произойти как во время процедуры, так и после нее. Установка кардиостимулятора нарушает целостность кожи, что может привести к попаданию инфекции.
Проводники кардиостимулятора могут переломаться или переместиться. Это может произойти вследствие физической активности, травмы или роста мягких тканей тела.
Небольшой процент пациентов может испытывать болевые ощущения в области установки кардиостимулятора. Это может быть вызвано раздражением нервных окончаний в области имплантации.
Редким осложнением является пневмоторакс. Это происходит, когда при внедрении кардиостимулятора в легкое попадает воздух.
- Перед установкой кардиостимулятора, пациент должен обговорить с врачом всех возможных осложнениях и рисках;
- Использование профилактических антибиотиков перед и после процедуры может снизить риск инфекции;
- Частая проверка кардиостимулятора и проводников может выявить любые проблемы в самом начале и помочь предотвратить их развитие.
Как избежать осложнений после установки кардиостимулятора сердца?

Кардиостимулятор сердца — это серьезное медицинское оборудование, которое способно улучшить качество жизни, но также может вызывать осложнения.
В первую неделю после установки кардиостимулятора сердца рекомендуется избегать физических нагрузок и поднимать тяжести не более 2-3 кг. В следующие несколько недель после операции следует избегать воздействия магнитных полей, таких как магниты, телефоны, динамики, компьютеры и т.д.
Также необходимо следить за инфекционной безопасностью. Каждый третий пациент, которому устанавливают кардиостимулятор сердца, сталкивается с осложнением в виде заражения. Поэтому важно точно следить за гигиеной рук, не посещать людных мест и контролировать рубашки, чтобы не допустить заражения шва, где была установлена аппаратура.
Отмена лекарств — еще одна важная рекомендация, чтобы избежать осложнений после установки кардиостимулятора сердца. Седативные снотворные препараты, антидепрессанты могут нарушить работу кардиостимулятора и привести к серьезным последствиям. Важно обсудить этот вопрос с врачом и получить рекомендации, какие препараты можно принимать, а какие следует исключить из списка лекарств.
Если наблюдаются какие-либо изменения в здоровье, необходимо немедленно связаться с врачом и сообщить о происходящем. Иногда может потребоваться дополнительная настройка аппарата или его замена для избежания осложнений.
Видео по теме:
Вопрос-ответ:
Каковы возрастные ограничения для установки кардиостимулятора?
Возрастные ограничения для установки кардиостимулятора изменяются в зависимости от состояния пациента. Обычно эту процедуру не проводят у детей младше 12 лет. Если возраст пациента более 80 лет, то принимается во внимание его общее состояние и наличие хронических заболеваний.
Какие противопоказания могут возникнуть при установке кардиостимулятора?
Противопоказания могут быть как временными, так и постоянными. Временные противопоказания могут включать в себя инфекционные заболевания, аллергические реакции на лекарства, а также принятие антикоагулянтов. Постоянные противопоказания включают тяжелое нарушение функции легких и почек, а также онкологические заболевания.
Какие альтернативы можно использовать, если установка кардиостимулятора противопоказана?
Если установка кардиостимулятора противопоказана, то как альтернативы можно рассмотреть имплантацию дефибриллятора или бивентрикулярного кардиостимулятора, которые выполняют похожие функции. Некоторые пациенты могут также улучшить свое состояние с помощью изменения образа жизни включая более активную физическую деятельность и соблюдение здорового рациона.
Как можно преодолеть возрастные ограничения и установить кардиостимулятор?
Преодолеть возрастные ограничения для установки кардиостимулятора можно с помощью комплексного медицинского обследования и оценки риска. Если риск серьезных осложнений у старшего пациента минимальный, то врачи могут принять решение об установке кардиостимулятора и сопутствующих процедурах.
Какие меры должен предпринимать пациент после установки кардиостимулятора?
Пациент должен соблюдать все рекомендации врача после установки кардиостимулятора, включая меры по укреплению сердечной мышцы с помощью здорового образа жизни, регулярных мероприятий физической реабилитации и поддержания регулярных консультаций с кардиологом. Кроме того, он должен следить за работой кардиостимулятора и своим самочувствием и реагировать на любые изменения в своем здоровье.
Как снизить риск осложнений после установки кардиостимулятора сердца?

Установка кардиостимулятора сердца может вызвать различные осложнения, в том числе инфекции, кровоизлияния и разрывы сердечной мышцы. Однако соблюдение некоторых мер предосторожности может помочь снизить риск возникновения осложнений.
1. Следуйте рекомендациям врача
Врач, который установил кардиостимулятор сердца, должен дать вам подробные рекомендации по уходу за ним и принимаемым лекарствам. Следуйте этим рекомендациям и обратитесь к врачу в случае возникновения каких-либо проблем.
2. Избегайте излишней физической нагрузки

Людям, которым был установлен кардиостимулятор сердца, не рекомендуется заниматься сильными физическими упражнениями, особенно в первые несколько недель после установки. Также стоит избегать перегрузок и длительных прогулок.
3. Избегайте электромагнитных полей
Избегайте контакта с электромагнитными полями, такими как сильные магниты, микроволновые печи и высоковольтные линии, которые могут повлиять на работу кардиостимулятора сердца. Также следует избегать использования мобильного телефона, держа его на расстоянии от кардиостимулятора сердца.
4. Регулярно проходите обследование
Регулярные обследования врача позволяют рано выявлять проблемы с кардиостимулятором сердца и принимать меры для предотвращения осложнений. Следуйте рекомендациям врача и проходите обследование вовремя.
5. Устраните источники стресса

Стресс может повлиять на работу кардиостимулятора сердца. Старайтесь избегать сильных эмоций и не подвергайтесь эмоциональным перегрузкам, особенно в первые недели после установки кардиостимулятора.
Следуя этим рекомендациям, вы сможете снизить риск возникновения осложнений после установки кардиостимулятора сердца и обеспечить правильную работу устройства.
Рекомендации по уходу за кардиостимулятором сердца
Период после установки устройства
В первые несколько дней после установки кардиостимулятора сердца обязательно соблюдайте все предписания врача. Избегайте тяжелых физических нагрузок, не поднимайте руки выше плечей, не надеживайтесь на сторону, где находится устройство. Избегайте областей, где могут подвергнуться механическим воздействиям. Не следует посещать баню, сауну и бассейн в первую неделю после установки устройства.
Рядовой уход за кардиостимулятором сердца
Периодически проверяйте состояние кожи в месте установки устройства, принимайте ванны или душ только если у вас нет никаких проблем с кожей в этой области. Носите свой медицинский браслет в круглосуточном режиме — в случае необходимости это позволит быстро предоставить врачам всю нужную информацию. При зарядке батареи кардиостимулятора следует избегать мест, где находятся генераторы мощного электрического поля сильного магнитного поля, автозарядники, электрические шкафы и тому подобное.
Профилактика инфицирования
При уходе за кардиостимулятором сердца требуется соблюдать обязательные профилактические меры перед контактом с устройством, чтобы предотвратить возможные инфицирования. Руки необходимо мыть перед заглядыванием в подкожную ткань устройства для проверки его функционирования. При сильной грязи или загрязненной зоне установки устройства обязательно следует применять антисептики для очистки участка. Если признаки практических проявлений каких-либо осложнений появляются, следует стать на контроль врача.
Следуя этим простым рекомендациям вы сможете защитить свое здоровье и продлить срок службы кардиостимулятора сердца.
Содержание:
- Перед операцией
- Ранний послеоперационный период. Нахождение в клинике
- Период восстановления. Первые 2 недели
- Месяц после имплантации
- Ограничения
- Когда стоит обратиться к врачу
1. Перед операцией
Ваш врач определил показания к установке Вам ПЭКС, назначил дату операции. Вам необходимо подготовиться к операции, выполнив рекомендуемое врачом предоперационное обследование, список будет выдан Вам на приеме у врача.
Перед назначенной датой госпитализации с Вами свяжется администратор Клиники и сообщит Вам время, к которому необходимо прибыть в клинику. Накануне перед операцией необходимо отменить прием следующих препаратов:
- Ксарелто, Эликвис за 1 сутки до даты госпитализации
- Прадакса за 2 суток до даты госпитализации
- Варфарин – за 3 суток до даты госпитализации, за 1 сутки необходимо проконтролировать МНО (операцию можно проводить, если МНО менее 2,0). Если у Вас протезированы клапаны сердца, о сроках отмены Варфарина необходимо проконсультироваться с лечащим врачом.
В день госпитализации не принимайте пищу, можно пить негазированную минеральную воду, принимайте только препараты от давления. Накануне вечером прием пищи и препаратов разрешен.
В Клинике Вас разместят в палате, необходимо переодеться в удобную одежду, ждать врача. Врач-кардиолог совместно с анестезиологом-реаниматологом проведет предоперационный осмотр, расскажет о ходе операции. Операция выполняется врачом хирургом-аритмологом в рентген-операционной с применением местного обезболивания, без общего наркоза. Во время операции хирург расскажет о выполняемых им действиях.
Примерно за 1,5-1 час до операции Вам введут антибиотик для профилактики инфекции. Если у Вас имеется непереносимость/аллергия необходимо сообщить об этом врачу.
2. Ранний послеоперационный период. Нахождение в клинике
Сразу после операции врач-аритмолог выполнит первичное программирование Вашего устройства, задаст необходимы параметры стимуляции и впишет их в протокол операции/программирования, который будет выдан Вам при выписке.
После операции Вы будете находиться под наблюдением врача в стационаре в течение суток при отсутствии осложнений. В первые 12 часов необходим строгий постельный режим в положении лежа на спине. Это необходимо для лучшего закрепления электродов кардиостимулятора в полостях сердца. В первые 2 часа после операции для уменьшения отека в области раны Вам будет наложен холодный компресс на место раны. Через полчаса после операции можно принимать пищу.
Некоторое время после имплантации кардиостимулятора Вы можете ощущать незначительные неудобства и болезненные ощущения в месте установки прибора. Если Вы испытываете боль, обратитесь к медицинскому персоналу и Вам будет предложено обезболивание.
Также на месте введения прибора может образовываться гематома, у некоторых пациентов возможно повышение температуры тела. Обратитесь к врачу и Вам будут даны дальнейшие рекомендации.
На 2-е сутки после операции выполняется проверка местоположения электродов электрокардиостимулятора. Для этого Вас проводят в рентген-операционную или в кабинет рентгена/КТ и выполнят кратковременное рентген-исследование. Если будет выявлено смещение электродов, то врач хирург-аритмолог выполнит в этот же день повторную операцию и проведет репозицию (поправит) электроды. Данная процедура требуется крайне редко.
Перед выпиской из стационара Вам выполнят перевязку послеоперационной раны. Как правило во время операции накладываются саморассасывающиеся швы и дополнительного снятия швов не требуется. Однако, если дополнительно будут наложены швы, которые потребуется удалить, врач сообщит Вам об этом и укажет необходимый срок снятия швов.
При выписке Вам будет выдана временная карточка-паспорт электрокардиостимулятора, которую необходимо всегда иметь при себе для предъявления в пунктах досмотра в аэропортах, вокзалах, в метро. Средства контроля в аэропортах, магазинах, метро («рамки») испортить стимулятор не могут, однако желательно сократить пребывание в этих зонах до минимума для исключения длительного контакта с магнитным полем.
Постоянный паспорт (пластиковая карта) кардиостимулятора будет выслан Вам «Почтой России» в течение 1-2 месяцев после операции.
3. Период восстановления. Первые 2 недели
После имплантации постоянного электрокардиостимулятора Вы можете вести привычный образ жизни! После выписки из стационара на 3 сутки необходимо самостоятельно сменить повязку в области раны и оставить ее еще на 2 суток. Затем при отсутствии других указаний со стороны врача, можно повязку снять, дальнейших перевязок не требуется.
Мыться под душем обычно можно уже на 2 сутки после операции, максимально избегая намокания послеоперационной повязки. На 4-5 сутки шов можно мочить, но не тереть мочалкой!
В течение первых 2 недель обычно трудоспособность восстанавливается полностью. Если Ваша работа не связана с подъемом тяжестей и тяжелым физическим трудом, то к работе можно возвращаться через 1-2 недели после операции.
Крайне не рекомендуется ношение тяжестей в руке со стороны имплантации, подъем руки со стороны имплантации выше горизонтальной плоскости (т.е. руку в плече не поднимать высоко). Движения в локтевом суставе не ограничены.
Вождение транспорта возможно без ограничений через 1-2 недели после операции. Однако необходимо соблюдать правила безопасности и не касаться высоковольтных проводов или проводов электрической системы автомобиля.
Передвижения на дальние расстояния, перелеты не ограничены. При прохождении рамок в аэропортах и вокзалах необходимо предоставить удостоверение (паспорт кардиостимулятора). Рамки испортить электрокардиостимулятор не могут!
4. Месяц после имплантации
Чаще всего через 1 месяц полностью восстанавливается трудоспособность и минимизируются ограничения по движению рукой со стороны имплантации. Однако в течение 3 месяцев рекомендуется ограничить резкие подъемы руки выше горизонтальной линии и резкие отведения руки в сторону.
Первый визит к врачу для проверки работы ЭКС назначается через 1 месяц. Врач-аритмолог приложит к области стимулятора специальное устройство-программатор и при необходимости поправит настройки электрокардиостимулятора.
5. Ограничения
Пациенты с электрокардиостимулятором могут заниматься спортом. Однако, есть виды спорта, которых стоит избегать:
- Контактные виды спорта (футбол, бокс, рэгби, каратэ, борьба), когда имеется угроза удара в область имплантированного кардиостимулятора и повреждения тканей над устройством.
- Стрельба из ружья или винтовки при угрозе возникновения отдачи во время выстрела и повреждения тканей над кардиостимулятором при направлении приклада ружья в область плеча, где имплантирован аппарат.
- Поднятие штанги, жим лежа, ввиду возникновения опасности давления в область имплантированного кардиостимулятора.
- Подводное плавание, ныряние на глубину, дайвинг. От данных видов спорта также стоит воздержаться ввиду оказываемого давления на область ЭКС толщей воды. Обычным плаванием заниматься разрешается в полном объеме через 2-3 месяца после операции.
- Пребывание в бане, сауне, инфракрасной бане разрешено, если нет других противопоказаний со стороны сердечно-сосудистых заболеваний.
- Работа по дому и на участке разрешена в том числе с использованием инструмента/электроинструмента, при условии его исправности. Использование микроволновых печей, индукционных плит разрешено. Необходимо ограничить использование дрелей, перфораторов, газонокосилок, отбойных молотков и других приборов, обладающих вибрационными свойствами.
- Передвижения не ограничены! Средства контроля в аэропортах, магазинах, метро («рамки») испортить стимулятор не могут, однако желательно сократить пребывание в этих зонах до минимума для исключения длительного контакта с магнитным полем.
- Использование мобильных устройств разрешено. Рекомендуется держать мобильный телефон у уха, противоположного стороне имплантации или на расстоянии около 30 см от стимулятора. Ношение мобильного устройства на груди крайне нежелательно.
- Запрещается использовать большую часть методов физиотерапевтического лечения на область стимулятора или рядом с ним (менее 20 см от места имплантации). При назначении врачом физиотерапевтических методов лечения, связанных с патологией коленных суставов, поясничного отдела позвоночника следует проконсультироваться с врачом о возможности использования данного метода лечения.
- Запрещается работать в области мощного магнитного излучения и электромагнитных полей.
- Не рекомендуется направление УЗ-луча при проведении УЗИ непосредственно на область кардиостимулятора.
- При хирургических вмешательствах необходимо использование биполярной электрокоагуляции.
- Электрокардиостимуляторы, имплантируемые в КардиоКлинике позволяют выполнять МРТ-исследования при необходимости. Имеются ограничения в зависимости от типа электрокардиостимулятора для выполнения МРТ на 3,0 Тесла томографе, разрешено при имплантации устройств с пометкой MRI. Использование 1,5 Тесла томографов не ограничено. При необходимости выполнения МРТ-исследования необходимо сообщить врачу об имеющемся ЭКС, непосредственно перед исследованием может понадобиться кратковременное перепрограммирование параметров устройства врачом-аритмологом.
6. Когда стоит обратиться к врачу
В течение первого года плановые визы к врачу-аритмологу для программирования устройства проводятся через 1,6, 12 месяцев после операции, далее чаще всего рекомендовано ежегодное прохождение проверок ЭКС.
Внеплановый визит к врачу должен состояться при появлении следующих жалоб:
- снижения частоты пульса менее заданного нижнего порога (чаще всего данный порог составляет 50-60 ударов в минуту), данный параметр необходимо уточнить у врача-аритмолога;
- появлении головокружений, обмороков;
- появлении симптомов воспаления: отек, покраснение, боль в области имплантации, появление гнойного отделяемого из раны, повышение температуры тела, не связанное с переносимым ОРВИ или заболевании другой локализации.
Важно! Ощущения сердцебиения при имплантированном ПЭКС беспокоить могут, это нормально, т.к. современные стимуляторы наделены функцией частотной адаптации, т.е. способностью увеличивать частоту пульса при стрессе, физической нагрузке, эмоциях (как и происходит с сердцем в норме). Однако, если Вас беспокоят эпизоды сердцебиений с высокой частотой пульса вне связи с вышеописанными состояниями, это повод обратиться к врачу, стимулятор способен записывать в своей памяти эпизоды различных аритмий, что может помочь врач в диагностике сердцебиений.
Срок службы современных ЭКС составляет в среднем 7-8 лет с момента имплантации. О подходящем истечении срока службы батареи кардиостимулятора Вам сообщит врач-аритмолог при программировании устройства и назначит Вам дату госпитализации для замены батареи ЭКС. При проведении замены кардиостимулятора электроды из организма не извлекаются, выполняется только смена батареи (самого устройства) в месте, где ранее была выполнена имплантация.
Записаться на прием
Оставьте нам свои контакты, и мы обязательно Вам перезвоним.

Асатурова Екатерина
Игоревна
Заведующая кардиологическим отделением стационара, врач-кардиолог, врач функциональной диагностики
Стаж работы : c 2015 года
Подробнее
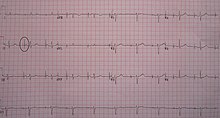
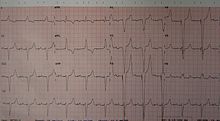
Кардиостимулятор – это медицинский прибор, который поддерживает ритм сердца в нормальном режиме. Операция по установке кардиостимулятора показана тем, у кого наблюдается слишком медленный ритм сердца или присутствует блокада между предсердиями и желудочками (антриовентикулярная блокада).
Операция по имплантации кардиостимулятора является малоинвазивной и может выполняться в условиях операционной, оснащенной рентгеновским аппаратом для мониторинга всех действий кардиохирурга. Для обезболивания применяется местная анестезия.
1. Врач пунктирует подключичную вену и закрепляет в ней интродьюсер, через который продвигает в просвет верхней полой вены электрод.
2. Далее под контролем рентгеноборудования электрод продвигается в правое предсердие или правый желудочек и закрепляется на стенке сердечной камеры. Если имплантируемый кардиостимулятор двух- или трехкамерный, то таким же образом выполняется и имплантация других электродов.
3. После фиксации электродов врач выполняет несколько проб для измерения порога возбудимости, на которые сердце отвечает сокращениями.
4. После получения хорошего графика ЭКГ, полученного с установленных электродов прибора, электроды фиксируются окончательно, и под кожей в подключичной области или под грудной мышцей выполняется «карман» для имплантации корпуса кардиостимулятора.
5. После введения прибора в «карман» и подключения к нему электродов ткани зашиваются.
В общей сложности такая методика операции по имплантации кардиостимулятора занимает не более одного часа.
Некоторое время после имплантации кардиостимулятора пациент может ощущать незначительное неудобство и болезненные ощущения в месте установки прибора. Также на месте введения прибора может образовываться гематома. У некоторых больных возможно повышение температуры тела. Все эти неприятные ощущения устраняются или самостоятельно, или при помощи симптоматической терапии. Как правило, больным после имплантации кардиостимулятора назначается профилактический курс приема антибиотиков. Уже в первый же день после операции большинство больных могут вставать с постели, а через неделю – возвращаются к привычному ритму жизни. Приступать к работе разрешается через 2 недели.
После установки кардиостимулятора больной в целом может вести привычный образ жизни. Большинство разнообразных приборов, оборудования и устройств, окружающих нас дома или на рабочем месте, не влияет на работу кардиостимулятора и может использоваться с минимальными мерами предосторожности или без них. Современные кардиостимуляторы достаточно хорошо защищены от внешних магнитных, электрических и электромагнитных воздействий, встречающихся в повседневной жизни.
Ограничений по питанию у пациентов с кардиостимуляторами нет. Необходимо следовать рекомендациям врача исходя из состояния здоровья и возможной диеты. Вождение транспорта также возможно без ограничений. Однако, необходимо соблюдать правила безопасности и не касаться высоковольтных проводов или проводов электрической системы автомобиля.
В первые три месяца после имплантации желательно ограничить движения рукой со стороны имплантации, избегая резких подъемов выше горизонтальной линии и резких отведений в сторону.
Пациенты с кардиостимуляторами могут заниматься любыми видами спорта, если нет ограничений по состоянию здоровья. Однако есть виды спорта, которых необходимо избегать:
• Контактные виды спорта (такие, как каратэ или футбол). При этих видах спорта есть угроза вызвать удар по области имплантированного кардиостимулятора. Удар, как правило, не может причинить вреда Вашему устройству, но может повредить ткани над кардиостимулятором.
• Стрельба из ружья или винтовки. Не стоит прикладывать приклад ружья в область плеча, где имплантирован кардиостимулятор. Отдача выстрела может привести к травме поверхностных тканей над кардиостимулятором.
• От подводного плавания, ныряния на любую глубину, дайвинга также желательно воздержаться. Разрешается заниматься обычным плаванием.
В любом случае, во время занятий физическими упражнениями необходимо ориентироваться на собственное самочувствие, и прекращать занятия сразу же, как возникнут тревожные симптомы или усталость.
Имплантируемый кардиостимулятор, как правило, не мешает обычной трудовой деятельности пациента. Можно работать по дому или на участке, использовать инструмент, в том числе электроинструмент, при условии его исправности (чтобы не было поражения электрическим током). Следует ограничить применение перфораторов и электродрелей, а также газонокосилок.
Существуют некоторые ограничения по использованию кардиостимуляторов и сотовых телефонов. Рекомендуется располагать телефон на расстоянии не менее 30 см от стимулятора и держать его у уха, противоположного стороне, на которой находится кардиостимулятор. На себе носить сотовый телефон не рекомендуется.
Кардиостимулятор не ограничивает человека в передвижении, и возможно планировать свои поездки на длительный период времени. Средства контроля в магазинах и аэропортах («рамки») испортить стимулятор не могут, однако желательно сократить пребывание в зоне их действия до минимума, так как магнитное поле оказывает влияние только непосредственно в момент прохода через «рамку». Необходимо будет предъявить свое удостоверение (карта пациента) на контрольно-пропускных пунктах в аэропортах, вокзалах, чтобы при необходимости выполнили ручной досмотр.
Однако во избежание сбоев в работе прибора следует соблюдать некоторые важные правила:
- запрещается выполнять магнитно-резонансную томографию (МРТ)
- запрещается использовать бо́льшую часть методов физиотерапии (прогревания, магнитотерапию и т. д.)
- необходимо избегать контакта с сильными электромагнитными источниками: линиями высоковольтных передач, телевизионными вышками, ретрансляторами.
Проверка ЭКС
Первая проверка проводится через 1,5-3 месяца после операции. За это время формируется хронический порог стимуляции, то есть становится возможной окончательная регулировка энергетических параметров стимуляции и можно проводить коррекцию параметров частотной адаптации. В течение первого года желательно провести проверки через 6 и 12 месяцев после операции. Это позволит убедиться в правильности подбора параметров стимуляции и лечебных функций. Далее, при отсутствии жалоб, больной может проходить контрольные осмотры один или два раза в год.
По мере приближения к окончанию срока службы аппарата (7-8 лет), который определен временем разрядки батареи, интервалы между проверками должны укорачиваться, особенно в тех случаях, когда больной «стимуляторзависимый» (собственный ритм сокращений сердца менее 30 в минуту). Важно не пропустить время рекомендуемой замены ЭКС. Обычная проверка ЭКС в кабинете врача включает: регистрацию электрокардиограммы и определение параметров стимуляции с помощью специальных приборов. После проверки может потребоваться перепрограммирование ЭКС, для того чтобы стимуляционная терапия соответствовала состоянию пациента.
Досрочный визит к врачу должен состояться при появлении таких жалоб:
- снижение частоты пульса
- признаки воспаления в области имплантации прибора: покраснение, отек, боль
- появление новых приступов головокружения или обморока.
Таким образом, после установки кардиостимулятора больной в целом может вести привычный образ жизни, однако во избежание сбоев в работе прибора следует соблюдать некоторые правила и проходить регулярное медицинское обследование.
7 июня 2016 г.
Вступление
Брошюра, которую Вы держите в руках, предназначена для Вас – уважаемый обладатель электрокардиостимулятора (ЭКС), Ваших родных и близких, чтобы Вы нашли на этих страницах ответы на все интересующие Вас вопросы. Мы расскажем Вам о том, что такое электрокардиостимулятор и как он работает, познакомим с особенностями строения сердца и постараемся объяснить, почему Вам нужен ЭКС. Также Вы узнаете немного об операции по имплантации ЭКС, о восстановительном периоде и об особенностях жизни со стимулятором.
Но главное, о чем нам хочется сказать Вам сейчас, это то, что в настоящее время в мире насчитывается более миллиона человек, которые живут со стимулятором и благодаря ему вернулись к нормальной и полноценной жизни – к работе, учебе, домашним делам, путешествиям.
Мы хорошо понимаем Ваше беспокойство перед предстоящей операцией и постараемся сделать все возможное, чтобы это событие стало для Вас менее волнительным и неизвестным.
Мы не ставим перед собой задачу дать Вам какие-нибудь медицинские советы или рекомендации. Все вопросы, касающиеся состояния вашего здоровья и работы ЭКС, Вам необходимо задать своему врачу.
Развитие кардиостимуляции в последние десятилетия привело к решению многих проблем, связанных с нарушением ритма сердца. И сейчас операция по имплантации ЭКС стала повседневной, а надежность и качество современных аппаратов, сделанных на основе последних достижений технической мысли, вызывает уверенность как у врачей, так и у пациентов.
Вы можете полностью доверять вашему стимулятору. Как показывает многолетний опыт, у большинства пациентов после операции значительно улучшается самочувствие и качество жизни благодаря тому, что электрические импульсы, вырабатываемые надежно работающим стимулятором, помогают сердцу в его работе.
Мы рады, что имеем возможность помочь Вам, и надеемся, что прибор, изготовленный нашей фирмой, и эта брошюра, написанная специально для Вас, помогут Вам обрести покой и здоровье. От души желаем Вам счастья, благополучия и долгих лет жизни!
История создания электрокардиостимуляторов
Впервые способность импульсов электрического тока вызвать сокращения мышцы заметил знаменитый итальянец Alessandro Volta (1876). Затем Российские физиологи Ю.М.Чаговец и Н.Е.Введенский изучили особенности воздействия электрического импульса на сердце и предположили возможность использования их для лечения некоторых заболеваний сердца. В 1927 г. G. Hyman создал первый в мире наружный электрокардиостимулятор и применил его в клинике для лечения больного, страдающего редким пульсом и потерями сознания. Это сочетание известно как приступ Морганьи-Эдемс-Стокса (МЭС).
В 1951 году американские кардиохирурги Callaghan и Bigelow использовали кардиостимулятор для лечения больной после операции, т.к. у нее развилась полная поперечная блокада сердца с редким ритмом и приступами МЭС. Однако у данного прибора имелся большой недостаток – он находился вне тела пациента и импульсы к сердцу проводились по проводам через кожу.
В 1959 году шведские ученые создали имплантируемый, т.е. полностью находящийся под кожей, кардиостимулятор (Siemens-Elema). Конечно, первые стимуляторы были недолговечными: от 12 до 24 мес. Однако это был огромный шаг вперед.
В России история кардиостимуляции ведет отсчет с 1960 года, когда академик А.Н.Бакулев обратился к ведущим конструкторам страны с предложением о разработке медицинских аппаратов. И тогда в Конструкторском Бюро точного машиностроения – одном из ведущих предприятий оборонной отрасли, возглавляемом А.Э.Нудельманом – начались первые разработки имплантируемых ЭКС (А.А.Рихтер, В.Е.Бельгов ). В декабре 1961 года первый Российский стимулятор, ЭКС-2, был имплантирован академиком А.Н. Бакулевым больной с полной атриовентрикулярной блокадой. ЭКС-2 был на вооружении врачей более 15 лет, спас жизнь тысячам больных и зарекомендовал себя как один из наиболее надежных и миниатюрных стимуляторов того периода в мире.
Более чем за тридцатипятилетний срок в подразделении КБточмаш, возглавлявшемся В.Е. Бельговым, было создано более 30 моделей имплантируемых электрокардиостимуляторов.
Особое место в ряду созданных приборов занимает ЭКС-445, предназначенный для проведения операции кардиомиопластики, впервые предложенной и освоенной в России, проводимой у больных с тяжелой сердечной недостаточностью при противопоказании к пересадке сердца. ЭКС-445 отмечен дипломом и золотой медалью Международной выставки в г. Брюсселе.
Ваш кардиостимулятор изготовлен группой компаний «ЭЛЕСТИМ-КАРДИО», созданных на базе научно-технического и интеллектуального потенциала КБточмаш. Приняв у КБточмаш эстафету по дальнейшему развитию российской кардиостимуляции, группа компаний «ЭЛЕСТИМ-КАРДИО» в настоящее время занимает ведущие позиции на Российском рынке по разработке и серийному выпуску электрокардиостимуляторов и электродов к ним. Мы осознаем, что качество и надежность наших изделий – залог качества жизни десятков тысяч больных. Поэтому особое внимание уделяется тщательному поэтапному контролю качества в процессе производства и проведению технических и медицинских испытаний в независимых организациях. Нашими партнерами являются более 100 клиник во всех регионах России и странах СНГ.
Сохраняя лучшие традиции и передовые технологии оборонной отрасли, тесно сотрудничая с врачами, мы реализуем свои научные достижения в новейшие разработки нашей продукции.
Как работает Ваше сердце

СЕРДЦЕ — это уникальный мышечный орган, расположенный в середине грудной клетки. Сердце перекачивает кровь по всему организму, насыщая клетки кислородом и питательными веществами.
Мышечная перегородка делит сердце продольно на левую и правую половины. Клапаны разделяют каждую половину на две камеры: верхнюю (предсердие) и нижнюю (желудочек).
Сокращаясь, сердечная мышца проталкивает кровь сначала через предсердия, а затем через желудочки. В легких кровь насыщается кислородом и через легочные вены поступает в левое предсердие, потом в левый желудочек и из него через аорту и ответвляющиеся от нее артериальные сосуды разносится по всему телу.
Отдав кислород, кровь собирается в полые вены, а через них — в правое предсердие и правый желудочек. Оттуда через легочную артерию кровь попадает в легкие, где вновь обогащается кислородом.
Основным показателем работы сердца является то количество крови, которое оно должно перекачивать за 1 мин. Обычно для взрослого человека это не менее 5,0 л (300 л в час, 7200 л в сутки). Сердце сокращается более 100 000 раз в день, перегоняя кровь по 20 000 км вен и артерий, составляющих кровеносную систему человека.
Когда взрослый человек находится в состоянии покоя, сердце совершает от 60 до 80 сокращений в минуту. При физической нагрузке, в момент стресса или возбуждения частота сокращений сердца может возрастать до 200 ударов в минуту.
Проводящая система сердца
Выполнение Вашим сердцем функций по сбору и перекачиванию крови зависит от ритма движения крошечных импульсов, поступающих из верхней камеры сердца в нижнюю. Эти импульсы распространяются по проводящей системе сердца, которая задает необходимую частоту, равномерность и синхронность сокращений предсердий и желудочков в соответствии с потребностями организма.
Естественный водитель ритма, называемый синусовым узлом или узлом Кис-Фляка, располагается в верхней части правого предсердия. Это — анатомическое образование, которое контролирует и регулирует сердечный ритм в соответствии с активностью организма, временем суток и многими другими факторами, влияющими на человека.
В естественном водителе ритма сердца возникают электрические импульсы, которые проходят через предсердия, заставляя их сокращаться, к атриовентрикулярному (т. е. предсердно-желудочковому) узлу, расположенному на границе предсердий и желудочков. Затем возбуждение по проводящим тканям распространяется в желудочках, вызывая их сокращение. После этого сердце отдыхает до следующего импульса, с которого начинается новый цикл.
Правильность работы сердца, его ритм, можно проверить, положив руку на сердце или измеряя Ваш пульс.

Почему Вам нужен стимулятор
Наиболее часто врачи рекомендуют применять электрокардиостимулятор, когда различные симптомы (головокружение, повышение давления, головные боли, боли в области сердца) указывают на замедление сердечного ритма. Это состояние называется брадикардия.
Брадикардия обычно вызывается либо поражением синусового узла (синдром слабости синусового узла), либо заболеваниями проводящей системы сердца (блокады сердца).
♦ Синдром слабости синусового узла (заболевание синусового узла). В этих случаях частота импульсов в синусовом узле значительно снижается и не соответствует потребностям организма (график 2).
♦ Блокада сердца. При этом либо не все импульсы возбуждения синусового узла достигают желудочков сердца (неполная АВ блокада), либо они вообще не проходят и предсердия и желудочки сокращаются независимо друг от друга. Блокада сердца может произойти в атрио-вентрикулярном (предсердно-желудочковом) узле или проводящих тканях (график 3).
Нарушения сердечного ритма могут вызываться различными причинами, включая наследственные дефекты сердца, процесс старения, образование рубцовых изменений тканей после перенесенного инфаркта миокарда, инфекционные заболевания; а также неизвестными причинами.
При этом ослабленная сердечная функция является недостаточной для прокачивания необходимого количества крови через кровеносную систему. Первым органом, реагирующим на недостаток крови, становится очень чувствительный головной мозг. Вследствие недостаточного снабжения кислородом Вы можете чувствовать головокружение, слабость, усталость, медлительность, внезапное нарушение дыхания и даже потерю сознания.
В этих случаях применяют искусственный водитель ритма — кардиостимулятор, способный стимулировать сердце электрическими импульсами. Этот прибор задает сердцу постоянный и адекватный ритм, заставляя сердечную мышцу ритмично сокращаться. Таким образом, нормализуется циркуляция крови и снабжение организма кислородом и питательными веществами.

Как работает Ваш стимулятор
С помощью имплантируемого электрокардиостимулятора восстанавливается подача регулярных электрических импульсов к сердечной мышце. Вся система электрокардиостимулятора состоит из двух частей:
♦ Импульсного генератора, который собственно и называется ЭКС. Импульсный генератор состоит из электронной схемы и батареи, которые помещены в герметичный корпус. Электронная схема проводит исследование активности Вашего сердца и генерирует посылаемые к сердцу импульсы, контролируя их синхронизацию.
♦ Электрода (или двух электродов), который представляет собой специальный спиральный проводник, обладающий достаточной гибкостью, чтобы выдерживать кручение и сгибание, вызываемые движениями тела и сокращениями сердца. Электрод передает сердцу электрический импульс, вырабатываемый импульсным генератором, и несет обратно информацию об активности сердца.
Контакт электрода с сердцем осуществляется через металлическую головку на конце провода. С помощью нее стимулятор «следит» за электрической активностью сердца и посылает электрические импульсы (стимулирует) только тогда, когда они требуются сердцу. В том случае, если сердечная деятельность полностью отсутствует или ритм очень редкий, стимулятор переходит в режим постоянной стимуляции и посылает импульсы к сердцу с заданной частотой. Если будет проявляться спонтанная активность сердца, стимулятор перейдет в режим ожидания, т. е. будет функционировать в режиме «по требованию» (on demand).
Ритм будет падать, когда батарея начнет иссякать. Электрокардиостимулятор должен быть заменен, когда его ритм уменьшится до определенного значения (уменьшенная частота указана в паспорте стимулятора). При этом Вам необходимо проходить амбулаторные обследования по графику, установленному Вашим врачом.

Типы электрокардиостимуляторов
Тип необходимого Вам стимулятора зависит от Ваших индивидуальных особенностей. Ваш врач предпишет наиболее подходящий для состояния Вашего здоровья электрокардиостимулятор.
В большинстве случаев при нарушении сердечного ритма часть времени сердце продолжает сокращаться нормально. Поэтому стимулятор включается только тогда, когда это требуется. Он включается автоматически и стимулирует сердце, пока оно не начнет биться в нормальном ритме. Такие приборы называют «электрокардиостимуляторы по требованию», так как они действуют только в случае необходимости.
Электрокардиостимуляторы можно «программировать». Если состояние Вашего здоровья и потребность в стимуляции изменятся, Ваш врач может изменить настройку определенных параметров стимулятора. Такая регулировка выполняется амбулаторно во время очередного приема врача без дополнительной операции.
Однокамерные электрокардиостимуляторы
В однокамерном электрокардиостимуляторе используется один электрод, размещаемый либо в правом предсердии, либо в правом желудочке (в зависимости от диагноза) с целью детекции собственных потенциалов сердца и его стимуляции.

Двухкамерные электрокардиостимуляторы
Для двухкамерного электрокардиостимулятора обычно требуются два электрода, один из которых размещается в предсердии, а другой — в желудочке. Двухкамерный электрокардиостимулятор детектирует сердечную активность предсердия и желудочка, определяя потребность в стимуляции. В процессе последовательной («секвенциальной») стимуляции за сокращением предсердий сразу же следует сокращение желудочков, что делает ритм сердца наиболее близким к естественному, т. е. более физиологичным.

Операция по имплантации электрокардиостимулятора
Вам, безусловно, будет интересно узнать немного о предстоящей операции.
На сегодняшний день операция по имплантации ЭКС является самой обычной процедурой. Операция проводится в специализированном кардиохирургическом стационаре и обычно занимает от одного до двух часов.
Как правило, стимуляторы имплантируются с электродами, которые подводятся к сердцу через вены (трансвенозно). Сам стимулятор располагают в верхней части грудной клетки в подключичной области, формируя для него ложе под мышцей. Кожный разрез выполняется длиной около 5 см, параллельно ключице. При помощи специального катетера и иглы электрод путем прокола вводится в большую подключичную вену и проводится под контролем рентгентелевизионной установки в полость сердца в правый желудочек (или предсердие). С помощью специального приспособления, расположенного на конце электрода, он фиксируется (прикрепляется) к стенке сердца. Кожа зашивается косметическими швами. Практически на второй день после операции больной, в том случае если операция и начальное программирование прошли без осложнений, может быть выписан домой под наблюдение врача по месту жительства.
Возможны и другие методы имплантации ЭКС. Несомненно, врач порекомендует Вам наиболее подходящий способ применительно к Вашим индивидуальным особенностям.
Иллюстрации, приведенные ниже, показывают различные типы электрокардиостимуляторов, имплантированных трансвенозным методом.
Восстановительный период
Некоторое время после операции Вы, очевидно, будете осознавать, что Вам имплантирован ЭКС. Это нормальное чувство и обычно со временем оно проходит.
Некоторое время после операции Вы, очевидно, будете осознавать, что Вам имплантирован ЭКС. Это нормальное чувство и обычно со временем оно проходит.
В начале могут возникнуть неприятные ощущения в районе разреза. Но в случае появления признаков воспаления (покраснение, болезненность, повышение температуры) необходимо сразу обратиться к врачу по месту выполнения операции.
Иногда возникает «подергивание» над местом расположения стимулятора. Это совершенно безопасно и вызвано мизерным электрическим током, вырабатываемым ЭКС, который может возбуждать окружающую ткань. Через некоторое время такие явления обычно самопроизвольно исчезают, либо устраняются путем перепрограммирования ЭКС.
Подобного рода осложнения возникают у незначительного процента больных. При этом подавляющее большинство обладателей электрокардиостимулятора не имеют абсолютно никаких проблем со своими приборами.
Вскоре Вы начнете забывать, что носите в себе искусственный электрокардиостимулятор. Симптомы, указывающие на нарушение сердечного ритма, будут уменьшаться и вскоре исчезнут совсем.
Постепенно, по мере улучшения самочувствия и следуя советам своего врача, Вы сможете вернуться к своим обычным делам:
♦ работе, учебе;
♦ поездкам на транспорте, вождению автомобиля;
♦ принятию ванны или душа, плаванию;
♦ половой жизни;
♦ различным видам отдыха — прогулкам, пешему туризму, работе в саду или на огороде, подвижным играм.
Электрокардиостимулятор — новое качество жизни. Молодые женщины переносят период беременности и роды, как и другие их сверстницы.
Однако очень важно при этом следовать советам своего врача. Возвращение к обычным видам деятельности должно вести к улучшению, а не к ухудшению Вашего самочувствия.
Ваша жизнь с электрокардиостимулятором
Очевидно, что теперь Вы ожидаете прочесть, каким образом Ваш электрокардиостимулятор повлияет на Вашу жизнь.
Вы должны знать, что ЭКС позволяет Вам избежать состояния, угрожающего Вашей жизни, и поэтому чувствуйте себя уверенно и постарайтесь жить так, как Вы жили всегда. Большинство пациентов после имплантации ЭКС возвратились к активной плодотворной жизни, хотя многим из них уже больше 65 лет. Известно, что знаменитый хоккеист сборной США Бобби Халл после имплантации ЭКС в свои 50 лет выступал за сборную команду страны.
Живите так, как живут люди Вашей возрастной группы. Неверно думать, что избежать различных осложнений или продлить время эксплуатации ЭКС можно погрузившись в тепличные условия или строго ограничив свою активность. Ваш доктор посоветует Вам, что можно делать, а чего лучше избегать.
Электрокардиостимулятор — сложный электронный прибор, на который могут воздействовать внешние электромагнитные поля. Рассмотрим их возможное воздействие на работу Вашего электрокардиостимулятора.
Использование бытовой техники
Электрокардиостимулятор имеет встроенную защиту от помех со стороны других электрических устройств. Однако если Вы предполагаете, что электрическое устройство создает помехи работе Вашего стимулятора (чувствуете головокружение, учащение сердцебиения), просто отойдите от этого устройства или выключите его. В Вашем стимуляторе не возникнет никаких постоянных изменений, и он возобновит нормальный режим работы. Однако в этом случае целесообразно обратиться к врачу с тем, чтобы проверить параметры настройки ЭКС.
Большинство электрических устройств повседневного использования абсолютно безопасны и не повлияют на работу Вашего стимулятора.
Вы можете использовать обычную бытовую технику при условии, что она находится в исправном состоянии (во избежание возникновения электрических помех):
♦ микроволновые печи;
♦ телевизоры, радиоприемники, магнитофоны; компьютеры;
♦ фены для волос, электробритвы, щипцы для завивки;
♦ стиральные машины, электрические плиты, пылесосы;
♦ тостеры, миксеры.
Чтобы снизить вероятность возникновения помех, ручные электроприборы рекомендуется держать на расстоянии не менее 10 см от места расположения электрокардиостимулятора.
Нельзя прислоняться к экрану включенного телевизора или передней стенке микроволновой печи, а также ремонтировать электрические устройства, не выключив их из сети.
Подальше от электрокардиостимулятора рекомендуется держать паяльники, размагничивающие устройства, устройства с моторами (электродрели, фены для волос, электробритвы) и генераторы радиоволн (сотовые телефоны, двусторонние приемопередатчики).
Не следует держать магниты или намагниченные материалы близко к стимулятору.
Кроме того, не допускается использовать электрические приборы и инструменты, если производитель данных изделий установил запрет на их эксплуатацию людьми с электрокардиостимуляторами. Для получения информации о возможных ограничениях такого рода следует подробно ознакомиться с эксплуатационными документами на соответствующие изделия.
Сотовые телефоны
Недавние исследования показали возможность взаимодействия сотовых телефонов и электрокардиостимуляторов. Однако любые эффекты взаимодействия являются временными и исчезают при удалении телефона на большее расстояние.
Рекомендуется располагать сотовый телефон на расстоянии не менее 30 см от стимулятора и держать его у уха, противоположного стороне, с которой находится имплантированное устройство. На себе носить сотовый телефон не рекомендуется.
Использование офисного и промышленного
оборудования
Офисное оборудование и рабочая техника не сказывается на работе Вашего ЭКС, если оно соответствует требованиям электрической безопасности. Помните, что используемое Вами оборудование и техника должны быть в исправном состоянии и нужным образом заземлены.
Примерами такого оборудования и техники могут быть:
♦ компьютеры;
♦ копировальная и множительная техника;
♦ электронные средства связи;
♦ электроинструменты столярных мастерских (электрорубанок, электродрель и т.п.);
♦ металлообрабатывающие станки и механизмы слесарных мастерских.
Не рекомендуется работать с электрооборудованием, которое Вы не можете экстренно выключить.
Перед началом работы с промышленным оборудованием высокого напряжения и мощными магнитами, а также вблизи передающих башен и антенн, следует посоветоваться с врачом.
Следует избегать воздействия от мощных источников электрических помех, таких как:
♦ электропилы;
♦ сварочное оборудование;
♦ диэлектрические нагреватели;
♦ электрические сталеплавильные печи и т. д.
Следует соблюдать осторожность, находясь вблизи катушки распределителя или проводов свечей зажигания работающего автомобильного двигателя. Любая регулировка распределителя должна производиться при выключенном двигателе.
Не рекомендуется длительное время находиться вблизи высоковольтных линий электропередач, мощных электрических сверхвысокочастотных (СВЧ) установок и передатчиков. Пересекать линии высоковольтных электропередач следует, по возможности, около опор.
Металлодетекторы и противокражные системы
Абсолютно противопоказано останавливаться в непосредственной близости (ближе 0,5 м) и проходить через рамки металлодетекторов и противокражных систем, которые в настоящее время широко применяются в системах контроля безопасности и защиты от краж в аэропортах, на станциях метро, вокзалах, стадионах, кинотеатрах, музеях, торговых предприятиях и других учреждениях. Хотя металлодетекторы не выводят электрокардиостимулятор из строя, создаваемые ими электромагнитные импульсы могут привести к переходу электрокардиостимулятора в асинхронный режим или временному прекращению стимуляции. Замените указанные процедуры контроля безопасности личным досмотром (в случае необходимости), предъявив «Карту пациента с имплантированным электрокардиостимулятором».
Медицинские процедуры
Необходимо сообщить любому медицинскому работнику, что у Вас имеется электрокардиостимулятор, предъявив при этом свою карту-удостоверение. Однако большинство медицинских процедур, примеры которых приведены ниже, безопасны для Вашего ЭКС:
♦ диагностическая рентгеноскопия, включая рентген грудной клетки, снимки зубов, маммографию;
♦ лечение зубов, включая сверление и обработку ультразвуком;
♦ электрофорез в случае, если оборудование не нацелено на место расположения имплантированного устройства.
Абсолютно противопоказано:
♦ ультразвуковое облучение;
♦ диатермия;
♦ токи Дарсенваля;
♦ литотрипсия;
♦ чрескожная стимуляция нервов;
♦ магнитно-резонансная томография (МРТ);
♦ гипербарическая оксигенация.
После применения наружных дефибрилляторов следует проверить значения параметров стимуляции ЭКС.
При приеме физиопроцедур рекомендуется проконтролировать Ваш пульс.
Прежде чем соглашаться на любую медицинскую процедуру или хирургическую операцию, проконсультируйтесь со своим врачом
На это необходимо обратить особое внимание
Самый быстрый способ проверить, исправен ли Ваш стимулятор -это посчитать Ваш пульс. Частота пульса должна совпадать или быть выше запрограммированной в клинике частоты ЭКС. При выписке из клиники Вам покажут, как правильно измерять пульс, и назначат день первого регулярного обследования.
Вам следует периодически измерять пульс в течение минуты сидя или лежа. Врач может посоветовать Вам завести ДНЕВНИК, где Вы будете записывать частоту пульса, дату и время подсчета. При необходимости Вам могут помочь члены Вашей семьи.
Регулярные обследования помогут Вашему врачу проверить работу электрокардиостимулятора, его функции, состояние батареи. Расписание обследований составит Ваш врач. Оно будет зависеть от типа Вашего ЭКС, состояния Вашего здоровья, а также от практики, принятой Вашим доктором.
Обычная проверка электрокардиостимулятора в кабинете врача включает регистрацию электрокардиограммы (ЭКГ). После проверки может потребоваться перепрограммирование ЭКС для того, чтобы Ваша стимуляционная терапия лучше соответствовала Вашему состоянию. Врач сделает это с помощью наружного программирующего устройства, так что никакая операция для этого не потребуется. Изменение параметров стимуляции Вы также можете заносить в ДНЕВНИК с указанием даты и новых параметров прибора.
Важно соблюдать все назначенные визиты к врачу и в клинику.
По мере приближения ожидаемого срока замены стимулятора регулярные обследования могут учащаться. Ваш врач сможет приблизительно определить срок службы электрокардиостимулятора в зависимости от типа ЭКС и режима его работы. Обычно кардиостимулятор рассчитан на 7-10 лет непрерывной работы. С приближением окончания этого срока стимулятор изменит частоту стимуляции, тем самым подавая сигнал к замене. Ваш врач или медсестра распознают эту смену частоты во время регулярных проверок. Но даже когда частота импульсов прибора упадет до определенного уровня, Вам не стоит беспокоиться. Ваш ЭКС будет нормально функционировать еще несколько месяцев. В течение этого времени электрокардиостимулятор будет заменен на новый прибор.
При замене аппарата Ваш врач проверит состояние электрода (электродов). При их удовлетворительном состоянии существующие электроды остаются на месте и подсоединяются к новому стимулятору. Замена прибора происходит очень просто и быстро.
Необходимые Вам документы
Внутри упаковки с электрокардиостимулятором Вы найдете следующие документы:
♦ паспорт на прибор.
♦ набор регистрационных карт «Карта пациента с имплантированным (реимплантированным) антиаритмическим устройством».
♦ Карту пациента с имплантированным электрокардиостимулятором, содержащую карту наблюдения за пациентом с имплантированным электрокардиостимулятором.
В паспорте на прибор Вы найдете параметры и функции работы ЭКС, его технические характеристики, а также гарантийные обязательства фирмы.
Регистрационные карты заполняются Вашим врачом после имплантации ЭКС. На каждой карте указано ее назначение. Карту, предназначенную для Вас, Вы можете поместить в свой ДНЕВНИК.
Убедительно просим Вас отправлять нам регистрационную карту, предназначенную для фирмы-изготовителя. Нам очень важно иметь информацию о Вас и Вашем приборе. Также проинформируйте фирму в случае изменения Вашего адреса, номера телефона, смены врача или изменении параметров стимуляции (просьба сообщить новые параметры ЭКС). Ваша помощь позволит нам лучше обслуживать Вас и Вашего врача.
«Карту пациента с имплантированным электрокардиостимулятором» заполняет врач после имплантации. Рекомендуем Вам всегда носить эту карту с собой и предъявлять при необходимости.
Это важно
♦ Следить за физическими признаками, которые могут указывать на необходимость проверки стимулятора, и немедленно сообщить своему врачу по месту проведения операции при появлении какого-либо из следующих признаков:
— затруднение дыхания, головокружения или обмороки.
— отеки ног, лодыжек, рук или запястий.
— воспаление (покраснение, болезненность, повышение температуры), опухание или свищ в области хирургических швов.
— необычное изменение пульса во время сна или в другое неподходящее время.
♦ Строго соблюдать график регулярных обследований, назначенный Вашим врачом.
♦ Выполнять все рекомендации врача, касающиеся приема лекарственных препаратов, физических нагрузок, диеты. Сообщите врачу, если Вы планируете изменить уровень нагрузок, отправиться в поездку или изменить адрес.
♦ Сообщать любому медицинскому работнику, что у Вас имеется электрокардиостимулятор, предъявив при этом карту-удостоверение владельца ЭКС.
♦ Если у Вас возникают вопросы, относящиеся к Вашему сердцу, состоянию здоровья или работе электрокардиостимулятора, необходимо проконсультироваться с Вашим врачом.
Рекомендуется всегда носить с собой «Карту пациента с имплантированным электрокардиостимулятором».
Заключение
Теперь Вы знаете, почему Вам нужен стимулятор, как он работает и что Вы должны делать для того, чтобы жить нормальной, полноценной жизнью.
Электрокардиостимулятор определяет ритм Вашего сердца, т. е. частоту, с которой оно бьется.
Конечно, он не может устранить причину нарушения ритма Вашего сердца, также как и предотвратить естественные возрастные изменения, которые происходят в сердце и кровеносной системе каждого человека.
Однако мы надеемся, что этот надежно работающий прибор, изготовленный по последнему слову техники, избавит Вас от многих симптомов, связанных с нарушением ритма сердца, и продлит Вам жизнь на многие годы.
This article is about the medical device that simulates the function. For the natural pacemaker in the heart, see Cardiac pacemaker.
| Artificial cardiac pacemaker | |
|---|---|

St. Jude single-lead pacemaker with ruler in cm (released in 2005[1][2]) |
|
| Specialty | Cardiology, electrophysiology |
|
[edit on Wikidata] |
An artificial cardiac pacemaker (artificial pacemaker, and sometimes just pacemaker, although the term is also used to refer to the body’s natural cardiac pacemaker) is a medical device, nowadays always implanted, that generates electrical pulses delivered by electrodes to one or more of the chambers of the heart, the upper atria or lower ventricles. Each pulse causes the targeted chamber(s) to contract and pump blood,[3] thus regulating the function of the electrical conduction system of the heart.
The primary purpose of a pacemaker is to maintain an adequate heart rate, either because the heart’s natural pacemaker is not fast enough, or because there is a block in the heart’s electrical conduction system. Modern pacemakers are externally programmable and allow a cardiologist, particularly a cardiac electrophysiologist, to select the optimal pacing modes for individual patients. Most pacemakers are on demand, in which the stimulation of the heart is based on the dynamic demand of the circulatory system. Others send out a fixed rate of impulses.[4]
A specific type of pacemaker called an implantable cardioverter-defibrillator combines pacemaker and defibrillator functions in a single implantable device.[5] Others, called biventricular pacemakers, have multiple electrodes stimulating different positions within the ventricles (the lower heart chambers) to improve their synchronization.[6]
Methods of pacing[edit]
Percussive pacing[edit]
Percussive pacing, also known as transthoracic mechanical pacing, is the use of the closed fist, usually on the left lower edge of the sternum over the right ventricle in the vena cava, striking from a distance of 20 – 30 cm to induce a ventricular beat (the British Journal of Anaesthesia suggests this must be done to raise the ventricular pressure to 10–15 mmHg to induce electrical activity). This is an old procedure used only as a life-saving means until an electrical pacemaker is brought to the patient.[7]
Transcutaneous pacing[edit]
Transcutaneous pacing (TCP), also called external pacing, is recommended for the initial stabilization of hemodynamically significant bradycardias of all types. The procedure is performed by placing two pacing pads on the patient’s chest, either in the anterior/lateral position or the anterior/posterior position. The rescuer selects the pacing rate, and gradually increases the pacing current (measured in mA) until electrical capture (characterized by a wide QRS complex with a tall, broad T wave on the ECG) is achieved, with a corresponding pulse. Pacing artifact on the ECG and severe muscle twitching may make this determination difficult. External pacing should not be relied upon for an extended period of time. It is an emergency procedure that acts as a bridge until transvenous pacing or other therapies can be applied.[8]
Epicardial pacing (temporary)[edit]

Temporary epicardial pacing is used during open heart surgery should the surgical procedure create atrio-ventricular block. The electrodes are placed in contact with the outer wall of the ventricle (epicardium) to maintain satisfactory cardiac output until a temporary transvenous electrode has been inserted.[9]
Transvenous pacing (temporary)[edit]
Transvenous pacing, when used for temporary pacing, is an alternative to transcutaneous pacing. A pacemaker wire is placed into a vein, under sterile conditions, and then passed into either the right atrium or right ventricle. The pacing wire is then connected to an external pacemaker outside the body. Transvenous pacing is often used as a bridge to permanent pacemaker placement. It can be kept in place until a permanent pacemaker is implanted or until there is no longer a need for a pacemaker and then it is removed.

Permanent transvenous pacing[edit]
Permanent pacing with an implantable pacemaker involves transvenous placement of one or more pacing electrodes within a chamber, or chambers, of the heart, while the pacemaker is implanted under the skin below the clavicle. The procedure is performed by incision of a suitable vein into which the electrode lead is inserted and passed along the vein, through the valve of the heart, until positioned in the chamber. The procedure is facilitated by fluoroscopy which enables the physician to view the passage of the electrode lead. After satisfactory lodgement of the electrode is confirmed, the opposite end of the electrode lead is connected to the pacemaker generator.
There are three basic types of permanent pacemakers, classified according to the number of chambers involved and their basic operating mechanism:[10]
- Single-chamber pacemaker. In this type, only one pacing lead is placed into a chamber of the heart, either the atrium or the ventricle.[10]
- Dual-chamber pacemaker. Here, wires are placed in two chambers of the heart. One lead paces the atrium and one paces the ventricle. This type more closely resembles the natural pacing of the heart by assisting the heart in coordinating the function between the atria and ventricles.[10]
- Biventricular pacemaker. This pacemaker has three wires placed in three chambers of the heart. One in the atrium and two in either ventricle. It is more complicated to implant.[10]
- Rate-responsive pacemaker. This pacemaker has sensors that detect changes in the patient’s physical activity and automatically adjust the pacing rate to fulfill the body’s metabolic needs.[10]
The pacemaker generator is a hermetically sealed device containing a power source, usually a lithium battery, a sensing amplifier which processes the electrical manifestation of naturally occurring heart beats as sensed by the heart electrodes, the computer logic for the pacemaker and the output circuitry which delivers the pacing impulse to the electrodes.
Most commonly, the generator is placed below the subcutaneous fat of the chest wall, above the muscles and bones of the chest. However, the placement may vary on a case-by-case basis.
The outer casing of pacemakers is so designed that it will rarely be rejected by the body’s immune system. It is usually made of titanium, which is inert in the body.
Leadless pacing[edit]
Leadless pacemakers are devices that are as small as a capsule and are small enough to allow the generator to be placed within the heart, therefore avoiding the need for pacing leads.[11] As pacemaker leads can fail over time, a pacing system that avoids these components offers theoretical advantages. Leadless pacemakers can be implanted into the heart using a steerable catheter fed into the femoral vein via an incision in the groin.[11]
Basic function[edit]


Modern pacemakers usually have multiple functions. The most basic form monitors the heart’s native electrical rhythm. When the pacemaker wire or «lead» does not detect heart electrical activity in the chamber – atrium or ventricle – within a normal beat-to-beat time period – most commonly one second – it will stimulate either the atrium or the ventricle with a short low voltage pulse. If it does sense electrical activity, it will hold off stimulating. This sensing and stimulating activity continues on a beat by beat basis and is called «demand pacing». In the case of a dual-chamber device, when the upper chambers have a spontaneous or stimulated activation, the device starts a countdown to ensure that in an acceptable – and programmable – interval, there is an activation of the ventricle, otherwise again an impulse will be delivered.
The more complex forms include the ability to sense and/or stimulate both the atrial and ventricular chambers.
| I | II | III | IV | V |
|---|---|---|---|---|
| Chamber(s) paced | Chamber(s) sensed | Response to sensing | Rate modulation | Multisite pacing |
| O = None | O = None | O = None | O = None | O = None |
| A = Atrium | A = Atrium | T = Triggered | R = Rate modulation | A = Atrium |
| V = Ventricle | V = Ventricle | I = Inhibited | V = Ventricle | |
| D = Dual (A+V) | D = Dual (A+V) | D = Dual (T+I) | D = Dual (A+V) |
From this the basic ventricular «on demand» pacing mode is VVI or with automatic rate adjustment for exercise VVIR – this mode is suitable when no synchronization with the atrial beat is required, as in atrial fibrillation. The equivalent atrial pacing mode is AAI or AAIR which is the mode of choice when atrioventricular conduction is intact but the sinoatrial node of the natural pacemaker is unreliable – sinus node disease (SND) or sick sinus syndrome. Where the problem is atrioventricular block (AVB) the pacemaker is required to detect (sense) the atrial beat and after a normal delay (0.1–0.2 seconds) trigger a ventricular beat, unless it has already happened – this is VDD mode and can be achieved with a single pacing lead with electrodes in the right atrium (to sense) and ventricle (to sense and pace). These modes AAIR and VDD are unusual in the US but widely used in Latin America and Europe.[13][14] The DDDR mode is most commonly used as it covers all the options though the pacemakers require separate atrial and ventricular leads and are more complex, requiring careful programming of their functions for optimal results.
Automatic pacemakers are designed to be over-ridden by the heart’s natural rate at any moment that it gets back to a non-pathologic normal sinus rhythm and can reinitiate influencing the electric activity in the heart when the pathologic event happens again.[15] A «ventricular-demand pacemaker» produces a narrow vertical spike on the ECG, just before a wide QRS. The spike of an «atrial-demand pacemaker» appears just before the P wave.[16]
Comparably, a Triggered Pacemaker is activated immediately after an electrical activity is commenced in the heart tissue by itself. A «ventricular triggered pacemaker» produces the impulse just after a pulse is created in the ventricular tissue and it appears as a simultaneous spike with QRS. An «atrial triggered pacemaker» is the mode in which an impulse is produced immediately after an electrical event in the atrium. It appears as a discharge following the p wave but prior to the QRS which is commonly widened.[17]
Biventricular pacing[edit]

Cardiac resynchronization therapy (CRT) is used for people with heart failure in whom the left and right ventricles do not contract simultaneously (ventricular dyssynchrony), which occurs in approximately 25–50% of heart failure patients. To achieve CRT, a biventricular pacemaker (BVP) is used, which can pace both the septal and lateral walls of the left ventricle. By pacing both sides of the left ventricle, the pacemaker can resynchronize the ventricular contractions.
CRT devices have at least two leads, one passing through the vena cava and the right atrium into the right ventricle to stimulate the septum, and another passing through the vena cava and the right atrium and inserted through the coronary sinus to pace the epicardial wall of the left ventricle. Often, for patients in normal sinus rhythm, there is also a lead in the right atrium to facilitate synchrony with the atrial contraction. Thus, the timing between the atrial and ventricular contractions, as well as between the septal and lateral walls of the left ventricle can be adjusted to achieve optimal cardiac function.
CRT devices have been shown to reduce mortality and improve quality of life in patients with heart failure symptoms; a LV ejection fraction less than or equal to 35% and QRS duration on EKG of 120 ms or greater.[18][19]
Biventricular pacing alone is referred to as CRT-P (for pacing). For selected patients at risk of arrhythmias, CRT can be combined with an implantable cardioverter-defibrillator (ICD): such devices, known as CRT-D (for defibrillation), also provide effective protection against life-threatening arrhythmias.[20]
Conduction System Pacing[edit]
Conventional placement of ventricular leads in or around the tip or apex of the right ventricle, or RV apical pacing, can have negative effects on heart function. It has been associated with increased risk of atrial fibrillation, heart failure, weakening of the heart muscle and potentially shorter life expectancy. His bundle pacing (HBP) leads to a more natural or perfectly natural ventricular activation and has generated strong research and clinical interest. By stimulating the His–Purkinje fiber network directly with a special lead and placement technique, HBP causes a synchronized and therefore more effective ventricular activation and avoids long-term heart muscle disease. HBP in some cases can also correct bundle branch block patterns.[21][22]
Advancements in function[edit]

A major step forward in pacemaker function has been to attempt to mimic nature by utilizing various inputs to produce a rate-responsive pacemaker using parameters such as the QT interval, pO2 – pCO2 (dissolved oxygen or carbon dioxide levels) in the arterial-venous system, physical activity as determined by an accelerometer, body temperature, ATP levels, adrenaline, etc.
Instead of producing a static, predetermined heart rate, or intermittent control, such a pacemaker, a ‘Dynamic Pacemaker’, could compensate for both actual respiratory loading and potentially anticipated respiratory loading. The first dynamic pacemaker was invented by Anthony Rickards of the National Heart Hospital, London, UK, in 1982.[23]
Dynamic pacemaking technology could also be applied to future artificial hearts. Advances in transitional tissue welding would support this and other artificial organ/joint/tissue replacement efforts. Stem cells may be of interest in transitional tissue welding.[citation needed]
Many advancements have been made to improve the control of the pacemaker once implanted. Many of these have been made possible by the transition to microprocessor controlled pacemakers. Pacemakers that control not only the ventricles but the atria as well have become common. Pacemakers that control both the atria and ventricles are called dual-chamber pacemakers. Although these dual-chamber models are usually more expensive, timing the contractions of the atria to precede that of the ventricles improves the pumping efficiency of the heart and can be useful in congestive heart failure.
Rate responsive pacing allows the device to sense the physical activity of the patient and respond appropriately by increasing or decreasing the base pacing rate via rate response algorithms.
The DAVID trials[24] have shown that unnecessary pacing of the right ventricle can exacerbate heart failure and increases the incidence of atrial fibrillation. The newer dual-chamber devices can keep the amount of right ventricle pacing to a minimum and thus prevent worsening of the heart disease.
Considerations[edit]
Insertion[edit]
A pacemaker may be implanted whilst a person is awake using local anesthetic to numb the skin with or without sedation, or asleep using a general anesthetic.[25] An antibiotic is usually given to reduce the risk of infection.[25] Pacemakers are generally implanted in the front of the chest in the region of the left or right shoulder. The skin is prepared by clipping or shaving any hair over the implant site before cleaning the skin with a disinfectant such as chlorhexidine. An incision is made below the collar bone and a space or pocket is created under the skin to house the pacemaker generator. This pocket is usually created just above the pectoralis major muscle (prepectoral), but in some cases the device may be inserted beneath the muscle (submuscular).[26] The lead or leads are fed into the heart through a large vein guided by X-ray imaging (fluoroscopy). The tips of the leads may be positioned within the right ventricle, the right atrium, or the coronary sinus, depending on the type of pacemaker required.[25] Surgery is typically completed within 30 to 90 minutes. Following implantation, the surgical wound should be kept clean and dry until it has healed. Some movements of the shoulder within a few weeks of insertion carry a risk of dislodging the pacemaker leads.[25]
The batteries within a pacemaker generator typically last 5 to 10 years. When the batteries are nearing the end of life, the generator is replaced in a procedure that is usually simpler than a new implant. Replacement involves making an incision to remove the existing device, disconnecting the leads from the old device and reconnecting them to a new generator, reinserting the new device and closing the skin.[25]
Periodic pacemaker checkups[edit]

Once the pacemaker is implanted, it is periodically checked to ensure the device is operational and performing appropriately; the device can be checked as often as is deemed necessary. Routine pacemaker checks are typically done in-office every six months, though will vary depending upon patient/device status and remote monitoring availability. Newer pacemaker models can also be interrogated remotely, with the patient transmitting their pacemaker data using a transmitter at home connected to a cellular telephone network.
During in-office follow-up, diagnostic tests may include:
- Sensing: the ability of the device to «see» intrinsic cardiac activity (atrial and ventricular depolarization).
- Impedance: A test to measure lead integrity. Large and/or sudden increases in impedance can indicate a lead fracture, while large and/or sudden decreases in impedance can be caused by insulation failure.
- Threshold amplitude: The minimum voltage (generally in hundredths of volts) required in order to pace the atrium or ventricle connected to the lead.
- Threshold duration: The time that the device requires at the preset amplitude to reliably pace the atrium or ventricle connected to the lead.
- Percentage of pacing: The percentage of time that the pacemaker has been actively pacing since the previous device interrogation, which shows how dependent the patient is on the device.
- Estimated battery life at current rate: As modern pacemakers are «on-demand» and only pace when necessary, battery lifespan is affected by how much the pacemaker is utilized. Other factors affecting battery life include programmed output and algorithms (features) that use battery power.
- Any events that were stored since the last follow-up, in particular arrhythmias such as atrial fibrillation. These are typically stored based on specific criteria set by the physician and specific to the patient. Some devices have the availability to display intracardiac electrograms showing the onset of an event as well as the event itself, which helps to diagnose its cause or origin.
Magnetic fields, MRIs, and other lifestyle issues[edit]
A patient’s lifestyle is usually not modified to any great degree after the insertion of a pacemaker. There are a few activities that are unwise, such as full-contact sports and exposure of the pacemaker to intense magnetic fields.
The pacemaker patient may find that some types of everyday actions need to be modified. For instance, the shoulder harness of a vehicle seatbelt may be uncomfortable if it falls across the pacemaker insertion site. Women will not be able to wear bras for a while after the operation, and later might have to wear bras with wide shoulder straps.
For some sports and physical activities, special pacemaker protection can be worn to prevent possible injuries, or damage to the pacemaker leads.
Pacemakers may be affected by magnetic or electromagnetic fields, and ionising and acoustic radiation. However, a 2013 study found that «The overall risk of clinically significant adverse events related to EMI (electromagnetic interference) in recipients of CIEDs (cardiovascular implantable electronic devices) is very low. Therefore, no special precautions are needed when household appliances are used. Environmental and industrial sources of EMI are relatively safe when the exposure time is limited and distance from the CIEDs is maximized. The risk of EMI-induced events is highest within the hospital environment.»[27] The study lists and tabulates (in Table 2) many sources of interference, and many different potential effects: damage to circuitry, asynchronous pacing, etc. Some sources of hazard in older devices have been eliminated in newer ones.
Activities involving strong magnetic fields should be avoided. This includes activities such as arc welding with certain types of equipment,[28] and maintaining heavy equipment that may generate strong magnetic fields. Some medical procedures, particularly magnetic resonance imaging (MRI), involve very strong magnetic fields or other conditions that may damage pacemakers.
However, many modern pacemakers are specified to be MR conditional or MRI conditional, safe to use during MRI subject to certain conditions.[29] The first to be so specified was the Medtronic Revo MRI SureScan, approved by the US FDA in February 2011,[30] which was the first to be specified as MR conditional.[31][32] There are several conditions to use of MR Conditional pacemakers, including certain patients’ qualifications and scan settings. An MRI conditional device has to have MRI settings enabled before a scan, and disabled afterwards.[33]
As of 2014 the five most commonly used cardiac pacing device manufacturers (covering more than 99% of the US market) made FDA-approved MR-conditional pacemakers.[34] The use of MRI may be ruled out by the patient having an older, non-MRI Conditional pacemaker, or by having old pacing wires inside the heart, no longer connected to a pacemaker.
A 2008 US study found[35] that the magnetic field created by some headphones used with portable music players or cellphones may cause interference if placed very close to some pacemakers.
In addition, according to the American Heart Association, some home devices have the potential to occasionally inhibit a single beat. Cellphones do not seem to damage pulse generators or affect how the pacemaker works.[36] It is recommended that objects containing magnets, or generating a significant magnetic field, should not be in close proximity to a pacemaker. Induction cooktops, in particular, can pose a risk.[37]
Before medical procedures, the patient should inform all medical personnel that they have a pacemaker. Having a pacemaker does not imply that a patient requires the use of antibiotics to be administered before procedures such as dental work.[38]
End-of-life care and pacemaker deactivation[edit]
A panel of the Heart Rhythm Society, a US specialist organization based in Washington, DC, deemed that it was legal and ethical to honor requests by patients, or by those with legal authority to make decisions for patients, to deactivate implanted cardiac devices. Lawyers say that the legal situation is similar to removing a feeding tube, though as of 2010 there was no legal precedent involving pacemakers in the United States. A patient in many jurisdictions (including the US) is deemed to have a right to refuse or discontinue treatment, including a pacemaker that keeps them alive. Physicians have a right to refuse to turn it off, but are advised by the HRS panel that they should refer the patient to a physician who will.[39][40] Some patients consider that hopeless, debilitating conditions, such as severe strokes or late-stage dementia, can cause so much suffering that they would prefer not to prolong their lives with supportive measures.[41]
Privacy and security[edit]
Security and privacy concerns have been raised with pacemakers that allow wireless communication. Unauthorized third parties may be able to read patient records contained in the pacemaker, or reprogram the devices, as has been demonstrated by a team of researchers.[42] The demonstration worked at short range; they did not attempt to develop a long range antenna. The proof of concept exploit helps demonstrate the need for better security and patient alerting measures in remotely accessible medical implants.[42] In response to this threat, Purdue University and Princeton University researchers have developed a prototype firewall device, called MedMon, which is designed to protect wireless medical devices such as pacemakers and insulin pumps from attackers.[43]
Complications[edit]
Complications from having surgery to implant a pacemaker are uncommon (each 1-3% approximately), but could include: infection where the pacemaker is implanted or in the bloodstream; allergic reaction to the dye or anesthesia used during the procedure; swelling, bruising or bleeding at the generator site, or around the heart, especially if the patient is taking blood thinners, elderly, of thin frame or otherwise on chronic steroid use.[45]
A possible complication of dual-chamber artificial pacemakers is ‘pacemaker-mediated tachycardia’ (PMT), a form of reentrant tachycardia. In PMT, the artificial pacemaker forms the anterograde (atrium to ventricle) limb of the circuit and the atrioventricular (AV) node forms the retrograde limb (ventricle to atrium) of the circuit.[46] Treatment of PMT typically involves reprogramming the pacemaker.[46]
Another possible complication is «pacemaker-tracked tachycardia,» where a supraventricular tachycardia such as atrial fibrillation or atrial flutter is tracked by the pacemaker and produces beats from a ventricular lead.[47] This is becoming exceedingly rare as newer devices are often programmed to recognize supraventricular tachycardias and switch to non-tracking modes.[48]
It is important to consider leads as a potential nidus for thromboembolic events. The leads are small-diameter wires from the pacemaker to the implantation site in the heart muscle, and are usually placed intravenously through the subclavian vein in order to access the right atrium. Placing a foreign object within the venous system in such a manner may disrupt blood-flow and allow for thrombus formation. Therefore, patients with pacemakers may need to be placed on anti-coagulation therapy to avoid potential life-threatening thrombosis or embolus.[49][50]
These leads may also damage the tricuspid valve leaflets, either during placement or through wear and tear over time. This can lead to tricuspid regurgitation and right-sided heart failure, which may require tricuspid valve replacement.[51]
Sometimes leads will need to be removed. The most common reason for lead removal is infection; however, over time, leads can degrade due to a number of reasons such as lead flexing.[52] Changes to the programming of the pacemaker may overcome lead degradation to some extent. However, a patient who has several pacemaker replacements over a decade or two in which the leads were reused may require lead replacement surgery.
Lead replacement may be done in one of two ways. Insert a new set of leads without removing the current leads (not recommended as it provides additional obstruction to blood flow and heart valve function) or remove the current leads and then insert replacements. The lead removal technique will vary depending on the surgeon’s estimation of the probability that simple traction will suffice to more complex procedures. Leads can normally be disconnected from the pacemaker easily, which is why device replacement usually entails simple surgery to access the device and replace it by simply unhooking the leads from the device to replace and hooking the leads to the new device. The possible complications, such as perforation of the heart wall, come from removing the lead{s} from the patient’s body.
The free end of a pacemaker lead is actually implanted into the heart muscle with a miniature screw or anchored with small plastic hooks called tines. The longer the leads have been implanted (starting from a year or two), the more likely that they will have additional attachments to the patient’s body at various places in the pathway from device to heart muscle, since the body tends to incorporate foreign devices into tissue. In some cases, for a lead that has been inserted for a short amount of time, removal may involve simple traction to pull the lead from the body. Removal in other cases is typically done with a laser or cutting device which threads like a cannula with a cutting edge over the lead and is moved down the lead to remove any organic attachments with tiny cutting lasers or similar device.[53][54]
Pacemaker lead malposition in various locations has been described in the literature. Treatment varies, depending on the location of the pacer lead and symptoms.[55]
Another possible complication called twiddler’s syndrome occurs when a patient manipulates the pacemaker and causes the leads to be removed from their intended location and causes possible stimulation of other nerves.
Overall life expectancy with pacemakers is excellent, and mostly depends upon underlying diseases, presence of atrial fibrillation, age and sex at the time of first implantation.[56]
Other devices[edit]
Sometimes devices resembling pacemakers, called implantable cardioverter-defibrillators (ICDs) are implanted. These devices are often used in the treatment of patients at risk from sudden cardiac death. An ICD has the ability to treat many types of heart rhythm disturbances by means of pacing, cardioversion, or defibrillation. Some ICD devices can distinguish between ventricular fibrillation and ventricular tachycardia (VT), and may try to pace the heart faster than its intrinsic rate in the case of VT, to try to break the tachycardia before it progresses to ventricular fibrillation. This is known as fast-pacing, overdrive pacing, or anti-tachycardia pacing (ATP). ATP is only effective if the underlying rhythm is ventricular tachycardia, and is never effective if the rhythm is ventricular fibrillation.
| I | II | III | IV |
|---|---|---|---|
| Shock chamber | Antitachycardia pacing chamber | Tachycardia detection | Antibradycardia pacing chamber |
| O = None | O = None | E = Electrogram | O = None |
| A = Atrium | A = Atrium | H = Hemodynamic | A = Atrium |
| V = Ventricle | V = Ventricle | V = Ventricle | |
| D = Dual (A+V) | D = Dual (A+V) | D = Dual (A+V) |
| ICD-S | ICD with shock capability only |
| ICD-B | ICD with bradycardia pacing as well as shock |
| ICD-T | ICD with tachycardia (and bradycardia) pacing as well as shock |
History[edit]

Origin[edit]
In 1889, John Alexander MacWilliam reported in the British Medical Journal (BMJ) of his experiments in which application of an electrical impulse to the human heart in asystole caused a ventricular contraction and that a heart rhythm of 60–70 beats per minute could be evoked by impulses applied at spacings equal to 60–70/minute.[58]
In 1926, Mark C Lidwill of the Royal Prince Alfred Hospital of Sydney, supported by physicist Edgar H. Booth of the University of Sydney, devised a portable apparatus which «plugged into a lighting point» and in which «One pole was applied to a skin pad soaked in strong salt solution» while the other pole «consisted of a needle insulated except at its point, and was plunged into the appropriate cardiac chamber». «The pacemaker rate was variable from about 80 to 120 pulses per minute, and likewise the voltage variable from 1.5 to 120 volts».[59] In 1928, the apparatus was used to revive a stillborn infant at Crown Street Women’s Hospital in Sydney, whose heart continued «to beat on its own accord», «at the end of 10 minutes» of stimulation.[60][61]
In 1932, American physiologist Albert Hyman, with the help of his brother, described an electro-mechanical instrument of his own, powered by a spring-wound hand-cranked motor. Hyman himself referred to his invention as an «artificial pacemaker», the term continuing in use to this day.[62][63]
An apparent hiatus in the publication of research conducted between the early 1930s and World War II may be attributed to the public perception of interfering with nature by «reviving the dead».[64] For example, «Hyman did not publish data on the use of his pacemaker in humans because of adverse publicity, both among his fellow physicians, and due to newspaper reporting at the time. Lidwell may have been aware of this and did not proceed with his experiments in humans».[61]
Transcutaneous[edit]
In 1950, Canadian electrical engineer John Hopps designed and built the first external pacemaker based upon observations by cardio-thoracic surgeons Wilfred Gordon Bigelow and John Callaghan at Toronto General Hospital.[65] The device was first tested on a dog at the University of Toronto’s Banting Institute.[66] A substantial external device using vacuum tube technology to provide transcutaneous pacing, it was somewhat crude and painful to the patient in use and, being powered from an AC wall socket, carried a potential hazard of electrocution of the patient and inducing ventricular fibrillation.[67]
A number of innovators, including Paul Zoll, made smaller but still bulky transcutaneous pacing devices from 1952 using a large rechargeable battery as the power supply.[68]
In 1957, William L. Weirich published the results of research performed at the University of Minnesota. These studies demonstrated the restoration of heart rate, cardiac output and mean aortic pressures in animal subjects with complete heart block through the use of a myocardial electrode.[69]
In 1958 Colombian doctor Alberto Vejarano Laverde and Colombian electrical engineer Jorge Reynolds Pombo constructed an external pacemaker, similar to those of Hopps and Zoll, weighing 45 kg and powered by a 12 volt car lead–acid battery, but connected to electrodes attached to the heart. This apparatus was successfully used to sustain a 70-year-old priest, Gerardo Florez.[70]
The development of the silicon transistor and its first commercial availability in 1956 was the pivotal event that led to the rapid development of practical cardiac pacemaking.[71]
Wearable[edit]
In 1958, engineer Earl Bakken of Minneapolis, Minnesota, produced the first wearable external pacemaker for a patient of C. Walton Lillehei. This transistorized pacemaker, housed in a small plastic box, had controls to permit adjustment of pacing heart rate and output voltage and was connected to electrode leads which passed through the skin of the patient to terminate in electrodes attached to the surface of the myocardium of the heart.
In the UK in the 1960s, Lucas Engineering in Birmingham was asked by Mr Abrams of The Queen Elizabeth Hospital to produce a prototype for a transistorised replacement for the electro-mechanical product. The team was headed by Roger Nolan, an engineer with the Lucas Group Research Centre. Nolan designed and created the first blocking oscillator and transistor-powered pacemaker. This pacemaker was worn on a belt and powered by a rechargeable sealed battery, enabling users to live a more-normal life.
One of the earliest patients to receive this Lucas pacemaker device was a woman in her early 30s. The operation was carried out in 1964 by South African cardiac surgeon Alf Gunning,[72][73] a student of Christiaan Barnard. This pioneering operation took place under the guidance of cardiac consultant Peter Sleight at the Radcliffe Infirmary in Oxford and his cardiac research team at St George’s Hospital in London.[74][75]
Implantable[edit]
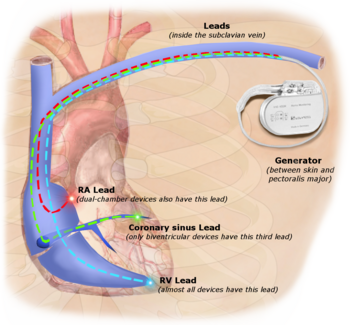
The first clinical implantation into a human of a fully implantable pacemaker was on October 8, 1958,[76] at the Karolinska Institute in Solna, Sweden, using a pacemaker designed by inventor Rune Elmqvist and surgeon Åke Senning (in collaboration with Elema-Schönander AB, later Siemens-Elema AB), connected to electrodes attached to the myocardium of the heart by thoracotomy. The device failed after three hours. A second device was then implanted which lasted for two days. The world’s first implantable pacemaker patient, Arne Larsson, went on to receive 26 different pacemakers during his lifetime. He died in 2001, at the age of 86, outliving the inventor and the surgeon.[77]
In 1959, temporary transvenous pacing was first demonstrated by Seymour Furman and John Schwedel, whereby the catheter electrode was inserted via the patient’s basilic vein.[78]
In February 1960, an improved version of the Swedish Elmqvist design was implanted by Doctors Orestes Fiandra and Roberto Rubio in the Casmu 1 Hospital of Montevideo, Uruguay. This pacemaker, the first implanted in the Americas, lasted until the patient died of other ailments, nine months later. The early Swedish-designed devices used batteries recharged by an induction coil from the outside.
Implantable pacemakers constructed by engineer Wilson Greatbatch entered use in humans from April 1960 following extensive animal testing. The Greatbatch innovation varied from the earlier Swedish devices in using primary cells (a mercury battery) as the energy source. The first patient lived for a further 18 months.
The first use of transvenous pacing in conjunction with an implanted pacemaker was by Parsonnet in the United States,[79][80][81] Lagergren in Sweden[82][83] and Jean-Jacques Welti in France[84] in 1962–63.
The transvenous, or pervenous, procedure involved incision of a vein into which was inserted the catheter electrode lead under fluoroscopic guidance, until it was lodged within the trabeculae of the right ventricle. This became the method of choice by the mid-1960s.
Cardiothoracic surgeon Leon Abrams and medical engineer Ray Lightwood developed and implanted the first patient-controlled variable-rate heart pacemaker in 1960 at the University of Birmingham. The first implant took place in March 1960, with two further implants the following month. These three patients made good recoveries and returned to a high quality of life. By 1966, 56 patients had undergone implantation with one surviving for over 5+1⁄2 years.[85][86]
Lithium battery[edit]

The preceding implantable devices all suffered from the unreliability and short lifetime of the available primary cell technology, mainly the mercury battery. In the late 1960s, several companies, including ARCO in the US, developed isotope-powered pacemakers, but this development was overtaken by the development in 1971 of the lithium iodide cell by Wilson Greatbatch.[88] Lithium-iodide or lithium anode cells became the standard for pacemaker designs.
A further impediment to the reliability of the early devices was the diffusion of water vapor from body fluids through the epoxy resin encapsulation, affecting the electronic circuitry. This phenomenon was overcome by encasing the pacemaker generator in a hermetically sealed metal case, initially by Telectronics of Australia in 1969, followed by Cardiac Pacemakers, Inc. of St. Paul, Minnesota in 1972. This technology, using titanium as the encasing metal, became the standard by the mid-1970s.
On July 9, 1974, Manuel A. Villafaña and Anthony Adducci, the founders of Cardiac Pacemakers, Inc. (Guidant), manufactured the world’s first pacemaker with a lithium anode and a lithium-iodide electrolyte solid-state battery. Lithium-iodide or lithium anode cells increased the life of pacemakers from one year to as long as eleven years, and has become the standard for pacemaker designs. They began designing and testing their implantable cardiac pacemaker powered by a new longer-life lithium battery in 1971. The first patient to receive a CPI pacemaker emerged from surgery in June 1973.[87][89]
Intra-cardial[edit]
In 2013, several firms announced devices that could be inserted via a leg catheter rather than invasive surgery. The devices are roughly the size and shape of a pill, much smaller than the size of a traditional pacemaker. Once implanted, the device’s prongs contact the muscle and stabilize heartbeats. Development of this type of device was continuing.[90] In November 2014, Bill Pike of Fairbanks, Alaska, received a Medtronic Micra pacemaker in Providence St Vincent Hospital in Portland, Oregon. D. Randolph Jones was the EP doctor. Also in 2014, St. Jude Medical Inc. announced the first enrollments in the company’s leadless Pacemaker Observational Study evaluating the Nanostim leadless pacing technology. The Nanostim pacemaker received European CE marking in 2013. Post-approval implant trials were carried out in Europe.[91] The European study was stopped after reports of six perforations that led to two patient deaths. After investigations, St Jude Medical restarted the study.[92] In the United States, this therapy had not been approved by the FDA as of 2014.[93] While the St Jude Nanostim and the Medtronic Micra are single-chamber pacemakers, it was anticipated that leadless dual-chamber pacing for patients with atrioventricular block would become possible with further development.[94]
Reusable pacemakers[edit]
Worldwide each year, in a simple procedure to avoid explosions, thousands of pacemakers are removed from bodies to be cremated. Pacemakers with significant remaining battery life are potentially life-saving devices for people in low- and middle-income countries (LMICs).[95] The Institute of Medicine, a US non-governmental organization, has reported that inadequate access to advanced cardiovascular technologies is a major contributor to cardiovascular disease morbidity and mortality in LMICs. Ever since the 1970s, multiple studies worldwide have reported on the safety and efficacy of pacemaker reuse. As of 2016, widely acceptable standards for safe pacemaker and ICD reuse had not been developed, and there continued to be legal and regulatory barriers to widespread adoption of medical device reuse.[96]
Manufacturers[edit]
Current and prior manufacturers of implantable pacemakers
- Biotronik (Germany)
- Boston Scientific (USA)
- Cardiac Pacemaker Inc. ; Guidant (USA) (now owned by Boston Scientific)
- Intermedics (USA)
- Lepu Medical (China)
- Medico (Italy)
- Medtronic (USA)
- Sorin Group (Italy) (merged with Cyberonics to form LivaNova; in 2018, LivaNova sold its cardiac rhythm management business unit to MicroPort for $190M[97] )
- St. Jude Medical (USA) (now owned by Abbott Laboratories)
- Abbott (USA)
See also[edit]
- Biological pacemaker
- Button cell
- Electrical conduction system of the heart
- Implantable cardioverter-defibrillator
- Infective endocarditis
- Pacemaker syndrome
References[edit]
- ^ «Devices@FDA». www.accessdata.fda.gov. Retrieved 2022-04-27.
- ^ Product Performance Report – Cardiac Rhythm Management (PDF) (Report). St. Jude Medical. October 2008.
- ^ «UpToDate». www.uptodate.com. Retrieved 2022-08-02.
- ^ «Pacemakers». Retrieved 28 July 2022.
- ^ «Overview of Pacemakers and Implantable Cardioverter Defibrillators (ICDs) – Health Encyclopedia – University of Rochester Medical Center». www.urmc.rochester.edu. Retrieved 2022-08-02.
- ^ «Biventricular Pacemaker». Cleveland Clinic. Retrieved 2022-08-02.
- ^ Eich C, Bleckmann A, Paul T (October 2005). «Percussion pacing in a three-year-old girl with complete heart block during cardiac catheterization». Br J Anaesth. 95 (4): 465–7. doi:10.1093/bja/aei209. PMID 16051649.
- ^ Shah, Maully; Rhodes, Larry; Kaltman, Jonathan (2017-03-20). Cardiac Pacing and Defibrillation in Pediatric and Congenital Heart Disease. John Wiley & Sons. ISBN 978-0-470-67109-2.
- ^ Valchanov, Kamen; Jones, Nicola; Hogue, Charles W. (2018-07-05). Core Topics in Cardiothoracic Critical Care. Cambridge University Press. ISBN 978-1-108-66567-4.
- ^ a b c d e «Pacemakers, Patient and Public Information Center : Heart Rhythm Society». Archived from the original on 2010-06-19.
- ^ a b «The leadless pacemaker: A new era in cardiac pacing». Hospital Healthcare Europe. Archived from the original on 2019-02-02. Retrieved 2019-02-01.
- ^ Bernstein AD, Daubert JC, Fletcher RD, Hayes DL, Lüderitz B, Reynolds DW, Schoenfeld MH, Sutton R (2002). «The revised NASPE/BPEG generic code for antibradycardia, adaptive-rate, and multisite pacing. North American Society of Pacing and Electrophysiology/British Pacing and Electrophysiology Group». Pacing Clin Electrophysiol. 25 (2): 260–4. doi:10.1046/j.1460-9592.2002.00260.x. PMID 11916002. S2CID 12887364.
- ^ Böhm A, Pintér A, Székely A, Préda I (1998). «Clinical Observations with Long-term Atrial Pacing». Pacing Clin Electrophysiol. 21 (1): 246–9. doi:10.1111/j.1540-8159.1998.tb01097.x. PMID 9474681. S2CID 23277568.
- ^ Crick JC (1991). «European Multicenter Prospective Follow-Up Study of 1,002 Implants of a Single Lead VDD Pacing System». Pacing Clin Electrophysiol. 14 (11): 1742–4. doi:10.1111/j.1540-8159.1991.tb02757.x. PMID 1749727. S2CID 698053.
- ^ Dubin, Dale (2000). Rapid Interpretation of EKG’s: An Interactive Course. Cover Publishing Company. ISBN 978-0-912912-06-6.
- ^ «UpToDate». www.uptodate.com. Retrieved 2018-09-10.
- ^ Baltazar, Romulo F. (2012-03-28). Basic and Bedside Electrocardiography. Lippincott Williams & Wilkins. ISBN 978-1-4511-4791-9.
- ^ Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L (2005). «The effect of cardiac resynchronization on morbidity and mortality in heart failure» (PDF). N. Engl. J. Med. 352 (15): 1539–49. doi:10.1056/NEJMoa050496. PMID 15753115. S2CID 13938919.
- ^ Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, Domanski M, Troutman C, Anderson J, Johnson G, McNulty SE, Clapp-Channing N, Davidson-Ray LD, Fraulo ES, Fishbein DP, Luceri RM, Ip JH (2005). «Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure». N. Engl. J. Med. 352 (3): 225–37. doi:10.1056/NEJMoa043399. PMID 15659722. S2CID 19118406.
- ^ Ganjehei L, Razavi M, Massumi A (2011). «Cardiac resynchronization therapy: a decade of experience and the dilemma of nonresponders». Texas Heart Institute Journal. 38 (4): 358–60. PMC 3147217. PMID 21841860.
- ^ Sharma, Parikshit S.; Vijayaraman, Pugazhendhi; Ellenbogen, Kenneth A. (2020). «Permanent His bundle pacing: shaping the future of physiological ventricular pacing». Nature Reviews Cardiology. 17 (1): 22–36. doi:10.1038/s41569-019-0224-z. PMID 31249403. S2CID 195698761.
- ^ «Focus on Electrophysiology: His Bundle Pacing: A More Physiologic Alternative For Pacing». American College of Cardiology. April 26, 2019.
- ^ «Anthony Francis Rickards». Heart. 90 (9): 981–2. 2004. doi:10.1136/hrt.2004.045674. PMC 1768450.
- ^ Wilkoff BL, Cook JR, Epstein AE, Greene HL, Hallstrom AP, Hsia H, Kutalek SP, Sharma A (December 2002). «Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial». JAMA. 288 (24): 3115–23. doi:10.1001/jama.288.24.3115. PMID 12495391.
- ^ a b c d e Ramsdale, David R. (2012). Cardiac pacing and device therapy. Rao, Archana. London: Springer. ISBN 978-1-4471-2939-4. OCLC 822576869.
- ^ Pena, Rafael E.; Shepard, Richard K.; Ellenbogen, Kenneth A. (December 2006). «How to make a submuscular pocket». Journal of Cardiovascular Electrophysiology. 17 (12): 1381–1383. doi:10.1111/j.1540-8167.2006.00665.x. ISSN 1540-8167. PMID 17081202. S2CID 38032736.
- ^ Beinart, R; Nazarian, S (24 December 2013). «Effects of external electrical and magnetic fields on pacemakers and defibrillators: from engineering principles to clinical practice». Circulation. 128 (25): 2799–809. doi:10.1161/CIRCULATIONAHA.113.005697. PMC 3908865. PMID 24366589.
- ^ Marco D, Eisinger G, Hayes DL (November 1992). «Testing of work environments for electromagnetic interference». Pacing Clin Electrophysiol. 15 (11 Pt 2): 2016–22. doi:10.1111/j.1540-8159.1992.tb03013.x. PMID 1279591. S2CID 24234010.
- ^ Maass, A. H.; Hemels, M. E. W.; Allaart, C. P. (7 November 2018). «Magnetic resonance imaging in patients with cardiac implantable electronic devices». Netherlands Heart Journal. 26 (12): 584–590. doi:10.1007/s12471-018-1192-3. ISSN 1568-5888. PMC 6288036. PMID 30406601.
- ^ «Revo MRI SureScan Pacing System — P090013». U.S. Food and Drug Administration — Medical Device Approvals and Clearances. 24 February 2011. Archived from the original on 20 October 2012.
- ^ «Terminology». Magnetic Resonance Safety Testing Services. Archived from the original on 11 October 2013. Retrieved 13 February 2023.
- ^ Husten, Larry. «FDA Approves Second Generation MRI-Friendly Pacemaker System From Medtronic». Forbes, 2013-02-13.
- ^ «For physicians: V: Select and save MRI settings; VII: Disable MRI settings» (PDF). MRI-Ready Systems Manual — MRI Procedure Information for the MR Conditional System (Report). St. Jude Medical. 2016.
- ^ Ferreira, António M; Costa, Francisco; Tralhão, António; Marques, Hugo; Cardim, Nuno; Adragão, Pedro (7 May 2014). «MRI-conditional pacemakers: current perspectives». Medical Devices: Evidence and Research. 7: 115–124. doi:10.2147/MDER.S44063. PMC 4019608. PMID 24851058.
- ^ «MP3 Headphones Interfere With Implantable Defibrillators, Pacemakers – Beth Israel Deaconess Medical Center». www.bidmc.org. Retrieved 2008-11-10.
- ^ «What is a pacemaker?». HRMReview. Archived from the original on 22 May 2014. Retrieved 22 May 2014.
- ^ Irnich, Werner; Bernstein, Alan D. (23 March 2006). «Do induction cooktops interfere with cardiac pacemakers?». EP Europace. 8 (5): 377–384. doi:10.1093/europace/eul014. ISSN 1532-2092. PMID 16635999.
- ^ Baddour, Larry M.; Epstein, Andrew E.; Erickson, Christopher C.; Knight, Bradley P.; Levison, Matthew E.; Lockhart, Peter B.; Masoudi, Frederick A.; Okum, Eric J.; Wilson, Walter R.; Beerman, Lee B.; Bolger, Ann F.; Estes, N.A. Mark; Gewitz, Michael; Newburger, Jane W.; Schron, Eleanor B.; Taubert, Kathryn A. (26 January 2010). «Update on Cardiovascular Implantable Electronic Device Infections and Their Management». Circulation. 121 (3): 458–477. doi:10.1161/circulationaha.109.192665. PMID 20048212.
- ^ «Heart devices can be turned off near end of life». amednews.com. May 31, 2010.
- ^ «End of Life and Heart Rhythm Devices». Heart Rhythm Society. 2014.
- ^ Butler, Katy (18 June 2010). «What Broke My Father’s Heart». The New York Times.
- ^ a b Halperin, Daniel; Thomas S. Heydt-Benjamin; Benjamin Ransford; Shane S. Clark; Benessa Defend; Will Morgan; Kevin Fu; Tadayoshi Kohno; William H. Maisel (May 2008). Pacemakers and Implantable Cardiac Defibrillators: Software Radio Attacks and Zero-Power Defenses (PDF). IEEE Symposium on Security and Privacy. Retrieved 2008-08-10.
- ^ «Researchers Develop Personal Firewall Solution for Pacemakers, Insulin Pumps». eSecurityPlanet.com. 2012-04-20. Retrieved 2012-04-20.
- ^ «UOTW #15 – Ultrasound of the Week». Ultrasound of the Week. 26 August 2014. Retrieved 27 May 2017.
- ^ «Risks – Pacemaker – Mayo Clinic». www.mayoclinic.org. Retrieved 2016-12-01.
- ^ a b Pacemaker-Mediated Tachycardia at eMedicine
- ^ «Pacemaker Mediated Tachycardia – an overview | ScienceDirect Topics». www.sciencedirect.com. Retrieved 2022-09-16.
- ^ Kamalvand, Kayvan; Tan, Kim; Kotsakis, Athanasios; Bucknall, Cliff; Sulke, Neil (1997-08-01). «Is Mode Switching Beneficial? A Randomized Study in Patients With Paroxysmal Atrial Tachyarrhythmias». Journal of the American College of Cardiology. 30 (2): 496–504. doi:10.1016/S0735-1097(97)00162-9. ISSN 0735-1097. PMID 9247524. S2CID 23092273.
- ^ Noheria, Amit; DeSimone, Christopher V.; Asirvatham, Samuel J. (November 2018). «Cardiac Implantable Electronic Device Lead Thrombus as a Nidus for Pulmonary and Systemic Embolization». JACC: Clinical Electrophysiology. 4 (11): 1437–1439. doi:10.1016/j.jacep.2018.08.019.
- ^ Santomauro, M.; Costanzo, A.; Ottaviano, L.; Cresta, R.; Minichiello, S.; Prastaro, M.; Chiariello, M. (2000). Raviele, Antonio (ed.). «Pacemaker/ICD Patients: To Anticoagulate or Not To Anticoagulate?». Cardiac Arrhythmias 1999. Milano: Springer Milan: 494–500. doi:10.1007/978-88-470-2139-6_66. ISBN 978-88-470-2139-6.
- ^ Lin, Grace; Nishimura, Rick A.; Connolly, Heidi M.; Dearani, Joseph A.; Sundt, Thoralf M.; Hayes, David L. (2005-05-17). «Severe Symptomatic Tricuspid Valve Regurgitation Due to Permanent Pacemaker or Implantable Cardioverter-Defibrillator Leads». Journal of the American College of Cardiology. 45 (10): 1672–1675. doi:10.1016/j.jacc.2005.02.037. ISSN 0735-1097.
- ^ Transvenous Lead Extraction: Heart Rhythm Society Expert Consensus on Facilities, Training, Indications, and Patient Management Archived 2014-12-12 at the Wayback Machine Author: Bruce L. Wilkoff. Coauthor(s): Charles J. Love, Charles L. Byrd, Maria Grazia Bongiorni, Roger G. Carrillo, George H. Crossley III, Laurence M. Epstein, Richard A. Friedman, Charles E. H. Kennergren, Przemyslaw Mitkowski, Raymond H. M. Schaerf, Oussama M. Wazni
- ^ «What is Laser-Assisted Lead Extraction? | DFW». HeartPlace. Retrieved 2022-09-16.
- ^ Gaca, Jeffrey G.; Lima, Brian; Milano, Carmelo A.; Lin, Shu S.; Davis, R. Duane; Lowe, James E.; Smith, Peter K. (May 2, 2009). «Laser-assisted extraction of pacemaker and defibrillator leads: the role of the cardiac surgeon». The Annals of Thoracic Surgery (published May 2009). 87 (5): 1446–1450, discussion 1450–1451. doi:10.1016/j.athoracsur.2009.02.015. ISSN 1552-6259. PMID 19379883.
- ^ Kalavakunta, Jagadeesh Kumar; Gupta, Vishal; Paulus, Basil; Lapenna, William (2014). «An Unusual Cause of Transient Ischemic Attack in a Patient with Pacemaker». Case Reports in Cardiology. 2014: 265759. doi:10.1155/2014/265759. PMC 4008350. PMID 24826308.
- ^ Brunner, M (January 2004). «Long-term survival after pacemaker implantation Prognostic importance of gender and baseline patient characteristics». European Heart Journal. 25 (1): 88–95. doi:10.1016/j.ehj.2003.10.022. PMID 14683747.
- ^ a b Bernstein AD, Camm AJ, Fisher JD, Fletcher RD, Mead RH, Nathan AW, Parsonnet V, Rickards AF, Smyth NP, Sutton R (1993). «North American Society of Pacing and Electrophysiology policy statement. NASPE/BPEG defibrillator code». Pacing Clin Electrophysiol. 16 (9): 1776–80. doi:10.1111/j.1540-8159.1993.tb01809.x. PMID 7692407. S2CID 72106633.
- ^ McWilliam JA (1889). «Electrical stimulation of the heart in man». Br Med J. 1 (1468): 348–50. doi:10.1136/bmj.1.1468.348. PMC 2154721. PMID 20752595.
- ^ Shah, Maully; Rhodes, Larry; Kaltman, Jonathan (2017-03-20). Cardiac Pacing and Defibrillation in Pediatric and Congenital Heart Disease. John Wiley & Sons. ISBN 978-0-470-67109-2.
- ^ Lidwell M C, «Cardiac Disease in Relation to Anaesthesia» in Transactions of the Third Session, Australasian Medical Congress, Sydney, Australia, Sept. 2–7, 1929, p. 160.
- ^ a b Mond HG, Sloman JG, Edwards RH (1982). «The first pacemaker». Pacing and Clinical Electrophysiology. 5 (2): 278–82. doi:10.1111/j.1540-8159.1982.tb02226.x. PMID 6176970. S2CID 22049678.
- ^ Aquilina, O (2006). «A brief history of cardiac pacing». Images in Paediatric Cardiology. 8 (2): 17–81. PMC 3232561. PMID 22368662.
- ^ Furman S, Szarka G, Layvand D (2005). «Reconstruction of Hyman’s second pacemaker». Pacing Clin Electrophysiol. 28 (5): 446–53. doi:10.1111/j.1540-8159.2005.09542.x. PMID 15869680. S2CID 29138993.
- ^ Kidder, David S.; Oppenheim, Noah D.; Young, Bruce K. (2009-10-13). The Intellectual Devotional: Health: Revive Your Mind, Complete Your Education, and Digest a Daily Dose of Wellness Wisdom. Harmony/Rodale. ISBN 978-1-60529-330-1.
- ^ «John Alexander Hopps fonds». Archival description. Library and Archives Canada. 2008-03-19. Archived from the original on 2020-07-28. Retrieved 16 Sep 2016.
- ^ «IEEE Milestone in Electrical Engineering and Computing». Archived from the original on February 25, 2021. Retrieved September 5, 2009.
- ^ Silva, Regis A. de (2013-01-24). Heart Disease. ABC-CLIO. ISBN 978-0-313-37607-8.
- ^ «Paul Maurice Zoll». Harvard Gazette. 19 April 2001.
- ^ Weirich WL, Gott VL, Lillehei CW (1957). «The treatment of complete heart block by the combined use of a myocardial electrode and an artificial pacemaker». Surg Forum. 8: 360–3. PMID 13529629.
- ^ Reynolds, Jorge (March 1988). «The Early History of Cardiac Pacing in Colombia». Pacing and Clinical Electrophysiology. 11 (3): 355–361. doi:10.1111/j.1540-8159.1988.tb05018.x. PMID 2452427. S2CID 20374411.
- ^ Jeffrey, Kirk; Parsonnet, Victor (19 May 1998). «Cardiac Pacing, 1960–1985». Circulation: An American Heart Association Journal. 97 (19): 1978–1991. doi:10.1161/01.CIR.97.19.1978. PMID 9609092.
- ^ «Gunning, Alfred James – Biographical entry – Plarr’s Lives of the Fellows Online». Livesonline.rcseng.ac.uk. Retrieved 2013-12-29.
- ^ «Our history». Nuffield Department of Surgical Sciences. University of Oxford. Retrieved 26 October 2020.
- ^ «British Cardiovascular Society». Bcs.com. Archived from the original on 2013-12-12. Retrieved 2013-12-29.
- ^ Record, C O; Sleight, P; Gunning, A J; Kenworthy-Browne, J M; Richings, M (1 November 1971). «Treatment of chronic heart block with the Lucas induction coil pacemaker». Heart. 33 (6): 938–942. doi:10.1136/hrt.33.6.938. PMC 458452. PMID 5120241.
- ^ Tesler, Ugo Filippo. A History of Cardiac Surgery: An Adventurous Voyage from Antiquity to the Artificial Heart (Cambridge Scholars Publishing, 2020) p.151
- ^ Altman, Lawrence (18 Jan 2002). «Arne H. W. Larsson, 86; Had First Internal Pacemaker». New York Times. Retrieved 3 March 2014.
- ^ Furman S, Schwedel JB (1959). «An intracardiac pacemaker for Stokes-Adams seizures». N. Engl. J. Med. 261 (5): 943–8. doi:10.1056/NEJM195911052611904. PMID 13825713.
- ^ Parsonnet V (1978). «Permanent transvenous pacing in 1962». Pacing Clin Electrophysiol. 1 (2): 265–8. doi:10.1111/j.1540-8159.1978.tb03472.x. PMID 83641. S2CID 12263609.
- ^ Parsonnet V, Zucker IR, Asa MM (1962). «Preliminary Investigation of the Development of a Permanent Implantable Pacemaker Using an Intracardiac Dipolar Electrode». Clin. Res. 10: 391.
- ^ Parsonnet V, Zucker IR, Gilbert L, Asa M (1962). «An intracardiac bipolar electrode for interim treatment of complete heart block». Am. J. Cardiol. 10 (2): 261–5. doi:10.1016/0002-9149(62)90305-3. PMID 14484083.
- ^ Lagergren H (1978). «How it happened: my recollection of early pacing». Pacing Clin Electrophysiol. 1 (1): 140–3. doi:10.1111/j.1540-8159.1978.tb03451.x. PMID 83610. S2CID 9118036.
- ^ Lagergren H, Johansson L (1963). «Intracardiac stimulation for complete heart block». Acta Chirurgica Scandinavica. 125: 562–566. PMID 13928055.
- ^ Jean Jacques Welti:Biography, Heart Rhythm Foundation[full citation needed]
- ^ Blue Plaque Guide
- ^ «University of Birmingham». bhamalumni.org. Archived from the original on 2014-10-06.
- ^ a b US 3822707, Adducci, Anthony J. & Schwalm, Arthur W., «Metal-enclosed cardiac pacer with solid-state power source», published 1974-07-09, issued 1972-04-17, assigned to Cardiac Pacemekers Inc.
- ^ «The History of Nuclear Powered Pacemakers». large.stanford.edu. Retrieved 2023-04-18.
- ^ «Pioneers of the Medical Device Industry». Minnesota Historical Society.
- ^ «Medtronic’s Minimally Invasive Pacemaker the Size of a Multivitamin». Singularity Hub. 2013-12-27. Retrieved 2013-12-29.
- ^ «European Post-Approval Trial for Nanostim». DAIC. 2014-03-18. Retrieved 2015-05-04.
- ^ «First-in-Human Data». Medscape. Retrieved 2014-06-19.
- ^ «Leadless Pacing from St. Jude Medical». Archived from the original on 2014-10-29.
- ^ Stiles, Steve (24 March 2014). «New Data on Leadless Pacemaker Supports Efficacy, Safety». Medscape.
- ^ Mazumdar, Tulip (2013-11-19). «British charity calls for re-use of pacemakers abroad». BBC News. Retrieved 2018-07-31.
- ^ Crawford, TC; Eagle, KA (2017). «Reuse of cardiac implantable electronic devices to improve and extend lives: a call to action». Heart Asia. 9 (1): 34–35. doi:10.1136/heartasia-2016-010835. PMC 5278341. PMID 28191825.
- ^ «LivaNova closes $190 CRM sale to MicroPort». Mass Device. 30 April 2018.
External links[edit]
- Detecting and Distinguishing Cardiac Pacing Artifacts
- Implantable Cardioverter Defibrillator from National Heart, Lung and Blood Institute
- Current indications for CRT-P and CRT-D: Webinar from the European Heart Rhythm Association (EHRA)