Торговое название:
- Катафлам
- Cataflam
Состав:
Каждая покрытая оболочкой таблетка содержит:
Диклофенак калия – 50 мг.
Вспомогательные компоненты:
Cтеарат магния, повидон, коллоидный кремний безводный, крахмал гликолята натрия, кукурузный крахмал, фосфат кальция, микрокристаллическая целлюлоза, полиэтилен гликоль 8000, оксид железа красный, диоксид титана, тальк, сахароза.
Свойства:
Диклофенак калия принадлежит к нестероидным средствам с выраженными противоревматическими, обезболивающими, противовоспалительными и жаропонижающими свойствами.
Показания:
- Остеоартроз, боль в пояснице, острые мышечно-скелетные расстройства и травмы, бурсит, растяжение связок, деформации и вывихи, облегчение боли при переломах, анкилозирующий спондилит, острая подагра, ревматоидный артрит, приступы мигрени.
- Болезненные и/или воспалительные состояния в гинекологии, например, первичная дисменорея или аднексит.
- Контроль боли и воспаления при ортопедических, стоматологических и других незначительных операциях.
- Кратковременное лечение лихорадки, связанной с инфекциями уха, горла или носа (ЛОР), например, фаринготонзиллит, средний отит.
Способ применения:
Для приема внутрь, таблетки следует проглатывать целиком с жидкостью, с едой или после еды. Используется самая низкая эффективная доза для контроля симптомов: рекомендуемая суточная доза 100–150 мг в 2 или 3 разделенных дозах. В более легких случаях достаточно 75–100 мг в день в 2 или 3 разделенных дозах. При первичной дисменорее суточная доза обычно: 50 – 150 мг. Начальной дозы 50 мг обычно достаточно. При необходимости можно назначить начальную дозу 100 мг с максимумом 200 мг/день, достигнутым в течение нескольких менструальных циклов. Лечение должно начинаться при появлении первых симптомов и продолжаться несколько дней. При мигрени начальная доза 50 мг – при первых признаках приступа. Если облегчение не наступает через 2 часа после первой дозы, может быть принята дополнительная доза 50 мг. При необходимости можно принимать дополнительные дозы 50 мг с интервалами в 4-6 часов, не превышая общую дозу 200 мг в день.
Для подростков в возрасте от 14 лет и старше обычно достаточна суточная доза от 75 до 100 мг разделенная на 2-3 приема. Максимальная суточная доза не должна превышать 150 мг.
Противопоказания:
- Детям до 14 лет;
- повышенная чувствительность к любому компоненту препарата, аспирину;
- тяжелая сердечная, печеночная, почечная недостаточность;
- брадикардия, выраженная артериальная гипотензия;
- желудочные кровотечения;
- период беременности, лактация.
Меры предосторожности:
При развитии печеночных заболеваний прием препарата следует прекратить. Пациентам с расстройствами работы сердца и сосудов во время терапии нужно находиться под контролем врача. Слабым и пожилым пациентам, больным с небольшой массой тела следует применять минимальные терапевтически эффективные дозы. Перед назначением лекарства нужно пройти клиническое обследование пациентам с пептическими язвами; с кишечными кровотечениями в анамнезе; с поражением печени и почек, в т. ч. и в анамнезе; с повышенным АД. При астме, сенной лихорадке, острых и хронических респираторных патологиях, у пациентов с полипами в носу прием препарата может вызывать астматические приступы. Лечение указанных состояний симптоматическое.
Побочные эффекты:
Головные боли, головокружение; вертиго; тахи-/брадикардия, артериальная гипертензия, аритмия, сердечная недостаточность; болезненные ощущения в области живота, рвота, спазмы, метеоризм, тошнота, диарея, диспепсия; задержка жидкости в организме, отеки; сыпь, отек Квинке.
Хранение:
Хранить в недоступном для детей месте.
Упаковка:
Картонная коробка содержит два блистера по 10 таблеток, бумажную инструкцию.
Generic name: diclofenac [ dye-KLOE-fen-ak ]
Drug class: Nonsteroidal anti-inflammatory drugs
What is Cataflam?
Cataflam is a nonsteroidal anti-inflammatory drug (NSAID). Diclofenac works by reducing substances in the body that cause pain and inflammation.
Cataflam is used to treat mild to moderate pain, or signs and symptoms of osteoarthritis or rheumatoid arthritis.
Cataflam is also used to treat menstrual cramps.
Warnings
Cataflam can increase your risk of fatal heart attack or stroke, especially if you use it long term or take high doses, or if you have heart disease. Even people without heart disease or risk factors could have a stroke or heart attack while taking this medicine. Do not use diclofenac just before or after heart bypass surgery (coronary artery bypass graft, or CABG).
Cataflam may also cause stomach or intestinal bleeding, which can be fatal. These conditions can occur without warning while you are using Cataflam, especially in older adults.
Before taking this medicine
You should not use Cataflam if you are allergic to diclofenac, or if you have ever had an asthma attack or severe allergic reaction after taking aspirin or an NSAID.
Diclofenac can increase your risk of fatal heart attack or stroke, even if you don’t have any risk factors. Do not use this medicine just before or after heart bypass surgery (coronary artery bypass graft, or CABG).
To make sure Cataflam is safe for you, tell your doctor if you have:
-
heart disease, high blood pressure;
-
ulcers or bleeding in your stomach;
-
asthma;
-
liver or kidney disease; or
-
if you smoke.
Taking diclofenac during the last 3 months of pregnancy may harm the unborn baby. Tell your doctor if you are pregnant or plan to become pregnant.
It may not be safe to breastfeed while using this medicine. Ask your doctor about any risk.
Cataflam is not approved for use by anyone younger than 18 years old.
How should I take Cataflam?
Take Cataflam exactly as directed on the label, or as prescribed by your doctor. Follow the directions on the label and read all medication guides. Your doctor may occasionally change your dose. Do not take this medicine in larger amounts or for longer than recommended. Use the lowest dose that is effective in treating your condition.
For treatment of pain or primary dysmenorrhea the recommended dosage of Cataflam is 50 mg three times daily. In some patients an initial dose of 100 mg of Cataflam, followed by 50 mg doses, may provide better relief.
For the relief of osteoarthritis the recommended dosage is 100-150 mg/day in divided doses, i.e. 50 mg two or three times a day.
For the relief of rheumatoid arthritis the recommended dosage is 150-200 mg/day in divided doses, i.e. 50 mg three or four times a day.
Different formulations of diclofenac, Voltaren (diclofenac sodium tablets) and Cataflam (diclofenac potassium immediate-release tablets) are not necessarily equivalent in strength even if the milligram strength is the same.
If you use Cataflam long-term, you may need frequent medical tests.
Store at room temperature away from moisture and heat. Keep the bottle tightly closed when not in use.
What happens if I miss a dose?
Take the missed dose as soon as you remember. Skip the missed dose if it is almost time for your next scheduled dose. Do not take extra medicine to make up the missed dose.
What happens if I overdose?
Seek emergency medical attention or call the Poison Help line at 1-800-222-1222.
What to avoid
Avoid drinking alcohol. It may increase your risk of stomach bleeding.
Avoid taking aspirin or other NSAIDs unless your doctor tells you to.
Ask a doctor or pharmacist before using other medicines for pain, fever, swelling, or cold/flu symptoms. They may contain ingredients similar to diclofenac (such as aspirin, ibuprofen, ketoprofen, or naproxen).
Cataflam side effects
Get emergency medical help if you have signs of an allergic reaction to Cataflam (hives, difficult breathing, swelling in your face or throat) or a severe skin reaction (fever, sore throat, burning eyes, skin pain, red or purple skin rash with blistering and peeling).
Stop using Cataflam and seek medical treatment if you have a serious drug reaction that can affect many parts of your body. Symptoms may include skin rash, fever, swollen glands, muscle aches, severe weakness, unusual bruising, or yellowing of your skin or eyes.
Get emergency medical help if you have signs of a heart attack or stroke: chest pain spreading to your jaw or shoulder, sudden numbness or weakness on one side of the body, slurred speech, feeling short of breath.
Stop using Cataflam and call your doctor at once if you have:
-
the first sign of any skin rash, no matter how mild;
-
flu-like symptoms;
-
heart problems — swelling, rapid weight gain, feeling short of breath;
-
kidney problems — little or no urinating, painful or difficult urination, swelling in your arms or legs, feeling tired or short of breath;
-
liver problems — nausea, diarrhea, stomach pain (upper right side), tiredness, itching, dark urine, jaundice (yellowing of the skin or eyes); or
-
signs of stomach bleeding — bloody or tarry stools, coughing up blood or vomit that looks like coffee grounds.
Common Cataflam side effects may include:
-
indigestion, gas, nausea, vomiting, stomach pain;
-
diarrhea, constipation;
-
headache, dizziness, drowsiness;
-
abnormal lab tests;
-
itching, sweating;
-
stuffy nose;
-
increased blood pressure; or
-
swelling or pain in your arms or legs.
This is not a complete list of side effects and others may occur. Call your doctor for medical advice about side effects. You may report side effects to FDA at 1-800-FDA-1088.
What other drugs will affect Cataflam?
Ask your doctor before using Cataflam if you take an antidepressant. Taking certain antidepressants with an NSAID may cause you to bruise or bleed easily.
Tell your doctor about all your other medicines, especially:
-
heart or blood pressure medication, including a diuretic or «water pill»;
-
other forms of diclofenac (Arthrotec, Flector, Pennsaid, Solaraze, Voltaren Gel);
-
a blood thinner — warfarin, Coumadin, Jantoven; or
-
other NSAIDs — aspirin, ibuprofen (Advil, Motrin), naproxen (Aleve), celecoxib (Celebrex), indomethacin, meloxicam, and others.
This list is not complete. Other drugs may interact with diclofenac, including prescription and over-the-counter medicines, vitamins, and herbal products. Not all possible drug interactions are listed here.
Popular FAQ
There is no known drug interaction between methocarbamol and non-steroidal anti-inflammatory drugs (NSAIDs) such as diclofenac. You may take methocarbamol and diclofenac together. Because it may cause drowsiness or dizziness, methocarbamol interacts with other drugs that have similar effects, such as alcohol and drugs that treat sleep disorders.
Common antidepressants used for orthopedic pain relief may include SSRIs like fluoxetine (Prozac), paroxetine (Paxil), and sertraline (Zoloft), SNRIs such as duloxetine (Cymbalta), or tricyclic antidepressants (TCAs) like amitriptyline (Elavil) or nortriptyline (Pamelor). Continue reading
You need to be careful when taking ibuprofen with blood pressure medicines because the combination can also cause serious damage to your kidneys, particularly if you are also taking a diuretic (water pill). In addition, ibuprofen can reduce the blood pressure lowering effect of your blood pressure medication. People who take blood pressure medications called ACE inhibitors or ARBs and diuretics have an increased risk of kidney damage, which can be compounded by also taking an NSAID, such as ibuprofen, particularly in high doses. Continue reading
More FAQ
- Which painkiller should you use?
- Why is diclofenac prescription only but ibuprofen is OTC?
- Can NSAIDs be used to treat a COVID-19 fever?
- Does the drug diclofenac have narcotics in it?
Further information
Remember, keep this and all other medicines out of the reach of children, never share your medicines with others, and use Cataflam only for the indication prescribed..
Always consult your healthcare provider to ensure the information displayed on this page applies to your personal circumstances.
Medical Disclaimer
Copyright 1996-2023 Cerner Multum, Inc. Version: 19.01.
Торговое название:
Катафлам
Cataflam
Состав:
Каждая покрытая оболочкой таблетка содержит:
Диклофенак калия – 50 мг.
Вспомогательные компоненты: стеарат магния, повидон, коллоидный кремний безводный, крахмал гликолята натрия, кукурузный крахмал, фосфат кальция, микрокристаллическая целлюлоза, полиэтилен гликоль 8000, оксид железа красный, диоксид титана, тальк, сахароза.
Свойства:
Диклофенак калия принадлежит к нестероидным средствам с выраженными противоревматическими, обезболивающими, противовоспалительными и жаропонижающими свойствами.
Показания:
Остеоартроз, боль в пояснице, острые мышечно-скелетные расстройства и травмы, бурсит, растяжение связок, деформации и вывихи, облегчение боли при переломах, анкилозирующий спондилит, острая подагра, ревматоидный артрит, приступы мигрени. Болезненные и/или воспалительные состояния в гинекологии, например, первичная дисменорея или аднексит. Контроль боли и воспаления при ортопедических, стоматологических и других незначительных операциях. Кратковременное лечение лихорадки, связанной с инфекциями уха, горла или носа (ЛОР), например, фаринготонзиллит, средний отит.
Способ применения:
Для приема внутрь, таблетки следует проглатывать целиком с жидкостью, с едой или после еды. Используется самая низкая эффективная доза для контроля симптомов: рекомендуемая суточная доза 100–150 мг в 2 или 3 разделенных дозах. В более легких случаях достаточно 75–100 мг в день в 2 или 3 разделенных дозах. При первичной дисменорее суточная доза обычно: 50 – 150 мг. Начальной дозы 50 мг обычно достаточно. При необходимости можно назначить начальную дозу 100 мг с максимумом 200 мг/день, достигнутым в течение нескольких менструальных циклов. Лечение должно начинаться при появлении первых симптомов и продолжаться несколько дней. При мигрени начальная доза 50 мг — при первых признаках приступа. Если облегчение не наступает через 2 часа после первой дозы, может быть принята дополнительная доза 50 мг. При необходимости можно принимать дополнительные дозы 50 мг с интервалами в 4-6 часов, не превышая общую дозу 200 мг в день.
Для подростков в возрасте от 14 лет и старше обычно достаточна суточная доза от 75 до 100 мг разделенная на 2-3 приема. Максимальная суточная доза не должна превышать 150 мг.
Противопоказания:
Детям до 14 лет; повышенная чувствительность к любому компоненту препарата, аспирину; тяжелая сердечная, печеночная, почечная недостаточность; брадикардия, выраженная артериальная гипотензия; желудочные кровотечения; период беременности, лактация.
Меры предосторожности:
При развитии печеночных заболеваний прием препарата следует прекратить. Пациентам с расстройствами работы сердца и сосудов во время терапии нужно находиться под контролем врача. Слабым и пожилым пациентам, больным с небольшой массой тела следует применять минимальные терапевтически эффективные дозы. Перед назначением лекарства нужно пройти клиническое обследование пациентам с пептическими язвами; с кишечными кровотечениями в анамнезе; с поражением печени и почек, в т. ч. и в анамнезе; с повышенным АД. При астме, сенной лихорадке, острых и хронических респираторных патологиях, у пациентов с полипами в носу прием препарата может вызывать астматические приступы. Лечение указанных состояний симптоматическое.
Побочные эффекты:
Головные боли, головокружение; вертиго; тахи-/брадикардия, артериальная гипертензия, аритмия, сердечная недостаточность; болезненные ощущения в области живота, рвота, спазмы, метеоризм, тошнота, диарея, диспепсия; задержка жидкости в организме, отеки; сыпь, отек Квинке.
Хранение:
Хранить в недоступном для детей месте.
Упаковка:
Картонная коробка содержит два блистера по 10 таблеток, бумажную инструкцию.
1 саше содержит 50 мг диклофенака калия, а также вспомогательные вещества: калия гидрокарбонат, маннитол (Е421) 721 мг, аспартам (Е951), натрия сахаринат (Е954), глицерина дибегенат, мятный ароматизатор, анисовый ароматизатор.
Нестероидные противовоспалительные и противоревматические средства.
Код ATX: М01А В05.
Фармакологические свойства
Катафаст содержит калиевую соль диклофенака, вещество нестероидной структуры, оказывающее выраженное анальгетическое, противовоспалительное и жаропонижающее действие.
Катафаст характеризуется быстрым началом действия, в связи с чем он особенно показан при лечении острых болевых и воспалительных синдромов. Основным механизмом действия диклофенака, установленным в условиях эксперимента, считается торможение биосинтеза простагландинов, которые играют важную роль в генезе воспаления, боли и лихорадки.
In vitro диклофенак калия в концентрациях, эквивалентным тем, которые достигаются при лечении пациентов, не подавляет биосинтез протеогликанов хрящевой ткани.
Фармакодинамика
Установлено, что Катафаст оказывает сильное анальгетическое действие при умеренно выраженном и тяжелом болевом синдроме. При наличии воспаления, вызванного, например, травмой или хирургическим вмешательством, препарат быстро устраняет как спонтанную боль, так и боль при движениях, а также уменьшает воспалительную отечность тканей и отек в области хирургической раны.
Проведенные клинические исследования позволили установить, что диклофенак калия способен устранять болевые ощущения и снижать выраженность кровопотери при первичной дисменорее. При приступах мигрени Катафаст уменьшает выраженность головной боли и таких сопутствующих симптомов как тошнота и рвота.
Фармакокинетика
Всасывание. Диклофенак быстро и полностью всасывается. Всасывание активного вещества начинается немедленно после приема препарата. После однократного приема внутрь содержимого саше, содержащего 50 мг диклофенака калия, его максимальная концентрация в плазме крови достигается через 5-20 минут и составляет 5,5 мкмоль/л.
При приеме препарата во время еды количество всасывающегося диклофенака не изменяется, хотя начало и скорость всасывания могут несколько замедляться.
Степень всасывания находится в линейной зависимости от величины дозы препарата.
После повторного приема показатели фармакокинетики не изменяются. Поэтому, если соблюдаются рекомендуемые интервалы между приемами отдельных доз препарата, кумуляции не отмечается.
Распределение. Связывание диклофенака с белками сыворотки крови составляет 99,7%, при этом с альбумином связывается 99,4% препарата. Объем распределения составляет 0,12- ОД 7 л/кг.
Диклофенак проникает в синовиальную жидкость, где его максимальная концентрация достигается на 2-4 часа позже, чем в плазме крови. Период полувыведения из синовиальной жидкости составляет 3-6 часов. Спустя 2 часа после достижения максимальных концентраций в плазме концентрация диклофенака в синовиальной жидкости остается более высокой; эта закономерность сохраняется в течение 12 часов.
Диклофенак определялся в низкой концентрации (100 нг/л) в грудном молоке у одной кормящей матери. Это эквивалентно 0,03 мг/кг/суточной дозы, которая попадает в грудное молоко.
Метаболизм. Диклофенак метаболизируется частично путем глюкуронизации неизмененной молекулы, но, главным образом, посредством однократного и множественного гидроксилирования и метоксилирования, что приводит к образованию нескольких фенольных метаболитов (3′-гидрокси-, 4′-гидрокси-, 5′-гидрокси-, 4′,5-дигидрокси- и 3′-гидрокси-4′-метоксидиклофенак), большая часть которых образует конъюгаты с глюкуроновой кислотой. Два из этих фенольных метаболитов биологически активны, но в значительно меньшей степени, чем диклофенак.
Выведение. Общий системный клиренс диклофенака составляет 263 ±56 мл/мин. Конечный период полужизни в плазме крови составляет 1-2 часа. Период полужизни в плазме крови 4-х метаболитов, включая два активных, также непродолжителен и составляет 1 -3 часа. Один из метаболитов, 3′-гидрокси-4′-метоксидиклофенак, имеет более длительный период полужизни в плазме, однако он полностью неактивен.
Около 60% от принятой дозы препарата выводится с мочой в виде конъюгатов неизмененного активного вещества с глюкуроновой кислотой, а также в виде метаболитов, большая часть из которых также превращается в глюкуроновые конъюгаты. В неизмененном виде экскретируется менее 1% диклофенака. Оставшаяся часть принятой дозы препарата выводится в виде метаболитов через желчь, с калом.
Фармакокинетика у отдельных групп пациентов
Влияния возраста пациента на всасывание, метаболизм и выведение препарата, принятого внутрь, не отмечено.
У пациентов с нарушением функции почек, получавших терапевтические дозы, не было выявлено накопления неизмененного активного вещества. У больных с клиренсом креатинина менее 10 мл/мин расчетные равновесные концентрации гидроксилированных метаболитов в плазме были примерно в 4 раза выше, чем у здоровых лиц. Однако, в конечном итоге, все метаболиты выводятся с желчью.
У пациентов с хроническим гепатитом или компенсированным циррозом печени показатели фармакокинетики и метаболизм диклофенака аналогичны таковым у пациентов без заболеваний печени.
Краткосрочное лечение (максимум 3 дня) следующих острых состояний:
посттравматическая боль, воспаление и отек, например, вследствие растяжений;
послеоперационная боль, воспаление и отек, например, после стоматологических вмешательств, хирургических или ортопедических операций;
боль и/или воспаление, сопровождающие воспалительные гинекологические заболевания, например, первичную дисменорею или аднексит;
приступы мигрени;
болевой синдром при патологии позвоночного столба;
внесуставной ревматизм;
в качестве вспомогательного средства при инфекциях уха, горла и носа, например, при фаринготонзиллите, отите, сопровождающихся выраженной болью и воспалением.
В соответствии с общепринятыми подходами к лечению инфекционно-воспалительных заболеваний необходимо также применять этиотропные средства. Изолированное повышение температуры не является показанием к применению препарата.
Дозу следует подбирать индивидуально. Побочные явления могут быть минимизированы при использовании минимальной эффективной дозы в течение минимального периода, необходимого для контроля над симптомами (см. Меры предосторожности).
Для взрослых рекомендуемая начальная доза препарата составляет 100-150 мг в день. В случае умеренной выраженности симптомов, обычно бывает достаточно применения 50-100 мг препарата в день. Суточную дозу следует делить на 2-3 приема.
При первичной дисменорее суточная доза должна быть подобрана индивидуально; обычно она составляет 1-3 саше. Начальная доза составляет 1-2 саше.
При мигрени начальная доза 50 мг должна быть принята при первых симптомах надвигающегося приступа. В случаях, когда в пределах 2 часов после приема первой дозы достаточное облегчение боли не наступает, можно принять последующую дозу 50 мг. Если необходимо, последующие дозы по 50 мг можно принимать с интервалами 6-8 часов, не превышая общую дозу 150 мг в сутки.
Содержимое пакетика следует растворить в стакане негазированной воды. Раствор может оставаться несколько мутным, но это не должно влиять на эффективность препарата. Раствор следует принимать предпочтительно перед приемом пищи.
Применение у особых групп пациентов
Дети
Катафаст не рекомендуется назначать детям до 14 лет.
Для подростков старше 14 лет обычно достаточно приема дозы 50-100 мг, разделенной на 1- 2 приема ежедневно. Не следует превышать максимальную суточную дозу 150 мг. Исследование Катафаста при приступах мигрени у детей не проводилось.
Пожилые пациенты (65 лет и старше)
Для данных групп пациентов коррекция стартовой дозы обычно не требуется. Вместе с тем, исходя из общепринятых подходов, необходима осторожность при приеме препарата у пожилых, особенно у ослабленных пациентов и у пациентов с низкой массой тела.
Пациенты с застойной сердечной недостаточностью (NYHA—I) или высокими сердечно—сосудистыми факторами риска
У пациентов с застойной сердечной недостаточностью (NYHA-I) или высокими факторами риска развития сердечно-сосудистых явлений диклофенак допускается применять только после тщательной оценки риска и пользы для пациента, а при продолжительности терапии более 4 недель – только в дозах <100 мг в сутки (см. Меры предосторожности).
Пациенты с нарушением функции почек
Катафаст противопоказан пациентам с почечной недостаточностью (СКФ <15 мл/мин/1,73м2) (см. Противопоказания). Поскольку специальные исследования у пациентов с нарушением функции почек не проводились, конкретные рекомендации по корректировке дозы дать невозможно. Рекомендуется соблюдать осторожность при применении Катафаста у пациентов с легким и умеренным нарушением функции почек (см. Меры предосторожности).
Пациенты с нарушением функции печени
Катафаст противопоказан пациентам с печеночной недостаточностью (см. Противопоказания). Поскольку специальные исследования у пациентов с нарушением функции печени не проводились, конкретные рекомендации по корректировке дозы дать невозможно. Рекомендуется соблюдать осторожность при применении Катафаста у пациентов с легким и умеренным нарушением функции печени (см. Меры предосторожности).
Язва желудка или кишечника в активной фазе; перенесенные желудочно-кишечное кровотечение или перфорация; перенесенные ранее пептическая язва/кровотечение (два и более эпизодов верифицированной язвы или кровотечения в анамнезе).
Повышенная чувствительность к активному веществу, другим ингредиентам препарата или другим лекарственным средствам, особенно аспирину и другим анальгетикам, жаропонижающим и нестероидным противовоспалительным средствам (НПВС).
Как и другие НПВС, Катафаст противопоказан пациентам, у которых прием ацетилсалициловой кислоты или других H1IBC провоцирует приступы бронхиальной астмы, ангионевротического отека, крапивницы или острого ринита (т.е. реакции перекрестной реактивности, вызванные НПВС).
Воспалительные заболевания кишечника (такие как болезнь Крона или язвенный колит).
Лечение послеоперационной боли после коронарного шунтирования (или с использованием аппарата искусственного кровообращения).
Из-за наличия в составе аспартама лекарственное средство противопоказано для пациентов с фенилкетонурией.
Печеночная недостаточность.
Почечная недостаточность (СКФ <15 мл/мин/1,73м2).
Установленная застойная сердечная недостаточность (согласно NYHA II-IV), ишемическая болезнь сердца, заболевания периферических артерий или цереброваскулярные заболевания.
Детский возраст (до 14 лет).
Последний триместр беременности.
Период грудного вскармливания.
Побочные эффекты
(Включая побочные эффекты, которые наблюдаются с другими формами диклофенака калия при кратковременном и длительном приеме).
Побочные реакции распределены в соответствии с частотой возникновения. Для оценки частоты возникновения побочных реакций использованы следующие критерии:
часто (≥1/100 — <1/10); нечасто (≥1/1000 — <1/100); редко (≥1/10000 — <1/1000); очень редко (<1/10000), включая отдельные случаи.
Со стороны системы кроветворения: очень редко — тромбоцитопения, лейкопения, гемолитическая анемия, апластическая анемия, агранулоцитоз.
Со стороны иммунной системы: редко — реакции гиперчувствительности, такие как астма, системные анафилактические или анафилактоидные реакции, включая гипотензию и шок; очень редко — ангионевротический отек (включая отек лица).
Со стороны нервной системы: часто — головная боль, головокружение; редко — сонливость; очень редко — парестезии, расстройства памяти, судороги, беспокойство, тремор, асептический менингит, нарушения вкуса, инсульт.
Психические нарушения: очень редко — дезориентация, депрессия, бессонница, раздражительность, ночные кошмары, психотические нарушения.
Со стороны органов зрения и чувств: очень редко — нарушения зрения (нечеткость зрения, диплопия), нарушения слуха, шум в ушах, часто — вертиго.
Со стороны сердечно-сосудистой системы: нечасто* — инфаркт миокарда, сердечная недостаточность, сердцебиение, боль в груди; очень редко — артериальная гипертензия, васкулит; частота неизвестна — синдром Коуниса.
Со стороны желудочно-кишечного тракта: часто — боли в эпигастральной области, тошнота, рвота, диарея, диспепсия, метеоризм, снижение аппетита; редко — гастрит, желудочно-кишечное кровотечение (кровавая рвота, мелена, диарея с примесью крови), язвы желудка и кишечника, сопровождающиеся или не сопровождающиеся кровотечением, стенозом ЖКТ или перфорацией, которая может приводить к перитониту; очень редко — колит (включая геморрагический колит, ишемический колит и обострение язвенного колита или болезни Крона), запор, стоматит, глоссит, нарушения со стороны пищевода, диафрагмоподобный стеноз кишечника, панкреатит.
Нарушения со стороны органов дыхания: редко — астма (включая диспноэ); очень редко — пневмонит.
Со стороны печени: часто — повышение уровня трансаминаз; редко — гепатит (с желтухой или без нее), нарушения функции печени; очень редко — молниеносный гепатит, печеночный некроз, печеночная недостаточность.
Дерматологические реакции: часто — сыпь; редко — крапивница; очень редко — высыпания в виде пузырей, экзема, мультиформная эритема, синдром Стивенса-Джонсона, синдром Лайелла (токсический эпидермальный некролиз), эксфолиативный дерматит, алопеция, реакции фоточувствительности; пурпура, в т.ч. аллергическая, зуд.
Со стороны почек: часто — задержка жидкости, отек, гипертензия; очень редко — острое повреждение почек (острая почечная недостаточность), гематурия и протеинурия, тубулоинтерстициальный нефрит, нефротический синдром, почечный папиллярный некроз.
* Частота отражает данные длительной терапии с применением высокой дозы (150 мг в сутки).
Описание отдельных побочных эффектов.
Артериотромботические явления
Мета анализ контролируемых клинических исследований и фармакоэпидемиологические данные указывают на то, что применение диклофенака повышает риск возникновения артериотромботических осложнений (например, инфаркт миокарда или инсульт), особенно при длительном применении или в высоких дозах (150 мг в сутки).
Зрительные нарушения
Нарушение зрения, нечеткость или двоение в глазах — характерные нежелательные эффекты для класса НПВС, которые обычно обратимы после прекращения приема препарата. Возможным механизмом возникновения является ингибирование синтеза простагландинов и других соединений, которые нарушают регуляцию кровотока сетчатки, вызывая возможные зрительные нарушения. Если такие нарушения возникают во время лечения диклофенаком, для исключения других возможных причин их возникновения следует провести офтальмологическое обследование.
В любое время в процессе лечения может возникнуть желудочно-кишечное кровотечение или развиться язва желудочно-кишечного тракта, иногда осложняющаяся перфорацией. Этим осложнениям необязательно предшествуют симптомы-предвестники или наличие указаний в анамнезе на язвенную болезнь. Серьезные последствия этих осложнений могут отмечаться у пациентов пожилого возраста. Если у пациентов, принимающих препарат, развиваются указанные осложнения, препарат должен быть отменен. Чтобы уменьшить риск желудочно-кишечной токсичности лечение нужно начинать и поддерживать с использованием минимальной эффективной дозы.
Для пациентов, которые получают сопутствующую терапию ацетилсалициловой кислотой или другими лекарственными средствами, которые могут усилить риск развития побочных эффектов, нужно рассматривать комбинированную терапию защитными средствами (например, ингибиторами протонной помпы). Пациентам, которые получают сопутствующую терапию системными кортикостероидами, антикоагулянтами, антитромбоцитарными средствами или селективными ингибиторами обратного захвата серотонина, рекомендуется соблюдать осторожность.
Во время приема препарата необходимо тщательное медицинское наблюдение пациентов, у которых имеются жалобы, указывающие на заболевания желудочно-кишечного тракта, имеющих указания в анамнезе на язвенную болезнь желудка и двенадцатиперстной кишки, больных язвенным колитом или страдающих болезнью Крона.
Клинические исследования и эпидемиологические данные убедительно свидетельствуют о наличии повышенного риска развития артериальных тромботических явлений (например, инфаркта миокарда или инсульта), которые могут быть ассоциированы с применением диклофенака, в частности при применении в высоких дозах (150 мг в сутки) и при длительном применении.
Пациентам со значительными факторами риска развития сердечно-сосудистых осложнений (например, артериальная гипертензия, гиперлипидемия, сахарный диабет, курение) назначать диклофенак следует только после тщательного рассмотрения такой возможности. Вследствие возможного повышения риска сердечно-сосудистых явлений при длительном применении или в высокой дозе препарата пациентам следует назначать диклофенак в минимальной эффективной дозе и принимать его максимально короткое время, необходимое для уменьшения выраженности симптомов. Следует периодически проводить повторную оценку необходимости облегчения симптомов и ответ на проводимое лечение.
У пациентов с застойной сердечной недостаточностью (NYHA-I) или высокими факторами риска развития сердечно-сосудистых осложнений (напр., артериальная гипертензия, гиперлипидемия, сахарный диабет, курение) допускается применять диклофенак только после тщательной оценки, а при продолжительности терапии более 4 недель — только в дозах < 100 мг в сутки.
Пациенты должны проявлять настороженность в отношении проявлений и симптомов тяжелых артериотромботических явлений (например, боль в груди, одышка, слабость, невнятная речь), которые могут возникать внезапно. Пациентов следует проинструктировать о необходимости незамедлительного обращения к врачу в подобных случаях.
Прием Катафаста обычно ограничивается несколькими днями. Однако если Катафаст принимается продолжительно, рекомендуется, как и при длительном приеме других НПВС, контролировать анализ крови.
Катафаст, как и другие НПВС, может временно ингибировать агрегацию тромбоцитов. Поэтому у пациентов с нарушениями гемостаза необходимо тщательное наблюдение.
У пациентов, ранее не принимавших препарат, во время приема этого препарата, так как и при лечении другими НПВС, в редких случаях могут развиться аллергические реакции, включая анафилактические и анафилактоидные реакции. У пациентов с астмой, аллергическими ринитами, отеком слизистой оболочки носа (назальные полипы), хронической обструктивной болезнью легких (особенно если они связаны с ринитоподобными аллергическими симптомами), реакции на Н11ВС, такие как провокация астмы, отек Квинке или крапивница, встречается более часто. Поэтому таким пациентам рекомендуется соблюдать осторожность.
Тщательное наблюдение необходимо при назначении Катафаста пациентам с нарушениями функции печени, поскольку их состояние может ухудшиться.
Во время приема препарата, также как и при лечении другими НПВС, может повышаться уровень одного или нескольких печеночных ферментов. Такие повышения обычно обратимы после прекращения приема препарата. Важно помнить, что Катафаст предназначен только для краткосрочного лечения (максимум 3 дня). Если нарушения со стороны функциональных показателей печени сохраняются или усиливаются, или если развиваются жалобы или симптомы, указывающие на заболевание печени, а также в том случае, если возникают другие побочные явления (например, эозинофилия, сыпь и т.п.), Катафаст следует отменить. Кроме повышения ферментов печени наблюдались редкие случаи тяжелых реакций со стороны печени, включая желтуху, и очень редко фульминантный гепатит, некроз печени и печеночная недостаточность, в отдельных случаях с фатальным исходом. Нужно иметь в виду, что гепатит на фоне приема препарата может возникнуть без продромальных явлений.
Осторожность необходима при назначении Катафаста больным печеночной порфирией, так как препарат может провоцировать приступы порфирии.
При приеме Н11ВС, включая Катафаст, очень редко могут развиваться серьезные кожные реакции, некоторые из которых фатальные, включая эксфолиативный дерматит, синдром Стивенса-Джонсона и токсический эпидермальный некроз. Самый высокий риск развития данных реакций на начальном этапе терапии. Большинство случаев происходит в первый месяц лечения. Следует прекратить терапию Катафастом при первых признаках кожных высыпаний, поражении слизистой оболочки или других признаках гиперчувствительности. Терапия НПВС, включая Катафаст, может быть связана с задержкой жидкости или отеком. Особая осторожность требуется при лечении пациентов с нарушениями функции сердца или почек, пациентов пожилого возраста, больных, получающих диуретические средства, а также больных, у которых имеется значительное уменьшение объема циркулирующей плазмы любой этиологии, например, в период до и после массивных хирургических вмешательств. В таких случаях во время приема Катафаста в качестве меры предосторожности рекомендуется регулярный контроль функции почек. После отмены препарата функция почек обычно восстанавливается до исходного уровня.
Катафаст, как и другие Н11ВС, благодаря своим фармакодинамическим свойствам, может маскировать жалобы и симптомы, характерные для инфекционно-воспалительных заболеваний.
Необходимо избегать одновременного приема Катафаста и других НПВС, включая ингибиторы циклооксигеназы-2, для уменьшения риска дополнительных побочных эффектов.
Исходя из общепринятых подходов, осторожность при приеме препарата необходима и у пациентов пожилого возраста, особенно у ослабленных или имеющих низкую массу тела.
Катафаст содержит аспартам, который является источником фенилаланина и может быть опасен для больных фенилкетонурией.
Беременность, грудное вскармливание, фертильность
Беременность
Подавление синтеза простагландинов может отрицательно повлиять на течение беременности и внутриутробное развитие плода. Данные эпидемиологических исследований свидетельствуют о повышенном риске выкидыша и/или развития сердечных пороков и гастрошизиса после приема ингибиторов синтеза простагландинов в ранние сроки беременности, однако обобщенные данные являются неубедительными. Считается, что риск повышается с увеличением дозы и длительности терапии. Показано, что у животных введение ингибиторов синтеза простагландинов приводит к нарушению имплантации эмбриона. Кроме того, у животных получавших ингибитор синтеза простагландинов в период органогенеза, увеличилась частота возникновения различных пороков развития сердечно-сосудистой системы. Лекарственное средство не следует назначать на протяжении первых двух триместров беременности, если только польза от его применения не превысит риски для плода.
Если диклофенак используют женщины, планирующие беременность, или в течение первого и второго триместра беременности, следует принимать лекарственное средство в минимальной эффективной дозе в течение кратчайшего срока.
При приеме ингибиторов синтеза простагландинов в третьем триместре беременности у плода возможны:
сердечно-легочная токсичность (преждевременное закрытие артериального протока и легочная гипертензия);
почечная дисфункция, при прогрессировании которой развивается почечная недостаточность с олигогидроамнионом.
При приеме диклофенака в конце беременности возможно развитие слабости родовой деятельности и увеличение продолжительности родов. У матери и у плода/новорожденного возможно удлинение времени кровотечения, антиагрегационный эффект может возникнуть даже после приема очень низких доз диклофенака.
Таким образом, диклофенак противопоказан в третьем триместре беременности.
Грудное вскармливание
Как и другие НПВС, диклофенак проникает в грудное молоко в небольшом количестве. В связи с этим, следует избегать приема Катафаста в период грудного вскармливания, чтобы предупредить нежелательные реакции у ребенка.
Фертильность
Не рекомендуется назначать препарат женщинам, планирующим беременность. У женщин, имеющих трудности с зачатием или проходящим обследование по поводу бесплодия, необходимо рассматривать целесообразность отмены препарата.
Влияние на способность водить автомашину и работать с механизмами
Пациентам, отмечающим во время приема препарата головокружение или другие неприятные ощущения со стороны центральной нервной системы, включая нарушения зрения, управлять автомашиной или другими механизмами не следует.
Типичной клинической картины передозировки диклофенака не существует. Передозировка может вызвать рвоту, желудочно-кишечное кровотечение, диарею, шум в ушах, судороги. В случаях тяжелого отравления возможны острая почечная недостаточность и поражение печени.
Лечение острого отравления НПВС состоит в проведении поддерживающей и симптоматической терапии.
Терапевтические меры, которые необходимы при передозировке: проведение поддерживающей и симптоматической терапии, особенно это касается лечения таких проявлений, как артериальная гипотензия, почечная недостаточность, судороги, симптомы раздражения желудочно-кишечного тракта, угнетение дыхания.
Маловероятно, что такие специфические лечебные мероприятия, как форсированный диурез, гемодиализ или гемоперфузия, окажутся полезными для выведения Н11ВС, так как активные вещества этих препаратов в значительной степени связываются с белками крови и подвергаются интенсивному метаболизму.
В случае передозировки, рекомендовано обратиться к врачу, поскольку вам может потребоваться медицинская помощь.
После приема потенциально токсической дозы применяется активированный уголь, после приема потенциально опасной для жизни дозы нужно вызвать рвоту или промыть желудок.
Взаимодействия
(Включая взаимодействия, которые наблюдаются с другими формами диклофенака калия или диклофенака натрия).
CYP2C9 ингибиторы. Рекомендуется соблюдать осторожность при одновременном приеме диклофенака и CYP2C9 ингибиторов (таких как вориконазол), который может отразиться на значительном увеличении концентрации диклофенака в плазме из-за ингибирования его метаболизма.
Препараты лития, дигоксин. Катафаст может повышать концентрации этих препаратов в плазме. Рекомендуется мониторинг концентрации лития и дигоксина в плазме при одновременном приеме препаратов с Катафастом.
Диуретические и гипотензивные средства. Катафаст, как и другие Н11ВС, может тормозить действие диуретических и антигипертензивных средств (β-блокаторы, ингибиторы АПФ).
Пациентам, особенно пожилым, эти комбинации необходимо назначать с осторожностью и периодически контролировать артериальное давление. Пациенты должны быть адекватно гидратированы. После начала и периодически во время лечения, особенно при назначении диуретических средств и ингибиторов АПФ, необходимо контролировать функцию почек, из-за повышенного риска нефротоксичности.
Одновременный прием Катафаста и калийсберегающих диуретиков, циклоспорина, такролимуса или триметоприма может приводить к повышению уровня калия в сыворотке крови (в случае применения такой комбинации лекарственных средств данный показатель следует регулярно контролировать).
НПВС и кортикостероиды. Одновременное системное применение НПВС и кортикостероидов может увеличивать частоту побочных реакций.
Антикоагулянты и антитромбоцитарные средства. Хотя в клинических исследованиях не было установлено влияния диклофенака на действие антикоагулянтов, существуют сообщения о повышении риска кровотечений у пациентов, принимавших одновременно диклофенак и эти препараты. В случае такого сочетания лекарственных средств рекомендуется тщательное и регулярное наблюдение пациентов.
Селективные ингибиторы обратного захвата серотонина. Одновременный прием НПВС и ингибиторов обратного захвата серотонина может увеличить риск желудочно-кишечных кровотечений.
Противодиабетические препараты. В клинических исследованиях установлено, что диклофенак может приниматься совместно с пероральными противодиабетическими средствами и не изменяет их клинической эффективности. Однако известны отдельные сообщения о развитии в таких случаях, как гипогликемии, так и гипергликемии, что вынуждало изменять дозу сахароснижающих препаратов во время терапии диклофенаком. Мониторинг уровня глюкозы в крови рекомендуется в качестве предупредительной меры при одновременном приеме препаратов.
Имеются также отдельные сообщения о развитии метаболического ацидоза при одновременном приеме диклофенака и метформина, особенно у пациентов с уже существующими почечными нарушениями.
Фенитоин. При одновременном приеме фенитоина и диклофенака рекомендуется мониторинг концентрации фенитоина в плазме из-за ожидаемого увеличения экспозиции фенитоина.
Метотрексат. Необходима осторожность при терапии НПВС менее чем за 24 часа до или после приема метотрексата, так как в таких случаях может повышаться концентрация метотрексата в крови и усиливаться его токсическое действие.
Циклоспорин и такролимус. Воздействие НПВС на синтез простагландинов в почках может усиливать нефротоксичность циклоспорина и такролимуса. В связи с этим, доза Катафаста у пациентов, получающих циклоспорин, должна быть ниже, чем у пациентов, которые не принимают циклоспорин или такролимус.
Хинолоновые антибактериальные средства. Имеются отдельные сообщения о развитии судорог у больных, получавших одновременно хинолоновые производные и Н11ВС.
Индукторы CYP2C9. Рекомендуется соблюдать осторожность при совместном назначении диклофенака с индукторами CYP2C9 (например, с рифампицином), которые могут привести к значительному снижению плазменной концентрации и экспозиции диклофенака.
Основные физико-химические свойства
Гомогенный порошок от белого до слегка желтоватого цвета.
Хранить в оригинальной упаковке при температуре не выше 25°С, предохранять от действия влаги. Хранить в недоступном для детей месте.
2 года.
Препарат не следует использовать после срока, отмеченного <ЕХР> на упаковке.
Срок годности заканчивается в последний день указанного месяца.
Условия отпуска из аптек
По рецепту врача.
Форма выпуска
По 3, 9 или 21 саше в картонной коробке.
Производитель
Мифарм С.п.А., Италия
Mipharm S.p.A., Via B.Quaranta, 12, 20141 Milano, Italy
Заявитель
Новартис Фарма АГ, Швейцария
Novartis Pharma AG, Lichtstrasse 35, 4056 Basel, Switzerland
Cataflam Description
CATAFLAM™ (diclofenac potassium tablets, USP) are a benzeneacetic acid derivative. CATAFLAM, is available as tablets of 50 mg (light brown) for oral administration. The chemical name is 2-[(2,6-dichlorophenyl)amino] benzeneacetic acid, monopotassium salt. The molecular weight is 334.25. Its molecular formula is C14H10Cl2NKO2, and it has the following structural formula:
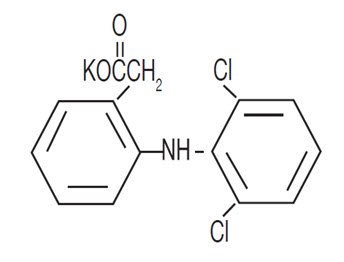
Each 50 mg CATAFLAM intended for oral administration, contains 50 mg diclofenac potassium for oral administration. In addition, each tablet contains the following inactive ingredients: colloidal silicon dioxide, hydroxyethyl cellulose, iron oxide red, magnesium stearate, methanol, polyethylene glycol, povidone, sodium bicarbonate, titanium dioxide and yellow iron oxide.
Cataflam — Clinical Pharmacology
Mechanism of Action
Diclofenac has analgesic, anti-inflammatory, and antipyretic properties.
The mechanism of action of CATAFLAM, like that of other NSAIDs, is not completely understood but involves inhibition of cyclooxygenase (COX-1 and COX-2).
Diclofenac is a potent inhibitor of prostaglandin synthesis in vitro. Diclofenac concentrations reached during therapy have produced in vivo effects. Prostaglandins sensitize afferent nerves and potentiate the action of bradykinin in inducing pain in animal models. Prostaglandins are mediators of inflammation. Because diclofenac is an inhibitor of prostaglandin synthesis, its mode of action may be due to a decrease of prostaglandins in peripheral tissues.
Pharmacokinetics
Absorption
Diclofenac is 100% absorbed after oral administration compared to IV administration as measured by urine recovery. However, due to first pass metabolism, only about 50% of the absorbed dose is systemically available (see Table 1). In some fasting volunteers, measurable plasma levels are observed within 10 minutes of dosing with CATAFLAM. Peak plasma levels are achieved approximately 1 hour in fasting normal volunteers, with a range of .33 to 2 hours. Food has no significant effect on the extent of diclofenac absorption. However, there is usually a delay in the onset of absorption and a reduction in peak plasma levels of approximately 30%.
| PK Parameter | Normal Healthy Adults (20-52 years) | |
|---|---|---|
| Mean | Coefficient of Variation (%) | |
| Absolute Bioavailability (%) [N = 7] | 55 | 40 |
| Tmax (hr)[N = 65] | 1.0 | 76 |
| Oral Clearance (CL/F; mL/min) [N = 61] | 622 | 21 |
| Renal Clearance (% unchanged drug in urine) [N = 7] |
< 1 | — |
| Apparent Volume of Distribution (V/F; L/kg) [N = 61] |
1.3 | 33 |
| Terminal Half-life (hr) [N = 48] | 1.9 | 29 |
Distribution
The apparent volume of distribution (V/F) of diclofenac potassium is 1.3 L/kg.
Diclofenac is more than 99% bound to human serum proteins, primarily to albumin. Serum protein binding is constant over the concentration range (0.15-105 mcg/mL) achieved with recommended doses. Diclofenac diffuses into and out of the synovial fluid. Diffusion into the joint occurs when plasma levels are higher than those in the synovial fluid, after which the process reverses, and synovial fluid levels are higher than plasma levels. It is not known whether diffusion into the joint plays a role in the effectiveness of diclofenac.
Elimination
Metabolism
Five diclofenac metabolites have been identified in human plasma and urine. The metabolites include 4′-hydroxy, 5- hydroxy, 3′-hydroxy, 4′, 5-dihydroxy and 3′-hydroxy 4′-methoxy-diclofenac. The major diclofenac metabolite, 4′-hydroxy-diclofenac, has very weak pharmacologic activity. The formation of 4′-hydroxy-diclofenac is primarily mediated by CYP2C9. Both diclofenac and its oxidative metabolites undergo glucuronidation or sulfation followed by biliary excretion. Acylglucuronidation mediated by UGT2B7 and oxidation mediated by CYP2C8 may also play a role in diclofenac metabolism. CYP3A4 is responsible for the formation of minor metabolites, 5- hydroxy-and 3′-hydroxy-diclofenac. In patients with renal dysfunction, peak concentrations of metabolites 4′- hydroxy- and 5-hydroxy-diclofenac were approximately 50% and 4% of the parent compound after single oral dosing compared to 27% and 1% in normal healthy subjects.
Excretion
Diclofenac is eliminated through metabolism and subsequent urinary and biliary excretion of the glucuronide and the sulfate conjugates of the metabolites. Little or no free unchanged diclofenac is excreted in the urine. Approximately 65% of the dose is excreted in the urine and approximately 35% in the bile as conjugates of unchanged diclofenac plus metabolites. Because renal elimination is not a significant pathway of elimination for unchanged diclofenac, dosing adjustment in patients with mild to moderate renal dysfunction is not necessary. The terminal half-life of unchanged diclofenac is approximately 2 hours.
Special Populations
Pediatric
The pharmacokinetics of CATAFLAM has not been investigated in pediatric patients.
Race
Pharmacokinetic differences due to race have not been identified.
Hepatic Impairment
Hepatic metabolism accounts for almost 100% of CATAFLAM elimination, so patients with hepatic disease may require reduced doses of CATAFLAM compared to patients with normal hepatic function.
Renal Impairment
Diclofenac pharmacokinetics has been investigated in subjects with renal insufficiency. No differences in the pharmacokinetics of diclofenac have been detected in studies of patients with renal impairment. In patients with renal impairment (inulin clearance 60-90, 30-60, and < 30 mL/min; N = 6 in each group), AUC values and elimination rate were comparable to those in healthy subjects.
Drug Interactions Studies
Voriconazole
When co administered with voriconazole (inhibitor of CYP2C9, 2C19 and 3A4 enzyme), the Cmax and AUC of diclofenac increased by 114% and 78%, respectively (see PRECAUTIONS: Drug Interactions).
Aspirin
When NSAIDs were administered with aspirin, the protein binding of NSAIDs were reduced, although the clearance of free NSAID was not altered. The clinical significance of this interaction is not known. See Table 2 for clinically significant drug interactions of NSAIDs with aspirin (see PRECAUTIONS: Drug Interactions).
Indications and Usage for Cataflam
Carefully consider the potential benefits and risks of CATAFLAM™(diclofenac potassium tablets, USP) and other treatment options before deciding to use CATAFLAM. Use the lowest effective dose for the shortest duration consistent with individual patient treatment goals (see WARNINGS: Gastrointestinal Bleeding, Ulceration, and Perforation).
CATAFLAM is indicated:
- For treatment of primary dysmenorrhea
- For relief of mild to moderate pain
- For relief of the signs and symptoms of osteoarthritis
- For relief of the signs and symptoms of rheumatoid arthritis
Contraindications
CATAFLAM™ is contraindicated in the following patients:
- Known hypersensitivity (e.g., anaphylactic reactions and serious skin reactions) to diclofenac or any components of the drug product (see WARNINGS: Anaphylactic Reactions, Serious Skin Reactions).
- History of asthma, urticaria, or allergic type reactions after taking aspirin or other NSAIDs. Severe, sometimes fatal, anaphylactic reactions to NSAIDs have been reported in such patients (see WARNINGS: Anaphylactic Reactions, Exacerbation of Asthma Related to Aspirin Sensitivity).
- In the setting of coronary artery bypass graft (CABG) surgery (see WARNINGS: Cardiovascular Thrombotic Events).
Warnings
Cardiovascular Thrombotic Events
Clinical trials of several COX-2 selective and nonselective NSAIDs of up to three years duration have shown an increased risk of serious cardiovascular (CV) thrombotic events, including myocardial infarction (MI) and stroke, which can be fatal. Based on available data, it is unclear that the risk for CV thrombotic events is similar for all NSAIDs. The relative increase in serious CV thrombotic events over baseline conferred by NSAID use appears to be similar in those with and without known CV disease or risk factors for CV disease. However, patients with known CV disease or risk factors had a higher absolute incidence of excess serious CV thrombotic events, due to their increased baseline rate. Some observational studies found that this increased risk of serious CV thrombotic events began as early as the first weeks of treatment. The increase in CV thrombotic risk has been observed most consistently at higher doses.
To minimize the potential risk for an adverse CV event in NSAID treated patients, use the lowest effective dose for the shortest duration possible. Physicians and patients should remain alert for the development of such events, throughout the entire treatment course, even in the absence of previous CV symptoms. Patients should be informed about the symptoms of serious CV events and the steps to take if they occur.
There is no consistent evidence that concurrent use of aspirin mitigates the increased risk of serious CV thrombotic events associated with NSAID use. The concurrent use of aspirin and an NSAID, such as diclofenac, increases the risk of serious gastrointestinal (GI) events (see WARNINGS: Gastrointestinal Bleeding, Ulceration, and Perforation).
Status Post Coronary Artery Bypass Graft (CABG) Surgery
Two large, controlled, clinical trials of a COX-2 selective NSAID for the treatment of pain in the first 10-14 days following CABG surgery found an increased incidence of myocardial infarction and stroke. NSAIDs are contraindicated in the setting of CABG (see CONTRAINDICATIONS).
Post-MI Patients
Observational studies conducted in the Danish National Registry have demonstrated that patients treated with NSAIDs in the post-MI period were at increased risk of reinfarction, CV-related death, and all-cause mortality beginning in the first week of treatment. In this same cohort, the incidence of death in the first year post-MI was 20 per 100 person years in NSAID-treated patients compared to 12 per 100 person years in non-NSAID exposed patients. Although the absolute rate of death declined somewhat after the first-year post-MI, the increased relative risk of death in NSAID users persisted over at least the next four years of follow up.
Avoid the use of CATAFLAM in patients with a recent MI unless the benefits are expected to outweigh the risk of recurrent CV thrombotic events. If CATAFLAMTM is used in patients with a recent MI, monitor patients for signs of cardiac ischemia.
Gastrointestinal Bleeding, Ulceration, and Perforation
NSAIDs, including diclofenac, cause serious gastrointestinal (GI) adverse events including inflammation, bleeding, ulceration, and perforation of the esophagus, stomach, small intestine, or large intestine, which can be fatal. These serious adverse events can occur at any time, with or without warning symptoms, in patients treated with NSAIDs. Only one in five patients, who develop a serious upper GI adverse event on NSAID therapy, is symptomatic. Upper GI ulcers, gross bleeding or perforation caused by NSAIDs occurred in approximately 1% of patients treated for 3-6 months, and in about 2%-4% of patients treated for one year. However, even short-term therapy is not without risk.
Risk Factors for GI Bleeding, Ulceration, and Perforation
Patients with a prior history of peptic ulcer disease and/or GI bleeding who use NSAIDs had a greater than 10-fold increased risk for developing a GI bleed compared to patients without these risk factors. Other factors that
increase the risk of GI bleeding in patients treated with NSAIDs include longer duration of NSAID therapy, concomitant use of oral corticosteroids, aspirin, anticoagulants, or selective serotonin reuptake inhibitors (SSRIs); smoking, use of alcohol, older age, and poor general health status. Most post-marketing reports of fatal GI events occurred in elderly or debilitated patients. Additionally, patients with advanced liver disease and/or coagulopathy are at increased risk for GI bleeding.
Strategies to Minimize the GI Risks in NSAID-treated Patients
- Use the lowest effective dosage for the shortest possible duration.
- Avoid administration of more than one NSAID at a time.
- Avoid use in patients at higher risk unless benefits are expected to outweigh the increased risk of bleeding. For such patients, as well as those with active GI bleeding, consider alternate therapies other than NSAIDs.
- Remain alert for signs and symptoms of GI ulceration and bleeding during NSAID therapy.
- If a serious GI adverse event is suspected, promptly initiate evaluation and treatment, and discontinue CATAFLAM until a serious GI adverse event is ruled out.
In the setting of concomitant use of low-dose aspirin for cardiac prophylaxis, monitor patients more closely for evidence of GI bleeding (see PRECAUTIONS: Drug Interactions).
Hepatotoxicity
In clinical trials of diclofenac-containing products, meaningful elevations (i.e., more than 3 times the ULN) of AST (SGOT) were observed in about 2% of approximately 5,700 patients at some time during diclofenac treatment (ALT was not measured in all studies).
In a large, open-label, controlled trial of 3,700 patients treated with oral diclofenac sodium for 2-6 months, patients were monitored first at 8 weeks and 1,200 patients were monitored again at 24 weeks. Meaningful elevations of ALT and/or AST occurred in about 4% of patients and included marked elevations (greater than 8 times the ULN) in about 1% of the 3,700 patients. In that open-label study, a higher incidence of borderline (less than 3 times the ULN), moderate (3-8 times the ULN), and marked (greater than 8 times the ULN) elevations of ALT or AST was observed in patients receiving diclofenac when compared to other NSAIDs. Elevations in transaminases were seen more frequently in patients with osteoarthritis than in those with rheumatoid arthritis.
Almost all meaningful elevations in transaminases were detected before patients became symptomatic. Abnormal tests occurred during the first 2 months of therapy with diclofenac in 42 of the 51 patients in all trials who developed marked transaminase elevations.
In postmarketing reports, cases of drug-induced hepatotoxicity have been reported in the first month, and in some cases, the first 2 months of therapy, but can occur at any time during treatment with diclofenac. Postmarketing surveillance has reported cases of severe hepatic reactions, including liver necrosis, jaundice, fulminant hepatitis with and without jaundice, and liver failure. Some of these reported cases resulted in fatalities or liver transplantation.
In a European retrospective population-based, case-controlled study, 10 cases of diclofenac associated drug-induced liver injury with current use compared with nonuse of diclofenac were associated with a statistically significant 4-fold adjusted odds ratio of liver injury. In this particular study, based on an overall number of 10 cases of liver injury associated with diclofenac, the adjusted odds ratio increased further with female gender, doses of 150 mg or more, and duration of use for more than 90 days.
Physicians should measure transaminases at baseline and periodically in patients receiving long-term therapy with diclofenac, because severe hepatotoxicity may develop without a prodrome of distinguishing symptoms. The optimum times for making the first and subsequent transaminase measurements are not known. Based on clinical trial data and postmarketing experiences, transaminases should be monitored within 4 to 8 weeks after initiating treatment with diclofenac. However, severe hepatic reactions can occur at any time during treatment with diclofenac.
If abnormal liver tests persist or worsen, if clinical signs and/or symptoms consistent with liver disease develop, or if systemic manifestations occur (e.g., eosinophilia, rash, abdominal pain, diarrhea, dark urine, etc.), CATAFLAM should be discontinued immediately.
Inform patients of the warning signs and symptoms of hepatotoxicity (e.g., nausea, fatigue, lethargy, diarrhea, pruritus, jaundice, right upper quadrant tenderness, and «flu-like» symptoms). If clinical signs and symptoms consistent with liver disease develop, or if systemic manifestations occur (e.g., eosinophilia, rash, etc.), discontinue CATAFLAM immediately, and perform a clinical evaluation of the patient.
To minimize the potential risk for an adverse liver related event in patients treated with CATAFLAM, use the lowest effective dose for the shortest duration possible. Exercise caution when prescribing CATAFLAM with concomitant drugs that are known to be potentially hepatotoxic (e.g., acetaminophen, antibiotics, anti-epileptics).
Hypertension
NSAIDs, including CATAFLAM can lead to new onset of hypertension or worsening of preexisting hypertension, either of which may contribute to the increased incidence of CV events. Patients taking angiotensin converting enzyme (ACE) inhibitors, thiazides diuretics or loop diuretics may have impaired response to these therapies when taking NSAIDs (see PRECAUTIONS: Drug Interactions).
Monitor blood pressure (BP) during the initiation of NSAID treatment and throughout the course of therapy.
Heart Failure and Edema
The Coxib and traditional NSAID Trialists’ Collaboration meta-analysis of randomized controlled trials demonstrated an approximately two-fold increase in hospitalization for heart failure in COX-2 selective-treated patients and nonselective NSAID treated patients compared to placebo- treated patients. In a Danish National Registry study of patients with heart failure, NSAID use increased the risk of MI, hospitalization for heart failure, and death.
Additionally, fluid retention and edema have been observed in some patients treated with NSAIDs. Use of diclofenac may blunt the CV effects of several therapeutic agents used to treat these medical conditions (e.g., diuretics, ACE-inhibitors, or angiotensin receptor blockers [ARBs]) (see PRECAUTIONS: Drug Interactions).
Avoid the use of CATAFLAM in patients with severe heart failure unless the benefits are expected to outweigh the risk of worsening heart failure. If CATAFLAM is used in patients with severe heart failure, monitor patients for signs of worsening heart failure.
Renal Toxicity and Hyperkalemia
Renal Toxicity
Long-term administration of NSAIDs has resulted in renal papillary necrosis and other renal injury. Renal toxicity has also been seen in patients in whom renal prostaglandins have a compensatory role in the maintenance of renal perfusion. In these patients, administration of an NSAID may cause a dose-dependent reduction in prostaglandin formation and, secondarily, in renal blood flow, which may precipitate overt renal decompensation. Patients at greatest risk of this reaction are those with impaired renal function, dehydration, hypovolemia, heart failure, liver dysfunction, those taking diuretics and ACE-inhibitors or ARBs, and the elderly. Discontinuation of NSAID therapy is usually followed by recovery to the pretreatment state.
No information is available from controlled clinical studies regarding the use of CATAFLAM in patients with advanced renal disease. The renal effects of CATAFLAM may hasten the progression of renal dysfunction in patients with preexisting renal disease.
Correct volume status in dehydrated or hypovolemic patients prior to initiating CATAFLAM. Monitor renal function in patients with renal or hepatic impairment, heart failure, dehydration, or hypovolemia during use of CATAFLAM (see PRECAUTIONS: Drug Interactions). Avoid the use of CATAFLAM in patients with advanced renal disease unless the benefits are expected to outweigh the risk of worsening renal function. If CATAFLAM is used in patients with advanced renal disease, monitor patients for signs of worsening renal function.
Hyperkalemia
Increases in serum potassium concentration, including hyperkalemia, have been reported with use of NSAIDs, even in some patients without renal impairment. In patients with normal renal function, these effects have been attributed to a hyporeninemic-hypoaldosteronism state.
Anaphylactic Reactions
Diclofenac has been associated with anaphylactic reactions in patients with and without known hypersensitivity to diclofenac and in patients with aspirin-sensitive asthma (see CONTRAINDICATIONS, WARNINGS: Exacerbation of Asthma Related to Aspirin Sensitivity).
Exacerbation of Asthma Related to Aspirin Sensitivity
A subpopulation of patients with asthma may have aspirin-sensitive asthma which may include chronic rhinosinusitis complicated by nasal polyps; severe, potentially fatal bronchospasm; and/or intolerance to aspirin and other NSAIDs. Because cross-reactivity between aspirin and other NSAIDs has been reported in such aspirin-sensitive patients, CATAFLAM is contraindicated in patients with this form of aspirin sensitivity (see CONTRAINDICATIONS). When CATAFLAM is used in patients with preexisting asthma (without known aspirin sensitivity), monitor patients for changes in the signs and symptoms of asthma.
Serious Skin Reactions
NSAIDs, including diclofenac, can cause serious skin adverse events such as exfoliative dermatitis, Stevens-Johnson Syndrome (SJS), and toxic epidermal necrolysis (TEN), which can be fatal. These serious events may occur without warning. Inform patients about the signs and symptoms of serious skin reactions and discontinue the use of CATAFLAM at the first appearance of skin rash or any other sign of hypersensitivity. CATAFLAM is contraindicated in patients with previous serious skin reactions to NSAIDs (see CONTRAINDICATIONS).
Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS)
Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS) has been reported in patients taking NSAIDs such as diclofenac potassium tablets. Some of these events have been fatal or life-threatening. DRESS typically, although not exclusively, presents with fever, rash, lymphadenopathy, and/or facial swelling. Other clinical manifestations may include hepatitis, nephritis, hematological abnormalities, myocarditis, or myositis. Sometimes symptoms of DRESS may resemble an acute viral infection.
Eosinophilia is often present. Because this disorder is variable in its presentation, other organ systems not noted here may be involved. It is important to note that early manifestations of hypersensitivity, such as fever or lymphadenopathy, may be present even though rash is not evident. If such signs or symptoms are present, discontinue CATAFLAM and evaluate the patient immediately.
Fetal Toxicity
Premature Closure of Fetal Ductus Arteriosus
Avoid use of NSAIDs, including CATAFLAM, in pregnant women at about 30 weeks gestation and later. NSAIDs including diclofenac potassium tablets, increase the risk of premature closure of the fetal ductus arteriosus at approximately this gestational age.
Oligohydramnios/Neonatal Renal Impairment
Use of NSAIDs, including CATAFLAM, at about 20 weeks gestation or later in pregnancy may cause fetal renal dysfunction leading to oligohydramnios and, in some cases, neonatal renal impairment. These adverse outcomes are seen, on average, after days to weeks of treatment, although oligohydramnios has been infrequently reported as soon as 48 hours after NSAID initiation. Oligohydramnios is often, but not always, reversible with treatment discontinuation. Complications of prolonged oligohydramnios may, for example, include limb contractures and delayed lung maturation. In some post marketing cases of impaired neonatal renal function, invasive procedures such as exchange transfusion or dialysis were required.
If NSAID treatment is necessary between about 20 weeks and 30 weeks gestation, limit CATAFLAM use to the lowest effective dose and shortest duration possible. Consider ultrasound monitoring of amniotic fluid if CATAFLAM treatment extends beyond 48 hours. Discontinue CATAFLAM if oligohydramnios occurs and follow up according to clinical practice (see PRECAUTIONS: Pregnancy).
Hematological Toxicity
Anemia has occurred in NSAID-treated patients. This may be due to occult or gross blood loss, fluid retention, or an incompletely described effect upon erythropoiesis. If a patient treated with CATAFLAM have any signs or symptoms of anemia, monitor hemoglobin or hematocrit.
NSAIDs, including CATAFLAM, may increase the risk of bleeding events. Co-morbid conditions such as coagulation disorders, concomitant use of warfarin and other anticoagulants, antiplatelet agents (e.g., aspirin), serotonin reuptake inhibitors (SSRIs) and serotonin norepinephrine reuptake inhibitors (SNRIs) may increase this risk. Monitor these patients for signs of bleeding (see PRECAUTIONS: Drug Interactions).
Precautions
General
CATAFLAMTM (diclofenac potassium tablets, USP) cannot be expected to substitute for corticosteroids or to treat corticosteroid insufficiency. Abrupt discontinuation of corticosteroids may lead to disease exacerbation. Patients on prolonged corticosteroid therapy should have their therapy tapered slowly if a decision is made to discontinue corticosteroids and the patient should be observed closely for any evidence of adverse effects, including adrenal insufficiency and exacerbation of symptoms of arthritis.
The pharmacological activity of CATAFLAM in reducing fever and inflammation may diminish the utility of these diagnostic signs in detecting complications of presumed noninfectious, painful conditions.
Information for Patients
Advise the patient to read the FDA-approved patient labeling (Medication Guide) that accompanies each prescription dispensed. Inform patients, families, or their caregivers of the following information before initiating therapy with CATAFLAM and periodically during the course of ongoing therapy.
Cardiovascular Thrombotic Events
Advise patients to be alert for the symptoms of cardiovascular thrombotic events, including chest pain, shortness of breath, weakness, or slurring of speech, and to report any of these symptoms to their healthcare provider immediately (see WARNINGS: Cardiovascular Thrombotic Events).
Gastrointestinal Bleeding, Ulceration, and Perforation
Advise patients to report symptoms of ulcerations and bleeding, including epigastric pain, dyspepsia, melena, and hematemesis to their healthcare provider. In the setting of concomitant use of low-dose aspirin for cardiac prophylaxis, inform patients of the increased risk for the signs and symptoms of GI bleeding (see WARNINGS: Gastrointestinal Bleeding, Ulceration, and Perforation).
Hepatotoxicity
Inform patients of the warning signs and symptoms of hepatotoxicity (e.g., nausea, fatigue, lethargy, pruritus, diarrhea, jaundice, right upper quadrant tenderness, and «flu-like» symptoms). If these occur, instruct patients to stop CATAFLAM and seek immediate medical therapy (see WARNINGS: Hepatotoxicity).
Heart Failure and Edema
Advise patients to be alert for the symptoms of congestive heart failure including shortness of breath, unexplained weight gain, or edema and to contact their healthcare provider if such symptoms occur (see WARNINGS: Heart Failure and Edema).
Anaphylactic Reactions
Inform patients of the signs of an anaphylactic reaction (e.g., difficulty breathing, swelling of the face or throat). Instruct patients to seek immediate emergency help if these occur (see WARNINGS: Anaphylactic Reactions).
Serious Skin Reactions, Including DRESS
Advise patients to stop taking CATAFLAM immediately if they develop any type of rash or fever and to contact their healthcare provider as soon as possible (see WARNINGS).
Female Fertility
Advise females of reproductive potential who desire pregnancy that NSAIDs, including VOLTAREN®, may be associated with a reversible delay in ovulation (see PRECAUTIONS: Carcinogenesis, Mutagenesis, Impairment of Fertility).
Fetal Toxicity
Inform pregnant women to avoid use of CATAFLAM and other NSAIDs starting at 30 weeks gestation because of the risk of the premature closing of the fetal ductus arteriosus. If treatment with diclofenac potassium tablets is needed for a pregnant woman between about 20 to 30 weeks gestation, advise her that she may need to be monitored for oligohydramnios, if treatment continues for longer than 48 hours (see WARNINGS: Fetal Toxicity, PRECAUTIONS: Pregnancy).
Avoid Concomitant Use of NSAIDs
Inform patients that the concomitant use of CATAFLAM with other NSAIDs or salicylates (e.g., diflunisal, salsalate) is not recommended due to the increased risk of gastrointestinal toxicity, and little or no increase in efficacy (see WARNINGS: Gastrointestinal Bleeding, Ulceration, and Perforation and Drug Interactions). Alert patients that NSAIDs may be present in «over-the-counter» medications for treatment of colds, fever, or insomnia.
Use of NSAIDs and Low-Dose Aspirin
Inform patients not to use low-dose aspirin concomitantly with CATAFLAM until they talk to their healthcare provider (see PRECAUTIONS: Drug Interactions).
Masking of Inflammation and Fever
The pharmacological activity of CATAFLAM in reducing fever and inflammation, and possibly fever, may diminish the utility of these diagnostic signs in detecting infections.
Laboratory Monitoring
Because serious GI bleeding, hepatotoxicity, and renal injury can occur without warning symptoms or signs, consider monitoring patients on long-term NSAID treatment with a CBC and a chemistry profile periodically (see WARNINGS: Gastrointestinal Bleeding, Ulceration and Perforation, and Hepatotoxicity).
Drug Interactions
See Table 2 for clinically significant drug interactions with diclofenac.
| Drugs That Interfere with Hemostasis | |
| Clinical Impact: |
|
| Intervention: | Monitor patients with concomitant use of CATAFLAM with anticoagulants (e.g., warfarin), antiplatelet agents (e.g., aspirin), selective serotonin reuptake inhibitors (SSRIs), and serotonin norepinephrine reuptake inhibitors (SNRIs) for signs of bleeding (see WARNINGS: Hematological Toxicity). |
| Aspirin | |
| Clinical Impact: | Controlled clinical studies showed that the concomitant use of NSAIDs and analgesic doses of aspirin does not produce any greater therapeutic effect than the use of NSAIDs alone. In a clinical study, the concomitant use of an NSAID and aspirin was associated with a significantly increased incidence of GI adverse reactions as compared to use of the NSAID alone (see WARNINGS: Gastrointestinal Bleeding, Ulceration, and Perforation). |
| Intervention: | Concomitant use of CATAFLAM and analgesic doses of aspirin is not generally recommended because of the increased risk of bleeding (see WARNINGS: Hematological Toxicity). CATAFLAM is not a substitute for low-dose aspirin for cardiovascular protection. |
| ACE Inhibitors, Angiotensin Receptor Blockers, and Beta-Blockers | |
| Clinical Impact: |
|
| Intervention: |
|
| Diuretics | |
| Clinical Impact: | Clinical studies, as well as post-marketing observations, showed that NSAIDs reduced the natriuretic effect of loop diuretics (e.g., furosemide) and thiazide diuretics in some patients. This effect has been attributed to the NSAID inhibition of renal prostaglandin synthesis. |
| Intervention: | During concomitant use of CATAFLAM with diuretics, observe patients for signs of worsening renal function, in addition to assuring diuretic efficacy including antihypertensive effects (see WARNINGS: Renal Toxicity and Hyperkalemia). |
| Digoxin | |
| Clinical Impact: | The concomitant use of diclofenac with digoxin has been reported to increase the serum concentration and prolong the half-life of digoxin. |
| Intervention: | During concomitant use of CATAFLAM and digoxin, monitor serum digoxin levels. |
| Lithium | |
| Clinical Impact: | NSAIDs have produced elevations in plasma lithium levels and reductions in renal lithium clearance. The mean minimum lithium concentration increased 15%, and the renal clearance decreased by approximately 20%. This effect has been attributed to NSAID inhibition of renal prostaglandin synthesis. |
| Intervention: | During concomitant use of CATAFLAM and lithium, monitor patients for signs of lithium toxicity. |
| Methotrexate | |
| Clinical Impact: | Concomitant use of NSAIDs and methotrexate may increase the risk for methotrexate toxicity (e.g., neutropenia, thrombocytopenia, renal dysfunction). |
| Intervention: | During concomitant use of CATAFLAM and methotrexate, monitor patients for methotrexate toxicity. |
| Cyclosporine | |
| Clinical Impact: | Concomitant use of CATAFLAM and cyclosporine may increase cyclosporine’s nephrotoxicity. |
| Intervention: | During concomitant use of CATAFLAM and cyclosporine, monitor patients for signs of worsening renal function. |
| NSAIDs and Salicylates | |
| Clinical Impact: | Concomitant use of diclofenac with other NSAIDs or salicylates (e.g., diflunisal, salsalate) increases the risk of GI toxicity, with little or no increase in efficacy (see WARNINGS: Gastrointestinal Bleeding, Ulceration, and Perforation). |
| Intervention: | The concomitant use of diclofenac with other NSAIDs or salicylates is not recommended. |
| Pemetrexed | |
| Clinical Impact: | Concomitant use of CATAFLAM and pemetrexed may increase the risk of pemetrexed associated myelosuppression, renal, and GI toxicity (see the pemetrexed prescribing information). |
| Intervention: | During concomitant use of CATAFLAM and pemetrexed, in patients with renal impairment whose creatinine clearance ranges from 45 mL/min to 79 mL/min, monitor for myelosuppression, renal and GI toxicity. NSAIDs with short elimination half-lives (e.g., diclofenac, indomethacin) should be avoided for a period of two days before, the day of, and two days following administration of pemetrexed. In the absence of data regarding potential interaction between pemetrexed and NSAIDs with longer half-lives (e.g., meloxicam, nabumetone), patients taking these NSAIDs should interrupt dosing for at least five days before, the day of, and two days following pemetrexed administration. |
| CYP2C9 Inhibitors or Inducers | |
| Clinical Impact: | Diclofenac is metabolized by cytochrome P450 enzymes, predominantly by CYP2C9. Co-administration of diclofenac with CYP2C9 inhibitors (e.g., voriconazole) may enhance the exposure and toxicity of diclofenac whereas co-administration with CYP2C9 inducers (e.g., rifampin) may lead to compromised efficacy of diclofenac. |
| Intervention: | A dosage adjustment may be warranted when diclofenac is administered with CYP2C9 inhibitors or inducers (see CLINICAL PHARMACOLOGY: Pharmacokinetics). |
Carcinogenesis, Mutagenesis, Impairment of Fertility
Carcinogenesis
Long-term carcinogenicity studies in rats given diclofenac sodium up to 2 mg/kg/day (approximately 0.1 times the maximum recommended human dose (MRHD) of CATAFLAM, 200 mg/day, based on body surface area (BSA) comparison) have revealed no significant increase in tumor incidence. A 2-year carcinogenicity study conducted in mice employing diclofenac sodium at doses up to 0.3 mg/kg/day (approximately 0.007 times the MRHD based on BSA comparison) in males and 1 mg/kg/day (approximately 0.02 times the MRHD based on BSA comparison) in females did not reveal any oncogenic potential.
Mutagenesis
Diclofenac sodium did not show mutagenic activity in in vitro point mutation assays in mammalian (mouse lymphoma) and microbial (yeast, Ames) test systems and was non-mutagenic in several mammalian in vitro and in vivo tests, including dominant lethal and male germinal epithelial chromosomal studies in mice, and nucleus anomaly and chromosomal aberration studies in Chinese hamsters.
Impairment of Fertility
Diclofenac sodium administered to male and female rats at 4 mg/kg/day (approximately 0.2 times the MRHD based on BSA comparison) did not affect fertility.
Based on the mechanism of action, the use of prostaglandin-mediated NSAIDs, including CATAFLAM, may delay or prevent rupture of ovarian follicles, which has been associated with reversible infertility in some women. Published animal studies have shown that administration of prostaglandin synthesis inhibitors has the potential to disrupt prostaglandin-mediated follicular rupture required for ovulation. Small studies in women treated with NSAIDs have also shown a reversible delay in ovulation. Consider withdrawal of NSAIDs, including CATAFLAM, in women who have difficulties conceiving or who are undergoing investigation of infertility.
Pregnancy
Risk Summary
Use of NSAIDs, including CATAFLAM, can cause premature closure of the fetal ductus arteriosus and fetal renal dysfunction leading to oligohydramnios and, in some cases, neonatal renal impairment. Because of these risks, limit dose and duration of CATAFLAM use between about 20 and 30 weeks of gestation and avoid CATAFLAM use at about 30 weeks of gestation and later in pregnancy (see WARNINGS: Fetal Toxicity).
Premature Closure of Fetal Ductus Arteriosus
Use of NSAIDs, including CATAFLAM, at about 30 weeks gestation or later in pregnancy increases the risk of premature closure of fetal ductus arteriosus.
Oligohydramnios/Neonatal Renal Impairment
Use of NSAIDs at about 20 weeks gestation or later in pregnancy has been associated with cases of fetal renal dysfunction leading to oligohydramnios, and in some cases, neonatal renal impairment.
Data from observational studies regarding other potential embryofetal risks of NSAID use in women in the first or second trimesters of pregnancy are inconclusive. In animal reproduction studies, no evidence of teratogenicity was observed in mice, rats, or rabbits given diclofenac during the period of organogenesis at doses up to approximately 0.5, 0.5, and 1 times, respectively, the maximum recommended human dose (MRHD) of CATAFLAM, despite the presence of maternal and fetal toxicity at these doses [see Data]. Based on animal data, prostaglandins have been shown to have an important role in endometrial vascular permeability, blastocyst implantation, and decidualization. In animal studies, administration of prostaglandin synthesis inhibitors such as diclofenac, resulted in increased pre-and-post implantation loss. Prostaglandins also have been shown to have an important role in kidney development. In published animal studies, prostaglandin synthesis inhibitors have been reported to impair kidney development when administered at clinically relevant doses.
The estimated background risk of major birth defects and miscarriage for the indicated population(s) is unknown. All pregnancies have a background risk of birth defect, loss, or other adverse outcomes. In the U.S. general population, the estimated background risk of major birth defects and miscarriage in clinically recognized pregnancies is 2-4% and 15-20%, respectively.
Clinical Considerations
Fetal/Neonatal Adverse Reactions
Premature Closure of Fetal Ductus Arteriosus
Avoid use of NSAIDs in women at about 30 weeks gestation and later in pregnancy, because NSAIDs, including CATAFLAM, can cause premature closure of fetal ductus arteriosus (see WARNINGS: Fetal Toxicity).
Oligohydramnios/Neonatal Renal Impairment
If an NSAID is necessary at about 20 weeks gestation or later in pregnancy, limit the use to the lowest effective dose and shortest duration possible. If CATAFLAM treatment extends beyond 48 hours, consider monitoring with ultrasound for oligohydramnios. If oligohydramnios occurs, discontinue CATAFLAM and follow up according to clinical practice (see WARNINGS: Fetal Toxicity).
Data
Human Data
Premature Closure of Fetal Ductus Arteriosus
Published literature reports that the use of NSAIDs at about 30 weeks of gestation and later in pregnancy may cause premature closure of fetal ductus arteriosus.
Oligohydramnios/Neonatal Renal Impairment
Published studies and post-marketing reports describe maternal NSAID use at about 20 weeks gestation or later in pregnancy associated with fetal renal dysfunction leading to oligohydramnios, and in some cases, neonatal renal impairment. These adverse outcomes are seen, on average, after days to weeks of treatment, although oligohydramnios has been infrequently reported as soon as 48 hours after NSAID initiation. In many cases, but not all, the decrease in amniotic fluid was transient and reversible with cessation of the drug. There have been a limited number of case reports of maternal NSAID use and neonatal renal dysfunction without oligohydramnios, some of which were irreversible. Some cases of neonatal renal dysfunction required treatment with invasive procedures, such as exchange transfusion or dialysis.
Methodological limitations of these post-marketing studies and reports include lack of a control group; limited information regarding dose, duration, and timing of drug exposure; and concomitant use of other medications. These limitations preclude establishing a reliable estimate of the risk of adverse fetal and neonatal outcomes with maternal NSAID use. Because the published safety data on neonatal outcomes involved mostly preterm infants, the generalizability of certain reported risks to the full term infant exposed to NSAIDs through maternal use is uncertain.
Animal Data
Reproductive and developmental studies in animals demonstrated that diclofenac sodium administration during organogenesis did not produce teratogenicity despite the induction of maternal toxicity and fetal toxicity in mice at oral doses up to 20 mg/kg/day (approximately 0.5 times the maximum recommended human dose [MRHD] of CATAFLAM, 200 mg/day, based on body surface area (BSA) comparison), and in rats and rabbits at oral doses up to 10 mg/kg/day (approximately 0.5 and 1 times, respectively, the MRHD based on BSA comparison). In a study in which pregnant rats were orally administered 2 mg/kg or 4 mg/kg diclofenac (0.1 and 0.2 times the MRHD based on BSA) from Gestation Day 15 through Lactation Day 21, significant maternal toxicity (peritonitis, mortality) was noted. These maternally toxic doses were associated with dystocia, prolonged gestation, reduced fetal weights and growth, and reduced fetal survival. Diclofenac has been shown to cross the placental barrier in mice, rats, and humans.
Labor or Delivery
There are no studies on the effects of CATAFLAM during labor or delivery. In animal studies, NSAIDs, including diclofenac, inhibit prostaglandin synthesis, cause delayed parturition, and increase the incidence of stillbirth.
Nursing Mothers
Risk Summary
Based on available data, diclofenac may be present in human milk. The developmental and health benefits of breastfeeding should be considered along with the mother’s clinical need for CATAFLAM and any potential adverse effects on the breastfed infant from the CATAFLAM or from the underlying maternal condition.
Data
One woman treated orally with a diclofenac salt, 150 mg/day, had a milk diclofenac level of 100 mcg/L, equivalent to an infant dose of about 0.03 mg/kg/day. Diclofenac was not detectable in breast milk in 12 women using diclofenac (after either 100 mg/day orally for 7 days or a single 50 mg intramuscular dose administered in the immediate postpartum period).
Pediatric Use
Safety and effectiveness in pediatric patients have not been established.
Geriatric Use
Elderly patients, compared to younger patients, are at greater risk for NSAID-associated serious cardiovascular, gastrointestinal, and/or renal adverse reactions. If the anticipated benefit for the elderly patient outweighs these potential risks, start dosing at the low end of the dosing range, and monitor patients for adverse effects (see WARNINGS: Cardiovascular Thrombotic Events, Gastrointestinal Bleeding, Ulceration, and Perforation, Hepatotoxicity, Renal Toxicity and Hyperkalemia, PRECAUTIONS: Laboratory Monitoring).
Diclofenac is known to be substantially excreted by the kidney, and the risk of adverse reactions to this drug may be greater in patients with impaired renal function. Because elderly patients are more likely to have decreased renal function, care should be taken in dose selection, and it may be useful to monitor renal function (see CLINICAL PHARMACOLOGY, ADVERSE REACTIONS).
Adverse Reactions/Side Effects
The following adverse reactions are discussed in greater detail in other sections of the labeling:
- Cardiovascular Thrombotic Events (see WARNINGS)
- GI Bleeding, Ulceration and Perforation (see WARNINGS)
- Hepatotoxicity (see WARNINGS)
- Hypertension (see WARNINGS)
- Heart Failure and Edema (see WARNINGS)
- Renal Toxicity and Hyperkalemia (see WARNINGS)
- Anaphylactic Reactions (see WARNINGS)
- Serious Skin Reactions (see WARNINGS)
- Hematologic Toxicity (see WARNINGS)
Clinical Trials Experience
Because clinical trials are conducted under widely varying conditions, adverse reaction rates observed in the clinical trials of a drug cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice.
In 718 patients treated for shorter periods, i.e., 2 weeks or less, with CATAFLAMTM (diclofenac potassium tablets, USP), adverse reactions were reported one-half to one-tenth as frequently as by patients treated for longer periods. In a 6-month, double-blind trial comparing CATAFLAM (N = 196) versus diclofenac sodium delayed-release tablets (N = 197) versus ibuprofen (N = 197), adverse reactions were similar in nature and frequency.
In patients taking CATAFLAM or other NSAIDs, the most frequently reported adverse experiences occurring in approximately 1%-10% of patients are:
Gastrointestinal experiences including abdominal pain, constipation, diarrhea, dyspepsia, flatulence, gross bleeding/perforation, heartburn, nausea, GI ulcers (gastric/duodenal) and vomiting.
Abnormal renal function, anemia, dizziness, edema, elevated liver enzymes, headaches, increased bleeding time, pruritus, rashes and tinnitus.
Additional adverse experiences reported occasionally include:
Body as a Whole: fever, infection, sepsis
Cardiovascular System: congestive heart failure, hypertension, tachycardia, syncope
Digestive System: dry mouth, esophagitis, gastric/peptic ulcers, gastritis, gastrointestinal bleeding, glossitis, hematemesis, hepatitis, jaundice
Hemic and Lymphatic System: ecchymosis, eosinophilia, leukopenia, melena, purpura, rectal bleeding, stomatitis, thrombocytopenia
Metabolic and Nutritional: weight changes
Nervous System: anxiety, asthenia, confusion, depression, dream abnormalities, drowsiness, insomnia, malaise, nervousness, paresthesia, somnolence, tremors, vertigo
Respiratory System: asthma, dyspnea
Skin and Appendages: alopecia, photosensitivity, sweating increased
Special Senses: blurred vision
Urogenital System: cystitis, dysuria, hematuria, interstitial nephritis, oliguria/polyuria, proteinuria, renal failure
Other adverse reactions, which occur rarely are:
Body as a Whole: anaphylactic reactions, appetite changes, death
Cardiovascular System: arrhythmia, hypotension, myocardial infarction, palpitations, vasculitis
Digestive System: colitis eructation, fulminant hepatitis with and without jaundice, liver failure, liver necrosis, pancreatitis
Hemic and Lymphatic System: agranulocytosis, hemolytic anemia, aplastic anemia, lymphadenopathy, pancytopenia
Metabolic and Nutritional: hyperglycemia
Nervous System: convulsions, coma, hallucinations, meningitis
Respiratory System: respiratory depression, pneumonia
Skin and Appendages: angioedema, toxic epidermal necrolysis, erythema multiforme, exfoliative dermatitis, Stevens Johnson Syndrome, urticaria
Special Senses: conjunctivitis, hearing impairment
To report SUSPECTED ADVERSE EVENTS, contact BluCrest at 1-877-938-4525 FDA at 1-800-FDA-1088 or http://www.fda.gov/ medwatch for voluntary reporting of adverse reactions.
Overdosage
Symptoms following acute NSAID overdosages have been typically limited to lethargy, drowsiness, nausea, vomiting, and epigastric pain, which have been generally reversible with supportive care. Gastrointestinal bleeding has occurred. Hypertension, acute renal failure, respiratory depression, and coma have occurred, but were rare (see WARNINGS: Cardiovascular Thrombotic Events, Gastrointestinal Bleeding, Ulceration, and Perforation, Hypertension, Renal Toxicity and Hyperkalemia).
Manage patients with symptomatic and supportive care following an NSAID overdosage. There are no specific antidotes. Consider emesis and/or activated charcoal (60 to 100 grams in adults, 1 to 2 grams per kg of body weight in pediatric patients) and/or osmotic cathartic in symptomatic patients seen within four hours of ingestion in patients with a large overdose (5 to 10 times the recommended dosage). Forced diuresis, alkalinization of urine, hemodialysis, or hemoperfusion may not be useful due to high protein binding.
For additional information about overdosage treatment contact a poison control center (1-800-222 -1222).
Cataflam Dosage and Administration
CATAFLAM™ (diclofenac potassium tablets, USP) may be administered as 50 mg tablets.
Carefully consider the potential benefits and risks of CATAFLAM and other treatment options before deciding to use CATAFLAM. Use the lowest effective dose for the shortest duration consistent with individual patient treatment goals (see WARNINGS: Gastrointestinal Bleeding, Ulceration, and Perforation).
After observing the response to initial therapy with CATAFLAM, the dose and frequency should be adjusted to suit an individual patient’s needs.
For treatment of pain or primary dysmenorrhea the recommended dosage is 50 mg three times a day. With experience, physicians may find that in some patients an initial dose of 100 mg of CATAFLAM, followed by 50 mg doses, will provide better relief.
For the relief of osteoarthritis, the recommended dosage is 100-150 mg/day in divided doses, 50 mg twice a day or three times a day.
For the relief of rheumatoid arthritis, the recommended dosage is 150-200 mg/day in divided doses, 50 mg three times a day or four times a day.
Different formulations of diclofenac (diclofenac sodium enteric-coated tablets; diclofenac sodium extended-release tablets; diclofenac potassium immediate-release tablets) are not necessarily bioequivalent even if the milligram strength is the same.
How is Cataflam supplied
CATAFLAM™ (diclofenac potassium tablets, USP) 50 mg are available for oral administration as light brown, round shaped, unscored, film coated tablets, imprinted «AMI» on one side and «DP» over «50» on the other side. They are supplied as follows:
| NDC 73684-150-60 | Bottles of 60 |
Dispense in a tight, light-resistant container as defined in the USP using a child resistant closure.
Keep container tightly closed.
Store at 20° to 25°C (68° to 77°F) [see USP Controlled Room Temperature].
Protect from moisture.
PHARMACIST: Dispense a Medication Guide with each prescription.
Manufactured for:
Blucrest Pharmaceuticals, LLC.
Hazlet, NJ 07730
Revision date: March 2021
| Medication Guide for Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | ||
| What is the most important information I should know about medicines called Nonsteroidal Anti- Inflammatory Drugs (NSAIDs)? | ||
NSAIDs can cause serious side effects, including:
Do not take NSAIDs right before or after a heart surgery called a «coronary artery bypass graft (CABG)».
The risk of getting an ulcer or bleeding increases with: |
||
|
||
|
|
|
NSAIDs should only be used:
|
||
| What are NSAIDs? NSAIDs are used to treat pain and redness, swelling, and heat (inflammation) from medical conditions such as different types of arthritis, menstrual cramps, and other types of short-term pain. |
||
| Who should not take NSAIDs? Do not take NSAIDs:
|
||
Before taking NSAIDs, tell your healthcare provider about all of your medical conditions, including if you:
Tell your healthcare provider about all of the medicines you take, including prescription or over- the-counter medicines, vitamins or herbal supplements. NSAIDs and some other medicines can interact with each other and cause serious side effects. Do not start taking any new medicine without talking to your healthcare provider first.
Get emergency help right away if you have any of the following symptoms: |
||
|
|
|
| Stop taking your NSAID and call your healthcare provider right away if you get any of the following symptoms: | ||
|
|
|
| If you take too much of your NSAID, call your healthcare provider or get medical help right away. These are not all the possible side effects of NSAIDs. For more information, ask your healthcare provider or pharmacist about NSAIDs. Call your doctor for medical advice about side effects. You may report side effects to FDA at 1- 800-FDA-1088. Other information about NSAIDs
|
||
| General information about the safe and effective use of NSAIDs Medicines are sometimes prescribed for purposes other than those listed in a Medication Guide. Do not use NSAIDs for a condition for which they were not prescribed. Do not give NSAIDs to other people, even if they have the same symptoms that you have. They may harm them. If you would like more information about NSAIDs, talk with your healthcare provider. You can ask your pharmacist or healthcare provider for information about NSAIDs that is written for health professionals. For more information, please visit: www.blucrestpharma.com or call BluCrest at 1-877-938-4525 This Medication Guide has been approved by the U.S. Food and Drug Administration. The brands listed are trademarks of their respective owners. Manufactured for: Blucrest Pharmaceuticals, LLC. Hazlet, NJ 07730 Revised: 03/2021 |
PRINCIPAL DISPLAY PANEL — 50 mg Tablet Bottle Label
NDC 73684-150-60
Cataflam™
(diclofenac potassium tablets, USP)
50 mg
PHARMACIST: Dispense the
Medication Guide provided
separately to each patient.
Rx Only
60 TABLETS
BluCrest
PHARMACEUTICALS LLC.

