ПРИМЕНЕНИЕ ДИСПЕРСИОННОГО АНАЛИЗА ПРИ РАЗРАБОТКЕ СОСТАВА И ТЕХНОЛОГИИ ТАБЛЕТОК КЕМАНТАНА С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Михеева А.С.
1
Блынская Е.В.
1
Алексеев К.В.
1
1 ФГБНУ «НИИ фармакологии имени В.В. Заксова»
В ФГБНУ «НИИ фармакологии имени В.В. Закусова» синтезировали оригинальную субстанцию кемантан (5-гидроксиадамантан-2-он), которая вошла в федеральную программу по развитию здравоохранения «2020». При разработке твердой лекарственной формы с модифицированным высвобождением для анализа полученных данных и оптимизации состава нами был применен двухфакторный дисперсионный анализ. Учитывались следующие характеристики, влияющие на таблеточную массу: сыпучесть (г/сек) и насыпная плотность (г/см3) – и влияющие на таблетки: прочность на сжатие (кГ/см2), прочность на истираемость ( %) и количественное высвобождение действующего вещества за восемь часов ( %). Изучили влияние факторов (A – количественное соотношение кемантана к вспомогательным веществам, а1 – 0,5:1, а2 – 1:1, а3 – 1:2; B – вид вспомогательного вещества, b1 – Kollidon SR, b2 – eudragit RS, b3 – Methocel K100M, b4 – Methocel K4M, b5 – Carbopol 71G b6 – КПН) на вышеуказанные характеристики. Проанализировав полученные данные, определили факторы, повлиявшие на качество таблеточной массы и таблеток. Оценили изменения параметров внутри факторов.
кемантан
ишемия головного мозга
дисперсионный анализ
модифицированное высвобождение
1. Alekseev K.V., Blynskaja E.V., Tihonova N.V. Fharmatsia, 2014, no. 7, pp. 34–38.
2. Fedin A.I. Consilium Medicum, 2000, T. 2, no. 12, pp. 6–12.
3. Jahno N.N., Parfenov V.A. Consilium Medicum, 2000, T. 2, no. 12.
4. Kuznecova E.V., Jarosh A.K., Buhtiarova T.A. Zhurnal NAMN Ukraini. 2013. T. 19, no. 1. pp. 12–22.
5. Litvin E.A., Kolyvanov G.P., Zherdev V.P. Farmakokinetika i farmakodinamika, 2012, no. 1, pp. 18–24.
Случаи поражения нервной и сосудистых систем за последнии годы участились. В течение последних 15 лет Российская Федерация прочно занимает первое место в мире по смертности от цереброваскулярных заболеваний. Частота ишемической болезни мозга составляет 8–10 случаев на 1000 населения. По статистическим данным ВОЗ, в большинстве стран мира среди причин смерти цереброваскулярные заболевания находятся на третьем месте. В России сосудистые поражения головного мозга в структуре летальности прочно обосновались на второй позиции (21,4 %), уступая только ишемической болезни сердца (25,7 %) и оставив далеко позади себя онкологические заболевания (14,7 %). Частным примером сосудистых поражений головного мозга является ишемия. Ишемическая болезнь головного мозга – это нарушение функции головного мозга, наступающее вследствие сужения или закупорки мозговых сосудов, крайний вариант таких проявлений – ишемический инсульт.
Ишемия головного мозга может привести к серьезным последствиям: хроническая дисциркуляторная энцефалопатия, изменения речи, изменения психики, поведения и восприятия. Высокий процент смертности и инвалидизация больных в совокупности с неоднозначными перспективами восстановления нарушенных функций и трудоспособности определяют медико-социальную значимость данной проблемы, делая актуальными разработку и создание лекарственных препаратов антиишемического действия [2, 3].
В ФГБНУ «НИИ фармакологии имени В.В. Закусова» синтезирована оригинальная субстанция кемантана (5-гидроксиадамантан-2-он), производная адамантана. Кемантан входит в программу по развитию здравоохранения «2020», обладает доказанной фармакологической активностью и усиливает кровоснабжение мозга в условиях глобальной преходящей ишемии.
Кемантан представляет кристаллический порошок с неудовлетворительными технологическими параметрами, что свидетельствует о необходимости ввести допонительные вспомогательные вещества при разработке лекарственной формы. Также мы учли, что кемантан имеет малый период полувыведения t1/2 (0,146 ч для крыс и 3,99 для человека). Кемантан полностью всасывается из ЖКТ в кровь, регистрируется уже на 5 минуте после перорального введения, в течение последующих 4 минут концентрация препарата быстро снижается, согласно кинетике первого порядка [4, 5].
Для уменьшения частоты приема препарата, мы решили ввести вспомогательные вещества, способствующие пролонгированному высвобождению.
Кемантан (5-гидроксиадамантан-2-он), производные акриловой кислоты (карбофил – Carbopol® 71G, Noveon, США) и целлюлозы (гидроксипропилметилцеллюлоза (гипромеллоза) – Methocel® (Methocel K100M, Methocel K4M) Dow, Германия); интерполимерный комплекс полиметакриловой кислоты и полиэтиленгликоля (композитный полимерный носитель КПН, Россия); производное полиметакриловой кислоты ( Eudragit® RS, Evonik Industries AG, Германия).
Для определения технологических параметров таблеточной массы и таблеток мы использовали методы, описанные в Фармакопее XII.
При обработке полученных результатов мы использовали двухфакторный дисперсионный анализ.
Экспериментальная часть. Для определения состава таблеток кемантана с модифицированным высвобождением мы применили двухфакторный дисперсионный анализ. С помощью критерия Фишера F, который показывает однородность дисперсии, оценивалась степень влияния фактора на технологические характеристики таблеточной массы и таблеток (p < 0,05, Fэксп > Fтабл) [1].
В качестве основных параметров, влияющих на таблеточную смесь, приняты Y1 – сыпучесть г/с, Y2 – насыпная плотность г/см3. Параметры, влияющие на технологические характеристики таблеток, нами рассмотрены: Y3 – прочность таблеток на сжатие (кГ/см2); Y4 – прочность таблеток на истирание ( %); Y5 – высвобождение действующего вещества из таблеток за 8 часов ( %).
В качестве факторов, влияющих на технологические параметры таблеточной массы и таблеток, выбрали: A – соотношение действующего вещества к вспомогательному, а1 – 0,5:1, а2 – 1:1, а3 – 1:2; B – вид вспомогательного вещества, b1 – Kollidon SR, b2 – eudragit RS, b3 – Methocel K100M, b4 – Methocel K4M, b5 – Carbopol 71G b6 – КПН.
Для проведения дисперсионного анализа мы составили 18 модельных составов. Для каждого состава были изучены технологические параметры: сыпучесть (г/с), насыпная плотность (г/см3). Далее смесь прессовали на ручном гидравлическом прессе (ПРГ-50, ВНИР, Россия), при давлении 4,0 кН и рассматривали технологические характеристики таблеток (прочность на сжатие (кГ/см2), прочность на истираемость ( %), количественное определение действующего вещества высвободившегося за 8 часов ( %).
Результаты изучения технологических параметров модельных смесей и таблеток представлены в табл. 1.
Таблица 1
Результаты испытания технологических параметров таблеточной массы и таблеток кемантана с модифицированным высвобождением
|
сыпучесть |
насыпная плотность |
прочность на раскол |
истераемость |
высвобождение за 8 часов |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1 |
4,61 |
0,456 |
81 |
99,7 |
29,99 |
|
2 |
5,29 |
0,582 |
109 |
99,9 |
20,52 |
|
3 |
6,12 |
0,595 |
150 |
99,99 |
7,49 |
|
4 |
3,86 |
0,464 |
75 |
99,89 |
100 |
|
5 |
3,95 |
0,526 |
91,5 |
99,9 |
51,79 |
|
6 |
4,05 |
0,569 |
60 |
99,8 |
39,8 |
|
7 |
5,01 |
0,396 |
100 |
99,9 |
98,37 |
|
8 |
6,87 |
0,482 |
137,5 |
99,9 |
51,79 |
|
9 |
8,12 |
0,589 |
150 |
99,99 |
18,24 |
|
Окончание табл. 1 |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
10 |
4,11 |
0,418 |
110 |
99,9 |
51,96 |
|
11 |
6,27 |
0,562 |
135 |
99,9 |
50,96 |
|
12 |
7,2 |
0,593 |
137,5 |
99,9 |
30,29 |
|
13 |
6,34 |
0,36 |
149 |
99,99 |
50,11 |
|
14 |
6,49 |
0,368 |
150 |
99,9 |
27,33 |
|
15 |
7,21 |
0,371 |
150 |
99,99 |
20,4 |
|
16 |
1,89 |
0,182 |
140 |
99,9 |
65,2 |
|
17 |
0,65 |
0,18 |
150 |
99,9 |
31,95 |
|
18 |
0,25 |
0,17 |
150 |
99,9 |
29,12 |

Рис. 1. Средние значения сыпучести по факторам

Рис. 2. Средние значения насыпной плотности по факторам

Рис. 3. Средние значения прочности на сжатие по факторам

Рис. 4. Средние значения истераемости по факторам
Для оценки отдельных параметров внутри факторов рассчитывали среднее значение для каждого уровня и согласно полученным данным строили гистограммы.
При анализе модельных смесей на сыпучесть значения SS1, SS2 и SS соответствуют 9201,154; 10947,783 и 9236,93. Влияние факторов на сыпучесть практически одинаково, однако по фактору А оно преобладает и равно 58,3 %, значение по фактору B = 41,7 %. Доля неконтролируемых случайных ошибок 0,39 %, возможно, связана с погрешностью измерений.
Для оценки параметров внутри факторов мы рассчитали средние значения для каждого уровня и построили гистограммы. На рис. 1 отображено, что наилучший результат по сыпучести имеет Eudragit RS, а наихудший принадлежит Kollidon SR.
Далее мы рассмотрели насыпную плотность и получили следующие результаты: SS1 = 0,333, SS2 = 0,353и SS = 0,334. Доля на неконтролируемую ошибку 0,34 %. Влияние фактора B соответствует 82,6 %, фактора A – 17,4 %.
При увеличении доли вспомогательных веществ увеличивается насыпная плотность, значения Kollidon SR, Eudragit RS и Methocel K4M имеют близкие значения (рис. 2).
После изучения характеристик модельных смесей их прессовали вручную на ручном гидравлическом прессе (ПРГ-50, ВНИР, Россия), при давлении 4,0 кН и рассматривали технологические характеристики таблеток.
Прочность на сжатие является одним из важнейших технологических параметров таблеток. Проанализировав полученные экспериментальные данные, мы получили следующие значения: SS1 = 14725,264, SS2 = 16959,403и SS = 14780,688, значение ошибки составило 0,375 %.
На прочность таблеток значительное влияние оказывает фактор B – 91,3 %, тогда как воздействие фактора A на качество таблеток составило только 8,7 %.
На рис. 3 видно, что максимальное влияние на прочность оказал Carbopol 71G.
Истираемость таблеток также является показателем качества таблеток. Проанализировав данные по истираемости, мы получили значения SS1, SS2 и SS, равные 0,029, 0,082 и 0,029 соответственно, доля случайных ошибок составила 0,94 %, возникновение случайной ошибки возможно из-за неточности измерений.
Влияние фактора B соответствует 75,17 %, фактора A 23,83 %.
На гистограмме отображено, что Carbopol 71G проявил максимальное влияние по сравнению с другими используемыми вспомогательными веществами (рис. 4).
Основным критерием выбора вспомогательного вещества для таблеток кемантана является высвобождение действующего вещества за 8 часов для дальнейшей разработки твердой дозированной формы. Значения составили SS1 = 154239, SS2 = 10947,78316 и SS = 9236,931308 соответственно. Случайная ошибка – 0,39 %.
Влияние факторов практически одинаково, на высвобождение в одинаковой степени влияет как соотношение (фактор A – 58,31 %), так и вид вспомогательного вещества (фактор B – 41,69 %).
Наибольшее влияние на пролонгацию высвобождения оказали Kollidon SR и Carbopol 71G (рис. 5).
Мы определили влияние каждого фактора на качество таблеточной массы и таблеток. Вычислив значения критерия Фишера и сравнив их с табличными, мы определили фактическое значение Fэксп. > Fтабл., это означает, что найденная оценка уравнения регрессии статистически надежна.
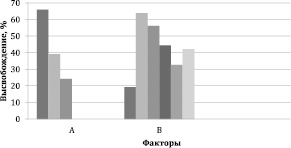
Рис. 5. Средние значения высвобождения действующего вещества из таблеток за 8 часов по факторам
Таблица 2
Дисперсионный анализ результатов испытания таблеточной массы и таблеток кемантана
|
Показатель качества (размерность) |
Источник Дисперсии |
Число степеней свободы |
Сумма квадратов (SS) |
Средний квадрат (MS) |
Fэксп |
Fтабл |
|
|
Таблеточная масса |
Сыпучесть (г/сек) |
Фактор А |
2 |
4,23843 |
2,11922 |
129,4432 |
4,3027 |
|
Фактор В |
5 |
72,18492 |
14,43698 |
881,8207 |
2,5706 |
||
|
Остаток |
17 |
0,27832 |
0,01637 |
– |
– |
||
|
Насыпная плотность (г/см3) |
Фактор А |
2 |
0,05790 |
0,02895 |
427,1099 |
4,302 |
|
|
Фактор В |
5 |
0,27535 |
0,05507 |
812,4675 |
2,5706 |
||
|
Остаток |
17 |
0,00115 |
0,000068 |
– |
– |
||
|
Таблетки |
Прочность на сжатие (кГ/см2) |
Фактор А |
2 |
1281,69444 |
640,84720 |
196,5687 |
4,302 |
|
Фактор В |
5 |
13443,56940 |
2688,71389 |
824,7159 |
2,5706 |
||
|
Остаток |
17 |
55,42200 |
3,26017 |
– |
– |
||
|
Прочность на истирание ( %) |
Фактор А |
2 |
0,00708 |
0,00353 |
223,5193 |
4,302 |
|
|
Фактор В |
5 |
0,021428 |
0,00429 |
270,6794 |
2,5706 |
||
|
Остаток |
17 |
0,00027 |
0,000016 |
– |
– |
||
|
Высвобождение действующего вещества (за 8 часов) |
Фактор А |
2 |
5365,58601 |
2682,76301 |
1274,769 |
4,302 |
|
|
Фактор В |
5 |
3835,56820 |
767,11364 |
364,5053 |
2,5706 |
||
|
Остаток |
17 |
35,77707 |
2,10453 |
– |
– |
Выводы
Проанализировав полученные данные, мы определили, что основным фактором, влияющим на качество таблеточной массы и на качество таблеток, является фактор B, а именно, вид вспомогательного вещества.
Рецензенты:
Колик Л.Г., д.б.н., заведующая лабораторией фармакологической регуляции состояний зависимости «НИИ фармакологии имени В.В. Закусова» РАМН, г. Москва;
Кондаков С.Э., д.ф.н., ведущий научный сотрудник лаборатории химической кинетики МГУ им. М.В. Ломоносова, Химический факультет МГУ им. М.В. Ломоносова, г. Москва.
Работа поступила в редакцию 12.02.2015.
Библиографическая ссылка
Михеева А.С., Блынская Е.В., Алексеев К.В. ПРИМЕНЕНИЕ ДИСПЕРСИОННОГО АНАЛИЗА ПРИ РАЗРАБОТКЕ СОСТАВА И ТЕХНОЛОГИИ ТАБЛЕТОК КЕМАНТАНА С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ // Фундаментальные исследования. – 2015. – № 2-2.
– С. 330-334;
URL: https://fundamental-research.ru/ru/article/view?id=36811 (дата обращения: 06.09.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Меманталь® (Memantal) инструкция по применению
📜 Инструкция по применению Меманталь®
💊 Состав препарата Меманталь®
✅ Применение препарата Меманталь®
📅 Условия хранения Меманталь®
⏳ Срок годности Меманталь®
Описание лекарственного препарата
Меманталь®
(Memantal)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2022 года.
Дата обновления: 2021.11.18
Лекарственная форма
| Меманталь® |
Таб., покр. пленочной оболочкой, 10 мг: 28, 30, 60, 90, 100 или 112 шт. рег. №: ЛП-000824 |
Форма выпуска, упаковка и состав
препарата Меманталь®
Таблетки, покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые, с широкой риской на одной стороне и маркировкой «M9MN» и «10» на другой.
Вспомогательные вещества: лактозы моногидрат — 149.75 мг, целлюлоза микрокристаллическая — 27.1 мг, тальк — 11.15 мг, кремния диоксид коллоидный — 1.25 мг, магния стеарат — 0.75 мг.
Состав оболочки: Опадрай® белый (лактозы моногидрат — 2.16 мг, гипромеллоза — 1.68 мг, титана диоксид — 1.56 мг, макрогол 4000 — 0.6 мг) — 6 мг.
10 шт. — блистеры (3) — пачки картонные.
10 шт. — блистеры (6) — пачки картонные.
10 шт. — блистеры (9) — пачки картонные.
10 шт. — блистеры (10) — пачки картонные.
14 шт. — блистеры (2) — пачки картонные.
14 шт. — блистеры (8) — пачки картонные.
Фармакологическое действие
Производное адамантана. Является неконкурентным антагонистом N-метил-D-аспартат-рецепторы (NMDA)-рецепторов, оказывает модулирующее действие на глутаматергическую систему. Регулирует транспорт ионов, блокирует кальциевые каналы, нормализует мембранный потенциал, улучшает процесс передачи нервного импульса. Улучшает когнитивные процессы, повышает повседневную активность.
Фармакокинетика
Всасывание и распределение
После приема внутрь мемантин быстро и полностью абсорбируется из ЖКТ. Cmax в плазме крови достигается в течение 2-6 ч. При нормальной функции почек кумуляции мемантина не отмечено.
Метаболизм и выведение
Выведение протекает двухфазно. T1/2 составляет в среднем в первой фазе 4-9 ч, во второй фазе — 40-65 ч. Около 80% мемантина выводится в неизмененном виде. Метаболиты не обладают собственной фармакологической активностью. Выводится с мочой. При щелочной реакции мочи выведение замедляется.
Показания препарата
Меманталь®
- деменция альцгеймеровского типа умеренной и тяжелой степени.
Режим дозирования
Терапия должна проводиться под контролем врача, имеющего опыт в вопросах диагностики и лечения деменции при болезни Альцгеймера. Терапию следует начинать только в том случае, если лицо, оказывающее регулярный уход за пациентом, будет следить за приемом лекарственного препарата пациентом. Диагноз должен быть поставлен в соответствии с действующими рекомендациями.
Переносимость и дозу препарата следует регулярно оценивать, преимущественно в течение 3 месяцев после начала терапии. Затем следует регулярно оценивать клиническую эффективность лекарственного препарата и переносимость терапии в соответствии с действующими клиническими рекомендациями. Поддерживающую терапию можно продолжать неопределенно долго при наличии терапевтического эффекта и хорошей переносимости препарата. Следует прекратить применение препарата, если терапевтический эффект более не наблюдается или если пациент не переносит лечение.
Препарат принимают внутрь, 1 раз/сут, всегда в одно и то же время, независимо от приема пищи. Режим дозирования устанавливают индивидуально. Начинать лечение рекомендуют с назначения минимальной эффективной дозы.
Назначают препарат в течение 1-й недели терапии (дни 1-7) в дозе 5 мг/сут, в течение 2-й недели (дни 8-14) — в дозе 10 мг/сут, в течение 3-й недели (дни 15-21) — в дозе 15 мг/сут, в течение 4-й недели (дни 22-28) — в дозе 20 мг/сут. Максимальная суточная доза 20 мг.
У пациентов старше 65 лет, а также у пациентов с КК 50-80 мл/мин, коррекция дозы не требуется. Для пациентов с умеренной почечной недостаточностью (КК 30-49 мл/мин) суточная доза составляет 10 мг. В дальнейшем, при хорошей переносимости препарата в течение 7 недель, дозу можно увеличить до 20 мг по стандартной схеме.
Инструкция по делению таблетки
Поместить таблетку округлой стороной на твердую поверхность риской вверх. Надавить указательным и большим пальцем одной из рук на противоположные стороны таблетки, продолжать оказывать давления пальцами до тех пор, пока таблетка не разломится на две части.
Побочное действие
Частота возникновения нежелательных реакций классифицировалась следующим образом: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000), частота не установлена (в настоящее время данные о распространенности побочных реакций отсутствуют).
Инфекционные и паразитарные заболевания: нечасто — грибковые инфекции.
Со стороны иммунной системы: часто — гиперчувствительность к мемантину или другим компонентам, входящим в состав препарата.
Нарушения психики: нечасто — спутанность сознания, галлюцинации (главным образом, у пациентов с тяжелой степенью болезни Альцгеймера); частота не установлена — психотические реакции.
Со стороны нервной системы: часто — головная боль, сонливость, головокружение, нарушение равновесия; нечасто — нарушение походки; очень редко — судороги, эпилептические припадки.
Со стороны сердца: нечасто — сердечная недостаточность, пороки сердца.
Со стороны сосудов: часто — повышение АД, венозный тромбоз и/или тромбоэмболия.
Со стороны дыхательной системы: часто — одышка.
Со стороны ЖКТ: часто — запор; редко — тошнота, рвота; частота не установлена — панкреатит.
Со стороны печени и желчевыводящих путей: часто — нарушение функциональных проб печени.
Прочие: нечасто — утомляемость, общая слабость.
При болезни Альцгеймера у пациентов в пострегистрационных исследованиях были зарегистрированы депрессия, суицидальные мысли и случаи суицида.
В постмаркетинговом периоде сообщалось о следующих нежелательных реакциях: агранулоцитоз, лейкопения (включая нейтропению), панцитопения, тромбоцитопения, тромбоцитопеническая пурпура, гепатит, острая почечная недостаточность, синдром Стивенса-Джонсона.
Противопоказания к применению
- индивидуальная повышенная чувствительность к препарату;
- тяжелые нарушения функции почек (КК менее 5-29 мл/мин);
- тяжелая печеночная недостаточность;
- беременность;
- грудное вскармливание;
- детский возраст до 18 лет (эффективность и безопасность не установлены);
- непереносимость лактозы, дефицит лактазы lapp или глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат).
C осторожностью назначают пациентам с тиреотоксикозом, эпилепсией; предрасположенностью к развитию судорог; при одновременном применении антагонистов NMDA-рецепторов (амантадин, кетамин, декстрометорфан), наличии факторов, повышающих рН мочи (резкая смена диеты, обильный прием щелочных желудочных буферов), почечном канальцевом ацидозе, тяжелых инфекциях мочевыводящих путей, инфаркте миокарда в анамнезе, сердечной недостаточности III-IV функционального класса (по классификации NYHA), неконтролируемой артериальной гипертензии, почечной и печеночной недостаточности.
Применение при беременности и кормлении грудью
Нет данных о применение мемантина у беременных женщин. Мемантин следует применять только в том случае, когда ожидаемая польза для матери превышает потенциальный риск для плода.
Нет данных о проникновении мемантина в грудное молоко. Принимая во внимание липофильную структуру активного вещества препарата, можно предположить то, что мемантин может проникать в грудное молоко, в связи с чем рекомендуется прекратить грудное вскармливание во время приема препарата.
Применение при нарушениях функции печени
Противопоказано применение при тяжелой печеночной недостаточности.
С осторожностью назначают препарат при печеночной недостаточности.
Применение при нарушениях функции почек
Противопоказано применение при тяжелых нарушениях функции почек (КК менее 5-29 мл/мин).
С осторожностью назначают препарат при почечной недостаточности.
Применение у детей
Противопоказано применение в детском возрасте до 18 лет.
Применение у пожилых пациентов
У пациентов старше 65 лет коррекция дозы не требуется.
Особые указания
С осторожностью назначают больным с тиреотоксикозом, эпилепсией, судорогами (в т.ч. в анамнезе); при одновременном применении антагонистов NMDA-рецепторов (амантадин, кетамин, декстрометорфан), наличии факторов, повышающих рН мочи (резкая смена диеты, обильный прием щелочных желудочных буферов), тяжелых инфекциях мочевыводящих путей, инфаркте миокарда в анамнезе, сердечной недостаточности III-IV функционального класса (по классификации NYHA), неконтролируемой артериальной гипертензии, почечной и печеночной недостаточности.
Влияние на способность к управлению транспортными средствами и механизмами
Мемантин может вызывать изменение скорости реакции, поэтому необходимо воздержаться от потенциально опасных видов деятельности, которые требуют повышенной концентрации внимания и скорости психомоторных реакций.
Передозировка
Симптомы: головокружение, тремор, ажитация, сонливость, спутанность сознания, возбуждение, ступор, судороги, психоз, агрессивность, галлюцинации, рвота, шаткость походки, диарея.
Лечение: промывание желудка, прием активированного угля, симптоматическая терапия. Специфического антидота нет.
Лекарственное взаимодействие
При одновременном применении с препаратами леводопы, антагонистами допаминовых рецепторов, м-холиноблокаторами действие последних может усиливаться.
При одновременном применении с барбитуратами и нейролептиками действие последних может уменьшаться.
При совместном применении может изменить (усилить или уменьшить) действие дантролена или баклофена, поэтому дозы препаратов следует подбирать индивидуально.
Следует избегать одновременного приема с амантадином, кетамином, фенитоином и декстрометорфаном из-за повышения риска развития психоза.
Возможно повышение в плазме крови концентрации циметидина, ранитидина, прокаинамида, хинидина, хинина и никотина при совместном приеме с мемантином.
Возможно снижение уровня гидрохлоротиазида при совместном применении с мемантином. Мемантин способен увеличивать экскрецию гидрохлоротиазида.
Возможно повышение MHO у пациентов, принимающих пероральные антикоагулянты (варфарин).
Одновременное применение с антидепрессантами, селективными ингибиторами обратного захвата серотонина и ингибиторами МАО требует тщательного наблюдения за пациентами.
В условиях in vitro мемантин не ингибирует изоферменты CYP1A2, 2А6, 2С9, 2D6, 2Е1, 3А, флавинсодержащую монооксидазу, эпоксидгидролазу или сульфатирование.
Условия хранения препарата Меманталь®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°C.
Срок годности препарата Меманталь®
Срок годности — 5 лет. Не применять по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ФАРМФИРМА СОТЕКС ЗАО
(Россия)

|
|
141345 Московская обл., |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Акатинол Мемантин
(МЕРЦ ФАРМА, Россия)
Акатинол Мемантин
(MERZ PHARMA, Германия)
Ауранекс
(Pharmaceutical Works «POLPHARMA», Польша)
Земотин®
(SUN PHARMACEUTICAL INDUSTRIES, Индия)
Марукса
(КРКА-РУС, Россия)
Меманейрин
(БИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ И СИСТЕМЫ, Россия)
Мемантин
(НПЦ ФАРМЗАЩИТА, Россия)
Мемантин
(ИЗВАРИНО ФАРМА, Россия)
Мемантин
(ФАРМАЦЕВТИЧЕСКИЕ ПРОЕКТЫ, Россия)
Мемантин
(АТОЛЛ, Россия)
Все аналоги
Меманталь — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-000824
Торговое название препарата:
Меманталь®
Международное непатентованное название:
мемантин
Лекарственная форма:
таблетки, покрытые пленочной оболочкой
Состав:
1 таблетка, покрытая пленочной оболочкой, содержит:
активное вещество: мемантина гидрохлорид 10,00 мг;
вспомогательные вещества:
ядро таблетки — лактозы моногидрат 149,75 мг, целлюлоза микрокристаллическая 27,10 мг, тальк 11,15 мг, кремния диоксид коллоидный 1,25 мг, магния стеарат 0,75 мг;
оболочка — Опадрай® белый (лактозы моногидрат 2,16 мг, гипромеллоза 1,68 мг, титана диоксид 1,56 мг, макрогол-4000 0,60 мг) — 6,00 мг.
Описание
Круглые двояковыпуклые таблетки белого цвета, покрытые пленочной оболочкой с широкой риской на одной стороне и маркировкой «M9MN» и «10» на другой.
Фармакотерапевтическая группа:
деменции средство лечения
Koд ATX: N06DX01
Фармакологические свойства
Фармакодинамика
Обладает ноотропным, церебровазодилатирующим, противогипоксическим и психостимулирующим действием. Производное адамантана, по химической структуре и фармакологическим свойствам близок к амантадину. Блокирует глутаматные N-метил-D-аспартат-рецепторы (NMDA-рецепторы) (в том числе в черной субстанции), тем самым снижая чрезмерное стимулирующее влияние кортикальных глутаматных нейронов на неостратум, развивающееся на фоне недостаточного выделения дофамина. Уменьшая поступление ионизированного кальция в нейроны, снижает возможность их деструкции. В большей степени влияет на скованность (ригидность и брадикинезию). Улучшает ослабленную память, концентрацию внимания, уменьшает утомляемость и симптомы депрессии, уменьшает спастичность, вызванную заболеваниями и повреждениями мозга.
Фармакокинетика
После приема внутрь мемантин быстро и полностью абсорбируется из желудочно-кишечного тракта. Максимальная концентрация в плазме крови достигается в течение 2-6 часов.
При нормальной функции почек кумуляции мемантина не отмечено.
Выведение протекает двухфазно. Период полувыведения составляет в среднем в первой фазе 4-9 часов, во второй фазе — 40-65 часов. Около 80% мемантина выводится в неизмененном виде. Метаболиты не обладают собственной фармакологической активностью. Выводится с мочой. При щелочной реакции мочи выведение замедляется.
Показания к применению
Противопоказания
Индивидуальная повышенная чувствительность к препарату, тяжелые нарушения функции почек (клиренс креатинина (КК) менее 5-29 мл/мин), тяжелая печеночная недостаточность, беременность, грудное вскармливание, детский возраст до 18 лет (эффективность и безопасность не установлены); непереносимость лактозы, дефицит лактазы Лаппа или глюкозо-галактозная мальабсорбция (препарат содержит лактозы моногидрат).
С осторожностью
назначают больным с тиреотоксикозом, эпилепсией, судорогами (в том числе в анамнезе); одновременное применение антагонистов NMDA-рецепторов (амантадин, кетамин, декстрометорфан), наличие факторов, повышающих рН мочи (резкая смена диеты, обильный прием щелочных желудочных буферов), тяжелые инфекции мочевыводящих путей, инфаркт миокарда в анамнезе, сердечная недостаточность (III-IV функциональный класс по классификации NYHA), неконтролируемая артериальная гипертензия, почечная и печеночная недостаточность.
Применение при беременности и в период лактации
Нет данных о применении мемантина у беременных женщин. Мемантин следует применять только в том случае, когда ожидаемая польза для матери превышает потенциальный риск для плода.
Нет данных о проникновении мемантина в грудное молоко. Принимая во внимание липофильную структуру активного вещества препарата, можно предположить то, что мемантин может проникать в грудное молоко, в связи с чем рекомендуется прекратить грудное вскармливание во время приема препарата.
Способ применения и дозы
Препарат принимают внутрь, один раз в день, всегда в одно и то же время, независимо от приема пищи. Режим дозирования устанавливают индивидуально. Начинать лечение рекомендуют с назначения минимальной эффективной дозы.
Назначают препарат в течение 1-й недели терапии (дни 1-7) в дозе 5 мг/сут, в течение 2-й недели (дни 8-14) — в дозе 10 мг/сут, в течение 3-й недели (дни 15-21) — в дозе 15 мг/сут, в течение 4-ой недели (дни 22-28) — в дозе 20 мг/сут. Максимальная суточная доза 20 мг. У пациентов старше 65 лет, а также больных с КК 50-80 мл/мин, коррекция дозы не требуется. Для больных с умеренной почечной недостаточностью (КК 30-49 мл/мин) суточная доза составляет 10 мг. В дальнейшем, при хорошей переносимости препарата в течение 7 недель, дозу можно увеличить до 20 мг по стандартной схеме.
Инструкция по делению таблетки
Поместите таблетку округлой стороной на твердую поверхность риской вверх. Надавите указательным и большим пальцем одной из рук на противоположные стороны таблетки, продолжайте оказывать давление пальцами до тех пор, пока таблетка не разломится на две части (смотрите иллюстрацию, представленную ниже).

Побочное действие
Частота возникновения нежелательных реакций классифицировалась следующим образом: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000), частота не установлена (в настоящее время данные о распространенности побочных реакций отсутствуют).
Со стороны центральной нервной системы: часто — головная боль, сонливость, головокружение; редко — спутанность сознания, галлюцинации (главным образом, у пациентов с болезнью Альцгеймера на стадии тяжелой деменции), нарушение походки; очень редко — судороги; частота не установлена — психотические реакции.
Со стороны пищеварительной системы: часто — запор; редко — тошнота, рвота; частота не установлена — панкреатит.
Со стороны сердечно-сосудистой системы: редко — артериальная гипертензия, венозный тромбоз/тромбоэмболия.
Прочие: редко — утомляемость, грибковые инфекции.
Имеются отдельные сообщения о возникновении этих побочных реакций при применении мемантина в клинической практике:
Головокружение, сонливость, повышенная возбудимость, повышенная утомляемость, беспокойство, повышение внутричерепного давления, тошнота, галлюцинации, головная боль, нарушения сознания, мышечный гипертонус, нарушения походки, депрессия, судороги, психотические реакции, суицидальные мысли, запор, тошнота, панкреатит, кандидомикоз, повышение артериального давления, рвота, цистит, повышение либидо, венозный тромбоз, тромбоэмболия, аллергические реакции.
Передозировка
Симптомы: головокружение, тремор, ажитация, сонливость, спутанность сознания, возбуждение, ступор, судороги, психоз, агрессивность, галлюцинации, рвота, шаткость походки, диарея.
Лечение: промывание желудка, прием активированного угля, симптоматическая терапия. Специфического антидота нет.
Взаимодействие с другими лекарственными препаратами
При одновременном применении с препаратами леводопы, антагонистами дофаминовых рецепторов, м-холиноблокаторами действие последних может усиливаться. При одновременном применении с барбитуратами и нейролептиками действие последних может уменьшаться.
При совместном применении может изменить (усилить или уменьшить) действие дантролена или баклофена, поэтому дозы препаратов следует подбирать индивидуально.
Следует избегать одновременного приема с амантадином, кетамином, фенитоином и декстрометорфаном из-за повышения риска развития психоза.
Возможно повышение в плазме крови концентрации циметидина, ранитадина, прокаинамида, хинидина, хинина и никотина при совместном приеме с мемантином.
Возможно снижение уровня гидрохлоротиазида при совместном применении с мемантином. Мемантин способен увеличивать экскрецию гидрохлоротиазида. Возможно повышение MHO (международное нормализованное отношение) у пациентов, принимающих пероральные антикоагулянты (варфарин).
Одновременное применение с антидепрессантами, селективными ингибиторами обратного захвата серотонина и ингибиторами моноаминооксидазы требует тщательного наблюдения за пациентами.
Особые указания
С осторожностью назначают больным с тиреотоксикозом, эпилепсией, судорогами (в том числе в анамнезе); одновременное применение антагонистов NMDA-рецепторов (амантадин, кетамин, декстрометорфан), наличие факторов, повышающих рН мочи (резкая смена диеты, обильный прием щелочных желудочных буферов), тяжелые инфекции мочевыводящих путей, инфаркт миокарда в анамнезе, сердечная недостаточность (III-IV функциональный класс по классификации NYHA), неконтролируемая артериальная гипертензия, почечная и печеночная недостаточность.
Влияние на способность к вождению автотранспорта и управлению механизмами
У пациентов с болезнью Альцгеймера на стадии умеренной или тяжелой деменции обычно нарушена способность к вождению автотранспорта и управлению сложными механизмами. Кроме того, мемантин может вызывать изменение скорости реакции, поэтому пациентам необходимо воздерживаться от управления автотранспортом или работы со сложными механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой по 10 мг.
По 10 или 14 таблеток в Ал/ПВХ блистер. По 3, 6, 9 и 10 блистеров по 10 таблеток или 2 и 8 блистеров по 14 таблеток в картонную пачку с инструкцией по применению.
Условия хранения
При температуре не выше 25°С. Хранить в недоступном для детей месте!
Срок годности
3 года. Не использовать по истечении срока годности.
Условия отпуска
По рецепту.
Производитель
«Синтон Испания, С.Л.»
К/Кастелло, 1, Полигоно Лас Салинае, 08830 Сан Бои де Ллобрегат, Испания
Наименование юридического лица, на имя которого выдано регистрационное удостоверение
ЗАО «ФармФирма «Сотекс»
Претензии потребителей направлять по адресу
ЗАО «ФармФирма «Сотекс»: 141345, Россия, Московская область, Сергиево-Посадский муниципальный район, сельское поселение Березняковское, пос. Беликово, д.11.
Купить Меманталь в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
В последние годы в России, как и во многих странах мира, увеличивается заболеваемость папилломавирусной инфекцией. Проблема ее диагностики и лечения привлекает внимание врачей различных специальностей: дерматологов, гинекологов, урологов, онкологов, патоморфологов, иммунологов, вирусологов. Это объясняется высокой контагиозностью и тенденцией к росту частоты данного заболевания, а также способностью некоторых разновидностей вируса папилломы человека (ВПЧ) инициировать злокачественные процессы. Последнее большей частью касается генитальных проявлений папилломавирусной инфекции.
Папилломавирус человека (ПВЧ) является эпителиотропным и обнаруживается в кожном покрове, слизистой оболочке рта, конъюнктиве, пищеводе, бронхах, прямой кишке.
В литературе имеются сведения о том, что внедрение ПВЧ-инфекции происходит на уровне незрелых клеток эпителия кожи и слизистых оболочек (базальный слой). Результатом этого внедрения является пролиферация клеток, но без продукции вирусных частиц, поскольку пролиферирующие клетки эпителия не способны поддерживать жизненный цикл вирусов. Полная репликация ПВЧ происходит только в высокоспециализированных клетках многослойного плоского эпителия: зернистых, шиповатых клетах кожи, поверхностных эпителиоцитах слизистой шейки матки. В настоящее время описано порядка 100 типов папилломавирусов. Следует отметить их ткане- и видоспецифичность. Различные типы ПВЧ связаны с различными видами поражений. Установлено, что с урогенитальной областью ассоциированы определенные типы ПВЧ. Выделяются разновидности:
- низкого онкологического риска;
- среднего онкологического риска;
- высокого онкологического риска.
Структура вирусного генома
Вирусы папиллом относятся к семейству паповавирусов (Papovaviridae), поражающих крупный рогатый скот, птиц, а также человека и способных инфицировать базальные клетки кожи и плоского эпителия. Папилломавирусы — эта одна из наиболее гетерогенных групп вирусов, критерием дифференциации которой является степень генетического родства вирусов по данным молекулярной гибридизации: она колеблется от 10 до 85%. Диаметр вирусных частиц составляет 55 нм. Вирус не имеет внешней оболочки. Капсид вируса состоит из 72 капсомеров. Детальный анализ молекулы ДНК ВПЧ стал возможен после разработки методики расщепления ДНК с использованием эндонуклеаз и анализа этих фрагментов с помощью гель-электрофореза.
При изучении препаратов, окрашенных по Папаниколау, определен специфический комплекс признаков, характеризующих ядро и цитоплазму эпителиальных клеток (койлоцитарная атипия клеток), обусловленных цитопатическим действием вирусов папиллом.
Специфической клеткой для этой инфекции является койлоцит, представляющий собой оксифилтноокрашенную клетку эпителия с четкими границами и ясно выраженной перинуклеарной зоной просветления и многочисленными вакуолями в цитоплазме.
Термин «койлоцитарная дисплазия» введен H. S. Stegner в 1981 г. Предполагается, что эти изменения являются следствием репродукции вируса, вызывающего нарушение метаболизма клеток, приводящие к их частичному некрозу с образованием баллоноподобных клеток.
Цитологическое исследование очагов, вызванных ПВЧ-инфекцией, показало, что в клеточном материале находятся большей частью безъядерные, или ортокератотические, клетки. Около 20% чешуек содержат ядра — т. наз. «паракератотические клетки».
Следует помнить, что для выявления ПВЧ одной морфологии недостаточно. В этой связи целесообразно использовать метод полимеразной цепной реакции (ПЦР), гибридизацию in situ. В литературе все чаще появляются сообщения об определении ПВЧ-инфекции в моче с помощью ПЦР как альтернативном методе тестирования образцов из шейки матки. Наряду с этим используется гнездовая ПЦР в одной пробирке и типоспецифическая гибридизация нуклеотидов.
Метод ПЦР используется при малосимптомных или асимптомных формах заболевания, вызванного ПВЧ-инфекцией.
Иммунохимическими методами удается выявить антигены ПВЧ в тканях остроконечных кондилом в 71,4% случаев, методом гибридизации — в 96,5% и с помощью ПЦР — в 10% случаев.
Эффективность ДНК-гибридизации не превышает эффективности гистологического исследования, но позволяет выявить пациентов с высокой степенью этой инфекции.
Клиника ПВЧ-инфекции
Клинические проявления ПВЧ-инфекции гениталий очень вариабельны. В настоящее время они подразделяются на остроконечные кондиломы, папиллярные разновидности кондилом (с выраженным экзофитным ростом), а также плоские и инвертированные (внутриэпителиальные) с эндофитным ростом. Последний вариант, известный также под названием «субклиническая ПВЧ-инфекция», наиболее сложен в диагностическом плане, поскольку отсутствуют четкие микроскопические изменения эпителия. В этом случае для определения четких границ поражения требуются специальные скрининговые приемы.
Своеобразным вариантом остроконечных кондилом является бовеноидный папуллез и гигантская кондилома Бушке — Левенштейна. Остроконечные кондиломы (ОК) представляют собой фиброэпителиальное образование на поверхности кожи и слизистых, с тонкой ножкой или широким основанием в виде единичного узелка или множественных эпителиальных выростов, напоминающих по своему виду петушиные гребни или цветную капусту. Диагностика крупных кондилом затруднений не вызывает. Генитальные кондиломы локализуются в основном в местах мацерации: малые половые губы, влагалище, шейка матки, устье уретры, область ануса, кожные покровы. У мужчин ОК располагаются в области крайней плоти, на головке полового члена, перинатальной области, реже эндоуретально. Инкубационный период колеблется от одного до 12 месяцев (в среднем 3-6 месяцев).
Исследования последних десятилетий свидетельствуют о том, что 85% пациенток с типичным ОК вульвы и промежности имеют дополнительные очаги ПВЧ-инфекции во влагалище или шейке матки, и почти у каждой четвертой из них выявляются ассоциированные ПВЧ-инфекцией заболевания — цервикальные интраэпителиальные неоплазии (ЦВН) различной степени тяжести. Одной из клинических разновидностей заболеваний, вызываемых ПВЧ-инфекцией, являются боуэноидные папулы, связанные с ПЧ 16, иногда пигментированные на коже и слизистых оболочках представителей обоих полов, чаще напоминающие обычные бородавки или себорейный кератоз. В противоположность болезни Боуэна, боуэноидные папулы доброкачественные и спонтанно регрессируют, хотя изредка могут озлокачествляться. Течение бессимптомное.
Некоторые авторы к этой группе заболеваний относят верруциформную эпидермодисплазию Левандовского — Лютца. В основе этого заболевания лежат локальные и генетические нарушения, ассоциирующиеся с хронической ПВЧ-инфекцией.
J. M. Handley и W. J. Dinsmore (1994) на основании литературных данных, а также своих собственных исследований предложили классификацию клинических форм ПВЧ-инфекции и ассоциированных с ней заболеваний (табл.1).
В подавляющем большинстве случаев манифестные формы ПВЧ-инфекции сочетаются с другими заболеваниями, передающимися половым путем. По данным Бернарда К. и Муги К. (1996), манифестные формы ПВЧ-инфекции возникают, как правило, в результате действия ряда факторов:
- социальных;
- инфекционных, связанных с ассоциациями заболеваний, передающихся половым путем (ЗППП);
- связанных с изменением иммунного статуса.
Наиболее существенным является влияние ассоциированных с ПВЧ-поражениями инфекций урогенитального тракта: урогенитального хламидиоза, микоплазмоза, цитомегаловирусной и герпетической инфекции, дисбиотических состояний. Результатом их влияния на течение ПВЧ-инфекции является хронизация процесса, формирование стойких, как правило уже неспецифических воспалительных изменений со стороны мочеполовой сферы и значительные трудности в проведении терапевтических мероприятий.
Значимость наличия сопутствующей инфекции для лечения кондиломатоза объясняется следующими обстоятельствами.
- Наличие ЗППП, ассоциированных с ПВЧ-инфекцией, удлиняет срок лечения последних в среднем в три раза.
- В большинстве случаев рецидивы связаны с вышеуказанной причиной.
- Эпителизация эрозий шейки матки после разрушения кондилом может быть достигнута только при наличии предварительного сканирования по поводу сопутствующих ЗППП и бактериального вагиноза.
В течение многих лет обсуждалась возможность существования взаимосвязи между неоплазиями шейки матки с венерическими заболеваниями. В группе женщин, страдающих инвазивным раком шейки матки (РШМ), отмечена более высокая частота выявления неспецифической микрофлоры, включая трихомонадные и гарднереловые инфекции. Примеры такого влияния обсуждались в отношении Treponema pallidum, Neisseria gonorrhoeae, Chlamidia trachomatis, вируса простого герпеса типа 2, цитомегаловируса, вируса папилломы человека. Эпидемиологические исследования убедительно показали, что неоспоримым фактором риска возникновения предраковых изменений и рака шейки матки является генитальная ПВЧ-инфекция.
Принципы лечения ПВЧ-инфекции
Учитывая тот факт, что специфические противовирусные препараты и вакцины, действующие на ПВЧ, пока отсутствуют, принято считать, что полного устранения вируса из организма достичь невозможно. Задача терапии — устранение клинических и субклинических форм ВПЧ-инфекции.
На сегодняшний день в арсенале практикующих врачей имеется множество методов удаления аногенитальных бородавок. Эффективность их варьирует от 30 до 90%, но ни один из методов не является панацеей, так как частота рецидивов достаточно высока при любом способе лечения. Лечение должно быть строго индивидуальным: необходимо подбирать наиболее оптимальное решение в каждом конкретном случае, иногда учитывая пожелания самого пациента. Проблема рецидивов не зависит от выбора терапии. Рецидивы аногенитальных бородавок связаны чаще всего не с реинфекцией от полового партнера, а с реактивацией инфекции. Существуют три пути развития событий при отсутствии лечения:
- бородавки могут разрешаться самостоятельно;
- оставаться без изменений;
- прогрессировать.
При этом всегда нужно принимать во внимание возможность персистенции вируса при отсутствии каких-либо клинических проявлений.
Выбирая наиболее оптимальный в каждом конкретном случае метод, необходимо руководствоваться четырьмя основными характеристиками:
- эффективность при данной патологии;
- частота рецидивов после лечения;
- переносимость (минимум побочных эффектов);
- простота выполнения процедур.
Помимо удаления аногенитальных бородавок необходимо решать следующие немаловажные задачи:
1. Выявлять и лечить у больных с аногенитальными бородавками (и их половых партнеров) другие заболевания, передающиеся половым путем (ЗППП).
2. Проводить скрининг всех женщин с бородавками аногенитальной области на цервикальную внутриэпителиальную неоплазию (ЦВН) с применением цитологического исследования и кольпоскопии.
3. Поддерживать дальнейшее наблюдение за очагами ЦВН на ранних стадиях для своевременного выявления их прогрессирования или развития микроинвазивной карциномы.
4. Проводить активное лечение аногенитальных бородавок, неоплазий на ранних стадиях, протекающих с развернутой клинической картиной, неоплазий на поздних стадиях и плоскоклеточной карциномы.
5. Давать больным рекомендации по использованию презервативов и ограничению случайных половых контактов для предотвращения инфицирования (и реинфицирования) ВПЧ-инфекцией и другими ЗППП.
По сути, лечение аногенитальных ВПЧ-поражений направлено либо на разрушение папилломатозных очагов тем или иным методом, либо на стимуляцию противовирусного иммунного ответа, возможно сочетание этих подходов.
Деструктивные методы
Физические деструктивные методы
Хирургическое иссечение. В настоящее время применяется нечасто, в основном используется при лечении злокачественных новообразований, когда необходимо широкое иссечение. Данный метод может потребовать госпитализации в связи с тем, что при проведении иссечения может возникнуть достаточно сильное кровотечение, а длительный послеоперационный период потребует специальной терапии.
Электрохирургические методы. К ним относят электрокоагуляцию, электроакустику, фульгацию, электрохирургическое иссечение (электроэксцизия) с использованием электроножа. Не так давно в медицине стали использовать плазму. Нашими учеными был разработан оригинальный плазменный коагулятор (плазмаскин) ЭКХ-1, не имеющий зарубежных аналогов. Измерения температуры в плазме показали, что она может достигать 2000-2500°С. Такие высокие значения температуры, в свою очередь, обеспечивают возможность работать в бесконтактном режиме, существенно снижается время операции и тем самым уменьшается зона некроза. Кроме того, при таком воздействии в большинстве случаев не превышается болевой порог. Данный температурный режим обеспечивает практически полное сжигание новообразований.
Достоинства данного метода:
- доступность;
- дешевизна;
- достаточно высокая эффективность;
- возможность применения в амбулаторных условиях;
- снижена опасность кровотечений.
Недостатки:
- необходимость обезболивания
- при использовании данного метода происходит выделение инфекционной ДНК ВПЧ вместе с образующимся дымом, поэтому необходимо создание адекватных условий для работы — вакуум-экстракция дыма, применение защитных масок.
Лазерное иссечение. Достаточно эффективным и безопасным методом является иссечение бородавок с помощью лазера. В практике применяют неодимовый и СО-лазеры. При использовании СО-лазера меньше повреждаются окружающие ткани, а неодимовый лазер дает лучший гемостатический эффект. Помимо того что лазер физически удаляет поражения, исследования показали, что лазерное излучение оказывает на ВПЧ токсическое действие. Для выполнения процедур требуется хорошо обученный персонал. При использовании лазеров необходимо обезболивание — чаще достаточно местной или локальной анестезии, что позволяет проводить процедуры в амбулаторных условиях. Лазерное иссечение и хирургические методы примерно одинаково эффективны. Лазеротерапию можно успешно применять для лечения распространенных, устойчивых к другой терапии кондилом. Она позволяет прекратить рецидивирование примерно у 40% больных. Исследования показали, что столь малоэффективный результат связан с тем, что СО-лазер неэффективен, когда речь идет об устранении генома из поражений, устойчивых к лечению (по данным метода ПЦР, молекулярно-биологическое излечение наступает у 26% больных).
Использование СО-лазера представляет собой метод выбора при лечении ЦВН. Применяют лазерную конизацию шейки матки. Рецидивы наблюдаются у 2% больных. Мягким методом лазеротерапии является вапоризация, не вызывающая практически никаких осложнений. Лазерная вапоризация успешно применяется при лечении ЦВН низкой степени. Рецидивы наблюдаются у 4% больных.
Лазеротерапия успешно используется для лечения остроконечных кандилом у беременных. Имеются сообщения о лечении беременных на 28–35-й неделе беременности. У большинства пациенток излечение наступало после первого сеанса. Каких-либо осложнений в родах или у новорожденных не выявлено.
Из побочных эффектов следует отметить изъязвление, кровотечение, вторичное инфицирование, рубцевание. Как и при использовании электрохирургических методов, происходит выделение ДНК ВПЧ с дымом, что также требует мер предосторожности.
Лазеротерапия не используется достаточно широко в связи с высокой стоимостью оборудования и необходимостью подготовки опытного персонала.
Криотерапия. Достаточно эффективный и безопасный метод, предполагающий использование в качестве хладагента жидкого азота, оксида азота и диоксида углерода. При этом происходит быстрое замораживание как внутри-, так и внеклеточной жидкости, приводящее к лизису и гибели клеток при оттаивании. Проведение криотерапии обычно не требует обезболивания, хотя при необходимости можно использовать местные анестетики. Криотерапию можно применять при лечении не очень больших бородавок различной локализации. Если же бородавки множественные, то удаление должно проводиться в несколько этапов. Для данного метода характерны следующие побочные явления: развитие местного покраснения, припухлости с последующим образованием пузырей и их изъязвлением. Для уменьшения повреждения окружающих тканей перед процедурой поверхность бородавок обрабатывают KY-гелем, который при замораживании дает возможность осторожно приподнять и отделить очаг поражения от подлежащего эпителия.
Метод может быть использован в гинекологической практике.
Чрезвычайно перспективным нам представляется сочетанное применение криодеструкции и плазменной коагуляции, позволяющее избежать недостатков, присущих вышеописанным методам в отдельности.
Химические деструктивные методы. Данная группа средств включает в себя растворы кислот, щелочей, солей. Среди них можно упомянуть ферезол, пероксид водорода, растворы акрихина и хингамина, препараты ртути и мышьяка, висмута, препараты на основе салициловой и молочной кислот, уксусную и азотную кислоты, соки туи и чистотела. Все эти средства легко доступны, однако обладают невысокой, плохо прогнозируемой эффективностью, дают многочисленные побочные эффекты.
Изопринозин следует применять в сочетании с местнодеструктивными методами лечения.
Эффективность комбинированного лечения ИП, по литературным данным, составляет от 38 до 96%.
Комбинированные методы лечения. Для лечения проявлений ПВЧ-инфекции предлагаются различные методики, основанные на использовании иммунных препаратов в сочетании с лазерным, электрохирургическим и криодеструктивным воздействием.
Сочетанное применение вышеуказанных методов позволяет уменьшить число рецидивов и тем самым повысить эффективность лечения.
Получены хорошие результаты при использовании комбинированного метода лечения кондилом, включающего разрушение очагов с помощью криодеструкции (температура воздействия от –160 до –180°С, экспозиция 40–120 с, двукратно) в сочетании со стимуляцией иммунитета. Для стимуляции местного иммунитета область поражения обрабатывали эмульсией, содержащей интерферон (ИФ), а для стимуляции иммунной системы всего организма назначали препарат кемантан по 0,2 г три раза в день внутрь в течение 10 дней.
Возможно сочетание различных деструктивных методов. При наличии проявлений ПВЧ-инфекции на коже и слизистых оболочках предварительно производят криораспыление в течение 10–30 с, позволяющее четко выявить границы поражения за счет характерной сосочковой поверхности поражений, которая при этом белеет. Затем область поражения подвергается воздействию плазмы (с помощью аппарата плазмаскин).
Ряд исследователей лучшим способом лечения аногенитальных бородавок признают хирургическое удаление всех видимых поражений с последующим местным введением ИФ. В некоторых случаях целесообразно общее и местное применение ИФ перед хирургическим иссечением обширных кондилом.
Терапевтический эффект от применения ИФ отсутствует, если заболевание длится более одного года, а также при иммунодефиците.
В настоящее время существует не так много средств, которые можно использовать после применения деструктивных методов. В частности, сейчас появился препарат импран для местного применения в области очагов поражения после деструктивного воздействия.
Специфическая противовирусная терапия
В настоящее время не существует препаратов, оказывающих специфическое действие на ВПЧ. Известные средства, подавляющие репликацию вируса простого герпеса (ацикловир, ганцикловир), оказались неэффективны при лечении аногенитальной ВПЧ-инфекции.
Теоретически вакцинация представляет собой идеальный метод лечения и профилактики аногенитальных бородавок.
Есть сообщения об эффективном применении индукторов ИФ. Представляет интерес местное применение низкомолекулярного производного имиквидахинолинамина — имиквимода, который является индуктором цитокинов и, в частности, Л-ИФ. Его используют в виде 5%-ного крема три раза в неделю либо ежедневно на ночь до полного исчезновения высыпаний (но не более 4 месяцев). Полное исчезновение кондилом наблюдается в 13–56% случаев. При ежедневном применении чаще развивались местные побочные эффекты: покраснение, отечность, эрозии. Крем особенно показан для лечения субклинической ВПЧ-инфекции. Возможно применение виразола.
Эффект от использования монотерапии ИФ все-таки недостаточно изучен и не очень высок, кроме того, необходимо принимать во внимание высокую стоимость такого лечения. В связи с этим данный метод не получил широкого распространения в практике.
Изопринозин. В последние годы пристальное внимание иммунологов привлек новый иммуномодулятор изопринозин, представляющий собой комплекс инозина и соли N,N-диметиламина-2-пропанола и Р-ацетаминобензойной кислоты. Препарат может применяться в виде таблеток либо раствора для парентерального инъецирования. Активным веществом в этом комплексе, по-видимому, является инозин, а соль аминоспирта стимулирует его проникновение через мембрану лимфоцитов и других клеток.
Изопринозин обладает мощным и широким иммуномодулирующим действием. Многочисленные данные и обширная литература свидетельствуют о том, что in vitro препарат существенно усиливает пролиферацию Т-лимфоцитов, индуцированную митогенами или специфическими антигенами, а также дифференцировку пре-Т-лимфоцитов в более зрелые Т-лимфоциты, сопровождающуюся появлением на их поверхности соответствующих антигенов. ИП также стимулирует индуцированную митогеном пролиферацию В-лимфоцитов. Доказано стимулирующее действие изопринолина на активность натуральных киллерных клеток (НК-клеток) у здоровых людей и функциональную способность цитотоксических Т-лимфоцитов. Препарат улучшает соотношение CD4+/CD8+; повышает выработку Т-лимфоцитами ИЛ-2; содействует созреванию и пролиферации Т-клеток; активизирует синтез ИЛ-1 макрофагами. ИП обладает противовирусным действием и препятствует использованию рибосомальной РНК для размножения вируса. Следует отметить, что в случае применения изопринолина с другими иммунокорректорами он существенно усиливал противовирусное действие последних.
Приняты различные схемы лечения с применением изопринолина в зависимости от размеров кондилом, их локализации и степени малигнизации.
Схема 1: лечение мелких, множественных остроконечных кандилом с низкой степенью малигнизации.
Препарат принимают по 2 табл. три раза в день в течение 14–28 дней.
Схема 2: лечение множественных кондилом с отдельными крупными кондиломами или плоской кондиломы шейки матки.
Среди применяемых в нашей стране и за рубежом химических препаратов, оказывающих деструктивное действие, можно выделить ТХУ и азотную кислоту, а также комбинированный кислотный препарат — солкодерм.
ТХУ и азотная кислота. ТХУ применяется в 80-90%-ной концентрации и вызывает образование локального коагуляционного некроза. Аналогичное действие оказывает раствор азотной кислоты. В силу своей дешевизны и доступности оба метода достаточно широко распространены и по сей день. Кислоты эффективны для лечения кондилом вульвы, препуциального мешка, венечной борозды, головки полового члена, особенно в тех случаях, когда противопоказано применение ПФ и ПФГ. Прижигания проводят один раз в неделю в течение 5-6 недель. Эффективность применения ТХУ и азотной кислоты составляет примерно 70-80%. В некоторых случаях может развиться местная реакция в виде мокнутия и изъязвления.
Солкодерм. Солкодерм — водный раствор, в качестве активной составляющей которого выступают продукты взаимодействия органических кислот (уксусной, щавелевой и молочной) и ионов металлов с азотной
кислотой. Раствор содержит нитриты в количестве 0,02 мг/мл.
Ниже перечислены свойства и механизм действия солкодерма, которые выделяют его среди других препаратов этой группы, использующихся в рамках деструктивных методов:
- при местном применении солкодерм вызывает немедленную прижизненную фиксацию ткани, на которую он наносится;
- действие препарата строго ограничивается местом применения;
- признаком немедленного эффекта является изменение окраски обрабатываемого участка;
- девитализированная ткань высыхает и темнеет (эффект мумификации);
- «мумифицированный» струп отторгается самостоятельно;
- процесс заживления непродолжителен, а осложнения (вторичная инфекция или рубцевание) редки.
Общая характеристика лечения солкодермом:
- препарат оказывает точно ограниченное местное действие на патологически измененную ткань, на которую он наносится, окружающая ткань при этом не повреждается;
- метод пригоден для лечения различных новообразований кожи;
- лечение безболезненно;
- быстрое заживление, отсутствие осложнений;
- лечение проводится амбулаторно и не требует специальной аппаратуры;
- отсутствие каких-либо ограничений для больного.
Показания к применению солкодерма: простые бородавки, подошвенные бородавки, аногенитальные бородавки (остроконечные кондиломы), себорейные кератозы, актинокератозы, базально-клеточные эпителиомы (базалиомы).
Солкодерм очень удобен в применении и достаточно эффективен для лечения кондилом любой локализации. В большинстве случаев достаточно однократного применения.
Цитотоксические препараты
Подофиллин (ПФ). Пофиллин — смола, полученная из растений P.pelatum и P.emodi, растущих в Северной Америке и Гималаях. Для лечения бородавок аногенитальной области применяют 10-25%-ный раствор ПФ в этаноле или настойке бензоина. Он связывается с аппаратом микротрубочек клетки и ингибирует митозы, а также подавляет транспорт нуклеиновых кислот, в результате чего происходит ингибирование синтеза ДНК и клеточного деления.
Применение ПФ является простым, доступным, достаточно безопасным методом лечения, который может быть использован в амбулаторных условиях, а также самостоятельно пациентами. Препарат наносят один-два раза в неделю в течение максимум 5 недель в количестве не более 0,5 мл за одну процедуру. Больному необходимо следить, чтобы вода не попадала на обработанное место в течение 4-6 часов после процедуры. ПФ не рекомендуется применять при вагинальных, цервикальных и внутриэпителиальных бородавках. По сведениям ряда авторов, частота рецидивирования варьирует от 0 до 67%.
Примерно у 10-15% больных развиваются местные побочные реакции в виде мокнущего контактного дерматита. Особенно тяжелые осложнения в виде множественных изъязвлений возникают при неправильном самостоятельном применении. В результате длительного или неправильного применения ПФ у больных могут возникать различные побочные реакции, такие как тошнота, рвота, боли в животе, диарея, симптомы поражения почек, миокарда, печени, ЦНС и костного мозга.
Применение ПФ противопоказано при беременности, т. к. были отмечены случаи тератогенного действия на плод и внутриутробной гибели плода.
Многие исследователи считают ПФ недостаточно изученным и грубоочищенным растительным экстрактом, в связи с чем рекомендуют использовать только высокоочищенные подофиллотоксины, причем самостоятельное применение препарата самими больными нежелательно в силу вышеуказанных осложнений.
Подофиллотоксин (ПФТ) (кондилин). ПФТ — наиболее активная в терапевтическом отношении фракция ПФ. Выпускается в виде растворов 0,25, 0,3 и 0,5%, а также в виде крема 0,15, 0,3 и 0,5%.
Обычно его назначают два раза в день в течение трех дней в неделю подряд на протяжении 4-5 недель.
Несмотря на то что ПФТ лучше очищен по сравнению с ПФ, сообщается о большой частоте побочных явлений при использовании ПФТ, особенно его 0,5%-ного раствора. Наиболее часто в результате применения ПФТ наблюдаются следующие побочные эффекты: местные воспалительные реакции (эритема, жжение, болезненность, зуд, мокнутие и эрозии в области аппликации). Хотя в литературе не описано системных побочных эффектов, рекомендуется ограничивать применение ПФТ дозой 0,2 мл за одну процедуру.
Недостатками ПФТ являются его высокая стоимость и большая длительность лечения.
5-фторурацил (5-ФУ). 5-фторурацил (5-ФУ) является антагонистом пиримидина и обладает способностью нарушать синтез как клеточной, так и вирусной ДНК. Для лечения бородавок аногенитальной области его назначают в виде 5%-ного крема. При лечении интравагинальных бородавок препарат назначается один раз на ночь в течение недели или один раз в неделю в течение 10 недель. Степень эффективности препарата, по мнению различных исследователей, составляет 85-90%. При применении 5-ФУ могут возникнуть мокнущие эрозии на слизистой влагалища, вплоть до развития тяжелого мокнущего контактного дерматита. При лечении бородавок терминальной части уретры крем вводится сразу после мочеиспускания на ночь в течение 3-8 дней. Полное излечение внутриуретральных бородавок наблюдается у 90-95% мужчин. Однако при лечении наблюдается множество побочных эффектов: стеноз и стриктуры уретры, дизурия, изъязвления. Препарат противопоказан при беременности.
Иммунологические методы
Интерферон. Поскольку вирус папилломы человека сохраняется в эпителиальных клетках и использование деструктивных методов не гарантирует от рецидивов, перспективным в этом плане является применение ИФ как в качестве монотерапии, так и в сочетании с другими методами лечения.
ИФ являются эндогенными цитокинами, обладающими противовирусными, антипролиферативными и иммуномодулирующими свойствами. Существуют три основных класса ИФ: лейкоцитарный (Л-ИФ), фибробластный (Ф-ИФ) и Т-лимфоцитарный (Т-ИФ). ИФ можно применять местно, внутриочагово и системно (подкожно, в/м или в/в). Установлено, что при использовании ИФ у пациентов в очагах поражения снижается количество вирусной ДНК (по данным ПЦР), что коррелирует с клиническим улучшением или исчезновением поражения.
Имеются данные, касающиеся использования для лечения кондилом отечественного ИФ — человеческого лейкоцитарного интерферона (ЧЛИ). Его применяли внутриочагово (под папиллому) в дозе 100 000-500 000 МЕ, на курс 3-6 процедур в сочетании с нанесением на поражения интерфероновой мази с активностью 40 МЕ. ЧЛИ можно назначать системно и при лечении распространенных поражений в сочетании с деструктивными методами.
Наиболее эффективным препаратом при различных способах, схемах и дозах введения можно считать Л-ИФ. При системном применении Л-ИФ полное исчезновение бородавок наблюдали у 11–100% пациентов. Эффективность применения Ф-ИФ составила 45–82%. Эффективность Т-ИФ, показанная в разных исследованиях, гораздо ниже, чем у Л-ИФ и Ф-ИФ, и варьирует от 7 до 57%.
Следует помнить, что бессистемное использование различных методов лечения приводит к высокому проценту рецидивов, однако разработка определенных алгоритмов, учитывающих пол больных, локализацию и количество высыпаний, позволяет существенно снизить количество рецидивов.
Таблица 1. Аногенитальная ВПЧ-инфекция и ассоциированные с ВПЧ заболевания
ВПЧ-инфекция
Развернутые клинические формы (видимые невооруженным глазом или не видимые, но определяющиеся при наличии соответствующей симптоматики):
- бородавки (остроконечные кондиломы, плоские кондиломы, вульгарные бородавки)
- симптоматические внутриэпителиальные неоплазии на ранних стадиях — койлоцитоз, дискератоз при отсутствии дисплазии (плоские кондиломы)
Субклинические формы (не видимые вооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/или цитологическом или гистологическом исследовании
- бессимптомные внутриэпителиальные неоплазии (ВН) на ранних стадиях — койлоцитоз, дискератоз при отсутствии дисплазии (плоские бородавки)
Латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ)
назад
Таблица 2. Заболевания, ассоциированные с ВПЧ
Клинические и субклинические формы:
- ВН на ранних стадиях — слабовыраженная дисплазия, /+-/ койлоцитоз, дискератоз (ВН 1 стадия)
- ВН на поздних стадиях — выраженная дисплазия, /+-/ койлоцитоз, дискератоз (ВН 2 стадия)
- ВН на поздних стадиях — тяжелая дисплазия или карцинома in situ /+-/ койлоцитоз, дискератоз (ВН 3 стадия, или CIS)
Микроинвазивная сквамозноклеточная карцинома:
- клинически видимые или невидимые, но при наличии соответствующей симптоматики
- субклинические, не видимые невооруженным глазом и бессимптомные, выявляющиеся только при цитологическом и гистологическом исследовании
- латентные — отсутствие морфологических и гистологических изменений при обнаружении ДНК ПВЧ-инфекции методом молекулярной гибридизации
- внутриэпителиальная неоплазия
Таблица 3. Классификация методов лечения аногенитальных бородавок
Деструктивные методы
- физические
- хирургическое иссечение
- электрохирургические методы
- криотерапия
- лазеротерапия
- химические
- азотная кислота
- трихлоруксусная кислота (ТХУ)
- солкодерм
Цитотоксические методы
- подофиллин (ПФ)
- подофиллотоксин (ПФТ)
- 5-фторурацил
Иммунологические методы
- интерфероны
- изопринозин
Комбинированные методы
- сочетанное применение различных методов
Фармакологические свойства производных аминоадамантана
Адамантан представляет собой каркасное соединение, трициклодекан С10Н16, все кольца которого находятся в конформации «кресло» [3], обладающее оригинальными химическими и биологическими свойствами. Адамантан был впервые выделен в 1933 году из нефти [28]. Считается, что особенности биологического действия производных адамантана во многом связаны с наличием объемного и высоколипофильного каркасного ядра. На основе адамантана создан целый ряд фармакологических средств, обладающих психостимулирующей, противовирусной, иммунотропной, противоопухолевой активностью, адаптогенными свойствами, а также противопаркинсонической активностью.
Примеры наиболее часто встречаемых в медицинской практике препаратов представлены в табл. 1.
Таблица 1. Производные адамантана и их фармакологическая активность
|
№ |
Химическая формула |
Название препарата |
Фармакологическое действие |
|
1 |
Мидантан, Amantadine, Simmetrel, Mantadix, Paramantine, Protexin, Viregite, Virofral и др. |
Противопаркинсоническое, противовирусное средство [12] |
|
|
2 |
Глудантан |
Противопаркинсоническое средство, антидепрессивное, противовирусное [12] |
|
|
3 |
Мемантин |
Противопаркинсоническое средство, средство терапии дегенеративных заболеваний головного мозга [30] |
|
|
4 |
Адапромин |
Противопаркинсоническое, антидепрессивное, противовирусное средство [12] |
|
|
5 |
Кармантадин |
Противопаркинсоническое средство [14] |
|
|
6 |
Допамантин |
Противопаркинсоническое средство [30] |
|
|
7 |
Бемантан |
Противопаркинсоническое средство [6] |
|
|
8 |
Димантан |
Противопаркинсоническое средство [13] |
|
|
9 |
Кемантан |
Иммуностимулирующее, противопаркинсоническое средство [1] |
|
|
11 |
Диадоний |
Недеполяризующий миорелаксант короткого действия [10] |
|
|
12 |
Ремантадин |
Противовирусное средство [14] |
|
|
13 |
Тромантадин, Vir-Merz, ViroSerol, Viruserol |
Противовирусное (противогерпетическое) средство [14] |
|
|
14 |
Сомантадина г/х |
Противовирусное средство [14] |
|
|
15 |
Беметазона-адамантоат (Betsovet) |
Противовоспалительное, противоаллергическое средство [14] |
|
|
16 |
Бромантан |
Иммунотропная и противовирусная активность, адаптоген психостимулятор [17] |
|
|
18 |
Хлодантан |
Адаптоген, иммуностимулятор [16] |
|
|
19 |
|
Гимантан |
Противопаркинсоническое средство [5] |
Биотрансформация производных аминоадамантана
В организме млекопитающих детоксикацию ксенобиотиков осуществляют специальные ферментные системы и мембранно-ассоциированные рецепторы, регулирующие их активность. Процесс метаболизма ксенобиотиков обычно включает две последовательные фазы. В первой фазе поступающие в организм чужеродные соединения активируются с помощью ферментов семейства цитохромов Р450 или микросомальных эпоксид- гидролаз (mEPOX), образуя короткоживущие промежуточные электрофильные метаболиты. Вторая фаза метаболизма связана с созданием из этих метаболитов конъюгатов с различными соединениями с целью повышения растворимости и дальнейшего выведения из организма с мочой [20, 22, 27].
Микросомальные ферменты катализируют реакции гидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфо-окисления и эпоксидирования [8].
Оксигеназные реакции, катализируемые цитохромом Р450, весьма разнообразны. Одна из наиболее широко распространенных реакций окисления ксенобиотиков – реакция окислительного дезалкилирования, которая сопровождается окислением алкильной группы, присоединенной к N-, O- или S-атомам. Второе место по распространенности принадлежит реакциям гидроксилирования циклических соединений, в том числе ароматических, предельных и гетероциклических углеводородов [7].
К настоящему времени не установлено, с участием каких конкретно изоформ цитохрома Р450 идет биотрансформация гимантана. Ферментные системы, вовлеченные в метаболизм производных аминоадамантана, будут рассмотрены на примере таких широко используемых фармакологических агентов, как мидантан, мемантин и другие. Известно, что в метаболизм этих препаратов в значительной степени вовлечены изоформы CYP3A4 и CYP2C19 суперсемейства цитохромов печени P450 [2].
В метаболизм каждого из нижеследующих лекарственных препаратов вовлечены различные изоформы цитохромов P450, поэтому следует подробнее рассмотреть метаболизм каждого из них в отдельности.
Основной путь метаболизма производных аминоадамантана – гидроксилирование адамантильного радикала одной или несколькими –ОН группами. Впоследствии метаболиты образуют конъюгаты с глюкуроновой кислотой. Гидроксилированные производные характеризуются уменьшенной способностью проникновения через ГЭБ по сравнению с неизмененными соединениями.
В экспериментах было показано, что гимантан после введения внутрь длительно находится в организме, интенсивно распределяется по органам и тканям, быстро проникает в головной мозг; в стриатуме обнаружено наибольшее содержание препарата. Многократное, с интервалом 24 ч, введение препарата экспериментальным животным характеризовалось кумуляцией, поскольку интервал между введениями меньше значения периода полувыведения [11].
Однако в экспериментах показано, что при введении внутрь происходит активный метаболизм гимантана с образованием продуктов, обладающих высокой проницаемостью в ткани. Предположено, что он происходит преимущественно по следующим основным направлениям: гидроксилирование адамантанового цикла, метилирование гидроксильной группы, образование конъюгатов.
Вещество DAMP (2,4-диамино-5адамантил-метилпиримидин) быстро метаболизируется микросомальными оксидазами смешанных функций в печени [29].
От 60 до 85% введенного перорально мидантана выводится в неизмененном виде [21]. В моче позвоночных животных определено 10 метаболитов, основной из которых – 1-ацетиламиноадамантан, характерный для большинства животных, также мидантан трансформируется в 1-метиламиноадамантан, и 1,1-дмиетиламиноадамантан, 1-метиленамино-адамантан, в результате это соединение трансформируется в 1-формил-аминоадамантан. Также идентифицировано небольшое количество 1-этилиденаминоадамантана и 1-ацетоксиаминоадамантана. Изо всех метаболитов конъюгаты с глюкуроновой кислотой образует 1-метил-1-оксиметиламиноадамантан.
Ремантадин гидроксилируется в организме позвоночных с последующим и параллельным образованием глюкуронидов [26, 31].
Среди метаболитов мемантина встречается 1-амино-4гидрокси-3,5-диметиладамантан, 1-гидрокси-3,5-диметиладамантан, 1-амино-3-гидрокси-метил-5-метиладамантан, 1-амино-7-гидрокси-3,5- диметиладамантан [33].
Фармакокинетика производных аминоадамантана
Фармакокинетика всей группы препаратов характеризуется относительно низким содержанием аминоадамантанов в плазме крови и высокой интенсивностью распределения по органам и тканям экспериментальных животных и человека. Многие адамантаны способны к кумуляции, подвергаются выраженному эффекту первого прохождения через печень, экскретируются с желчью, обладают хорошей проницаемостью через ГЭБ.
Изменение физико-химических свойств в ряду производных модифицирует фармакокинетику и, следовательно, динамику развития фармакологических эффектов. Чем липофильнее препарат, тем более интенсивно препарат распределяется в жировую ткань, а высокая гидрофильность способствует проникновению в хорошо васкуляризированные органы: мозг, почки, легкие, печень и селезенку.
Препарат АДК-910, будучи гидрофильным, обладает вышеуказанными свойствами, но интенсивнее выводится из организма и не склонен к кумуляции, что в свою очередь обеспечивает низкое значение токсичности: LD50 = 9200 мг/кг.
LD50 бромантана составляет 5640 мг/кг [14].
Мидантан (1-аминоадамантан) быстро всасывается при введении внутрь, у мышей Сmax достигается через 30 мин. Обладает высокой тканевой доступностью.
С мочой мышей выделяется до 63% неизмененного препарата, через 12 часов экскреция обычно заканчивается, однако через 70 часов обнаруживается до 18% препарата, в кале же обнаруживается лишь 2% мидантана. В моче обнаруживается метаболит 1-амио-3-гидроксиадамантана в количестве до 0,1%. В экскрементах обезьян (моча) обнаруживается 54% мидантана и 0,3% неизмененного препарата в кале. В моче человека в течение трех суток определяется до 86% от введенной дозы, большая часть которого приходится на первые сутки [9].
Ремантадин хорошо всасывается из ЖКТ мышей, Cmax достигается через 0,5 часа после перорального введения, t1/2 ремантадина составляла 1,5 часа при дозе 40 мг/кг, биодоступность составила 58,6%, суммарный клиренс 4,3 л/ч*кг. В плазме крови мышей обнаруживается два метаболита ремантадина, гидроксилированные производные. Препарат характеризуется высокой тканевой доступностью, что подтверждается высоким значением объема распределения (7,6 л/кг), Тmах мозга составляет 1 час, обнаруживается до 4,8% от введенной дозы соответственно. Через 12 часов после перорального введения в органах и тканях определяются лишь следовые количества препарата (0,1%), кроме печени (0,2%). Однако радиоактивность меченого 14С-ремантадина определяется в течение 96 часов после введения.
Ремантадин легко проходит через ГЭБ, плаценту, полностью выводится из организма мышей, в т.ч. эмбрионов [19].
Tmax ремантадина у собак достигалось через 1,7 часа после перорального введения, значение концентрации дозозависимо. t1/2 ремантадина составляла 3,3 часа, биодоступность 99,4%, суммарный клиренс 3,7 л/ч*кг, спустя 48 часов после введения, в моче определяется лишь 5% от введенной дозы.
У людей различных возрастных групп наблюдаются различия в фармакокинетике. В старшей возрастной группе (50-70+ лет) отмечены более высокие значения Сmax и t1/2, по сравнению с молодыми (35 лет).
Максимальная концентрация R-ремантадина достигается быстрее его S-изомера, однако последний более активно распределяется по тканям и органам (1128 л против 1082 л), а также реагирует с глюкуроновой кислотой интенсивнее [26].
Мемантин. У крыс при введении внутрибрюшинно (100 мкмоль/кг) уже через 15 минут наступает Сmax, в печени максимальная концентрация достигается через 30 минут, а в мозге – через 60 минут. Через 8 часов определяются следовые количества препарата в плазме крови, а через 24 часа препарат уже не регистрируется в тканях и органах. Сmax мемантина в мозге достигается через час и держится в течение ещё двух часов, однако достигаемый уровень концентрации препарата в мозге при пероральном приеме значительно ниже, чем при внутрибрюшинном, в среднем в 4,4 раза. При этом, мемантин распределён неравномерно: наибольшее содержание вещества наблюдается в височной доле мозга (0,39 мкг/г) и гипоталамусе (0,31 мкг/г), наименьшее – в центральной моторной области (0,11 мкг/г). Такие концентрации обеспечивают необходимый терапевтический эффект.
В плазме крови крыс в среднем уровень концентрации мемантина в 10-20 раз ниже, чем в мозге [32].
При внутрибрюшинном введении препарат в основном выводится с мочой (6-11% неизмененного препарата), нежели с калом (следовые количества), в течение 5-6 часов. Большая часть экскретируемого вещества приходится на 2 часа. До 4% от введенной дозы приходится на метаболиты мемантина [14].
У людей наблюдается высокая вариабельность в значениях выводимого с мочой препарата: от 40 до 70% от введенной дозы. Период полувыведения варьирует от 53 до 97 часов. В среднем ежедневно выделяется 17% от введенной дозы.
Почечный клиренс мемантина в среднем составляет 148,6 мл/мин, причем при защелачивании мочи человека (до рН =8) экскреция и клиренс снижаются, а закисление, наоборот, приводит к ускорению выведения препарата, что вероятно, может быть объяснено канальцевой реабсорбцией в почках, зависящей от рН. При увеличении объема выделяемой мочи почечный клиренс увеличивается пропорционально (6 л жидкости в день создает прирост на 9 мл/мин), однако в абсолютном значении вклад изменения скорости выделения мочи в процесс экскреции препарата мал [23].
В мозге и печени человека обнаруживается метаболит 1-амино-3-гидроксиметил-5-метиладамантан в концентрации 1% от неизмененного препарата, прочие метаболиты в мозге обнаружены не были. Полученные результаты позволяют заключить, что гидроксилированные производные мемантина плохо проникают через ГЭБ и не вносят вклада в фармакологический эффект препарата.
Адапромин быстро всасывается из ЖКТ лабораторных животных в системный кровоток, время достижения максимальной концентрации составляет для крыс 1,34 и 1,48 ч для кроликов соответственно. Высокая концентрация адапромина в крови поддерживается спустя 6 часов после введения, резкое снижение концентрации наблюдается с 8 часов у крыс, а у кроликов – через 10 часов. У лабораторных животных обнаруживаются следовые количества препарата в плазме крови спустя 24 часа после введения. Однако у кроликов t1/2 равно 3 часам, достигаемое за счет интенсивной элиминации водорастворимого адапромина и его метаболитов. Разница в значениях констант элиминации у крыс кроликов вызваны межвидовыми различиями [15].
Наибольшая сорбционная способность у адапромина отмечается для печени, затем легких, почек и мозга. В кале определяется 2,7% общей радиоактивности (внутривенное введение), 10% для перорального способа введения. Вещество выводится с мочой (до 91,5% общей радиоактивности 3Н-адапромина при внутривенном введении и 79,6% при пероральном, из которых 7 процентов приходится на неизмененный препарат) преимущественно в виде глюкуронида. Возможно, это увеличение выведения с калом обеспечено наличием в ЖКТ невсосавшегося препарата или продуктов его биотрансформации. Выведение препарата с калом после внутривенного введения позволяет сделать вывод о внутрипеченочной циркуляции меченого адапромина или его метаболитов.
Адапромин быстро абсорбируется из ЖКТ в кровь, интенсивно распределяется по внутренним органам и тканям, легко преодолевает ГЭБ. Препарат гидрофилен, быстро исчезает из системного кровотока, и выводится с мочой преимущественно в виде глюкуронида.
Кемантан полностью всасывается из ЖКТ в кровь, регистрируется уже на 5 минуте после перорального введения, в течение последующих 4 минут концентрация препарата быстро снижается, согласно кинетике первого порядка. Время достижения максимальной концентрации для перорально вводимой лекарственной формы в среднем составляет 4,5 минут, период полувыведения кемантана колеблется от 7,7 до 8,8 минут, константа элиминации составляет 0,0845 1/мин. Однако собственно значение Сmax для таблеток в среднем в 2,3 раз выше, чем для желатиновых капсул с субстанцией. Относительная биодоступность таблеток также выше по отношению к капсулам (почти в 3 раза).
В организме кроликов кемантан метаболизируется до гидроксильного производного 1,4-адамантандиола. Этот метаболит также быстро регистрируется в плазме крови (5 минут после перорального введения), но его концентрация достигает максимального уровня через 30-45 минут и определяется в течение 3 часов. При инкубировании цельной крови с препаратом наблюдается постепенное снижение его концентрации, в то время как концентрации 1,4-адамантандиола увеличиваются. Это свидетельствует о том, что метаболизм кемантана в значительной степени осуществляется ферментами крови. Интенсивность этого процесса у человека значительно выше, по сравнению с крысами, и неизмененный препарат в плазме крови практически не идентифицируется. Регистрируется только 1,4-адамантандиол, который медленно распределяется по тканям и органам. MRT кемантана у крыс составляет 0,314 ч, а у человека 6,35 ч. Аналогично с t1/2 (0,146 ч для крыс и 3,99 для человека) и kel (4,734 и 0,311 1/ч соответственно) [14].
В группах мужчин и женщин также были обнаружены различия в фармакокинетике: так у женщин препарат полностью выводится из организма в течение 10 часов, в то время как у мужчин он перестает определяться только через 24 часа. У женщин кемантан обнаруживают в крови значительно раньше и в более высокой концентрации по сравнению с мужчинами (Сmax = 1,975 против 1,105 соответственно).
За сутки с мочой экскретируется всего 0,6% от введенной дозы, наиболее интенсивно кемантан и его метаболит выводятся в течение первых шести часов после введения вне зависимости от пола добровольца [4].
Бемантан после введения внутрь крысам быстро всасывается из ЖКТ в системный кровоток и уже через 15 минут определяется в плазме крови, достигая Сmax через 30 минут после введения. Во все временные интервалы бемантан характеризуется высокой тканевой доступностью (kр мозг = 2,0 kр печ = 4,0).
Неизмененный бемантан в незначительных количествах выводится преимущественно с мочой (10% от введенной дозы).
Препарат DAMP липофилен и быстро поглощается клетками [25]. Как и прочие представители данной группы соединений, интенсивно проникает в ткани. Он накапливается в них в значительно больших количествах, чем в плазме крови, особенно это характерно для печени, селезенки, почек и поджелудочной железы [29]. В отличие от прочих паренхиматозных органов, в тканях поджелудочной железы концентрация препарата росла со временем (kp панк в 24 часовой интервал в 21,2 раза выше, чем в первый час после введения), DAMP был распределен по тканям органа неравномерно. Во всех остальных органах через 24 часа концентрация препарата снижается до 1-4% от введенной дозы.
В мозге крыс метаболиты 2,4-диамино-5адамантил-метилпиримидина не обнаружены, что свидетельствует об их неспособности проникать через ГЭБ. Метаболиты составляют 4% от введенной дозы.
Из организма крыс с мочой экскретирует 90% общей радиоактивности в течение 24 часов, 10% радиоактивности покидает организм с калом, частично препарат экскретируется желчью. Из экскретов только 10% приходится на неизменённое вещество [29].
У собак DAMP обнаруживается в моче (63,3%) и кале (10,2%) спустя 48 часов после внутривенного введения. В моче обнаружено два соединения, одно из которых представляет собой гидроксилированный по адамантильному радикалу DAMP и его сульфатный конъюгат [24]. На метаболиты приходится большая часть радиоактивности, экскретируемой с мочой.
При исследовании препарата гимантана методом изотопной метки [3Н] было определено, что гимантан хорошо всасывается из ЖКТ экспериментальных животных, активно метаболизируется, особенно при пероральном способе введения. За 10 суток выводится всего 39,7% радиоактивного эквивалента гимантана от введенной дозы, причем большая часть выводится в первые сутки, из них на неизмененное соединение приходится около 4%. Согласно ранее полученным данным скорость выведения 3Н-гимантана в среднем составляет 38,7 ч. [18] Препарат обладает t1/2 360-402 ч, а его MRT колеблется от 580 до 526 часов в зависимости от способа введения.
После внутривенного введения препарата количество неизмененного соединения составляет 32,26% от уровня радиоактивного эквивалента, а при введении внутрь – 7,24%. Рассчитанная величина абсолютной биодоступности составила 28,3%.
Расчет тотального содержания 3Н-гимантана в перерасчете на весь орган показал, что наибольшее количество радиоактивного эквивалента препарата накапливается в мышцах и сальнике. На долю мышечной ткани приходится около 50% препарата, в то время как его содержание в крови на порядок меньше.
Многократное введение гимантана приводит к кумуляции препарата в крови кроликов.
Список литературы
1. Арцимович Н. Г., Фадеева Т. А., Шалыминова Ю. А. А. С. 1586711 СССР А1 А61 К31112 Иммуностимулирующее средство кемантан. Бюл. № 31 23.08.90.
2. Арчаков А. И. Микросомальное окисление. М.: Наука, 1975. 326 с.
3. Багрий Е. И. Адамантаны: получение, свойства, применение. М.: Наука, 1989. 264 с.
4. Бойко С. С., Жердев В. П., Кисляк Н. А. Использование метода газо-жидкостной хроматографии для изучения фармакокинетики и метаболизма производных адамантана//Химико-фармацевтический журнал. 1991. Т. 54, № 1. С. 76-78
5. Вальдман Е. А., Воронина Т. А., Неробкова Л. Н. Противопаркинсоническая активность нового производного адамантана// Экспериментальная и клиническая фармакология. 1999. № 4. С. 3-7.
6. Вихляев Ю.В., Ульянова О. В., Воронина Т. А. Антикаталептическая активность производных аминоадамантана. I. Производные 1-аминоадмантана и 3,3’-диамино-1,1’-диадамантана//Химико-фармацевтический журнал. 1980. № 3. С. 59-62.
7. Гудвин Т., Мерсер Э. Введение в биохимию растений. В 2 томах. М.: Мир, 1986. Т. 1. 392 с.
8. Иноземцева И. А., Мелик-Саркисян С. С., Кретович В.Л. Гетерогенность цитохрома бактероидов//ДАН. 1978. Т. 240. № 6. С. 1468-1471.
9. Кадыков А. С. Лечение мидантаном больных паркинсонизмом//Советская медицина. 1973. Т. 9. С. 143-146
10. Климова Н. В., Пушкарь Г. В., Сколдинов А. П. Синтез диадония.//Химико-фармацевтический журнал. 1988. № 2. С. 215-216.
11. Ковалев Г. И, Родионов А. П., Петренко Е. С., Золотарев Ю. А. Сравнительное изучение распределения [3 Н]-гимантана в структурах мозга и вилочковой железе крыс//Экспериментальная и клиническая фармакология. 2003. Т. 66, № 3. С. 50-52.
12. Машковский М. Д. Лекарственные средства. В 2 частях. Ч. 1. 12-е изд., перераб. и доп. М.: Медицина, 1993.
13. Морозов И. С., Вальдман Е. А., Воронина Т. А., Неробкова Л. Н. и др. Антикаталептическая активность гетероциклических производных 2-аминоадамантана//Химико-фармацевтический журнал. 2000. № 4. С. 27-30.
14. Морозов И. С., Петров В. И., Сергеева С. А. Фармакология адамантанов. Волгоград: Волгоградская медицинская академия, 2001. 320 с.
15. Паринов В. Я., Криева М. А., Полис Я. Ю. Изучение фармакокинетики адапромина у крыс и кроликов при пероральном введении// Эксп. и клин. Фармакотерапия. 1986. № 15. С. 65-70.
16. Патент РФ № 1646256 2- [п-бром (или хлор)бензоил]аминоадамантана, повышающие резистентность организма к действию экстремальных факторов среды обитания и обладающие иммуностимулирующей активностью. Морозов И. С., Арцимович Н. Г., Климова Н. В. и др.
17. Патент № 1826906 РФ Иммуностимулирующее средство бромантан. Морозов И. С., Арцимович Н. Г., Фадеева Т. А. и др. Бюл. № 25 Открытия. Изобретения. 1992. С. 10.
18. Петренко Е. С. Экспериментальное изучение фармакокинетики оригинального противопаркинсонического препарата гимантана. Автореф. дис.. канд. биол. наук. М., 2003.
19. Правдина Н. Ф., Тулькес С. Г., Шобухов В. М. Динамика накопления и элиминации [3 Н]-ремантадина в ткани мышей//Вопросы вирусологии. 1982. № 2. С. 208-209.
20. Страйер Л. Биохимия. В 3 томах. М.: Мир, 1985. Т. 2. 312 с.
21. Bleidner W. E., Harmon J. B., Hewes W. E. Absorbtion, disruption and excretion of amantadine hydrochloride//J. Pharmacol. Exp. Theor. 1965. Vol. 150 № 3. P. 484-490.
22. Evans G. A handbook ofbioanalysis and drug metabolism. CRC Press, 2004. 390 p.
23. Freudenthaler S., Meineke I., Shreeb K-H., et al. Influence of urine pH and urinary flow on the renal excretion of memantine//Br. J. Clin. Pharmacol. 1998. № 46. Р. 541-546.
24. Girotra R. N., Gesser T., Greizersterin H. B. Metabloism and excretion of 2,4-diamino-5- (1-adamantyl)-6-methylpyrimidine (DAMP); a new antifolate. 1979. Vol. 21. P. 174.
25. Greco W. R., Hakala M. T. Cellular pharmacokinetics of lipophilic diaminopyrimidine antifolates//J. Pharmacol. Exp. Theor. 1980. Vol. 212 № 1. P. 39-46.
26. Hoffman C. E., Gaylord J., Blazecki J. W. et al. Pharmacokinetics and metabolism ofrimantadine hydrochloride in mice and dogs//Atimicrob. A. a chemo. 1988. Vol. 32. № 11. P. 1699-1704.
27. Keefe D., Leto K. Cytochrome P450 from the mesocarp of avocado (Persea americana)//Plant Phisiol., 1989. Vol. 89. P. 1141.
28. Landa S., Machacek V. Amantadine a new hydroicarbon extracted from petroleum//Coll. Czechosl. Chem. Commun. 1933. Vol. 5, № 1. Р. 1-5.
29. Zakrzewski S. F., Dave C., Mead L. H., Deluomo D. S. Studies with a new antifolate 2,4-diamino-5-adamantyl-6-methylpyrimidine (DAMP): tissue distribution and disposition of 2,4-diamino-5-adamantyl-6-methylpyrimidine and its metabolite//J. Pharmacol Exp Ther. 1978. Vol. 205, № 1. Р. 19-26.
30. USN and the USP dictionary of drug names USAN 1991 1961-1990 comulative list/William M. Heller, Ph. D., Editor Carolin A. Fleeger, Associate editor 1990 The United States Pharmacopeial Convention, Inc. Twinbrok Parkway, Rockville, MD 20852. 1990.
31. Rubio F. R., Fukuda E. K., Garland W. A. Urinary metabolites of rimantadine in humans//Drug. Metab. Dispos. 1988. Vol. 16, № 5. Р. 773-7.
32. Wesemann W., Sonntag K.-H., Maj J. On the pharmacodynamics and pharmacokinetics of memantine//Drug. Res. 1983. № 33. Р. 1122-1134.
33. Wessemann W., Schollmeyer J. D., Sturm G. Gaschromatoghraphishe und massenspectrometrische Untersuchungen uber harnpflichtige Metabolite von adamantanaminen//Arzheim. Frosch. 1977. Bd. 27, № 7. Р. 1471-1477.
