Rec.INN
зарегистрированное ВОЗ
Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Иммунодепрессивное средство. Кладрибин, 2-хлоро-дезоксиаденозин, является хлорсодержащим пуриновым производным, обладающим резистентностью к действию аденозиндезаминазы. Подавляет аутоиммунные воспалительные процессы, лежащие в основе развития рассеянного склероза, за счет избирательного угнетения активности лимфоцитов. Кладрибин проявляет действие в отношении как делящихся, так и неделящихся лимфоцитов. За счет продолжительного противовоспалительного эффекта кладрибина уменьшается выраженность воспалительных изменений в тканях нервной системы при рассеянном склерозе.
Взаимоотношение между концентрацией кладрибина в плазме крови и эффективностью при рассеянном склерозе не установлено.
На фоне лечения кладрибином отмечено уменьшение числа рецидивов, снижение активности заболевания в мозговой ткани и замедление прогрессирования инвалидизации пациента.
Кладрибин проявляет цитотоксические эффекты (за счет активного метаболита 5′-трифосфата-2-хлор-2′-дезоксиаденозина) в отношении делящихся и неделящихся клеток, ингибируя синтез и репарацию ДНК (ингибирует рибонуклеотидредуктазу, катализирующую реакции образования дезоксинуклеозидтрифосфатов, ДНК-полимеразу и активирует специфическую эндонуклеазу, что приводит к одноцепочечным разрывам ДНК), что в конечном итоге приводит к гибели клетки. Лимфоидные клетки более чувствительны к препарату (т.к. обладают в них более высокая активность дезоксицитидинкиназы и низкая активность 5′-нуклеотидазы), чем нелимфоидные.
Фармакокинетика
Линейная зависимость фармакокинетических показателей при в/в введении показана при дозах от 2.5 до 21.5 мг/м2.
При приеме внутрь в дозе 10 мг кладрибин быстро всасывается. Cmax в плазме крови составляет 22-29 нг/мл, AUC составляет 80-101 нг × ч/мл. Среднее Тmax кладрибина в плазме крови составляет 0.5 ч. При одновременном приеме с высококалорийной пищей абсорбция кладрибина замедляется: среднее Тmax составляет 1.5 ч, а Cmax снижается на 29%, при этом AUC не изменяется. Прием пищи не оказывает клинически значимого действия на абсорбцию кладрибина.
Связывание кладрибина с белками плазмы крови составляет 20% и не зависит от его концентрации. Vd большой, в среднем — 482 л (стандартное отклонение ±185).
При в/в введении в спинномозговую жидкость проникает 25% дозы.
Внутриклеточная концентрация фосфорилированного кладрибина в несколько сотен раз превышает соответствующую концентрацию в плазме крови.
Подвергается внутриклеточному метаболизму. На начальном этапе фосфорилирование до 5′-монофосфата осуществляет дезоксицитидинкиназа. Поскольку активность дезоксицитидинкиназы выше такового для 5′-нуклеотидазы, а также вследствие устойчивости препарата к действию аденозиндезаминазы, в клетке быстро накапливаются все три фосфорилированные формы 2-хлор-2′-дезоксиаденозина.
Основным веществом, содержащимся в плазме крови и моче, как при в/в введении, так и при приеме внутрь, является неизмененный кладрибин. Основной метаболит, образующийся в печени, 2-хлороаденозин, определяется в минимальном количестве в крови и моче. Другие метаболиты определяются также в следовых количествах.
Почечный клиренс составляет 23.1 л/ч, а метаболический (внепочечный) — 22.7 л/ч. Почечный клиренс превышает скорость клубочковой фильтрации, что указывает на активное выделение кладрибина почками. Внепочечные пути выведения кладрибина включают как процесс метаболических изменений в печени, так и экстенсивный внутриклеточный метаболизм и выведение. В незначительном количестве выводится через кишечник.
Общий клиренс кладрибина зависит от КК. Общий клиренс кладрибина у пациентов с почечной недостаточностью легкой степени (КК = 65 мл/мин) уменьшается на 18%. Предсказуемое снижение клиренса кладрибина у пациентов с почечной недостаточностью средней степени (КК = 40 мл/мин) и тяжелой степени (КК = 20 мл/мин) составляет, соответственно, 30% и 40%.
Показания активного вещества
КЛАДРИБИН
Лечение рассеянного склероза рецидивирующего (ремиттирующего) течения.
Волосатоклеточный лейкоз.
Режим дозирования
Рассеянный склероз: внутрь по 10-20 мг/сут. Схема и длительность лечения устанавливаются индивидуально. Перед началом лечения и далее, через определенные интервалы, выполняют общий клинический анализ крови для подтверждения возможности начала или продолжения лечения. При необходимости курс может быть отложен до улучшения общего состояния пациента (например, при остром инфекционном заболевании), а также для восстановления показателей крови. Начинать лечение рекомендуется только при отсутствии отклонений показателей общего клинического анализа крови.
Волосатоклеточный лейкоз: в/в капельно вводят в дозе 0.09-0.1 мг/кг/сут в течение 7 дней. Дозу и продолжительность лечения устанавливают в зависимости от особенностей течения заболевания и тяжести состояния.
Побочное действие
Со стороны системы кроветворения: клинически значимая лимфопения, лейкопения, нейтропения, тромбоцитопения, анемия, панцитопения, апластическая и гемолитическая анемии; очень редко — миелодиспластический синдром.
Со стороны пищеварительной системы: тошнота, рвота, анорексия, диарея, запор, гастралгия, повышение билирубина и/или трансаминаз.
Со стороны нервной системы: головная боль, головокружение, бессонница, периферическая сенсорная невропатия.
Со стороны органов чувств: часто — звон в ушах.
Со стороны сердечно-сосудистой системы: тахикардия, отеки.
Со стороны дыхательной системы: кашель, учащенное дыхание, интерстициальный пневмонит, изменение перкуторного звука и аускультативных характеристик дыхания.
Со стороны половой системы: часто — нарушения менструального цикла (мено- и метроррагии).
Дерматологические реакции: часто — кожная сыпь (пустулы, папулы, макулы, зудящая или эритематозная сыпь); в единичных случаях — кожная реакция с вовлечением слизистых оболочек и развитием многоформной эритемы.
Местные реакции: в месте инфузии — эритема, боль, отечность, тромбоз, флебит.
Прочие: гипертермия, слабость, астения, повышенная утомляемость, боль различной локализации, пурпура, петехии, носовые кровотечения, снижение иммунитета; предрасположенность к оппортунистическим инфекциям, инфекциям вызванными Herpes simplex, Herpes zoster, цитомегаловирусом.
Противопоказания к применению
Умеренная или тяжелая хроническая почечная недостаточность (КК менее 50 мл/мин); умеренная или тяжелая печеночная недостаточность (4 и более по шкале Чайлд-Пью); одновременное применение миелосупрессивных препаратов; острое инфекционное заболевание или обострение хронического заболевания (в т.ч. активный или латентный туберкулез, гепатит); снижение иммунитета в связи с заболеванием или вследствие приема иммунодепрессантов, включая циклоспорин, метотрексат, митоксантрон, натализумаб, или длительного применения ГКС (кратковременный курс лечения ГКС допускается); вакцинация в течение предшествующих лечению 3 месяцев аттенуированной вакциной (живые или ослабленные вакцины); беременность, период лактации (грудного вскармливания); детский и подростковый возраст до 18 лет; повышенная чувствительность к кладрибину.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Мужчины должны использовать эффективные методы контрацепции, как во время лечения, так и в течение 3 месяцев после приема последней дозы. Такая предосторожность обусловлена возможным негативным влиянием кладрибина на сперматогенез. Если у партнерши пациента, принимающего кладрибин, наступает беременность, необходимо сообщить врачу о возможных неблагоприятных эффектах для плода.
Не установлено, выделяется ли кладрибин с грудным молоком, но с учетом потенциальных нежелательных эффектов, рекомендуется либо прекращение грудного вскармливания во время лечения, либо прекращения лечения кладрибином, в зависимости от важности продолжения терапии.
Данные экспериментальных исследований подтверждают наличие у кладрибина эмбриотоксического и тератогенного действия. Влияния на репродуктивную функцию потомства и его общее состояние не отмечено.
Особые указания
С осторожностью следует применять кладрибин у пациентов пожилого возраста (недостаточно клинических данных и с учетом большей вероятности нарушения функции почек или печени, сопутствующих заболеваний и совместно принимаемых препаратов), у пациентов с умеренно выраженными нарушениями функции почек (КК = 50-80 мл/мин), т.к. общий клиренс кладрибина зависит от КК.
Лечение пациентов с почечной и/или печеночной недостаточностью следует проводить под непосредственным контролем функции почек и печени. Лечение должно быть прекращено в случае развития нефро- или гепатотоксичности.
Необходимо тщательное наблюдение за пожилыми пациентами (в связи с отсутствием данных по фармакокинетике).
С особой осторожностью следует применять у пациентов с исходным угнетением функции костного мозга любого происхождения из-за риска проявления пролонгированной гипоплазии. В некоторых случаях лечение может привести к тяжелым формам иммуносупрессии с уменьшением числа CD4+-лейкоцитов.
Миелосупрессия, вызываемая кладрибином, дозозависима и обычно обратима, проявляется в течение месяца с момента лечения. Во время лечения и как минимум в течение 4-8 нед. после необходим тщательный контроль гематологических показателей крови.
При возникновении гипертермии на фоне нейтропении необходим контроль общего состояния пациента в течение первого месяца лечения и в случае необходимости назначения антибактериальной терапии.
В случае развития нейротоксичности лечение следует приостановить до разрешения неврологической симптоматики.
Вследствие лимфопении и возможной миелосупрессии на фоне лечения кладрибином возможно ослабление иммунной защиты организма и повышение вероятности развития или обострения инфекционных заболеваний. Возможна активизация и латентных инфекций, включая туберкулез, гепатиты или герпетическую инфекцию. Снижение количества лимфоцитов является дозозависимым и может быть более выраженным у пациентов пожилого возраста. Во время лечения необходимо тщательно контролировать состояние пациента, и при появлении симптомов инфекционного заболевания прервать или отложить прием кладрибина до полного выздоровления.
Пациентам, которым в связи с индуцированной кладрибином лимфопенией требуется переливание крови, рекомендуется до переливания крови провести облучение клеточных компонентов с целью предотвращения трансфузионно-обусловленной реакции «трансплантат против хозяина».
Нет опыта применения кладрибина для приема внутрь у пациентов с рассеянным склерозом и злокачественными новообразованиями в период лечения или в период, предшествовавший лечению (за исключением базально-клеточного или плоскоклеточного рака кожи in situ, удаленного хирургическим путем, с периодом ремиссии более 5 лет). Таким образом, риск рецидивирования злокачественных новообразований после лечения кладрибином неизвестен. У пациентов со злокачественными новообразованиями и рассеянным склерозом вопрос о применении кладрибина следует решать индивидуально с учетом соотношения возможного риска и пользы для пациента. Существуют единичные сообщения о развитии негематологических злокачественных новообразований, включая хорионкарциному, меланому, рак яичников, рак поджелудочной железы, а также рак шейки матки in situ в стадии 0, рассматриваемый как предраковое состояние. При этом причинно-следственная связь с приемом кладрибина не была установлена. Однако, учитывая продолжительный иммунодепрессивный эффект при применении кладрибина, риск развития новообразований не может быть исключен.
Лечение кладрибином не следует начинать или продолжать в течение 3 месяцев после вакцинации живыми, в т.ч. аттенуированными вакцинами, из-за повышения риска активизации инфекции, по поводу которой проводилась профилактика. Вакцинацию живыми, в т.ч. аттенуированными вакцинами, не следует назначать как во время лечения кладрибином, так и в течение 3 месяцев после применения последней дозы.
Влияние на способность к управлению транспортными средствами и механизмами
Во время лечения может отмечаться головокружение (вертиго). В таком случае пациент должен воздержаться от вождения автотранспорта или другой деятельности, требующей повышенного внимания и скорости психомоторных реакций.
Лекарственное взаимодействие
Совместное или последующее применение иммуномодулирующих препаратов следует проводить под тщательным клиническим контролем с оценкой гематологических показателей. Проведение краткосрочной терапии ГКС допускается при совместном назначении кладрибина с препаратами, обладающими гематотоксическими свойствами (например, интерфероны, карбамазепин, НПВС), под тщательным мониторингом гематологических показателей.
Применение кладрибина у иммунокомпрометированных пациентов, включая пациентов получающих иммунодепрессанты (например, циклоспорин, метотрексат, митоксантрон, натализумаб) или длительное лечение ГКС, противопоказано из-за повышения риска побочных реакций.
Степень абсорбции кладрибина и его биодоступность зависят от транспортного механизма, связанного с белками семейства ABCG2, которые также влияют на биодоступность других препаратов, таких как иринотекан, топотекан, розувастатин и сульфасалазин. Ингибиторы белков ABCG2 в ЖКТ могут увеличивать биодоступность и системное действие кладрибина.
Известными ингибиторами ABCG2, in vivo меняющими фармакокинетические параметры субстратов более чем на 20%, являются циклоспорин и ингибиторы обратной транскриптазы: ритонавир, лопинавир и атазанавир. При совместном применении подобных препаратов с кладрибином требуется осторожность. Биодоступность кладрибина при пероральном приеме составляет около 40%, это позволяет предполагать, что при полном блокировании функции кишечных белков ABCG2 биодоступность может увеличиться не более чем в 2.5 раза.
Кладрибин чувствителен к кислотной среде, поэтому любые препараты, влияющие на кислотность желудочного сока, могут нарушать стабильность препарата и изменять его биодоступность. Однако установлено, что биодоступность кладрибина не изменяется при совместном назначении с пантопразолом или омепразолом.
Мавенклад — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006137
Торговое наименование:
МАВЕНКЛАД®
Международное непатентованное наименование:
кладрибин
Лекарственная форма:
таблетки
Состав
1 таблетка содержит:
действующее вещество: кладрибин 10,00 мг;
вспомогательные вещества: гидроксипропилбетадекс 143,76 мг, сорбитол 64,04 мг, магния стеарат 2,20 мг.
Описание
Круглые двояковыпуклые таблетки белого цвета, с гравировкой «С» на одной стороне и «10» на другой стороне.
Фармакотерапевтическая группа:
иммунодепрессанты, селективные иммунодепрессанты.
Код ATX:
L04AA40
Фармакологические свойства
Механизм действия
Кладрибин (2-хлоро-2′-дезоксиаденозин) является нуклеозидным аналогом 2′-дезоксиаденозина. За счет наличия хлора в пуриновом кольце, кладрибин обладает резистентностью к действию аденозиндезаминазы, что увеличивает время нахождения пролекарства кладрибин в клетке.
Последующее фосфорилирование кладрибина в его активную трифосфатную форму, 2-хлордезоксиаденозинтрифосфат (Cd-ATP), преимущественно происходит в лимфоцитах, так как для них характерен постоянный высокий уровень дезоксицитидинкиназы (DCK) и относительно низкий уровень 5′-нуклеотидазы (5′-NTase). Высокое соотношение DCK и 5′-NTase способствует накоплению Cd-ATP в лимфоцитах, что приводит к гибели клеток.
В результате более низкого соотношения DCK и 5′-NTase другие клетки, развивающиеся из костною мозга, меньше подвержены воздействию кладрибина, чем лимфоциты.
DCK представляет собой фермент, ограничивающий скорость превращения пролекарства кладрибин в его активную трифосфатную форму, что приводит к селективному уменьшению делящихся и неделящихся Т и В клеток.
Первичный апоптоз-индуцирующий механизм действия Cd-ATP оказывает прямое и непрямое действие на синтез ДНК и функцию митохондрий. В делящихся клетках Cd-ATP препятствует синтезу ДНК путем ингибирования рибонуклеотидредуктазы и избирательной конкуренции с дезоксиаденозинтрифосфатом за включение в ДНК посредством ДНК-полимераз. В покоящихся клетках кладрибин вызывает одноцепочечные разрывы ДНК, быстрое потребление никотинамидадениндинуклеотида, истощение АТФ и гибель клеток. Имеются данные о том, что кладрибин также может вызывать прямой каспаз-зависимый и -независимый апоптоз посредством высвобождения цитохрома С и апоптоз-индуцирующего фактора в цитозоль неделящихся клеток.
Патогенез рассеянного склероза (PC) включает сложный каскад событий, в котором ключевую роль играют различные типы иммунных клеток, включая аутореактивные Т и В клетки. Механизм, с помощью которого кладрибин оказывает свои терапевтические эффекты при рассеянном склерозе, полностью не выяснен, однако считается, что его преимущественное воздействие на Т и В лимфоциты прерывает каскад событий в иммунной системе, имеющих центральное значение в развитии рассеянного склероза.
Различия в уровне экспрессии DCK и 5′-NTases между подтипами иммунных клеток могут объяснять различия в чувствительности иммунных клеток к кладрибину. Из-за этих различий клетки врожденной иммунной системы в меньшей степени подвержены воздействию кладрибина, чем клетки адаптивной иммунной системы.
Фармакодинамика
Кладрибин оказывает длительные эффекты, преимущественно направленные на лимфоциты и аутоиммунные процессы, участвующие в патогенезе рассеянного склероза.
В клинических исследованиях наибольшая частота лимфопении 3 или 4 степени тяжести (от 0,5×109/л до 0,2×109/л или менее 0,2×109/л) наблюдалась у пациентов через 2 месяца после приема первой дозы кладрибина в течение каждого года терапии, что указывало на разрыв во времени между концентрацией кладрибина в плазме крови и максимальным гематологическим эффектом.
Данные клинических исследований показывают, что при назначении препарата в рекомендуемой суммарной дозе 3,5 мг/кг массы тела постепенное возвращение показателей медианы числа лимфоцитов к нормальным значениям происходит на 84-й неделе после приема первой дозы кладрибина (примерно через 30 недель после приема последней дозы кладрибина). Более чем у 75 % пациентов число лимфоцитов возвратилось к норме к 144-й неделе после приема первой дозы кладрибина (примерно через 90 недель после приема последней дозы кладрибина).
Терапия кладрибином в таблетках приводит к быстрому сокращению числа циркулирующих CD4+ и CD8+ Т-клеток. CD8+ Т-клетки показывают менее выраженное снижение и более быстрое восстановление, чем CD4+ Т-клетки, что приводит к временному снижению соотношения CD4/CD8. Кладрибин уменьшает число CD19+ В-клеток и CD16+/CD56+ естественных клеток-киллеров, которые также восстанавливаются быстрее, чем CD4+ Т-клетки.
Эффективность у пациентов с высокой активностью заболевания
Был проведен апостериорный анализ эффективности в подгруппах пациентов с высокой активностью заболевания, получавших кладрибин перорально в рекомендуемой дозе 3,5 мг/кг. Подгруппа пациентов включала:
- пациенты с 1 обострением в течение предшествующего года и по крайней мере 1 TlGd+ очаг или 9 или более Т2 очагов на фоне проводимой терапии другими ПИТРС;
- пациенты с 2 или более обострениями в течение предшествующего года, независимо от того, проводилась терапия ПИТРС или нет.
Фармакокинетика
Кладрибин является пролекарством и для его активации требуется внутриклеточное фосфорилирование. Фармакокинетические показатели кладрибина изучались при внутривенном и пероральном введении пациентам с рассеянным склерозом и пациентам с онкологическими заболеваниями, а также в исследованиях in vitro.
Абсорбция
После перорального введения кладрибин быстро всасывается. После приема внутрь 10 мг кладрибина средняя максимальная концентрация (Сmax) в плазме крови находится в диапазоне от 22 нг/мл до 29 нг/мл, а соответствующая площадь под кривой «концентрация-время» (AUC) составляет от 80 до 101 нг ч/мл (среднее арифметическое из различных исследований). При приеме натощак среднее время достижения максимальной концентрации (Тmax) кладрибина в плазме крови составляет около 0,5 часа (в диапазоне от 0,5 ч до 1,5 ч). При одновременном приеме с высококалорийной пищей абсорбция кладрибина замедляется: среднее Тmax составляет 1,5 часа (в диапазоне от 1 ч до 3 ч), а Сmax снижается на 29 % (основываясь на среднем геометрическом значении), при этом AUC не изменяется. Биодоступность кладрибина после перорального введения в дозе 10 мг составляет около 40 %.
Распределение
Объем распределения препарата большой, что указывает на его экстенсивное распределение в тканях и на внутриклеточное поглощение. В среднем объем распределения кладрибина составляет от 480 л до 490 л. Связь кладрибина с белками плазмы крови составляет 20 % и не зависит от концентрации препарата.
Прохождению кладрибина через биологические мембраны способствуют различные транспортные белки, в том числе ENT1, CNT3 и BCRP.
В исследованиях in vitro кладрибин лишь минимально связан с P-gp (Р-гликопротеин). Клинически значимое взаимодействие с ингибиторами P-gp маловероятно. Возможные последствия влияния индукции P-gp на биодоступность кладрибина формально не изучались.
В исследованиях in vitro показано незначительное опосредованное транспортными белками поглощение кладрибина гепатоцитами.
Кладрибин обладает способностью проникать через гематоэнцефалический барьер. Небольшое исследование у онкологических пациентов показало, что отношение концентрации кладрибина в цереброспинальной жидкости к концентрации его в плазме составляет 0,25.
Кладрибин и/или его фосфорилированные метаболиты главным образом накапливаются и удерживаются в лимфоцитах. In vitro отношение внеклеточной концентрации к внутриклеточной концентрации через 1 час после воздействия кладрибина составляло примерно 30/40.
Биотрансформация
Метаболизм кладрибина изучали у пациентов с рассеянным склерозом после однократного перорального введения дозы 10 мг и однократного внутривенного введения дозы 3 мг. Основным компонентом, присутствующим в плазме и в моче, являлся неизмененный кладрибин как после перорального, так и после внутривенного введения. Метаболит 2-хлороаденин был также обнаружен в плазме и в моче, в количестве ≤3 % от неизмененного кладрибина после перорального введения. Другие метаболиты определялись в плазме и в моче в следовых количествах.
В клетках печени в условиях in vitro наблюдался незначительный метаболизм кладрибина (90 % кладрибина остается в неизмененном виде).
Кладрибин не является релевантным субстратом для ферментов цитохрома Р450 и потенциальным ингибитором CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4. Предполагается, что ингибирование этих ферментов или генетические полиморфизмы (например, CYP2D6, CYP2C9 или CYP2C19) не окажут клинически значимого влияния на фармакокинетику кладрибина или его воздействие. Кладрибин не оказывает клинически значимого индуктивного воздействия на ферменты CYP1A2, CYP2B6 и CYP3A4.
После проникновения в клетку при участии дезоксицитидинкиназы (DCK) происходит фосфорилирование кладрибина с образованием кладрибин-5′-монофосфата (Cd-AMP) (и также при участии дезоксигуанозинкиназы в митохондриях). В дальнейшем Cd-AMP фосфорилируется до дифосфата кладрибина (Cd-ADP) и трифосфата кладрибина (Cd-ATP). Дефосфорилирование и дезактивация Cd-AMP катализируются цитоплазматической 5′-нуклеотидазой (5′-Ntase). В исследовании внутриклеточной фармакокинетики Cd-AMP и Cd-ATP у пациентов с хроническим миелоидным лейкозом уровни Cd-ATP составляли примерно половину от уровня Cd-AMP. Внутриклеточный период полувыведения Cd-ATP составляет 10 ч, Cd-AMP – 15 ч.
Элиминация
Основываясь на объединенных популяционных фармакокинетических данных различных исследований, медианные значения элиминации составили 22,2 л/ч для почечного клиренса и 23,4 л/ч для метаболического (внепочечного) клиренса. Почечный клиренс превышал скорость клубочковой фильтрации, что указывает на активное выделение кладрибина почками. Метаболический клиренс кладрибина (примерно 50 %) включает в себя незначительный процесс метаболических изменений в печени и экстенсивное обширное внутриклеточное распределение, улавливание активного трифосфата кладрибина (Cd-ATP) во внутриклеточное пространство (т.е. в лимфоциты) и последующее выведение внутриклеточного Cd-ATP в соответствии с жизненным циклом этих клеток.
Период полувыведения кладрибина (Т1/2) – около 24 часов.
Дозо-временная зависимость
После перорального введения кладрибина в диапазоне доз от 3 мг до 20 мг Сmax и AUC увеличивались пропорционально дозе, следовательно, на абсорбцию препарата не влияют процессы с ограничением по скорости или накоплению для доз до 20 мг.
Не обнаружено значительного увеличения концентрации кладрибина в плазме крови после повторного введения. Нет данных, что фармакокинетика кладрибина после повторного введения может изменяться в зависимости от времени.
Фармакокинетика у особых групп пациентов
Не проводилось клинических исследований для оценки фармакокинетики кладрибина у пациентов с рассеянным склерозом пожилого возраста или педиатрического возраста, или у пациентов с почечной или печеночной недостаточностью.
На основе модели популяционной фармакокинетики статистически значимого влияния возраста (от 18 до 65 лет) или пола на фармакокинетику кладрибина не обнаружено.
Пациенты с почечной недостаточностью.
Почечный клиренс кладрибина зависит от клиренса креатинина (КК). Основываясь на популяционном фармакокинетическом анализе пациентов с нормальной функцией почек и с легкой почечной недостаточностью, ожидается, что общий клиренс у пациентов с легкой почечной недостаточностью (КК = 60 мл/мин) будет умеренно снижаться, приводя к увеличению экспозиции на 25 %. У пациентов со средней степенью почечной недостаточности (КК = 40 мл/мин) предполагаемое уменьшение клиренса кладрибина составляет 30 % и у пациентов с тяжелой степенью почечной недостаточности (КК = 20 мл/мин) – 40 %.
Пациенты с печеночной недостаточностью.
Роль печени в процессе выведения кладрибина незначительна.
Фармакокинетические взаимодействия.
Исследование взаимодействия лекарственных средств у пациентов с рассеянным склерозом показало, что биодоступность перорально введенного кладрибина в дозе 10 мг не изменялась при совместном применении с пантопразолом.
Показания к применению
Препарат МАВЕНКЛАД® показан для лечения взрослых пациентов с высокоактивным рецидивирующим рассеянным склерозом, подтвержденным данными клинических или радиологических исследований (см. раздел «Фармакодинамика»).
Противопоказания
- повышенная чувствительность к кладрибину или другим компонентам препарата;
- обострение хронической инфекции (туберкулез, гепатит);
- ВИЧ-инфекция;
- начало терапии кладрибином у иммунокомпрометированных пациентов, в том числе пациентов, получающих иммуносупрессивную или миелосупрессивную терапию (см. раздел «Взаимодействие с другими лекарственными средствами»);
- средняя и тяжелая степень почечной недостаточности (клиренс креатинина <60 мл/мин) (см. раздел «Особые указания»);
- средняя и тяжелая степень печеночной недостаточности;
- непереносимость фруктозы;
- совместное применение с интерфероном бета;
- вакцинация живыми, в том числе аттенуированными вакцинами;
- беременность, период грудного вскармливания;
- детский возраст до 18 лет (недостаточно клинических данных).
С осторожностью
У пациентов пожилого возраста, старше 65 лет, из-за недостаточности клинических данных и с учетом большей вероятности недостаточности почек или печени, сопутствующих заболеваний и других применяемых препаратов.
Следует соблюдать осторожность при комбинированной терапии с препаратами, обладающими гематотоксическими свойствами, индукторами транспортных белков BCRP и Р-гликопротеина.
Применение при беременности и в период грудного вскармливания
Контрацепция у мужчин и женщин
Перед началом терапии во время 1-го и 2-го года лечения препаратом МАВЕНКЛАД® пациенты мужского и женского пола, обладающие детородным потенциалом, должны быть предупреждены о возможном серьезном риске для плода и необходимости использовать эффективные методы контрацепции.
Женщинам с детородным потенциалом необходимо пройти тест на беременность до начала лечения препаратом МАВЕНКЛАД® на первом и втором году терапии и использовать эффективные методы контрацепции во время приема препарата и как минимум 6 месяцев после приема последней дозы.
Женщины, использующие системные гормональные противозачаточные средства, должны добавить барьерный метод контрацепции во время терапии препаратом МАВЕНКЛАД® и в течение как минимум 4 недель после последней дозы во время 1-го и 2-го года лечения.
Женщины, которые забеременели во время терапии, должны прекратить лечение препаратом МАВЕНКЛАД®.
Поскольку кладрибин угнетает синтез ДНК, можно ожидать неблагоприятные воздействия на гаметогенез человека. Поэтому пациенты мужского пола должны использовать эффективные методы контрацепции для предупреждения беременности у своих партнерш во время терапии препаратом МАВЕНКЛАД® и в течение как минимум 6 месяцев после приема последней дозы.
Беременность
Кладрибин ингибирует синтез ДНК, что может приводить к врожденным порокам развития при применении во время беременности.
Исследования на животных показали токсичность препарата МАВЕНКЛАД® в отношении репродуктивной системы.
МАВЕНКЛАД® противопоказан беременным женщинам (см. раздел «Противопоказания»), В случае наступления беременности в период лечения препарат должен быть отменен.
Период грудного вскармливания
Данные о проникновении кладрибина в грудное молоко человека отсутствуют. С учетом потенциальных нежелательных эффектов препарата рекомендуется прекращение грудного вскармливания во время терапии и в течение одной недели после приема последней дозы препарата МАВЕНКЛАД®.
Фертильность
Эффекты кладрибина на фертильность у пациентов мужского пола неизвестны.
В исследованиях на животных нарушения тестикулярной функции наблюдались у мышей и обезьян. Влияния кладрибина на фертильность или репродуктивную функцию у мышей не обнаружено.
Способ применения и дозы
Способ применения
Таблетки принимают внутрь, независимо от приема пищи, не разжевывая и запивая водой.
Поскольку таблетки не покрыты оболочкой, их необходимо проглатывать сразу же после освобождения из блистера, не оставлять на поверхности и не держать в руках дольше, чем это необходимо. В случае если таблетка была оставлена на поверхности или если она разломалась в процессе высвобождения из блистера, поверхность необходимо тщательно вымыть.
При обращении с препаратом руки должны быть сухими. После применения препарата необходимо тщательно вымыть руки.
Рекомендуемая доза
Рекомендуемая суммарная доза препарата МАВЕНКЛАД® составляет 3,5 мг/кг массы тела пациента в течение 2 лет: 1,75 мг/кг на 1 курс лечения в год. Годовой курс терапии состоит из 2 недель лечения: одна неделя в начале 1-го месяца и одна неделя в начале 2-го месяца соответствующего года лечения. Каждая неделя лечения состоит из 4 или 5 дней, в течение которых препарат принимают 1 раз в день в дозе 10 мг или 20 мг (одна или две таблетки) в зависимости от массы тела пациента.
Расчёт дозы и количества препарата в зависимости от массы тела пациента представлены ниже в таблицах 1 и 2.
После завершения 2 годовых курсов лечения дальнейший прием препарата в течение 3-го и 4-го года не требуется.
Возобновление лечения после 4-х лет не изучалось.
Критерии начета и продолжения лечения
Число лимфоцитов должно быть:
— в норме перед началом 1-го года лечения препаратом МАВЕНКЛАД®;
— ≥0,8×109/л перед началом 2-го года лечения препаратом МАВЕНКЛАД®.
При необходимости 2-й годовой курс лечения может быть отложен на срок до 6 месяцев до восстановления приемлемого числа лимфоцитов. В случае если период восстановления числа лимфоцитов занимает более 6 месяцев, прием препарата МАВЕНКЛАД® должен быть прекращен.
Расчет дозы
Расчет дозы в течение двух лет терапии проводится лечащим врачом на основании массы тела пациента в соответствии с Таблицей 1. Для некоторых диапазонов массы тела число таблеток может варьировать от одной недели лечения к другой. Пероральное применение кладрибина у пациентов массой тела менее 40 кг не исследовалось.
Таблица 1. Доза препарата МАВЕНКЛАД® на неделю лечения в зависимости от массы тела пациента для каждого года терапии.
| Масса тела пациента, кг | Доза в мг (число таблеток) на неделю лечения | |
| 1-я неделя лечения | 2-я неделя лечения | |
| более или равно 40, но менее 50 | 40 мг (4 таблетки) | 40 мг (4 таблетки) |
| более или равно 50, но менее 60 | 50 мг (5 таблеток) | 50 мг (5 таблеток) |
| более или равно 60, но менее 70 | 60 мг (6 таблеток) | 60 мг (6 таблеток) |
| более или равно 70, но менее 80 | 70 мг (7 таблеток) | 70 мг (7 таблеток) |
| более или равно 80, но менее 90 | 80 мг (8 таблеток) | 70 мг (7 таблеток) |
| более или равно 90, но менее 100 | 90 мг (9 таблеток) | 80 мг (8 таблеток) |
| более или равно 100, но менее 110 | 100 мг (10 таблеток) | 90 мг (9 таблеток) |
| более или равно 110 | 100 мг (10 таблеток) | 100 мг (10 таблеток) |
Таблица 2 показывает распределение общего числа таблеток по дням в течение недельного курса терапии. Интервал между приемом таблеток должен составлять 24 часа. Прием препарата должен осуществляться в одно и то же время суток в течение каждой недели терапии. Если суточная доза составляет 2 таблетки, таблетки принимают вместе как одну дозу.
Таблица 2. Распределение общего числа таблеток препарата МАВЕНКЛАД® в дозе 10 мг по дням в течение недельного курса терапии.
| Общее число таблеток в неделю | 1-й день | 2-й день | 3-й день | 4-й день | 5-й день |
| 4 | 1 | 1 | 1 | 1 | 0 |
| 5 | 1 | 1 | 1 | 1 | 1 |
| 6 | 2 | 1 | 1 | 1 | 1 |
| 7 | 2 | 2 | 1 | 1 | 1 |
| 8 | 2 | 2 | 2 | 1 | 1 |
| 9 | 2 | 2 | 2 | 2 | 1 |
| 10 | 2 | 2 | 2 | 2 | 2 |
Пропущенную дозу препарата (1 или 2 таблетки) следует принять, как только вы об этом вспомнили, в тот же день в соответствии с графиком лечения.
Пропущенная доза не должна приниматься вместе с последующей запланированной дозой на следующий день. В случае пропуска дозы пациент должен принять пропущенную дозу на следующий день, продлив, таким образом, курс приема препарата на сутки. Если пропущены две последовательные дозы, применяется то же правило, и число дней недельного курса лечения увеличивается на два дня.
Особые группы пациентов
Пациенты с почечной недостаточностью.
Клинические исследования по применению препарата МАВЕНКЛАД® у пациентов с почечной недостаточностью не проводились.
У пациентов с легкой степенью почечной недостаточности (клиренс креатинина от 60 до 89 мл/мин) коррекция дозы препарата не требуется.
Препарат МАВЕНКЛАД® противопоказан пациентам со средней и тяжелой степенью почечной недостаточности, так как безопасность и эффективность применения препарата у данной группы пациентов не установлены (см. раздел «Противопоказания»).
Пациенты с печеночной недостаточностью.
Клинических исследований по применению препарата у пациентов с печеночной недостаточностью не проводились.
Несмотря на то, что роль печени в процессе выведения кладрибина незначительна, применение препарата МАВЕНКЛАД® у пациентов со средней и тяжелой степенью печеночной недостаточности (индекс Чайлд-Пью >6) противопоказано, так как данные отсутствуют (см. раздел «Противопоказания»).
Пациенты пожилого возраста (старше 65 лет).
Клинические исследования по применению кладрибина в таблетках не включали пациентов старше 65 лет, поэтому неизвестно, есть ли у них отличие в ответе на терапию по сравнению с более молодыми пациентами (см. раздел «С осторожностью»).
Детский и подростковый возраст.
Безопасность и эффективность препарата МАВЕНКЛАД® у пациентов с рассеянным склерозом в возрасте до 18 лет не установлена, поэтому прием препарата в этой группе пациентов противопоказан (см. раздел «Противопоказания»).
Инструкция по использованию специальной упаковки препарата МАВЕНКЛАД®

- Вымойте и насухо вытрите руки, приготовьте стакан питьевой воды.

- Возьмите упаковку препарата в руку и поверните к себе той стороной, где напечатана инструкция по обращению со специальной упаковкой.

- (1) Откройте клапан картонной пачки с левой стороны.
(2) Одновременно нажмите и удерживайте в нажатом состоянии кнопки, расположенные на боковых поверхностях картонной пачки, указательным и большим пальцами правой руки.
(3) Потяните пластиковый контейнер до упора, но не извлекайте его из пачки.
- Возьмите из пластикового контейнера инструкцию по применению. Убедитесь в том, что вы ознакомились со всей информацией, представленной в инструкции, включая инструкцию по обращению со специальной упаковкой. Храните инструкцию в безопасном месте.

- Приподнимите блистер из пластикового контейнера и выдавите большим пальцем на ладонь 1 или 2 таблетки согласно прописанной схеме лечения.

- Положите таблетку в рот и запейте ее водой. Таблетку необходимо проглотить сразу, не разжевывая и не рассасывая. Необходимо избегать длительного контакта таблетки с кожей рук и касания руками носа, глаз и других частей тела.

- Тщательно вымойте руки с мылом.

- Верните контейнер с блистером назад в упаковку. Храните препарат в оригинальной упаковке для защиты от влаги.
Храните таблетки МАВЕНКЛАД® в блистере до следующего приема. Не выдавливайте таблетки заранее. Не храните таблетки в другом контейнере.
Побочное действие
Для описания частоты возникновения нежелательных реакций (HP) используется следующая классификация: очень часто (≥1/10), часто (≥1/100 до <1/10), нечасто (≥1/1000 до <1/100), редко (≥1/10000 до <1/1000), очень редко (<1/10000), частота неизвестна (частота не может быть определена на основе имеющихся данных).
Инфекционные и паразитарные заболевания
Часто: опоясывающий лишай, герпес слизистой оболочки полости рта.
Очень редко: туберкулез.
Со стороны крови и лимфатической системы
Очень часто: лимфопения.
Часто: снижение числа нейтрофилов.
Со стороны кожи и подкожных тканей
Часто: кожная сыпь, алопеция.
Описание отдельных нежелательных реакций
Лимфопения
В клинических исследованиях у 20-25 % пациентов, получивших кумулятивную дозу кладрибина 3,5 мг/кг в течение 2 лет в качестве монотерапии, развивалась транзиторная лимфопения 3 или 4 степени тяжести, установленная по результатам лабораторных исследований. Лимфопения 4 степени тяжести наблюдалась у менее 1 % пациентов. Наиболее часто лимфопения 3 или 4 степени тяжести наблюдалась у пациентов через 2 месяца после приема первой дозы кладрибина в рамках 1-го и 2-го годовых курсов терапии (частота лимфопении 3-й степени составила на 1-м и 2-м годах 4,0 % и 11,3 %, соответственно, частота лимфопении 4-й степени на 1-м и 2-м годах составила 0 % и 0,4 %, соответственно). Ожидается, что у большинства пациентов восстановление числа лимфоцитов до нормальных значений или до значения лимфопении 1-й степени происходит в течение девяти месяцев.
Чтобы уменьшить риск развития тяжелой лимфопении, необходимо определять число лимфоцитов до начала терапии кладрибином, во время терапии и после ее окончания (см. раздел «Особые указания»), а также строго соблюдать критерии начала и продолжения лечения кладрибином (см. раздел «Способ применения и дозы»).
Передозировка
Симптомы: имеется ограниченный опыт случаев передозировки препаратом МАВЕНКЛАД®. Известно, что лимфопения вследствие приема препарата МАВЕНКЛАД® является дозозависимой.
Лечение: антидот при передозировке неизвестен. Рекомендуется назначение симптоматической терапии и тщательное наблюдение. Возможно потребуется рассмотреть вопрос о прекращении терапии. Из-за быстрого и экстенсивного внутриклеточного и тканевого распределения маловероятно, что гемодиализ при передозировке кладрибином будет эффективен.
Взаимодействие с другими лекарственными средствами
В состав препарата МАВЕНКЛАД® входит гидроксипропилбетадекс, который может увеличивать растворимость и системную биодоступность слаборастворимых лекарственных средств при совместном приеме. Прием других пероральных препаратов возможен не ранее, чем за 3 часа до или через 3 часа после приема препарата МАВЕНКЛАД®.
Иммунодепрессивные препараты.
Использование препарата у иммунокомпрометированных пациентов, включая пациентов, получающих иммуносупрессивную или миелосупрессивную терапию (например, метотрексат, циклофосфамид, циклоспорин или азатиоприн) или длительное лечение глюкокортикостероидами, противопоказано из-за риска дополнительного влияния на иммунную систему (см. раздел «Противопоказания»).
Проведение краткосрочной терапии глюкокортикостероидами допускается.
Препараты, модифицирующие течение болезни.
Совместное применение кладрибина с интерфероном бета может увеличить риск развития лимфопении. Безопасность и эффективность применения препарата МАВЕНКЛАД® в комбинации с другими препаратами, модифицирующими течение болезни, у пациентов с рассеянным склерозом не установлена. Совместное применение не рекомендовано.
Препараты, обладающие гематотоксическими свойствами.
При применении препарата МАВЕНКЛАД® до или совместно с препаратами, обладающими гематотоксическими свойствами (например, карбамазепин), можно ожидать дополнительные нежелательные эффекты со стороны крови. В таких случаях следует проводить тщательный мониторинг гематологических показателей.
Вакцинация живыми, в том числе аттенуированными вакцинами.
Лечение препаратом МАВЕНКЛАД® не следует начинать в течение 4-6 недель после вакцинации живыми, в том числе аттенуированными вакцинами из-за повышения риска активизации инфекции.
Вакцинация живыми, в том числе аттенуированными вакцинами не должна назначаться как во время лечения препаратом МАВЕНКЛАД®, так и после прекращения приема препарата до тех пор. пока число лейкоцитов в крови не вернется к норме.
Сильнодействующие ингибиторы транспортных белков ENT1, CNT3, BCRP.
На уровне абсорбции кладрибина единственное возможное клинически значимое взаимодействие вероятно с белками резистентности рака молочной железы (BCRP или ABCG2). Ингибирование белков BCRP в желудочно-кишечном тракте может увеличивать биодоступность кладрибина при пероральном приёме и его системное действие.
Известные BCRP ингибиторы (например, элтромбопаг) in vivo могут менять фармакокинетические параметры субстратов транспортных белков на 20 %.
Данные исследований in vitro свидетельствуют о том, что кладрибин является субстратом уравновешивающих переносчиков нуклеозидов (ENT1) и концентрирующих переносчиков нуклеозидов (CNT3) транспортных белков. Следовательно, биодоступность, внутриклеточное распределение и почечная элиминация кладрибина теоретически могут быть изменены под действием сильнодействующих ингибиторов транспортных белков ENT1 и CNT3, таких как дилазеп, нифедипин, нимодипин, цилостазол, сулиндак или резерпин.
Однако их непосредственное влияние на действие кладрибина трудно предсказать. Несмотря на то что клиническое значение таких взаимодействий неизвестно, рекомендуется избегать совместного назначения сильнодействующих ингибиторов транспортных белков (ENT1, CNT3 или BCRP) в течение 4-5 дней терапии кладрибином. В случае если это невозможно, следует рассмотреть выбор альтернативного лекарственного препарата с отсутствием или с минимальным ингибированием транспортных белков ENT1, CNT3 или BCRP. Если и это невозможно, рекомендуется снижение дозы этих лекарственных препаратов до минимальной поддерживающей, раздельный прием препаратов и тщательное наблюдение за пациентами.
Сильнодействующие индукторы транспортных белков BCRP и Р-гликопротеина.
Влияние сильнодействующих индукторов эффлюксных транспортных белков BCRP и Р-гликопротеина на биодоступность и распределение кладрибина не изучалось.
Снижение эффектов кладрибина возможно при совместном применении индукторов транспортных белков BCRP (например, кортикостероидов) или индукторов транспортных белков Р-гликопротеина (например, рифампицина, препаратов зверобоя).
Гормональные контрацептивные средства.
В настоящее время не установлено, влияет ли кладрибин на снижение эффективности системных гормональных контрацептивных средств. В связи с этим женщинам, которые применяют системные гормональные контрацептивные средства, необходимо дополнительно пользоваться барьерными методами контрацепции на фоне терапии кладрибином и в течение как минимум 4 недель после приема последней дозы препарата каждого года лечения кладрибином в таблетках.
Особые указания
Гематологический мониторинг.
Механизм действия кладрибина связан с уменьшением числа лимфоцитов. Снижение числа лимфоцитов является дозозависимым. Уменьшение числа нейтрофилов, эритроцитов, уровня гематокрита, уровня гемоглобина, а также тромбоцитов по сравнению с начальными значениями наблюдалось в ходе клинических исследований, однако данные параметры обычно остаются в норме.
Аддитивные нежелательные гематологические реакции возможны, если кладрибин назначается до или совместно с другими лекарственными средствами, которые влияют на показатели крови (см. раздел «Взаимодействие с другими лекарственными средствами»).
Число лимфоцитов должно определяться:
- перед началом лечения препаратом МАВЕНКЛАД® на первом году терапии;
- перед началом 2-ого года лечения препаратом МАВЕНКЛАД® на втором году терапии;
- через 2 и 6 месяцев после начала лечения на первом и втором годах терапии. Если число лимфоцитов составляет менее 0,5×109/л, то контроль должен проводиться до восстановления числа лимфоцитов.
Для принятия решения о лечении исходя из числа лимфоцитов, смотри раздел «Способ применения и дозы» и подраздел «Инфекционные заболевания».
Инфекционные заболевания.
При приеме кладрибина может ослабляться иммунная защита организма и повышаться вероятность развития или обострения инфекционных заболеваний. До начала терапии препаратом МАВЕНКЛАД® следует исключить ВИЧ-инфекцию, активный туберкулез, активный гепатит (см. раздел «Противопоказания»). Могут активироваться латентные инфекции, в том числе туберкулез и гепатит. Поэтому до начала терапии на первом и втором годах лечения необходимо провести скрининг на латентные инфекции, в особенности на туберкулез и гепатит В и С. Начало терапии препаратом МАВЕНКЛАД® следует отложить до полного выздоровления.
Начало терапии также следует отложить в случае острой инфекции до ее разрешения. Особое внимание следует уделять пациентам, не имеющим в анамнезе указание на перенесенную инфекцию, вызываемую вирусом ветряной оспы (varicella zoster). Таким серонегативным к вирусу ветряной оспы пациентам до начала терапии кладрибином рекомендуется проводить вакцинацию. Начало терапии препаратом МАВЕНКЛАД® следует отложить на 4-6 недель для обеспечения полного эффекта вакцинации.
Увеличение заболеваемости опоясывающим лишаем (Herpes zoster) было отмечено у пациентов, принимающих кладрибин. Если число лимфоцитов не превышает 0,2×109/л, следует назначить профилактическое антигерпетическое лечение на период пока сохраняется лимфопения 4 степени.
Пациентов с числом лимфоцитов ниже 0,5×109/л необходимо тщательно наблюдать на предмет признаков и симптомов инфекции, в особенности опоясывающего лишая. В случае обнаружения симптомов инфекции необходимо начать соответствующую терапию. Лечение препаратом МАВЕНКЛАД® может быть прервано или отложено до полного выздоровления.
Случаи прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) были зарегистрированы у пациентов, получавших кладрибин по поводу волосатоклеточного лейкоза с другим режимом дозирования.
В базе данных клинических исследований кладрибина при рассеянном склерозе (1976 пациентов, 8650 пациенто-лет) не отмечено ни одного случая ПМЛ. Тем не менее перед началом терапии препаратом МАВЕНКЛАД® (обычно в течение предшествующих 3 месяцев) необходимо выполнить магнитно-резонансную томографию (МРТ). Это особенно важно, если пациент уже получал препараты для лечения рассеянного склероза, которые имеют риск развития ПМЛ.
Злокачественные новообразования.
В клинических исследованиях и долгосрочных наблюдениях у пациентов, получавших кумулятивную дозу кладрибина в таблетках 3,5 мг/кг, частота злокачественных новообразований была выше (10 случаев на 3414 пациенто-лет или 0,29 случаев на 100 пациенто-лет), чем у пациентов, получавших плацебо (3 случая на 2022 пациенто-лет или 0,15 случаев на 100 пациенто-лет).
Препарат МАВЕНКЛАД® не рекомендован пациентам с рассеянным склерозом с активными злокачественными новообразованиями. Вопрос о назначении препарата МАВЕНКЛАД® пациентам с указанием на злокачественное образование в анамнезе должен решаться индивидуально с учетом соотношения возможного риска и пользы для пациента. Пациентам, получавшим терапию препаратом МАВЕНКЛАД®, рекомендовано проходить стандартные обследования на выявление злокачественных новообразований.
Контрацепция у мужчин и женщин.
Перед началом терапии во время первого и второго года лечения препаратом МАВЕНКЛАД® пациенты мужского и женского пола, обладающие детородным потенциалом, должны быть предупреждены о возможном серьезном риске для плода и необходимости использовать эффективные методы контрацепции.
У женщин с детородным потенциалом беременность должна быть исключена до начала терапии препаратом МАВЕНКЛАД® на первом и втором годах терапии. Женщинам детородного возраста необходимо использовать эффективные методы контрацепции во время лечения препаратом МАВЕНКЛАД® и как минимум 6 месяцев после приема последней дозы. Мужчины должны использовать эффективные методы контрацепции для предупреждения беременности у своих партнерш во время терапии препаратом МАВЕНКЛАД® и в течение как минимум 6 месяцев после приема последней дозы.
Переливание крови.
Пациентам, которым требуется переливание крови, рекомендуется до переливания крови провести облучение клеточных компонентов с целью предотвращения трансфузионно-обусловленной реакции «трансплантат против хозяина». Рекомендуется консультация специалиста-гематолога.
Смена терапии, переход с других препаратов на кладрибин и с кладрибина на другие препараты.
У пациентов, получавших ранее терапию иммуномодулирующими и иммуносупрессорными препаратами, механизм их действия и продолжительность терапевтического эффекта должны быть рассмотрены до начала терапии препаратом МАВЕНКЛАД®. Возможное аддитивное влияние на иммунную систему должно быть также принято во внимание при приеме таких препаратов пациентами, получавшими препарат МАВЕНКЛАД®.
Пациенты педиатрического возраста.
Безопасность и эффективность препарата МАВЕНКЛАД® у пациентов с рассеянным склерозом педиатрического возраста не установлена. Прием препарата пациентам до 18 лет противопоказан.
Пациенты пожилого возраста.
Клинические исследования по применению кладрибина в таблетках не включали пациентов старше 65 лет, поэтому неизвестно, есть ли у них отличие в ответе на терапию по сравнению с более молодыми пациентами.
Следует соблюдать осторожность при использовании препарата МАВЕНКЛАД® у пациентов пожилого возраста, принимая во внимание большую вероятность почечной или печеночной недостаточности, сопутствующих заболеваний и совместного применения лекарственных препаратов.
Пациенты с почечной недостаточностью.
Клинические исследования по применению препарата МАВЕНКЛАД® у пациентов с почечной недостаточностью не проводились.
У пациентов с легкой степенью почечной недостаточности (клиренс креатинина от 60 до 89 мл/мин) коррекция дозы препарата не требуется.
Препарат МАВЕНКЛАД® противопоказан пациентам со средней и тяжелой степенью почечной недостаточности, так как безопасность и эффективность применения препарата у данной группы пациентов не установлены (см. раздел «Противопоказания»).
Пациенты с печеночной недостаточностью.
Клинических исследований по применению препарата у пациентов с печеночной недостаточностью не проводилось.
Несмотря на то что роль печени в процессе выведения кладрибина незначительна, применение препарата МАВЕНКЛАД® у пациентов со средней и тяжелой степенью печеночной недостаточности (индекс Чайлд-Пью больше 6) противопоказано, так как данные отсутствуют (см. раздел «Противопоказания»).
Непереносимость фруктозы.
Препарат МАВЕНКЛАД® содержит сорбитол в своем составе, поэтому пациентам с непереносимостью фруктозы прием препарата не рекомендован.
Влияние на способность управлять транспортными средствами, механизмами
Препарат МАВЕНКЛАД® не оказывает влияния на способность управлять транспортными средствами и механизмами.
Форма выпуска
Таблетки, 10 мг.
По 1,4, 5, 6, 7 или 8 таблеток в блистере из алюминиевой фольги, 1 блистер в картонном конверте с 8 отверстиями для таблеток. 1 картонный конверт закреплен в пластиковом контейнере. Инструкция по медицинскому применению вложена в пластиковый контейнер. 1 пластиковый контейнер закреплен в картонной пачке с системой «защиты от детей» и контролем первого вскрытия.
Условия хранения
При температуре не выше 25 °С в оригинальной упаковке (пачке картонной).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать после истечения срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
Все стадии производства, включая выпускающий контроль качества:
НЕРФАРМА С.Р.Л., Виале Пастер, 10 (Нервиано), 20014 Милан, Италия.
Или в случае упаковки препарата Р-Фарм Джермани ГмбХ, Германия:
Производитель:
Производство готовой лекарственной формы и фасовка (первичная упаковка):
НЕРФАРМА С.Р.Л., Виале Пастер, 10 (Нервиано), 20014 Милан, Италия.
Вторичная (потребительская упаковка) и выпускающий контроль качества:
Р-Фарм Джермани ГмбХ, Хайнрих-Мак-Штрассе, 35, г. Иллертиссен, 89257, Германия.
Владелец регистрационного удостоверения
ООО «Мерк»
Юридический адрес: 1 15054, г. Москва, ул. Валовая, д. 35, Россия
Организация, принимающая претензии потребителей
ООО «Мерк»
115054, г. Москва, ул. Валовая, д. 35
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Описание препарата МАВЕНКЛАД® (таблетки, 10 мг) основано на официальной инструкции, утверждено компанией-производителем в 2020 году
Дата согласования: 22.06.2020
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
Фотографии упаковок

22.06.2020
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки | 1 табл. |
| действующее вещество: | |
| кладрибин | 10,00 мг |
| вспомогательные вещества: гидроксипропилбетадекс — 143,76 мг; сорбитол — 64,04 мг; магния стеарат — 2,20 мг |
Описание лекарственной формы
Круглые двояковыпуклые таблетки белого цвета, с гравировкой «С» на одной стороне и «10» на другой стороне.
Фармакологическое действие
Фармакологическое действие
—
иммунодепрессивное.
Фармакодинамика
Механизм действия
Кладрибин (2-хлоро-2′-дезоксиаденозин) является нуклеозидным аналогом 2′-дезоксиаденозина. За счет наличия хлора в пуриновом кольце, кладрибин обладает резистентностью к действию аденозиндезаминазы, что увеличивает время нахождения пролекарства кладрибин в клетке.
Последующее фосфорилирование кладрибина в его активную трифосфатную форму, 2-хлордезоксиаденозинтрифосфат (Cd-ATP), преимущественно происходит в лимфоцитах, т.к. для них характерен постоянный высокий уровень дезоксицитидинкиназы (DCK) и относительно низкий уровень 5′-нуклеотидазы (5′-NTase). Высокое соотношение DCK и 5′-NTase способствует накоплению Cd-ATP в лимфоцитах, что приводит к гибели клеток. В результате более низкого соотношения DCK и 5′-NTase другие клетки, развивающиеся из костного мозга, меньше подвержены воздействию кладрибина, чем лимфоциты.
DCK представляет собой фермент, ограничивающий скорость превращения пролекарства кладрибин в его активную трифосфатную форму, что приводит к селективному уменьшению делящихся и неделящихся T- и B-клеток.
Первичный апоптозиндуцирующий механизм действия Cd-ATP оказывает прямое и непрямое действие на синтез ДНК и функцию митохондрий. В делящихся клетках Cd-ATP препятствует синтезу ДНК путем ингибирования рибонуклеотидредуктазы и избирательной конкуренции с дезоксиаденозинтрифосфатом за включение в ДНК посредством ДНК-полимераз. В покоящихся клетках кладрибин вызывает одноцепочечные разрывы ДНК, быстрое потребление никотинамидадениндинуклеотида, истощение АТФ и гибель клеток. Имеются данные о том, что кладрибин также может вызывать прямой каспаззависимый и -независимый апоптоз посредством высвобождения цитохрома С и апоптозиндуцирующего фактора в цитозоль неделящихся клеток.
Патогенез рассеянного склероза (РС) включает сложный каскад событий, в котором ключевую роль играют различные типы иммунных клеток, включая аутореактивные Т- и В-клетки. Механизм, с помощью которого кладрибин оказывает свои терапевтические эффекты при рассеянном склерозе, полностью не выяснен, однако считается, что его преимущественное воздействие на Т- и В-лимфоциты прерывает каскад событий в иммунной системе, имеющих центральное значение в развитии рассеянного склероза.
Различия в уровне экспрессии DCK и 5′-NTases между подтипами иммунных клеток могут объяснять различия в чувствительности иммунных клеток к кладрибину. Из-за этих различий клетки врожденной иммунной системы в меньшей степени подвержены воздействию кладрибина, чем клетки адаптивной иммунной системы.
Фармакодинамика
Кладрибин оказывает длительные эффекты, преимущественно направленные на лимфоциты и аутоиммунные процессы, участвующие в патогенезе рассеянного склероза.
В клинических исследованиях наибольшая частота лимфопении 3-й или 4-й степени тяжести (от 0,5·109/л до 0,2·109/л или менее 0,2·109/л) наблюдалась у пациентов через 2 месяца после приема первой дозы кладрибина в течение каждого года терапии, что указывало на разрыв во времени между концентрацией кладрибина в плазме крови и максимальным гематологическим эффектом.
Данные клинических исследований показывают, что при назначении препарата в рекомендуемой суммарной дозе 3,5 мг/кг постепенное возвращение показателей медианы числа лимфоцитов к нормальным значениям происходит на 84-й неделе после приема первой дозы кладрибина (примерно через 30 недель после приема последней дозы кладрибина). Более чем у 75% пациентов число лимфоцитов возвратилось к норме к 144-й неделе после приема первой дозы кладрибина (примерно через 90 недель после приема последней дозы кладрибина).
Терапия кладрибином в таблетках приводит к быстрому сокращению числа циркулирующих CD4+ и CD8+ Т-клеток. CD8+ Т-клетки показывают менее выраженное снижение и более быстрое восстановление, чем CD4+ Т-клетки, что приводит к временному снижению соотношения CD4/CD8. Кладрибин уменьшает число CD19+ В-клеток и CD16+/CD56+ естественных клеток-киллеров, которые также восстанавливаются быстрее, чем CD4+ Т-клетки.
Эффективность у пациентов с высокой активностью заболевания
Был проведен апостериорный анализ эффективности в подгруппах пациентов с высокой активностью заболевания, получавших кладрибин перорально в рекомендуемой дозе 3,5 мг/кг.
Подгруппа пациентов включала:
— пациенты с 1 обострением в течение предшествующего года и по крайней мере 1 T1Gd+ очаг или 9 или более Т2 очагов на фоне проводимой терапии другими препаратами, изменяющими течение рассеянного склероза (ПИТРС);
— пациенты с 2 или более обострениями в течение предшествующего года, независимо от того, проводилась терапия ПИТРС или нет.
Фармакокинетика
Кладрибин является пролекарством, и для его активации требуется внутриклеточное фосфорилирование. Фармакокинетические показатели кладрибина изучались при внутривенном и пероральном введении пациентам с рассеянным склерозом и пациентам с онкологическими заболеваниями, а также в исследованиях in vitro.
Абсорбция. После перорального введения кладрибин быстро всасывается. После приема внутрь 10 мг кладрибина средняя максимальная концентрация (Сmax) в плазме крови находится в диапазоне от 22 нг/мл до 29 нг/мл, а соответствующая площадь под кривой «концентрация-время» (AUC) составляет от 80 до 101 нг·ч/мл (среднее арифметическое из различных исследований). При приеме натощак среднее время достижения максимальной концентрации (Tmax) кладрибина в плазме крови составляет около 0,5 часа (в диапазоне от 0,5 до 1,5 ч). При одновременном приеме с высококалорийной пищей абсорбция кладрибина замедляется: среднее Tmax составляет 1,5 часа (в диапазоне от 1 до 3 ч), а Cmaхснижается на 29% (основываясь на среднем геометрическом значении), при этом AUC не изменяется. Биодоступность кладрибина после перорального введения в дозе 10 мг составляет около 40%.
Распределение. Объем распределения препарата большой, что указывает на его экстенсивное распределение в тканях и на внутриклеточное поглощение. В среднем объем распределения кладрибина составляет от 480 л до 490 л. Связь кладрибина с белками плазмы крови составляет 20% и не зависит от концентрации препарата.
Прохождению кладрибина через биологические мембраны способствуют различные транспортные белки, в том числе ENT1, CNT3 и BCRP.
В исследованиях in vitro кладрибин лишь минимально связан с P-гликопротеином (P-gp). Клинически значимое взаимодействие с ингибиторами P-gp маловероятно. Возможные последствия влияния индукции P-gp на биодоступность кладрибина формально не изучались.
В исследованиях in vitro показано незначительное опосредованное транспортными белками поглощение кладрибина гепатоцитами.
Кладрибин обладает способностью проникать через гематоэнцефалический барьер. Небольшое исследование у онкологических пациентов показало, что отношение концентрации кладрибина в цереброспинальной жидкости к концентрации его в плазме составляет 0,25.
Кладрибин и/или его фосфорилированные метаболиты главным образом накапливаются и удерживаются в лимфоцитах. In vitro отношение внеклеточной концентрации к внутриклеточной концентрации через 1 час после воздействия кладрибина составляло примерно 30/40.
Биотрансформация. Метаболизм кладрибина изучали у пациентов с рассеянным склерозом после однократного перорального введения дозы 10 мг и однократного внутривенного введения дозы 3 мг. Основным компонентом, присутствующим в плазме и в моче, являлся неизмененный кладрибин как после перорального, так и после внутривенного введения. Метаболит 2-хлороаденин был также обнаружен в плазме и в моче, в количестве ≤3% от неизмененного кладрибина после перорального введения. Другие метаболиты определялись в плазме и в моче в следовых количествах.
В клетках печени в условиях in vitro наблюдался незначительный метаболизм кладрибина (90% кладрибина остается в неизмененном виде).
Кладрибин не является релевантным субстратом для ферментов цитохрома Р450 и потенциальным ингибитором CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4. Предполагается, что ингибирование этих ферментов или генетические полиморфизмы (например, CYP2D6, CYP2C9 или CYP2C19) не окажут клинически значимого влияния на фармакокинетику кладрибина или его воздействие. Кладрибин не оказывает клинически значимого индуктивного воздействия на ферменты CYP1A2, CYP2B6 и CYP3A4.
После проникновения в клетку при участии дезоксицитидинкиназы (DCK) происходит фосфорилирование кладрибина с образованием кладрибин-5′-монофосфата (Cd-AMP) (и также при участии дезоксигуанозинкиназы в митохондриях). В дальнейшем Cd-AMP фосфорилируется до дифосфата кладрибина (Cd-ADP) и трифосфата кладрибина (Cd-ATP). Дефосфорилирование и дезактивация Cd-AMP катализируются цитоплазматической 5′-нуклеотидазой (5′-Ntase). В исследовании внутриклеточной фармакокинетики Cd-AMP и Cd-ATP у пациентов с хроническим миелоидным лейкозом уровни Cd-ATP составляли примерно половину от уровня Cd-AMP. Внутриклеточный период полувыведения Cd-ATP составляет 10 ч, Cd-AMP — 15 ч.
Элиминация. Основываясь на объединенных популяционных фармакокинетических данных различных исследований, медианные значения элиминации составили 22,2 л/ч для почечного клиренса и 23,4 л/ч для метаболического (внепочечного) клиренса. Почечный клиренс превышал скорость клубочковой фильтрации, что указывает на активное выделение кладрибина почками. Метаболический клиренс кладрибина (примерно 50%) включает в себя незначительный процесс метаболических изменений в печени и экстенсивное обширное внутриклеточное распределение, улавливание активного трифосфата кладрибина (Cd-ATP) во внутриклеточное пространство (т.е. в лимфоциты) и последующее выведение внутриклеточного Cd-ATP в соответствии с жизненным циклом этих клеток.
Период полувыведения кладрибина (T1/2) — около 24 часов.
Дозовременная зависимость. После перорального введения кладрибина в диапазоне доз от 3 до 20 мг Cmax и AUC увеличивались пропорционально дозе, следовательно, на абсорбцию препарата не влияют процессы с ограничением по скорости или накоплению для доз до 20 мг.
Не обнаружено значительного увеличения концентрации кладрибина в плазме крови после повторного введения. Нет данных, что фармакокинетика кладрибина после повторного введения может изменяться в зависимости от времени.
Особые группы пациентов
Не проводилось клинических исследований для оценки фармакокинетики кладрибина у пациентов с рассеянным склерозом пожилого возраста или педиатрического возраста, или у пациентов с почечной или печеночной недостаточностью.
На основе модели популяционной фармакокинетики, статистически значимого влияния возраста (от 18 до 65 лет) или пола на фармакокинетику кладрибина не обнаружено.
Почечная недостаточность. Почечный клиренс кладрибина зависит от клиренса креатинина (Cl креатинина). Основываясь на популяционном фармакокинетическом анализе пациентов с нормальной функцией почек и с легкой почечной недостаточностью, ожидается, что общий клиренс у пациентов с легкой почечной недостаточностью (Cl креатинина = 60 мл/мин) будет умеренно снижаться, приводя к увеличению экспозиции на 25%. У пациентов со средней степенью почечной недостаточности (Cl креатинина = 40 мл/мин) предполагаемое уменьшение клиренса кладрибина составляет 30% и у пациентов с тяжелой степенью почечной недостаточности (Cl креатинина = 20 мл/мин) — 40%.
Печеночная недостаточность. Роль печени в процессе выведения кладрибина незначительна.
Фармакокинетические взаимодействия
Исследование взаимодействия лекарственных средств у пациентов с рассеянным склерозом показало, что биодоступность перорально введенного кладрибина в дозе 10 мг не изменялась при совместном применении с пантопразолом.
Показания
Лечение взрослых пациентов с высокоактивным рецидивирующим рассеянным склерозом, подтвержденным данными клинических или радиологических исследований (см. «Фармакодинамика»).
Противопоказания
- повышенная чувствительность к кладрибину или другим компонентам препарата;
- обострение хронической инфекции (туберкулез, гепатит);
- ВИЧ-инфекция;
- начало терапии кладрибином у иммунокомпроментированных пациентов, в т.ч. пациентов, получающих иммуносупрессивную или миелосупрессивную терапию (см. «Взаимодействие»);
- средняя и тяжелая степень почечной недостаточности (клиренс креатинина <60 мл/мин) (см. «Особые указания»);
- средняя и тяжелая степень печеночной недостаточности;
- непереносимость фруктозы;
- совместное применение с интерфероном бета;
- вакцинация живыми, в т.ч. аттенуированными вакцинами;
- беременность, период грудного вскармливания;
- детский возраст до 18 лет (недостаточно клинических данных).
С осторожностью: у пациентов пожилого возраста, старше 65 лет, из-за недостаточности клинических данных и с учетом большей вероятности недостаточности почек или печени, сопутствующих заболеваний и других применяемых препаратов.
Следует соблюдать осторожность при комбинированной терапии с препаратами, обладающими гематотоксическими свойствами, индукторами транспортных белков BCRP и P-gp.
Применение при беременности и кормлении грудью
Контрацепция у мужчин и женщин. Перед началом терапии во время 1-го и 2-го года лечения препаратом МАВЕНКЛАД® пациенты мужского и женского пола, обладающие детородным потенциалом, должны быть предупреждены о возможном серьезном риске для плода и необходимости использовать эффективные методы контрацепции.
Женщинам с детородным потенциалом необходимо пройти тест на беременность до начала лечения препаратом МАВЕНКЛАД® на 1-м и 2-м году терапии и использовать эффективные методы контрацепции во время приема препарата и как минимум 6 месяцев после приема последней дозы.
Женщины, использующие системные гормональные противозачаточные средства, должны добавить барьерный метод контрацепции во время терапии препаратом МАВЕНКЛАД® и в течение как минимум 4 недель после последней дозы во время 1-го и 2-го года лечения.
Женщины, которые забеременели во время терапии, должны прекратить лечение препаратом МАВЕНКЛАД®.
Поскольку кладрибин угнетает синтез ДНК, можно ожидать неблагоприятных воздействий на гаметогенез человека. Поэтому пациенты мужского пола должны использовать эффективные методы контрацепции для предупреждения беременности у своих партнерш во время терапии препаратом МАВЕНКЛАД® и в течение как минимум 6 месяцев после приема последней дозы.
Беременность. Кладрибин ингибирует синтез ДНК, что может приводить к врожденным порокам развития при применении во время беременности.
Исследования на животных показали токсичность препарата МАВЕНКЛАД® в отношении репродуктивной системы.
МАВЕНКЛАД® противопоказан беременным женщинам (см. «Противопоказания»).
В случае наступления беременности в период лечения препарат должен быть отменен.
Период грудного вскармливания. Данные о проникновении кладрибина в грудное молоко женщин отсутствуют. С учетом потенциальных нежелательных эффектов препарата рекомендуется прекращение грудного вскармливания во время терапии и в течение одной недели после приема последней дозы препарата МАВЕНКЛАД®.
Фертильность. Эффекты кладрибина на фертильность у пациентов мужского пола неизвестны. В исследованиях на животных нарушения тестикулярной функции наблюдались у мышей и обезьян. Влияния кладрибина на фертильность или репродуктивную функцию у мышей не обнаружено.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Способ применения
Внутрь, независимо от приема пищи, не разжевывая и запивая водой. Поскольку таблетки не покрыты оболочкой, их необходимо проглатывать сразу же после освобождения из блистера, не оставлять на поверхности и не держать в руках дольше, чем это необходимо. В случае если таблетка была оставлена на поверхности или она разломалась в процессе высвобождения из блистера, поверхность необходимо тщательно вымыть.
При обращении с препаратом руки должны быть сухими. После применения препарата необходимо тщательно вымыть руки.
Рекомендуемая доза
Рекомендуемая суммарная доза препарата МАВЕНКЛАД® составляет 3,5 мг/кг в течение 2 лет: 1,75 мг/кг на 1 курс лечения в год. Годовой курс терапии состоит из 2 недель лечения: одна неделя в начале 1-го месяца и одна неделя в начале 2-го месяца соответствующего года лечения. Каждая неделя лечения состоит из 4 или 5 дней, в течение которых препарат принимают 1 раз в день в дозе 10 мг или 20 мг (одна или две таблетки) в зависимости от массы тела пациента.
Расчет дозы и количества препарата в зависимости от массы тела пациента представлены ниже в таблицах 1 и 2.
После завершения 2 годовых курсов лечения дальнейший прием препарата в течение 3-го и 4-го года не требуется.
Возобновление лечения после 4 лет не изучалось.
Критерии начала и продолжения лечения
Число лимфоцитов должно быть:
— в норме перед началом 1-го года лечения препаратом МАВЕНКЛАД®;
— ≥0,8·109/л перед началом 2-го года лечения препаратом МАВЕНКЛАД®.
При необходимости 2-й годовой курс лечения может быть отложен на срок до 6 месяцев до восстановления приемлемого числа лимфоцитов. В случае если период восстановления числа лимфоцитов занимает более 6 месяцев, прием препарата МАВЕНКЛАД® должен быть прекращен.
Расчет дозы
Расчет дозы в течение двух лет терапии проводится лечащим врачом на основании массы тела пациента в соответствии с таблицей 1. Для некоторых диапазонов массы тела число таблеток может варьировать от одной недели лечения к другой. Пероральное применение кладрибина у пациентов массой тела менее 40 кг не исследовалось.
Таблица 1
Доза препарата МАВЕНКЛАД® на неделю лечения в зависимости от массы тела пациента для каждого года терапии
| Масса тела пациента, кг | Доза, мг (число таблеток) на неделю лечения | |
| 1-я неделя лечения | 2-я неделя лечения | |
| Более или равно 40, но менее 50 | 40 мг (4 таблетки) | 40 мг (4 таблетки) |
| Более или равно 50, но менее 60 | 50 мг (5 таблеток) | 50 мг (5 таблеток) |
| Более или равно 60, но менее 70 | 60 мг (6 таблеток) | 60 мг (6 таблеток) |
| Более или равно 70, но менее 80 | 70 мг (7 таблеток) | 70 мг (7 таблеток) |
| Более или равно 80, но менее 90 | 80 мг (8 таблеток) | 70 мг (7 таблеток) |
| Более или равно 90, но менее 100 | 90 мг (9 таблеток) | 80 мг (8 таблеток) |
| Более или равно 100, но менее 110 | 100 мг (10 таблеток) | 90 мг (9 таблеток) |
| Более или равно 110 | 100 мг (10 таблеток) | 100 мг (10 таблеток) |
Таблица 2 показывает распределение общего числа таблеток по дням в течение недельного курса терапии. Интервал между приемом таблеток должен составлять 24 часа. Прием препарата должен осуществляться в одно и то же время суток в течение каждой недели терапии. Если суточная доза составляет 2 таблетки, таблетки принимают вместе как одну дозу.
Таблица 2
Распределение общего числа таблеток препарата МАВЕНКЛАД® в дозе 10 мг по дням в течение недельного курса терапии
| Общее число таблеток в неделю | 1-й день | 2-й день | 3-й день | 4-й день | 5-й день |
| 4 | 1 | 1 | 1 | 1 | 0 |
| 5 | 1 | 1 | 1 | 1 | 1 |
| 6 | 2 | 1 | 1 | 1 | 1 |
| 7 | 2 | 2 | 1 | 1 | 1 |
| 8 | 2 | 2 | 2 | 1 | 1 |
| 9 | 2 | 2 | 2 | 2 | 1 |
| 10 | 2 | 2 | 2 | 2 | 2 |
Пропущенную дозу препарата (1 или 2 таблетки) следует принять, как только вы об этом вспомнили, в тот же день в соответствии с графиком лечения.
Пропущенная доза не должна приниматься вместе с последующей запланированной дозой на следующий день. В случае пропуска дозы пациент должен принять пропущенную дозу на следующий день, продлив, таким образом, курс приема препарата на сутки. Если пропущены две последовательные дозы, применяется то же правило, и число дней недельного курса лечения увеличивается на два дня.
Особые группы пациентов
Почечная недостаточность. Клинические исследования по применению препарата МАВЕНКЛАД® у пациентов с почечной недостаточностью не проводились. У пациентов с легкой степенью почечной недостаточности (клиренс креатинина от 60 до 89 мл/мин) коррекция дозы препарата не требуется.
Препарат МАВЕНКЛАД® противопоказан пациентам со средней и тяжелой степенью почечной недостаточности, т.к. безопасность и эффективность применения препарата у данной группы пациентов не установлены (см. «Противопоказания»).
Печеночная недостаточность. Клинических исследований по применению препарата у пациентов с печеночной недостаточностью не проводились. Несмотря на то что роль печени в процессе выведения кладрибина незначительна, применение препарата МАВЕНКЛАД® у пациентов со средней и тяжелой степенью печеночной недостаточности (индекс Чайлд-Пью >6) противопоказано, т.к. данные отсутствуют (см. «Противопоказания»).
Пожилой возраст (старше 65 лет). Клинические исследования по применению кладрибина в таблетках не включали пациентов старше 65 лет, поэтому неизвестно, есть ли у них отличие в ответе на терапию по сравнению с более молодыми пациентами (см. С осторожностью).
Детский и подростковый возраст. Безопасность и эффективность препарата МАВЕНКЛАД® у пациентов с рассеянным склерозом в возрасте до 18 лет не установлена, поэтому прием препарата в этой группе пациентов противопоказан (см. «Противопоказания»).
Инструкция по использованию специальной упаковки препарата МАВЕНКЛАД®
1. Вымыть и насухо вытереть руки, приготовить стакан питьевой воды.
2. Взять упаковку препарата в руку и повернуть к себе той стороной, где напечатана инструкция по обращению со специальной упаковкой.
3. (1) Открыть клапан картонной пачки с левой стороны. (2) Одновременно нажать и удерживать в нажатом состоянии кнопки, расположенные на боковых поверхностях картонной пачки, указательным и большим пальцами правой руки. (3) Потянуть пластиковый контейнер до упора, но не извлекать его из пачки.
4. Взять из пластикового контейнера инструкцию по применению. Убедиться в том, что пациент ознакомился со всей информацией, представленной в инструкции, включая инструкцию по обращению со специальной упаковкой. Хранить инструкцию в безопасном месте.
5. Приподнять блистер из пластикового контейнера и выдавить большим пальцем на ладонь 1 или 2 таблетки согласно прописанной схеме лечения.
6. Положить таблетку в рот и запить ее водой. Таблетку необходимо проглотить сразу, не разжевывая и не рассасывая. Необходимо избегать длительного контакта таблетки с кожей рук и касания руками ноcа, глаз и других частей тела.
7. Тщательно вымыть руки с мылом.
8. Вернуть контейнер с блистером назад в упаковку. Хранить препарат в оригинальной упаковке для защиты от влаги.
Хранить таблетки МАВЕНКЛАД® в блистере до следующего приема. Не выдавливать таблетки заранее. Не хранить таблетки в другом контейнере.
Побочные действия
Для описания частоты возникновения нежелательных реакций (НР) используется следующая классификация: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000); очень редко (<1/10000); частота неизвестна (частота не может быть определена на основе имеющихся данных).
Инфекционные и паразитарные заболевания: часто — опоясывающий лишай, герпес слизистой оболочки полости рта; очень редко — туберкулез.
Со стороны крови и лимфатической системы: очень часто — лимфопения; часто — снижение числа нейтрофилов.
Со стороны кожи и подкожных тканей: часто — кожная сыпь, алопеция.
Описание отдельных нежелательных реакций
Лимфопения. В клинических исследованиях у 20–25 % пациентов, получивших кумулятивную дозу кладрибина 3,5 мг/кг в течение 2 лет в качестве монотерапии, развивалась транзиторная лимфопения 3-й или 4-й степени тяжести, установленная по результатам лабораторных исследований. Лимфопения 4-й степени тяжести наблюдалась у менее 1% пациентов. Наиболее часто лимфопения 3-й или 4-й степени тяжести наблюдалась у пациентов через 2 месяца после приема первой дозы кладрибина в рамках 1-го и 2-го годовых курсов терапии (частота лимфопении 3-й степени составила на 1-м и 2-м годах 4,0 и 11,3% соответственно, частота лимфопении 4-й степени на 1-м и 2-м годах составила 0 и 0,4% соответственно). Ожидается, что у большинства пациентов восстановление числа лимфоцитов до нормальных значений или до значения лимфопении 1-й степени происходит в течение девяти месяцев.
Чтобы уменьшить риск развития тяжелой лимфопении, необходимо определять число лимфоцитов до начала терапии кладрибином, во время терапии и после ее окончания (см. «Особые указания»), а также строго соблюдать критерии начала и продолжения лечения кладрибином (см. «Способ применения и дозы»).
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
В состав препарата МАВЕНКЛАД® входит гидроксипропилбетадекс, который может увеличивать растворимость и системную биодоступность слаборастворимых лекарственных средств при совместном приеме. Прием других пероральных препаратов возможен не ранее чем за 3 часа до или через 3 часа после приема препарата МАВЕНКЛАД®.
Иммунодепрессивные препараты. Использование препарата у иммунокомпрометированных пациентов, включая пациентов, получающих иммуносупрессивную или миелосупрессивную терапию (например, метотрексат, циклофосфамид, циклоспорин или азатиоприн) или длительное лечение глюкокортикостероидами, противопоказано из-за риска дополнительного влияния на иммунную систему (см. «Противопоказания»).
Проведение краткосрочной терапии глюкокортикостероидами допускается.
Препараты, модифицирующие течение болезни. Совместное применение кладрибина с интерфероном бета может увеличить риск развития лимфопении. Безопасность и эффективность применения препарата МАВЕНКЛАД® в комбинации с другими препаратами, модифицирующими течение болезни, у пациентов с рассеянным склерозом не установлена. Совместное применение не рекомендовано.
Препараты, обладающие гематотоксическими свойствами. При применении препарата МАВЕНКЛАД® до или совместно с препаратами, обладающими гематотоксическими свойствами (например, карбамазепин), можно ожидать дополнительные нежелательные эффекты со стороны крови. В таких случаях следует проводить тщательный мониторинг гематологических показателей.
Вакцинация живыми, в т.ч. аттенуированными, вакцинами. Лечение препаратом МАВЕНКЛАД® не следует начинать в течение 4–6 недель после вакцинации живыми, в т.ч. аттенуированными, вакцинами из-за повышения риска активизации инфекции.
Вакцинация живыми, в т.ч. аттенуированными, вакцинами не должна назначаться как во время лечения препаратом МАВЕНКЛАД®, так и после прекращения приема препарата до тех пор, пока число лейкоцитов в крови не вернется к норме.
Сильнодействующие ингибиторы транспортных белков ENT1, CNT3, BCRP. На уровне абсорбции кладрибина единственное возможное клинически значимое взаимодействие вероятно с белками резистентности рака молочной железы (BCRP или ABCG2). Ингибирование белков BCRP в желудочно-кишечном тракте может увеличивать биодоступность кладрибина при пероральном приеме и его системное действие.
Известные ингибиторы BCRP (например, элтромбопаг) in vivo могут менять фармакокинетические параметры субстратов транспортных белков на 20%.
Данные исследований in vitro свидетельствуют о том, что кладрибин является субстратом уравновешивающих переносчиков нуклеозидов (ENT1) и концентрирующих переносчиков нуклеозидов (CNT3) транспортных белков. Следовательно, биодоступность, внутриклеточное распределение и почечная элиминация кладрибина теоретически могут быть изменены под действием сильнодействующих ингибиторов транспортных белков ENT1 и CNT3, таких как дилазеп, нифедипин, нимодипин, цилостазол, сулиндак или резерпин. Однако их непосредственное влияние на действие кладрибина трудно предсказать.
Несмотря на то что клиническое значение таких взаимодействий неизвестно, рекомендуется избегать совместного назначения сильнодействующих ингибиторов транспортных белков (ENT1, CNT3 или BCRP) в течение 4–5 дней терапии кладрибином. В случае если это невозможно, следует рассмотреть выбор альтернативного лекарственного препарата с отсутствием или с минимальным ингибированием транспортных белков ENT1, CNT3 или BCRP. Если и это невозможно, рекомендуется снижение дозы этих лекарственных препаратов до минимальной поддерживающей, раздельный прием препаратов и тщательное наблюдение за пациентами.
Сильнодействующие индукторы транспортных белков BCRP и Р-gp. Влияние сильнодействующих индукторов эффлюксных транспортных белков BCRP и Р-gp на биодоступность и распределение кладрибина не изучалось.
Снижение эффектов кладрибина возможно при совместном применении индукторов транспортных белков BCRP (например, кортикостероидов) или Р-gp (например, рифампицина, препаратов зверобоя).
Гормональные контрацептивные средства. В настоящее время не установлено, влияет ли кладрибин на снижение эффективности системных гормональных контрацептивных средств. В связи с этим женщинам, которые применяют системные гормональные контрацептивные средства, необходимо дополнительно пользоваться барьерными методами контрацепции на фоне терапии кладрибином и в течение как минимум 4 недель после приема последней дозы препарата каждого года лечения кладрибином в таблетках.
Передозировка
Симптомы: имеется ограниченный опыт случаев передозировки препарата МАВЕНКЛАД®. Известно, что лимфопения вследствие приема препарата МАВЕНКЛАД® является дозозависимой.
Лечение: антидот при передозировке неизвестен. Рекомендуется назначение симптоматической терапии и тщательное наблюдение. Возможно, потребуется рассмотреть вопрос о прекращении терапии. Из-за быстрого и экстенсивного внутриклеточного и тканевого распределения маловероятно, что гемодиализ при передозировке кладрибина будет эффективен.
Особые указания
Гематологический мониторинг.
Механизм действия кладрибина связан с уменьшением числа лимфоцитов. Снижение числа лимфоцитов является дозозависимым. Уменьшение числа нейтрофилов, эритроцитов, уровня гематокрита, уровня гемоглобина, а также тромбоцитов, по сравнению с начальными значениями, наблюдалось в ходе клинических исследований, однако данные параметры обычно остаются в норме.
Аддитивные нежелательные гематологические реакции возможны, если кладрибин назначается до или совместно с другими лекарственными средствами, которые влияют на показатели крови (см. «Взаимодействие»).
Число лимфоцитов должно определяться:
— перед началом лечения препаратом МАВЕНКЛАД® на первом году терапии; перед началом 2-го года лечения препаратом МАВЕНКЛАД® на втором году терапии; через 2 и 6 месяцев после начала лечения на первом и втором годах терапии. Если число лимфоцитов составляет менее 0,5·109/л, то контроль должен проводиться до восстановления числа лимфоцитов.
Для принятия решения о лечении исходя из числа лимфоцитов см. раздел «Способ применения и дозы» и подраздел Инфекционные заболевания (ниже).
Инфекционные заболевания. При приеме кладрибина может ослабляться иммунная защита организма и повышаться вероятность развития или обострения инфекционных заболеваний. До начала терапии препаратом МАВЕНКЛАД® следует исключить ВИЧ-инфекцию, активный туберкулез, активный гепатит (см. «Противопоказания»). Могут активироваться латентные инфекции, в т.ч. туберкулез и гепатит. Поэтому до начала терапии на первом и втором годах лечения необходимо провести скрининг на латентные инфекции, в особенности на туберкулез и гепатит В и С. Начало терапии препаратом МАВЕНКЛАД® следует отложить до полного выздоровления.
Начало терапии также следует отложить в случае острой инфекции до ее разрешения. Особое внимание следует уделять пациентам, не имеющим в анамнезе указание на перенесенную инфекцию, вызываемую вирусом ветряной оспы (varicella zoster). Таким серонегативным к вирусу ветряной оспы пациентам до начала терапии кладрибином рекомендуется проводить вакцинацию. Начало терапии препаратом МАВЕНКЛАД® следует отложить на 4–6 недель для обеспечения полного эффекта вакцинации.
Увеличение заболеваемости опоясывающим лишаем (Herpes zoster) было отмечено у пациентов, принимающих кладрибин. Если число лимфоцитов не превышает 0,2·109/л, следует назначить профилактическое антигерпетическое лечение на период, пока сохраняется лимфопения 4-й степени.
Пациентов с числом лимфоцитов ниже 0,5·109/л необходимо тщательно наблюдать на предмет признаков и симптомов инфекции, в особенности опоясывающего лишая. В случае обнаружения симптомов инфекции необходимо начать соответствующую терапию. Лечение препаратом МАВЕНКЛАД® может быть прервано или отложено до полного выздоровления.
Случаи прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) были зарегистрированы у пациентов, получавших кладрибин по поводу волосатоклеточного лейкоза с другим режимом дозирования.
В базе данных клинических исследований кладрибина при рассеянном склерозе (1976 пациентов, 8650 пациенто-лет) не отмечено ни одного случая ПМЛ. Тем не менее перед началом терапии препаратом МАВЕНКЛАД® (обычно в течение предшествующих 3 месяцев) необходимо выполнить магнитно-резонансную томографию (МРТ). Это особенно важно, если пациент уже получал препараты для лечения рассеянного склероза, которые имеют риск развития ПМЛ.
Злокачественные новообразования. В клинических исследованиях и долгосрочных наблюдениях у пациентов, получавших кумулятивную дозу кладрибина в таблетках 3,5 мг/кг, частота злокачественных новообразований была выше (10 случаев на 3414 пациенто-лет или 0,29 случая на 100 пациенто-лет), чем у пациентов, получавших плацебо (3 случая на 2022 пациенто-лет или 0,15 случая на 100 пациенто-лет).
Препарат МАВЕНКЛАД® не рекомендован пациентам с рассеянным склерозом с активными злокачественными новообразованиями. Вопрос о назначении препарата МАВЕНКЛАД® пациентам с указанием на злокачественное образование в анамнезе должен решаться индивидуально, с учетом соотношения возможного риска и пользы для пациента. Пациентам, получавшим терапию препаратом МАВЕНКЛАД®, рекомендовано проходить стандартные обследования на выявление злокачественных новообразований.
Контрацепция у мужчин и женщин. Перед началом терапии во время первого и второго года лечения препаратом МАВЕНКЛАД® пациенты мужского и женского пола, обладающие детородным потенциалом, должны быть предупреждены о возможном серьезном риске для плода и необходимости использовать эффективные методы контрацепции.
У женщин с детородным потенциалом беременность должна быть исключена до начала терапии препаратом МАВЕНКЛАД® на первом и втором годах терапии. Женщинам детородного возраста необходимо использовать эффективные методы контрацепции во время лечения препаратом МАВЕНКЛАД® и как минимум 6 месяцев после приема последней дозы. Мужчины должны использовать эффективные методы контрацепции для предупреждения беременности у своих партнерш во время терапии препаратом МАВЕНКЛАД® и в течение как минимум 6 месяцев после приема последней дозы.
Переливание крови. Пациентам, которым требуется переливание крови, рекомендуется до переливания крови провести облучение клеточных компонентов с целью предотвращения трансфузионно-обусловленной реакции «трансплантат против хозяина». Рекомендуется консультация специалиста-гематолога.
Смена терапии, переход с других препаратов на кладрибин и с кладрибина на другие препараты. У пациентов, получавших ранее терапию иммуномодулирующими и иммуносупрессорными препаратами, механизм их действия и продолжительность терапевтического эффекта должны быть рассмотрены до начала терапии препаратом МАВЕНКЛАД®. Возможное аддитивное влияние на иммунную систему должно быть также принято во внимание при приеме таких препаратов пациентами, получавшими препарат МАВЕНКЛАД®.
Пациенты педиатрического возраста. Безопасность и эффективность препарата МАВЕНКЛАД® у пациентов с рассеянным склерозом педиатрического возраста не установлена. Прием препарата пациентам до 18 лет противопоказан.
Пациенты пожилого возраста. Клинические исследования по применению кладрибина в таблетках не включали пациентов старше 65 лет, поэтому неизвестно, есть ли у них отличие в ответе на терапию по сравнению с более молодыми пациентами.
Следует соблюдать осторожность при использовании препарата МАВЕНКЛАД® у пациентов пожилого возраста, принимая во внимание большую вероятность почечной или печеночной недостаточности, сопутствующих заболеваний и совместного применения лекарственных препаратов.
Почечная недостаточность. Клинические исследования по применению препарата МАВЕНКЛАД® у пациентов с почечной недостаточностью не проводились. У пациентов с легкой степенью почечной недостаточности (клиренс креатинина от 60 до 89 мл/мин) коррекция дозы препарата не требуется.
Препарат МАВЕНКЛАД® противопоказан пациентам со средней и тяжелой степенью почечной недостаточности, так как безопасность и эффективность применения препарата у данной группы пациентов не установлены (см. «Противопоказания»).
Печеночная недостаточность. Клинических исследований по применению препарата у пациентов с печеночной недостаточностью не проводилось. Несмотря на то что роль печени в процессе выведения кладрибина незначительна, применение препарата МАВЕНКЛАД® у пациентов со средней и тяжелой степенью печеночной недостаточности (индекс Чайлд-Пью больше 6) противопоказано, так как данные отсутствуют (см. «Противопоказания»).
Непереносимость фруктозы. Препарат МАВЕНКЛАД® содержит сорбитол в своем составе, поэтому пациентам с непереносимостью фруктозы прием препарата не рекомендован.
Влияние на способность управлять транспортными средствами, механизмами. Препарат МАВЕНКЛАД® не оказывает влияния на способность управлять транспортными средствами и механизмами.
Форма выпуска
Таблетки, 10 мг. По 1, 4, 5, 6, 7 или 8 таблеток в блистере из алюминиевой фольги, 1 блистер в картонном конверте с 8 отверстиями для таблеток. 1 картонный конверт закреплен в пластиковом контейнере. Инструкция по медицинскому применению вложена в пластиковый контейнер. 1 пластиковый контейнер закреплен в картонной пачке с системой защиты от детей и контролем первого вскрытия.
Производитель
Все стадии производства, включая выпускающий контроль качества: НЕРФАРМА С.Р.Л., Виале Пастер, 10 (Нервиано), 20014 Милан, Италия.
Или в случае упаковки препарата Р-Фарм Джермани ГмбХ, Германия:
Производитель
Производство готовой лекарственной формы и фасовка (первичная упаковка). НЕРФАРМА С.Р.Л., Виале Пастер, 10 (Нервиано), 20014 Милан, Италия.
Вторичная (потребительская упаковка) и выпускающий контроль качества. Р-Фарм Джермани ГмбХ, Хайнрих-Мак-Штрассе, 35, г. Иллертиссен, 89257, Германия.
Владелец регистрационного удостоверения. ООО «Мерк». Юридический адрес. Россия, 115054, Москва, ул. Валовая, 35,
Организация, принимающая претензии потребителей. ООО «Мерк». 115054, Москва, ул. Валовая, 35.
Тел.: (495) 937-33-04; факс: (495) 937-33-05.
e-mail: safety@merck.ru
Условия отпуска из аптек
По рецепту.
RUS-CIS/MAV/0620/0026.
Условия хранения
При температуре не выше 25 °C, в оригинальной упаковке (пачка картонная).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Действующим веществом препарата КЛАДРИБИН является кладрибин. КЛАДРИБИН относится к противоопухолевым препаратам и применяется для лечения следующих видов рака:
• рак крови, вызванный чрезмерным увеличением количества белых клеток крови – лейкоцитов. Это заболевание называется волосатоклеточным лейкозом;
• рак крови, вызванный чрезмерным увеличением количества определенного вида белых клеток крови, которые называются лимфоцитами. Это заболевание называется В-клеточный хронический лимфолейкоз. При этом заболевании кладрибин применяют в том случае, если лечение другими препаратами оказалось неэффективным.
• у Вас аллергия на кладрибин или любой другой компонент препарата, указанный в разделе Состав.
Перед применением препарата КЛАДРИБИН проконсультируйтесь с лечащим врачом, если:
• у Вас какая-либо инфекция;
• у Вас когда-либо были проблемы с почками или печенью;
• у Вас когда-либо были заболевания крови или костного мозга.
Если Вы не уверены, относится ли к Вам что-либо из вышеперечисленного, сообщите лечащему врачу перед применением препарата КЛАДРИБИН.
В этих случаях лечащий врач определит, можно ли Вам вводить КЛАДРИБИН.
Немедленно обратитесь к врачу, если во время или после лечения КЛАДРИБИНОМ у Вас возникнут двоение в глазах, нечеткость или утрата зрения, затруднение речи, слабость в руке или ноге, изменение походки или нарушение равновесия, постоянное онемение, снижение или утрата чувствительности, утрата памяти или спутанность сознания – эти симптомы могут быть признаками угрожающего жизни поражения мозга (прогрессирующей мультифокальной лейкоэнцефалопатии).
Если какие-либо из этих симптомов были у Вас до начала лечения КЛАДРИБИНОМ, сообщите врачу о любых изменениях.
Анализ крови
Вам понадобится регулярно сдавать анализ крови до лечения кладрибином и во время него. Анализ крови позволит проверить состояние ваших печени и почек, а также оценить эффективность лечения.
Если Вам понадобится сдать анализ крови в другом учреждении, сообщите врачу о лечении кладрибином. Применение кладрибина может повлиять на результат анализа крови.
Сведения о вспомогательных веществах
Данный препарат содержит менее 1 ммоль (23 мг) натрия на флакон, то есть практически не содержит натрия.
Данный препарат содержит менее 1 ммоль (39 мг) калия на флакон, то есть практически не содержит калия.
Проконсультируйтесь с лечащим врачом, если Вы принимаете, недавно принимали или можете начать принимать любые другие препараты. Это относится и к любым препаратам, отпускаемым без рецепта врача.
Сообщите врачу, если Вы принимаете:
• препараты, которые нарушают образование клеток крови в костном мозге;
• прививки с использованием живых вакцин;
• другие препараты для лечения рака, такие как флударабин, пентостатин (деоксикоформицин), циклофосфамид;
• препараты для лечения вирусных инфекций, в том числе ВИЧ, такие как диданозин, тенофовир, адефовир;
• гормональные препараты (кортикостероиды).
Если Вы не уверены, относится ли к Вам что-либо из вышеперечисленного, сообщите лечащему врачу перед применением препарата КЛАДРИБИН.
Если Вы беременны, думаете, что можете быть беременны, или планируете беременность, не применяйте кладрибин. Кладрибин может навредить ребенку.
И мужчинам, и женщинам необходимо использовать эффективные методы контрацепции во время лечения кладрибином и в течение 6 месяцев после его завершения.
Откажитесь от грудного вскармливания на время терапии кладрибином и в течение 6 месяцев после ее окончания.
Откажитесь от вождения и работы с механизмами до консультации с врачом. Ваше заболевание и проводимое лечение могут повлиять на способность управлять транспортными средствами и работать с механизмами.
Доза препарата зависит от Вашего диагноза и веса. Лечащий врач определит необходимую Вам дозу препарата.
Взрослые и пожилые люди
• Волосатоклеточный лейкоз – обычная доза составляет 0,09 мг на 1 кг массы тела в сутки. Препарат вводят в течение 24 часов 7 дней подряд без перерыва.
• В-клеточный хронический лимфолейкоз – обычная доза составляет 0,12 мг на 1 кг массы тела в сутки. Препарат вводят в течение 2 часов на протяжении 5 дней. Курс лечения повторяют каждые 28 дней. Максимально проводят 6 курсов терапии.
Дети
Безопасность и эффективность применения кладрибина у детей не изучена, поэтому применение препарата в данной группе пациентов противопоказано.
Способ применения
КЛАДРИБИН вводят путем внутривенной инфузии («капельницы»). Перед применением препарат разводят физиологическим раствором.
Если Вам ввели препарата КЛАДРИБИН больше, чем следовало
Дозу препарата контролирует лечащий врач. Тем не менее, если Вам кажется, что Вам ввели слишком высокую дозу препарата КЛАДРИБИН, немедленно сообщите врачу или медсестре.
При наличии вопросов по применению препарата обратитесь к лечащему врачу.
Подобно всем лекарственным препаратам, КЛАДРИБИН может вызывать нежелательные реакции, однако они возникают не у всех.
Немедленно обратитесь к врачу, если Вы чувствуете любую из приведенных ниже нежелательных реакций –
Вам может понадобиться неотложная медицинская помощь:
• сыпь, зуд, крапивница, отек лица или губ, затруднение дыхания могут быть признаками аллергической реакции (могут проявляться менее чем у 1 из 10 человек);
• лихорадка и озноб могут быть первыми признаками инфекции (могут проявляться более чем у 1 из 10 человек). Инфекция может возникнуть из-за снижения количества нейтрофилов в крови. В число возможных проявлений инфекции входят:
— кашель, одышка, затруднение дыхания, хрипы, воспаление легких;
— боль или дискомфорт при мочеиспускании;
— чувствительность, покраснение и повышение температуры кожи;
— грибковая инфекция ротовой полости («молочница»);
— инфекция и воспаление кишечника;
— заражение крови;
• повышенная кровоточивость и появление синяков, красных или фиолетовых пятнышек под кожей могут быть признаками нарушения свертываемости крови (могут проявляться менее чем у 1 из 10 человек);
• слабость или одышка могут быть вызваны снижением уровня гемоглобина в крови (анемией) (могут проявляться менее чем у 1 из 10 человек);
• отеки (могут проявляться менее чем у 1 из 10 человек);
• воспаление вены или образование тромба (менее чем у 1 из 10 человек);
• сыпь с волдырями и шелушением кожи, особенно вокруг рта, носа, глаз и наружных половых органов (синдром Стивенса-Джонсона) (могут проявляться менее чем у 1 из 100 человек);
• разрушение опухолевых клеток (синдром лизиса опухоли) может вызывать проблемы с сердцем и почками, слабость и судороги (могут проявляться менее чем у 1 из 100 человек).
Сообщите врачу во время следующего визита, если у Вас возникнут любые из следующих реакций:
Очень часто (могут проявляться более чем у 1 из 10 человек):
• головная боль, тошнота;
• сыпь, покраснение, отек или боль в месте введения препарата.
Часто (могут проявляться менее чем у 1 из 10 человек):
• учащенное сердцебиение, нарушение притока крови к сердцу;
• боль в животе или повышенное газообразование, запор или диарея, рвота;
• боль или слабость в мышцах либо суставах, боль;
• беспокойство или бессонница, спутанность сознания;
• зуд, конъюнктивит;
• недомогание, головокружение, повышенная утомляемость, снижение аппетита, раздражение;
• нарушение работы почек;
• подавление иммунитета;
• повышенная потливость;
• развитие других злокачественных опухолей в будущем.
Нечасто (могут проявляться менее чем у 1 из 100 человек):
• нарушение образования различных типов клеток крови;
• увеличение количества эозинофилов в крови;
• серьезное поражение нервов, которое может приводить к полному или частичному параличу;
• снижение настроения;
• повышение уровня билирубина в крови и активности печеночных ферментов;
• инфекция, вызываемая вирусом герпеса.
Редко (могут проявляться менее чем у 1 из 1000 человек):
• нарушение работы сердца;
• нарушение сердечного ритма.
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше.
Вы также можете сообщить о нежелательных реакциях в информационную базу данных по нежелательным реакциям (действиям) на лекарственные препараты, включая сообщения о неэффективности лекарственных препаратов, выявленным на территории государства (УП «Центр экспертиз и испытаний в здравоохранении», rceth.by). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Хранить в оригинальной упаковке при температуре от 2 °C до 8 °C.
Хранить в недоступном и невидимом для детей месте.
Срок годности – 5 лет.
Не применять по истечении срока годности.
Один флакон 10 мл содержит действующее вещество:
кладрибин – 10,0 мг.
Один флакон 5 мл содержит действующее вещество:
кладрибин – 5,0 мг.
1 мл раствора содержит 1 мг кладрибина.
Вспомогательные вещества: калия дигидрофосфат, натрия хлорид, натрия гидроксида 1 М раствор, вода для инъекций.
КЛАДРИБИН, раствор для внутривенного введения 1мг/мл – прозрачный бесцветный раствор.
По 5 мл или 10 мл во флаконы. Флакон по 10 мл вместе с листком-вкладышем помещают в пачку из картона. Флакон или 5 флаконов по 5 мл вместе с листком-вкладышем помещают в пачку из картона.
Для поставки в стационары: 40 флаконов по 10 мл или 60 флаконов по 5 мл вместе с листком-вкладышем помещают в групповые коробки.
По рецепту.
Держатель регистрационного удостоверения и производитель:
РУП «Белмедпрепараты»,
Республика Беларусь, 220007, г. Минск,
ул. Фабрициуса, 30, тел./факс:(+375 17) 220 37 16,
e-mail: medic@belmedpreparaty.com
| Кладрибин | |
|---|---|
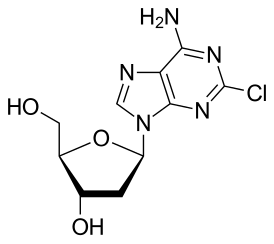 |
|
| Общие | |
| Хим. формула | C10H12ClN5O3 |
| Классификация | |
| Рег. номер CAS | 4291-63-8 |
| PubChem | 20279 |
| Рег. номер EINECS | 636-978-6 |
| SMILES |
C1C(C(OC1N2C=NC3=C2N=C(N=C3N)Cl)CO)O |
| InChI |
InChI=1S/C10H12ClN5O3/c11-10-14-8(12)7-9(15-10)16(3-13-7)6-1-4(18)5(2-17)19-6/h3-6,17-18H,1-2H2,(H2,12,14,15)/t4-,5+,6+/m0/s1 PTOAARAWEBMLNO-KVQBGUIXSA-N |
| ChEBI | 567361 |
| ChemSpider | 19105 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Кладрибин — цитостатический противоопухолевый химиотерапевтический препарат из группы антагонистов пуринов, аналог 2′-дезоксиаденозина, входящего в состав молекулы ДНК. Кладрибин проявляет цитотоксические эффекты (за счет активного метаболита 5′-трифосфата-2-хлор-2′-дезоксиаденозина) в отношении делящихся и неделящихся клеток, ингибируя синтез и репарацию ДНК (ингибирует рибонуклеотидредуктазу, катализирующую реакции образования дезоксинуклеозидтрифосфатов, ДНК-полимеразу и активирует специфическую эндонуклеазу, что приводит к одноцепочечным разрывам ДНК), что в конечном итоге приводит к гибели клетки. Лимфоидные клетки более чувствительны к препарату (так как обладают в них более высокая активность дезоксицитидинкиназы и низкая активность 5′-нуклеотидазы), чем нелимфоидные.
Фармакокинетика[править | править код]
В СМЖ проникает 25 % препарата. Подвергается внутриклеточному метаболизму. На начальном этапе фосфорилирование до 5′-монофосфата осуществляет дезоксицитидинкиназа. Поскольку активность дезоксицитидинкиназы выше такового для 5′-нуклеотидазы, а также вследствие устойчивости препарата к действию аденозиндезаминазы, в клетке быстро накапливаются все три фосфорилированные формы 2-хлор-2′-дезоксиаденозина. При в/в введении T1/2 — 5,7—19,7 ч. Выводится преимущественно почками (35 %), незначительное количество (1 %) кишечником.
Показания[править | править код]
Рассеянный склероз, волосатоклеточный лейкоз.
Противопоказания[править | править код]
Гиперчувствительность, умеренная или тяжелая ХПН (КК менее 50 мл/мин), умеренная или тяжелая печеночная недостаточность (4 и более по шкале Чайлд-Пьюга), одновременное применение миелосупрессивных ЛС, детский возраст (до 16 лет), беременность, период лактации.
С осторожностью[править | править код]
Угнетение функции костного мозга, инфекции.
Дозирование[править | править код]
В/в капельно, в виде 2-х- или 24-хчасовых инфузий. Дозу и продолжительность лечения устанавливают в зависимости от особенностей течения заболевания и тяжести состояния. Рекомендуемая доза — 0,09—0,1 мг/кг/сут в течение 7 дней. Данные об увеличении противоопухолевого эффекта при проведении дополнительных курсов отсутствуют.
Перед введением необходимое количество концентрата разводят в 0,5—1 л 0,9 % раствора NaCl, для 24-х инфузий используют бактериостатический 0,9 % раствор NaCl (содержит в качестве консерванта бензиловый спирт).
Побочное действие[править | править код]
Со стороны органов кроветворения[править | править код]
Лейкопения, нейтропения, тромбоцитопения, анемия, панцитопения, апластическая и гемолитическая анемии; очень редко — миелодиспластический синдром.
Со стороны пищеварительной системы[править | править код]
Тошнота, рвота, анорексия, диарея, запор, гастралгия, повышение билирубина и/или трансаминаз.
Со стороны нервной системы[править | править код]
Головная боль, головокружение, бессонница, периферические сенсорные нейропатии.
Со стороны сердечно-сосудистой системы[править | править код]
Тахикардия, отеки.
Со стороны дыхательной системы[править | править код]
Кашель, учащенное дыхание, интерстициальный пневмонит, изменение перкуторного звука и аускультативных характеристик дыхания.
Со стороны кожных покровов[править | править код]
Сыпь, шелушение кожи, кожный зуд, крапивница.
Местные реакции[править | править код]
Эритема, боль, отечность, тромбоз, флебит.
Прочие[править | править код]
Гипертермия, слабость, астения, повышенная утомляемость, боль различной локализации, пурпура, петехии, носовые кровотечения, снижение иммунитета; предрасположенность к оппортунистическим инфекциям, инфекциям, вызванным Herpes simplex, Herpes zoster, цитомегаловирусом.
Передозировка[править | править код]
Симптомы[править | править код]
Необратимая нейротоксичность (парез/тетрапарез), острая нефротоксичность, выраженное угнетение костномозгового кроветворения (нейтропения, анемия, тромбоцитопения).
Лечение[править | править код]
Симптоматическое, антидот неизвестен.
Взаимодействие[править | править код]
При назначении одновременно или непосредственно после др. миелотоксичных препаратов возможно аддитивное угнетение функции костного мозга.
При назначении в высоких дозах в сочетании с циклофосфамидом и лучевой терапией возрастает нейротоксичность (необратимые пара- и тетрапарезы) и нефротоксичность (острая почечная недостаточность).
Аллопуринол и антибиотики усиливают кожную сыпь.
При смешивании с 5 % раствором декстрозы — усиление деградации кладрибина.
Особые указания[править | править код]
Лечение препаратом должно осуществляться под контролем врача, имеющего опыт применения противоопухолевой терапии. Миелосупрессия, вызываемая препаратом, дозозависима и обычно обратима, проявляется в течение месяца с момента лечения. Во время лечения и как минимум в течение 4—8 нед., после необходим тщательный контроль гематологических показателей крови.
Особую осторожность следует соблюдать пациентам с исходным угнетением функции костного мозга любого происхождения из-за риска проявления пролонгированной гипоплазии.
В некоторых случаях лечение может привести к тяжелым формам иммуносупрессии с уменьшением числа CD4±лейкоцитов. При возникновении гипертермии на фоне нейтропении необходим контроль общего состояния пациента в течение первого месяца лечения и в случае необходимости назначения антибактериальной терапии.
В случае развития нейротоксичности лечение препаратом должно быть приостановлено до разрешения неврологической симптоматики.
Лечение пациентов с почечной и/или печеночной недостаточностью следует проводить под непосредственным контролем функции почек и печени. Лечение должно быть прекращено в случае развития нефро- или гепатотоксичности.
Необходимо тщательное наблюдение за пожилыми пациентами (в связи с отсутствием данных по фармакокинетике).

