Ксофиго — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-004060
Торговое наименование препарата:
Ксофиго®
Международное непатентованное наименование:
Радия хлорид [223Ra]
Лекарственная форма:
раствор для внутривенного введения
Состав:
1 мл раствора для внутривенного введения содержит:
активное вещество: радия хлорид [223Ra], в пересчете на радий-223 (в референтную дату) 1100 кБк (0,58 нг).
вспомогательные вещества: натрия хлорид 6,3 мг, натрия цитрат 7,2 мг*, хлористоводородная кислота 0,2 мг, вода для инъекций до 1,0 мл.
Содержание радия хлорида [223Ra] указано в пересчете на радий-223 в референтную дату**.
* указано количество натрия цитрата безводного; в процессе производства используется натрия цитрата дигидрат;
** референтная дата — дата, установленная как «12.00 часов по центральноевропейскому времени через 14 дней после даты производства лекарственного препарата» и соответствующая дате калибровки.
Описание:
Бесцветный прозрачный раствор.
Фармакотерапевтическая группа:
Радиофармацевтическое терапевтическое средство.
Код АТХ:
V10XX03
Фармакологические свойства
Физико-химические свойства
1 мл раствора содержит 1100 кБк радия хлорида [223Ra], что соответствует 0,58 нг радия-223 в референтную дату. Радий содержится в растворе в виде свободного иона.
В каждом флаконе содержится 6 мл раствора (6600 кБк радия хлорида [223Ra] в референтную дату).
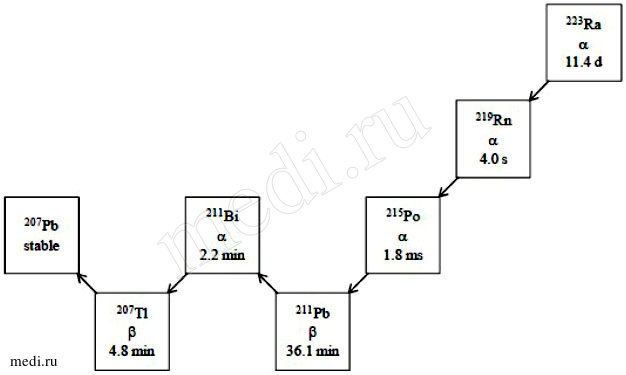
Радия хлорид [223Ra] испускает альфа-частицы и имеет период полураспада 11,4 дней. Удельная активность радия-223 1,9 МБк/нг.
Радиоактивный распад радия-223 до свинца-207 состоит из шести звеньев цепочки короткоживущих дочерних изотопов и сопровождается испусканием альфа-, бета- и гамма-частиц c разной вероятностью эмиссии и величиной энергии распада. Величина энергии альфа-излучения составляет 95,3 % (диапазон энергии 5,0 — 7,5 МэВ), величина энергии бета-излучения — 3,6 % (среднее значение энергии 0,445 МэВ и 0,492 МэВ), величина энергии гамма-излучения — 1,1 % (диапазон энергии 0,01 — 1,27 МэВ).
Рисунок 1. Цепочка радиоактивного распада радия-223 (с характером распада и параметрами периодов полураспада).
Фармакодинамика
Механизм действия
Ксофиго® является препаратом, терапевтическое действие которого обусловлено эмиссией α-частиц.
Действующее вещество препарата Ксофиго®, изотоп радия (радия хлорид [223Ra]), имитирует кальций и образует комплексное соединение с минералом костной ткани гидроксиапатитом. Благодаря этому изотоп радия избирательно воздействует на костную ткань, в частности на костные метастатические очаги рака предстательной железы.
Высокое линейное значение энергии переноса α-частиц (80 кэВ/мкм) приводит к высокой частоте разрыва двухцепочечной молекулы ДНК и вызывает сильный цитотоксический эффект. На моделях in vivo было показано дополнительное воздействие препарата на микроокружение опухоли, включая остеокласты и остеобласты, что способствовало его дополнительной эффективности. Диапазон действия α-частиц радия хлорида [223Ra] менее 100 мкм (менее десяти диаметров клетки), что минимизирует повреждение здоровых окружающих тканей.
Фармакокинетика
Всасывание
При внутривенном введении препарата Ксофиго® его биодоступность составляет 100%.
Распределение и накопление в органах
После внутривенного введения изотоп радия (радий-223) быстро выводится из системного кровотока и накапливается, в первую очередь, в костях и костных метастазах или выделяется непосредственно в кишечник.
Около 20% введенной дозы препарата оставалось в системном кровотоке через 15 минут после введения. Около 4% введенной дозы препарата оставалось в системном кровотоке через 4 часа после введения, снижаясь до менее 1% через 24 часа. Объем распределения превышал объем циркулирующей крови, что свидетельствует о распределении в периферических полостях.
Радиофармацевтическая активность отмечалась в костях и кишечнике через 10 минут после введения. Уровень активности в костях был 44-77% через 4 часа после введения. Не отмечалось значительного накопления изотопа радия в таких органах, как сердце, печень, почки, мочевой пузырь и селезенка через 4 часа после инъекции.
Биотрансформация
Изотоп радия (радий-223) подвергается радиоактивному распаду и не метаболизируется.
Выведение
Изотоп радия в основном выводится из организма через кишечник. Около 5% выводится почками. Данные о гепатобилиарной экскреции отсутствуют.
Результаты измерения радиоактивности всего тела через 7 дней после введения препарата (с учетом фактора распада) показывают, что 76% введенной дозы выводятся из организма. На скорость выведения радия-223 из желудочно-кишечного тракта влияет высокая вариабельность скорости прохождения содержимого через кишечник в популяции. Нормальный диапазон частоты опорожнения кишечника составляет от 1 раза в день до 1 раза в неделю.
Линейность/нелинейность
В исследованном диапазоне активности (51-276 кБк/кг) фармакокинетические показатели радия хлорида [223Ra] были линейными.
Дети
Безопасность и эффективность препарата Ксофиго® не изучались у детей и подростков до 18 лет.
Показания к применению
Кастрационно-резистентный рак предстательной железы с костными метастазами и отсутствием висцеральных метастазов.
Противопоказания
Детский возраст до 18 лет (информация об эффективности и безопасности применения препарата Ксофиго® у детей отсутствует).
С осторожностью
- у пациентов со снижением функции костного мозга;
- у пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей;
- у пациентов с риском возникновения компрессии спинного мозга или с состоявшейся компрессией спинного мозга.
- у пациентов с переломами костей;
- у пациентов с болезнью Крона и язвенным колитом;
- у пациентов с нарушением функции печени;
- у пациентов с нарушением функции почек тяжелой степени тяжести (КК <30 мл/мин).
Применение при беременности и в период грудного вскармливания
Препарат Ксофиго® не применяется у женщин.
Способ применения и дозы
Для внутривенного введения.
Препарат Ксофиго® должен назначаться только врачом, имеющим опыт применения радиофармацевтических препаратов. Перед назначением препарата пациент должен пройти обследование. Применение препарата может осуществляться только в специализированных лечебных учреждениях персоналом, имеющим разрешение на обращение с радиофармацевтическими препаратами.
Активная доза препарата Ксофиго® составляет 55 кБк/кг. Назначается 6 инъекций препарата с интервалами в 4 недели.
Безопасность и эффективность препарата Ксофиго® при получении пациентом более 6-ти инъекций не изучались.
Способ введения
Препарат Ксофиго® предназначен для внутривенного введения. Препарат следует вводить медленно (как правило, до 1 минуты).
Иглу от инфузионной системы или катетер до и после введения препарата следует промыть изотоническим раствором натрия хлорида 0,9%.
Подготовка к введению радиофармацевтического препарата
Перед применением следует внимательно осмотреть раствор. Препарат Ксофиго® представляет собой прозрачный бесцветный раствор. При изменении цвета, обнаружении видимых частиц или дефекта упаковки препарат применять нельзя.
Препарат Ксофиго® представляет собой раствор, готовый к применению. Не следует разводить или смешивать препарат Ксофиго® с другими растворами.
Флакон с препаратом предназначен только для однократного использования.
При расчете объема, предназначенного для введения пациенту, необходимо учитывать:
- массу тела пациента, кг;
- уровень активной дозы (55 кБк/кг);
- активную концентрацию препарата на референтную дату (1100 кБк/мл); референтная дата указывается на этикетке флакона и свинцового контейнера;
- коэффициент радиоактивного распада радия-223. Таблица со значениями коэффициента радиоактивного распада находится в каждой упаковке препарата.
Следует подтвердить уровень радиоактивности препарата в каждом флаконе с помощью радиометрического дозиметра.
Суммарный объем вводимого раствора для каждого пациента рассчитывается по формуле:
| Объем вводимого препарата = | масса тела пациента (кг) х активная доза (55 кБк/кг)
коэффициент радиоактивного распада х 1100 кБк/мл |
Дозиметрия
Расчет лучевой нагрузки основывается на клинических данных по биораспределению препарата Ксофиго®. Расчет проводился при помощи оценки экспоненциального моделирования дозы внутреннего облучения в органах (OLINDA/EXM), программного обеспечения, основанного на алгоритме терапевтической дозы внутреннего облучения (ТДВО), широко используемого для имплантированных бета- и гамма-активных радионуклидов. Изотоп радия-223 испускает преимущественно α -частицы. Были сделаны дополнительные допущения для оптимального расчета лучевой нагрузки препарата Ксофиго® для кишечника, красного костного мозга и костной ткани/остеогенных клеток с учетом биораспределения и характерных особенностей препарата.
Таблица 3. Лучевая нагрузка
| Орган-мишень | Альфа-излучение1 (Гр/МБк) |
Бета-излучение (Гр/МБк) |
Гамма-излучение (Гр/МБк) |
Суммарная доза (Гр/МБк) |
Коэффициент отклонения (%) |
| Надпочечники | 0,00000 | 0,00002 | 0,00009 | 0,00012 | 56 |
| Головной мозг | 0,00000 | 0,00002 | 0,00008 | 0,00010 | 80 |
| Молочная железа | 0,00000 | 0,00002 | 0,00003 | 0,00005 | 120 |
| Стенка желчного пузыря | 0,00000 | 0,00002 | 0,00021 | 0,00023 | 14 |
| Стенка нижнего отдела толстой кишки | 0,00000 | 0,04560 | 0,00085 | 0,04645 | 83 |
| Стенка тонкой кишки | 0,00319 | 0,00360 | 0,00047 | 0,00726 | 45 |
| Стенка желудка | 0,00000 | 0,00002 | 0,00012 | 0,00014 | 22 |
| Стенка верхнего отдела толстой кишки | 0,00000 | 0,03150 | 0,00082 | 0,03232 | 50 |
| Стенка сердца | 0,00161 | 0,00007 | 0,00005 | 0,00173 | 42 |
| Почки | 0,00299 | 0,00011 | 0,00011 | 0,00320 | 36 |
| Печень | 0,00279 | 0,00010 | 0,00008 | 0,00298 | 36 |
| Легкие | 0,00000 | 0,00002 | 0,00005 | 0,00007 | 90 |
| Мышца | 0,00000 | 0,00002 | 0,00010 | 0,00012 | 41 |
| Яичники | 0,00000 | 0,00002 | 0,00046 | 0,00049 | 40 |
| Поджелудочная железа | 0,00000 | 0,00002 | 0,00009 | 0,00011 | 43 |
| Красный костный мозг | 0,13200 | 0,00642 | 0,00020 | 0,13879 | 41 |
| Остеогенные клетки | 1,14000 | 0,01490 | 0,00030 | 1,15206 | 41 |
| Кожа | 0,00000 | 0,00002 | 0,00005 | 0,00007 | 79 |
| Селезенка | 0,00000 | 0,00002 | 0,00007 | 0,00009 | 54 |
| Яички | 0,00000 | 0,00002 | 0,00006 | 0,00008 | 59 |
| Тимус | 0,00000 | 0,00002 | 0,00003 | 0,00006 | 109 |
| Щитовидная железа | 0,00000 | 0,00002 | 0,00005 | 0,00007 | 96 |
| Стенка мочевого пузыря | 0,00371 | 0,00016 | 0,00016 | 0,00403 | 63 |
| Матка | 0,00000 | 0,00002 | 0,00023 | 0,00026 | 28 |
| Все тело | 0,02220 | 0,00081 | 0,00012 | 0,02311 | 16 |
1Поскольку изотоп радия-223 не накапливается в большинстве мягких тканей, вклад альфа-излучения в суммарную дозу облучения для данных органов был установлен как 0.
В клинических исследованиях препарата Ксофиго® частота и тяжесть гематологических нежелательных реакций были значительно ниже, чем можно было бы ожидать, основываясь на лучевой нагрузке для красного костного мозга. Это может быть связано с пространственным распределением α-частиц, что приводит к неравномерному распределению дозы ионизирующего излучения в красном костном мозге.
Особые группы пациентов
Пациенты с нарушением функции печени
Безопасность и эффективность препарата Ксофиго® не изучались у пациентов с нарушением функции печени.
Поскольку изотоп радия-223 не подвергается метаболизму в печени и не выводится с желчью, предполагается, что нарушение функции печени не влияет на фармакокинетические показатели радия хлорида [223Ra]. Пациентам с нарушением функции печени коррекция дозы не требуется.
Пациенты с нарушением функции почек
В клиническом исследовании III фазы не наблюдалось значимых различий безопасности или эффективности препарата Ксофиго® у пациентов с нарушением функции почек легкой степени тяжести (КК 50-80 мл/мин) в сравнении с пациентами с нормальной функцией почек. Имеются ограниченные данные для пациентов с нарушением функции почек средней степени тяжести (КК 30-50 мл/мин). Нет данных для пациентов с тяжелой (КК<30 мл/мин) или терминальной степенью нарушения функции почек. Однако, поскольку экскреция радия-223 хлорида через почки является минимальной, и его выведение осуществляется, главным образом, через кишечник, предполагается, что нарушение функции почек не влияет на фармакокинетические показатели радия-223 хлорида. Пациентам с нарушением функции почек коррекции дозы не требуется.
Пациенты пожилого возраста
В целом в клинических исследованиях не отмечалось значимых различий безопасности и эффективности препарата Ксофиго® у пожилых (65 лет и старше) пациентов в сравнении с более молодыми пациентами. Пациентам пожилого возраста коррекция дозы не требуется.
Дети
Безопасность и эффективность препарата Ксофиго® не изучались у детей и подростков до 18 лет. Опыт применения препарата у детей с раком предстательной железы отсутствует.
Побочное действие
Общий профиль безопасности препарата Ксофиго® основывается на данных клинических исследований с участием 600 пациентов, получавших терапию в клинических исследованиях III фазы.
В клинических исследованиях наиболее частыми нежелательными реакциями (>10% пациентов) были диарея, тошнота, рвота и тромбоцитопения.
Наиболее серьезными нежелательными реакциями при применении препарата Ксофиго® были тромбоцитопения и нейтропения (см. раздел «Особые указания»).
Перечисленные ниже нежелательные реакции, отмеченные при применении препарата Ксофиго® в ходе клинических исследований, представлены в соответствии с поражением органов и систем, и распределены по частоте возникновения в соответствии со следующей градацией: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1000 до <1/100). Для классификации и описания конкретной реакции, ее синонимов и связанных с ней состояний, используется наиболее подходящий термин из Медицинского словаря для регуляторной деятельности (MedDRA).
В каждой частотной группе нежелательные явления представлены в порядке уменьшения их значимости.
Таблица 4. Неблагоприятные реакции, наблюдавшиеся в ходе клинических исследований препарата Ксофиго®
| Системно-органный класс (MedDRA) | Очень часто | Часто | Нечасто |
| Нарушения со стороны крови и лимфатической системы | Тромбоцитопения | Нейтропения, панцитопения, лейкопения | Лимфопения |
| Нарушения со стороны желудочно-кишечного тракта | Диарея, рвота, тошнота | ||
| Общие расстройства и нарушения в месте введения | Реакции в месте введения |
Описание отдельных нежелательных реакций
Тромбоцитопения и нейтропения
Тромбоцитопения (все степени) наблюдалась у 11,5 % пациентов, получавших терапию препаратом Ксофиго® и у 5,6% пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 6,3% пациентов, получавших препарат Ксофиго® и у 2% пациентов, получавших плацебо (см. раздел «Особые указания»). В целом, частота случаев тромбоцитопении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (2,8 % у пациентов, принимавших препарат Ксофиго®, в сравнении с 0,8 % у пациентов, принимавших плацебо) в сравнении с пациентами, которые ранее получали доцетаксел (8,9% у пациентов, принимавших препарат Ксофиго®, в сравнении с 2,9% у пациентов, принимавших плацебо).
У пациентов с распространенной диффузной инфильтрацией костей сообщалось о случаях тромбоцитопении (все степени) у 19,6% пациентов, получавших терапию препаратом Ксофиго®, и у 6,7% пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 5,9% пациентов, получавших препарат Ксофиго®, и у 6,7% пациентов, получавших плацебо (см. раздел «Особые указания»).
Сообщалось о случаях нейтропении (все степени) у 5% пациентов, получавших терапию препаратом Ксофиго®, и у 1% пациентов, получавших плацебо. Нейтропения 3-й и 4-й степени наблюдалась у 2,2% пациентов, получавших препарат Ксофиго®, и у 0,7% пациентов, получавших плацебо. В целом частота случаев нейтропении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (0,8% у пациентов, принимавших препарат Ксофиго®, и 0,8% у пациентов, принимавших плацебо) в сравнении с пациентами, которые ранее получали доцетаксел (3,2% у пациентов, принимавших препарат Ксофиго®, и 0,6% у пациентов, принимавших плацебо).
В клиническом исследовании I фазы максимальное снижение количества нейтрофилов и тромбоцитов возникало через 2-3 недели после однократного внутривенного введения препарата Ксофиго®.
Реакции в месте введения
Сообщалось о реакциях в месте введения 1-й и 2-й степени, которые включали эритему, боль и отек, у 1,2% пациентов, получавших препарат Ксофиго®, и у 0 % пациентов, получавших плацебо.
Вторичные злокачественные опухоли
Терапия препаратом Ксофиго® приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях препарата Ксофиго® не сообщалось о вторичных онкологических заболеваниях на фоне терапии препаратом при последующем наблюдении до трех лет.
Передозировка
Симптомы
Не сообщалось о случаях непреднамеренной передозировки препарата Ксофиго® в клинических исследованиях.
Лечение
Специфический антидот отсутствует.
В случае непреднамеренной передозировки препарата Ксофиго® следует принять стандартные поддерживающие меры, включая контроль токсического действия на систему крови и желудочно-кишечный тракт.
В клиническом исследовании I фазы оценивалась разовая активная доза препарата Ксофиго®, которая составляла 276 кБк/кг. Ограничивающая дозу токсичность не наблюдалась.
Взаимодействие с другими лекарственными препаратами и другие формы взаимодействия
Клинические исследования взаимодействия препарата Ксофиго® с другими препаратами не проводились.
Существует вероятность взаимодействия препарата Ксофиго® с кальцием и фосфатами. Следует прекратить прием препаратов, содержащих данные вещества и/или витамин D за несколько дней до начала терапии препаратом Ксофиго®.
Сочетанное проведение химиотерапии и терапии препаратом Ксофиго® может оказывать аддитивное действие на подавление функции костного мозга (см. раздел «Особые указания»). Безопасность и эффективность сочетанной химиотерапии и терапии препаратом Ксофиго® не установлены.
Особые указания
Подавление функции костного мозга
Сообщалось о случаях подавления функции костного мозга (тромбоцитопения, нейтропения, лейкопения, панцитопения) у пациентов, получавших терапию препаратом Ксофиго® (см. раздел «Побочное действие«).
Следует проводить общий анализ крови у пациентов перед каждой инъекцией препарата Ксофиго®. Перед первым введением препарата абсолютное число нейтрофилов (АЧН) должно быть >1,5 х 109/л, количество тромбоцитов >100 х 109/л и гемоглобин >10,0 г/дл. Перед последующими введениями препарата АЧН должно быть >1,0 х 109/л, количество тромбоцитов >50 х 109/л. Если, несмотря на проведение поддерживающей терапии, данные показатели не нормализуются в течение 6-ти недель после последнего введения препарата Ксофиго®, дальнейшую терапию следует продолжать только после тщательной оценки соотношения пользы и риска.
В клинических исследованиях III фазы наблюдалось повышение частоты нежелательных реакций со стороны крови (нейтропения и тромбоцитопения) у пациентов со снижением функции костного мозга (например, после предшествующей цитотоксической химиотерапии и/или наружной дистанционной лучевой терапии (НДЛТ)), или у пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей по данным радиоизотопного исследования (см. раздел «Побочное действие»). При лечении таких пациентов следует соблюдать осторожность.
Эффективность и безопасность цитотоксической химиотерапии, проводившейся после терапии препаратом Ксофиго®, не установлены. Имеющиеся ограниченные данные показывают, что пациенты получавшие химиотерапию после терапии препаратом Ксофиго®, имели сопоставимые гематологические показатели, в сравнении с пациентами, получавшими химиотерапию после приема плацебо (см.раздел «Фармакодинамика»).
Болезнь Крона и язвенный колит
Безопасность и эффективность препарата Ксофиго® у пациентов с болезнью Крона и язвенным колитом не изучались. Поскольку препарат Ксофиго® выводится через кишечник, радиоактивное излучение может привести к обострению острого воспалительного заболевания кишечника. Следует внимательно оценивать соотношение пользы и риска при назначении препарата Ксофиго® пациентам с острым воспалительным заболеванием кишечника.
Компрессия спинного мозга
Следует завершить стандартную поддерживающую терапию, проводимую по клиническим показаниям, у пациентов с нелеченой угрожающей или выявленной компрессией спинного мозга до начала или возобновления терапии препаратом Ксофиго®.
Переломы костей
У пациентов с переломами костей ортопедическую стабилизацию переломов следует выполнить до начала или возобновления терапии препаратом Ксофиго®.
Остеонекроз челюсти
У пациентов, получавших терапию бисфосфонатами и препаратом Ксофиго®, не может исключаться повышенный риск остеонекроза челюсти (ОНЧ). В клиническом исследовании III фазы сообщалось о случаях остеонекроза челюсти у 0,67% пациентов (4/600) в группе препарата Ксофиго® в сравнении с 0,33% у пациентов (1/301) в группе, принимавшей плацебо. При этом все пациенты с остеонекрозом челюсти получали предшествующую или сопутствующую терапию бисфосфонатами (например, золедроновая кислота) и предшествующую химиотерапию (например, доцетаксел).
Вторичные злокачественные опухоли
Терапия препаратом Ксофиго® приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях препарата Ксофиго® не сообщалось о вторичных онкологических заболеваниях на фоне терапии препаратом при последующем наблюдении до трех лет.
Информация о некоторых ингредиентах
В зависимости от вводимого объема, разовая доза лекарственного препарата может содержать до 2,35 ммоль (54 мг) натрия. Это следует принимать во внимание при назначении препарата пациентам, соблюдающим диету, контролирующую потребление натрия.
Фертильность
Данные о влиянии препарата Ксофиго® на фертильность человека отсутствуют. Данные исследований на животных показали возможность риска негативного влияния препарата Ксофиго® на фертильность. Мужчинам следует проконсультироваться относительно консервации спермы перед началом терапии.
Контрацепция у мужчин
Не проводилось исследований применения препарата Ксофиго® для оценки его влияния на репродуктивную функцию у животных.
Вследствие возможного влияния на сперматогенез, связанного с радиоактивным воздействием, следует рекомендовать мужчинам применять надежные методы контрацепции во время лечения и в течение 6 месяцев после терапии препаратом Ксофиго®.
Особые указания по обращению с препаратом и его утилизации
Общие указания
Работа с препаратом Ксофиго® должна осуществляться в соответствии с «Нормами радиационной безопасности» (НРБ-99/2009) и «Основными санитарными правилами обеспечения радиационной безопасности» (ОСПОРБ-99/Ю). Радиофармацевтический препарат Ксофиго® могут получать, использовать и назначать только квалифицированные сотрудники, имеющие соответствующую подготовку и разрешение на работу с радиоактивными веществами. Работа с препаратом, его хранение и утилизация должны осуществляться в специализированном лечебном учреждении, имеющем лицензию на право осуществления деятельности в области использования атомной энергии.
Использование препарата Ксофиго® должно отвечать требованиям радиационной безопасности и качества лекарственных препаратов. Применение препарата следует проводить с соблюдением правил асептики.
Радиационная защита
Изотоп радия-223 испускает преимущественно α-частицы, тем не менее, при распаде радия-223 и его дочерних изотопов образуется бета- и гамма-излучение. Благодаря гамма-излучению, использование специальных приборов позволяет измерить радиоактивность препарата Ксофиго® и определить степень радиоактивного загрязнения.
Сотрудникам, работающим с радиофармацевтическими препаратами и подвергающимся риску радиоактивного заражения в результате внешнего облучения или заражения от разлитых отходов жизнедеятельности пациентов (например, моча, кал, рвотные массы и др.) необходимо соблюдать меры радиационной защиты в соответствии с нормативными требованиями. Следует соблюдать осторожность при контакте с материалами (например, постельное белье), использовавшимися пациентами. Поскольку введенная активная доза препарата Ксофиго®, как правило, менее 8 МБк, воздействие внешнего облучения на персонал при контакте с пациентом, получающим терапию препаратом Ксофиго®, существенно ниже в сравнении с другими радиофармацевтическими препаратами, применяющимися с терапевтической целью. Тем не менее, следуя принципам ALARA («достижение результата с минимально возможным воздействием»), для минимизации радиационного воздействия на персонал рекомендуется до минимума сократить время, проводимое в зоне облучения, максимально увеличить расстояние до источника излучения, использовать средства радиационной защиты.
Неиспользованный препарат, упаковку и материалы, используемые при подготовке и введении препарата Ксофиго®, следует утилизировать как радиоактивные отходы в соответствии с нормативными требованиями.
Влияние на способность управлять транспортными средствами, механизмами
Данные о влиянии препарата на способность управлять транспортными средствами и работу с другими механизмами отсутствуют.
Форма выпуска
Раствор для внутривенного введения, 1100 кБк/мл.
По 6 мл раствора препарата (6600 кБк на референтную дату) во флакон из бесцветного стекла I гидролитического класса, вместимостью 10 мл, укупоренный резиновой пробкой серого цвета с обкаткой колпачком алюминиевым.
Флакон снабжен пластиковой крышкой и пластиковым донышком и обернут клейкой прозрачной пленкой. Каждый флакон и два влагопоглощающих диска из целлюлозы (снизу флакона) помещают в свинцовый контейнер, покрытый снаружи серым пластиком.
По 1 свинцовому контейнеру с инструкцией по применению и таблицами со значениями коэффициента радиоактивного распада в картонную коробку типа А для транспортирования радиоактивных веществ.
Условия хранения
Хранение и работа с препаратом должны проводиться в соответствии с «Нормами радиационной безопасности» (НРБ-99/2009) и «Основными санитарными правилами обеспечения радиационной безопасности (ОСПОРБ-99/10)».
Хранить в недоступном для детей месте.
Срок годности
28 сут. с даты производства.
Не использовать по истечении срока годности.
Условия отпуска
Отпуск только для специализированных лечебно-диагностических учреждений.
Не подлежит реализации через аптечную сеть.
Производитель
Производство готовой лекарственной формы
Институт Энергетических Технологий, Институтвейен, 18, N0-2007, г. Хьеллер, Норвегия Institutt for energiteknikk Isoptolaboratoriene, Instituttveien 18, NO-2007 Kjeller, Norway
Первичная упаковка
Институт Энергетических Технологий, Институтвейен, 18, NO-2007, г. Хьеллер, Норвегия Institutt for energiteknikk Isoptolaboratoriene, Instituttveien 18, NO-2007 Kjeller, Norway
Вторичная/третичная упаковка
Институт Энергетических Технологий, Институтвейен, 18, NO-2007, г. Хьеллер, Норвегия Institutt for energiteknikk Isoptolaboratoriene, Instituttveien 18, NO-2007 Kjeller, Norway
Выпускающий контроль качества
Байер АС, Драмменсвейен 288, NO-0283 Осло, Норвегия. Bayer AS, Drammensveien 288, NO-0283 Oslo, Norway.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Байер Фарма АГ, Мюллерштрассе 178, 13353 Берлин, Германия
Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany
За дополнительной информацией и с претензиями обращаться по адресу:
107113 Москва, 3-я Рыбинская ул., д.18, стр.2
Таблицы значений коэффициента радиоактивного распада радия-223 в день N относительно референтной даты.
Таблица 1. Значения коэффициента радиоактивного распада радия-223 для часовых зон с 2-й (MSK- 1; UTC + 2) по 4-ю (MSK + 1; UTC + 4)*.
| День N от референтной даты | Коэффициент радиоактивного распада радия-223 |
| -14 | 2,34 |
| -13 | 2,20 |
| -12 | 2,07 |
| -11 | 1,95 |
| -10 | 1,83 |
| -9 | 1,73 |
| -8 | 1,62 |
| -7 | 1,53 |
| -6 | 1,44 |
| -5 | 1,35 |
| -4 | 1,27 |
| -3 | 1,20 |
| -2 | 1,13 |
| -1 | 1,06 |
| 0 | 1,00 |
| 1 | 0,94 |
| 2 | 0,89 |
| 3 | 0,83 |
| 4 | 0,78 |
| 5 | 0,74 |
| 6 | 0,69 |
| 7 | 0,65 |
| 8 | 0,62 |
| 9 | 0,58 |
| 10 | 0,55 |
| 11 | 0,51 |
| 12 | 0,48 |
| 13 | 0,45 |
| 14 | 0,43 |
Таблица 2. Значения коэффициента радиоактивного распада радия-223 для часовых зон с 5-й (MSK+2; UTC+5) по 7-ю (MSK+4; UTC+7)*.
| Дата введения препарата Ксофиго® относительно референтной даты |
Коэффициент радиоактивного распада радия-223 |
| -14 | 2,36 |
| -13 | 2,22 |
| -12 | 2,09 |
| -11 | 1,97 |
| -10 | 1,85 |
| -9 | 1,75 |
| -8 | 1,64 |
| -7 | 1,55 |
| -6 | 1,46 |
| -5 | 1,37 |
| -4 | 1,29 |
| -3 | 1,21 |
| -2 | 1,14 |
| -1 | 1,07 |
| 0 | 1,01 |
| 1 | 0,95 |
| 2 | 0,90 |
| 3 | 0,84 |
| 4 | 0,79 |
| 5 | 0,75 |
| 6 | 0,70 |
| 7 | 0,66 |
| 8 | 0,62 |
| 9 | 0,59 |
| 10 | 0,55 |
| 11 | 0,52 |
| 12 | 0,49 |
| 13 | 0,46 |
| 14 | 0,43 |
Таблица 3. Значения коэффициента радиоактивного распада радия-223 для часовых зон с 8-й (MSK+5; UTC+8) по 12-ю (MSK+9; UTC+12)*.
| Дата введения препарата Ксофиго® относительно референтной даты |
Коэффициент радиоактивного распада радия-223 |
| -14 | 2,38 |
| -13 | 2,24 |
| -12 | 2,11 |
| -11 | 1,98 |
| -10 | 1,87 |
| -9 | 1,76 |
| -8 | 1,65 |
| -7 | 1,56 |
| -6 | 1,46 |
| -5 | 1,38 |
| -4 | 1,30 |
| -3 | 1,22 |
| -2 | 1,15 |
| -1 | 1,08 |
| 0 | 1,02 |
| 1 | 0,96 |
| 2 | 0,90 |
| 3 | 0,85 |
| 4 | 0,80 |
| 5 | 0,75 |
| 6 | 0,71 |
| 7 | 0,67 |
| 8 | 0,63 |
| 9 | 0,59 |
| 10 | 0,56 |
| 11 | 0,52 |
| 12 | 0,49 |
| 13 | 0,46 |
| 14 | 0,44 |
* MSK — московское время;
** UTC — всемирное координированное время. Центральноевропейское время CET = UTC+1.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Форма выпуска, упаковка и состав
препарата Ксофиго®
Раствор для в/в введения бесцветный, прозрачный.
Содержание радия хлорида [223Ra] указано в пересчете на радий-223 в референтную дату**.
Вспомогательные вещества: натрия хлорид — 6.3 мг, натрия цитрат — 7.2 мг*, хлористоводородная кислота — 0.2 мг, вода д/и — до 1 мл.
6 мл (6600 кБк#) — флаконы бесцветного стекла вместимостью 10 мл (1) в комплекте с 2 дисками влагопоглощающими из целлюлозы — контейнеры свинцовые (1) с таблицами со значениями коэффициента радиоактивного распада — коробки картонные типа А для транспортирования радиоактивных веществ.
* указано количество натрия цитрата безводного; в процессе производства используется натрия цитрата дигидрат;
** референтная дата — дата, установленная как «12.00 часов по центральноевропейскому времени через 14 дней после даты производства лекарственного препарата» и соответствующая дате калибровки.
Фармакологическое действие
Радиофармацевтическое терапевтическое средство. Терапевтическое действие обусловлено эмиссией α-частиц.
Радия хлорид [223 Ra] имитирует кальций и образует комплексное соединение с минералом костной ткани гидроксиапатитом. Благодаря этому изотоп радия избирательно воздействует на костную ткань, в частности на костные метастатические очаги рака предстательной железы. Высокое линейное значение энергии переноса α-частиц (80 кэВ/мкм) приводит к высокой частоте разрыва двухцепочечной молекулы ДНК и вызывает сильный цитотоксический эффект. На моделях in vivo было показано дополнительное воздействие препарата на микроокружение опухоли, включая остеокласты и остеобласты, что способствовало его дополнительной эффективности. Диапазон действия α-частиц радия хлорида [223 Ra] менее 100 мкм (менее десяти диаметров клетки), что минимизирует повреждение здоровых окружающих тканей.
Фармакокинетика
При в/в введении препарата, содержащего радия хлорид [223 Ra] его биодоступность составляет 100%.
После в/в введения изотоп радия (радий-223) быстро выводится из системного кровотока и накапливается, в первую очередь, в костях и костных метастазах или выделяется непосредственно в кишечник.
Около 20% введенной дозы оставалось в системном кровотоке через 15 мин после введения. Около 4% введенной дозы оставалось в системном кровотоке через 4 ч после введения, снижаясь до менее 1% через 24 ч. Vd превышал ОЦК, что свидетельствует о распределении в периферических полостях. Радиофармацевтическая активность отмечалась в костях и кишечнике через 10 мин после введения. Через 4 ч после введения средние значения радиоактивной дозы, определяющейся в костях и кишечнике, составляли около 61% и 49% соответственно. Не отмечалось значительного накопления изотопа радия в таких органах, как сердце, печень, почки, мочевой пузырь и селезенка через 4 ч после инъекции.
Изотоп радия (радий-223) подвергается радиоактивному распаду и не метаболизируется.
Изотоп радия в основном выводится из организма через кишечник. Около 5% выводится почками. Данные о гепатобилиарной экскреции отсутствуют.
Результаты измерения радиоактивности всего тела через 7 дней после введения (с учетом фактора распада) показывают, что 76% введенной дозы выводится из организма. На скорость выведения радия-223 из ЖКТ влияет высокая вариабельность скорости прохождения содержимого через кишечник в популяции. Нормальный диапазон частоты опорожнения кишечника составляет от 1 раза в день до 1 раза в неделю.
Показания активных веществ препарата
Ксофиго®
Кастрационно-резистентный рак предстательной железы с костными метастазами и отсутствием висцеральных метастазов.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Для в/в введения.
Препарат, содержащий радия хлорид [223Ra] должен назначаться только врачом, имеющим опыт применения радиофармацевтических препаратов. Перед назначением препарата пациент должен пройти обследование. Применение препарата может осуществляться только в специализированных лечебных учреждениях персоналом, имеющим разрешение на обращение с радиофармацевтическими препаратами.
Активная доза составляет 55 кБк/кг. Назначается 6 инъекций с интервалами в 4 недели.
Побочное действие
Со стороны крови и лимфатической системы: очень часто — тромбоцитопения; часто — нейтропения, панцитопения, лейкопения; нечасто — лимфопения.
Со стороны пищеварительной системы: очень часто — диарея, рвота, тошнота.
Прочие: часто — реакции в месте введения.
Противопоказания к применению
Повышенная чувствительность к активному веществу, возраст до 18 лет.
С осторожностью
У пациентов со снижением функции костного мозга; у пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей; у пациентов с риском возникновения компрессии спинного мозга или с состоявшейся компрессией спинного мозга; у пациентов с переломами костей; у пациентов с болезнью Крона и язвенным колитом; у пациентов с нарушением функции печени; у пациентов с нарушением функции почек тяжелой степени тяжести (КК <30 мл/мин).
Применение при беременности и кормлении грудью
Не применяется у женщин.
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Особые указания
Перед каждой инъекцией следует проводить общий анализ крови. Перед первым введением препарата абсолютное число нейтрофилов (АЧН) должно быть ≥1.5×109/л, количество тромбоцитов ≥100×109/л и гемоглобин ≥10.0 г/дл. Перед последующими введениями препарата АЧН должно быть ≥1.0×109/л, количество тромбоцитов ≥50×109/л. Если, несмотря на проведение поддерживающей терапии, данные показатели не нормализуются в течение 6 недель после последнего введения, дальнейшую терапию следует продолжать только после тщательной оценки соотношения пользы и риска.
Следует с осторожностью проводить лечение пациентов со снижением функции костного мозга (например, после предшествующей цитотоксической химиотерапии и/или наружной дистанционной лучевой терапии (НДЛТ)), или у пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей.
Поскольку активное вещество выводится через кишечник, радиоактивное излучение может привести к обострению острого воспалительного заболевания кишечника. Следует внимательно оценивать соотношение пользы и риска при назначении данного средства пациентам с острым воспалительным заболеванием кишечника.
Следует завершить стандартную поддерживающую терапию, проводимую по клиническим показаниям, у пациентов с нелеченой угрожающей или выявленной компрессией спинного мозга до начала или возобновления терапии данным средством.
У пациентов с переломами костей ортопедическую стабилизацию переломов следует выполнить до начала или возобновления терапии данным средством.
Терапия данным средством приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
Диарея, тошнота и рвота, которые могут возникать на фоне лечения, могут вызывать дегидратацию организма. Необходимо следить за своевременным приемом жидкости и контролировать водный баланс организма. В случае развития тяжелой или стойкой диареи, тошноты и рвоты следует рекомендовать пациентам обращаться за медицинской помощью.
Лечение пациентов с признаками или симптомами дегидратации или гиповолемии должно быть начато как можно скорее.
Данные исследований на животных показали возможность риска негативного влияния данного средства на фертильность. Мужчинам следует проконсультироваться относительно консервации спермы перед началом терапии.
Вследствие возможного влияния на сперматогенез, связанного с радиоактивным воздействием, следует рекомендовать мужчинам применять надежные методы контрацепции во время лечения и в течение 6 месяцев после терапии данным средством.
Использование данного средства должно отвечать требованиям радиационной безопасности и качества лекарственных препаратов.
Изотоп радия-223 испускает преимущественно α-частицы, тем не менее, при распаде радия-223 и его дочерних изотопов образуется бета- и гамма-излучение. Благодаря гамма- излучению, использование специальных приборов позволяет измерить радиоактивность данного средства и определить степень радиоактивного загрязнения.
Сотрудникам, работающим с радиофармацевтическими препаратами и подвергающимся риску радиоактивного заражения в результате внешнего облучения или заражения от разлитых отходов жизнедеятельности пациентов (например, моча, кал, рвотные массы) необходимо соблюдать меры радиационной защиты в соответствии с нормативными требованиями. Следует соблюдать осторожность при контакте с материалами (например, постельное белье), использовавшимися пациентами. Поскольку введенная активная доза, как правило, менее 8 МБк, воздействие внешнего облучения на персонал при контакте с пациентом, получающим терапию данным средством, существенно ниже в сравнении с другими радиофармацевтическими препаратами, применяющимися с терапевтической целью. Тем не менее, следуя принципам ALARA («достижение результата с минимально возможным воздействием»), для минимизации радиационного воздействия на персонал рекомендуется до минимума сократить время, проводимое в зоне облучения, максимально увеличить расстояние до источника излучения, использовать средства радиационной защиты.
Лекарственное взаимодействие
Существует вероятность взаимодействия с кальцием и фосфатами. Следует прекратить прием препаратов, содержащих данные вещества и/или витамин D за несколько дней до начала терапии данным средством.
Сочетанное проведение химиотерапии и терапии радия хлоридом [223Ra] может оказывать аддитивное действие на подавление функции костного мозга. Безопасность и эффективность сочетанной химиотерапии и терапии радия хлоридом [223Ra] не установлены.
Применение в комбинации с абиратерона ацетатом и преднизоном/преднизолоном не рекомендуется.
У пациентов, получавших терапию бисфосфонатами и данным средством, нельзя исключить повышенный риск остеонекроза челюсти.
Обобщенные научные материалы по действующему веществу препарата Ксофиго® (раствор для внутривенного введения, 1100 кБк/мл)
Дата последней актуализации: 13.03.2017
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Владелец РУ
- Условия хранения
- Срок годности
- Источники информации
- Фармакологическая группа
- Характеристика
- Фармакология
- Показания к применению
- Противопоказания
- Ограничения к применению
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
Действующее вещество
ATX
Владелец РУ
Байер Фарма АГ
Условия хранения
В соответствии с основными санитарными правилами обеспечения радиационной безопасности (ОСПОРБ-99) и Нормами радиационной безопасности (НРБ-99).
Хранить в недоступном для детей месте.
Срок годности
28 сут.
Не применять по истечении срока годности, указанного на упаковке.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2016.
Фармакологическая группа
Характеристика
Радия хлорид [223Ra] испускает альфа-частицы и имеет период полураспада 11,4 дня. Удельная активность радия-223 1,9 МБк/нг.
Радиоактивный распад радия-223 до свинца-207 состоит из шести звеньев цепочки короткоживущих дочерних изотопов и сопровождается испусканием α-, β- и γ-частиц с разной вероятностью эмиссии и величиной энергии распада. Величина энергии α-излучения составляет 95,3% (диапазон энергии 5–7,5 МэВ), величина энергии β-излучения — 3,6% (среднее значение энергии 0,445 и 0,492 МэВ), величина энергии γ-излучения — 1,1% (диапазон энергии 0,01–1,27 МэВ).
Фармакология
Фармакодинамика
Терапевтическое действие радия хлорида обусловлено эмиссией α-частиц.
Изотоп радия, радия хлорид [223Ra], имитирует кальций и образует комплексное соединение с минералом костной ткани гидроксиапатитом. Благодаря этому изотоп радия избирательно воздействует на костную ткань, в частности на костные метастатические очаги рака предстательной железы. Высокое линейное значение энергии переноса α-частиц (80 кэВ/мкм) приводит к высокой частоте разрыва двухцепочечной молекулы ДНК и вызывает сильный цитотоксический эффект. На моделях in vivo было показано дополнительное воздействие радия хлорида на микроокружение опухоли, включая остеокласты и остеобласты, что способствовало его дополнительной эффективности. Диапазон действия α-частиц радия хлорида — менее 100 мкм (менее десяти диаметров клетки), что минимизирует повреждение здоровых окружающих тканей.
Фармакокинетика
Всасывание. При в/в введении радия хлорида его биодоступность составляет 100%.
Распределение и накопление в органах. После в/в введения радий-223 быстро выводился из системного кровотока и накапливался в первую очередь в костях и костных метастазах или выделялся непосредственно в кишечник.
Около 20% введенной дозы оставалось в системном кровотоке через 15 мин после введения. Около 4% введенной дозы оставалось в системном кровотоке через 4 ч после введения, снижаясь до менее 1% через 24 ч. Vd превышал ОЦК, что свидетельствует о распределении в периферических полостях.
Радиофармацевтическая активность отмечалась в костях и кишечнике через 10 мин после введения. Уровень активности в костях был 44–77% через 4 ч после введения. Не отмечалось значительное накопление изотопа радия в таких органах, как сердце, печень, почки, мочевой пузырь и селезенка через 4 ч после инъекции.
Биотрансформация. Радий-223 подвергается радиоактивному распаду и не метаболизируется.
Выведение. Изотоп радия в основном выводится из организма через кишечник. Около 5% выводится почками. Данные о гепатобилиарной экскреции отсутствуют.
Результаты измерения радиоактивности всего тела через 7 дней после введения (с учетом фактора распада) показывают, что 76% введенной дозы выводятся из организма. На скорость выведения радия-223 из ЖКТ влияет высокая вариабельность скорости прохождения содержимого через кишечник в популяции. Нормальный диапазон частоты опорожнения кишечника составляет от 1 раза в день до 1 раза в неделю.
Линейность. В исследованном диапазоне активности (51–276 кБк/кг) фармакокинетические показатели радия хлорида были линейными.
Дети. Безопасность и эффективность радия хлорида не изучались в возрасте до 18 лет.
Показания к применению
Кастрационно-резистентный рак предстательной железы с костными метастазами и отсутствием висцеральных метастазов.
Противопоказания
Гиперчувствительность; возраст до 18 лет (информация об эффективности и безопасности применения у детей отсутствует).
Ограничения к применению
Снижение функции костного мозга; рак предстательной железы на стадии прогрессирующей диффузной инфильтрации костей; риск возникновения компрессии спинного мозга или состоявшаяся компрессия спинного мозга; переломы костей; болезнь Крона и язвенный колит; нарушение функции печени; нарушение функции почек тяжелой степени (Cl креатинина <30 мл/мин).
Применение при беременности и кормлении грудью
Не применяется у женщин.
Побочные действия
Общий профиль безопасности радия хлорида основывается на данных клинических исследований с участием 600 пациентов, получавших терапию в клинических исследованиях III фазы.
В клинических исследованиях наиболее частыми нежелательными реакциями (>10% пациентов) были диарея, тошнота, рвота и тромбоцитопения.
Наиболее серьезными нежелательными реакциями при применении радия хлорида были тромбоцитопения и нейтропения (см. «Меры предосторожности»).
Перечисленные ниже нежелательные реакции, отмеченные при применении радия хлорида в ходе клинических исследований, представлены в соответствии с системно-органной классификацией MedDRA (в наиболее подходящих терминах) и распределены по частоте возникновения в следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100).
В каждой частотной группе нежелательные явления представлены в порядке уменьшения их значимости.
Со стороны крови и лимфатической системы: очень часто — тромбоцитопения; часто — нейтропения, панцитопения, лейкопения; нечасто — лимфопения.
Со стороны ЖКТ: очень часто — диарея, рвота, тошнота.
Общие расстройства и нарушения в месте введения: часто — реакции в месте введения.
Описание отдельных нежелательных реакций
Тромбоцитопения и нейтропения. Тромбоцитопения (все степени тяжести) наблюдалась у 11,5% пациентов, получавших терапию радия хлоридом и 5,6% пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 6,3% пациентов, получавших радия хлорид и 2% пациентов, получавших плацебо (см. «Меры предосторожности»). В целом, частота случаев тромбоцитопении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (2,8% у пациентов, получавших радия хлорид, в сравнении с 0,8% у пациентов, получавших плацебо), чем у пациентов, которые ранее получали доцетаксел (8,9 и 2,9% пациентов соответственно).
У пациентов с распространенной диффузной инфильтрацией костей сообщалось о случаях тромбоцитопении (все степени) у 19,6% пациентов, получавших терапию радия хлоридом, и 6,7% пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 5,9% пациентов, получавших радия хлорид, и 6,7% пациентов, получавших плацебо (см. «Меры предосторожности»).
Сообщалось о случаях нейтропении (все степени) у 5% пациентов, получавших терапию радия хлоридом, и 1% пациентов, получавших плацебо. Нейтропения 3-й и 4-й степени наблюдалась у 2,2% пациентов, получавших радия хлорид, и 0,7% пациентов, получавших плацебо. В целом частота случаев нейтропении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (0,8% у пациентов, получавших радия хлорид, и 0,8% у пациентов, получавших плацебо), в сравнении с пациентами, которые ранее получали доцетаксел (3,2 и 0,6% пациентов соответственно).
В клиническом исследовании I фазы максимальное снижение количества нейтрофилов и тромбоцитов возникало через 2–3 нед после однократного в/в введения радия хлорида.
Реакции в месте введения. Сообщалось о реакциях в месте введения 1-й и 2-й степени тяжести, которые включали эритему, боль и отек, у 1,2% пациентов, получавших радия хлорид, и 0% пациентов, получавших плацебо.
Вторичные злокачественные опухоли. Терапия радия хлоридом приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях радия хлорида не сообщалось о вторичных онкологических заболеваниях на фоне терапии при последующем наблюдении до трех лет.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Клинические исследования взаимодействия радия хлорида с другими ЛС не проводились.
Существует вероятность взаимодействия радия хлорида с кальцием и фосфатами.
Следует прекратить прием ЛС, содержащих данные вещества и/или витамин D, за несколько дней до начала терапии радия хлоридом.
Сочетанное проведение химиотерапии и терапии радия хлоридом может оказывать аддитивное действие на подавление функции костного мозга (см. «Меры предосторожности»). Безопасность и эффективность сочетанной химиотерапии и терапии радия хлоридом не установлены.
Передозировка
Симптомы: не сообщалось о случаях непреднамеренной передозировки радия хлорида в клинических исследованиях.
Лечение: специфический антидот отсутствует. В случае непреднамеренной передозировки радия хлорида следует принять стандартные поддерживающие меры, включая контроль токсического действия на систему крови и ЖКТ.
В клиническом исследовании I фазы оценивалась разовая активная доза радия хлорида, которая составляла 276 кБк/кг. Ограничивающая дозу токсичность не наблюдалась.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
В/в, медленно (как правило до 1 мин).
Меры предосторожности
Подавление функции костного мозга
Сообщалось о случаях подавления функции костного мозга (тромбоцитопения, нейтропения, лейкопения, панцитопения) у пациентов, получавших терапию радия хлоридом (см. «Побочные действия»).
Следует проводить общий анализ крови у пациентов перед каждым применением радия хлорида. Перед первым введением радия хлорида абсолютное число нейтрофилов (АЧН) должно быть >1,5×109/л, количество тромбоцитов — >100×109/л и Hb — >10 г/дл. Перед последующими введениями АЧН должно быть >1,0×109/л, количество тромбоцитов — >50×109/л. Если, несмотря на проведение поддерживающей терапии, данные показатели не нормализуются в течение 6 нед после последнего введения радия хлорида, дальнейшую терапию следует продолжать только после тщательной оценки соотношения пользы и риска.
В клинических исследованиях III фазы наблюдалось повышение частоты нежелательных реакций со стороны крови (нейтропения и тромбоцитопения) у пациентов со снижением функции костного мозга (например после предшествующей цитотоксической химиотерапии и/или наружной дистанционной лучевой терапии) или пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей по данным радиоизотопного исследования (см. «Побочные действия»). При лечении таких пациентов следует соблюдать осторожность.
Эффективность и безопасность цитотоксической химиотерапии, проводившейся после терапии радия хлоридом, не установлены. Имеющиеся ограниченные данные показывают, что пациенты, получавшие химиотерапию после терапии радия хлоридом, имели сопоставимые гематологические показатели в сравнении с пациентами, получавшими химиотерапию после приема плацебо.
Болезнь Крона и язвенный колит
Безопасность и эффективность радия хлорида у пациентов с болезнью Крона и язвенным колитом не изучались. Поскольку радия хлорид выводится через кишечник, радиоактивное излучение может привести к обострению острого воспалительного заболевания кишечника. Следует внимательно оценивать соотношение пользы и риска при назначении радия хлорида пациентам с острым воспалительным заболеванием кишечника.
Компрессия спинного мозга
Следует завершить стандартную поддерживающую терапию, проводимую по клиническим показаниям, у пациентов с нелеченой угрожающей или выявленной компрессией спинного мозга до начала или возобновления терапии радия хлоридом.
Переломы костей
У пациентов с переломами костей ортопедическую стабилизацию переломов следует выполнить до начала или возобновления терапии радия хлоридом.
Остеонекроз челюсти
У пациентов, получавших терапию бисфосфонатами и радия хлоридом, не может исключаться повышенный риск остеонекроза челюсти. В клиническом исследовании III фазы сообщалось о случаях остеонекроза челюсти у 0,67% пациентов (4/600) в группе радия хлорида в сравнении с 0,33% (1/301) у пациентов в группе плацебо. При этом все пациенты с остеонекрозом челюсти получали предшествующую или сопутствующую терапию бисфосфонатами (например золедроновая кислота) и предшествующую химиотерапию (например доцетаксел).
Вторичные злокачественные опухоли
Терапия радия хлоридом приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях радия хлорида не сообщалось о вторичных онкологических заболеваниях на фоне терапии при последующем наблюдении до трех лет.
Фертильность. Данные о влиянии радия хлорида на фертильность человека отсутствуют.
Данные исследований на животных показали возможность риска негативного влияния радия хлорида на фертильность. Мужчинам следует проконсультироваться относительно консервации спермы перед началом терапии.
Контрацепция у мужчин
Не проводилось исследований применения радия хлорида для оценки его влияния на репродуктивную функцию у животных.
Вследствие возможного влияния на сперматогенез, связанного с радиоактивным воздействием, следует рекомендовать мужчинам применять надежные методы контрацепции во время лечения и в течение 6 мес после терапии.
Влияние на способность управлять транспортными средствами, работать с механизмами. Данные о влиянии радия хлорида на способность управлять транспортными средствами и работать с другими механизмами отсутствуют.
Ксофиго®
МНН: Радия хлорид [223 Ra]
Производитель: Институт энергетических технологий
Анатомо-терапевтическо-химическая классификация: Радия (223Ra) дихлорид
Номер регистрации в РК:
№ РК-ЛС-5№022177
Информация о регистрации в РК:
08.06.2021 — 08.06.2031
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
2 310 492 KZT
- Скачать инструкцию медикамента
Торговое название
Ксофиго®
Международное непатентованное название
Нет
Лекарственная форма
Раствор для инъекций 1100 кБк/мл
Состав
1 флакон содержит
активное вещество – радия-223 дихлорида 6.6 МБк на контрольную дату,
вспомогательные вещества: натрия цитрат, натрия хлорид, кислота хлороводородная, вода для инъекций.
Описание
Прозрачный бесцветный раствор
Фармакотерапевтическая группа
Радиотерапевтические средства. Радиофармацевтические терапевтические препараты прочие. Различные терапевтические радиофармацевтические препараты. Радия (223Ra) дихлорид.
Код АТХ V10XX03
Фармакологические свойства
Фармакокинетика
Данные фармакокинетики, биораспределения и режима дозирования были получены на основании 3-х исследований I фазы.
Данные фармакокинетики были получены у 25 пациентов при режиме дозирования от 51 до 276 кБк (от 0.00138 до 0.00746 мКи)/кг. Данные фармакокинетики, биораспределения и режима дозирования были получены у 6 пациентов при двукратном введении дозы в 110 кБк (0.00297 мКи)/кг с интервалом в 6 недель, и у 10 пациентов при дозировке в 55 (0.00149 мКи), 110 (0.00297 мКи) или 221 кБк (0.00597 мКи)/кг.
Всасывание
Ксофиго® вводится внутривенно и, таким образом, его биодоступность составляет 100%.
Распределение
После внутривенной инъекции радий-223 быстро выводится из крови и внедряется преимущественно в костную ткань и область метастазов в кости, или выделяется в кишечник.
Через 15 минут после внутривенной инъекции около 20% введенного активного вещества остается в крови. Через 4 часа около 4% введенного активного вещества остается в крови, его количество снижалось до менее 1% через 24 часа после инъекции. Объем распределения превышал объем циркулирующей крови, что свидетельствует о распределении в периферические ткани.
Через 10 минут после инъекции активное вещество обнаруживалось в костях и в кишечнике. Уровень активности в костной ткани был в диапазоне между 44% и 77% через 4 часа после инъекции.
Через 4 часа после инъекции не было выявлено какого-либо значимого накопления препарата в других органах, таких как сердце, печень, почки, мочевой пузырь и селезенка.
Метаболизм
Радий-223 – это изотоп, который распадается и не метаболизируется.
Выведение
Выведение с каловыми массами является основным путем выведения из организма. Около 5% выводится с мочой, нет доказательных признаков о гепатобилиарной экскреции.
Измерение радиоактивности всего организма через 7 дней после инъекции (после корректировки на распад) показали, что в среднем 76% введенного активного вещества было выведено из организма. На уровень выведения радия-223 дихлорида из желудочно-кишечного тракта повлияла высокая вариабельность скорости прохождения содержимого через кишечник в популяции, с нормальной частотой опорожнения кишечника от одного раза в день до одного раза в неделю.
Линейность/ Нелинейность
Фармакокинетика радия-223 дихлорида была линейной при исследованном диапазоне дозирования ( от 51 до 276 кБк (от 0.00184 до 0.00746 мКи)/кг).
Фармакокинетика у различных групп пациентов
Пациенты детского возраста
Безопасность и эффективность применения Ксофиго® у детей и подростков младше 18 лет не изучены.
Пациенты пожилого возраста
Коррекция дозы у пожилых пациентов не требуется.
Пациенты с нарушениями функции печени
Фармакокинетические исследования у пациентов с нарушениями функции печени не проводились. Поскольку радий-223 является изотопом и не метаболизируется, предполагается, что нарушения функции печени не повлияют на фармакокинетику радия-223 дихлорида.
Пациенты с нарушениями функции почек
Фармакокинетические исследования у пациентов с нарушениями функции почек не проводились. Поскольку выделение с мочой минимально и основное выведение осуществляется через фекалии, предполагается, что нарушения функции почек не повлияют на фармакокинетику радия-223 дихлорида.
Фармакодинамика
Ксофиго® – это терапевтический альфа-излучающий радиофармацевтический препарат с таргетным противоопухолевым воздействием на костные метастазы.
Активное действующее вещество Ксофиго®, изотоп радий-223 (в виде радия-223 дихлорида), имитирует кальций и избирательно воздействует на кости, особенно на области, пораженные метастазами, путем образования комплексов с костным минералом гидроксиапатитом. Высокий уровень линейной передачи энергии альфа-излучателей (80 кэВ/микрометр) приводит к высокой частоте двухцепочечных разрывов ДНК в прилегающих опухолевых клетках, что оказывает мощное местное противоопухолевое воздействие. Воздействие на микроокружение опухоли, включая остеобласты и остеокласты, также дополняет эффект in vivo. Диапазон распространения альфа-частиц радия-223 составляет менее 100 микрометров (менее 10 клеточных диаметров), что минимизирует ущерб для окружающих здоровых тканей
Фармакодинамические эффекты
По сравнению с плацебо, было выявлено существенное различие в пользу Ксофиго® по всем пяти сывороточным биомаркерам ремоделирования костной ткани, которые изучались в рандомизированном исследовании II фазы (маркеры костеобразования: костный изофермент щелочной фосфатазы (ЩФ), щелочная фосфатаза общая и N-терминальный пропептид проколлагена I типа [PINP], маркеры резорбции кости: C-терминальные продукты деградации коллагена I типа [S-CTX-I] и С-терминальный телопептид коллагена I типа [ICTP]).
Клиническая эффективность и безопасность
Клиническая безопасность и эффективность Ксофиго® были оценены в рамках двойного слепого рандомизированного 0000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 многоцентрового исследования III фазы (ALSYMPCA) с многократным введением у пациентов с кастрационно-резистентным раком предстательной железы и костными метастазами.
Первичным оцениваемым показателем эффективности была общая выживаемость. Вторичные оцениваемые показатели включали время до скелетных осложнений с клиническими проявлениями, ЩФ и прогрессию по данным ПСА.
На дату завершения сбора данных для запланированного промежуточного анализа в общей сложности 809 пациентов были рандомизированы в соотношении 2:1 для получения Ксофиго® в дозе 55 кБк (0.00149 мКи)/кг, вводимого внутривенно каждые 4 недели в течение 6 циклов (N=541) плюс наилучшее стандартное лечение, или плацебо плюс наилучшее стандартное лечение (N=268). Наилучшее стандартное лечение включало в себя в том числе наружную дистанционную лучевую терапию (EBRT), бисфосфонаты, кортикостероиды, антиандрогены, эстрогены, эстрамустин или кетоконазол. По рекомендации Независимого Комитета по мониторингу данных, исследование было сделано открытым после того как в промежуточном анализе была доказана эффективность на основании заранее установленных критериев остановки. Дополненный описательный анализ безопасности и общей выживаемости был проведен у 921 рандомизированных пациентов до осуществления замены терапии (т.е. предложения пациентам из группы плацебо получать лечение Ксофиго®).
Демографические характеристики и клиническая картина исходного заболевания (популяция промежуточного анализа) были сопоставимы между группами, получавшими лечение Ксофиго® и плацебо, и представлены ниже для Ксофиго®:
-
Средний возраст пациентов был 70 лет (от 49 до 90 лет).
-
87% включенных пациентов имели статус 0-1 по шкале ECOG.
-
41% получали бисфосфонаты .
-
42% пациентов не получали до этого доцетаксел, по причине противопоказаний либо отказа от терапии доцетакселом
-
46% пациентов не испытывали боли или отмечали боль 1 степени по шкале ВОЗ (без симптомов или с минимальными симптомами), у 54% отмечалась боль 2-3 степени по шкале ВОЗ.
-
У 16% пациентов имелось < 6 метастазов в кости, у 44% пациентов — от 6 до 20 метастазов в кости, у 40% пациентов имелось более 20 метастазов в кости или «суперскан».
В течение периода лечения 83% пациентов одновременно получали агонисты рилизинг-гормона лютеинизирующего гормона (РГЛГ) и 26% пациентов получали антиандрогены.
Результаты как промежуточного, так и дополненного анализов показали, что общая выживаемость была значимо выше у пациентов, получавших лечение Ксофиго® плюс наилучшее стандартное лечение по сравнению с пациентами, получавшими плацебо плюс наилучшее стандартное лечение (смотрите Таблицу 1).
В группе плацебо отмечалась более высокая частота смертности, не связанной с раком предстательной железы (26/541, 4,8% в группе, получавшей лечение Ксофиго® в сравнении с 23/268, 8,6% в группе плацебо).
В промежуточном анализе было выявлено увеличение медианы общей выживаемости на 2,8 месяцев при лечении Ксофиго® плюс наилучшее стандартное лечение по сравнению с плацебо плюс наилучшее стандартное лечение (Отношение рисков (HR) = 0.695 (95% Доверительный интервал (CI) 0.552/0.875), p = 0.00185, медиана общей выживаемости: 14.0 месяцев против 11.2 месяцев, соответственно) со снижением риска смерти более чем на 30%. В дополненном анализе было показано увеличение медианы общей выживаемости на 3.6 месяцев при лечении Ксофиго® плюс наилучшее стандартное лечение по сравнению с плацебо плюс наилучшее стандартное лечение (Отношение рисков (HR) =0.695 (95%) Доверительный интервал (CI) 0.581/0.832), медиана общей выживаемости: 14.9 месяцев против 11.3 месяцев, соответственно).
Таблица 1: Результаты выживаемости в исследовании III фазы ALSYMPCA
|
Ксофиго® |
Плацебо |
|
|
Промежуточный анализ Количество (%) смертельных исходов Медиана общей выживаемости (месяцы) (95% ДИ) |
N=541 191 (35,3%) 14,0 (12,1-15,8) |
N=268 123 (45,9%) 11,2 (9,0-13,2) |
|
Отношение рисковб (95% ДИ) Значение pа (двусторонний) |
0,695 (0,552-0,875) 0,00185 |
|
|
Дополненный анализ Количество (%) смертельных исходов Медиана общей выживаемости (месяцы) (95% ДИ) |
N=614 333 (54,2%) 14,9 (13,9-16,1) |
N=307 195 (63,5 %) 11,3 (10,4-12,8) |
|
Отношение рисковб (95% ДИ) |
0,695 (0,581-0,832) |
ДИ = доверительный интервал
а Изучение показателей эффективности в исследовании III фазы ALSYMPCA было остановлено после промежуточного анализа. Поскольку дополненный анализ представлен в описательных целях, значение p не предусмотрено.
б Отношение рисков (Ксофиго® по сравнению с плацебо) < 1 в пользу Ксофиго®.
Результаты промежуточного и дополненного анализа показали также значительное улучшение по всем основным вторичным оцениваемым показателям в группе, получавшей лечение Ксофиго® по сравнению с группой плацебо (см. таблицу 2). В отношении прогрессии по ЩФ отмечалось статистически значимом преимущество в виде нормализации ЩФ и ответа по данным ЩФ на 12-й неделе.
Таблица 2. Вторичные оцениваемые показатели эффективности в исследовании III фазы ALSYMPCA (промежуточный анализ)
|
Частота [к-во (%) пациентов] |
Анализ времени до события (95% ДИ) [медиана к-ва месяцев] |
||||||
|
Ксофиго® N=541 |
Плацебо N=268 |
Ксофиго® N=541 |
Плацебо N=268 |
Отношение рисков <1 в пользу Ксофиго® |
Значение р |
||
|
Симптоматическое скелетное событие (ССС) |
Совокупный показатель СССа |
132 (24.4%) |
82 (30.6%) |
13.5 (12.2 – 19.6) |
8.4 (7.2 – NE)b |
0.610 (0.461 – 0.807) |
0.00046 |
|
Компоненты ССС |
Наружная дистанционная лучевая терапия (EBRT) для облегчения боли |
122 (22.6%) |
72 (26.9%) |
17.0 (12.9 – НО) |
10.8 (7.9 – НО) |
0.649 (0.483 – 0.871) |
0.00375 |
|
Компрессия спинного мозга |
17 (3.1%) |
16 (6.0%) |
НО |
НО |
0.443 (0.223 – 0.877) |
0.01647 |
|
|
Хирургическое вмешательство |
9 (1.7%) |
5 (1.9%) |
НО |
НО |
0.801 (0.267 – 2.398) |
0.69041 |
|
|
Переломы кости |
20 (3.7%) |
18 (6.7%) |
НО |
НО |
0.450 (0.236 – 0.856) |
0.01255 |
|
|
Прогрессия по общей ЩФc |
79 (14.6%) |
116 (43.3%) |
НО |
3.5 (4.1) |
0.162 (0.120 – 0.220) |
<0.00001 |
|
|
Прогрессия по ПСАd |
288 (53.2%) |
141 (52.6%) |
3.6 (3.5 – 3.7) |
3.4 (3.3 – 3.5) |
0.671 (0.546 – 0.826) |
0.00015 |
ЩФ – щелочная фосфатаза; ДИ=Доверительный интервал; НО – нет оценки; ПСА — простат-специфический антиген; ССС – симптоматическое скелетное событие
aССС было определено как возникновение любого из следующих событий: наружной дистанционной лучевой терапии для облегчения боли, или патологического перелома, или компрессии спинного мозга, или ортопедического хирургического вмешательства для удаления опухоли
b НО: нет оценки, недостаточное количество событий после медианы
c Определяется как ≥ 25% увеличение по сравнению с исходным уровнем/самым низким уровнем.
d Определяется как повышение на ≥ 25% и увеличением абсолютного значения по крайней мере на 2 нг/мл по сравнению с исходным уровнем/самым низким уровнем.
Анализ выживаемости в подгруппах
Анализ выживаемости в подгруппах показал стабильное преимущество в отношении выживаемости в пользу Ксофиго®, независимо от уровня общей щелочной фосфатазы (ЩФ), исходного применения бисфосфонатов и предшествующей терапии доцетакселом.
Качество жизни
Связанное со здоровьем качество жизни (СЗКЖ) оценивалось в исследовании III фазы ALSYMPCA с использованием специальных опросников: EQ-5D (общий опросник) и FACT-P (опросник для больных раком предстательной железы). В обеих группах наблюдалось снижение качества жизни. По сравнению с плацебо, снижение качества жизни происходило медленнее на фоне лечения Ксофиго® на основании показателей индекса полезности EQ-5D (-0,040 против — 0,109; р = 0,001), самооценки по Визуальной аналоговой шкале (ВАШ) EQ-5D состояния здоровья (-2,661 против 5,860; р = 0,018) и суммарного количества баллов (-3,880 против -7,651, р = 0,006), однако не достигало опубликованных минимально значимых различий. Имеются ограниченные данные о замедлении снижения СЗКЖ после периода лечения.
Обезболивание
Данные исследования III фазы ALSYPMCA по времени до наружной дистанционной лучевой терапии (EBRT) для облегчения боли и снижения количества пациентов с болью в костях в качестве нежелательного явления в группе Ксофиго® указывают на положительный эффект в отношении боли в костях.
Дальнейшая цитотоксическая терапия
В ходе рандомизированного исследования ALSYMPCA (рандомизация в соотношении 2:1) 93 (17%) пациентов в группе Ксофиго® и 54 (16,8%) пациентов в группе плацебо получали цитотоксическую химиотерапию в разное время после последнего курса лечения. Значимые различия в гематологических показателях между этими двумя группами отсутствовали.
Показания к применению
— кастрационно-резистентный рак предстательной железы с симптоматическими костными метастазами и отсутствием подтвержденных висцеральных метастазов
Способ применения и дозы
Метод введения
Препарат Ксофиго® вводится в виде медленной внутривенной инъекции (обычно до 1 минуты).
Внутривенный катетер необходимо промыть изотоническим раствором хлорида натрия до и после инъекции Ксофиго®.
Дополнительные рекомендации по введению представлены ниже в разделе «Инструкция по введению/подготовке лекарственного средства».
Режим дозирования
Курс лечения Ксофиго® составляет 6 инъекций по 55 кБк на кг массы тела, вводимых с интервалом в 4 недели. Безопасность и эффективность применения Ксофиго® курсом, превышающим 6 инъекций, не были изучены.
Для более подробной информации по расчету необходимого для введения объема препарата смотрите раздел ниже «Инструкция по введению/подготовке лекарственного средства».
Инструкция по введению/подготовке лекарственного средства
Общие указания
Ксофиго® (альфа-излучающий радиофармацевтический препарат) должен получать, использовать и вводить персонал, уполномоченный работать с радиофармацевтическими препаратами в соответствующем медицинском учреждении, и после оценки пациента квалифицированным врачом.
Получение, хранение, использование, транспортировка и утилизация Ксофиго® должны осуществляться в соответствии с нормативными требованиями и/или соответствующими лицензиями компетентной официальной организации.
Работа с Ксофиго® должна осуществляться таким образом, чтобы она соответствовала как требованиям радиационной безопасности, так и требованиям к качеству фармацевтических препаратов. Должны быть предприняты соответствующие асептические меры предосторожности.
Радиационная защита
Гамма-излучение, связанное с распадом радия-223 и его дочерних продуктов распада, позволяет измерять радиоактивность Ксофиго® и обнаруживать загрязнения стандартными приборами. Введение Ксофиго® связано с потенциальными рисками для других людей (например, медицинский персонал, медработники, осуществляющие уход за больным, члены семьи пациентов) в связи с радиацией или загрязнением биологическими жидкостями, такими как моча, фекалии и рвотные массы. В этой связи необходимо предпринимать меры по радиационной защите в соответствии с национальными и местными требованиями. Следует соблюдать осторожность при обращении с материалами, такими как простыни, имевшими контакт с такими биологическими жидкостями. Радий – 223 является преимущественно излучателем альфа-частиц, тем не менее, гамма- и бета-излучение возникает при распаде радия-223 и его радиоактивных дочерних продуктов распада. Внешнее радиационное излучение, связанное с подготовкой доз для пациентов, значительно ниже по сравнению с другими радиофармацевтическими средствами, использующимися в терапевтических целях, так как получаемая радиоактивность будет, как правило, ниже 8 МБк (0.216 мКи). Однако, в соответствии с концепцией ALARA (“As Low As Reasonably Achievable” — достижение результата с минимально возможным воздействием), для минимизации радиационного воздействия рекомендуется минимизировать время, проводимое в радиационных зонах, максимально увеличить дистанцию до источников радиации, и использовать соответствующую защиту от излучения.
Любые неиспользованные продукты или материалы, использованные в отношении подготовки или введения лекарственного средства, должны рассматриваться как радиоактивные отходы и утилизироваться в соответствии с местными нормативами.
Инструкции по подготовке лекарственного препарата Ксофиго® Данный лекарственный препарат должен быть визуально осмотрено перед его использованием. Препарат Ксофиго® – это прозрачный бесцветный раствор, который не должен использоваться в случае изменения цвета, появления механических включений или повреждения контейнера.Препарат Ксофиго® представляет собой готовый раствор и не должен разводиться или смешиваться с любыми другими растворами. Каждый флакон предназначен только для однократного применения. Объем раствора, который должен быть введен данному пациенту, должен быть рассчитан исходя из:
-
Массы тела пациента (кг)
-
Дозы (55 кБк (0.00149 мКи)/кг массы тела)
-
Объемной радиоактивности лекарственного средства (1100 кБк/мл; 0.0297 мКи/мл) на контрольную дату. Эта контрольная дата указана на флаконе и маркировке свинцового контейнера.
-
Фактора поправки на радиоактивный распад (DK) для корректировки физического распада радия-223. Таблица факторов поправки на радиоактивный распад приводится для каждого флакона.
Общий объем раствора, который должен быть введен пациенту, рассчитывается по следующей формуле:
|
Объем раствора, который должен быть введен (мл) |
= |
Масса тела (кг) доза (55 кБк (0.00149 мКи)/кг массы тела) |
|
Фактор поправки на распад 1100 кБк (0.0297 мКи)/мл |
Дозиметрия
Расчет поглощенной дозы излучения осуществляется на основании клинических данных биологического распределения. Расчеты поглощенных доз были осуществлены при помощи OLINDA/EXM (Organ Level INternal Dose Assessment – Оценка дозы внутреннего излучения на органы /EXponential Modeling – Экспоненциальное моделирование), программного обеспечения на основе алгоритма медицинской дозы внутреннего ионизирующего излучения (MIRD), который широко используется для установленных бета и гамма-излучающих радионуклидов. Для радия-223, в первую очередь как излучателя альфа-частиц, были сделаны дополнительные предположения для кишечника, красного костного мозга и остеобластов/остеогенных клеток кости, для обеспечения наилучших возможных расчетов поглощенной дозы для Ксофиго®, принимая во внимание его полученные путем наблюдения биораспределение и специфические характеристики.
Для вводимого активного вещества в 4.025 МБк (0.1086 мКи) (55 кБк (0.001495 мКи) на кг массы тела для 73-кг взрослого) рассчитанные поглощенные дозы для кости (остеогенных клеток) составляют 4.6255 Гр (462.55 рад) и для красного костного мозга составляют 0.5572 Гр (50.66 рад). Рассчитанные поглощенные дозы для основных органов выделения составляют 0.0292 Гр (2.92 рад) для стенки тонкого кишечника, 0.1298 Гр (12.98 рад) для стенки проксимального толстого кишечника и 0.1865 Гр (18.65 рад) для стенки дистального толстого кишечника.
Рассчитанные поглощенные дозы для других органов ниже: стенка сердца (0.0069 Гр, 0.69 рад), легкое (0.0003 Гр, 0.03 рад), печень (0.0119 Гр, 1.19 рад), почки (0.0129 Гр, 1.29 рад), стенка мочевого пузыря (0.01627 Гр, 1.62 рад), яички (0.0003 Гр, 0.03 рад), и селезенка (0.0004 Гр, 0.04 рад).
Гематологические нежелательные лекарственные реакции, выявленные в ходе клинических исследований при лечении Ксофиго®, встречались значительно реже и были менее серьезными, чем можно было бы ожидать от рассчитанных поглощенных доз для красного костного мозга. Это может быть связано с пространственным распределением альфа-частиц, что приводит к неравномерно распределенной дозе облучения красного костного мозга.
Дополнительная информация по особым категориям пациентов
Дети и подростки
Безопасность и эффективность применения Ксофиго® у детей и подростков младше 18 лет не изучалась.
Пациенты пожилого возраста
Из 600 пациентов, получавших лечение Ксофиго® в исследовании III фазы, 447 пациентов (74.5%) были в возрасте 65 лет и старше, 196 пациентов (32.7%) были в возрасте 75 лет и старше.
Существенных различий в безопасности и эффективности при применении лекарственного средства у пожилых (возраст ≥ 65 лет) и более молодых пациентов (возраст < 65 лет) выявлено не было.
Коррекция дозы у пожилых пациентов не требуется.
Пациенты с печеночной недостаточностьюБезопасность и эффективность применения Ксофиго® у пациентов с печёночной недостаточностью не изучалась.
Поскольку радий-223 не метаболизируется в печени и не выводится с желчью, предполагается, что печеночная недостаточность не оказывает влияния на фармакокинетику радия-223 дихлорида.
Коррекция дозы у пациентов с печеночной недостаточностью не требуется.
Пациенты с почечной недостаточностью
В клиническом исследовании III фазы не наблюдалось значимых различий в безопасности или эффективности между пациентами с незначительной почечной недостаточностью (клиренс креатинина [КК]: 50-80 мл/мин) и нормальной функцией почек. Имеются ограниченные данные по пациентам с умеренной почечной недостаточностью (КК: 30-50 мл/мин). Отсутствуют данные по пациентам с тяжелой (КК <30 мл/мин) или терминальной почечной недостаточностью. Поскольку выведение с мочой минимально и препарат преимущественно выводится с фекалиями, предполагается, что почечная недостаточность не повлияет на фармакокинетику радия-223 дихлорида.
Коррекция дозы у пациентов с почечной недостаточностью не требуется.
Побочные действия
Общий профиль безопасности Ксофиго® основан на данных, полученных у 600 пациентов, получавших лечение Ксофиго® в исследовании III фазы.
Наиболее серьезными побочными действиями были тромбоцитопения и нейтропения (смотрите раздел «Особые указания» и подраздел «Описание отдельных побочных действий», приведенный ниже).
Наиболее часто наблюдаемыми побочными действиями (³ 10%) у пациентов, получающих Ксофиго®, были диарея, тошнота, рвота и тромбоцитопения.
Побочные действия, наблюдаемые при лечении Ксофиго®, представлены в таблице ниже. Побочные действия, отмеченные в клинических исследованиях, классифицированы в соответствии с частотой их возникновения.
Очень часто (> 1/10)
— тромбоцитопения;
— диарея, рвота, тошнота
Часто (> 1/100 и <1/10)
— нейтропения, панцитопения, лейкопения
— реакции в месте введения
Нечасто( > /1 000 и <1/100)
— лимфопения
Описание отдельных побочных действий
Тромбоцитопения и нейтропения
Тромбоцитопения (все степени) наблюдалась у 11.5% пациентов, получавших лечение Ксофиго® и у 5.6% пациентов, получавших плацебо. Тромбоцитопения 3 и 4 степени наблюдалась у 6.3% пациентов, получавших лечение Ксофиго® и у 2% пациентов, получавших плацебо (смотрите раздел «Особые указания»). В целом, частота возникновения тромбоцитопении 3 и 4 степени была ниже у пациентов, которые ранее не получали доцетаксел ых было сообщено в течение клинических исследований ены в порядке 000000000000000(2.8% при лечении Ксофиго®0000000000000000о этого не получали 00000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 и 0.8% в группе плацебо) по сравнению с пациентами, ранее получавшие лечение доцетакселом (8.9% при лечении Ксофиго®0000000000000000о этого не получали 00000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 и 2.9% в группе плацебо).
Случаи нейтропении (все степени) отмечались у 5% пациентов, получавших лечение Ксофиго® и у1% пациентов группы плацебо. Нейтропения 3 и 4 степени наблюдалась у 2.2% пациентов, получавших лечение Ксофиго® и у 0.7% пациентов группы плацебо. В целом, частота возникновения нейтропении 3 и 4 степени была ниже у пациентов, которые до этого не получали доцетаксел ых было сообщено в течение клинических исследований ены в порядке 000000000000000(0.8% при лечении Ксофиго®0000000000000000о этого не получали 00000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 и0000000000000000о этого не получали 00000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 0.8% в группе плацебо) по сравнению с пациентами, которые до этого получали доцетаксел (3.2% при лечении Ксофиго®0000000000000000о этого не получали 00000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 и0000000000000000о этого не получали 00000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 0.6% в группе плацебо).
В исследовании I фазы самые низкие уровни нейтрофилов и тромбоцитов возникали со 2 по 3 неделю после однократного внутривенного введения Ксофиго®.
Реакции в месте введения
Были зарегистрированы реакции в месте введения 1 и 2 степени, такие как эритема, боль и отек, у 1.2% пациентов, получавших лечение Ксофиго® и у 0% пациентов, получавших плацебо.
Вторичные злокачественные опухоли
Лечение Ксофиго® сопровождается кумулятивным общим облучением пациента. В долгосрочной перспективе это может приводить к повышенному риску возникновения рака и врожденных пороков развития. Не было зарегистрировано ни одного случая рака после применения Ксофиго® во время клинических исследований с наблюдением в течение трех лет.
Противопоказания
— гиперчувствительность к компонентам препарата.
Лекарственные взаимодействия
Клинические исследования взаимодействия не проводились.
Поскольку взаимодействие с кальцием и фосфатом не может быть исключено, прием препаратов, содержащих эти вещества и/или витамин D, следует прекращать за несколько дней до начала лечения Ксофиго®.
Сопутствующая химиотерапия может оказывать аддитивный эффект на подавление костномозгового ростка.
Безопасность и эффективность сопутствующей химиотерапии на фоне лечения Ксофиго® не установлены.
Особые указания
Подавление функции костного мозга
Были получены сообщения о подавлении функции костного мозга, в частности тромбоцитопении, нейтропении, лейкопении и панцитопении, у пациентов, получавших лечение Ксофиго®.
В этой связи гематологическое обследование пациентов должно проводиться до начала лечения и перед каждым последующим введением Ксофиго®. Перед первым введением Ксофиго® абсолютное количество нейтрофилов (АКН) должно быть ≥ 1.5 x 109/л, содержание тромбоцитов ≥ 100 x 109/л и гемоглобин ≥ 10.0 г/дл. Перед последующими введениями АКН должно быть ≥ 1.0 x 109/л и содержание тромбоцитов ≥ 50 x 109/л. В случае, когда не происходит восстановления этих значений в течение 6 недель после последнего введения Ксофиго®, несмотря на проводимую стандартную терапию, дальнейшее лечение препаратом Ксофиго® должно быть продолжено только после тщательного соотношения пользы/риска.
Следует соблюдать осторожность при лечении пациентов с известным сниженным костномозговым резервом, например, после цитотоксической химиотерапии и/или лучевой терапии (EBRT) или пациентов с раком предстательной железы с наличием распространенной диффузной инфильтрации костного мозга (EOD4; «суперскан»).
Эффективность и безопасность применения цитотоксической химиотерапии после лечения Ксофиго® не изучены. Имеющиеся ограниченные данные указывают на то, что у пациентов, получавших химиотерапию после лечения Ксофиго®, гематологический профиль не отличался о такового у пациентов, получавших химиотерапию после плацебо.
Болезнь Крона и неспецифичекий язвенный колит
Безопасность и эффективность применения Ксофиго® у пациентов с болезнью Крона и неспецифическим язвенным колитом не изучалась. Ввиду экскреции Ксофиго® с фекалиями, радиация может привести к ухудшению острого воспалительного заболевания кишечника. У пациентов с острыми воспалительными заболеваниями кишечника следует назначать Ксофиго® после тщательной оценки пользы и риска.
Компрессия спинного мозга
У пациентов с нелеченой угрожающей или диагностированной компрессией спинного мозга стандартная терапия, в соответствии с клиническими показаниями, должна быть закончена до начала или возобновления лечения Ксофиго®.
Переломы костей
У пациентов с переломами костей ортопедическая стабилизация переломов должна быть осуществлена до начала или возобновления лечения Ксофиго®.
Остеонекроз челюсти
У пациентов, получавших бисфосфонаты и Ксофиго®, не может быть исключен повышенный риск остеонекроза челюсти (ОНЧ). В исследовании III фазы случаи ОНЧ описывались у 0,67% пациентов (4/600) в группе Ксофиго® по сравнению с 0,33% пациентов (1/301) в группе плацебо. Однако все пациенты с ОНЧ также получали предшествующую или сопутствующую терапию бисфосфонатами (например, золедроновая кислота) и предшествующую химиотерапию (например, доцетаксел).
Вторичные злокачественные опухоли
Ксофиго® способствует общему долгосрочному кумулятивному облучению пациентов. Таким образом, длительное кумулятивное облучение может ассоциироваться с повышенным риском рака и наследственных пороков развития. В частности, может повышаться риск остеосаркомы, миелодиспластического синдрома и лейкозов. Не зарегистрированы случаи индуцированного действием Ксофиго® рака в клинических исследованиях при последующем наблюдении до 3-х лет.
Вспомогательные вещества с известным эффектом
В зависимости от вводимого объема, данный препарат может содержать до 2,35 ммоль (54 мг) натрия в одной дозе. Это необходимо учитывать у пациентов с контролем натрия в пище.
Контрацепция
Ввиду потенциального влияния на сперматогенез, связанного с радиоактивным излучением, необходимо рекомендовать мужчинам использовать эффективные методы контрацепции во время лечения и в течение 6 месяцев после лечения Ксофиго®.
Беременность и период лактации
Ксофиго® не предназначен для применения у женщин.
Ксофиго® не должен применяется у женщин, которые являются, или могут быть беременными, а также в период лактации.
Фертильность
Данных о влиянии Ксофиго® на фертильность у человека не имеется.
Существует потенциальный риск того, что радиоактивное излучение при использовании Ксофиго® может привести к неблагоприятному воздействию на фертильность. Необходимо проконсультироваться с врачом в отношении консервирования спермы до лечения.
Пациенты детского возраста
Безопасность и эффективность применения Ксофиго® у детей и подростков младше 18 лет не изучены.
Несовместимость с другими лекарственными средствами
Ввиду отсутствия исследований по лекарственной совместимости, Ксофиго® не следует смешивать с другими лекарственными средствами.
Особенности влияния лекарственного средства на способность управлять автотранспортом и потенциально опасными механизмами.
Не имеется доказательных данных или предположений о том, что Ксофиго® может повлиять на способность управлять автомобилем и механизмами.
Передозировка
О случаях непреднамеренной передозировки Ксофиго® во время клинических исследований не сообщалось.
Ксофиго® вводился однократно в дозах до 276 кБк (0,00746 мКи) на кг массы тела без развития дозолимитирующей токсичности.
Лечение: специфического антидота не имеется. В случае непреднамеренной передозировки необходимо предпринять общие поддерживающие меры, включая мониторинг возможной гематологической и желудочно-кишечной токсичности.
Форма выпуска и упаковка
По 6 мл препарата помещают во флакон бесцветного стекла типа I вместимостью 10 мл, укупоренный серой резиновой пробкой из силиконизированного хлорбутила или бромбутила с фольгированным ETFE, и обжатый алюминиевым колпачком.
Флакон оборачивают прозрачной клейкой пленкой, которая с пластиковым основанием и крышкой образует цилиндрическую форму.
Флакон в цилиндрической форме помещают в экранирующий контейнер из свинца.
Свинцовый контейнер вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную коробку со вставками для стабилизации контейнера и с указанием знака радиационной опасности.
Условия хранения
Хранение согласно нормам и правилам радиационной безопасности.
Хранить в недоступном для детей месте!
Срок хранения
28 суток
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска
По рецепту.
Препарат предназначен только для стационарного применения.
Производитель
Институт энергетических технологий, Кьеллер, Норвегия
Владелец регистрационного удостоверения
Байер Фарма АГ, Берлин, Германия.
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукта (товара)
ТОО «Байер КАЗ»
ул. Тимирязева, 42, бизнес-центр «Экспо-Сити», пав. 15
050057 Алматы, Республика Казахстан
тел. +7 727 258 80 40,
факс: +7 727 258 80 39,
e-mail: kz.claims@bayer.com
Наименование, адрес и контактные данные организации на территории Республики Казахстан, ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства».
ТОО «Байер КАЗ»
ул. Тимирязева 42, павильон 15, бизнес-центр «Экспо-сити», пав. 15
050057, Алматы, Республика Казахстан
тел: +7 701 715 78 46 (круглосуточно)
тел:+7 727 258 80 40, вн. 106 (в рабочие часы)
факс: +7 727 2588 039
e-mail: pv.centralasia@bayer.com
| 051655251477976225_ru.doc | 163.5 кб |
| 258390231477977475_kz.doc | 216.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Лекарственная форма
раствор для внутривенного введения
Состав
1 мл раствора для внутривенного введения содержит:
Действующее вещество: радия хлорид [223Ra], в пересчёте на радий-223 (в референтную дату) 1100 кБк (0,58 нг).
Вспомогательные вещества: натрия хлорид 6,3 мг, натрия цитрат 7,2 мг*, хлористоводородная кислота 0,2 мг, вода для инъекций до 1,0 мл.
Содержание радия хлорида [223Ra] указано в пересчёте на радий-223 в референтную дату**.
* указано количество натрия цитрата безводного; в процессе производства используется натрия цитрата дигидрат;
** референтная дата — дата, установленная как «12.00 часов по центральноевропейскому времени через 14 дней после даты производства лекарственного препарата» и соответствующая дате калибровки.
Описание
Бесцветный прозрачный раствор.
Физико-химические свойства
1 мл раствора содержит 1100 кБк радия хлорида [223Ra], что соответствует 0,58 нг радия- 223 в референтную дату. Радий содержится в растворе в виде свободного иона.
В каждом флаконе содержится 6 мл раствора (6600 кБк радия хлорида [223Ra] в референтную дату).
Радия хлорид [223Ra] испускает альфа-частицы и имеет период полураспада 11,4 дней. Удельная активность радия-223 1,9 МБк/нг.
Радиоактивный распад радия-223 до свинца-207 состоит из шести звеньев цепочки короткоживущих дочерних изотопов и сопровождается испусканием альфа-, бета- и гамма-частиц с разной вероятностью эмиссии и величиной энергии распада. Величина энергии альфа-излучения составляет 95,3 % (диапазон энергии 5,0 — 7,5 МэВ), величина энергии бета-излучения — 3,6 % (среднее значение энергии 0,445 МэВ и 0,492 МэВ), величина энергии гамма-излучения — 1,1 % (диапазон энергии 0,01 — 1,27 МэВ).
Рисунок 1. Цепочка радиоактивного распада радия-223 (с характером распада и параметрами периодов полураспада).
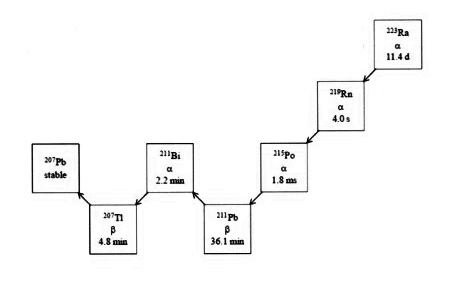
Фармакологическое действие
Фармакодинамика
Механизм действия
Ксофиго® является препаратом, терапевтическое действие которого обусловлено эмиссией α-частиц.
Действующее вещество препарата Ксофиго®, изотоп радия (радия хлорид [223Ra]), имитирует кальций и образует комплексное соединение с минералом костной ткани гидроксиапатитом. Благодаря этому изотоп радия избирательно воздействует на костную ткань, в частности на костные метастатические очаги рака предстательной железы. Высокое линейное значение энергии переноса α-частиц (80 кэВ/мкм) приводит к высокой частоте разрыва двухцепочечной молекулы ДНК и вызывает сильный цитотоксический эффект. На моделях in vivo было показано дополнительное воздействие препарата на микроокружение опухоли, включая остеокласты и остеобласты, что способствовало его дополнительной эффективности. Диапазон действия α-частиц радия хлорида [223Ra] менее 100 мкм (менее десяти диаметров клетки), что минимизирует повреждение здоровых окружающих тканей.
Фармакокинетика
Всасывание
При внутривенном введении препарата Ксофиго® его биодоступность составляет 100 %.
Распределение и накопление в органах
После внутривенного введения изотоп радия (радий-223) быстро выводится из системного кровотока и накапливается, в первую очередь, в костях и костных метастазах или выделяется непосредственно в кишечник.
Около 20 % введённой дозы препарата оставалось в системном кровотоке через 15 минут после введения. Около 4 % введённой дозы препарата оставалось в системном кровотоке через 4 часа после введения, снижаясь до менее 1 % через 24 часа. Объём распределения превышал объём циркулирующей крови, что свидетельствует о распределении в периферических полостях.
Радиофармацевтическая активность отмечалась в костях и кишечнике через 10 минут после введения. Через 4 часа после введения средние значения радиоактивной дозы, определяющейся в костях и кишечнике, составляли около 61 % и 49 % соответственно. Не отмечалось значительного накопления изотопа радия в таких органах, как сердце, печень, почки, мочевой пузырь и селезенка через 4 часа после инъекции.
Биотрансформация
Изотоп радия (радий-223) подвергается радиоактивному распаду и не метаболизируется.
Выведение
Изотоп радия в основном выводится из организма через кишечник. Около 5 % выводится почками. Данные о гепатобилиарной экскреции отсутствуют.
Результаты измерения радиоактивности всего тела через 7 дней после введения препарата (с учётом фактора распада) показывают, что 76 % введённой дозы выводятся из организма. На скорость выведения радия-223 из желудочно-кишечного тракта влияет высокая вариабельность скорости прохождения содержимого через кишечник в популяции. Нормальный диапазон частоты опорожнения кишечника составляет от 1 раза в день до 1 раза в неделю.
Линейность/нелинейность
В исследованном диапазоне активности (51-276 кБк/кг) фармакокинетические показатели радия хлорида [223Ra] были линейными.
Дети
Безопасность и эффективность препарата Ксофиго® не изучались у детей и подростков до 18 лет.
Показания
Кастрационно-резистентный рак предстательной железы с костными метастазами и отсутствием висцеральных метастазов.
Противопоказания
— Гиперчувствительность к действующему веществу или любому вспомогательному компоненту препарата
— Детский возраст до 18 лет (информация об эффективности и безопасности применения препарата Ксофиго® у детей отсутствует).
С осторожностью
— У пациентов со снижением функции костного мозга;
— у пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей;
— у пациентов с риском возникновения компрессии спинного мозга или с состоявшейся компрессией спинного мозга.
— у пациентов с переломами костей;
— у пациентов с болезнью Крона и язвенным колитом;
— у пациентов с нарушением функции печени;
— у пациентов с нарушением функции почек тяжёлой степени тяжести (КК <30 мл/мин).
Беременность и лактация
Препарат Ксофиго® не применяется у женщин.
Способ применения и дозы
Для внутривенного введения.
Препарат Ксофиго® должен назначаться только врачом, имеющим опыт применения радиофармацевтических препаратов. Перед назначением препарата пациент должен пройти обследование. Применение препарата может осуществляться только в специализированных лечебных учреждениях персоналом, имеющим разрешение на обращение с радиофармацевтическими препаратами.
Активная доза препарата Ксофиго® составляет 55 кБк/кг. Назначается 6 инъекций препарата с интервалами в 4 недели.
Безопасность и эффективность препарата Ксофиго® при получении пациентом более 6-ти инъекций не изучались.
Способ введения
Препарат Ксофиго® предназначен для внутривенного введения. Препарат следует вводить медленно (как правило, до 1 минуты).
Иглу от инфузионной системы или катетер до и после введения препарата следует промыть изотоническим раствором натрия хлорида 0,9 %.
Подготовка к введению радиофармацевтического препарата
Перед применением следует внимательно осмотреть раствор. Препарат Ксофиго® представляет собой прозрачный бесцветный раствор. При изменении цвета, обнаружении видимых частиц или дефекта упаковки препарат применять нельзя.
Препарат Ксофиго® представляет собой раствор, готовый к применению. Не следует разводить или смешивать препарат Ксофиго® с другими растворами.
Флакон с препаратом предназначен только для однократного использования.
При расчёте объёма, предназначенного для введения пациенту, необходимо учитывать:
— массу тела пациента, кг;
— уровень активной дозы (55 кБк/кг);
— активную концентрацию препарата на референтную дату (1100 кБк/мл); референтная дата указывается на этикетке флакона и свинцового контейнера;
— коэффициент радиоактивного распада радия-223. Таблица со значениями коэффициента радиоактивного распада находится в каждой упаковке препарата.
Следует подтвердить уровень радиоактивности препарата в каждом флаконе с помощью радиометрического дозиметра.
Суммарный объём вводимого раствора для каждого пациента рассчитывается по формуле:
Объём вводимого препарата = масса тела пациента (кг) × активная доза (55 кБк/кг) / коэффициент радиоактивного распада × 1100 кБк/мл
Дозиметрия
Расчёт лучевой нагрузки основывается на клинических данных по биораспределению препарата Ксофиго®. Расчёт проводился при помощи оценки экспоненциального моделирования дозы внутреннего облучения в органах (OLINDA/EXM), программного обеспечения, основанного на алгоритме терапевтической дозы внутреннего облучения (ТДВО), широко используемого для имплантированных бета- и гамма-активных радионуклидов. Изотоп радия-223 испускает преимущественно α-частицы. Были сделаны дополнительные допущения для оптимального расчёта лучевой нагрузки препарата
Ксофиго® ® для кишечника, красного костного мозга и костной ткани/остеогенных клеток с учётом биораспределения и характерных особенностей препарата.
Таблица 3. Лучевая нагрузка
|
Орган-мишень |
Альфа- излучение1 (Гр/МБк) |
Бета- излучение (Гр/МБк) |
Гамма- излучение (Гр/МБк) |
Суммарная доза (Гр/МБк) | Коэффициент отклонения (%) |
|
Надпочечники |
0,00000 |
0,00002 |
0,00009 |
0,00012 |
56 |
|
Головной мозг |
0,00000 |
0,00002 |
0,00008 |
0,00010 |
80 |
|
Молочная железа |
0,00000 |
0,00002 |
0,00003 |
0,00005 |
120 |
|
Стенка желчного пузыря |
0,00000 |
0,00002 |
0,00021 |
0,00023 |
14 |
|
Стенка нижнего отдела толстой кишки |
0,00000 |
0,04561 |
0,00085 |
0,04645 |
83 |
|
Стенка гонкой кишки |
0,00319 |
0,00360 |
0,00047 |
0,00726 |
45 |
|
Стенка желудка |
0,00000 |
0,00002 |
0,00011 |
0,00014 |
22 |
|
Стенка верхнего отдела толстой кишки |
0,00000 |
0,03149 |
0,00082 |
0,03232 |
50 |
|
Стенка сердца |
0,00161 |
0,00007 |
0,00005 |
0,00173 |
42 |
|
Почки |
0,00299 |
0,00011 |
0,00011 |
0,00321 |
36 |
|
Печень |
0,00279 |
0,00010 |
0,00008 |
0,00298 |
36 |
|
Легкие |
0,00109 |
0,00007 |
0,00005 |
0,00121 |
_ 2 |
|
Мышца |
0,00000 |
0,00002 |
0,00010 |
0,00012 |
41 |
|
Яичники |
0,00000 |
0,00002 |
0,00046 |
0,00049 |
40 |
|
Поджелудочная железа |
0,00000 |
0,00002 |
0,00009 |
0,00011 |
43 |
|
Красный костный мозг |
0,13217 |
0,00642 |
0,00020 |
0,13879 |
41 |
|
Остеогенные клетки |
1,13689 |
0,01487 |
0,00030 |
1,15206 |
41 |
|
Кожа |
0,00000 |
0,00002 |
0,00005 |
0,00007 |
79 |
|
Селезенка |
0,00000 |
0,00002 |
0,00007 |
0,00009 |
54 |
|
Яички |
0,00000 |
0,00002 |
0,00006 |
0,00008 |
59 |
|
Тимус |
0,00000 |
0,00002 |
0,00003 |
0,00006 |
109 |
|
Щитовидная железа |
0,00000 |
0,00002 |
0,00005 |
0,00007 |
96 |
|
Стенка мочевого пузыря |
0,00371 |
0,00016 |
0,00016 |
0,00403 |
63 |
|
Матка |
0,00000 |
0,00002 |
0,00023 |
0,00026 |
28 |
|
Все тело |
0,02220 |
0,00081 |
0,00012 |
0,02312 |
16 |
1 Поскольку изотоп радия-223 не накапливается в большинстве мягких тканей, вклад альфа-излучения в суммарную дозу облучения для данных органов был установлен как 0.
2 Лучевая нагрузка на лёгкие основывается на расчёте смоделированных данных, показывающих зависимость радиофармацевтической активности препарата в крови от времени, с использованием совокупных значений, полученных у всех пациентов.
В клинических исследованиях препарата Ксофиго® частота и тяжесть гематологических нежелательных реакций были значительно ниже, чем можно было бы ожидать, основываясь на лучевой нагрузке для красного костного мозга. Это может быть связано с пространственным распределением α-частиц, что приводит к неравномерному распределению дозы ионизирующего излучения в красном костном мозге.
Особые группы пациентов
Пациенты с нарушением функции печени
Безопасность и эффективность препарата Ксофиго® не изучались у пациентов с нарушением функции печени.
Поскольку изотоп радия-223 не подвергается метаболизму в печени и не выводится с желчью, предполагается, что нарушение функции печени не влияет на фармакокинетические показатели радия хлорида [223Ra]. Пациентам с нарушением функции печени коррекция дозы не требуется.
Пациенты с нарушением функции почек
В клиническом исследовании III фазы не наблюдалось значимых различий безопасности или эффективности препарата Ксофиго® у пациентов с нарушением функции почек лёгкой степени тяжести (КК 50–80 мл/мин) в сравнении с пациентами с нормальной функцией почек. Имеются ограниченные данные для пациентов с нарушением функции почек средней степени тяжести (КК 30–50 мл/мин). Нет данных для пациентов с тяжёлой (КК < 30 мл/мин) или терминальной степенью нарушения функции почек. Однако, поскольку экскреция радия-223 хлорида через почки является минимальной, и его выведение осуществляется, главным образом, через кишечник, предполагается, что нарушение функции почек не влияет на фармакокинетические показатели радия-223 хлорида. Пациентам с нарушением функции почек коррекции дозы не требуется.
Пациенты пожилого возраста
В целом в клинических исследованиях не отмечалось значимых различий безопасности и эффективности препарата Ксофиго® у пожилых (65 лет и старше) пациентов в сравнении с более молодыми пациентами. Пациентам пожилого возраста коррекция дозы не требуется.
Дети
Безопасность и эффективность препарата Ксофиго® не изучались у детей и подростков до 18 лет. Опыт применения препарата у детей с раком предстательной железы отсутствует.
Побочные эффекты
Общий профиль безопасности препарата Ксофиго® основывается на данных клинических исследований с участием 600 пациентов, получавших терапию в клинических исследованиях III фазы.
В клинических исследованиях наиболее частыми нежелательными реакциями (> 10 % пациентов) были диарея, тошнота, рвота и тромбоцитопения.
Наиболее серьёзными нежелательными реакциями при применении препарата Ксофиго® были тромбоцитопения и нейтропения (см. раздел «Особые указания»).
Перечисленные ниже нежелательные реакции, отмеченные при применении препарата Ксофиго® в ходе клинических исследований, представлены в соответствии с поражением органов и систем, и распределены по частоте возникновения в соответствии со следующей градацией: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100). Для классификации и описания конкретной реакции, её синонимов и связанных с ней состояний, используется наиболее подходящий термин из Медицинского словаря для регуляторной деятельности (MedDRA).
В каждой частотной группе нежелательные явления представлены в порядке уменьшения их значимости.
Таблица 4. Неблагоприятные реакции, наблюдавшиеся в ходе клинических исследований препарата Ксофиго®
|
Системно-органный класс (MedDRA) |
Очень часто |
Часто |
Нечасто |
|
Нарушения со стороны крови и лимфатической системы |
Тромбоцитопения |
Нейтропения, панцитопения, лейкопения |
Лимфопения |
|
Нарушения со стороны желудочно-кишечного тракта |
Диарея, рвота, тошнота |
||
|
Общие расстройства и нарушения в месте введения |
Реакции в месте введения |
Описание отдельных нежелательных реакций
Тромбоцитопения и нейтропения
Тромбоцитопения (все степени) наблюдалась у 11,5 % пациентов, получавших терапию препаратом Ксофиго® и у 5,6 % пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 6,3 % пациентов, получавших препарат Ксофиго® и у 2 % пациентов, получавших плацебо (см. раздел «Особые указания»). В целом, частота случаев тромбоцитопении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (2,8 % у пациентов, принимавших препарат Ксофиго®, в сравнении с 0,8 % у пациентов, принимавших плацебо) в сравнении с пациентами, которые ранее получали доцетаксел (8,9 % у пациентов, принимавших препарат Ксофиго®, в сравнении с 2,9 % у пациентов, принимавших плацебо).
У пациентов с распространённой диффузной инфильтрацией костей сообщалось о случаях тромбоцитопении (все степени) у 19,6 % пациентов, получавших терапию препаратом Ксофиго®, и у 6,7 % пациентов, получавших плацебо. Тромбоцитопения 3-й и 4-й степени наблюдалась у 5,9 % пациентов, получавших препарат Ксофиго®, и у 6,7 % пациентов, получавших плацебо (см. раздел «Особые указания»).
Сообщалось о случаях нейтропении (все степени) у 5 % пациентов, получавших терапию препаратом Ксофиго®, и у 1 % пациентов, получавших плацебо. Нейтропения 3-й и 4-йстепени наблюдалась у 2,2 % пациентов, получавших препарат Ксофиго®, и у 0,7 % пациентов, получавших плацебо. В целом частота случаев нейтропении 3-й и 4-й степени была ниже у пациентов, ранее не получавших доцетаксел (0,8 % у пациентов, принимавших препарат Ксофиго®, и 0,8 % у пациентов, принимавших плацебо) в сравнении с пациентами, которые ранее получали доцетаксел (3,2 % у пациентов, принимавших препарат Ксофиго®, и 0,6 % у пациентов, принимавших плацебо).
В клиническом исследовании I фазы максимальное снижение количества нейтрофилов и тромбоцитов возникало через 2–3 недели после однократного внутривенного введения препарата Ксофиго®.
Реакции в месте введения
Сообщалось о реакциях в месте введения 1-й и 2-й степени, которые включали эритему, боль и отёк, у 1,2 % пациентов, получавших препарат Ксофиго®, и у 0 % пациентов, получавших плацебо.
Вторичные злокачественные опухоли
Терапия препаратом Ксофиго® приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях препарата Ксофиго® не сообщалось о вторичных онкологических заболеваниях на фоне терапии препаратом при последующем наблюдении до трёх лет.
Передозировка
Симптомы
Не сообщалось о случаях непреднамеренной передозировки препарата Ксофиго® в клинических исследованиях.
Лечение
Специфический антидот отсутствует.
В случае непреднамеренной передозировки препарата Ксофиго® следует принять стандартные поддерживающие меры, включая контроль токсического действия на систему крови и желудочно-кишечный тракт.
В клиническом исследовании I фазы оценивалась разовая активная доза препарата Ксофиго®, которая составляла 276 кБк/кг. Ограничивающая дозу токсичность не наблюдалась.
Взаимодействие
Клинические исследования взаимодействия препарата Ксофиго® с другими препаратами не проводились.
Существует вероятность взаимодействия препарата Ксофиго® с кальцием и фосфатами. Следует прекратить приём препаратов, содержащих данные вещества и/или витамин D за несколько дней до начала терапии препаратом Ксофиго®.
Сочетанное проведение химиотерапии и терапии препаратом Ксофиго® может оказывать аддитивное действие на подавление функции костного мозга (см. раздел «Особые указания»). Безопасность и эффективность сочетанной химиотерапии и терапии препаратом Ксофиго® не установлены.
Особые указания
Подавление функции костного мозга
Сообщалось о случаях подавления функции костного мозга (тромбоцитопения, нейтропения, лейкопения, панцитопения) у пациентов, получавших терапию препаратом Ксофиго® (см. раздел «Побочное действие»).
Следует проводить общий анализ крови у пациентов перед каждой инъекцией препарата Ксофиго®. Перед первым введением препарата абсолютное число нейтрофилов (АЧН) должно быть ≥ 1,5 × 109/л, количество тромбоцитов ≥ 100 × 109/л и гемоглобин ≥ 10,0 г/дл. Перед последующими введениями препарата АЧН должно быть ≥ 1,0 × 109/л, количество тромбоцитов ≥ 50 × 109/л. Если, несмотря на проведение поддерживающей терапии, данные показатели не нормализуются в течение 6-ти недель после последнего введения препарата Ксофиго®, дальнейшую терапию следует продолжать только после тщательной оценки соотношения пользы и риска.
В клинических исследованиях III фазы наблюдалось повышение частоты нежелательных реакций со стороны крови (нейтропения и тромбоцитопения) у пациентов со снижением функции костного мозга (например, после предшествующей цитотоксической химиотерапии и/или наружной дистанционной лучевой терапии (НДЛТ)), или у пациентов с раком предстательной железы на стадии прогрессирующей диффузной инфильтрации костей по данным радиоизотопного исследования (см. раздел «Побочное действие»). При лечении таких пациентов следует соблюдать осторожность.
Эффективность и безопасность цитотоксической химиотерапии, проводившейся после терапии препаратом Ксофиго®, не установлены. Имеющиеся ограниченные данные показывают, что пациенты получавшие химиотерапию после терапии препаратом
Ксофиго®, имели сопоставимые гематологические показатели, в сравнении с пациентами, получавшими химиотерапию после приёма плацебо (см.раздел «Фармакодинамика»).
Болезнь Крона и язвенный колит
Безопасность и эффективность препарата Ксофиго® у пациентов с болезнью Крона и язвенным колитом не изучались. Поскольку препарат Ксофиго® выводится через кишечник, радиоактивное излучение может привести к обострению острого воспалительного заболевания кишечника. Следует внимательно оценивать соотношение пользы и риска при назначении препарата Ксофиго® пациентам с острым воспалительным заболеванием кишечника.
Компрессия спинного мозга
Следует завершить стандартную поддерживающую терапию, проводимую по клиническим показаниям, у пациентов с нелеченой угрожающей или выявленной компрессией спинного мозга до начала или возобновления терапии препаратом Ксофиго®.
Переломы костей
У пациентов с переломами костей ортопедическую стабилизацию переломов следует выполнить до начала или возобновления терапии препаратом Ксофиго®.
Остеонекроз челюсти
У пациентов, получавших терапию бисфосфонатами и препаратом Ксофиго®, не может исключаться повышенный риск остеонекроза челюсти (ОНЧ). В клиническом исследовании III фазы сообщалось о случаях остеонекроза челюсти у 0,67 % пациентов (4/600) в группе препарата Ксофиго® в сравнении с 0,33 % у пациентов (1/301) в группе, принимавшей плацебо. При этом все пациенты с остеонекрозом челюсти получали предшествующую или сопутствующую терапию бисфосфонатами (например, золедроновая кислота) и предшествующую химиотерапию (например, доцетаксел).
Вторичные злокачественные опухоли
Терапия препаратом Ксофиго® приводит к длительному суммарному накоплению радиационного воздействия у пациентов. Длительное накопление радиационного воздействия может быть связано с повышенным риском возникновения рака и наследственных пороков развития. В частности, может повышаться риск развития остеосаркомы, миелодиспластического синдрома и лейкозов.
В клинических исследованиях препарата Ксофиго® не сообщалось о вторичных онкологических заболеваниях на фоне терапии препаратом при последующем наблюдении до трёх лет.
Токсическое поражение желудочно-кишечного тракта
Терапия препаратом Ксофиго® увеличивает частоту случаев диареи, тошноты и рвоты (см. раздел «Побочное действие»). Это может быть причиной дегидратации. Необходимо следить за своевременным приёмом жидкости и контролировать водный баланс организма. В случае развития тяжёлой или стойкой диареи, тошноты и рвоты следует рекомендовать пациентам обращаться за медицинской помощью.
Лечение пациентов с признаками или симптомами дегидратации или гиповолемии должно быть начато как можно скорее.
Информация о некоторых ингредиентах
В зависимости от вводимого объёма, разовая доза лекарственного препарата может содержать до 2,35 ммоль (54 мг) натрия. Это следует принимать во внимание при назначении препарата пациентам, соблюдающим диету, контролирующую потребление натрия.
Фертильность
Данные о влиянии препарата Ксофиго® на фертильность человека отсутствуют.
Данные исследований на животных показали возможность риска негативного влияния препарата Ксофиго® на фертильность. Мужчинам следует проконсультироваться относительно консервации спермы перед началом терапии.
Контрацепция у мужчин
Не проводилось исследований применения препарата Ксофиго® для оценки его влияния на репродуктивную функцию у животных.
Вследствие возможного влияния на сперматогенез, связанного с радиоактивным воздействием, следует рекомендовать мужчинам применять надёжные методы контрацепции во время лечения и в течение 6 месяцев после терапии препаратом Ксофиго®.
Особые указания по обращению с препаратом и его утилизации
Общие указания
Работа с препаратом Ксофиго® должна осуществляться в соответствии с «Нормами радиационной безопасности» (НРБ-99/2009) и «Основными санитарными правилами обеспечения радиационной безопасности» (ОСПОРБ-99/Ю). Радиофармацевтический препарат Ксофиго® могут получать, использовать и назначать только квалифицированные сотрудники, имеющие соответствующую подготовку и разрешение на работу с радиоактивными веществами. Работа с препаратом, его хранение и утилизация должны осуществляться в специализированном лечебном учреждении, имеющем лицензию на право осуществления деятельности в области использования атомной энергии.
Использование препарата Ксофиго® должно отвечать требованиям радиационной безопасности и качества лекарственных препаратов. Применение препарата следует проводить с соблюдением правил асептики.
Радиационная защита
Изотоп радия-223 испускает преимущественно α-частицы, тем не менее, при распаде радия-223 и его дочерних изотопов образуется бета- и гамма-излучение. Благодаря гамма- излучению. использование специальных приборов позволяет измерить радиоактивность препарата Ксофиго® и определить степень радиоактивного загрязнения.
Сотрудникам, работающим с радиофармацевтическими препаратами и подвергающимся риску радиоактивного заражения в результате внешнего облучения или заражения от разлитых отходов жизнедеятельности пациентов (например, моча, кал, рвотные массы и др.) необходимо соблюдать меры радиационной защиты в соответствии с нормативными требованиями. Следует соблюдать осторожность при контакте с материалами (например, постельное белье), использовавшимися пациентами. Поскольку введенная активная доза препарата Ксофиго®, как правило, менее 8 МБк, воздействие внешнего облучения на персонал при контакте с пациентом, получающим терапию препаратом Ксофиго®, существенно ниже в сравнении с другими радиофармацевтическими препаратами, применяющимися с терапевтической целью. Тем не менее, следуя принципам ALARA («достижение результата с минимально возможным воздействием»), для минимизации радиационного воздействия на персонал рекомендуется до минимума сократить время, проводимое в зоне облучения, максимально увеличить расстояние до источника излучения, использовать средства радиационной защиты.
Неиспользованный препарат, упаковку и материалы, используемые при подготовке и введении препарата Ксофиго®, следует утилизировать как радиоактивные отходы в соответствии с нормативными требованиями.
Влияние на способность управлять транспортными средствами или работать с механизмами
Данные о влиянии препарата на способность управлять транспортными средствами и работу с другими механизмами отсутствуют.
Форма выпуска
Раствор для внутривенного введения, 1100 кБк/мл.
Хранение
Хранение и работа с препаратом должны проводиться в соответствии с «Нормами радиационной безопасности» (НРБ-99/2009) и «Основными санитарными правилами обеспечения радиационной безопасности (ОСПОРБ-99/10)».
Хранить в недоступном для детей месте.
Срок годности
28 сут. с даты производства.
Не использовать по истечении срока годности.
Условия отпуска
Отпуск только для специализированных лечебно-диагностических учреждений.
Не подлежит реализации через аптечную сеть.
Условия отпуска из аптек
Для стационаров
Классификация
-
Фармакотерапевтическая группа
-
Действующее вещество

