Исследовательская группа из университетов Тюбингена и Геттингена изучила эффекты нового класса антибиотиков, которые эффективны против патогенов с множественной лекарственной устойчивостью. Результаты были опубликованы в научном журнале Angewandte Chemie.
Как объяснила Надин Шиллинг из Института органической химии в Тюбингенском университете, пептидные антибиотики нарушают энергообеспечение бактериальных клеток, что приводит к их гибели. В Европейском союзе в 2015 году было зарегистрировано приблизительно 670 000 резистентных к антибиотикам инфекций, что привело к смерти 33 000 пациентов.
Ученые из Тюбингенского университета обнаружили в 2016 году первый пептидный антибиотик, который содержится в микробиоме человека. Ученые назвали вещество «лугдунином», в честь его производителя — Staphylococcus lugdunensis, который обитает в слизистой оболочке носа человека. Лугдунин имеет необычную химическую структуру и может быть прототипом для нового класса антибиотиков.
Staphylococcus lugdunensis — неподвижные грамположительные кокки диаметром от 0,8 до 1 мкм. Они растут индивидуально, парами, небольшими скоплениями или цепочками длиной от 3 до 5 клеток. Staphylococcus lugdunensis — факультативный анаэроб, который имеет слегка желтоватый цвет. Некоторые штаммы бактерий образуют большое количество лугдунина.
Лугдунин — новый тиазолидиновый циклопептид, который проявляет микромолярную активность против метициллин-резистентного золотистого стафилококка. Антибактериальная активность сильно коррелирует с изменением мембранного потенциала у Staphylococcus aureus.
Исследователи синтезировали различные вещества и изучили механизм действия нового класса антибиотиков. «Каждая бактериальная клетка нуждается в трансмембранном потенциале» — объясняет Шиллинг. — «То есть для патогена крайне важно, чтобы концентрации электрически заряженных частиц внутри и снаружи клетки различались. Антибиотик вызывает «энергетический сбой», поэтому бактериальная клетка умирает».
Многие из новых антибиотиков, используемых в настоящее время, отличаются незначительно от тех, которые имеют множественную резистентность. Лугдунин имеет уникальную химическую структуру и состоит из кольца аминокислотных строительных блоков (пептидной структуры), включающего характерное кольцевое серно-азотное соединение, называемое тиазолидином.
«Многие ранее известные пептидные антибиотики очень специфичны» — объясняет Шиллинг. Лекарственные средства связываются с ферментом благодаря своей пространственной структуре, блокируют необходимые процессы и, таким образом, предотвращают образование новых бактериальных клеток. Лугдунин, с другой стороны, не теряет антибиотический эффект при изменении пространственной структуры; т.е. действие не основано на пространственном взаимодействии.
Чтобы выяснить, эффективен ли новый пептидный антибиотик в качестве терапевтического средства, понадобятся кандидаты для доклинических и клинических исследований. Можно ли использовать лугдунин и сопутствующие препараты в будущем, ученые хотят выяснить, в частности, в рамках продолжающегося с начала 2019года в Тюбингенском университете исследования.
Источник: https://www.univadis.ru
Опубликовано: WILEY, Synthetic Lugdunin Analogues Reveal Essential Structural Motifs for Antimicrobial Action and Proton Translocation Capability
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Доступные населению антибиотики теряют эффективность, а их частое и необоснованное применение приводит к отбору устойчивых форм бактерий внутри организмов людей и животных. MDRO в человеческом микробиоме трудно выявить, ведь обычно их носительство бессимптомно. Однако в стрессовых условиях (после хирургических операций, при травмах или иммуносупрессии) оно может перерасти в агрессивную инфекцию, побороть которую будет крайне сложно. А если еще учесть и частую устойчивость подобных бактерий к классическим дезинфектантам, становится понятным, почему MDRO считают настоящим бичом стационаров и роддомов. Они — куда более осязаемая угроза для населения всех континентов, чем тот же вирус Эбола, поэтому огромные усилия сейчас направляются на поиск и производство новых антибиотиков, способных «взломать» защитные системы MDRO.
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
О пептидных антибиотиках «биомолекула» подробно рассказывала ранее: «Антимикробные пептиды — возможная альтернатива традиционным антибиотикам» [4].
Может показаться странным, что человеческая микробиота производит антибиотики, ведь индустрия поиска противомикробных веществ всегда была сосредоточена на почвенных бактериях: считалось, что именно там бурлит жизнь и активно идет борьба за существование. Однако в микробиоме человека насчитывается более тысячи видов бактерий, конкурирующих за место и питательные вещества. Это способствует появлению настоящего «оружия массового поражения» — бактериоцинов, производимых с помощью ферментов двух типов — поликетидсинтаз и нерибосомных пептидсинтетаз [5].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

Рисунок 3. Антибактериальная активность S. lugdunensis против метициллин-резистентного S. aureus. Слева — дикий штамм IVK28 образует зону лизиса на культуре S. aureus. В центре — штамм IVK28ΔlugD (с «выключенным» встраиванием транспозона геном lugD) не оказывает влияния на золотистого стафилококка. Справа — штамм с восстановленной активностью гена lugD снова лизирует клетки конкурента.
В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Разношерстные участники и пикантные подробности бактериального горизонтального генетического переноса описаны в статье «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [11].
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
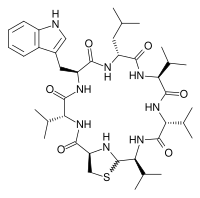
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
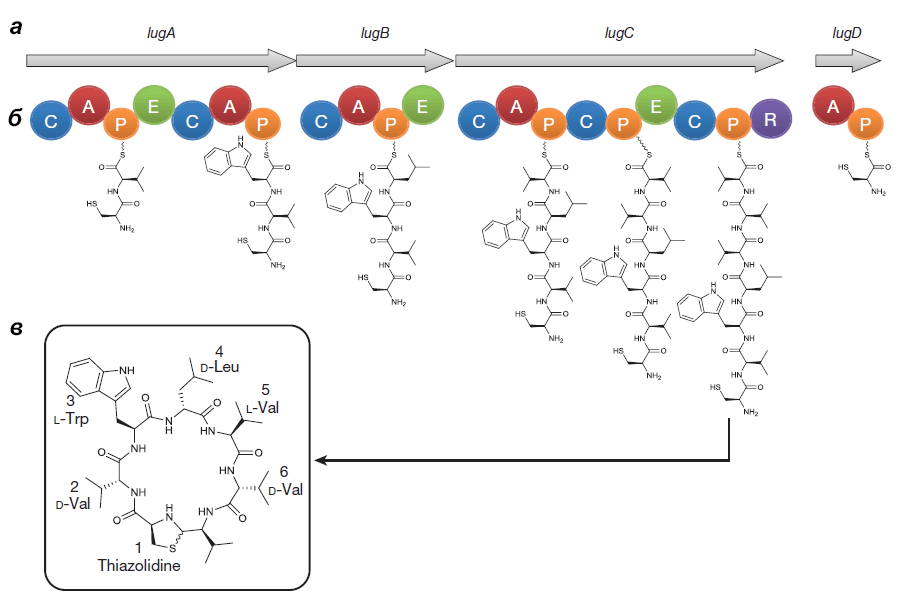
Рисунок 4. Кластер генов, биосинтетический путь и химическая структура лугдунина. а — Гены «субъединиц» (не модулей!) нерибосомной пептидсинтетазы S. lugdunensis: lugA, B, C и D. б — Функциональные домены продуктов оперона: А — аденилирующий, Р — пептидильный, С — конденсирующий, Е — эпимеризующий, R — редуктазный. Их специфические комбинации составляют модули — обособленные каталитические единицы фермента. Биосинтез лугдунина начинается, видимо, в инициирующем модуле LugD и продолжается последовательно с помощью LugA-C. в — Структурная формула лугдунина.
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл−1, что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл−1) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. |
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
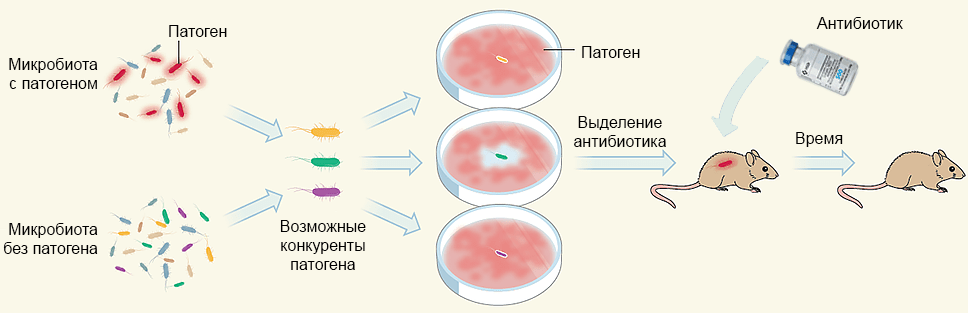
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Из-за высокой эффективности лугдунина авторы обсуждаемой работы предлагают использовать S. lugdunensis в борьбе с золотистым стафилококком, особенно у пациентов с высокими рисками развития инфекции — после операций, иммуносупрессии или гемодиализа. Ранее пробиотическими, как правило, называли бактерий, активно действующих на благо макроорганизма в желудочно-кишечном тракте. Группа Ципперера выступает за расширение понятия «пробиотики» — включение туда бактерий, борющихся с инфекциями и в других местах человеческого тела, таких как носовая полость или кожа.
В очень редких случаях и сам S. lugdunensis может вызывать заболевания, но если удастся создать мутантов, полностью утративших факторы вирулентности, или встроить lug-оперон в абсолютно «мирные» бактерии, можно разработать безопасный пробиотический препарат.
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
- Zipperer A., Konnerth M.C., Laux C., Berscheid A., Janek D., Weidenmaier C. et al. (2016). Human commensals producing a novel antibiotic impair pathogen colonization. Nature. 535, 511–516;
- Dobson A., Cotter P.D., Ross R.P., Hill C. (2012). Bacteriocin production: a probiotic trait? Appl. Environ. Microbiol. 78, 1–6;
- Donia M.S., Cimermancic P., Schulze C.J., Wieland Brown L.C., Martin J., Mitreva M. et al. (2014). A systematic analysis of biosynthetic gene clusters in the human microbiome reveals a common family of antibiotics. Cell. 158, 1402–1414;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Lewis K. and Strandwitz P. (2016). Antibiotics right under our nose. Nature. 535, 501–502;
- Википедия: «Золотистый стафилококк»;
- Карпов И.А. и Качанко Е.Ф. (2005). Стафилококковая инфекция: клинические аспекты и перспективы терапии. Медицинские новости. 9, 53–56;
- Mandal A. (2012). What is Staphylococcus aureus? News-Medical.net;
- Naber C.K. (2009). Staphylococcus aureus bacteremia: epidemiology, pathophysiology, and management strategies. Clin. Infect. Dis. 48, S231–S237;
- Стафилококк золотистый (Staphylococcus aureus). ГастроСкан;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Википедия: «Нерибосомные пептиды»;
- Caboche S., Pupin M., Leclère V., Fontaine A., Jacques P., Kucherov G. (2008). NORINE: a database of nonribosomal peptides. Nucleic Acids Res. 36, D326–D331;
- Mironovskiĭ M.L., Ostash B.E., Fedorenko V.A. (2010). Diversity of genes encoding nonribosomal peptide synthetases in the Streptomyces sioyaensis genome. Genetika. 46, 896–903.
From Wikipedia, the free encyclopedia
|
|
| Names | |
|---|---|
| IUPAC name
(1R,4R,7S,10R,13S,16R,19S)-7-(1H-Indol-3-ylmethyl)-10-isobutyl-4,13,16,19-tetraisopropyl-21-thia-3,6,9,12,15,18,23-heptaazabicyclo[18.2.1]tricosane-2,5,8,11,14,17-hexone |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
|
PubChem CID |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C40H62N8O6S |
| Molar mass | 783.05 g·mol−1 |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Lugdunin is an investigational antibiotic, classified as a thiazolidine-containing cyclic peptide. It was isolated in 2016 after Staphylococcus lugdunensis was identified as the species of bacteria from the human nose that suppressed growth of species of disease-causing bacteria in that part of the human microbiome.[1][2][3]
Lugdunin is a non-ribosomally synthesized cyclic peptide that inhibits growth of Staphylococcus aureus strains. The lugdunin genes are located on a 30-kbp operon. The genes lugA, lugB, lugC, and lugD encode four non-ribosomal peptide synthases, which are preceded by a putative regulator gene lugR.[4]
| Gene | locustag | protein size/aa | Genbank protein entry | RefSeq protein entry |
|---|---|---|---|---|
| lugR | SLUG_RS03935 | 196 | CCB53263.1 | WP_002460032.1 |
| lugA | SLUG_RS03940 | 2374 | CCB53264.1 | WP_002478842.1 |
| SLUG_RS03945 | 124 | CCB53265.1 | WP_002460029.1 | |
| lugB | SLUG_RS03950 | 1230 | CCB53266.1 | WP_014533237.1 |
| lugC | SLUG_RS03955 | 2937 | CCB53267.1 | WP_002478844.1 |
| lugT | SLUG_RS03960 | 228 | CCB53268.1 | WP_002460022.1 |
| lugD | SLUG_RS03965 | 579 | CCB53269.1 | WP_002478846.1 |
Biosynthesis[edit]
Lugdunin is synthesized by non ribosomal peptide synthetases in S. lugdunensis. The molecule is a cyclic peptide composed of a thiazolidine heterocycle and three D amino acids. The operon responsible for lugdunin synthesis is approximately 30 kb and contains four non ribosomal peptide synthetase genes. The operon contains a phosphopantetheinyl transferase, monooxygenase, an unknown tailoring enzyme, a regulator gene, and a type II thioesterase.[5] Phosphopantetheinyl transferases carry out the activation of T domains, which act as carrier proteins. Monooxygenases incorporate a single hydroxyl into a lugdunin intermediate. The type II thioesterase is utilized to remove intermediates that stall during biosynthesis.[citation needed]
A surprising note about lugdunin is that the operon only encodes five adenylation domains, an interestingly small amount for such a large molecule. This discrepancy is accounted for by the addition of three consecutive valine residues in alternating D and L configurations by LugC. The thiazolidine ring forms following the release of the metabolite via reduction. The N-terminal L-Cysteine residue nucleophilically attacks the carbonyl[6] on the C-terminal L-valine residue, thus forming an imine macrocycle. The Schiff base formed in this reaction is then nucleophilically attacked by a cysteine thiol which produces the thiazolidine heterocycle previously described.[citation needed]
References[edit]
- ^ Gallagher, James (2016-07-27). «Antibiotic resistance: ‘Snot wars’ study heralds new class of drugs». BBC News. Retrieved 2016-07-27.
- ^ Zipperer, Alexander; Konnerth, Martin C.; Laux, Claudia; Berscheid, Anne; Janek, Daniela; Weidenmaier, Christopher; Burian, Marc; Schilling, Nadine A.; Slavetinsky, Christoph (2016). «Human commensals producing a novel antibiotic impair pathogen colonization». Nature. 535 (7613): 511–516. Bibcode:2016Natur.535..511Z. doi:10.1038/nature18634. PMID 27466123. S2CID 205249755.
- ^ «Scientists find microbiotic treasure hidden in the nose». Los Angeles Times. 2016-07-27. Retrieved 2016-07-27.
- ^ Krismer, Bernhard; Peschel, Andreas; Grond, Stephanie; Brötz-Oesterhelt, Heike; Schittek, Birgit; Kalbacher, Hubert; Willmann, Matthias; Marschal, Matthias; Slavetinsky, Christoph; Schilling, Nadine A.; Burian, Marc; Weidenmaier, Christopher; Janek, Daniela; Berscheid, Anne; Laux, Claudia; Konnerth, Martin C.; Zipperer, Alexander (July 2016). «Extended Data Figure 1: Gene cluster of lugdunin and generation of S. lugdunensis IVK28-Xyl». Nature. 535 (7613): 511–516. Bibcode:2016Natur.535..511Z. doi:10.1038/nature18634. PMID 27466123. S2CID 205249755.
- ^ Krauss, Sophia; Zipperer, Alexander; Wirtz, Sebastian; Saur, Julian; Konnerth, Martin C.; Heilbronner, Simon; Torres Salazar, Benjamin O.; Grond, Stephanie; Krismer, Bernhard; Peschel, Andreas (2020-12-16). «Secretion of and Self-Resistance to the Novel Fibupeptide Antimicrobial Lugdunin by Distinct ABC Transporters in Staphylococcus lugdunensis». Antimicrobial Agents and Chemotherapy. 65 (1): e01734–20. doi:10.1128/AAC.01734-20. ISSN 0066-4804. PMC 7927808. PMID 33106269.
- ^ «Lugdunin — an overview | ScienceDirect Topics». www.sciencedirect.com. Retrieved 2022-06-04.
External links[edit]
- «Press release: A potential lifesaver lies unrecognized in the human body» (PDF). www.uni-tuebingen.de. University of Tübingen. Retrieved 2016-07-28.
Немецкие ученые выделили из бактерий, обитающих в
человеческом носу, новый антибиотик широкого спектра действия. Результаты
работы опубликованы в журнале Nature.
Сотрудники Университета Тюбингена провели скрининг антимикробной
активности бактерий из коллекции назальных мазков в отношении золотистого
стафилококка (Staphylococcus aureus). Содержимое носа было выбрано для
исследования, поскольку оно представляет собой скудную питательную среду, где
конкуренция за нутриенты между микроорганизмами особенно высока.
Выяснилось, что штамм IVK28
бактерии Staphylococcus lugdunensis в определенных условиях эффективно подавляет рост золотистого стафилококка. Химический
анализ показал, что при дефиците железа и росте на твердой питательной среде
этот микроорганизм производит вещество, которое является мощным антибиотиком.
Соединение, названное лугдунин, представляет собой циклический пептид из пяти аминокислот (D-валин,
L-триптофан, D-лейцин, L-валин
и D-валин), связанных с тиазолидиновым гетероциклом. В микробной
клетке его продуцирует нерибосомальная пептидсинтетаза. Антибиотиков подобной
структуры до сих пор не было известно, и исследователи предложили сделать его
первым представителем группы макроциклических тиазолидиновых пептидов.
В ходе последующих экспериментов выяснилось, что лугдунин производит
бактерицидный эффект не только на золотистый стафилококк (в том числе
метициллин-резистентный), но и на многие грамотрицательные бактерии, такие как
энтеропатогенная кишечная палочка, ванкомицин-резистентные энтерококки,
синегнойная палочка и другие. Механизм его действия может быть связан с блокированием
основных бактериальных метаболических путей — при его воздействии микробные клетки прекращали поглощать и использовать компоненты белков и нуклеиновых кислот (в этом лугдунин схож с антибиотиком
даптомицином из группы циклических липопептидов). Тем не менее, конкретная молекулярная мишень препарата пока неизвестна. На активность и метаболизм
человеческих иммунных клеток лугдунин не влияет даже в высоких концентрациях.
Эффективность нового антибиотика подтвердили на мышах с
кожной стафилококковой инфекцией. Трехкратная аппликация 1,5 микрограмма
лугдунина через 24, 30 и 42 часа после заражения уничтожила патоген как на поверхности, так и в
глубоких слоях кожи.
Чтобы изучить взаимодействие S. lugdunensis и S. aureus в естественной среде,
ученые провели микробиологический анализ мазков из носа 187 госпитализированных
пациентов. Искомые бактерии были выделены соответственно у 9,1 и 32,1 процента.
При этом частота носительства золотистого стафилококка при наличии S. lugdunensis оказалась почти в шесть
раз меньше, чем в его отсутствие (5,9 против 34,7 процента).
Для внедрения лугдунина в практику необходимо уточнить его
эффективность и токсичность в доклинических и клинических испытаниях. Не
исключено, что молекулу придется модифицировать для повышения растворимости и
активности.
Олег Лищук
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
| Staphylococcus lugdunensis | |
|---|---|
| Научная классификация | |
| Царство: | Бактерии |
| Тип: | Фирмикуты |
| Класс: | Bacilli |
| Порядок: | Bacillales |
| Семейство: | Staphylococcaceae |
| Род: | Staphylococcus |
| Виды: | S. lugdunensis |
| Биномиальное название | |
| Staphylococcus lugdunensis . Freney et al. 1988 |
Staphylococcus lugdunensis является коагулазонегативным членом рода Staphylococcus, состоящим из грамположительных бактерий со сферическими клетками, которые появляются в кластеры.
Содержание
- 1 История
- 2 Описание
- 3 Острый послеоперационный эндофтальмит
- 4 Клинические особенности
- 5 См. также
- 6 Ссылки
- 7 Дополнительная литература
- 8 Внешние ссылки
История
Впервые он был описан в 1988 году после того, как был дифференцирован с помощью анализа ДНК. Его название происходит от Lugdunum, латинского названия Lyon, Франция, где этот организм был впервые изолирован.
Описание
Колонии S. lugdunensis обычно гемолитические, липкие. желтого или коричневого цвета и около 2–4 мм в диаметре после 48-часовой инкубации. Также они могут иметь характерный сладкий запах сена. S. lugdunensis может продуцировать связанную коагулазу (то есть фермент связывается с клетками), свойство, которое он разделяет с S. aureus, но в отличие от S. aureus, он не производят свободную коагулазу. В лаборатории он может дать положительный тест на слайд-коагулазу, но отрицательный тест на коагулазу в пробирке. Его довольно легко идентифицировать, потому что, в отличие от подавляющего большинства стафилококков, он декарбоксилат орнитин и положителен на пирролидонилариламидазу.
В прошлом его часто ошибочно определяли как S. hominis, S. aureus или другие виды. Он встречается как комменсал на коже человека, но был зарегистрирован как причина серьезных человеческих инфекций, таких как остеомиелит, артрит, сепсис, раневые инфекции и агрессивный эндокардит.
S. lugdunensis, как правило, очень восприимчив к антистафилококковым антибиотикам, но сообщается об увеличении устойчивости к пенициллину.
Острый послеоперационный эндофтальмит
Острый послеоперационный эндофтальмит, вызванный S. lugdunensis, редко встречается в клинических исследованиях. Пять случаев острого посткатарактального хирургического эндофтальмита были взяты из многоцентрового проспективного исследования, проведенного в четырех университетских больницах во Франции (с 2004 по 2005 год). Эти случаи характеризовались тяжелым воспалением глаз, которое происходило со средней задержкой в 7,6 дней после операции по удалению катаракты, тяжелой потерей зрения (движения рук или меньше в трех случаях) и плотной инфильтрацией стекловидного тела. Первоначально каждый из этих пациентов лечился по стандартному протоколу с использованием интравитреального (ванкомицин и цефтазидим), системного и местного антибиотиков. Учитывая тяжесть эндофтальмита, хотя бактерии были чувствительны к интравитреальным антибиотикам, в четырех случаях потребовалась витрэктомия pars plana. Окончательный прогноз зрения осложнился тяжелой отслойкой сетчатки в трех случаях. Микробиологический диагноз был поставлен с помощью обычных культур со специфическими биохимическими тестами и эубактериальной ПЦР-амплификации с последующим прямым секвенированием.
Клинические особенности
С. lugdunensis был связан с широким спектром инфекций, включая сердечно-сосудистые инфекции (тяжелый эндокардит нативного и протезного клапана, миокардит и инфицированную миксому), эмпиему, остеомиелит и инфекции протезных / нативных суставов, инфекции кожи и мягких тканей (фурункулы, целлюлит, и абсцессы), инфекции центральной нервной системы, перитонит, эндоцефалит и инфекции мочевыводящих путей.
См. Также
- Лугдунин
Ссылки
Дополнительная литература
- Crompton, Marcus J.; Данстан, Р. Хью; Макдональд, Маргарет М.; Готфрис, Йохан; фон Эйфф, Кристоф; Робертс, Тимоти К.; Чжоу, Дуншэн (8 апреля 2014 г.). «Небольшие изменения в параметрах окружающей среды приводят к изменениям устойчивости к антибиотикам, морфологии клеток и состава мембранных жирных кислот у Staphylococcus lugdunensis». PLOS ONE. 9 (4): e92296. doi : 10.1371 / journal.pone.0092296. PMC 3979647. PMID 24714666.
- Missineo, A.; Ди Пото, А.; Geoghegan, J. A.; Rindi, S.; Heilbronner, S.; Gianotti, V.; Arciola, C. R.; Фостер, Т. Дж.; Speziale, P.; Пьетрокола, Г. (июнь 2014 г.). «IsdC из Staphylococcus lugdunensis вызывает образование биопленок в условиях роста с низким содержанием железа». Инфекция и иммунитет. 82 (6): 2448–2459. DOI : 10.1128 / IAI.01542-14. PMC 4019187. PMID 24686057.
Внешние ссылки
- Типовой штамм Staphylococcus lugdunensis в BacDive — база метаданных по бактериальному разнообразию
