Описание препарата НУКАЛА (лиофилизат для приготовления раствора для подкожного введения, 100 мг) основано на официальной инструкции, утверждено компанией-производителем в 2018 году
Дата согласования: 30.08.2018
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Характеристика
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
Фотографии упаковок

30.08.2018
Действующее вещество
ATX
Фармакологическая группа
Состав
| Лиофилизат для приготовления раствора для подкожного введения | |
| Состав см. в таблице |
| Наименование | Количество в 1 фл.1, мг | Количество в 1 дозе, мг |
|
активное вещество |
||
|
меполизумаб |
1442 | 100 |
|
вспомогательные вещества |
||
| сахароза | 197,5–256,8 | 160 |
| динатрия гидрофосфат гептагидрат | 8,82–11,47 | 7,15 |
| полисорбат 80 | 0,82–1,07 | 0,67 |
| хлористоводородная кислота | q.s. до рН 6,5–7,5 | не применимо |
| 1Для вспомогательных веществ указаны минимальное и максимальное количества в 1 фл. | ||
| 2 Препарат содержит 144 мг в 1 фл.; указанное на этикетке количество 100 мг/фл. основано на том, что извлекаемый объем составляет 1 мл при восстановлении лиофилизата. Избыток 44% позволяет получить извлекаемый объем 1 мл после восстановления с помощью 1,2 мл стерильной воды для инъекций. Указанный объем обусловливает распределение твердых частиц в окончательном объеме, концентрация полученного раствора составляет 100 мг/мл. Избыток не включен |
Описание лекарственной формы
Однородная лиофилизированная сухая масса белого цвета.
Восстановленный раствор: прозрачный или опалесцирующий, от бесцветного до светло-желтого или светло-коричневого цвета.
Фармакологическое действие
Фармакологическое действие
—
ингибирующее ИЛ-5, противоастматическое.
Характеристика
Меполизумаб представляет собой гуманизированное моноклональное антитело (IgGl,κ), направленное против ИЛ-5 человека, продуцируемое клетками яичника китайского хомячка с помощью технологии рекомбинации ДНК.
Фармакодинамика
Механизм действия. Меполизумаб представляет собой гуманизированное моноклональное антитело (IgGl,κ), направленное против ИЛ-5 человека с высоким сродством и специфичностью. ИЛ-5 является основным цитокином, который отвечает за рост, дифференцировку, привлечение, активацию и выживание эозинофилов. Меполизумаб ингибирует биоактивность ИЛ-5 в наномолярных дозах посредством блокирования связывания ИЛ-5 с α-цепью рецепторного комплекса ИЛ-5, экспрессируемого на клеточной поверхности эозинофилов, что приводит к ингибированию передачи сигнала ИЛ-5, снижению продукции и выживаемости эозинофилов.
Фармакодинамические эффекты. После п/к введения препарата в дозе 100 мг каждые 4 нед на протяжении 32 нед количество эозинофилов в крови снизилось со среднего геометрического исходного количества 290 до 40 клеток/мкл (n=182), что соответствовало снижению на 84% по сравнению с плацебо. Данную величину снижения наблюдали в течение 4 нед терапии.
Иммуногенность. В соответствии с возможными иммуногенными свойствами белковых и пептидных препаратов у пациентов после проведения терапии могут появиться антитела к меполизумабу. В целом у 15 из 260 (6%) пациентов, получавших препарат п/к в дозе 100 мг, появились антитела к меполизумабу после введения как минимум одной дозы меполизумаба. Нейтрализующие антитела были выявлены у одного пациента, получавшего меполизумаб. Антитела к меполизумабу не оказывали заметного влияния на фармакокинетику или фармакодинамику меполизумаба у большинства пациентов, также не была отмечена корреляция между титрами антител и изменением уровня эозинофилов.
Фармакокинетика
После п/к введения пациентам с бронхиальной астмой меполизумаб проявил примерно пропорциональную дозе фармакокинетику в диапазоне доз от 12,5 до 250 мг.
Всасывание. После п/к введения здоровым добровольцам или пациентам с бронхиальной астмой меполизумаб всасывался медленно с медианой времени до достижения Cmax в плазме крови в диапазоне от 4 до 8 дней. После однократного п/к введения в область живота, бедра или плеча здоровым добровольцам абсолютная биодоступность меполизумаба составила 64, 71 и 75% соответственно. У пациентов с бронхиальной астмой абсолютная биодоступность меполизумаба при п/к введении в область плеча составляла 74–80%. После многократного п/к введения каждые 4 нед наблюдалось приблизительно двукратное накопление препарата в равновесном состоянии.
Распределение. После однократного в/в введения меполизумаба пациентам с бронхиальной астмой средний Vd составлял от 55 до 85 мл/кг.
Метаболизм. Меполизумаб представляет собой гуманизированное моноклональное антитело IgG1, которое расщепляется при воздействии протеолитических ферментов, широко распространенных не только в ткани печени, но и во всем организме.
Выведение. После однократного в/в введения препарата пациентам с бронхиальной астмой средний общий клиренс составлял от 1,9 до 3,3 мл/сут/кг, а средний конечный T1/2 — примерно 20 дней. После п/к введения меполизумаба средний конечный T1/2 составлял от 16 до 22 дней. В популяционном фармакокинетическом анализе расчетный общий клиренс меполизумаба составлял 3,1 мл/сут/кг.
Особые группы пациентов
Пожилой возраст (65 лет и старше). Данные по фармакокинетике меполизумаба при применении у пациентов пожилого возраста (65 лет и старше) в клинических исследованиях ограничены (n=90). Однако в популяционном фармакокинетическом анализе не выявлены признаки влияния возраста (12–82 года) на фармакокинетику меполизумаба.
Нарушение функции почек. Официальные исследования по изучению влияния нарушения функции почек на фармакокинетику меполизумаба не проводились. На основании популяционного фармакокинетического анализа коррекция дозы пациентам с Cl креатинина 50–80 мл/мин не требуется. Данные по пациентам с Cl креатинина <50 мл/мин ограничены.
Нарушение функции печени. Официальные исследования по изучению влияния нарушения функции печени на фармакокинетику меполизумаба не проводились. Поскольку меполизумаб расщепляется широко распространенными протеолитическими ферментами, которые присутствуют не только в ткани печени, маловероятно, что изменения функции печени окажут какое-либо влияние на выведение из организма меполизумаба.
Показания
Тяжелая эозинофильная астма у пациентов старше 18 лет (в качестве дополнительной поддерживающей терапии).
Противопоказания
Гиперчувствительность к меполизумабу или любому другому компоненту, входящему в состав препарата.
Применение при беременности и кормлении грудью
Данные по применению меполизумаба у беременных женщин ограничены (менее 300 исходов беременности).
Меполизумаб проникает через плацентарный барьер у обезьян. Результаты исследований на животных не указывают на наличие репродуктивной токсичности. Влияние меполизумаба на плод человека неизвестно.
В качестве меры предосторожности желательно избегать применения препарата Нукала во время беременности. Во время беременности препарат Нукала следует применять только в случае, если потенциальная польза для матери превышает потенциальный риск для плода.
Отсутствуют данные, касающиеся выделения меполизумаба с грудным молоком у человека. Однако у яванских макак меполизумаб выделялся в грудное молоко в концентрациях, которые составляли менее 0,5% от концентраций, определенных в плазме крови.
Решение о прекращении грудного вскармливания или прекращении применения препарата Нукала должно быть принято с учетом пользы грудного вскармливания для ребенка и терапии для матери.
Фертильность. Данные по влиянию на фертильность человека отсутствуют. В исследованиях на животных было продемонстрировано отсутствие нежелательных эффектов терапии антителами к ИЛ-5 на фертильность.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
П/к. Препарат может быть введен в область плеча, бедра или живота. Введение осуществляет медицинский работник.
Препарат Нукала должны назначать врачи, имеющие опыт диагностики и терапии тяжелой рефрактерной эозинофильной бронхиальной астмы.
Порошок следует восстановить перед введением, восстановленный раствор необходимо использовать немедленно.
Инструкцию по восстановлению препарата перед применением см. ниже в разделе Рекомендации по применению.
Взрослые. Рекомендуемая доза составляет 100 мг меполизумаба в виде п/к инъекции 1 раз каждые 4 нед. Препарат Нукала предназначен для длительной терапии. Врач должен оценивать необходимость продолжения терапии, по крайней мере, ежегодно на основании степени тяжести заболевания у пациента и результатов контроля обострений.
Особые группы пациентов
Дети (до 18 лет). Безопасность и эффективность применения препарата Нукала у детей и подростков до 18 лет не установлена.
Пожилой возраст (65 лет и старше). У пациентов пожилого возраста коррекция дозы не требуется (см. «Фармакокинетика»).
Нарушение функции почек. Пациентам с нарушением функции почек коррекция дозы не требуется (см. «Фармакокинетика»).
Нарушение функции печени. Пациентам с нарушением функции печени коррекция дозы не требуется (см. «Фармакокинетика»).
Рекомендации по применению
Препарат Нукала не содержит консервантов, поэтому его восстановление необходимо проводить в асептических условиях.
Инструкция по восстановлению
1. Препарат во флаконе восстанавливают с помощью 1,2 мл стерильной воды для инъекций. Предпочтительно использование шприца объемом 2–3 мл и иглы калибром 21. Поток стерильной воды для инъекций должен быть направлен вертикально в центр лиофилизата.
Восстановление проводят при комнатной температуре, аккуратно вращая флакон на протяжении 10 с круговыми движениями с 15-секундными интервалами до растворения препарата.
Примечание: во время процедуры восстановленный раствор встряхивать нельзя, поскольку это может привести к образованию пены или осаждению препарата. Процесс восстановления обычно занимает 5 мин после добавления стерильной воды, но может продлиться дольше.
2. В случае использования механического устройства для восстановления препарата (вихревой мешалки) восстановление может быть проведено при перемешивании со скоростью 450 об./мин продолжительностью не более 10 мин. Также приемлемо перемешивание со скоростью 1000 об./мин продолжительностью не более 5 мин.
3. До применения восстановленный раствор визуально проверяют на наличие посторонних частиц и прозрачность. Раствор должен быть от прозрачного до опалесцирующего, от бесцветного до бледно-желтого или светло-коричневого цвета, не должен содержать видимых частиц. Однако ожидается и допускается присутствие в растворе мелких пузырьков воздуха. При наличии посторонних частиц в растворе, или если раствор выглядит мутным или имеет молочно-белый цвет, его использовать нельзя.
4. Если восстановленный раствор препарата не использован немедленно, его необходимо:
— защищать от солнечного света;
— хранить при температуре ниже 30 °C, не замораживать;
— утилизировать, если раствор не использован в течение 8 ч после восстановления.
Введение
1. Для п/к введения предпочтительно использование полипропиленового шприца объемом 1 мл с одноразовой иглой калибром 21–27 × 0,5 дюйма (13 мм).
2. Непосредственно перед введением набирают в шприц 1 мл восстановленного раствора. Во время процедуры восстановленный раствор препарата встряхивать нельзя, поскольку это может привести к образованию пены или осаждению препарата.
3. Вводят п/к в область плеча, бедра или живота 1 мл раствора (эквивалентно 100 мг меполизумаба).
Утилизация
Весь неиспользованный препарат или отходы следует утилизировать в соответствии с местными требованиями.
Побочные действия
Краткий обзор профиля безопасности
В клинических исследованиях с участием пациентов с тяжелой рефрактерной эозинофильной бронхиальной астмой наиболее часто регистрируемыми нежелательными реакциями во время терапии являлись головная боль, реакции в месте инъекции и боль в спине.
Перечень нежелательных реакций
В общей сложности 915 пациентов с тяжелой рефрактерной эозинофильной бронхиальной астмой получали меполизумаб п/к или в/в во время клинических исследований продолжительностью 24–52 нед.
Ниже представлены нежелательные реакции, зарегистрированные в двух плацебо-контролируемых исследованиях у пациентов, получавших меполизумаб п/к в дозе 100 мг (n = 263).
Частота встречаемости нежелательных реакций определяется следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥ 1/1000 и <1/100), редко (≥1/10000 и <1/1 000), очень редко (<1/10000, включая отдельные случаи) и неизвестно (невозможно оценить на основании доступных данных).
Инфекционные и паразитарные заболевания: часто — фарингит, инфекции нижних дыхательных путей, инфекции мочевыводящих путей.
Со стороны иммунной системы: часто — реакции гиперчувствительности (системные аллергические)1; редко — анафилаксия2.
Со стороны нервной системы: очень часто — головная боль.
Со стороны дыхательной системы, органов грудной клетки и средостения: часто — заложенность носа.
Со стороны ЖКТ: часто — боль в верхних отделах живота.
Со стороны кожи и подкожных тканей: часто — экзема.
Со стороны скелетно-мышечной системы и соединительной ткани: часто — боль в спине.
Общие расстройства и нарушения в месте введения: часто — пирексия, местные реакции в месте инъекции, реакции на введение препарата (системные неаллергические)3.
1Системные реакции, в т.ч. реакции гиперчувствительности, регистрировали с общей частотой, сопоставимой с частотой при применении плацебо. Примеры сопутствующих проявлений и описание времени до их развития см. в разделе «Особые указания», подраздел «Гиперчувствительность и реакции на введение препарата».
2Из спонтанных сообщений в пострегистрационном периоде.
3Наиболее распространенными проявлениями, связанными с сообщениями о системных неаллергических реакциях на введение препарата, являлись сыпь, приливы жара и миалгия; эти проявления регистрировали нечасто и у <1% пациентов, получавших меполизумаб п/к в дозе 100 мг.
Описание отдельных нежелательных реакций
Местные реакции в месте инъекции. В двух плацебо-контролируемых исследованиях частота развития местных реакций в месте инъекции при п/к введении меполизумаба в дозе 100 мг и плацебо составляла 8 и 3% соответственно. Все эти явления были несерьезными, легкой или умеренной степени выраженности, и большинство разрешились в течение нескольких дней. Местные реакции в месте инъекции возникали преимущественно в начале терапии и во время первых 3 инъекций, сообщения о развитии реакций при последующих инъекциях регистрировали реже.
Наиболее распространенные проявления этих явлений включали боль, эритему, припухлость, зуд и ощущение жжения.
Дети
Доступные в настоящее время данные клинических исследований у детей крайне ограничены для характеристики профиля безопасности применения меполизумаба в этой популяции. Однако ожидается, что частота встречаемости, тип и степень тяжести нежелательных реакций в популяции детей аналогичны таковым, наблюдаемым у взрослых.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Официальные исследования по оценке взаимодействия меполизумаба с другими лекарственными препаратами не проводились.
Ферменты системы цитохрома Р450, эффлюксные насосы и механизмы связывания с белком не принимают участие в клиренсе меполизумаба. Установлено, что повышенные концентрации провоспалительных цитокинов (например, ИЛ-6) посредством взаимодействия с соответствующими рецепторами на гепатоцитах подавляют образование изоферментов CYP450 и переносчиков лекарственных препаратов, однако повышение концентрации провоспалительных маркеров при тяжелой бронхиальной астме является минимальным и признаки экспрессии рецепторов ИЛ-5α на гепатоцитах отсутствуют. Поэтому вероятность лекарственных взаимодействий с меполизумабом оценивается как низкая.
Передозировка
В клинической практике случаи передозировки меполизумаба не зарегистрированы. В клиническом исследовании с участием пациентов с эозинофильной бронхиальной астмой однократные дозы до 1500 мг вводили в/в без признаков дозозависимой токсичности.
Лечение: отсутствует специфическое лечение передозировки меполизумаба. В случае передозировки при необходимости следует проводить поддерживающее лечение с надлежащим мониторингом. Дальнейшее лечение следует проводить по клиническим показаниям.
Особые указания
Препарат Нукала не следует применять для лечения обострения бронхиальной астмы. Во время терапии препаратом Нукала могут развиваться связанные с течением бронхиальной астмы нежелательные явления или обострения. Пациентам следует рекомендовать обратиться за медицинской помощью, если после начала терапии препаратом Нукала симптомы бронхиальной астмы остаются неконтролируемыми или отмечено их ухудшение.
Не рекомендуется резкая отмена кортикостероидов после начала терапии препаратом Нукала. Снижение дозы кортикостероидов при необходимости должно быть постепенным и происходить под наблюдением врача.
Гиперчувствительность и реакции на введение препарата. После введения препарата Нукала наблюдались острые и замедленные системные реакции, включая реакции гиперчувствительности (например, анафилаксия, крапивница, ангионевротический отек, сыпь, бронхоспазм, гипотензия). Эти реакции, как правило, развиваются в течение нескольких часов после введения препарата, но в некоторых случаях они возникали с задержкой (т.е. обычно через несколько дней). Эти реакции могут возникать впервые после длительной терапии (см. «Побочные действия»).
Паразитарные инфекции. Эозинофилы могут принимать участие в иммунном ответе на некоторые гельминтные инфекции. Пациенты с существующими гельминтными инфекциями должны получить лечение по поводу инфекции до начала терапии препаратом Нукала. В случае развития инфекции у пациентов во время применения препарата Нукала и отсутствия ответа на противогельминтную терапию следует рассмотреть вопрос о временном прекращении терапии препаратом Нукала.
Влияние на способность управлять транспортными средствами, механизмами. Препарат Нукала не оказывает влияние или оказывает незначительное влияние на способность к управлению транспортными средствами и работе с механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для п/к введения, 100 мг.
Количество лиофилизированной сухой массы, требуемое для обеспечения вводимой дозы 100 мг меполизумаба, во флаконе вместимостью 10 мл из прозрачного стекла типа 1 с пробкой из бромбутилового каучука и серым алюминиевым обжимным колпачком с пластиковой отрывной крышкой. 1 фл. помещают в пачку картонную. 3 пачки картонные упаковывают в прозрачную термоусадочную пленку.
Производитель
Производитель готовой лекарственной формы. «ГлаксоСмитКляйн Мэньюфэкчуринг С.п.А.», Италия.
Фасовщик (первичная упаковка) «ГлаксоСмитКляйн Мэньюфэкчуринг С.п.А.», Италия.
Упаковщик (вторичная (потребительская) упаковка) «ГлаксоСмитКляйн Мэньюфэкчуринг С.п.А.», Италия.
Производитель (выпускающий контроль качества) «ГлаксоСмитКляйн Мэньюфэкчуринг С.п.А.»/GlaxoSmithKline Manufacturing S.p.A. Страда Провинчиале Асолана №90 (Сан Поло) — 43056 Торриле (ПР), Италия/Strada Provincial Asolana N. 90 (loc. San Polo) — 43056 Torrile, Italy.
Наименование и адрес держателя или владельца регистрационного удостоверения лекарственного препарата. ЗАО «ГлаксоСмитКляйн Трейдинг». 119180, Москва, Якиманская наб., 2.
Сообщить о нежелательном явлении на фоне применения продуктов ЗАО «ГлаксоСмитКляйн Трейдинг» можно, обратившись по адресу: 125167, Москва, Ленинградский пр-т, 37а, к. 4, БЦ «Аркус III» — ЗАО «ГлаксоСмитКляйн Трейдинг»;
Тел.: (495) 777-89-00; факс: (495) 777-89-04;
e-mail: EAEU.PV4customers@gsk.com;
или в Федеральную службу по надзору в сфере здравоохранения по адресу: 109074, Москва, Славянская площадь, 4, стр.1;
Тел.: (495) 698-45-38, (495) 578-02-30
e-mail: info@roszdravnadzor.ru, pharm@roszdravnadzor.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре не выше 25 °C (не замораживать).
Восстановленный раствор хранить не более 8 ч при температуре ниже 30 °C. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
4 года.
Не применять по истечении срока годности, указанного на упаковке.
Нукала (Nucala) инструкция по применению
📜 Инструкция по применению Нукала
💊 Состав препарата Нукала
✅ Применение препарата Нукала
📅 Условия хранения Нукала
⏳ Срок годности Нукала
Описание лекарственного препарата
Нукала
(Nucala)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2020 года.
Дата обновления: 2020.02.19
Код ATX:
R03DX09
(Меполизумаб)
Лекарственная форма
| Нукала |
Лиоф. д/пригот. р-ра д/п/к введения 100 мг/1 доза: фл. 1 или 3 шт. рег. №: ЛП-004794 |
Форма выпуска, упаковка и состав
препарата Нукала
Лиофилизат для приготовления раствора для п/к введения в виде однородной сухой массы белого цвета; восстановленный раствор от бесцветного до светло-желтого или светло-коричневого цвета, прозрачный или опалесцирующий.
Вспомогательные вещества:** сахароза — 197.5-256.8 мг, динатрия гидрофосфата гептагидрат — 8.82-11.47 мг, полисорбат 80 — 0.82-1.07 мг, хлористоводородная кислота — q.s. до pH 6.5-7.5.
Флаконы вместимостью 10 мл из прозрачного стекла типа I (1) — пачки картонные с контролем первого вскрытия.
Флаконы вместимостью 10 мл из прозрачного стекла типа I (1) — пачки картонные с контролем первого вскрытия (3) — пленка термоусадочная.
* Препарат содержит 144 мг в 1 флаконе; указанное на этикетке количество 100 мг/флакон основано на том, что извлекаемый объем составляет 1 мл при восстановлении лиофилизата. Избыток 44% позволяет получить извлекаемый объем 1 мл после восстановления с помощью 1.2 мл стерильной воды д/и. Указанный объем обуславливает распределение твердых частиц в окончательном объеме, концентрация полученного раствора составляет 100 мг/мл. Избыток не включен.
** Для вспомогательных веществ указаны минимальное и максимальное количества в 1 флаконе.
Фармакологическое действие
Механизм действия
Меполизумаб представляет собой гуманизированное моноклональное антитело (IgG1, каппа), направленное против интерлейкина-5 (ИЛ-5) человека с высоким сродством и специфичностью. ИЛ-5 является основным цитокином, который отвечает за рост, дифференцировку, привлечение, активацию и выживание эозинофилов. Меполизумаб ингибирует биоактивность ИЛ-5 в наномолярных дозах посредством блокирования связывания ИЛ-5 с альфа-цепью рецепторного комплекса ИЛ-5, экспрессируемого на клеточной поверхности эозинофилов, что приводит к ингибированию передачи сигнала ИЛ-5 и снижению продукции и выживаемости эозинофилов.
Фармакодинамические эффекты
После п/к введения препарата взрослым и детям в возрасте от 12 лет с тяжелой бронхиальной астмой с эозинофильным профилем воспаления дыхательных путей (далее — тяжелая бронхиальная астма) в дозе 100 мг каждые 4 недели на протяжении 32 недель количество эозинофилов в крови снизилось со среднего геометрического исходного количества 290 до 40 клеток/мкл на 32-й неделе (N=182) (снижение на 84% по сравнению с плацебо). Данная величина снижения количества эозинофилов в крови сохранялась у пациентов с тяжелой рефрактерной эозинофильной астмой (N=998), получавших препарат в течение медианы времени 2.8 лет (диапазон от 4 недель до 4.5 лет) в открытом дополнительном исследовании.
После п/к введения препарата детям в возрасте 6-11 лет с тяжелой бронхиальной астмой в дозе 40 мг (при массе тела <40 кг) и в дозе 100 мг (при массе тела ≥40 кг) каждые 4 недели в течение 52 недель количество эозинофилов в крови снизилось со среднего геометрического исходного количества 306 (N=16) до 48 клеток/мкл (N=15) и с 331 до 44 клеток/мкл (N=10) соответственно (снижение на 85% и 87% соответственно).
Данную величину снижения наблюдали у взрослых и у детей в течение 4 недель терапии.
После п/к введения препарата пациентам с эозинофильным гранулематозом с полиангиитом (синдром Чарджа-Стросса) в дозе 300 мг каждые 4 недели в течение 52 недель количество эозинофилов в крови снизилось до среднего геометрического количества 38 клеток/мкл (снижение на 83% по сравнению с плацебо).
Иммуногенность
В соответствии с возможными иммуногенными свойствами белковых и пептидных препаратов, у пациентов после проведения терапии могут появиться антитела к меполизумабу. В плацебо-контролируемых исследованиях у 15 из 260 (6%) пациентов с тяжелой бронхиальной астмой, получавших препарат п/к в дозе 100 мг, и у 1 из 68 (1%) пациентов с эозинофильным гранулематозом с полиангиитом (синдром Чарджа-Стросса), получавших 300 мг меполизумаба п/к, были обнаружены антитела к меполизумабу после введения как минимум одной дозы меполизумаба. Профиль иммуногенности меполизумаба при применении у пациентов с тяжелой бронхиальной астмой (N=998) в течение медианы времени 2.8 лет (диапазон от 4 недель до 4.5 лет) в открытом дополнительном исследовании соответствовал профилю иммуногенности, наблюдавшемуся в плацебо-контролируемых исследованиях.
В начальной краткосрочной фазе клинического исследования у 2 из 35 (6%) детей в возрасте 6-11 лет с тяжелой бронхиальной астмой, получавших препарат п/к в дозе 40 мг (при массе тела <40 кг) или в дозе 100 мг (при массе тела ≥40 кг), были обнаружены антитела к меполизумабу после введения как минимум одной дозы меполизумаба. Во время долгосрочной фазы клинического исследования ни у одного ребенка не были выявлены антитела к меполизумабу. Нейтрализующие антитела были выявлены у одного взрослого пациента с тяжелой бронхиальной астмой, получавшего меполизумаб в дозе 100 мг. Антитела к меполизумабу не оказывали значимого влияния на фармакокинетику или фармакодинамику меполизумаба у большинства пациентов, также не было отмечено корреляции между титрами антител и изменением уровня эозинофилов в крови.
Фармакокинетика
После п/к введения пациентам с тяжелой бронхиальной астмой фармакокинетика меполизумаба была пропорциональна дозе в диапазоне доз от 12.5 мг до 250 мг. Фармакокинетические свойства меполизумаба у пациентов с эозинофильным гранулематозом с полиангиитом (синдром Чарджа-Стросса) были сопоставимы с фармакокинетическими свойствами меполизумаба у пациентов с тяжелой бронхиальной астмой. Системное воздействие после п/к введения меполизумаба в дозе 300 мг пациентам с эозинофильным гранулематозом с полиангиитом (синдром Чарджа-Стросса) примерно в 3 раза превышало системное воздействие после введения меполизумаба в дозе 100 мг пациентам с тяжелой бронхиальной астмой.
Всасывание
После п/к введения здоровым добровольцам или пациентам с тяжелой бронхиальной астмой меполизумаб всасывался медленно с медианой времени до достижения максимальной концентрации в плазме крови (Тmax) в диапазоне от 4 до 8 сут.
После однократного п/к введения в область живота, бедра или плеча здоровым добровольцам абсолютная биодоступность меполизумаба составила 64%, 71% и 75% соответственно. У пациентов с тяжелой бронхиальной астмой абсолютная биодоступность меполизумаба при п/к введении в область плеча составляла 74-80%. После многократного п/к введения каждые 4 недели наблюдалось приблизительно двукратное накопление препарата в равновесном состоянии.
Распределение
После однократного в/в введения меполизумаба пациентам с тяжелой бронхиальной астмой средний Vd составлял от 55 до 85 мл/кг.
Метаболизм
Меполизумаб представляет собой гуманизированное моноклональное антитело IgG1, которое расщепляется при воздействии протеолитических ферментов, широко распространенных не только в ткани печени, но и во всем организме.
Выведение
После однократного в/в введения препарата пациентам с тяжелой бронхиальной астмой средний общий клиренс (CL) составлял от 1.9 до 3.3 мл/сут/кг, а средний конечный T1/2 — примерно 20 сут. После п/к введения меполизумаба средний конечный T1/2 составлял от 16 до 22 сут. В популяционном фармакокинетическом анализе расчетный общий клиренс меполизумаба составлял 3.1 мл/сут/кг.
Фармакокинетика у особых групп пациентов
Пациенты пожилого возраста (65 лет и старше). Данные по фармакокинетике меполизумаба при применении у пациентов пожилого возраста (≥65 лет) в клинических исследованиях ограничены (N=90). Однако в популяционном фармакокинетическом анализе не выявлены признаки влияния возраста (12-82 года) на фармакокинетику меполизумаба.
Пациенты с нарушением функции почек. Официальные исследования по изучению влияния нарушения функции почек на фармакокинетику меполизумаба не проводились. На основании популяционного фармакокинетического анализа коррекция дозы у пациентов с КК 50-80 мл/мин не требуется. Данные для пациентов с КК <50 мл/мин ограничены.
Пациенты с нарушением функции печени. Официальные исследования по изучению влияния нарушения функции печени на фармакокинетику меполизумаба не проводились. Поскольку меполизумаб расщепляется широко распространенными протеолитическими ферментами, которые присутствуют не только в ткани печени, маловероятно, что изменения функции печени окажут какое-либо влияние на выведение из организма меполизумаба.
Дети
Данные по фармакокинетике у детей ограничены (59 пациентов с эозинофильным эзофагитом, 55 пациентов с тяжелой бронхиальной астмой). Фармакокинетику меполизумаба при в/в введении оценивали в популяционном фармакокинетическом анализе в исследовании, проведенном с участием детей в возрасте 2-17 лет с эозинофильным эзофагитом. Фармакокинетика у детей была в значительной степени прогнозируемой на основании данных, полученных у взрослых, после коррекции по массе тела. Фармакокинетика меполизумаба у подростков с тяжелой бронхиальной астмой, включенных в исследования III фазы, соответствовала фармакокинетике у взрослых.
В открытом неконтролируемом исследовании продолжительностью 12 недель оценивали фармакокинетику после п/к введения у детей в возрасте от 6 до 11 лет включительно с тяжелой бронхиальной астмой. Фармакокинетика у детей в целом соответствовала данным у взрослых и подростков после введения поправки на массу тела и с учетом биодоступности. Абсолютная биодоступность при п/к введении является полной, в то время как у взрослых и подростков она составляет 76%. Содержание препарата в сыворотке крови после п/к введения в дозе 40 мг (при массе тела <40 кг) или 100 мг (при массе тела ≥40 кг) было в 1.32 и 1.97 раза выше, чем у взрослых после введения дозы 100 мг.
Изучение режима дозирования, предусматривающего п/к введение в дозе 40 мг каждые 4 недели, у детей в возрасте 6-11 лет при широком диапазоне массы тела 15-70 кг, с использованием методов моделирования фармакокинетических процессов и имитационного моделирования, позволяет прогнозировать, что содержание препарата в сыворотке крови при этом режиме дозирования будет в среднем составлять около 38% от данного параметра у взрослых после введения дозы 100 мг. Этот режим дозирования препарата считается приемлемым благодаря широкому терапевтическому индексу меполизумаба.
Показания препарата
Нукала
- в качестве дополнительной поддерживающей терапии тяжелой бронхиальной астмы с эозинофильным профилем воспаления дыхательных путей у пациентов в возрасте от 6 лет и старше;
- лечение эозинофильного гранулематоза с полиангиитом (синдром Чарджа-Стросса) у пациентов старше 18 лет.
Режим дозирования
Препарат Нукала должен назначать врач, имеющий опыт диагностики и терапии тяжелой бронхиальной астмы с эозинофильным профилем воспаления дыхательных путей, эозинофильного гранулематоза с полиангиитом (синдром Чарджа-Стросса).
Препарат Нукала предназначен только для п/к введения, которое должен осуществлять медицинский работник. Препарат можно вводить в область плеча, бедра или живота.
Порошок следует растворить перед введением, восстановленный раствор необходимо использовать немедленно.
Тяжелая бронхиальная астма
У взрослых и детей в возрасте 12 лет и старше рекомендуемая доза составляет 100 мг меполизумаба п/к 1 раз каждые 4 недели; у детей в возрасте от 6 до 12 лет рекомендуемая доза составляет 40 мг меполизумаба п/к 1 раз каждые 4 недели.
Один флакон с препаратом Нукала предназначен для применения у одного пациента, неиспользованный остаток восстановленного раствора препарата подлежит уничтожению.
Препарат Нукала предназначен для длительной терапии. Врач должен оценивать необходимость продолжения терапии по крайней мере ежегодно на основании степени тяжести заболевания у пациента и результатов контроля обострений.
Эозинофильный гранулематоз с полиангиитом (синдром Чарджа-Стросса)
Рекомендуемая доза составляет 300 мг меполизумаба п/к 3 отдельными инъекциями по 100 мг меполизумаба п/к 1 раз каждые 4 недели. При введении нескольких инъекций одновременно расстояние между местами введения инъекций должно быть не менее 5 см.
Для получения дозы 300 мг следует растворить и ввести содержимое 3 отдельных флаконов, следуя указаниям, представленным в разделе «Рекомендации по применению» для введения дозы 100 мг.
Особые группы пациентов
Безопасность и эффективность применения препарата Нукала у детей в возрасте до 6 лет не установлена.
У пациентов пожилого возраста (65 лет и старше) коррекции дозы не требуется.
У пациентов с нарушением функции почек и печени коррекции дозы не требуется.
Рекомендации по применению
Препарат Нукала не содержит консервантов, поэтому его восстановление необходимо проводить в асептических условиях.
Инструкция по восстановлению
1. Препарат во флаконе восстанавливают с помощью 1.2 мл стерильной воды для инъекций. Предпочтительно использование шприца объемом 2-3 мл и иглы калибром 21. Струя стерильной воды для инъекций должна быть направлена вертикально в центр лиофилизата. Восстановление проводят при комнатной температуре, аккуратно вращая флакон круговыми движениями на протяжении 10 сек с 15-секундными интервалами до растворения препарата.
Примечание: в процессе приготовления восстановленный раствор встряхивать нельзя, т.к. это может привести к образованию пены или осаждению препарата. Процесс восстановления обычно занимает 5 мин после добавления стерильной воды, но может продлиться дольше.
2. В случае использования механического устройства для восстановления препарата (вихревой мешалки) восстановление может быть проведено при перемешивании со скоростью 450 оборотов/мин продолжительностью не более 10 мин. Также приемлемо перемешивание со скоростью 1000 оборотов/мин продолжительностью не более 5 мин.
3. Перед применением восстановленный раствор визуально проверяют на наличие посторонних частиц и прозрачность. Раствор должен быть от прозрачного до опалесцирующего, от бесцветного до светло-желтого или светло-коричневого цвета, не должен содержать видимых частиц. Однако ожидается и допускается присутствие в растворе мелких пузырьков воздуха. При наличии посторонних частиц в растворе или если раствор выглядит мутным или имеет молочно-белый цвет, раствор использовать нельзя.
4. Если восстановленный раствор препарата не использован немедленно, его необходимо:
• защищать от солнечного света;
• хранить при температуре ниже 30°С, не замораживать;
• утилизировать, если раствор не использован в течение 8 ч после восстановления.
Введение дозы 100 мг
1. Для п/к введения предпочтительно использование полипропиленового шприца объемом 1 мл с одноразовой иглой калибром 21-27×0.5 дюйма (13 мм).
2. Непосредственно перед введением набирают в шприц 1 мл восстановленного раствора. Во время процедуры восстановленный раствор препарата встряхивать нельзя, поскольку это может привести к образованию пены или осаждению препарата.
3. Вводят п/к в область плеча, бедра или живота 1 мл раствора (эквивалентно 100 мг меполизумаба).
Введение дозы 40 мг
1. Для п/к введения предпочтительно использование полипропиленового шприца объемом 1 мл с одноразовой иглой калибром 21-27×0.5 дюйма (13 мм).
2. Непосредственно перед введением набирают в шприц 0.4 мл восстановленного раствора. Во время процедуры восстановленный раствор препарата встряхивать нельзя, поскольку это может привести к образованию пены или осаждению препарата. Оставшийся раствор утилизируют.
3. Вводят п/к в область плеча, бедра или живота 0.4 мл раствора (эквивалентно 40 мг меполизумаба).
Утилизация
Весь неиспользованный препарат или отходы следует утилизировать в соответствии с местными требованиями.
Побочное действие
Тяжелая бронхиальная астма
В клинических исследованиях с участием пациентов с тяжелой бронхиальной астмой наиболее часто регистрируемыми нежелательными реакциями во время терапии являлись головная боль, реакции в месте инъекции и боль в спине.
Перечень нежелательных реакций
В общей сложности 915 пациентов с тяжелой бронхиальной астмой получали меполизумаб п/к или в/в во время трех плацебо-контролируемых клинических исследований продолжительностью 24-52 недели. Ниже представлены нежелательные реакции, зарегистрированные в двух плацебо-контролируемых исследованиях у пациентов, получавших меполизумаб п/к в дозе 100 мг (N=263). Профиль безопасности меполизумаба при применении у пациентов с тяжелой бронхиальной астмой (N=998) в течение медианы времени 2.8 лет (диапазон от 4 недель до 4.5 лет) в открытом дополнительном исследовании соответствовал профилю безопасности, наблюдавшемуся в плацебо-контролируемых исследованиях.
Частота встречаемости нежелательных реакций определяется следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000), очень редко (<1/10000, включая отдельные случаи) и частота неизвестна (невозможно оценить на основании доступных данных).
Инфекционные и паразитарные заболевания: часто — фарингит, инфекции нижних дыхательных путей, инфекции мочевыводящих путей.
Со стороны иммунной системы: часто — реакции гиперчувствительности (системные аллергические)*; редко — анафилаксия**.
Со стороны нервной системы: очень часто — головная боль.
Со стороны дыхательной системы: часто — заложенность носа.
Со стороны пищеварительной системы: часто — боль в верхних отделах живота.
Со стороны кожи и подкожных тканей: часто — экзема.
Со стороны костно-мышечной системы: часто — боль в спине.
Общие расстройства и нарушения в месте введения: часто — местные реакции в месте инъекции, пирексия, реакции на введение препарата (системные неаллергические)***.
* Системные реакции, в т.ч. реакции гиперчувствительности, регистрировали с общей частотой, сопоставимой с частотой при применении плацебо. Примеры сопутствующих проявлений и описание времени до их развития см. в разделе «Особые указания», подраздел «Гиперчувствительность и реакции на введение препарата».
** Из спонтанных сообщений в пострегистрационном периоде.
*** Наиболее распространенными проявлениями, связанными с сообщениями о системных неаллергических реакциях на введение препарата, являлись сыпь, приливы жара и миалгия; эти проявления регистрировали нечасто и у <1% пациентов, получавших меполизумаб п/к в дозе 100 мг.
Эозинофильный гранулематоз с полиангиитом (синдром Чарджа-Стросса)
В двойном слепом плацебо-контролируемом клиническом исследовании у пациентов с эозинофильным гранулематозом с полиангиитом (синдром Чарджа-Стросса) (300 мг меполизумаба, N=136) не выявлено побочных реакций дополнительно к побочным реакциям, зарегистрированным в клинических исследованиях у пациентов с тяжелой бронхиальной астмой.
Описание отдельных нежелательных реакций
Реакции в месте инъекции
В двух плацебо-контролируемых исследованиях частота развития местных реакций в месте инъекции при п/к введении меполизумаба в дозе 100 мг и плацебо составляла 8% и 3% соответственно. Все эти явления были несерьезными, легкой или умеренной степени выраженности, и большинство разрешились в течение нескольких дней. Местные реакции в месте инъекции возникали преимущественно в начале терапии и во время первых 3 инъекций, сообщения о развитии реакций при последующих инъекциях регистрировали реже. Наиболее распространенные проявления этих явлений включали боль, эритему, припухлость, зуд и ощущение жжения.
Дети
Тридцать семь пациентов в возрасте 12-17 лет были включены в четыре плацебо-контролируемые исследования (25 получали меполизумаб в/в или п/к) в течение 24-52 недель. Тридцать шесть пациентов в возрасте 6-11 лет получали меполизумаб п/к в открытом исследовании в течение 12 недель. После 8-недельного перерыва в терапии 30 пациентов из данной группы продолжили лечение меполизумабом в течение следующих 52 недель. Профиль нежелательных явлений был сходным с профилем, наблюдаемым у взрослых. Не были выявлены дополнительные нежелательные реакции.
Противопоказания к применению
- повышенная чувствительность к меполизумабу или любому другому компоненту, входящему в состав препарата.
Применение при беременности и кормлении грудью
Беременность
Данные по применению меполизумаба у беременных женщин ограничены (менее 300 исходов беременности).
Меполизумаб проникает через плацентарный барьер у обезьян. Результаты исследований на животных не указывают на наличие репродуктивной токсичности. Влияние меполизумаба на плод человека неизвестно.
В качестве меры предосторожности желательно избегать применения препарата Нукала во время беременности. Препарат Нукала следует применять у беременных женщин только в случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
Отсутствуют данные, касающиеся выделения меполизумаба с грудным молоком у человека. Однако у яванских макак меполизумаб выделялся с грудным молоком в концентрациях, которые составляли менее 0.5% от концентраций, определенных в плазме крови.
Решение о прекращении грудного вскармливания или прекращении применения препарата Нукала должно быть принято с учетом пользы грудного вскармливания для ребенка и терапии для матери.
Фертильность
Данные по влиянию на фертильность человека отсутствуют. В исследованиях на животных было продемонстрировано отсутствие нежелательных эффектов терапии антителами к ИЛ-5 на фертильность.
Применение при нарушениях функции печени
Пациентам с нарушением функции печени коррекция дозы не требуется.
Применение при нарушениях функции почек
Пациентам с нарушением функции почек коррекция дозы не требуется.
Применение у детей
Безопасность и эффективность применения препарата Нукала у детей в возрасте до 6 лет не установлена.
Применение у пожилых пациентов
Пациентам пожилого возраста (65 лет и старше) коррекция дозы не требуется.
Особые указания
Препарат Нукала не следует применять для лечения обострения бронхиальной астмы.
Во время терапии препаратом Нукала могут развиваться связанные с течением бронхиальной астмы нежелательные явления или обострения. Пациентам следует рекомендовать обратиться за медицинской помощью, если после начала терапии препаратом Нукала симптомы бронхиальной астмы остаются неконтролируемыми или отмечено их ухудшение.
Не рекомендуется резкая отмена кортикостероидов после начала терапии препаратом Нукала. Снижение дозы кортикостероидов, при необходимости, должно быть постепенным и происходить под наблюдением врача.
Гиперчувствительность и реакции на введение препарата
После введения препарата Нукала наблюдались острые системные реакции и системные реакции замедленного типа, включая реакции гиперчувствительности (например, анафилаксия, крапивница, ангионевротический отек, сыпь, бронхоспазм, артериальная гипотензия). Эти реакции, как правило, развиваются в течение нескольких часов после введения препарата, но в некоторых случаях они возникают с задержкой (т.е. обычно через несколько дней). Эти реакции могут возникать впервые после длительной терапии.
Паразитарные инфекции
Эозинофилы могут принимать участие в иммунном ответе на некоторые гельминтные инфекции. Пациенты с существующими гельминтными инфекциями должны получить лечение по поводу инфекции до начала терапии препаратом Нукала. В случае развития инфекции у пациентов во время применения препарата Нукала и отсутствия ответа на противогельминтную терапию, следует рассмотреть вопрос о временном прекращении терапии препаратом Нукала.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Нукала не оказывает влияния или оказывает незначительное влияние на способность к управлению транспортными средствами и работе с механизмами.
Передозировка
В клинической практике случаи передозировки меполизумабом не зарегистрированы.
В клиническом исследовании с участием пациентов с эозинофильной астмой при в/в однократном введении в дозах до 1500 мг не наблюдалось признаков дозозависимой токсичности.
Лечение: отсутствует специфическое лечение передозировки меполизумабом. В случае передозировки при необходимости следует проводить поддерживающее лечение с надлежащим мониторингом. Дальнейшее лечение следует проводить по клиническим показаниям.
Лекарственное взаимодействие
Официальные исследования по оценке взаимодействия меполизумаба с другими лекарственными препаратами не проводились.
Изоферменты системы цитохрома Р450, эффлюксные насосы и механизмы связывания с белком не принимают участие в клиренсе меполизумаба. Установлено, что повышенные концентрации провоспалительных цитокинов (например, ИЛ-6) посредством взаимодействия с соответствующими рецепторами на гепатоцитах подавляют образование изоферментов CYP450 и переносчиков лекарственных препаратов, однако повышение концентрации провоспалительных маркеров при тяжелой рефрактерной эозинофильной астме является минимальным, и признаки экспрессии рецепторов ИЛ-5 альфа на гепатоцитах отсутствуют. Поэтому вероятность лекарственного взаимодействия с меполизумабом оценивается как низкая.
Условия хранения препарата Нукала
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре не выше 25°С; не замораживать.
Срок годности препарата Нукала
Срок годности — 4 года. Не применять после истечения срока годности, указанного на упаковке.
Восстановленный раствор хранить не более 8 ч при температуре ниже 30°С; не замораживать.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ГЛАКСОСМИТКЛЯЙН ТРЕЙДИНГ АО
(Россия)

|
|
125167 Москва |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Нукала — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-004794
Торговое наименование препарата:
Нукала /Nucala.
Международное непатентованное наименование:
меполизумаб / mepolizumab.
Лекарственная форма:
лиофилизат для приготовления раствора для подкожного введения.
СОСТАВ
|
Наименование |
Количество в 1 флаконе1, мг |
Количество в 1 дозе, мг |
|
Действующее вещество |
||
|
Меполизумаб |
1442 |
100 |
|
Вспомогательные вещества |
||
|
Сахароза |
197,5-256,8 |
160 |
|
Динатрия гидрофосфат гептагидрат |
8,82-11,47 |
7,15 |
|
Полисорбат 80 |
0,82-1,07 |
0,67 |
|
Хлористоводородная кислота |
q.s. до pH 6,5-7,5 |
Не применимо |
Примечания:
1. Для вспомогательных веществ указаны минимальное и максимальное количества в 1 флаконе.
2. Препарат содержит 144 мг в 1 флаконе; указанное на этикетке количество 100 мг/флакон основано на том, что извлекаемый объем составляет 1,0 мл при восстановлении лиофилизата. Избыток 44 % позволяет получить извлекаемый объем 1,0 мл после восстановления с помощью 1,2 мл стерильной воды для инъекций. Указанный объем обуславливает распределение твердых частиц в окончательном объеме, концентрация полученного раствора составляет 100 мг/мл. Избыток не включен.
ОПИСАНИЕ
Однородная лиофилизированная сухая масса белого цвета.
Восстановленный раствор: прозрачный или опалесцирующий раствор от бесцветного до светло-желтого или светло-коричневого цвета.
ХАРАКТЕРИСТИКА ПРЕПАРАТА
Меполизумаб представляет собой гуманизированное моноклональное антитело (IgGl, каппа), направленное против интерлейкина-5 (ИЛ-5) человека, продуцируемое клетками яичника китайского хомячка с помощью технологии рекомбинации ДНК.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА
Препараты для лечения обструктивных заболеваний дыхательных путей, прочие препараты для лечения обструктивных заболеваний дыхательных путей для системного применения.
Код ATX: R03DX09.
Фармакологические свойства
Фармакодинамика
Механизм действия
Меполизумаб представляет собой гуманизированное моноклональное антитело (IgGl, каппа), направленное против интерлейкина-5 (ИЛ-5) человека с высоким сродством и специфичностью. ИЛ-5 является основным цитокином, который отвечает за рост, дифференцировку, привлечение, активацию и выживание эозинофилов. Меполизумаб ингибирует биоактивность ИЛ-5 в наномолярных дозах посредством блокирования связывания ИЛ-5 с альфа цепью рецепторного комплекса ИЛ-5, экспрессируемого на клеточной поверхности эозинофилов, что приводит к ингибированию передачи сигнала ИЛ-5 и снижению продукции и выживаемости эозинофилов.
Фармакодинамические эффекты
После подкожного введения препарата в дозе 100 мг каждые 4 недели на протяжении 32 недель количество эозинофилов в крови снизилось со среднего геометрического исходного количества 290 до 40 клеток/мкл (N=182), что соответствовало снижению на 84 % по сравнению с плацебо. Данную величину снижения наблюдали в течение 4 недель терапии.
Иммуногенностъ
В соответствии с возможными иммуногенными свойствами белковых и пептидных препаратов, у пациентов после проведения терапии могут появиться антитела к меполизумабу. В целом у 15 из 260 (6%) пациентов, получавших препарат подкожно в дозе 100 мг, появились антитела к меполизумабу после введения, как минимум, одной дозы меполизумаба. Нейтрализующие антитела были выявлены у одного пациента, получавшего меполизумаб. Антитела к меполизумабу не оказывали заметного влияния на фармакокинетику или фармакодинамику меполизумаба у большинства пациентов, также не было отмечено корреляции между титрами антител и изменением уровня эозинофилов.
Фармакокинетика
После подкожного введения пациентам с бронхиальной астмой меполизумаб проявил примерно пропорциональную дозе фармакокинетику в диапазоне доз от 12,5 мг до 250 мг. Всасывание
После подкожного введения здоровым добровольцам или пациентам с бронхиальной астмой меполизумаб всасывался медленно с медианой времени до достижения максимальной концентрации в плазме крови (Тмах) в диапазоне от 4 до 8 дней.
После однократного подкожного введения в область живота, бедра или плеча здоровым добровольцам абсолютная биодоступность меполизумаба составила 64%, 71 % и 75%, соответственно. У пациентов с бронхиальной астмой абсолютная биодоступность меполизумаба при подкожном введении в область плеча составляла 74-80 %. После многократного подкожного введения каждые 4 недели наблюдалось приблизительно двукратное накопление препарата в равновесном состоянии.
Распределение
После однократного внутривенного введения меполизумаба пациентам с бронхиальной астмой средний объем распределения составлял от 55 до 85 мл/кг.
Метаболизм
Меполизумаб представляет собой гуманизированное моноклональное антитело IgGl, которое расщепляется при воздействии протеолитических ферментов, широко распространенных не только в ткани печени, но и во всем организме.
Выведение
После однократного внутривенного введения препарата пациентам с бронхиальной астмой средний общий клиренс (CL) составлял от 1,9 до 3,3 мл/сут/кг, а средний конечный период полувыведения— примерно 20 дней. После подкожного введения меполизумаба средний конечный период полувыведения (t1/2) составлял от 16 до 22 дней. В популяционном фармакокинетическом анализе расчетный общий клиренс меполизумаба составлял 3,1 мл/сут/кг.
Особые группы пациентов
Пациенты пожилого возраста (в возрасте 65 лет и старше)
Данные по фармакокинетике меполизумаба при применении у пациентов пожилого возраста (> 65 лет) в клинических исследованиях ограничены (N=90). Однако в популяционном фармакокинетическом анализе не выявлены признаки влияния возраста (12-82 года) на фармакокинетику меполизумаба.
Пациенты с нарушением функции почек
Официальные исследования по изучению влияния нарушения функции почек на фармакокинетику меполизумаба не проводились. На основании популяционного фармакокинетического анализа коррекция дозы пациентам с клиренсом креатинина 50-80 мл/мин не требуется. Данные по пациентам с клиренсом креатинина < 50 мл/мин ограничены.
Пациенты с нарушением функции печени
Официальные исследования по изучению влияния нарушения функции печени на фармакокинетику меполизумаба не проводились. Поскольку меполизумаб расщепляется широко распространенными протеолитическими ферментами, которые присутствуют не только в ткани печени, маловероятно, что изменения функции печени окажут какое-либо влияние на выведение из организма меполизумаба.
Показания к применению
Препарат Нукала показан в качестве дополнительной поддерживающей терапии тяжелой эозинофильной астмы пациентов в возрасте от 6 лет и старше.
Противопоказания
Гиперчувствительность к меполизумабу или любому другому компоненту, входящему в состав препарата.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО
Вскармливания, влияние на фертильность
Беременность
Данные по применению меполизумаба у беременных женщин ограничены (менее 300 исходов беременности).
Меполизумаб проникает через плацентарный барьер у обезьян. Результаты исследований на животных не указывают на наличие репродуктивной токсичности. Влияние меполизумаба на плод человека неизвестно.
В качестве меры предосторожности желательно избегать применения препарата Нукала во время беременности. Во время беременности препарат Нукала следует применять только в случае, если потенциальная польза для матери превышает потенциальный риск для плода.
Период грудного вскармливания
Отсутствуют данные, касающиеся выделения меполизумаба с грудным молоком у человека. Однако у яванских макак меполизумаб выделялся в грудное молоко в концентрациях, которые составляли менее 0,5 % от концентраций, определенных в плазме крови.
Решение о прекращении грудного вскармливания или прекращении применения препарата Нукала должно быть принято с учетом пользы грудного вскармливания для ребенка и терапии для матери.
Фертильность
Данные по влиянию на фертильность человека отсутствуют. В исследованиях на животных было продемонстрировано отсутствие нежелательных эффектов терапии антителами к ИЛ-5 на фертильность.
Способ применения и дозы
Препарат Нукала должны назначать врачи, имеющие опыт диагностики и терапии тяжелой рефрактерной эозинофильной бронхиальной астмы.
Препарат Нукала предназначен только для подкожного введения, которое должен осуществлять медицинский работник. Препарат может быть введен в область плеча, бедра или живота.
Порошок следует восстановить перед введением, восстановленный раствор необходимо использовать немедленно. Инструкции по восстановлению препарата перед применением см. раздел «Рекомендации по применению».
Взрослые
Рекомендуемая доза составляет 100 мг меполизумаба в виде подкожной инъекции один раз каждые 4 недели.
Препарат Нукала предназначен для длительной терапии. Врач должен оценивать необходимость продолжения терапии, по крайней мере, ежегодно на основании степени тяжести заболевания у пациента и результатов контроля обострений.
Особые группы пациентов
Дети (до 18 лет)
Безопасность и эффективность применения препарата Нукала у детей и подростков до 18 лет не установлена.
Пациенты пожилого возраста (в возрасте 65 лет и старше)
У пациентов пожилого возраста коррекция дозы не требуется (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика»).
Пациенты с нарушением функции почек
Пациентам с нарушением функции почек коррекция дозы не требуется (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика»).
Пациенты с нарушением функции печени
Пациентам с нарушением функции печени коррекция дозы не требуется (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика»).
Рекомендации по применению
Препарат Нукала не содержит консервантов, поэтому его восстановление необходимо проводить в асептических условиях.
Инструкция по восстановлению
1. Препарат во флаконе восстанавливают с помощью 1,2 мл стерильной воды для инъекций. Предпочтительно использование шприца объемом 2-3 мл и иглы калибром 21. Поток стерильной воды для инъекций должен быть направлен вертикально в центр лиофилизата. Восстановление проводят при комнатной температуре, аккуратно вращая флакон круговыми движениями на протяжении 10 секунд с 15-секундными интервалами до растворения препарата.
Примечание: во время процедуры восстановленный раствор встряхивать нельзя, поскольку это может привести к образованию пены или осаждению препарата. Процесс восстановления обычно занимает 5 минут после добавления стерильной воды, но может продлиться дольше.
2. В случае использования механического устройства для восстановления препарата (вихревой мешалки) восстановление может быть проведено при перемешивании со скоростью 450 оборотов в минуту продолжительностью не более 10 минут. Также приемлемо перемешивание со скоростью 1000 оборотов в минуту продолжительностью не более 5 минут.
3. До применения восстановленный раствор визуально проверяют на наличие посторонних частиц и прозрачность. Раствор должен быть от прозрачного до опалесцирующего, от бесцветного до бледно-желтого или светло-коричневого цвета, не должен содержать видимых частиц. Однако ожидается и допускается присутствие в растворе мелких пузырьков воздуха. При наличии посторонних частиц в растворе или если раствор выглядит мутным или имеет молочно-белый цвет, раствор использовать нельзя.
4. Если восстановленный раствор препарата не использован немедленно, его необходимо:
- защищать от солнечного света;
- хранить при температуре ниже 30°С, не замораживать;
- утилизировать, если раствор не использован в течение 8 часов после восстановления.
Введение
1. Для подкожного введения предпочтительно использование полипропиленового шприца объемом 1 мл с одноразовой иглой калибром 21-27 х 0,5 дюйма (13 мм).
2. Непосредственно перед введением набирают в шприц 1 мл восстановленного раствора. Во время процедуры восстановленный раствор препарата встряхивать нельзя, поскольку это может привести к образованию пены или осаждению препарата.
3. Вводят подкожно в область плеча, бедра или живота 1 мл раствора (эквивалентно 100 мг меполизумаба).
Утилизация
Весь неиспользованный препарат или отходы следует утилизировать в соответствии с местными требованиями.
Побочное действие
Краткий обзор профиля безопасности
В клинических исследованиях с участием пациентов с тяжелой рефрактерной эозинофильной бронхиальной астмой наиболее часто регистрируемыми нежелательными реакциями во время терапии являлись головная боль, реакции в месте инъекции и боль в спине.
Перечень нежелательных реакций
В общей сложности, 915 пациентов с тяжелой рефрактерной эозинофильной бронхиальной астмой получали меполизумаб подкожно (п/к) или внутривенно (в/в) во время клинических исследований продолжительностью 24-52 недели. Ниже представлены нежелательные реакции, зарегистрированные в двух плацебо-контролируемых исследованиях у пациентов, получавших меполизумаб подкожно в дозе 100 мг (N = 263).
Частота встречаемости нежелательных реакций определяется следующим образом: очень часто (> 1/10), часто (> 1/100 и < 1/10), нечасто (> 1/1 000 и < 1/100), редко (> 1/10 000 и < 1/1 000), очень редко (< 1/10 000, включая отдельные случаи) и неизвестно (невозможно оценить на основании доступных данных).
Частота встречаемости нежелательных реакций
Инфекционные и паразитарные заболевания
Часто: фарингит, инфекции нижних дыхательных путей, инфекции мочевыводящих путей.
Нарушения со стороны иммунной системы
Часто: реакции гиперчувствительности (системные аллергические)*.
Редко: анафилаксия**.
Нарушения со стороны нервной системы
Очень часто: головная боль.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Часто: заложенность носа.
Нарушения со стороны желудочно-кишечного тракта
Часто: боль в верхних отделах живота.
Нарушения со стороны кожи и подкожных тканей Часто: экзема.
Нарушения со стороны скелетно-мышечной и соединительной тканей
Часто: боль в спине.
Общие расстройства и нарушения в месте введения
Часто: пирексия, местные реакции в месте инъекции, реакции на введение препарата (системные неаллергические)***.
*Системные реакции, в том числе реакции гиперчувствительности, регистрировали с общей частотой, сопоставимой с частотой при применении плацебо. Примеры сопутствующих проявлений и описание времени до их развития см. в разделе «Особые указания», подраздел «Гиперчувствительность и реакции на введение препарата».
**Из спонтанных сообщений в пострегистрационном периоде.
***Наиболее распространенными проявлениями, связанными с сообщениями о системных неаллергических реакциях на введение препарата, являлись сыпь, приливы жара и миалгия; эти проявления регистрировали нечасто и у < 1 % пациентов, получавших меполизумаб подкожно в дозе 100 мг.
Описание отдельных нежелательных реакций
Местные реакции в месте инъекции
В двух плацебо-контролируемых исследованиях частота развития местных реакций в месте инъекции при подкожном введении меполизумаба в дозе 100 мг и плацебо составляла 8 % и 3 %, соответственно. Все эти явления были несерьезными, легкой или умеренной степени выраженности, и большинство разрешились в течение нескольких дней. Местные реакции в месте инъекции возникали преимущественно в начале терапии и во время первых 3 инъекций, сообщения о развитии реакций при последующих инъекциях регистрировали реже. Наиболее распространенные проявления этих явлений включали боль, эритему, припухлость, зуд и ощущение жжения.
Дети
Доступные в настоящее время данные клинических исследований у детей крайне ограничены для характеристики профиля безопасности применения меполизумаба в этой популяции. Однако ожидается, что частота встречаемости, тип и степень тяжести нежелательных реакций в популяции детей аналогичны таковым, наблюдаемым у взрослых.
ПЕРЕДОЗИРОВКА
В клинической практике случаи передозировки меполизумабом не зарегистрированы.
В клиническом исследовании с участием пациентов с эозинофильной бронхиальной астмой однократные дозы до 1500 мг вводили внутривенно без признаков дозозависимой токсичности.
Лечение
Отсутствует специфическое лечение передозировки меполизумабом. В случае передозировки при необходимости следует проводить поддерживающее лечение с надлежащим мониторингом.
Дальнейшее лечение следует проводить по клиническим показаниям.
Взаимодействие с другими лекарственными препаратами
Официальные исследования по оценке взаимодействия меполизумаба с другими лекарственными препаратами не проводились.
Ферменты системы цитохрома Р450, эффлюксные насосы и механизмы связывания с белком не принимают участие в клиренсе меполизумаба. Установлено, что повышенные концентрации провоспалительных цитокинов (например, ИЛ-6) посредством взаимодействия с соответствующими рецепторами на гепатоцитах подавляют образование изоферментов CYP450 и переносчиков лекарственных препаратов, однако повышение концентрации провоспалительных маркеров при тяжелой бронхиальной астме является минимальным, и признаки экспрессии рецепторов ИЛ-5 альфа на гепатоцитах отсутствуют. Поэтому вероятность лекарственных взаимодействий с меполизумабом оценивается как низкая.
ОСОБЫЕ УКАЗАНИЯ
Препарат Нукала не следует применять для лечения обострения бронхиальной астмы.
Во время терапии препаратом Нукала могут развиваться связанные с течением бронхиальной астмы нежелательные явления или обострения. Пациентам следует рекомендовать обратиться за медицинской помощью, если после начала терапии препаратом Нукала симптомы бронхиальной астмы остаются неконтролируемыми или отмечено их ухудшение.
Не рекомендуется резкая отмена кортикостероидов после начала терапии препаратом Нукала. Снижение дозы кортикостероидов, при необходимости, должно быть постепенным и происходить под наблюдением врача.
Гиперчувствительность и реакции на введение препарата
После введения препарата Нукала наблюдались острые и замедленные системные реакции, включая реакции гиперчувствительности (например, анафилаксия, крапивница, ангионевротический отек, сыпь, бронхоспазм, гипотензия). Эти реакции, как правило, развиваются в течение нескольких часов после введения препарата, но в некоторых случаях они возникали с задержкой (т.е. обычно через несколько дней). Эти реакции могут возникать впервые после длительной терапии (см. раздел «Побочное действие»). Паразитарные инфекции
Эозинофилы могут принимать участие в иммунном ответе на некоторые гельминтные инфекции. Пациенты с существующими гельминтными инфекциями должны получить лечение по поводу инфекции до начала терапии препаратом Нукала. В случае развития инфекции у пациентов во время применения препарата Нукала и отсутствия ответа на проти во гельминтную терапию, следует рассмотреть вопрос о временном прекращении терапии препаратом Нукала.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Нукала не оказывает влияния или оказывает незначительное влияние на способность к управлению транспортными средствами и работе с механизмами.
ФОРМА ВЫПУСКА
Лиофилизат для приготовления раствора для подкожного введения, 100 мг.
Количество лиофилизированной сухой массы, требуемое для обеспечения вводимой дозы 100 мг меполизумаба, во флакон вместимостью 10 мл из прозрачного стекла типа 1 с пробкой из бромбутилового каучука и серым алюминиевым обжимным колпачком с пластиковой отрывной крышкой. 1 флакон с инструкцией по применению в пачку картонную.
Количество лиофилизированной сухой массы, требуемое для обеспечения вводимой дозы 100 мг меполизумаба, во флакон вместимостью 10 мл из прозрачного стекла типа 1 с пробкой из бромбутилового каучука и серым алюминиевым обжимным колпачком с пластиковой отрывной крышкой. 1 флакон с инструкцией по применению в пачку картонную. 3 пачки картонные в прозрачной термоусадочной пленке.
Срок годности
2 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия хранения
Хранить при температуре не выше 25°С в защищенном от света месте. Не замораживать.
Восстановленный раствор хранить не более 8 часов при температуре ниже 30°С. Не замораживать.
Хранить в недоступном для детей месте.
Условия транспортирования
Транспортировать при температуре не выше 25°С в защищенном от света месте. Не замораживать.
Условия отпуска
Отпускают по рецепту.
Производитель
Производитель готовой лекарственной формы
«ГлаксоСмитКляйн Мэньюфэкчуринг С.п.А.», Италия
Фасовщик (первичная упаковка)
«ГлаксоСмитКляйн Мэньюфэкчуринг С.п.А.», Италия
Упаковщик (вторичная (потребительская) упаковка)
«ГлаксоСмитКляйн Мэньюфэкчуринг С.п.А.», Италия
Производитель (выпускающий контроль качества)
«ГлаксоСмитКляйн Мэньюфэкчуринг С.п.А.» / GlaxoSmithKline Manufacturing S.p.A.
Страда Провинчиале Асолана №90 (Сан Поло)— 43056 Торриле (ПР), Италия / Strada Provinciate Asolana N. 90 (loc. San Polo) — 43056 Torrile (PR), Italy
НАИМЕНОВАНИЕ И АДРЕС ДЕРЖАТЕЛЯ ИЛИ ВЛАДЕЛЬЦА РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
ЗАО «ГлаксоСмитКляйн Трейдинг» 119180, г. Москва, Якиманская наб., д. 2
Организация, принимающая претензии но качеству лекарственного препарата и сообщения о нежелательных реакциях:
ЗАО «ГлаксоСмитКляйн Трейдинг» , 121614, г. Москва, ул. Крылатская, д. 17, корп. 3, эт. 5
Бизнес-Парк «Крылатские холмы»
Тел.: (495) 777 89 00; факс: (495) 777 89 04
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Меполизумаб в лечении эозинофильного гранулематоза с полиангиитом
Эозинофильный гранулематоз с полиангиитом (ЭГПА; старое название – синдром ЧергаСтраусс) – это АНЦА-ассоциированный васкулит, характеризующийся сочетанием бронхиальной астмы/риносинусита и эозинофилии крови с поражением периферической нервной системы, почек, кожи, сердца и других органов. У трети больных определяются АНЦА к миелопероксидазе. Лечение ЭГПА начинают с глюкокортикостероидов ± иммуносупрессивных препаратов. При рефрактерном к стандартной терапии или рецидивирующем течении ЭГПА может быть использован генно-инженерный биологический препарат меполизумаб (300 мг подкожно каждые 4 недели), блокирующий взаимодействие интерлейкина (ИЛ)-5 с рецепторами на поверхности эозинофилов. ИЛ-5 – это основной цитокин, регулирующий дифференцировку, рост, активацию, выживаемость и миграцию эозинофилов. Эффективность и безопасность меполизумаба установлены в двойном слепом, плацебо-контролируемом клиническом исследовании у 136 больных ЭГПА. Применение ингибитора ИЛ-5 на фоне стандартной иммуносупрессивной терапии по сравнению с плацебо позволяло чаще достичь ремиссии заболевания, оказывало стероидосберегающее действие и снижало частоту обострений ЭГПА.
Эозинофильный гранулематоз с полиангиитом (ЭГПА) относится к группе системных васкулитов, ассоциированных с
антителами к цитоплазме нейтрофилов (АНЦА), и характеризуется сочетанием бронхиальной астмы/риносинусита и
эозинофилии крови с поражением периферической нервной системы, почек, кожи, сердца и других органов [1]. ЭГПА был
описан в 1951 году J. Churg и L. Strauss, которые наблюдали 13 пациентов с эозинофильной бронхиальной астмой и
некротизирующим васкулитом сосудов мелкого калибра в сочетании с периваскулярной эозинофильной инфильтрацией и
гранулематозом [2]. Долгое время заболевание именовали синдромом Черга-Страусс, однако на конференции в Чапел-Хилл
(2012 г.) было предложено новое название, соответствующее номенклатуре других АНЦА-ассоциированных васкулитов
(гранулематоза с полиангиитом и микроскопического полиангиита) и отражающее характер гистологических изменений при
ЭГПА [3,4].
Основой лечения ЭГПА являются глюкокортикостероиды, которые для индукции ремиссии назначают в дозе 0,5-1 мг/кг в
пересчете на преднизолон (не более 60 мг), в то время как иммунодепрессанты, в частности циклофосфамид, применяют
только при наличии неблагоприятных прогностических факторов (поражение сердца или желу дочно-кишечного тракта,
тяжелая пери ферическая полиневропатия, альвеолярное кровотечение и/или гломерулонефрит) или отсутствии ответа на
монотерапию глюкокортикостероидами [5]. Несмотря на поддерживающую иммуносупрессивную терапию у значительной части
больных ЭГПА развиваются рецидивы заболевания. Например, в крупном французском исследовании (n=383) рецидивы
васкулита были отмечены у 35,2% и 22,5% АНЦА-пози тивных и АНЦА-негативных больных, соответственно, а 5-летняя
безрецидивная выживаемость составила 58,1% и 67,8% [6]. Сходные данные были получены в нашем исследовании у 93
больных ЭГПА: 5-лет няя выживаемость без рецидивов, требовавших усиления иммуносупрессивной те рапии, составила
68,1% и 77,9% у пациентов с АНЦА-позитивным и АНЦА-негативным вариантами заболевания, соответственно [7]. Даже если
иммуносупрессивная терапия приводит к стойкой ремиссии системного васкулита, больные обычно не могут отказаться от
пероральных глюкокортикостероидов из-за обострений бронхиальной астмы и риносинусита, которые развиваются несмотря
на лечение ингаляционными глюкокортикостероидами и бронходилататорами. Например, в нашей когорте только 8% больных
смогли полностью прекратить прием пероральных глюкокортикостероидов [7]. Длительная терапия глюкокортикостероидами
даже в небольших дозах неизбежно приводит к развитию многочисленных побочных эффектов, в том числе остеопороза,
сахарного диабета, артериальной гипертонии, вторичной надпочечниковой недостаточности и др.
Приведенные данные диктуют необходимость разработки новых эффективных и безопасных препаратов для лечения ЭГПА.
Меполизумаб – это гуманизированное моноклональное антитело, которое блокирует взаимодействие интерлейкина (ИЛ)-5 с
рецепторами на поверхности эозинофилов и вызывает снижение продукции и выживаемости этих клеток. Эффективность и
безопасность меполизумаба в дозе 100 мг подкожно каждые 4 недели установлены у пациентов с тяжелой эозинофильной
бронхиальной астмой [8], а в 2020 г. препарат (в дозе 300 мг каждые 4 недели) был одобрен для применения у больных
ЭГПА на основании результатов двойного слепого, плацебо-контролируемого исследования MIRRA [9], которое обсуждается
в данной статье.
Критерии классификации ЭГПА
Практически у всех больных ЭГПА начинается с бронхиальной астмы и/или риносинусита. Особенностью бронхиальной
астмы у таких больных являются позднее развитие (после 40 лет), эозинофилия крови и среднетяжелое или тяжелое
течение. Спустя несколько лет после начала бронхиальной астмы у пациентов появляются различные системные
проявления, которые, как правило, сочетаются с увеличением эозинофилии крови (доля эозинофилов в общем анализе
крови может достигать 50-70%) и могут быть связаны с эозинофильной инфильтрацией тканей (эозинофильные
инфильтраты в легких, кардиомиопатия, гастроэнтерит) и/или васкулитом (гломерулонефрит, периферическая
полиневропатия, кожная пурпура, альвеолярное кровотечение) [1]. Симптомы, позволяющие заподозрить развитие ЭГПА
у пациентов с бронхиальной астмой/ риносинуситом, перечислены в табл. 1.
| Показатели | Меполизумаб (n=68) | Плацебо (n=68) |
|---|---|---|
| Возраст, лет | 49±12 | 48±14 |
| Мужчины, n (%) | 26 (38) | 30 (44) |
| АНЦА, n (%) | 7 (10) | 6 (9) |
| Преднизолон, мг/сут (меиана и диапазон) | 12,0 | 11,0 |
| (7,5-40,0) | (7,5-50,0) | |
| Иммуносупрессивная терапия, n (%) | 41 (60) | 31 (46) |
| Клинические проявления ЭГПА, n (%) | ||
| Эозинофильная астма | 68 (100) | 68 (100) |
| Гистологические признаки | 25 (37) | 31 (46) |
| Нейропатия | 32 (47) | 24 (35) |
| Инфильтраты в легких | 50 (74) | 48 (71) |
| Синусит | 64 (94) | 64 (94) |
| Кардиомиопатия | 13 (19) | 7 (10) |
| Гломерулонефрит | 1 (1) | 0 |
| Альвеолярное кровотечение | 3 (4) | 1 (1) |
| Пальпируемая пурпура | 9 (13) | 8 (12) |
| АНЦА в любое время | 13 (19) | 13 (19) |
| Рецидивирующее течение, n (%) | 51 (75) | 49 (72) |
| Рефрактерное течение, n (%) | 34 (50) | 40 (59) |
| Срок после установления диагноза, лет | 5,2±4,4 | 5,9±4,9 |
Характерный признак ЭГПА – наличие АНЦА к миелопероксидазе (МПО), хотя, в отличие от других АНЦА-ассоциированных
васкулитов, АНЦА определяются значительно реже – в 30-35% случаев. На основании результатов серологического
исследования многие авторы предлагают выделять МПО-АНЦА позитивный и негативный варианты ЭГПА, которые
характеризуются преобладанием признаков васкулита (поражение почек, нейропатия, кожный васкулит) или
эозинофильного гранулематозного воспаления (ин фильтраты в легких, поражение сердца), соответственно (рис. 1)
[6,10]. В некоторых исследованиях наличие МПО-АНЦА ассоциировалось с более высоким риском рецидивов ЭГПА, но
более низким риском смерти. Выделение двух вариантов ЭГПА представляется достаточно условным, так как они в
значительной степени перекрещиваются между собой. Например, типичные проявления васкулита, такие как
гломерулонефрит или периферическая невропатия, могут наблюдаться как при АНЦА-позитивном, так и АНЦА-негативном
ЭГПА, т.е. отрицательный результат серологического исследования не позволяет сделать вывод об отсутствии
васкулита. С другой стороны, некоторые проявления болезни, например, поражение нервной системы или сердца, могут
быть следствием как васкулита, так и эозинофильной инфильтрации тканей [11].
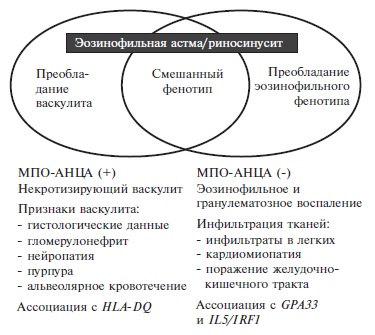
Первые классификационные критерии ЭГПА были предложены J. Lanham и соавт. в 1984 г. и включали в себя
бронхиальную астму, эозинофилию крови и признаки васкулита с поражением по крайней мере двух органов [12].
Однако в клинической практике чаще всего используются классификационные критерии Американской коллегии
ревматологов, разработанные в 1990 г.: бронхиальная астма, эозинофилия крови более 10%, невропатия, преходящие
инфильтраты в легких, поражение синусов и наличие эозинофилов в биоптатах ткани [13]. Наличие по крайней мере 4
из 6 критериев позволяет классифицировать системный васкулит как ЭГПА с чувствительностью 85% и специфичностью
99,7%. Следует отметить, что наличие гистологического подтверждения не считают обязательным для установления
диагноза ЭГПА. В то же время важное диагностическое значение имеет определение АНЦА, наличие которых не
предусматривается в классификационных критериях Американской коллегии ревматологов. В 2015 г. в рекомендациях
рабочей группы по ЭГПА было указано, что у пациентов с эозинофильной астмой наличие МПО-АНЦА с высокой
вероятностью указывает на ЭГПА, хотя отсутствие этих антител не исключает данный диагноз [14]. Сходной точки
зрения придерживаются и другие авторы, рассматривающие МПО-АНЦА как «суррогатный» маркер васкулита наряду с
некоторыми клиническими проявлениями, такими как множественный мононеврит [15].
Для выявления АНЦА могут быть использованы метод непрямой иммунофлюоресценции и иммуноферментный анализ. При
применении первого метода выделяют два типа антител – с диффузным цитоплазматическим (цАНЦА) или перинуклеарным
(пАНЦА) окрашиванием, в то время как антигенспецифические твердофазные методы дают возможность определить
антитела к протеиназе-3 (ПР3) и МПО. В настоящее время именно последние методы рекомендуют использовать для
определения АНЦА [16]. Необходимо обратить внимание на то, что, в отличие от гранулематоза с полиангиитом, при
ЭГПА практически во всех случаях определяются МПО-АНЦА, а не ПР3-АНЦА.
Таким образом, диагноз ЭГПА следует подозревать у пациентов с бронхиальной астмой/риносинуситом, сочетающимися с
высокой эозинофилией крови, при появлении различных системных проявлений, особенно характерных для васкулита,
таких как гломерулонефрит, кожная пурпура, периферическая полиневропатия, альвеолярное кровотечение. В таких
случаях необходимо определять АНЦА с помощью антигенспецифических методов. Наличие МПО-АНЦА имеет важное
значение для подтверждения диагноза ЭГПА, хотя у 2/3 больных они отсутствуют.
Исследование MIRRA
ИЛ-5 – это основной цитокин, регулирующий дифференцировку, рост, активацию, выживаемость и миграцию эозинофилов
[17]. Глюкокортикостероиды вызывают апоптоз эозинофилов, что частично объясняет их эффективность при
эозинофильной бронхиальной астме и других заболеваниях, ассоциирующихся с эозинофилией крови и тканей [18].
Однако пациенты с тяжелой эозинофильной бронхиальной астмой, гиперэозинофильным синдромом или ЭГПА могут быть
рефрактерными к ингаляционным или системным глюкокортикостероидам, что объясняется высокими уровнями ИЛ-5 в
бронхах и других тканях [19]. Этиданные обосновывают включение ингибиторов ИЛ-5 в схемы терапии указанных
состояний.
В клинических исследованиях у больных тяжелой эозинофильной бронхиальной астмой лечение меполизумабом вызывало
снижение числа обострений и улучшение качества жизни и показателей функции внешнего дыхания, а также оказывало
стероидосбе регающее действие [20,21]. Профиль безопасности препарата оказался благоприятным. Основными
нежелательными явлениями были головная боль и боли в горле, реже встречались реакции в месте инъекции [22].
Положительные результаты применения меполизумаба у пациентов с эозинофильной бронхиальной астмой и роль
эозинофилов и ИЛ-5 в патогенезе ЭГПА послужили основанием для изучения эффективности и безопасности препарата
при этом заболевании.
Первый случай успешного применения меполизумаба у молодой пацентки с ЭГПА был описан в 2010 г. [23]. В том же
году были опубликованы результаты небольшого неконтролируемого исследования, в котором применение меполизумаба
позволило достичь ремиссии у 8 из 10 больных ЭГПА, не ответивших на лечение иммуносупрессивными средствами и
глюкокортикостероидами в дозе более 12,5 мг/сут [24]. После прекращения введения меполизумаба у 7 пациентов
развился рецидив, что указывало на целесообразность поддерживающей терапии препаратом.
В 2017 году были опубликованы результаты регистрационного двойного слепого, плацебо-контролируемого 52-недельного исследования MIRRA, в котором эффективность и безопасность меполизумаба изучались у 136 больных рецидивирующим или рефрактерным ЭГПА, установленным по крайней мере 6 мес назад [9]. ЭГПА диагностировали на основании наличия бронхиальной астмы в сочетании с эозинофилией крови (>10% или >1000 клеток в мм3) и по крайней мере двумя из следующих признаков:
- характерные гистологические изменения: эозинофильный васкулит, периваскулярная эозинофильная инфильтрация
или гранулематозное воспаление с большим числом эозинофилов; - нейропатия;
- легочные инфильтраты;
- синусит;
- кардиомиопатия;
- гломерулонефрит;
- альвеолярное кровотечение;
- пальпируемая пурпура;
- АНЦА.
После скрининга пациентов рандомизировали на две группы (1:1) и в течение 52 недель проводили терапию
меполизумабом в дозе 300 мг подкожно каждые 4 недели или плацебо. Во время исследования допускалась стандартная
терапия глюкокортикостероидами ± иммуносупрессивными препаратами. Доза, выбранная для изучения у больных ЭГПА,
превышала зарегистрированную дозу меполизумаба у пациентов с эозинофильной бронхиальной астмой (300 и 100 мг
подкожно каждые 4 недели, соответственно), так как ожидалось, что для подавления активности системного васкулита
потребуется более высокая доза ингибитора ИЛ-5. Эффективность лечения оценивали на основании анализа двух
первичных конечных точек – общей длительности ремиссии в неделях (Бирмингемский индекс активности васкулита
[BVAS], равный 0, и доза преднизолона ≤4,0 мг/сут) и доли пациентов, у которых отмечалась ремиссия через 36 и 48
недель. Кроме того, анализировали различные вторичные конечные точки, в частности предполагавшие менее «строгое»
опре деление ремиссии (доза преднизолона ≤7,5 мг) в соответствии с рекомендациями Европейской антиревматической
лиги (EULAR) [25].
Пациенты, включенные в исследование, были репрезентативными по отношению к общей популяции больных ЭГПА (табл.
2). У всех больных имелась эозинофильная бронхиальная астма, а у большинства – риносинусит. У 41% больных
наблюдалась активная полиневропатия, у 15% – кардиомиопатия, у 13% – пальпируемая пурпура, у 19% – определялись
АНЦА в любые сроки после начала болезни. В то же время альвеолярное кровотечение и гломерулонефрит отмечались в
единичных случаях. Очевидно, что исследователи старались не включать таких пациентов в клиническое исследование,
так как они нуждаются в лечении иммуносупрессивными препаратами, такими как циклофосфамид или ритуксимаб.
По обоим первичным показателям эффективности меполизумаб достоверно превосходил плацебо. Доля пациентов, у
которых ремиссия ЭГПА во время исследования сохранялась в течение по крайней мере 24 недель, составила 28% и 3%
в двух группах, соответственно (отношение шансов 5,91; 95% доверительный интервал [ДИ] 2,68-13,03; p<0,001)
(рис. 2), а частота ремиссии в конце лечения (через 36 и 48 недель) – 32% и 3% (отношение шансов 16,75; 95% ДИ
3,61-77,56; p<0,001). Лечение меполизумабом было более эффективным у пациентов с числом эозинофилов ≥150 в
мм3. В этой выборке при приеме плацебо ни в одном случае не удалось достичь ремиссии, сохранявшейся ≥24 недель,
в то время как в группе меполизумаба доля таких больных составила 33% (отношение шансов 26,10; 95% ДИ
7,02-97,02)
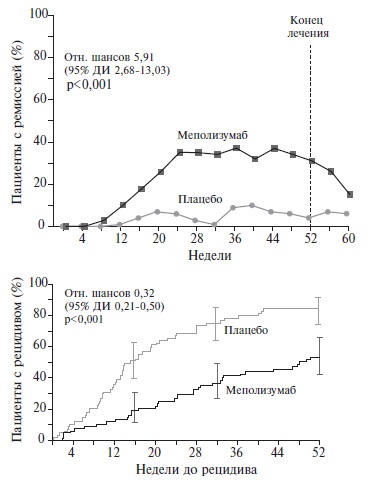
MIRRA
Доля пациентов, у которых развилось обострение ЭГПА в течение 52 недель, в группе меполизумаба была значительно
ниже, чем в группе плацебо (56% и 82%, соответственно; отношение шансов 0,32; 95% ДИ 0,210,50; p<0,001).
Ежегодная частота обострений также была на 50% ниже в группе меполизумаба (1,14 и 2,27, соответственно;
р<0,001). Обострения васкулита в группах меполизумаба и плацебо отмечались у 43% и 65% больных,
соответственно, бронхиальной астмы – у 37% и 60%, риносинусита – у 35% и 51%.
Меполизумаб оказывал также стероидосберегающее действие. К концу исследования (недели 48-52) доза преднизолона
была снижена по крайней мере до 4,0 мг у 44% и 7% больных групп меполизумаба и плацебо, соответственно, а
полностью прекратили прием глюкокортикостероидов 18% и 3% пациентов.
Переносимость меполизумаба была хорошей, в частности из-за нежелательных явлений лечение было прекращено у 3%
больных основной группы и 1% больных группы плацебо. Основными нежелательными явлениями в обеих группах были
головная боль (32% и 18%, соответственно), назофарингит (18% и 24%), артралгии (22% и 18%), синусит (21% и 16%)
и инфекции верхних отделов дыхательных путей (21% и 16%).
Недавно J. Steinfeld и соавт. провели повторный анализ результатов исследования MIRRA с целью дополнительной
оценки эффективности меполизумаба с учетом трех основных целей лечения – достижение ремиссии, снижение дозы
глюкокортикостероида и профилактика рецидивов [26]. Терапию меполизумабом считали эффективной, если была
достигнута по крайней мере одна из трех клинических конечных точек, выделенных в протоколе исследования: (1)
ремиссия в любые сроки исследования (недели 1-52); (2) снижение дозы глюкокортикостероида по крайней мере на 50%
в конце исследования (недели 48-52); (3) отсутствие обострений ЭГПА во время исследования (недели 152). Как и в
первичной публикации, авторы выделяли два определения ремиссии ЭГПА: первое – BVAS, равный 0, и доза
преднизолона ≤4 мг/сут, второе – BVAS, равный 0, и доза преднизолона <7,5 мг/сут. Критериями обострения ЭГПА
считали значение BVAS>0 или ухудшение бронхиальной астмы или симптомов риносинусита, требовавшие увеличения дозы
преднизолона более 4 мг/сут, назначения иммуносупрессивных препаратов или увеличения их доз или госпитализации.
По обоим «комбинированным» показателям эффективности меполизумаб достоверно превосходил плацебо (рис. 3). В
целом эффективность лечения в группе меполизумаба составила 78-87% (в зависимости от определения ремиссии), а в
группе плацебо – 32-53%. Преимущество меполизумаба перед плацебо было выявлено и при анализе отдельных
компонентов клинического ответа, в том числе частоты достижения ремиссии, снижения дозы пероральных
глюкокортикостероидов по крайней мере на 50% и отсутствия обострений заболевания во время исследования. Доля
пациентов, у которых были достигнуты все три перечисленные конечные точки, составила 29% в группе меполизумаба и
только 7% в группе плацебо.
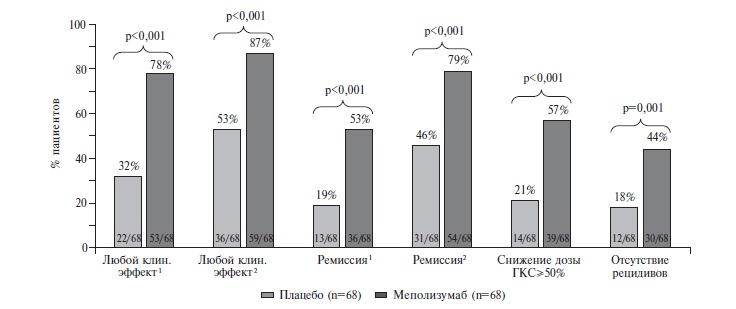
исследовании MIRRA.
обострений ЭГПА. Авторы анализировали два варианта клинической эффективности в зависимости от определения
ремиссии: 1 — BVAS=0 и доза преднизолона 4 мг/сут и менее, 2 BVAS=0 идозапреднизолона7,5 мг/сутименее
Кроме того, авторы оценили результаты лечения в трех когортах пациентов, в том числе с исходным числом
эозинофилов менее 150 в мл (n=57), исходной дозой преднизолона более 20 мг/сут (n=21) и массой тела более 85 кг
(n=45). Во всех этих выборках исследуемый препарат по эффективности превосходил плацебо, хотя у пациентов,
получавших преднизолон в исходной дозе более 20 мг/сут, разница между группами не достигла статистической
значимости (рис. 4). Результаты этого анализа имеют важное практическое значение, так как количество эозинофилов
в крови обычно быстро снижается после назначения глюкокортикостероидов и не всегда увеличивается при обострении
заболевания. При ве денные выше данные показали, что лечение меполизумабом эффективно у пациентов как с более
высокой, так и низкой эозинофилией крови.
ЭГПА – это редко встречающийся АНЦА-ассоциированный васкулит, который следует подозревать у пациентов с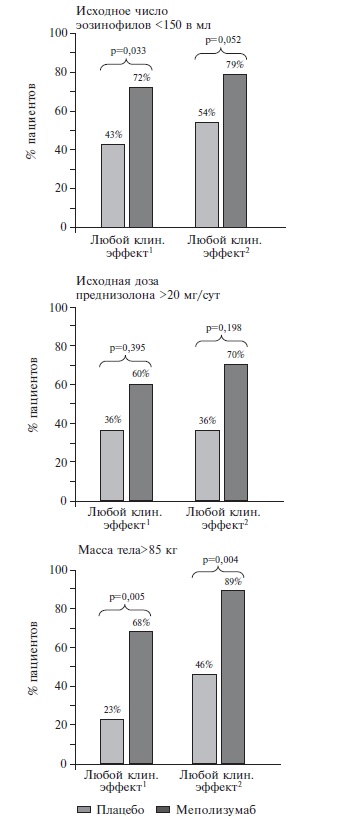
выборках пациентов с ЭГПА.
Заключение
бронхиальной астмой/риносинуситом и эозинофилией крови при появлении системных проявлений, в том числе
лихорадки, артралгий, нейропатии, поражения сердца, почек и желудочно-кишечного тракта. Важное значение в
диагностике ЭГПА имеют МПО-АНЦА, хотя они определяются только у трети больных. Основой лечения ЭГПА остаются
глюкокортикостероиды, которые при наличии неблагоприятных прогностических факторов, таких как поражение сердца
или почек, тяжелая периферическая полиневропатия и др., или неэффективности монотерапии применяют в комбинации с
иммуносупрессивными препаратами. Однако даже комбинированная иммуносупрессивная терапия не всегда позволяет
достичь необходимого ответа, а примерно у трети пациентов наблюдается рецидивирующее течение заболевания.
Результаты двойного слепого плацебо-контролируемого исследования MIRRA показали, что меполизумаб, ингибирующий
взаимодействие ИЛ-5 с рецепторами, может быть использован в качестве дополнения к стандартной иммуносупрессивной
терапии при рефрактерном или рецидивирующем ЭГПА. В этом исследовании применение меполизумаба по сравнению с
плацебо позволяло чаще достичь ремиссии заболевания, оказывало стероидосберегающее действие и снижало частоту
обострений ЭГПА. Теоретически более высокой эффективности меполизумаба можно ожидать у пациентов с преобладающим
эозинофильным фенотипом ЭГПА, однако на практике оценить вклад васкулита и эозинофильной инфильтрации тканей в
развитие клинических проявлений заболевания сложно. Степень эозинофилии крови не имеет особого значения при
выделении фенотипов ЭГПА, так как она не всегда отражает выраженность эозинофильной инфильтрации тканей. В
исследовании MIRRA, подтвердившем эффективность меполизумаба при ЭГПА, у значительной части пациентов помимо
эозинофильной бронхиальной астмы отмечались периферическая полиневропатия и кожная пурпура, которые традиционно
считают проявлениями васкулита. Наличие МПО-АНЦА, которые рассматривают как «суррогатный» маркер васкулита,
также не является основанием для отказа от терапии меполизумаба. Хотя перед началом исследования АНЦА были
выявлены только у 10% больных, однако на протяжении всей болезни частота их обнаружения составила 19%. В то же
время в исследовании MIRRA фактически не было пациентов с альвеолярным кровотечением и быстропрогрессирующим
гломерулонефритом. Для лечения пациентов с указанными проявлениями ЭГПА целесообразно применять
иммуносупрессивные препараты, в том числе циклофосфамид или ритуксимаб. Около половины пациентов, включенных в
исследование MIRRA, получали не только глюкокортикостероиды, но и иммуносупрессивные препараты. В исследовании
не изучалась возможность снижения доз или отмены последних на фоне терапии меполизумабом. Соответственно,
оценивать целесообразность модификации иммуносупрессивной терапии после достижения стойкой ремиссии ЭГПА и
снижения дозы/отмены преднизолона следует индивидуально. Необходимо также учитывать, что обострения ЭГПА могут
отражать не только рецидив васкулита, но и ухудшение течения бронхиальной астмы и/или риносинусита. В последнем
случае альтернативой пероральным глюкокортикостероидам могут служить ингаляционные глюкокортикостероиды и
современные бронходилататоры.
Используемые источники
- Жабина Е.С., Моисеев С.В., Новиков П.И., Федоров К.Е. Эозинофильный гранулематоз с полиангиитом (Черга-Страусс): клинические варианты, диагностика и лечение. Клин фармакол тер 2013;22(5):85-92 [Zhabina ES, Moiseev SV, Novikov PI, Fedorov KE. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome): clinical forms, diagnosis and treatment. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2013;22(5):85-92 (In Russ.)].
- Churg J., Strauss L. Allergic granulomatosis, allergic angiitis and periarteritis nodosa. Am J Pathol 1951;27:277–301.
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 Revised international Chapel Hill consensus conference nomenclature of vasculitides. Arthritis Rheum 2013; 65:1–11.
- Моисеев С.В., Семенкова Е.Н., Новиков П.И. Актуальная номенклатура сис темных васкулитов – рекомендации международной консенсусной конференции (Чапел-Хилл, 2012). Клин фармакол тер 2014;23(1):32-7 [Moiseev SV, Semenkova EN, Novikov PI. New nomenclature of systemic vasculitides recommended at the International Consensus Conference (Chapel-Hill, 2012). Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2014;23(1):32-7 (In Russ.)].
- Groh M, Pagnoux C, Baldini C, et al. Eosinophilic granulomatosis with poly angiitis (Churg–Strauss) (EGPA) Consensus Task Force recommendations for evaluation andmanagement. Europ J Intern Med 2015;26:545–53
- Comarmond C, Pagnoux C, Khellaf M, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Arthritis Rheum 2013;65(1):270-81.
- Загвоздкина Е.С., Новиков П.И., Моисеев С.В. Особенности клинических проявлений и течения эозинофильного гранулематоза с полиангиитом в зависимости от наличия антител к цитоплазме нейтрофилов. Клин фармакол тер 2017;26(1):24-30 [Zagvozdkina ES, Novikov PI, Moiseev SV. Clinical features of eosinophilic granulomatosis with polyangiitis in ANCA-positive and ANCA-negative patients. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2017;26(1):24-30 (In Russ.)].
- Deeks ED. Mepolizumab: A review in eosinophilic asthma. BioDrugs 2016; 30(4):361-70.
- Wechsler ME, Akuthota P, Jayne D, et al. Mepolizumab or placebo for eosino philic granulomatosis with polyangiitis. N Engl J Med 2017;376(20):1921-32
- Lyons PA, Peters JE, Alberici F, et al. Genome-wide association study of eosinophilic granulomatosis with polyangiitis reveals genomic loci stratified by ANCA status. Nat Commun 2019;10:5120.
- Berti A, Boukhlal S, Groh M, Cornec D. Eosinophilic granulomatosis with polyangiitis: the multifaceted spectrum of clinical manifestations at different stages of the disease. Expert Rev Clin Immunol 2020;16: 51-61.
- Lanham JG, Elkon KB, Pusey CD, Hughes GR. Systemic vasculitis with asthma and eosinophilia: a clinical approach to the Churg-Strauss syndrome. Medicine (Baltimore) 1984;63:65–81.
- Masi AT, Hunder GG, Lie JT, et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum 1990; 33: 1094–100.
- Groh M, Pagnoux C, Baldini C, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur J Intern Med 2015;26:545-53.
- Cottin V, Bel E, Bottero P, et al.; Groupe d’Etudes et de Recherche sur les Maladies Orphelines Pulmonaires (GERM“O”P). Revisiting the systemic vasculitis in eosinophilic granulomatosis with polyangiitis (Churg-Strauss): A study of 157 patients by the Groupe d’Etudes et de Recherche sur les Maladies Orphelines Pulmonaires and the European Respiratory Society Taskforce on eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Autoimmun Rev 2017;16:1-9.
- Bossuyt X, Cohen Tervaert JW, Arimura Y, et al. Position paper: Revised 2017 international consensus on testing of ANCAs in granulomatosis with polyangiitis and microscopic polyangiitis. Nat Rev Rheumatol 2017;13(11):683-92.
- Varricchi G, Canonica GW. The role of interleukin 5 in asthma. Expert Rev Clin Immunol 2016;12(9):903-5.
- Zhang X, Moilanen E, Kankaanranta H. Enhancement of human eosinophil apoptosis by fluticasone propionate, budesonide, and beclomethasone. Eur J Pharmacol 2000;406(3):325-32.
- Dunican EM, Fahy JV. Asthma and corticosteroids: time for a more precise approach to treatment. Eur Respir J 2017;49(6):1701167.
- Nair P, Pizzichini MM, Kjarsgaard M, et al. Mepolizumab for prednisone-dependent asthma with sputum eosinophilia. N Engl J Med 2009;360(10):985–93.
- Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet 2012;380(9842):651–9.
- Kallur L, Gonzalez-Estrada A, Eidelman F, Dimov V. Pharmacokinetic drug evaluation of mepolizumab for the treatment of severe asthma associated with persistent eosinophilic inflammation in adults. Expert Opin Drug Metab Toxicol 2017;13(12):1275–80.
- Kahn J-E, Grandpeix-Guyodo C, Marroun I, et al. Sustained response to mepolizumab in refractory Churg-Strauss syndrome. J Allergy Clin Immunol 2010;125(1):267–270.
- Moosig F, Gross WL, Herrmann K, et al. Targeting interleukin-5 in refractory and relapsing Churg-Strauss syndrome. Ann Intern Med 2011;155(5):341–3.
- Hellmich B, Flossmann O, Gross WL, et al. EULAR recommendations for conducting clinical studies and/or clinical trials in systemic vasculitis: focus on antineutrophil cytoplasm antibody-associated vasculitis. Ann Rheum Dis 2007;66: 605-17.
- Steinfeld J, Bradford ES, Brown J, et al. Evaluation of clinical benefit from treatment with mepolizumab for patients with eosinophilic granulomatosis with polyangiitis. J Allergy Clin Immunol 2019;143:2170-7.
Версия на английском языке
-
Архив журнала
/ -
2019
/ - №11
Опыт использования меполизумаба при тяжелой бронхиальной астме
DOI: https://dx.doi.org/10.18565/pharmateca.2019.11.85-88
Г.Р. Сергеева, А.А. Знахуренко, Е.В. Лешенкова, А.В. Емельянов
Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия
Актуальность. Лечение больных тяжелой бронхиальной астмой препаратами моноклональных антител против ключевых цитокинов, участвующих в развитии астмы, считается новым направлением терапии и требует тщательного отбора пациентов на основании клинических особенностей и биологических маркеров. В настоящее время в РФ зарегистрировано пять биологических препаратов для лечения пациентов с Т2-эндотипом бронхиальной астмы; клинический опыт их применения, в частности меполизумаба, относительно невелик.
Описание клинического случая. Пациентка с тяжелым течением бронхиальной астмы, неконтролируемой на 5-й ступени терапии (высокие дозы ингаляционных глюкокортикостероидов, длительно действующих β2-адреноагонистов, антихолинергические препараты длительного действия, пероральные глюкокортикостероиды), с повышенными биомаркерами эозинофильного воспаления (эозинофилы периферической крови, уровень общего IgE) и низкими показателями функции легких в течение года получала препарат меполизумаб дополнительно к базисной терапии.
Заключение. В результате лечения наблюдалось улучшение контроля заболевания и качества жизни, удалось снизить дозу пероральных глюкокортикостероидов более чем в 2 раза и значительно уменьшить использование ресурсов здравоохранения.
Ключевые слова: тяжелая бронхиальная астма, биологическая терапия, меполизумаб, клинический случай
Введение
Тяжелой бронхиальной астмой (ТБА) страдают 5–10% больных этим заболеванием. К особенностям ее течения относятся частые обострения и госпитализации, низкое качество жизни пациентов и повышенный риск смерти. Для лечения ТБА используются высокие дозы ингаляционных глюкокортикостероидов (ИГКС) совместно с длительно действующими β2-адреноагонистами (ДДБА) или антагонистами лейкотриеновых рецепторов/теофиллином и тиотропия бромидом, в ряде случаев – системные глюкокортикостероиды (СГКС) [1]. Несмотря на проводимое лечение, при ведении пациентов бывает трудно достигнуть контроля астмы [2], в связи с чем возникает необходимость назначения биологической терапии. Она предусматривает использование моноклональных антител против ключевых цитокинов, участвующих в развитии астмы, и требует тщательного отбора пациентов на основании клинических особенностей и биологических маркеров.
В настоящее время в РФ зарегистрировано 5 биологических препаратов, используемых при Т2-эндотипе ТБА: гуманизированные моноклональные антитела к иммуноглобулину Е (IgE) – омализумаб, к интерлейкину-5 (ИЛ-5) – меполизумаб и реслизумаб, к рецепторам ИЛ-5 – бенрализумаб, антагонист ИЛ-4/13 – дупилумаб [3]. В качестве дополнительных показаний к назначению биологических препаратов рассматриваются назальный полипоз (анти-IgE, анти-ИЛ-5, анти-ИЛ-4/13), атопический дерматит (дупилумаб), гиперэозинофильный синдром (меполизумаб).
Препараты моноклональных антител для лечения тяжелой эозинофильной астмы, встречающейся у не менее чем 50% пациентов с ТБА, в частности меполизумаб, снижают частоту обострений заболевания [4–7], улучшают контроль [6, 7], качество жизни пациентов [4) и функцию легких [7], снижают потребность в СГКС у пациентов с гормонзависимой ТБА [7–9]. Они имеют хороший профиль безопасности [5, 7] и оказывают стойкий эффект при длительном использовании [7, 9, 10]. Опыт применения биологической терапии, в частности меполизумаба, в реальной клинической практике в России относительно невелик.
В качестве примера лечения больного ТБА с использованием меполизумаба приводим собственное клиническое наблюдение.
Клинический пример
Пациентка М. 48 лет, служащая. При обращении предъявляла жалобы на приступы затрудненного дыхания с дистанционными хрипами, одышку при незначительной физической нагрузке, на кашель в течение дня с вязкой трудноотделяемой слизистой мокротой. Потребность в вентолине составляла 6–8 ингаляций в сутки, в т.ч. в ночное время. Симптомы провоцировались физической и эмоциональной нагрузкой, контактом с домашней пылью и шерстью животных, ОРВИ, воздействием резких запахов и табачного дыма. Кроме того, отмечала постоянную заложенность носа, выделения слизистого характера и снижение обоняния. Пользовалась нафтизином 3–4 раза в день и назонексом 100 мкг в каждую половину носа 2 раза в день.
Из анамнеза болезни известно, что впервые приступы удушья и симптомы аллергического ринита возникли в возрасте 34 лет. В 42 года после обследования пульмонологом был установлен диагноз «БА тяжелого течения». С этого времени непрерывно принимала ИГКС в высоких дозах в сочетании с ДДБА (в течение последних 5 лет – Серетид Мультидиск 50/500 мкг 2 раза в день), дополнительно периодически использовала антигистаминные и антилейкотриеновые препараты, в последние 3 года постоянно применяла тиотропия бромид (Спирива Респимат) по 5 мкг ежедневно. Около 3 лет назад (в 45 лет) появились тяжелые приступы удушья после приема аспирина и других нестероидных противовоспалительных препаратов (НПВП). Из-за тяжести течения болезни в тот период к лечению были добавлены пероральные ГКС (преднизолон, метипред), которые принимала непрерывно. Их доза постепенно увеличивалась до 5 таблеток в день. В возрасте 47 лет был выявлен полипоз носа, хронический полипозный риносинусит, с этого времени постоянно применяла мометазона фуроат (Назонекс) интраназально по 100 мкг в каждый носовой ход 2 раза в день. Проводились курсы плазмафереза и разгрузочно-диетической терапии, которые давали кратковременный эффект. В течение последних лет 2 раза была госпитализирована в отделение интенсивной терапии по поводу тяжелых обострений БА, интубаций не было. Частота госпитализаций составляла в среднем 2–3 раза в год, вызовы «неотложной помощи» с парентеральным введением СГКС – 1–2 раза в месяц.
Анамнез жизни: образование высшее, бытовые условия хорошие, в квартире животных нет. Профессиональных вредностей нет. Наследственность: у матери аллергическая БА (аллергия к шерсти кошек и собак). Аллергологический анамнез: имеются клинические признаки аллергии к клещам домашней пыли, шерсти кошек и собак, подтвержденные повышенным уровнем аллерген-специфических IgE в сыворотке крови. Уровень общего IgE составил 216 МЕ/мл.
Страдает непереносимостью аспирина и других НПВП, проявляющейся тяжелыми приступами удушья. Гинекологический анамнез: роды 1, постменопауза с 46 лет, гинекологических заболеваний нет. Вредных привычек нет. Не курит и никогда не курила. Сопутствующие заболевания: хронический гастродуоденит с 25 лет, в ремиссии, терапию не получает; гастроэзофагеальная рефлюксная болезнь, рефлюксэзофагит с 47 лет, применяет омепразол (Омез) 20 мг 1 раз в день; аутоиммунный тиреоидит с 46 лет, в настоящее время эутиреоз, терапию не проводит; остеохондроз грудного и поясничного отделов позвоночника с 45 лет, терапию не проводит.
Объективное обследование. Состояние удовлетворительное. Рост 171 см, масса тела 59,0 кг, индекс массы тела – 20,2 кг/м2. Сознание ясное. Носовое дыхание затруднено, выделений нет. В неврологических позах устойчива. Зрачки D=S, реакция на свет живая, содружественная. Кожа, слизистые обычной окраски, отеков нет. Периферические лимфатические узлы не увеличены. Щитовидная железа не увеличена. Пульс – 84 в минуту, ритмичный, симметричный удовлетворительных свойств. Артериальное давление – 125/78 мм рт.ст. Тоны сердца приглушены, шумов нет. Частота дыханий – 16 в минуту. Грудная клетка правильной формы, активна в дыхании. Перкуторно над легкими легочный звук с коробочным оттенком. Дыхание жесткое, проводится равномерно во все отделы, свистящие сухие рассеянные хрипы, усиливающиеся на выдохе. Язык чистый, влажный. Живот мягкий, безболезненный. Печень не увеличена. Поколачивание по пояснице безболезненное с обеих сторон. Со стороны костно-мышечной системы – без патологии.
Результаты дополнительного обследования: в клиническом анализе крови количество лейкоцитов – 7,0×109 клеток/л, содержание эозинофилов – 260 клеток/мкл. Оксид азота выдыхаемого воздуха составил 5,5 ppb (норма до 25 ppb), назальный оксид азота – 55,2 ppb (норма до 1000 ppb) на фоне терапии топическими ГКС. Общий IgE крови повышен до 216 МЕ/мл.
Результаты спирометрии: исходно форсированная жизненная емкость легких (ФЖЕЛ) – 70% должного, объем форсированного выдоха за 1-ю секунду (ОФВ1) – 45%, ОФВ1/ФЖЕЛ – 0,55. После пробы с бронхолитиком (400 мкг – 4 вдоха сальбутамола) – ФЖЕЛ –101%, ОФВ1 – 73%, ОФВ1/ФЖЕЛ – 0,62. Прирост ОФВ1 составил 820 мл и 64%, что соответствует положительной (≥200 мл и ≥12%) пробе с бронхолитиком. Обращают на себя внимание низкие показатели ОФВ1 (менее 60% от должного), отсутствие нормализации отношения ОФВ1/ФЖЕЛ после пробы с бронхолитиком, что свидетельствует о наличии фиксированной обструкции дыхательных путей, а также высокие показатели прироста ОФВ1.
При компьютерной томографии органов грудной клетки наблюдаются умеренно выраженный пневмофиброз, дисковидные ателектазы в нижних отделах легких с обеих сторон; компьютерной томографией носа и придаточных пазух выявлен полипозный риносинусит, левостороннее искривление носовой перегородки.
Средний балл по вопроснику ACQ-5 составил 3,6 балла, что соответствует неконтролируемому течению заболевания. Качество жизни по вопроснику госпиталя Святого Георгия (SGRQ) составило 85 баллов, т.е. БА оказывала выраженное воздействие на повседневную жизнь пациентки.
Диагноз основной: бронхиальная астма: аллергическая, аспириновая, гормонзависимая с фиксированной обструкцией, с поздним началом, тяжелое течение, неконтролируемая. Аллергический ринит: персистирующий, тяжелое течение. Полипоз носа, хронический полипозный риносинусит. Бытовая, эпидермальная аллергия.
Сопутствующие заболевания: хронический гастродуоденит, ремиссия. Гастроэзофагеальная рефлюксная болезнь, рефлюкс-эзофагит. Аутоиммунный тиреоидит, эутиреоз. Остеохондроз грудного и поясничного отделов позвоночника.
Лечение
В связи с тяжелым течением заболевания, частыми обострениями БА на фоне проводимой терапии высокими дозами Серетида, Спиривы и постоянного приема преднизолона при уровне эозинофилов крови 260 кл/мкл пациентке было назначено лечение моноклональным антителом к ИЛ-5 меполизумабом. Меполизумаб применялся по 100 мг подкожно в область плеча или передней поверхности бедра 1 раз в месяц [13]. Побочных явлений после введения препарата (местных или системных) отмечено не было.
Результаты последующего наблюдения
В течение года лечения меполизумабом госпитализаций по поводу БА не было, хотя в течение первого месяца от начала терапии обращалась за «неотложной помощью» по поводу приступа удушья на фоне сильного стресса. В последующем вызовов «неотложной помощи» не было. Дозу преднизолона удалось снизить с 25 мг в сутки (5 таблеток) до 10 мг в сутки (2 таблетки). Пациентка продолжала получать базисную терапию: Серетид Мультидиск 50/500 мкг 2 раза в день, Спирива Респимат по 5 мкг ежедневно, потребность в Вентолине снизилась до 1–2 ингаляций в сутки.
Через 12 месяцев лечения показатели спирометрии несколько улучшились: до пробы с бронхолитиком ФЖЕЛ – 71% должного, ОФВ1 – 61%, проба с бронхолитиком отрицательная, постбронхолитический показатель ОФВ1/ФЖЕЛ – 0,65. Количество эозинофилов периферической крови составило 74 клетки/мкл. Кроме того, отмечено клиническое улучшение в течении полипозного риносинусита, практически свободным стало носовое дыхание, частично восстановилось обоняние, пациентка значительно реже стала пользоваться Назонексом и нафтизином.
Средний балл по вопроснику ACQ-5 был равен 1,2 балла (менее 1,5 баллов), что соответствует частично контролируемому течению БА, отмечено клинически значимое улучшение (более 0,5 балла) по сравнению с исходным показателем. Также наблюдалось клинически значимое (снижение более чем на 4 балла относительно исходного) улучшение качества жизни, согласно общему баллу вопросника SGRQ, которое составило 57 баллов.
Обсуждение
Пациентка с тяжелым течением БА получала максимально возможный объем терапии (высокие дозы ИГКС, ДДБА, антихолинергические препараты длительного действия, СГКС). Несмотря на это, астма продолжала оставаться неконтролируемой и характеризовалась частыми тяжелыми обострениями. Результаты обследования выявили высокие риски последующих обострений (отсутствие контроля заболевания, низкие показатели функции легких, наличие фиксированной бронхиальной обструкции, высокий прирост в пробе с бронхолитиком). При исследовании биомаркеров эозинофильного воспаления дыхательных путей (подтверждающих наличие Т2-эндотипа БА) часть маркеров на фоне лечения была нормализована (оксид азота выдыхаемого воздуха, назальный оксид азота), но сохранялись повышенными уровни общего IgE крови (более 100 МЕ/мл) и эозинофилов периферической крови (более 150 клеток/мкл), что послужило дополнительным обоснованием целесообразности использования фенотипспецифической терапии меполизумабом – моноклональными антителами к ИЛ-5.
В течение 12 месяцев терапии с использованием Нукалы отмечено снижение количества эозинофилов периферической крови менее 150 клеток/мкл, что сопровождалось существенным улучшением контроля БА, улучшением течения полипозного риносинусита и позволило снизить дозу СГКС.
Заключение
Таким образом, у пациентки с ТБА, неконтролируемой на 5-й ступени терапии (высокие дозы ИГКС, ДДБА, антихолинергические препараты длительного действия, пероральные ГКС), с повышенными биомаркерами эозинофильного воспаления (эозинофилы периферической крови более 150 клеток/мкл, уровень общего IgE более 100 МЕ/мл) и низкими показателями функции легких лечение меполизумабом в течение года привело к улучшению контроля заболевания и качества жизни. В результате использования препарата удалось снизить дозу пероральных ГКС более чем в 2 раза и значительно уменьшить использование ресурсов здравоохранения (отсутствие госпитализаций, многократное снижение частоты обращений за «неотложной помощью»).
Согласие пациента
Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации.
Литература
1. Chung K.F., Wenzel S.E., Brozek J.L., et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014;43(2):343–73. Doi:10.1183/09031936.00202013.
2. Global Initiative for asthma. NHLB/WHO Workshop Report.-National Heart Lung Blood Insti-tute, updated 2019. www.ginasthma.org. Access 17.04.2019.
3. Бронхиальная астма. Федеральные клинические рекомендации. 2019.
4. Haldar P., Brightling C.E., Hargadon B., et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med. 2009;360:973–84. Doi: 10.1056/NEJMoa0808991.
5. Pavord I.D., Korn S., Howarth P., et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebocontrolled trial. Lancet. 2012;380:651–59. Doi: 10.1016/S0140-6736(12)60988-X.
6. Ortega H.G., Liu M.C., Pavord I.D., et al. Mepolizumab treatment in patients with severe eo-sinophilic asthma. N Engl J Med. 2014;371:1198–207. Doi: 10.1056/NEJMoa1403290.
7. Nair P., Pizzichini M., Kjarsgaard M., et al. Mepolizumab for prednison-dependent asthma with sputum eosinophilia. N Engl J Med. 2009;360:985–93. Doi: 10.1056/NEJMoa0805435.
8. Khurana S., Brusselle G.G., Bel E.H., et al. Long-term Safety and Clinical Benefit of Mepoli-zumab in Patients With the Most Severe Eosinophilic Asthma: the COSMEX Study. Clin Ther. 2019;pii: S0149–2918(19)30350-9. Doi: 10.1016/j.clinthera.2019.07.007.
9. Bel E.H., Wenzel S.E., Thompson P.J., et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014;371:1189–97. Doi: 10.1056/NEJMoa1403291.
10. Lugogo N., Domingo C., Chanez P., et al. Long-term Efficacy and Safety of Mepolizumab in Patients With Severe Eosinophilic Asthma: A Multicenter, Open-label, Phase IIIb Study. Clin Ther. 2016;38(9):2058–2070.e1. Doi: 10.1016/j.clinthera.2016.07.010.
11. Albers F.C., Ortega H., Bradford E.S., et al. Durability of clinical response following long-term treatment with mepolizumab in patients with severe eosinophilic asthma: the COLUMBA study. Presented at the American Thoracic Society International Conference, San Diego, CA, USA. 2018;18–23.
12. Ortega H.G., Albers F.C., Bradford E.S., et al. Long-term Safety of Mepolizumab in Patients With Severe Eosinophilic Asthma: The COLUMBA Study. Presented at the American Thoracic Society International Conference, San Diego, CA, USA. 2018;18–23. Poster No. P892(A1367).
13. Инструкция по медицинскому применению препарата Нукала.
Об авторах / Для корреспонденции
Автор для связи: А.В. Емельянов, д.м.н., профессор, зав. кафедрой пульмонологии, Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия; е-mail: aleksandr.emelyanov@szgmu.ru
Адрес: 191015, Россия, Санкт-Петербург, ул. Кирочная, 41
ORCID:
Г.Р. Сергеева https://orcid.org/0000-0003-1544-4336
Е.В. Лешенкова https://orcid.org/0000-0003-4616-3166
А.В. Емельянов https://orcid.org/0000-0002-8574-6869

