Варгатеф — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-002830
Торговое наименование:
ВАРГАТЕФ
Международное непатентованное наименование:
нинтеданиб (nintedanib)
Лекарственная форма:
мягкие капсулы
Состав
Одна капсула 100 мг содержит:
Активное вещество: нинтеданиба этансульфонат — 120,40 мг, что соответствует 100,00 мг нинтеданиба основания;
Вспомогательные вещества: триглицериды средней цепи — 107,40 мг, твердый жир — 51,00 мг, лецитин — 1,20 мг;
Оболочка капсулы: желатин — 111,24 мг, глицерин 85% — 49,09 мг, титана диоксид (Е171) — 1,21 мг, железа оксид красный (суспензия с глицерином 85%) — 0,06 мг, железа оксид желтый (суспензия с глицерином 85 %) — 0,36 мг, чернила Опакод® тип S-1 -17823.
Одна капсула 150 мг содержит:
Активное вещество: нинтеданиба этансульфонат — 180,60 мг, что соответствует 150,00 мг нинтеданиба основания;
Вспомогательные вещества: триглицериды средней цепи — 161,10 мг, твердый жир -76,50 мг, лецитин — 1,80 мг;
Оболочка капсулы: желатин — 141,84 мг, глицерин 85% — 61,43 мг, титана диоксид (Е171) — 0.39 мг, железа оксид красный (суспензия с глицерином 85%) — 1,24 мг, железа оксид желтый (суспензия с глицерином 85 %) — 1,86 мг, чернила Опакод® тип S-1-17823.
Описание
Капсулы 100 мг
Продолговатые непрозрачные мягкие желатиновые капсулы розовато-оранжевого (персикового) цвета, содержащие ярко-желтую вязкую суспензию, на одной стороне которых черным цветом напечатан символ компании Берингер Ингельхайм и «100».
Капсулы 150 мг
Продолговатые непрозрачные мягкие желатиновые капсулы коричневого цвета, содержащие ярко-желтую вязкую суспензию, на одной стороне которых черным цветом напечатан символ компании Берингер Ингельхайм и «150».
Фармакотерапевтическая группа
противоопухолевое средство — протеинтирозинкиназы ингибитор
Код ATX:
L01XE31
Фармакологические свойства
Фармакодинамика
Механизм действия
Нинтеданиб — ингибитор тирозинкиназы, относящийся к классу малых молекул, блокирующий киназную активность рецепторов фактора роста эндотелия сосудов 1-3 (VEGFR 1-3), рецепторов тромбоцитарного фактора роста а и В (PDGFR а и В) и рецепторов фактора роста фибробластов 1-3 (FGFR 1-3). Кроме того, ингибируются Fms-подобная протеинтирозинкиназа (Flt-З), лимфоцит-специфическая протеинтирозинкиназа (Lck), протоонкогенная протеинтирозинкиназа (Src) и киназы рецептора колониестимулирующего фактора 1 (CSF1R). Нинтеданиб конкурентно взаимодействует с аденозинтрифосфат (АТФ) связывающим участком этих киназ и блокирует каскады внутриклеточной передачи сигналов, которые, как было продемонстрировано, участвуют в патогенезе ремоделирования фиброзной ткани.
Фармакодинамические эффекты
Опухолевый ангиогенез является процессом, который вносит существенный вклад в рост, прогрессирование и образование метастазов опухоли. Этот процесс преимущественно запускается проангиогенными факторами такими, как фактором роста эндотелия сосудов и основным фактором роста фибробластов (VEGF и bFGF), секретируемыми опухолевыми клетками, чтобы привлечь эндотелиальные и периваскулярные клетки хозяина и облегчить доставку кислорода и питательных веществ через сосудистую систему.
Нинтеданиб эффективно противодействует образованию и развитию сосудистой системы опухоли, приводит к замедлению и остановке роста опухоли.
В исследованиях in vitro на клетках человека было показано, что нинтеданиб ингибирует процессы, предположительно связанные с инициацией фиброзного патогенеза, с высвобождением профибротических медиаторов из моноцитов периферической крови и с поляризацией макрофагов с образованием макрофагов. активированных по альтернативному пути. Было продемонстрировано, что нинтеданиб ингибирует фундаментальные процессы фиброза органов, пролиферации и миграции фибробластов, трансформацию в активный фенотип миофибробласта и секрецию внеклеточного матрикса. В исследованиях на животных с использованием многочисленных моделей ИЛФ (идиопатический легочный фиброз), ИЗЛ-ССД (интерстициальные заболевания легких при системной склеродермии), ИЗЛ-РА (интерстициальные заболевания легких при ревматоидном артрите) и других видов фиброза органов, было показано противовоспалительное и противофибротическое действие нинтеданиба в легких, коже, сердце, почках и печени. Нинтеданиб также обладает активностью в отношении сосудов. Он уменьшал апоптоз эндотелиальных клеток микрососудов кожи и замедлял ремоделирование легочных сосудов путем уменьшения пролиферации клеток гладкой мускулатуры сосудов, толщины стенки легочных сосудов и уменьшал процентную долю окклюзированных легочных сосудов.
Фармакокинетика
Фармакокинетика нинтеданиба может считаться линейной в отношении времени (т.е. данные, полученные в случае применения однократной дозы, могут экстраполироваться на данные, полученные в результате многократного применения). После многократного применения препарата накопление составляет 1,04 при оценке максимальной концентрации (Cmax) и 1,38 при оценке площади под кривой «концентрация-время» (AUCτ ). Остаточные концентрации нинтеданиба остаются стабильными в течение одного года и более.
Всасывание
Сmах нинтеданиба в плазме крови достигается приблизительно через 2-4 часа после приема препарата во время еды (диапазон 0,5-8 часов). Абсолютная биодоступность дозы 100 мг составляет у здоровых добровольцев 4,69 % (90 % доверительный интервал (ДИ): 3,615-6,078).
Установлено, что экспозиция нинтеданиба увеличивается пропорционально дозе (в диапазонах доз 50-450 мг один раз в день и 150-300 мг два раза в день). Устойчивые концентрации в плазме крови достигаются, как максимум, в течение одной недели после начала приема.
Экспозиция нинтеданиба увеличивается после приема пищи примерно на 20 % по сравнению с приемом препарата натощак (ДИ: 95,3-152,5 %), а всасывание замедляется. Медиана времени достижения максимальной концентрации в плазме крови натощак — 2,00 часа, после еды — 3,98 часа.
Распределение
Распределение нинтеданиба осуществляется путем двухфазной кинетики. После внутривенной инфузии во время терминальной фазы наблюдается большой объем распределения (Vd) 1050 л, геометрический коэффициент вариации (gCV) 45,0 %.
Связывание нинтеданиба с белками плазмы человека in vitro считается значительным, связанная фракция составляет 97,8 %. Основным белком, участвующим в связывании, считается альбумин сыворотки крови. Нинтеданиб преимущественно распределяется в плазме, соотношение кровь/плазма составляет 0,869.
Нинтеданиб является субстратом для гликопротеина-Р (P-gp). Показано, что нинтеданиб in vitro не является субстратом или ингибитором полипептидных переносчиков органических анионов (ОАТР-1В1, ОАТР-1ВЗ, ОАТР-2В1), переносчика органических катионов-2 (ОСТ-2) или белка, ассоциированного с множественной лекарственной устойчивостью-2 (MRP-2). Нинтеданиб также не является субстратом для белка резистентности рака молочной железы (BCRP). In vitro было установлено, что нинтеданиб обладает слабой ингибирующей активностью в отношении ОСТ-1, BCRP и P-gp, что, как считается, имеет небольшую клиническую значимость. Такое же заключение сделано в отношении нинтеданиба как субстрата для ОСТ-1.
Биотрансформация
Основной реакцией, участвующей в метаболизме нинтеданиба, является гидролитическое расщепление с помощью эстераз, что приводит к образованию свободного кислого метаболита нинтеданиба. В доклинических исследованиях in vivo установлено, что данный метаболит не обладает эффективностью, несмотря на влияние на целевые рецепторы препарата. В дальнейшем он глюкуронизируется ферментами уридин-дифосфат-глюкуронозилтрансферазами (UGT 1А1, UGT 1А7, UGT 1А8 и UGT 1А10) с образованием глюкуронида.
Считается, что биотрансформация нинтеданиба с участием изоферментов СУР происходит только в небольшой степени, основное участие принимает изофермент CYP ЗА4. В исследовании ADME у человека основной метаболит, образующийся с участием изоферментов CYP, обнаружить в плазме не удалось. По данным исследования in vitro, CYP-зависимый метаболизм составляет примерно 5 %, тогда как расщепление, осуществляемое эстеразами, составляет 25 %.
Выведение
Общий клиренс из плазмы после внутривенной инфузии составляет 1390 мл/мин (gCV 28,8 %). Экскреция почками неизмененной активной субстанции в течение 48 часов после приема нинтеданиба внутрь составляет примерно 0,05 % от величины дозы (gCV 31,5 %), а после внутривенного введения — примерно 1,4 % (gCV 24,2 %); почечный клиренс составляет 20 мл/мин (gCV 32,6%). После приема внутрь [ 14С]-нинтеданиба радиоактивный материал выводился преимущественно с желчью и обнаруживался в кале (93,4% от величины дозы, gCV 2,61 %). Вклад почечной экскреции в общий клиренс составляет 0.649 % от величины дозы (gCV 26,3 %). Выведение считается полным (более 90 %) через 4 дня после приема. Период полувыведения нинтеданиба составляет от 10 до 15 часов (gCV примерно 50 %).
Зависимость эффекта от экспозиции
Немелкоклеточный рак легкого (НМРЛ)
В ходе исследования зависимости нежелательных явлений от фармакокинетики нинтеданиба была установлена тенденция к более частому повышению активности ферментов печени при большей экспозиции нинтеданиба. Подобной зависимости не отмечается для нарушений со стороны желудочно-кишечного тракта (ЖКТ).
Для клинических конечных точек анализ взаимосвязи фармакокинетики с эффективностью не проводился. С помощью метода логистической регрессии установлена статистически значимая взаимосвязь между экспозицией нинтеданиба и влиянием на изменения, обнаруживаемые методом динамической контрастной магнитно-резонансной томографии.
ИЛФ и ИЗЛ-ССД
Анализ зависимости «экспозиция-ответ» показал наличие взаимосвязи типа Еmах между воздействием в диапазоне, наблюдавшемся в ряде исследований Фазы II и III, и ежегодным уровнем снижения форсированной жизненной емкости легких; ЕС50 составляла около 3-5 нг/мл (относительная стандартная ошибка: приблизительно 55 %). Для сравнения, медиана наблюдаемых минимальных концентраций нинтеданиба при применении препарата ВАРГАТЕФ в дозе 150 мг 2 раза в сутки составляла примерно 10 нг/мл.
В отношении безопасности возможно имеется слабая взаимосвязь между экспозицией нинтеданиба в плазме крови и повышением активности аланинаминотранферазы (АЛТ) и/или аспартатаминотрансферазы (ACT). Фактически применяемая доза может быть более существенным прогностическим фактором риска развития диареи любой интенсивности, даже если экспозицию в плазме крови нельзя исключить в качестве определяющего фактора риска.
Фармакокинетика у особых групп пациентов
Фармакокинетические свойства нинтеданиба были сопоставимы у здоровых добровольцев, пациентов с ИЛФ, ИЗЛ-ССД и НМРЛ. Основываясь на результатах популяционного фармакокинетического анализа и описательных исследований, на воздействие нинтеданиба не влиял пол (с учетом массы тела), нарушения функции почек легкой и средней степени тяжести (рассчитанная по клиренсу креатинина), метастазы в печени, общее состояние больного (оценка по опроснику Восточной Объединенной Онкологической Группы, Eastern Cooperative Oncology Group (ECOG)), употребление алкоголя, или генотип P-gp. Популяционный фармакокинетический анализ выявил умеренное влияние возраста, массы тела и расовой принадлежности на воздействие нинтеданиба. В связи с тем, что наблюдалась высокая межиндивидуальная вариабельность воздействия, эти влияния не считались клинически значимыми. Тем не менее, рекомендуется тщательное мониторирование пациентов, у которых выявляется несколько таких факторов риска, представленных ниже.
Возраст
Экспозиция нинтеданиба линейно увеличивается с возрастом. У 45-летних пациентов (5-й процентиль) значение AUCτ,ss (в равновесном состоянии на период дозирования) было ниже на 16 %, а у 76-летних пациентов (95-й процентиль) выше на 13 % по сравнению с пациентами, медиана возраста которых составляла 62 года. Диапазон возраста, оценивавшийся в ходе анализа, составлял 29-85 лет; возраст более 75 лет отмечался примерно у 5 % популяции пациентов.
Аналогичные исследования у детей не проводились.
Масса тела
Наблюдается обратная корреляция между массой тела и экспозицией нинтеданиба. У пациентов с массой тела 50 кг (5-й процентиль) величина AUCτ,ss увеличивалась на 25 %, а у пациентов с массой тела 100 кг (95-й процентиль) уменьшалась на 19 % по сравнению с пациентами, медиана массы тела которых составляла 71,5 кг.
Раса
Средняя популяционная экспозиция нинтеданиба на 33-50 % выше у пациентов-китайцев, тайваньцев и индийцев, и на 16% выше у пациентов японского происхождения, а у пациентов-корейцев — на 16-22 % ниже, чем у пациентов европеоидной расы (с поправкой на массу тела). Данные в отношении пациентов негроидной расы являются очень ограниченными, диапазон этих данных сходен с пациентами европеоидной расы.
Нарушения функции печени
В исследовании I фазы при изучении однократного введения препарата значения Сmах и AUC были в 2,2 раза выше у добровольцев с легкими нарушениями функции печени (класс А по шкале Чайлд-Пью; 90 % доверительный интервал (ДИ) 1,3-3,7 для Сmax и 1,2-3,8 для AUC, соответственно), чем у здоровых добровольцев.
У добровольцев с умеренными нарушениями функции печени (класс В по шкале Чайлд-Пью) значение Сmах (90 % ДИ 4,4-13,2) было в 7,6 раза выше, и 8,7 раза выше значение AUC (90% ДИ 5,7-13,1) соответственно, в сравнении со здоровыми добровольцами. В исследовании не принимали участия пациенты с тяжелыми нарушениями функции печени (класс С по шкале Чайлд-Пью).
Показания к применению
- Местнораспространенный, метастатический или рецидивирующий немелкоклеточный рак легкого (аденокарцинома) после химиотерапии первой линии в комбинации с доцетакселом.
- Идиопатический легочный фиброз (идиопатический фиброзирующий альвеолит); для лечения и замедления прогрессирования заболевания.
- Интерстициальные заболевания легких при системной склеродермии
Противопоказания
- Гиперчувствительность к нинтеданибу, сое или арахису, или любому вспомогательному компоненту препарата;
- беременность и период грудного вскармливания;
- нарушения функции печени средней и тяжелой степени тяжести (опыт применения отсутствует);
- тяжелые нарушения функции почек (клиренс креатинина < 30 мл/мин) (опыт применения отсутствует)*;
- активные метастазы в головной мозг (опыт применения отсутствует);
- возраст младше 18 лет (опыт применения отсутствует).
* Эффективность и безопасность нинтеданиба у пациентов с тяжелыми нарушениями функции почек (клиренс креатинина < 30 мл/мин) не были изучены. Через почки выводится менее 1 % разовой дозы нинтеданиба.
В отношении противопоказаний для доцетаксела, пожалуйста, обратитесь к соответствующей инструкции по применению этого препарата.
С осторожностью
Нарушения функции печени легкой степени тяжести; наследственная предрасположенность к кровотечениям (болезнь фон Виллебранда); стабильные метастазы в головной мозг; терапия антикоагулянтами; венозные тромбоэмболии; перфорации ЖКТ в анамнезе; пациенты, которые ранее подвергались абдоминальным хирургическим вмешательствам; артериальная тромбоэмболия.
Применение при беременности и в период грудного вскармливания
Беременность
Специальных исследований по применению препарата ВАРГАТЕФ во время беременности у человека не проводилось, однако в доклинических исследованиях у животных установлена репродуктивная токсичность этого препарата. Поскольку нинтеданиб может обладать эмбриотоксическим действием у человека, он не должен применяться во время беременности, поэтому перед началом лечения необходимо проведение теста на беременность, а также во время терапии по мере необходимости. Пациенткам следует немедленно сообщить врачу о развитии беременности во время терапии препаратом ВАРГАТЕФ. Если во время терапии развивается беременность, необходимо прекратить лечение препаратом ВАРГАТЕФ и проинформировать пациентку о потенциальной опасности эмбриотоксического воздействия препарата. Применение нинтеданиба может быть вредно для плода. Женщинам детородного возраста, принимающим препарат ВАРГАТЕФ, следует рекомендовать избегать наступления беременности во время лечения препаратом ВАРГАТЕФ и использовать высокоэффективные методы контрацепции во время применения препарата и на протяжении, по крайней мере, 3 месяцев после приема последней дозы. В данный момент неизвестно, может ли нинтеданиб снижать эффективность гормональных контрацептивов, поэтому женщинам, использующим гормональные контрацептивы, необходимо использовать и барьерные методы контрацепции.
Грудное вскармливание
Специальных исследований у человека о выделении нинтеданиба и его метаболитов в грудное молоко не проводилось. В доклинических исследованиях показано, что у крыс в период лактации в грудное молоко проникает небольшое количество нинтеданиба и его метаболитов (≤ 0,5 % от величины применявшейся дозы). Поэтому нельзя исключить риск для новорожденных и грудных детей. Во время лечения препаратом ВАРГАТЕФ кормление грудью следует прекратить.
Фертильность
В доклинических исследованиях признаков нарушений фертильности у самцов выявлено не было. В субхронических и хронических исследованиях токсичности, во время которых уровень системного воздействия препарата был сравним с уровнем, достигающимся при использовании максимальной рекомендуемой дозы у человека, признаков нарушений фертильности у самок крыс обнаружено не было.
За информацией о влиянии доцетаксела на беременность, грудное вскармливание и фертильность, пожалуйста, обратитесь к соответствующей инструкции по применению этого препарата.
Способ применения и дозы
Капсулы принимают внутрь предпочтительно во время еды. Капсулы следует проглатывать целиком, запивая водой, не разжевывая и не разламывая.
Пропуск дозы
Если какая-либо доза препарата ВАРГАТЕФ была пропущена, то следует продолжить прием препарата в изначально рекомендуемой дозе по расписанию следующего приема препарата. Если доза была пропущена, пациент не должен принимать дополнительную дозу препарата.
НМРЛ
Лечение препаратом ВАРГАТЕФ следует назначать и проводить под контролем врача, имеющего опыт в назначении противоопухолевой терапии.
Рекомендуемая доза препарата ВАРГАТЕФ составляет 200 мг два раза в день с интервалом примерно в 12 часов со 2 по 21 день стандартного 21-дневного цикла лечения доцетакселом.
ВАРГАТЕФ не должен применяться в день начала химиотерапии доцетакселом, т.е. в 1 день лечения.
Максимальная рекомендуемая суточная доза составляет 400 мг.
После окончания применения доцетаксела можно продолжить терапию препаратом ВАРГАТЕФ до тех пор, пока сохраняется клинический эффект, или до развития неприемлемой токсичности.
Изменение дозы в случае развития нежелательных реакций
В качестве первоначальной меры для устранения нежелательных реакций рекомендуется временный перерыв в лечении препаратом ВАРГАТЕФ до тех пор, пока нежелательная реакция не снизится до уровня, который позволит возобновить терапию (см. Таблицы 1 и 2). Лечение может возобновляться в уменьшенной дозе.
Для обеспечения индивидуальной безопасности и переносимости рекомендуется снижение суточной дозы препарата на 100 мг (т.е. уменьшение разовой дозы на 50 мг), как это описывается в Таблицах 1 и 2. Если нежелательная реакция (реакции) сохраняется, т.е. если пациент не переносит препарат в дозе 100 мг два раза в день, лечение препаратом нужно окончательно прекратить.
В случае специфического повышения активности АСТ/АЛТ более чем в 3 раза по сравнению с ВГН в сочетании с повышением концентрации общего билирубина в 2 и более раза по сравнению с ВГН и щелочной фосфатазы (ЩФ) менее чем в 2 раза по сравнению с ВГН (см. Таблицу 2), применение препарата ВАРГАТЕФ следует временно прекратить. Если не будет установлена альтернативная причина нарушений, ВАРГАТЕФ должен быть окончательно отменен.
Таблица 1.
Информация об изменении дозы в случае развития диареи, рвоты и других негематологических или гематологических нежелательных явлений, исключая повышение уровней печеночных ферментов (см. Таблицу 2).
|
Нежелательная реакция* |
Изменение дозы |
|
Диарея 2 степени тяжести в течение более 7 дней подряд, несмотря на антидиарейное лечение. |
После временного прекращения лечения и уменьшения тяжести реакции до 1 степени или восстановления исходного состояния пациента рекомендуется снижение дозы с 200 мг два раза в день до 150 мг два раза в день. |
|
Рвота ≥ 2 степени тяжести Другая негематологическая или |
* Общие терминологические критерии для нежелательных явлений — СТСАЕ (Common Terminology Criteria for Adverse Events)
Таблица 2.
Информация об изменении дозы в случае повышения активности ACT и/или АЛТ и повышения концентрации билирубина.
|
Повышение АСТ/АЛТ и билирубина |
Изменение дозы |
|
Повышение активности ACT и/или АЛТ в > 2,5 раза по сравнению с ВГН в сочетании с повышением общего билирубина в ≥ 1,5 раза по сравнению с ВГН. |
После временного прекращения лечения и снижения активности трансаминаз до ≤ 2,5 раза по сравнению с ВГН в сочетании со снижением билирубина до нормы, доза снижается с 200 мг 2 раза в день до 150 мг 2 раза в день и, если еще одно снижение дозы считается необходимым, то со 150 мг 2 раза в день до 100 мг два раза в день. |
|
Повышение значений ACT и/или АЛТ в > 3 раза по сравнению с ВГН в сочетании с повышением общего билирубина в ≥ 2 раза по сравнению с ВГН и повышением ЩФ в < 2 раза по сравнению с ВГН. |
Если альтернативная причина нарушений не будет установлена, то препарат ВАРГАТЕФ должен быть окончательно отменен. |
ИЛФ и ИЗЛ-ССД
Лечение препаратом ВАРГАТЕФ следует назначать и проводить под контролем врача, имеющего опыт диагностики и лечения заболеваний, при которых показан препарат. Рекомендуемая доза препарата составляет 150 мг два раза в день, приблизительно через каждые 12 часов.
Максимальная суточная доза составляет 300 мг.
Изменение дозы в случае развития нежелательных реакций
При развитии нежелательных реакций таких, как диарея, тошнота и рвота в дополнение к симптоматической терапии, при необходимости, рекомендуется снижение дозы или временное прерывание лечения до тех пор, пока нежелательная реакция не снизится до уровня, который позволит возобновить терапию. Лечение препаратом ВАРГАТЕФ может быть возобновлено в полной дозе (150 мг два раза в день) или в сниженной дозе (100 мг два раза в день). Если пациент не переносит дозу препарата 100 мг два раза в день, лечение препаратом ВАРГАТЕФ следует прекратить.
В случае прерывания лечения вследствие повышения активности трансаминаз (ACT или АЛТ) более чем в 3 раза по сравнению с ВГН после восстановления показателей до нормальных значений рекомендовано возобновить терапию в уменьшенной дозе (100 мг два раза в день). Впоследствии доза может быть увеличена до полной дозы (150 мг два раза в день).
Особые группы пациентов
Детский возраст
Безопасность и эффективность препарата ВАРГАТЕФ у пациентов детского возраста в клинических исследованиях не изучалась.
Пожилой возраст (>65 лет)
Не отмечено никаких общих различий по безопасности и эффективности применения препарата у пожилых пациентов по сравнению с пациентами моложе 65 лет. Исходной коррекции дозы препарата на основании возраста пациента не требуется.
Раса и масса тела
Основываясь на данных популяционного фармакокинетического анализа, исходная коррекция дозы препарата ВАРГАТЕФ в зависимости от расы или массы тела не требуется. Данные по безопасности у пациентов негроидной расы ограничены.
Нарушения функции почек
Через почки выводится менее 1 % однократной дозы нинтеданиба. У пациентов с нарушениями функции почек легкой или средней степени тяжести изменения начальной дозы не требуется. У пациентов с тяжелыми нарушениями функции почек (клиренс креатинина < 30 мл/мин) безопасность, эффективность и фармакокинетика нинтеданиба не изучались.
Нарушения функции печени
Нинтеданиб выводится преимущественно с желчью (через кишечник) (> 90 %). У пациентов с нарушениями функции печени (класс А по шкале Чайлд-Пью, класс В по шкале Чайлд-Пью), концентрация препарата в крови повышалась.
У пациентов с нарушениями функции печени средней и тяжелой степени тяжести (классы В и С по шкале Чайлд-Пью) безопасность, эффективность и фармакокинетика нинтеданиба не изучались. Поэтому лечение пациентов с нарушениями функции печени средней и тяжелой степени тяжести препаратом ВАРГАТЕФ не рекомендуется.
НМРЛ
У пациентов с нарушениями функции печени легкой степени тяжести (класс А по шкале Чайлд-Пью), изменения начальной дозы не требуется.
ИЛФ и ИЗЛ-ССД
Для пациентов с нарушениями функции печени легкой степени тяжести (класс А по шкале Чайлд-Пью) рекомендованная доза препарата ВАРГАТЕФ составляет 100 мг два раза в день с интервалом примерно в 12 часов.
В случае пациентов с нарушениями функции печени легкой степени тяжести (класс А по шкале Чайлд-Пью) для устранения нежелательных реакций следует рассмотреть возможность временного перерыва в лечении препаратом или окончательного прекращения терапии.
За информацией о дозировании, способе применения и модификации дозы доцетаксела, пожалуйста, обратитесь к соответствующей инструкции по применению этого препарата.
Побочное действие
Частота побочных реакций, приведенных ниже, изложена в соответствии со следующей градацией: очень часто (≥ 1/10); часто (≥ 1/100; < 1/10); нечасто (≥ 1/1000; < 1/100); редко (≥ 1/10000; < 1/1000); очень редко (< 1/10000), неизвестно (частота не может быть оценена по доступным данным). Данные о побочных реакциях также учитывают опыт пострегистрационного применения.
НМРЛ
Наиболее часто сообщавшимися нежелательными реакциями, считавшимися связанными с применением препарата ВАРГАТЕФ, были диарея, повышение активности ферментов печени (АЛТ и ACT) и рвота.
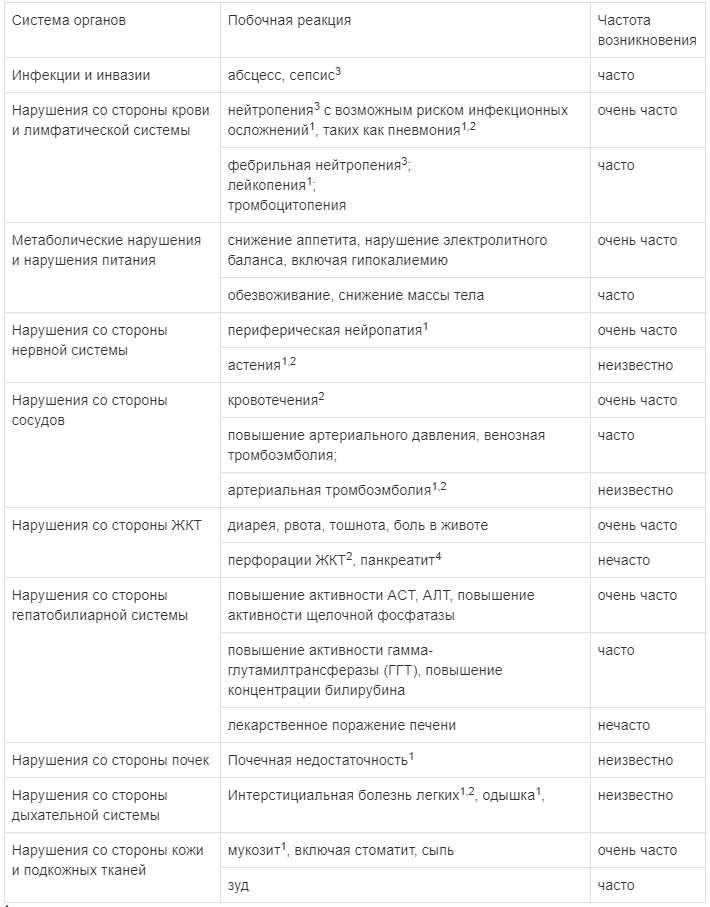 1 — Данные побочные реакции наблюдались при проведении клинических исследований, однако связь с приемом препарата ВАРГАТЕФ не доказана.
1 — Данные побочные реакции наблюдались при проведении клинических исследований, однако связь с приемом препарата ВАРГАТЕФ не доказана.
2 — В клинических исследованиях частота встречаемости данных побочных реакций у пациентов, принимавших нинтеданиб в комбинации с доцетакселом, не превышала частоту встречаемости таковых у пациентов, принимавших плацебо в комбинации с доцетакселом.
3 — Пожалуйста, обратитесь также к инструкции по медицинскому применению доцетаксела.
4 — Случаи панкреатита были зафиксированы у пациентов, принимавших нинтеданиб при лечении ИЛФ и НМРЛ. Большая часть этих случаев была зафиксирована у пациентов с показанием ИЛФ.
Диарея является часто сообщавшимся нежелательным явлением со стороны ЖКТ. Отмечается тесная временная связь между развитием диареи и применением доцетаксела. В клиническом исследовании LUME-Lung 1 диарея легкой и средней степени тяжести отмечалась у большинства пациентов. Диарея ≥ 3 степени тяжести при использовании комбинированного лечения отмечалась у 6,3 % пациентов, тогда как при использовании одного доцетаксела — только у 3,6 % пациентов.
Такие часто сообщающиеся побочные эффекты, как тошнота и рвота, в большинстве случаев были легкой или средней степени тяжести.
По данным клинических исследований, применение препарата ВАРГАТЕФ в комбинации с доцетакселом сопровождалось более частым развитием нейтропении ≥ 3 степени тяжести (по критериям СТСАЕ), чем в случае применения одного доцетаксела.
Повышение активности печеночных ферментов (АЛТ, ACT, ЩФ, гамма-глутамилтрансфераза (ГГТ)) и концентрации билирубина было в большинстве случаев обратимым при уменьшении дозы или прерывании терапии.
Ингибирование VEGFR способно привести к увеличению риска кровотечений. В клинических исследованиях у пациентов с аденокарциномой, принимавших ВАРГАТЕФ. повышение частоты кровотечений было сравнимо в обеих лечебных группах. Самым частым видом кровотечений было носовое кровотечение легкой или средней степени тяжести. Дисбаланса легочных или смертельных кровотечений не наблюдалось, о церебральных кровотечениях не сообщалось. Большинство летальных кровотечений были опухоль — ассоциированными.
В пострегистрационном периоде наблюдались случаи несерьезных и серьезных кровотечений, некоторые из которых приводили к летальному исходу. У пациентов с кровотечениями 3 или 4 степени тяжести следует тщательно оценить пользу и риски продолжения терапии препаратом ВАРГАТЕФ, а также необходимо рассмотреть возможность прекращения данной терапии. При возобновлении терапии препаратом ВАРГАТЕФ рекомендуется использовать сниженную суточную дозу.
Частота артериальных тромбоэмболий в двух лечебных группах исследования LUME-Lung 1 была сравнимой. Пациенты с недавно перенесенным инфарктом миокарда или инсультом из исследования исключались.
Частота перфораций ЖКТ в отдельных лечебных группах в клинических исследованиях была сопоставима.
ИЛФ и ИЗЛ-ССД
Наиболее часто сообщавшимися нежелательными реакциями, связанными с применением нинтеданиба, были диарея, тошнота и рвота, боль в области живота, снижение аппетита, снижение массы тела и повышение активности ферментов печени.
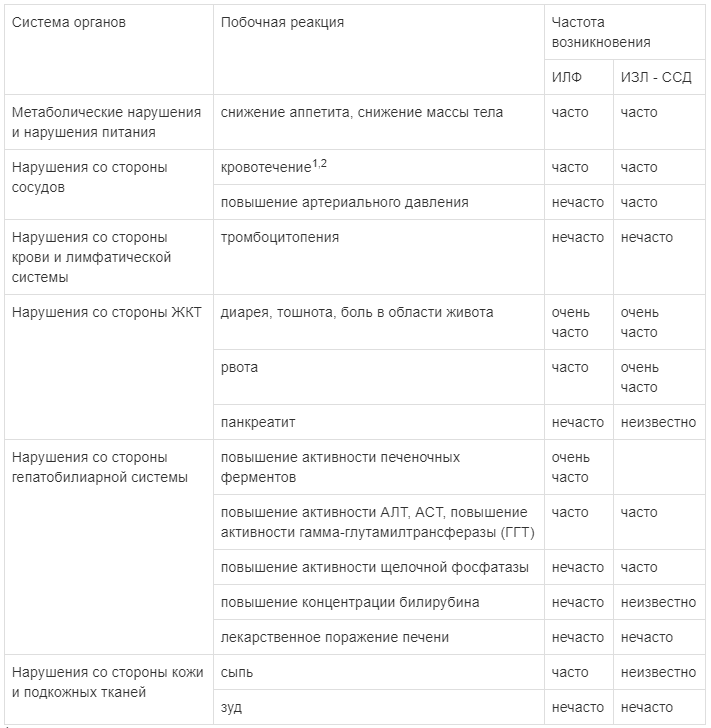 1 — Представленный термин описывает более широкую группу нежелательных явлений, нежели чем отдельное состояние или термин, предусмотренный MedDRA.
1 — Представленный термин описывает более широкую группу нежелательных явлений, нежели чем отдельное состояние или термин, предусмотренный MedDRA.
2 — В пострегистрационном периоде наблюдались случаи несерьезных и серьезных кровотечений, некоторые из которых приводили к летальному исходу.
В клинических исследованиях диарея была наиболее часто репортируемым желудочно-кишечным явлением. У большинства пациентов данные явления были легкой и средней степени тяжести и отмечались на протяжении первых 3 месяцев лечения. В исследованиях INPULSIS у пациентов с ИЛФ диарея отмечалась у 62,4 % по сравнению с 18,4% пациентов, получавших препарат ВАРГАТЕФ или плацебо, соответственно. Диарея стала причиной снижения дозы у 10,7 % пациентов, а прекращения терапии препаратом ВАРГАТЕФ — у 4,4 % пациентов. В исследовании SENSCIS у пациентов с ИЗЛ-ССД диарея отмечалась у 75,7 % в сравнении с 31,6 % пациентов, получавших препарат ВАРГАТЕФ и плацебо, соответственно. Диарея стала причиной снижения дозы препарата ВАРГАТЕФ у 22,2 % пациентов и причиной прекращения терапии препаратом у 6,9 % пациентов.
Тошнота и рвота были часто сообщаемыми нежелательными явлениями. У большинства пациентов отмечалась тошнота и рвота легкой или средней степени тяжести. Тошнота стала причиной прекращения лечения препаратом нинтеданиб у 2 % пациентов. Рвота стала причиной прекращения лечения у 0.8 % пациентов.
Ингибирование VEGFR может быть связано с повышением риска развития кровотечений. В клинических исследованиях частота развития кровотечений у пациентов была немного выше в группе препарата ВАРГАТЕФ (10,3% в исследовании INPULSIS, 11,1 % в исследовании SENSIS), по сравнению с группой плацебо (7.8 % в исследовании INPULSIS, 8,3 % в исследовании SENSIS). Наиболее частыми нежелательными явлениями в виде кровотечений были носовые кровотечения, не относившиеся к категории серьезных. Серьезные кровотечения возникали нечасто и с одинаковой частотой в обеих лечебных группах (плацебо -1,4%; ВАРГАТЕФ — 1,3%). В исследовании SENSCIS серьезные кровотечения возникали нечасто в обеих группах лечения (плацебо — 0,7 %, ВАРГАТЕФ — 1,4 %).
В пострегистрационном периоде наблюдались случаи несерьезных и серьезных кровотечений, некоторые из которых приводили к летальному исходу. Из клинических исследований исключались пациенты с инфарктом миокарда или инсультом в ближайшем анамнезе. В исследовании INPULSIS случаи развития артериальной тромбоэмболии встречались редко: у 0,7 % пациентов, получавших плацебо, и 2,5 % пациентов в группе, получавших препарат ВАРГАТЕФ. В то время как нежелательные реакции в виде ишемической болезни сердца были сравнимы в группах нинтеданиба и плацебо, пациентов, у которых развился инфаркт миокарда, оказалось больше в группе препарата ВАРГАТЕФ (1,6%) по сравнению с группой плацебо (0,5 %). В исследовании SENSCIS случаи развития артериальной тромбоэмболии встречались редко: у 0,7 % пациентов, получавших плацебо, и у 0,7 % пациентов в группе, получавшей препарат ВАРГАТЕФ. Инфаркт миокарда встречался редко в группе плацебо (0,7 %) и не встречался в группе пациентов, получавших препарат ВАРГАТЕФ.
Передозировка
Симптомы
В клинических исследованиях нинтеданиб изучался в наивысшей однократной дозе 450 мг один раз в день. Также зафиксированы случаи передозировки при применении препарата в максимальной дозе 600 мг в течение восьми дней. Наблюдавшиеся нежелательные явления были сопоставимы с известным профилем безопасности нинтеданиба: увеличение активности ферментов печени и нарушения со стороны ЖКТ. Пациенты полностью восстановились после нежелательных явлений. В исследованиях INPULSIS был зафиксирован один случай непреднамеренного повышения дозы до 600 мг 2 раза в день на протяжении 21 дня у пациента с ИЛФ. В период некорректного приема препарата было зафиксировано развитие несерьезного нежелательного явления (назофарингит), которое купировалось в данном периоде без регистрации каких-либо других нежелательных реакций.
Лечение
Специфического антидота на случай передозировки нет. При подозрении на передозировку необходимо отменить ВАРГАТЕФ и проводить симптоматическую терапию.
Взаимодействие с другими лекарственными препаратами
Индукторы/ингибиторы P-gp
Нинтеданиб является субстратом для P-gp. Показано, что совместное применение с активным ингибитором P-gp кетоконазолом увеличивает экспозицию нинтеданиба, судя по величине AUC, в 1,61 раза, а судя по величине Сmах, в 1,83 раза.ли эритромицин) в случае совместного применения с препаратом ВАРГАТЕФ могут увеличивать экспозицию нинтеданиба. У таких пациентов переносимость нинтеданиба должна тщательно мониторироваться.
Активные индукторы P-gp (например, рифампицин, карбамазепин, фенитоин и препараты зверобоя продырявленного) могут уменьшать экспозицию нинтеданиба. Рекомендуется подбор альтернативной сопутствующей терапии с отсутствием или минимальным индуцирующим действием на систему P-gp.
Изоферменты CYP
Изоферменты CYP принимают лишь небольшое участие в биотрансформации нинтеданиба. В доклинических исследованиях нинтеданиб и его метаболиты (свободный кислый метаболит нинтеданиба и его глюкуронид) не ингибировали и не индуцировали изоферменты CYP. Поэтому вероятность лекарственных взаимодействий с нинтеданибом, основанных на влиянии на изоферменты CYP, считается небольшой.
Одновременная терапия с пирфенидоном
Было проведено изучение совместного применения нинтеданиба и пирфенидона у пациентов с ИЛФ в рамках специального фармакокинетического исследования. Пациенты первой группы получали однократную дозу 150 мг нинтеданиба до начала постепенного повышения дозы пирфенидона до максимальной (по 801 мг три раза в сутки), и еще одну дозу нинтеданиба 150 мг по достижении равновесного состояния (в последний день). Пациенты второй группы получали пирфенидон в постоянной дозе 801 мг три раза в сутки. У них была проведена оценка ФК профиля до начала совместной терапии и через 7 дней совместного приема нинтеданиба в дозировке 150 мг два раза в сутки. В первой группе скорректированные соотношения среднегеометрических значений (90 % доверительный интервал (ДИ) составляли 93% (57-151%) и 96% (70-131%) для показателей Сmах и AUCo-tz нинтеданиба соответственно (n=12). Во второй группе скорректированные соотношения среднегеометрических значений (90 % ДИ) составляли 97% (86-110%) и 95% (86-106 %) для показателей Cmax,ss и AUCτ,ss пирфенидона соответственно (n=12).
На основании полученных результатов можно сделать вывод об отсутствии признаков значимого фармакокинетического взаимодействия между нинтеданибом и пирфенидоном при совместном применении.
Одновременное применение с другими препаратами
Одновременное применение нинтеданиба с доцетакселом (75 мг/м2) в существенной степени не изменяет фармакокинетику этих препаратов.
Одновременное применение нинтеданиба с бозентаном не изменяет фармакокинетику нинтеданиба.
Возможность взаимодействий нинтеданиба с гормональными контрацептивными средствами не изучалась.
Одновременный прием с пищей
ВАРГАТЕФ рекомендуется принимать одновременно с пищей (см. раздел «Фармакокинетика»).
Особые указания
Желудочно-кишечные расстройства
— диарея
Лечение диареи (адекватная гидратация и антидиарейные лекарственные средства, например, лоперамид) следует проводить при появлении первых признаков. В случае развития диареи может потребоваться прерывание лечения, снижение дозы или прекращение терапии.
— тошнота и рвота
В случае сохранения симптомов тошноты и рвоты, несмотря на симптоматическое лечение (включая противорвотную терапию), может потребоваться снижение дозы, прерывание лечения или прекращение терапии.
Диарея и рвота могут приводить к обезвоживанию с нарушением или без нарушения водно-электролитного баланса, что может приводить к нарушениям функции почек. В случае обезвоживания рекомендуется восстановление водно-электролитного баланса.
Если возникают существенные желудочно-кишечные нежелательные явления, то необходимо проведение мониторирования концентрации электролитов в крови.
Нейтропения и сепсис
Во время терапии НМРЛ препаратом ВАРГАТЕФ, в частности при комбинации его с доцетакселом, необходимо проводить мониторинг форменных элементов крови на предмет развития нейтропении и возможных последующих осложнений в виде сепсиса или фебрильной нейтропении. Частое мониторирование всех форменных элементов крови следует осуществлять в начале каждого курса лечения у пациентов, получающих лечение нинтеданибом в комбинации с доцетакселом, в период наименьших значений нейтрофилов, а также при наличии клинических показаний после окончания последнего курса терапии данной комбинацией.
Нарушения функции печени
Безопасность и эффективность препарата не изучались у пациентов с нарушениями функции печени средней (класс В по шкале Чайлд-Пью) или тяжелой (класс С по шкале Чайлд-Пью) степени тяжести. Поэтому у таких пациентов применение препарата ВАРГАТЕФ не рекомендуется.
НМРЛ
В связи с повышением концентрации препарата в крови риск развития нежелательных явлений может быть выше у пациентов с легкими нарушениями функции печени (класс А по шкале Чайлд-Пью).
При проведении терапии нинтеданибом наблюдались случаи лекарственного поражения печени. В пострегистрационном периоде были получены сообщения о тяжелых формах лекарственного поражения печени с летальным исходом.
После начала терапии рекомендуется тщательный контроль активности печеночных трансаминаз, щелочной фосфатазы и концентрации билирубина (периодически, во время начала комбинированной терапии с доцетакселом, т.е. в начале каждого лечебного курса). Если отмечается существенное повышение активности печеночных ферментов, может потребоваться прерывание лечения, уменьшение дозы или прекращение терапии препаратом ВАРГАТЕФ.
При начале комбинированного лечения препаратом ВАРГАТЕФ и доцетакселом должны определяться уровни трансаминаз, ЩФ и билирубина. Эти показатели следует мониторировать в зависимости от клинических показаний или периодически во время лечения, например, в фазе комбинации с доцетакселом в начале каждого курса терапии и ежемесячно, если прием препарата ВАРГАТЕФ продолжается в виде монотерапии после прекращения терапии доцетакселом.
Если выявляется соответствующее повышение ферментов печени, может потребоваться перерыв в лечении, снижение дозы или прекращение терапии препаратом ВАРГАТЕФ (см. раздел «Способ применения и дозы»/ Таблица 2). Следует проводить поиск альтернативных причин повышения активности ферментов печени и принятие соответствующих мер при необходимости.
В случае повышения активности ферментов печени (АСТ/АЛТ) более чем в 3 раза по сравнению с ВЕН в сочетании с повышением уровня билирубина в 2 и более раза по сравнению с ВЕН, и повышением ЩФ менее чем в 2 раза по сравнению с ВГН, терапию препаратом ВАРГАТЕФ следует прервать. Если не будет установлена альтернативная причина изменений этих лабораторных показателей, препарат ВАРГАТЕФ следует окончательно отменить.
Для пациентов женского пола и азиатского происхождения характерен более высокий риск повышения активности печеночных ферментов.
Увеличение экспозиции нинтеданиба характеризовалось линейной зависимостью от возраста пациента, а также было обратно пропорционально массе тела, что также может повлечь за собой более высокий риск повышения активности печеночных ферментов. У пациентов с этими факторами риска рекомендуется тщательный контроль показателей функции печени.
ИЛФ и ИЗЛ-ССД
В связи с повышением концентрации препарата в крови риск развития нежелательных явлений может быть выше у пациентов с легкими нарушениями функции печени (класс А по шкале Чайлд-Пью). Пациенты с легкими нарушениями функции печени (класс А по шкале Чайлд-Пью) должны получать сниженную дозу препарата ВАРГАТЕФ.
При проведении терапии нинтеданибом наблюдались случаи лекарственного поражения печени. В пострегистрационном периоде были получены сообщения о несерьезных и серьезных случаях лекарственного поражения печени, включая тяжелые формы лекарственного поражения печени с летальным исходом.
Большая часть нарушений со стороны печени наблюдаются в течение первых 3-х месяцев терапии. Таким образом, рекомендуется оценивать активность печеночных трансаминаз и концентрацию билирубина до начала терапии препаратом ВАРГАТЕФ регулярно в течение первых трех месяцев терапии, а затем периодически во время лечения (например, при каждом визите пациента) или по клиническим показаниям.
Повышение активности печеночных ферментов (АЛТ, ACT, ЩФ. гамма-глутамилтрансфераза (ГГТ)) и билирубина было в большинстве случаев обратимым при уменьшении дозы или прерывании терапии.
В случае повышения уровня трансаминаз (ACT или АЛТ) более чем в 3 раза выше ВГН рекомендовано уменьшить дозу или прервать терапию препаратом ВАРГАТЕФ и проводить мониторирование пациента. Как только показатели трансаминаз вернутся к исходному уровню, доза препарата ВАРГАТЕФ может быть вновь повышена до полной (150 мг два раза в день) или лечение может быть возобновлено в сниженной дозе (100 мг два раза в день), которая впоследствии может быть повышена до полной дозы. Если повышение каких-либо показателей функции печени сопровождается клиническими признаками или симптомами повреждения печени, например, желтухой, лечение препаратом следует окончательно прекратить. Следует провести поиск альтернативных причин повышения активности ферментов печени.
Для пациентов с низкой массой тела (<65 кг), лиц азиатского происхождения и пациентов женского пола характерен более высокий риск повышения активности печеночных ферментов.
Увеличение экспозиции нинтеданиба характеризовалось линейной зависимостью от возраста пациента, что также может повлечь за собой более высокий риск повышения активности печеночных ферментов.
У пациентов с этими факторами риска рекомендуется тщательный контроль показателей функции печени.
Риск развития кровотечений
Данных о применении препарата ВАРГАТЕФ у пациентов с наследственной предрасположенностью к кровотечениям (например, болезнь фон Виллебранда) не имеется.
НМРЛ
Пациенты с недавно отмечавшимся легочным кровотечением (> 2,5 мл крови), а также пациенты с центрально расположенными опухолями и рентгенологическими признаками локальной инвазии крупных сосудов или с рентгенологическими признаками наличия полостей или некротических изменений опухоли исключались из клинических исследований. Поэтому применение препарата ВАРГАТЕФ у таких пациентов не рекомендуется.
— метастазы в головной мозг
Увеличения частоты церебральных кровотечений у пациентов с ранее адекватно лечеными метастазами в головной мозг (стабильными в течение ≥ 4 недель до начала лечения препаратом ВАРГАТЕФ) не наблюдалось. Однако такие пациенты должны тщательно мониторироваться в отношении признаков и симптомов церебральных кровотечений.
Пациенты с активными метастазами в головной мозг исключались из клинических исследований, применение препарата ВАРГАТЕФ у них не рекомендуется.
— терапия антикоагулянтами
В клинические исследования включались пациенты, получавшие длительную терапию низкомолекулярными гепаринами в низких дозах или ацетилсалициловой кислотой в дозах ≤ 325 мг/сут. Увеличения частоты кровотечений у таких пациентов не наблюдалось. Данных о применении препарата ВАРГАТЕФ у пациентов, предварительно получавших лечение антикоагулянтами в более высоких дозах, не имеется. Пациентам, у которых во время лечения препаратом ВАРГАТЕФ развивались тромбоэмболические нарушения, в связи с чем требовалась терапия антикоагулянтами, разрешалось продолжить прием препарата ВАРГАТЕФ, при этом увеличения частоты кровотечений не отмечалось. У пациентов, принимающих такие антикоагулянты, как варфарин или фенпрокумон, необходимо регулярно проверять протромбиновое время, международное нормализованное отношение (МНО) или следить за клиническими признаками кровотечений.
ИЛФ и ИЗЛ-ССД
В клинические исследования не включались пациенты с известным риском развития кровотечений, включая пациентов с наследственной предрасположенностью к кровотечениям или пациентов, получающих антикоагулянтную терапию в высоких дозах. Следовательно, данной категории пациентов лечение препаратом ВАРГАТЕФ должно быть назначено только в том случае, если потенциальная польза проводимой терапии превышает потенциальный риск.
Артериальная тромбоэмболия
Необходимо соблюдать осторожность при лечении пациентов с высоким сердечнососудистым риском, включая ишемическую болезнь сердца. Следует рассмотреть возможность перерыва в лечении пациентов, у которых развились симптомы острой ишемии миокарда.
Венозная тромбоэмболия
НМРЛ
У пациентов, получающих ВАРГАТЕФ, отмечался повышенный риск венозных тромбоэмболий, в том числе тромбоза глубоких вен. Пациенты должны тщательно мониторироваться в отношении тромбоэмболических нарушений. Пациентам с опасными для жизни венозными тромбоэмболиями ВАРГАТЕФ необходимо отменить.
ИЛФ и ИЗЛ-ССД
В клинических исследованиях не наблюдалось повышенного риска развития венозных тромбоэмболических осложнений. Однако в связи с особенностями механизма действия нинтеданиба. у пациентов может отмечаться повышенный риск развития тромбоэмболических явлений.
Перфорации ЖКТ
Частота перфораций ЖКТ в отдельных лечебных группах в клинических исследованиях была сопоставима. Основываясь на механизме действия препарата ВАРГАТЕФ. у пациентов возможен повышенный риск перфораций ЖКТ. В пострегистрационном периоде были получены сообщения о случаях перфорации ЖКТ, некоторые из которых приводили к летальному исходу. Особое внимание должно уделяться лечению пациентов, которые ранее подвергались абдоминальным хирургическим вмешательствам, или перенесших перфорацию полого органа в недавнем анамнезе, а также пациентов с ИЛФ, имеющих в анамнезе пептическую язву, дивертикулез или получающих сопутствующую терапию глюкокортикостероидами или НПВП. В связи с этим ВАРГАТЕФ может применяться только как минимум через 4 недели после больших хирургических, включая абдоминальные, вмешательств. В случае возникновения гастроинтестинальной перфорации терапия препаратом ВАРГАТЕФ должна прекращаться.
Нарушение заживления ран
Нинтеданиб, в связи с особенностями механизма действия, может нарушать заживление ран. В клинических исследованиях увеличения частоты нарушений заживления ран не наблюдалось. Специальных исследований, в которых бы изучалось влияние нинтеданиба на заживление ран, не проводилось. Поэтому лечение должно начинаться или возобновляться (если осуществлялся перерыв в связи с хирургическим вмешательством) с учетом клинического мнения об адекватности заживления раны.
Особые группы пациентов
В исследовании LUME-Lung 1 у пациентов с массой тела менее 50 кг, принимавших нинтеданиб в сочетании с доцетакселом, наблюдалась более высокая частота развития серьезных нежелательных явлений, чем у пациентов с массой тела ≥ 50 кг, хотя число пациентов с массой тела менее 50 кг было небольшим. Поэтому рекомендуется тщательное наблюдение за пациентами с массой тела менее 50 кг.
Влияние препарата на способность управления транспортными средствами, механизмами
Исследований по влиянию препарата на способность управлять транспортными средствами и занятию другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций не проводилось.
Во время применения препарата ВАРГАТЕФ пациентам нужно рекомендовать соблюдать осторожность при управлении транспортными средствами или механизмами.
Форма выпуска
Капсулы 100 мг
По 10 капсул в А1/А1 блистер. 6 блистеров в пачку картонную с инструкцией по медицинскому применению.
или
По 10 капсул в А1/А1 блистер. 6 блистеров в пачку картонную с инструкцией по медицинскому применению. По 2 пачки картонные в пленку из полипропилена.
Капсулы 150 мг
По 10 капсул в А1/А1 блистер. 6 блистеров в пачку картонную с инструкцией по медицинскому применению.
Условия хранения
Хранить в оригинальной упаковке при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать после истечения срока годности.
Условия отпуска
Отпускается по рецепту.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Берингер Ингельхайм Интернешнл ГмбХ
55216, Бингер Штрассе 173, Ингельхайм-на-Рейне, Германия
Наименование и адрес места осуществления производства лекарственного препарата
Производитель готовой лекарственной формы
Каталент Германия Эбербах ГмбХ
69412, Гаммельсбахер Штр. 2, Эбербах, Германия
Первичная, вторичная упаковка и выпускающий контроль качества
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ
55216, Бингер Штрассе 173, Ингельхайм-на-Рейне, Германия
Получить дополнительную информацию о препарате, а также направить свои претензии и информацию о нежелательных явлениях можно по следующему адресу в России
ООО «Берингер Ингельхайм»
125171, Москва, Ленинградское шоссе, 16А, стр.З
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
© КУДЕЛЯ Л. М., МАНАКОВА Я. Л., ХУСАИНОВА Е. С. УДК [616.24-002.17 : 616.24-007]-06-085 DOI: 10.20333/2500136-2018-5-99-103
ОПЫТ ПРИМЕНЕНИЯ НИНТЕДАНИБА У ПАЦИЕНТА С ИДИОПАТИЧЕСКИМ ЛЁГОЧНЫМ ФИБРОЗОМ И ЭМФИЗЕМОЙ
Л. М. Куделя1,2, Я. Л. Манакова1,2, Е. С. Хусаинова2
Государственная Новосибирская областная клиническая больница, Новосибирск 630087, Российская Федерация 2Новосибирский государственный медицинский университет, Новосибирск 630091, Российская Федерация
Резюме. Идиопатический легочный фиброз (ИЛФ) является прогрессирующим фибротическим заболеванием легких, причина которого не известна. Оно характеризуется прогрессирующим снижением легочной функции, а при отсутствии специфического лечения неблагоприятным прогнозом. Далее представлено описание клинического случая идиопатического легочного фиброза в сочетании с эмфиземой с положительным клиническим и рентгенологическим ответом при назначении антифибротического препарата — нинтеданиба.
Ключевые слова: интерстициальные заболевания легких, идиопатический легочный фиброз, эмфизема, фенотип, клинический случай, перфинидон, нинтеданиб.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Для цитирования: Куделя ЛМ, Манакова ЯЛ, Хусаинова ЕС. Опыт применения нинтеданиба у пациента с идиопатическим лёгочным фиброзом и эмфиземой. Сибирское медицинское обозрение. 2018;(5):99-103. DOI: 10.20333/2500136-2018-5-99-103
EXPERIENCE OF NINTEDANIB USE IN THE PATIENT WITH IDIOPATHIC PULMONARY FIBROSIS AND EMPHYISEMA
L. M. Kudelya1,2, Y. L. Manakova1,2, E. S. Khusainova2
‘Novosibirsk Regional Clinical Hospital, Novosibirsk 630087, Russian Federation
Novosibirsk State Medical University, Novosibirsk 630091, Russian Federation
Abstract. Idiopathic pulmonary fibrosis (IPF) is a progressive fibrotic lung disease, the cause of which is unknown. It is characterized by a progressive decrease of pulmonary function, and by unfavorable prognosis in case of specific treatment absence. Further goes the description of a clinical case of idiopathic pulmonary fibrosis combined with emphysema with a positive clinical and radiological response for the prescribed antifibrotic — nintedanib. Key words: interstitial lung diseases, idiopathic pulmonary fibrosis, emphysema, phenotype, clinical case, pirfenidone, nintedanib. Conflict of interest. The authors declare the absence of obvious and potential conflicts of interest associated with the publication of this article. Citation: Kudelya LM, Manakova YL, Khusainova ES. Experience of nintedanib use in the patient with idiopathic pulmonary fibrosis and emphysema. Siberian Medical Review. 2018;(5):99-103. DOI: 10.20333/2500136-2018-5-99-103
Идиопатический легочный фиброз (ИЛФ) — это хроническое прогрессирующее заболевание неизвестной этиологии, которое является наиболее частой формой интерстициальных заболеваний легких, имеет гистологический и/или рентгенологический паттерн обычной интерстициальной пневмонии, встречается у людей пожилого и среднего возраста и характеризуется неблагоприятным прогнозом. ИЛФ относится к группе орфанных заболеваний. Согласно исследованиям с опросом всех крупных пульмонологических центров РФ, распространенность заболевания составляет около 9-11 случаев на 100 тыс. населения. Заболевание развивается преимущественно у мужчин старше 50 лет, однако, следует отметить, что наиболее часто ИЛФ встречается в возрасте 60-70 лет.
Считается, что идиопатический легочный фиброз имеет различные фенотипы заболевания. Можно выделить три фенотипа ИЛФ: комбинация легочного фиброза и эмфиземы (КЛФЭ), комбинация высокой легочной гипертензии (ЛГ) с ИЛФ, а также быстропро-грессирующий идиопатический легочный фиброз [1].
Самым частым является сочетание эмфиземы и ИЛФ, что связано с общим фактором риска этих заболеваний — курением. При проведении компьютерной томографии высокого разрешения (ВРКТ) у этих пациентов наряду с картиной обычной интерстици-альной пневмонии обнаруживаются признаки цен-трилобулярной и парасептальной эмфиземы в верхних долях. Сочетание эмфиземы и ИЛФ определяет худший прогноз по сравнению с классическим идио-патическим легочным фиброзом [2].
Куделя Л. М., Манакова Я. Л., Хусаинова Е. С. Kudelya L. M., Manakova Y. L., Khusainova E. S.
Опыт применения нинтеданиба у пациента с идиопатическим лёгочным фиброзом и эмфиземой Experience of nintedanib use in the patient with idiopathic pulmonary fibrosis and emphyisema
Сочетание легочной гипертензии и ИЛФ имеет место при обнаружении у больных с легочным фиброзом среднего давления в легочной артерии более 25 мм рт. ст. [3]. При прогрессировании ИЛФ распространённость ЛГ возрастает. Достоверно отмечено, что уровень давления в легочной артерии выше 17 мм рт. ст. ассоциирован с высокой летальностью в течение 5 лет у пациентов с ИЛФ [4].
Как было отмечено ранее, ИЛФ имеет прогрессирующее течение, у одних пациентов фиброз прогрессирует медленно, спустя 24 и более мес от начала заболевания, у других отмечается быстропрогрессиру-ющее течение — менее 6 мес от появления симптомов. Это связано с различной экспрессией генов у разных групп больных. При проведении иммуногистохими-ческого исследования легочных биоптатов у больных с быстрым прогрессированием заболевания наблюдалась выраженная экспрессия рецептора аденозина А2В в клетках эпителия [5]. При увеличении содержания рецептора аденозина А2В, который участвует в процессе дифференцировки легочных фибробластов в миофибробласты, возрастает скорость фиброза. Помимо апрегуляции генов у больных с быстропро-грессирующим течением ИЛФ, имеет место аутоиммунный компонент с повышением содержания В-и Т-лимфоцитов в ткани легкого [6].
Диагностика ИЛФ требует исключения известных причин интерстициальных заболеваний легких: профессиональных, бытовых воздействий [7]. Диагностический алгоритм был сформулирован в Федеральных клинических рекомендациях по диагностике и лечению ИЛФ (2016) и включает в себя выполнение КТВР, данные функциональных легочных тестов, лабораторные исследования и результаты гистологического исследования биоптата легких, если состояние пациента позволяет выполнить хирургическую биопсию легких.
«Золотым стандартом» в постановке диагноза ИЛФ является мультидисциплинарная дискуссия, с участием опытных специалистов — клиницистов, рентгенологов и морфологов [8].
В последнее время изменилось понимание патогенеза идиопатического легочного фиброза, и связанные с ним подходы к терапии заболевания. На сегодняшний день предпочтение отдается препаратам с антифибротической и антипролиферативной активностью [5]. Нинтеданиб и перфинидон относятся к препаратам с доказанной антифибротиче-ской активностью. Нинтеданиб — тройной ингибитор тирозинкиназ, блокатор рецепторов сосудистого эндотелиального фактора роста, фактора роста
фибробластов и тромбоцитарного фактора роста. Перфинидон — антифибротический препарат, регулирующий профибротические и провоспалительные каскады цитокинов, уменьшающий пролиферацию фибробластов и синтез коллагена [9, 10].
В качестве иллюстрации эффективности антифи-бротической терапии — демонстрируем опыт применения нинтеданиба у пациента с фенотипом идиопа-тического легочного фиброза и эмфиземы.
Больной Х. 66 лет, поступил в пульмонологическое отделение ГНОКБ 15.09.2016г. с жалобами на одышку смешанного характера с преобладанием инспиратор-ного компонента при незначительной физической нагрузке, малопродуктивный кашель со слизисто-гной-ной мокротой, слабость, быструю утомляемость. Из анамнеза известно: стаж курения более 40 лет, отказ от курения в 2014г; 8 пневмоний, с 2015г. ИБС: стенокардия напряжения, ФК1. Выполнена чрезкожная транслюминальная ангиопластика со стентировани-ем огибающей артерии. С 2015г зафиксировано снижение функции внешнего дыхания: ФЖЕЛ 3,11 — 69,7 %, ОФВ1 2,86 — 82,74 %, сатурация 98 %; при аускуль-тации легких — двусторонняя крепитация «velero»; пальцы Гиппократа. При МСКТ визуализировано типичное сочетание ретикулярных изменений с трак-ционными бронхоэктазами, зонами сотового легкого в кортикальных отделах; повышение плотности легочной паренхимы до -806HU и уменьшения объема легких до 4515мм3 (рис. 1).
При гистологическом исследовании паренхимы легкого полученной при проведении торакоскопиче-ской биопсии выявлены признаки обычной интер-стициальной пневмонии. Установлен диагноз: ИЛФ. ХОБЛ 1 степени, вне обострения. ДН 0. Назначено терапия: спирива 18 мкг 1 раз в день, флуимуцил 600 мг 2 раза в день.
Для решения вопроса о назначении патогенетической терапии нинтеданиб (Варгатеф) в сентябре 2016г. оценена функциональная способность легких: бодиплетизмография (БПГ) от 02.09.2016 SR — 91,6 %, R — 80 %, ITGV — 63,8 %, RV — 53,6 %, DLCO — 48,2 %; ЖЕЛ 2,58-56 %; ОФВ1 2,53 — 74 %/75 %; ФЖЕЛ 2,7061 %; ТТ — 124 %. Тест 6-минутной ходьбы: SpO2 -96 % до теста, пульс — 100 в мин, дистанция — 470 метров. После теста — SpO2 — 94 %, пульс -110 в мин. МСКТ от 11.09.16: сохраняется типичный для ИЛФ паттерн обычной интерстициальной пневмонии, плотность легочной паренхимы до -806HU, объем легких до 4515мм3. Клинический диагноз: ИЛФ, прогрессирующее течение. ДН 1. Назначено лечение — нинтеданиб (Варгатеф) 150 мг 2 раза в день (19.09.2016).
100
Siberian Medical Review. 2018;(5):99-103
Рисунок 1. МСКТлегких больного идиопатическим легочным фиброзом от 19.09.2015. Figure 1. MDCT of patient’s lungs with idiopathic pulmonary fibrosis from 19.09.2015.
В течение последующих 1,5 месяцев наблюдалась хорошая переносимость препарата, одышка не нарастала.
В ноябре 2016г. появилась диарея, доза нинтеданиба снижена до 150 мг в сутки.
В отделение пульмонологии Университетской клинике Аахена 21.12.2016 — 12.01.2017 гг. проведено повторное обследование. На основании проведенного в России обследования: функциональной диагностики легких, компьютерной томографии, отсутствия у больного в анамнезе данных об экзогенном аллергическом альвеолите, отсутствия типичных симптомов ревматологического заболевания сделан вывод о том, что результаты соответствуют идиопатическому легочному фиброзу. Повторно проведено гистологическое исследование биоптатов ткани легкого: выявлена картина обычной интерстициальной пневмонии.
При госпитализации в пульмонологическое отделение ОКБ 21.03.-29.03.17 — одышка при физической нагрузке, стул до 6-8 раз в сутки, неоформленный, тошнота. При осмотре: зона крепитации уменьшилась, ЧДД 17 в мин, Сатурация 97 %. ЧСС 70 в мин. По результатам СПГ: ЖЕ Л 2,76 — 62,9 %, ОФВ1 2,46 — 72 % (от 16. 09.2016: ЖЕЛ 2,58 — 56 %, ОФВ1 2,53 — 74-75 %). Данные диффузионной способности легких: DLCO — 52,2 %; SReff 0,17 — 17,4 %; Reff 0,05 -18,1 %
В терапии: доза нинтеданиба снижена до 200 мг в сутки (100 мг 2 раза в день). После уменьшения дозы — стул 2-3 раза в сутки, тошноты нет. МСКТ от 22.03.17 г.: интерстициальное поражение обоих легких с формированием картины сотового легкого, как проявление ИЛФ; плотность легочной паренхимы до -821HU, объем легких до 4793 мм3)
^деля Л. M., Mанакова Я. Л., Хусаинова Е. С. Kudelya L. M., Manakova Y. L., Khusainova E. S.
Опыт применения нинтеданиба у пациента с идиопатическим лёгочным фиброзом и эмфиземой Experience of nintedanib use in the patient with idiopathic pulmonary fibrosis and emphyisema
Рисунок 2. Контрольная МСКТ легких пациента с ИЛФ от 22.03.2017. Figure 2. Check MDCT of patient’s lungs with IPF from 22.03.2017.
При ретроспективном анализе МСКТ за период 2015-2017гг. выявлена следующая динамика течения процесса (рис. 2). В период с 23.07.15 по 13.02.16гг. отмечается прогрессирование заболевания, с уменьшением объема функционирующей паренхимы (увеличение плотности легочной паренхимы с -823 до -801HU и уменьшение объема легких с 5138 до 4767 мм3 вследствие фиброза, увеличение объема воздухо-проводящих путей со 132 до 201 мм3 за счет формирования тракционных бронхоэктазов). На фоне приема нинтеданиба в течение 6 месяцев отмечается улучшение объективных показателей (плотность паренхимы легких уменьшилась -821 HU, объем легких увеличился до 4798 мм3, объем воздухопроводящих путей увеличился до 226 мм3).
В настоящий момент пациент принимает нинтеда-ниб 150 мг 2 раза в сутки.
Заключение
Назначение антифибротического препарата -нинтеданиба у пациента с идиопатическим легочным фиброзом в сочетании с эмфиземой позволило достичь положительной клинико-рентгенологической динамики.
Литература/ References
1. Selman M, Garrilo G, Estrada A, Mejia M, Bacer-ril C, Cisneros J, Gaxiola M, Pérez-Padilla R, Navarro C, Richards T, Dauber J, King TE Jr, Pardo A, Kaminski N. Accelerated variant of idiopathic pulmonary fibrosis: clinical behavior and gene expression pattern. PLosOne 2007; 2(5): e482. DOI: 10.1371/journal.pone.0000482
2. Mejia M, Garrillo G, Rojas-Serrano J, Estrada A, Suárez T, Alonso D, Barrientos E, Gaxiola M, Navarro C, Selman M. Idiopathic pulmonary fibrosis and emphysema:
102
Siberian Medical Review. 2018;(S):99-103
decreased survival associated with severe pulmonary arterial hypertension. Chest. 2009; 136(1): 10-15. D01:10.1378/chest.08-2306
3. Barst RJ, McGoon M, Torbicki A, Sitbon O, Krowka MJ, Olschewski H, Gaine S. Diagnosis and differential assessment of pulmonary arterial hypertension. Journal of the American College of Cardiology. 2004; 43 (12): 40-47. D0I:10.15593/rzhbiomeh/2015.3.02
4. Hamada K, Nagai S, Tanaka S, Handa T, Shigematsu M, Nagao T, Mishima M, Kitaichi M, Izumi T, Significance of pulmonary arterial pressure and diffusion capacity of the lung as prognosticator in patients with idiopathic pulmonary fibrosis. Chest. 2007;131(3): 650-656. D0I:10.1378/chest.06-1466
5. Spagnolo P, Wells AU, Collard HR. Pharmacological treatment of idiopathic pulmonary fibrosis: un update. Drug Discovery Today. 2015. http://dx.doi.org/10.1016/j. drug-dis.2015.01.001
6. Авдеев СН. Различные варианты течения иди-опатического легочного фиброза: фенотипы и комор-бидные состояния. Практическая пульмонология. 2016; (2): 37-47. [Avdeev SN. Different variants of the course of idiopathic pulmonary fibrosis: phenotypes and comorbid conditions. Practical Pulmonology. 2016; (2): 37-47. (In Russian)]
7. Чучалин АГ, Авдеев СН, Айсанов ЗР, Белевский АС, Демура СА, Илькович ММ, Коган ЕА, Самсонова МВ, Сперанская АА, Тюрин ИЕ, Черняев АЛ, Черняк БА, Черняк АВ, Шмелев ЕИ. Диагностика и лечение идиопатического легочного фиброза. Федеральные клинические рекомендации. Пульмонология. 2016; 26 (4): 399-420. [Chuchalin AG, Avdeev SN, Aisanov ZR, Belevskiy AS, Demura SA, Il’kovich MM, Kogan EA, Samsonova MV, Speranskaya AA, Tyurin IE, Chernyaev AL, Chernyak BA, Chernyak AV, Shmelev EI. Diagnosis and treatment of idiopathic pulmonary fibrosis. Federal Clinical Recommendations. Russian Pulmonology. 2016; 26 (4): 399-420. (In Russian)]
8. Walsh SLF, Wells AU, Desai SR, Poletti V, Piciucchi S, Dubini A, Nunes H, Valeyre D, Brillet PY, Kambouchner M, Morais A, Pereira JM, Moura CS, Grutters JC, van den Heuvel DA, van Es HW, van Oosterhout MF,
Seldenrijk CA, Bendstrup E, Rasmussen F, Madsen LB, Gooptu B, Pomplun S, Taniguchi H, Fukuoka J, Johkoh T, Nicholson AG, Sayer C, Edmunds L, Jacob J, Kokosi MA, Myers JL, Flaherty KR, Hansell DM. Multicentre evalution of multidisciplinary team meeting agreement on diagnosis in diffuse parenchymal lung disease a care-cohort study. The Lancet. Respiratory medicine. 2016; 4(7):557-565. DOI: 10.1183/13993003.congress-2016.pa3556
9. King TE, Bradford WZ. Castro-Bernardini S. et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. The New England Journal of Medicine. 2014; (370):2083-92. DOI: 10.1056/nejmoa1402582
10. Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, Cottin V, Flaherty KR, Hansell DM, Inoue Y, Kim DS, Kolb M, Nicholson AG, Noble PW, Selman M, Taniguchi H, Brun M, Le Maulf F, Girard M, Stowasser S, Schlenker-Herceg R, Disse B, Collard HR. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. The New England Journal of Medicine. 2014; (370): 2071-82. DOI: 10.1055/s-0035-1544829
Сведения об авторах
Куделя Любовь Михайловна, д.м.н., профессор; Новосибирский государственный медицинский университет; адрес: Российская Федерация, 630091, г. Новосибирск, ул. Красный проспект, д. 52; Государственная Новосибирская областная клиническая больница; адрес: Российская Федерация, 630087, г. Новосибирск, ул. Немировича-Данченко, д. 130; тел.: +79139399257; e-mail: oxy80@mail.ru
Манакова Яна Леонидовна, к.м.н., доцент; Новосибирский государственный медицинский университет, адрес: Российская Федерация, 630091, г. Новосибирск, ул. Красный проспект, д. 52; Государственная Новосибирская областная клиническая больница; адрес: Российская Федерация, 630087, г. Новосибирск, ул. Немировича-Данченко, д. 130; тел.: +79139191240; e-mail: ymanakova@mail.ru
Хусаинова Екатерина Сергеевна, врач ординатор; Новосибирский государственный медицинский университет, адрес: Российская Федерация, 630091, г. Новосибирск, ул. Красный проспект, д. 52; Государственная Новосибирская областная клиническая больница; адрес: Российская Федерация, 630087, г. Новосибирск, ул. Немировича-Данченко, д. 130; тел.: +79833214767; e-mail: Ekhus88@yandex.ru
А^^г information
Lyubov’M. Kudelya, Dr.Med.Sci., Professor, Novosibirsk State Medical University; Address: 52, Krasnyyprospect Str., Novosibirsk, Russian Federation 630091; Novosibirsk Regional Clinical Hospital; Address: 130, Nemirovicha-Danchenko Str., Novosibirsk, Russian Federation 630087; Phone: +79139399257; e-mail: oxy80@mail.ru
Yana L. Manakova, Cand.Med.Sci., Assistant professor; Novosibirsk State Medical University; Address: 52, Krasnyy prospect Str., Novosibirsk, Russian Federation 630091; Novosibirsk Regional Clinical Hospital; Address: 130, Nemirovicha-Danchenko Str., Novosibirsk, Russian Federation 630087; Phone: +79139191240; e-mail: ymanakova@mail.ru
Ekaterina S. Khusainova, resident physician; Novosibirsk State Medical University; Address: 52, Krasnyy prospect Str., Novosibirsk, Russian Federation 630091; Novosibirsk Regional Clinical Hospital; Address: 130, Nemirovicha-Danchenko Str., Novosibirsk, Russian Federation 630087; Phone: +79833214767; e-mail: EKhus88@yandex.ru
Поступила 31.08.2017 г.
Принята к печати 11.09.2018 г.
Received 31 August 2017 Accepted for publication 11 September 2018
Актуальность
Интерстициальные фиброзирующие болезни легких являются неуклонно прогрессирующими инвалидизирующими заболеваниями, существенно снижающими качество и продолжительность жизни пациентов. В настоящий момент терапия, которая бы позволила улучшить прогноз и самочувствие таких пациентов, практически отсутствует.
Нинтеданим – антифибротический препаат из группы ингибиторов тирозинкиназ. Доклинические исследования продемонстрировали способность препарата замедлять процессы, вовлеченные в развитие легочного фиброза. В связи с чем целью исследования INBUILD стала оценка эффективности и безопасности нинтеданиба у пациентов с прогрессирующими фиброзирующими заболеваниями легких.
Методы
Рандомизированное двойное слепое плацебоконтролируемое исследование выполнялось в 153 центрах в 15 странах.
Включались пациенты старше 18 лет, имеющие установленный диагноз интерстициального прогрессирующего фиброзирующего заболевания легких, поражающего более 10% легочного объема по данным компьютерной томографии.
На момент включения в исследования форсированная жизненная емкость легких (ФЖЕЛ) должна была быть хотя бы 45% от должного значения, а диффузионная способность легких по монооксиду углерода – в пределах 30-80%.
Пациенты были рандомизированы в две группы – приема 150 мг дважды в день нинтеданиба и плацебо.
Первичной конечной точкой исследования стало годичное уменьшение ФЖЕЛ, оцениваемое через 52 недели терапии.
Результаты
В общей сложности в исследование было включено 663 пациента.
Скорректированное снижение ФЖЕЛ составило –80.8 мл в год в группе нинтеданиба и –187.8 мл в год – в группе плацебо (p<0.001). Однако показатели качества жизни, оцениваемые с помощью специализированных опросников, значимо не отличались между группами активной терапии и плацебо.
Частота всех и серьезных нежелательных явлений оказывалась сходной в обеих группах. Однако пациенты, принимающие нинтеданиб чаще страдали диареей и тошнотой.
Заключение
Таким образом, у пациентов с прогрессирующим фиброзирующим заболеванием легких нинтеданиб замедлил прогрессирование уменьшения ФЖЕЛ.
В то же время, несмотря на такое функциональное улучшение, препарат не приводил к улучшению качества жизни. А прогностическую значимость такой терапии еще только предстоит оценить при проведении более продолжительных проспективных исследований.
Источник:
1. Flaherty K, Wells A, Cottin V, Devaraj A, Walsh S, Inoue Y, et al. N Engl J Med. 2019. doi: 10.1056/NEJMoa1908681.
Варгатеф® (Vargatef) инструкция по применению
📜 Инструкция по применению Варгатеф®
💊 Состав препарата Варгатеф®
✅ Применение препарата Варгатеф®
📅 Условия хранения Варгатеф®
⏳ Срок годности Варгатеф®
Описание лекарственного препарата
Варгатеф®
(Vargatef)
Основано на листке-вкладыше препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2021 года.
Дата обновления: 2020.11.17
Код ATX:
L01EX09
(Нинтеданиб)
Лекарственные формы
| Варгатеф® |
Мягкие капс. 100 мг: 60 шт. рег. №: ЛП-(001278)-(РГ-RU) |
|
|
Мягкие капс. 150 мг: 60 шт. рег. №: ЛП-(001278)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Варгатеф®
Мягкие капсулы желатиновые, продолговатые, непрозрачные, розовато-оранжевого (персикового) цвета, содержащие ярко-желтую вязкую суспензию, на одной стороне которых черным цветом напечатан символ компании Берингер Ингельхайм и «100».
Вспомогательные вещества: триглицериды средней цепи — 107.40 мг, твердый жир — 51.00 мг, лецитин — 1.20 мг.
Состав оболочки капсулы: желатин — 111.24 мг, глицерин 85% — 49.09 мг, титана диоксид (Е171) — 1.21 мг, железа оксид красный (суспензия с глицерином 85%) — 0.06 мг, железа оксид желтый (суспензия с глицерином 85%) — 0.36 мг, чернила Опакод® тип S-1-17823.
10 шт. — блистеры (6) — пачки картонные.
10 шт. — блистеры (6) — пачки картонные (2) — пленка полипропиленовая.
Мягкие капсулы желатиновые, продолговатые, непрозрачные, коричневого цвета, содержащие ярко-желтую вязкую суспензию, на одной стороне которых черным цветом напечатан символ компании Берингер Ингельхайм и «150».
Вспомогательные вещества: триглицериды средней цепи — 161.10 мг, твердый жир — 76.50 мг, лецитин — 1.80 мг.
Состав оболочки капсулы: желатин — 141.84 мг, глицерин 85% — 61.43 мг, титана диоксид (Е171) — 0.39 мг, железа оксид красный (суспензия с глицерином 85%) — 1.24 мг, железа оксид желтый (суспензия с глицерином 85%) — 1.86 мг, чернила Опакод® тип S-1-17823.
10 шт. — блистеры (6) — пачки картонные.
Фармакологическое действие
Механизм действия
Нинтеданиб — ингибитор тирозинкиназы, относящийся к классу малых молекул, блокирующий киназную активность рецепторов фактора роста эндотелия сосудов 1-3 (VEGFR 1-3), рецепторов тромбоцитарного фактора роста α и β (PDGFR α и β) и рецепторов фактора роста фибробластов 1-3 (FGFR 1-3). Кроме того, ингибируются Fms-подобная протеинтирозинкиназа (Flt-3), лимфоцит-специфическая протеинтирозинкиназа (Lck), протоонкогенная протеинтирозинкиназа (Src) и киназы рецептора колониестимулирующего фактора 1 (CSF1R). Нинтеданиб конкурентно взаимодействует с АТФ-связывающим участком этих киназ и блокирует каскады внутриклеточной передачи сигналов, которые, как было продемонстрировано, участвуют в патогенезе ремоделирования фиброзной ткани при интерстициальных заболеваниях легких.
Фармакодинамические эффекты
Опухолевый ангиогенез является процессом, который вносит существенный вклад в рост, прогрессирование и образование метастазов опухоли. Этот процесс преимущественно запускается проангиогенными факторами, такими как фактор роста эндотелия сосудов и фактор роста фибробластов (VEGF и bFGF), секретируемыми опухолевыми клетками, чтобы привлечь эндотелиальные и периваскулярные клетки хозяина и облегчить доставку кислорода и питательных веществ через сосудистую систему. Нинтеданиб эффективно противодействует образованию и развитию сосудистой системы опухоли, приводит к замедлению и остановке роста опухоли.
В исследованиях in vitro на клетках человека было показано, что нинтеданиб ингибирует процессы, предположительно связанные с инициацией фиброзного патогенеза, с высвобождением профибротических медиаторов из моноцитов периферической крови и с поляризацией макрофагов с образованием макрофагов, активированных по альтернативному пути. Было продемонстрировано, что нинтеданиб ингибирует фундаментальные процессы фиброза органов, пролиферации и миграции фибробластов, трансформацию в активный фенотип миофибробласта и секрецию внеклеточного матрикса. В исследованиях на животных с использованием многочисленных моделей ИЛФ (идиопатический легочный фиброз), ИЗЛ-ССД (интерстициальные заболевания легких при системной склеродермии), ИЗЛ-РА (интерстициальные заболевания легких при ревматоидном артрите) и других видов фиброза органов было показано противовоспалительное и противофибротическое действие нинтеданиба в легких, коже, сердце, почках и печени. Нинтеданиб также обладает активностью в отношении сосудов. Он уменьшал апоптоз эндотелиальных клеток микрососудов кожи и замедлял ремоделирование легочных сосудов путем уменьшения пролиферации клеток гладкой мускулатуры сосудов, толщины стенки легочных сосудов и уменьшал процентную долю окклюзированных легочных сосудов.
Фармакокинетика
Фармакокинетика нинтеданиба может считаться линейной в отношении времени (т.е. данные, полученные при применении однократной дозы, могут экстраполироваться на данные, полученные в результате многократного применения). После многократного применения препарата накопление составляет 1.04 при оценке Сmax и 1.38 при оценке AUCt. Остаточные концентрации нинтеданиба остаются стабильными в течение одного года и более.
Всасывание
Сmax нинтеданиба в плазме крови достигается приблизительно через 2-4 ч после приема препарата во время еды (диапазон 0.5-8 ч). Абсолютная биодоступность при дозе 100 мг составляет у здоровых добровольцев 4.69% (90% доверительный интервал (ДИ): 3.615-6.078).
Установлено, что экспозиция нинтеданиба увеличивается пропорционально дозе (в диапазонах доз 50-450 мг 1 раз/сут и 150-300 мг 2 раза/сут). Css в плазме крови достигаются, как максимум, в течение одной недели после начала приема.
Экспозиция нинтеданиба увеличивается после приема пищи примерно на 20% по сравнению с приемом препарата натощак (ДИ: 95.3-152.5%), а всасывание замедляется. Медиана времени достижения Сmax в плазме крови при приеме натощак — 2 ч, после еды — 3.98 ч.
Распределение
Распределение нинтеданиба осуществляется путем двухфазной кинетики. После в/в инфузии во время терминальной фазы наблюдается большой Vd — 1050 л, геометрический коэффициент вариации (gCV) 45%.
Связывание нинтеданиба с белками плазмы человека in vitro считается значительным, связанная фракция составляет 97.8%. Основным белком, участвующим в связывании, считается альбумин сыворотки крови. Нинтеданиб преимущественно распределяется в плазме, соотношение кровь/плазма составляет 0.869.
Нинтеданиб является субстратом для P-гликопротеина (P-gp). Показано, что нинтеданиб in vitro не является субстратом или ингибитором полипептидных переносчиков органических анионов (ОАТР-1В1, ОАТР-1В3, ОАТР-2В1), переносчика органических катионов-2 (ОСТ-2) или белка, ассоциированного с множественной лекарственной устойчивостью-2 (MRP-2). Нинтеданиб также не является субстратом для белка резистентности рака молочной железы (BCRP). In vitro было установлено, что нинтеданиб обладает слабой ингибирующей активностью в отношении ОСТ-1, BCRP и P-gp, что, как считается, имеет небольшую клиническую значимость. Такое же заключение сделано в отношении нинтеданиба как субстрата для ОСТ-1.
Метаболизм
Основной реакцией, участвующей в метаболизме нинтеданиба, является гидролитическое расщепление с помощью эстераз, что приводит к образованию свободного кислого метаболита нинтеданиба. В доклинических исследованиях in vivo установлено, что данный метаболит не обладает эффективностью, несмотря на влияние на целевые рецепторы препарата. В дальнейшем он глюкуронизируется ферментами уридиндифосфат-глюкуронилтрансферазами (UGT1А1, UGT1А7, UGT1А8 и UGT1А10) с образованием глюкуронида.
Считается, что биотрансформация нинтеданиба с участием изоферментов CYP происходит только в небольшой степени, основное участие принимает изофермент CYP3A4. В исследовании ADME у человека основной метаболит, образующийся с участием изоферментов CYP, обнаружить в плазме не удалось. По данным исследования in vitro CYP-зависимый метаболизм составляет примерно 5%, тогда как расщепление, осуществляемое эстеразами, составляет 25%.
Выведение
Общий клиренс из плазмы после в/в инфузии составляет 1390 мл/мин (gCV 28.8%). Экскреция почками неизмененного нинтеданиба в течение 48 ч после приема препарата внутрь составляет примерно 0.05% дозы (gCV 31.5%), а после в/в введения — примерно 1.4% (gCV 24.2%); почечный клиренс составляет 20 мл/мин (gCV 32.6%). После приема внутрь [14С]-нинтеданиба радиоактивный материал выводился преимущественно с желчью и обнаруживался в кале (93.4% дозы, gCV 2.61%). Вклад почечной экскреции в общий клиренс составляет 0.649% дозы (gCV 26.3%). Выведение считается полным (более 90%) через 4 дня после приема. T1/2 нинтеданиба составляет от 10 до 15 ч (gCV примерно 50%).
Зависимость эффекта от экспозиции
Немелкоклеточный рак легкого (НМРЛ). В ходе исследования зависимости нежелательных явлений от фармакокинетики нинтеданиба была установлена тенденция к более частому повышению активности ферментов печени при большей экспозиции нинтеданиба. Подобной зависимости не отмечается для нарушений со стороны ЖКТ.
Для клинических конечных точек анализ взаимосвязи фармакокинетики с эффективностью не проводился. С помощью метода логистической регрессии установлена статистически значимая взаимосвязь между экспозицией нинтеданиба и влиянием на изменения, обнаруживаемые методом динамической контрастной МРТ.
ИЛФ, другие хронические фиброзирующие ИЗЛ с прогрессирующим фенотипом ИЗЛ-ССД. Анализ зависимости «экспозиция-ответ» показал наличие взаимосвязи типа Еmax между воздействием в диапазоне, наблюдавшемся в ряде исследований фазы II и III, и ежегодным уровнем снижения форсированной жизненной емкости легких; ЕС50 составляла около 3-5 нг/мл (относительная стандартная ошибка: 54-67%). Для сравнения, медиана наблюдаемых минимальных концентраций нинтеданиба при применении препарата Варгатеф® в дозе 150 мг 2 раза/сут составляла примерно 10 нг/мл.
В отношении безопасности возможно имеется слабая взаимосвязь между экспозицией нинтеданиба в плазме крови и повышением активности АЛТ и/или ACT. Фактически применяемая доза может быть более существенным прогностическим фактором риска развития диареи любой интенсивности, даже если экспозицию в плазме крови нельзя исключить в качестве определяющего фактора риска.
Фармакокинетика у особых групп пациентов
Фармакокинетические свойства нинтеданиба были сопоставимы у здоровых добровольцев, пациентов с ИЛФ, другими хроническими фиброзирующими ИЗЛ с прогрессирующим фенотипом, ИЗЛ-ССД и НМРЛ. Согласно результатам популяционного фармакокинетического анализа и описательных исследований, на воздействие нинтеданиба не влиял пол (с учетом массы тела), нарушения функции почек легкой и средней степени тяжести (рассчитанная по КК), метастазы в печени, общее состояние больного (оценка по опроснику Восточной Объединенной Онкологической Группы, Eastern Cooperative Oncology Group (ECOG)), употребление алкоголя или генотип Р-гликопротеина. Популяционный фармакокинетический анализ выявил умеренное влияние возраста, массы тела и расовой принадлежности на воздействие нинтеданиба. В связи с тем, что наблюдалась высокая межиндивидуальная вариабельность воздействия, эти влияния не считались клинически значимыми. Тем не менее, рекомендуется тщательное мониторирование пациентов, у которых выявляется несколько факторов риска, представленных ниже.
Возраст
Экспозиция нинтеданиба линейно увеличивается с возрастом. У 45-летних пациентов (5-й процентиль) значение AUCt,ss (в равновесном состоянии на период дозирования) было ниже на 16%, а у 76-летних пациентов (95-й процентиль) выше на 13% по сравнению с пациентами, медиана возраста которых составляла 62 года. Диапазон возраста, оценивавшийся в ходе анализа, составлял 29-85 лет; возраст более 75 лет отмечался примерно у 5% популяции пациентов.
Аналогичные исследования у детей не проводились.
Масса тела
Наблюдается обратная корреляция между массой тела и экспозицией нинтеданиба. У пациентов с массой тела 50 кг (5-й процентиль) величина AUCt,ss увеличивалась на 25%, а у пациентов с массой тела 100 кг (95-й процентиль) уменьшалась на 19% по сравнению с пациентами, медиана массы тела которых составляла 71.5 кг.
Раса
Средняя популяционная экспозиция нинтеданиба на 33-50% выше у пациентов-китайцев, тайваньцев и индийцев, на 16% выше у пациентов японского происхождения, а у пациентов-корейцев — на 16-22% ниже, чем у пациентов европеоидной расы (с поправкой на массу тела). Данные в отношении пациентов негроидной расы являются очень ограниченными, диапазон этих данных сходен с пациентами европеоидной расы.
Нарушения функции печени
В исследовании I фазы при изучении однократного введения препарата значения Сmax и AUC были в 2.2 раза выше у добровольцев с легкими нарушениями функции печени (класс А по шкале Чайлд-Пью; 90% ДИ 1.3-3.7 для Сmax и 1.2-3.8 для AUC соответственно), чем у здоровых добровольцев.
У добровольцев с умеренными нарушениями функции печени (класс В по шкале Чайлд-Пью) значение Сmax (90% ДИ 4.4-13.2) было в 7.6 раза выше и в 8.7 раза выше значение AUC (90% ДИ 5.7-13.1) соответственно, в сравнении со здоровыми добровольцами. В исследовании не принимали участия пациенты с тяжелыми нарушениями функции печени (класс С по шкале Чайлд-Пью).
Показания препарата
Варгатеф®
- местно-распространенный, метастатический или рецидивирующий немелкоклеточный рак легкого (аденокарцинома) после химиотерапии первой линии в комбинации с доцетакселом;
- идиопатический легочный фиброз (идиопатический фиброзирующий альвеолит); для лечения и замедления прогрессирования заболевания;
- другие хронические фиброзирующие интерстициальные заболевания легких (ИЗЛ) с прогрессирующим фенотипом;
- интерстициальные заболевания легких при системной склеродермии.
Режим дозирования
Препарат принимают внутрь, предпочтительно во время еды. Капсулы следует проглатывать целиком, запивая водой, не разжевывая и не разламывая.
Пропуск дозы
Если очередная доза препарата Варгатеф® пропущена, следует продолжить прием препарата в изначально рекомендуемой дозе по расписанию следующего приема препарата. Если доза была пропущена, пациент не должен принимать дополнительную дозу препарата.
НМРЛ
Лечение препаратом Варгатеф® должен назначать и проводить врач, имеющий опыт в назначении противоопухолевой терапии.
Рекомендуемая доза препарата Варгатеф® составляет 200 мг 2 раза/сут с интервалом примерно в 12 ч, со 2 по 21 день стандартного 21-дневного цикла лечения доцетакселом.
Варгатеф® не должен применяться в день начала химиотерапии доцетакселом, т.е. в 1 день лечения.
Максимальная рекомендуемая суточная доза составляет 400 мг.
После окончания применения доцетаксела можно продолжить терапию препаратом Варгатеф® до тех пор, пока сохраняется клинический эффект, или до развития неприемлемой токсичности.
Изменение дозы в случае развития нежелательных реакций
В качестве первоначальной меры для устранения нежелательных реакций рекомендуется временный перерыв в лечении препаратом Варгатеф® до тех пор, пока нежелательная реакция не снизится до уровня, который позволит возобновить терапию (см. таблицы 1 и 2). Лечение можно возобновлять в уменьшенной дозе.
Для обеспечения индивидуальной безопасности и переносимости рекомендуется снижение суточной дозы препарата на 100 мг (т.е. уменьшение разовой дозы на 50 мг), как это описывается в таблицах 1 и 2. Если нежелательная реакция (реакции) сохраняется, т.е. если пациент не переносит препарат в дозе 100 мг 2 раза/сут, лечение следует прекратить.
В случае специфического повышения активности АСТ/АЛТ более чем в 3 раза по сравнению с ВГН в сочетании с повышением концентрации общего билирубина в 2 и более раза по сравнению с ВГН и ЩФ менее чем в 2 раза по сравнению с ВГН (см. таблицу 2), применение препарата Варгатеф® следует временно прекратить. Если не будет установлена альтернативная причина нарушений, Варгатеф® следует окончательно отменить.
Таблица 1. Информация об изменении дозы в случае развития диареи, рвоты и других негематологических или гематологических нежелательных явлений, исключая повышение активности печеночных ферментов (см. таблицу 2)
* Общие терминологические критерии для нежелательных явлений — СТСАЕ (Common Terminology Criteria for Adverse Events).
Таблица 2. Информация об изменении дозы в случае повышения активности ACT и/или АЛТ и повышения концентрации билирубина
ИЛФ, другие хронические фиброзирующие ИЗЛ с прогрессирующим фенотипом и ИЗЛ-ССД
Лечение препаратом Варгатеф® следует назначать и проводить под контролем врача, имеющего опыт диагностики и лечения заболеваний, при которых показан препарат.
Рекомендуемая доза препарата составляет 150 мг 2 раза/сут, приблизительно через каждые 12 ч.
Максимальная суточная доза составляет 300 мг.
Изменение дозы в случае развития нежелательных реакций
При развитии нежелательных реакций, таких как диарея, тошнота и рвота в дополнение к симптоматической терапии, при необходимости, рекомендуется снижение дозы или временное прерывание лечения до тех пор, пока нежелательная реакция не снизится до уровня, который позволит возобновить терапию. Лечение препаратом Варгатеф® может быть возобновлено в полной дозе (150 мг 2 раза/сут) или в сниженной дозе (100 мг 2 раза/сут). Если пациент не переносит дозу препарата 100 мг 2 раза/сут, лечение препаратом Варгатеф® следует прекратить.
В случае прерывания лечения вследствие повышения активности трансаминаз (ACT или АЛТ) более чем в 3 раза по сравнению с ВГН после восстановления показателей до нормальных значений рекомендовано возобновить терапию в уменьшенной дозе (100 мг 2 раза/сут). Впоследствии доза может быть увеличена до полной дозы (150 мг 2 раза/сут).
Особые группы пациентов
Детский возраст
Безопасность и эффективность препарата у пациентов детского возраста в клинических исследованиях не изучалась.
Пожилой возраст (>65 лет)
Не отмечено никаких различий по безопасности и эффективности применения препарата у пациентов пожилого возраста (>65 лет) по сравнению с пациентами моложе 65 лет. Исходной коррекции дозы препарата в зависимости от возраста пациента не требуется.
Раса и масса тела
Основываясь на данных популяционного фармакокинетического анализа, исходная коррекция дозы препарата Варгатеф® в зависимости от расы и массы тела не требуется. Данные по безопасности у пациентов негроидной расы ограничены.
Нарушения функции почек
Почками выводится менее 1% однократной дозы нинтеданиба. У пациентов с нарушениями функции почек легкой или средней степени изменения начальной дозы не требуется. У пациентов с тяжелыми нарушениями функции почек (КК <30 мл/мин) безопасность, эффективность и фармакокинетика нинтеданиба не изучались.
Нарушения функции печени
Нинтеданиб выводится преимущественно с желчью (через кишечник) (>90%). У пациентов с нарушениями функции печени легкой и средней степени тяжести (класс А по шкале Чайлд-Пью, класс В по шкале Чайлд-Пью) концентрация препарата в крови повышалась. У пациентов с нарушениями функции печени средней и тяжелой степени (классы В и С по шкале Чайлд-Пью) безопасность, эффективность и фармакокинетика нинтеданиба не изучались. Поэтому лечение пациентов с нарушениями функции печени средней и тяжелой степени препаратом Варгатеф® не рекомендуется.
НМРЛ
У пациентов с нарушениями функции печени легкой степени тяжести (класс А по шкале Чайлд-Пью) изменения начальной дозы не требуется.
ИЛФ, другие хронические фиброзирующие ИЗЛ с прогрессирующим фенотипом и ИЗЛ-ССД
Для пациентов с нарушениями функции печени легкой степени тяжести (класс А по шкале Чайлд-Пью) рекомендованная доза препарата Варгатеф® составляет 100 мг 2 раза/сут с интервалом примерно в 12 ч. Для устранения нежелательных реакций у данной категории пациентов следует рассмотреть возможность временного перерыва в лечении препаратом или окончательного прекращения терапии.
За информацией о дозировании, способе применения и модификации дозы доцетаксела следует обратиться к соответствующей инструкции по применению этого препарата.
Побочное действие
Частота побочных реакций, приведенных ниже, изложена в соответствии со следующей градацией: очень часто (≥1/10); часто (≥1/100; <1/10); нечасто (≥1/1000; <1/100); редко (≥1/10000; <1/1000); очень редко (<1/10000); неизвестно (частота не может быть оценена по доступным данным). Данные о побочных реакциях также учитывают опыт пострегистрационного применения.
НМРЛ
Наиболее частыми нежелательными реакциями, считавшимися связанными с применением нинтеданиба, были диарея, повышение активности ферментов печени (АЛТ и ACT) и рвота.
1 Данные побочные реакции наблюдались при проведении клинических исследований, однако связь с приемом препарата Варгатеф® не доказана.
2 В клинических исследованиях частота встречаемости данных побочных реакций у пациентов, принимавших нинтеданиб в комбинации с доцетакселом, не превышала частоту встречаемости таковых у пациентов, принимавших плацебо в комбинации с доцетакселом.
3 Следует обратиться также к инструкции по медицинскому применению доцетаксела.
4 Случаи панкреатита были зафиксированы у пациентов, принимавших нинтеданиб при лечении ИЛФ и НМРЛ. Большая часть этих случаев была зафиксирована у пациентов с показанием ИЛФ.
Диарея является частым нежелательным явлением со стороны ЖКТ. Отмечается тесная временная связь между развитием диареи и применением доцетаксела. В клиническом исследовании LUME-Lung 1 диарея легкой и средней степени тяжести отмечалась у большинства пациентов. Диарея ≥3 степени тяжести при применении комбинированного лечения отмечалась у 6.3% пациентов, тогда как при применении одного доцетаксела — только у 3.6% пациентов.
Такие частые побочные эффекты, как тошнота и рвота, в большинстве случаев были легкой или средней степени тяжести.
По данным клинических исследований применение препарата Варгатеф® в комбинации с доцетакселом сопровождалось более частым развитием нейтропении ≥3 степени тяжести (по критериям СТСАЕ), чем в случае применения одного доцетаксела.
Повышение активности печеночных ферментов (АЛТ, АСТ, ЩФ, ГГТ) или концентрации билирубина было в большинстве случаев обратимым при уменьшении дозы или прерывании терапии.
Ингибирование VEGFR способно привести к увеличению риска кровотечений. В клинических исследованиях у пациентов с аденокарциномой, принимавших Варгатеф®, повышение частоты кровотечений было сравнимо в обеих лечебных группах. Самым частым видом кровотечений было носовое кровотечение легкой или средней степени тяжести. Дисбаланса легочных или смертельных кровотечений не наблюдалось, о церебральных кровотечениях не сообщалось. Большинство летальных кровотечений были опухоль-ассоциированными.
В пострегистрационном периоде наблюдались случаи несерьезных и серьезных кровотечений, некоторые из которых приводили к летальному исходу. У пациентов с кровотечениями 3 или 4 степени тяжести следует тщательно оценить пользу и риск продолжения терапии препаратом Варгатеф®, а также необходимо рассмотреть возможность прекращения данной терапии. При возобновлении терапии препаратом Варгатеф® рекомендуется назначать сниженную суточную дозу.
Частота артериальной тромбоэмболии в двух лечебных группах исследования LUME-Lung 1 была сравнимой. Пациенты с недавно перенесенным инфарктом миокарда или инсультом из исследования исключались.
Частота перфораций ЖКТ в отдельных лечебных группах в клинических исследованиях была сопоставима.
ИЛФ, другие хронические фиброзирующие ИЗЛ с прогрессирующим фенотипом и ИЗЛ-ССД
Наиболее частыми нежелательными реакциями, связанными с применением нинтеданиба, были диарея, тошнота и рвота, боль в области живота, снижение аппетита, снижение массы тела и повышение активности ферментов печени.
1 Представленный термин описывает более широкую группу нежелательных явлений, нежели чем отдельное состояние или термин, предусмотренный MedDRA.
2 В пострегистрационном периоде наблюдались случаи несерьезных и серьезных кровотечений, некоторые из которых приводили к летальному исходу.
В клинических исследованиях диарея была наиболее часто репортируемым желудочно-кишечным явлением. У большинства пациентов данные явления были легкой и средней степени тяжести и отмечались на протяжении первых 3 месяцев лечения. В исследованиях INPULSIS диарея отмечалась у 62.4% по сравнению с 18.4% пациентов, получавших препарат Варгатеф® или плацебо соответственно. Диарея стала причиной снижения дозы у 10.7% пациентов, а прекращения терапии препаратом Варгатеф® — у 4.4% пациентов. В исследовании INBUILD у пациентов с другими хроническими фиброзирующими ИЗЛ с прогрессирующим фенотипом диарея была зарегистрирована у 66.9% пациентов, получавших лечение препаратом Варгатеф® по сравнению с 23.9%, получавших плацебо. Диарея стала причиной снижения дозы препарата Варгатеф® у 16.0% пациентов и причиной прекращения терапии у 5.7% пациентов.
В исследовании SENSCIS у пациентов с ИЗЛ-ССД диарея отмечалась у 75.7% в сравнении с 31.6% пациентов, получавших препарат Варгатеф® и плацебо соответственно. Диарея стала причиной снижения дозы препарата Варгатеф® у 22.2% пациентов и причиной прекращения терапии препаратом у 6.9% пациентов.
Тошнота и рвота были часто сообщаемыми нежелательными явлениями. У большинства пациентов отмечалась тошнота и рвота легкой или средней степени тяжести. Тошнота стала причиной прекращения лечения препаратом нинтеданиб у 2% пациентов, рвота стала причиной прекращения лечения у 0.8% пациентов. В исследовании INBUILD частота возникновения тошноты и рвоты, приводящих к прекращению применения препарата Варгатеф®, составила 0.3% и 0.9% соответственно. В исследовании SENSCIS тошнота и рвота стали причиной прекращения лечения препаратом Варгатеф® у 2.1% и 1.4% пациентов соответственно.
Ингибирование VEGFR может быть связано с повышением риска развития кровотечений.
В клинических исследованиях частота развития кровотечений у пациентов была незначительно выше в группе препарата Варгатеф® или сопоставимой между группами:
10.3% по сравнению с 7.8% в группе плацебо в исследовании INPULSIS;
11.1% по сравнению с 12.7% в группе плацебо в исследовании INBUILD;
11.1% по сравнению с 8.3% в группе плацебо в исследовании SENSCIS.
Наиболее частыми нежелательными явлениями в виде кровотечений были носовые кровотечения, не относившиеся к категории серьезных. Серьезные кровотечения возникали нечасто и с одинаковой частотой в обеих группах терапии:
1.3% по сравнению с 1.4% в группе плацебо в исследовании INPULSIS;
0.9% по сравнению с 1.5% в группе плацебо в исследовании INBUILD;
1.4% по сравнению с 0.7% в группе плацебо в исследовании SENSCIS.
В пострегистрационном периоде наблюдались случаи несерьезных и серьезных кровотечений, некоторые из которых приводили к летальному исходу. Из клинических исследований исключались пациенты с инфарктом миокарда или инсультом в ближайшем анамнезе. В клинических исследованиях случаи развития артериальной тромбоэмболии встречались нечасто:
2.5% по сравнению с 0.7% в группе плацебо в исследовании INPULSIS;
0.9% по сравнению с 0.9% в группе плацебо в исследовании INBUILD;
0.7% по сравнению с 0.7 % в группе плацебо в исследовании SENSCIS.
В исследовании INPULSIS у большего числа пациентов в группе препарата Варгатеф® развивался инфаркт миокарда (1.6%) по сравнению с группой плацебо (0.5%), в то время как нежелательные реакции в виде ИБС были сравнимы в группах нинтеданиба и плацебо. В исследованиях INBUILD и SENSCIS инфаркт миокарда встречался редко в группе пациентов, получавших препарат Варгатеф® — 0.9% по сравнению с 0.9% в группе плацебо в исследовании INBUILD; 0% по сравнению с 0.7% в группе плацебо в исследовании SENSCIS.
Противопоказания к применению
- гиперчувствительность к нинтеданибу, сое или арахису, или любому вспомогательному компоненту препарата;
- нарушения функции печени средней и тяжелой степени (опыт применения отсутствует);
- тяжелые нарушения функции почек (КК <30 мл/мин) (опыт применения отсутствует)*;
- активные метастазы в головной мозг (опыт применения отсутствует);
- беременность;
- период грудного вскармливания;
- возраст до 18 лет (опыт применения отсутствует).
* Эффективность и безопасность нинтеданиба у пациентов с тяжелыми нарушениями функции почек (КК <30 мл/мин) не были изучены. Почками выводится менее 1% разовой дозы нинтеданиба.
В отношении противопоказаний для доцетаксела следует обратиться к соответствующей инструкции по применению этого препарата.
С осторожностью: нарушения функции печени легкой степени тяжести; наследственная предрасположенность к кровотечениям (болезнь фон Виллебранда); стабильные метастазы в головной мозг; терапия антикоагулянтами; венозные тромбоэмболии; перфорации ЖКТ в анамнезе; пациенты, которые ранее подвергались хирургическим вмешательствам на органах брюшной полости; артериальная тромбоэмболия.
Применение при беременности и кормлении грудью
Беременность
Специальных исследований по применению препарата Варгатеф® при беременности у человека не проводилось, однако в доклинических исследованиях у животных установлена репродуктивная токсичность этого препарата. Поскольку нинтеданиб может обладать эмбриотоксическим действием у человека, препарат не следует применять при беременности. Перед началом лечения рекомендуется проведение теста на беременность, а также во время терапии по мере необходимости.
Пациенткам следует немедленно сообщить врачу о развитии беременности во время терапии препаратом Варгатеф®. Если во время терапии развивается беременность, необходимо прекратить лечение препаратом Варгатеф и проинформировать пациентку о потенциальной опасности эмбриотоксического воздействия препарата.
Применение нинтеданиба может быть вредно для плода. Женщинам детородного возраста, принимающим препарат Варгатеф®, следует рекомендовать избегать наступления беременности во время лечения препаратом Варгатеф® и использовать высокоэффективные методы контрацепции во время применения препарата и на протяжении, по крайней мере, 3 месяцев после приема последней дозы. В данный момент неизвестно, может ли нинтеданиб снижать эффективность гормональных контрацептивов, поэтому женщинам, использующим гормональные контрацептивы, необходимо использовать и барьерные методы контрацепции.
Грудное вскармливание
Специальных исследований у человека о выделении нинтеданиба и его метаболитов с грудным молоком не проводилось. В доклинических исследованиях показано, что у крыс в период лактации в грудное молоко проникает небольшое количество нинтеданиба и его метаболитов (≤0.5% от величины применявшейся дозы). Поэтому нельзя исключить риск для новорожденных и грудных детей. Во время лечения препаратом Варгатеф® кормление грудью следует прекратить.
Фертильность
В доклинических исследованиях не было выявлено признаков нарушений фертильности у самцов. В исследованиях субхронической и хронической токсичности, во время которых уровень системного воздействия препарата был сравним с уровнем, достигающимся при применении максимальной рекомендуемой дозы у человека, признаков нарушений фертильности у самок крыс обнаружено не было.
За информацией о влиянии доцетаксела на беременность, грудное вскармливание и фертильность следует обратиться к соответствующей инструкции по применению этого препарата.
Применение при нарушениях функции печени
С осторожностью следует применять препарат у пациентов с нарушениями функции печени легкой степени.
Противопоказано применение препарата пациентам с нарушениями функции печени средней и тяжелой степени (опыт применения отсутствует).
Применение при нарушениях функции почек
С осторожностью следует применять препарат у пациентов с нарушениями функции печени легкой степени.
Противопоказано применение пациентам с тяжелыми нарушениями функции почек (КК <30 мл/мин) (опыт применения отсутствует).
Применение у детей
Применение препарата у детей и подростков в возрасте до 18 лет противопоказано (опыт применения отсутствует).
Применение у пожилых пациентов
Не отмечено никаких общих различий по безопасности и эффективности применения препарата у пациентов пожилого возраста (>65 лет) по сравнению с пациентами в возрасте до 65 лет. Коррекция дозы препарата в зависимости от возраста пациента не требуется.
Особые указания
Желудочно-кишечные расстройства
Диарея. Лечение диареи (адекватная гидратация и антидиарейные лекарственные средства, например, лоперамид) следует проводить при появлении первых признаков. В случае развития диареи может потребоваться прерывание лечения, снижение дозы или прекращение терапии.
Тошнота и рвота. В случае сохранения тошноты и рвоты, несмотря на симптоматическое лечение (включая противорвотную терапию), может потребоваться снижение дозы, прерывание лечения или прекращение терапии.
Диарея и рвота могут приводить к обезвоживанию с нарушением или без нарушения водно-электролитного баланса, что может приводить к нарушениям функции почек. В случае обезвоживания рекомендуется восстановление водно-электролитного баланса.
Если возникают существенные желудочно-кишечные нежелательные явления, необходимо проведение контролировать концентрации электролитов в крови.
Нейтропения и сепсис
Во время терапии НМРЛ препаратом Варгатеф®, в частности при комбинации с доцетакселом, необходимо проводить мониторинг форменных элементов крови на предмет развития нейтропении и возможных последующих осложнений в виде сепсиса или фебрильной нейтропении. Частое мониторирование всех форменных элементов крови следует осуществлять в начале каждого цикла лечения у пациентов, получающих терапию нинтеданибом в комбинации с доцетакселом, в период наименьших значений нейтрофилов, а также при наличии клинических показаний после окончания последнего цикла терапии данной комбинацией.
Нарушения функции печени
Безопасность и эффективность препарата не изучалась у пациентов с нарушениями функции печени средней (класс В по шкале Чайлд-Пью) или тяжелой (класс С по шкале Чайлд-Пью) степени. Поэтому у таких пациентов применение препарата Варгатеф® не рекомендуется.
НМРЛ. В связи с повышением концентрации препарата в крови риск развития нежелательных явлений может быть выше у пациентов с легкими нарушениями функции печени (класс А по шкале Чайлд-Пью).
При проведении терапии нинтеданибом наблюдались случаи лекарственного поражения печени. В пострегистрационном периоде были получены сообщения о тяжелых формах лекарственного поражения печени с летальным исходом.
После начала терапии рекомендуется тщательный контроль активности печеночных трансаминаз, ЩФ и концентрации билирубина (периодически, во время начала комбинации с доцетакселом, т.е. в начале каждого лечебного цикла). Если отмечается существенное повышение активности печеночных ферментов, может потребоваться прерывание лечения, уменьшение дозы или прекращение терапии препаратом Варгатеф®.
Перед началом комбинированного лечения препаратом Варгатеф® и доцетакселом следует определять активность трансаминаз, ЩФ и содержание билирубина. Эти показатели следует контролировать в зависимости от клинических показаний или периодически во время лечения, например, в фазе комбинации с доцетакселом в начале каждого цикла терапии и ежемесячно, если прием препарата Варгатеф® продолжается в виде монотерапии после прекращения терапии доцетакселом.
Если выявляется соответствующее повышение активности ферментов печени, может потребоваться перерыв в лечении, снижение дозы или прекращение терапии препаратом Варгатеф® (см. раздел «Режим дозирования»/таблица 2). Следует проводить поиск альтернативных причин повышения активности ферментов печени и принятие соответствующих мер при необходимости.
В случае повышения активности ферментов печени (ACT/АЛТ) более чем в 3 раза по сравнению с ВГН в сочетании с повышением уровня билирубина в 2 и более раза по сравнению с ВГН и повышением активности ЩФ менее чем в 2 раза по сравнению с ВГН, терапию препаратом Варгатеф® следует прервать. Если не будет установлена альтернативная причина изменений этих лабораторных показателей, Варгатеф® следует окончательно отменить.
Для пациентов женского пола и азиатского происхождения характерен более высокий риск повышения активности печеночных ферментов.
Увеличение экспозиции нинтеданиба характеризовалось линейной зависимостью от возраста пациента, а также было обратно пропорционально массе тела, что также может повлечь за собой более высокий риск повышения активности печеночных ферментов. У пациентов с этими факторами риска рекомендуется тщательный контроль показателей функции печени.
ИЛФ, другие хронические фиброзирующие ИЗЛ с прогрессирующим фенотипом и ИЗЛ-ССД. В связи с повышением концентрации препарата в крови риск развития нежелательных явлений может быть выше у пациентов с легкими нарушениями функции печени (класс А по шкале Чайлд-Пью). Пациенты с легкими нарушениями функции печени (класс А по шкале Чайлд-Пью) должны получать сниженную дозу препарата Варгатеф®.
При проведении терапии нинтеданибом наблюдались случаи лекарственного поражения печени. В пострегистрационном периоде были получены сообщения о несерьезных и серьезных случаях лекарственного поражения печени, включая тяжелые формы лекарственного поражения печени с летальным исходом.
Большая часть нарушений со стороны печени наблюдаются в течение первых 3 месяцев терапии. Таким образом, рекомендуется оценивать активность печеночных трансаминаз и концентрацию билирубина до начала терапии препаратом Варгатеф® регулярно в течение первых 3 месяцев терапии, а затем периодически во время лечения (например, при каждом визите пациента) или по клиническим показаниям.
Повышение активности печеночных ферментов (АЛТ, ACT, ЩФ, ГГТ) и билирубина было в большинстве случаев обратимым при уменьшении дозы или прерывании терапии.
В случае повышения активности трансаминаз (ACT или АЛТ) более чем в 3 раза выше ВГН рекомендовано уменьшить дозу или прервать терапию препаратом Варгатеф® и наблюдать за состоянием пациента. Как только показатели трансаминаз вернутся к исходному уровню, доза препарата Варгатеф® может быть вновь повышена до полной (150 мг 2 раза/сут) или лечение может быть возобновлено в сниженной дозе (100 мг 2 раза/сут), которая впоследствии может быть повышена до полной дозы. Если повышение каких-либо показателей функции печени сопровождается клиническими признаками или симптомами повреждения печени, например, желтухой, лечение препаратом следует окончательно прекратить. Следует провести поиск альтернативных причин повышения активности ферментов печени.
Для пациентов с низкой массой тела (<65 кг), лиц азиатского происхождения и пациентов женского пола характерен более высокий риск повышения активности печеночных ферментов.
Увеличение экспозиции нинтеданиба характеризовалось линейной зависимостью от возраста пациента, что также может повлечь за собой более высокий риск повышения активности печеночных ферментов.
У пациентов с этими факторами риска рекомендуется тщательный контроль показателей функции печени.
Риск развития кровотечений
Данных о применении препарата Варгатеф® у пациентов с наследственной предрасположенностью к кровотечениям (например, болезнь Виллебранда) не имеется.
НМРЛ. Пациенты с недавно отмечавшимся легочным кровотечением (>2.5 мл крови), а также пациенты с центрально расположенными опухолями и рентгенологическими признаками локальной инвазии крупных сосудов или с рентгенологическими признаками наличия полостей или некротических изменений опухоли исключались из клинических исследований. Поэтому применение препарата Варгатеф® у таких пациентов не рекомендуется.
• метастазы в головной мозг
Увеличение частоты церебральных кровотечений у пациентов с ранее адекватно лечеными метастазами в головной мозг (стабильными в течение ≥4 недель до начала лечения препаратом Варгатеф®) не наблюдалось. Однако таких пациентов следует тщательно наблюдать в отношении признаков и симптомов церебральных кровотечений.
Пациенты с активными метастазами в головной мозг исключались из клинических исследований, применение препарата Варгатеф® у них не рекомендуется.
• терапия антикоагулянтами
В клинические исследования включались пациенты, получавшие длительную терапию низкомолекулярными гепаринами в низких дозах или ацетилсалициловой кислотой в дозах ≤325 мг/сут. Увеличение частоты кровотечений у таких пациентов не наблюдалось. Данных о применении препарата Варгатеф® у пациентов, предварительно получавших лечение антикоагулянтами в более высоких дозах, не имеется. Пациентам, у которых во время лечения препаратом Варгатеф® развивались тромбоэмболические нарушения, в связи с чем требовалась терапия антикоагулянтами, разрешалось продолжить прием препарата Варгатеф®, при этом увеличения частоты кровотечений не отмечалось. У пациентов, принимающих такие антикоагулянты, как варфарин или фенпрокумон, необходимо регулярно контролировать протромбиновое время, МНО или следить за клиническими признаками кровотечений.
ИЛФ, другие хронические фиброзирующие ИЗЛ с прогрессирующим фенотипом и ИЗЛ-ССД. В клинические исследования не включались пациенты с известным риском развития кровотечений, включая пациентов с наследственной предрасположенностью к кровотечениям или пациентов, получающих антикоагулянтную терапию в высоких дозах. Следовательно, данной категории пациентов лечение препаратом Варгатеф® следует назначать только в том случае, если потенциальная польза проводимой терапии превышает потенциальный риск.
Артериальная тромбоэмболия
Необходимо соблюдать осторожность при лечении пациентов с высоким сердечно-сосудистым риском, включая ИБС. Следует рассмотреть возможность перерыва в лечении пациентов, у которых развились симптомы острой ишемии миокарда.
Венозная тромбоэмболия
НМРЛ. У пациентов, получающих Варгатеф®, отмечался повышенный риск венозных тромбоэмболий, в т.ч. тромбоза глубоких вен. Пациентов следует тщательно наблюдать в отношении тромбоэмболических нарушений. У пациентов с опасными для жизни венозными тромбоэмболиями Варгатеф® необходимо отменить.
ИЛФ, другие хронические фиброзирующие ИЗЛ с прогрессирующим фенотипом и ИЗЛ-ССД. В клинических исследованиях не наблюдалось повышенного риска развития венозных тромбоэмболических осложнений. Однако в связи с особенностями механизма действия нинтеданиба у пациентов может отмечаться повышенный риск развития тромбоэмболических явлений.
Перфорации ЖКТ
Частота перфораций ЖКТ в отдельных лечебных группах в клинических исследованиях была сопоставима. Однако механизм действия препарата Варгатеф® указывает на возможность повышения риска перфораций ЖКТ. В пострегистрационном периоде были получены сообщения о случаях перфорации ЖКТ, некоторые из которых приводили к летальному исходу. Особое внимание следует уделять лечению пациентов, которые ранее подвергались абдоминальным хирургическим вмешательствам, или перенесших перфорацию полого органа в недавнем анамнезе, а также пациентов с ИЛФ, имеющих в анамнезе пептическую язву, дивертикулез или получающих сопутствующую терапию ГКС или НПВП. В связи с этим Варгатеф® можно применять только, как минимум, через 4 недели после обширных хирургических вмешательств (включая абдоминальные). В случае возникновения гастроинтестинальной перфорации терапию препаратом Варгатеф® следует прекратить.
Нарушение заживления ран
Нинтеданиб, в связи с особенностями механизма действия, может нарушать заживление ран. В клинических исследованиях увеличение частоты нарушений заживления ран не наблюдалось. Специальных исследований, в которых бы изучалось влияние нинтеданиба на заживление ран, не проводилось. Поэтому лечение следует начинать или возобновлять (если осуществлялся перерыв в связи с хирургическим вмешательством) с учетом клинического мнения об адекватности заживления раны.
Особые группы пациентов
В исследовании LUME-Lung 1 у пациентов с массой тела менее 50 кг, принимавших нинтеданиб в сочетании с доцетакселом, наблюдалась более высокая частота развития серьезных нежелательных явлений, чем у пациентов с массой тела ≥50 кг, хотя число пациентов с массой тела менее 50 кг было небольшим. Поэтому рекомендуется тщательное наблюдение за пациентами с массой тела менее 50 кг.
Влияние на способность к управлению транспортными средствами и механизмами
Исследований по влиянию препарата на способность к управлению транспортными средствами и занятию другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не проводилось.
Во время применения препарата Варгатеф® пациентам следует соблюдать осторожность при управлении транспортными средствами или механизмами.
Передозировка
Симптомы: в клинических исследованиях нинтеданиб изучался в максимальной однократной дозе 450 мг 1 раз/сут. Также зафиксированы случаи передозировки при применении препарата в максимальной дозе 600 мг в течение 8 дней. Наблюдавшиеся нежелательные явления были сопоставимы с известным профилем безопасности нинтеданиба: увеличение активности ферментов печени и нарушения со стороны ЖКТ. Пациенты полностью восстановились после нежелательных явлений. В исследованиях INPULSIS был зафиксирован один случай непреднамеренного повышения дозы до 600 мг 2 раза/сут на протяжении 21 дня у пациента с ИЛФ. В период некорректного приема препарата было зафиксировано развитие несерьезного нежелательного явления (назофарингит), которое купировалось в данном периоде без регистрации каких-либо других нежелательных реакций.
Лечение: специфического антидота на случай передозировки нет. При подозрении на передозировку необходимо отменить Варгатеф® и проводить симптоматическую терапию.
Лекарственное взаимодействие
Индукторы/ингибиторы P-gp
Нинтеданиб является субстратом для P-gp. Показано, что совместное применение с активным ингибитором P-gp кетоконазолом увеличивает экспозицию нинтеданиба, судя по величине AUC, в 1.61 раза, а судя по величине Сmax, в 1.83 раза.
Одновременное применение рифампицина (активного индуктора P-gp) приводит к уменьшению экспозиции нинтеданиба, судя по величине AUC, на 50.3%, а судя по величине Сmax, на 60.3% (по сравнению с применением только нинтеданиба).
Активные ингибиторы P-gp (например, кетоконазол или эритромицин) в случае совместного применения с препаратом Варгатеф® могут увеличивать экспозицию нинтеданиба. У таких пациентов переносимость нинтеданиба следует тщательно контролировать.
Активные индукторы P-gp (например, рифампицин, карбамазепин, фенитоин и препараты зверобоя продырявленного) могут уменьшать экспозицию нинтеданиба. Рекомендуется подбор альтернативной сопутствующей терапии с отсутствием или минимальным индуцирующим действием на систему P-gp.
Изоферменты CYP
Изоферменты CYP принимают лишь небольшое участие в биотрансформации нинтеданиба. В доклинических исследованиях нинтеданиб и его метаболиты (свободный кислый метаболит нинтеданиба и его глюкуронид) не ингибировали и не индуцировали изоферменты CYP. Поэтому вероятность лекарственного взаимодействия с нинтеданибом, основанного на влиянии на изоферменты CYP, считается небольшой.
Одновременное применение с пирфенидоном
Было проведено изучение совместного применения нинтеданиба и пирфенидона у пациентов с ИЛФ в рамках специального фармакокинетического исследования. Пациенты первой группы получали однократную дозу нинтеданиба 150 мг до начала постепенного повышения дозы пирфенидона до максимальной (по 801 мг 3 раза/сут), и еще одну дозу нинтеданиба 150 мг по достижении равновесного состояния (в последний день). Пациенты второй группы получали пирфенидон в постоянной дозе 801 мг 3 раза/сут. У них была проведена оценка фармакокинетического профиля до начала совместной терапии и через 7 дней совместного приема нинтеданиба в дозе 150 мг 2 раза/сут. В первой группе скорректированные соотношения среднегеометрических значений (90% ДИ) составляли 93% (57-151%) и 96% (70-131%) для показателей Сmax и AUC0-tz нинтеданиба соответственно (n=12). Во второй группе скорректированные соотношения среднегеометрических значений (90% ДИ) составляли 97% (86-110%) и 95% (86-106%) для показателей Cmaxss и AUCt,ss пирфенидона соответственно (n=12). На основании полученных результатов можно сделать вывод об отсутствии признаков значимого фармакокинетического взаимодействия между нинтеданибом и пирфенидоном при совместном применении.
Одновременное применение с другими препаратами
Одновременное применение нинтеданиба с доцетакселом (75 мг/м2) не изменяет в существенной степени фармакокинетику этих препаратов.
Одновременное применение нинтеданиба с бозентаном не изменяет фармакокинетику нинтеданиба.
Возможность взаимодействия нинтеданиба с гормональными контрацептивными средствами не изучалась.
Одновременный прием с пищей
Варгатеф® рекомендуется принимать одновременно с пищей (см. раздел «Фармакокинетика»).
Условия хранения препарата Варгатеф®
Препарат следует хранить в недоступном для детей месте в оригинальной упаковке при температуре не выше 25°С.
Срок годности препарата Варгатеф®
Срок годности — 3 года. Не применять после истечения срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЕШНЛ ГМБХ
(Германия)
|
|
ООО «Берингер Ингельхайм» |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Нинтеданиб
Nintedanib
Фармакодинамика
Механизм действия
Нинтеданиб — тройной ингибитор ангиокиназы, блокирующий рецепторы фактора роста эндотелия сосудов 1–3 (VEGFR 1–3), рецепторы тромбоцитарного фактора роста α и β (PDGFR α и β) и рецепторы фактора роста фибробластов 1–3 (FGFR 1–3), через которые реализуется активность киназы. Нинтеданиб конкурентно взаимодействует с АТФ-связывающим участком этих рецепторов и блокирует внутриклеточную передачу сигналов, которая крайне важна для пролиферации и выживания эндотелиальных, а также периваскулярных клеток (перицитов и гладкомышечных клеток сосудов), а также особенно важна для пролиферации, миграции и трансформации фибробластов, представляющих основные патологические механизмы идиопатического лёгочного фиброза (ИЛФ). Кроме того, ингибируются киназы Flt–3, Lck и Src.
Фармакодинамические эффекты
Опухолевый ангиогенез является процессом, который вносит существенный вклад в рост, прогрессирование и образование метастазов опухоли. Этот процесс преимущественно запускается проангиогенными факторами, такими как фактор роста эндотелия сосудов и основной фактор роста фибробластов (VEGF и bFGF), секретируемыми опухолевыми клетками, чтобы привлечь эндотелиальные и периваскулярные клетки хозяина и облегчить доставку кислорода и питательных веществ через сосудистую систему. Нинтеданиб эффективно противодействует образованию и развитию сосудистой системы опухоли, приводит к замедлению и остановке роста опухоли.
Активация сигнальных каскадов FGFR и PDGFR также особенно важна для пролиферации, миграции лёгочных фибробластов/миофибробластов, характерных клеток в патогенезе ИЛФ. Потенциальное воздействие на ингибирование VEGFR в патогенезе ИЛФ в настоящее время полностью не выяснено. Считается, что на молекулярном уровне нинтеданиб ингибирует сигнальные каскады FGFR и PDGFR, играющие роль в пролиферации и миграции лёгочных фибробластов, путём взаимодействия с АТФ-зоной связывания внутриклеточного домена рецептора, таким образом, вмешиваясь в процессы перекрёстной активации путём аутофосфорилирования гомодимеров рецепторов. In vitro таргетные рецепторы ингибировались нинтеданибом в малых концентрациях, измеряемых наномолями. В человеческих лёгочных фибробластах, полученных от пациентов с ИЛФ, нинтеданиб ингибировал PDGF-, FGF- и VEGF-стимулированную пролиферацию клеток, значения полумаксимальной эффективной концентрации (EC50) составили 11; 5,5 и менее чем 1 нмоль/л соответственно. В концентрации от 100 до 1 000 нмоль/л нинтеданиб также ингибировал PDGF-, FGF- и VEGF-стимулированную миграцию фибробластов и TGF-β2 (тpaнсформирующий фактор роста β2)-индуцированную трансформацию фибробластов в миофибробласты. Кроме того, полагают, что противовоспалительная активность нинтеданиба ограничивает фиброзную стимуляцию путём снижения фиброзных медиаторов, таких как интерлейкины (ИЛ-1β и ИЛ-6). Роль антиангиогенной активности нинтеданиба в механизме действия препарата при фиброзных заболеваниях лёгких в настоящее время неясна. В исследованиях in vivo было показано, что нинтеданиб обладает высокой антифиброзной и противовоспалительной активностью.
Фармакокинетика
Фармакокинетика нинтеданиба может считаться линейной в отношении времени (то есть данные, полученные в случае применения однократной дозы, могут экстраполироваться на данные, полученные в результате многократного применения). После многократного применения нинтеданиба накопление составляет 1,04 при оценке Cmax и 1,38 при оценке AUCτ. Остаточные концентрации нинтеданиба остаются стабильными в течение одного года и более.
Абсорбция
Cmax нинтеданиба в плазме крови достигается приблизительно через 2–4 часа после приёма во время еды (диапазон 0,5–8 часов). Абсолютная биодоступность дозы 100 мг составляет у здоровых добровольцев 4,69 % (90 % доверительный интервал (ДИ) 3,615–6,078).
Установлено, что экспозиция нинтеданиба увеличивается пропорционально дозе (в диапазонах доз 50–450 мг 1 раз в день и 150–300 мг 2 раза в день). Устойчивые концентрации в плазме крови достигаются как максимум в течение 1 недели после начала приёма.
Экспозиция нинтеданиба увеличивается после приёма пищи примерно на 20 % по сравнению с приёмом натощак (ДИ 95,3–152,5 %), а всасывание замедляется. Медиана Tmax в плазме крови натощак — 2 часа, после еды — 3,98 часа.
Распределение
Распределение нинтеданиба осуществляется путём двухфазной кинетики. После внутривенной инфузии во время терминальной фазы наблюдается большой объём распределения (Vd) 1 050 л, геометрический коэффициент вариации (gCV) 45 %. Связывание нинтеданиба с белками плазмы человека in vitro считается значительным, связанная фракция составляет 97,8 %. Основным белком, участвующим в связывании, считается альбумин сыворотки крови. Нинтеданиб преимущественно распределяется в плазме, соотношение кровь/плазма составляет 0,869.
Нинтеданиб является субстратом для гликопротеина Р (P-gp). Показано, что нинтеданиб in vitro не является субстратом или ингибитором полипептидных переносчиков органических анионов (OATP-1B1, ОАТР-1В3, ОАТР-2В1), переносчика органических катионов-2 (ОСT-2) или белка, ассоциированного с множественной лекарственной устойчивостью-2 (MRP-2). Нинтеданиб также не является субстратом для белка резистентности рака молочной железы (BCRP). In vitro было установлено, что нинтеданиб обладает слабой ингибирующей активностью в отношении ОСТ-1, BCRP и P-gp, что, как считается, имеет небольшую клиническую значимость. Такое же заключение сделано в отношении нинтеданиба как субстрата для ОСТ-1.
Биотрансформация
Основной реакцией, участвующей в метаболизме нинтеданиба, является гидролитическое расщепление с помощью эстераз, что приводит к образованию свободного кислого метаболита нинтеданиба. В доклинических исследованиях in vivo установлено, что данный метаболит не обладает эффективностью, несмотря на влияние на целевые рецепторы нинтеданиба. В дальнейшем он глюкуронизируется ферментами УДФ-ГТ (UGT 1А1, UGT 1А7, UGT 1А8 и UGT 1А10) с образованием глюкуронида.
Считается, что биотрансформация нинтеданиба с участием изоферментов CYP происходит только в небольшой степени, основное участие принимает изофермент CYP3A4. В исследовании ADME у человека основной метаболит, образующийся с участием изоферментов CYP, обнаружить в плазме не удалось. По данным исследования in vitro, CYP-зависимый метаболизм составляет примерно 5 %, тогда как расщепление, осуществляемое эстеразами, составляет 25 %.
Элиминация
Общий клиренс из плазмы после внутривенной инфузии составляет 1 390 мл/мин (gCV 28,8 %). Экскреция почками неизменённого нинтеданиба в течение 48 часов после приёма нинтеданиба составляет примерно 0,05 % от величины дозы (gCV 31,5 %), а после внутривенного введения — примерно 1,4 % (gCV 24,2 %); почечный клиренс составляет 20 мл/мин (gCV 32,6 %). После приёма внутрь 14C-нинтеданиба радиоактивный материал выводился преимущественно с желчью и обнаруживался в фекалиях (93,4 % от величины дозы, gCV 2,61 %). Вклад почечной экскреции в общий клиренс составляет 0,649 % от величины дозы (gCV 26,3 %). Выведение считается полным (более 90 %) через 4 дня после приёма. Период полувыведения (T½) нинтеданиба составляет от 10 до 15 часов (gCV примерно 50 %).
Зависимость эффекта от экспозиции
Немелкоклеточный рак лёгкого (НМРЛ)
В ходе исследования зависимости нежелательных явлений от фармакокинетики нинтеданиба была установлена тенденция к более частому повышению активности ферментов печени при большей экспозиции нинтеданиба. Подобной зависимости не отмечается для нарушений со стороны желудочно-кишечного тракта. Для клинических конечных точек анализ взаимосвязи фармакокинетики с эффективностью не проводился. С помощью метода логистической регрессии установлена статистически значимая взаимосвязь между экспозицией нинтеданиба и влиянием на изменения, обнаруживаемые методом динамической контрастной МРТ.
Идиопатический лёгочный фиброз (ИЛФ)
В анализе фармакокинетических нежелательных явлений, основанном на данных исследований II фазы, большее воздействие нинтеданиба, как правило, было связано с повышением уровня печёночных ферментов.
Фармакокинетика у особых групп пациентов
Фармакокинетические свойства нинтеданиба были сопоставимы у здоровых добровольцев, пациентов с ИЛФ и НМРЛ. Основываясь на результатах популяционного фармакокинетического анализа у пациентов с ИЛФ и НМРЛ и описательных исследований, на воздействие нинтеданиба не влияли пол (с учётом массы тела), нарушение функции почек лёгкой и средней степени тяжести (рассчитанное по клиренсу креатинина), метастазы в печени, общее состояние больного (оценка по опроснику восточной объединённой онкологической группы, Eastern Cooperative Oncology Group (ECOG), употребление алкоголя или генотип Р-gp. Популяционный фармакокинетический анализ выявил умеренное влияние пола, массы тела и расовой принадлежности на воздействие нинтеданиба. В связи с тем, что наблюдалась высокая межиндивидуальная вариабельность воздействия, эти влияния не считались клинически значимыми. Тем не менее, рекомендуется тщательное мониторирование пациентов, у которых выявляется несколько факторов риска, представленных ниже.
Возраст
Экспозиция нинтеданиба линейно увеличивается с возрастом. У 45-летних пациентов (5-й процентиль) значение AUCτ,ss (в равновесном состоянии на период дозирования) было ниже на 16 %, а у 76-летних пациентов (95-й процентиль) выше на 13 % по сравнению с пациентами, медиана возраста которых составляла 62 года. Диапазон возраста, оценивавшийся в ходе анализа, составлял 29–85 лет; возраст более 75 лет отмечался примерно у 5 % популяции пациентов.
Аналогичные исследования у детей не проводились.
Масса тела
Наблюдается обратная корреляция между массой тела и экспозицией нинтеданиба. У пациентов с массой тела 50 кг (5-й процентиль) величина AUCτ,ss увеличивалась на 25 %, а у пациентов с массой тела 100 кг (95-й процентиль) уменьшалась на 19 % по сравнению с пациентами, медиана массы тела которых составляла 71,5 кг.
Раса
Средняя геометрическая экспозиция нинтеданиба на 33 % выше у пациентов — китайцев, тайванцев и индийцев, а у корейцев — на 22 % ниже, чем у пациентов европеоидной расы (с поправкой на массу тела). Но в связи с высокой межиндивидуальной вариабельностью воздействия нинтеданиба эти влияния не считаются клинически значимыми. Данные в отношении пациентов негроидной расы являются очень ограниченными, диапазон этих данных сходен с пациентами европеоидной расы.
Нарушения функции печени
Фармакокинетические показатели нинтеданиба были получены у пациентов с нарушениями показателей функции печени (повышение активности аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ) и концентрации билирубина). У пациентов с исходным повышением активности ACT и АЛТ (до 10 раз по сравнению с верхней границей нормы (ВГН)) и концентрации билирубина (до 1,5 раза по сравнению с ВГН) наблюдается тенденция к увеличению экспозиции нинтеданиба (по сравнению с пациентами с нормальными значениями активности ACT, AЛT и концентрации билирубина). Ограниченные данные о пациентах с повышенной активностью АЛТ или ACT, превышавшей ВГН более чем в 10 раз, и повышением концентрации билирубина, превышавшим ВГН более чем в 1,5 раза, не позволили сделать окончательные выводы.
Показания
Местно-распространённый, метастатический или рецидивирующий немелкоклеточный рак лёгкого (аденокарцинома) после химиотерапии первой линии в комбинации с доцетакселом. Идиопатический лёгочный фиброз (идиопатический фиброзирующий альвеолит); для лечения и замедления прогрессирования заболевания.
Противопоказания
Гиперчувствительность к нинтеданибу, беременность и период грудного вскармливания, нарушения функции печени средней и тяжёлой степени тяжести (опыт применения отсутствует), тяжёлые нарушения функции почек (клиренс креатинина <30 мл/мин) (опыт применения отсутствует)1, активные метастазы в головной мозг (опыт применения отсутствует), возраст младше 18 лет (опыт применения отсутствует).
1 Эффективность и безопасность нинтеданиба у пациентов с тяжёлыми нарушениями функции почек (клиренс креатинина <30 мл/мин) не были изучены. Через почки выводится менее 1 % разовой дозы нинтеданиба.
Информация о противопоказаниях в отношении доцетаксела дана в соответствующей инструкции по применению этого препарата и в данном описании не рассматривается.
С осторожностью
Нарушения функции печени лёгкой степени тяжести; наследственная предрасположенность к кровотечениям (болезнь фон Виллебранда); стабильные метастазы в головной мозг; терапия антикоагулянтами; венозные тромбоэмболии; перфорации желудочно-кишечного тракта в анамнезе; пациенты, которые ранее подвергались абдоминальным хирургическим вмешательствам; артериальная тромбоэмболия.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — D.
Специальных исследований по применению нинтеданиба во время беременности у человека не проводилось, однако в доклинических исследованиях у животных установлена репродуктивная токсичность этого препарата. Поскольку нинтеданиб может обладать эмбриотоксическим действием у человека, он не должен применяться во время беременности, и, по меньшей мере перед началом лечения, рекомендуется проведение теста на беременность.
Пациенткам следует немедленно сообщить врачу о развитии беременности во время терапии нинтеданибом. Если во время терапии развивается беременность, пациентку необходимо проинформировать о потенциальной опасности эмбриотоксического воздействия нинтеданиба. Также должен рассматриваться вопрос о прекращении лечения нинтеданибом.
Женщинам детородного возраста, принимающим нинтеданиб, следует рекомендовать использовать надёжные методы контрацепции во время применения нинтеданиба и на протяжении по крайней мере 3 месяца после приёма последней дозы.
Применение в период грудного вскармливания
Специальных исследований о выделении нинтеданиба и его метаболитов в грудное молоко у человека не проводилось. В доклинических исследованиях показано, что у крыс в период лактации в грудное молоко проникает небольшое количество нинтеданиба и его метаболитов (≤0,5 % от величины применявшейся дозы). Поэтому нельзя исключить риск для новорождённых и грудных детей. Во время лечения нинтеданибом кормление грудью следует прекратить.
Фертильность
В доклинических исследованиях признаков нарушений фертильности у самцов выявлено не было. В исследованиях, во время которых уровень системного воздействия нинтеданиба был сравним с уровнем, достигающимся при использовании максимальной рекомендуемой дозы у человека (250 мг 2 раза в день), признаков нарушений фертильности у самок крыс обнаружено не было.
Информация о влиянии доцетаксела на беременность, грудное вскармливание и фертильность дана в соответствующей инструкции по применению этого препарата и в данном описании не рассматривается.
Способ применения и дозы
Режим дозирования индивидуальный, в зависимости от показаний и стадии заболевания, состояния системы кроветворения, схемы противоопухолевой терапии.
Побочные действия
НМРЛ
Наиболее часто сообщавшимися нежелательными реакциями, считавшимися связанными с применением нинтеданиба, были диарея, повышение активности ферментов печени (АЛT и АСТ) и рвота.
Частота побочных реакций, приведённых ниже, изложена в соответствии со следующей градацией: очень часто (>1/10); часто (>1/100; ≤1/10); нечасто (>1/1 000; ≤1/100); редко (>1/10 000; ≤1/1 000); очень редко (≤1/10 000).
Инфекции и инвазии
Часто — абсцесс, сепсис.
Со стороны крови и лимфатической системы
Очень часто — нейтропения с возможным риском инфекционных осложнений1, таких как пневмония1, 2; часто — фебрильная нейтропения, лейкопения1.
Метаболические нарушения и нарушения питания
Очень часто — снижение аппетита, нарушение электролитного баланса, включая гипокалиемию; часто — обезвоживание.
Со стороны нервной системы
Очень часто — периферическая нейропатия, астения1, 2.
Со стороны сосудов
Очень часто — кровотечения2; часто — повышение артериального давления, тромбоэмболия, артериальная тромбоэмболия1, 2.
Со стороны желудочно-кишечного тракта
Очень часто — диарея, рвота, тошнота, боль в животе, мукозит, включая стоматит; нечасто — перфорации желудочно-кишечного тракта2.
Со стороны гепатобилиарной системы
Очень часто — повышение активности АСТ, АЛТ, повышение активности щелочной фосфатазы (ЩФ); часто — повышение концентрации билирубина.
Со стороны почек
Почечная недостаточность1.
Со стороны дыхательной системы
Интерстициальная болезнь лёгких1, 2, одышка1, 2.
1 Данные побочные реакции наблюдались при проведении клинических исследований, однако связь с приёмом нинтеданиба не доказана.
2 В клинических исследованиях частота встречаемости данных побочных реакций у пациентов, принимавших нинтеданиб в комбинации с доцетакселом, не превышала частоту встречаемости таковых у пациентов, принимавших плацебо в комбинации с доцетакселом.
Диарея является часто сообщавшимся нежелательным явлением со стороны желудочно-кишечного тракта. Отмечается тесная временная связь между развитием диареи и применением доцетаксела. В клиническом исследовании LUME-Lung 1 диарея лёгкой и средней степени тяжести отмечалась у большинства пациентов. Диарея ≥3-й степени тяжести при использовании комбинированного лечения отмечалась у 6,3 % пациентов, тогда как при использовании одного доцетаксела — только у 3,6 % пациентов.
Такие часто сообщающиеся побочные эффекты, как тошнота и рвота, в большинстве случаев были лёгкой или средней степени тяжести.
По данным клинических исследований, применение нинтеданиба в комбинации с доцетакселом сопровождалось более частым развитием нейтропении ≥3-й степени тяжести (по критериям СТСАЕ), чем в случае применения одного доцетаксела. Более высокий риск повышения активности печёночных ферментов и концентрации билирубина возможен у женщин. В большинстве случаев изменение этих лабораторных показателей было обратимым и не сопровождалось клиническими симптомами повреждения печени.
ИЛФ
Наиболее часто сообщавшимися нежелательными реакциями, связанными с применением нинтеданиба, были диарея, тошнота и рвота, боль в области живота, снижение аппетита, снижение массы тела и повышение уровня ферментов печени.
Частота побочных реакции, приведённых ниже, изложена в соответствии со следующей градацией: очень часто (>1/10); часто (>1/100; ≤1/10); нечасто (>1/1 000; ≤1/100); редко (>1/10 000; ≤1/1 000); очень редко (≤1/10 000).
Метаболические нарушения и нарушения питания
Часто — снижение аппетита, снижение массы тела.
Со стороны сосудов
Нечасто — повышение артериального давления.
Со стороны желудочно-кишечного тракта
Очень часто — диарея, тошнота, боль в области живота; часто — рвота.
Со стороны гепатобилиарной системы
Очень часто — повышение уровня печёночных ферментов; часто — повышение активности АЛТ, AСT, повышение активности ГГТ; нечасто — повышение активности ЩФ, повышение концентрации билирубина.
В исследованиях INPULSIS диарея была наиболее часто репортируемым желудочно-кишечным явлением у 62,4 % по сравнению с 18,4 % пациентов, получавших нинтеданиб или плацебо соответственно. У большинства пациентов данные явления были лёгкой и средней степени тяжести и отмечались на протяжении первых 3 месяцев лечения. Диарея стала причиной прекращения терапии нинтеданибом у 4,4 % пациентов.
Тошнота и рвота были часто сообщаемыми нежелательными явлениями. У большинства пациентов отмечалась тошнота и рвота лёгкой или средней степени тяжести. Тошнота стала причиной прекращения лечения нинтеданибом у 2 % пациентов. Рвота стала причиной прекращения лечения у 0,8 % пациентов. Более высокий риск повышения активности печёночных ферментов (АЛТ, АСТ, ЩФ, ГГТ) возможен у женщин. В большинстве случаев повышение активности трансаминаз было обратимым и не сопровождалось клиническими симптомами повреждения печени.
Передозировка
Симптомы
В клинических исследованиях нинтеданиб изучался в наивысшей однократной дозе 450 мг 1 раз в день. Также зафиксированы случаи передозировки при применении нинтеданиба в максимальной дозе 600 мг в течение 8 дней. Наблюдавшиеся нежелательные явления были сопоставимы с известным профилем безопасности нинтеданиба: увеличение активности ферментов печени и нарушения со стороны желудочно-кишечного тракта. Пациенты полностью восстановились после нежелательных явлений. В исследованиях INPULSIS был зафиксирован 1 случай непреднамеренного повышения дозы до 600 мг 2 раза в день на протяжении 21 дня у пациента с ИЛФ. В период некорректного приёма нинтеданиба было зафиксировано развитие несерьёзного нежелательного явления (назофарингит), которое купировалось в данном периоде без регистрации каких-либо других нежелательных реакций.
Лечение
Специфического антидота на случай передозировки нет. При подозрении на передозировку необходимо отменить нинтеданиб и проводить симптоматическую терапию.
Взаимодействие
Индукторы/ингибиторы P-gp
Нинтеданиб является субстратом для P-gp. Показано, что совместное применение с активным ингибитором P-gp кетоконазолом увеличивает экспозицию нинтеданиба, судя по величине AUC — в 1,61 раза, а судя по величине Cmax — в 1,83 раза.
Одновременное применение рифампицина (активный индуктор P-gp) приводит к уменьшению экспозиции нинтеданиба, судя по величине AUC — на 50,3 %, а судя по величине Cmax — на 60,3 % (по сравнению с применением одного нинтеданиба).
Активные ингибиторы P-gp (например кетоконазол или эритромицин) в случае совместного применения с нинтеданибом могут увеличивать экспозицию нинтеданиба. У таких пациентов переносимость нинтеданиба должна тщательно мониторироваться.
Активные индукторы P-gp (например рифампицин, карбамазепин, фенитоин и препараты зверобоя продырявленного) могут уменьшать экспозицию нинтеданиба. Рекомендуется подбор альтернативной сопутствующей терапии с отсутствием или минимальным индуцирующим действием на систему P-gp.
Изоферменты СYР
Изоферменты СYР принимают лишь небольшое участие в биотрансформации нинтеданиба. В доклинических исследованиях нинтеданиб и его метаболиты (свободный кислый метаболит нинтеданиба и его глюкуронид) не ингибировали и не индуцировали изоферменты CYP. Поэтому вероятность лекарственного взаимодействия с нинтеданибом, основанного на влиянии на изоферменты CYP, считается небольшой.
Одновременная терапия с пирфенидоном
Одновременное назначение нинтеданиба с пирфенидоном было изучено в исследовании с параллельными группами японских пациентов с ИЛФ. Воздействие нинтеданиба имело тенденцию к снижению при одновременном назначении пирфенидона по сравнению с назначением только нинтеданиба. Нинтеданиб не оказывал эффекта на фармакокинетику пирфенидона. В связи с коротким периодом одновременного воздействия и малым количеством пациентов, никакие выводы о безопасности и эффективности комбинированного лечения не могут быть сделаны.
Одновременное применение с другими препаратами
Одновременное применение нинтеданиба с доцетакселом (75 мг/м2) не изменяет в существенной степени фармакокинетику этих препаратов.
Возможность взаимодействия нинтеданиба с гормональными контрацептивными средствами не изучалась.
Особые указания
Желудочно-кишечные расстройства
Диарея
Лечение диареи (адекватная гидратация и противодиарейные средства, например лоперамид) следует проводить при появлении первых признаков. В случае развития диареи может потребоваться прерывание лечения, снижение дозы или прекращение терапии.
Тошнота и рвота
В случае возникновения тошноты и рвоты рекомендовано применение препаратов с противорвотным действием, например глюкокортикостероидов, антигистаминных средств или антагонистов серотониновых 5-НТ3-рецепторов. Несмотря на соответствующее поддерживающее лечение, могут потребоваться прерывание лечения нинтеданибом, снижение его дозы или прекращение терапии.
В случае обезвоживания рекомендуется восстановление водно-электролитного баланса. Если возникают существенные желудочно-кишечные нежелательные явления, то необходимо проведение мониторирования концентрации электролитов в крови.
Нейтропения и сепсис
Во время терапии нинтеданибом, в частности при комбинации его с доцетакселом, необходимо проводить мониторинг показателей крови на предмет развития нейтропении и возможных последующих осложнений в виде сепсиса или фебрильной нейтропении.
Нарушения функции печени
Безопасность и эффективность нинтеданиба не изучалась у пациентов с нарушениями функции печени средней (класс B по шкале Чайлд-Пью) или тяжёлой (класс C по шкале Чайлд-Пью) степени тяжести. Поэтому у таких пациентов применение нинтеданиба не рекомендуется.
НМРЛ
После начала терапии рекомендуется тщательный контроль активности печёночных трансаминаз, щелочной фосфатазы и концентрации билирубина (периодически, во время начала комбинации с доцетакселом, то есть в начале каждого лечебного цикла). Если отмечается существенное повышение активности печёночных ферментов, может потребоваться прерывание лечения, уменьшение дозы или прекращение терапии нинтеданибом.
ИЛФ
Рекомендуется оценивать активность печёночных трансаминаз и концентрацию билирубина до начала терапии нинтеданибом, а затем периодически во время лечения (например при каждом визите пациента) или по клиническим показаниям. В случае повышения уровня трансаминаз (ACT или АЛТ) более чем в 5 раз выше ВГН рекомендовано прервать терапию нинтеданибом и проводить мониторирование пациента. Если повышение каких-либо показателей функции печени связано с клиническими симптомами поражения печени, например желтухой, лечение нинтеданибом следует окончательно прекратить. Следует исследовать альтернативные причины повышения уровней печёночных ферментов. Как только показатели трансаминаз вернутся к исходному уровню, лечение нинтеданибом можно возобновить в сниженной дозе (100 мг 2 раза в день), которая впоследствии может быть повышена до полной дозы (150 мг 2 раза в день).
Особые группы пациентов
НМРЛ
Такие показатели как возраст, масса тела и отношение к азиатской расе может привести к более высокому риску повышения активности печёночных ферментов. У пациентов с несколькими факторами риска рекомендуется тщательное мониторирование показателей функции печени.
Риск развития кровотечений
Ингибирование VEGFR способно привести к увеличению риска кровотечений. В клинических исследованиях у пациентов с аденокарциномой, принимавших нинтеданиб, повышение частоты кровотечений не наблюдалось. Данных о применении нинтеданиба у пациентов с наследственной предрасположенностью к кровотечениям (например болезнь Виллебранда) не имеется.
НМРЛ
Пациенты с недавно отмечавшимся лёгочным кровотечением (>2,5 мл крови), а также пациенты с центрально расположенными опухолями и рентгенологическими признаками локальной инвазии крупных сосудов или с рентгенологическими признаками наличия полостей или некротических изменений опухоли исключались из клинических исследований. Поэтому применение нинтеданиба у таких пациентов не рекомендуется.
Метастазы в головной мозг
Увеличение частоты церебральных кровотечений у пациентов с ранее адекватно лечеными метастазами в головной мозг (стабильными в течение ≥4 недель до начала лечения нинтеданибом) не наблюдалось. Однако такие пациенты должны тщательно мониторироваться в отношении признаков и симптомов церебральных кровотечений.
Пациенты с активными метастазами в головной мозг исключались из клинических исследований, применение нинтеданиба у них не рекомендуется.
Терапия антикоагулянтами
В клинические исследования включались пациенты, получавшие длительную терапию низкомолекулярными гепаринами в низких дозах или ацетилсалициловой кислотой в дозах ≤325 мг/сут. Увеличение частоты кровотечений у таких пациентов не наблюдалось. Данных о применении нинтеданиба у пациентов, предварительно получавших лечение антикоагулянтами в более высоких дозах, не имеется. Пациентам, у которых во время лечения нинтеданибом развивались тромбоэмболические нарушения, в связи с чем требовалась терапия антикоагулянтами, разрешалось продолжить приём нинтеданиба, при этом увеличение частоты кровотечений не отмечалось. У пациентов, принимающих такие антикоагулянты, как варфарин или фенпрокумон, необходимо регулярно проверять ПВ, МНО или следить за клиническими признаками кровотечений.
ИЛФ
Во время проведения клинических исследований не наблюдалось существенного риска развития кровотечений на фоне приёма нинтеданиба. В клинические исследования не включались пациенты с известным риском развития кровотечений, включая пациентов с наследственной предрасположенностью к кровотечениям или получающих антикоагулянтную терапию в высоких дозах. Следовательно, данной категории пациентов лечение нинтеданибом должно быть назначено только в том случае, если потенциальная польза проводимой терапии превышает потенциальный риск.
Артериальная тромбоэмболия
ИЛФ
Из клинических исследований INPULSIS исключались пациенты с инфарктом миокарда или инсультом в ближайшем анамнезе. Случаи развития артериальной тромбоэмболии встречались редко: у 0,7 % пациентов, получавших плацебо, и 2,5 % пациентов в группе, получавшей нинтеданиб.
В то время как нежелательные реакции, отражающие ишемические заболевания сердца, были сравнимы в группах нинтеданиба и плацебо, пациентов, у которых развился инфаркт миокарда, оказалось больше в группе нинтеданиба (1,6 %) по сравнению с группой плацебо (0,5 %). Необходимо соблюдать осторожность при лечении пациентов с высоким сердечно-сосудистым риском, включая известное заболевание коронарных артерий. Следует рассмотреть возможность перерыва в лечении пациентов, у которых развились симптомы острой ишемии миокарда.
Венозная тромбоэмболия
НМРЛ
У пациентов, получающих нинтеданиб, отмечался повышенный риск венозных тромбоэмболий, в том числе тромбоза глубоких вен. Пациенты должны тщательно мониторироваться в отношении тромбоэмболических нарушений. Пациентам с опасными для жизни венозными тромбоэмболиями нинтеданиб необходимо отменить.
ИЛФ
В исследованиях INPULSIS не наблюдалось повышенного риска развития венозных тромбоэмболических осложнений. Однако в связи с особенностями механизма действия нинтеданиба, у пациентов может отмечаться повышенный риск развития тромбоэмболических явлений.
Перфорации желудочно-кишечного тракта
Частота перфораций желудочно-кишечного тракта в отдельных лечебных группах в клинических исследованиях была сопоставима. Однако механизм действия нинтеданиба указывает на возможность повышения риска перфораций желудочно-кишечного тракта. Особое внимание должно уделяться лечению пациентов, которые ранее подвергались абдоминальным хирургическим вмешательствам. В связи с этим нинтеданиб может применяться только как минимум через 4 недели после больших хирургических вмешательств. В случае возникновения гастроинтестинальной перфорации терапия нинтеданибом должна прекращаться.
Нарушение заживления ран
Нинтеданиб, в связи с особенностями механизма действия, может нарушать заживление ран. В исследованиях LUME-Lung 1 и INPULSIS увеличение частоты нарушений заживления ран не наблюдалось. Специальных исследований, в которых бы изучалось влияние нинтеданиба на заживление ран, не проводилось. Поэтому лечение должно начинаться или возобновляться (если осуществлялся перерыв в связи с хирургическим вмешательством) с учётом клинического мнения об адекватности заживления раны.
Информация о мерах предосторожности в отношении доцетаксела дана в соответствующей инструкции по применению этого препарата и в данном описании не рассматривается.
Особые группы пациентов
Детский возраст
Безопасность и эффективность нинтеданиба у пациентов детского возраста в клинических исследованиях не изучалась.
Пожилой возраст (>65 лет)
Не отмечено никаких общих различий по безопасности и эффективности применения нинтеданиба у пожилых пациентов по сравнению с пациентами моложе 65 лет. Снижать дозу на основании возраста пациента не требуется.
Раса и масса тела. НМРЛ
Основываясь на данных популяционного фармакокинетического анализа, исходная коррекция дозы нинтеданиба в зависимости от расы и массы тела не требуется.
Нарушения функции почек
Через почки выводится менее 1% однократной дозы нинтеданиба. У пациентов с нарушениями функции почек лёгкой или средней степени тяжести изменение начальной дозы не требуется. У пациентов с тяжёлыми нарушениями функции почек (клиренс креатинина <30 мл/мин) безопасность, эффективность и фармакокинетика нинтеданиба не изучались.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследований по влиянию нинтеданиба на способность управлять транспортными средствами и занятию другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не проводилось. Во время применения нинтеданиба пациентам нужно рекомендовать соблюдать осторожность при управлении транспортными средствами или механизмами.
Классификация
-
АТХ
L01XE31, L01EX09
-
Фармакологическая группа
-
Коды МКБ 10
-
Категория при беременности по FDA
D
(риск доказан)
Информация о действующем веществе Нинтеданиб предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Нинтеданиб, содержатся в инструкции производителя, прилагаемой к упаковке.
