Инфекционные заболевания: часто — инфекция верхних дыхательных путей; нечасто — бронхит, пневмония; энцефалит.
Доброкачественные, злокачественные и неуточненные новообразования (включая полипы и кисты): редко — гистиоцитарный некротический лимфаденит (лимфаденит Кикучи).
Со стороны системы кроветворения: нечасто — эозинофилия.
Со стороны иммунной системы: нечасто — инфузионные реакции, анафилактические реакции, реакции гиперчувствительности.
Со стороны эндокринной системы: часто — гипергликемия, гипотиреоз, гипертиреоз; нечасто — недостаточность функции надпочечников, гипопитуитаризм, гипофизит, тиреоидит, диабетический кетоацидоз, сахарный диабет.
Со стороны обмена веществ: часто — снижение аппетита; нечасто — дегидратация, метаболический ацидоз.
Со стороны нервной системы: часто — периферическая нейропатия, головная боль, головокружение; нечасто — полиневропатия; редко — синдром Гийена-Барре, демиелинизация, миастенический синдром, аутоиммунная невропатия (включая парез лицевого и отводящего нервов).
Со стороны органа зрения: часто — нечеткость зрения, сухость глаз; нечасто — увеит.
Со стороны сердечно-сосудистой системы: часто — повышение АД; нечасто — тахикардия, васкулит; редко — аритмия (включая желудочковую аритмию), мерцательная аритмия.
Со стороны дыхательной системы: часто — пневмонит, одышка, кашель; нечасто — плеврит; редко — инфильтрация легких.
Со стороны пищеварительной системы: очень часто — диарея, тошнота; часто — колит, стоматит, рвота, боль в животе, запор, сухость во рту; нечасто — панкреатит; редко — гастрит, язва двенадцатиперстной кишки.
Со стороны печени и желчевыводящих путей: нечасто — гепатит, гипербилирубинемия; редко — холестаз.
Со стороны кожи и подкожных тканей: очень часто — сыпь (в т.ч. пятнисто-папулезная сыпь, эритемная сыпь, зудящая сыпь, везикулезная сыпь, макулезная сыпь, кореподобная сыпь, папулезная сыпь, пустулезная сыпь, папулосквамозная сыпь, везикулезная сыпь, генерализованная сыпь, дерматит, акнеиформный дерматит, аллергический дерматит, атопический дерматит, буллезный дерматит, эксфолиативный дерматит, псориазиформный дерматит, медикаментозная сыпь), зуд; часто — витилиго, сухость кожи, эритема, алопеция; нечасто — многоформная эритема, псориаз, розацеа, крапивница; редко — токсический эпидермальный некролиз.
Со стороны костно-мышечной системы: часто — костно-мышечная боль (в т.ч. боль в спине, боль в костях, мышечно-скелетная боль в груди, костно-мышечный дискомфорт, миалгия, боль в шее, боль в конечностях, спинальная боль), артралгия; нечасто — ревматическая полимиалгия.
Со стороны мочевыводящей системы: нечасто — тубулоинтерстициальный нефрит, почечная недостаточность.
Общие реакции: очень часто — утомляемость; часто — повышение температуры тела, отеки (включая периферические отеки); нечасто — боль в груди.
Со стороны лабораторных показателей: очень часто — снижение массы тела; часто — повышение активности трансаминаз, повышение активности липазы, повышение активности амилазы, повышение активности ЩФ, повышение креатинина, лимфопения, лейкопения, тромбоцитопения, анемия, гипонатриемия; нечасто — повышение концентрации общего билирубина, гиперкальциемия, гипокальциемия, гиперкалиемия, гипокалиемия, гипомагниемия, нейтропения, снижение абсолютного числа нейтрофилов, гипернатриемия; редко — гипермагнезиемия.

Иммунотерапия препаратом Ниволумаб
Обновлено: 28 апреля 2022
31978
Как действует ниволумаб при раке? О клиническом применении препарата Опдиво, его преимуществах и побочных эффектах рассказывает онколог-химиотерапевт высшей категории Круглова Марина Сергеевна
- arrow_forward
Как действует Ниволумаб? - arrow_forward
Преимущества терапии ниволумабом - arrow_forward
Побочные эффекты ниволумаба
Ниволумаб — противоопухолевый препарат из группы ингибиторов контрольных точек и фактический стимулятор иммунитета. Опдиво — это торговое название, присвоенное компанией-производителем моноклональному человеческому антителу ниволумаб. Антитело представляет собой чистейший и абсолютно однородный по свойствам белок.
Как действует Ниволумаб?
Принцип действия Ниволумаба на опухоль диаметрально отличается от всех прочих иммунологических противоопухолевых препаратов. Доставшиеся нам из прошлого века и до настоящего времени используемые в онкологии цитокины — интерферон-альфа и интерлейкин-2 — синтезированные человеком продукты жизнедеятельности лимфоцитов, доставляемые в организм уже в готовом виде.
Ниволумаб также радикально отличается от механизма действия цитостатиков, суть которых уничтожить опухолевую клетку (цитотоксический эффект) или остановить ее пролиферативную активность (цитостатический эффект).
В конечном итоге Опдиво вынуждает лимфоциты вырабатывать цитокины, но не прямым способом, а помогая лимфоциту выйти из оцепенения, в которое его ввергает злокачественный процесс.
Ниволумаб блокирует взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (PD-L1 и PD-L2).
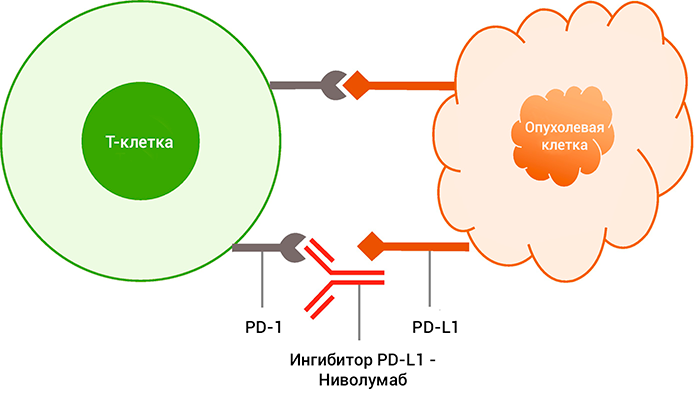
PD-1-рецептор является негативным регулятором активности Т-клеток. Связывание PD-1 с лигандами PD-L1 и PD-L2, которые способны экспрессироваться клетками опухолей или иными клетками микроокружения опухолей, приводит к ингибированию пролиферации Т-клеток и секреции цитокинов. Ниволумаб потенцирует иммунный ответ посредством блокады связывания PD-1 с лигандами PD-L1 и PD-L2.
Выражаясь простыми словами, взаимодействие ниволумаба с лимфоцитом осуществляет через специальный рецептор на поверхностной мембране. Занятый им рецептор не может связаться с продуцируемыми опухолевыми клетками и их окружением — лигандами.
Лиганды специально синтезируются для обмана лимфоцита, чтобы он не замечал развитие злокачественного процесса. Связывание лигандов со специальным рецептором PD-1 на поверхности лимфоцита приводит к нарушению его работы и воспроизводства. В результате получается, что опухолевые клетки не замечаются «больным» лимфоцитом и могут спокойно воспроизводить себе подобных.
С помощью ниволумаба лимфоцит «прозревает» и вырабатывает смертельные для раковой клетки цитокины. Если интерферон и интерлейкин вводятся в огромных дозах, то активированный опдиво лимфоцит вырабатывает их без превышения своих функциональных возможностей.
О существовании рецептора можно узнать по присутствию специфического белка PD-1, который имеется у 10–15% больных.
Применение Ниволумаба
Ниволумаб при раке доказал свою эффективность в многочисленных клинических исследованиях по всему миру и сегодня зарегистрирован в России для лечения девяти нозологий:
- 1-я линия терапии почечно-клеточного рака;
- 2-я линия терапии почечно-клеточного рака;
- Метастатическая меланома;
- Адъювантная терапия меланомы;
- Опухоли головы и шеи;
- Мелкоклеточный рак легкого;
- Немелкоклеточный рак легкого;
- Рак желудка или пищеводно-желудочного перехода;
- Рак мочевого пузыря;
- Гепатоцеллюлярный рак;
- Колоректальный рак;
- Лимфома Ходжкина.
Преимущества терапии ниволумабом
Преимущество иммунотерапии состоит в том, что при показаниях, ее можно использовать у ослабленных, возрастных пациентов, с выраженной сопутствующей патологией ввиду меньшей токсичности и более легкой переносимостью.
То есть иммунотерапия дает новые возможности пациентам, которым химиотерапия противопоказана по состоянию здоровья.
Еще одним достоинством иммунотерапии является длительность ответа на лечение. Если по результатам контрольных обследований на иммунотерапии возникает регресс опухоли, то зачастую этот ответ может быть очень длительным.
Как проводится лечение Ниволумабом?
Препарат вводится в виде внутривенной инфузии в течение 30 или 60 минут согласно инструкции. Терапия ниволумабом должна продолжаться до прогрессирования или развития непереносимой токсичности.
 В адъювантном (послеоперационном) режиме при терапии пациентов с меланомой лечение ниволумабом проводится до развития рецидива заболевания или непереносимой токсичности, максимально — до 1 года.
В адъювантном (послеоперационном) режиме при терапии пациентов с меланомой лечение ниволумабом проводится до развития рецидива заболевания или непереносимой токсичности, максимально — до 1 года.
Возможность назначать препарат одним из трех одобренных способов введения позволяет врачу подобрать оптимальный режим для каждого конкретного пациента:
- 3 мг/кг каждые 2 недели в течение 60 или 30 минут;
- 240 мг каждые 2 недели в течение 60 или 30 минут;
- 480 мг каждые 4 недели в течение 60 или 30 минут.
Отличие иммунотерапии от химиотерапии заключается в отсутствии специальной пре- и постмедикации. Пациент не нуждается в антиэметогенной терапии, глюкокортикостероидах, антигистаминных, гастропротективных препаратах. Не требуется принимать их для профилактики и между курсами иммунотерапии.
Побочные эффекты ниволумаба
Вторая сторона медали современной иммунотерапии – это побочные эффекты, осложнения, а также иммуноопосредованные нежелательные явления.
Токсичность на фоне иммунотерапии имеет другой профиль, нежели стандартная химиотерапия. Побочные действия ниволумаба связаны с аутоиммунными реакциями на фоне «гиперактивного» иммунитета. Они обусловлены избыточной активацией иммунной системы с аутоиммунным поражением нормальных тканей различных органов и систем.
Осложнения на терапии ниволумабом могут появиться уже в течение 1 недели или только через 54 недели от начала терапии, симптомы могут усиливаться в любой момент времени и приводить к фатальным последствиям.
Наиболее частыми побочными эффектами ниволумаба по результатам клинических исследований являются утомляемость (34%), сыпь (19%), зуд (14%), диарея (13%), тошнота (13%) и снижение аппетита (10%), а также – повышение температуры или озноб с лихорадочным состоянием. В большинстве случаев побочные реакции выражаются от легкой до средней степени тяжести.
Все побочные реакции, включая тяжелые, купируются или при помощи симптоматической терапии, или путем отмены иммунотерапии.
Что делать, если на лечении ниволумабом развились нежелательные явления?
Для того, чтобы устранить побочные эффекты иммунотерапии, необходимо не только знать весь анамнез и сопутствующие заболевания конкретного пациента, но и понимать природу и механизм иммуноопосредованной токсичности.
Крайне важно, чтобы лечение ниволумабом осуществлял онколог, который не только имеет опыт проведения иммунотерапии, но и умеет распознавать ее нежелательные явления на ранней стадии. Своевременное выявление осложнений позволит не только их купировать, но и не прерывать противоопухолевое лечение.
Например, когда мы проводим иммунотерапию в клинике, мы осуществляем тщательный мониторинг показателей систем организма, строго по графикам. Также мы информируем и обучаем пациентов, как оперативно выявить и вовремя среагировать на нежелательные явления, так как своевременная диагностика и надлежащая медикаментозная терапия может улучшить результаты и при этом не окажет негативного влияния на активность иммунного препарата.
Мы накопили большой клинический опыт применения ниволумаба и разработали собственные восстановительные программы и этапы действий для успешного устранения побочных эффектов иммунотерапии. Наш подход – сделать лечение не только эффективным, но и максимально комфортным для вас.
Запишитесь на прием к онкологу по телефону +7 (812) 952-83-73, и мы примем вас в день обращения.
Отзывы
Леонова О.П.
21 августа 2020
Хочу выразить благодарность сотрудникам клиники De Vita и особенно врачу-химиотерапевту Кругловой Марине Сергеевне за квалифицированную помощь, человечное отношение, высокий профессионализм. В тяжелые моменты онкологического лечения необходимы грамотные и своевременные консультации, психологическая помощь и поддержка. Все это было сделано в вашей клинике.
Спасибо вам за ваш опыт, профессионализм, грамотность и человеческое отношение. С уважением,
…
Читать полностью
семья Ивановых
20 августа 2020
Благодаря грамотному лечению, профессионализму и внимательному отношению врача с большой буквы Ирины Александровны, я вернулась к жизни! Спасибо Вам большое, что в самое сложное время для нашей семьи Вы были с нами! Отдельное спасибо хирургу Сергею Александровичу и всему медицинскому персоналу! С уважением, семья Ивановых. Желаем здоровья, долголетия и многомонетия!
…
Читать полностью
Замулина И.В.
7 августа 2020
Благодарю за чуткость, профессионализм, доброе отношение в клинике Де Вита. Очень серьезное лечение прошла легко и без побочных эффектов. Отдельное спасибо за профессионализм Анне Игоревне Буйняковой! С благодарностью,
…
Читать полностью
Вот и закончился мой 12-недельный курс химиотерапии в клинике De Vita.
Все это время сотрудники клиники помогали мне пройти лечение без осложнений и максимально комфортно .
Хочу поблагодарить:
— руководство за безупречную организацию работы и замечательно подобранных сотрудников;
— моего лечащего врача Круглову Марину Сергеевну за профессионализм, внимание и доброе отношение благодаря которому я поверила в лечение и смогла его выдержать;
— замечательных медсестер за золотые руки и сердечность, особенно Анастасию;
— улыбчивых и внимательных менеджеров, которые встречали и провожали меня каждый раз.
Желаю всем работникам крепкого здоровья, хорошего настроения и терпения в нелегком труде.
…
Читать полностью
Елена Викторовна
17 июля 2020
Хочу сказать большое спасибо всем сотрудникам клиники De VIta, это замечательные, внимательные, знающие свое дело люди. Отдельное спасибо моему лечащему врачу Буйняковой А.И. за ее помощь, поддержку и внимание. Доктора знаю уже больше 10 лет и очень ей благодарна за маму, которую она подняла на ноги. Судьба меня свела опять с Анной Игоревной, я очень рада, что эта замечательная женщина, мой лечащий врач. Она не просто профессионал своего дела, а красивая, чуткая женщина. И я от всего сердца хочу поблагодарить ее за все усилия и помощь в лечении. Так же огромное спасибо девочкам мед.сестрам и администраторам за четкую, слаженную работу. Всем сотрудникам клиники желаю успехов, процветания и конечно здоровья.
…
Читать полностью
Григорьева Л.Е.
26 июня 2020
Сегодня 26 июня 2020 года — моя последняя капельница!!! Позади долгий непростой путь длиной в 6 месяцев. И все это время я чувствовала огромную поддержку и внимание своего доктора Буйняковой Анны Игоревны.
Уважаемая, дорогая Анна Игоревна! Огромное Вам спасибо и низкий поклон за Вашу отзывчивость, Ваш профессионализм, чуткость, внимательность, ответственность, за позитивный настрой! Хочется поблагодарить медсестру Людмилу за ее «волшебные руки», внимательность, ответственное отношение к больным. Спасибо девушкам администраторам Яне и Марии, Вале за доброжелательность и внимание, четкую слаженную работу, а также психологу А.А. Ястребовой за моральную поддержку. Желаю всем сотрудникам ДеВита успехов, процветания, здоровья!
…
Читать полностью
семья Чаусовых
21 июня 2020
Наша семья выражает благодарность Уваровой Светлане Николаевне, Кругловой Марине Сергеевне и всему персоналу онкологического центра за отзывчивость, доброжелательность, высокий профессионализм. Поздравляем Вас с Днем Медицинского работника! Пусть всё сделанное Вами добро возвращается к Вам многократно в виде здоровья и долголетия!!
…
Читать полностью
Спасибо всей команде De Vita за работу и отношение. Особенно благодарю Андрея Сергеевича за профессионализм и поддержку! Спокойствие и уверенность врача передаётся пациенту, мне это очень помогло. В такой трудной ситуации сходишь с ума, здесь я получила помощь! А также все ответы на свои вопросы, заботу, хорошее лечение и только позитивный заряд. Спасибо!
…
Читать полностью
Поздравляю клинику с днём рождения и хочу сердечно поблагодарить химиотерапевта Анну Игоревну Буйнякову за высокий профессионализм, за помощь и поддержку в непростой «химический» период. Ни один вопрос не остался без ответа, Анна Игоревна практически провела меня за руку через всю химию. Спасибо Вам огромное за это!
Также благодарю и хочу отметить медсестру Людмилу, ее отличную работу и душевность. Очень хорошее и приятное впечатление от всех, с кем пришлось разговаривать и встречаться в клинике. Хорошие и комфортные условия для лечения такого коварного заболевания. Вы даёте уверенность в победе! Низкий поклон вам!
Татьяна, Великий Новгород.
…
Читать полностью
Юдина Наталия Андреевна
15 мая 2020
Всех сотрудников De Vita хочу поблагодарить за внимательное и чуткое отношение к запросам и потребностям клиентов. Отдельная огромная-преогромная благодарность лечащему врачу Буйняковой Анне Игоревне за профессионализм, отзывчивость, внимательность, за веру в возможности пациента, за готовность прийти на помощь а любое время суток. Здоровья Вам, успехов, всех благ.! Спасибо Вам большое.
С уважением,
…
Читать полностью

Fab fragment of nivolumab (blue) binding the extracellular domain of PD-1 (purple). From PDB entry 5ggr. |
|
| Monoclonal antibody | |
|---|---|
| Type | Whole antibody |
| Source | Human |
| Target | PD-1 |
| Clinical data | |
| Trade names | Opdivo |
| Other names | ONO-4538, BMS-936558, MDX1106 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a614056 |
| License data |
|
| Pregnancy category |
|
| Routes of administration |
Intravenous (IV) |
| Drug class | Immunotherapy[2] |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Identifiers | |
| CAS Number |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEMBL |
|
| Chemical and physical data | |
| Formula | C6362H9862N1712O1995S42 |
| Molar mass | 143599.39 g·mol−1 |
Nivolumab, sold under the brand name Opdivo, is a medication used to treat a number of types of cancer.[7] This includes melanoma, lung cancer, malignant pleural mesothelioma, renal cell carcinoma, Hodgkin lymphoma, head and neck cancer, urothelial carcinoma, colon cancer, esophageal squamous cell carcinoma, liver cancer, gastric cancer, and esophageal or gastroesophageal junction (GEJ) cancer.[5][6][7][8][9] It is used by slow injection into a vein.[5][6][7]
The most common side effects include fatigue, rash, musculoskeletal pain, pruritus (itching), diarrhea, nausea, asthenia (weakness), cough, dyspnea (shortness of breath), constipation, decreased appetite, back pain, arthralgia (joint pain), upper respiratory tract infection, pyrexia (fever), headache, abdominal pain, and vomiting.[9] Use during pregnancy may harm the baby.[1][7] Nivolumab is a human IgG4 monoclonal antibody that blocks PD-1.[7] It is a type of immunotherapy and works as a checkpoint inhibitor, blocking a signal that prevents activation of T cells from attacking the cancer.[7][2] The most common side effects when used in combination with chemotherapy include peripheral neuropathy (damage to the nerves outside of the brain and spinal cord), nausea, fatigue, diarrhea, vomiting, decreased appetite, abdominal pain, constipation and musculoskeletal pain.[8]
Nivolumab was approved for medical use in the United States in 2014.[7][5] It is on the World Health Organization’s List of Essential Medicines.[10] It is made using Chinese hamster ovary cells.[11] Nivolumab is the second FDA-approved systemic therapy for mesothelioma[12] and is the first FDA-approved immunotherapy for the first-line treatment of gastric cancer.[8]
Medical uses[edit]
In the U.S., nivolumab is indicated to treat:
- Unresectable or Metastatic Melanoma[5]
- Adjuvant Treatment of Melanoma[5]
- Metastatic Non-Small Cell Lung Cancer[5]
- Malignant Pleural Mesothelioma[5]
- Advanced Renal Cell Carcinoma[5]
- Classical Hodgkin Lymphoma[5]
- Squamous Cell Carcinoma of the Head and Neck[5]
- Urothelial Carcinoma[5]
- Microsatellite Instability-High or Mismatch Repair Deficient Metastatic Colorectal Cancer[5]
- Hepatocellular Carcinoma[5]
- Esophageal Cancer[5]
- Gastric Cancer, Gastroesophageal Junction Cancer, and Esophageal Adenocarcinoma[5]
Nivolumab is used as a first-line treatment for inoperable or metastatic melanoma in combination with ipilimumab if the cancer does not have a mutation in BRAF,[5] and as a second-line treatment for inoperable or metastatic melanoma following treatment of ipilimumab and, if the cancer has a BRAF mutation, a BRAF inhibitor.[5][13] It is also used to treat metastatic squamous non-small cell lung cancer with progression with or after platinum-based drugs and for treatment of small cell lung cancer[5][14] It also used as a second-line treatment for renal cell carcinoma after anti-angiogenic treatment has failed.[5]
Nivolumab is used for primary or metastatic urothelial carcinoma, the most common form of bladder cancer. It can be prescribed for locally advanced or metastatic form of the condition that experience disease progression during or following platinum-containing chemotherapy or have progression within 12 months of neoadjuvant or adjuvant treatment with platinum-containing chemotherapy.[15]
Nivolumab is indicated for the adjuvant treatment of people with melanoma with involvement of lymph nodes or in people with metastatic disease who have undergone complete resection.[5][16]
The combination of nivolumab with ipilimumab is used for the first-line treatment of adults with malignant pleural mesothelioma (MPM) that cannot be removed by surgery.[5][12]
In April 2021, the U.S. Food and Drug Administration (FDA) approved nivolumab, in combination with certain types of chemotherapy, for the initial treatment of people with advanced or metastatic gastric cancer, gastroesophageal junction cancer and esophageal adenocarcinoma.[8]
In May 2021, the U.S. FDA approved nivolumab for people with completely resected esophageal or gastroesophageal junction (GEJ) cancer with residual pathologic disease who have received neoadjuvant chemoradiotherapy.[9]
In August 2021, the U.S. FDA approved nivolumab for the adjuvant treatment of people with urothelial carcinoma (UC) who are at high risk of recurrence after undergoing radical resection.[17]
In May 2022, the U.S. FDA expanded the indication to include the first-line treatment of patients with advanced or metastatic esophageal squamous cell carcinoma (ESCC).[18] In the same year, the FDA as approved the combination of relatlimab and nivolumab (Opdivo) for the treatment of some people with advanced melanoma.[19]
Side effects[edit]
The drug label contains warnings with regard to increased risks of severe immune-mediated inflammation of the lungs, the colon, the liver, the kidneys (with accompanying kidney dysfunction), as well as immune-mediated hypothyroidism and hyperthyroidism.[5] Hypothyroidism may affect 8.5% and hyperthyroidism 3.7%.[20] Autoimmune diabetes similar to diabetes mellitus type 1 may occur in approximately 2% of people treated with nivolumab.[20]
In trials for melanoma, the following side effects occurred in more than 10% of subjects and more frequently than with chemotherapy alone: rash and itchy skin, cough, upper respiratory tract infections, and peripheral edema. Other clinically important side effects with less than 10% frequency were ventricular arrhythmia, inflammation of parts of the eye (iridocyclitis), infusion-related reactions, dizziness, peripheral and sensory neuropathy, peeling skin, erythema multiforme, vitiligo, and psoriasis.[5]
In trials for lung cancer, the following side effects occurred in more than 10% of subjects and more frequently than with chemotherapy alone: fatigue, weakness, edema, fever, chest pain, generalized pain, shortness of breath, cough, muscle and joint pain, decreased appetite, abdominal pain, nausea and vomiting, constipation, weight loss, rash, and itchy skin.[5]
Levels of electrolytes and blood cells counts were also disrupted.[5]
Pregnancy and breastfeeding[edit]
Use during pregnancy may harm the baby.[1][5][7]
Pharmacokinetics[edit]
Based on data from 909 patients, the terminal half-life of nivolumab is 26.7 days and steady-state concentrations were reached by 12 weeks when administered at 3 mg/kg every 2 weeks.[5]: 29 Age, gender, race, baseline LDH, PD-L1 expression, tumor type, tumor size, renal impairment, and mild hepatic impairment do not affect clearance of the drug.[5]: 30
Mechanism of action[edit]
T cells protect the body from cancer by killing certain cancer cells. But cancer cells evolve proteins to protect themselves from T cells. Nivolumab blocks those protective proteins. Thus, the T cells can kill the cancer cells.[21][22] This is an example of immune checkpoint blockade.[21][22]
PD-1 is a protein on the surface of activated T cells. If another molecule, called programmed cell death 1 ligand 1 or programmed cell death 1 ligand 2 (PD-L1 or PD-L2), binds to PD-1, the T cell becomes inactive. This is one way that the body regulates the immune system, to avoid an overreaction.[22] Many cancer cells make PD-L1, which inhibits T cells from attacking the tumor. Nivolumab blocks PD-L1 from binding to PD-1, allowing the T cell to work.[21][22] PD-L1 is expressed on 40–50% of melanomas and has limited expression otherwise in most visceral organs with the exception of respiratory epithelium and placental tissue.[13]
Physical properties[edit]
Nivolumab is a fully human monoclonal immunoglobulin G4 antibody to PD-1.[13] The gamma 1 heavy chain is 91.8% unmodified human design while the kappa light chain is 98.9%.[23]
History[edit]
Nivolumab was generated under intellectual property of Ono Pharmaceutical regarding PD-1 and under a research collaboration entered in 2005 between Ono and Medarex.[citation needed]
Through the research collaboration with Ono, it was invented at Medarex using its transgenic mice with a humanized immune system; the discovery and in vitro characterization of the antibody, originally called MDX-1106/ONO-4538, was published (much later) in 2014.[24] Under the agreement between the companies in 2005, Medarex held an exclusive right of nivolumab in North America, and Ono retained the right in all other countries except North America.
Bristol-Myers Squibb acquired Medarex in 2009, for $2.4B, largely on the strength of its checkpoint inhibitor program.[25][26]
Promising clinical trial results made public in 2012, caused excitement among industry analysts and in the mainstream media; PD-1 was being avidly pursued as a biological target at that time, with companies including Merck with pembrolizumab (Keytruda), Roche (via its subsidiary Genentech) with atezolizumab, GlaxoSmithKline in collaboration with the Maryland biotech company Amplimmune; and Teva in collaboration with the Israeli biotech company CureTech competing.[27][28]
Ono received approval from Japanese regulatory authorities to use nivolumab to treat unresectable melanoma in July 2014, which was the first regulatory approval of a PD-1 inhibitor anywhere in the world.[29]
Merck received its first FDA approval for its PD-1 inhibitor, pembrolizumab (Keytruda), in September 2014.[30]
Nivolumab received FDA approval for the treatment of melanoma in December 2014.[13][31] In April 2015, the Committee for Medicinal Products for Human Use of the European Medicines Agency recommended approval of Nivolumab for metastatic melanoma as a monotherapy.[32]
In March 2015, the U.S. FDA approved it for the treatment of squamous cell lung cancer.[33]
On 19 June 2015, the European Medicines Agency (EMA) granted a marketing authorization valid throughout the European Union.[6]
In November 2015, the FDA approved nivolumab as a second-line treatment for renal cell carcinoma after having granted the application breakthrough therapy designation, fast track designation, and priority review status.[34]
In May 2016, the FDA approved nivolumab for the treatment of patients with classical Hodgkin lymphoma (cHL) who have relapsed or progressed after autologous hematopoietic stem cell transplantation (auto-HSCT) and post-transplantation brentuximab vedotin.[35]
On 20 December 2017, the FDA granted approval to nivolumab for adjuvant treatment of melanoma with involvement of lymph nodes or for metastatic disease with complete resection.[36]
On 16 April 2018, the FDA granted approval to nivolumab in combination with ipilimumab for the first-line treatment of intermediate and poor risk advanced renal cell carcinoma patients.[37]
On 15 June 2018, China’s Drug Administration approved nivolumab, the country’s first immuno-oncology and the first PD-1 therapy.[38]
In October 2020, the U.S. Food and Drug Administration (FDA) approved the combination of nivolumab with ipilimumab for the first-line treatment of adults with malignant pleural mesothelioma (MPM) that cannot be removed by surgery.[12]
In April 2021, the FDA approved nivolumab, in combination with certain types of chemotherapy, for the initial treatment of people with advanced or metastatic gastric cancer, gastroesophageal junction cancer and esophageal adenocarcinoma.[8]
Research[edit]
Nivolumab, and other PD-1 inhibitors, appear to be effective in people with brain metastases[39] and for cancer in people with autoimmune diseases.[40]
Hodgkin’s lymphoma[edit]
In Hodgkin’s lymphoma, Reed–Sternberg cells harbor amplification of chromosome 9p24.1, which encodes PD-L1 and PD-L2 and leads to their constitutive expression. In a small clinical study published in 2015, nivolumab elicited an objective response rate of 87% in a cohort of 20 patients.[27]
The evidence is very uncertain about the effect of Nivolumab for patients with a Hodgkin’s lymphoma on the overall survival, the quality of life, the survival without a progression, the response rate (=complete disappear) and grade 3 or 4 serious adverse events.[41]
Biomarkers[edit]
Amplification of chromosome 9p24 may serve as a predictive biomarker in Hodgkin’s lymphoma.[27]
Each company pursuing mAbs against PD-1 as drugs developed assays to measure PD-L1 levels as a potential biomarker using their drugs as the analyte-specific reagent in the assay. BMS partnered with Dako on a nivolumab-based assay. However, as of 2015 the complexity of the immune response had hindered efforts to identify people who would be likely to respond well to PD-1 inhibitors;[27] in particular PD-L1 levels appear to be dynamic and modulated by several factors, and efforts to correlate PD-L1 levels before or during treatment with treatment response or duration of response had failed to reveal any useful correlations as of 2015.[13]
Lung cancer[edit]
In 2016, BMS announced the results of a clinical trial in which nivolumab failed to achieve its endpoint and was no better than traditional chemotherapy at treating newly diagnosed lung cancer.[42] BMS went on to attempt to win approval for a combination therapy against lung cancer which included nivolumab and BMS’s older drug ipilimumab. The application was withdrawn in early 2019 following disappointing clinical trial data.[43]
Infusion times of 60 minutes and 30 minutes appear to have similar pharmacokinetics (absorption, distribution, metabolism, and elimination) of the treatment.[44]
Nivolumab is indicated for the treatment of people with metastatic squamous non small cell lung cancer (NSCLC) with progression on or after platinum-based chemotherapy.[5] CHECKMATE-227 [45] tested the combination of nivolumab and ipilimumab in patients with stage IV or recurrent NSCLC without previous treatment.[46] Patients with a PD-L1 expression level of 1% or more were randomized in a 1:1:1 ratio to receive nivolumab plus ipilimumab, nivolumab alone, or chemotherapy.[46][45] The chemotherapy used was cisplatin or carboplatin, combined with Gemcitabine for patient with squamous cell NSCLC, or pemetrexed for patients with nonsquamous disease.[45][46] The overall survival was 17.1, 15.7 and 14.9 months, respectively.[46][45] The patients who had a PD-L1 expression level of less than 1% were randomly assigned in a 1:1:1 ratio to receive nivolumab plus ipilimumab, nivolumab plus chemotherapy, or chemotherapy.[46] The OS was 17.2, 15.2 and 12.2 months, respectively[45]
In June 2023, BMS has provided positive four-year follow-up results from a phase 3 study (CheckMate-9LA[47]) of a combination of nivolumab and ipilimumab together with chemotherapy, compared to chemotherapy alone, as a first-line treatment in patients with metastatic non-small cell lung cancer (NSCLC) showing overall survival at a minimum follow-up of 47.9 months found 21% of patients treated with the dual immunotherapy-based combination alive at four years compared to 16% of patients treated with chemotherapy alone.[47][48]
Melanoma[edit]
PD-L1 is expressed in 40-50% of melanomas.[49] Phase I and II clinical trials have shown nivolumab as a promising and durable treatment option in melanoma as a single agent and in combination with ipilimumab.[13] Phase III trials are ongoing.[50]
In October 2022, the results of a Phase 3 trial, CheckMate -76K, showed that Opdivo reduced the risk of death by 58% as an adjuvant therapy in patients with completely resected stage two melanoma, the most serious type of skin cancer.[50][51]
Urothelial carcinoma[edit]
In February 2023, BMS reported that the three-year follow-up results from its phase 3 (CheckMate-274) trial of nivolumab showed significant sustained clinical benefits with nivolumab for the adjuvant treatment of patients with muscle-invasive urothelial carcinoma at a high risk of recurrence after radical resection.[52][53]
See also[edit]
- Nivolumab/relatlimab
References[edit]
- ^ a b c «Nivolumab (Opdivo) Use During Pregnancy». Drugs.com. 4 November 2019. Retrieved 11 March 2020.
- ^ a b «Nivolumab (Opdivo)». Cancer Research UK. Retrieved 15 December 2019.
- ^ «Prescription medicines: registration of new chemical entities in Australia, 2016». Therapeutic Goods Administration (TGA). 21 June 2022. Retrieved 10 April 2023.
- ^ «Opdivo 10 mg/mL concentrate for solution for infusion — Summary of Product Characteristics (SmPC)». (emc). 24 August 2020. Retrieved 2 October 2020.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad «Opdivo- nivolumab injection». DailyMed. 17 December 2019. Retrieved 11 March 2020.
- ^ a b c d «Opdivo EPAR». European Medicines Agency (EMA). 30 January 2020. Retrieved 11 March 2020.
- ^ a b c d e f g h «Nivolumab Monograph for Professionals». Drugs.com. Retrieved 14 November 2019.
- ^ a b c d e «FDA Approves First Immunotherapy for Initial Treatment of Gastric Cancer». U.S. Food and Drug Administration (FDA) (Press release). 16 April 2021. Retrieved 16 April 2021.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ a b c «FDA approves nivolumab for resected esophageal or GEJ cancer». U.S. Food and Drug Administration. 20 May 2021. Retrieved 20 May 2021.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Rajan A, Kim C, Heery CR, Guha U, Gulley JL (September 2016). «Nivolumab, anti-programmed death-1 (PD-1) monoclonal antibody immunotherapy: Role in advanced cancers». Human Vaccines & Immunotherapeutics. 12 (9): 2219–31. doi:10.1080/21645515.2016.1175694. PMC 5027703. PMID 27135835.
- ^ a b c «FDA Approves Drug Combination for Treating Mesothelioma». U.S. Food and Drug Administration (FDA) (Press release). 2 October 2020. Retrieved 2 October 2020.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ a b c d e f Johnson DB, Peng C, Sosman JA (March 2015). «Nivolumab in melanoma: latest evidence and clinical potential». Therapeutic Advances in Medical Oncology. 7 (2): 97–106. doi:10.1177/1758834014567469. PMC 4346215. PMID 25755682.
- ^ Sundar R, Cho BC, Brahmer JR, Soo RA (March 2015). «Nivolumab in NSCLC: latest evidence and clinical potential». Therapeutic Advances in Medical Oncology. 7 (2): 85–96. doi:10.1177/1758834014567470. PMC 4346216. PMID 25755681.
- ^ Bushey R (3 February 2017). «Opdivo Gains FDA Approval for Common Bladder Cancer». Drug Discovery & Development. Archived from the original on 4 February 2017.
- ^ «FDA grants regular approval to nivolumab for adjuvant treatment of melanoma». U.S. Food and Drug Administration (FDA). 20 December 2017. Retrieved 2 October 2020.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ «FDA approves nivolumab for adjuvant treatment of urothelial carcinoma». U.S. Food and Drug Administration (FDA). 20 August 2021. Retrieved 20 August 2021.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ «FDA approves Opdivo». U.S. Food and Drug Administration (FDA). 31 May 2022. Retrieved 31 May 2022.
- ^ «FDA approves nivolumab for adjuvant treatment of urothelial carcinoma». U.S. Food and Drug Administration (FDA). 6 April 2023. Retrieved 6 April 2023.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ a b de Filette J, Andreescu CE, Cools F, Bravenboer B, Velkeniers B (March 2019). «A Systematic Review and Meta-Analysis of Endocrine-Related Adverse Events Associated with Immune Checkpoint Inhibitors». Hormone and Metabolic Research. 51 (3): 145–156. doi:10.1055/a-0843-3366. PMID 30861560.
- ^ a b c Pardoll DM (March 2012). «The blockade of immune checkpoints in cancer immunotherapy». Nature Reviews. Cancer. 12 (4): 252–64. doi:10.1038/nrc3239. PMC 4856023. PMID 22437870.
- ^ a b c d Syn NL, Teng MW, Mok TS, Soo RA (December 2017). «De-novo and acquired resistance to immune checkpoint targeting». The Lancet. Oncology. 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ WHO Drug Information, Vol. 26, No. 2, 2012. Proposed INN List 107
- ^ Wang C, Thudium KB, Han M, Wang XT, Huang H, Feingersh D, et al. (September 2014). «In vitro characterization of the anti-PD-1 antibody nivolumab, BMS-936558, and in vivo toxicology in non-human primates». Cancer Immunology Research. 2 (9): 846–56. doi:10.1158/2326-6066.CIR-14-0040. PMID 24872026.
- ^ Allison M (September 2009). «Bristol-Myers Squibb swallows last of antibody pioneers». Nature Biotechnology. 27 (9): 781–3. doi:10.1038/nbt0909-781. PMID 19741612. S2CID 205270797.
- ^ John Carroll for FierceBiotech 23 Jul 2009 Bristol-Myers to buy Medarex for $2.1B
- ^ a b c d Sharma P, Allison JP (April 2015). «The future of immune checkpoint therapy». Science. 348 (6230): 56–61. Bibcode:2015Sci…348…56S. doi:10.1126/science.aaa8172. PMID 25838373. S2CID 4608450.
- ^ A Pollack (June 2012). «Drug helps immune system fight cancer». New York Times.
- ^ John Carroll for FierceBiotech 7 Jul 2014 Anti-PD-1 cancer star nivolumab wins world’s first regulatory approval
- ^ «FDA approves Keytruda for advanced melanoma» (Press release). U.S. Food and Drug Administration (FDA). 4 September 2014. Archived from the original on 25 December 2015. Retrieved 24 December 2015.
- ^ «FDA approves Opdivo for advanced melanoma» (Press release). U.S. Food and Drug Administration (FDA). 22 December 2014. Archived from the original on 13 February 2017. Retrieved 16 December 2019.
- ^ «New treatment for advanced melanoma». European Medicines Agency (EMA) (Press release). 24 April 2015. Retrieved 11 March 2020.
- ^ «FDA expands approved use of Opdivo to treat lung cancer» (Press release). U.S. Food and Drug Administration (FDA). Archived from the original on 5 March 2015. Retrieved 4 March 2015.
- ^ «FDA approves Opdivo to treat advanced form of kidney cancer». U.S. Food and Drug Administration (FDA) (Press release). 23 November 2015. Archived from the original on 25 January 2018. Retrieved 2 October 2020.
- ^ «Nivolumab (Opdivo) for Hodgkin Lymphoma». U.S. Food and Drug Administration (FDA). 17 May 2016.
- ^ «FDA grants regular approval to nivolumab for adjuvant treatment of melanoma». U.S. Food and Drug Administration (FDA). 21 December 2017. Retrieved 12 April 2018.
- ^ «FDA approves nivolumab plus ipilimumab combination for intermediate or poor-risk advanced renal cell carcinoma». U.S. Food and Drug Administration (FDA). Retrieved 20 April 2018.
- ^ «Bristol-Myers’ Opdivo ushers in a new era as the first I-O therapy approved in China | FiercePharma». www.fiercepharma.com. 15 June 2018. Retrieved 19 June 2018.
- ^ Caponnetto S, Draghi A, Borch TH, Nuti M, Cortesi E, Svane IM, Donia M (May 2018). «Cancer immunotherapy in patients with brain metastases». Cancer Immunology, Immunotherapy. 67 (5): 703–711. doi:10.1007/s00262-018-2146-8. hdl:11573/1298742. PMID 29520474. S2CID 3782427.
- ^ Donia M, Pedersen M, Svane IM (April 2017). «Cancer immunotherapy in patients with preexisting autoimmune disorders». Seminars in Immunopathology. 39 (3): 333–337. doi:10.1007/s00281-016-0595-8. PMID 27730287. S2CID 3387103.
- ^ Goldkuhle M, Dimaki M, Gartlehner G, Monsef I, Dahm P, Glossmann JP, et al. (Cochrane Haematological Malignancies Group) (July 2018). «Nivolumab for adults with Hodgkin’s lymphoma (a rapid review using the software RobotReviewer)». The Cochrane Database of Systematic Reviews. 2018 (7): CD012556. doi:10.1002/14651858.CD012556.pub2. PMC 6513229. PMID 30001476.
- ^ Loftus P, Rockoff JD, Steele A (5 August 2016). «Bristol Myers: Opdivo Failed to Meet Endpoint in Key Lung-Cancer Study». Wall Street Journal. ISSN 0099-9660. Retrieved 21 August 2016.
- ^ Erman M (24 January 2019). «Bristol-Myers has Opdivo lung cancer setback as sales beat estimates». Reuters. Retrieved 24 January 2019.
- ^ Waterhouse D, Horn L, Reynolds C, Spigel D, Chandler J, Mekhail T, Mohamed M, Creelan B, Blankstein KB, Nikolinakos P, McCleod MJ, Li A, Oukessou A, Agrawal S, Aanur N (April 2018). «Safety profile of nivolumab administered as 30-min infusion: analysis of data from CheckMate 153». Cancer Chemotherapy and Pharmacology. 81 (4): 679–686. doi:10.1007/s00280-018-3527-6. PMID 29442139. S2CID 3906670.
- ^ a b c d e Hellmann MD, Paz-Ares L, Bernabe Caro R, Zurawski B, Kim SW, Carcereny Costa E, et al. (November 2019). «Nivolumab plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer». The New England Journal of Medicine. 381 (21): 2020–2031. doi:10.1056/NEJMoa1910231. PMID 31562796.
- ^ a b c d e Nasser NJ, Gorenberg M, Agbarya A (November 2020). «First line Immunotherapy for Non-Small Cell Lung Cancer». Pharmaceuticals. 13 (11): 373. doi:10.3390/ph13110373. PMC 7695295. PMID 33171686.
- ^ a b Bristol-Myers Squibb (11 November 2022). «A Phase 3, Randomized Study of Nivolumab Plus Ipilimumab in Combination With Chemotherapy vs Chemotherapy Alone as First Line Therapy in Stage IV Non-Small Cell Lung Cancer».
- ^ «Four-Year Outcomes from Phase 3 CheckMate -9LA Trial Show Durable, Long-Term Survival with Opdivo (nivolumab) Plus Yervoy (ipilimumab) with Two Cycles of Chemotherapy for Patients with Metastatic Non-Small Cell Lung Cancer». news.bms.com. Retrieved 5 June 2023.
- ^ Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, et al. (August 2002). «Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion». Nature Medicine. 8 (8): 793–800. doi:10.1038/nm730. PMID 12091876. S2CID 27694471.
- ^ a b «CA209-76K». EU Clinical Trials Register. Retrieved 20 October 2022.
- ^ «Bristol Myers Squibb Announces Adjuvant Treatment with Opdivo (nivolumab) Demonstrated Statistically Significant and Clinically Meaningful Improvement in Recurrence-Free Survival (RFS) in Patients with Stage IIB/C Melanoma in the CheckMate -76K Trial». news.bms.com. Retrieved 20 October 2022.
- ^ Clinical trial number NCT02632409 for «A Phase 3 Randomized, Double-blind, Multi-center Study of Adjuvant Nivolumab Versus Placebo in Subjects With High Risk Invasive Urothelial Carcinoma (CheckMate 274: CHECKpoint Pathway and nivoluMAb Clinical Trial Evaluation 274)» at ClinicalTrials.gov
- ^ «BMS reports positive three-year results for Opdivo to treat bladder cancer». PMLive. 21 February 2023. Retrieved 22 February 2023.
External links[edit]
- «Nivolumab». Drug Information Portal. U.S. National Library of Medicine.
- «Nivolumab». NCI Drug Dictionary. National Cancer Institute.
- «Nivolumab». National Cancer Institute. 7 January 2015.
- Clinical trial number NCT01721746 for «A Study to Compare BMS-936558 to the Physician’s Choice of Either Dacarbazine or Carboplatin and Paclitaxel in Advanced Melanoma Patients That Have Progressed Following Anti-CTLA-4 Therapy (CheckMate 037)» at ClinicalTrials.gov
- Clinical trial number NCT01721772 for «Study of Nivolumab (BMS-936558) Compared With Dacarbazine in Untreated, Unresectable, or Metastatic Melanoma (CheckMate 066)» at ClinicalTrials.gov
- Clinical trial number NCT01844505 for «Phase 3 Study of Nivolumab or Nivolumab Plus Ipilimumab Versus Ipilimumab Alone in Previously Untreated Advanced Melanoma (CheckMate 067)» at ClinicalTrials.gov
- Clinical trial number NCT02388906 for «Efficacy Study of Nivolumab Compared to Ipilimumab in Prevention of Recurrence of Melanoma After Complete Resection of Stage IIIb/c or Stage IV Melanoma (CheckMate 238)» at ClinicalTrials.gov
- Clinical trial number NCT02477826 for «An Investigational Immuno-therapy Trial of Nivolumab, or Nivolumab Plus Ipilimumab, or Nivolumab Plus Platinum-doublet Chemotherapy, Compared to Platinum Doublet Chemotherapy in Patients With Stage IV Non-Small Cell Lung Cancer (NSCLC) (CheckMate 227)» at ClinicalTrials.gov
- Clinical trial number NCT03215706 for «A Study of Nivolumab and Ipilimumab Combined With Chemotherapy Compared to Chemotherapy Alone in First Line NSCLC (CheckMate 9LA)» at ClinicalTrials.gov
- Clinical trial number NCT01642004 for «Study of BMS-936558 (Nivolumab) Compared to Docetaxel in Previously Treated Advanced or Metastatic Squamous Cell Non-small Cell Lung Cancer (NSCLC) (CheckMate 017)» at ClinicalTrials.gov
- Clinical trial number NCT01673867 for «Study of BMS-936558 (Nivolumab) Compared to Docetaxel in Previously Treated Metastatic Non-squamous NSCLC (CheckMate057)» at ClinicalTrials.gov
- Clinical trial number NCT02899299 for «Study of Nivolumab Combined With Ipilimumab Versus Pemetrexed and Cisplatin or Carboplatin as First Line Therapy in Unresectable Pleural Mesothelioma Patients (CheckMate743)» at ClinicalTrials.gov
- Clinical trial number NCT02231749 for «Nivolumab Combined With Ipilimumab Versus Sunitinib in Previously Untreated Advanced or Metastatic Renal Cell Carcinoma (CheckMate 214)» at ClinicalTrials.gov
- Clinical trial number NCT03141177 for «A Study of Nivolumab Combined With Cabozantinib Compared to Sunitinib in Previously Untreated Advanced or Metastatic Renal Cell Carcinoma (CheckMate 9ER)» at ClinicalTrials.gov
- Clinical trial number NCT01668784 for «Study of Nivolumab (BMS-936558) vs. Everolimus in Pre-Treated Advanced or Metastatic Clear-cell Renal Cell Carcinoma (CheckMate 025)» at ClinicalTrials.gov
- Clinical trial number NCT02181738 for «Study of Nivolumab in Patients With Classical Hodgkin’s Lymphoma (Registrational) (CheckMate 205)» at ClinicalTrials.gov
- Clinical trial number NCT01592370 for «An Investigational Immuno-Therapy Study to Determine the Safety and Effectiveness of Nivolumab and Daratumumab in Patients With Multiple Myeloma» at ClinicalTrials.gov
- Clinical trial number NCT02105636 for «Trial of Nivolumab vs Therapy of Investigator’s Choice in Recurrent or Metastatic Head and Neck Carcinoma (CheckMate 141)» at ClinicalTrials.gov
- Clinical trial number NCT02387996 for «A Study of Nivolumab in Participants With Metastatic or Unresectable Bladder Cancer» at ClinicalTrials.gov
- Clinical trial number NCT02060188 for «An Investigational Immuno-therapy Study of Nivolumab, and Nivolumab in Combination With Other Anti-cancer Drugs, in Colon Cancer That Has Come Back or Has Spread (CheckMate142)» at ClinicalTrials.gov
- Clinical trial number NCT01658878 for «An Immuno-therapy Study to Evaluate the Effectiveness, Safety and Tolerability of Nivolumab or Nivolumab in Combination With Other Agents in Patients With Advanced Liver Cancer (CheckMate040)» at ClinicalTrials.gov
- Clinical trial number NCT02743494 for «An Investigational Immuno-therapy Study of Nivolumab or Placebo in Participants With Resected Esophageal or Gastroesophageal Junction Cancer (CheckMate 577)» at ClinicalTrials.gov
- Clinical trial number NCT02569242 for «Study of Nivolumab in Unresectable Advanced or Recurrent Esophageal Cancer» at ClinicalTrials.gov
- Clinical trial number NCT02872116 for «Efficacy Study of Nivolumab Plus Ipilimumab or Nivolumab Plus Chemotherapy Against Chemotherapy in Stomach Cancer or Stomach/Esophagus Junction Cancer (CheckMate649)» at ClinicalTrials.gov
- Clinical trial number NCT02632409 for «An Investigational Immuno-therapy Study of Nivolumab, Compared to Placebo, in Patients With Bladder or Upper Urinary Tract Cancer, Following Surgery to Remove the Cancer (CheckMate 274)» at ClinicalTrials.gov
Опдиво®
Opdivo®
Регистрационный номер
Торговое наименование
Опдиво®
Международное непатентованное наименование
Лекарственная форма
концентрат для приготовления раствора для инфузий
Состав
1 флакон с концентратом для приготовления раствора для инфузий содержит*:
активное вещество: ниволумаб 47,0 мг или 107,0 мг,
вспомогательные вещества: натрия цитрата дигидрат 27,6 мг или 62,9 мг; натрия хлорид 13,7 мг или 31,2 мг; маннитол 141,0 мг или 321,0 мг; пентетовая кислота 0,0376 мг или 0,0856 мг; полисорбат 80 0,940 мг или 2,14 мг; натрия гидроксид и кислота хлористоводородная — q.s. до pH 6.0; вода для инъекций — q.s. до 4,7 мл или до 10,7 мл,
* — Фасовка производится с учётом перезакладки в 0,7 мл, что необходимо для гарантии полного извлечения заявленной дозировки. Извлекаемое количество ниволумаба (объём раствора) в одном флаконе — 40 мг (4,0 мл) и 100 мг (10,0 мл) соответственно.
Описание
Прозрачный или опалесцирующий раствор от бесцветного до светло-жёлтого цвета.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Ниволумаб является человеческим моноклональным антителом, которое блокирует взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (PD-L1 и PD-L2). Ниволумаб представляет собой иммуноглобулин G4 (IgG4), его приблизительная молекулярная масса составляет 146 кДа.
PD-1 рецептор является негативным регулятором активности Т-клеток. Связывание PD-1 с лигандами PD-L1 и PD-L2, которые способны экспрессироваться клетками опухолей или иными клетками микроокружения опухолей, приводит к ингибированию пролиферации Т-клеток и секреции цитокинов. Ниволумаб потенцирует иммунный ответ посредством блокады связывания PD-1 с лигандами PD-L1 и PD-L2. В исследованиях на мышиных моделях блокирование активности PD-1 приводило к уменьшению роста опухоли.
Комбинация ниволумаба (анти-PD-1) и ипилимумаба (анти-CTLA-4) приводит к усилению активации Т-клеток, которая оказалась выше, чем эффект каждого из антител в отдельности, это повышает противоопухолевый ответ при метастатической меланоме и распространённом почечно-клеточном раке. На сингенных моделях опухоли у мышей двойная блокада PD-1 и CTLA-4 оказала синергическую противоопухолевую активность.
Фармакокинетика
Фармакокинетика ниволумаба линейна в диапазоне доз от 0,1 до 10 мг/кг.
Клиренс ниволумаба снижается со временем со средним максимальным снижением (до 26 % от базового значения (32,5 %)), приводящим к установлению среднего системного клиренса 7,91 мл/ч (коэффициент вариабельности — 46 %) у пациентов с метастатическими опухолями. Снижение значений клиренса не считается клинически значимым. Клиренс ниволумаба не снижается со временем у пациентов с полностью резектированной меланомой, так как средний популяционный клиренс на 24 % ниже у таких пациентов в сравнении с клиренсом в равновесном состоянии у пациентов с метастатической меланомой.
Средний объём распределения в равновесном состоянии — 6,6 л (коэффициент вариабельности — 24,4 %); средний период полувыведения (t½) составил 25 дней (коэффициент вариабельности — 55,4 %). При применении в дозе 3 мг/кг каждые 2 недели концентрация ниволумаба в равновесном состоянии достигалась к 12-ой неделе применения, коэффициент системного накопления приблизительно был равен 4.
Предполагаемое действие ниволумаба после 30-минутной инфузии сравнимо с таковым после 60-минутной инфузии.
На основании анализа доза/экспозиция клинически значимых различий в безопасности и эффективности между дозами ниволумаба 240 мг каждые 2 недели или 480 мг каждые 4 недели или 3 мг/кг каждые 2 недели не наблюдалось.
Клиренс ниволумаба не снижался с течением времени у пациентов с полностью резецированной меланомой, поскольку средний клиренс в этой популяции пациентов на 24 % ниже по сравнению с клиренсом в равновесном состоянии у пациентов с метастатической меланомой.
Клиренс ниволумаба возрастал при увеличении массы тела пациента, однако приведённая методика расчёта дозы приводила к равновесным терапевтическим концентрациям препарата в крови пациентов с различной массой тела (от 34 до 162 кг).
Метаболизм ниволумаба не описан, однако, ввиду идентичности структуры ниволумаба с человеческим моноклональным антителом IgG4, предполагаемый путь метаболизма препарата соответствует метаболизму эндогенного иммуноглобулина — распад на аминокислоты в каталитическом пути обмена белка.
Ниволумаб в комбинации с ипилимумабом: При применении ниволумаба в дозе 1 мг/кг в комбинации с ипилимумабом в дозе 3 мг/кг клиренс ниволумаба увеличивался на 29 %, в сравнении с ниволумабом, применяемым при монотерапии, клиренс ипилимумаба увеличивался на 9 %, причём данное повышение не являлось клинически значимым. При применении ниволумаба в дозе 3 мг/кг в комбинации с ипилимумабом в дозе 1 мг/кг клиренс ниволумаба увеличивался на 17 %, а клиренс ипилимумаба увеличивался на 18 %, что также не являлось клинически значимым.
При применении в комбинации, в присутствии антител к ниволумабу, клиренс ниволумаба увеличивался на 20 %, а клиренс ипилимумаба увеличивался на 5,7 % в присутствии антител к ипилимумабу. Такие изменения также не были признаны клинически значимыми.
Ниволумаб в комбинации с ипилимумабом и двумя циклами химиотерапии: При применении ниволумаба в дозе 360 мг, каждые 3 недели, в комбинации с ипилимумабом в дозе 1 мг/кг, каждые 6 недель, и химиотерапией клиренс ниволумаба уменьшался примерно на 10 %, а клиренс ипилимумаба увеличивался примерно на 22 %, что не являлось клинически значимым.
При применении в комбинации с ипилимумабом и химиотерапией, в присутствии антител к ниволумабу, клиренс ниволумаба увеличивался примерно на 29 %. Это не оказывало значимого влияния на эффективность и безопасность терапии у пациентов с АЛЛ (антителами к лекарственным препаратам)/антителами к ниволумабу.
Особые группы пациентов
Популяционный фармакокинетический анализ показал отсутствие зависимости клиренса ниволумаба от возраста пациента, пола, расы, типа опухоли, размера опухоли и наличия нарушений функции печени. Хотя в исследованиях и наблюдалась слабая зависимость клиренса от показаний ЭКГ, уровня гломерулярной фильтрации, количества сывороточного альбумина и массы тела, эта связь была признана клинически не значимой.
Пациенты с нарушением функции почек
Фармакокинетические свойства ниволумаба были изучены у пациентов с лёгкой (клиренс креатинина от 60 до 90 мл/мин/1,73 м2), средней (клиренс креатинина от 30 до 60 мл/мин/1,73 м2), тяжёлой (клиренс креатинина <30 мл/мин и ≥15 мл/мин /1,73 м2) степенью почечной недостаточности в сравнении с пациентами с нормальной функцией почек (клиренс креатинина ≥90 мл/мин/1,73 м2). Не наблюдалось клинически значимых различий в клиренсе ниволумаба у пациентов с лёгкой и средней почечной недостаточностью и у пациентов с нормальной функцией почек. Клиренс ниволумаба у пациентов с тяжёлой почечной недостаточностью недостаточно изучен.
Фармакокинетические свойства были изучены у пациентов с различными типами опухолей (рак лёгкого, меланома, рак почки, рак головы и шеи, уротелиальный рак, рак желудка, классическая лимфома Ходжкина) с печёночной недостаточностью лёгкой (повышение общего билирубина в 1,0–1,5 раза выше ВГН или ACT не выше ВГН, классификация национального института рака) и средней (повышение общего билирубина более чем в 1,5–3,0 раза выше ВГН и любое значение ACT) степени тяжести в сравнении с пациентами с нормальной функцией печени (общий билирубин и ACT в пределах нормы). Различий в клиренсе ниволумаба между вышеуказанными группами пациентов не обнаружено. Подобные результаты были получены и для пациентов с гепатоцеллюлярным раком. Фармакокинетика препарата не изучалась у пациентов с тяжёлой степенью печёночной недостаточности (повышение уровня общего билирубина более чем в 3,0 раза выше ВГН и любое значение ACT).
Показания
- В качестве монотерапии или в комбинации с ипилимумабом для неоперабельной или метастатической меланомы у взрослых пациентов, независимо от мутации в гене BRAF.
- В качестве адъювантной терапии пациентов с меланомой с поражением лимфатических узлов или с метастазами после хирургического лечения, независимо от мутации в гене BRAF.
- В качестве монотерапии местнораспространённого или метастатического немелкоклеточного рака лёгкого (НМРЛ) у взрослых после платиносодержащей химиотерапии.
- В комбинации с ипилимумабом и двумя циклами платиносодержащей химиотерапии для метастатического или рецидивирующего немелкоклеточного рака лёгкого (НМРЛ) у взрослых при отсутствии мутаций в генах EGFR или ALK, ранее не получавших лечения.
- В качестве монотерапии метастатического мелкоклеточного рака лёгкого у взрослых с прогрессированием после химиотерапии на основе препаратов платины и минимум одной другой линии терапии.
- В качестве монотерапии распространённого почечно-клеточного рака (ПКР) у взрослых после предшествующей системной терапии;
- В комбинации с ипилимумабом для распространённого почечно-клеточного рака (ПКР) у взрослых с промежуточным или плохим прогнозом, ранее не получавших лечения.
- В качестве монотерапии рецидивирующей или рефрактерной классической лимфомы Ходжкина (кЛХ) у взрослых после предшествующей аутологичной трансплантации стволовых клеток (аутоТСК) и терапии с использованием брентуксимаба ведотина или после 3-х и более линий системной терапии, включающей аутологичную трансплантацию стволовых клеток (аутоТСК).
- В качестве монотерапии рецидивирующего или метастатического плоскоклеточного рака головы и шеи после платиносодержащей терапии.
- В качестве монотерапии местнораспространенного неоперабельного или метастатического уротелиального рака после платиносодержащей терапии, а также с прогрессированием в течение 12 месяцев после неоадъювантной или адъювантной платиносодержащей химиотерапии.
- В качестве монотерапии или в комбинации с ипилимумабом для гепатоцеллюлярного рака после предшествующей терапии ингибиторами тирозинкиназ (ИТК).
- В качестве монотерапии или в комбинации с ипилимумабом для метастатического колоректального рака с высоким уровнем микросателлитной нестабильности (MSI- Н) или дефицитом репарации ошибок репликации ДНК (dMMR) после терапии с использованием фторпиримидина, оксалиплатина и иринотекана у взрослых пациентов.
- В качестве монотерапии распространённого или рецидивирующего рака желудка или пищеводно-желудочного перехода после 2-х и более линий системной терапии.
Противопоказания
- Гиперчувствительность к любому компоненту препарата.
- Детский возраст до 18 лет в связи с отсутствием данных по эффективности и безопасности.
- Беременность и период грудного вскармливания.
С осторожностью
- Тяжёлые аутоиммунные заболевания в активной стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни;
- Нарушение функции печени тяжёлой степени;
- Нарушение функции почек тяжёлой степени.
Отдельные группы пациентов
-
Пациенты с активными метастазами в головной мозг (или лептоменингеальными метастазами), активными аутоиммунными заболеваниями, пациенты, получающие терапию системными иммуносупрессорами, а также пациенты с исходным функциональным статусом по шкале ECOG ≥2 были исключены из всех регистрационных исследований ниволумаба и ниволумаба в комбинации с ипилимумабом. В отсутствии данных ниволумаб следует применять с осторожностью у данных групп пациентов после тщательной оценки соотношения польза-риск, основанной на индивидуальных показателях.
В клинических исследованиях ниволумаба или ниволумаба в комбинации с ипилимумабом не принимали участие следующие группы пациентов:
Меланома: пациенты с меланомой глаза/сосудистой оболочки глаза.
Адъювантная терапия меланомы: пациенты с предшествующей терапией меланомы (кроме пациентов после хирургического лечения, с адъювантной радиотерапией после нейрохирургического удаления поражений центральной нервной системы, предшествующей адъювантной терапии интерфероном, завершённой не ранее чем за 6 месяцев до включения в исследование) и пациентов с предшествующей терапией анти-PD- 1, анти- PD-L1, анти- PD-L2, анти- CD137 или анти- CTLA-4 антителами, включая ипилимумаб или другие антитела или Т-специфичные ко-стимуляторы или ингибиторы контрольных точек.
Немелкоклеточный рак лёгкого: пациенты с клиническими симптомами интерстициального заболевания лёгких.
Немелкоклеточный рак лёгкого: пациенты с наличием драйверной мутации EGFR или транслокации ALK, ранее не получавшие лечения.
Мелкоклеточный рак лёгкого: пациенты с клиническими симптомами интерстициального заболевания лёгких.
Почечно-клеточный рак: пациенты с метастазами в головной мозг в анамнезе или активными метастазами в головной мозг, ранее получавшие терапию.
Почечно-клеточный рак: пациенты с метастазами в головной мозг в анамнезе или активными метастазами в головной мозг, ранее не получавшие терапию.
Классическая лимфома Ходжкина: пациенты с клиническими симптомами интерстициального заболевания лёгких.
Рак головы и шеи: пациенты с раком носоглотки или слюнной железы в качестве первичного места расположения опухоли.
Гепатоцеллюлярный рак: пациенты с нарушениями функции печени любой степени, кроме класса A по Чайлд-Пью, в скрининге; ко-инфекция вирусами гепатита В/С или вирусами гепатита B/D.
Рак желудка или пищеводно-желудочного перехода: пациенты с дивертикулитом или язвенной болезнью желудочно-кишечного тракта или асцитом, требующими лечения.
Применение при беременности и в период грудного вскармливания
Исследований применения препарата Опдиво® у беременных женщин не проводилось. Исследования на животных показали репродуктивную токсичность ниволумаба. Иммуноглобулин IgG4 может проникать через плацентарный барьер, поэтому вероятно воздействие препарата на плод. Применение препарата Опдиво® при беременности противопоказано. Во время лечения и на период как минимум 5 месяцев после последнего введения препарата Опдиво® женщинам детородного возраста рекомендуется применение контрацепции.
Исследований касательно проникновения ниволумаба в грудное молоко женщин в период лактации не проводилось. Согласно общим сведениям попадание антител в грудное молоко возможно, поэтому нельзя исключить риск для новорождённого при применении препарата в период грудного вскармливания. Ввиду потенциальной опасности развития серьёзных побочных реакций у ребёнка, применение препарата Опдиво® в период грудного вскармливания противопоказано.
Способ применения и дозы
Препарат должен вводиться под руководством врача, имеющего опыт лечения онкологических заболеваний.
Препарат Опдиво® вводят в виде 60-минутной или 30-минутной внутривенной инфузии.
Рекомендуется: в начале лечения вводить препарат в виде 60-минутной инфузии и затем, в случае нормальной переносимости при введении препарата, перейти на время инфузии в течение 30 минут.
При необходимости переключения пациентов с режима дозирования 3 мг/кг или 240 мг каждые 2 недели на режим дозирования 480 мг каждые 4 недели, первую дозу 480 мг следует вводить через две недели после последней дозы 3 мг/кг или 240 мг. И наоборот, если пациенты должны быть переведены с режима дозирования 480 мг каждые 4 недели на 3 мг/кг или 240 мг каждые 2 недели, первую дозу 3 мг/кг или 240 мг следует вводить через четыре недели после последнего введения дозы 480 мг.
Лечение должно продолжаться до прогрессирования или развития непереносимой токсичности.
В адъювантном режиме при терапии пациентов с меланомой лечение должно продолжаться до развития рецидива заболевания или непереносимой токсичности, максимально до 1 года. На фоне терапии ниволумабом наравне со стандартными ответами, могли наблюдаться атипичные ответы на лечение (т.е. временное увеличение размера опухоли или появление небольших новых очагов поражения в течение первых нескольких месяцев терапии с последующим уменьшением опухоли). У клинически стабильных пациентов с начальными признаками прогрессирования заболевания лечение ниволумабом рекомендуется продолжить до момента подтверждения прогрессирования заболевания.
Неоперабельная или метастатическая меланома:
- в качестве монотерапии — препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели;
- в комбинации с ипилимумабом —
препарат Опдиво® в дозе 1 мг/кг с последующим введением ипилимумаба в тот же день в дозе 3 мг/кг в виде 90-минутной внутривенной инфузии каждые 3 недели, всего 4 введения,
далее — монотерапия — препарат Опдиво® в дозе 3 мг/кг или 240 мг — первое введение через 3 недели после последнего совместного введения, далее каждые 2 недели или в дозе 480 мг — первое введение через 6 недель после последнего совместного введения, далее каждые 4 недели.
Адъювантная терапия пациентов с меланомой:
- препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели.
Немелкоклеточный рак легкого:
- в качестве монотерапии — препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели.
- в комбинации с ипилимумабом и платиносодержащей химиотерапией —
препарат Опдиво® в дозе 360 мг в виде 30-минутной внутривенной инфузии каждые 3 недели, ипилимумаб в дозе 1 мг/кг в виде 30-минутной внутривенной инфузии каждые 6 недель и платиносодержащая химиотерапия в каждые 3 недели. Первой должна проводиться инфузия препарата Опдиво®, далее проводится инфузия ипилимумаба с последующей инфузией химиотерапии в тот же день.
После завершения двух циклов химиотерапии лечение продолжают препаратом Опдиво® в дозе 360 мг каждые 3 недели и ипилимумабом в дозе 1 мг/кг каждые 6 недель до прогрессирования заболевания, непереносимой токсичности или не более 24 месяцев у пациентов без прогрессирования заболевания.
Метастатический мелкоклеточный рак лёгкого:
- препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели.
Распространённый почечно-клеточный рак:
- в качестве монотерапии — препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели;
- в комбинации с ипилимумабом —
препарат Опдиво® в дозе 3 мг/кг с последующим введением ипилимумаба в тот же день в дозе 1 мг/кг в виде 30-минутной внутривенной инфузии каждые 3 недели, всего 4 введения,
далее — монотерапия — препарат Опдиво® в дозе 3 мг/кг или 240 мг — первое введение через 3 недели после последнего совместного введения, далее каждые 2 недели или в дозе 480 мг — первое введение через 6 недель после последнего совместного введения, далее каждые 4 недели.
Рецидивирующая или рефрактерная классическая лимфома Ходжкина:
- препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели. Рецидивирующий или метастатический плоскоклеточный рак головы и шеи:
- препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели. Местнораспространённый неоперабельный или метастатический уротелиальный рак:
- препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели.
Гепатоцеллюлярный рак:
- в качестве монотерапии — препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели.
- в комбинации с ипилимумабом —
препарат Опдиво® в дозе 1 мг/кг с последующим введением ипилимумаба в тот же день в дозе 3 мг/кг в виде 30-минутной внутривенной инфузии каждые 3 недели, всего 4 введения, далее — монотерапия — препарат Опдиво® в дозе 3 мг/кг или 240 мг — первое введение через 3 недели после последнего совместного введения, далее каждые 2 недели или в дозе 480 мг
- первое введение через 6 недель после последнего совместного введения, далее каждые 4 недели.
Метастатический колоректальный рак:
- в качестве монотерапии — препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели;
- в комбинации с ипилимумабом —
препарат Опдиво® в дозе 3 мг/кг с последующим введением ипилимумаба в тот же день в дозе 1 мг/кг в виде 30-минутной внутривенной инфузии каждые 3 недели, всего 4 введения, далее — монотерапия — препарат Опдиво® в дозе 3 мг/кг или 240 мг — первое введение через 3 недели после последнего совместного введения, далее каждые 2 недели или в дозе 480 мг
- первое введение через 6 недель после последнего совместного введения, далее каждые 4 недели.
Рак желудка или пищеводно-желудочного перехода:
- препарат Опдиво® — в дозе 3 мг/кг или 240 мг каждые 2 недели или 480 мг каждые 4 недели.
Ознакомьтесь с информацией, содержащейся в инструкции по применению лекарственного препарата ипилимумаб для получения информации по рекомендованной схеме дозирования.
Повышение или понижение дозы препарата не рекомендуется. Пропуск введения очередной дозы или отмена терапии могут быть связаны с индивидуальной безопасностью или переносимостью препарата. Рекомендации по окончательной отмене или пропуску введения препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом приведены в Таблице 1. Подробные рекомендации по устранению иммуноопосредованных нежелательных реакций приводятся в разделе «Особые указания».
При применении препарата Опдиво® в комбинации с ипилимумабом в случае приостановки применения одного из препаратов необходимо приостановить применение и другого препарата.
Терапию препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом необходимо полностью прекратить в случае развития нежелательных реакций 4 степени тяжести или рецидивирующих нежелательных реакций 3 степени тяжести, а также при устойчивых, несмотря на лечение, нежелательных реакциях 2 и 3 степени тяжести.
|
Иммуноопосредов анные нежелательные реакции |
Тяжесть |
Модификация лечения |
|
Иммуноопосредованный пневмонит |
Пневмонит 2 степени тяжести. |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом до исчезновения симптомов, положительной рентгенологической динамики и купирования нежелательных реакций глюкокортикостероидами. |
|
Пневмонит 3 или 4 степени тяжести |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
|
|
Иммуноопосредованный колит |
Диарея или колит 2 степени тяжести |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами в случае необходимости. |
|
Диарея или колит 3 степени тяжести (монотерапия ниволумабом) |
Приостановить приём препарата Опдиво® до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами. |
|
|
Диарея или колит 3 степени тяжести (ниволумаб в комбинации с ипилимумабом) |
Отмена обоих препаратов без возобновления. |
|
|
Диарея или колит 4 степени тяжести |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
|
|
Иммуноопосредованный гепатит |
Пациенты с нормальной активностью аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ) и уровнем билирубина на момент начала лечения: |
|
|
Повышение активности ACT, АЛТ или уровня общего билирубина 2 степени тяжести |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом до возвращения лабораторных показателей к исходному уровню и купирования нежелательных реакций глюкокортикостероидами в случае необходимости. |
|
|
Повышение активности ACT, АЛТ или уровня общего билирубина 3 или 4 степени тяжести |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
|
|
Пациенты с гепатоцеллюлярным раком с повышенной активностью АСТ/АЛТ на момент начала лечения: |
||
|
Приостановить приём препарата Опдиво® до возвращения лабораторных показателей к исходному уровню и купирования нежелательных реакций глюкокортикостероидами. |
|
|
Повышение активности АСТ/АЛТ в течение лечения до >10 × ВГН (независимо от уровня в начале лечения) или Повышение уровня общего билирубина 3 или 4 степени тяжести |
Отмена препарата Опдиво® без возобновления. |
|
|
Иммуноопосредова иные нефрит и почечная дисфункция |
Повышение уровня креатинина 2 или 3 степени тяжести |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом до возвращения уровня креатинина к исходному уровню и купирования нежелательных реакций глюкокортикостероидами. |
|
Повышение уровня креатинина 4 степени тяжести |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
|
|
Иммуноопосредова иная эндокринопатия |
Симптоматическая эндокринопатия 2 или 3 степени тяжести (включая гипотиреоз, гипертиреоз, гипофизит) Недостаточность коры надпочечников 2 степени тяжести Диабет 3 степени тяжести |
Приостановить приём препарата Опдиво® или препарата Опдиво®с ипилимумабом до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами (в случае необходимости снятия симптомов острого воспаления). Прием препарата Опдиво® или препарата Опдиво® с ипилимумабом следует продолжать при наличии адекватной заместительной гормональной терапии при условии отсутствия симптомов нежелательных реакций. |
|
Эндокринопатия 4 степени тяжести (включая гипотиреоз, гипертиреоз, гипофизит) Недостаточность коры надпочечников 3 или 4 степени тяжести Диабет 4 степени тяжести |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
|
|
Иммуноопосредова иные кожные реакции |
Сыпь 3 степени тяжести |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами. |
|
Подозрение на синдром Стивенса-Джонсона или токсический эпидермальный некролиз |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом. |
|
|
Сыпь 4 степени тяжести Подтверждённый синдром Стивенса-Джонсона или токсический эпидермальный некролиз |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
|
|
Иммуноопосредованный энцефалит |
Впервые выявленные неврологические признаки или симптомы от умеренной до тяжёлой степени тяжести |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом до исчезновения симптомов и купирования нежелательных реакций на фоне терапии глюкокортикостероидами. |
|
Иммуно- опосредованный энцефалит |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
|
|
Иммуноопосредованный миокардит |
Миокардит 2 степени тяжести |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом до купирования симптомов и завершения лечения глюкокортикостероидами. После восстановления может быть рассмотрен вопрос о возобновлении терапии. |
|
Миокардит 3 степени тяжести |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
|
|
Прочие иммуноопосредова иные нежелательные реакции |
Нежелательные реакции 3 степени тяжести (впервые выявленные) |
Приостановить приём препарата Опдиво® или препарата Опдиво® с ипилимумабом до исчезновения симптомов и купирования нежелательных реакций глюкокортикостероидами. |
|
Нежелательные реакции 4 степени тяжести или повторные случаи нежелательных реакций 3 степени тяжести. Сохранение нежелательных реакций 2 или 3 степени тяжести несмотря на модификацию лечения. Невозможность снижения суточной дозы глюкокортикостероидов до эквивалентной 10 мг преднизона. |
Отмена препарата Опдиво® или препарата Опдиво® с ипилимумабом без возобновления. |
Примечание: степень токсичности соответствует общей терминологии критериев нежелательных явлений Национального института рака, Версия 4.0 (NCI-CTCAE v4)
Нарушение функции почек
Коррекции дозы препарата при лёгкой и средней степени тяжести нарушения функции почек не требуется.
Нарушение функции печени
При печёночной недостаточности лёгкой и средней степени тяжести коррекции дозы препарата не требуется.
Пациенты пожилого возраста
Коррекции дозы препарата у пациентов 65 лет и старше не требуется.
Инструкции по приготовлению и введению препарата
Приготовление раствора для инфузий
- Дозировка препарата определяется как мг/кг или мг. На основании дозы, выписанной пациенту, определяют количество флаконов препарата, необходимых для введения. Для одного пациента может потребоваться более 1 флакона для приготовления разовой дозы для введения.
- Разбавленный раствор для инфузий готовят в асептических условиях.
- Препарат Опдиво® может использоваться не разведенным после переноса во флакон стерильной инфузионной системы или после разведения стерильным 0,9 % раствором натрия хлорида для инфузий или стерильным 5 % раствором глюкозы для инфузий.
- Проводят визуальный контроль концентрата на наличие механических включений и изменение цвета. Препарат Опдиво® представляет собой прозрачную или опалесцирующую жидкость, от бесцветного до светло-желтого цвета.
- Удаляют защитную пластиковую крышку с флакона. Пробку флакона протирают стерильной ватой, смоченной в спирте.
-
Переносят необходимый объём препарата (концентрация 10 мг/мл) с помощью стерильного шприца во флакон стерильной инфузионной системы. Разведение проводят с помощью стерильного 0,9 % раствора натрия хлорида для инфузий или стерильного 5 % раствора глюкозы для инфузий:
◦ концентрация разбавленного раствора должна быть от 1 до 10 мг/мл;
◦ конечный объём разбавленного препарата, предназначенный для введения, не должен превышать 160 мл;
◦ для пациентов с весом менее 40 кг конечный объём разбавленного препарата, предназначенный для введения, не должен превышать 4 мл/кг массы тела.
- Для упрощения приготовления раствора препарата исходный концентрат может быть перенесён непосредственно во флаконы для инфузий, уже содержащие соответствующие количества стерильного 0,9 % раствора натрия хлорида для инфузий или стерильного 5 % раствора глюкозы для инфузий.
- Приготовленный раствор перемешивают путем осторожного переворачивания емкости для инфузий.
Не встряхивать флакон с препаратом!
- Перед введением необходимо провести визуальный контроль приготовленного раствора препарата на наличие механических включений и изменение цвета. Раствор препарата Опдиво® представляет собой прозрачную или опалесцирующую жидкость, от бесцветного до светло-жёлтого цвета.
- Нельзя вводить препарат при наличии в нем посторонних частиц, а также если раствор спит мутным или его цвет изменился.
-
Препарат Опдиво® совместим со следующими типами оборудования для инфузий:
◦ Стеклянные флаконы, поливинилхлоридные (PVC) и полиолефиновые контейнеры для инфузий;
◦ Поливинилхлоридные (PVC) системы для внутривенного введения;
◦ Проточные фильтры для инфузионных систем с полиэфирсульфоновыми мембранами с размером пор 0,2 — 1,2 мкм.
- С точки зрения микробиологической чистоты, приготовленный раствор должен использоваться немедленно. В противном случае приготовленный раствор можно хранить в защищённом от света месте до 24 часов при температуре 2–8 °C (из указанных 24 часов раствор препарата может находиться при комнатной температуре (20–25 °C) и комнатном освещении в течение не более чем 8-ми часов, включая время, необходимое для введения препарата).
- Неиспользованный остаток препарата Опдиво® во флаконе и пустой флакон следует уничтожить согласно местным рекомендациям.
Введение раствора для инфузий
- Препарат нельзя вводить в виде быстрой внутривенной инъекции или в виде болюсной инъекции.
- После введения каждой дозы препарата Опдиво® необходимо промыть инфузионную систему стерильным 0,9 % раствором натрия хлорида для инфузий или стерильным 5 % раствором глюкозы для инфузий.
- Не смешивать препарат Опдиво® с другими лекарственными препаратами в одном флаконе или системе для инфузий и не вводить его одновременно с другими препаратами для инфузий.
- Препарат должен вводиться в течение 60 минут или 30 минут через стерильную инфузионную систему с низкой способностью связывания белков со стерильным, апирогенным проточным фильтром (размер пор 0,2–1,2 мкм).
- При проведении комбинированной терапии с ипилимумабом препарат Опдиво® следует вводить первым с последующим введением ипилимумаба в тот же день. Для каждой инфузии используют отдельные флаконы/системы для инфузий и фильтры.
Побочное действие
При применении препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом чаще всего отмечались иммуноопосредованные побочные реакции. Большинство таких побочных реакций, включая тяжелые, купировались при помощи соответствующей терапии или путем отмены препарата.
В клинических исследованиях с применением препарата Опдиво® в качестве монотерапии в дозе 3 мг/кг по типам опухолей, наиболее частыми (≥10 %) нежелательными реакциями были утомляемость (28 %), сыпь (16 %), зуд (13 %), диарея (12 %), нейтропения (12 %) и тошнота (11 %).
Меланома
В клинических исследованиях с применением препарата Опдиво® в дозе 1 мг/кг в комбинации с ипилимумабом 3 мг/кг при лечении меланомы, наиболее частыми (≥10 %) нежелательными реакциями были сыпь (52 %), утомляемость (46 %), диарея (43 %), зуд (36 %), тошнота (26 %), гипертермия (19 %), снижение аппетита (16 %), гипотиреоз (16 %), колит (15 %), рвота (14 %), боли в животе (13 %), артралгия (13 %), головная боль (11 %), одышка (10 %). В большинстве случаев побочные реакции были выражены от легкой до средней степени тяжести (степень 1 и 2).
Гепатоцеллюлярный рак у пациентов, ранее получавших лечение
Общий профиль безопасности в клиническом исследовании с применением ниволумаба в дозе 3 мг/кг у пациентов с гепатоцеллюлярным раком, ранее получавших сорафениб, как правило, совпадал с профилем, установленным по всем типам опухолей для ниволумаба в монотерапии, за исключением большей частоты повышения активности трансаминаз и уровня билирубина. Серьёзные нежелательные реакции наблюдались у 49 % пациентов. Наиболее частыми серьёзными нежелательными реакциями, отмеченными как минимум у 2 % пациентов, были повышение температуры тела, асцит, боль в спине, общее ухудшение физического состояния, боль в животе, пневмония, анемия.
В исследовании 2 фазы с применением ниволумаба в дозе 3 мг/кг у пациентов с гепатоцеллюлярным раком, ранее получавших сорафениб, повышение активности ACT, АЛТ и уровня общего билирубина 3 или 4 степени тяжести было отмечено у 17 %, 11 % и 7 % пациентов, соответственно.
В клиническом исследовании с применением препарата Опдиво® в дозе 1 мг/кг в комбинации с ипилимумабом в дозе 3 мг/кг терапия была прекращена у 29 % пациентов по причине развития нежелательных реакций и приостановлена у 65 % пациентов по причине развития нежелательных реакций. Наиболее частыми серьёзными нежелательными реакциями, отмеченными как минимум у 4 % пациентов, были повышение температуры, диарея, анемия, повышение активности ACT, недостаточность функции надпочечников, варикозное расширение вен пищевода, гипонатриемия, повышение уровня билирубина в крови, пневмонит.
Адъювантная терапия меланомы
В клиническом исследовании с применением препарата Опдиво® в качестве монотерапии в дозе 3 мг/кг терапия была прекращена у 9 % пациентов по причине развития нежелательных реакций, 20 % пациентов пропустили по меньшей мере один приём препарата Опдиво® по причине развития нежелательных реакций. Нежелательные реакции 3 и 4 степени тяжести были зафиксированы у 25 % пациентов, получавших ниволумаб. Наиболее частыми нежелательными реакциями 3 и 4 степени тяжести, отмеченными как минимум у 2 % пациентов, были диарея и повышение активности липазы и амилазы. Серьезные нежелательные реакции были зафиксированы у 18 % пациентов, получавших ниволумаб. Самыми распространёнными нежелательными реакциями (по меньшей мере, у 20 % пациентов, получавших адъювантную терапию меланомы ниволумабом) были утомляемость, диарея, сыпь, скелетно-мышечные боли, артралгия, нейтропения, зуд, головная боль, тошнота, инфекции верхних дыхательных путей, боль в животе, гипотиреоз. Самыми распространёнными иммуноопосредованными нежелательными реакциями были сыпь (16 %), диарея/колит (6 %) и гепатит (3 %).
Распространённый или метастатический почечно-клеточный рак у пациентов, ранее не получавших лечения
В клиническом исследовании с применением препарата Опдиво® в дозе 3 мг/кг в комбинации с ипилимумабом в дозе 1 мг/кг терапия была прекращена по причине развития нежелательных явлений у 31 % пациентов. У 54 % пациентов имела место задержка введения препарата в связи с нежелательными явлениями. Снижение дозы препаратов ниволумаб и ипилимумаб не допускалось. Серьёзные нежелательные явления наблюдались у 59 % пациентов, получавших препарат Опдиво® в комбинации с ипилимумабом. Наиболее частыми нежелательными явлениями, зарегистрированными не менее чем у 2 % пациентов, были диарея, повышение температуры тела, пневмония, пневмонит, гипофизит, острая почечная недостаточность, одышка, надпочечниковая недостаточность и колит. Наиболее часто встречавшимися нежелательными явлениями (зарегистрированными у 20 и более % пациентов, получавших препарат Опдиво® в комбинации с ипилимумабом) были утомляемость, сыпь, диарея, костно-мышечная боль, зуд, тошнота, кашель, повышение температуры тела, артралгия и снижение аппетита. Наиболее часто встречавшиеся отклонения лабораторных показателей, зарегистрированные у более чем 30 % пациентов, получавших препарат Опдиво® в комбинации с ипилимумабом, включали в себя повышение уровня липазы, анемию, повышение уровня креатинина, повышение уровня АЛТ, повышение уровня ACT, гипонатриемию, повышение уровня амилазы и лимфопению.
Метастатический колоректальный рак с высоким уровнем микросателлитной нестабильности (MSI-H) или дефицитом репарации ошибок репликации ДНК (dMMR) у пациентов, ранее получавших терапию с использованием фторпиримидина, оксалиплатина и иринотекана
В клиническом исследовании по оценке эффективности препарата Опдиво® в дозе 3 мг/кг в комбинации с ипилимумабом в дозе 1 мг/кг терапия была отменена у 13 % пациентов по причине развития нежелательных явлений. Задержка введения препарата имела место у 45 % пациентов и была связана с нежелательными явлениями. Серьезные нежелательные явления наблюдались у 47 % пациентов. Наиболее часто встречавшимися серьёзными нежелательными явлениями, зарегистрированными не менее чем у 2 % пациентов, были колит/диарея, нарушения работы печени, боль в животе, острая почечная недостаточность, повышение температуры тела и обезвоживание. Наиболее часто встречающимися нежелательными реакциями (зарегистрированными у более чем 20 % пациентов) были утомляемость, диарея, повышение температуры тела, костно-мышечная боль, боль в животе, зуд, тошнота, сыпь, снижение аппетита и рвота.
Метастатический мелкоклеточный рак лёгкого
В клиническом исследовании с применением препарата Опдиво® в дозе 3 мг/кг терапия была отменена у 10 % пациентов по причине развития нежелательных реакций. Задержка введения препарата наблюдалась у 25 % пациентов в связи с нежелательными реакциями. Серьёзные нежелательные реакции наблюдались у 45 % пациентов. Наиболее часто встречавшимися серьёзными нежелательными реакциями, зарегистрированными не менее чем у 2 % пациентов, были пневмония, одышка, пневмонит, плевральный выпот и обезвоживание. Наиболее часто встречающимися нежелательными реакциями (зарегистрированными у более чем 20 % пациентов) были утомляемость, снижение аппетита, одышка, скелетно-мышечная боль, тошнота, диарея, запор, кашель. В целом профиль токсичности у пациентов с метастатическим мелкоклеточным раком легкого не отличается от профиля токсичности у пациентов с другими солидными опухолями при монотерапии препаратом Опдиво®.
Немелкоклеточный рак легкого
В клиническом исследовании с применением препарата Опдиво® в дозе 360 мг в комбинации с ипилимумабом в дозе 1 мг/кг и двумя циклами химиотерапии наиболее частыми побочными реакциями (более чем у 10 % пациентов) были: утомляемость (36 %), тошнота (26 %), сыпь (25 %), диарея (20 %), зуд (18 %), снижение аппетита (16 %), гипотиреоз (15 %) и рвота (13 %). Большинство побочных реакций были от легкой до средней степени тяжести (1 или 2 степени).
Ниже приведены побочные реакции, отмечавшиеся у пациентов, получавших терапию препаратом Опдиво®.
Побочные реакции представлены по частоте их регистрации: очень частые (≥1/10), частые (≥1/100, <1/10), нечастые (≥1/1 000, <1/100), редкие (≥1/10 000, <1/1 000), очень редкие (<1/10 000).
Инфекции и инвазии:
Частые: инфекции верхних дыхательных путей;
Нечастые: бронхит, пневмония1.
Новообразования доброкачественные, злокачественные и неустановленной природы (в том числе кисты и полипы):
Редкие: гистиоцитарный некротический лимфаденит (лимфаденит Кикучи)
Со стороны крови и лимфатической системы:
Частые: нейтропения;
Нечастые: эозинофилия.
Пострегистрационные данные: гемофагоцитарный лимфогистиоцитоз (ГЛГ), аутоиммунная гемолитическая анемия.
Со стороны иммунной системы:
Частые: инфузионные реакции2, гиперчувствительность2;
Редкие: анафилактические реакции2.
Пострегистрационные данные: отторжение трансплантата солидного органа, реакция «трансплантат против хозяина» (ТПХ).
Со стороны эндокринной системы:
Очень частые: гипергликемия;
Частые: гипогликемия, гипотиреоз, гипертиреоз;
Нечастые: недостаточность функции надпочечников, гипопитуитаризм, гипофизит, сахарный диабет, диабетический кетоацидоз, тиреоидит;
Нарушения обмена веществ и питания:
Частые: снижение аппетита;
Нечастые: дегидратация, метаболический ацидоз.
Со стороны нервной системы:
Частые: периферическая нейропатия, головная боль, головокружение;
Нечастые: полинейропатия, аутоиммунная нейропатия (включая парез лицевого и отводящего нервов);
Редкие: синдром Гийена-Барре, демиелинизация, миастенический синдром, энцефалит1,2.
Со стороны органов зрения:
Нечастые: нечеткость зрения, увеит, сухость глаз;
Постмаркетинговые данные: синдром Фогта-Коянаги-Хорада.
Со стороны сердечно-сосудистой системы:
Частые: повышение артериального давления;
Нечастые: тахикардия;
Редкие: аритмия (включая желудочковую аритмию), миокардит1,5, мерцательная аритмия, васкулит.
Со стороны дыхательной системы:
Частые: пневмонит1,2, одышка1, кашель;
Нечастые: плевральный выпот;
Редкие: инфильтрация легких.
Со стороны желудочно-кишечного тракта:
Очень частые: диарея, тошнота;
Частые: колит1, стоматит, рвота, боль в животе, запор, сухость во рту;
Нечастые: гастрит, панкреатит;
Редкие: язва двенадцатиперстной кишки.
Со стороны печени и желчных путей:
Нечастые: гепатит2.
Редкие: холестаз.
Со стороны кожи и подкожной клетчатки:
Очень частые: сыпь4, зуд;
Частые: витилиго, сухость кожи, эритема, алопеция;
Нечастые: многоформная эритема, псориаз, розацеа, крапивница;
Редкие: токсический эпидермальный некролиз1,5, синдром Стивенса-Джонсона1,5.
Со стороны опорно-двигательной системы:
Частые: костно-мышечная боль6, артралгия;
Нечастые: ревматическая полимиалгия, артрит;
Редкие: миопатия, миозит (включая полимиозит)1,5, рабдомиолиз1,5, синдром Шегрена;
Со стороны почек и мочевыводящих путей:
Нечастые: тубулоинтерстициальный нефрит, почечная недостаточность (включая острую почечную недостаточность)1,2.
Общие нарушения и реакции на введение препарата:
Очень частые: утомляемость;
Частые: повышение температуры тела, отеки (включая периферические отёки);
Нечастые: боль, боль в груди;
Со стороны лабораторных показателей:
Очень частые: повышение активности ACT, повышение активности АЛТ, повышение активности щелочной фосфатазы, повышение активности липазы, повышение активности амилазы, гипокальциемия, повышение креатинина, лимфопения, лейкопения, нейтропения, тромбоцитопения, анемия, гиперкальциемия, гиперкалиемия, гипокалиемия, гипомагнезиемия, гипонатриемия;
Частые: снижение массы тела, повышение уровня общего билирубина, гипермагнезиемия, гипернатриемия.
Ниже приведены побочные реакции, отмечавшиеся у пациентов, получавших терапию препаратом Опдиво® в комбинации с ипилимумабом.
Побочные реакции представлены по частоте их регистрации: очень частые (≥1/10), частые (≥1/100, <1/10), нечастые (≥1/1 000, <1/100), редкие (≥1/10 000, <1/1 000), очень редкие (<1/10 000).
Инфекции и инвазии:
Частые: пневмония, инфекции верхних дыхательных путей;
Нечастые: бронхит, менингит;
Со стороны крови и лимфатической системы:
Частые: эозинофилия
Пострегистрационные данные: гемофагоцитарный лимфогистиоцитоз (ГЛГ), аутоиммунная гемолитическая анемия.
Со стороны иммунной системы:
Частые: инфузионные реакции2, гиперчувствительность2, саркоидоз;
Пострегистрационные данные: отторжение трансплантата солидного органа, реакция «трансплантат против хозяина» (ТПХ).
Со стороны эндокринной системы:
Очень частые: гипотиреоз, гипертиреоз, гипергликемия, гипогликемия;
Частые: тиреоидит, недостаточность функции надпочечников2, гипопитуитаризм, гипофизит2, сахарный диабет2, аутоиммунные заболевания щитовидной железы;
Нечастые: диабетический кетоацидоз2, вторичная адренокортикальная недостаточность.
Нарушения обмена веществ и питания:
Очень частые: снижение аппетита;
Частые: дегидратация;
Нечастые: метаболический ацидоз.
Со стороны нервной системы:
Очень частые: головная боль;
Частые: периферическая нейропатия, головокружение;
Нечастые: полинейропатия, синдром Гийена-Барре, полинейропатия, неврит, паралич малоберцового нерва, аутоиммунная нейропатия (включая парез лицевого и отводящего нервов), энцефалит2, парестезия, миастения гравис2.
Со стороны органов зрения:
Частые: увеит, нечёткость зрения;
Постмаркетинговые данные: синдром Фогта-Коянаги-Хорада.
Со стороны сердечно-сосудистой системы:
Частые: тахикардия, повышение артериального давления;
Нечастые: аритмия (включая желудочковую аритмию)1,3, мерцательная аритмия, миокардит1,2,5.
Со стороны дыхательной системы:
Очень частые: одышка;
Частые: пневмонит1,2, кашель, легочная эмболия1, плевральный выпот;
Со стороны желудочно-кишечного тракта:
Очень частые: колит1, диарея, боль в животе, рвота, тошнота;
Частые: панкреатит, стоматит, запор, сухость во рту;
Нечастые: гастрит, перфорация кишечника1, дуоденит;
Со стороны печени и желчных путей:
Частые: гепатит2;
Со стороны кожи и подкожной клетчатки:
Очень частые: сыпь4, зуд;
Частые: витилиго, сухость кожи, эритема, алопеция, крапивница;
Нечастые: псориаз, синдром Стивенса-Джонсона5, мультиформная эритема;
Редкие: токсический эпидермальный некролиз1,5.
Со стороны опорно-двигательной системы:
Очень частые: артралгия, костно-мышечная боль6;
Частые: артрит, мышечные спазмы, мышечная слабость, скованность суставов;
Нечастые: спондилоартропатия, синдром Шегрена, миопатия, миозит (включая полимиозит)1,5, рабдомиолиз1,5, ревматическая полимиалгия, некротизирующий миозит;
Со стороны почек и мочевыводящих путей:
Частые: почечная недостаточность (включая острую почечную недостаточность)1’2
Нечастые: тубулоинтерстициальный нефрит.
Общие нарушения и реакции на введение препарата:
Очень частые: утомляемость, повышение температуры тела;
Частые: отеки (включая периферические отёки), боль, боль в груди, озноб, отек лица, острые респираторные инфекции;
Со стороны лабораторных показателей2:
Очень частые: повышение активности ACT, повышение активности АЛТ, повышение уровня общего билирубина, повышение активности щелочной фосфатазы, повышение активности липазы, повышение активности амилазы, повышение креатинина, лимфопения, лейкопения, нейтропения, тромбоцитопения, анемия, гипокальциемия, гиперкалиемия, гипокалиемия, гипомагнезиемия, гипонатриемия;
Частые: снижение массы тела, гиперкальциемия, гипермагнезиемия, гипернатриемия.
ПРИМЕЧАНИЕ:
1 Включая побочные реакции с летальным исходом.
2 Включая жизнеугрожающие побочные реакции.
3 Для метастатической меланомы все побочные реакции со стороны сердечно-сосудистой системы считались по мнению исследователей не связанными с применением ниволумаба кроме аритмий (мерцательная аритмия, тахикардия, желудочковая экстрасистолия).
4 Включая пятнисто-папулезную сыпь, эритемную сыпь, зудящую сыпь, везикулёзную сыпь, макулёзную сыпь, кореподобную сыпь, папулёзную сыпь, пустулёзную сыпь, папуло-сквамозную сыпь, везикулёзную сыпь, генерализованную сыпь, эксфолиативную сыпь, дерматит, акнеиформный дерматит, аллергический дерматит, атопический дерматит, буллезный дерматит, эксфолиативный дерматит, псориазиформный дерматит, медикаментозную сыпь.
5 Включая отчёты по внешним данным. Частота основана на данных по программе расширенного доступа.
6 Включая боль в спине, костную боль, мышечно-скелетную боль в груди, костно-мышечный дискомфорт, миалгию, боль в шее, боль в конечностях, спинальную боль.
Ниже приведены побочные реакции, отмечавшиеся у пациентов, получавших терапию препаратом Опдиво® в комбинации с ипилимумабом и химиотерапией*.
Побочные реакции представлены по частоте их регистрации: очень частые (≥1/10), частые (≥1/100, <1/10), нечастые (≥1/1 000, <1/100), редкие (≥1/10 000, <1/1 000), очень редкие (<1/10 000).
Инфекции и инвазии:
Частые: конъюнктивит, пневмония, инфекции дыхательных путей.
Со стороны крови и лимфатической системы:
Частые: фебрильная нейтропения;
Нечастые: эозинофилия
Со стороны иммунной системы:
Частые: инфузионные реакции, гиперчувствительность;
Со стороны эндокринной системы:
Очень частые: гипотиреоз;
Частые: гипертиреоз, недостаточность функции надпочечников, гипофизит, тиреоидит;
Нечастые: гипопитуитаризм, гипопаратиреоз.
Нарушения обмена веществ и питания:
Очень частые: снижение аппетита;
Частые: дегидратация, гипоальбуминемия, гипофосфатемия.
Со стороны нервной системы:
Частые: периферическая нейропатия, головокружение;
Нечастые: полинейропатия, аутоиммунная нейропатия (включая парез лицевого и отводящего нервов), энцефалит.
Со стороны органов зрения:
Частые: сухость глаз;
Нечастые: помутнение зрения, эписклерит.
Со стороны сердечно-сосудистой системы:
Нечастые: повышение артериального давления, тахикардия, мерцательная аритмия, брадикардия.
Со стороны дыхательной системы:
Частые: пневмонит, одышка, кашель;
Нечастые: плевральный выпот.
Со стороны желудочно-кишечного тракта:
Очень частые: тошнота, диарея, рвота;
Частые: запор, стоматит, боль в животе, колит, сухость во рту, панкреатит;
Нечастые: гастрит, перфорация кишечника, дуоденит;
Со стороны печени и желчных путей:
Частые: гепатит;
Со стороны кожи и подкожной клетчатки:
Очень частые: сыпь1, зуд;
Частые: алопеция, сухость кожи, эритема, крапивница;
Нечастые: псориаз, синдром Стивенса-Джонсона, витилиго;
Со стороны опорно-двигательной системы:
Частые: костно-мышечная боль2, артралгия, артрит;
Нечастые: мышечная слабость, мышечные спазмы, ревматическая полимиалгия.
Со стороны почек и мочевыводящих путей:
Частые: почечная недостаточность (включая острую почечную недостаточность);
Нечастые: нефрит.
Общие нарушения и реакции на введение препарата:
Очень частые: утомляемость;
Частые: повышение температуры тела, отеки (включая периферические отёки);
Нечастые: озноб, боль в груди.
Со стороны лабораторных показателей:
Очень частые: повышение активности ACT, повышение активности АЛТ, повышение активности щелочной фосфатазы, повышение активности липазы, повышение активности амилазы, повышение креатинина, лимфопения, лейкопения, нейтропения, тромбоцитопения, анемия, гипокальциемия, гиперкальциемия, гиперкалиемия, гипокалиемия, гипомагнезиемия, гипермагнезиемия, гипонатриемия, гипергликемия, гипогликемия;
Частые: повышение уровня тиреотропного гормона, повышение уровня общего билирубина, гипернатриемия;
Нечастые: повышение активности гамма-глутамилтрансферазы.
ПРИМЕЧАНИЕ:
* препарат Опдиво® каждые 3 недели в комбинации с ипилимумабом каждые 6 недель и платиносодержащей химиотерапией каждые 3 недели 2 цикла. Затем препарат Опдиво® каждые 3 недели в комбинации с ипилимумабом каждые 6 недель
1 Включая пятнисто-папулезную сыпь, эритемную сыпь, зудящую сыпь, макулёзную сыпь, кореподобную сыпь, папулёзную сыпь, генерализованную сыпь, дерматит, акнеиформный дерматит, аллергический дерматит, атопический дерматит, буллезный дерматит, медикаментозную сыпь.
2 Включая боль в спине, костную боль, мышечно-скелетную боль в груди, миалгию, боль в шее, боль в конечностях, спинальную боль.
Иммуногенность
Препарат Опдиво®, как и другие моноклональные антитела, обладает иммуногенностью.
У 11,2 % пациентов, получавших терапию препаратом Опдиво®, наблюдалось образование антител к ниволумабу. Нейтрализация антител определилась у 0,7 % пациентов.
Образование антител к ниволумабу наблюдалось у 37,8 % пациентов, получавших терапию препаратом Опдиво® в дозе 1 мг/кг в комбинации с ипилимумабом в дозе 3 мг/кг, и у 23,8–26 % пациентов, получавших терапию препаратом Опдиво® в дозе 3 мг/кг в комбинации с ипилимумабом в дозе 1 мг/кг . Нейтрализация антител определилась у 4,6 % пациентов, получавших терапию препаратом Опдиво® в дозе 1 мг/кг в комбинации с ипилимумабом в дозе 3 мг/кг, и у 0,5–1,9 % пациентов, получавших терапию препаратом Опдиво® в дозе 3 мг/кг в комбинации с ипилимумабом в дозе 1 мг/кг. У 4,1–8,4 % пациентов, получавших терапию препаратом Опдиво® в комбинации с ипилимумабом, наблюдалось образование антител к ипилимумабу. Нейтрализация антител определилась у 0–0,3 % пациентов.
В целом образование антител к ниволумабу не сопровождалось повышением частоты встречаемости инфузионных реакций, также не было показано их влияние на эффективность терапии.
Не выявлено взаимосвязи между изменениями фармакокинетических параметров, отсутствием клинического эффекта, изменением профиля токсичности и наличием антител в плазме крови как при монотерапии, так и при комбинированной терапии с ипилимумабом. Образование антител к ниволумабу наблюдалось у 33,8 % пациентов, получавших терапию препаратом Опдиво® в комбинации с ипилимумабом и платиносодержащей химиотерапией. Нейтрализация антител определялась у 2,6 % пациентов. У 7,5 % пациентов, получавших терапию препаратом Опдиво® в комбинации с ипилимумабом и платиносодержащей химиотерапией, наблюдалось образование антител к ипилимумабу. Нейтрализация антител определялась у 0–1,6 % пациентов.
Передозировка
Случаев передозировки выявлено не было.
При передозировке лечение должно заключаться в симптоматической лекарственной терапии в соответствии с возникающими побочными реакциями при тщательном наблюдении за пациентом.
Взаимодействие с другими лекарственными средствами
Фармакокинетические взаимодействия
Ниволумаб представляет собой человеческое моноклональное антитело. Ввиду того, что антитела не подвергаются метаболизму при участии изоферментов цитохрома Р450 и других изоферментов, ингибирование или индукция этих ферментов при совместном применении с другими лекарственными препаратами не оказывают влияние на фармакокинетику ниволумаба.
Другие формы взаимодействий
Системная иммуносупрессия
В связи с возможностью фармакодинамического взаимодействия следует избегать применения системных глюкокортикостероидов и других иммунодепрессантов перед началом терапии препаратом Опдиво®. После начала терапии препаратом Опдиво® глюкокортикостероиды и другие иммунодепрессанты могут применяться для коррекции иммуноопосредованных побочных реакций, вызванных воздействием препарата на иммунную систему. Применение системных глюкокортикостероидов после начала лечения препаратом не снижает эффективности препарата Опдиво®.
Особые указания
Препарат Опдиво® или препарат Опдиво® в комбинации с ипилимумабом может вызывать тяжёлые, в том числе с летальным исходом, побочные реакции, вызванные влиянием на иммунную систему и обусловленные специфическим механизмом его действия. Пациенты должны находиться под непрерывным контролем (как минимум 5 месяцев после введения последней дозы), так как нежелательные реакции, обусловленные воздействием препарата Опдиво® или ипилимумаба, могут развиться в любой момент во время применения или после отмены терапии. При подозрении на развитие иммуноопосредованной нежелательной реакции должна быть проведена адекватная оценка для подтверждения или исключения иной этиологии. Основываясь на тяжести нежелательной реакции, применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть прекращено с последующим его возобновлением или без возобновления с назначением глюкокортикостероидов.
В случае проведения иммуносупрессивной терапии глюкокортикостероидами, предназначенной для устранения нежелательных реакций, после улучшения состояния снижение дозы глюкокортикостероидов проводят медленно, в течение, по меньшей мере, 1 месяца. Быстрое снижение дозы может привести к ухудшению тяжести или рецидиву нежелательных реакций. Иммуносупрессивная терапия препаратами, отличными от глюкокортикостероидов, назначается в случае наступления ухудшения или отсутствия улучшения при применении глюкокортикостероидов.
Применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует прекратить во время получения пациентом иммуносупрессивной дозы глюкокортикостероидов или проведения другой иммуносупрессивной терапии.
Если препарат Опдиво® применяется в комбинации с ипилимумабом, перед началом лечения прочтите инструкцию по применению ипилимумаба. Оба препарата могут вызывать нежелательные реакции со стороны иммунной системы. В клинических исследованиях нежелательные реакции со стороны иммунной системы при применении ниволумаба в комбинации с ипилимумабом, возникали чаще, чем при применении ниволумаба в качестве монотерапии. Большая часть нежелательных реакций со стороны иммунной системы, при должном лечении, включая применение глюкокортикостероидов и модификацию лечения, разрешились или состояние, вызванное ими, улучшилось.
Препарат Опдиво® или препарат Опдиво® в комбинации с ипилимумабом должен быть отменен при любых рецидивирующих иммуноопосредованных нежелательных реакциях от средней до тяжёлой степени и отменен без возобновления при тяжёлом иммуноопосредованном пневмоните и иммуноопосредованном гепатите, а также жизнеугрожающих иммуноопосредованных нежелательных реакциях.
Необходимо назначение антибиотиков для профилактики развития оппортунистических инфекций у пациентов, получающих иммуносупрессивную терапию.
Пациентам с местнораспространённым или метастатическим немелкоклеточным раком лёгкого (НМРЛ) с наличием активирующих мутаций гена EGFR или транслокации ALK рекомендуется назначать терапию препаратом Опдиво® после получения ими соответствующей таргетной терапии.
Применение препарата Опдиво®у пациентов с быстрым прогрессированием меланомы
Врач должен принимать во внимание эффект отсроченного действия препарата Опдиво® при принятии решения о начале терапии у пациентов с быстро прогрессирующим заболеванием.
Иммуноопосредованный пневмонит
При терапии препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом были отмечены случаи тяжёлого пневмонита или интерстициального заболевания лёгких, включая случаи с летальным исходом. Пациенты должны наблюдаться на наличие признаков и симптомов пневмонита, таких как рентгенографические изменения (например, затемнение по типу матового стекла, очаги воспаления), одышка и гипоксия. Инфекции и связанные с заболеванием симптомы должны быть исключены.
При пневмоните 3 или 4 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует отменить без возобновления и начать приём глюкокортикостероидов в дозе, эквивалентной 2-4 мг/кг/день метилпреднизолона.
При пневмоните 2 степени тяжести (симптоматической) применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить и начать приём глюкокортикостероидов в дозе, эквивалентной 1 мг/кг/день метилпреднизолона. При наступлении улучшения применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом может быть продолжено после медленного снижения дозы глюкокортикостероидов. В случае наступления ухудшения или отсутствия улучшения, которые продолжаются несмотря на приём глюкокортикостероидов, дозу глюкокортикостероидов следует увеличить до эквивалентной 2–4 мг/кг/день метилпреднизолона, и применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть отменено без возобновления.
Иммуноопосредованный колит
При терапии препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом были отмечены случаи тяжёлой диареи или колита. Пациенты должны наблюдаться на наличие признаков диареи и дополнительных симптомов колита, таких как боль в животе, слизь или кровь в стуле. Инфекции и связанные с ними симптомы должны быть исключены. Развитие цитомегаловирусной инфекции/реактивация инфекции было отмечено у пациентов с иммуноопосредованным колитом, рефрактерным к терапии глюкокортикостероидами. Обследования на наличие инфекций (включая цитомегаловирус, прочие культуры вирусной этиологии, Clostridium difficile, простейшие и яйца глистов) должны быть выполнены при жалобах на диарею или колит для исключения инфекционной или другой альтернативной этиологии. При диарее или колите 4 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует отменить окончательно и начать приём глюкокортикостероидов в дозе, эквивалентной 1–2 мг/кг/день метилпреднизолона.
При диарее 3 степени тяжести применение препарата Опдиво® в комбинации с ипилимумабом следует отменить окончательно и начать приём глюкокортикостероидов в дозе, эквивалентной 1–2 мг/кг/день метилпреднизолона.
При диарее или колите 3 степени тяжести применение препарата Опдиво® в качестве монотерапии следует приостановить и начать приём глюкокортикостероидов в дозе, эквивалентной 1–2 мг/кг/день метилпреднизолона. При наступлении улучшения применение препарата Опдиво® в качестве монотерапии может быть продолжено после медленного снижения дозы глюкокортикостероидов. В случае наступления ухудшения или отсутствия улучшения, которые продолжаются несмотря на приём глюкокортикостероидов, применение препарата Опдиво® в качестве монотерапии должно быть отменено без возобновления.
При диарее или колите 2 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить. Персистирующую диарею или колит следует устранять при помощи введения глюкокортикостероидов в дозе, эквивалентной 0,5–1 мг/кг/день метилпреднизолона. При наступлении улучшения применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом может быть продолжено после медленного снижения дозы глюкокортикостероидов. В случае наступления ухудшения или отсутствия улучшения, которые продолжаются несмотря на приём глюкокортикостероидов, дозу глюкокортикостероидов следует увеличить до эквивалентной 1–2 мг/кг/день метилпреднизолона, и применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть отменено без возобновления.
Добавление альтернативной иммуносупрессивной терапии к глюкокортикостероидам или замену глюкокортикостероидной терапии следует рассматривать у пациентов с иммуноопосредованным колитом, рефрактерным к терапии глюкокортикостероидами, в случае, если исключены другие причины его развития (включая цитомегаловирусную инфекцию/реактивацию инфекции, подтвержденную методом ПЦР после биопсии и другую вирусную, бактериальную и паразитарную этиологию).
Иммуноопосредованный гепатит
При терапии препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом были отмечены случаи тяжёлого гепатита. Пациенты должны наблюдаться на наличие признаков и симптомов гепатита, таких как повышение активности трансаминаз и общего билирубина. Инфекции и связанные с заболеванием симптомы должны быть исключены.
При повышении активности трансаминаз и уровня общего билирубина 3 или 4 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует отменить без возобновления и начать приём глюкокортикостероидов в дозе, эквивалентной 1–2 мг/кг/день метилпреднизолона.
При повышении активности трансаминаз и уровня общего билирубина 2 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить. Персистирующий подъем уровня этих лабораторных показателей должен быть устранён при помощи введения глюкокортикостероидов в дозе, эквивалентной 0,5–1 мг/кг/день метилпреднизолона. При наступлении улучшения применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом может быть продолжено после медленного снижения дозы глюкокортикостероидов. В случае наступления ухудшения или отсутствия улучшения, которые продолжаются несмотря на приём глюкокортикостероидов, дозу глюкокортикостероидов следует увеличить до эквивалентной 1–2 мг/кг/день метилпреднизолона, и применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть отменено без возобновления.
Контроль повышенной активности трансаминазу пациентов с гепатоцеллюлярным раком
У пациентов с гепатоцеллюлярным раком применение ниволумаба следует временно приостановить или отменить без возобновления на основании следующих критериев и начать приём глюкокортикостероидов в дозе, эквивалентной 1–2 мг/кг/день метилпреднизолона:
- при активности трансаминаз от > 1 до 3 × ВГН в начале лечения с повышением в течение лечения от >5 до 10 × ВГН — применение ниволумаба следует приостановить.
- при активности трансаминаз от >3 до 5 × ВГН в начале лечения с повышением в течение лечения от >8 до 10 × ВГН — применение ниволумаба следует приостановить.
- независимо от активности трансаминаз в начале лечения — при повышении в течение лечения активности трансаминаз до >10 × ВГН или повышении уровня общего билирубина 3 или 4 степени тяжести — применение ниволумаба следует отменить без возобновления.
Иммуноопосредованные нефрит и почечная дисфункция
При терапии препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом были отмечены случаи тяжелого нефрита и почечной дисфункции, поэтому пациенты должны наблюдаться на наличие их признаков и симптомов. У большинства пациентов отмечено бессимптомное повышение сывороточного креатинина. Должна быть исключена этиология, связанная с заболеванием.
При повышении уровня сывороточного креатинина 4 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует отменить окончательно и начать приём глюкокортикостероидов в дозе, эквивалентной 1–2 мг/кг/день метилпреднизолона.
При повышении уровня сывороточного креатинина 2 или 3 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить и начать приём глюкокортикостероидов в дозе, эквивалентной 0,5–1 мг/кг/день метилпреднизолона. При наступлении улучшения применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом может быть продолжено после медленного снижения дозы глюкокортикостероидов. В случае наступления ухудшения или отсутствия улучшения, которые продолжаются несмотря на приём глюкокортикостероидов, дозу глюкокортикостероидов следует увеличить до эквивалентной 1–2 мг/кг/день метилпреднизолона и применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть отменено без возобновления.
Иммуноопосредованная эндокринопатия
При терапии препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом были отмечены случаи тяжёлой эндокринопатии, включая гипотиреоз, гипертиреоз, недостаточность коры надпочечников (включая вторичную недостаточность коры надпочечников), гипофизит (включая гипопитуитаризм), сахарный диабет и диабетический кетоацидоз.
Пациенты должны наблюдаться на наличие признаков и симптомов эндокринопатий и изменения функции щитовидной железы (в начале лечения, периодически во время лечения и основываясь на клинической оценке). У пациентов может отмечаться утомляемость, головная боль, изменение психического состояния, боль в животе, необычный ритм работы кишечника и гипотензия или неспецифические симптомы, которые могут иметь сходство с другими состояниями, такими как метастазы в головной мозг или сопутствующие заболевания. В случае отсутствия выявления иной этиологии, признаки и симптомы эндокринопатий должны считаться иммуноопосредованными.
При симптоматическом гипотиреозе применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить и, в случае необходимости, провести заместительную терапию гормонами щитовидной железы. При симптоматическом гипертиреозе применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить и, в случае необходимости, провести терапию антитиреоидными препаратами. В случае острого тиреоидита должны назначаться глюкокортикостероиды в дозе, эквивалентной 1 — 2 мг/кг/день метилпреднизолона. При наступлении улучшения применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом может быть продолжено после медленного снижения дозы глюкокортикостероидов. Необходимо продолжать наблюдение за функцией щитовидной железы для контроля адекватности проводимой заместительной гормональной терапии гормонами щитовидной железы. При развитии жизнеугрожающего (4 степени тяжести) гипертиреоза и гипотиреоза применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть отменено.
При симптоматической недостаточности коры надпочечников 2 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить и, в случае необходимости, провести физиологическое замещение глюкокортикостероидов. При тяжелой (3 степени тяжести) или жизнеугрожающей (4 степени тяжести) недостаточности коры надпочечников применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует отменить окончательно. Необходимо продолжать наблюдение за функцией надпочечников и уровнем гормонов для контроля адекватности проводимой заместительной терапии глюкокортикостероидами.
При симптоматическом гипофизите 2–3 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить и провести, в случае необходимости, гормонозаместительную терапию. В случае острого гипофизита назначаются глюкокортикостероиды в дозе, эквивалентной 1–2 мг/кг/день метилпреднизолона. При наступлении улучшения применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом может быть продолжено после медленного снижения дозы глюкокортикостероидов. При жизнеугрожающем гипофизите 4 степени терапия препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом должна быть отменена окончательно. Необходимо продолжать наблюдение за функцией гипофиза и уровнем гормонов для контроля адекватности проводимой гормонозаместительной терапии.
При симптоматическом диабете применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить и провести, в случае необходимости, заместительную терапию инсулином. Необходим мониторинг уровня сахара в крови для контроля адекватности проводимой заместительной терапии инсулином. При развитии жизнеугрожающего диабета 4 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть отменено окончательно.
Иммуноопосредованные кожные реакции
При терапии препаратом Опдиво® были отмечены случаи развития тяжёлой формы сыпи. При терапии препаратом Опдиво® в комбинации с ипилимумабом тяжёлые формы сыпи развивались чаще. Применение ниволумаба или ниволумаба в комбинации с ипилимумабом следует приостановить при сыпи 3 степени тяжести и отменить без восстановления при 4 степени тяжести. При сыпи тяжёлой степени назначается лечение глюкокортикостероидами в дозе, эквивалентной 1–2 мг/кг/день метилпреднизолона.
Препарат Опдиво® или препарат Опдиво® в комбинации с ипилимумабом следует назначать с осторожностью у пациентов, у которых ранее отмечались тяжёлые или жизнеугрожающие нежелательные кожные реакции при лечении иными иммуностимулирующими противоопухолевыми препаратами.
Наблюдались редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза, некоторые из них со смертельным исходом. При возникновении симптомов или признаков синдрома Стивенса-Джонсона и токсического эпидермального некролиза, применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить, а пациента необходимо перевести в специализированное отделение для мониторинга состояния и лечения. При подтверждённом синдроме Стивенса-Джонсона и токсическом эпидермальном некролизе, пациенту рекомендуется полное прекращение применения препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом.
Иммуноопосредованный энцефалит
При терапии препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом были отмечены случаи иммуноопосредованного энцефалита при отсутствии ясной альтернативной этиологии. Обследование пациентов с неврологическими симптомами может включать консультацию невролога, МРТ головного мозга и люмбальную пункцию (но не ограничиваться ими).
Применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить у пациентов с впервые возникшими неврологическими признаками или симптомами умеренной или тяжёлой степени и провести обследование для исключения инфекции или других причин неврологических нарушений умеренной или тяжёлой степени. При исключении другой этиологии энцефалита, пациентам с иммуноопосредованным энцефалитом следует назначить кортикостероиды в дозе, эквивалентной 1–2 мг/кг/день преднизона, с последующим постепенным снижением дозы глюкокортикостероидов. При развитии иммуноопосредованного энцефалита препарат Опдиво® или препарат Опдиво® в комбинации с ипилимумабом следует полностью отменить.
Иные иммуноопосредованные нежелательные реакции
Следующие иммуноопосредованные нежелательные реакции были отмечены у менее 1 % пациентов, получавших лечение препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом во время проведения клинических исследований при любом дозировании и типе опухоли: панкреатит, увеит, ирит, ревматическая полимиалгия, демиелинизация, аутоиммунная нейропатия (включая парез лицевого и отводящего нервов), синдром Гийена-Барре, гипопитуитаризм, синдром системного воспалительного ответа, миастенический синдром, энцефалит, гастрит, саркоидоз, дуоденит, двигательная дисфункция, миозит, миокардит, рабдомиолиз, лимфаденит Кикучи, васкулит, апластическая анемия, перикардит. В пострегистрационных наблюдениях во время терапии препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом были отмечены случаи развития синдрома Фогта-Коянаги-Хорада.
При подозрении на иммуноопосредованные нежелательные реакции должна быть проведена адекватная оценка для подтверждения их этиологии или исключения иных причин их появления. Исходя из тяжести нежелательной реакции, применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом следует приостановить и начать терапию глюкокортикостероидами. При наступлении улучшения приём препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом может быть продолжен после медленного снижения дозы глюкокортикостероидов. Препарат Опдиво® или препарат Опдиво® в комбинации с ипилимумабом должен быть отменен без возобновления при проявлении любых рецидивирующих тяжелых иммуноопосредованных нежелательных реакций и любых жизнеугрожающих иммуноопосредованных нежелательных реакций.
При применении препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом отмечались случаи миотоксичности (миозит, миокардит, рабдомиолиз), некоторые со смертельным исходом.
Ввиду того, что в некоторых случаях миокардит может протекать бессимптомно, диагностика миокардита требует высокого индекса клинического подозрения. В связи с этим, пациенты с сердечными или сердечно-легочными симптомами должны пройти неотложное диагностическое обследование для оценки наличия миокардита при тщательном мониторинге. Тропонин является чувствительным, но не диагностическим маркёром миокардита. При подозрении на миокардит безотлагательно начинают лечение высокими дозами глюкокортикостероидов (преднизолоном в дозе 1–2 мг/кг/день или метилпреднизолоном в дозе 1–2 мг/кг/день), и проводят срочную консультацию кардиолога с диагностическим обследованием, включающим электрокардиографию, тропонин и эхокардиографию. Исходя из заключения кардиолога, может понадобиться дополнительное исследование, включающее кардиальную магнитную резонансную томографию. В случае постановки диагноза, применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть приостановлено. При миокардите 3 степени тяжести применение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть прекращено (см. также Таблицу 1 в разделе «Способ применения и дозы»).
Отторжение трансплантата солидного органа было отмечено в пострегистрационных наблюдениях у пациентов, получавших терапию PD-1/PD-L1 ингибиторами. Лечение препаратом Опдиво® может увеличивать риск отторжения у реципиентов трансплантата солидного органа.
Внезапно возникающие и тяжёлые реакции «трансплантат против хозяина» (ТПХ), иногда с летальным исходом, были отмечены в пострегистрационных наблюдениях у пациентов, перенёсших аллогенную трансплантацию стволовых клеток и впоследствии получавших PD-1/PD-L1 ингибиторы.
Осложнения аллогенной трансплантации гемопоэтических стволовых клеток (ТГСК) после лечения ингибиторами PD-1/PD-L1
Применение ингибиторов PD-1/PD-L1, включая ниволумаб, назначаемых перед аллогенной трансплантацией гемопоэтических стволовых клеток (ТГСК), может ассоциироваться с повышенным риском связанных с трансплантацией осложнений, включая реакцию ТПХ. Случаи летального исхода были отмечены в рамках клинических исследований. Необходимо осуществлять тщательный мониторинг пациентов для выявления признаков осложнений, связанных с трансплантацией, на ранних этапах.
Инфузионные реакции
Во время клинических исследований отмечались случаи тяжелых инфузионных реакций. В случае развития тяжёлых или жизнеугрожающих инфузионных реакций, введение препарата Опдиво® или препарата Опдиво® в комбинации с ипилимумабом должно быть прекращено с назначением соответствующей лекарственной терапии. Пациенты с лёгкой или умеренной инфузионной реакцией могут продолжать терапию препаратом Опдиво® или препаратом Опдиво® в комбинации с ипилимумабом под непрерывным наблюдением и проведением премедикации в соответствии с действующими стандартами профилактики инфузионных реакций.
Пациенты на диете с контролируемым содержанием натрия
Каждый миллилитр лекарственного препарата Опдиво® содержит 0,1 ммоль (или 2,5 мг) натрия, что должно учитываться при лечении пациентов, находящихся на диете с контролируемым содержанием натрия.
Влияние на способность управлять транспортными средствами, механизмами
Ввиду возможного появления нежелательных реакций, таких как утомляемость, пациентам следует воздерживаться от вождения автотранспорта и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, в период лечения препаратом Опдиво® до установления факта, что данные побочные реакции у них отсутствуют.
Форма выпуска
Концентрат для приготовления раствора для инфузий 10 мг/мл.
По 4 мл или 10 мл во флакон прозрачного бесцветного стекла типа I, герметично закрытый бутилрезиновой пробкой и алюминиевым колпачком с защитной пластиковой крышкой.
По 1 флакону вместе с инструкцией по применению помещают в пачку картонную.
Хранение
Хранить при температуре от 2 до 8 °C в защищённом от света месте.
Не замораживать. Не встряхивать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять препарат по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Препарат Опдиво
Лекарственный препарат группы моноклональных антител, назначаемый для борьбы со злокачественными новообразованиями. Останавливает рост опухоли и предупреждает ее метастазирование. То есть, не дает распространяться раковым клеткам в другие органы и системы.
Характеристика
Уникальный иммуноонкологический препарат, созданный для лечения разных видов злокачественных опухолей. Опдиво – это продажное название препарата ниволумаб. На данный момент средство одобрено для лечения:
- Меланомы.
- Рака легких.
- Почек.
- Других онкопатологий.
На разнообразных тематических конференциях и во врачебной практике онкологи отмечают хорошие результаты от применения препарата. Он – это новейшая разработка в иммунотерапии, его действие абсолютно уникально, так как стимулирует иммунный ответ организма.
Во многих странах велось активное исследование эффективности данного препарата для разных видов рака. А в 2018 году за открытие эффекта иммунотерапии Джеймсу Аллисону и Тасуко Хондзе присудили Нобелевскую премию в сфере медицины.
Механизм воздействия
Опдиво – это моноклональныое антитело. Его воздействие основано на способности ниволумаба подавлять активность PD-1. Они принимают участие в ингибировании функции Т-линфоцитов, которые отвечают за обнаружение и уничтожение чужеродных клеток в организме. Действующее вещество способно усиливать ответ Т-клеток, в том числе противоопухолевый. За счет этого происходит блокировка механизма связывания PD-1 с лигандами PD-L1 и PD-L2.
Схема приема
Лечение назначается только врачом, он же принимает решение, касательно дозировки. В инструкции по применению четко указано, что стандартная дозировка составляет 3 мг на 1 кг массы тела пациента.
Введение препарата проводится через внутривенные инъекции, длительно, капельно. Периодичность применения – каждые 2 недели (14 суток). Общее количество необходимых для пациента курсов определяет лечащий врач.
Введение препарата в монотерапии или в комбинации с ипилимумабом длиться пока не будет клинического ответа у пациента или не возникнет непереносимости средства. Снижение или увеличение дозы не рекомендовано. Если существует риск возникновения непереносимости или в целях безопасности препарат могут отсрочить на определенное время.
В 2016 году были внесены изменения в информацию, касательно дозировки при лечении ряда болезней, таких как:
- Метастатическая меланома.
- Немелкоклеточный рак легкого.
- Почечно-клеточная карцинома.
Изменения коснулись раздела о способах применения и допустимых дозах. Так вместо ранее утвержденных 3 мг/кг веса, внутривенно каждые 2 недели, рекомендовали применять в дозе 240 мг внутривенной также каждые 2 недели.
Действенность
На данный момент ведутся изучения эффективности действующего вещества препарата и безопасности его. По результатам, которые уже есть – отмечены высокие показатели выживаемости без прогрессирования. Препарат вызывает объективный ответ у онкобольных, которым он прописан. Полученные результаты дают надежду на излечение пациентам, что на 100% оправдывает его цену.
Показания
- Лечение распространенной (нерезектабельной или метастатической меланомы у взрослых пациентов в качестве монотерапии или в комбинации с препаратом Ервой (ипилимумаб).
- Местно распространенный или метастатический немелкоклеточный рак легкого после ранее проведенной химиотерапии у взрослых пациентов.
- Монотерапия распространенного почечно-клеточного рака после ранее проведенной терапии у взрослых.
- Лечение рецидивирующей или рефрактерной классической ходжкинской лимфомы после аутологичной трансплантации стволовых клеток и лечения брентуксимаба ведотином.
Среди противопоказаний возраст менее 18 лет, беременность и лактация, гиперчувствительность к компонентам.
Особенности поведения на период лечения
Врач на протяжении всего курса лечения наблюдает за пациентом. При этом отслеживаются возможные побочные реакции со стороны легких и сердца. Возможны лабораторные отклонения со стороны нарушения электролитного баланса и обезвоживания. Эти моменты также тщательно контролируются врачом. В период лактации возможно воздействие на организм новорожденного через молоко, поэтому при необходимости проводить терапию в это период важно получить консультацию у опытного онколога.
Есть вероятность, хотя и минимальная, что данное лекарство от рака окажет влияние на способность управления механическими средствами. Но все же нужно с осторожностью отнестись к управлению транспортными средствами и садиться за руль только если нет отрицательного влияния на концентрацию влияния.
Если до назначения и начала приема пациент придерживался диеты с низким содержанием натрия (соли) то нужно сообщить об этом врачу. В препарате содержится 2,5 мг натрия на 1 мл концентрата.
Возможные побочные эффекты
Как и у любого препарата для лечения злокачественных новообразований у Опдиво они тоже есть, среди самых распространенных:
- Утомляемость.
- Сыпь на коже, зуд.
- Крапивница, гипермия, сухость кожи.
- Расстройство кишечника, боли в животе.
- Тошнота, рвота иногда.
- Ухудшение аппетита.
- Анемические проявления, тромбоцитопения, лейкопения.
- Повышение температуры тела, озноб.
- Боли в мышцах, суставах.
- Нарушение функций печени.
- Депигментация кожи.
- Снижения массы тела.
- Патологии щитовидной железы.
- Нарушения метаболизма.
- Воспаление легких.
- Мышечные спазмы.
- Кашель, одышка.
- Головные боли.
- Нарушение чувствительности в дистальных отделах конечностей.
- Изменение восприятия вкусовых ощущений.
- Выраженная нестабильность артериального давления.
- Повышенная чувствительность кожи к УФ-излучению.
- Нарушение функции глотания, изжога.
Побочные эффекты
В случае приема препарата, как правило, наблюдались иммуно-опосредованные побочные эффекты. Большая их часть, в том числе тяжелые, прекращались посредством соответствующего лечения либо отменой лекарственного средства.
Согласно клиническим исследованиям с использованием препарата в виде монотерапии в дозировке 3 мг/кг по типам новообразований, самыми частыми негативными реакциями являлись утомляемость, появление кожных высыпаний, а также возникновение зуда, диареи, тошноты и ухудшение аппетита. В большинстве случаев побочные действия проявлялись от легкой до средней степени.
Особые указания
Лекарственное средство способно вызывать тяжелые, включая летальные, побочные действия, которые вызваны влиянием на иммунитет и зависят от специфического механизма его эффекта. Над пациентами должен осуществляться непрерывный контроль, поскольку негативные реакции, которые обусловлены воздействием препарата, могут появиться в любое время при приеме или после отмены лечения. В случае подозрения на развитие иммуно-опосредованной отрицательного действия необходимо провести адекватную оценку с целью подтверждения либо исключения другой этиологии. Учитывая тяжесть нежелательной реакции, использование медицинского препарата необходимо прекратить с возобновлением либо без него, но с назначением глюкокортикостероидов.
При проведении иммуносупрессивного лечения глюкокортикостероидами, предназначенными для избавления от нежелательных реакций, после того, как улучшится состояние пациента, снижать дозу глюкокортикостероидов нужно медленно, в течение минимум 30 дней. Быстрое уменьшение дозы способствует ухудшению тяжести либо рецидиву нежелательных эффектов.
Иммуносупрессивное лечение препаратами, которые отличаются от глюкокортикостероидов, назначают при наступлении ухудшения либо на фоне отсутствия улучшения при приеме глюкокортикостероидов.
Применение препарата необходимо прекратить при получении пациентом иммуносупрессивной дозы глюкокортикостероидов либо проведении иммуносупрессивной терапии. Кроме того, препарат требуется отменить в случае любых рецидивирующих иммуно-опосредованных нежелательных реакций от средней до тяжелой стадии и отменить без возобновления, если развивается тяжелый иммуно-опосредованный пневмонит и иммуноопосредованный гепатит, а также иммуно-опосредованные нежелательные реакции.
Использование препарата у пациентов с быстрым прогрессированием меланомы. Врачи обсуждают эффект отсроченного действия до начала терапии.
Иммуно-опосредованный пневмонит
В ходе лечения препаратом отмечаются случаи тяжелого пневмонита либо интерстициальной патологии легких, в том числе случаи со смертельным исходом. Пациентов наблюдают на наличие проявлений пневмонита, таких как изменения на рентгенографии (к примеру, затемнения по типу матового стекла, воспалительные очаги), одышка и гипоксия. Инфекции и связанные с недугом признаки необходимо исключить.
В случае 3 или 4 стадии развития пневмонита прием препарата отменяется без возобновления и начинается применение глюкокортикостероидов в дозе, соответствующей 2-4 мг/кг/день метилпреднизолона.
В случае 2 степени тяжести (симптоматической) пневмонита прием ЛС приостанавливается и назначается прием глюкокортикостероидов в дозе, которая эквивалентна 1-2 мг/кг/день метилпреднизолона. Если отмечается улучшение, то прием препарата возобновляется после медленного уменьшения дозы глюкокортикостероидов. При возникновении ухудшений или отсутствии улучшения, которые наблюдаются, несмотря на применение глюкокортикостероидов, дозу последних нужно увеличить до той, что будет равна 2-4 мг/кг/день метилпреднизолона, и прием ниволумаба должен быть отменен без возобновления.
Иммуно-опосредованный колит
При лечении данным препаратом отмечаются случаи сильной диареи или колита. Пациентов наблюдают на наличие симптомов диареи и дополнительных проявлений колита, например, боли в животе, слизи или крови в кале. Инфекции и связанные недугом проявления необходимо исключить.
В случае 4 стадии развития диареи или колита прием лекарства отменяется полностью и начинается применение глюкокортикостероидов в дозе, равной 1-2 мг/кг/день метилпреднизолона.
Если у пациента 3 степень тяжести диареи или колита, прием ниволумаба приостанавливается и начинается прием глюкокортикостероидов в дозе, равной 1-2 мг/кг/день метилпреднизолона. В случае появления улучшения прием препарата продолжается после медленного уменьшения дозы глюкокортикостероидов. При наступлении ухудшения либо отсутствии улучшения, продолжающихся, несмотря на употребление глюкокортикостероидов, прием ЛС должен быть отменен без возобновления.
В случае 2 стадии тяжести диареи либо колита прием медицинского препарата нужно приостановить.
Иммуно-опосредованный гепатит
При лечении препаратом отмечаются случаи сильного гепатита. Пациенты наблюдаются на наличие проявлений и симптоматики гепатита, таких как увеличение уровня трансаминаз и общего билирубина. Инфекции и связанные с недугом проявления следует исключить.
В случае увеличения уровня трансаминаз и общего билирубина прием препарата нужно отменить без возобновления и начать применение глюкокортикостероидов в дозе, равной 1 — 2 мг/кг/день метилпреднизолона.
В случае 2 степени тяжести увеличения концентрации трансаминаз и общего билирубина использование лекарства нужно приостановить. Персистирующий подъем уровня таких лабораторных результатов устраняется посредством введения глюкокортикостероидов в дозе, равной 1 — 2 мг/кг/день метилпреднизолона. Если наступает улучшение, прием ниволумаба может быть продолжен после медленного уменьшения дозы глюкокортикостероидов.
Иммуно-опосредованные нефрит и почечная дисфункция
При терапии препаратом были отмечены случаи тяжелого нефрита или почечной дисфункции, поэтому пациенты должны наблюдаться на наличие их признаков и симптомов. У большинства пациентов отмечено бессимптомное повышение сывороточного креатинина. Должна быть исключена этиология, связанная с заболеванием.
При 4 степени тяжести увеличения уровня сывороточного креатинина прием препарата нужно прекратить окончательно и начать применение глюкокортикостероидов в дозе, соответствующей I — 2 мг/кг/день метилпреднизолона.
Если у пациента отмечается 2 или 3 степень тяжести увеличения уровня сывороточного креатинина, прием ЛС стоит приостановить и начать применение глюкокортикостероидов в дозе, равной 0, 5 — 1 мг/кг/день метилпреднизолона. В случае наблюдения улучшения прием ниволумаба может быть продолжен после постепенного уменьшения дозы глюкокортикостероидов. При ухудшении или отсутствии улучшения, которые отмечаются, невзирая на применение глюкокортикостероидов, дозу последних стоит увеличить до равной I — 2 мг/кг/день метилпреднизолона, и прием ниволумаба должен быть отменен окончательно.
Иммуно-опосредованная эндокринопатия
Во время лечения препаратом отмечаются признаки сильной эндокринопатии, в том числе гипотиреоза, гипертиреоза, недостаточности коры надпочечников, гипофизита, сахарного диабета и диабетического кетоацидоза.
Пациенты наблюдаются на наличие симптоматики эндокринопатий и изменения работы щитовидной железы. Многие жалуются на усталость, головную боль, изменение настроения, болезненность в животе, необычного ритма работы ЖКТ и гипотонии или на неспецифические реакции, которые могут напоминать другие состояния, такие как метастазы в головной мозг или сопутствующие недуги.
При симптоматическом гипотиреозе прием лекарства стоит приостановить и при необходимости выполнить заместительную терапию гормонами щитовидной железы. В случае развития симптоматического гипертиреоза прием Опдиво нужно приостановить, и при необходимости принимать антитиреоидные препараты.
В случае симптоматической недостаточности коры надпочечников второй степени прием ниволумаба нужно приостановить и при необходимости назначить физиологическое замещение глюкокортикостероидов. Если наблюдается симптоматическая недостаточность коры надпочечников 3-4 степени, прием препарата отменяется без возобновления и при необходимости проводится физиологическое замещение глюкокортикостероидов.
При диагнозе «симптоматический гипофизит 2-3 степени» прием нужно приостановить и выполнить в случае необходимости гормонозаместительное лечение. При остром гипофизите назначаются глюкокортикостероиды в дозе, равной 1 — 2 мг/кг/день метилпреднизолона. При наступлении улучшения применение может быть продолжено после медленного снижения дозы глюкокортикостероидов. При симптоматическом гипофизите 4 стадии лечение ниволумабом должно быть отменено окончательно. Требуется продолжать наблюдение за работой гипофиза и уровнем гормонов для контроля адекватности выполняемой гормонозаместительной терапии.
Иммуно-опосредованная сыпь
При лечении отмечаются случаи тяжелой формы сыпи (в том числе редкие случаи смертельного токсического эпидермального некролиза), основанные на иммуно-опосредованной природе. Прием стоит закончить в случае возникновения сыпи 3 степени тяжести и прекратить окончательно при 4 степени тяжести. При сыпи тяжелой стадии врач назначает терапию глюкокортикостероидами в дозе, которая равна 1 — 2 мг/кг/день метилпреднизолона.
Препарат стоит осторожно назначать пациентам, у которых до этого отмечались тяжелые либо жизнеугрожающие нежелательные кожные проявления при терапии другими иммуностимулирующими противоопухолевыми ЛС.
Инфузионные реакции
В ходе клинических исследований наблюдались тяжелые инфузионные реакции. При их развитии введение препарата Опдиво необходимо прекратить с назначением соответствующего лекарственного лечения. Если у пациента отмечается легкая или умеренная инфузионная реакция, можно продолжать терапию Опдиво под непрерывным контролем и выполнением премедикации согласно действующим стандартам профилактики инфузионных реакций.
Каждый миллилитр лекарственного препарата включает 0, 1 ммоль (или 2, 5 мг) натрия, что необходимо учитывать при терапии пациентов, которые находятся на диете с контролируемым содержанием натрия.
Влияние на способность управлять автомобилем и другими транспортными средствами и механизмами
Из-за вероятного возникновения нежелательных реакций, к которым относится утомляемость, пациентам нужно воздерживаться от вождения автомобиля и потенциально опасных видов деятельности, которые требуют повышенной концентрации внимания и стремительности психомоторных реакций в ходе лечения препаратом до установления факта, что такие побочные эффекты у них не отмечаются.
Возможность лечения других форм рака
Лечение других форм рака кроме изложенных выше возможно для:
- Рака желудка.
- Рецидивирующего или метастатического плоскоклеточного рака головы и шеи.
- Метастатической уротелиальной карциномы.
На данный момент продолжаются исследования в отношении эффективности при монотерапии или в сочетании с другими препаратами химиотерапии.
Взаимодействие с другими препаратами
Ниволумаб – это человеческое моноклональное антитело, поэтому исследование касательно его фармакокинетического воздействия не проводились. На моноклональные антитела, которые не метаболизируются ферментами Р450 (CYP) ферментами, метаболизирующими лекарственные средства, сопутствующее применение Опдиво с другими подобными препаратами не повлияет на его эффективность.
При этом следует избегать одновременного приема с системными кортикостероидами и другими иммуносупрессантами. Они способны повлиять на фармакодинамику. Но возможно применение для лечения побочных реакций со стороны иммунитета.
Условия хранения
Хранить необходимо в холодильнике при температуре +2+8 градусов, не замораживать. Хранение должно осуществляться в оригинальной упаковке. Во время хранения и транспортировки не встряхивать флакон.
Есть ли аналоги и заменители?
На данный момент в Опдиво нет зарегистрированных аналогов или заменителей. Но по этому направлению активно ведутся исследования и проводятся разработки.
Инструкция по применению
Вводится только под наблюдением врача, который имеет опыт лечения онкологических заболеваний. Применяется взрослым в дозе – 3 мг/кг массы тела. Введение осуществляется в виде 60-минутной внутривенной инфузии. Раствор для инфузии готовится в асептических условиях. Кратность приема – каждые 2 недели.
Количество курсов зависит от отклика организма пациента. Каждую очередную порцию препарата врач назначает, пока не обнаружится клинический ответ или не появятся первые признаки непереносимой токсичности.
Не рекомендовано повышение или уменьшение дозы. Задержка или отмена может быть связана с индивидуальной безопасностью или переносимостью средства.
