Метиленовый синий и другие красители в микроскопии
Как приготовить образец для изучения в микроскопе?
Для изучения микроорганизмов производят микроскопирование как живых, так и убитых микробов в неокрашенном и окрашенном виде.
Микроскопический препарат готовят на предметном стекле. Предметные стекла должны быть кристально чисты и абсолютно обезжирены. На поверхности обезжиренного стекла вода легко расплывается и не образует капель шаровидной формы.
Новые стекла перед употреблением кипятят в 1%-ном растворе соды 10 минут, промывают водой, слабой соляной кислотой и хорошо прополаскивают в дистиллированной воде. 
Дочерние и родовые шрамы на поверхности дрожжевых клеток.
Стекла после исследования надо обработать раствором серной кислоты в течение 2 часов, хорошо промыть в воде и прокипятить 10 минут в 4%-ном растворе соды. Ополоснутые затем дистиллированной водой стекла протирают чистой полотняной тканью.
Хранить предметные стекла лучше всего в банке с притертой пробкой, погруженными в смесь спирта с эфиром, взятых в равных объемах. Из банки предметные стекла достают пинцетом.
Покровные стекла — тонкие стеклышки (толщиной 0,15-0,17 мм) размерами обычно 18х18 мм, 20х20 мм, 18х24 мм. Ими накрывают препарат на предметном стекле для изучения.
Как приготовить раствор метиленового синего
Физиологический раствор натрия хлорида с метиленовым синим: метиленовый синий 0,1 г; физиологический раствор натрия хлорида -100,0 мл. Отвешивают указанное выше количество метиленового синего и помещают его в чистую бутылку. Прибавляют физиологический раствор натрия хлорида и тщательно перемешивают до полного растворения кристаллов краски. Для работы фильтруют небольшое количество раствора краски в капельницу.
Техника приготовления краски из сухого порошка. Некоторое количество порошка малахитового зеленого или метиленового синего растирают пестиком в чистой сухой ступке. Отвешивают 3 г порошка краски, насыпают его в бутылку и прибавляют дистиллированную воду, чтобы получилось 100 мл раствора. Для приготовления рабочего раствора наливают 1 мл одного из полученных выше 3%-х водных растворов краски в бутылочку емкостью 250 мл. Прибавляют 100 мл глицерина и 100 мл дистиллированной воды; перед использованием раствор тщательно перемешивают.
Где взять метиленовый синий?

Коврик, скальпель, метиленовый синий.
Если у вас домашний микроскоп, возникает вопрос, где брать препараты?
Всё очень просто: этот препарат продаётся в магазинах, он используется в аквариумистике. Смотрите на фото. Также для приготовления препаратов для микроскопа пригодится скальпель и коврик для резки (безопасный, вы не будете царапать под ним стол, он самовосстанавливающийся).
На фото — коврик для резки, скальпель и бутылочка метиленового синего. Всё приобретено в самом обычном (не специализированном) интернет-магазине.

Метиленовый синий — это ещё и кондиционер для аквариумной воды, стоит он буквально копейки.

Метиленовый синий для аквариумной воды, описание.

Инструкция к скальпелю, от Maped.

Безопасный коврик для резки удобен для работы со скальпелем.
Исследование микроорганизмов в живом виде
Плесневые грибы и дрожжи лучше рассматривать в живом виде в препарате «раздавленная капля». Клетки этих микроорганизмов относительно крупные, обычно при микроскопировании в живом виде хорошо выявляются их форма, размеры, детали внутреннего строения, характер размножения (почкование, деление, спорообразование и т.д.).
Бактерии чаще рассматривают в мертвом виде на фиксированных окрашенных препаратах (из-за их малого размера). При этом мы получаем более ясное представление о форме и размерах клеток, о способности их к спорообразованию.
В живом виде в «раздавленной капле» бактерии рассматривают в том случае, когда выясняют их способность к движению.
При микроскопировании дрожжей в каплю жидкости на стекле добавляют петлей небольшое количество метиленовой сини (до голубого окрашивания) и эту смесь тщательно размешивают. Окраска живых дрожжей метиленовой синью применяется для того, чтобы выявить мертвые клетки, легко окрашивающиеся в синий цвет. Живые клетки остаются неокрашенными, так как не пропускают краску через свою оболочку.
Приготовленный на предметном стекле препарат дрожжей накрывают покровным стеклом и рассматривают с объективом 40Х. В таком препарате обычно хорошо видны прозрачные овальные или круглые клетки дрожжей с ядрами и оболочками, которые хорошо заметны в клетках живых дрожжей. Мертвые клетки, как правило, более мелкие по сравнению с живыми и окрашены в синий цвет.
Окраска дрожжей метиленовым синим
Наибольшее распространение получил метод выявления мертвых клеток с помощью метиленового синего. После попадания в клеточную цитоплазму под действием ферментов редуктаз этот краситель восстанавливается живыми дрожжевыми клетками до бесцветных соединений. Мертвые клетки окрашиваются в синий цвет. Эффективность данного метода зависит не только от состояния клеточной мембраны, но и от активности оксидоредуктаз в клетке.
Окраска клеток метиленовым синим и сафранином
Более полную информацию о физиологическом состоянии дрожжей дает окрашивание фиксированных препаратов метиленовым синим, танином и сафранином. Сафранин применяется для выявления клеточных ядер, которые окрашиваются в красный цвет. Если клетки живые и содержат оксидоредуктазы, расщепляющие метиленовый синий, то окрашенный препарат приобретает красноватый, а не фиолетовой оттенок.
Реактивы: краситель метиленовый синий; краситель сафранин; 5 %-й раствор танина в воде; физиологический раствор (0,9 %-й раствор NaCl). 
Нанести каплю суспензии дрожжей на обезжиренное мылом предметное стекло. Оставить высыхать на воздухе при комнатной температуре. После высыхания капли зафиксировать препарат (10 раз провести стеклом в пламени спиртовки). Нагревать несильно, не пережигать. Залить стекло раствором метиленового синего и выдержать в течение 4 минут при комнатной температуре. Смыть краситель теплой водой. Залить стекло свежеприготовленным раствором танина на 2 минуты. Смыть краситель под струей воды. Залить на 16 минут стекло раствором сафронина. Смыть краситель. Микроскопирование следует проводить нефлюоресцирующим маслом при увеличении 400х.
Препарат живых бактерий
Препарат живых бактерий готовится подобно препарату дрожжей, но бактерии можно рассматривать и без добавления краски. Препарат рассматривается с иммерсионным объективом 90 X, лучше всего в затемненном поле (т.е. с прикрытой диафрагмой). Если культура бактерий подвижная, то хорошо видны быстрые разнохарактерные движения отдельных клеток.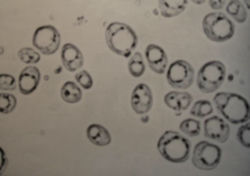
Морфология голодных и старых клеток (фотоувеличение 400х).
Для приготовления препарата плесневых грибов очень осторожно (чтобы не разрушить органов спороношения) специальной иглой (можно препаровальной) или ботаническим пинцетом снимают кусочек пленки гриба и переносят его в каплю воды, предварительно нанесенную на предметное стекло. Препарат осторожно, слегка придавливая, накрывают покровным стеклом и рассматривают под микроскопом с объективом 8Х. При этом увеличении хорошо различается строение органов спороношения плесневых грибов. Для подробного изучения отдельных деталей строения (гиф, сумок и т.д.) препарат рассматривают с объективом 40X.
При приготовлении препаратов в раздавленной капле нужно помнить :
1. При опускании покровного стекла на каплю следует прикоснуться его ребром к краю капли и, постепенно наклоняя, опустить стекло.
2. Капля не должна быть большой, чтобы жидкость не переливалась за края и не попадала на верхнюю сторону покровного стекла. Избыток воды снимите фильтровальной бумагой.
3. Одиночные пузырьки воздуха, оставшиеся под покровным стеклом, обычно не мешают наблюдению. Но если их много, препарат лучше приготовить заново.
4. Препарат не должен быть слишком густым, чтобы микроорганизмы не заслоняли друг друга.
5. Приготовленные препараты рассматривают тут же после приготовления (особенно живых бактерий), так как в иначе вода высыхает и клетки бактерий теряют подвижность.
6. Бактериологическую петлю (или иглу) перед каждым очередным пассажем и после него (нанесение капли воды на стекло, снятие культуры с агара и ее размешивание, взятие краски и т.д.) следует обязательно докрасна прокаливать в пламени горелки. После прокаливания петлю быстро охлаждают на воздухе (держат 2-3 секунды, ни к чему не прикасаясь) и приступают к выполнению очередного этапа работы.
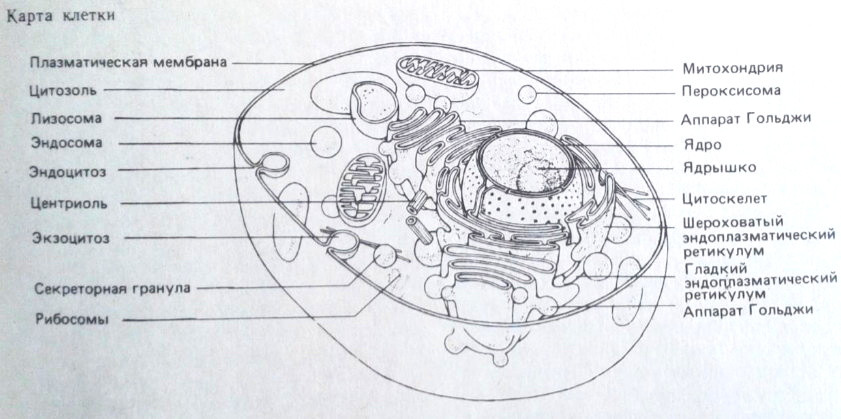
Морфологическая модель клетки.
Простая окраска препаратов
При простой окраске препаратов на фиксированный мазок наливают несколько капель какого-либо красящего раствора (метиленового синего, разведенного фуксина и прочее). Для получения более чистых препаратов рекомендуется красящий раствор наливать на отрезок фильтровальной бумаги, которой покрывают мазок.
Раствор краски в среднем выдерживают на мазке 2-3 минуты (в зависимости от вида краски):
- Фуксин красит интенсивно, причем окрашиваются одинаково хорошо все виды бактерий. Продолжительность окрашивания раствором фуксина вполне достаточна на протяжении 1-2 минут.
- Щелочную метиленовую синь оставляют для окрашивания мазка на 2-3 минуты. Она красит менее сильно, но препарат получается более изящный, к тому же различные бактерии приобретают окраску различной интенсивности. При окраске метиленовой синью у крупных клеток (например, дрожжевых) дифференцируется ядро и цитоплазма.
- Раствор генцианвиолета держат для окраски 3-5 минуты.
Виды красителей для приготовления образцов для микроскопа
Красители в микробиологии являются солями двух типов: 1) кислые красители – у которых ион, придающий окраску (хромофор), является анионом (пример — эозин); 2) основные красители – те, у которых роль хромофора играет катион (пример — метиленовый синий). 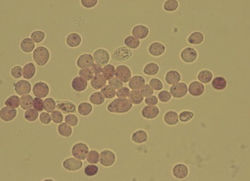
Окраска клеток дрожжей иодонитротетразолиум хлоридом.
Кислые красители являются кислыми потому, что хромофор, будучи кислотой, при образовании придающей окраску соли, связывается с основанием (NaOH).
Красители второго типа называются основными потому, что хромофор, будучи основанием, при образовании соли связывается с кислотой (HCl).
Обычно кислые красители связываются более интенсивно с цитоплазменными (основными) компонентами клетки, а основные – с ядерными (кислыми).
Методы окрашивания основаны либо на микроскопировании в видимом (обычном) свете, либо на флуоресцентной микроскопии. Красителями для светового микроскопа являются метиленовый синий, раствор Люголяи др. Из флуоресцентных красителей применяют магниевую соль 1-анилино-8-нафтален сульфоновой кислоты (Mg-ANS), а также дигидрородамин.
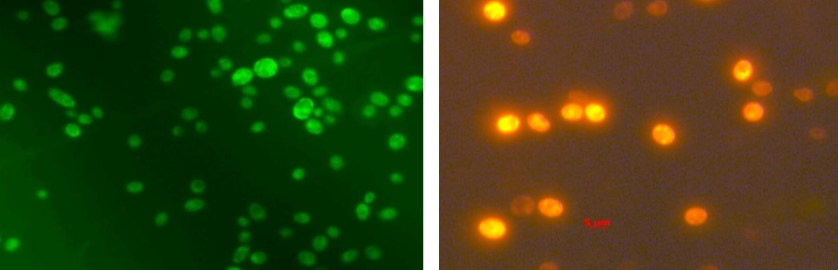
Окраска клеток дигидрородамином в зеленом и красном спектре.
Наиболее простым для проверки жизнеспособности дрожжевых клеток в суспензии является метод с использованием метиленового синего. Этот метод обусловлен тем, что метиленовый синий благодаря дыхательной активности клеток быстро редуцируется и теряет окраску. При отмирании клетки становятся более проницаемы для метиленового синего, и при отсутствии дыхательной активности цвет остается синим. Таким образом, метиленовый синий указывает на отсутствие у клеток дыхательного метаболизма, а не на их гибель как таковую, причем существует возможность, что некоторые метаболически активные клетки оказываются не способными к размножению, в связи с чем они будут отнесены к мертвым.
Если число жизнеспособных клеток превышает 90%, этим можно пренебречь, но при снижении числа таких клеток менее чем до 90% эта погрешность становится все более значимой. Общее количество клеток в 1 см3 и количество «синих» клеток измеряется в камере для подсчета. Для измерения процента жизнеспособных клеток с точностью 0,5% необходимо насчитать не менее 200 клеток. Для получения большей точности необходимо наличие не менее 600 клеток, причем не менее чем в двух отдельных пробах. Использовать два раздельных анализа следует потому, что среднее из двух результатов обеспечит большую точность результатов.
Другие красители дают лучшие результаты, например метиленовый фиолетовый.
Как бы то ни было, в настоящее время общепризнано, что информация о проценте жизнеспособных клеток не позволяет гарантировать приемлемое состояние засевных дрожжей. Термин «жизнеспособность» отражает способность дрожжей к быстрому и эффективному сбраживанию, а не состояние «быть живым».
10.1. ЖИЗНЕСПОСОБНОСТЬ ДРОЖЖЕЙ ПО СТЕПЕНИ ОКИСЛЕНИЯ
В качестве индикаторов жизнеспособности предложены самые разные методы, включая содержание гликогена, АТФ или стерола, образование СО2 или потребление О2 из раствора глюкозы, а также скорость выделения определенных ионов.
Наиболее удобным методом для определений, которые должны быть выполнены в кратчайшее время, является выделение ионов Н+, т. е. снижение значения величины рН, при введении дрожжей в сбраживаемый субстрат.
Для определения жизнеспособности дрожжей по степени окисления дрожжи промывают центрифугированием и затем тщательно перемешивают в 100 см3 дистиллированной воды. Через 10 мин добавляют 5 см3 20%-ного (масс/об) раствора глюкозы и перемешивают еще 10 мин. В ходе инкубации в течение 20 мин каждую минуту измеряют рН суспензии. Резкое снижение значения рН сразу же и после добавления раствора глюкозы до < 4 свидетельствует об активности дрожжей, а степень окисления коррелирует с изменением величины рН.
Как и метод с использованием метиленового синего, данный метод достаточно быстр и позволяет получить результаты до внесения дрожжей.
10.2. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА МЕРТВЫХ КЛЕТОК
10.2.1. ДИФФЕРЕНЦИАЛЬНОЕ ОКРАШИВАНИЕ МЕТИЛЕНОВЫМ СИНИМ
Около 1 г сушеных дрожжей вносят в пробирку со стерильным солодовым суслом плотностью 8% видимых СВ.
Пробирку ставят в термостат при температуре 30°С на 4 ч. За это время все живые клетки, содержащиеся в пробе, выходят из состояния анабиоза и начинают почковаться. Из подмоложенных таким способом дрожжей готовят препарат, который окрашивают метиленовый синим, приготовленным на буферной смеси.
Для прессованных дрожжей и живой культуры нет необходимости в такой процедуре.
Каплю взвеси дрожжей смешивают с каплей синьки на предметном стекле и накрывают покровным стеклом. Мертвые клетки окрашиваются, а живые остаются неокрашенными. В пяти полях зрения отдельно подсчитывают количество мертвых и живых клеток, процент мертвых клеток вычисляют по отношению ко всему количеству клеток. Материнскую клетку с неотделившейся почкой принимают за одну клетку.
10.2.2. ЛЮМИНЕСЦЕНТНЫЙ МЕТОД
Используют люминесцентный микроскоп или люминесцентный осветитель и флуорохром примулин.
Краситель готовят в виде двух растворов: водный раствор (1:20 000) и раствор (1:20 000) в фосфатном буфере рН 8–9. Оба раствора хранят в темноте.
Предметные и покровные стекла тщательно обезжирены.
При микроскопировании белых вин бактериологической петлей помещают на предметное стекло каплю осадка и рядом каплю водного раствора примулина, смешивают их и накрывают покровным стеклом, на которое затем наносят каплю нелюминесцирующего иммерсионного масла.
При микроскопировании красных вин (в связи с гашением люминесценции) красный цвет необходимо устранить, что достигается созданием в препарате щелочной среды. Красный цвет вина при этом превращается в синий.
Бактериологической петлей помещают на предметное стекло каплю осадка вина и две капли раствора примулина в фосфатном буферном растворе рН 8–9. Капли тщательно смешивают петлей в течение 1–2 мин, затем накрывают покровным стеклом, на которое помещают каплю нелюминесцирующего иммерсионного масла.
Приготовленные препараты рассматривают в люминесцентном микроскопе в фиолетовой и синей видимой частях спектра. Для этого пользуются светофильтрами: синим, сине-зеленым, белым и запирающим желтым.
Сначала препарат рассматривают в проходящем свете и подсчитывают общее количество микроорганизмов, а затем – в свете люминесценции, подсчитывая только количество мертвых клеток.
В свете люминесценции живые микроорганизмы не видны, иногда у дрожжевых клеток светится только оболочка в виде тонкого зеленого кольца. Мертвые дрожжи и бактерии в свете люминесценции светятся зеленым и желтым светом разной интенсивности.
При подсчете микроорганизмов необходимо учитывать разведение исследуемого материала в 2 раза для белых вин и в 3 раза – для красных.
10.2.3. МЕТОД ЭПИФЛУОРЕСЦЕНЦИИ
Методика позволяет определять количество жизнеспособных клеток дрожжей в винах и других сброженных материалах, содержащих их небольшое количество (в момент розлива в бутылки), с использованием эпифлуоресценции, и сравнивается с контрольным методом (подсчет колоний на питательной среде).
Применяют также красители-флуорохромы и люминесцентный микроскоп.
Препарат готовят на мембранах Миллипор из поликарбоната диаметром 13–25 мм или из ацетилцеллюлозы диаметром 45 мм.
Испытуемое вино фильтруют под вакуумом через мембраны, окрашивают и подсчитывают под микроскопом число клеток в см3 с учетом числа клеток и подсчитанных полей, площади фильтрующей мембраны, площади полей микроскопа, объема отфильтрованного образца, числа наблюдаемых полей.
ТЕХНОЛОГИЧЕСКИЕИННОВАЦИИ в ОТРАСЛИ»^^^^^^^
УДК 66.663.45
Применение методов окраски дрожжей для оценки их физиологического состояния
С. Г. Давыденко, канд. биол. наук; Л. М. Васильева; Б. Э. Баташов; А. Т. Дедегкаев, канд. техн. наук ОАО «Пивоваренная компания «Балтика»
Ключевые слова: витальные красители; дрожжи; микроскопия;
физиологическая активность; флуоресцентные красители.
Keywords: vital dyes; yeast; microscopy; physiological activity; fluorescent dyes.
Физиологическое состояние засеваемых дрожжей — очень важный фактор для правильного хода брожения, который обеспечивает получение пива требуемого качества.
Состояние дрожжей определяется терминами «жизнеспособность» и «жизненность». Жизнеспособность — соотношение мертвых и живых клеток, жизненность — мера активности метаболизма или физиологического состояния живых клеток. Физиологическое состояние имеет большое значение для ведения технологического процесса пивоварения, поскольку его главный участник — дрожжи. В связи с этим было проведено много исследований, направленных на разработку точного метода измерения состояния дрожжей с использованием современных технологий.
Изучение микроорганизмов объективно осложнено в связи с их размерами, недоступными для восприятия человеческому глазу, который способен различать детали объекта, отстоящие друг от друга не менее чем на 0,08 мм. С помощью светового и электронного микроскопа можно получить большее разрешение — 0,2 мкм и 0,1-0,01 нм соответственно. Увидеть детали строения микроорганизмов сложно, для
этого нужна специальная дорогостоящая техника, основанная на разработке особых способов освещения (косое освещение, люминесценция, микроскопия в темном поле, метод фазового контраста и т. д.). Однако наиболее эффективно применение красителей, позволяющих не только преодолевать проблему практически неокрашеных живых микроорганизмов, попадающих в поле зрения микроскопа, но и выявлять их органел-лы (ядро, цитоплазму, митохондрии) или специфически окрашивать белки, жиры, полисахариды и нуклеиновые кислоты.
Красители широко применяют в современной гистологии и цитологии, для решения задач в прикладной науке и производстве. В пивоварении дрожжи являются основным активным объектом, осуществляющим процесс брожения пивного сусла, поэтому оценка их физиологического состояния необходима для ведения технологического процесса.
Физиологическую активность микроорганизмов можно определить методами окрашивания различными красителями. Окраска проводится для выяснения их морфологии, физиологии, наличия определенных веществ (белков, жиров, полисахаридов, ионов
Окрашивание в видимом свете Флуоресцентные красители
Метиленовый синий Магниевая соль 1-анилин-8-нафтален-
Метиленовый синий + сафранин О сульфоновой кислоты
Раствор Люголя Родамин В
Иодонитротетразолиум хлорид Акридиновый оранжевый
Красный Понсо Бромкрезоловый зеленый
Метиленовый фиолетовый Диацетат флуоресцеина
Дигидрородамин 123
Эозин
Примулин
Эритрозин В
металлов). Физиологическая активность определяет и технологическую эффективность дрожжей, применяемых в производстве.
Методы окрашивания основаны либо на микроскопировании в видимом свете, либо на флуоресцентной микроскопии. Наиболее широко распространенные красители при микро-скопировании в видимом свете — ме-тиленовый синий, сафранин, раствор Люголя, иодонитротетразолиум хлорид (INT) и т. д. К флуоресцентным относят такие красители как магниевая соль 1-анилин-8-нафталенсульфоновой кислоты (Mg-ANS), родамин и т. д. (см. таблицу) [1, 2].
Окрашивание метиленовым синим: 0,01 г метиленового синего и 2,0 г двуводного цитрата натрия растворяют в 10 мл дистиллированной воды, фильтруют и доводят объем до 100 мл. Для окраски используют суспензию дрожжей концентрацией 107 клеток/мл. Тщательно перемешивают образец дрожжей. Делают ряд разведений в физиологическом растворе, чтобы получить удобную для подсчета концентрацию 107 клеток/ мл. Смешивают суспензию клеток и краситель в соотношении 1:1. Закрывают препарат покровным стеклом и производят подсчет не менее 500 клеток. Окрашенные синие клетки считаются мертвыми [3].
Окрашивание сафранином и метиленовым синим: готовят 5%-ный раствор танина и 1%-ный раствор сафранина на дистиллированной воде. Раствор метиленового синего готовят, как описано выше. Суспензию клеток центрифугируют при 4000 мин-1 в течение 5 мин. Сливают надосадочную жидкость, промывают физиологическим раствором и снова центрифугируют при тех же условиях. На обезжиренное стекло наносят каплю суспензии 107 клеток/ мл. После высыхания капли при комнатной температуре препарат фиксируют в пламени. Далее заливают стекло раствором метиленового синего на 4 мин при комнатной температуре. Смывают струей теплой воды. Заливают стекло свежеприготовленным 5%-ным раствором таннина на 2 мин. Таннин играет роль бесцветного протравного красителя. Смывают краситель под струей воды. Заливают стекло раствором сафранина на 16 мин, затем смывают краситель [1].
Сафранин (арабск. zafaran — шафран) — анилиновый краситель,
с;
ПИВО и НАПИТКИ
б • 2011
‘ГЕХНОЛОГИЧЕСКИЕИННОВАЦИИ в ОТРАСЛИ |
применяемым в гистологическом технике для выявления клеточных ядер, которые окрашиваются в красный цвет. Сафранин (иногда Шафраник) — красящее вещество, принадлежащее к группе азокрасок, основного характера, обыкновенно в виде солянокислых солей. Самую простую формулу имеет фено-С, сложнее состав толу-С, содержащего метиловые группы. В технику микроскопи-рования сафранин введен в 1881 г. (Hermann, Flemming, Pfitzner) для окраски ядер и главным образом кариокинеза и с тех пор получил широкое применение [4].
Окрашивание раствором Люголя: 2 г иодистого калия растворяют в 5 мл дистиллированной воды, к раствору добавляют 1 г кристаллического иода. После растворения иода полученный раствор в колбе доводят дистиллированной водой до объема 300 мл. Смешивают суспензию и краситель в соотношении 1:1. Закрывают препарат покровным стеклом и производят подсчет не менее 500 клеток. Оценивают интенсивность коричневого окрашивания. Более окрашенные клетки содержат больше гликогена [5].
Окрашивание иодонитроте-тразолиум хлоридом (INT): 40 мг INT (Sigma) растворяют в 10 мл стерильной воды до конечной концентрации 0,4%. Дрожжи центрифугируют 5 мин при 4000 мин-1, сливают надосадочную жидкость и снова ресуспензируют в физиологическом растворе до конечной концентрации 107 клеток/мл. К 1 мл дрожжевой суспензии добавляют 0,4 мл 0,4%-ного раствора INT и инкубируют 30 мин при 30 °С. Водный раствор красителя свободно проникает в клетки. В результате окислительно-восстановительной реакции в живых клетках образуется нерастворимое вещество — фармазан (красного или малинового цвета). Мертвые же клетки остаются неокрашенными [6, 7].
Окрашивание флуоресцентной магниевой солью 1-анилин-8-нафталенсульфоновой кислоты (Mg-ANS): 300 мг Mg-ANS (Sigma) растворяют в 2 мл спирта и добавляют 98 мл стерильной воды до конечной концентрации 0,3%. Этот раствор можно хранить при 4 °С в стеклянных бутылках из темного стекла в течение 6 мес. Для выполнения процедуры окрашивания дрожжи центрифугируют 5 мин при 4000 мин-1, сливают надосадочную жидкость и снова ресу-
Рис. 1. Клетки дрожжей Saccharomyces cerevisiae, окрашенные метиленовым синим (увеличение хб30)
спензируют в физиологическом растворе до конечной концентрации 10 млн клеток в 1 мл. К 0,5 мл этой суспензии добавляют 0,5 мл 0,3%-ного раствора Mg-ANS и инкубируют 5 мин при 25 °С. Живые клетки не окрашиваются красителем, а мертвые имеют желто-зеленое флуоресцентное свечение при микроскопировании [8, 9].
Окрашивание дигидрородамином 123: в 1 мл 0,1 M буфер Tris (2-Amino-2-hydroxy-methyl-1,3-propanediol) HCl pH 8,0 растворяют 2 мг дигирородами-на 123 (Fluka). К 100 мкл суспензии дрожжей с концентрацией 107 клеток/ мл добавляют 1 мл 0,2%-ного раствора дигидрородамина 123, который окисляется до флуоресцирующего родамина в присутствии активных радикалов кислорода [10].
Различные методы окрашивания могут дать дополнительную информацию о том, что происходит или уже произошло с клеткой. Производят окрашивание как прижизненных, так и фиксированных препаратов.
Наибольшее распространение получил метод выявления мертвых клеток на прижизненных препаратах микроорганизмов с помощью мети-ленового синего (рис. 1). После по-
Рис. 2. Клетки дрожжей Saccharomyces cerevisiae, окрашенные раствором Люголя (увеличение х1000)
падания в клеточную цитоплазму под действием ферментов редуктаз этот краситель восстанавливается живыми дрожжевыми клетками до бесцветных соединений. Эффективность данного метода зависит не только от состояния клеточной мембраны, но и от активности определенных оксидоредуктаз в клетке, и таким образом он отражает и жизнестойкость, и жизнеспособность дрожжей (мертвые клетки окрашиваются в синий цвет) [3].
Для выявления запасного полисахарида дрожжей — гликогена — дрожжи окрашивают раствором Люголя. В результате клетки дрожжей становятся желтыми, а гликоген — коричневым (рис. 2). Количество гликогена в клетках дрожжей меняется в зависимости от их возраста и условий культивирования. У очень молодых клеток гликоген отсутствует, а клетки при окрашивании раствором иода приобретают бледно-желтый цвет [5]. Постепенно дрожжи накапливают гликоген, и при обработке раствором Люголя выявляются темно-коричневые гранулы гликогена, свидетельствующие о накоплении питательных веществ клеткой.
Метод, основанный на редукции трифенилтеразолиновых солей
ФШЦЛТЛ
ООО «ФЕАИЦАТА ХОЛДИНГ»
Производитель пребиотиков и витаминных премиксов на основе лактулозы
Телефон/факс: (495) 648-69-03, (495) 911-70-54 E-mail: i.vasileva@felizata.ru www.felizata.ru
5 • 2011
ПИВО и НАПИТКИ 9
ТЕХНОЛОГИЧЕСКИЕИННОВАЦИИ в ОТРАСЛИ
на основе изменения активности Д-глицеральдегид-3-фосфат NAD ок-сидоредуктазы, характеризует активность клеток при брожении. Проникая в дрожжевую клетку, иодонитротетра-золиум хлорид (iodonitrotetrazolium chloride, INT) образует за счет клеточных ферментов нерастворимые гранулы иодонитротетразолиум-формазана, которые имеют интенсивную красную окраску, наблюдаемую при микроско-пировании в светлом поле (рис. 3). Количество и размер гранул свидетельствует об активности окислительно-восстановительных процессов в клетке [6, 7].
Более полную информацию о физиологическом состоянии клеток дает
Рис. 3. Клетки дрожжей Saccharomyces cerevisiae, окрашенные раствором иодонитротетразолиум хлорида (INT) (увеличение х1000)
окраска фиксированных препаратов метиленовым синим, таннином и сафранином (рис. 4).
а 6
Рис. 5. Клетки дрожжей в видимом свете и окрашенные Mg-ANS (увеличение х1000): а — микроскопирование в видимом свете; б — флуоресцентное микроскопирование с Mg-ANS
а
Рис. б. Клетки дрожжей Saccharomyces cerevisiae, окрашенные дигидрородамином 123 (увеличение х1000): а — красный; б — зеленый светофильтр
а 6
Рис. 7. Окрашенные клетки дрожжей Saccharomyces cerevisiae: а — дигидрородамином 123; б — метиленовым синим (увеличение х1000)
Рис. 4. Клетки дрожжей Saccharomyces cerevisiae, окрашенные метиленовым синим, таннином и сафранином (увеличение хб30)
Суть процессов окраски заключается в том, что остатки фосфорной кислоты, которые обычно связаны с ядерными белками (чаще всего ги-стонами), при вытеснении последних легко вступают в химические реакции с основными красителями. Для этого могут быть использованы сафранин О, янус зеленый В, толуидиновый синий, тионин, азур А и некоторые другие красители, разведенные растворы которых в уксусной кислоте избирательно окрашивают хроматин. Во время активной транскрипции определенного участка ДНК формирующие хроматин гистоны покидают поверхность ДНК и освобождаются фосфорные группы молекулы ДНК, которые вступают в реакцию с сафранином и другими основными красителями. Таким образом, «покраснение» клеток может свидетельствовать об активном процессе транскрипции, а следовательно, и об активном метаболизме. Метиленовый синий окрашивает белки цитоплазмы [1].
Для определения жизнеспособности дрожжевых клеток используют Mg-ANS. Проникая в клетку, Mg-ANS образует флуоресцирующие желто-зеленые комплексы с белками цитоплазмы (рис. 5). По сравнению с окраской метиленовым синим для детекции используется в 1000 раз меньше красителя, что снижает вероятность ингибирования им клеток. Результаты, полученные этим методом, считаются более точными, но требуют наличия хорошей техники для микроскопиро-вания. Живые клетки не окрашиваются красителем, а мертвые имеют желто-зеленое флуоресцентное свечение при микроскопировании [8, 9].
Выявление активных форм кислорода (АФК) в клетке свидетельствует либо о ее старении, либо о том, что она находится в состоянии стресса. Метод дигидрородаминового окрашивания
10 ПИВО и НАПИТКИ 5 • 2011
ТТЕХНОЛОГИЧЕСКИЕИННОВАЦИИ в ОТРАСЛИ
позволяет оценивать количество АФК по количеству флуоресцирующих (красных или зеленых в зависимости от использования соответствующего фильтра) клеток (рис. 6). Дигидроро-дамин 123 (Fluka) окисляется до флуоресцирующего родамина [10].
Окрашивание дигидрородами-ном 123 — чувствительный метод, позволяющий производить оценку физиологического состояния живых, но уже ослабленных клеток, что дает важную информацию о ходе процесса брожения и позволяет диагностировать проблемы, влияющие на жизнеспособность. Для сравнения на рис. 7 представлены препараты одной и той же суспензии дрожжей, окрашенные дигидрородамином 123 (рис. 7, а) и метиленовым синим (рис. 7, б) при использовании зеленого светофильтра.
Дигидрородамин 123 выявляет ослабленные клетки, неспособные эффективно бороться с АФК (см. рис. 7, а), в то время как метиленовый синий окрашивает уже мертвые клетки (см. рис. 7, б). Такое окрашивание дает информацию о том, как будут вести себя дрожжи во время брожения.
Применение красителей для оценки физиологического состояния дрожжей в пивоварении достаточно велико, однако многие флуоресцентные красители широко не используются, так как для них необходимы дорогостоящие микроскопы. Наиболее применяемый — классический метод окрашивания метиленовым синим, дающий стабильные, но иногда завышенные результаты из-за незначительной токсичности самого красителя. Именно этот краситель широко используется в пивоварении для оценки технологической эффективности дрожжей. Остальные красители применяют для уточнения результатов, полученных с помощью метиленового синего, например Mg-ANS, или для характеристики определенных процессов в клетке (INT, дигидрородамин 123).
ЛИТЕРАТУРА
1. Селиванов, Е. В. Красители в биологии и медицине: справочник/Е. В. Селиванов. — Барнаул: Азбука, 2003. — 44 с.
2. http ://www.propivo .ru / prof/ technology / 22 / izmerenie.htm.
3. Smart, K.A. Use of Methylene Violet Staining Procedures to Determine Yeast Viability and Vitality/K. A. Smart, K. M. Chambers, I. Lambert, C. J. Jenkins // Journal-American society of brewing chemists. — 1999. — Vol. 57. — № 1. — P. 18-23.
4. top//bigmeden.ru/article.
5. Теппер, Е. З. Практикум по микробиологии: изд. 2-е, перераб. и доп./Е. З. Теппер, В. К. Шильникова, Г. И. Переверзева. — М.: Колос, 1979. — 216 с.
6. Munujos, P. Assay of succinate dehydrogenase activity by a colorimetric-continuous method using iodonitrotetrazolium chloride as electron acceptor/P. Munujos, J. Coll-Cantí, F. González-Sastre, F. Gella // J. Anal Biochem. — 1993. — Vol. 212. — № 2. — P. 506-509.
7. Mailloux, R. J. The monitoring of nucleotide diphosphate kinase activity by blue native polyacry lamide gel electrophoresis/ R. J. Mailloux, R. Darwich, J. Lemire, V. Appanna // Electrophoresis. — 2008. — Vol. 29. — № 7. — P. 1484-1489.
8. Jenkins, C.L. Impact of Serial Repitching on Lager Brewing Yeast Quality/C. L. Jenkins [et al.] // Journal-American society of brewing chemists. — 2003. — Vol. 61. — № 1. — P. 1-9.
9. Van Zandycke, S. M. Determination of Yeast Viability Using Fluorophores/S. M. Van Zandycke, O. Sima, S. Gualdoni, A. Smart // Journal-American society of brewing chemists. — 2003. — Vol. 61. — № 1. — P. 15-22.
10. Nevzglyadova, O. V. Bud selection and apoptosis-like degradation of nuclei in yeast heterokaryons: a KAR1 effect/O. V. Nevzglyadova, A. V. Ar-tyomov, E. V. Mikhailova, T. R. Soidla // Molecular Genetics and Genomics. — Vol. 274. — № 4. — P. 419-427. ®
ДРОЖЖЕЙ
Для
микроскопирования дрожжей следует
приготовить препарат «раздавленная
капля» из чистых культур дрожжей ‑
винных, пекарских и диких. Приготовленные
препараты изучить под микроскопом со
средним увеличением (с объективом х40).
При этом необходимо рассмотреть, прежде
всего, форму клетки и ее строение,
обратить внимание на клеточную оболочку,
цитоплазму, вакуоли и включения запасных
питательных веществ. Цитоплазма при
микроскопировании представляет собой
темную зернистую массу, вакуоли и капли
жира в виде светлых (блестящих) пятнышек,
гликоген ‑ в виде уплотненных зерен.
Необходимо убедиться в неподвижности
дрожжевых клеток.
Затем
изучают способы бесполого размножения
дрожжей. Для этого нужно отыскать в поле
зрения микроскопа почкующиеся клетки.
Все препараты зарисовать при работе с
объективом х40. На рисунках обозначить
анатомическое строение дрожжевых
клеток, почкующиеся клетки. В выводе
указать отличие изученных препаратов
дрожжей по форме.
Определить
относительное количество живых и мертвых
клеток в пекарских дрожжах ‑ старых
и подмоложенных. К капле суспензии
дрожжей на предметном стекле добавить
каплю слабого раствора (1:1000) метиленового
синего, размешать, накрыть покровным
стеклом. Мертвые клетки прокрашиваются
быстрее и ярче вследствие посмертного
повышения проницаемости клеточной
оболочки. Препарат зарисовать в цвете.
Раздел 2.Определение включений в клетках дрожжей
В
процессе
жизнедеятельности микроорганизмов в
цитоплазме клеток могут формироваться
морфологические образования, представляющие
собой либо продукты обмена клетки, либо
запасные питательные вещества. Включения
различны по своей химической природе.
Это могут быть жироподобные вещества,
полисахариды (гликоген, крахмал,
гранулеза), серополифосфаты (волютин),
кристаллы щавелевой кислоты и др. Они
не являются постоянными компонентами
клетки, они образуются в зависимости
от условий культивирования, возраста
культуры и могут использоваться в
метаболизме клетки.
Клеточные
включения могут выявляться цитохимическими
методами.
а).
Определение полисахаридов (гликогена
и гранулезы)
-
На
предметное стекло наносят небольшую
каплю микробной суспензии, добавляют
каплю концентрированного раствора
Люголя и выдерживают 10-15 минут при
комнатной температуре. -
Накрывают
покровным стеклом, удаляют избыток
жидкости и микроскопируют с сухой
системой либо с иммерсией.
Гранулы
крахмалоподобных веществ (гранулеза)
окрашены в синий, а гранулы гликогеноподобных
веществ (крахмал) ‑в красновато-коричневый
цвет.
Окрашивание
гликогена происходит в кислой среде,
поэтому перед выявлением в клетках
гликогена среду, в которой выращивали
микроорганизмы, подкисляют либо на
предметное стекло вместо воды наносят
каплю 0,5%-го раствора HCl
и в ней эмульгируют исследуемую культуру.
б).
Обнаружение жироподобных веществ
Жировые
включения или липидные гранулы в клетках
микроорганизмов могут быть представлены
нейтральными жирами и поли-β-оксимасляной
кислотой. Коэффициент преломления жиров
и гранул, состоящих из нейтральных
жиров, отличается от коэффициента
преломления протоплазмы, поэтому в
препарате «раздавленная капля»
жир виден в клетках в виде блестящих
ярких капелек. Препарат необходимо
рассматривать в затемненном поле зрения,
опустив конденсор и закрыв диафрагму
(объектив х40). Гранулы поли-β-оксимасляной
кислоты выявляют с помощью жирорастворимого
красителя судана III.
-
Наносят
каплю густой микробной взвеси на
предметное стекло. Добавляют каплю
формалина (40%-го), либо 5%-го раствора HCl
и выдерживают 5 минут (формалин убивает
клетку и разрыхляет ее оболочку). -
Добавляют
каплю метиленового синего (1:10 либо
1:40) и выдерживают 10 минут. -
Добавляют
каплю концентрированного раствора
судана (III)
в 90% этаноле и выдерживают 5 минут.
Накрывают покровным стеклом. Микроскопируют
с сухой или иммерсионной системой.
Клетки
окрашены в синий, включения жира — в
розово-оранжевый цвет.
в).
Выявление волютина
Волютин-полиметафосфат,
в клетках чаще содержится в виде зерен
диаметром 0,3 мкм, иногда в дисперсном
состоянии. Волютин встречается в клетках
многих бактерий и большинства дрожжей.
Волютин дает явление метахромазии; на
этом основана его окраска метиленовым
синим. Волютин растворяется в слабых
кислотах и щелочах, но после окраски
становится кислотоустойчивым, на этом
основан метод Омелянского.
Окраска
метиленовым синим:
фиксированный мазок дрожжей окрашивают
метиленовым синим 3-5 мин, промывают,
сушат и микроскопируют в иммерсионной
системе. Зерна волютина выглядят
красно-фиолетовыми на фоне голубой
протоплазмы.
Метод
Омелянского:
фиксированный мазок окрашивают в течение
30 с фуксином Циля, затем обесцвечивают
1% раствором серной кислоты 30 мин. и после
промывания водой докрашивают метиленовым
синим 1 мин.; промывают водой, высушивают
и микроскопируют в иммерсионной системе.
Зерна волютина ‑ ярко-красные,
протоплазма ‑ голубая. Препараты
зарисовать в цвете.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
 Если вы не читали первую часть статьи по использованию микроскопа в пивоварении, то рекомендуем сначала ознакомиться с ней, чтобы узнать для чего нужен микроскоп в домашнем пивоварении, а также ознакомиться с руководством по его выбору и дополнительным аксессуарам. В этой же части мы предлагаем продолжение перевода статьи: «Microscope use in brewing» , где будет рассказано, как правильно пользоваться микроскопом в пивоварении. Приятного чтения!
Если вы не читали первую часть статьи по использованию микроскопа в пивоварении, то рекомендуем сначала ознакомиться с ней, чтобы узнать для чего нужен микроскоп в домашнем пивоварении, а также ознакомиться с руководством по его выбору и дополнительным аксессуарам. В этой же части мы предлагаем продолжение перевода статьи: «Microscope use in brewing» , где будет рассказано, как правильно пользоваться микроскопом в пивоварении. Приятного чтения!
Использование микроскопа
подготовка образца
Поскольку клетки подсчитываются только в очень маленьком образце, образец должен быть соответствующий пиву или жидкости, содержащей популяцию дрожжей. Это означает, что весь объем необходимо перемешать очень хорошо, и дрожжевым клеткам нельзя позволять флокулировать. Этот момент очень важен.
Существует два подхода для определения уровня засева, т.е. начальной концентрации клеток в пиве. Клетки можно подсчитать, как только они были засеяны в пиве, и клетки могут быть подсчитаны, пока они находятся в сосуде для размножения. Преимущество первого заключается в том, что он не требует разбавления. Но если засеяно больше клеток, чем было необходимо, то они не могут быть удалены. Следующий способ требует разбавление образца. Если количество сусла, добавленного к дрожжам, составляет около 5% от объема сусла, подлежащего засеву (1 л к 20 л партии) рекомендуется разбавление 1:20.
Для этого добавьте 19 мл воды в пробирку или другую небольшую емкость и затем добавьте 1 мл перемешенной дрожжевой культуры. Хорошо все перемешайте, но не трясите их энергично. Некоторые дрожжевые штаммы, в частности элевые дрожжи, любят скапливаться в пене. Повторно втяните образец в пипетку и вытяните его обратно, чтобы промыть пипетку.
дефлокуляция дрожжей
Плохие флокулянты, такие как пыльные дрожжи и немецкие элевые дрожжи, легки в обращение. Большинство других флокулирующих штаммов нуждаются в некоторой помощи. Вот несколько практических способов для дефлокуляции дрожжей во время подсчета клеток.
свежее сусло
Мальтоза ингибирует флокуляцию, потому как дрожжи размножаются в свежем сусле. Это справедливо и для хороших флокулянтов, таких как английские элевые дрожжи (WLP 002). Просто добавьте свежее сусло к дрожжевому осадку и поместите его на магнитную мешалку в течение нескольких минут. Это очень практичный способ определения количества дрожжей в дрожжевых осадках до засева, так как здоровье дрожжей не затрагивается, а дефлокуляция дрожжей также позволит более равномерно распределиться дрожжам по всей поверхности образца.
серная кислота
Когда образец дрожжей подлежащий подсчету не предназначен для засева, то дрожжи могут стать нефлокулентными с добавлением некоторого количества серной кислоты (H2SO4 ). Однако, серная кислота является очень едкой и с ней необходимо обращаться осторожно.
динатрий ЭДТУ
Более безопасным, чем серная кислота является ЭДТУ. ЭДТУ (этилендиаминтетрауксусная кислота) представляет собой хелатирующий агент, который хелатирует («захватывает») ионы кальция, необходимые для флокуляции. В результате образец дрожжей не флокулирует. Это не влияет на здоровье дрожжей, а окрашивание метиленовым синим можно использовать для оценки жизнеспособности дрожжей.
PWB
Моющее средство PBW (Powdered Brewery Wash) также содержит хелатообразующие агенты и способна предотвращать флокуляцию дрожжей. В то время оно безопасно в использование и легко доступно для многих пивоваров, но оно влияет на здоровье дрожжей, а окрашивание метиленовым синим не может использоваться для оценки жизнеспособности культуры.
Рисунок 3 — темный гемоцитометр с двумя заполненными счетными сетками. Образец был окрашен метиленовым синем, намного сильнее, чем это необходимо или полезно, чтобы проиллюстрировать, как он всасывается в счетную камеру

подготовка гемоцитометра (счетной камеры)
Подготовьте гемоцитометр в соответствии с инструкциями производителя. В большинстве случаев это означает, что покровное стекло должно находится на счетной сетке (сетках) придерживаясь двумя выступами.
Теперь вытяните образец с помощью пипетки и создайте небольшую каплю на кончике пипетки. Поднесите кончик с каплей прямо рядом с краем покровного стекла, чтобы образец попадал в счетную камеру капелярным способом. Если ваш гемоцитометр имеет две счетные сетки, вытяните еще один образец и повторите процедуру для другой счетной сетки. Образец должен охватывать счетную сетку, избегая переполнения в «канавах» или переполнения по всей поверхности. Слишком много жидкости в канавах может подтолкнуть покровное стекло вверх и изменить объем выше счетной сетки.
Теперь поместите гемоцитометр на предметный столик микроскопа и выберите самое слабое увеличение. С помощью ручки фокусировки подвиньте столик ближе к объективу и, посмотрите в окуляр, сдвиньте столик от объектива до тех пор, пока не увидите счетную сетку. Сфокусируйтесь и перейдите к следующему более высокому уровню увеличения. Повторно сфокусируйте и отрегулируйте положение столика так, чтобы отображалась счетная сетка по центру. Обратите внимание, насколько равномерно распределены клетки. Если они сгруппированы вместе, возможно необходимо будет повторно перемешать образец, или дрожжам потребуется больше времени для дефлокуляции.
Если фокус не нуждается в изменении, его можно оставить как есть, и в следующий раз, когда вы будете считать клетки, вам не потребуется проходить описанную процедуру фокусировки.
подсчет
Измените увеличение на 400-х. Это лучшее увеличение для подсчета дрожжевых клеток. По правилам обычно подсчитываются клетки в 4-х угловых сетках 4×4 и в центральной сетке 4×4 (см. рис. 13 для полной счетной сетки Нойбауэра). Если концентрация дрожжей низкая, возможно, потребуются дополнительные сетки. См. рис. 4, как подсчитывать клетки в одной из сеток 4×4.
При использовании (чаще всего) гемоцитометра с глубиной 0,1 мм концентрация клеток исходного образца в миллионах клеток на мл (или млрд. клеток на литр) составляет:
Рисунок 4 — Когда ведется подсчет количества клеток, то считаются те, которые касаются середины тройных линий сверху и слева от сетки 4×4, но исключаются клетки, касающиеся правой и нижней средней линии. Считайте почкующиеся клетки за две, так как они скоро станут двумя клетками.


Коэффициент разбавления — это соотношение количества образца к объему воды, пошедшей на разбавление, плюс один. Примеры:
- Без разбавления: коэффициент разбавления 0+1=1
- 1 мл образца + 1 мл воды: коэффициент разбавления 1+1=2
- 2 мл образца + 10 мл воды (разбавление 1 : 5+1): значит коэффициент разбавления 6
Формула также обозначает, что подсчет одной строки из 4 маленьких квадратов в неразбавленном образце дает очень грубую оценку плотности клеток.
Количество клеток в культуре в миллиардах можно рассчитать, умножив концентрацию клеток на объем культуры или пива в литрах (1 миллион / мл = 1 миллиард / л). Обратите внимание, что это тот объем, в котором популяция дрожжей в настоящее время приостановлена.
Количество клеток, определенное с помощью гемоцитометра, имеет пределы точности, которые должен понимать каждый пивовар. Ошибка может быть сведена к минимуму если:
- Убедиться, что взятый образец является представителем культуры или пива. Это означает тщательное перемешивание.
- При разбавлении образца его необходимо тщательно перемешать и пипетку необходимо промыть разбавленным образцом.
- Подсчитать достаточное количество клеток. Следует подсчитать не менее 100 клеток, поскольку статистическая ошибка обратно пропорциональна квадратному корню из подсчитанного количества клеток, как показано ниже.
Следующая формула может быть использована для оценки статистической ошибки, основанной на количестве подсчитанных клеток:

В идеале следует брать несколько разных образцов и подсчитывать их отдельно. Если этого не сделано, две счетные камеры должны, по крайней мере, заполняться отдельными пипетками.
Окрашивание метиленовым синим
Окрашивание метиленовым синим позволяет простейшим способом оценить здоровье дрожжевой культуры. Теоретически мертвые клетки окрашиваются в синий цвет, а живые клетки остаются бесцветными. На практике же есть тенденция переоценивать жизнеспособность. Тем не менее, несмотря на свои недостатки, окрашивание метиленовым синим является практически стандартным в пивоваренной промышленности тестом на жизнеспособность благодаря своей простоте и быстрым результатам. Это также удобный тест для домашних пивоваров, поскольку метиленовая синь легко доступна в Интернете и имеет длительный срок хранения.
В окисленной форме метиленовая синь имеет синий цвет. В своей редуцированной форме, называемой лейкометиленовая синь, цвет отсутствует.
Когда метиленовый синий проникает в живые клетки, дыхание клетки (потребление кислорода) быстро редуцирует его до бесцветной лейкообразной формы. Вот почему живые клетки не окрашиваются. В мертвых клетках метиленовая синь может накапливаться в своей окисленной (синей) форме. Но что, если метиленовый синий не сможет попасть в мертвые клетки. Когда клетка стареет она откладывает липиды и сахара в клеточных стенках с целью защиты от окружающей среды. Это предотвращает проникновение метиленовой сини, и когда клетка позже умирает, она не будет окрашиваться в синий. Если свежую дрожжевую культуру подвергнуть тепловой пастеризации, чтобы убить все дрожжевые клетки, то все клетки будут окрашиваться метиленовым синим (рис. 5). С другой стороны, если старая и мертвая культура дрожжей окрашивается, но не все такие клетки становятся темно-синими (рис. 6). Вот почему окрашивание метиленовым синим переоценивает жизнеспособность культуры по сравнению с подсчетами на агарной пластине, где жизнеспособность клеток оценивается путем подсчета клеток, которые способны расти и образовывать колонии.
Из-за переоценки метиленового синего, результаты менее 85-90% следует рассматривать как непригодными к использованию. В практике пивоварения если культура дрожжей показывает жизнеспособность менее 90%, при тестировании с метиленовой синью, ее не следует использовать и выращивать новую культуру. Этого можно добиться размножением небольшого образца старых дрожжей.
Для проведения теста жизнеспособности с метиленовыми синим пивоварами следует следовать этому руководству:
- приготовьте 1% раствор метиленового синего и оставьте его в бутылке с пипеткой. Он будет вам на запас
- при необходимости разведите образец дрожжей
- добавьте 1 каплю на каждые 5 мл разбавленного образца дрожжей. Капля добавляет объем 0,05-0,07 мл и уменьшает количество клеток на ~ 1%, что явно связано с погрешностью подсчета клеток и, следовательно, можно смело игнорировать.
- позвольте окрашенному образцу постоять 1 минуту
- поместите образец через пипетку в гемоцитометр и смотрите под микроскопом при 400 кратном увеличение
Чтобы правильно видеть какие клетки окрашены, возможно, фокус придется слегка отрегулировать вверх или вниз. Подсчитайте бесцветные и светло-синие / зеленые клетки как жизнеспособные и подсчитайте синие клетки как мертвые. Не считайте синие окрашенные почки клеток, если материнские клетки не окрашиваются. Почки заняты растущим метаболизмом и не могут редуцировать краситель.
Жизнеспособность культуры дрожжей с метиленовой синью может быть рассчитана как:

подсчет клеток с использованием ImageJ
Подсчет клеток в микроскопе занимает много времени и довольно утомителен. Альтернативой является съемка(и) и подсчет клеток с помощью программного обеспечения подсчета для рабочего стола, такого как ImageJ . Картинки могут быть сделаны с помощью специальной камеры, установленной на микроскоп или даже с камеры сотового телефона, которая удерживается близко к окуляру. Последнее потребует некоторой практики, но работает достаточно хорошо. При съемке для подсчета клеток также можно взять их при уменьшенном увеличении (100x) и, следовательно, в более широком поле зрения. В этом случае единственное изображение должно быть сделано для каждой сетки гемоцитометра.
ImageJ имеет как автоматические, так и ручные режимы подсчета. Для автоматизированного подсчета клеток, основанного на распознавании частиц на изображении, требуется довольно равномерно освещенное изображение высокого качества, которое я не могу снять с помощью мобильного телефона. Из-за этого я использую счетчик клеток в разделе Plugins-> Analyze-> Cell Counter. После установки изображения выбирается тип клеток, и каждый щелчок на изображении оставляет пометку и увеличивает счетчик для этого типа клетки. Различные типы клеток могут использоваться для разных сеток или подсчета окрашенных и неокрашенных клеток.

Рисунок 8 — Снимок экрана ImageJ и подключаемый модуль счетчика клеток. Изображение, на котором подсчитываются клетки, сделано с сотового телефона при 100-кратном увеличении. Она был увеличена, чтобы показать одну из счетных сеток 4×4
Другие виды использования
оценка состояния здоровья дрожжей
Здоровые дрожжевые клетки должны быть упитанные и круглые, в то время как голодные дрожжевые клетки имеют более вытянутую форму похожую на мяч для американского футбола. На Рис. 6 можно увидеть такую старую культуру дрожжей.
элевые против лагерных дрожжей
Рисунок 9 — Элевые дрожжи, демонстрирующие типичную тенденцию к образованию струнных колоний

В целом, вы не сможете различить разные штаммы дрожжей, хотя у некоторых штаммов больше клеток, чем у других. Но есть одна разница между элевыми и лагерными дрожжами, которую иногда можно наблюдать. Элевые дрожжи, как правило, склеиваются после почкования и заканчивают формирование в небольшие струнные колонии, состоящие из 5-10 клеток (см. Рис. 9). Эти колонии часто присоединяются к пузырькам CO2 и поднимаются в верх при брожение. Лагерные дрожжи отделяются после почкования и формируются в группы только при флокуляции. Эти группы представляют собой скопления клеток, а не цепочки.
определение источника помутнений в пиве
Когда в пиве появляется помутнение, имеет смысл взглянуть на его под микроскопом. Процедура такая же, как и для подсчета клеток, за исключением того, что гемоцитометр следует мыть более тщательно, чем обычно, чтобы избежать попадания частиц, которых нет в пиве. Я также советую заполнить одну из сторон гемоцитометра водой, чтобы вы могли сравнить пиво с водой.
Если это не сильная муть, частицы будут довольно далеко друг от друга. Но вы сможете увидеть, является ли мутность результатом дрожжевых или белковых комплексов. Белковые комплексы намного меньше дрожжей (~ 0,5 мкм по сравнению с дрожжами, которые в 10 раз больше). Если мутность является результатом микробной инфекции, она должна быть заметна по вкусу. Бактерии намного меньше дрожжей и обычно имеют форму стержней. Однако не путайте стержнеобразные кристаллы (возможно, моногидрат оксалата кальция) с бактериями. Эти стержни, которые иногда находятся в осадке, примерно такие же, как дрожжевые клетки (см. Рис. 11).
Дрожжевая муть в конечном итоге прекратится. Белковая муть намного упрямее и займет много месяцев, чтобы осесть или нуждается в лечении с помощью оклеивающего агента, такого как желатин.
Приложение
Галерея разных изображений в микроскопии
Улучшенная сетка подсчета Нойбауэра

Рисунок 13 — улучшенная сетка подсчета Нойбауэра. 5 зеленых квадратов представляют собой сетки 4×4, которые обычно используются для подсчета дрожжевых клеток.
