Фармакологическое действие
Гуманизированное (с присоединенным гипервариабельным участком) моноклональное антитело, относящееся к изотипу иммуноглобулина G4/каппа. Олокизумаб селективно связывается с человеческим ИЛ-6 и эффективно нейтрализует эффекты ИЛ-6 in vivo и in vitro. Полученные данные свидетельствуют о том. что олокизумаб не связывается в значительной степени с другими молекулами семейства ИЛ-6 и не влияет на их функционирование, а также не активирует сигнальный путь ИЛ-6.
У пациентов со среднетяжелым или тяжелым ревматоидным артритом, недостаточно контролируемым терапией метотрексатом, п/к введение олокизумаба в дозе 64 мг каждые 2 недели или 64 мг каждые 4 недели вызывало резкое снижение среднего уровня C-реактивного белка в плазме ко 2 неделе лечения. Низкие уровни СРБ сохранялись в течение 24 недель на протяжении всего периода лечения.
У пациентов, получавших олокизумаб, также чаще отмечалось улучшение качества жизни, уменьшение боли и количества болезненных и отечных суставов. Воздействие олокизумаба было заметным уже через 4 недели лечения, выраженный эффект развивался приблизительно через 12 недель от начала введения препарата и сохранялся в течение не менее чем 24 недель.
Фармакокинетика
После однократного п/к введения олокизумаба пациентам с легким или умеренным ревматоидным артритом в дозах от 0.3 до 6 мг/кг Cmax в крови дозозависимо возрастала. Время достижения Cmax составляло от 4 до 12 дней, при этом поддающиеся определению концентрации олокизумаба сохранялись до 16 нед. При многократном введении Css олокизумаба в крови нарастала в течение начального периода терапии и достигала равновесного состояния через 16 и 14 нед. от начала лечения. При п/к введении биодоступность составляет 63%. В исследовании in vitro на криоконсервированных гепатоцитах человека олокизумаб обращал ингибиторный эффект ИЛ-6 на активность CYP1A1/2, CYP2B6, CYP2C9, CYP3A4/5 и CYP2C19, а также на активность NTCP. Клиренс олокизумаба у пациентов с легким или умеренным ревматоидным артритом составлял 0.17 л/сут с низкой или средней индивидуальной вариабельностью.
Показания активного вещества
ОЛОКИЗУМАБ
Терапия пациентов старше 18 лет с ревматоидным артритом средней или высокой степени активности в комбинации с метотрексатом, при недостаточной эффективности монотерапии метотрексатом.
Режим дозирования
Вводят п/к в область бедра или передней брюшной стенки.
Доза составляет 64 мг каждые 2-4 недели.
Побочное действие
Инфекции и паразитарные заболевания: часто — бронхит; нечасто — легочный туберкулез, кандидоз кожи, вульвовагинальный кандидоз, отрубевидный лишай, подкожный абсцесс, рожистое воспаление, сепсис, вызванный стафилококковой инфекцией, синдром токсического шока.
Со стороны обмена веществ: очень часто — лейкопения, нейтропения; нечасто — гиперхолестеринемия.
Со стороны печени и желчевыводящих путей: очень часто — повышение активности АСТ, повышение активности АЛТ; часто — повышение активности ГГТ.
Со стороны кожи и подкожных тканей: часто — зуд, сыпь; нечасто — изменение цвета пота, дерматит, экхимоз, зудящая сыпь.
Общие нарушения и реакции в месте введения: нечасто — боль в месте инъекции, эритема.
Лабораторные и инструментальные данные: часто — позитивный тест на микобактерию туберкулеза.
Противопоказания к применению
Повышенная чувствительность к олокизумабу, активные инфекционные заболевания (в т.ч. туберкулез); детский возраст до 18 лет; беременность, период грудного вскармливания.
С осторожностью
У пациентов с серьезными или оппортунистическими инфекциями в анамнезе; с сопутствующими заболеваниями и состояниями, являющимися факторами риска развития инфекций (в т.ч. сахарный диабет, почечная недостаточность, прием иммуносупрессивных препаратов, пожилой возраст); у пациентов, контактировавших с больными туберкулезом; с дивертикулитом или перфорациями кишечника в анамнезе и другими факторами риска перфорации кишечника; с нарушениями функции печени и печеночной недостаточностью.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
С осторожностью применять у пациентов с нарушениями функции печени и печеночной недостаточностью.
Применение при нарушениях функции почек
С осторожностью применять при нарушениях функции почек.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
С осторожностью применять у пациентов пожилого возраста.
Особые указания
Назначать лечение олокизумабом и наблюдать за ходом лечения разрешается врачам, имеющим опыт в диагностике и лечении ревматоидного артрита.
Анафилактические или анафилактоидные реакции: введение препаратов, содержащих белки, может быть связано с возникновением иммунологических/аллергических или неиммунологических реакций повышенной чувствительности к препарату, которые могут быть тяжелыми. Эти реакции могут возникать в виде острой инфузионной реакции, аллергической реакции или реакции гиперчувствительности замедленного типа.
Инфекции: для пациентов, получающих иммуносупрессивные препараты, включая блокаторы сигнального пути ИЛ-6, характерна повышенная частота развития инфекций. Применение олокизумаба связано с повышенным риском развития или активизацией инфекций. Не следует начинать терапию олокизумабом пациентам с инфекциями в активной фазе. При развитии серьезных инфекций терапию олокизумабом следует прекратить. Пациентов следует проинструктировать о возможных признаках и симптомах развития инфекции, требующих немедленного обращения к врачу.
Туберкулезная инфекция: перед началом терапии олокизумабом необходимо провести обследование пациента на наличие латентной формы туберкулезной инфекции. Пациентам с выявленной латентной формой туберкулезной инфекции перед началом терапии олокизумабом следует провести стандартный курс противотуберкулезной терапии.
Следует с осторожностью применять олокизумаб пациентам, находящимся в тесном контакте (совместное проживание или нахождение в других замкнутых пространствах, например, на рабочем месте, на общественных собраниях или в здании на протяжении длительных периодов в течение дня) с лицом, страдающим активным туберкулезом. Перед применением олокизумаба у таких пациентов следует тщательно оценить соотношение риска и пользы терапии.
Риск перфорации желудочно-кишечного тракта: при применении ингибиторов сигнального пути ИЛ-6 известны случаи перфорации желудочно-кишечного тракта, в основном на фоне дивертикулита. Следует соблюдать осторожность при применении олокизумаба у пациентов с дивертикулитом или перфорацией кишечника в анамнезе и другими факторами риска перфорации кишечника. При появлении желудочно-кишечных симптомов, таких как абдоминальная боль, на фоне лечения олокизумабом, следует незамедлительно провести обследование пациента.
Почечная недостаточность: пациентов с почечной недостаточностью не включали в клиническое исследование олокизумаба. В связи с отсутствием данных следует соблюдать осторожность при применении олокизумаба у пациентов с нарушениями функции почек.
Вакцинация: безопасность иммунизации живыми вакцинами на фоне применения ингибиторов ИЛ-6, в том числе олокизумаба, не установлена. Пациентов с необходимостью вакцинации живыми вакцинами не включали в клиническое исследование.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и механизмами не проводились. Хотя на данный момент при терапии олокизумабом нежелательные реакции, связанные с головокружением, не отмечались, головокружение часто наблюдалось при терапии другими ингибиторами ИЛ-6. Пациентам, испытывающим головокружение во время терапии препаратом Артлегиа, следует рекомендовать не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Лекарственное взаимодействие
Одновременное применение с метотрексатом не влияло на экспозицию олокизумаба. Не ожидается также влияния олокизумаба на экспозицию метотрексата при их одновременном применении, клинические данные отсутствуют. Во всех клинических исследованиях у пациентов с ревматоидным артритом олокизумаб применялся совместно с метотрексатом.
Специальные клинические исследования лекарственных взаимодействий олокизумаба не проводились. По результатам клинического исследования СКЕ001 не сообщалось о случаях клинически значимых лекарственных взаимодействий олокизумаба с другими препаратами.
В исследовании in vitro на криоконсервированных гепатоцитах человека олокизумаб обращал ингибиторный эффект ИЛ-6 на активность CYP1A1/2, CYP2B6, CYP2C9, CYP3A4/5 и CYP2C19, а также на активность NTCP. Поэтому следует учитывать, что у пациентов с активным ревматоидным артритом может потребоваться коррекция доз препаратов, метаболизирующихся данными изоферментами, после начала применения препарата.
Концентрация следующих препаратов может снизиться при совместном применении с олокизумабом (список не является исчерпывающим): статины (симвастатин, ловастатин, аторвастатин); пероральные контрацептивы; блокаторы кальциевых каналов; ГКС (дексаметазон, метилпреднизолон); варфарин; хинидин; теофиллин; тизанидин; фенитоин; пимозид; циклоспорин; сиролимус; такролимус; бензодиазепины (например, диазепам, алпразолам, триазолам, мидазолам. бромазепам).
Олокизумаб в лечении ревматоидного артрита
- Моисеев С.В.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
- Новиков П.И.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
,
- Гуляев С.В.
- Клиника им. Е.М. Тареева Первого МГМУ им. И.М. Сеченова (Сеченов — ский Университет)
,
- Буланов Н.М.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
- Шевцова Т.П.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
- Щеголева Е.М.
- Клиника им. Е.М. Тареева Первого МГМУ им. И.М. Сеченова (Сеченов — ский Университет)
- DOI
- 10.32756/ 0869- 5490-2021-2-67-74
- Количество просмотров
- 2273
Скачать статью в PDF
Олокизумаб – новый оригинальный ингибитор интерлейкина (ИЛ-6), который, в отличие от других представителей этой группы, представляет собой моноклональное антитело, взаимодействующее не с рецепторами, а с самим цитокином. Препарат зарегистрирован для лечения больных ревматоидным артритом средней и высокой степени активности, не ответивших на терапию метотрексатом и другими стандартными базисными противовоспалительными препаратами или генно-инженерными биологическими препаратами. Эффективность и безопасность терапии олокизумабом в сочетании с метотрексатом у пацентов с низким ответом на метотрексат и ингибиторы фактора некроза опухоли a были доказаны в нескольких международных клинических исследованиях 3 фазы (программа CREDO), в том числе в сравнительном исследовании с адалимумабом. В статье на основании двух клинических наблюдений обсуждаются показания к назначению олокизумаба больным ревматоидным артритом, а также перспективы его применения для профилактики прогрессирования АА-амилоидоза.
С.В. Моисеев. Сегодня перспективы лечения ревматоидного артрита (РА) связывают
с расширением спектра и внедрением в клиническую практику генноинженерных биологических препаратов (ГИБП) и
таргетных синтетических базисных противовоспалительных препаратов (БПВП), которые позволяют достичь устойчивого
эффекта у пациентов, не отвечающих на метотрексат (МТ) и другие стандартные БПВП. В модификации базисной терапии
нуждаются около половины больных РА, поэтому частота применения ГИБП неуклонно возрастает. Например, в когортном
американском исследовании (n=40733) доля пациентов с РА, получающих ГИБП, увеличилась с 16% в 2004 г. до 39% в 2013
г. [1]. В 2010 г. в странах Европы частота применения ГИБП у больных РА составила в среднем 19,1%. Она была ниже в
Португалии и Италии и существенно выше в таких странах, как Ирландия и Нидерланды, где более трети пациентов с РА
получали ГИБП [2]. В Российской Федерации зарегистрированы все основные ГИБП, предназначенные для лечения РА, в том
числе ингибиторы фактора некроза опухоли-альфа (инфликсимаб, адалимумаб и др.), рецепторов интерлейкина (ИЛ)-6
(тоцилизумаб, сарилумаб), костимуляции Т-лимфоцитов (абатацепт) и моноклональные антитела к В-лимфоцитам
(ритуксимаб), а также таргетные БПВП (тофацитиниб, барицитиниб, упадацитиниб). Одним из основных барьеров к их более
широкому применению является высокая стоимость по сравнению с таковой стандартных БПВП, поэтому важное значение
имеет разработка биоаналогов ГИБП и отечественных оригинальных ГИБП. В мае 2020 г. в нашей стране для лечения
взрослых пациентов с РА средней и высокой степени активности был зарегистрирован олокизумаб (Артлегиа, «Р-Фарм»),
который представляет собой гуманизированное моноклональное антитело, специфически нейтрализующее ИЛ-6 [3]. Наравне с
другими ингибиторами ИЛ-6 он активно использовался для лечения среднетяжелых и тяжелых форм COVID-19, поэтому многие
врачи уже имеют опыт применения этого препарата. В каких случаях обосновано назначение олокизумаба и других ГИБП
пациентам с РА?
П.И. Новиков. Принципы лечения РА подробно рассматриваются в рекомендациях
Европейской антиревматической лиги (EULAR), которые были опубликованы в начале 2020 г. [4]. В целом за последние
годы общие подходы к терапии этого заболевания существенно не изменились, в частности всем больным РА сразу после
установления диагноза необходимо назначать стандартные БПВП, а препаратом выбора остается МТ. Оптимальная доза МТ у
большинства больных составляет 20-25 мг/нед. Лефлуномид или сульфасалазин целесообразно применять на первой ступени
лечения при наличии противопоказаний к назначению МТ, таких как нарушение функции почек или анемия, а также при его
неэффективности. Цель лечения – ремиссия заболевания, которая предполагает отсутствие признаков воспалительной
активности (например, счет DAS28<2,6), хотя у больных с длительным анамнезом РА приемлемым результатом терапии
может быть и низкая активность заболевания [5]. БПВП нередко применяют в комбинации с глюкокортикостероидами,
которые позволяют быстрее достичь снижения воспалительной активности, однако назначать их на длительный срок не
следует, учитывая высокий риск развития нежелательных эффектов. В идеале глюкокортикостероиды должны быть отменены в
течение 3 мес после начала лечения. Если терапия стандартными БПВП ± глюкортикостероидами оказывается неэффективной,
т.е. не позволяет достичь ремиссии или по крайней мере низкой активности заболевания в течение 6 мес, то
целесообразно подключать к терапии ГИБП или таргетные БПВП.
С.В. Моисеев. Следует ли назначать ГИБП только в случае неэффективности всех
БПВП, в том числе в комбинации друг с другом, или, наоборот, лучше стремиться к более раннему их включению в схему
терапии?
П.И. Новиков. Однозначно ответить на этот вопрос сложно, так как сроки
назначения ГИБП зависят от многих факторов, включая активность и течение РА, результаты предыдущей терапии, наличие
и тяжесть системных проявлений, доступность конкретных препаратов в регионе. К сожалению, на практике решение
данного вопроса иногда затягивается, хотя несвоевременная модификация базисной противовоспалительной терапии может
привести к прогрессированию структурных изменений суставов и инвалидизации пациента. Как указано выше, длительный
прием глюкокортикостероидов, даже в низких дозах, не следует рассматривать как альтернативу присоединению ГИБП к
недостаточно эффективной терапии МТ и/или другими стандартными БПВП.
В рекомендациях EULAR выделены неблагоприятные прогностические
факторы, наличие которых обосновывает более раннее назначение ГИБП или таргетных БПВП пациентам с РА:
- сохранение умеренной или высокой активности РА несмотря на лечение стандартными БПВП ± глюкортикостероидами;
- высокие уровни острофазовых белков;
- высокий счет опухших суставов;
- наличие ревматоидного фактора (РФ) и/или антител к цитруллинированным протеидам (АЦЦП), особенно в высоких
титрах; - наличие ранних эрозий;
- неэффективность по крайней мере двух стандартных БПВП.
Таким образом, прежде чем рекомендовать применение ГИБП пациенту с РА, все же необходимо убедиться в неэффективности
не только МТ, но и других стандартных БПВП, что соответствует реальной клинической практике лечения РА в нашей
стране.
С.В. Моисеев. С какого ГИБП следует начинать лечение у больных РА, не
ответивших на терапию первой линии?
Т.П. Шевцова. В прошлом среди ГИБП препаратами первой линии считали ингибиторы
факторы некроза опухоли альфа (ФНО), что отражало больший опыт их применения в клинической практике. Однако в
последних рекомендациях EULAR не оговаривается, препарат какой группы следует назначать в случае неэффективности
стандартных БПВП. Соответственно, врач может выбрать любой ГИБП или таргетный БПВП с учетом конкретных
обстоятельств. Примером успешного применения олокизумаба у пациента, не ответившего на лечение стандартными БПВП,
может служить следующее наблюдение.
Больная Ж., 38 лет, педагог. Пять лет назад развился полиартрит с поражением
мелких суставов кистей, локтевых и коленных суставов. При обследовании обнаружены повышение СОЭ и СРБ,
резкоположительные РФ и АЦЦП, рентгенологически – эрозивный артрит. Диагностирован РА и начата терапия МТ в дозе до
25 мг/нед в комбинации с низкими дозами глюкокортикостероидов (постепенное снижение до отмены в течение 3 месяцев),
которая в течение 6 месяцев привела к разрешению артрита и нормализации острофазовых показателей. Переносимость
лечения была удовлетворительной. Однако через 1,5 года постоянной терапии при стабильной дозе МТ развилось ухудшение
болезни – умеренная-высокая активность по DAS28-СРБ. В течение следующих 9 месяцев получала метотрексат 25 мг/нед в
сочетании с сульфасалазином 2000 мг/сут, гидроксихлорохином 400 мг/сут, а затем лефлуномидом 20 мг/сут и
преднизолоном 10 мг/сут. Тем не менее, у пациентки сохранялись суставной синдром, повышение СОЭ и СРБ (DAS28-СРБ
составлял 5,7), отмечалось прогрессирование рентгенологических изменений. Учитывая недостаточную эффективность
традиционной терапии БПВП, назначен олокизумаб в дозе 64 мг каждые 4 недели в сочетании с МТ 25 мг/нед. Через 3
месяца самочувствие значительно улучшилось, а DAS28-СРБ снизился до 4,0. Через 6 месяцев достигнута ремиссия артрита
(DAS28-СРБ – 2,1), постепенно отменены глюкокортикостероиды. Переносимость лечения удовлетворительная, нежелательных
эффектов не отмечалось (однократно наблюдалось снижение количества лейкоцитов до 3,8 × 109/л, однако оно
нормализовалось самостоятельно). В настоящее время продолжается комбинированная терапия.
ИЛ-6 – это плеотропный провоспалительный цитокин, который играет важную роль в патогенезе РА и других
иммуновоспалительных ревматических заболеваний [6,7]. В отличие от других ингибиторов ИЛ-6, блокирующих рецепторы
этого цитокина, олокизумаб представляет собой моноклональное антитело, которое непосредственно взаимодействует с
ИЛ-6. Ингибиторы ИЛ-6 обладают выраженной противовоспалительной активностью, поэтому основным доводом в пользу их
назначения пациентам с РА служит высокая активность воспалительного процесса. Например, в приведенном наблюдении у
пациентки отмечались высокие счет опухших суставов и концентрация СРБ несмотря на терапию МТ, сульфасалазином,
лефлуномидом и гидроксихлорохином. Более того, у пациентки было выявлено нарастание рентгенологических изменений в
суставах, а сохранение высокой воспалительной активности позволяло предсказать их дальнейшее прогрессирование.
Очевидно, что в этом случае не было смысла продолжать терапию только стандартными БПВП и необходимо было усилить
базисную терапию путем присоединения ГИБП.
Е.М. Щеголева. Эффективность и безопасность олокизумаба изучались в
плацебо-контролируемых рандомизированных исследованиях у нескольких тысяч пациентов с РА (программа CREDO). В
международное исследование CREDO 1 были включены 428 пациентов с РА умеренной или высокой активности, не ответивших
на терапию МТ [8]. Больные были рандомизированы на три равные группы и получали олокизумаб подкожно в дозах 64 мг
каждые 2 или 4 недели или плацебо в сочетании с МТ в прежней дозе (в среднем около 16 мг/нед) в течение 24 недель.
После завершения двойной слепой фазы пациенты могли завершить терапию или продолжить лечение препаратом в одной из
возможных доз и перейти в открытое наблюдательное исследование. Первичной конечной точкой исследования была частота
ответа по критериям Американской коллегии ревматологов (ACR 20) через 12 недель. Кроме того, оценивали целый ряд
вторичных показателей эффективности и безопасность препарата. Три группы были сопоставимы по основным
клинико-демографическим показателям. В частности, средний возраст пациентов составлял около 50 лет, а более 80% из
них были женщины. Показателями активности заболевания были высокие DAS28-СРБ (в среднем около 6,0), концентрация СРБ
(выше 20 мг/л) и счет опухших суставов (в среднем около 14). По первичному показателю эффективности олокизумаб в
обеих дозах (64 мг каждые 2 или 4 недели) достоверно превосходил плацебо – частота ответа по критериям ACR 20 в трех
группах составила 63,4%, 70,4% и 25,9%, соответственно (p<0,0001 по сравнению с плацебо в обоих случаях).
Статистически значимое преимущество перед плацебо было выявлено и при анализе вторичных показателей эффективности
(табл. 1), в частности доля пациентов, достигших низкой активности РА (DAS28-СРБ<3,2) через 12 недель, при
лечении олокизумабом составила 33,6-38,7%, а при применении плацебо – всего 3,5%. В группе плацебо не было
зарегистрировано ни одного случая ремиссии РА (CDAI<2,8), в то время как при лечении олокизумабом частота
ремиссии через 24 недели составляла 7,7-8,4%. Хотя этот показатель был относительно невысоким, тем не менее, следует
отметить, что он был достигнут у больных с длительным анамнезом заболевания (в среднем около 8 лет) и соответствует
частоте ремиссии при лечении другими ГИБП.
| Олокизумаб 64 мг/2 нед (n=143) |
Олокизумаб 64 мг/4 нед (n=142) |
Плацебо (n=143) |
|
|---|---|---|---|
| Примечание: *p<0,01, ***p<0,001 по сравнению с плацебо | |||
| ACR 20 через 12 недель | 91 (63,6)*** | 100 (70,4)*** | 37 (25,9) |
| DAS28<3,2 через 12 недель | 48 (33,6)*** | 55 (38,7)*** | 5 (3,5) |
| ACR 50 через 24 недели | 61 (42,7)*** | 69 (48,6)*** | 11 (7,7) |
| CDAI<2,8 через 24 недели | 12 (8,4)** | 11 (7,7)** | 0 |
У пациентов с РА часто наблюдается снижение качества жизни в результате боли и скованности в суставах, ограничения
подвижности, усталости, инвалидизации и депрессии [9]. Соответственно, для оценки эффективности лечения РА
необходимо не только определять стандартные показатели клинической активности заболевания, но и исходы, сообщаемые
самим пациентом (patient’s reported outcomes, PROs). Е.Л. Насонов и соавт. [10] проанализировали влияние олокизумаба
на PROs у больных, принимавших участие в исследовании CREDO 1. PROs включали в себя функциональную недостаточность
по индексу HAQ-DI, общую оценку активности заболевания пациентом (PtGA) по визуальной аналоговой шкале (ВАШ), боль
по ВАШ, усталость по шкале FACIT-F, качество жизни по опроснику EQ-5D, физическому и психическому компонентам шкалы
SF-36. Терапия олокизумабом в дозе 64 мг каждые 2 и 4 недели привела к значительному улучшению всех PROs по
сравнению с плацебо через 12 и 24 недели. При лечении ингибитором ИЛ-6 доля пациентов, у которых было отмечено
значительное улучшение общей активности заболевания, боли по ВАШ, счета HAQ-DI и FACIТ-F, значительно превышала
таковую в группе плацебо (рис. 1). Кроме того, лечение привело к улучшению качества жизни, которое оценивали с
помощью физического и психического компонентов шкалы SF-36.
Недавно было завершено исследование CREDO 2, в котором эффективность и безопасность олокизумаба изучали у 1648
С.В. Гуляев. К настоящему времени опубликованы результаты двойных слепых,
С.В. Моисеев. Возможна ли монотерапия олокизумабом или его необходимо всегда
П.И. Новиков. Любые ГИБП и таргетные БПВП следует применять в комбинации с МТ
С.В. Моисеев. РА – это системное заболевание, ко то рое поражает не только
Н.М. Буланов. Внесуставные проявления наблюдаются по крайней мере у 20-40%
Н.В. Чеботарева. К числу висцеральных проявлений любых ревматических
Е.М. Щеголева. Больная М., 58 лет,
Летом 2020 г. пациентка отметила усиление болей и скованности в мелких и крупных суставах верхних и нижних
Н.В. Чеботарева. В данном наблюдении заподозрить АА-амилоидоз у пациентки с
С.В. Моисеев. Разработка оригинального отечественного ингибитора ИЛ-6 имеет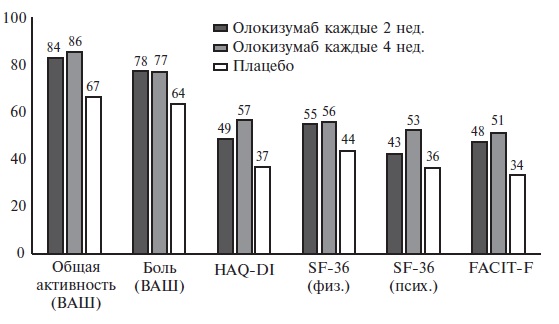
соответствующих показателей
пациентов с РА из 18 стран мира. В этом исследовании, результаты которого были доложены на ежегодном Конгрессе
Британского общества ревматологов, олокизумаб по эффективности также превосходил плацебо и не уступал адалимумабу.
плацебо-контролируемых исследований, которые демонстрируют эффективность олокизумаба у больных, не ответивших не
только на стандартные БПВП, но и ингибиторы ФНО [11]. В 12-недельном плацебо-контролируемом исследовании 2b фазы
сравнивали эффективность олокизумаба подкожно в различных дозах (60, 120 и 240 мг каждые 2 или 4 недели),
тоцилизумаба в дозе 8 мг/кг внутривенно каждые 4 недели и плацебо у 221 пациента со средне-тяжелым или тяжелым РА, у
которых предыдущая терапия ингибитором ФНО оказалась неэффективной (более трети больных имели опыт применения двух и
более препаратов этой группы). Во время исследования большинство пациентов продолжали прием МТ. Первичной конечной
точкой было снижение счета DAS28-СРБ через 12 недель. По этому показателю олокизумаб во всех дозах достоверно
превосходил плацебо и не отличался от тоцилизумаба. Частота ответа по критериям ACR при применении олокизумаба была
выше, чем в группах плацебо (ACR 20: 32,5-60,7% и 17,1-29,9%, ACR 50: 11,5-33,2% и 1,3-4,9%, соответственно), хотя
разница не достигла статистической значимости. Следует отметить, что в этом дозоопределяющем исследовании 2b фазы
пациенты были распределены на 9 групп, поэтому число больных в каждой группе было небольшим (20-23 человек), чем,
вероятно, и объяснялось отсутствие статистически значимой разницы результатов лечения. Сходные данные были получены
в другом плацебо-контролируемом исследовании, которое проводилось в нескольких странах Азии (Японии, Корее и
Тайване) у 119 больных РА, не ответивших на ингибиторы ФНО [12]. В этом исследовании олокизумаб также вызывал более
значительное снижение DAS28-СРБ, чем плацебо. Этот эффект проявлялся уже в течение первой недели после начала
лечения и сохранялся на протяжении 12 недель. Кроме того, при применении олокизумаба было выявлено достоверное
увеличение частоты ответа по критериям ACR 20 и ACR 50 по сравнению с плацебо. В настоящее время завершено
плацебо-контролируемое исследование 3 фазы (CREDO 3) с целью подтверждения эффективности олокизумаба в дозах 64 мг
каждые 2 или 4 недели у пациентов с активным РА, не ответивших на лечение ингибиторами ФНО.
применять в комбинации с МТ или другими стандартными БПВП
или другими БПВП, что позволяет повысить эффективность лечения РА и снизить вероятность образования нейтрализующих
антител. При этом дозу МТ обычно удается снизить до 10 мг/нед. На практике любой ревматолог сталкивается с больными,
которые по тем или иным причинам получают монотерапию ГИБП, например, из-за плохой переносимости МТ или
противопоказаний к его применению. Доля таких пациентов достигает 40% [4]. Эффективность монотерапии олокизумабом в
клини ческих исследованиях не изучалась. Тем не менее, монотерапия другими ингибиторами ИЛ-6 по эффективности
превосходила монотерапию ингибитором ФНО адалимумабом. В связи с этим в рекомендациях EULAR указано, что ингибиторы
ИЛ-6 имеют преимущество перед другими ГИБП, если больной не может одновременно принимать стандартные БПВП. Однако
необходимо еще раз подчеркнуть, что монотерапия ГИБП является скорее вынужденной мерой, чем стандартом лечения РА.
суставы, но и сопровождается различными внесуставными проявлениями, включающими в себя ревматоидные узлы, кожный
васкулит и васкулит других органов, невропатию, плеврит, перикардит, синдром Шегрена, поражение органа зрения
(склерит, эписклерит), легких (интерстициальное заболевание легких) и почек [14]. На важность изучения РА как
системного заболевания еще в 50-х гг. прошлого столетия указывал академик Е.М. Тареев, который писал, что «… нельзя представлять ревматоид как заболевание будто бы только суставов», а
«изучение этого заболевания, несомненно, задерживалось необоснованным узким взглядом на болезнь как на местное
заболевание суставов» [14,15]. Влияет ли олокизумаб на системные проявления РА?
больных РА. Чаще всего встречаются ревматоидные узлы, синдром Шегрена и синдром Рейно [16]. Частота некоторых
внесуставных проявлений может быть выше, чем принято считать. Например, клинически явное интерстициальное
заболевание легких определяется у 2-10% пациентов с РА, в то время как бессимптомные интерстициальные изменения в
легких могут быть выявлены у 30-60% больных [17,18]. В клинических исследованиях, в которых изучаются новые
препараты для лечения РА, оценивается только их влияние на суставные проявления и общую активность заболевания.
Можно предположить, что подавление системного воспаления обеспечит обратное развитие внесуставных проявлений РА или
по крайней мере затормозит их прогрессирование, однако судить об этом можно только на основании ретроспективных
исследований или серий клинических наблюдений. В крупном американском когортном исследовании у 20757 больных РА
лечение ГИБП, проводившееся у 4617 пациентов, ассоциировалось с достоверным снижением риска развития хронической
болезни почек 3б стадии на 29% и прогрессирующего уменьшения расчетной скорости клубочковой фильтрации на 33% [19].
Эффективный контроль воспалительной активности может способствовать и снижению риска сердечно-сосудистых исходов,
который повышен у больных не только с РА, но и другими иммуновоспалительными заболеваниями [20]. Установлено, что
высокое содержание ИЛ-6 коррелирует с риском развития коронарной болезни сердца и является предиктором возникновения
сердечно-сосудистых событий у пациентов со стабильной ишемической болезнью сердца [21]. Некоторые системные
проявления, в том числе поражение почек (различные варианты гломерулонефрита) или легких (интерстициальная
пневмония) и васкулит, диктуют выбор определенных иммуносупрессивных препаратов, прежде всего ритуксимаба, который с
успехом применяют для лечения волчаночного нефрита, АНЦА-ассоциированных васкулитов и поражения легких при системной
склеродермии. В то же время при наличии ревматоидных узлов, плеврита или перикардита можно применять и другие ГИБП,
включая ингибиторы ИЛ-6. Это цитокин играет важную роль в патогенезе многих клинических проявлений РА, в том числе
анемии, инсулинорезистентности, утомляемости, нарушений настроения и остеопороза [7]. В исследовании CREDO 1 лечение
олокизумабом по сравнению с плацебо вызывало достоверное улучшение счета FACIТ-F, который используется для оценки
выраженности усталости (рис. 2) [10]. ИЛ-6 является основным индуктором синтеза гепцидина, который регулирует
метаболизм железа и опосредует развитие анемии при хронических заболеваниях, в том числе у больных РА [22]. В
рандомизированном контролируемом исследовании лечение тоцилизумабом в комбинации с МТ у пациентов с РА привело к
увеличению среднего содержания гемоглобина через 24 недели, в то время как при применении плацебо и МТ этот эффект
отсутствовал [23]. Сходные данные были получены и при лечении сарилумабом. В исследовании MONARCH монотерапия
сарилумабом по сравнению с адалимумабом привела к более значительному снижению доли пациентов с анемией и
достоверному увеличению среднего содержания гемоглобина [24].
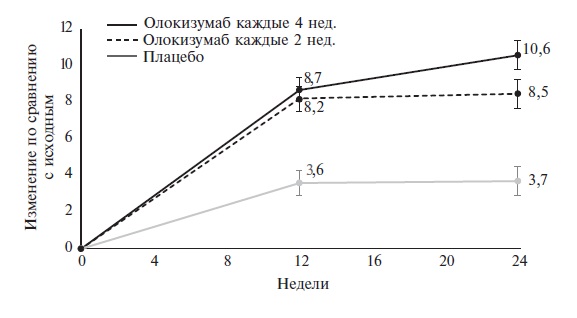
FACIT-F
иммуновоспалительных заболеваний относится поражение почек, основные варианты которого включают в себя
гломерулонефрит, в том числе быстопрогрессирующий, АА-амилоидоз, ревматоидный васкулит и лекарственную нефропатию.
Важную роль в этиологии хронической болезни почек при РА, как и в общей популяции, играют некоторые сопутствующие
заболевания, такие как артериальная гипертония и сахарный диабет 2 типа [25]. Хронический гломерулонефрит при РА
встречается значительно реже, чем при системной красной волчанке. Частота лекарственной нефропатии у больных РА
снизилась за счет более редкого применения нефротоксичных лекарственных препаратов, таких как D-пеницилламин,
циклоспорин и препараты золота, хотя длительный прием нестероидных противовоспалительных препаратов может быть
причиной развития интерстициального нефрита. В то же время олокизумаб, как и другие ИЛ-6, не оказывает
нежелательного действия на функцию почек, а ее снижение не является противопоказанием к назначению этого препарата.
Одним из основных вариантов поражения почек при РА остается АА-амилоидоз [26], хотя частота его также снизилась на
фоне более ранней и агрессивной базисной терапии. АА-амилоид образуется из сывороточного предшественника SAA (serum
amyloid A) – острофазового белка, продуцируемого в значительных количествах в ответ на воспаление. По этои причине
АА-амилоидоз называют также реактивным или вторичным. В то же время причиной AL-амилоидоза является В-лимфоцитарная
дискразия, характеризующаяся формированием аномального клона плазматических или В-клеток в костном мозге, которые
продуцируют аномальные иммуноглобулины, обладающие амилоидогенностью (легкие цепи моноклонального иммуноглобулина,
чаще λ, реже κ-типа) [27]. Два типа амилоидоза значительно отличаются друг от друга по клинической картине. Для
AL-амилоидоза характерна системность с поражением сердца, почек, нервной системы, языка и других органов, в то время
как при AA-амилоидозе прогрессирующее поражение почек – это обычно единственное проявление заболевания, хотя при
гистологическом исследовании отложения амилоида могут быть выявлены и в других тканях. У больных РА развитие
АА-амилоидоза ассоциировалось с большей длительностью заболевания (>15 лет) и недостаточным контролем воспаления,
характеризовавшимся стойким повышением уровня СРБ (>15 мг/л) [28]. Подавление активности РА может предупредить
развитие или прогрессирование АА-амилоидоза у больных РА, что иллюстрирует следующее клиническое наблюдение.
продавец. В 2010 году появились боли и припухание в мелких суставах кистей, сопровождавшиеся скованностью, позднее
присоединились боли в локтевых и коленных суставах. СОЭ 48 мм/ч. При обследовании выявлен высокоположительный РФ.
Диагностирован РА. Принимала диклофенак без эффекта. Добиться уменьшения болей в суставах удалось только после
назначения преднизолона в дозе 30 мг/сут. В течение 6 месяцев получала МТ в дозе 15 мг/нед, а затем 20 мг/нед,
однако в последующем препарат был отменен в связи с повышением активности АСТ до 84 ед/л и АЛТ до 110 ед/л. В
течение нескольких лет проводилась терапия лефлуномидом в дозе 20 мг/сут, однако добиться стойкой ремиссии РА не
удалось. Сохранялись умеренно выраженные боли в суставах и лабораторные признаки активности заболевания (увеличение
СОЭ до 45-50 мм/ч и содержания СРБ до 10-15 мг/л). Попытки присоединения сульфасалазина и гидроксихлорохина к
лефлуномиду также не привели к достижению полного клинического эффекта. С 2019 г. небольшая протеинурия до 0,5
г/сут, которую расценивали как проявление хронического пиелонефрита.
конечностей. Направлена на консультацию в клинику им. Е.М. Тареева. При осмотре выявлены ульнарная деформация
кистей, деформация пальцев по типу «бутоньерки» и «шеи лебедя», вальгусная деформация стоп, припухлость и
болезненность при пальпации лучезапястных суставов, мелких суставов кистей, правого коленного сустава. СОЭ 48 мм/ч,
СРБ 16,2 мг/л, DAS28-СРБ 6,5 баллов. При рентгенографии определялись единичные эрозии и сужение суставных щелей
кистей и стоп. Обращало на себя внимание увеличение протеинурии до 2,8 г/сут. Функция почек была нормальной
(скорость клубочковой фильтрации, рассчитанная по формуле CKD-EPI, 98 мл/мин/1,73 м2). Для уточнения диагноза
выполнена биопсия почки, результаты которой подтвердили наличие AA-амилоидоза. Проба Манту отрицательная. При
рентгенографии грудной клетки изменений в легких не выявлено. Учитывая недостаточную эффективность проводимой ранее
терапии стандартными БПВП, пациентке был назначен олокизумаб в дозе 64 мг подкожно один раз в 2 недели в сочетании с
МТ в дозе 15 мг/нед. Уже через 2 недели после начала лечения пациентка отметила значительное уменьшение боли и
скованности в суставах. Переносимость терапии была хорошей. Через 3 месяца при амбулаторном обследовании в клинике
припухлости и болезненности при пальпации в суставах нет. СОЭ 12 мм/ч, СРБ 0,8 мг/л, DAS28-СРБ 2,2. Протеинурия
снизилась до 1,6 г/сут. В течение последующих 9 мес продолжала лечение, состояние оставалось удовлетворительным,
периодически беспокоили легко выраженные боли в суставах, однако припухлость их и скованность отсутствовали.
Протеинурия не превышала 0,5 г/сут. При обследовании в клинике в апреле 2021 г. года СОЭ 12 мм/ч, СРБ 0,9 мг/л,
протеинурия 0,4 г/сут, расчетная скорость клубочковой фильтрации 92 мл/мин/1,73 м2.
длительным анамнезом РА позволяла нарастающая протеинурия, которая не сопровождалась изменениями мочевого осадка и
артериальной гипертонией. Первоначально появление белка в моче трактовалось как проявление хронического
пиелонефрита, хотя у пациентки с 10-летним анамнезом РА и стойким сохранением высокой воспалительной активности
несмотря на базисную терапию правильнее было бы сразу предполагать диагноз АА-амилоидоза, не дожидаясь дальнейшего
нарастания протеинурии. Изменения в моче и клинические симптомы не позволяют надежно предсказать тип поражения почек
при РА, поэтому пациентам с необъяснимыми протеинурией и хронической болезнью почек показана нефробиопсия. Учитывая
системность заболевания, альтернативой ей может быть биопсия других органов и тканей, например, слизистой оболочки
прямой кишки или подкожной жировой клетчатки. Развитию АА-амилоидоза способствовало сохранение высокой
воспалительной активности РА, которую длительно не удавалось контролировать стандартными БПВП. Эффективность
олокизумаба у больных РА, осложнившимся АА-амилоидозом, не изучалась, хотя в клиническом исследовании применение
этого препарата привело к снижению уровня SAA. Кроме того, опубликовано несколько серий наблюдений, отражающих опыт
применения других ингибиторов ИЛ-6 при этом заболевании. I. Miyagawa и соавт. оценивали эффективность тоцилизумаба
(8 мг/кг каждые 4 недели) у 5 больных РА и АА-амилоидозом [29]. У всех пациентов определялась высокая активность РА
(средний счет CDAI 33,9, средняя концентрация СРБ 29,8 мг/л) несмотря на терапию БПВП или этанерцептом. У 4
пациентов, в том числе у 2 больных, не ответивших на ингибитор ФНО, лечение тоцилизумабом привело к улучшению
почечной дисфункции, включая протеинурию, и значительному снижению концентрации SAA. У всех больных через 1 год не
было выявлено прогрессирования поражения почек, а счет SDAI снизился с 33,9 до 4,7 (р=0,012). Авторы сделали вывод,
что ингибитор ИЛ-6 оказывает благоприятное влияние на течение АА-амилоидоза у больных РА, в том числе при отсутствии
ответа на другие препараты. Y. Okuda и соавт. сопоставили результаты применения тоцилизумаба и ингибиторов ФНО у 42
пациентов с различными ревматологическими заболеваниями, осложнившимися АА-амилоидозом [30]. В течение 5 лет доля
пациентов, продолжавших лечение тоцилизумабом, значительно превышала долю больных, которые продолжали прием
ингибитора ФНО (90,4% и 34,3%, соответственно). При этом медиана содержания SAA снизилась с 219,2 до 5,0 мкг/мл при
применении ингибитора ИЛ-6 и со 143,6 до 38,1 мкг/мл при лечении ингибитором ФНО (р=0,0194), а расчетная скорость
клубочковой фильтрации увеличилась у 72,7% и 34,4% больных, соответственно (р=0,0062). Приведенные данные указывают
на более высокую эффективность ингибиторов ИЛ-6 у пациентов с АА-амилоидозом, что отражает более значительное
снижение содержания острофазовых белков, прежде всего SAA, при лечении препаратами этой группы по сравнению с
таковым при применении ингибиторов ФНО. Однако следует учитывать, что эти результаты были получены не в
рандомизированном клиническом исследовании. В нашем наблюдении назначение олокизумаба позволило добиться не только
быстрого уменьшения воспалительной активности, но и уменьшения протеинурии, хотя срок наблюдения пациентки все же
слишком короткий, чтобы судить о течении АА-амилоидоза.
важное значение для улучшения результатов лечения РА. Эффективность и безопасность олокизумаба у больных РА были
подтверждены в крупных международных клинических исследованиях, которые проводились не только в России, но и во
многих других странах мира. Основным показанием к назначению олокизумаба пациентам с РА является неэффективность по
крайней мере двух стандартных БПВП или противопоказания к их применению. Препарат можно назначать и при отсутствии
ответа на ингибиторы ФНО. Олокизумаб может использоваться в качестве ГИБП не только второй, но и первой линии,
например, при высокой концентрации СРБ и наличии других признаков высокой воспалительной активности заболевания.
Представляет интерес изучение эффективности олокизумаба у пациентов с РА, осложнившимся АА-амилоидозом, учитывая
положительный опыт применения других ингибиторов ИЛ-6 при этом состоянии.
Используемые источники
- van Os J, Kapur S. Schizophrenia. Lancet 2009;374(9690):635-45.
- Levav I, Rutz W. The WHO World Health Report 2001 new understanding new hope. Isr J Psychiatry Relat Sci 2002;39(1):50-6.
- Harvey RC, James AC, Shields GE. A systematic review and network meta-analysis to assess the relative efficacy of antipsychotics for the treatment of positive and negative symptoms in early-onset schizophrenia. CNS Drugs 2016;30(1):2739.
- Fraguas D, Correll CU, MerchЗn-Naranjo J, et al. Efficacy and safety of secondgeneration antipsychotics in children and adolescents with psychotic and bipolar spectrum disorders: comprehensive review of prospective head-to-head and placebo-controlled comparisons. Eur Neuropsychopharmacol 2011;21(8):621-45. Kaguelidou F, Holstiege J, Schink T, et al. Use of antipsychotics in children and adolescents: a picture from the ARITMO population-based European cohort study. Epidemiol Psychiatr Sci 2020;29:e117.
- Pagsberg AK, Tarp S, Glintborg D, et al. Acute antipsychotic treatment of children and adolescents with schizophrenia-spectrum disorders: a systematic review and network meta-analysis. J Am Acad Child Adolesc Psychiatry 2017;56(3):191202.
- Eum S, Lee AM, Bishop JR. Pharmacogenetic tests for antipsychotic medications: clinical implications and considerations. Dialogues Clin Neurosci 2016;18(3):32337.
- Pouget JG, MЯller DJ. Pharmacogenetics of antipsychotic treatment in schizophrenia. Methods Mol Biol 2014;1175:557-87.
- Kapur S, Seeman P. Does fast dissociation from the dopamine d(2) receptor explain the action of atypical antipsychotics?: A new hypothesis. Am J Psychiatry 2001;158(3):360-9.
- Hwang R, Zai C, Tiwari A, et al. Effect of dopamine D3 receptor gene polymorphisms and clozapine treatment response: exploratory analysis of nine polymorphisms and meta-analysis of the Ser9Gly variant. Pharmacogenomics J 2010;10(3): 200-18.
- Blasi G, Selvaggi P, Fazio L, et al. Variation in dopamine D2 and serotonin 5HT2A receptor genes is associated with working memory processing and response to treatment with antipsychotics. Neuropsychopharmacology 2015; 40(7):1600-8. Kang SG, Na KS, Lee HJ, et al. DRD2 genotypic and haplotype variation is associated with improvements in negative symptoms after 6 weeks’ amisulpride treatment. J Clin Psychopharmacol 2015; 35(2):158-62.
- Zhang JP, Robinson DG, Gallego JA, et al. Association of a schizophrenia risk variant at the DRD2 locus with antipsychotic treatment response in first-episode psychosis. Schizophr Bull 2015; 41(6):1248-55.
- Huang E, Maciukiewicz M, Zai CC, et al. Preliminary evidence for association of genome-wide significant DRD2 schizophrenia risk variant with clozapine response. Pharmacogenomics 2016;17(2):103-9.
- Kaur G, Gupta D, Chavan BS, et al. Identification of genetic correlates of response to Risperidone: Findings of a multicentric schizophrenia study from India. Asian J Psychiatr 2017;29:174-182.
- Yoshida K, MЯller DJ. Pharmacogenetics of antipsychotic drug treatment: update and clinical implications. Mol Neuropsychiatry 2020; 5(Suppl 1):1-26.
- Zhang JP, Malhotra AK. Pharmacogenetics and antipsychotics: therapeutic efficacy and side effects prediction. Expert Opin Drug Metab Toxicol 2011;7(1):9-37. Pai P, Arathil P, Kotambail A, et al. Association of GRIN1, ABCB1, and DRD4 genes and response to antipsychotic drug treatment in schizophrenia. Psychiatr Genet 2015;25(3):135-6.
- Terzi T, Kastelic M, Dolan V, Plesniar BK. Genetic polymorphisms in dopaminergic system and treatment-resistant schizophrenia. Psychiatr Danub 2016;28(2):127-31.
- Zhang JP, Lencz T, Zhang RX, et al. Pharmacogenetic associations of antipsychotic drug-related weight gain: a systematic review and meta-analysis. Schizophr Bull 2016;42(6):1418-37. .
- Koning JP, Vehof J, Burger H, et al; Genetic Risk and Outcome in Psychosis (GROUP) investigators. Association of two DRD2 gene polymorphisms with acute and tardive antipsychotic-induced movement disorders in young Caucasian patients. Psychopharmacology (Berl) 2012;219(3):727-36.
- Shaffer D, Gould MS, Brasic J, et al. A children’s global assessment scale (CGAS). Arch Gen Psychiatry 1983;40(11):1228-31.
- Kay SR, Opler LA, Spitzer RL, et al. SCID-PANSS: two-tier diagnostic system for psychotic disorders. Compr Psychiatry 1991;32(4):355-61.
- Busner J, Targum SD. The clinical global impressions scale: applying a research tool in clinical practice. Psychiatry (Edgmont) 2007;4(7):28-37.
- Lingjaerde O, Ahlfors UG, Bech P, et al. The UKU side effect rating scale. A new comprehensive rating scale for psychotropic drugs and a cross-sectional study of side effects in neuroleptic-treated patients. Acta Psychiatr Scand Suppl 1987;334:1-100.
- Simpson GM, Angus JW. A rating scale for extrapyramidal side effects. Acta Psychiatr Scand Suppl 1970; 212:11-9.
- Barnes TR. The Barnes akathisia rating scale revisited. J Psychopharmacol 2003;17(4):365-70.
- Gardner DM, Murphy AL, O’Donnell H, et al. International consensus study of antipsychotic dosing. Am J Psychiatry 2010;167(6):686-93.
- Rodriguez S, Gaunt TR, Day IN. Hardy-Weinberg equilibrium testing of biological ascertainment for Mendelian randomization studies. Am J Epidemiol 2009;169(4):505-14.
- SolО X, GuinЧ E, Valls J, et al. SNPStats: a web tool for the analysis of association studies. Bioinformatics 2006;22(15):1928-9.
- Shen YC, Chen SF, Chen CH, et al. Effects of DRD2/ANKK1 gene variations and clinical factors on aripiprazole efficacy in schizophrenic patients. J Psychiatr Res 2009;43(6):600-6.
- Ikeda M, Yamanouchi Y, Kinoshita Y, et al. Variants of dopamine and serotonin candidate genes as predictors of response to risperidone treatment in first-episode schizophrenia. Pharmacogenomics 2008;9(10):1437-43.
- Zhang JP, Lencz T, Malhotra AK. D2 receptor genetic variation and clinical response to antipsychotic drug treatment: a meta-analysis. Am J Psychiatry 2010;167(7):763-72.
- Lannfelt L, Sokoloff P, Martres M-P, et al. Amino acid substitution in the dopamine D3 receptor as a useful polymorphism for investigating psychiatric disorders. Psychiatric Genetics 1992;2(4), 249–56.
- Noble EP. D2 dopamine receptor gene in psychiatric and neurologic disorders and its phenotypes. Am J Med Genet B Neuropsychiatr Genet 2003;116B:103-25.
Версия на английском языке
Состав
Основной компонент Артлегии представлен олокизумабом. Из дополнительных компонентов выделяют: натрия хлорид, D-глюцит, твин 80, L-гистидина гидрохлорида моногидрат, воду для инъекций.
Форма выпуска
Выпускается как раствор, предназначенный для подкожной инъекции, с дозой 160 мг/мл. Для расфасовки могут быть использованы флаконы или одноразовые стеклянные шприцы.
Лекарственное средство объемом 0,4 мл фасуется в стеклянные флаконы емкостью 2 мл. Укупориваются хлорбутилкаучуковой пробкой, для дополнительной герметизации используются алюминиевые колпачки, снабженные крышкой. Заполненные и укупоренные флаконы упаковываются в пачку из картона, куда вкладывается инструкция.
Дополнительно к флакону лекарственного средства в пачку могут помещаться стерильный шприц емкостью 1 мл, две иглы размером G18 и G27 для набора и введения лекарства подкожно, каждая из которых изготавливается из медицинской стали и защищена пластмассовым колпачком, спиртовые салфетки и инструкция.
Для более удобного применения препарата предусмотрено использование шприца из боросиликатного стекла в качестве первичной упаковки. Готовым раствором (по 0,4 мл) наполняется шприц емкостью 1 мл. В конструкции каждого предусмотрен пластиковый упор для пальцев, в комплект включена стальная игла, которая защищена колпачком из пластика. Шприц закрыт эластичной плунжерной пробкой. В нее ввинчен полипропиленовый шток. Расфасованное лекарство упаковывается в картонный вкладыш, который с салфеткой и инструкцией помещается в пачку.
Фармакологическое действие
Основным компонентом препарата Артлегиа является олокизумаб (ОКЗ). Это гуманизированное моноклональное антитело, содержащее гипервариабельный участок. ОКЗ относится к изотипу IgG4/каппа.
Лекарственное вещество избирательно связывается с интерлейкином-6 и угнетает его действие. Результаты исследований подтверждают, что вещество не взаимодействует с другими мономерами ИЛ-6, а потому не оказывает никакого влияния на их функции, не запускает сигнальный путь интерлейкина-6.
Фармакодинамика и фармакокинетика
Согласно результатам клинических испытаний, после введения лекарства в количестве 1 мг/кг и 3 мг/кг пациентам с подтвержденным РА отмечается уменьшение уровня C-реактивного белка в биоматериале на протяжении первых суток. Этот процесс длится примерно неделю от начала терапии. Минимальное значение C-реактивного белка удается сохранить на протяжении 2,5 месяцев даже после одной инъекции.
Во время проведения испытаний 2-ой фазы с участием пациентов с формой РА с активностью выше средней регулярные инъекции ОКЗ в дозе 60 — 480 мг/мес на протяжении 3-х месяцев показало стойкое уменьшение концентрации C-реактивного белка в исследуемом биоматериале.
Средняя концентрация CРБ в крови пациентов в исследуемых группах была в пределах 5,0 — 11,3 мг/л до подкожной инъекции лекарства, не больше 1 мг/л для изучаемых доз по истечению недели от начала приема и дальше на протяжении всего курса лечения.
В течение 3-ей фазы CREDO 1, CREDO 2 у пациентов с РА, который не контролируется метотрексатом, и в испытаниях CREDO 3 при неэффективности ингибиторов фактора некроза опухоли (ФНО) было доказано, что инъекция 64 мг ОКЗ каждый месяц обеспечивает уменьшение концентрации CРБ до показателей нормы через 2 недели после первой инъекции. Минимальный уровень C-реактивного белка сохраняется полгода.
Терапевтическая эффективность
Для изучения эффекта инъекций ОКЗ подкожно было проведено 3 рандомизированных двойных слепых контролируемых многоцентровых исследования.
Для испытаний CREDO 1 и CREDO 2 было отобрано 428 и 1648 человек, страдающих РА с активностью выше средней, который не контролируется метотрексатом. Участникам был прописан ОКЗ в количестве 64 мг по двум схемам: инъекция каждые 2 и 4 недели или плацебо на протяжении полугода параллельно с лечением метотрексатом, регулярная доза которого составляла 15 — 25 мг в неделю. Если положительный ответ на лечение после 3,5 месяцев приема отсутствует, пациентам рекомендовали параллельный прием гидроксихлорохина, сульфасалазина.
В испытаниях CREDO 3 участвовали 368 человек с РА, характеризующимся степенью активности выше средних показателей, у которых наблюдался недостаточно сильный ответ на лечение ингибиторами ФНО. Участникам вводили 64 мг ОКЗ по стандартной схеме на протяжении полугода или плацебо в течение 4 месяцев.
Через 4 месяца после начала испытаний участники группы плацебо повторно рандомизируются для инъекций 64 мг ОКЗ каждые 2 и 4 недели до завершения полугодовой терапии. Абсолютно все группы испытуемых одновременно принимали фоново 15 — 25 мг метотрексата в неделю. При отсутствии положительного эффекта от подкожного введения ОКЗ после 14 недель соответствующей терапии дополнительно рекомендуются сульфасалазин, гидроксихлорохин.
Доказано, что терапия олокизумабом в обеих дозах вместе с Метотрексатом более действенна, чем совместный приема метотрексата и плацебо. В результате такое лечение способствовало уменьшению выраженности симптоматики РА, позволило сохранить низкую активность заболевания.
Частота ответа на введение ОКЗ в клинических испытаниях изучалась с учетом региона постоянного проживания участника, его пола и возраста, наличия лишней массы тела на момент сбора группы испытуемых, степени проявления и продолжительности сохранения характерной симптоматики, длительности терапии метотрексатом, серологического статуса.
Никакие из указанных факторов не повлияли на ответ на инъекции ОКЗ. Положительное действие заметно уже через месяц терапии, выраженный эффект развивается примерно в течение 3 месяцев от начала подкожного введения лекарства и сохраняется на протяжении не менее полугода.
Фармакокинетика
Биодоступность лекарства определялась на основании результатов испытаний, в которых приняли участие 173 пациента с легкой либо умеренной формой РА. Им вводили Артлегию в разной дозе на протяжении 3 месяцев. Полученные результаты объединили с данными, которые получили от 40 пациентов с легкой либо средней формой РА после одной инъекции разных доз лекарства, и данными от 41 добровольца после введения ОКЗ однократно. Биодоступность Артлегии находится в пределах 63%.
После однократной подкожной инъекции ОКЗ участникам испытаний с легким или умеренным течением РА в расчете 0,3 — 6 мг/кг максимальное содержание лекарства в крови увеличивается в зависимости от дозы.
Через 4 — 12 дней достигается максимальная доза, а поддающееся определению содержание ОКЗ сохраняется на протяжении 4 месяцев.
Максимальная доза активного компонента при однократном введении 64 мг пациентам со средним и тяжелым проявлением симптомов ревматоидного артрита достигается через 10 дней. В случае многократных инъекций содержание ОКЗ в крови постепенно увеличивается в течение начального этапа терапии и достигает равновесного значения через 4 месяца.
Клиренс ОКЗ у пациентов с легкой или умеренной формой ревматоидного артрита не превышает, как правило, 0,17 л/сут.
Скорость уменьшения концентрации C-реактивного белка у пациентов с активной фазой ревматоидного артрита, которые принимали ОКЗ, не определялся дозой лекарства. У больных с легкими и умеренными проявлениями РА была обнаружена положительная корреляция содержания действующего вещества в крови со значениями нейтропении, увеличением содержания АСТ, АЛТ, триглицеридов. К концу 2-ой недели терапии наблюдается устойчивое уменьшение концентрации васкулоэндотелиальных факторов роста, амилоидного сывороточного белка A вне зависимости от дозы приема.
Показания к применению
Показаниями к применению уколов Артлегиа являются:
- ревматоидный артрит со средней/высокой степенью активности при одновременном приеме метотрексата;
- РА при низкой эффективности лечения одним метотрексатом;
- РА при неэффективности монотерапии ингибиторами ФНО;
- для патогенетического лечения цитокинового шторма (потенциально угрожающий жизни системный воспалительный ответ организма на определенные инфекции в виде чрезмерного продуцирования противовоспалительных цитокинов и хемокинов) при коронавирусе средней и тяжелой формы.
Противопоказания
Противопоказаниями к применению лекарственного средства считаются:
- повышенная чувствительность к действующему и вспомогательным веществам;
- активная фаза инфекционных болезней;
- возраст пациента менее 18 лет;
- фруктоземия (генетическая непереносимость фруктозы);
- лактация.
Побочные действия
Как правило, прием лекарственного препарата не провоцирует появления нежелательных эффектов. Однако иногда возникают следующие побочные действия:
- инфекционные и паразитарные болезни: скрытое течение туберкулеза, фарингит (воспаление глотки), конъюнктивит (раздражение конъюнктивы глаза в ответ на действие раздражающих факторов), сепсис (заражение крови), флегмона (острое разлитое гнойное воспаление жировой клетчатки), пневмония (воспаление легочной ткани), абсцесс (гнойное воспаление тканей с их расплавлением и образованием гнойной полости), фолликулит (гнойное воспаление волосяного фолликула), грибковое поражение кожи, инфекции, спровоцированные Helicobacter, паронихия (воспаление околоногтевого валика), онихомикоз (грибковое поражение ногтевой пластины), периодонтит (воспаление периодонта), вульвовагинальный микоз;
- в функциях лимфатической системы и крови: лейкопения (снижение количества лейкоцитов в единице крови), нейтропения (уменьшение числа нейтрофилов), тромбоцитопения (число тромбоцитов ниже 150*109/л), лимфоцитоз (увеличение количества лимфоцитов), лимфаденопатия (увеличение лимфатических узлов), эозинофилия (абсолютное повышение числа эозинофилов), увеличение числа эритроцитов;
- в функциях иммунной системы: повышенная чувствительности к препарату;
- в функциях эндокринной системы: гипотиреоз (состояние, при котором наблюдается стойкий недостаток гормонов щитовидной железы);
- в функциях метаболизма: гиперхолестеринемия (высокий уровень холестерина), гипертриглицеридемия (высокое содержание триглицеридов), гиперлипидемия (высокая концентрация липидов), сахарный диабет (состояние, которое характеризуется высоким уровнем глюкозы, возникающим из-за нарушения выработки инсулина и/или дефекта его действия), гиперкалиемия (повышенное содержание калия), гипернатриемия (высокий уровень натрия), избыточный вес, недостаток витамина D;
- в функциях психики: нарушения сна, вплоть до бессонницы;
- в функциях нервной системы: проявления шейно-плечевого синдрома, приступы мигрени, парестезия (ощущение жжения, покалывания), ишиас (невралгия седалищного нерва), вертебро-базиллярная недостаточность (нарушение работы головного мозга из-за ослабления кровотока в позвоночной или базиллярной артериях);
- в функциях зрения: катаракта (помутнение хрусталика), конъюнктивит аллергической этиологии, отек века, кератит (воспаление роговицы глаза);
- в функциях слуха: тиннит (шум в ушах);
- в функциях сердечно-сосудистой системы: стенокардия («грудная жаба»), фибрилляция предсердия, тахикардия, брадикардия (замедление частоты сердечных сокращений до менее чем 60), желудочковые экстрасистолы, недостаточность митрального клапана, атеросклероз аорты, тромбоз глубоких вен, диабетическая ангиопатия (поражение крупных и мелких кровеносных сосудов);
- в функциях дыхательной системы: астма, коллапс легкого, дисфония (качественное нарушение голосовой функции), носовое кровотечение, интерстициальное заболевание легких, боль в горле, ринорея (обильные слизистые выделения), вазомоторный ринит;
- в функциях ЖКТ: диарея, абдоминальная боль, стоматит (воспаление слизистой рта), вздутие, запор, кариес, полип желудка, гастрит (воспалительные или воспалительно-дистрофические изменения слизистой желудка), геморрой, боль при глотании;
- в функциях печени: повышение активности АЛТ, АСТ, печеночных энзимов, трансаминаз, повышенное содержание ФПП, прямого и непрямого билирубина, холелитиаз, нарушения работы печени;
- в функциях кожи: высыпания, солнечный кератоз (нарушение строения эпидермиса), экхимоз (кровоизлияния в кожу диаметром более 3 мм), эритема (ограниченное интенсивное покраснение), гипергидроз (повышенное потоотделение), гиперкератоз (аномальное утолщение эпидермиса), реакции фоточувствительности, зуд;
- в функциях скелетной, мышечной, соединительной ткани: миозит (воспалительное поражение скелетной мускулатуры), поражение межпозвоночных дисков, суставный выпот, остеохондроз (дегенеративное изменение позвонков и межпозвоночных дисков), остеопороз (состояние, характеризующееся изменением структуры костной ткани), подошвенный фасциит (воспалительно-дегенеративное изменение плантарной фасции);
- в функциях мочевыделительной системы: гематурия (повышенное содержание эритроцитов в моче), нефролитиаз (мочекаменная болезнь), нефропатия (поражение клубочкового аппарата и паренхимы почек), протеинурия (выделение белка в моче), почечные колики;
- в репродуктивных функциях: маточное кровотечение;
- в месте инъекции: эритема, зуд, кровотечение;
- общие нарушения: астения.
В результатах лабораторных анализов возможно повышение содержания ГГТ, уровня адипонектина и гемоглобина, показателей гематокрита, положительный тест на микобактерии туберкулеза.
Артлегиа, инструкция по применению (Способ и дозировка)
Использование при РА
Лекарство предназначено для подкожной инъекции в бедро, переднюю брюшную стенку. Однократная доза подразумевает введение 0,4 мл, что соответствует дозе вещества 160 мг/мл. Предварительно лекарство рекомендуется нагреть в руке или оставив на столе вдали от прямых солнечных лучей до комфортной температуры. При этом хранить вне холодильника (более 8 градусов) можно не больше 4 ч.
Процедура проводится под тщательным контролем медицинского персонала. Для своевременного предупреждения аллергических реакций за изменением самочувствия пациента нужно наблюдать минимум полчаса по окончанию манипуляции. Когда пациент научиться самостоятельно выполнять подкожные инъекции, он сможет проводить процедуру вне стен лечебного учреждения. Однако такое решение принимает исключительно специалист, который имеет опыт диагностики и терапии РА. Инъекция лекарственного средства осуществляется одноразовыми шприцами. Многократное использование недопустимо.
Введение пропущенной дозы
После вынужденного пропуска укола процедуру следует провести максимально быстро. Промежуток между манипуляциями — не меньше половины интервала подобранной схемы.
| Подобранный график введения лекарства | Интервал пропуска | Необходимые действия |
| 64 мг каждые 4 недели |
Меньше 14 дней Больше 14 дней |
Провести процедуру и дальше следовать установленному режиму. Отменить пропущенную инъекцию |
| 64 мг каждые 2 недели |
Меньше 7 дней Больше 7 дней |
Выполнить манипуляцию и далее следовать графику Отменить |
Отмена лекарственного средства
Лечение олокизумабом рекомендуется прекратить, если отмечается стойкий рост биохимических параметров работы печени в виде:
- увеличение содержания АЛТ/АСТ больше 8 верхних значений нормы без учета концентрации общего билирубина, наличия сопутствующих признаков;
- увеличение концентрации АЛТ/АСТ больше 5 ВГН на протяжении больше 2-х недель после укола без учета показателя общего билирубина;
- увеличение АЛТ/АСТ больше 3 ВГН, значения общего билирубина более 2 ВГН;
- рост АЛТ/АСТ больше 3 ВГН на фоне признаков поражения печени, появляются постоянная апатия, приступы тошноты вне зависимости от приемов пищи, дискомфорт в верхнем правом квадранте живота, высыпания, незначительное повышение температуры тела;
- лабораторные отклонения в виде таких показателей, как абсолютное число нейтрофилов менее 500/мм3, число лимфоцитов меньше 500*106/л в проведенных подряд 2 исследованиях, тромбоцитов менее 50*109/л;
- во время терапии обнаружилась беременность;
- при прободении слизистой ЖКТ;
- при присоединении тяжелой инфекции.
Режим дозирования
Терапевтическая доза — по 64 мг 1 раз каждый месяц. Если сохраняется высокая активность РА с DAS28 больше 6,9, врач может рекомендовать увеличить кратность инъекций лекарства до 64 мг каждые 2 недели.
Использование для предупреждения «цитокинового шторма» при коронавирусе
Лекарство следует вводить подкожно по 0,4 мл раствора. Перед проведением процедуры для более комфортного введения его рекомендуется нагреть до комфортной температуры. При этом хранить его вне условий холодильника допускается не больше 4 часов.
Рекомендуемая разовая доза — 64 мг.
Особая группа пациентов
Можно не корректировать дозу для пациентов в возрасте от 65 лет.
Степень безопасности лекарства при подтвержденной почечной недостаточности не определялась.
Уточнений по лечению пациентов с данной патологией лекарством с ОКЗ нет.
Правила подготовки к процедуре введения
Флакон, предварительно наполненный шприц с ОКЗ извлекают из холодильника. Нужно подождать около полчаса перед процедурой, чтобы содержимое стало комфортной для введения температуры. Подогревать лекарство на сторонних источниках тепла нельзя.
Руки нужно вымыть теплой водой с использованием мыла, выбрать ровную поверхность и осмотреть флакон с ОКЗ. Запрещено введение лекарства:
- если оно хранилось в несоответствующих условиях более 4 часов;
- название указано с ошибкой;
- срок годности истек;
- на флаконе, шприце обнаруживаются трещины, сколы, утечка содержимого;
- раствор помутнел, изменил окрашивание, появились хлопья, сторонние частицы.
Лекарство, расфасованное в шприц, готово к применению. При отсутствии противопоказаний можно проводить процедуру.
Лекарство во флаконе следует подготовить к введению точно следуя приложенной инструкции.
На подготовленную поверхность нужно выложить одноразовый шприц объемом 1 мл, 2 стерильные иглы (18G используется для набора лекарства, 27G — для подкожного введения), 2 салфетки.
На шприц надевают, не снимая колпачок, иглу 18G для забора содержимого. С флакона удаляют пластмассовую крышку, протирают пробку салфеткой, пропитанной этиловым спиртом.
Шприц нужно взять правой рукой, снять колпачок и ввести иглу вертикально в центральную часть резиновой пробки. Кончик иглы должен просматриваться внутри.
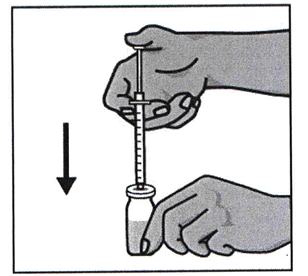
Флакон берут левой рукой, переворачивая его, чтобы содержимое было над пробкой. Шприц удерживают правой рукой, оттягивают поршень вниз, набирая всю жидкость.
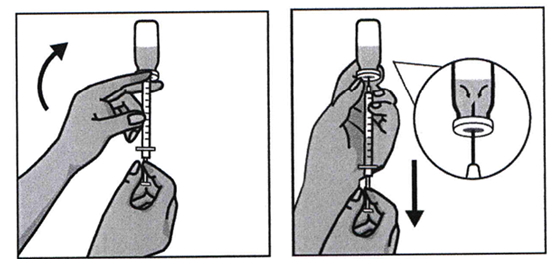
Иглу вытаскивают и закрывают защитным колпачком. После этого ее заменяют на иглу 27G для введения лекарства.
Важно! Не следует проводить инъекцию иглой, предназначенной для набора содержимого, поскольку это может стать причиной болезненности процедуры и сторонних повреждений в месте введения.
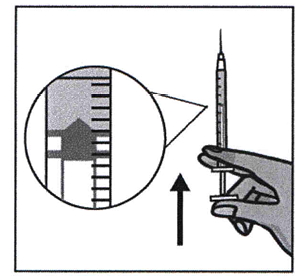
Защитный колпачок аккуратно снимают. Прикасаться к игле нельзя. Шприц следует удерживать в вертикальном положении. Перед инъекцией по шприцу следует постучать пальцами для того, чтобы пузырьки воздуха, которые попали во время набора из флакона, поднялись вверх. После этого поршень медленно сдвигают, удаляя воздух и лишний раствор до 0,4 мл.
Наполненный шприц помещают в упаковку так, чтобы игла ее не касалась.
Следует выбрать место для введения лекарства. Для этого подходит верхняя часть бедра либо живот, но на расстоянии не меньше 5 см от пупка. Если процедура проводится медработником, он может предложить другие зоны, которые также подходят для подкожной инъекции. Запрещено делать уколы в родинки, пигментные пятна, шрамы, уплотнения любой этиологии, гиперемию.
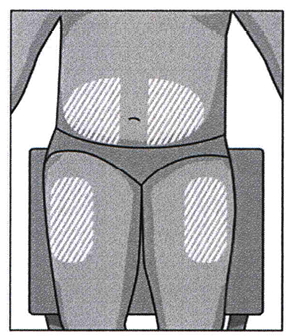
Следует периодически менять зону инъекции таким образом, чтобы новая находилась на расстоянии не меньше 2,5 см от предыдущей. Допустимо поочередное введение лекарства в область живота и бедер.
Непосредственно введение лекарственного средства. Кожу протирают новой салфеткой со спиртом, дают ей высохнуть. Не прикасаясь к зоне введения, кожу вокруг нее аккуратно сжимают второй рукой и плотно удерживают.
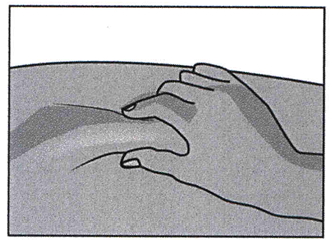
Шприц держат ведущей рукой над предполагаемым местом укола под углом 90 град. Быстрым толкающим движением иглу вводят в кожу. При малом количестве подкожного жира, допустим угол введения в 45 град.
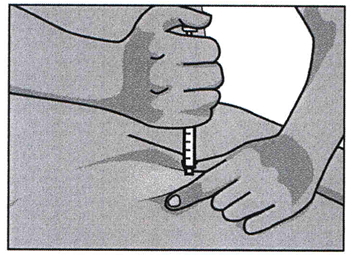
Во избежание болезненности рекомендуется вводить препарат медленно. Следует подождать 10-15 секунд и потом извлечь иглу под тем же углом, под которым ее ранее ввели. Допустимо появление небольшого кровотечения.
Использованный шприц помещают в емкость для острых предметов. Для введения лекарства всегда следует использовать новый шприц, чтобы избежать вторичного инфицирования и травмирования места инъекции.
Передозировка
Во время проведения испытаний случаев передозировки ОКЗ зарегистрировано не было. При этом результаты подтверждают, что общий профиль безопасности действующего вещества при введении лекарства по 240 мг каждые 2 недели на протяжении 3 месяцев вполне сопоставим с ОПБ у категории больных, получавших рекомендованные дозы.
Взаимодействие
Терапия олокизумабом и метотрексатом не показала отрицательного влияния на экспозицию ОКЗ.
Отсутствуют терапевтически значимые данные о каком-либо влиянии ОКЗ на экспозицию метотрексата. Во время всех испытаний у пациентов с РА олокизумаб вводился подкожно на фоне приема метотрексата.
Взаимодействие ОКЗ с другими лекарственными средствами специально не изучалось в рамках проведенных исследований. В группе CREDO 1 данных о значимом взаимодействии действующего вещества с другими лекарствами также нет.
В рамках изучения in vitro с использованием человеческих гепатоцитов была доказана способность ОКЗ предотвращать угнетающий эффект ИЛ-6 на активность 2C19, CYP1A1/2, 3A4/5, 2B6, 2C9, NTCP. Полученные результаты указывают на то, что пациентам с активной формой РА требуется коррекция доз лекарственных средств, которые преобразуются указанными изоформами CYP, сразу же после введения ОКЗ.
При необходимости совместного применения с ОКЗ нужно учитывать возможное снижение концентрации препаратов таких групп:
- статины (Аторвастатин, Симвастатин);
- антагонисты кальция (Верапамил, Дилтиазем, Амлодипин);
- глюкокортикостероиды (Дексаметазон, Преднизолон);
- антикоагулянты непрямого действия (Варфарин);
- оральные контрацептивы (Логест, Ярина, Чарозетта);
- антиаритмические препараты IA (Хинидин);
- бронходилатирующие средства (Теофиллин);
- миорелаксанты прямого действия (Тизанидин);
- противоэпилептические (Фенитоин);
- антипсихотические (Пимозид);
- иммунодепрессанты (Циклоспорин, Сиролимус);
- бензодиазипины (особенно внимательным следует быть с содержанием Диазепама, Алпразолама, Триазолама, Мидазолама, Бромазепама).
Условия продажи
Отпуск — по рецепту врача.
Условия хранения
Следует хранить в холодильнике при температуре от 2 до 8 градусов. Замораживать запрещено.
Срок годности
3 года.
Запрещен к применению по окончанию срока годности.
Особые указания
Вероятность возникновения анафилактических реакций: инъекции лекарственных средств, которые содержат белковые компоненты, часто связаны с развитием иммунологической/неиммунологической реакции гиперчувствительности, бывающими иногда крайне тяжелыми. Подобные состояния проявляются в форме острой инфузионной, аллергической или реакции сенсибилизации замедленного типа. Поэтому первая процедура обязательно проводится в медицинском учреждении, чтобы вовремя предупредить любые осложнения.
Инфекции: для пациентов, которые принимают иммунносупрессоры, свойственна повышенная вероятность возникновения тяжелых инфекций. Нельзя начинать терапию препаратом ОКЗ тем, у кого выявлена активная фаза любого воспалительного процесса. С особой осторожностью Артлегиа рекомендуется при высокой вероятности вторичного инфицирования. При тяжелом течении инфекции терапию ОКЗ нужно прервать. Таким пациентам следует детально рассказать о возможных проявлениях и симптоматике инфекционных заболеваний, которые требуют срочного обращения к специалисту.
Туберкулез: перед началом лечения ОКЗ проводится обследование, которое поможет своевременно обнаружить латентную форму заболевания. При выявлении туберкулезного поражения легких следует сначала пройти стандартный курс терапии. Особого внимания требует назначение ОКЗ пациенту, который тесно контактирует с лицом, у которого диагностирована активная форма туберкулеза. Сначала нужно оценить соотношение риска и пользы от терапии.
Вероятность прободения стенок ЖКТ: особенно возрастает на фоне подтвержденного дивертикулита. В группе риска также находятся пациенты, в анамнезе которых указаны случаи желудочных кровотечений.
Появление любых желудочно-кишечных симптомов во время терапии ОКЗ требует срочной консультации гастроэнтеролога.
Почечная недостаточность: в клинических испытаниях ОКЗ не принимали участия пациенты с указанной патологией. Поэтому важно соблюдать осторожность при введении лекарства данной группе пациентов.
Дисфункция печени: ОКЗ провоцирует увеличение концентрации АСТ, АЛТ, гамма-глутамилтрансферазы. Однако больных, у которых АСТ или АЛТ выше 1,5 ВГН, не включали в испытания. В связи с этим, применение ОКЗ при патологиях печени должно проходить с особой осторожностью.
Контроль лабораторных показателей крови: в результатах испытаний отмечено снижение уровня лейкоцитов и нейтрофилов во время инъекций ОКЗ. Назначение других ингибиторов ИЛ-6 не вызывало увеличения частоты присоединения вторичных инфекций при нейтропении. Для программа клинических испытаний не подходят пациенты, у которых уровень лейкоцитов был ниже 3,5*109/л, а нейтрофилов менее 2000/мм3.
Иммунизация: не устанавливалась безопасность назначения живых вакцин.
Новообразования злокачественной природы: безопасность терапии ОКЗ у пациентов со злокачественной опухолью не изучалась; вероятность возникновения новообразований не известна.
Влияние на возможность управления транспортом
Дополнительные исследования для определения влияния лекарственного средства на способность управлять транспортом не проводились. Во время лечения ОКЗ не наблюдалось приступов головокружения. Однако в очень редких случаях возможна головная боль и головокружение, поэтому пациентам с подобными симптомами рекомендуется не управлять транспортом в период приема Артлегии.
Аналоги Артлегиа
Совпадения по коду АТХ 4-го уровня:
Артлегиа не имеет аналогов по действующему веществу, однако есть препараты, которые относятся к одной фармакологической группе и применяются по одинаковым показаниям. К подобным лекарственным средствам относятся:
- Генолар, лиофилизат для приготовления раствора для подкожного введения;
- Иларис, раствор для подкожного введения;
- Ксолар, раствор для подкожного введения;
- Энбрел, раствор для подкожного введения.
Синонимы
Лекарственных препаратов, которые содержат ОКЗ, помимо Артлегии, нет на фармацевтическом рынке. Замена другим лекарственным средством, содержащим другое действующее вещество для лечения РА возможна только после консультации с лечащим врачом.
Артлегиа при коронавирусе
Лекарственное средство Артлегиа можно применять в рамках патогенетического лечения синдрома высвобождения цитокинов при ковиде среднетяжелой и тяжелой формы. Новый штамм коронавирусной инфекции проявляется формированием системного гипервоспаления. Такая реакция обусловлена активным синтезом провоспалительных цитокинов, что провоцирует повреждение тканей и внутренних органов.
Развивается так называемый «цитокиновый шторм». Это опасное осложнение значительно ухудшает течение заболевания и дальнейший прогноз.
ИЛ-6 считается одним из основных цитокинов, провоцирующих гипервоспаление. Его угнетение позволяет предупредить гипериммунную реакцию.
Препарат Артлегиа от коронавируса — первый в стране ингибитор ИЛ-6, угнетающий именно цитокин, а не его рецептор. Поэтому утверждение нового показания позволяет специалистам быстро принимать решения о своевременном назначении антицитокиновой терапии. Даже непродолжительные исследования подтверждают высокую эффективность лекарства от коронавируса.
Детям
Степень эффективности и безопасности лекарственного средства, содержащего ОКЗ, у детей младше 18 лет пока не определены. Поэтому данных по его применению нет. В связи с этим, препарат противопоказан до достижения 18 лет.
С алкоголем
Клинические исследования не показали значимого взаимодействия лекарственного средства с этанолом. Однако Артлегиа и спиртные напитки несовместимы, поскольку алкоголь нельзя употреблять при заболеваниях, которые лечат ОКЗ.
При беременности и лактации
В рамках клинических испытаний не проводились исследования по применению ОКЗ у беременных. Однако считается, что ИЛ-6 участвует в раскрытии шейки матки, последующем рождении плаценты. В связи с этим, лекарственное средство может нарушить ход родовой деятельности.
Перед применением лекарства с ОКЗ женщинам рекомендуется провести тест на беременность. Специалист должен объяснить риск приема лекарства у беременных, указать на необходимость использования подобранных гинекологом средств контрацепции и выполнении тестов с определением уровня ХГЧ на регулярной основе во время терапии и еще минимум полгода по ее окончанию. При наступлении беременности следует сразу же сообщить врачу и прекратить применение ОКЗ.
Применять лекарство при беременности можно только в случае очевидной клинической необходимости, когда эффективность для матери превышает риск возможных осложнений для плода.
Лактация
Нет подтвержденных данных о негативном воздействии лекарства на здоровье ребенка, находящегося на грудном вскармливании. Поскольку Артлегиа применяется вместе с метотрексатом, который выделяется в грудное молоко, следует прервать вскармливание ребенка во время терапии ОКЗ.
Отзывы об Артлегиа
Положительные отзывы пациентов подтверждаются отчетами врачей о высокой эффективности лекарственного препарата с ОКЗ. Несмотря на высокую эффективность при коронавирусе, препарат не является специфическим средством для лечения этого заболевания. Он помогает предупредить опасные для жизни осложнения. Однако самостоятельно его включать в схему лечения нельзя даже после подтверждения диагноза.
Чаще всего Артлегиа используется для лечения ревматоидного артрита. Высокая эффективность лекарственного препарата подтверждается положительным отзывами специалистов и пациентов.
Цена Артлегиа, где купить
Лекарство Артлегиа является достаточно специфическим, поэтому его нужно предварительно заказать в аптеке. Где купить препарат в Москве и есть ли он в наличии, можно посмотреть в интернете. Стоимость лекарства варьируется
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Артлегиа раствор для п/к введ. фл. 160мг/мл 0,4млАО Р-Фарм/АО Ортат
показать еще
Способ применения и дозировка
Препарат Артлегиа вводится подкожно, в область бедра или передней брюшной стенки, 0,4 мл раствора с концентрацией 160 мг/мл единовременно.
Перед введением раствор следует нагреть до комнатной температуры.
Время хранения препарата при температуре >8 °С не должно превышать 4 часов.
Состав
На 1 мл:
Действующее вещество: олокизумаб — 160,0 мг
Вспомогательные вещества: натрия хлорид, полисорбат 80, L-гистидина гидрохлорида моногидрат, сорбитол, вода для инъекций.
Фармакотерапевтическая группа
Ингибиторы интерлейкина
Показания
Терапия пациентов старше 18 лет с ревматоидным артритом средней или высокой степени активности в комбинации с метотрексатом, при недостаточной эффективности монотерапии метотрексатом.
Противопоказания
- Гиперчувствительность к олокизумабу, любому компоненту препарата в анамнезе.
- Активные инфекционные заболевания (в том числе и туберкулез).
- Детский возраст до 18 лет.
- Наследственная непереносимость фруктозы (препарат содержит сорбитол).
- Беременность.
- Период грудного вскармливания.
Побочное действие
Инфекции и паразитарные заболевания: часто — бронхит; нечасто — легочный туберкулез, кандидоз кожи, вульвовагинальный кандидоз, отрубевидный лишай, подкожный абсцесс, рожистое воспаление, сепсис, вызванный стафилококковой инфекцией, синдром токсического шока.
Со стороны обмена веществ: очень часто — лейкопения, нейтропения; нечасто — гиперхолестеринемия.
Со стороны печени и желчевыводящих путей: очень часто — повышение активности АСТ, повышение активности АЛТ; часто — повышение активности ГГТ.
Со стороны кожи и подкожных тканей: часто — зуд, сыпь; нечасто — изменение цвета пота, дерматит, экхимоз, зудящая сыпь.
Общие нарушения и реакции в месте введения: нечасто — боль в месте инъекции, эритема.
Лабораторные и инструментальные данные: часто — позитивный тест на микобактерию туберкулеза.
Условия хранения
В защищённом от света месте при температуре от 2 до 8 °С.
Хранить в недоступном для детей месте.
Не замораживать.
Срок годности
3 года
Хранятся в холодильнике
Да
Содержит спирт
Нет
Кодеинсодержащий
Нет
Наркотический/Психотропный
Нет
Обращаем ваше внимание, что инструкция к товарам может меняться. Для уточнения актуальной информации обратитесь к оригинальной инструкции.
Самовывоз в Москве
Горздрав
Москва, ул. Бауманская, 35/1
36,6
Москва, ул. Маршала Бирюзова, 16
Горздрав
Москва, ул. Земляной вал, 27, стр.2
Горздрав
Москва, ул. Генерала Белова, 35
Ригла
Москва, ул. Грузинский Вал, 26, стр.1
Ригла
Москва, ул. Никольская, 10/2, стр.2Б
Горздрав
Москва, ул. Гарибальди, 3
Аптеки в вашем городе 2397 аптек
Планета Здоровья
— 227 аптек
Все сети аптек в вашем городе
Кратко о товаре Артлегиа раствор для подкожного введения 160 мг/мл шприц 0,4 мл в Москве
Купить Артлегиа раствор для подкожного введения 160 мг/мл шприц 0,4 мл в Москве можно в удобной для вас аптеке, сделав заказ на Мегаптека.ру
Цена на Артлегиа раствор для подкожного введения 160 мг/мл шприц 0,4 мл в Москве – от 50677 рублей
Инструкция по применению для Артлегиа раствор для подкожного введения 160 мг/мл шприц 0,4 мл
