Орунгамин® (Orungamin) инструкция по применению
📜 Инструкция по применению Орунгамин®
💊 Состав препарата Орунгамин®
✅ Применение препарата Орунгамин®
📅 Условия хранения Орунгамин®
⏳ Срок годности Орунгамин®
Описание лекарственного препарата
Орунгамин®
(Orungamin)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2021 года.
Дата обновления: 2021.10.13
Владелец регистрационного удостоверения:
Контакты для обращений:
ОЗОН ООО
(Россия)
Код ATX:
J02AC02
(Итраконазол)
Лекарственная форма
| Орунгамин® |
Капс. 100 мг: от 4 до 140 шт. рег. №: ЛП-(000637)-(РГ-RU) Предыдущий рег. №: Р N002656/01 |
Форма выпуска, упаковка и состав
препарата Орунгамин®
Капсулы твердые желатиновые, размер №0, корпус прозрачный, крышечка синего цвета непрозрачная; содержимое капсул — сферические пеллеты белого или почти белого цвета.
* пеллет итраконазола (22%) — 455 мг.
Состав на 1000 г пеллет: действующее вещество: итраконазол — 220 мг;
вспомогательные вещества: сахароза — 117.05 г, сахарная крупка (сахароза, патока крахмальная) — 347.19 г, гипромеллоза — 280.53 г, метилпарагидроксибензоат натрия — 0.165 г, пропилпарагидроксибензоат натрия — 0.015 г, эудрагит Е-100 — 35.05 г.
Состав корпуса капсулы: желатин — до 100%.
Состав крышечки капсулы: краситель индигокармин — 0.0471%, титана диоксид — 1%, желатин — до 100%.
4 шт. — упаковки ячейковые контурные (1) — пачки картонные.
7 шт. — упаковки ячейковые контурные (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные (3) — пачки картонные.
Фармакологическое действие
Синтетический противогрибковый препарат широкого спектра действия, содержащий итраконазол — производное триазола. Механизм действия итраконазола заключается в ингибировании биосинтеза эргостерола — основного компонента клеточной мембраны гриба, участвующего в поддержании структурной целостности мембраны. Нарушение синтеза эргостерола приводит к изменению проницаемости мембраны и лизису клетки, что и обусловливает противогрибковый эффект препарата.
Итраконазол активен в отношении инфекций, вызываемых грибами:
- дерматофитами (Trichophyton spp., Microsporum spp., Epidermophyton floccosum);
- дрожжеподобными грибами Candida spp. (включая Candida albicans, Candida tropicalis, Candida parapsilosis, Candida krusei, Cryptococcus neoformans, Malassezia spp. Trichosporon spp, Geotrichum spp.), Aspergillus spp., Blastomyces dermatitidis, Cladosporium spp., Coccidioides immitis, Cryptococcus neoformans, Geotrichum spp., Histoplasma spp., включая Histoplasma capsulatum, Paracoccidioides brasiliensis, Sporothrix schenckii, Fonsecaea spp.; Cladosporium spp.; Blastomyces dermatitidis; Coccidioides immitis; Pseudallescheria boydii; Penicillium marneffei) и многими другими.
Candida krusei, Candida glabrata и Candida tropicalis являются наименее чувствительными к действию итраконазола видами Candida.
Основными типами грибов, развитие которых не подавляется итраконазолом, являются Zygomyces (Rhizopus spp., Rhizomucor spp., Mucor spp., Absidia spp.), Fusarium spp., Scedosporium spp. и Scopulariopsis spp.
Устойчивость к азолам развивается медленно и часто является результатом нескольких генетических мутаций. Описанные механизмы развития устойчивости включают в себя гиперэкспрессию гена EGR11, кодирующего фермент 14α-деметилазу, который является основной мишенью действия азолов, и точечные мутации EGR11, приводящие к уменьшению связывания ферментов с азолами и/или к активации транспортных систем, что приводит к увеличению выведения азолов. Наблюдалась перекрестная устойчивость Candida spp. к препаратам группы азолов, хотя устойчивость к одному препарату этой группы не обязательно означает наличие устойчивости к другим препаратам группы азолов. Сообщалось о штаммах Aspergillus fumigatus, устойчивых к итраконазолу.
Фармакокинетика
Максимальная концентрация (Cmax) неизменного итраконазола в плазме достигается в течение 2-5 ч после перорального приема. Вследствие нелинейной фармакокинетики итраконазол накапливается в плазме крови при многократном приеме. Равновесная концентрация (Сss) итраконазола, как правило, достигается в течение примерно 15 дней, при этом значения Cmax итраконазола и AUC (площадь под кривой «концентрация-время») при многократном приеме в 4-7 раз выше, чем при однократном приеме. Максимальная равновесная концентрация итраконазола в плазме крови (Сss max) составляет около 2 мкг/мл при применении 200 мг итраконазола 1 раз/сут. Конечный период полувыведения (Т1/2) обычно составляет 16-28 ч при однократном приеме и 34-42 ч при многократном приеме. Концентрация итраконазола в плазме крови снижается до практически неопределяемого значения в течение 7-14 дней после прекращения терапии в зависимости от назначенной дозы и продолжительности лечения. Клиренс итраконазола уменьшается при более высоких дозах в связи с насыщением путей его метаболизации в печени.
Всасывание
Итраконазол быстро абсорбируется после приема внутрь. Cmax неизмененного итраконазола в плазме крови достигается после 2-5 ч после приема внутрь. Абсолютная биодоступность итраконазола после приема внутрь составляет около 55%. После приема внутрь максимальная биодоступность итраконазола отмечается при приеме капсул сразу после приема пищи.
Всасывание итраконазола в капсулах снижено у пациентов с пониженной кислотностью желудочного сока, например, на фоне приема препаратов, подавляющих секрецию соляной кислоты в желудке (таких как антагонисты гистаминовых Н2-рецепторов, ингибиторы протоновой помпы), или у пациентов с ахлоргидрией на фоне различных заболеваний. Всасывание итраконазола натощак у таких пациентов увеличивается при приеме одновременно с кислыми напитками (такими как недиетическая кола). При приеме итраконазола в дозе 200 мг однократно натощак совместно с недиетической колой после предварительного приема антагониста гистаминовых Н2-рецепторов ранитидина всасывание итраконазола было сопоставимым с всасыванием итраконазола при приеме только одного итраконазола.
Экспозиция итраконазола ниже при приеме итраконазола в капсулах по сравнению с экспозицией итраконазола при приеме той же дозы в виде раствора для приема внутрь.
Распределение
Итраконазол на 99.8% связывается с белками плазмы крови, в основном с альбумином (гидроксиитраконазол связывается с альбумином на 99.6%). Также отмечено сродство к липидам. В несвязанном виде в плазме крови остается только 0.2% итраконазола. Кажущийся объем распределения (Vd) более 700 л, что свидетельствует о его значительном распределении в тканях. Концентрации в легких, почках, костях, желудке, селезенке и мышцах в 2-3 раза выше, чем соответствующие концентрации в плазме крови, при этом концентрация препарата в тканях, содержащих кератин, особенно в коже, примерно в 4 раза превышает концентрацию в плазме крови. Концентрация в спинномозговой жидкости значительно ниже, чем в плазме крови, тем не менее, была продемонстрирована эффективность итраконазола против возбудителей инфекций, присутствующих в цереброспинальной жидкости.
Метаболизм
Как было показано в исследованиях in vitro, CYP3A4 является основным изоферментом, участвующим в метаболизме итраконазола. Итраконазол подвергается активному метаболизму в печени с образованием множества метаболитов. Основным метаболитом является гидроксиитраконазол, который in vitro обладает противогрибковой активностью, сопоставимой с итраконазолом. Концентрации гидроксиитраконазола в плазме крови примерно в 2 раза превышают концентрацию итраконазола.
Выведение
Итраконазол выводится преимущественно в форме неактивных метаболитов почками (35%) и через кишечник (54%) в течение одной недели после приема раствора для приема внутрь. Почечная экскреция итраконазола и его активного метаболита гидроксиитраконазола составляет менее 1% от дозы препарата, введенной в/в. На основании результатов изучения фармакокинетики 14С-меченого препарата после приема внутрь выведение неизмененного итраконазола через кишечник варьирует от 3% до 18% от принятой дозы.
Поскольку перераспределение итраконазола из тканей, содержащих кератин, является незначительным, выведение итраконазола из этих тканей связано с регенерацией эпидермиса. В отличие от плазмы крови, концентрация итраконазола в коже сохраняется в течение от 2 до 4 недель после прекращения 4-недельного курса терапии, а концентрация в кератине ногтя, где итраконазол может быть обнаружен уже через 1 неделю после начала лечения, сохраняется, по крайней мере, в течение 6 месяцев после окончания 3-месячного курса лечения.
Фармакокинетика у особых групп пациентов
Нарушения функции печени. Итраконазол метаболизируется преимущественно в печени. В ходе исследования фармакокинетики сравнили фармакокинетические показатели пациентов с циррозом печени и здоровых добровольцев. У пациентов с циррозом печени при однократном приеме 100 мг итраконазола средняя Cmax была значительно ниже (на 47%), чем у здоровых добровольцев. Средний Т1/2 при приеме однократной дозы был увеличен у пациентов с циррозом печени и составлял 37±17 ч по сравнению с 16±5 ч у здоровых добровольцев. Средняя AUC была аналогичной у пациентов с циррозом печени и здоровых добровольцев. Данные о длительном применении итраконазола у пациентов c циррозом печени отсутствуют (см. разделы «Режим дозирования», «Особые указания»).
Нарушения функции почек. Данные о приеме внутрь итраконазола для лечения пациентов с нарушениями функции почек ограничены. У пациентов с уремией, у которых средний КК составлял 13 мл/мин×1.73 м2, системное воздействие итраконазола (AUC) было несколько ниже по сравнению с основной популяцией. Не выявлено значительного влияния гемодиализа или длительного перитонеального диализа, проводимого в амбулаторных условиях, на показатели фармакокинетики (Tmax, Cmax, AUC0-8 ч). После однократного в/в введения конечный Т1/2 итраконазола у пациентов с незначительным (КК 50-79 мл/мин), средним (КК 20-49 мл/мин) или тяжелым нарушением функции почек (КК менее 20 мл/мин) был сходным с таковым у здоровых добровольцев (диапазон средних значений 42-49 ч по сравнению с 48 ч у пациентов с нарушениями функции почек и здоровых добровольцев, соответственно). Общая экспозиция итраконазола, на основании оценки показателя AUC, была снижена у пациентов с умеренными или тяжелыми нарушениями функции почек на 30% и 40% соответственно по сравнению с пациентами, у которых функция почек не нарушена.
Данные о длительном применении итраконазола пациентами с нарушениями функции почек не доступны. Проведение диализа не влияет на Т1/2 и клиренс итраконазола или гидроксиитраконазола.
Дети. Данные о фармакокинетике итраконазола у пациентов детского возраста ограничены. Исследования фармакокинетики у детей и подростков в возрасте от 5 месяцев до 17 лет проводились с различными лекарственными формами итраконазола. Индивидуальные дозы препарата в капсулах и растворе для приема внутрь варьировали от 1.5 до 12.5 мг/кг/сут при приеме 1 раз/сут или 2 раза/сут. При приеме итраконазола в одной и той же суточной дозе 2 раза/сут по сравнению с приемом 1 раз/сут Cmax и Cmin в плазме была сопоставимой с таковой у взрослых пациентов при приеме итраконазола 1 раз/сут. Не зарегистрировано существенных возрастных различий показателей AUC итраконазола и его общего клиренса; в редких случаях наблюдалась незначительная взаимосвязь между возрастом пациентов и значениями Vd, Cmax и конечного Т1/2. Установленный клиренс итраконазола и его Vd зависят от массы тела пациентов.
Показания препарата
Орунгамин®
- поражение кожи и слизистых оболочек:
- дерматомикозы;
- вульвовагинальный кандидоз;
- отрубевидный лишай;
- кандидоз слизистой оболочки полости рта;
- грибковый кератит.
- онихомикозы, вызванные дерматофитами и/или дрожжеподобными грибами;
- системные микозы:
- системный аспергиллез и кандидоз;
- криптококкоз, включая криптококковый менингит (у пациентов с иммунодефицитом и у всех пациентов с криптококкозом ЦНС итраконазол должен назначаться только в случаях, если препараты первой линии лечения не применимы в данном случае или не эффективны);
- гистоплазмоз;
- споротрихоз;
- паракокцидиоидомикоз;
- бластомикоз;
- прочие редко встречающиеся системные или тропические микозы.
Режим дозирования
Препарат принимают внутрь, сразу после приема пищи. Капсулы следует глотать целиком.
Биодоступность итраконазола при приеме внутрь может быть снижена у некоторых пациентов с нарушенным иммунитетом, например, у пациентов с нейтропенией, пациентов со СПИД или пациентов с трансплантированными органами. В таких случаях может потребоваться двукратное увеличение дозы.
Онихомикозы, вызванные дерматофитами и/или дрожжеподобными и плесневыми грибами
Выведение итраконазола из кожи и ногтевой ткани осуществляется медленнее, чем из плазмы крови. Таким образом, оптимальный клинический и микологический эффект достигаются через 2-4 недели после окончания лечения при заболеваниях кожи и через 6-9 месяцев после окончания лечения заболеваний ногтей.
Прочие редко встречающиеся системные микозы
* Продолжительность лечения может быть скорректирована в зависимости от эффективности лечения.
Особые группы пациентов
Дети. Данные о применении итраконазола в форме капсул для лечения детей ограничены. Применение препарата для лечения детей не рекомендуется, за исключением случаев, когда ожидаемая польза от лечения превышает потенциальный риск.
Пожилые пациенты. Данные о применении итраконазола в форме капсул для лечения пациентов пожилого возраста ограничены. Рекомендуется применять препарат для лечения пациентов данной категории только в том случае, если ожидаемая польза от лечения превышает потенциальный риск. При выборе дозы препарата для лечения пожилых пациентов рекомендуется учитывать снижение функции почек, печени и сердца, чаще встречающихся в пожилом возрасте, а также наличие сопутствующих заболеваний или прием других лекарственных средств.
Нарушение функции печени. Данные о применении итраконазола внутрь для лечения пациентов с нарушениями функции печени ограничены. Следует с осторожностью применять препарат у данной категории пациентов.
Нарушение функции почек. Данные о применении итраконазола внутрь для лечения пациентов с нарушениями функции почек ограничены. У некоторых пациентов с нарушением функции почек, экспозиция итраконазола может быть снижена. Следует с осторожностью применять препарат у данной категории пациентов, в некоторых случаях может потребоваться изменение дозы лекарственного средства.
Побочное действие
Побочные действия итраконазола систематизированы относительно каждой из систем органов в зависимости от частоты встречаемости, с использованием следующей классификации: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000, включая единичные случаи), частота неизвестна (недостаточно данных для оценки частоты развития).
Данные, полученные в ходе клинических исследований
Инфекционные и паразитарные заболевания: нечасто — ринит, синусит, инфекции верхних дыхательных путей.
Со стороны системы кроветворения: редко — лейкопения; частота неизвестна — нейтропения.
Со стороны иммунной системы: нечасто — повышенная чувствительность.
Со стороны нервной системы: часто — головная боль; редко — парестезия, гипестезия.
Со стороны органа слуха и лабиринтные нарушения: редко — звон в ушах.
Со стороны пищеварительной системы: часто — боль в животе, тошнота; нечасто — диспепсия, запор, метеоризм, диарея, рвота; редко — дисгевзия.
Со стороны печени и желчевыводящих путей: нечасто — гипербилирубинемия, нарушение функции печени.
Со стороны кожных покровов и подкожно-жировой клетчатки: нечасто — кожный зуд, кожная сыпь, крапивница.
Со стороны почек и мочевыводящих путей: редко — поллакиурия.
Со стороны репродуктивной системы и молочной железы: нечасто — нарушение менструального цикла; редко — эректильная дисфункция.
Осложнения общего характера и реакции в месте введения: редко — отечный синдром.
Ниже приведен список нежелательных реакций, связанных с приемом итраконазола, которые были зарегистрированы в ходе клинического изучения итраконазола в лекарственных формах: раствор для приема внутрь и/или в форме раствора для в/в введения (за исключением нежелательных реакций, относящихся к категории «воспаление в месте введения», поскольку данные побочные реакции являются специфичными для лекарственной формы раствор для в/в введения).
Со стороны системы кроветворения: гранулоцитопения, тромбоцитопения.
Со стороны иммунной системы: анафилактоидные реакции.
Со стороны обмена веществ: гипергликемия, гиперкалиемия, гипокалиемия, гипомагниемия.
Психические нарушения: спутанность сознания.
Со стороны нервной системы: периферическая невропатия, головокружение, сонливость.
Со стороны сердечно-сосудистой системы: сердечная недостаточность, недостаточность левого желудочка, тахикардия, повышение АД, снижение АД.
Со стороны дыхательной системы: отек легких, дисфония, кашель.
Со стороны пищеварительной системы: желудочно-кишечные расстройства.
Со стороны печени и желчевыводящих путей: гепатит, желтуха, нарушение функции печени.
Со стороны кожи и подкожных тканей: эритематозная сыпь, гипергидроз.
Со стороны костно-мышечной системы: миалгия, артралгия.
Со стороны почек и мочевыводящих путей: недостаточность функции почек, недержание мочи.
Общие расстройства и нарушения в месте введения: генерализованные отеки, отек лица, боль в груди, гипертермия, боль, усталость, озноб.
Влияние на результаты лабораторных показателей и инструментальных исследований: повышение активности АЛТ, АСТ, ЩФ в плазме крови; повышение активности ЛДГ в плазме крови, повышение концентрации мочевины в крови, повышение активности ГГТ, повышение активности печеночных ферментов, отклонение от нормы показателей общего анализа мочи.
Дети
Безопасность применения итраконазола оценивалась в клинических исследованиях у 165 детей в возрасте от 1 года до 17 лет. В ходе исследований было отмечено, что наиболее часто встречающимися нежелательными реакциями были: головная боль (3.0%), рвота (3.0%), боль в животе (2.4%), диарея (2.4%), нарушения функции печени (1.2%), тошнота (1.2%), крапивница (1.2%), артериальная гипотензия (1.2%). Характер побочных реакций, встречающихся у детей, схож с тем, что наблюдается у взрослых пациентов, тем не менее, частота побочных реакций у детей выше.
Побочные реакции, зарегистрированные в пострегистрационном периоде применения итраконазола (данные получены на основании спонтанных сообщений)
Со стороны иммунной системы: очень редко — сывороточная болезнь, ангионевротический отек, анафилактические, анафилактоидные и аллергические реакции.
Со стороны обмена веществ: очень редко — гипертриглицеридемия.
Со стороны нервной системы: очень редко — тремор.
Со стороны органа зрения: очень редко — нарушение зрения (включая диплопию, нечеткое зрение).
Со стороны органа слуха и лабиринтные нарушения: очень редко — стойкая или временная потеря слуха.
Со стороны сердечно-сосудистой системы: очень редко — хроническая сердечная недостаточность.
Со стороны дыхательной системы: часто — одышка.
Со стороны пищеварительной системы: очень редко — панкреатит.
Со стороны гепатобилиарной системы: очень редко — тяжелое токсическое поражение печени (в т.ч. несколько случаев острой печеночной недостаточности с летальным исходом).
Со стороны кожных покровов и подкожно-жировой клетчатки: очень редко — токсический эпидермальный некролиз, синдром Стивенса-Джонсона, острый генерализованный экзантематозный пустулез, многоформная эритема, эксфолиативный дерматит, лейкоцитокластический васкулит, алопеция, фоточувствительность.
Влияние на результаты лабораторных показателей и инструментальных исследований: очень редко — повышение активности КФК крови.
Противопоказания к применению
- гиперчувствительность к итраконазолу или вспомогательным веществам;
- одновременный прием лекарственных средств, являющихся субстратами изофермента CYP3A4, может увеличивать концентрацию итраконазола в плазме крови, усиливать или пролонгировать терапевтический и нежелательные эффекты, которые могут вызвать потенциально опасную ситуацию (например, повышение концентрации в плазме некоторых препаратов может вызвать удлинение интервала QT и сердечную тахикардию, включая случаи двунаправленной веретенообразной желудочковой тахикардии, фатальной аритмии; см. раздел «Лекарственное взаимодействие»);
- одновременный прием лекарственных средств, являющихся субстратами изофермента CYP3A4 (см. раздел «Лекарственное взаимодействие»), таких как:
- Левацетилметадол, метадон;
- дизопирамид, дофетилид, дронедарон, хинидин;
- телитромицин у пациентов с нарушениями функции почек или печени тяжелой степени тяжести;
- тикагрелор;
- галофантрин;
- астемизол, мизоластин, терфенадин;
- алкалоиды спорыньи: дигидроэрготамин, эргометрин (эргоновин), эрготамин и метилэргометрин (метилэргоновин), элетриптан;
- иринотекан;
- луразидон, мидазолам для приема внутрь, пимозид, сертиндол, триазолам;
- бепридил, фелодипин, лерканидипин, нисолдипин;
- ивабрадин, ранолазин;
- эплеренон;
- цизаприд, домперидон;
- ловастатин, симвастатин, аторвастатин;
- фезотеродин у пациентов с недостаточностью функции почек или печени умеренной или тяжелой степени, солифенацин у пациентов с недостаточностью функции почек тяжелой степени и с недостаточностью функции печени, умеренной или тяжелой степени;
- колхицин у пациентов с нарушениями функции печени или почек.
- хроническая сердечная недостаточность в настоящее время или в анамнезе (за исключением терапии жизнеугрожающих или других опасных инфекций; см. раздел «Особые указания»);
- непереносимость фруктозы, дефицит сахаразы/изомальтазы, глюкозо-галактозная мальабсорбция;
- детский возраст до 3 лет;
- беременность (за исключением случаев, угрожающих жизни, и если ожидаемый положительный эффект для матери превышает возможный вред для плода);
- период грудного вскармливания.
С осторожностью: при циррозе печени; при тяжелых нарушениях функции печени и почек; при гиперчувствительности к другим азолам; у пожилых пациентов; у детей (см. также раздел «Особые указания»).
Применение при беременности и кормлении грудью
Беременность
Препарат Орунгамин® не следует применять при беременности, за исключением случаев, угрожающих жизни, и если ожидаемый положительный эффект для матери превышает возможный вред для плода.
В доклинических исследованиях было показано, что итраконазол обладает репродуктивной токсичностью.
Данных о применении итраконазола при беременности недостаточно. В ходе клинического применения итраконазола были отмечены случаи врожденных аномалий. Такие случаи включали нарушения развития зрения, скелета, мочеполовой и сердечно-сосудистой систем, а также хромосомные нарушения и множественные пороки развития. Однако, является ли применение итраконазола причиной возникновения данных нарушений, достоверно не установлено.
Эпидемиологические данные в отношении воздействия итраконазола в I триместре беременности, в основном у пациенток, получавших краткосрочную терапию по поводу вульвовагинальных кандидозов, не выявили повышенного риска развития врожденных аномалий по сравнению с контрольной группой, не подвергавшейся воздействию ни одного из известных тератогенных факторов.
Женщинам детородного возраста, принимающим препарат Орунгамин®, необходимо использовать адекватные методы контрацепции на протяжении всего курса лечения вплоть до наступления первой менструации после его завершения.
Грудное вскармливание
Поскольку итраконазол может проникать в грудное молоко, при необходимости применения препарата в период лактации женщинам, принимающим препарат Орунгамин®, следует прекратить грудное вскармливание.
Применение при нарушениях функции печени
С осторожностью следует назначать препарат при циррозе печени, тяжелых нарушениях функции печени.
Применение при нарушениях функции почек
С осторожностью следует назначать препарат при тяжелых нарушениях функции почек.
Применение у детей
Противопоказано применение препарата в детском возрасте до 3 лет.
Поскольку клинических данных о применении итраконазола у детей недостаточно, рекомендуется назначать препарат детям только в случае, если возможная польза от лечения превосходит потенциальный риск
Применение у пожилых пациентов
С осторожностью следует назначать препарат пациентам пожилого возраста.
Особые указания
Влияние на деятельность сердца
В исследованиях на здоровых добровольцах лекарственной формы итраконазола раствор для в/в введения отмечалось преходящее бессимптомное уменьшение фракции выброса левого желудочка, нормализовавшееся до следующей инфузии. Клиническая значимость полученных данных для лекарственных форм для приема внутрь неизвестна. Итраконазол обладает отрицательным инотропным действием. Сообщалось о случаях хронической сердечной недостаточности, связанных с приемом итраконазола. При суточной дозе 400 мг итраконазола наблюдалось более частое возникновение сердечной недостаточности; при меньших суточных дозах такой закономерности не было выявлено. Риск возникновения хронической сердечной недостаточности предположительно пропорционален суточной дозе. Препарат Орунгамин® не следует принимать пациентам с хронической сердечной недостаточностью или с наличием этого симптомокомплекса в анамнезе, за исключением случаев, когда возможная польза значительно превосходит потенциальный риск. При индивидуальной оценке соотношения пользы и риска следует принимать во внимание такие факторы, как серьезность показаний, режим дозирования и индивидуальные факторы риска возникновения сердечной недостаточности (ИБС, поражения клапанов, обструктивная болезнь легких, почечная недостаточность и другие заболевания, сопровождающиеся отеками). Таких пациентов необходимо проинформировать о признаках и симптомах хронической сердечной недостаточности и следить за их появлением во время курса терапии. При появлении подобных признаков прием препарата Орунгамин® необходимо прекратить.
Угрожающие жизни аритмии сердца и/или внезапная смерть отмечались у пациентов при одновременном применении метадона.
Блокаторы кальциевых каналов могут обладать отрицательным инотропным эффектом, который может быть аддитивным по отношению к эффекту итраконазола. Кроме того, итраконазол может ингибировать метаболизм блокаторов кальциевых каналов. Следовательно, следует проявлять осторожность при одновременном применении итраконазола и блокаторов кальциевых каналов из-за повышения риска застойной сердечной недостаточности.
Лекарственное взаимодействие
Одновременный прием некоторых лекарственных средств с итраконазолом может привести к изменению в эффективности итраконазола и/или одновременно применяемых лекарственных препаратов, возникновению опасных для жизни побочных реакций и/или внезапной смерти. Препараты, которые нельзя принимать одновременно с итраконазолом, не рекомендованные для одновременного применения и/или рекомендованные для одновременного применения с итраконазолом с осторожностью, перечислены в разделе «Лекарственное взаимодействие».
Перекрестная гиперчувствительность
Данные в отношении наличия перекрестной гиперчувствительности между итраконазолом и другими противогрибковыми средствами с азольной структурой (из группы азолов) ограничены. При наличии гиперчувствительности к другим азолам следует с осторожностью назначать итраконазол.
Невропатия
Лечение следует прекратить при возникновении периферической невропатии, которая может быть связана с приемом препарата Орунгамин® в форме капсул.
Чувствительность
При системных кандидозах, предположительно вызванных флуконазол-резистентными штаммами Candida, нельзя предположить чувствительность к итраконазолу, следовательно, рекомендуется проверить чувствительность перед началом терапии итраконазолом.
Взаимозаменяемость
Не рекомендуется взаимозаменяемое использование итраконазола в форме капсул и итраконазола в форме раствора для приема внутрь, ввиду того, что экспозиция итраконазола выше при применении его в лекарственной форме раствор для приема внутрь, чем в форме капсул, даже при приеме в одинаковых дозах.
Сниженная кислотность желудочного сока
При сниженной кислотности желудочного сока абсорбция итраконазола из капсул нарушается. Пациентам со сниженной кислотностью желудочного сока вследствие заболевания (например, у пациентов с ахлоргидрией) или вследствие приема лекарственных препаратов (например, лекарственные средства, подавляющие желудочную секрецию) рекомендуется принимать препарат Орунгамин® в капсулах одновременно с кислыми напитками (такими как недиетическая кола). Следует контролировать противогрибковую активность препарата и увеличивать дозу итраконазола при необходимости.
Влияние на функцию печени
В очень редких случаях при применении итраконазола развивалось тяжелое токсическое поражение печени, включая несколько случаев острой печеночной недостаточности с летальным исходом. В большинстве случаев это происходило с пациентами, у которых уже имелись заболевания печени, у пациентов с другими тяжелыми заболеваниями, которым препарат был назначен для лечения системных заболеваний, а также у пациентов, получавших другие лекарственные средства, обладающие гепатотоксическим действием. Однако у некоторых пациентов не было сопутствующих заболеваний или очевидных факторов риска в отношении поражения печени. Несколько таких случаев возникли в первый месяц терапии, а некоторые — в первую неделю терапии. В связи с этим рекомендуется регулярно контролировать функцию печени у пациентов, получающих терапию итраконазолом. В случае возникновения симптомов, предполагающих возникновение гепатита, а именно: анорексии, тошноты, рвоты, слабости, боли в животе и потемнения мочи, необходимо немедленно прекратить лечение и провести исследование функции печени. Пациентам с повышенной активностью печеночных ферментов или заболеванием печени в активной фазе, или при перенесенном токсическом поражении печени вследствие приема других препаратов не следует назначать лечение препаратом Орунгамин®, за исключением тех случаев, когда ожидаемая польза превышает потенциальный риск поражения печени.
Рекомендуется проводить наблюдение за уровнем лабораторных параметров функции печени у пациентов с уже имеющимися нарушениями функции печени или пациентов, у которых отмечались проявления гепатотоксичности других лекарственных средств. Итраконазол преимущественно метаболизируется в печени. Поскольку у пациентов с нарушениями функции печени полный Т1/2 итраконазола несколько увеличен, рекомендуется осуществлять контроль концентраций итраконазола в плазме крови и при необходимости корректировать дозу препарата.
Нарушения функции почек
Данные по применению препарата у пациентов с нарушениями функции почек ограничены, у некоторых пациентов с недостаточностью функции почек экспозиция итраконазола может быть снижена. Поэтому таким пациентам следует назначать препарат с осторожностью.
Рекомендуется осуществлять контроль концентраций итраконазола в плазме крови и при необходимости корректировать дозу препарата.
Пациенты с иммунодефицитом
Биодоступность итраконазола при приеме внутрь может быть снижена у некоторых пациентов с нарушенным иммунитетом, например, у пациентов с нейтропенией, больных СПИД или перенесших операцию по трансплантации органов. Таким образом, доза должна быть скорректирована в зависимости от клинической картины у этой группы пациентов.
Пациенты с системными грибковыми инфекциями, представляющими угрозу жизни
Вследствие фармакокинетических характеристик препарата Орунгамин® в форме капсул, его применение не рекомендуется для начала лечения системных микозов, представляющих угрозу для жизни пациентов.
Пациенты со СПИД
Врач должен оценить необходимость проведения поддерживающей терапии у ВИЧ-инфицированных пациентов, имеющих СПИД, у которых существует риск рецидива, ранее получавшим лечение по поводу системных грибковых инфекций.
Применение в педиатрической практике
Поскольку клинических данных о применении итраконазола у детей недостаточно, рекомендуется назначать препарат детям только в случае, если возможная польза от лечения превосходит потенциальный риск.
Пациенты пожилого возраста
Данные по применению препарата Орунгамин® у пациентов пожилого возраста ограничены. Рекомендуется назначать препарат только в случае, если возможная польза от лечения превышает потенциальный риск.
В целом рекомендуется при подборе дозы для пациентов пожилого возраста обратить внимание на частоту снижения функции печени, почек, сердечно-сосудистой системы и сопутствующих заболеваний или другой лекарственной терапии.
Потеря слуха
Сообщалось о временной или стойкой потере слуха у пациентов, принимающих итраконазол. В некоторых случаях потеря слуха происходила на фоне одновременного приема с хинидином (см. разделы «Противопоказания», «Лекарственное взаимодействие»). Слух обычно восстанавливается после окончания терапии препаратом, однако у некоторых пациентов потеря слуха необратима.
Способность к зачатию
В исследованиях на животных отмечалась репродуктивная токсичность итраконазола.
Муковисцидоз (кистозный фиброз)
У пациентов с муковисцидозом (кистозным фиброзом) наблюдалась вариабельность концентрации итраконазола в плазме крови при применении итраконазола в форме раствора для приема внутрь в дозе 2.5 мг/кг 2 раза/сут. Как следствие, терапевтическая Css итраконазола в плазме крови может не достигаться. Css более 250 нг/мл достигались приблизительно у 50% пациентов старше 16 лет и не достигались ни у одного пациента моложе 16 лет. При отсутствии ответа на терапию препаратом Орунгамин®, капсулы следует рассмотреть возможность перехода на альтернативную терапию.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования по изучению влияния лекарственного средства Орунгамин® на способность управлять транспортными средствами и работать с техникой не проводились. Необходимо принимать во внимание возможность возникновения побочных реакций, таких как головокружение, нарушение зрения или потеря слуха (см. раздел «Побочное действие»). При появлении описанных нежелательных реакций следует воздержаться от выполнения указанных видов деятельности.
Передозировка
Симптомы, наблюдаемые при передозировке препарата, сопоставимы с дозозависимыми побочными реакциями, наблюдаемыми при применении препарата в обычных дозах.
Лечение: специфического антидота не существует. В случае передозировки следует проводить поддерживающую терапию. Итраконазол не выводится из организма при гемодиализе. Рекомендуется обратиться в токсикологический центр с целью коррекции лечения при передозировке препарата Орунгамин®.
Лекарственное взаимодействие
Итраконазол — препарат с высоким потенциалом лекарственного взаимодействия. Ниже описаны различные виды лекарственного взаимодействия и связанные с ним общие рекомендации. Кроме того, представлена таблица с примерами лекарственных средств, которые могут взаимодействовать с итраконазолом, организованная по группам препаратов для более простого использования. Список примеров не является исчерпывающим, поэтому при совместном применении каких-либо препаратов с итраконазолом следует изучить инструкции по их применению на предмет информации, связанной с метаболизмом, путями лекарственного взаимодействия, потенциальными рисками и специфическими действиями в отношении совместного применения.
Итраконазол метаболизируется преимущественно изоферментом CYP3A4. Другие лекарственные средства, которые также метаболизируются с участием данного изофермента или изменяют его активность, могут влиять на фармакокинетику итраконазола. Сходным образом итраконазол может влиять на фармакокинетику лекарственных средств, которые также метаболизируются при участии данного изофермента. При одновременном применении итраконазола с умеренными или сильными индукторами CYP3A4 может снижаться биодоступность итраконазола и гидроксиитраконазола, так что может быть снижена эффективность. Совместное применение с умеренными или сильными ингибиторами CYP3A4 может повысить биодоступность итраконазола, приводя к более выраженным или длительным фармакологическим эффектам итраконазола.
Всасывание итраконазола снижается у пациентов со сниженной кислотностью желудка. Препараты, снижающие кислотность желудка, нарушают всасывание итраконазола из капсул. Чтобы противостоять данному эффекту, рекомендуется принимать итраконазол в капсулах с кислотным напитком (например, недиетической колой), если принимаются препараты для снижения кислотности желудка (см. раздел «Особые указания»).
Итраконазол и его основной метаболит гидроксиитраконазол являются сильными ингибиторами CYP3A4. Итраконазол является ингибитором лекарственных транспортных молекул Р-гликопротеина и белка резистентности к раку молочной железы (BCRP). Итраконазол может ингибировать метаболизм препаратов, метаболизируемых CYP3A4, и транспорт препаратов Р-гликопротеином и/или BCRP, в результате чего может возрастать концентрация этих препаратов и/или их активных метаболитов в плазме при одновременном приеме с итраконазолом. Повышение концентраций в плазме может усиливать или пролонгировать как терапевтические, так и нежелательные эффекты этих препаратов. Для некоторых препаратов совместное применение с итраконазолом может привести к снижению концентрации препарата или его активного компонента в плазме. В результате этого эффективность препаратов может быть снижена.
После отмены терапии итраконазолом концентрации в плазме снижаются ниже предела определения в течение 7-14 дней в зависимости от доз и длительности терапии. У пациентов с циррозом печени или лиц, получавших ингибиторы CYP3A4, концентрации в плазме снижаются медленнее. Это особенно важно учитывать в начале терапии препаратами, на метаболизм которых влияет итраконазол.
Применимы следующие общие рекомендации, если в таблице не указано иное:
- «Противопоказано» — ни при каких обстоятельствах нельзя применять данный лекарственный препарат в комбинации с итраконазолом. Это относится к следующим препаратам: субстраты CYP3A4, у которых может возрастать концентрация в плазме с пролонгацией или усилением терапевтических и/или нежелательных эффектов до возникновения потенциально серьезных ситуаций (см. раздел «Противопоказания»).
- «Не рекомендуется» — рекомендуется избегать применения данного лекарственного средства, за исключением случаев, когда ожидаемая польза превышает потенциальный риск, связанный с проводимой терапией. Если нельзя избежать применения данной комбинации лекарственных средств, рекомендуется наблюдать за состоянием пациента для своевременного выявления симптомов и признаков усиления или пролонгации эффектов препаратов или развития нежелательных эффектов, в случае необходимости следует корректировать дозы итраконазола и/или одновременно принимаемых препаратов. При наличии возможности рекомендуется контролировать плазменную концентрацию препаратов. Это относится к следующим препаратам: умеренные или сильные индукторы CYP3A4 (не рекомендуется назначение за 2 недели до и в течение лечения итраконазолом); субстраты CYP3A4/P-gp/BCRP, повышение или снижение концентраций, которых в плазме может привести к значительному риску (не рекомендуется назначение во время и в течение 2 недель после лечения итраконазолом).
- «Применять с осторожностью» — рекомендуется тщательное наблюдение при одновременном применении препарата с итраконазолом. При одновременном применении лекарственных средств рекомендуется наблюдать за состоянием пациента и корректировать дозы итраконазола и/или сопутствующих препаратов по мере необходимости. Если возможно, рекомендуется определять концентрации в плазме. Это относится к следующим препаратам: препараты, снижающие кислотность желудка (только для итраконазола в капсулах); умеренные или сильные ингибиторы CYP3A4; субстраты CYP3A4/P-gp/BCRP, для которых повышение или снижение концентраций в плазме может привести к клинически значимому риску.
Примеры взаимодействующих препаратов представлены в таблице ниже. Препараты, перечисленные в таблице, выбраны на основе данных исследований лекарственного взаимодействия или клинических случаев, а также потенциального лекарственного взаимодействия на основе механизма действия.
Примечание
Среднее повышение концентрации:
↑: <100% (<2 раза);
↑↑: 100-400% (≥2 раза и <5 раз);
↑↑↑: 400-900% (≥5 раза и <10 раз);
↑↑↑↑: ≥10 раз.
Среднее снижение концентрации:
↓: <40%;
↓↓: 40-80%;
↓↓↓: >80%.
Отсутствие эффекта: ↔.
Для описания эффекта (средняя колонка) указано название исходного лекарственного вещества, даже если эффект относится к активному компоненту или активному метаболиту пролекарства.
a Для препаратов со стрелками в скобках оценка основана на механизме лекарственного взаимодействия и информации о клиническом лекарственном взаимодействии с кетоконазолом или другими мощными ингибиторами CYP3A4 и/или ингибиторами Р-гликопротеина или BCRP, а также на данных моделирования, клинических случаев и/или экспериментов in vitro. Для других перечисленных препаратов оценка основана на данных клинического лекарственного взаимодействия препарата с итраконазолом.
b Параметры фармакокинетики не установлены.
с Связанные с препаратом нежелательные лекарственные реакции представлены в соответствующей инструкции по применению.
Дети
Лекарственное взаимодействие изучено только у взрослых.
Условия хранения препарата Орунгамин®
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре не выше 25°С.
Срок годности препарата Орунгамин®
Срок годности — 3 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ОЗОН ООО
(Россия)

|
|
445351 Самарская обл., |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Ирунин®
(ВЕРОФАРМ, Россия)
Итразол®
(ВЕРТЕКС, Россия)
Итраконазол
(ДЕВЕЛОПМЕНТ МК, Россия)
Итраконазол
(ПРОИЗВОДСТВО МЕДИКАМЕНТОВ, Россия)
Итраконазол
(RUSAN PHARMA, Индия)
Итраконазол
(АТОЛЛ, Россия)
Итраконазол
(ФОРМУЛА-ФР, Россия)
Итраконазол
(АВВА РУС, Россия)
Итраконазол
(AVVA PHARMACEUTICALS, Кипр)
Итраконазол-АКОС
(БИОКОМ, Россия)
Все аналоги

26.09.2022
Описание препарата Орунгамин (капсулы, 100 мг) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 26.09.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Капсулы | 1 капс. |
| действующее вещество: | |
| пеллет итраконазола (22%) | 455,000 мг |
| (в пересчете на итраконазол — 100,000 мг) | |
| вспомогательные вещества: натрия лаурилсульфат — 0,220 мг; капсулы твердые желатиновые №0 | |
| корпус капсулы: желатин — до 100% | |
| крышечка капсулы: краситель индигокармин — 0,0471%; титана диоксид — 1,0%; желатин — до 100% | |
| Пеллеты | 1000 г |
| действующее вещество: | |
| итраконазол | 220,000 г |
| вспомогательные вещества: сахарная крупка (сахароза, патока крахмальная) — 347,190 г; гипромеллоза — 280,530 г; сахароза — 117,050 г; эудрагит Е100 — 35,050 г; метилпарагидроксибензоат натрия — 0,165 г; пропилпарагидроксибензоат натрия — 0,015 г |
Описание лекарственной формы
Капсулы: твердые желатиновые №0, корпус прозрачный, крышечка синего цвета непрозрачная.
Содержимое капсул — белые или почти белые сферические пеллеты.
Фармакологическое действие
Фармакологическое действие
—
противогрибковое.
Фармакодинамика
Орунгамин® — синтетическое противогрибковое средство широкого спектра действия, содержащее итраконазол, производное триазола. Механизм действия итраконазола заключается в ингибировании биосинтеза эргостерола — основного компонента клеточной мембраны гриба, участвующего в поддержании структурной целостности мембраны. Нарушение синтеза эргостерола приводит к изменению проницаемости мембраны и лизису клетки, что и обусловливает противогрибковый эффект препарата.
Итраконазол активен в отношении инфекций, вызываемых грибами: Candida spp. (включая Candida albicans, Candida tropicalis, C.parapsilosis и C.dubliniensis), Aspergillus spp., Blastomyces dermatitidis, Cladosporium spp., Coccidioides immitis, Cryptococcus neoformans, Geotrichum spp., Histoplasma spp., включая H.capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei, Sporothrix schenckii, Trichosporon spp.
Итраконазол также показал активность в отношении Epidermophyton floccosum, Fonsecaea spp., Malassezia spp., Microsporum spp., Pseudallescheria boydii, Trichophyton spp. и других дрожжевых и грибковых инфекций.
Candida krusei, Candida glabrata и Candida tropicalis являются наименее чувствительными к действию итраконазола видами
Candida. In vitro род Candida несколько изолированно показывал однозначную резистентность к итраконазолу.
Основными типами грибов, развитие которых не подавляется итраконазолом, являются Zygomyces (Rhizopus spp., Rhizomucor spp., Mucor spp, Absidia spp.), Fusarium spp., Scedosporium sрр. и Scopulariopsis spp.
Устойчивость к азолам развивается медленно и часто является результатом нескольких генетических мутаций. Описанные механизмы развития устойчивости включают в себя гиперэкспрессию гена EGR11, кодирующего фермент 14-α-деметилазу, который является основной мишенью действия азолов, и точечные мутации EGR11, приводящие к уменьшению связывания ферментов с азолами и/или к активации транспортных систем, что приводит к увеличению выведения азолов. Наблюдалась перекрестная устойчивость Candida spp. к препаратам группы азолов, хотя устойчивость к одному препарату этой группы не обязательно означает наличие устойчивости к другим препаратам группы азолов. Сообщалось о штаммах Aspergillus fumigates, устойчивых к итраконазолу.
Фармакокинетика
Cmax итраконазола в плазме достигается в течение 2–5 ч после перорального приема. Вследствие нелинейной фармакокинетики, итраконазол накапливается в плазме крови при многократном приеме. Css итраконазола, как правило, достигается в течение примерно 15 дней, при этом значения Cmax итраконазола составляют 0,5; 1,1 и 2,0 мкг/мл соответственно после перорального введения 100 мг 1 раз в день, 200 мг 1 раз в день, 200 мг 2 раза в день. Конечный T1/2 обычно составляет 16–28 ч при однократном приеме и 34–42 ч при многократном приеме. Концентрация итраконазола в плазме крови снижается до практически неопределяемого значения в течение 7–14 дней после прекращения терапии в зависимости от назначенной дозы и продолжительности лечения. Общее среднее значение клиренса итраконазола в плазме при в/в введении составляет 278 мл/мин. Клиренс итраконазола уменьшается при более высоких дозах в связи с насыщением путей его метаболизации в печени.
Всасывание. Итраконазол быстро абсорбируется после приема внутрь. Cmax неизмененного итраконазола в плазме крови достигаются после 2–5 ч после приема внутрь. Абсолютная биодоступность итраконазола после приема внутрь составляет около 55%. После приема внутрь максимальная биодоступность итраконазола отмечается при приеме капсул сразу после приема пищи.
Всасывание итраконазола в капсулах снижено у пациентов с пониженной кислотностью желудочного сока, например, на фоне приема препаратов, подавляющих секрецию соляной кислоты в желудке (таких как антагонисты Н2-гистаминовых рецепторов, ингибиторы протонной помпы), или у пациентов с ахлоргидрией на фоне различных заболеваний. Всасывание итраконазола натощак у таких пациентов увеличивается при приеме одновременно с кислыми напитками (такими как недиетическая кола). При приеме итраконазола в дозе 200 мг однократно натощак совместно с недиетической колой после предварительного приема антагониста Н2-гистаминовых рецепторов ранитидина всасывание итраконазола было сопоставимым с всасыванием итраконазола при приеме только одного итраконазола.
Экспозиция итраконазола ниже при приеме итраконазола в капсулах по сравнению с экспозицией итраконазола при приеме той же дозы в виде раствора для приема внутрь.
Распределение. Итраконазол на 99,8% связывается с белками плазмы крови, в основном с альбумином (гидроксиитраконазол связывается с альбумином на 99,6%). Также отмечено сродство к липидам. В несвязанном виде в плазме крови остается только 0,2% итраконазола. Кажущийся Vd более 700 л, что свидетельствует о его значительном распределении в тканях. Концентрации в легких, почках, костях, желудке, селезенке и мышцах в 2–3 раза выше, чем соответствующие концентрации в плазме крови, при этом концентрация препарата в тканях, содержащих кератин, особенно в коже, примерно в 4 раза превышает концентрацию в плазме крови. Концентрация в спинномозговой жидкости значительно ниже, чем в плазме крови, тем не менее была продемонстрирована эффективность итраконазола против возбудителей инфекций, присутствующих в цереброспинальной жидкости.
Метаболизм. Как было показано в исследованиях in vitro, CYP3А4 является основным изоферментом, участвующим в метаболизме итраконазола. Итраконазол подвергается активному метаболизму в печени с образованием множества метаболитов. Основным метаболитом является гидроксиитраконазол, который in vitro обладает противогрибковой активностью, сопоставимой с итраконазолом. Концентрации гидроксиитраконазола в плазме крови, примерно в 2 раза превышают концентрацию итраконазола.
Выведение. Итраконазол выводится преимущественно в форме неактивных метаболитов почками (35%) и через кишечник (54%) в течение одной недели после приема раствора для приема внутрь. Почечная экскреция итраконазола и его активного метаболита гидроксиитраконазола составляет менее 1% от дозы препарата, введенной в/в. На основании результатов изучения фармакокинетики 14С-меченого препарата, после приема внутрь выведение неизмененного итраконазола через кишечник варьирует от 3 до 18% от принятой дозы.
Поскольку перераспределение итраконазола из тканей, содержащих кератин, является незначительным, выведение итраконазола из этих тканей связано с регенерацией эпидермиса. В отличие от плазмы крови, концентрация итраконазола в коже сохраняется в течение от 2 до 4 нед после прекращения 4-недельного курса терапии, а концентрация в кератине ногтя, где итраконазол может быть обнаружен уже через 1 нед после начала лечения, сохраняется по крайней мере в течение 6 мес после окончания 3-месячного курса лечения.
Особые категории пациентов
Нарушения функции печени. Итраконазол метаболизируется преимущественно в печени. В ходе исследования фармакокинетики сравнили фармакокинетические показатели пациентов с циррозом печени и здоровых добровольцев. У пациентов с циррозом печени при однократном приеме 100 мг итраконазола средняя Cmax была значительно ниже (на 47%), чем у здоровых добровольцев. Средний T1/2 при приеме однократной дозы был увеличен у пациентов с циррозом печени и составлял (37±17) ч по сравнению с (16±5) ч у здоровых добровольцев. Средняя AUC была аналогичной у пациентов с циррозом печени и здоровых добровольцев. Данные о длительном применении итраконазола у пациентов с циррозом печени отсутствуют (см. «Способ применения и дозы», «Особые указания»).
Нарушения функции почек. Данные о приеме внутрь итраконазола для лечения пациентов с нарушениями функции почек ограничены. У пациентов с уремией, у которых средний Cl креатинина составлял 13 мл/мин/1,73 м2, системное воздействие итраконазола (AUC) было несколько ниже по сравнению с основной популяцией. Не выявлено значительного влияния гемодиализа или длительного перитонеального диализа, проводимого в амбулаторных условиях, на показатели фармакокинетики (Tmax, Cmax, AUC0-8). После однократного в/в введения конечный T1/2 итраконазола у пациентов с незначительным (Cl креатинина 50–79 мл/мин), средним (Cl креатинина 20–49 мл/мин) или тяжелым нарушением функции почек (Cl креатинина <20 мл/мин) сходен с таковым у здоровых добровольцев (диапазон средних значений 42–49 ч по сравнению с 48 ч у пациентов с нарушениями функции почек и здоровых добровольцев соответственно). Общая экспозиция итраконазола, на основании оценки показателя AUC, была снижена у пациентов с умеренными или тяжелыми нарушениями функции почек на 30 и 40% соответственно по сравнению с пациентами, у которых функция почек не нарушена.
Данные о длительном применении итраконазола пациентами с нарушениями функции почек недоступны. Проведение диализа не влияет на T1/2 и клиренс итраконазола или гидроксиитраконазола.
Дети. Данные о фармакокинетике итраконазола у пациентов детского возраста ограничены. Исследования фармакокинетики у детей и подростков от 5 мес до 17 лет проводились с различными ЛФ итраконазола. Индивидуальные дозы препарата в капсулах и растворе для приема внутрь варьировали от 1,5 до 12,5 мг/кг/сут при приеме 1 или 2 раза в день. При приеме итраконазола в одной и той же суточной дозе 2 раза в день по сравнению с приемом 1 раз в день плазменные Cmax и Cmin были сопоставимы с таковыми у взрослых пациентов при приеме итраконазола 1 раз в сутки. Не зарегистрировано существенных возрастных различий показателей AUC итраконазола и его общего клиренса; в редких случаях наблюдалась незначительная взаимосвязь между возрастом пациентов и значениями Vd, Cmax и конечного T1/2. Установленный клиренс итраконазола и его Vd зависят от массы тела пациентов.
Показания
- поражение кожи и слизистых оболочек:
— дерматомикозы;
— вульвовагинальный кандидоз;
— отрубевидный лишай;
— кандидоз слизистой оболочки полости рта;
— грибковый кератит;
- онихомикозы, вызванные дерматофитами и/или дрожжеподобными грибами;
- системные микозы:
— системный аспергиллез и кандидоз;
— криптококкоз, включая криптококковый менингит (у пациентов с иммунодефицитом и у всех пациентов с криптококкозом ЦНС итраконазол должен назначаться только в случаях, если препараты 1-й линии лечения неприменимы в данном случае или неэффективны);
— гистоплазмоз;
— споротрихоз;
— паракокцидиоидомикоз;
— бластомикоз;
— прочие редко встречающиеся системные или тропические микозы.
Противопоказания
- гиперчувствительность к итраконазолу и/или вспомогательным веществам;
- одновременный прием ЛС, являющихся субстратами изофермента CYP3A4, может увеличивать концентрацию итраконазола в плазме крови, усиливать или пролонгировать терапевтический и нежелательные эффекты, которые могут вызвать потенциально опасную ситуацию (например, повышение концентрации в плазме некоторых препаратов может вызвать удлинение интервала QT и сердечную тахикардию, включая случаи двунаправленной веретенообразной желудочковой тахикардии, фатальной аритмии (см. «Взаимодействие»);
- одновременный прием ЛС, являющихся субстратами изофермента CYP3A4 (см. «Взаимодействие»):
— левацетилметадол, метадон;
— дизопирамид, дофетилид, дронедарон, хинидин;
— телитромицин (у пациентов с нарушениями функции почек или печени тяжелой степени);
— тикагрелор;
— галофантрин;
— астемизол, мизоластин, терфенадин;
— алкалоиды спорыньи (дигидроэрготамин, эргометрин (эргоновин), эрготамин и метилэргометрин (метилэргоновин), элетриптан);
— иринотекан;
— луразидон, мидазолам для приема внутрь, пимозид, сертиндол, триазолам;
— бепридил, фелодипин, лерканидипин, нисолдипин;
— ивабрадин, ранолазин;
— эплеренон;
— цизаприд, домперидон;
— ловастатин, симвастатин, аторвастатин;
— фезотеродин (у пациентов с недостаточностью функции почек или печени умеренной или тяжелой степени), солифенацин (у пациентов с недостаточностью функции почек тяжелой степени и с недостаточностью функции печени умеренной или тяжелой степени);
— колхицин (у пациентов с нарушениями функции печени или почек);
- хроническая сердечная недостаточность в настоящее время или в анамнезе (за исключением терапии жизнеугрожающих или других опасных инфекций — см. «Особые указания»);
- непереносимость фруктозы, дефицит сахаразы/изомальтазы, глюкозо-галактозная мальабсорбция;
- беременность (за исключением случаев, угрожающих жизни, и если ожидаемый положительный эффект для матери превышает возможный вред для плода);
- период грудного вскармливания;
- возраст до 3 лет.
С осторожностью: гиперчувствительность к другим азолам; цирроз печени; тяжелые нарушения функции печени и почек; пожилой возраст; дети (см. «Особые указания»).
Применение при беременности и кормлении грудью
Беременность. Препарат Орунгамин® не должен применяться при беременности, за исключением случаев, угрожающих жизни, и, если ожидаемый положительный эффект для матери превышает возможный вред для плода.
В доклинических исследованиях было показано, что итраконазол обладает репродуктивной токсичностью.
Данных о применении итраконазола при беременности недостаточно. В ходе клинического применения итраконазола были отмечены случаи врожденных аномалий.
Такие случаи включали нарушения развития органа зрения, скелета, мочеполовой системы и ССС, а также хромосомные нарушения и множественные пороки развития. Однако является ли применение итраконазола причиной возникновения данных нарушений, достоверно не установлено.
Эпидемиологические данные в отношении воздействия итраконазола в I триместре беременности, в основном у пациенток, получавших краткосрочную терапию по поводу вульвовагинальных кандидозов, не выявили повышенного риска развития врожденных аномалий по сравнению с контрольной группой, не подвергавшейся воздействию ни одного из известных тератогенных факторов.
Женщинам детородного возраста, принимающим препарат Орунгамин®, необходимо использовать адекватные методы контрацепции на протяжении всего курса лечения вплоть до наступления первой менструации после его завершения.
Грудное вскармливание. Поскольку итраконазол может проникать в грудное молоко, при необходимости применения в период грудного вскармливания, женщинам, принимающим препарат Орунгамин®, следует прекратить грудное вскармливание.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Внутрь, сразу после приема пищи. Капсулы следует глотать целиком.
| Показание | Доза | Продолжительность |
| Вульвовагинальный кандидоз | 200 мг 2 раза в сутки или 200 мг/сут |
1 день или 3 дня |
| Отрубевидный лишай | 200 мг/сут | 7 дней |
| Дерматомикозы гладкой кожи | 200 мг 2 раза в сутки или 100 мг/сут |
7 дней или 15 дней |
| Поражения высококератинизированных областей кожного покрова, таких как кисти рук и стопы | 200 мг 2 раза в сутки или 100 мг/сут |
7 дней или 30 дней |
| Кандидоз слизистой оболочки полости рта | 100 мг/сут | 15 дней |
| Грибковый кератит | 200 мг/сут | 21 день Возможна коррекция длительности лечения с учетом положительной динамики клинической картины |
Биодоступность итраконазола при приеме внутрь может быть снижена у некоторых пациентов с нарушенным иммунитетом, например у пациентов с нейтропенией, СПИДом или трансплантированными органами. В данных случаях может потребоваться двукратное увеличение дозы.
| Онихомикозы, вызванные дерматофитами и/или дрожжеподобными и плесневыми грибами | |||||||||
| Онихомикозы (пульс-терапия) | Дозы и продолжительность лечения | ||||||||
| Один курс: ежедневный прием по 200 мг 2 раза (2 капсулы 2 раза в сутки) в течение одной недели. Для лечения грибкового поражения ногтевых пластинок пальцев кистей рекомендуется 2 курса. Для лечения грибковых поражений ногтевых пластинок пальцев стоп рекомендуется 3 курса. Интервал между курсами, в течение которого не нужно принимать препарат, составляет 3 нед. Клинические результаты станут очевидны после окончания лечения, по мере отрастания ногтей. |
|||||||||
| Локализация онихомикозов | 1-я нед | 2-я нед | 3-я нед | 4-я нед | 5-я нед | 6-я нед | 7-я нед | 8-я нед | 9-я нед |
| Поражение ногтевых пластинок пальцев стоп с поражением или без поражения ногтевых пластинок пальцев кистей | 1-й курс | Недели, свободные от приема препарата Орунгамин® | 2-й курс | Недели, свободные от приема препарата Орунгамин® | 3-й курс | ||||
| Поражение ногтевых пластинок пальцев кистей | 1-й курс | Недели, свободные от приема препарата Орунгамин® | 2-й курс | ||||||
| Онихомикозы (непрерывное лечение) | Доза | Продолжительность лечения | |||||||
| Поражение ногтевых пластинок пальцев стоп с поражением или без поражения ногтевых пластинок пальцев кистей | По 200 мг/сут | 3 мес |
Выведение итраконазола из кожи и ногтевой ткани осуществляется медленнее, чем из плазмы крови. Таким образом, оптимальный клинический и микологический эффект достигается через 2–4 нед после окончания лечения при заболеваниях кожи и через 6–9 мес после окончания лечения заболеваний ногтей.
| Прочие редко встречающиеся системные микозы | |||
| Показание | Доза | Средняя продолжительность лечения* | Замечания |
| Аспергиллез | 200 мг/сут | 2–5 мес | В случае инвазивного или диссеминированного заболевания дозу рекомендуется увеличить до 200 мг 2 раза в сутки |
| Кандидоз | 100–200 мг/сут | от 3 нед до 7 мес | В случае инвазивного или диссеминированного заболевания дозу рекомендуется увеличить до 200 мг 2 раза в сутки |
| Криптококкоз (кроме менингита) | 200 мг/сут | от 2 мес до 1 года | |
| Криптококковый менингит | 200 мг 2 раза в сутки | от 2 мес до 1 года | Поддерживающая терапия — см. «Особые указания» |
| Гистоплазмоз | от 200 мг/сут до 200 мг 2 раза в сутки | 8 мес | |
| Бластомикоз | от 100 мг/сут до 200 мг 2 раза в сутки | 6 мес | |
| Споротрихоз | 100 мг/сут | 3 мес | |
| Паракокцидиоидомикоз | 100 мг/сут | 6 мес | Данные об эффективности данной дозы для лечения паракокцидиоидоза у пациентов со СПИДом отсутствуют |
| Хромомикоз | 100–200 мг/сут | 6 мес |
* Продолжительность лечения может быть скорректирована в зависимости от эффективности лечения.
Особые группы пациентов
Нарушение функции печени. Данные о применении итраконазола внутрь для лечения пациентов с нарушениями функции печени ограничены. Следует с осторожностью применять препарат у данной категории пациентов.
Нарушение функции почек. Данные о применении итраконазола внутрь для лечения пациентов с нарушениями функции почек ограничены. У некоторых пациентов с нарушением функции почек экспозиция итраконазола может быть снижена. Следует с осторожностью применять препарат у данной категории пациентов, в некоторых случаях может потребоваться изменение дозы ЛС.
Пожилые пациенты. Данные о применении итраконазола, капсулы, для лечения пациентов пожилого возраста ограничены. Рекомендуется применять препарат Орунгамин®, капсулы, для лечения пациентов данной категории, только если ожидаемая польза от лечения превышает потенциальные риски. При выборе дозы препарата для лечения пожилых пациентов рекомендуется учитывать снижение функции почек, печени и сердца, чаще встречающихся в пожилом возрасте, а также наличие сопутствующих заболеваний или прием других ЛС.
Дети. Данные о применении итраконазола, капсулы, для лечения детей ограничены. Применение препарата Орунгамин®, капсулы, для лечения детей не рекомендуется, за исключением случаев, когда ожидаемая польза от лечения превышает потенциальный риск.
Побочные действия
Побочные действия итраконазола систематизированы относительно каждой из систем органов в зависимости от частоты встречаемости, с использованием следующей классификации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000, включая единичные случаи); частота неизвестна (недостаточно данных для оценки частоты развития).
Данные, полученные в ходе клинических исследований
Инфекционные и паразитарные заболевания: нечасто — ринит, синусит, инфекции верхних дыхательных путей.
Со стороны кроветворной и лимфатической систем: редко — лейкопения; частота неизвестна — нейтропения.
Со стороны иммунной системы: нечасто — повышенная чувствительность.
Со стороны нервной системы: часто — головная боль; редко — парестезия, гипостезия.
Со стороны органа слуха и лабиринтные нарушения: редко — звон в ушах.
Со стороны ЖКТ: часто — боль в животе, тошнота; нечасто — диспепсия, запор, метеоризм, диарея, рвота; редко — дисгевзия.
Со стороны печени и желчевыводящих путей: нечасто — гипербилирубинемия, нарушение функции печени.
Со стороны кожных покровов и подкожно-жировой клетчатки: нечасто — кожный зуд, кожная сыпь, крапивница.
Со стороны почек и мочевыводящих путей: редко — поллакиурия.
Со стороны репродуктивной системы и молочных желез: нечасто — нарушение менструального цикла; редко — эректильная дисфункция.
Осложнения общего характера и реакции в месте введения: редко — отечный синдром. Ниже приведен список нежелательных реакций, связанных с приемом итраконазола, которые были зарегистрированы в ходе клинического изучения итраконазола в ЛФ раствор для приема внутрь и/или раствор для в/в введения (за исключением нежелательных реакций, относящихся к категории воспаления в месте введения, поскольку данные побочные реакции являются специфичными для ЛФ раствор для в/в введения).
Со стороны кроветворной и лимфатической систем: гранулоцитопения, тромбоцитопения.
Со стороны иммунной системы: анафилактоидные реакции.
Со стороны обмена веществ: гипергликемия, гиперкалиемия, гипокалиемия, гипомагниемия.
Со стороны психики: спутанность сознания.
Со стороны нервной системы: периферическая нейропатия, головокружение, сонливость.
Со стороны ССС: сердечная недостаточность, недостаточность левого желудочка, тахикардия, повышение АД, снижение АД.
Со стороны дыхательной системы, органов грудной клетки и средостения: отек легких, дисфония, кашель.
Со стороны ЖКТ: желудочно-кишечные расстройства.
Со стороны печени и желчевыводящих путей: гепатит, желтуха, нарушение функции печени.
Со стороны кожи и подкожных тканей: эритематозная сыпь, гипергидроз.
Со стороны скелетно-мышечной системы и соединительной ткани: миалгия, артралгия.
Со стороны почек и мочевыводящих путей: недостаточность функции почек, недержание мочи.
Общие расстройства и нарушения в месте введения: генерализованные отеки, отек лица, боль в груди, гипертермия, боль, усталость, озноб.
Влияние на лабораторные показатели и результаты инструментальных исследований: повышение активности АЛТ, АСТ, ЩФ в плазме крови, повышение активности лактатдегидрогеназы в плазме крови, повышение концентрации мочевины в крови, повышение активности ГГТ, повышение активности печеночных ферментов, отклонение от нормы показателей общего анализа мочи.
Дети
Безопасность применения итраконазола оценивалась в клинических исследованиях у 165 детей от 1 года до 17 лет. В ходе исследований было отмечено, что наиболее часто встречающимися нежелательными реакциями были: головная боль (3,0%), рвота (3,0%), боль в животе (2,4%), диарея (2,4%), нарушения функции печени (1,2%), тошнота (1,2%), крапивница (1,2%), гипотензия (1,2%). Характер побочных реакций, встречающихся у детей, схож с тем, что наблюдается у взрослых пациентов, тем не менее частота побочных реакций у детей выше.
Побочные реакции, зарегистрированные в пострегистрационном периоде применения итраконазола (данные получены на основании спонтанных сообщений)
Со стороны иммунной системы: очень редко — сывороточная болезнь, ангионевротический отек, анафилактические, анафилактоидные и аллергические реакции.
Со стороны обмена веществ: очень редко — гипертриглицеридемия.
Со стороны нервной системы: очень редко — тремор.
Со стороны органа зрения: очень редко — нарушение зрения (включая диплопию, нечеткое зрение).
Со стороны органа слуха и лабиринтные нарушения: очень редко — стойкая или временная потеря слуха.
Со стороны ССС: очень редко — ХСН.
Со стороны органов дыхания: часто — одышка.
Со стороны ЖКТ: очень редко — панкреатит.
Со стороны гепатобилиарной системы: очень редко — тяжелое токсическое поражение печени (в том числе несколько случаев острой печеночной недостаточности с летальным исходом).
Со стороны кожных покровов и подкожно-жировой клетчатки: очень редко — токсический эпидермальный некролиз, синдром Стивенса-Джонсона, острый генерализованный экзентематозный пустулез, полиморфная эритема, эксфолиативный дерматит, лейкоцитокластический васкулит, алопеция, фоточувствительность.
Влияние на результаты лабораторных показателей и инструментальных исследований: очень редко — повышение активности креатинфосфокиназы крови.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Итраконазол — препарат с высоким потенциалом лекарственных взаимодействий. Ниже описаны различные виды лекарственных взаимодействий и связанные с ними общие рекомендации. Кроме того, представлена таблица с примерами ЛС, которые могут взаимодействовать с итраконазолом, организованная по группам препаратов для более простого использования. Список примеров не является исчерпывающим, поэтому при совместном применении каких-либо препаратов с итраконазолом следует изучить инструкции по их применению на предмет информации, связанной с метаболизмом, путями лекарственных взаимодействий, потенциальными рисками и специфическими действиями в отношении совместного применения.
Итраконазол метаболизируется преимущественно изоферментом CYP3A4. Другие ЛС, которые также метаболизируются с участием данного изофермента или изменяют его активность, могут влиять на фармакокинетику итраконазола. Сходным образом итраконазол может влиять на фармакокинетику ЛС, которые также метаболизируются при участии данного изофермента. При одновременном применении итраконазола с умеренными или сильными индукторами CYP3A4 может снижаться биодоступность итраконазола и гидроксиитраконазола, так что может быть снижена эффективность. Совместное применение с умеренными или сильными ингибиторами CYP3A4 может повысить биодоступность итраконазола, приводя к более выраженным или длительным фармакологическим эффектам итраконазола.
Всасывание итраконазола снижается у пациентов со сниженной кислотностью желудка. Препараты, снижающие кислотность желудка, нарушают всасывание итраконазола из капсул. Чтобы противостоять данному эффекту, рекомендуется принимать итраконазол в капсулах с кислотным напитком (например, недиетической колой), если принимаются препараты для снижения кислотности желудка (см. «Особые указания»).
Итраконазол и его основной метаболит гидроксиитраконазол являются сильными ингибиторами CYP3A4. Итраконазол является ингибитором лекарственных транспортных молекул P-gp и BCRP. Итраконазол может ингибировать метаболизм препаратов, метаболизируемых CYP3A4, и транспорт препаратов P-gp и/или BCRP, в результате чего может возрастать концентрация этих препаратов и/или их активных метаболитов в плазме при одновременном приеме с итраконазолом. Повышение концентраций в плазме может усиливать или пролонгировать как терапевтические, так и нежелательные эффекты этих препаратов. Для некоторых препаратов совместное применение с итраконазолом может привести к снижению концентрации препарата или его активного компонента в плазме. В результате этого эффективность препаратов может быть снижена.
После отмены терапии итраконазолом концентрации в плазме снижаются ниже предела определения в течение 7–14 дней в зависимости от доз и длительности терапии. У пациентов с циррозом печени или лиц, получавших ингибиторы CYP3A4, концентрации в плазме снижаются медленнее. Это особенно важно учитывать в начале терапии препаратами, на метаболизм которых влияет итраконазол.
Применимы следующие общие рекомендации, если в таблице не указано иное.
Противопоказано. Ни при каких обстоятельствах нельзя применять данные лекарственные препараты в комбинации с итраконазолом: субстраты CYP3A4, у которых может возрастать концентрация в плазме с пролонгацией или усилением терапевтических и/или нежелательных эффектов до возникновения потенциально серьезных ситуаций (см. «Противопоказания»).
Не рекомендуется. Рекомендуется избегать применения данного ЛС, за исключением случаев, когда ожидаемая польза превышает потенциальный риск, связанный с проводимой терапией. Если нельзя избежать применения данной комбинации ЛС, рекомендуется наблюдать за состоянием пациента для своевременного выявления симптомов и признаков усиления или пролонгации эффектов препаратов или развития нежелательных эффектов, в случае необходимости следует корректировать дозы итраконазола и/или одновременно принимаемых препаратов. При наличии возможности рекомендуется контролировать плазменную концентрацию препаратов. Это относится к следующим препаратам:
— умеренные или сильные индукторы CYP3A4 (не рекомендуется назначение за 2 нед до и в течение лечения итраконазолом);
— субстраты CYP3A4/P-gp/BCRP, повышение или снижение концентраций которых в плазме может привести к значительному риску (не рекомендуется назначение во время и в течение 2 нед после лечения итраконазолом).
Применять с осторожностью. Рекомендуется тщательное наблюдение при одновременном применении препарата с итраконазолом. При одновременном применении ЛС рекомендуется наблюдать за состоянием пациента и корректировать дозы итраконазола и/или сопутствующих препаратов по мере необходимости. Если возможно, рекомендуется определять концентрации в плазме. Это относится к следующим препаратам:
— препараты, снижающие кислотность в желудке (только для итраконазола в капсулах);
— умеренные или сильные ингибиторы CYP3A4;
— субстраты CYP3A4/P-gp/BCRP, для которых повышение или снижение концентраций в плазме может привести к клинически значимому риску.
Примеры взаимодействующих препаратов представлены в таблице ниже. Препараты, перечисленные в таблице, выбраны на основе данных исследований лекарственных взаимодействий или клинических случаев, а также потенциальных лекарственных взаимодействий на основе механизма действия.
| Классы препаратов и препараты | Ожидаемый/потенциальный эффект по отношению к уровню препарата (см. сноски) | Клинические комментарии |
| Альфа-адреноблокаторы | ||
| Алфузозин Силодозин Тамсулозин |
Алфузозин Cmax (↑↑), AUC (↑↑)а Силодозин Cmax (↑↑), AUC (↑↑)а Тамсулозин Cmax (↑↑), AUC (↑↑)а |
Не рекомендуется во время и 2 нед после окончания лечения итраконазолом. Повышен риск появления нежелательных реакцийс, связанных с алфузозином/силодозином/тамсулозином |
| Анальгетики | ||
| Алфентанил Бупренорфин (в/в и подъязычно) Оксикодон Суфентанил |
Алфентанил AUC (↑↑–↑↑↑↑)а Бупренорфин Cmax (↑↑), AUC (↑↑)а Оксикодон Cmax (↑), AUC (↑↑) Суфентанил — повышение концентрации (степень неизвестна)a,b |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на анальгетикис, может потребоваться снижение дозы алфентанила/бупренорфина/оксикодона/суфентанила |
| Фентанил | Фентанил в/в AUC (↑↑)а Фентанил в других формах — повышение концентрации (степень неизвестна)a,b |
Не рекомендуется во время и 2 нед после окончания лечения итраконазолом. Повышен риск появления нежелательных реакций на фентанилс |
| Левацетилметадол (левометадил) | Левацетилметадол Cmax (↑↑), AUC (↑↑↑)а | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на левацетилметадол: пролонгация интервала QT и пируэтная тахикардия |
| Метадон | (R)-метадон Cmax (↑), AUC (↑)а | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на метадон: потенциально угрожающее жизни угнетение дыхания, пролонгация интервала QT и пируэтная тахикардия |
| Противоаритмические средства | ||
| Дигоксин | Дигоксин Cmax ↑, AUC ↑ | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на дигоксин, может потребоваться снижение дозы дигоксинас |
| Дизопирамид | Дизопирамид — повышение концентрации (↑↑)а,b | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на дизопирамид: серьезные аритмии, включая пируэтную тахикардию |
| Дофетилид | Дофетилид Cmax (↑), AUC (↑)а | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на дофетилид: серьезные желудочковые аритмии, включая пируэтную тахикардию |
| Дронедарон | Дронедарон Cmax (↑↑↑), AUC (↑↑↑↑)а | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на дронедарон: пролонгация интервала QT и сердечно-сосудистая смерть |
| Хинидин | Хинидин Cmax ↑, AUC ↑↑ | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на хинидин: пролонгация интервала QT, пируэтная тахикардия, гипотензия, спутанность сознания и делирий |
| Антибиотики | ||
| Бедаквилин | Бедаквилин Сmах (↔), AUC (↑) в течение 2 нед, 1 раз в сутки бедаквилинаа | Не рекомендуется в течение более чем 2 нед в любой момент лечения бедаквилином в связи с повышением риска появления нежелательных реакций на бедаквилинс |
| Ципрофлоксацин Эритромицин |
Итраконазол Сmах ↑, AUC ↑ | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол, может потребоваться снижение дозы итраконазола |
| Кларитромицин | Кларитромицин — повышение концентрации (степень неизвестна)a,b Итраконазол Сmах ↑, AUC ↑ |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол и/или кларитромицинс, может потребоваться снижение дозы итраконазола и/или кларитромицина |
| Деламанид Триметрексат |
Деламанид — повышение концентрации (степень неизвестна)a,b Триметрексат — повышение концентрации (степень неизвестна)a,b |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на деламанид/триметрексат, может потребоваться снижение дозы итраконазолас |
| Изониазид Рифампицин |
Изониазид — концентрация итраконазола (↓↓↓)a,b Рифампицин — AUC итраконазола ↓↓↓ |
Не рекомендуется в течение 2 нед до и во время лечения итраконазолом, может быть снижена эффективность итраконазола |
| Рифабутин | Рифабутин — повышение концентрации (степень неизвестна)a,b Итраконазол Сmах ↓↓, AUC ↓↓ |
Не рекомендуется в течение 2 нед до, во время и в течение 2 нед после лечения итраконазолом. Возможно снижение эффективности итраконазола и повышение риска появления нежелательных реакций на рифабутинc |
| Телитромицин | У здоровых добровольцев: телитромицин Cmax ↑, AUC ↑ При тяжелом нарушении функции почек: телитромицин AUC (↑↑)а При тяжелом нарушении функции печени: телитромицин — повышение концентрации (степень неизвестна)a,b |
Противопоказан пациентам с тяжелым нарушением функции печени или почек во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на телитромицин, включая печеночную токсичность, пролонгацию интервала QT и пируэтную тахикардию. У других пациентов следует применять с осторожностью, наблюдать на предмет появления нежелательных реакций на телитромицин, может потребоваться снижение дозы телитромицинас |
| Антикоагулянты и антитромбические средства | ||
| Апиксабан Ривароксабан Ворапаксар |
Апиксабан Сmах (↑), AUC (↑)а Ривароксабан Сmах (↑), AUC (↑–↑↑)а Ворапаксар Сmах (↑), AUC (↑)а |
Не рекомендуется во время и 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на апиксабан/ривароксабан/ворапаксарс |
| Кумарины (например, варфарин) Цилостазол |
Кумарины (например, варфарин) — повышение концентрации (степень неизвестна)a,b Цилостазол Сmах (↑), AUC (↑↑)а |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на кумарины/цилостазол, может потребоваться снижение дозы кумаринов/цилостазолас |
| Дабигатран | Дабигатран Сmах (↑↑), AUC (↑↑)а | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на дабигатран, может потребоваться снижение дозы дабигатранас |
| Тикагрелор | Тикагрелор Сmах (↑↑), AUC (↑↑↑)а | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на тикагрелор, например кровотечений |
| Противосудорожные средства | ||
| Карбамазепин | Концентрация карбамазепина (↑)a,b Концентрация итраконазола (↓↓)a,b |
Не рекомендуется в течение 2 нед до, во время и в течение 2 нед после лечения итраконазолом. Эффективность итраконазола может быть снижена в связи с повышением риска появления нежелательных реакций на карбамазепинc |
| Фенобарбитал Фенитоин |
Фенобарбитал — концентрация итраконазола (↓↓↓)a,b Фенитоин — AUC итраконазола (↓↓↓) |
Не рекомендуется в течение 2 нед до, во время и в течение 2 нед после лечения итраконазолом. Может быть снижена эффективность итраконазола |
| Противодиабетические средства | ||
| Репаглинид Саксаглиптин |
Репаглинид Сmах ↑, AUC ↑ Саксаглиптин Сmах (↑↑), AUC (↑↑)a |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на репаглинид/саксаглиптин, может потребоваться снижение дозы репаглинида/саксаглиптинас |
| Антигельминтные, противогрибковые и антипротозойные средства | ||
| Артеметер-люмефантрин Хинин |
Артеметер Сmах (↑↑), AUC (↑↑)a Люмефантрин Сmах (↑), AUC (↑)a Хинин Сmах ↔, AUC ↑ |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на артеметер-люмефантрин/хининс. Специфические действия описаны в инструкциях по применению |
| Галофантрин | Галофантрин — повышение концентрации (степень неизвестна)a,b | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на галофантрин: пролонгация интервала QT и летальные аритмии |
| Изавуконазол | Изавуконазол Сmах (↔), AUC (↑↑↑)а | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на изавуконазол: нарушения со стороны печени, реакции гиперчувствительности и эмбрио-/фетотоксичность |
| Празиквантел | Празиквантел Сmах (↑↑), AUC (↑)a | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на празиквантел, может потребоваться снижение дозы празиквантелас |
| Антигистаминные средства | ||
| Астемизол | Астемизол Сmах (↑), AUC (↑↑)a | Противопоказан во время и в течение 2 недель после лечения итраконазолом. Повышен риск появления нежелательных реакций на астемизол: пролонгация интервала QT, пируэтная тахикардия и другие желудочковые аритмии |
| Биластин Эбастин Рупатадин |
Биластин Сmах (↑↑), AUC (↑)a Эбастин Сmах ↑↑, AUC ↑↑↑ Рупатадин — повышение концентрации (↑↑↑↑)a,b |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на биластин/эбастин/рупатадинс, может потребоваться снижение дозы биластина/эбастина/рупатадина |
| Мизоластин | Мизоластин Сmах (↑), AUC (↑)a | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на мизоластин: пролонгация интервала QT |
| Терфенадин | Терфенадин — повышение концентрации (степень неизвестна)b | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на терфенадин: пролонгация интервала QT, пируэтная тахикардия и другие желудочковые аритмии |
| Противомигренозные средства | ||
| Элетриптан | Элетриптан Сmах (↑↑), AUC (↑↑↑)a | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на элетриптанс, может потребоваться снижение дозы элетриптана |
| Алкалоиды спорыньи (дигидроэрготамин, эргометрин, эрготамин, метилэргометрин) | Алкалоиды спорыньи — повышение концентрации (степень неизвестна)a,b | Противопоказаны во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на алкалоиды спорыньи, таких как эрготизм |
| Противоопухолевые препараты | ||
| Бортезомиб Брентуксимаба ведотин Бусульфан Эрлотиниб Гефитиниб Иматиниб Иксабепилон Нинтеданиб Панобиностат Понатиниб Руксолитиниб Сонидегиб Вандетаниб |
Бортезомиб AUC (↑)a Брентуксимаба ведотин AUC (↑)a Бусульфан Сmах ↑, AUC ↑ Эрлотиниб Сmах (↑↑), AUC (↑)a Гефитиниб Сmах ↑, AUC ↑ Иматиниб Сmах(↑), AUC (↑)a Иксабепилон Сmах(↔), AUC (↑)a Нинтеданиб Сmах(↑), AUC (↑)a Панобиностат Сmах(↑), AUC (↑)a Понатиниб Сmах(↑), AUC (↑)a Руксолитиниб Сmах(↑), AUC (↑)a Сонидегиб Сmах(↑), AUC (↑↑)a Вандетаниб Сmах ↔, AUC ↑ |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на противоопухолевые препаратыс, может потребоваться снижение дозы противоопухолевого препарата |
| Иделалисиб | Иделалисиб Сmах (↑), AUC (↑)а Итраконазол — повышение концентрации в сыворотке (степень неизвестна)a,b |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол и/или иделалисибс, может потребоваться снижение дозы итраконазола и/или иделалисиба |
| Акситиниб Бозутиниб Кабазитаксел Кабозантиниб Церитиниб Кобиметиниб Кризотиниб Дабрафениб Дазатиниб Доцетаксел |
Акситиниб Сmах (↑), AUC (↑↑)а Бозутиниб Сmах (↑↑↑), AUC (↑↑↑)а Кабазитаксел Сmах (↔), AUC (↔)а Кабозантиниб Сmах (↔), AUC (↑)а Церитиниб Сmах (↑), AUC (↑↑)а Кобиметиниб Сmах ↑↑, AUC ↑↑↑ Кризотиниб Сmах (↑), AUC (↑↑)а Дабрафениб AUC (↑)а Дазатиниб Сmах (↑↑), AUC (↑↑)а Доцетаксел AUC (↔–↑↑)а Ибрутиниб Сmах (↑↑↑↑), AUC (↑↑↑↑)а Лапатиниб Сmах (↑↑), AUC (↑↑)а Нилотиниб Сmах (↑), AUC (↑↑)а Олапариб Сmах ↑, AUC ↑↑ Пазопаниб Сmах (↑), AUC (↑)а Сунитиниб Сmах (↑), AUC (↑)а Трабектедин Сmах (↑), AUC (↑)а Трастузумаб эмтанзин — повышение концентрации (степень неизвестна)a,b Алкалоиды барвинка — повышение концентрации (степень неизвестна)a,b |
Не рекомендуется во время и 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на противоопухолевые препаратыс. Дополнительно: для кабазитаксела, даже если изменения параметров фармакокинетики не достигали статистической значимости в исследовании лекарственного взаимодействия с низкими дозами кетоконазола, наблюдалась высокая вариативность результатов. Для ибрутиниба специфические действия описаны в инструкции по применению |
| Регорафениб | AUC регорафиниба (↓↓ по данным для активного компонента)а | Не рекомендуется во время и 2 нед после лечения итраконазолом. Может быть снижена эффективность регорафениба |
| Иринотекан | Иринотекан и его активный метаболит — повышение концентрации (степень неизвестна)a,b | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на иринотекан: потенциально угрожающая жизни миелосупрессия и диарея |
| Антипсихотики, анксиолитики и снотворные средства | ||
| Алпразолам Арипипразол Бротизолам Буспирон Галоперидол Мидазолам (в/в) Пероспирон Кветиапин Рамелтеон Рисперидон Суворексант Зопиклон |
Алпразолам Сmах ↔, AUC ↑↑ Арипипразол Сmах ↑, AUC ↑ Бротизолам Сmах ↔, AUC ↑↑ Буспирон Сmах ↑↑↑↑, AUC ↑↑↑↑ Галоперидол Сmах ↑, AUC ↑ Мидазолам (в/в) — повышение концентрации ↑↑b Пероспирон Сmах ↑↑↑, AUC ↑↑↑ Кветиапин Сmах (↑↑), AUC (↑↑↑)а Рамелтеон Сmах (↑), AUC (↑)а Рисперидон — повышение концентрации ↑b Суворексант Сmах (↑), AUC (↑↑)а Зопиклон Сmах ↑, AUC ↑ |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на антипсихотики, анксиолитики или снотворныес, может потребоваться снижение доз этих препаратов |
| Луразидон | Луразидон Сmах (↑↑↑), AUC (↑↑↑)а | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на луразидон: гипотензия, циркуляторный коллапс, тяжелые экстрапирамидные симптомы, судороги |
| Мидазолам (перорально) | Мидазолам Сmах ↑–↑↑, AUC ↑↑–↑↑↑↑ | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на мидазолам: угнетение дыхания, остановка сердца, пролонгированная седация и кома |
| Пимозид | Пимозид Сmах (↑), AUC (↑↑)а | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на пимозид: аритмии сердца, возможно, связанные с пролонгацией интервала QT и пируэтной тахикардией |
| Сертиндол | Сертиндол — повышение концентрации (степень неизвестна)a,b | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на сертиндол: пролонгация интервала QT и пируэтная тахикардия |
| Триазолам | Триазолам Сmах ↑–↑↑, AUC ↑↑–↑↑↑↑ | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на триазолам: судороги, угнетение дыхания, ангиоотек, апноэ и кома |
| Противовирусные средства | ||
| Асунапревир (с усилением) Тенофовира дизопроксила фумарат (TDF) |
Асунапревир Сmах (↑↑↑), AUC (↑↑↑)а Тенофовир — повышение концентрации (степень неизвестна)a,b |
Применять с осторожностью; специфические действия описаны в инструкции по применению противовирусного препарата |
| Боцепревир | Боцепревир Сmах (↑), AUC (↑↑)а Итраконазол — повышение концентрации (степень неизвестна)a,b |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол и/или боцепревирc, может потребоваться снижение дозы итраконазола. Специфические действия указаны в инструкции по применению боцепревира |
| Кобицистат | Кобицистат — повышение концентрации (степень неизвестна)a,b Итраконазол — повышение концентрации (степень неизвестна)a,b |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол, может потребоваться снижение дозы итраконазола |
| Даклатасвир Ванипревир |
Даклатасвир Сmах (↑), AUC (↑↑)а Ванипревир Сmах(↑↑↑), AUC (↑↑↑)а |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на даклатасвир/ванипревирc, может потребоваться снижение дозы даклатасвира/ванипревира |
| Дарунавир (с усилением) Фосампренавир (с усилением ритонавиром) Телапревир |
Усиленный ритонавиром дарунавир: Сmахитраконазола (↑↑), AUC (↑↑)а Усиленный ритонавиром фосампренавир: Сmах итраконазола (↑), AUC(↑↑)а Телапревир: Сmах итраконазола (↑), AUC (↑↑)а |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол, может потребоваться снижение дозы итраконазола |
| Элвитегравир (усиленный) | Элвитегравир Сmах (↑), AUC (↑)а Итраконазол — повышение концентрации (степень неизвестна)a,b |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол и/или элвитегравир (усиленный ритонавиром)с. Может потребоваться снижение дозы итраконазола; см. инструкцию по применению элвитегравира |
| Эфавиренз Невирапин |
Эфавиренз: Сmах итраконазола ↓, AUC ↓ Невирапин: Сmах итраконазола ↓, AUC ↓↓ |
Не рекомендуется в течение 2 нед до и во время лечения итраконазолом. Эффективность итраконазола может быть снижена |
| Индинавир | Концентрация итраконазола (↑)b Индинавир Сmах ↔, AUC ↑ |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол и/или индинавирc, может потребоваться снижение доз итраконазола и/или индинавира |
| Маравирок | Маравирок Сmах (↑↑), AUC (↑↑↑)а | Применять с осторожностью, наблюдать на предмет появления нежелательных реакцийc. Может потребоваться снижение дозы маравирока |
| Ритонавир | Итраконазол Сmах (↑), AUC (↑↑)а Ритонавир Сmах (↔), AUC (↑)а |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол и/или ритонавирc. Может потребоваться снижение дозы итраконазола. Специфические действия описаны в инструкции по применению ритонавира |
| Саквинавир | Саквинавир (без усиления) Сmах ↑↑, AUC ↑↑↑ Итраконазол (с усиленным саквинавиром) Сmах (↑), AUC (↑↑)а |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол и/или саквинавирc. Может потребоваться снижение дозы итраконазола. Специфические действия описаны в инструкции по применению саквинавира |
| Симепревир | Симепревир Сmах (↑↑), AUC (↑↑↑)а | Не рекомендуется во время и в течение 2 нед после лечения итраконазолом |
| Бета-блокаторы | ||
| Надолол | Надолол Сmах ↑↑, AUC ↑↑ | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на надололc. Может потребоваться снижение дозы надолола |
| Блокаторы кальциевых каналов | ||
| Бепридил | Бепридил — повышение концентрации (степень неизвестна)a,b | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на бепридил, таких как новая аритмия и желудочковая тахикардия по типу пируэтной |
| Дилтиазем | Дилтиазем и итраконазол — повышение концентрации (степень неизвестна)a,b | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на итраконазол и/или дилтиаземc, может потребоваться снижение дозы итраконазола и/или дилтиазема |
| Фелодипин Лерканидипин Нисолдипин |
Фелодипин Сmах ↑↑↑, AUC ↑↑↑ Лерканидипин AUC (↑↑↑↑)а Нисолдипин Сmах (↑↑↑↑), AUC (↑↑↑↑)а |
Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на дигидропиридины: гипотензия и периферический отек |
| Другие дигидропиридины Верапамил |
Дигидропиридины — повышение концентрации (степень неизвестна)a,b Верапамил — повышение концентрации (степень неизвестна)a,b |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на дигидропиридины/верапамилс, может потребоваться снижение доз дигидропиридинов/верапамила |
| Различные средства для лечения заболеваний ССС | ||
| Алискирен Риоцигуат Силденафил (для лечения легочной гипертензии) Тадалафил (для лечения легочной гипертензии) |
Алискирен Сmах ↑↑↑, AUC ↑↑↑ Риоцигуат Сmах (↑), AUC (↑↑)a Силденафил/тадалафил — повышение концентрации (степень неизвестна, но эффект может быть более выраженным, чем сообщено для урологических средств)a,b |
Не рекомендуется во время и в течение 2 нед после лечения итраконазоломc. Повышен риск появления нежелательных реакций на сердечно-сосудистый препарат |
| Бозентан Гуанфацин |
Бозентан Сmах (↑↑), AUC (↑↑)a Гуанфацин Сmах (↑), AUC (↑↑)a |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на бозентан/гуанфацинс, может потребоваться снижение дозы бозентана/гуанфацина |
| Ивабрадин | Ивабрадин Сmах (↑↑), AUC (↑↑↑)a | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на ивабрадин, таких как фибрилляция предсердий, брадикардия, синусовая остановка сердца и блокада сердца |
| Ранолазин | Ранолазин Сmах (↑↑), AUC (↑↑)a | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на ранолазин, таких как пролонгация интервала QT и почечная недостаточность |
| Контрацептивные средства | ||
| Диеногест Улипристал |
Диеногест Сmах (↑), AUC (↑↑)a Улипристал Сmах (↑↑), AUC (↑↑↑)a |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на контрацептивные средстваc; специфические действия указаны в инструкциях по применению диеногеста/улипристала |
| Диуретики | ||
| Эплеренон | Эплеренон Сmах (↑), AUC (↑↑↑)a | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на эплеренон, таких как гиперкалиемия и гипотензия |
| Желудочно-кишечные средства | ||
| Апрепитант Лоперамид Нетупитант |
Апрепитант AUC (↑↑↑)a Лоперамид Сmах ↑↑, AUC ↑↑ Нетупитант Сmах (↑), AUC (↑↑)a |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на апрепитант/лоперамид/нетупитантс, может потребоваться снижение дозы апрепитанта/лоперамида. Специфические действия для нетупитанта представлены в инструкции |
| Цизаприд | Цизаприд — повышение концентрации (степень неизвестна)a,b | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на цизаприд, таких как тяжелые сердечно-сосудистые явления, включая пролонгацию интервала QT, серьезные желудочковые аритмии и пируэтную тахикардию |
| Домперидон | Домперидон Сmах ↑↑, AUC ↑↑ | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на домперидон, таких как тяжелые желудочковые аритмии и внезапная сердечная смерть |
| Средства для снижения кислотности в желудке | Итраконазол Сmах ↓↓, AUC ↓↓ | Применять с осторожностью препараты, снижающие кислотность в желудке, например, такие нейтрализующие кислоту средства, как алюминия гидроксид, или подавляющие выработку кислоты препараты, например, антагонисты Н2-рецепторов и ингибиторы протонной помпы. При одновременном лечении нейтрализующими кислоту средствами, например, алюминия гидроксидом, их следует принимать по крайней мере за 2 ч до или через 2 ч после приема капсул итраконазола (см. «Особые указания») |
| Налоксегол | Налоксегол Сmах (↑↑↑), AUC (↑↑↑↑)a | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на налоксегол, таких как симптомы отмены опиоидов |
| Saccharomyces boulardii | S. boulardii — снижение колонизации (степень неизвестна) | Не рекомендуется во время и 2 нед после лечения итраконазолом. Эффективность S. boulardii может быть снижена |
| Иммуносупрессоры | ||
| Будесонид Циклесонид Циклоспорин Дексаметазон Флутиказон Метилпреднизолон Такролимус Темсиролимус |
Будесонид (для ингаляций) Сmах ↑, AUC ↑↑; будесонид (другие формы) — повышение концентрации (степень неизвестна)a,b Циклесонид (для ингаляций) Сmах (↑↑), AUC (↑↑)a Циклоспорин (в/в) — повышение концентрации ↔–↑b Циклоспорин (другие формы) – повышение концентрации (степень неизвестна)a,b Дексаметазон Сmах ↔ (в/в) ↑ (перорально), AUC ↑↑ (в/в, перорально) Флутиказон (для ингаляций) — повышение концентрации ↑↑b Флутиказон (назальная форма) — повышение концентрации (↑)a,b Метилпреднизолон (перорально) Сmах ↑–↑↑, AUC ↑↑ Метилпреднизолон (в/в) AUC ↑↑ Такролимус (в/в) — повышение концентрации ↑b Такролимус (перорально) Сmах (↑↑), AUC (↑↑)a Темсиролимус (в/в) Сmах (↑↑), AUC (↑↑)a |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на иммуносупрессоры, может потребоваться снижение дозы иммуносупрессора |
| Эверолимус Сиролимус (рапамицин) |
Эверолимус Сmах (↑↑), AUC (↑↑↑↑)a Сиролимус Сmах (↑↑), AUC (↑↑↑↑)a |
Не рекомендуется во время и в течение 2 нед после лечения итраконазоломс. Повышен риск появления нежелательных реакций на эверолимус/сиролимус |
| Препараты, регулирующие уровни липидов | ||
| Аторвастатин | Аторвастатин Сmах ↔–↑↑, AUC ↔–↑↑ | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на ловастатин/симвастатин, таких как миопатия, рабдомиолиз и отклонения лабораторных параметров функции печени |
| Ломитапид | Ломитапид Сmах (↑↑↑↑), AUC (↑↑↑↑)a | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на ломитапид, таких как печеночная токсичность и тяжелая желудочно-кишечная реакция |
| Ловастатин Симвастатин |
Ловастатин Сmах ↑↑↑↑, AUC ↑↑↑↑ Симвастатин Сmах ↑↑↑↑, AUC ↑↑↑↑ |
Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на ловастатин/симвастатин, таких как миопатия, рабдомиолиз и отклонения лабораторных параметров функции печени |
| НПВС | ||
| Мелоксикам | Мелоксикам Сmах ↓↓, AUC ↓ | Применять с осторожностью, наблюдать на предмет снижения эффективности мелоксикама, может потребоваться коррекция дозы мелоксикама |
| Респираторные средства | ||
| Салметерол | Салметерол Сmах (↑), AUC (↑↑↑↑)a | Не рекомендуется во время и 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на салметеролс |
| СИОЗС, трициклические и другие антидепрессанты | ||
| Ребоксетин Венлафаксин |
Ребоксетин Сmах (↔), AUC (↑)a Венлафаксин Сmах (↑), AUC (↑)a |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на ребоксетин/венлафаксинс, может потребоваться снижение доз ребоксетина/венлафаксина |
| Урологические препараты | ||
| Аванафил | Аванафил Сmах (↑↑), AUC (↑↑↑↑)a | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на аванафил, таких как приапизм, нарушения зрения и внезапная потеря слуха |
| Дапоксетин | Дапоксетин Сmах (↑), AUC (↑)a | Противопоказан во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на дапоксетин, таких как ортостатическая гипотензия и визуальные эффекты |
| Дарифенацин Варденафил |
Дарифенацин Сmах (↑↑↑), AUC (↑↑↑–↑↑↑↑)a Варденафил Сmах (↑↑), AUC (↑↑↑↑)a |
Не рекомендуется во время и 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на дарифенацин/варденафилс |
| Дутастерид Имидафенацин |
Дутастерид — повышение концентрации (степень неизвестна)a,b | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на урологические препаратыc, может потребоваться снижение дозы урологического препарата |
| Оксибутинин Силденафил (эректильная дисфункция) Тадалафил (эректильная дисфункция и ДГПЖ) Толтеродин Уденафил |
Имидафенацин Сmах ↑, AUC ↑ Оксибутинин — повышение концентрации ↑b Силденафил Сmах (↑↑), AUC (↑↑–↑↑↑↑)a Тадалафил Сmах (↑), AUC (↑↑)a Толтеродин Сmах (↑–↑↑), AUC (↑↑)a у лиц со слабым метаболизмом CYP2D6 Уденафил Cmax (↑), AUC (↑↑)а |
Специфические действия по дутастериду указаны в инструкции по его применению. Для силденафила и тадалафила см. также «Особые указания» |
| Фезотеродин | Фезотеродин Сmах (↑↑), AUC (↑↑)a | Противопоказан пациентам с нарушением функции печени или почек от средней до тяжелой степени во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на фезотеродин, таких как тяжелые антихолинергические эффекты. Применять с осторожностью у других пациентов: наблюдать на предмет появления нежелательных реакций на фезотеродинс, может потребоваться снижение дозы фезотеродина |
| Солифенацин | Солифенацин Сmах (↑), AUC (↑↑)a | Противопоказан пациентам с нарушением функции почек тяжелой степени или с нарушением функции печени от средней до тяжелой степени во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на солифенацин: антихолинергические эффекты и пролонгация интервала QT. Применять с осторожностью у других пациентов, наблюдать на предмет появления нежелательных реакций на солифенацинc, может потребоваться снижение дозы солифенацина |
| Другие препараты и ЛС | ||
| Алитритиноин (перорально) Каберголин Каннабиоиды Цинакальцет |
Алитритиноин Сmах (↑), AUC (↑)a Каберголин Сmах (↑↑), AUC (↑↑)a Каннабиоиды — повышение концентрации, степень неизвестна, но вероятно (↑↑)а Цинакальцет Сmах (↑↑), AUC (↑↑)a |
Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на алитритиноин/каберголин/каннабиоиды/цинакальцет, может потребоваться снижение доз этих препаратовc |
| Колхицин | Колхицин Сmах (↑), AUC (↑↑)a | Противопоказан пациентам с нарушением функции почек или печени во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на колхицин: снижение сердечного выброса, аритмии сердца, респираторный дистресс и угнетение костного мозга. Не рекомендуется другим пациентам во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на колхицинс |
| Элиглустат | CYP2D6 EMs: Cmax элиглустата (↑↑), AUC (↑↑)а. Более выраженное повышение ожидается у лиц со средним или слабым метаболизмом CYP2D6 IMs/PMs и при одновременном применении ингибитора CYP2D6 |
Противопоказан пациентам с сильным метаболизмом CYP2D6 EMs, получающим мощный или умеренный ингибитор CYP2D6, а также пациентам со средним или слабым метаболизмом CYP2D6 во время и в течение 2 нед после терапии итраконазолом. Повышен риск появления нежелательных реакций на элиглустат: пролонгация интервалов PR, QTc и/или QRS, а также сердечные аритмии. Применять с осторожностью у лиц с сильным метаболизмом CYP2D6 EMs, наблюдать на предмет появления нежелательных реакций на элиглустатс, может потребоваться снижение дозы элиглустата |
| Алкалоиды спорыньи | Алкалоиды спорыньи — повышение концентрации (степень неизвестна)а,b | Противопоказаны во время и в течение 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на алкалоиды спорыньи, таких как эрготизм (см. также Противомигренозные средства) |
| Ивакафтор | Ивакафтор Сmах (↑↑), AUC (↑↑↑)a | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на ивакафторc, может потребоваться снижение дозы ивакафтора |
| Лумакафтор/ивакафтор | Ивакафтор Сmах (↑↑), AUC (↑↑)a Лумакафтор Сmах (↔), AUC (↔)a Итраконазол — снижение концентрации, степень неизвестна, но, вероятно ↓↓↓ |
Не рекомендуется в течение 2 нед до, во время и в течение 2 нед после лечения итраконазолом. Возможно снижение эффективности итраконазола, возрастает риск появления нежелательных реакций на ивакафторc |
| Антагонисты рецепторов вазопрессина | ||
| Кониваптан Толваптан |
Кониваптан Сmах (↑↑), AUC (↑↑↑↑)a Толваптан Сmах (↑↑), AUC (↑↑↑)a |
Не рекомендуется во время и 2 нед после лечения итраконазолом. Повышен риск появления нежелательных реакций на кониваптан/толваптанс |
| Мозаваптан | Мозаваптан Сmах ↑, AUC ↑↑ | Применять с осторожностью, наблюдать на предмет появления нежелательных реакций на мозаваптанс, может потребоваться снижение дозы мозаваптана |
Среднее повышение концентрации: ↑: <100 % (<2 раз); ↑↑: 100–400 % (≥2 раз и <5 раз); ↑↑↑: 400–900 % (≥5 раз и <10 раз); ↑↑↑↑: ≥10 раз.
Среднее снижение концентрации: ↓: <40 %; ↓↓: 40–80%; ↓↓↓: >80%.
Отсутствие эффекта: ↔.
Для описания эффекта (средняя колонка) указано название исходного лекарственного вещества, даже если эффект относится к активному компоненту или активному метаболиту пролекарства.
а Для препаратов со стрелками в скобках оценка основана на механизме лекарственных взаимодействий и информации о клинических лекарственных взаимодействиях с кетоконазолом или другими мощными ингибиторами CYP3A4 и/или ингибиторами P-gp или BCRP, а также на данных моделирования, клинических случаев и/или экспериментов in vitro. Для других перечисленных препаратов оценка основана на данных клинических лекарственных взаимодействий препарата с итраконазолом.
b Параметры фармакокинетики не установлены.
c Связанные с препаратом нежелательные лекарственные реакции представлены в соответствующей инструкции по применению.
Особые группы пациентов
Дети. Лекарственные взаимодействия изучены только у взрослых людей.
Передозировка
Симптомы: сопоставимы с дозозависимыми побочными реакциями, наблюдаемыми при применении обычных доз препарата.
Лечение: поддерживающее. Специфического антидота нет. Итраконазол не выводится из организма при гемодиализе. Рекомендуется обратиться в токсикологический центр с целью корректировки лечения при передозировке препарата Орунгамин®.
Особые указания
Влияние на деятельность сердца. В исследованиях здоровых добровольцев ЛФ итраконазола раствор для в/в введения отмечалось преходящее бессимптомное уменьшение фракции выброса левого желудочка, нормализовавшееся до следующей инфузии. Клиническая значимость полученных данных для лекарственных форм для приема внутрь неизвестна. Итраконазол обладает отрицательным инотропным действием.
Сообщалось о случаях ХСН, связанных с приемом итраконазола. При суточной дозе 400 мг итраконазола наблюдалось более частое возникновение сердечной недостаточности; при меньших суточных дозах такой закономерности не было выявлено. Риск возникновения ХСН, предположительно, пропорционален суточной дозе. Препарат Орунгамин® не следует принимать пациентам с ХСН или наличием этого симптомокомплекса в анамнезе, за исключением случаев, когда возможная польза значительно превосходит потенциальный риск. При индивидуальной оценке соотношения пользы и риска следует принимать во внимание такие факторы, как серьезность показаний, режим дозирования и индивидуальные факторы риска возникновения сердечной недостаточности (ИБС, поражения клапанов, обструктивная болезнь легких, почечная недостаточность и другие заболевания, сопровождающиеся отеками). Таких пациентов необходимо проинформировать о признаках и симптомах ХСН и следить за их появлением во время курса терапии. При появлении подобных признаков прием препарата Орунгамин® необходимо прекратить.
Угрожающие жизни аритмии сердца и/или внезапная смерть отмечались у пациентов при одновременном применении метадона.
Блокаторы кальциевых каналов могут обладать отрицательным инотропным эффектом, который может быть аддитивным по отношению к эффекту итраконазола. Кроме того, итраконазол может ингибировать метаболизм БКК. Следовательно, следует проявлять осторожность при одновременном применении итраконазола и БКК из-за повышения риска застойной сердечной недостаточности.
Лекарственные взаимодействия. Одновременный прием некоторых ЛС с итраконазолом может привести к изменению в эффективности итраконазола и/или одновременно применяемых лекарственных препаратов, возникновению опасных для жизни побочных реакций и/или внезапной смерти. Препараты, которые нельзя принимать одновременно с итраконазолом, не рекомендованные для одновременного применения и/или рекомендованные для одновременного применения с итраконазолом с осторожностью, перечислены в разделе «Взаимодействие».
Перекрестная гиперчувствительность. Данные в отношении наличия перекрестной гиперчувствительности между итраконазолом и другими противогрибковыми средствами с азольной структурой (из группы азолов) ограничены. При наличии гиперчувствительности к другим азолам следует с осторожностью назначать итраконазол.
Невропатия. Лечение препаратом Орунгамин® стоит прекратить в случае возникновения невропатии. При системном кандидозе в случае, если предполагается, что штаммы рода Candida резистентны к флуконазолу, невозможно предполагать, что они чувствительны к итраконазолу, следовательно, рекомендуется проверять чувствительность штаммов до терапии итраконазолом.
Взаимозаменяемость. Не рекомендуется взаимозаменяемое использование итраконазола, капсулы, и итраконазола, раствор для приема внутрь, ввиду того что экспозиция итраконазола выше при применении его в ЛФ раствор для приема внутрь, чем в форме капсул, даже при приеме одинаковых доз итраконазола.
Сниженная кислотность желудочного сока. При сниженной кислотности желудочного сока абсорбция итраконазола из капсул нарушается. Пациентам со сниженной кислотностью желудочного сока вследствие заболевания (например, у пациентов с
ахлоргидрией) или приема лекарственных препаратов (например, ЛС, подавляющие желудочную секрецию) рекомендуется принимать препарат Орунгамин® в капсулах одновременно с кислыми напитками (такими как недиетическая кола). Следует контролировать противогрибковую активность препарата и увеличивать дозу итраконазола при необходимости.
Влияние на функцию печени. В очень редких случаях при применении итраконазола развивалось тяжелое токсическое поражение печени, включая несколько случаев острой печеночной недостаточности с летальным исходом. В большинстве случаев это происходило с пациентами, у которых уже имелись заболевания печени, у пациентов с другими тяжелыми заболеваниями, которым препарат был назначен для лечения системных заболеваний, а также у пациентов, получавших другие ЛС, обладающие гепатотоксическим действием. Однако у некоторых пациентов не было сопутствующих заболеваний или очевидных факторов риска в отношении поражения печени. Несколько таких случаев возникли в 1-й мес терапии, а некоторые — в 1-ю нед терапии. В связи с этим рекомендуется регулярно контролировать функцию печени у пациентов, получающих терапию итраконазолом. В случае возникновения симптомов, предполагающих возникновение гепатита, а именно: анорексии, тошноты, рвоты, слабости, боли в животе и потемнения мочи, необходимо немедленно прекратить лечение и провести исследование функции печени. Пациентам с повышенной активностью печеночных ферментов, или заболеванием печени в активной фазе, или при перенесенном токсическом поражении печени вследствие приема других препаратов не следует назначать лечение препаратом Орунгамин®, за исключением тех случаев, когда ожидаемая польза превышает потенциальный риск поражения печени. Рекомендуется проводить наблюдение за уровнем лабораторных параметров функции печени у пациентов с уже имеющимися нарушениями функции печени или пациентов, у которых отмечались проявления гепатотоксичности других ЛС. Итраконазол преимущественно метаболизируется в печени. Поскольку у пациентов с нарушениями функции печени полный T1/2 итраконазола несколько увеличен, рекомендуется осуществлять контроль концентраций итраконазола в плазме крови и при необходимости корректировать дозу препарата.
Нарушения функции почек. Данные по применению препарата у пациентов с нарушениями функции почек ограничены, у некоторых пациентов с недостаточностью функции почек экспозиция итраконазола может быть снижена. Поэтому таким пациентам следует назначать препарат с осторожностью.
Рекомендуется осуществлять контроль концентраций итраконазола в плазме крови и при необходимости корректировать дозу препарата.
Иммунодефицит. Биодоступность итраконазола при приеме внутрь может быть снижена у некоторых пациентов с нарушенным иммунитетом, например у пациентов с нейтропенией, больных СПИДом или перенесших операцию по трансплантации органов. Таким образом, доза должна быть скорректирована в зависимости от клинической картины у этой группы пациентов.
Системные грибковые инфекции, представляющие угрозу жизни. Вследствие фармакокинетических характеристик препарата Орунгамин® в виде капсул, его применение не рекомендуется для начала лечения системных микозов, представляющих угрозу для жизни пациентов.
СПИД. Врач должен оценить необходимость проведения поддерживающей терапии у ВИЧ-инфицированных пациентов, имеющих СПИД, у которых существует риск рецидива, ранее получавших лечение по поводу системных грибковых инфекций.
Применение в педиатрической практике. Поскольку клинических данных о применении итраконазола у детей недостаточно, рекомендуется назначать препарат детям только в случае, если возможная польза от лечения превосходит потенциальный риск.
Женщины детородного возраста. Необходимо использовать адекватные методы контрацепции на протяжении всего курса терапии вплоть до наступления первой менструации после его завершения.
Лечение следует прекратить при возникновении периферической нейропатии, которая может быть связана с приемом препарата Орунгамин®, капсулы.
Системные кандидозы. При системных кандидозах, предположительно, вызванных флуконазол-резистентными штаммами Candida, нельзя предположить чувствительность к итраконазолу, следовательно, рекомендуется проверить чувствительность перед началом терапии итраконазолом.
Пожилой возраст. Данные по использованию препарата Орунгамин® у пациентов пожилого возраста ограниченны. Рекомендуется назначать препарат только в случае, если возможная польза от лечения превышает потенциальный риск.
В целом рекомендуется при подборе дозы для пациентов пожилого возраста обратить внимание на частоту снижения функции печени, почек, ССС и сопутствующих заболеваний или другой лекарственной терапии.
Потеря слуха. Сообщалось о временной или стойкой потере слуха у пациентов, принимающих итраконазол. В некоторых случаях потеря слуха происходила на фоне одновременного приема с хинидином (см. «Противопоказания», «Взаимодействие»). Слух обычно восстанавливается после окончания терапии препаратом, однако у некоторых пациентов потеря слуха необратима.
Способность к зачатию. В исследованиях на животных отмечалась репродуктивная токсичность итраконазола.
Муковисцидоз (кистозный фиброз). У пациентов с муковисцидозом (кистозным фиброзом) наблюдалась вариабельность концентрации итраконазола в плазме крови при применении итраконазола в форме раствора для приема внутрь в дозе 2,5 мг/кг 2
раза в сутки. Как следствие, терапевтическая Css итраконазола в плазме крови может не достигаться. Css >250 нг/мл достигались приблизительно у 50% пациентов старше 16 лет и не достигались ни у одного пациента моложе 16 лет. При отсутствии ответа на терапию препаратом Орунгамин®, капсулы, следует рассмотреть возможность перехода на альтернативную терапию.
Влияние на способность управлять транспортными средствами, механизмами. Исследования по изучению влияния ЛС Орунгамин® на способность управлять транспортными средствами и работать с техникой не проводились. Необходимо принимать во внимание возможность возникновения побочных реакций, таких как головокружение, нарушение зрения или потеря слуха (см. «Побочные действия»). При появлении описанных нежелательных реакций следует воздержаться от выполнения указанных видов деятельности.
Форма выпуска
Капсулы, 100 мг. По 4, 5, 6, 7, 10, 14 капс. в контурной ячейковой упаковке из пленки ПВХ либо пленки ПВХ/ПВДХ и фольги алюминиевой печатной лакированной.
Или по 4, 5, 6, 7, 10, 14 капс. в контурной ячейковой упаковке из материала комбинированного на основе фольги (трехслойный материал, включающий алюминиевую фольгу, пленку из ориентированного полиамида, ПВХ-пленку) и фольги алюминиевой печатной лакированной.
1, 2, 3, 4, 5, 6, 7, 8 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную упаковку (пачку).
Комплект (по 3 контурные ячейковые упаковки по 14 капс. вместе с инструкцией по применению в пачке из картона и по 3 контурные ячейковые упаковки по 14 капс. вместе с инструкцией по применению в пачке из картона) в пачке из картона.
Производитель
Производитель, ответственный за выпускающий контроль качества. ООО «Озон», Россия. Самарская обл., г. Жигулевск, ул. Гидростроителей, 6.
Держатель РУ. ООО «Озон». 445351, Россия, Самарская обл., г. Жигулевск, ул. Песочная, 11.
Все претензии потребителей следует направлять представителю держателя регистрационного удостоверения. ООО «Озон». 445351, Россия, Самарская обл., г. Жигулевск, ул. Гидростроителей, 6.
Тел.: (987) 459-99-91, (987) 459-99-92.
e-mail: ozon@ozon-pharm.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C, в оригинальной упаковке (пачка картонная).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Орунгамин — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
Р N002656/01 от 28.06.2010
Торговое название:
Орунгамин
Международное непатентованное название:
итраконазол
Лекарственная форма:
капсулы.
Состав на 1 капсулу:
итраконазола пеллеты 455 мг (Активное вещество: итраконазол 100 мг, Вспомогательные вещества: гипромеллоза (гидроксипропилметилцеллюлоза Е-5), бутилметакрилата, диметиламиноэтилметакрилата и метилметакрилата сополимер [1:2:1] (эудрагит Е-100), сахароза (сахар)).
Капсулы твердые желатиновые № 0.
Состав капсул: корпус: желатин; крышечка: краситель индигокармин, титана диоксид, желатин.
Описание
Капсулы № 0, крышечка — непрозрачная синяя, корпус — прозрачный натурального цвета желатина. Содержимое капсул — сферические микрогранулы от почти белого до кремового цвета.
Фармакотерапевтическая группа:
противогрибковое средство.
Код ATX: [J02AC02]
ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
Фармакодинамика
Итраконазол — синтетическое противогрибковое средство широкого спектра действия, производное триазола. Ингибирует синтез эргостерола клеточной мембраны грибов, что обуславливает противогрибковый эффект препарата.
Итраконазол активен в отношении:
- дерматофитов (Trichophyton spp, Microsporum spp, Epidermophyton floccosum),
- дрожжевых грибов Candida spp. (включая Candida albicans, Candida parapsilosis),
- плесневых грибов (Cryptococcus neoformans, Aspergillus spp., Trichosporon spp., Geotrichum spp., Penicillium mameffei, Pseudallescheria boydii, Histoplasma spp., Coccidioides immitis, Paracoccidioides braziliensis, Sporothrix schenckii. Fonsecaea spp., Cladosporium spp., Blastomyces dermatidis), Malassezia spp..
Некоторые штаммы могут быть устойчивы к действию итраконазола: С. glabrata, С. krusei, С. tropicalis, Absidia spp., Fusarium spp., Mucor spp., Rhizomucor spp.. Rhizopus spp., Scedosporium proliferans, Scopulariopsis spp.. Эффективность лечения оценивается через 2-4 нед. после прекращения терапии (при системных микозах), через 6-9 мес. — при онихомикозах (по мере смены ногтей).
Фармакокинетика
При пероральном применении максимальная биодоступность итраконазола отмечается при приеме капсул сразу после еды. Максимальная концентрация в плазме достигается в течение 3-3,5 часов после приема внутрь и составляет 28,34 нг/мл. При длительном приеме равновесная концентрация достигается в течение 1-2 недель. Итраконазол на 99,8% связывается с белками плазмы. Концентрация итраконазола в крови составляет 60% от концентрации в плазме. Накопление препарата в кератиновых тканях, особенно в коже, примерно в 4 раза превышает накопление в плазме, а скорость его выведения зависит от регенерации эпидермиса.
В отличие от концентраций в плазме, которые не поддаются обнаружению уже через 7 дней после прекращения терапии, терапевтические концентрации в коже сохраняются в течение 2-4 недель после прекращения 4-х недельного курса лечения. Итраконазол обнаруживается в кератине ногтей уже через одну неделю после начала лечения и сохраняется, по крайней мере, в течение 6 месяцев после завершения 3-х месячного курса терапии. Итраконазол определяется также в кожном сале и в меньшей степени в поту.
Итраконазол хорошо распределяется в тканях, которые подвержены грибковым поражениям. Концентрации в легких, почках, печени, костях, желудке, селезенке и мышцах в 2-3 раза превышали соответствующие концентрации в плазме. Терапевтические концентрации в тканях влагалища сохраняются еще в течение 2 дней после окончания 3-х дневною курса лечения в дозе 200 мг в сутки, и 3-х дней после окончания однодневного курса лечения в дозе 200 мг дважды в сутки. Итраконазол метаболизируется в печени с образованием активных метаболитов, в т. ч. гидроксиитраконазола. Является ингибитором изоферментов CYP3A4, CYP3A5 и CYP3A7.
Выведение из плазмы — двухфазное: почками в течение 1 нед. (35% в виде метаболитов, 0.03% — в неизмененном виде) и через кишечник (3-18% в неизмененном виде). Период полувыведения — 1-1.5 дня. Не удаляется при проведении диализа.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
• поражение кожи и слизистых оболочек:
- дерматомикозы;
- вульвовагинальный кандидоз;
- разноцветный лишай,
- кандидоз слизистой оболочки полости рта; кератомикоз;
- глубокие висцеральные кандидозы.
• онихомикозы, вызванные дерматофитами и/или дрожжами и плесневыми грибами:
• системные микозы:
- системный аспергиллез и кандидоз;
- криптококкоз (включая криптококковый менингит): у пациентов с иммунодефицитом и у всех пациентов с криптококкозом центральной нервной системы итраконазол должен назначаться только в случаях, если препараты первой линии лечения не применимы в данном случае или не эффективны;
- гистоплазмоз;
- споротрихоз;
- паракокцидиоидоз;
- бластомикоз;
- прочие редко встречающиеся системные микозы.
ПРОТИВОПОКАЗАНИЯ
1 .Гиперчувствительность к итраконазолу или вспомогательным веществам.
2.Хроническая сердечная недостаточность, в т. ч. в анамнезе (за исключением терапии жизнеугрожающих состояний).
3.Одновременный прием следующих лекарственных средств:
- препараты, метаболизируемые изоферментом CYP3A4, которые могут удлинять QT интервал (астемизол, бепридил, цизаприд, дофетилид, левацетилметадол, мизоластин, пимозид, хинидин, сертиндол, терфенадин);
- ингибиторы ГМГ-КоА редуктазы, метаболизирующиеся изоферментом CYP3A4 (симвастатин, ловастатин);
- пероральный прием триазолама и мидазолама;
- препаратов алкалоидов спорыньи (дигидроэрготамин, эргометрин, эрготамин и метилэргометрин);
- нисолдипина, элетриптана.
4.Детский возраст до 3-х лет.
5.Непереносимость фруктозы, дефицит сахаразы/изомальтазы, глюкозо-галактозная мальабсорбция.
С ОСТОРОЖНОСТЬЮ — почечная/печеночная недостаточность, периферическая нейропатия, факторы риска хронической сердечной недостаточности (ишемическая болезнь сердца, поражение сердечных клапанов, тяжелые заболевания легких, в т. ч. хроническая обструктивная болезнь легких, состояния, сопровождающиеся отечным синдромом), нарушение слуха, одновременный прием блокаторов «медленных» кальциевых каналов, детский и пожилой возраст.
БЕРЕМЕННОСТЬ И ПЕРИОД ЛАКТАЦИИ
Применение препарата во время беременности возможно только в тех случаях, когда предполагаемая польза для матери превышает потенциальный риск для плода. Поскольку итраконазол может проникать в грудное молоко, при необходимости применения в период лактации, женщинам, применяющим итраконазол, следует прекратить грудное вскармливание.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Принимать итраконазол внутрь, сразу после еды. Капсулы следует глотать целиком.
| Показание | Доза | Продолжительность |
| Вульвовагинальный кандидоз | 200 мг 2 раза в сутки или 200 мг 1 раз в сутки | 1 день или 3 дня |
| Разноцветный лишай | 200 мг 1 раз в сутки | 7 дней |
| Дерматомикоз гладкой кожи | 200 мг 1 раз в сутки или 100 мг 1 раз в сутки | 7 дней или 15 дней |
| Поражения высококератинизированных областей кожного покрова, таких как кисти рук и стопы | 200 мг 2 раза в сутки или 100 мг 1 раз в сутки | 7 дней или 30 дней |
| Кандидоз слизистой оболочки полости рта | 100 мг 1 раз в сутки | 15 дней |
| Грибковый кератит | 200 мг 1 раз в сутки | 21 день Возможна коррекция длительности лечения с учетом положительной динамики клинической картины |
При кандидозе слизистой оболочке полости рта биодоступность препарата, при пероральном приеме, может быть снижена у некоторых пациентов с нарушенным иммунитетом, например, у больных с нейтропенией, больных СПИДом или пациентов с трансплантированными органами. В данных случаях может потребоваться двукратное увеличение дозы.
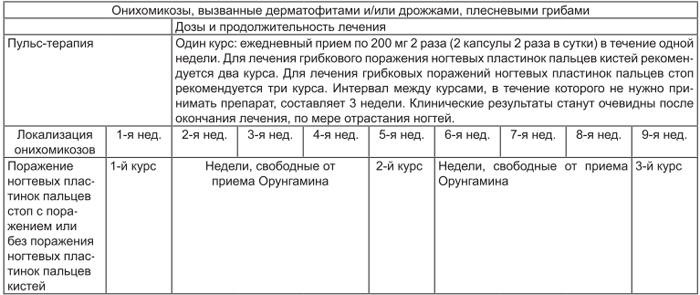
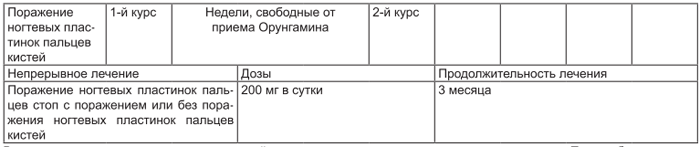
Выведение итраконазола из кожи и ногтевой ткани осуществляется медленнее, чем из плазмы. Таким образом, опти мальный клинический и микологический эффект достигается через 2-4 недели после окончания лечения при заболе ваниях кожи и через 6-9 месяцев после окончания лечения заболеваний ногтей.
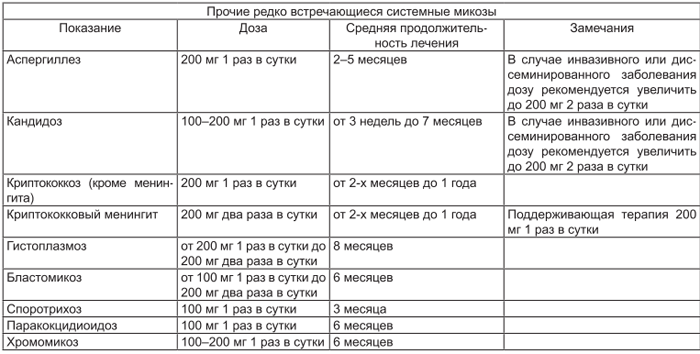
ПОБОЧНОЕ ДЕЙСТВИЕ
Со стороны органов кроветворения: лейкопения, нейтропения, тромбоцитопения.
Аллергические реакции: сывороточная болезнь, ангионевротический отек, анафилактические и анафилактоидные реакции, гиперчувствительность.
Со стороны кожных покровов: токсический эпидермальный некролиз, синдром Стивенса-Джонсона, многоформная эритема, эксфолиативный дерматит, лейкокластический васкулит, алопеция, фотосенсибилизация, крапивница, сыпь, зуд.
Со стороны обмена веществ: гипертриглицеридемия, гипокалиемия.
Со стороны нервной системы: периферическая нейропатия, парестезия, гипестезия, головокружение.
Со стороны органов зрения и слуха: нарушение зрения, включая расплывчатость и диплопию, шум в ушах, преходящая или постоянная глухота.
Со стороны сердечно-сосудистой системы: застойная сердечная недостаточность.
Со стороны дыхательной системы: отек легких.
Со стороны пищеварительной системы: боль в животе, рвота, тошнота, диарея, нарушение вкусового восприятия, повышение активности «печеночных» ферментов; диспепсия, запор, гепатит, гипербилирубинемия; гепатотоксичность, острая печеночная недостаточность.
Со стороны опорно-двигательного аппарата: миалгия, артралгия.
Со стороны мочеполовой системы: поллакиурия, недержание мочи, нарушение менструального цикла, эректильная дисфункция.
Прочие: отеки.
ПЕРЕДОЗИРОВКА
Данные отсутствуют. При случайной передозировке в течение первого часа после приема препарата следует провести промывание желудка, принять активированный уголь.
Симптоматическое лечение. Гемодиализ не эффективен. Специфического антидота не существует.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
Лекарственные средства, оказывающие влияние на абсорбцию итраконазола.
Лекарственные средства, снижающие кислотность желудочного сока, нарушают абсорбцию итраконазола, что связано с растворимостью оболочек капсул.
Лекарственные средства, оказывающие влияние на метаболизм итраконазола.
Итраконазол в основном метаболизируется с участием изофермента CYP3A4. При одновременном применении с рифампицином, рифабутином, фенитоином, являющимися мощными индукторами изофермента CYP3A4, биодоступность итраконазола и гидроксиитраконазола значительно снижается, что приводит к существенному уменьшению эффективности препарата. Одновременное применение итраконазола с данными препаратами, являющимися потенциальными индукторами микросомальных печеночных ферментов, не рекомендуется.
Мощные ингибиторы изофермента CYP3A4, такие как ритонавир, индинавир, кларитромицин и эритромицин, могут увеличивать биодоступность итраконазола.
Влияние итраконазола на метаболизм других лекарственных средств:
Итраконазол может ингибировать метаболизм препаратов, являющихся субстратами изоферментов CYP3A. Результатом этого может быть усиление или пролонгация их действия, в том числе и побочных эффектов. При применении сопутствующих препаратов необходимо изучить информацию, касающуюся их метаболизма. После прекращения лечения концентрации итраконазола в плазме снижаются постепенно в зависимости от дозы и длительности лечения (см. раздел «Фармакокинетика»). Это следует принимать в расчет при оценке ингибирующего эффекта итраконазола на метаболизм одновременно назначаемых препаратов.
Лекарственные средства, назначать которые одновременно с итраконазолом не рекомендуется:
• Терфенадин, астемизол, бепридил, мизоластин, цизаприд, дофетилид, хинидин, пимозид, сертиндол, левацетилметадол, ингибиторы ГМГ-КоА редуктазы, такие как симвастатин и ловастатин.
• Мидазолам для приема внутрь и триазолам.
• Препараты алкалоидов спорыньи такие, как дигидроэрготамин, эргометрин, эрготамин и метилэргометрин.
• Нисолдипин
• Блокаторы «медленных» кальциевых каналов могут оказывать отрицательный инотропный эффект, который усиливается при одновременном приеме с итраконазолом. При одновременном приеме итраконазола и блокаторов «медленных» кальциевых каналов необходимо соблюдать осторожность, так как метаболизм блокаторов «медленных» кальциевых каналов может быть снижен.
Препараты, при одновременном назначении которых рекомендуется следить за их концентрацией в плазме, действием, побочными эффектами.
При необходимости дозу этих препаратов следует уменьшить.
• непрямые антикоагулянты;
• ингибиторы ВИЧ-протеазы (ритонавир, индинавир, саквинавир);
• некоторые противоопухолевые препараты (алкалоиды барвинка розового, в том числе винкристин и винбластин; бусульфан, доцетаксел, триметрексат);
• метаболизируемые изоферментом CYP3A4 блокаторы «медленных» кальциевых каналов (верапамил и производные дигидропиридина);
• некоторые иммунодепрессивные средства (циклоспорин, такролимус, сиролимус);
• некоторые метаболизируемые изоферментом CYP3A4 ингибиторы ГМГ- КоА редуктазы (аторвастатин);
• некоторые глюкокортикостероиды (будесонид, дексаметазон, флутиказон и метилпреднизолон);
•. дигоксин (из-за ингибирования Р-гликопротеина);
• другие препараты: карбамазепин, буспирон, алфентанил, алпразолам, бротизолам, мидазолам для внутривенного
введения, рифабутин, эбастин, ребоксетин, цилостазол, дизопирамид, галофантрин, репаглинид, фентанил.
Взаимодействия между итраконазолом, зидовудином и флувастатином не обнаружено. Не отмечалось влияния итраконазола на метаболизм этинилэстрадиола и норэтистерона. Влияние на связывание белков.
Исследования in vitro продемонстрировали отсутствие взаимодействия между итраконазолом и такими лекарственными средствами, как имипрамин, пропранолол, диазепам, циметидин, индометацин, толбутамид и сульфамеразин при связывании с белками плазмы.
ОСОБЫЕ УКАЗАНИЯ
• Для предотвращения реинфекции необходимо одновременное лечение половых партнеров и соблюдение личной гигиены. В период лечения рекомендуется воздерживаться от половых контактов. При сохранении признаков инфекции после завершения лечения, следует провести повторное микробиологическое исследование с целью подтверждения диагноза.
• Эффективность итраконазола для лечения грибковых инфекций при тяжелой нейтропении неизвестна, поэтому в таких случаях препарат должен использоваться только при неэффективности 1-й линии терапии.
• При возникновении факторов риска хронической сердечной недостаточности (ишемическая болезнь сердца, поражение сердечных клапанов, тяжелые заболевания легких, в т. ч. хроническая обструктивная болезнь легких, состояния, сопровождающиеся отечным синдромом) во время лечения итраконазолом терапию следует отменить.
• При приеме итраконазола у некоторых пациентов отмечалась преходящая и постоянная глухота.
• 1 капсула орунгамина содержит 4 хлебных единицы (ХЕ).
ВОЗДЕЙСТВИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ АВТОМОБИЛЕМ И РАБОТАТЬ С ТЕХНИКОЙ
Воздействия на способность управлять автомобилем и работать с техникой не оказывает.
ФОРМА ВЫПУСКА
Капсулы по 100 мг.
По 5 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 5, 10, 15, 20, 30 или 50 капсул в контейнер полимерный. Свободное пространство в контейнере заполняют ватой медицинской гигроскопической.
Один контейнер или 1, 2, 3, 4, 5, 6, 8 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона.
Условия хранения
Хранить в сухом, защищенном от света месте при температуре не выше 25°С. Хранить в защищенном от детей месте.
Срок годности
3 года. Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту.
Юридический адрес:
445351, Россия, г. Жигулевск, Самарская обл., ул. Песочная, 11.
Адрес для переписки (фактический адрес, в том числе для приема претензий):
445351, Россия, г. Жигулевск, Самарская обл., ул. Гидростроителей, 6.
ПРОИЗВОДИТЕЛЬ
ООО «Озон»
Купить Орунгамин в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Капсулы № 0, крышечка — непрозрачная синяя, корпус — прозрачный натурального цвета желатина. Содержимое капсул — сферические микрогранулы от почти белого до кремового цвета.
противогрибковое средство.
Код
ATX
[J02AC02]
ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
Фармакодинамика
Итраконазол — синтетическое противогрибковое средство широкого спектра действия, производное триазола. Ингибирует синтез эргостерола клеточной мембраны грибов, что обуславливает противогрибковый эффект препарата.
Итраконазол активен в отношении:
- дерматофитов (Trichophyton spp, Microsporum spp, Epidermophyton floccosum),
- дрожжевых грибов Candida spp. (включая Candida albicans, Candida parapsilosis),
- плесневых грибов (Cryptococcus neoformans, Aspergillus spp., Trichosporon spp., Geotrichum spp., Penicillium mameffei, Pseudallescheria boydii, Histoplasma spp., Coccidioides immitis, Paracoccidioides braziliensis, Sporothrix schenckii. Fonsecaea spp., Cladosporium spp., Blastomyces dermatidis), Malassezia spp..
Некоторые штаммы могут быть устойчивы к действию итраконазола: С. glabrata, С. krusei, С. tropicalis, Absidia spp., Fusarium spp., Mucor spp., Rhizomucor spp.. Rhizopus spp., Scedosporium proliferans, Scopulariopsis spp.. Эффективность лечения оценивается через 2-4 нед. после прекращения терапии (при системных микозах), через 6-9 мес. — при онихомикозах (по мере смены ногтей).
Фармакокинетика
При пероральном применении максимальная биодоступность итраконазола отмечается при приеме капсул сразу после еды. Максимальная концентрация в плазме достигается в течение 3-3,5 часов после приема внутрь и составляет 28,34 нг/мл. При длительном приеме равновесная концентрация достигается в течение 1-2 недель. Итраконазол на 99,8% связывается с белками плазмы. Концентрация итраконазола в крови составляет 60% от концентрации в плазме. Накопление препарата в кератиновых тканях, особенно в коже, примерно в 4 раза превышает накопление в плазме, а скорость его выведения зависит от регенерации эпидермиса.
В отличие от концентраций в плазме, которые не поддаются обнаружению уже через 7 дней после прекращения терапии, терапевтические концентрации в коже сохраняются в течение 2-4 недель после прекращения 4-х недельного курса лечения. Итраконазол обнаруживается в кератине ногтей уже через одну неделю после начала лечения и сохраняется, по крайней мере, в течение 6 месяцев после завершения 3-х месячного курса терапии. Итраконазол определяется также в кожном сале и в меньшей степени в поту.
Итраконазол хорошо распределяется в тканях, которые подвержены грибковым поражениям. Концентрации в легких, почках, печени, костях, желудке, селезенке и мышцах в 2-3 раза превышали соответствующие концентрации в плазме. Терапевтические концентрации в тканях влагалища сохраняются еще в течение 2 дней после окончания 3-х дневною курса лечения в дозе 200 мг в сутки, и 3-х дней после окончания однодневного курса лечения в дозе 200 мг дважды в сутки. Итраконазол метаболизируется в печени с образованием активных метаболитов, в т. ч. гидроксиитраконазола. Является ингибитором изоферментов CYP3A4, CYP3A5 и CYP3A7.
Выведение из плазмы — двухфазное: почками в течение 1 нед. (35% в виде метаболитов, 0.03% — в неизмененном виде) и через кишечник (3-18% в неизмененном виде). Период полувыведения — 1-1.5 дня. Не удаляется при проведении диализа.
• поражение кожи и слизистых оболочек:
- дерматомикозы;
- вульвовагинальный кандидоз;
- разноцветный лишай,
- кандидоз слизистой оболочки полости рта; кератомикоз;
- глубокие висцеральные кандидозы.
• онихомикозы, вызванные дерматофитами и/или дрожжами и плесневыми грибами:
• системные микозы:
- системный аспергиллез и кандидоз;
- криптококкоз (включая криптококковый менингит): у пациентов с иммунодефицитом и у всех пациентов с криптококкозом центральной нервной системы итраконазол должен назначаться только в случаях, если препараты первой линии лечения не применимы в данном случае или не эффективны;
- гистоплазмоз;
- споротрихоз;
- паракокцидиоидоз;
- бластомикоз;
- прочие редко встречающиеся системные микозы.
1 .Гиперчувствительность к итраконазолу или вспомогательным веществам.
2.Хроническая сердечная недостаточность, в т. ч. в анамнезе (за исключением терапии жизнеугрожающих состояний).
3.Одновременный прием следующих лекарственных средств:
- препараты, метаболизируемые изоферментом CYP3A4, которые могут удлинять QT интервал (астемизол, бепридил, цизаприд, дофетилид, левацетилметадол, мизоластин, пимозид, хинидин, сертиндол, терфенадин);
- ингибиторы ГМГ-КоА редуктазы, метаболизирующиеся изоферментом CYP3A4 (симвастатин, ловастатин);
- пероральный прием триазолама и мидазолама;
- препаратов алкалоидов спорыньи (дигидроэрготамин, эргометрин, эрготамин и метилэргометрин);
- нисолдипина, элетриптана.
4.Детский возраст до 3-х лет.
5.Непереносимость фруктозы, дефицит сахаразы/изомальтазы, глюкозо-галактозная мальабсорбция.
С
ОСТОРОЖНОСТЬЮ
— почечная/печеночная недостаточность, периферическая нейропатия, факторы риска хронической сердечной недостаточности (ишемическая болезнь сердца, поражение сердечных клапанов, тяжелые заболевания легких, в т. ч. хроническая обструктивная болезнь легких, состояния, сопровождающиеся отечным синдромом), нарушение слуха, одновременный прием блокаторов «медленных» кальциевых каналов, детский и пожилой возраст.
БЕРЕМЕННОСТЬ И ПЕРИОД ЛАКТАЦИИ
Применение препарата во время беременности возможно только в тех случаях, когда предполагаемая польза для матери превышает потенциальный риск для плода. Поскольку итраконазол может проникать в грудное молоко, при необходимости применения в период лактации, женщинам, применяющим итраконазол, следует прекратить грудное вскармливание.
Способ применения и дозировка
Принимать итраконазол внутрь, сразу после еды. Капсулы следует глотать целиком.
| Показание | Доза | Продолжительность |
| Вульвовагинальный кандидоз | 200 мг 2 раза в сутки или 200 мг 1 раз в сутки | 1 день или 3 дня |
| Разноцветный лишай | 200 мг 1 раз в сутки | 7 дней |
| Дерматомикоз гладкой кожи | 200 мг 1 раз в сутки или 100 мг 1 раз в сутки | 7 дней или 15 дней |
| Поражения высококератинизированных областей кожного покрова, таких как кисти рук и стопы | 200 мг 2 раза в сутки или 100 мг 1 раз в сутки | 7 дней или 30 дней |
| Кандидоз слизистой оболочки полости рта | 100 мг 1 раз в сутки | 15 дней |
| Грибковый кератит | 200 мг 1 раз в сутки | 21 день Возможна коррекция длительности лечения с учетом положительной динамики клинической картины |
При кандидозе слизистой оболочке полости рта биодоступность препарата, при пероральном приеме, может быть снижена у некоторых пациентов с нарушенным иммунитетом, например, у больных с нейтропенией, больных СПИДом или пациентов с трансплантированными органами. В данных случаях может потребоваться двукратное увеличение дозы.
Выведение итраконазола из кожи и ногтевой ткани осуществляется медленнее, чем из плазмы. Таким образом, опти мальный клинический и микологический эффект достигается через 2-4 недели после окончания лечения при заболе ваниях кожи и через 6-9 месяцев после окончания лечения заболеваний ногтей.
ПОБОЧНОЕ ДЕЙСТВИЕ
Со стороны органов кроветворения: лейкопения, нейтропения, тромбоцитопения.
Аллергические реакции: сывороточная болезнь, ангионевротический отек, анафилактические и анафилактоидные реакции, гиперчувствительность.
Со стороны кожных покровов: токсический эпидермальный некролиз, синдром Стивенса-Джонсона, многоформная эритема, эксфолиативный дерматит, лейкокластический васкулит, алопеция, фотосенсибилизация, крапивница, сыпь, зуд.
Со стороны обмена веществ: гипертриглицеридемия, гипокалиемия.
Со стороны нервной системы: периферическая нейропатия, парестезия, гипестезия, головокружение.
Со стороны органов зрения и слуха: нарушение зрения, включая расплывчатость и диплопию, шум в ушах, преходящая или постоянная глухота.
Со стороны сердечно-сосудистой системы: застойная сердечная недостаточность.
Со стороны дыхательной системы: отек легких.
Со стороны пищеварительной системы: боль в животе, рвота, тошнота, диарея, нарушение вкусового восприятия, повышение активности «печеночных» ферментов; диспепсия, запор, гепатит, гипербилирубинемия; гепатотоксичность, острая печеночная недостаточность.
Со стороны опорно-двигательного аппарата: миалгия, артралгия.
Со стороны мочеполовой системы: поллакиурия, недержание мочи, нарушение менструального цикла, эректильная дисфункция.
Прочие: отеки.
Данные отсутствуют. При случайной передозировке в течение первого часа после приема препарата следует провести промывание желудка, принять активированный уголь.
Симптоматическое лечение. Гемодиализ не эффективен. Специфического антидота не существует.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
Лекарственные средства, оказывающие влияние на абсорбцию итраконазола.
Лекарственные средства, снижающие кислотность желудочного сока, нарушают абсорбцию итраконазола, что связано с растворимостью оболочек капсул.
Лекарственные средства, оказывающие влияние на метаболизм итраконазола.
Итраконазол в основном метаболизируется с участием изофермента CYP3A4. При одновременном применении с рифампицином, рифабутином, фенитоином, являющимися мощными индукторами изофермента CYP3A4, биодоступность итраконазола и гидроксиитраконазола значительно снижается, что приводит к существенному уменьшению эффективности препарата. Одновременное применение итраконазола с данными препаратами, являющимися потенциальными индукторами микросомальных печеночных ферментов, не рекомендуется.
Мощные ингибиторы изофермента CYP3A4, такие как ритонавир, индинавир, кларитромицин и эритромицин, могут увеличивать биодоступность итраконазола.
Влияние итраконазола на метаболизм других лекарственных средств:
Итраконазол может ингибировать метаболизм препаратов, являющихся субстратами изоферментов CYP3A. Результатом этого может быть усиление или пролонгация их действия, в том числе и побочных эффектов. При применении сопутствующих препаратов необходимо изучить информацию, касающуюся их метаболизма. После прекращения лечения концентрации итраконазола в плазме снижаются постепенно в зависимости от дозы и длительности лечения (см. раздел «Фармакокинетика»). Это следует принимать в расчет при оценке ингибирующего эффекта итраконазола на метаболизм одновременно назначаемых препаратов.
Лекарственные средства, назначать которые одновременно с итраконазолом не рекомендуется:
• Терфенадин, астемизол, бепридил, мизоластин, цизаприд, дофетилид, хинидин, пимозид, сертиндол, левацетилметадол, ингибиторы ГМГ-КоА редуктазы, такие как симвастатин и ловастатин.
• Мидазолам для приема внутрь и триазолам.
• Препараты алкалоидов спорыньи такие, как дигидроэрготамин, эргометрин, эрготамин и метилэргометрин.
• Нисолдипин
• Блокаторы «медленных» кальциевых каналов могут оказывать отрицательный инотропный эффект, который усиливается при одновременном приеме с итраконазолом. При одновременном приеме итраконазола и блокаторов «медленных» кальциевых каналов необходимо соблюдать осторожность, так как метаболизм блокаторов «медленных» кальциевых каналов может быть снижен.
Препараты, при одновременном назначении которых рекомендуется следить за их концентрацией в плазме, действием, побочными эффектами.
При необходимости дозу этих препаратов следует уменьшить.
• непрямые антикоагулянты;
• ингибиторы ВИЧ-протеазы (ритонавир, индинавир, саквинавир);
• некоторые противоопухолевые препараты (алкалоиды барвинка розового, в том числе винкристин и винбластин; бусульфан, доцетаксел, триметрексат);
• метаболизируемые изоферментом CYP3A4 блокаторы «медленных» кальциевых каналов (верапамил и производные дигидропиридина);
• некоторые иммунодепрессивные средства (циклоспорин, такролимус, сиролимус);
• некоторые метаболизируемые изоферментом CYP3A4 ингибиторы ГМГ- КоА редуктазы (аторвастатин);
• некоторые глюкокортикостероиды (будесонид, дексаметазон, флутиказон и метилпреднизолон);
•. дигоксин (из-за ингибирования Р-гликопротеина);
• другие препараты: карбамазепин, буспирон, алфентанил, алпразолам, бротизолам, мидазолам для внутривенного
введения, рифабутин, эбастин, ребоксетин, цилостазол, дизопирамид, галофантрин, репаглинид, фентанил.
Взаимодействия между итраконазолом, зидовудином и флувастатином не обнаружено. Не отмечалось влияния итраконазола на метаболизм этинилэстрадиола и норэтистерона. Влияние на связывание белков.
Исследования in vitro продемонстрировали отсутствие взаимодействия между итраконазолом и такими лекарственными средствами, как имипрамин, пропранолол, диазепам, циметидин, индометацин, толбутамид и сульфамеразин при связывании с белками плазмы.
• Для предотвращения реинфекции необходимо одновременное лечение половых партнеров и соблюдение личной гигиены. В период лечения рекомендуется воздерживаться от половых контактов. При сохранении признаков инфекции после завершения лечения, следует провести повторное микробиологическое исследование с целью подтверждения диагноза.
• Эффективность итраконазола для лечения грибковых инфекций при тяжелой нейтропении неизвестна, поэтому в таких случаях препарат должен использоваться только при неэффективности 1-й линии терапии.
• При возникновении факторов риска хронической сердечной недостаточности (ишемическая болезнь сердца, поражение сердечных клапанов, тяжелые заболевания легких, в т. ч. хроническая обструктивная болезнь легких, состояния, сопровождающиеся отечным синдромом) во время лечения итраконазолом терапию следует отменить.
• При приеме итраконазола у некоторых пациентов отмечалась преходящая и постоянная глухота.
• 1 капсула орунгамина содержит 4 хлебных единицы (ХЕ).
ВОЗДЕЙСТВИЕ
НА
СПОСОБНОСТЬ
УПРАВЛЯТЬ
АВТОМОБИЛЕМ
И
РАБОТАТЬ
С
ТЕХНИКОЙ
Воздействия на способность управлять автомобилем и работать с техникой не оказывает.
Капсулы по 100 мг.
По 5 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 5, 10, 15, 20, 30 или 50 капсул в контейнер полимерный. Свободное пространство в контейнере заполняют ватой медицинской гигроскопической.
Один контейнер или 1, 2, 3, 4, 5, 6, 8 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона.
Хранить в сухом, защищенном от света месте при температуре не выше 25°С. Хранить в защищенном от детей месте.
3 года. Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту.
Юридический адрес
445351, Россия, г. Жигулевск, Самарская обл., ул. Песочная, 11.
Адрес для переписки (фактический адрес, в том числе для приема претензий
):
445351, Россия, г. Жигулевск, Самарская обл., ул. Гидростроителей, 6.
ПРОИЗВОДИТЕЛЬ
ООО «Озон»
С осторожностью — почечная/печеночная недостаточность, периферическая нейропатия, факторы риска хронической сердечной недостаточности (ишемическая болезнь сердца, поражение сердечных клапанов, тяжелые заболевания легких, в т.ч. хроническая обструктивная болезнь легких, состояния, сопровождающиеся отечным синдромом), нарушение слуха, одновременный прием блокаторов -медленных- кальциевых каналов, детский и пожилой возраст.
Применение при беременности и в период грудного вскармливания
Беременность Препарат Орунгамин — не должен применяться при беременности, за исключением случаев, угрожающих жизни, и, если ожидаемый положительный эффект для матери превосходит возможный вред для плода. В доклинических исследованиях было показано, что итраконазол проникает через плаценту у крыс. Данных о применении итраконазола при беременности недостаточно. В ходе клинического применения итраконазола были отмечены случаи врожденных аномалий. Такие случаи включали нарушения развития зрения, скелета, мочеполовой и сердечно-сосудистой систем, а также хромосомные нарушения и множественные пороки развития. Однако является ли применение итраконазола причиной возникновения данных нарушений, достоверно не установлено. Эпидемиологические данные в отношении воздействия итраконазола в первом триместре беременности, в основном у пациенток, получавших краткосрочную терапию по поводу вульвовагинальных кандидозов, не выявили повышенного риска развития врожденных аномалий по сравнению с контрольной группой, не подвергавшейся воздействию ни одного из известных тератогенных факторов. Женщинам детородного возраста, принимающим препарат Орунгамин -, необходимо использовать адекватные методы контрацепции на протяжении всего курса лечения вплоть до наступления первой менструации после его завершения.
Грудное вскармливание
Поскольку итраконазол может проникать в грудное молоко, при необходимости применения в период грудного вскармливания, женщинам, принимающим препарат Орунгамин -, следует прекратить грудное вскармливание.
Влияние на деятельность сердца: в исследованиях лекарственной формы итраконазола раствор для в/в введения отмечалось преходящее бессимптомное уменьшение фракции выброса левого желудочка, нормализовавшееся до следующей инфузии. Клиническая значимость полученных данных для лекарственных форм для приема внутрь неизвестна. Итраконазол обладает отрицательным инотропным действием. Сообщалось в случаях хронической сердечной недостаточности, связанных с приемом итраконазола. При суточной дозе 400 мг итраконазола наблюдалось более частое возникновение сердечной недостаточности; при меньших суточных дозах такой закономерности не было выявлено. Риск возникновения хронической сердечной недостаточности предположительно пропорционален суточной дозе. Препарат Орунгамин не следует принимать пациентам с хронической сердечной недостаточностью или с наличием этого симптомокомплекса в анамнезе, за исключением случаев, когда возможная польза значительно превосходит потенциальный риск. При индивидуальной оценке соотношения пользы и риска следует принимать во внимание такие факторы, как серьезность показаний, режим дозирования и индивидуальные факторы риска возникновения сердечной недостаточности (ишемическая болезнь сердца, поражения клапанов, обструктивная болезнь легких, почечная недостаточность и другие заболевания, сопровождающиеся отеками). Таких пациентов необходимо проинформировать о признаках и симптомах хронической сердечной недостаточности и следить за их появлением во время курса терапии. При появлении подобных признаков прием препарата Орунгамин — необходимо прекратить. Угрожающие жизни аритмии сердца и/или внезапная смерть отмечались у пациентов при одновременном применении метадона.
— Лекарственные взаимодействия: одновременный прием некоторых лекарственных средств с итраконазолом может привести к изменению в эффективности итраконазола и/или одновременно применяемых лекарственных препаратов, возникновению опасных для жизни побочных реакций и/или внезапной смерти.
Препараты, которые нельзя принимать одновременно с итраконазолом, не рекомендованные для одновременного применения и/или рекомендованные для одновременного применения с итраконазолом с осторожностью, перечислены в разделе
-Взаимодействие с другими лекарственными средствами.
Перекрестная гиперчувствительность: данные в отношении наличия перекрестной гиперчувствительности между итраконазолом и другими противогрибковыми средствами азольной структуры (из группы азолов) ограничены. При наличии гиперчувствительности к другим азолам следует с осторожностью назначать итраконазол.
Взаимозаменяемость: не рекомендуется взаимозаменяемое использование итраконазола, капсулы и итраконазола, раствора для приема внутрь ввиду того, что экспозиция итраконазола выше при применении его в лекарственной форме: раствор для приема внутрь, чем в форме капсул, даже при приеме одинаковых доз итраконазола. Сниженная кислотность желудочного сока: при сниженной кислотности желудочного сока абсорбция итраконазола из капсул нарушается. Пациентам со сниженной кислотностью желудочного сока вследствие заболевания (например, у пациентов с ахлоргидрией) или вследствие приема лекарственных препаратов (например, лекарственные средства, подавляющие желудочковую секрецию) рекомендуется принимать препарат Орунгамин в капсулах одновременно с кислыми напитками (такими как недиетическая кола). Следует контролировать противогрибковую активность препарата и увеличивать дозу итраконазола при необходимости.
Влияние на функцию печени: в очень редких случаях при применении итраконазола развивалось тяжелое токсическое поражение печени, включая несколько случаев острой печеночной недостаточности с летальным исходом. В большинстве случаев это происходило с пациентами, у которых уже имелись заболевания печени, у пациентов с другими тяжелыми заболеваниями, которым препарат был назначен для лечения системных заболеваний, а также у пациентов, получавших другие лекарственные средства, обладающие гепатотоксическим действием. Однако у некоторых пациентов не было сопутствующих заболеваний или очевидных факторов риска в отношении поражения печени. Несколько таких случаев возникли в первый месяц терапии, а некоторые — в первую неделю терапии. В связи с этим рекомендуется регулярно контролировать функцию печени у пациентов, получающих терапию итраконазолом. В случае возникновения симптомов, предполагающих возникновение гепатита, а именно: анорексии, тошноты, рвоты, слабости, боли в животе и потемнения мочи, необходимо немедленно прекратить лечение и провести исследование функции печени. Пациентам с повышением активности (-печеночных- ферментов или заболеванием печени в активной фазе, или при перенесенном токсическом поражении печени вследствие приема других препаратов не следует назначать лечение препаратом Орунгамин 39; за исключением тех случаев, когда ожидаемая польза оправдывает риск поражения печени. В таких случаях необходимо во время лечения контролировать активность -печеночных- ферментов. Итраконазол преимущественно метаболизируется в печени. Поскольку у пациентов с нарушениями функции печени полный период полувыведения итраконазола несколько увеличен, рекомендуется осуществлять контроль концентраций итраконазола в плазме крови и при необходимости корректировать дозу препарата. Нарушения функции почек: данные по применению препарата с нарушениями функции почек ограничены, у некоторых пациентов с недостаточность функции почек экспозиция итраконазола может быть снижена. Поэтому таким пациентам следует назначать препарат с осторожностью. Рекомендуется осуществлять контроль концентраций итраконазола в плазме крови и при необходимости корректировать дозу препарата.
Пациенты с иммунодефицитом: биодоступность итраконазола при приеме внутрь может быть снижена у некоторых пациентов с нарушенным иммунитетом, например, у пациентов с нейтропенией, больных СПИДом или перенесших операцию по трансплантации органов. Пациенты с системными грибковыми инфекциями, представляющим угрозу жизни: вследствие фармакокинетических характеристик препарата Орунгамин в виде капсул, его применение не рекомендуется для начала лечения системных микозов, представляющих угрозу для жизни пациентов. Пациенты со СПИДом: врач должен оценить необходимость проведения поддерживающей терапии пациентам СПИДом, ранее получавшим лечение по поводу системных грибковых инфекций, например, споротрихоза, бластомикоза, гистоплазмоза или криптококкоза (как менингеального, так и неменингеального), у которых существует риск рецидива.
Применение в педиатрической практике: поскольку клинических данных о применении итраконазола у детей недостаточно, рекомендуется назначать препарат детям только в случае, если возможная польза от лечения превосходит потенциальный риск, Женщинам детородного возраста, принимающим препарат Орунгамин -, необходимо использовать адекватные методы контрацепции на протяжении всего курса терапии вплоть до наступления первой менструации после его завершения. Лечение следует прекратить при возникновении периферической нейропатии, которая может быть связана с приемом препарата Орунгамин -, капсулы.
При системных кандидозах, предположительно вызванных флуконазол-резистентными штаммами Candida, нельзя предположить чувствительность к итраконазолу, следовательно, рекомендуется проверить чувствительность перед началом терапии итраконазолом. Потеря слуха: сообщалось о временной или стойкой потере слуха у пациентов, принимающих итраконазол. В некоторых случаях потеря слуха происходила на фоне одновременного приема с хинидином (см. разделы -Противопоказания-, -Взаимодействие с другими лекарственными средствами-). Слух обычно восстанавливается после окончания терапии препаратом, однако у некоторых пациентов потеря слуха необратима.
Способность к зачатию: исследования на животных не показали наличия репродуктивной токсичности у итраконазола. Муковисцидоз (кистозный фиброз): у пациентов с муковисцидозом (кистозным фиброзом) наблюдалась вариабельность концентрации итраконазола в плазме крови при применении итраконазола в форме раствора для приема внутрь в дозе 2,5 мг/кг 2 раза в сутки. Как следствие, терапевтическая равновесная концентрация итраконазола в плазме крови может не достигаться. Равновесные концентрации более 250 нг/мл достигались приблизительно у 50% пациентов старше 16 лет и не достигались ни у одного пациента моложе 16 лет. При отсутствии ответа на терапию препаратом Орунгамин -, капсулы следует рассмотреть возможность перехода на альтернативную терапию. Влияние на способность к вождению автотранспорта и управлению механизмами Исследования по изучению влияния лекарственного средства Орунгамин — на способность управлять транспортными средствами и работать с техникой не проводились. Необходимо принимать во внимание возможность возникновения побочных реакций, таких как головокружение, нарушение зрения или потеря слуха (см. раздел -Побочное действие-). При появлении описанных нежелательных реакций следует воздержаться от выполнения указанных видов деятельности.

