Нейровоспаление характеризуется инфильтрацией иммунных клеток, активацией тучных и глиальных клеток и продукцией воспалительных медиаторов в периферической центральной нервной системе. Растёт число доказательств важной роли нейровоспаления в развитии и поддержании хронической боли. Это поддерживает идею применения новых терапевтических подходов в лечении хронической боли, основанных на противовоспалительных медиаторах и медиаторах разрешения воспаления, которые действуют на иммунные клетки, в частности, на тучные клетки и глию, тем самым ослабляя или прекращая воспаление. К этим медиаторам относится пальмитоилэтаноламид (ПЭА), который снижает активацию тучных клеток и контролирует поведение глии.
Для оценки эфффективности и безопасности пальмитоилэтаноламида на интенсивность боли у пациентов, страдающих от хронической и нейропатической боли, был проведен мета-анализ клинических исследований ПЭА.
В мета-анализ были включены двойные слепые, контролируемые и открытые клинические испытания. Суммарно было включено 12 исследований, 3 из которых были двойными слепыми, сравнивающими действующее вещество с плацебо, 2 были открытыми испытаниями нового препарата против стандартной терапии и 7 были открытыми исследованиями без контроля.
Мета-анализ показал, что ПЭА вызывает прогрессивное снижение боли сильнее, чем контрольные препараты. Ни в одном исследовании не было зарегистрировано побочных эффектов и нежелательных реакций, связанных с приемом ПЭА. Результаты позволяют говорить, что ПЭА представляет собой новую терапевтическую стратегию для лечения хронической и нейропатической боли, связанной с нейровоспалением.
Пальмитоилэтаноламид является эндогенным амидом жирной кислоты (FAE), принадлежащим к классу лигандов ядерных факторов. ПЭА связывается с рецептором в клеточном ядре и вызывает широкий спектр изменений биологических функций, относящихся к хронической боли и воспалению. Его главной мишенью является α-рецептор, активируемый пероксисомным пролифератором (PPAR-α). ПЭА также имеет аффинность к каннабиноидоподобным рецепторам GPR55 и GPR119, связанным с G белками. Однако ПЭА не может считаться классическим эндоканнабиноидом, так как у него отсутствует аффинность к каннабиноидным рецепторам CB1 и CB2. Тем не менее, в присутствии ПЭА (и других структурно близких N-ацилэтаноламидов) происходит усиление активности анандамида, названное “эффектом синергии” (“entourage effect”).
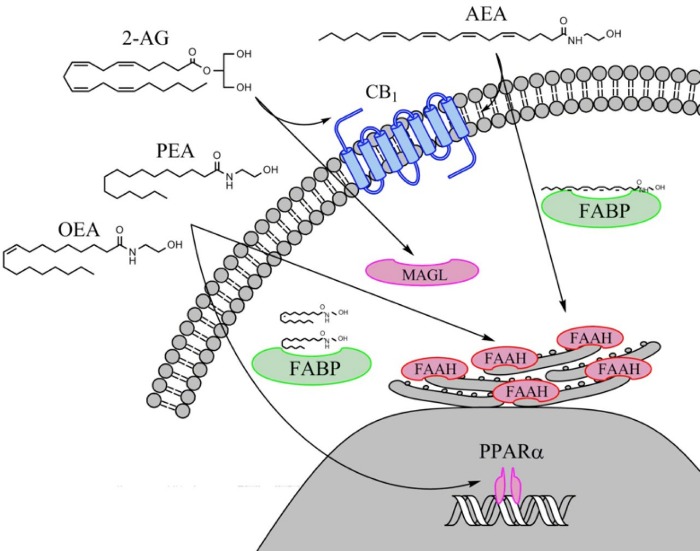
Пальмитоилэтаноламид (PEA) и олеоилэтаноламид (OEA) активируют ядерные рецепторы PPARα, в ядро они переносятся белками, аналогичными тем, что транспортируют жирные кислоты (fatty acid binding proteins — FABPs).
Ряд исследований показал, что при боли и хроническом воспалении происходят дисбаланс в эндоканнабиноидной системе и изменения уровня ПЭА. Например, при β-амилоид-индуцированном нейровоспалении развитие заболевания сопровождает дисрегуляция каннабиноидных рецепторов и их эндогенных лигандов. Также была продемонстрирована противовоспалительная, антиноцицептивная, нейропротективная и противосудорожная активность ПЭА.
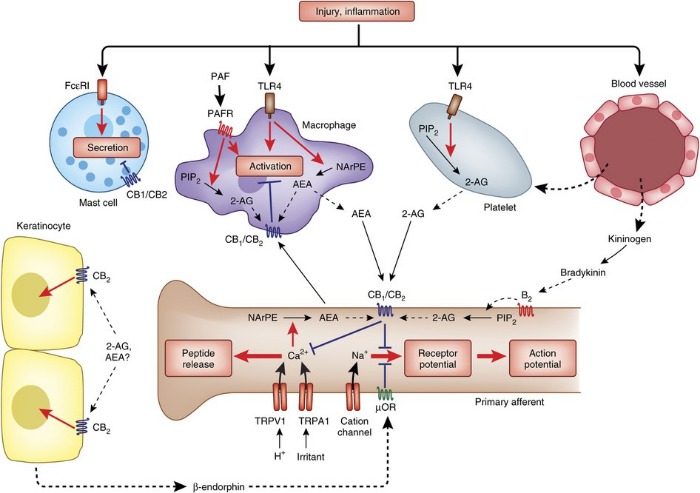
Эндоканнабиноиды контролируют периферические ноцицептивные сигналы
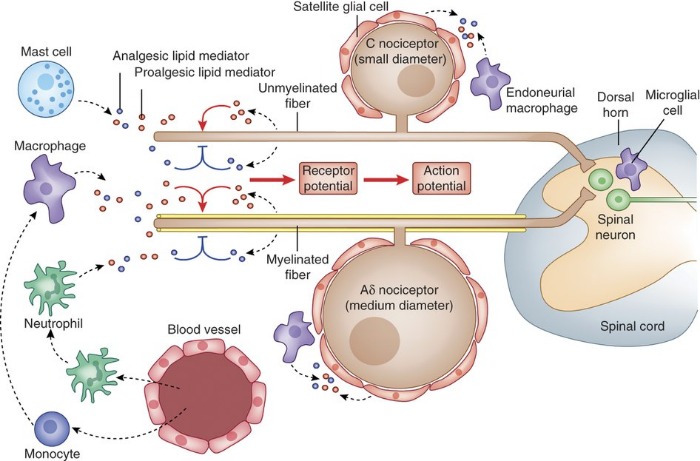
Периферическая регуляция ноцицептивных сигналов липидными медиаторами
ПЭА, как N-ацилэтаноламид, имеет физико-химические свойства, сравнимые с анадамидом, и, хотя он не является эндоканнабиноидом, ПЭА часто изучается в сочетании с анандамидом из-за перекрытия их синтетических и метаболических путей. N-ацилэтаноламиды, такие как ПЭА, часто действуют в качестве сигнальных молекул, активируя внутриклеточные и мембранно-связанные рецепторы и регулируя многие физиологические функции, связанные с воспалительным каскадом и состоянием хронической боли. Эндоканнабиноидные липиды широко распространены в природе: они встречаются во множестве растений, в тканях беспозвоночных и млекопитающих.
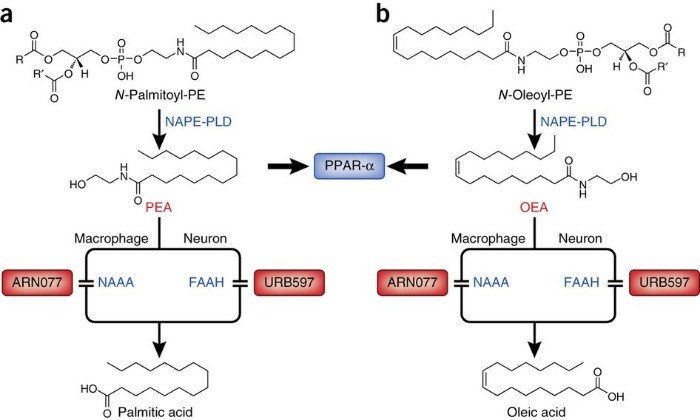
Синтез и инактивация ПЭА и OЭA
Механизм действия ПЭА иногда описывается как аутокоидный антагонизм локального повреждения (Autacoid Local Injury Antagonism — ALIA), и ПЭА в рамках этой номенклатуры относится в алиамидам. Акроним ALIA был впервые предложен группой лауреата нобелевской премии Rita Levi-Montalcini, которая в 1993 году первые предоставила доказательства, что N-ацилэтаноламиды, такие как ПЭА, могут регулировать активацию тучных клеток. Аутокоиды являются местно синтезируемыми регуляторными молекулами. Алиамиды представляют собой аутокоиды, синтезируемые по востребованию в ответ на повреждение, и их действие направлено на устранение патологии. Вскоре после публикации Levi-Montalcini было показано, что тучные клетки являются важной мишенью противовоспалительной активности ПЭА, и с 1993 года как минимум в 25 публикациях были описаны различные эффекты ПЭА на тучные клетки.
Также получены доказательства, что тучные клетки находятся в непосредственной близости от нервных окончаний и их дегрануляция может усилить ноцицептивный сигнал — причина, почему периферические тучные клетки считаются провоспалительными и проноцицептивными. Активность ПЭА в настоящее время рассматривается в качестве нового подхода для лечения нейропатической боли и при похожих заболеваниях (таких как диабет и глаукома), основанных на гиперактивации глии и родственных клеток. Микроглия играет ключевую роль в феномене увеличения интенсивности хронической боли (“wind-up” phenomenon) и центральной сенсибилизации.
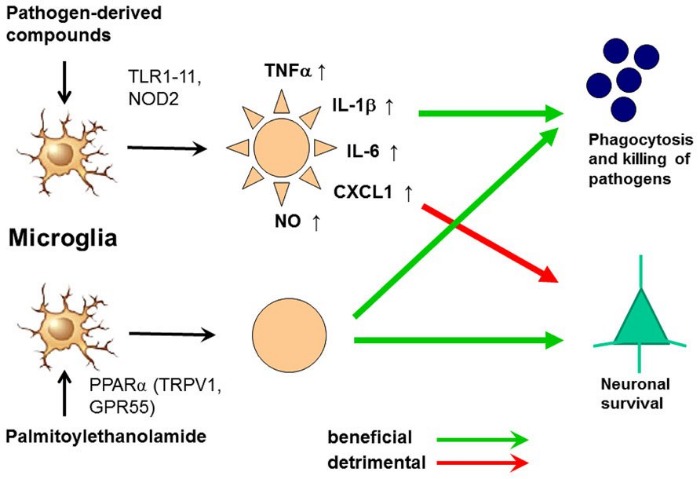
Активация микроглии агонистами TLR и ПЭА.
Метаболизируется ПЭА клеточными ферментами — гидролазой жирных кислот и N-ацилэтаноламид-гидролизующей ацидамидазой; последняя обладает большей специфичностью относительно ПЭА и других амидов жирных кислот.
Источники и дополнительная информация:
- https://www.ncbi.nlm.nih.gov/pubmed/26815246 — публикация
- https://en.wikipedia.org/wiki/Palmitoylethanolamide — PEA
- http://www.frca.co.uk/article.aspx?articleid=100514 — феномен wind-up
- https://www.liveinternet.ru/users/39446/post337121752/ — каннабиноиды и entourage effect
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
- Protocol
- Open Access
- Published:
- Aniello Alfieri1,
- Maria Caterina Pace1,
- Vincenzo Pota1,
- Pasquale Sansone1,
- Giacomo Piccinno1,
- Manlio Barbarisi2,
- Caterina Aurilio1 &
- …
- Marco Fiore
ORCID: orcid.org/0000-0001-7263-02291
Systematic Reviews
volume 8, Article number: 9 (2019)
Cite this article
-
32k Accesses
-
7 Citations
-
46 Altmetric
-
Metrics details
Abstract
Background
Palmitoylethanolamide (PEA) belong to endocannabinoid family, a group of fatty acid amides. PEA has been proven to have analgesic and anti-inflammatory activity and has been used in several controlled studies focused on the management of chronic pain among adult patients with different underlying clinical conditions.
Methods/design
A literature search will be performed using PubMed, EMBASE, and the Cochrane Central Register of Controlled Trials (CENTRAL). The population will be patients who have chronic pain, the intervention will be the administration of PEA alone or in combination with other drugs for the pain management; the comparison will be the standard therapy in accordance with the current guidelines for the treatment of pain. The Outcomes will be the reduction of pain not restricted to specific scales laying out the pain outcome data described in the included studies.
Discussion
This scoping review aims to describe the clinical applications of the PEA in chronic pain management and its outcome.
Scoping review registration
Open Science Framework https://osf.io/74tmx/.
Peer Review reports
Background
Palmitoylethanolamide (PEA) is an endogenous fatty acid amide, an analog of the endocannabinoid anandamide (AEA), that belongs to the family of N-acylethanolamines (NAE) [1]. NAEs are released from cells in response to noxious stimuli. As all NAEs, also the PEA has a local effect, and its tissue levels are closely regulated through the balance of production and degradation activity. Two intracellular amidases, expressed in the inflammatory cells, have been involved in lipid amide degradation: fatty-acid amide hydrolase (FAAH) and N-acylethanolamine hydrolyzing acid amidase (NAAA) [2].
The effects of the PEA are due to its interaction with several pathways: at first, it reduces, via the peroxisome proliferator-activated receptor alpha (PPARα), the recruitment and activation of mast cells at sites of nerve injury and the release of pro-inflammatory mediators from these cells [3, 4]; secondly, it inhibits the microglia activation and the recruitment of mast cells into spinal cord after peripheral nerve injury, as well as following spinal neuroinflammation or spinal cord injury [5, 6]. In the beginning, PEA was also supposed to be an agonist of the cannabinoid type II receptor (CB2) [7]; subsequently, in their research, Sugiura et al. have demonstrated that PEA has just a very low affinity for this receptor [8], clarifying why CB2 antagonists do not inhibit some of its anti-inflammatory effects [9]. Anyhow, PEA indirectly activates CB2 and the cannabinoid receptor type 1 (CB1) [10], down-modulating fatty acid amide hydrolase (FAAH), the enzyme responsible of the degradation of the anandamide (AEA), a CB1 agonist [11].
Several studies focused on the use of PEA in a multitude of chronic pain conditions. For example, it can have a beneficial effect like adjuvant for the treatment of the low back pain [12] or it was used alone for chronic pain management in critically ill older patients, where the use of traditional analgesics can lead to high risk of adverse effect [13]. Encouraging results have been shown in the treatment of non-surgical radiculopathies with an ultra-micronized formulation of PEA [14] and the combination therapy with alpha-lipoic acid to reduce chronic prostatitis/chronic pelvic pain syndrome [15].
Importance of this review
Although pharmacological pain therapy offers several alternatives, pain management remains often unsatisfactory. In order to reinforce the therapeutic solutions, the use of the PEA for the treatment of chronic or inflammatory pain may be a valid strategy. To our knowledge, this is the first scoping review that summarizes the literature findings on the use of PEA in chronic pain management.
Methods/design
Research questions
This review is designed to answer the following research question:
What are the current clinical applications of PEA in the management of chronic pain?
We will prepare this scoping review according to the Preferred Reporting Items for Systematic Reviews and Meta-Analysis Extension for Scoping Reviews (PRISMA-ScR) [16].
Searching
A literature search will be performed using several computer-assisted databases, including PubMed, EMBASE, and the Cochrane Central Register of Controlled Trials (CENTRAL). To the results, we will add the publications cited in articles obtained by primary research, previous reviews, or books to identify additional eligible studies.
The search strategy and the search string will be formulated following the PICO method.
The Population will be patients who have chronic pain, and the Intervention will be the administration of PEA alone or in combination with other drugs for the treatment of pain. The Comparator will be the standard therapy in accordance with the current guidelines for the treatment of pain. The Outcomes will be pain reduction measured with any type of pain assessment scale.
Computer searches will be performed using the following search string: “palmitoylethanolamide” AND “pain.”
The reference list of the retrieved articles will be used to find relevant studies that will be not allocated through the searching procedure. We will not restrict the search with any filter. Duplicates will be removed after the literature search, and two reviewers (AA and GP) will independently conduct a two-stage screening reading the titles and abstracts identified in the search strategy detailed above. Each title will be screened using a screening guide. Titles will be retained if they appear to meet the inclusion criteria or if it is uncertain if they do (Table 1).
Full size table
Eligibility criteria
To be included in the review, studies will need to have a control group, in which patients with chronic pain are explicitly treated with PEA, with no restrictions on publication year. We will exclude unpublished works as a full-text, abstract, conference meetings, studies published in not peer-review journals, uncontrolled studies as case series or case reports, reviews, and studies published not in English.
Papers will be excluded if they do not fit into the conceptual framework of the study, focused on chronic pain management.
Primary abstract screening
Initially, the articles will be selected by the authors assessing titles and abstracts to identify potentially eligible studies; then, the full-text of the eligible studies will be reviewed by the authors to exclude irrelevant studies or methodologies not being a useful motivation for future analysis.
Methods for data extraction
The reviewers will record key information from included articles in a Microsoft Excel data extraction form designed a priori. Two reviewers (AA and GP) will independently extract data to minimize errors. Each study will be extracted with the following information: title, year of publication, first author, the country where the study was conducted, type of study, lying chronic disease for which the PEA was used, and outcome.
Strategy for data synthesis
The number of studies identified and selected at each stage of the scoping review and the reasons for exclusion will be presented in a PRISMA flow diagram. Results will be summarized in table form (Table 2) and discussed deeper in narrative form to address the research questions. Results will be grouped conceptually, by general study details, study characteristics, participants, interventions/exposures/comparators, instruments used in goal-setting, outcomes, and results. This review will present summaries of these categories, including quantitative measurements of associations (mean differences for scores by validated questionnaires, risk ratios, or odds ratios for dichotomous outcomes), if applicable. Additional groups may be identified during the extraction of results.
Full size table
Authors of papers will be contacted to request missing or additional data for clarification, where required. We will report the results of critical appraisal in narrative form and in a table.
The final protocol was registered prospectively with the Open Science Framework on 12 December 2018 (https://osf.io/74tmx/).
Discussion
This protocol is for a scoping review that is planned and not started. This scoping review aims to describe the clinical applications of the PEA in pain management of different chronic diseases and its outcome.
Abbreviations
- AEA:
-
Anandamide
- CB1:
-
Cannabinoid type I receptor
- CB2:
-
Cannabinoid type II receptor
- CENTRAL:
-
Cochrane Central Register of Controlled Trials
- FAAH:
-
Fatty-acid amide hydrolase
- NAAA:
-
N-acylethanolamine hydrolyzing acid amidase
- NAE:
-
N-acylethanolamines
- PEA:
-
Palmitoylethanolamide
- PPARα:
-
Peroxisome proliferator-activated receptor alpha
- PRISMA-P:
-
Preferred Reporting Items for Systematic Reviews and Meta-Analysis Protocols
- VAS Pain:
-
Visual Analog Scale for Pain
References
-
Hansen HS. Palmitoylethanolamide and other anandamide congeners. Proposed role in the diseased brain. Exp Neurol. 2010;224(1):48–55 https://doi.org/10.1016/j.expneurol.2010.03.022.
Article
CASGoogle Scholar
-
Petrosino S, Iuvone T, Di Marzo V. N-palmitoyl-ethanolamine: biochemistry and new therapeutic opportunities. Biochimie. 2010;92(6):724–7 https://doi.org/10.1016/j.biochi.2010.01.006.
Article
CASGoogle Scholar
-
Cerrato S, Brazis P, della Valle MF, Miolo A, Puigdemont A. Effects of palmitoylethanolamide on immunologically induced histamine, PGD2 and TNFα release from canine skin mast cells. Vet Immunol Immunopathol. 2010;133(1):9–15 https://doi.org/10.1016/j.vetimm.2009.06.011.
Article
CASGoogle Scholar
-
Costa B, Colombo A, Bettoni I, Bresciani E, Torsello A, Comelli F. The endogenous ligand palmitoylethanolamide relieves neuropathic pain via mast cell and microglia modulation. 21st Annual Symposium Of The International Cannabinoid Research Society. St. Charles, Il. Usa: Pheasant Run; 2011. http://icrs.co/SYMPOSIUM.2011/ICRS2011.Final.Programme.pdf.
Google Scholar
-
Genovese T, Esposito E, Mazzon E, Di Paola R, Meli R, Bramanti P, Piomelli D, Calignano A, Cuzzocrea S. Effects of palmitoylethanolamide on signaling pathways implicated in the development of spinal cord injury. J Pharmacol Exp Ther. 2008;326(1):12–23. https://doi.org/10.1124/jpet.108.136903.
Article
CASGoogle Scholar
-
Esposito E, Paterniti I, Mazzon E, Genovese T, Di Paola R, Galuppo M, Cuzzocrea S. Effects of palmitoylethanolamide on release of mast cell peptidases and neurotrophic factors after spinal cord injury. Brain Behav Immun. 2011;25(6):1099–112 https://doi.org/10.1016/j.bbi.2011.02.006.
Article
CASGoogle Scholar
-
Facci L, Dal Toso R, Romanello S, Buriani A, Skaper SD, Leon A. Mast cells express a peripheral cannabinoid receptor with differential sensitivity to anandamide and palmitoylethanolamide. Proc Natl Acad Sci U S A. 1995;92(8):3376–80 7724569.
Article
CASGoogle Scholar
-
Sugiura T, Kondo S, Kishimoto S, Miyashita T, Nakane S, Kodaka T, Suhara Y, Takayama H, Waku K. Evidence that 2-arachidonoylglycerol but not N-palmitoylethanolamine or anandamide is the physiological ligand for the cannabinoid CB2 receptor. Comparison of the agonistic activities of various cannabinoid receptor ligands in HL-60 cells. J Biol Chem. 2000;275(1):605–12 https://doi.org/10.1074/jbc.275.1.605January 7, 2000.
Article
CASGoogle Scholar
-
Costa B, Conti S, Giagnoni G, Colleoni M. Therapeutic effect of the endogenous fatty acid amide, palmitoylethanolamide, in rat acute inflammation: inhibition of nitric oxide and cyclo-oxygenase systems. Br J Pharmacol. 2002;137(4):413–20. https://doi.org/10.1038/sj.bjp.0704900.
Article
CASGoogle Scholar
-
Petrosino S, Di Marzo V. The pharmacology of palmitoylethanolamide and first data on the therapeutic efficacy of some of its new formulations. Br J Pharmacol. 2017;174(11):1349–65. https://doi.org/10.1111/bph.13580.
Article
CASGoogle Scholar
-
Di Marzo V, Melck D, Orlando P, Bisogno T, Zagoory O, Bifulco M, Vogel Z, De Petrocellis L. Palmitoylethanolamide inhibits the expression of fatty acid amide hydrolase and enhances the anti-proliferative effect of anandamide in human breast cancer cells. Biochem J. 2001;358(Pt 1):249–55 11485574.
Article
Google Scholar
-
Passavanti MB, Fiore M, Sansone P, Aurilio C, Pota V, Barbarisi M, Fierro D, Pace MC. The beneficial use of ultramicronized palmitoylethanolamide as add-on therapy to Tapentadol in the treatment of low back pain: a pilot study comparing prospective and retrospective observational arms. BMC Anesthesiol. 2017;17(1):171. https://doi.org/10.1186/s12871-017-0461-9.
Article
Google Scholar
-
Germini F, Coerezza A, Andreinetti L, Nobili A, Rossi PD, Mari D, Guyatt G, Marcucci M. N-of-1 randomized trials of ultra-micronized palmitoylethanolamide in older patients with chronic pain. Drugs Aging. 2017;34(12):941–52 https://doi.org/10.1007/s40266-017-0506-2.
Article
CASGoogle Scholar
-
Chirchiglia D, Chirchiglia P, Signorelli F. Nonsurgical lumbar radiculopathies treated with ultramicronized palmitoylethanolamide (umPEA): a series of 100 cases. Neurol Neurochir Pol. 2018;52(1):44–7. https://doi.org/10.1016/j.pjnns.2017.11.002.
PubMed
Google Scholar
-
Giammusso B, Di Mauro R, Bernardini R. The efficacy of an association of palmitoylethanolamide and alpha-lipoic acid in patients with chronic prostatitis/chronic pelvic pain syndrome: a randomized clinical trial. Arch Ital Urol Androl. 2017;89(1):17–21.
Article
CASGoogle Scholar
-
Tricco AC, Lillie E, Zarin W, O’Brien KK, Colquhoun H, Levac D, Moher D, Peters MDJ, Horsley T, Weeks L, Hempel S, Akl EA, Chang C, McGowan J, Stewart L, Hartling L, Aldcroft A, Wilson MG, Garritty C, Lewin S, Godfrey CM, Macdonald MT, Langlois EV, Soares-Weiser K, Moriarty J, Clifford T, Tunçalp Ö, Straus SE. PRISMA extension for scoping reviews (PRISMA-ScR): checklist and explanation. Ann Intern Med. 2018;169(7):467–73 https://doi.org/10.7326/M18-0850.
Article
Google Scholar
Download references
Funding
There is no funding related to this manuscript to declare.
Availability of data and materials
The datasets generated and/or analyzed during the current study are available from the corresponding author on reasonable request.
Author information
Authors and Affiliations
-
Department of Women, Child and General and Specialized Surgery, University of Campania “Luigi Vanvitelli”, Piazza L. Miraglia, 2, 80138, Naples, Italy
Maria Beatrice Passavanti, Aniello Alfieri, Maria Caterina Pace, Vincenzo Pota, Pasquale Sansone, Giacomo Piccinno, Caterina Aurilio & Marco Fiore
-
Department of Medical, Surgical, Neurological, Metabolic and Aging Sciences, University of Campania “Luigi Vanvitelli”, Piazza L. Miraglia, 2, 80138, Naples, Italy
Manlio Barbarisi
Authors
- Maria Beatrice Passavanti
You can also search for this author in
PubMed Google Scholar - Aniello Alfieri
You can also search for this author in
PubMed Google Scholar - Maria Caterina Pace
You can also search for this author in
PubMed Google Scholar - Vincenzo Pota
You can also search for this author in
PubMed Google Scholar - Pasquale Sansone
You can also search for this author in
PubMed Google Scholar - Giacomo Piccinno
You can also search for this author in
PubMed Google Scholar - Manlio Barbarisi
You can also search for this author in
PubMed Google Scholar - Caterina Aurilio
You can also search for this author in
PubMed Google Scholar - Marco Fiore
You can also search for this author in
PubMed Google Scholar
Contributions
This study was mainly written by MF, AA, and MBP. AA and GP collected the data. CA and MCP supervised the writing of the paper. PS, VP, and MB critically revised the paper. All authors gave final approval of the version to be published and agreed to be accountable for all aspects of the work.
Corresponding author
Correspondence to
Marco Fiore.
Ethics declarations
Ethics approval and consent to participate
Not applicable
Consent for publication
Not applicable
Competing interests
The authors declare that they have no competing interests related to this manuscript.
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Passavanti, M.B., Alfieri, A., Pace, M.C. et al. Clinical applications of palmitoylethanolamide in pain management: protocol for a scoping review.
Syst Rev 8, 9 (2019). https://doi.org/10.1186/s13643-018-0934-z
Download citation
-
Received:
-
Accepted:
-
Published:
-
DOI: https://doi.org/10.1186/s13643-018-0934-z
Keywords
- Palmitoylethanolamide
- Systematic review
- PEA
- Pain
- Pain management
- Endocannabinoids
- Ethanolamines
- Humans
- Palmitic acids
- Palmidrol
Не занимайтесь самолечением! Обратитесь к врачу за консультацией.
Пальмитоилэтаноламид эффективно справляется с острым и хроническим болевым синдромом, устраняет клеточный стресс и повышает уровень успокаивающих веществ. Польза этого препарата для здоровья неоспорима, но сможет ли он стать заменой анальгетикам, читайте ниже.

Содержание статьи
- Что такое пальмитоилэтаноламид?
- Польза PEA для здоровья человека
- Облегчение боли и мигрени
- Поддержка суставов
- При депрессии и стрессе
- Здоровье глаз
- Защита клеток мозга
- Препараты ПЭА в аптеке и правила их приема
- Лучший пальмитоилэтаноламид на iHerb
- ПЭА в капсулах от Lake Avenue Nutrition
- Комплекс PEA ComfortMAX от Life Extension
- Пальмитоилэтаноламид Life Extension в таблетках
- Противопоказания к применению
Что такое пальмитоилэтаноламид?
Пальмитоилэтаноламид (ПЭА) — это активный липидный биорегулятор, который представляет собой амид жирной кислоты. Это вещество вырабатывается естественным путем в организме человека, как защитная реакция на боль, воспаление и другие раздражители.


PEA относится к группе липидов, которые регулируют работу клеток. Наибольшее количество вещества содержится в арахисе, люцерне, фасоли, яичном желтке, молоке и мясных субпродуктах.
Польза PEA для здоровья человека
Пальмитоилэтаноламид способен купировать как хронические, так и острые воспалительные процессы во всех органах и тканях организма. Источники: nih.gov и ncbi.nlm.nih.gov
Облегчение боли и мигрени
PEA эффективно притупляет болевые синдромы, независимо от их характера и локализации. Вещество снимает спазмы сосудов, уменьшая интенсивность неприятных ощущений.
ПЭА применяют при следующих состояниях:
- мигренях;
- болях в области таза и позвоночника;
- дискомфортных ощущениях, вызванных онкологическими заболеваниями;
- в послеоперационный период.
Поддержка суставов
Пальмитоилэтаноламид позволяет снизить интенсивность боли и купировать воспаление.
РЕА назначают для поддержки суставов при таких заболеваниях, как:
- остеоартрит;
- подагра;
- ревматоидный артрит;
- системная красная волчанка;
- ревматизм.
Обезболивающий и противовоспалительный эффект сохраняются продолжительное время даже после прекращения приема добавки.
При депрессии и стрессе
Хронические заболевания, сопровождающиеся постоянной болью, часто приводят к возникновению депрессии. Прием пальмитоилэтаноламида стабилизирует состояние больного, улучшает настроение и снижает интенсивность стрессовых реакций.

Пальмитоилэтаноламид, в отличие от антидепрессантов, не вызывает привыкания. Его эффект заметен не только на начальных стадиях, но и на протяжении всего курса лечения.
Здоровье глаз
Добавки с пальмитоилэтаноламидом снимают воспалительный процесс и позволяют быстро понизить внутриглазное давление, что положительно сказывается на защите зрения.
Читайте в блоге: Арника Монтана как натуральное обезболивающее средство
Защита клеток мозга
ПЭА предотвращает потерю когнитивных способностей, блокирует процесс разрушения нейронов и восстанавливает измененную экспрессию белков. В результате приема улучшаются клинические показатели — неврологический статус и функции мозга.


При черепно-мозговой травме жирная кислота уменьшает отек и размер поражения.
Препараты ПЭА в аптеке и правила их приема
Производством ПЭА занимаются зарубежные фармацевтические компании. На отечественный рынок добавка попадает через посредников, однако через них цена будет сильно завышена.
Сертифицированные препараты с пальмитоилэтаноламидом в форме капсул, таблеток и порошка можно заказать в интернет-магазине iHerb. Доставка без переплат осуществляется в Россию и страны СНГ из США.
Рекомендованная суточная дозировка — 300–1200 мг, в зависимости от заболевания. За 1 прием допускается не более 600 мг.
Ограничений относительно курса приема ПЭА нет. Главное — следовать инструкции от производителя и соблюдать назначения лечащего врача.
Лучший пальмитоилэтаноламид на iHerb
По многочисленным отзывам покупателей с сайта iHerb добавки с пальмитоилэтаноламидом быстро снимают болевой синдром и дискомфортные ощущения.
ПЭА в капсулах от Lake Avenue Nutrition
Природный анальгетик от Lake Avenue Nutrition производится в упаковках по 30, 90 и 365 капсул с дозировкой 300 мг активного вещества ПЭА каждая. Не содержит ГМО, глютен, сою, имеет сертификат качества GMP.
Назначение: 2 капсулы в день с едой. Цена на сайте iHerb составляет 8 долларов.

Комплекс PEA ComfortMAX от Life Extension
Компания Life Extension выпускает препарат двойного действия для поддержки нервной системы. В банке — 30 штук. Состав каждой таблетки включает 600 мг PEA и небольшое количество кальция.
Инструкция по применению: по 1 таблетке утром и вечером перед сном. Стоимость товара на Айхерб — 33 доллара.

Пальмитоилэтаноламид Life Extension в таблетках
Пищевая добавка помогает снятию эпизодической боли и дискомфорта. В банке содержится 60 таблеток, в каждой — 600 мг ПЭА.
Применение: разжевывать по 1 таблетке 1–2 раза в день, независимо от еды. Цена — около 25 долларов.

Противопоказания к применению
Пальмитоилэтаноламид не вызывает побочных эффектов и токсического воздействия на организм даже при длительном употреблении. Однако стоит учесть, что вещество имеет некоторые противопоказания:
- дети до 1 года;
- беременность и кормление грудью;
- индивидуальная непереносимость.
ПЭА является натуральным средством для купирования боли и дискомфортных состояний, однако перед началом приема добавки лучше посоветоваться с неврологом. Если у вас имеются результаты использования данного препарата, поделитесь об этом в комментарии.

Пальмитоилэтаноламид
Palmitoylethanolamide
Фармакологическое действие
Пальмитоилэтаноламид (ПЭА) — эндогенный амид жирной кислоты, проявляет противовоспалительную, нейропротективную, противосудорожную и обезболивающую активность. Предполагается, что основной мишенью ПЭА является α-рецептор, активируемый пролифератором пероксисом (PPAR-α). ПЭА также имеет сродство к каннабиноидоподобным G-связанным рецепторам GPR55 и GPR119. ПЭА не может строго считаться классическим эндоканнабиноидом, потому что ему не хватает сродства к каннабиноидным рецепторам CB1 и CB2.
ПЭА синтезируется различными типами клеток животных, а также присутствует в растениях. Он был выделен из фосфолипидной фракции яичного желтка, из арахисовой муки, а также из соевого лецитина.
Показания
Исследуется на предмет оценки фармакокинетики, фармакодинамики, эффективности, переносимости и безопасности при терапии воспалительных заболеваний, боли, фибромиалгии, синдрома раздражённого кишечника, неврологических расстройств.
Изучался как потенциальный препарат для лечения пациентов с инфекцией, вызванной коронавирусом SARS-CoV-2 (COVID-19).
Подробнее о лечении COVID-19
Временные методические рекомендации профилактики, диагностики и лечения новой коронавирусной инфекции (COVID-19)*
В список возможных к назначению лекарственных средств для лечения COVID-19 у взрослых включены:
- Фавипиравир,
- Молнупиравир,
- Нирматрелвир + Ритонавир,
- Ремдесивир,
- Синтетическая малая интерферирующая рибонуклеиновая кислота (миРНК) [двуцепочечная],
- Иммуноглобулин человека против COVID-19,
- Интерферон-альфа (IFN-α),
- Интерферон альфа-2b (IFN-α2b)
- Умифеновир,
- Имидазолилэтанамид пентандиовой кислоты,
- Касиривимаб + имдевимаб,
- Бамланивимаб + этесевимаб,
- Сотровимаб,
- Регданвимаб.
В список препаратов упреждающей противовоспалительной терапии COVID-19 у взрослых включены:
- Барицитиниб,
- Тофацитиниб,
- Упадацитиниб,
- Олокизумаб,
- Левилимаб,
- Тоцилизумаб,
- Сарилумаб,
- Канакинумаб,
- Анакинра,
- Метилпреднизолон,
- Дексаметазон,
- Гидрокортизон,
- Будесонид.
В список возможных к назначению антикоагулянтов для лечения COVID-19 у взрослых включены:
1) антикоагулянты для парентерального введения:
- нефракционированный гепарин: нефракционированный гепарин.
- низкомолекулярные гепарины: далтепарин натрия, надропарин кальция, эноксапарин натрия, парнапарин натрия, бемипарин натрия.
- синтетические антикоагулянты: фондапаринукс натрия.
- ривароксабан, апиксабан, дабигатрана этексилат.
2) пероральные антикоагулянты:
По процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций зарегистрирован ряд препаратов и вакцин, рекомендованных к применению для лечения, профилактики и терапии последствий новой коронавирусной инфекции (COVID-19).
Смотрите также код МКБ 10:
- U07.1 КОВИД-19 (COVID-19), вирус идентифицирован
* См. Версия 17 (14.12.2022) — Временные методические рекомендации профилактики, диагностики и лечения новой коронавирусной инфекции (COVID-19) — Минздрав России.
Информация о действующем веществе Пальмитоилэтаноламид предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Пальмитоилэтаноламид, содержатся в инструкции производителя, прилагаемой к упаковке.
- Наличие: В наличии
- Код Товара:
Описание
- ПЭА (пальмитоилэтаноламид) Lake Avenue Nutrition
- Избавляет от незначительного периодического дискомфорта*
- Не содержит ГМО, глютена и сои
- Производится на предприятии, имеющем регистрацию GMP
Lake Avenue Nutrition предлагает продукты высокого качества по доступным ценам.
Блог iHerb
Краткое руководство по применению пальмитоилэтаноламида (ПЭА)
Сертификат качества iTested
Рекомендация по применению
Принимать по 2 капсулы в день во время еды или в соответствии с рекомендациями врача.
Ингредиенты
Основные ингредиенты
Пальмитоилэтаноламид (ПЭА)
Другие ингредиенты
Растительная целлюлоза (капсула), микрокристаллическая целлюлоза, дикальций фосфат, карбонат кальция, экстракт риса, аравийская камедь и подсолнечное масло.
При производстве не используются молоко, яйца, рыба, моллюски, древесные орехи, арахис, пшеница, соя и глютен. Производится на независимом предприятии, имеющем регистрацию GMP, где могут обрабатываться другие продукты, содержащие эти аллергены и ингредиенты.
Пищевая ценность
| Пищевая ценность | ||
| Размер порции: 2 растительные капсулы | ||
| Порций в упаковке: 15 | ||
| Количество в 1 порции | % от суточной нормы | |
| Пальмитоилэтаноламид (ПЭА) | 600 мг | † |
| † Суточная норма не определена. |
