1 мл лекарственного средства содержит: активное вещество — афлиберцепта 40 мг,
вспомогательные вещества: натрия хлорид, натрия дигидрофосфат моногидрат, натрия гидрофосфат гептагидрат, сахароза, полисорбат 20, вода для инъекций.
Прозрачный, слегка опалесцирующий раствор.
Препараты для лечения заболеваний глаз. Средства для лечения сосудистых расстройств окологлазного пространства. Антинеоваскулярные средства. Афлиберцепт. Код ATX S01LA05.
Фармакологические свойства
Фармакокинетика
Лекарственное средство Эйлеа® вводится непосредственно в стекловидное тело для оказания локального воздействия.
Абсорбция / распределение
После интравитреального введения афлиберцепт медленно проникает в системный кровоток, где обнаруживается в основном в виде неактивного стабильного комплекса с VEGF (фактор роста эндотелия сосудов), при этом только «свободный афлиберцепт» может связывать эндогенный VEGF.
В исследовании фармакокинетики с частым отбором проб у 6 пациентов с неоваскулярной влажной возрастной макулярной дегенерацией (влажной ВМД) максимальная концентрация свободного афлиберцепта в плазме (системная Смакс) была низкой и составляла в среднем около 0,02 мкг/мл (в диапазоне от 0 до 0.054) в течение 1-3 дней после интравитреального введения 2 мг афлиберцепта, и через две недели после введения дозы, афлиберцепт вовсе не обнаруживался практически у всех пациентов. Афлиберцепт не кумулирует в плазме крови при интравитреальном введении каждые 4 недели.
Средняя максимальная концентрация свободного афлиберцепта в плазме крови примерно в 50-500 раз ниже, чем концентрация, необходимая для ингибирования биологической активности VEGF в системном кровотоке на 50% на животных моделях, у которых изменения артериального давления наблюдались после достижения концентрации свободного афлиберцепта в системном кровотоке около 10 мкг/мл, давление возвращалось к нормальным значениям при снижении концентрации ниже приблизительно 1 мкг/мл. В исследовании на здоровых добровольцах было установлено, что после интравитреального введения 2 мг афлиберцепта пациентам, средняя максимальная концентрация в плазме крови свободного афлиберцепта более чем в 100 раз ниже концентрации, необходимой для связывания половины максимального уровня системного VEGF (2.91 мкг/мл). Таким образом, развитие системных фармакодинамических эффектов, таких как изменения артериального давления, маловероятно.
Экскреция
Поскольку Эйлеа® — белковое лекарственное средство, никаких исследований метаболизма не проводилось.
Свободный афлиберцепт связывается с VEGF с образованием стабильного инертного комплекса. Ожидается, что, как и другие крупные белки, и свободный и связанный афлиберцепт будет выводиться из организма путем протеолитического катаболизма.
Нарушение функции почек
Никаких специальных исследований лекарственного средства Эйлеа® с участием пациентов с нарушенной функцией почек не проводилось.
Фармакодинамика
Афлиберцепт представляет собой рекомбинантный гибридный белок, состоящий из фрагментов внеклеточных доменов человеческих рецепторов VEGF (фактора роста эндотелия сосудов) 1 и 2, соединенных с Fc-фрагментом человеческого IgGl.
Афлиберцепт вырабатывается в клетках К1 яичника китайского хомячка (СНО/ЯКХ) по технологии рекомбинантной ДНК.
Афлиберцепт действует как растворимый рецептор-ловушка, связывающийся с VEGF-А и P1GF с большим сродством, чем их естественные рецепторы, и, таким образом, может ингибировать связывание и активацию этих родственных VEGF рецепторов.
Механизм действия
Эндотелиальный сосудистый фактор роста А (VEGF-А) и плацентарный фактор роста (P1GF) относятся к семейству VEGF ангиогенных факторов, которые обладают мощным митогенным, хемотаксическим действием в отношении эндотелиальных клеток и повышают проницаемость сосудов. VEGF действует посредством двух типов тирозинкиназных рецепторов, VEGFR-1 и VEGFR-2, которые присутствуют на поверхности эндотелиальных клеток. P1GF связывается только с фактором VEGFR-1, который также присутствует на поверхности лейкоцитов. Избыточная активация VEGF-А этих рецепторов может привести к патологической неоваскуляризации и избыточной проницаемости сосудов. В этих процессах P1GF может проявлять синергизм с VEGF-А и стимулировать инфильтрацию лейкоцитов и сосудистое воспаление.
Фармакодинамические эффекты
Неоваскулярная влажная возрастная макулярная дегенерация (влажная ВМД)
Влажная ВМД характеризуется патологической хориоидальной неоваскуляризацией (ХНВ). Просачивание крови и жидкости из участков ХНВ может вызвать утолщение или отек сетчатки и/или суб-/интраретинальное кровоизлияние, что приводит к снижению остроты зрения.
У пациентов, получавших лекарственное средство Эйлеа® (одна инъекция в месяц в течение трех первых месяцев, с последующей одной инъекцией каждый месяц или каждые 2 месяца), отмечалось уменьшение толщины центральной зоны сетчатки (ТЦЗС) вскоре после начала лечения и уменьшение среднего размера патологического участка ХНВ, что соответствует результатам, полученным у пациентов на фоне ежемесячного введения ранибизумаба в дозе 0.5 мг.
Макулярный отек вследствие окклюзии центральной вены сетчатки (ОЦВС) или ее ветвей (ОВВС)
При ОЦВС и ОВВС развивается ишемия сетчатки, провоцирующая высвобождение VEGF, которые в свою очередь дестабилизируют плотные соединения и стимулируют пролиферацию эндотелиальных клеток. Повышение активности VEGF приводит к нарушению гематоретинального барьера, повышенной проницаемости сосудов, отеку сетчатки и неоваскуляризации.
У пациентов, получавших терапию лекарственным средством Эйлеа® (одна инъекция раз в месяц на протяжении шести месяцев), наблюдалась постоянная, быстрая и устойчивая ответная реакция в отношении морфологии (ТЦЗС по данным ОКТ). Улучшение среднего показателя ТЦЗС сохранялось на протяжении 24 недель.
Диабетический макулярный отек (ДМО)
ДМО является последствием диабетической ретинопатии и характеризуется повышенной проницаемостью сосудов и повреждением капилляров сетчатки, что может привести к потере остроты зрения.
У пациентов, получавших лекарственное средство Эйлеа®, большинство из которых страдали диабетом II типа, вскоре после начала лечения наблюдался быстрый и устойчивый морфологический ответ (ТЦЗС согласно оценке данных ОКТ).
Миопическая хориоидальная неоваскуляризация (миопическая ХНВ)
Миопическая ХНВ является частой причиной потери зрения у взрослых людей с патологической миопией. Она развивается как механизм заживления ран вследствие разрывов мембран Бруха и представляет собой наиболее опасное для зрения явление в патологической миопии.
Лекарственное средство Эйлеа® показано взрослым пациентам для лечения:
неоваскулярной (влажной) возрастной макулярной дегенерации (влажной ВМД);
снижения остроты зрения, вызванного макулярным отеком вследствие окклюзии вен сетчатки (центральной вены (ОЦВС) или ее ветвей (ОВВС));
снижения остроты зрения, вызванного диабетическим макулярным отеком (ДМО);
снижения остроты зрения, вызванного миопической хориоидальной неоваскуляризацией (миопической ХНВ).
Способ применения и дозировка
Лекарственное средство Эйлеа® предназначено только для интравитреального введения.
Лекарственное средство должно вводиться только квалифицированным врачом, имеющим опыт проведения интравитреальных инъекций.
Режим дозирования
Неоваскулярная возрастная макулярная дегенерация
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора для инъекций.
Лечение Эйлеа® начинают с трех последовательных инъекций 1 раз в месяц. Затем интервал между инъекциями увеличивают до двух месяцев.
На основании заключения врача о результатах изменения остроты зрения и/или анатомических показателей интервал между инъекциями может поддерживаться на уровне двух месяцев или впоследствии увеличиваться при лечении в режиме «лечить и увеличивать интервал», при котором интервалы между введениями доз препарата увеличиваются с шагом в 2 или 4 недели для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей. В случае ухудшения остроты зрения и/или анатомических показателей интервалы между инъекциями должны быть соответственно сокращены до минимума — два месяца в течение первых 12 месяцев лечения.
Нет необходимости в проведении мониторинга между инъекциями. На основании заключения врача контрольные обследования могут выполняться чаще, чем визиты для проведения инъекций.
Интервалы лечения больше четырех месяцев между инъекциями не изучались.
Макулярный отек, разившийся вследствие ОЦВС или ОВВС
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора для инъекций.
После начальной инъекции лекарственного средства лечение проводят каждый месяц. Интервал между двумя инъекциями должен быть не менее одного месяца.
Если не наблюдается улучшение остроты зрения и анатомических показателей после непрерывного лечения, терапия лекарственным средством Эйлеа® должна быть прекращена.
Ежемесячная терапия продолжается до достижения максимально возможной остроты зрения в отсутствие признаков активности заболевания. Для этого может потребоваться
три или более последовательных ежемесячных инъекции.
Затем лечение может быть продолжено в режиме «лечить и увеличивать интервал» при постепенном увеличении интервалов времени между инъекциями для поддержания достигнутых стабильных остроты зрения и /или анатомических показателей, однако имеющихся данных недостаточно для того, чтобы сделать вывод о продолжительности этих интервалов. В случае ухудшения остроты зрения и (или) анатомических показателей интервалы между инъекциями должны быть соответствующим образом сокращены.
График мониторинга и лечения должен определяться лечащим врачом индивидуально, на основании ответа пациента.
Мониторинг проявлений активности заболевания может включать в себя стандартный офтальмологический осмотр, функциональную диагностику или проведение визуальных методов исследования (например, оптическую когерентную томографию или флуоресцеиновую ангиографию).
ДМО
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, (эквивалентно 50 мкл раствора для инъекций) интравитреально в виде первых пяти последовательных ежемесячных инъекций, с дальнейшим интервалом лечения 1 инъекция в 2 месяца. Нет необходимости в проведении мониторинга между инъекциями.
Через 12 месяцев лечения Эйлеа® интервал между инъекциями может быть увеличен на основании результатов изменения остроты зрения и анатомических показателей; при лечении в режиме «лечить и увеличивать интервал» интервалы между введениями доз препарата постепенно увеличиваются для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей, однако данных для установления длины таких интервалов недостаточно. В случае ухудшения остроты зрения и анатомических показателей интервалы между инъекциями должны быть соответственно сокращены. В этом случае лечащий врач должен составить график контрольных обследований, которые могут быть более частыми, чем инъекции.
Если результаты остроты зрения и анатомические показатели указывают на отсутствие эффекта от проводимого лечения, терапию лекарственным средством Эйлеа® следует прекратить.
Миопическая ХНВ
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора для инъекций.
Дополнительные дозы могут вводиться, если результаты остроты зрения и/или анатомические показатели показывают, что заболевание сохраняется. Рецидивы следует рассматривать как новое проявление заболевания.
График мониторинга определяется лечащим врачом.
Интервал между двумя инъекциями должен составлять не менее одного месяца.
Дополнительная информация для особых категорий пациентов
Пациенты с нарушениями функции печени и/или почек
Какие — либо специальные исследования Эйлеа® у больных с нарушениями функции печени и почек не проводились. На основании доступных данных, коррекции дозы у таких пациентов не требуется.
Пожилые пациенты
Особых мер предосторожности не требуется. Опыт применения у пациентов старше 75 лет с диабетическим макулярным отеком ограничен.
Применение в педиатрии
Безопасность и эффективность лекарственного средства у детей и подростков не изучалась. Лекарственное средство Эйлеа® не показано к применению у данной группы пациентов при влажной ВМД, ОЦВС, ОВВС, ДМО и миопической ХНВ.
Техника введения
Интравитреальные введения должны осуществляться квалифицированным врачом, имеющим опыт проведения интравитреальных инъекций в соответствии с медицинскими стандартами и действующими руководящими положениями. В целом должны обеспечиваться адекватная анестезия и асептические условия, включая применение наружных бактерицидных средств широкого спектра действия (например, наносить повидон-йод на кожу вокруг глаза, веко и поверхность глаза). Рекомендуется дезинфекция рук хирурга, использование стерильных перчаток и салфеток, стерильного векорасширителя (или его эквивалента).
Инъекционную иглу следует вводить в стекловидное тело на 3.5-4.0 мм кзади от лимба, избегая горизонтального меридиана и направляя ее к центру глазного яблока. Объем введенного препарата составляет 0.05 мл. Следующая инъекция лекарственного средства проводится в другой участок склеры.
Сразу после интравитреальной инъекции состояние пациента необходимо контролировать на предмет повышения внутриглазного давления. Надлежащий мониторинг может состоять из проверки перфузии диска зрительного нерва или офтальмотонометрии. При необходимости следует обеспечить доступ к стерильному оборудованию для проведения парацентеза.
После интравитреальной инъекции пациентам необходимо без промедления сообщать о каких-либо симптомах эндофтальмита (например, боль в глазу, покраснение глаза, светобоязнь, нечеткость зрения).
Каждый флакон должен применяться только для лечения одного глаза. Извлечение нескольких доз из флакона может увеличить риск загрязнения и последующего инфицирования.
Флакон содержит дозу афлиберцепта, превышающую рекомендованную дозу 2 мг. Извлекаемый из флакона объем (100 мкл) не следует использовать целиком. Избыточный объем следует выпустить из шприца до инъекции. Ввод всего объема флакона может привести к передозировке. Для удаления пузырьков воздуха и избыточного объема лекарственного средства, медленно нажимайте на поршень шприца, чтобы совместить цилиндрическое основание поршня с черной меткой дозы на шприце (эквивалентной 50 микролитрам, т.е. 2 мг афлиберцепта).
После инъекции все неиспользованное лекарственное средство должно быть утилизировано.
О любых побочных эффектах, развившихся на фоне применения лекарственного средства, в том числе и не описанных в инструкции, необходимо сообщить врачу.
Оценка безопасности применения лекарственного средства Эйлеа® осуществлялась в ходе исследований фазы III с участием 3102 пациентов. Из них 2501 пациентов получали рекомендованную дозу 2 мг.
Серьезные офтальмологические нежелательные реакции, связанные с инъекцией Эйлеа® наблюдались менее чем в одной из 1900 проведенных интравитреальных инъекций, и включали слепоту, эндофтальмит, отслойку сетчатки, травматическую катаракту, катаракту, кровоизлияние в стекловидное тело, отслойку стекловидного тела и повышение внутриглазного давления (смотрите раздел «Меры предосторожности»). Наиболее распространенными нежелательными реакциями (как минимум у 5 % пациентов, получивших терапию Эйлеа®) были субконъюнктивальное кровоизлияние (25%), снижение остроты зрения (11%), боль в глазу (10%), катаракта (8%), повышение внутриглазного давления (8 %), отслойка стекловидного тела (7 %), плавающие помутнения стекловидного тела (7 %).
Перечисленные ниже данные по безопасности лекарственного средства включают в себя все нежелательные реакции, основанные на исследованиях фазы III по показаниям влажная ВМД, ОЦВС, ОВВС, ДМО и миопическая ХНВ с указанием возможности наличия причинно-следственной связи с процедурой введения или с лекарственным средством.
Нежелательные лекарственные реакции классифицированы в соответствии с системно-органными классами: очень часто (> 1/10), часто (> 1/100, < 1/10), нечасто (> 1/1 000, < 1/100), редко (> 1/10 000, < 1/1 000). В рамках каждой группы нежелательные реакции представлены в порядке уменьшения степени тяжести.
| Системно-органные классы | Очень часто | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | реакции гиперчувствительности*** | |||
| Нарушения со стороны органа зрения | снижение остроты зрения, субконъюнктивальное кровоизлияние, боль в глазу | разрыв пигментного эпителия сетчатки*, отслойка пигментного эпителия сетчатки, дегенерация сетчатки, кровоизлияние в стекловидное тело, катаракта, кортикальная катаракта, ядерная катаракта, субкапсулярная катаракта, эрозия роговицы, повреждение роговицы, повышение внутриглазного давления, нечеткость зрения, плавающие помутнения стекловидного тела, отслойка стекловидного тела, боль в месте введения, ощущение инородного тела в глазах, повышенное слезоотделение, отек век, кровоизлияние в месте введения, точечный кератит, гиперемия конъюнктивы, окулярная гиперемия | эндофтальмит* *, отслойка сетчатки, разрыв сетчатки, ирит, увеит, иридоциклит, помутнение хрусталика, повреждение эпителия роговицы, раздражение в месте введения, аномальная чувствительность тканей глаза, покраснение век, воспаление передней камеры глаза, отек роговицы | слепота, травматическая катаракта, воспаление стекловидного тела, гипопион |
* Состояния, как известно, связанные, с влажной ВМД. Наблюдались только в исследованиях с влажной ВМД.
** Эндофтальмит с положительной и отрицательной культурой.
*** В пострегистрационном периоде сообщения о реакциях гиперчувствительности включали сыпь, зуд, крапивницу и в отдельных случаях — тяжелые анафилактические/анафилактоидные реакции.
Описание отдельных нежелательных реакций
Артериальная тромбоэмболия (АТЯ) является нежелательным явлением, потенциально связанным с системным ингибированием эндотелиального фактора роста сосудов (VEGF). Теоретически существует риск развития АТЯ после интравитреального применения ингибиторов VEGF, включая инфаркт миокарда и инсульт.
Как и все лекарственные средства белковой природы Эйлеа® обладает иммуногенным потенциалом.
повышенная чувствительность к афлиберцепту или вспомогательным компонентам лекарственного средства;
активная или подозреваемая окулярная или периокулярная инфекция;
активное тяжелое внутриглазное воспаление.
Лекарственные взаимодействия
Исследования в отношении лекарственных взаимодействий не проводились. Осуществление вспомогательной фотодинамической терапии с применением вертепорфина (PDT) и Эйлеа не изучалось, поэтому, профиль безопасности не был установлен.
Реакции, обусловленные интравитреальным введением
Интравитреальные инъекции, включая инъекции лекарственного средства Эйлеа®, могут вызвать развитие эндофтальмита, внутриглазное воспаление, регматогенную отслойку сетчатки, разрыв сетчатки и ятрогенную травматическую катаракту (см. раздел «Побочное действие»).
При введении лекарственного средства Эйлеа® всегда необходимо соблюдать соответствующую технику асептического проведения инъекций. Кроме того, необходим мониторинг пациентов в течение недели после инъекции, для выявления первых признаков воспаления и своевременного назначения необходимой терапии.
При появлении каких-либо симптомов, свидетельствующих о развитии эндофтальмита или любой другой реакции, указанной выше, необходимо немедленно сообщить врачу. Наблюдались случаи повышения внутриглазного давления в первые 60 минут после интравитреальных инъекций, включая инъекции лекарственного средства Эйлеа® (смотрите раздел «Побочное действие»). Пациенты с плохо контролируемой глаукомой нуждаются в особых мерах предосторожности. Лекарственное средство Эйлеа® не следует вводить при внутриглазном давлении > 30 мм рт. ст. Во всех случаях необходим контроль внутриглазного давления и перфузии диска зрительного нерва с назначением соответствующей состоянию терапии.
Иммуногенность
Так как Эйлеа® представляет собой белок с терапевтическими свойствами, существует вероятность проявления иммуногенности (см. раздел «Побочное действие»). При появлении признаков или симптомов внутриглазного воспаления, таких как боль, светобоязнь или покраснение, которые могут являться клиническими проявлениями гиперчувствительности к лекарственному средству, необходимо сообщить врачу.
Системные эффекты
После интравитреальных инъекций ингибиторов VEGF были отмечены системные нежелательные явления, включая кровоизлияния вне органа зрения и тромбоэмболии артерий. Существует теоретический риск связи этих явлений с ингибированием VEGF. Имеются ограниченные данные относительно безопасности применения афлиберцепта пациентами с ОЦВС, ОВВС, ДМО или миопической ХНВ с анамнестическими сведениями об инсульте, транзиторной ишемической атаке или инфаркте миокарда за период в 6 месяцев перед началом терапии. Указанным пациентам следует соблюдать осторожность при терапии лекарственным средством Эйлеа®.
Прочее
Как и в случае интравитреального введения других анти-VEGF препаратов при влажной ВМД, ОЦВС, ОВВС, ДМО и миопической ХНВ, следует принять во внимание следующее:
Безопасность и эффективность лекарственного средства Эйлеа® при введении одновременно в оба глаза систематически не изучались (см. раздел «Фармакодинамика»). Одновременное билатеральное введение может привести к повышению системной экспозиции лекарственного средства, что, в свою очередь, повышает риск системных нежелательных явлений.
Сопутствующее применение других анти-VEGF (фактор роста эндотелия сосудов). Отсутствуют данные об одновременном применении лекарственного средства Эйлеа® с другими анти-VEGF препаратами (системными или глазными).
Факторы риска, связанные с нарушением целостности слоя пигментных клеток после анти-VEGF терапии влажной ВМД, включают распространенную и/или локализованную в верхних отделах отслойку пигментного эпителия сетчатки. Пациентам с факторами риска развития разрывов пигментного эпителия сетчатки следует соблюдать осторожность в начале терапии лекарственным средством Эйлеа®.
Пациентам с регматогенной отслойкой сетчатки или макулярными разрывами 3 или 4 стадии от лечения следует воздержаться.
В случае разрыва сетчатки введение дозы следует остановить и не возобновлять лечение до достаточного восстановления места разрыва.
От инъекции следует воздержаться до следующей запланированной по графику инъекции в случае:
снижения наилучшей корригированной остроты зрения (BCVA) более чем на 30 букв, по сравнению с последней оценкой остроты зрения;
субретинальных кровоизлияний, затрагивающих центральную ямку, или в случае размера кровоизлияния >50% общей площади поражения.
Следует воздержаться от введения дозы лекарственного средства в течение предыдущих или последующих 28 дней в случае выполнения или планирования операции на глазу.
Лекарственное средство Эйлеа® не следует использовать во время беременности, за исключением случаев, когда потенциальная выгода превышает потенциальный риск для плода (см. раздел «Беременность и период лактации»).
Женщинам репродуктивного возраста следует использовать эффективные способы контрацепции в период лечения и в течение, по меньшей мере, 3 месяцев после последней интравитреальной инъекции афлиберцепта.
Имеется ограниченный опыт лечения пациентов с ишемическим макулярным отеком вследствие окклюзии ветви вены сетчатки и ишемическим макулярным отеком вследствие окклюзии центральной вены сетчатки. Пациентам с клиническими признаками необратимой ишемической потери зрительной функции терапия афлиберцептом не рекомендована.
Группы пациентов с ограниченными данными
Имеется только ограниченный опыт лечения ДМО у пациентов с сахарным диабетом типа I, у пациентов с уровнем гликированного гемоглобина более 12 %, или у пациентов с пролиферативной диабетической ретинопатией. Лекарственное средство Эйлеа® не изучалось у пациентов с активными системными инфекциями или у пациентов с сопутствующими заболеваниями глаз, такими как отслойка сетчатки или разрыв макулы. Также отсутствует опыт лечения лекарственным средством Эйлеа® пациентов с сахарным диабетом и неконтролируемой гипертензией. При лечении таких пациентов врач должен учитывать этот дефицит информации.
Отсутствует опыт лечения миопической ХНВ у пациентов не азиатской популяции, пациентов ранее проходивших лечение миопической ХНВ, и пациентов с экстрафовеальными поражениями.
Женщины репродуктивного возраста
Женщинам репродуктивного возраста во время терапии лекарственным средством Эйлеа® необходимо использовать эффективную контрацепцию, по крайней мере, в течение 3 месяцев после последней интравитреальной инъекции.
Беременность
Данные по применению афлиберцепта у беременных женщин отсутствуют.
В исследования на животных была продемонстрирована эмбрио-фетотоксичность.
Несмотря на то, что системная экспозиция после внутриглазного введения Эйлеа® очень мала, лекарственное средство не следует применять при беременности, за исключением тех случаев, когда потенциальная польза от лечения превышает потенциальный риск для плода.
Период грудного вскармливания
Неизвестно, проникает ли афлиберцепт в грудное молоко. Нельзя исключить существование риска для ребенка находящегося на грудном вскармливании.
Не рекомендуется принимать лекарственное средство Эйлеа® в период грудного вскармливания. Необходимо принять решение о прерывании грудного вскармливания или воздержании от приема лекарственного средства, принимая во внимание пользу грудного вскармливания для ребенка и пользу лечения для матери.
Фертильность
Результаты исследований на животных с высокой системной экспозицией показывают, что афлиберцепт может нарушать мужскую и женскую фертильность. Подобные эффекты маловероятны после внутриглазного введения лекарственного средства с учетом очень низкой системной экспозиции.
Влияние лекарственного средства на способность управлять транспортными средствами и потенциально опасными механизмами
У пациентов могут наблюдаться временные нарушения зрения, связанные как с инъекцией, так и с процедурой обследования.
Пациентам не следует управлять автомобилем или сложными механизмами до восстановления четкости зрительного восприятия.
В клинических исследованиях применялись дозы до 4 мг с интервалом в 1 месяц, наблюдались отдельные случаи передозировки при применении дозы 8 мг.
Симптомы: передозировка в результате введения большего объема может привести к повышению внутриглазного давления.
Лечение: в случаях передозировки следует контролировать внутриглазное давление, при необходимости лечащий врач должен назначить адекватную терапию по его коррекции.
Форма выпуска и упаковка
По 0.278 мл раствора во флакон из бесцветного стекла типа I, вместимостью 2 мл. укупоренный пробкой из бутилкаучука, фольгированный фторполимером, обжатый алюминиевым кольцом и полипропиленовым колпачком.
По 1 флакону, 1 фильтровальной игле вместе с инструкцией по медицинскому применению помещают в пачку из картона.
Хранить при температуре от 2 °C до 8 °C. Не замораживать.
Хранить в картонной пачке для предотвращения воздействия света.
Хранить в недоступном для детей месте!
Перед использованием невскрытый флакон может храниться при температуре не выше 25°С до 24 часов. После вскрытия флакона необходимо соблюдать асептические условия.
Срок хранения
2 года.
Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту
Информация о производителе
Владелец регистрационного удостоверения:
Байер АГ, Германия.
Производитель готовой лекарственной формы:
Регенерон Фармасьютикалс, Инк.,
Нью-Йорк 12144, США.
Выпускающий контроль качества/Упаковка:
Байер АГ, Германия
13353 Берлин, Мюллерштрассе 178, Германия.
Дополнительную информацию можно получить по адресу: 220089, Минск, пр-т Дзержинского 57, 14 эт.
Тел.: +375(17) 239-54-20 (30).
Факс. +375(17) 336-12-36.
Инструкции по введению
Флакон предназначен только для однократного использования (для одного глаза).
Флакон содержит 100 мкл извлекаемого объема лекарственного средства, что превышает рекомендованную дозу в 50 мкл. Извлекаемый из флакона объем (100 мкл) не следует использовать целиком, часть его должна быть отброшена перед применением.
Перед введением следует визуально осмотреть флакон. Нельзя использовать флакон при наличии посторонних частиц и/или изменения цвета раствора или при любом изменении внешнего вида раствора.
Для интравитреального введения необходимо использовать иглу для инъекций размером 30 G × 1/2.
Снимите пластиковый колпачок и продезинфицируйте наружную часть резиновой пробки флакона.
Соедините иглу 18G с 5-микронным фильтром, вложенную в картоннуюупаковку с 1-милиллитровым стерильным шприцем с замком Люэра.
Вводите фильтровальную иглу в центр пробки флакона, пока она полностью не войдет во флакон, а кончик не достигнет дна или нижнего края флакона.
В асептических условиях извлеките все содержимое флакона лекарственного средства Эйлеа® в шприц, удерживая флакон в вертикальном положении, слегка наклонив его для полного извлечения лекарственного средства. Чтобы предотвратить попадание воздуха необходимо обеспечить погружение косого края фильтровальной иглы в жидкость. Продолжайте наклонять флакон во время отбора лекарственного средства, удерживая срез фильтровальной иглы погруженным в жидкость.
Удостоверьтесь в том, что шток поршня при заборе раствора из флакона в достаточной степени поднят, и игла с фильтром пустая.
Снимите фильтровальную иглу и утилизируйте ее надлежащим образом.
Примечание: фильтровальная игла не предназначена для интравитреальных инъекций.
В условиях асептики, скручивающим движением наденьте крепко иглу для инъекций 30G × 1/2 дюйма на переходную канюлю шприца с люэровским замком.
8. Удерживая шприц с поднятой вверх иглой, проверьте его на наличие пузырьков. Если есть пузырьки, мягко постучите по шприцу пальцем до тех пор, пока все пузырьки не поднимутся вверх.
9. Устраните все пузырьки и удалите излишки лекарственного средства, медленно нажимая на поршень шприца так, чтобы его конец совпал с линией на отметке 0,05 мл на шприце.
10. Флакон предназначен только для одноразового использования.
Извлечение нескольких доз из флакона может увеличить риск загрязнения и последующего инфицирования.
Весь неиспользованный объем лекарственного препарата или отходы должны быть утилизированы.
Советский журнал «Здоровье» был одним из самых знаменитых СМИ, посвященных популяризации медицины. Издание «о здоровье и способах его сохранения» было основано в 1955 году и выходило каждый месяц. В журнале печатались репортажи о сложных операциях, достижениях советских врачей и науки, книжные рецензии и даже карикатуры. А ещё там публиковалась реклама советских товаров народного потребления. Посмотрим, на что гражданин мог потратить свои рубли.
Реклама потребительских товаров на страницах журнала появляется с 1970‑х годов. Но место ей отведено далеко не в каждом номере. Один выпуск содержит не более одного рекламного макета на последней странице журнала. Помимо бытовой техники, там же рекламировались советские аптечные препараты, уходовая косметика, продукты питания и даже путевки на речные круизы. VATNIKSTAN демонстрирует самые примечательные рекламные сообщения из журнала.
Бра со светорегулятором

Дизайнерское изделие для интерьера стоило 15 рублей. Производилась на московском заводе «Старт».
Бытовой надплиточный воздухоочиститель БЭВ‑1

Прадед современных кухонных вытяжек. Вот что о ней пишет В.П. Шмаров в книге «Благоустройство сельского дома»:
«В газифицированных кухнях целесообразна установка над плитами газосборных кожухов (зонтов), соединенных с системой вентиляции. Хорошие результаты дает установка над плитой электровоздухоочистителя типа БЭВ‑1.У4.2. Его производительность 130±40 м3/ч. Аэрозоли и механические примеси отсасываются вентилятором и осаждаются на аэрозольном фильтре, после чего очищенный воздух проходит через камеру с бактерицидной ртутно-кварцевой лампой, обеспечивающей стерилизацию воздуха, а совместно с сорбентом и газовую его очистку. Циркуляция очищенного воздуха предотвращает конденсацию пара на стенах кухни».
Автоприцеп «Скиф»

Прицеп «Скиф» называли мечтой туриста. Прицеп-палатка и прицеп-дача — именно так называли изделие, впервые выпущенное в 1975 году на заводе «Искра». В развёрнутом состоянии тентовый домик мог вместить трёх взрослых людей и двух детей. В среднем прицеп стоил в районе двух тысяч рублей. Найти объявления о его продаже можно и сегодня.
Массажёр

По словам создателей — незаменимая вещь для утренней зарядки.
Светорегуляторы

Ещё один гаджет для светильников производства Рижского опытного завода.
Холодильник БИРЮСА‑5

Живой по сей день производитель бытовой техники из Красноярска. Эта модель, хоть и признана старой, но судя по отзывам пользователей, — вещь долговечная.
Пылесос «Тайфун»

Советский макет робота R2D2 за 54 рубля. Производитель отмечает повышенную комфортность изделия и утверждает, что им можно чистить пол от пролитой жидкости.
Электропечь и электросковорода

Гаджеты для готовки еды от розетки. Названия — «Чудо» и «Чудесница». Производились на Уральском заводе бытовых изделий. При небрежном использовании об верхнюю крышку печи можно было запросто обжечься.
Электрощётка «Ветерок» и электрополотер ЭП‑3

«Ветерок» в советские времена считался аксессуаром исключительно автомобильным (из-за своих компактных размеров). Гаджет производился Ленинградским машиностроительным объединением «Спутник».
Электрополотёр предназначался для уборки паркетного пола. С его помощью чистоты и блеска можно было добиться намного быстрее. Стоило это удовольствие 33 рубля.
Термос для трёх блюд

Производился Минским заводом холодильников (ныне предприятие «Атлант»).
Холодильник Бирюса-17

Несмотря на увлекающее описание, на фото холодильника виднеется ржавчина.
Массажное устройство

Далеко не единственное среди всей продукции массажного назначения.
АИР‑2 для страдающих логоневрозом

В основе работы аппарата — создание искусственного эха, благодаря которому пользователь слышит сам себя с задержкой.
Стиральная машина «Вятка-автомат»

Производилась на кировском заводе «Веста». Своим появлением «Вятка» обязана несовершенством советских электросетей: её предшественница — автоматическая стиральная машина «Волга-10» систематически выбивала пробки у населения. К слову, лицензия на производство стиральных машин типа «Вятка» была куплена у итальянской компании Мерлони Проджети (сейчас Indesit).
Машину можно было купить без очереди. Но магазин мог потребовать справку о исправности и пригодности электросети к ней.
Чрескожные противоболевые электронейростимуляторы ЭТНС-100–1 и ЭТНС-100–2

Изделие больше напоминает оснастку актера Дольфа Лундгрена в роли Ивана Драго. Это чудо инженерной мысли должно было помочь в лечении остеохондроза.
Настольный прибор «Ромашка‑2»

Паровой ингалятор который, по всей видимости, производится до сих пор. Используется для очищения пор и лечения ангины.
Очки «БСС»

Так называемые «Очки с бифокальными линзами». Сама технология расположения линз сегодня считается устаревшей. Бифокальная линза имеет две оптические зоны: обширную для дали и миниатюрный сегмент для чтения.
Тепловая полумаска

Для путешествий по северным широтам. Производитель — НИИ Резиновой промышленности.
Стимулятор «Биотонус» СКИ‑1

Изделие эпохи советского киберпанка. Производился на Минском электромеханическом заводе. Согласно заводской инструкции аппарат предназначался для лечения «заболеваний периферической нервной системы, снятия болевых синдромов различного происхождения и коррекции психофизиологического состояния человека». Один из пользователей отзывался, что лечил с его помощью насморк. Также аппарат снискал некоторую популярность у советских спортсменов.
Электронейросветостимулятор «Элеан»

Конкурент Биотонуса, сделанный на Подольском электромеханическом заводе. Также предназначался для лечения в домашних условиях. Принцип действия прост и он описан в инструкции:
«Для снятия болей достаточно прижать электростимулятор к больному месту, включить прибор, плавно увеличить напряжение до «покалывания» и провести процедуру (3−20 минут)».
Слайд-фильмы почтой

Перестройка добралась и до журнала «Здоровье». Школьники ходили в кино на «Аварию — дочь мента», а люди постарше вовсю знакомились с тем, чего в СССР официально не было, согласно знаменитому крылатому выражению.
Правда, предупреждение гласит, что получить материалы мог только врач да и то, поставив личную печать.
Тренажёр «Пульс‑1»

Культуризм в позднем СССР был достаточно распространённым явлением, хоть и подпольным. Подвальные «качалки» были повсюду, а в подмосковных Люберцах любители тяжелой атлетики оформились в целую субкультуру люберов.
Электромассажёр ЭМР‑2 «Пульсар»

Массажёр продавался с несколькими насадками. На нём можно было регулировать частоту и амплитуду колебаний. Одна из обладательниц устройства делилась отзывом, что использовала его для лечения целлюлита. Впрочем, хватало и довольно сатирических отзывов на это чудо бытовой техники.
Тренажёры «Континент»

Ещё один серьёзный прибор для «качков». Его можно было нередко встретить в школьных спортзалах и спортклубах.
Тренажёр экстренной помощи «ВИТИМ»
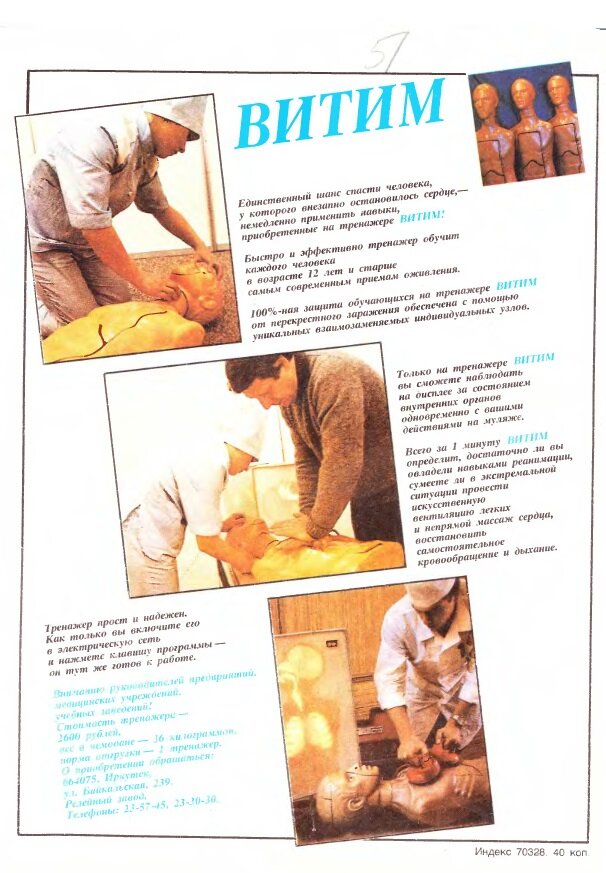
По сути, представляет из себя прокачанный манекен для тренировки оказания первой помощи — конкретно этот образец имитирует сердечно-легочную реанимации. Получил распространение не только среди медиков, но и в милиции, МЧС и на предприятиях повышенной опасности. В инструкции указано, что одно из назначений тренажёра — «оказание помощи при ломке наркомана с аспирацией агонии».
Видео «Здоровье»

Видеомания не обошла стороной и Советский Союз. кто победнее — ходили в видеосалоны, а обладатели настоящего японского видеомагнитофона могли пополнять собственные медиатеки в том числе и за счет таких альманахов. Тут и упоминается смертельное последствие ВИЧ. Тоже один из элементов эпохи.
Поделиться
Изобретение относится к медицинской технике, в частности к устройствам электрофизического воздействия, и может быть использовано для нейростимуляции и лечебного воздействия на биологически активные зоны поверхности тела человека и стимуляции процессов регенерации при травмах и послеоперационного вмешательства, а также обезболивания.
Известно устройство, содержащее блок коммутации, соединенный с контактными и воздействующими электродами, с выходами блока поиска биологически активных зон, блоком контроля контакта и реле времени с генератором воздействия [1].
Недостатком известного устройства является сложное техническое решение, при этом стимуляция биологически активных зон осуществляется большим током, что в некоторых случаях приводит к осложнениям.
Наиболее близким по технической сущности является устройство, содержащее источник питания, генератор прямоугольных импульсов, узел установки частоты, формирователь импульсов высокого напряжения, выходы которого соединены с электродом воздействия и индифферентным электродом, узел установки амплитуды, блок световой стимуляции, конденсатор накопительный, ключ тока управления, узел установки длительности прямоугольных импульсов и коммутатор, выходы которого соединены с входами блока световой стимуляции, а первый вход — с первым выходом генератора, подключенного к первому входу формирователя импульсов высокого напряжения, второй вход которого через последовательно соединенные ключ тока управления и узел установки амплитуды соединен со вторым выходом генератора, подключенного первым и вторым входами к выходам соответственно узла установки частоты и узла установки длительности прямоугольных импульсов [2].
Недостатком известного решения является значительный ток воздействия, что является противопоказанием при лечении ряда заболеваний, и невозможность саморегуляции сигнала воздействия в зависимости от реакции биологически активной зоны.
Технической сущностью изобретения является устранение указанных недостатков, повышение эффективности и обеспечение безопасности за счет высокого напряжения при минимальном токе стимуляции с одновременным световым воздействием.
Технический результат достигается тем, что в устройстве электроимпульсной и световой стимуляции, содержащем источник питания, генератор прямоугольных импульсов, узел установки частоты, формирователь импульсов высокого напряжения, выходы которого соединены с электродом воздействия и индифферентным электродом, узел установки амплитуды, блок световой стимуляции, конденсатор накопительный, ключ тока управления, узел установки длительности прямоугольных импульсов и коммутатор, выходы которого соединены с входами блока световой стимуляции, а первый вход — с первым выходом генератора, подключенного к первому входу формирователя импульсов высокого напряжения, второй вход которого через последовательно соединенные ключ тока управления и узел установки амплитуды соединен со вторым выходом генератора, подключенного первым и вторым входами к выходам соответственно узла установки частоты и узла установки длительности прямоугольных импульсов, при этом первый выход источника питания соединен с третьим входом генератора, вторыми входами узла установки амплитуды и ключа тока управления, а также входами узла установки длительности прямоугольных импульсов и частоты, второй выход источника питания подключен ко второму входу коммутатора. накопительный конденсатор включен между выходами источника питания, формирователь импульсов высокого напряжения конструктивно выполнен в виде индуктивного преобразователя на стальном магнитопроводе, обработанном и скрепленном склеивающим составом с добавлением магнитонаполнителя карбонильного железа, с сопротивлением вторичной обмотки катушки преобразователя, подключенного ко входам блоки электродов, не менее 500 Ом.
Устройство (см. чертеж) содержит источник 1 питания, конденсатор 2 накопительный, узел 3 установки частоты и узел 4 установки длительности прямоугольных импульсов, генератор 5 прямоугольных импульсов, узел 6 установки амплитуды, ключ 7 тока управления и формирователь 8 импульсов высокого напряжения, а также блок 9 электродов в составе электродов 10 воздействия и электрода 11 индифферентного и коммутатора 12 с блоком 13 световой стимуляции.
Устройство работает следующим образом. При включении источника 1 питания начинает работать формирователь 5 прямоугольных импульсов и блок 13 световой стимуляции, который одновременно является и индикатором работы устройства. Прямоугольные импульсы с выхода генератора 5 прямоугольных импульсов поступают на управляющий вход узла 6 установки амплитуды, который служит для ограничения выходного тока ключа 7 тока управления. Ток управления с ключа 7 поступает на вход формирователя 8 импульсов высокого напряжения, к которому подключен блок 9 электродов в составе воздействующих 10 и индифферентного 11 электродов.
При этом генератор 5 прямоугольных импульсов собран по схеме управляемого мультивибратора, где с помощью узла 3 установки частоты задается частота импульсов; а узла 4 формируется сигнал установки длительности импульсов. Длительность этих импульсов должна быть определенной и строго заданной. При очень малой длительности ток в цепи ключа 7 не успевает вырасти до величины, достаточной для формирования импульсов высокой амплитуды. При большой длительности возрастает ток потребления и происходит сбой работы формирователя 8 импульсов высокого напряжения.
Формирователь 8 импульсов высокого напряжения конструктивно выполнен как индуктивный преобразователь или трансформатор. При этом напряжение сигнала тока управления первичной обмотки составляет около 9 В, а напряжение сигнала стимуляции вторичной обмотки преобразователя должно быть не менее 1200-1500 В при сопротивлении нагрузки 1 МОм.
Такое решение достигается тем, что индуктивный преобразователь выполнен на стальном магнитопроводе, обработанном и скрепленном клеящим составом с добавлением магнитонаполнителя, например карбонильного железа. Соотношение витков первичной и вторичной обмотки катушки преобразователя составляет не менее 1/5 при сопротивлении вторичной обмотки, соединенной со входами блока электродов, не менее 500 Ом.
При этом выходы преобразователя 8 подключены к блоку электродов таким образом, чтобы на группу воздействующих электродов блока 9 поступал сигнал отрицательной полярности.
Такое решение позволяет наиболее оптимальным и простейшим способом отслеживать состояние биологически активной зоны, на которую направлено воздействие и осуществлять автоматическое саморегулирование параметрами сигнала стимуляции. В частности при уменьшении сопротивления зоны в процессе лечебного воздействия уменьшается и амплитуда воздействующего сигнала. В случае необходимости быстрого обезболивания сопротивление зоны воздействия автоматически понижается за счет высокой начальной амплитуды сигнала, что особенно важно, например, при купирования постравматических шоковых состояний.
Таким образом, достигается электрическое взаимодействие с состоянием проводимости биологически активной зоны воздействия, которое в свою очередь влияет на изменение индуктивности преобразователя, чем и осуществляется саморегуляция лечебного процесса стимуляции.
Так как работа устройства происходит в импульсном режиме, наиболее экономичном для автономного источника питания, то наличие накопительного конденсатора создает условия дополнительного накопительного источника тока. Так, в момент импульсного его потребления, накопительный конденсатор сохраняет работоспособность устройства за счет накопленного напряжения в межимпульсном периоде и позволяет удерживать амплитуду сигнала воздействия, необходимую и заданную трансформатором в зависимости от состояния зоны воздействия.
Кроме того, накопительный конденсатор позволяет срабатывать источнику световой стимуляции блока 13 в импульсном режиме вспышки, не создавая дополнительной нагрузки на источник питания. При этом источник световой стимуляции выполнен с использованием полупроводниковых светоэлементов с генерацией излучения в диапазоне от 400 до 750 нм.
Коммутатор 12 предназначен для возможности включения источников световой стимуляции блока 13 в зависимости от необходимости использования их в различном диапазоне излучения. Так, например для лечения вирусных заболевании слизистых необходимо использовать источник с излучением в диапазоне 690-710 нм, а при лечении воспалительных процессов необходимо использовать более короткий диапазон излучения.
Таким образом, представленное решение позволяет осуществлять лечебное воздействие на биологически активные зоны поверхности тела человека амплитудой, достаточной для высокой эффективности лечения при, исключительно минимальном токе воздействующего сигнала, а следовательно и полной безопасности в любых условиях. Световая стимуляция дополняет лечебный эффект за счет возможности импульсного воздействия и фотосинтеза биологически активных веществ в зоне воздействия.
Техническое решение устройства позволяет использовать автономный источник питания с минимальным потреблением тока в процессе работы, что повышает его потребительские свойства.
Устройство рекомендовано Минздравом России для практического применения как аппарат электроимпульсной и световой стимуляции «ЭЛЕАН».
Источники информации
1. Авторское свидетельство СССР 525961, кл. G 06 F 15/42, опубл. 1975 г.
2. Патент РФ 2017506, кл. А 61 N 39/00 опубл. 15.08.1994 г. (прототип).
Изобретение относится к медицинской технике и может быть использовано для нейростимуляции и лечебного воздействия на биологически активные зоны поверхности тела человека и процессов регенерации при травмах и послеоперационного вмешательства. Техническим результатом является повышение эффективности воздействия и обеспечение безопасности при эксплуатации. Устройство содержит источник питания, генератор прямоугольных импульсов, узел установки частоты, формирователь импульсов высокого напряжения, выходы которого соединены с электродом воздействия и индифферентным электродом, узел установки амплитуды, блок световой стимуляции, конденсатор накопительный, ключ тока управления, узел установки длительности прямоугольных импульсов и коммутатор, выходы которого соединены с входами блока световой стимуляции, а первый вход — с первым выходом генератора, подключенного к первому входу формирователя импульсов высокого напряжения, второй вход которого через последовательно соединенные ключ тока управления и узел установки амплитуды соединен со вторым выходом генератора, подключенного первым и вторым входами к выходам соответственно узла установки частоты и узла установки длительности прямоугольных импульсов. При этом первый выход источника питания соединен с третьим входом генератора, вторыми входами узла установки амплитуды и ключа тока управления, а также входами узлов установки длительности прямоугольных импульсов и частоты, второй выход источника питания подключен ко второму входу коммутатора, накопительный конденсатор включен между выходами источника питания. Формирователь импульсов высокого напряжения конструктивно выполнен в виде индуктивного преобразователя на стальном магнитопроводе, обработанном и скрепленном склеивающим составом с добавлением магнитонаполнителя, с сопротивлением вторичной обмотки катушки преобразователя, подключенной ко входам блока электродов, не менее 500 Ом. 1 ил.
Устройство электроимпульсной и световой стимуляции, содержащее источник питания, генератор прямоугольных импульсов, узел установки частоты, формирователь импульсов высокого напряжения, выходы которого соединены с электродом воздействия и индифферентным электродом, узел установки амплитуды, блок световой стимуляции, конденсатор накопительный, ключ тока управления, узел установки длительности прямоугольных импульсов и коммутатор, выходы которого соединены с входами блока световой стимуляции, а первый вход — с первым выходом генератора, подключенного к первому входу формирователя импульсов высокого напряжения, второй вход которого через последовательно соединенные ключ тока управления и узел установки амплитуды соединен со вторым выходом генератора, подключенного первым и вторым входами к выходам соответственно узла установки частоты и узла установки длительности прямоугольных импульсов, при этом первый выход источника питания соединен с третьим входом генератора, вторыми входами узла установки амплитуды и ключа тока управления, а также входами узлов установки длительности прямоугольных импульсов и частоты, второй выход источника питания подключен ко второму входу коммутатора, накопительный конденсатор включен между выходами источника питания, формирователь импульсов высокого напряжения конструктивно выполнен в виде индуктивного преобразователя на стальном магнитопроводе, обработанном и скрепленном склеивающим составом с добавлением магнитонаполнителя, с сопротивлением вторичной обмотки катушки преобразователя, подключенной ко входам блока электродов, не менее 500 Ом.
