| Сиролимус | |
|---|---|
 |
|
 |
|
| Химическое соединение | |
| Брутто-формула | C51H79NO13 |
| CAS | 53123-88-9 |
| PubChem | 5284616 |
| DrugBank | 00877 |
| Состав | |
| Классификация | |
| АТХ | L04AA10 |
| Способы введения | |
| интраперитонеальная инъекция[d], перорально и Внутривенное вливание | |
| Другие названия | |
| Рапамицин | |
Сиролимус, рапамицин — иммунодепрессант[1], применяемый для предотвращения отторжений органов при трансплантации[2][3]; часто используется при трансплантациях почек [4]. Сиролимус предотвращает активацию T и B клеток, подавляя их ответ на интерлейкины-2 (IL-2). Активно используется при стентировании[5]. Также показал эффективность при лечении аутоиммунных заболеваний у мышей[6].
История[править | править код]
История рапамицина началась в 1965 году, когда канадская экспедиция изучала остров Пасхи (Рапа Нуи на местном) у горы Рано Кау и собирала образцы почв. Образцы были заморожены и часть их оказалась у компании Ayerst. В ней работал Сурен Сегал (Suren Sehgal [7]), который в 1972 году, через 7 лет, выделил бактерию Streptomyces hygroscopicus, которая выделяла вещество с противогрибковым эффектом. Вещество назвали рапамицин. Название препарата произошло от туземного названия этого острова «Rapa Nui»[8]. Сурен родился в Пакистане, его отец был владельцем фармацевтического завода и у Сурена был с детства интерес к препаратам. Еще в 16 он поступил в университет, а после окончания научной работы, переехал в Канаду.
Несколько лет длились исследования, было обнаружено его мощное воздействие на иммунитет и многое другое. Однако Ayerst не заинтересовалась этим препаратом, из-за финансовых вопросов в 1983 году начались сокращения и монреальская лаборатория была закрыта, а большинство сотрудников уволено.
Был приказ уничтожить имеющиеся биологические образцы при закрытии компании. Но Сурен Сегал нарушил приказ и принес домой пакет с образцами Streptomyces hygroscopicus, которые хранились в его холодильнике. Сегала перевели в лабораторию в Принстоне, а сверток переехал с ним в упаковке с сухим льдом. После смены менеждмента (Wyeth выкупила Ayerst в 1987 году), Сегал убедил руководство продолжить работу над этой бактерией. Видимо он нашел аргументы и в 1999 году рапамицин был одобрен FDA и в сентябре 1999 был выпущен под торговым названием Rapamune[9].
Механизм действия[править | править код]
Рапамицин ингибирует mTOR, связываясь со своим рецептором, цитоплазматическим белком FKBP12 (FK-binding protein 12), после чего этот комплекс узнает домен FRB (FKBP12-Rapamycin Binding domain) mTOR комплекса 1 (mTORC1). Это связывание приводит к дестабилизации mTORC1[10], который должен регулировать аутофагию, контроль трансляции, транскрипционную регуляцию и некоторые другие функции, связанные с клеточным ростом и выживанием.
Также сиролимус подавляет ответ на интерлейкин-2 и, таким образом, препятствует активации T и B клеток, а значит и иммунному ответу.
Использование[править | править код]
Предотвращение отторжения трансплантируемых органов[править | править код]
Основным преимуществом рапамицина перед кальциневриновыми ингибиторами является низкая токсичность по отношению к почкам. Пациенты, принимающие кальциневриновые ингибиторы в течение длительного времени, часто страдали ослаблением функций почек или даже хронической почечной недостаточностью. Этих синдромов удалось избежать, используя сиролимус вместо кальциневриновых ингибиторов. Особенно этот эффект был заметен при трансплантации почек больным с Гемолитикоуремическим синдромом, так как болезнь часто рецидивировала в случае использования кальциневриновых ингибиторов. Как бы то ни было, 7 октября 2008 года, FDA выпустило предупреждение[источник не указан 2806 дней] о возможных нарушениях почечных функций, вызванных употреблением рапамицина. Также возможными побочными эффектами использования сиролимуса могут быть замедление заживления постоперацинных ран и тромбоцитопения. По этим причинам многие медицинские центры предпочитают назначать рапамицин не сразу после трансплантации, а только по прошествии нескольких недель.
Использование при стентировании[править | править код]
Антипролиферативный эффект рапамицина также был использован для предотвращения рестеноза сосудов после их стентирования. Формирование слоя полимеризованного рапамицина на поверхности стентов уменьшает вероятность образования бляшек в стенированных сосудах и, следовательно, предотвращает их повторное сужение в период восстановления после операции. Тем не менее, предполагается, что такие стенты могут повышать вероятность риска сосудистого тромбоза.
Первые Сиролимус-выделяющие коронарные стенты начали выпускаться под маркой Cypher, сейчас выпускаются многими производителями.
Использование для биологических исследований[править | править код]
Рапамицин используется в биологических исследованиях как агент для химически индуцированной димеризации. Для димеризации белков используются клеточные линии, экспрессирующие два гибридных белка, один из которых содержит FRB домен, а другой- FKBP домен. Такие гибридные белки димеризуются только в присутствии рапамицина. Этот метод позволяет контролировать и изучать локализацию и взаимодействия белков.
Побочные эффекты[править | править код]
Интерстициальный пневмонит[править | править код]
Одним из побочных эффектов использования сиролимуса при легочной трансплантации является риск развития интерстициального пневмонита. Механизм этого явления пока недостаточно изучен.
Онкология[править | править код]
Как и любые иммунодепрессанты, рапамицин подавляет врожденные противораковые механизмы защиты нашего организма, что способствует развитию опухоли, которое было бы затруднено в обычных условиях. Есть данные, что у больных раком, принимавших рапамицин, скорость развития опухоли была выше, чем у больных с интактной иммунной системой. Тем не менее, многие научные работы указывают на то, что определенные дозы рапамицина могут усилить иммунный ответ организма на опухоли или даже вызвать их деградацию.
Диабетоподобные симптомы[править | править код]
Рапамицин способен ингибировать не только mTORC1 комплекс, но и родственный комплекс mTORC2. Нарушение функций mTORC2 может привести к «диабетоподобным» синдромам, таким как нечувствительность к инсулину и ухудшение переносимости глюкозы.
Биосинтез[править | править код]
Биосинтез рапамицина осуществляется двумя мультиферментными комплексами: поликетидсинтазой 1 (PKS) и нерибосомальной пептидил синтазой (NRPS). PKS состоит из трех ферментных комплексов: RapA, RapB и RapC, которые организованы так, что первые 4 стадии элонгации поликетидной цепи происходят в RapA, следующие 6 стадий в RapB, а последние 4 стадии, завершающие синтез линейного поликетида происходят в RapC. Далее линейный поликетид модифицируется NRPS. RapP комплекс присоединяет L-пипеколат к терминальному концу поликетида, и поликетид циклизуется с образованием промежуточного продукта прерапамицина[11]

Рис. 1: Доменная организация PKS с соответствующими интермедиатами

Рис. 2: Прерапамицин

Рис. 3: Последовательность стадий, необходимых для превращения прерапамицина в рапамицин
Далее прерапамицин (Рис. 2) претерпевает 5 превращений (Рис. 3), которые ведут к образованию окончательного продукта рапамицина. В начале, под действием RapI (SAM-зависимая O-метилтрансфераза (MTase)) прерапамицин O-метилируется по C39. Далее RapJ (цитохром P450 моноксигеназа) присоединяет карбонильную группу к C9. RapM, следующая MTase, O-метилирует C16. Далее RapN, ещё одна P450 моноксигеназа образует гидроксильную группу на C27, которая сразу же O-метилируется RapQ с получением рапамицина.
Исследования[править | править код]
Как было показано, сиролимус подавляет развитие кожной Саркомы Капоши у пациентов после пересадки почек. Есть данные, что рапамицин также может быть полезен при лечении туберозного склероза (TSC), врожденного заболевания, при котором у больных развиваются доброкачественные опухоли в мозгу, легких, почках, коже и других органах. Использование mTOR ингибиторов способствовало ремиссии TSC опухолей. По результатам исследований in vitro было высказано предположение, что рапамицин может подавлять распространение ВИЧ в организме, подавляя образование CCR5 рецепторов и способствуя аутофагии. В исследованиях на мышах было также замечено, что сиролимус препятствует развитию аутизма и болезни Альцгеймера.
Увеличение продолжительности жизни и жизнеспособности[править | править код]
В 2006 впервые было показано, что рапамицин продлевает жизнь эукариот[12]. Изначально такой эффект наблюдался на дрожжевых клетках. Было подтверждено, что эффект рапамицина определяется его влиянием на TOR киназу, так как другие ингибиторы TOR также приводили к увеличению продолжительности жизни клеток в стационарной фазе.
Исследования проведенные на мышах[править | править код]
В 2009 году в публикации журнала Nature было показано увеличение максимальной продолжительности жизни у мышей[13]. В эксперименте кормили рапамицином в количестве 14 ppm как молодых (9 месячных), так и уже пожилых (20 месячных — эквивалент 60 человеческим годам) особей. Так было показано, что наибольшая продолжительность жизни мышей, которым давали рапамицин, повысилась в среднем на 9 % у самцов и 14 % у самок[13].
Таким образом, рапамицин является первым фармакологическим агентом, для которого было показано, что он увеличивает продолжительность жизни млекопитающих. И как показали исследования[13][14][15] этот эффект не зависит от пола животного.
Связь со скоростью старения[править | править код]
Увеличение продолжительности жизни не обязательно говорит о том, что старение замедлилось. Другим объяснением может быть ингибирование сокращающих жизнь патологий, таких как, например, злокачественные опухоли. Часто мыши умирают именно от злокачественных опухолей. Попытка понять почему мыши, которым давали рапамицин, живут дольше, показала, что основной причиной смерти (более 70%) у мышей являются именно опухоли. И рапамицин увеличивает продолжительность жизни благодаря своим антираковым свойствам, замедляя и ингибируя образование новых опухолей и разрастание старых[16][17][18].
В ходе старения большинство тканей и систем органов подвергаются характерным молекулярным, структурным и функциональным изменениям.
Влияние на кровеносную систему[править | править код]
Оказалось, что принятие сиролимуса животными в течение относительно продолжительного времени (в течение 1 года в концентрации для которой было увеличение продолжительности жизни — 14 ppm) приводит к уменьшению объема и веса сердца[19]. Также рапамицин способствует увеличению количества эритроцитов у мышей, имеющих фенотип с уменьшенным количеством красных кровяных телец, причем, независимо от возраста[19].
Влияние на скелет и сухожилия[править | править код]
Существует несколько характерных изменений (снижение трабекулярной костной системы и прогрессирование кифозных изменений в позвоночнике[20], происходящих в скелете организма в ходе его старения. Изучение этих признаков старения показало, что, похоже, рапамицин не влияет на скелет в целом и кости в частности, зато значительно улучшает биомеханические свойства сухожилий[20][21].
Влияние на двигательную активность[править | править код]
В ходе старения у мышей уменьшается желание разведывать территорию и в общем снижается двигательная активность[14][22]. Опыты, проведенные над молодыми (7 месяцев) и зрелыми (18 месяцев) особями, показали, что у мышей, которым давали рапамицин, моторные функции оказываются на более высоком уровне, чем у тех, кому его не давали[14]. Причем, это улучшение мышечной активности наблюдается как у молодых, так и взрослых особей.
Влияние на зрение[править | править код]
У мышей с возрастом появляются проблемы со зрением, развивается катаракта в передней части глаза (65)[источник не указан 2806 дней]. Как показали исследования, рапамицин не способствует улучшению зрения у пожилых особей, а, возможно, даже негативно воздействует на конкретные черты строения глаза (меняет его плотность).
Влияние на иммунитет[править | править код]
Оказалось, что у мышей рапамицин каким-то образом может влиять на количество Т клеток, причем похоже, что он может противодействовать возрастному изменению в их количестве[19]. Если говорить более подробно, то рапамицин способен приводить к уменьшению числа CD25+ CD4+ и CD44hi T клеток и увеличивать γδ популяцию.
Влияние на метаболизм[править | править код]
Было показано, что рапамицин способен увеличивать дыхательный обмен по крайней мере в одной из исследованных когорт[19], что, несомненно, заслуживает внимания и дальнейших исследований.
Существуют данные, что мыши, которые в эксперименте потребляли меньшее количество калорий на протяжении определенного периода времени, в среднем жили дольше[источник не указан 2806 дней]. Поэтому некоторыми предполагается, что рапамицин замедляет общий метаболизм мышей, влияя на них также, как малокалорийные диеты. Для мышей, которые переходили на малокалорийную диету в возрасте 20 месяцев, наблюдался меньший эффект на продление средней продолжительности жизни, чем в случае с рапамицином. Не исключено, что рапамицин также может быть использован как антивозрастной препарат для пожилых людей; это удобно, так как не требует употребления препарата на протяжении всей жизни. Тем не менее, не стоит забывать, что высокие дозы рапамицина могут подавлять иммунную систему человека, делая его более подверженным инфекциям.
Влияние на обучение и память[править | править код]
Использование классического физиологического опыта (лабиринта Барнса), показало, что рапамицин улучшает обучаемость и укрепляет память генетически измененных мышей[21].
Исследования на собаках[править | править код]
В настоящее время проводится испытание влияния малых доз рапамицина на продолжительность жизни и здоровье собак в рамках исследовательского проекта «Dog Aging Project»[23][24].
Библиография[править | править код]
- Gibbons J.J., Abraham R.T., Yu K. Mammalian target of rapamycin: discovery of rapamycin reveals a signaling pathway important for normal and cancer cell growth (англ.) // Semin. Oncol. : journal. — 2009. — December (vol. 36 Suppl 3). — P. S3—S17. — doi:10.1053/j.seminoncol.2009.10.011. — PMID 19963098.
- Vézina C, Kudelski A, Sehgal SN (October 1975). «Rapamycin (AY-22,989), a new antifungal antibiotic». J. Antibiot. 28 (10): 721–6. doi:10.7164/antibiotics.28.721.PMID 1102508.
- Pritchard DI (2005). «Sourcing a chemical succession for cyclosporin from parasites and human pathogens». Drug Discovery Today 10 (10): 688–691. doi:10.1016/S1359-6446(05)03395-7. PMID 15896681.
- McAlister VC, Mahalati K, Peltekian KM, Fraser A, MacDonald AS. (June 2002). «A clinical pharmacokinetic study of tacrolimus and sirolimus combination immunosuppression comparing simultaneous to separated administration.». Ther Drug Monit. 24 (3): 346–50.doi:10.1097/00007691-200206000-00004. PMID 12021624.
- «Cypher Sirolimus-eluting Coronary Stent». Cypher Stent. Retrieved 2008-04-01.
- Shuchman M (2006). «Trading restenosis for thrombosis? New questions about drug-eluting stents». N Engl J Med 355 (19): 1949–52. doi:10.1056/NEJMp068234.PMID 17093244
- Delgado JF, Torres J, José Ruiz-Cano M, et al. (September 2006). «Sirolimus-associated interstitial pneumonitis in 3 heart transplant recipients». J. Heart Lung Transplant. 25 (9): 1171–4. doi:10.1016/j.healun.2006.05.013. PMID 16962483
Примечания[править | править код]
- ↑ http://www.cancer.gov/publications/dictionaries/cancer-drug?cdrid=42555 Архивная копия от 22 декабря 2015 на Wayback Machine NCI Drug Dictionary — sirolimus «A natural macrocyclic lactone produced by the bacterium Streptomyces hygroscopicus, with immunosuppressant properties.»
- ↑ Thomas E. Glover, Christopher J. E. Watson, Paul Gibbs, J. Andrew Bradley, Evangelia E. Ntzani. Conversion From Calcineurin to Mammalian Target of Rapamycin Inhibitors in Liver Transplantation: A Meta-Analysis of Randomized Controlled Trials // Transplantation. — 2015-12-04. — ISSN 1534-6080. — doi:10.1097/TP.0000000000001006. Архивировано 25 января 2018 года.
- ↑ Farzaneh Ashrafi, Shahrzad Shahidi, Zeinab Ebrahimi, Mojgan Mortazavi. Outcome of rapamycin therapy for post-transplant-lymphoproliferative disorder after kidney transplantation: case series // International Journal of Hematology-Oncology and Stem Cell Research. — 2015-01-01. — Т. 9, вып. 1. — С. 26—32. — ISSN 2008-3009. Архивировано 2 декабря 2017 года.
- ↑ http://apps.who.int/medicinedocs/en/d/Js2266e/3.6.html Архивная копия от 22 декабря 2015 на Wayback Machine «.. The Food and Drug Administration has approved sirolimus ..new immunosuppressant drug, to prevent acute organ rejection in patients receiving kidney transplants, to be taken in conjunction with ciclosporin and corticosteroids.»
- ↑ Anwer Habib, Vinit Karmali, Rohini Polavarapu, Hirokuni Akahori, Qi Cheng. Sirolimus-FKBP12.6 impairs endothelial barrier function through protein kinase C-α activation and disruption of the p120-vascular endothelial cadherin interaction // Arteriosclerosis, Thrombosis, and Vascular Biology. — 2013-10-01. — Т. 33, вып. 10. — С. 2425—2431. — ISSN 1524-4636. — doi:10.1161/ATVBAHA.113.301659. Архивировано 25 января 2018 года.
- ↑ Nicolas Prevel, Yves Allenbach, David Klatzmann, Benoit Salomon, Olivier Benveniste. Beneficial role of rapamycin in experimental autoimmune myositis // PloS One. — 2013-01-01. — Т. 8, вып. 11. — С. e74450. — ISSN 1932-6203. — doi:10.1371/journal.pone.0074450. Архивировано 25 января 2018 года.
- ↑ C. Vézina, A. Kudelski, S. N. Sehgal. Rapamycin (AY-22,989), a new antifungal antibiotic. I. Taxonomy of the producing streptomycete and isolation of the active principle // The Journal of Antibiotics. — 1975-10-01. — Т. 28, вып. 10. — С. 721—726. — ISSN 0021-8820. Архивировано 7 сентября 2017 года.
- ↑ rapamycin | drug | Britannica.com. Дата обращения: 18 декабря 2015. Архивировано 23 декабря 2015 года.
- ↑ Источник. Дата обращения: 18 декабря 2015. Архивировано 22 декабря 2015 года.
- ↑ Noriko Oshiro, Ken-ichi Yoshino, Sujuti Hidayat, Chiharu Tokunaga, Kenta Hara. Dissociation of raptor from mTOR is a mechanism of rapamycin-induced inhibition of mTOR function (англ.) // Genes to Cells. — 2004-04-01. — Vol. 9, iss. 4. — P. 359—366. — ISSN 1365-2443. — doi:10.1111/j.1356-9597.2004.00727.x. Архивировано 8 декабря 2015 года.
- ↑ T Schwecke, J F Aparicio, I Molnár, A König, L E Khaw. The biosynthetic gene cluster for the polyketide immunosuppressant rapamycin. (англ.) // Proceedings of the National Academy of Sciences. — 1995-08-15. — Vol. 92, iss. 17. — P. 7839–7843. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.92.17.7839.
- ↑ Mikhail V. Blagosklonny. Aging and immortality: quasi-programmed senescence and its pharmacologic inhibition // Cell Cycle (Georgetown, Tex.). — 2006-09-01. — Т. 5, вып. 18. — С. 2087—2102. — ISSN 1551-4005.
- ↑ 1 2 3 David E. Harrison, Randy Strong, Zelton Dave Sharp, James F. Nelson, Clinton M. Astle. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice (англ.) // Nature. — 2009-07-16. — Vol. 460, iss. 7253. — P. 392—395. — ISSN 0028-0836. — doi:10.1038/nature08221. Архивировано 25 мая 2021 года.
- ↑ 1 2 3 Richard A. Miller, David E. Harrison, C. M. Astle, Joseph A. Baur, Angela Rodriguez Boyd. Rapamycin, But Not Resveratrol or Simvastatin, Extends Life Span of Genetically Heterogeneous Mice // The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. — 2011-02-01. — Т. 66A, вып. 2. — С. 191—201. — ISSN 1079-5006. — doi:10.1093/gerona/glq178. Архивировано 25 января 2017 года.
- ↑ Richard A. Miller, David E. Harrison, Clinton M. Astle, Elizabeth Fernandez, Kevin Flurkey. Rapamycin-mediated lifespan increase in mice is dose and sex dependent and metabolically distinct from dietary restriction // Aging Cell. — 2014-06-01. — Т. 13, вып. 3. — С. 468—477. — ISSN 1474-9726. — doi:10.1111/acel.12194.
- ↑ Maria Comas, Ilia Toshkov, Karen K. Kuropatwinski, Olga B. Chernova, Alexander Polinsky. New nanoformulation of rapamycin Rapatar extends lifespan in homozygous p53−/− mice by delaying carcinogenesis // Aging (Albany NY). — 2012-10-29. — Т. 4, вып. 10. — С. 715—722. — ISSN 1945-4589. Архивировано 18 июня 2022 года.
- ↑ Mikhail V. Blagosklonny. Rapalogs in cancer prevention // Cancer Biology & Therapy. — 2012-12-01. — Т. 13, вып. 14. — С. 1349—1354. — ISSN 1538-4047. — doi:10.4161/cbt.22859.
- ↑ Vladimir N. Anisimov, Mark A. Zabezhinski, Irina G. Popovich, Tatiana S. Piskunova, Anna V. Semenchenko. Rapamycin Extends Maximal Lifespan in Cancer-Prone Mice // The American Journal of Pathology. — 2010-05-01. — Т. 176, вып. 5. — С. 2092—2097. — ISSN 0002-9440. — doi:10.2353/ajpath.2010.091050. Архивировано 4 мая 2022 года.
- ↑ 1 2 3 4 Frauke Neff, Diana Flores-Dominguez, Devon P. Ryan, Marion Horsch, Susanne Schröder. Rapamycin extends murine lifespan but has limited effects on aging // The Journal of Clinical Investigation. — 2013-08-01. — Т. 123, вып. 8. — С. 3272—3291. — ISSN 0021-9738. — doi:10.1172/JCI67674. Архивировано 14 мая 2016 года.
- ↑ 1 2 James M. Flynn, Monique N. O’Leary, Christopher A. Zambataro, Emmeline C. Academia, Michael P. Presley. [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4098908/ Late-life rapamycin treatment reverses age-related heart
dysfunction] // Aging cell. — 2013-10-01. — Т. 12, вып. 5. — С. 851—862. — ISSN 1474-9718. — doi:10.1111/acel.12109. Архивировано 6 мая 2021 года. - ↑ 1 2 J. Julie Wu, Jie Liu, Edmund B. Chen, Jennifer J. Wang, Liu Cao. Increased mammalian lifespan and a segmental and tissue-specific slowing of aging following genetic reduction of mTOR expression // Cell reports. — 2013-09-12. — Т. 4, вып. 5. — С. 913—920. — ISSN 2211-1247. — doi:10.1016/j.celrep.2013.07.030.
- ↑ John E. Wilkinson, Lisa Burmeister, Susan V. Brooks, Chi-Chao Chan, Sabrina Friedline. Rapamycin slows aging in mice // Aging cell. — 2012-08-01. — Т. 11, вып. 4. — С. 675—682. — ISSN 1474-9718. — doi:10.1111/j.1474-9726.2012.00832.x. Архивировано 8 сентября 2018 года.
- ↑ Creevy, Kate E.; Akey, Joshua M.; Kaeberlein, Matt; Promislow, Daniel E. L. (2022-02-02). “An open science study of ageing in companion dogs”. Nature. 602 (7895): 51–57. DOI:10.1038/s41586-021-04282-9. PMC 8940555. PMID 35110758.
- ↑ Dog Aging Project goal is to help both dogs and humans live longer, healthier lives. NIA (24 февраля 2022).
Ссылки[править | править код]
- Рапамицин замедляет старение у мышей — «Элементы», Александр Марков, 15.07.2009
Рапамун — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
П N013700/01
Торговое наименование препарата
Рапамун®
Международное непатентованное наименование
Сиролимус
Лекарственная форма
раствор для приема внутрь
Состав
Активное вещество: сиролимус 1 мг/мл.
Вспомогательные вещества: полисорбат 80 — 10,8 мг, фозал 50 ПГ — 993,2 мг (фосфатидилхолин, пропиленгликоль, моно- и диглицериды, этанол, жирные кислоты сои, аскорбил пальмитат).
Описание
Раствор от бледно-желтого до желтого цвета без видимых механических включений.
Фармакотерапевтическая группа
Иммунодепрессивное средство
Код АТХ
L04AA
Фармакодинамика:
Сиролимус ингибирует активацию Т-лимфоцитов за счет блокирования кальций-опосредованной и кальций-независимой внутриклеточной передачи сигнала.
Данные исследований свидетельствуют о том, что механизм действия сиролимуса отличается от механизма действия циклоспорина, такролимуса и других иммунодепрессантов. Согласно экспериментальным данным, сиролимус связывается со специфическим цитозольный белком — иммунофилином (FK-связывающим белком-12 — FKPB-12), комплекс FKPB-12-сиролимус подавляет активацию киназы «мишени рапамицина млекопитающих» (mTOR-mammalian Target of Rapamycin) и имеет принципиальное значение для развития клеточного цикла.
Ингибирование mTOR приводит к блокаде нескольких специфичных путей, по которым происходит передача сигнала. В конечном итоге ингибируется активация лимфоцитов, приводящая к иммунодепрессии.
Лимфангиолейомиоматоз включает инфильтрацию легочной ткани клетками подобными гладким мышцам (LAM клетки), которые содержат инактивирующие мутации гена туберозного склерозного комплекса (TSC). Потеря функции TSC гена активирует mTOR путь, приводящий к пролиферации клеток и выделению лимфангиогенетического фактора роста. Сиролимус ингибирует mTOR путь и, таким образом, пролиферацию LAM клеток.
Фармакокинетика:
После приема внутрь сиролимус быстро всасывается; при этом максимальная концентрация (Сmах) достигается приблизительно через один час после однократного приема здоровыми добровольцами, и приблизительно через два часа после повторного приема пациентами в стабильном клиническом состоянии после аллогенной трансплантации почки. Системная биодоступность сиролимуса при одновременном приеме с циклоспорином составляет приблизительно 14%. При последующем приеме средняя концентрация сиролимуса в крови увеличивается приблизительно в 3 раза.
Период полувыведения (t1/2) при повторном пероральном приеме препарата больными в стабильном клиническом состоянии после пересадки почки составил 62 ± 16 часов, а средние равновесные концентрации достигались через 5-7 дней. Коэффициент, отражающий соотношение концентрации в крови к концентрации в плазме (К/П), равняется 36. Это свидетельствует о том, что сиролимус в значительной степени накапливается в форменных элементах крови.
Сиролимус является субстратом как для изофермента системы цитохрома Р450 IIIA4 (CYP3A4), так и для Р-гликопротеина (P-gp). Сиролимус подвергается экстенсивному метаболизму посредством О-деметилирования и/или гидроксилирования. В крови определяются семь основных метаболитов, включая гидроксил-, диметил-, и гидроксидиметил-производные. Тем не менее, в крови человека сиролимус является основным компонентом препарата, который более чем на 90% определяет иммунодепрессивное действие препарата Рапамун®.
После однократного приема [14С]-сиролимуса здоровыми добровольцами основная часть (91,1%) препарата, меченного радиоизотопом, экскретировалась через кишечник, и лишь небольшая часть (2,2%) через почки.
У находящихся на диализе детей (со снижением скорости клубочковой фильтрации на 30-50%) 5-11 лет и 12-18 лет было отмечено, что среднее, нормализованное по массе тела, отношение клиренса к фильтрации (CL/F) выше в младшей возрастной группе (580 мл/час/кг), по сравнению со старшей возрастной группой (450 мл/час/кг), тогда как у взрослых соответствующее значение составляет 287 мл/час/кг. В пределах каждой возрастной группы отмечается изменчивость данного показателя в широких пределах.
У пациентов с нарушением функции печени от легкой до средней степени тяжести (класс А или В по классификации Чайлд-Пью) средние значения площади под кривой «концентрация-время» (AUC) и t1/2 сиролимуса были повышены, соответственно, на 61 и 43%, а среднее значение CL/F снижено на 33% по сравнению со здоровыми испытуемыми.
У пациентов с выраженным нарушением функции печени (класс С по классификации Чайлд-Пью) средние значения AUC и t1/2 сиролимуса были повышены, соответственно, на 210% и 170%, а среднее значение CL/F снижено на 67% по сравнению со здоровыми испытуемыми. Более длительный t1/2 сиролимуса в результате нарушения функции печени приводил к замедлению достижения его равновесного состояния в организме.
В группе пациентов с различной функцией почек — от нормальной до полностью отсутствующей (пациенты на гемодиализе) фармакокинетические параметры сиролимуса были сходными.
Клинические исследования сиролимуса не включали достаточное количество пациентов в возрасте старше 65 лет, поэтому невозможно оценить имеется ли разница в ответе на прием препарата у пожилых пациентов и пациентов молодого возраста.
Лимфангиолейомиоматоз
В клинических исследованиях у пациентов с лимфангиолейомиоматозом, получавших таблетки сиролимус в дозе 2 мг в день, после трех недель терапии медиана минимальной концентрации сиролимуса в цельной крови составляла 6,8 нг/мл (интерквартильный размах от 4,6 до 9,0 нг/мл; n=37). При контроле концентрации сиролимуса в крови (целевое значение концентрации 5-15 нг/мл), в конце 12 месяцев терапии, медиана концентрации была 6,8 нг/мл (интерквартильный размах от 5,9 до 8,9 нг/мл; n=37).
Показания:
Рапамун® предназначен для профилактики отторжения трансплантата у взрослых пациентов с низким или умеренным иммунологическим риском после трансплантации почки. Рекомендуется применять Рапамун® изначально в комбинации с глюкокортикостероидами и микроэмульсией циклоспорина в течение первых 2-3 месяцев после трансплантации. Терапия препаратом Рапамун® может быть продолжена в виде поддерживающей терапии совместно с глюкокортикостероидами только, если циклоспорин будет постепенно отменен.
Рапамун® показан для лечения пациентов с лимфангиолейомиоматозом.
Противопоказания:
Повышенная чувствительность к сиролимусу, его производным или другим компонентам препарата.
Аллергические реакции на арахис, сою.
Детский возраст до 18 лет (недостаточно опыта применения, имеются только ограниченные данные, см. раздел «Фармакокинетика»).
С осторожностью:
Следует соблюдать осторожность при одновременном применении сиролимуса и препаратов, влияющих на функцию почек.
Беременность и лактация:
Данные о применении препарата Рапамун® у беременных женщин отсутствуют. В период беременности Рапамун® следует применять лишь в тех случаях, когда предполагаемая польза для матери превышает возможный риск для плода.
Эффективную контрацепцию необходимо начинать до лечения препаратом Рапамун® и продолжать в период лечения, а также в течение 12 недель после его окончания.
Нет данных о поступлении сиролимуса в грудное молоко. Учитывая потенциальный риск для ребенка, во время лечения препаратом Рапамун® грудное вскармливание следует прекратить.
Способ применения и дозы:
Рапамун® предназначен только для приема внутрь.
Рапамун® нужно постоянно принимать либо одновременно с приемом пищи, либо между приемами пищи.
Рекомендуется принимать препарат Рапамун® через 4 часа после приема микроэмульсии циклоспорина.
При хранении в холодильнике во флаконе с раствором может появиться незначительное помутнение. Если это произошло, необходимо оставить препарат на некоторое время при комнатной температуре, после чего осторожно взболтать. Наличие помутнения не влияет на качество продукта.
Профилактика отторжения органов при трансплантации почки
Рапамун® должен назначаться только врачами, имеющими опыт иммуносупрессивной терапии и лечения пациентов при трансплантации органов.
Терапия должна проводиться в специально оборудованных учреждениях, укомплектованных соответствующими лабораторными и вспомогательными медицинскими ресурсами. Врач, ответственный за поддерживающую терапию, должен иметь полную информацию, необходимую для наблюдения за пациентом.
Взрослые
Начальная терапия (в течение 2-3 месяцев после трансплантации): при обычном режиме приема, как можно скорее после трансплантации, внутрь однократно применяют ударную дозу препарата Рапамун®, равную 6 мг, с последующим применением дозы в 2 мг один раз в день. Впоследствии дозу препарата Рапамун® подбирают индивидуально таким образом, чтобы минимальные концентрации в крови составляли от 4 до 12 нг/мл (хроматографический метод). Лечение препаратом Рапамун® продолжают на фоне одновременного постепенного снижения дозы глюкокортикостероидови микроэмульсии циклоспорина.
В течение первых 2-3 месяцев после трансплантации минимальные концентрации циклоспорина рекомендуется поддерживать в пределах 150-400 нг/мл (иммунный метод определения концентрации).
Поддерживающая терапия: через 4-8 недель после начала лечения циклоспорином его дозу следует постепенно снижать вплоть до полной отмены препарата, а дозу препарата Рапамун® подбирать таким образом, чтобы минимальные концентрации в крови составляли от 12 до 20 нг/мл (хроматографический метод). Рапамун® следует принимать вместе с глюкокортикостероидами.
Пациентам, у которых отмена циклоспорина оказалась неудачной либо невозможна, длительность совместной терапии циклоспорином и препаратом Рапамун® не должна составлять более 3 месяцев. В клинически оправданных ситуациях таким пациентам следует отменить Рапамун® и назначить альтернативный режим иммунодепрессии.
Отмена циклоспорина не изучалась у пациентов с острым отторжением трансплантата III степени по классификации Bnaff 93 или у пациентов с сосудистым отторжением, резвившихся до отмены циклоспорина. Также отмена циклоспорина не изучалась у пациентов, находящихся на диализе или у которых креатинин плазмы крови > 4,5 мг/дл, пациентов негроидной расы, при повторной трансплантации почки, при трансплантации нескольких органов или у пациентов с высоким титром панель-реактивных антител. Данных для применения сиролимуса у пациентов негроидной расы недостаточно.
Пожилые пациенты (старше 65 лет):
Опыт применения препарата Рапамун® у пациентов старше 65 лет недостаточен, чтобы определить, существуют ли различия в ответе на терапию между пациентами данной возрастной группы и более молодыми. У 35 пациентов старше 65 лет после пересадки почки минимальные концентрации сиролимуса не отличались от соответствующих концентраций у 822 пациентов от 18 до 65 лет. Результаты, полученные при применении препарата Рапамун® внутрь у 12 пациентов в возрасте старше 65 лет после трансплантации почек, также соответствовали результатам, полученным для взрослых пациентов (n=167) в возрасте от 18 до 65 лет.
Применение у пациентов с нарушениями функций почек: нет необходимости в изменении дозы у пациентов с нарушениями функции почек.
Применение у пациентов с нарушениями функций печени: при тяжелой печеночной недостаточности поддерживающую дозу препарата Рапамун® рекомендуется уменьшить примерно в два раза в связи с замедленным клиренсом препарата. Ударную дозу изменять не следует.
После изменения дозы или приема ударной дозы препарата Рапамун® у больных тяжелой печеночной недостаточностью, в связи с замедлением достижения равновесного состояния контроль концентрации препарата в крови необходимо проводить каждые 5-7 дней до тех пор, пока 3 последовательные определения концентрации сиролимуса не подтвердят достижения стабильного уровня.
Применение у пациентов с лимфапгиолейомиоматозом
Начальная доза Рапамун® для пациентов с лимфапгиолейомиоматозом — 2 мг в день. Минимальную концентрацию сиролимуса в цельной крови измеряют на 10-20 день с последующей коррекцией дозы препарата для поддержания концентрации в диапазоне 5-15 нгмл.
Для большинства пациентов корректировка дозы может осуществляться на основе следующей формулы: новая доза препарата Рапамун® = текущая доза х (желаемая концентрация/текущая концентрация). Частая коррекция дозы препарата Рапамун®, не основанная на равновесной концентрации препарата, может привести к передозировке или назначению недостаточной дозы, в связи с длительным периодом полувыведения сиролимуса.
После корректировки поддерживающей дозы препарата Рапамун®, пациент должен принимать эту дозу, по крайней мере, 7-14 дней, прежде чем будет проведена следующая коррекция дозы на основании контроля концентрации препарата в крови. При достижении стабильной дозы, контроль концентрации препарата в крови должен проводиться, по крайней мере, каждые три месяца.
Мониторинг терапевтической концентрации лекарственного средства:
у большинства пациентов, получавших 2 мг препарата Рапамун® через 4 часа после циклоспорина, минимальные концентрации сиролимуса в крови соответствовали заданному интервалу от 4 до 12 нг/мл (по данным хроматографического анализа).
Оптимальная терапия требует мониторинга терапевтической концентрации лекарственного средства у всех пациентов.
Концентрацию сиролимуса в крови необходимо контролировать особенно тщательно у следующих групп пациентов: (1) пациенты с нарушением функции печени; (2) в период одновременного применения индукторов или ингибиторов изофермента CYP3A4 и P-gp, а также после окончания их приема (см. раздел «Взаимодействие с другими лекарственными препаратами»); и/или (3) в случае резкого снижения дозы или отмены циклоспорина, поскольку для этих групп пациентов с наибольшей вероятностью потребуется коррекция дозы.
Для того чтобы минимизировать колебания концентрации сиролимуса, Рапамун® следует принимать через постоянныеинтервалы времени по отношению к циклоспорину, а именно через 4 часа после приема циклоспорина. В оптимальном случае подбор дозы препарата Рапамун® должен быть основан на более, чем однократном измерении минимальной концентрации, выполненном не ранее, чем через 5 дней после последнего изменения дозы.
После начала лечения раствором препарата Рапамун® пациент может продолжить терапию препаратом Рапамун® в таблетках при точном сохранении дозы. После перевода пациента на другую лекарственную форму или другой режим дозирования рекомендуется измерять минимальную концентрацию сиролимуса в течение 1- 2 недель.
После отмены циклоспорина рекомендуется поддерживать минимальную концентрацию сиролимуса в крови на уровне 12-20 нг/мл (хроматографический метод). Циклоспорин ингибирует метаболизм сиролимуса, поэтому если доза препарата Рапамун® не будет увеличена, концентрации сиролимуса после отмены циклоспорина снизятся. В среднем, доза препарата Рапамун® должна быть в 4 раза выше с учетом отсутствия фармакокинетического взаимодействия (2-кратное повышение) и повышенной потребности в иммунодепрессии в отсутствие циклоспорина (2-кратное повышение). Скорость повышения дозы препарата Рапамун® должна соответствовать скорости выведения циклоспорина после его отмены.
При необходимости коррекции дозы при поддерживающей терапии (после отмены циклоспорина), ее можно провести у большинства пациентов по следующей формуле: новая доза препарата Рапамун® = текущая доза х (желаемая концентрация/текущая концентрация).
Ударную дозу следует применять в дополнение к поддерживающей дозе, если требуется значительно увеличить минимальную концентрацию сиролимуса: ударная доза препарата Рапамун® = 3 х (новая поддерживающая доза — текущая поддерживающая доза).
Максимальная дневная доза препарата Рапамун® не должна превышать 40 мг. Если рассчитанная дневная доза превышает 40 мг из-за ударной дозы, ударную дозу следует принимать дольше 2 дней. Определение минимальной концентрации сиролимуса следует осуществлять, но крайней мере, через 3-4 дня после применения ударной дозы.
Расчет 24-часовой минимальной концентрации сиролимуса основан на результатах хроматографических методов.
Для измерения концентраций сиролимуса в крови использовали различные подходы. В настоящее время концентрации сиролимуса в крови измеряются как хроматографическими, так и иммуноферментными методами. Величины концентраций, полученные этими методами, не взаимозаменяемы. Используя иммуноферментные системы, следует всегда следовать рекомендациям производителя, чтобы скоррелировать полученные значения с таковыми, полученными стандартными хроматографическими методами. Все концентрации сиролимуса, приведенные в данном документе, были измерены методами хроматографии или пересчитаны в соответствующие эквивалентные величины. Для определения желаемой минимальной концентрации сиролимуса следует проводить корректировку в соответствии с используемыми методами.
Мониторинг терапевтических концентраций лекарственного средства не должен являться единственным ориентиром при подборе дозы сиролимуса. Особое внимание следует уделять клиническим симптомам, результатам гистологического исследования и лабораторным данным.
Инструкции по разведению
1) Снимите с флакона защитный колпачок — для этого сдавите колпачок с боков и поверните его. Вводите адаптер для шприца во флакон до тех пор, пока он не поравняется с верхним краем флакона. Не пытайтесь удалить уже введенный адаптер для шприца из флакона. Вставьте один из шприцев-дозаторов в отверстие адаптера (поршень шприца полностью опущен).
2) Наберите из флакона при помощи шприца-дозатора предписанное количество раствора препарата Рапамун® для перорального приема. Для этого осторожно потяните за поршень шприца-дозатора, пока нижняя граница черной линии поршня не сравняется с соответствующей отметкой на шприце дозаторе. При наборе раствора в шприц флакон должен находиться в вертикальном положении. Если в шприце-дозаторе появились пузырьки воздуха, возвратите раствор из шприца во флакон и повторите процедуру заново.
3) Точно отмеренное количество препарата Рапамун® перенесите с помощью шприца только в стеклянный либо пластиковый сосуд, содержащий как минимум, 60 мл воды либо апельсинового сока. Никакие другие жидкости, включая грейпфрутовый сок, не должны использоваться для разведения. Энергично перемешайте и сразу выпейте.
Повторно налейте в сосуд дополнительное количество воды или апельсинового сока, энергично перемешайте и сразу выпейте.
4) Вам может быть рекомендовано принимать препарат в определенное время дня. Если необходимо взять препарат с собой, наполните шприц- дозатор до соответствующей метки и наденьте на шприц-колпачок — при этом должен произойти щелчок (а). После этого поместите шприц-дозатор с надетым на него колпачком в футляр (б). Шприц с препаратом может храниться мри комнатной температуре (не превышающей 25 °С) или в холодильнике. Набранный в шприц препарат должен быть использован в 24 часов.
Шприц-дозатор и колпачок предназначены для одноразового использования, после чего их нужно выбросить.
Побочные эффекты:
1. Побочные действия, наблюдавшиеся при профилактике отторжения трансплантата после трансплантации почки.
Из побочных явлений наиболее часто (у > 10 % пациентов) встречались: тромбоцитопения, анемия, пирексия, повышение артериального давления, гипокалиемия, гипофосфатемия, инфекции мочевыводящего тракта, гиперхолестеринемия, гипергликемия, гипертриглицеридемия, боль в животе, лимфоцеле, периферические отеки, артралгия, акне, боль различной локализации, запор, диарея, тошнота, головная боль и повышение концентрации креатинина в плазме крови и лактатдегидрогеназы.
Частота проявления любого побочного эффекта может повышаться при увеличении минимальной концентрации сиролимуса в крови.
В приведенной ниже таблице указаны побочные явления, выявленные в ходе клинических исследований, а также зарегистрированные после выхода препарата на рынок. Перечисленные побочные явления классифицированы в соответствии с органной принадлежностью и частотой проявления и представлены в таблице в порядке уменьшения серьезности заболевания. В этот список включены лишь те побочные явления, которые, по крайней мере, предположительно могут иметь причинную взаимосвязь с терапией препаратом Рапамун®.
Большинство пациентов получали комбинированную иммунодепрессивную терапию, в состав которой входил Рапамун® и другие иммунодепрессанты.
Частота реакций распределена в соответствии с классификацией ВОЗ: очень частые (≥ 10%), частые (≥ 1% и < 10%), нечастые (≥ 0,1% и < 1%), редкие (≥ 0,01% и < 0,1%), очень редкие (< 0,01%), неизвестно — невозможно определить частоту на основании имеющихся данных.
Инфекционные и паразитарные заболевания:
очень частые — пневмония, грибковые, вирусные и бактериальные инфекции, Herpes simplex, инфекции мочевыводящих путей;
нечастые — инфекции вызванные микобактериями (включая туберкулез), инфекции, вызванные вирусом Эпштейна-Барр, энтероколит, вызванный Clostridium difficile;
частые — сепсис, пиелонефрит, ,цитомегаловирусные инфекции, Herpes zoster.
Доброкачественные, злокачественные и неуточнённые новообразования (включая кисты и полипы):
частые — рак кожи, сквамозноклеточная карцинома, базальноклеточная карцинома;
нечастые — лимфома/посттрансплантационные лимфопролиферативные нарушения, меланома.
Нарушения со стороны крови и лимфатической системы:
очень частые — тромбоцитопения, анемия, лейкопения;
частые — гемолитико-уремический синдром, нейтропения;
нечастые — панцитопения, тромбоцитопеническая пурпура.
Нарушения со стороны иммунной системы:
частые — реакции гиперчувствительности (включая ангионевротический отек, анафилактические и анафилактоидные реакции;
нечастые — эксфолиативный дерматит;
редкие — аллергический васкулит.
Нарушения со стороны обмена веществ и питания:
очень частые — гиперлипидемия (включая гиперхолестеринемию), гипертриглицеридемия, гипокалиемия, гипофосфатемия, гипергликемия, сахарный диабет, задержка жидкости.
Нарушения со стороны нервной системы:
очень частые — головная боль;
неизвестно — синдром задней обратимой энцефалопатии*.
Нарушения со стороны сердца:
очень частые — тахикардия;
частые перикардиальный выпот (включая гемодинамически значимые выпоты у детей и взрослых).
Нарушения со стороны сосудов:
очень частые — лимфоцеле, повышение артериального давления;
частые — венозный тромбоз (включая тромбоз глубоких вен);
нечастые — застой лимфы.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
частые — пневмонит, плевральный выпот, носовое кровотечение, легочная эмболия;
нечастые — легочное кровотечение;
редкие — альвеолярный протеиноз легких.
Нарушения со стороны желудочно-кишечного тракта:
очень частые — боль в животе, диарея, запор, тошнота;
частые — панкреатит, стоматит, асцит.
Нарушения со стороны печени и желчевыводящих путей:
неизвестно — печеночная недостаточность.
Нарушения со стороны кожи и подкожных тканей:
очень частые — сыпь, акне;
нечастые — эксфолиативный дерматит.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
очень частые — артралгия;
частые — остеонекроз.
Нарушения со стороны почек и мочевыводящих путей:
очень частые — протеинурия;
нечастые — нефротический синдром, очаговый сегментарный гломерулосклероз.
Нарушения со стороны половых органов и молочной железы:
очень частые — нарушения менструального цикла (включая аменорею и меноррагию);
частые — кисты яичников.
Общие расстройства и нарушения в месте введения:
очень частые — периферические отеки, пирексия, боль различной локализации, замедленное заживление ран, отеки.
Лабораторные и инструментальные данные:
очень частые — повышение активности лактатдегидрогеназы, повышение концентрации креатинина в плазме крови, повышение активности аланинаминотрансферазы и аспартатаминотрансферазы.
* побочные реакции, наблюдавшиеся при постмаркетинговом применении препарата.
Иммунодепрессия повышает риск развития лимфомы и других злокачественных новообразований кожи (см. раздел «Особые указания»).
Опубликованы данные о гепатотоксичности препарата Рапамун®. Риск гепатотоксичности может возрастать по мере повышения минимальной концентрации сиролимуса в крови. Имеются сообщения о редких случаях некроза печени с летальным исходом при превышении минимальной концентрации сиролимуса в крови.
Отмечались случаи интерстициальных заболеваний легких (в том числе, пневмонит и, нечасто, облитерирующий бронхиолит с организующейся пневмонией и фиброз легких), в некоторых случаях с летальным исходом при неидентифицированном возбудителе, у пациентов, получавших иммунодепрессивную терапию, включая Рапамун®. В некоторых случаях отмена препарата Рапамун® или снижение дозы приводили к устранению интерстициального легочного процесса. Риск заболевания может возрастать по мере повышения минимальной концентрации сиролимуса в крови.
Описаны случаи замедленного заживления ран после трансплантации, включая расхождение фасций, послеоперационные грыжи и разрыв анастомозов.
У некоторых больных на фоне лечения препаратом Рапамун® наблюдалось обратимое нарушение функциональной активности спермы.
У пациентов с замедленной функцией трансплантата прием сиролимуса может привести к замедлению восстановления функции почек.
В подгруппе пациентов с исходно сниженной скоростью клубочковой фильтрации (<40 мл/мин), а также у пациентов после трансплантации почки при переводе с терапии ингибиторами кальциневрина на сиролимус частота серьезных нежелательных явлений на фоне приема препарата Рапамун® была выше (включая пневмонию, реакцию острого отторжения трансплантата, гибель трансплантата и летальный исход).
Сообщалось о случаях развития кист яичников и нарушений менструального цикла (включая аменорею и менорагию). Пациенты с кистами яичников, сопровождающимися клиническими симптомами, подлежат дополнительному обследованию. Частота развития кист может быть выше во время пременопаузы, чем в постменопаузе. В некоторых случаях эти нарушения разрешались после отмены терапии препаратом Рапамун®.
Имеются сообщения о случаях нефропатии, ассоциированной с ВК вирусом и прогрессивной мультифокальной лейкоэнцефалопатии, ассоциированная с JC вирусом, у пациентов, получавших иммунодепрессанты, в том числе Рапамун®. Так как это данные, полученные в пострегистрационном периоде, точной информации о частоте развития этих реакций нет.
В исследовании, оценивающем безопасность и эффективность перехода с терапии такролимусом на Рапамун® через 3-5 месяцев после пересадки почки, наблюдались более высокая частота острого отторжения трансплантата и впервые выявленного сахарного диабета после перехода на терапию Рапамуном®.
2. Побочные действия, наблюдавшиеся у пациентов с лимфангиолейомиоматозом
Безопасность препарата оценивалась в контролируемом исследовании на 89 пациентах, больных лимфангиолейомиоматозом, 46 из которых получали Рапамун®. Побочные действия, наблюдавшиеся в этом исследовании, согласовывались с известным профилем безопасности препарата для показания профилактика отторжения трансплантата после трансплантации почки.
Нежелательные реакции, наблюдавшиеся с частотой >20% в группе пациентов, получавших Рапамун®, чаще, чем в группе плацебо, включали: стоматит, диарея, боль в животе, тошнота, назофарингит, акне, боль в груди, периферические отеки, инфекции верхних дыхательных путей, головная боль, головокружение, боль в мышцах, гиперхолестеринемия.
Дополнительно наблюдалось уменьшение веса, с большей частотой у пациентов, получавших Рапамун®, чем плацебо.
Передозировка:
В настоящее время информация о случаях передозировки минимальна. У одного пациента, принявшего 150 мг препарата Рапамун®, наблюдалась фибрилляция предсердий. В целом, проявления передозировки совпадают с дозозависимыми побочными явлениями, связанными с фармакологическим действием препарата, перечисленными в разделе «Побочное действие».
В случае передозировки рекомендуется проводить симптоматическое лечение. Учитывая малую растворимость сиролимуса в воде и высокий уровень связывания с эритроцитами и белками, предполагается, что Рапамун® не может быть в значимых количествах удален из организма с помощью диализа.
Взаимодействие:
В стенке кишечника и печени сиролимус подвергается экстенсивному метаболизму под действием изофермента CYP3A4. Кроме того, сиролимус является субстратом для локализованного в тонком кишечнике P-gp, осуществляющего выведение многих лекарственных средств. Поэтому вещества, воздействующие на эти белки, могут влиять на всасывание сиролимуса и его последующее выведение.
Ингибиторы изофермента CYP3A4 и P-gp (кетоконазол, вориконазол, итраконазол, телитромицин или кларитромицин) снижают метаболизм сиролимуса, что приводит к повышению его концентрации.
Индукторы изофермента CYP3A4 и P-gp (рифампицин или рифабутин) усиливают метаболизм сиролимуса, снижая его концентрацию.
Не рекомендуется применять сиролимус одновременно с мощными индукторами или ингибиторами изофермента CYP3A4 и P-gp.
Циклоспорин (субстрат и ингибитор изофермента CYP3A4 и P-gp): циклоспоринзначительно повышает скорость и степень всасывания сиролимуса.
Одновременный прием препарата Рапамун® в дозе 5 мг, затем 5 мг через 2 часа и 10 мг через 4 часа после применения 300 мг микроэмульсии циклоспорина приводил к увеличению AUC сиролимуса приблизительно до 183%, 141% и 80%, соответственно. Эффект действия циклоспорина проявился и в увеличении Сmax и tmax сиролимуса. Если сиролимус принимался за 2 часа до применения микроэмульсии циклоспорина, не отмечалось никакого влияния на AUC и Сmax сиролимуса. У здоровых добровольцев, получавших однократную дозу сиролимуса одновременно с циклоспорином (микроэмульсией) или с 4 часовым интервалом, фармакокинетика циклоспорина не изменялась. Рекомендуется применять Рапамун® через 4 часа после приема микроэмульсии циклоспорина.
Рифампицин (индуктор изофермента CYP3A4 и P-gp): многократный прием рифампицина снижал концентрацию сиролимуса в крови после однократного приема 20 мг препарата Рапамун® в виде раствора для приема внутрь. Рифампицин увеличивал клиренс сиролимуса приблизительно в 5,5 раз и уменьшал AUC сиролимуса и Сmax, приблизительно на 82 и 71%, соответственно. Не рекомендуется применять сиролимус одновременно с рифампицином.
Кетоконазол (ингибитор изофермента CYP3A4 и P-gp): повторный прием кетоконазола значительно изменял скорость, степень всасывания и воздействие сиролимуса: о чем свидетельствовало 4,4-, 1,4- и 10,9-кратное увеличение, соответственно, Сmax, tmax и AUC. Не рекомендуется применять сиролимус одновременно с кетоконазолом.
Вориконазол (ингибитор изофермента CYP3A4): при одновременном применении здоровым добровольцам сиролимуса (2 мг однократно) и вориконазола (внутрь по 400 мг каждые 12 часов в первый день, затем по 100 мг каждые 12 часов в течение 8 дней) отмечалось в среднем 7-кратное повышение Сmax и 11-кратное увеличение AUC сиролимуса. Не рекомендуется применять сиролимус одновременно с вориконазолом.
Дилтиазем (субстрат и ингибитор изофермента CYP3A4 и P-gp): при одновременном приеме 10 мг препарата Рапамун® в форме раствора для приема внутрь и 120 мг дилтиазема биодоступность сиролимуса значительно повышалась. Cmax, tmax и AUC сиролимуса увеличивались, соответственно, в 1,4, 1,3 и 1,6 раз. Сиролимус не изменял фармакокинетику дилтиазема и его метаболитов — дезацетилдилтиазема и десметилдилтиазема. При применении дилтиазема необходимо контролировать концентрацию сиролимуса в крови и при необходимости корректировать дозу препарата.
Верапамил (ингибитор изофермента CYP3A4): при применении многократных доз верапамила и сиролимуса в форме раствора для приема внутрь скорость и степень всасывания обоих соединений значительно изменялась. Cmax, tmax и AUC сиролимуса в цельной крови увеличивались, соответственно, в 2,3, 1,1 и 2,2 раза. Значения Сmax, и AUC S-(-) верапамила в плазме крови увеличивались в 1,5 раза, a tmax сокращалось на 24%. Необходимо контролировать концентрацию сиролимуса и, при необходимости, снижать дозы обоих лекарственных средств.
Эритромицин (ингибитор изофермента CYP3A4): при применении повторных доз эритромицина и сиролимуса в форме раствора для приема внутрь скорость и степень всасывания обоих соединений значительно увеличивалась. Cmax, tmax и AUC сиролимуса в цельной крови увеличивались, соответственно, в 4,4, 1,4 и 4,2 раза. Cmax, tmax и AUC эритромицина в плазме крови увеличивались, соответственно, в 1,6, 1,3 и 1,7-раза. Необходимо контролировать концентрацию сиролимуса и, при необходимости, снижать дозы обоих препаратов.
Пероральные контрацептивы: не наблюдалось клинически значимого фармакокинетического взаимодействия между сиролимусом и 0,3 мг норгестрела/0,03 мг этинилэстрадиола. Хотя результаты исследования взаимодействия однократной дозы препарата Рапамун® и перорального контрацептива свидетельствуют об отсутствии фармакокинетического взаимодействия, при длительном лечении препаратом Рапамун® нельзя исключить возможных изменений фармакокинетики, которые могут отразиться на эффективности перорального контрацептива.
Другие возможные взаимодействия: умеренные и слабые ингибиторы изофермента CYP3A4 могут снижать метаболизм сиролимуса и повышать концентрацию сиролимуса в крови (например, блокаторы «медленных» кальциевых каналов: никардипин; противогрибковые средства: клотримазол, флуконазол, итраконазол, вориконазол; антибиотики: тролеандомицин, телитромицин, кларитромицин; и другие вещества: бромокриптин, циметидин, даназол, ингибиторы протеаз: ритонавир, андинавир, боцепревир и телапревир).
Индукторы изофермента CYP3A4 могут ускорять метаболизм сиролимуса и снижать концентрацию сиролимуса в крови (например, лекарственное растение Зверобой продырявленный — Hypericum perforatum; противосудорожные средства: карбамазепин, фенобарбитал, фенитоин).
Хотя in vitro сиролимус ингибирует активность изоферментов микросомальной системы цитохрома Р450 у человека (изоферменты CYP2C9, CYP2C19, CYP2D6, CYP3A4/5), подавление активности этих изоферментов in vivo маловероятно, поскольку для этого концентрации сиролимуса должны быть значительно выше, чем у пациентов, получающих препарат в терапевтических дозах. Ингибиторы P-gp могут уменьшать высвобождение сиролимуса из клеток кишечника и способствовать повышению его концентрации в крови.
Грейпфрутовый сок уменьшает метаболизм, опосредованный изоферментом CYP3A4, и потенциально усиливает обратный транспорт из энтероцитов в полость тонкого кишечника, опосредованный P-gp и, следовательно, его не следует употреблять во время приема препарата Рапамун®.
Фармакокинетическое взаимодействие может наблюдаться с желудочно-кишечными прокинетическими средствами, такими как цизаприд, метоклопрамид.
Не наблюдалось клинически значимого фармакокинетического взаимодействия сиролимуса с ацикловиром, аторвастатином, дигоксином, глибенкламидом, метилпреднизолоном, нифедипином, преднизолоном и триметопримом/ сульфаметоксазолом.
При одновременном применении препарата Рапамун® с ингибиторами кальциневрина возможно повышение риска гемолитико-уремического синдрома/ тромботической тромбоцитопенической пурпуры/тромботической микроангиопатии, индуцируемых ингибиторами кальциневрина.
Особые указания:
К настоящему времени не получено достаточно данных о применении препарата Рапамун® у больных с высоким иммунологическим риском, поэтому его применение у таких пациентов не рекомендуется. Имеется исследовательский опыт по применению сиролимуса совместно со следующими лекарственными средствами: такролимусом, циклоспорином, азатиоприном, микофенолатом мофетила, глюкокортикостероидами и цитотоксическими антителами.
Комбинации препарата Рапамун® с другими иммунодепрессивными препаратами изучены недостаточно.
Так как период полувыведения у сиролимуса длительный, частые коррекции дозы препарата Рапамун®, основанные не на равновесной концентрации препарата, могут привести к передозировке препарата или применению слишком маленькой дозы. Применение сиролимуса, микофенолата мофетила и глюкокортикостероидов в комбинации с антителами к интерлейкин (IL)-2 рецепторам не рекомендуется при пересадке почечного трансплантата de novo.
Иммунодепрессанты могут оказывать влияние на эффективность вакцинации. Во время лечения иммунодепрессантами, включая Рапамун®, вакцинация может быть менее эффективна. В период лечения препаратом Рапамун® следует избегать применения живых вакцин.
У пациентов с нарушением функции печени следует тщательно контролировать уровень минимальной концентрации сиролимуса в крови. Учитывая удлиненный t1/2 препарата у этой категории пациентов после изменения дозы или приема ударной дозы препарата Рапамун® контроль концентрации препарата в крови необходимо проводить до достижения ее стабильного уровня (см. раздел «Способ применения и дозы»).
У пациентов с тяжелой печеночной недостаточностью рекомендуется снижение поддерживающей дозы на половину, что определяется уменьшением клиренса.
Снижение устойчивости к инфекциям и предрасположенность к развитию лимфомы и других злокачественных заболеваний, в особенности кожи, может быть следствием угнетения иммунной системы.
Необходимо принимать меры предосторожности, обычные для пациентов с повышенным риском рака кожи: ограничивать воздействие солнечного и ультрафиолетового излучения с помощью защитной одежды и использования кремов с высоким солнцезащитным эффектом.
В результате чрезмерного угнетения иммунной системы возможно повышение восприимчивости к инфекциям, в том числе к инфекциям, вызываемым условно патогенными микроорганизмами, вероятные последствия которых, сепсис и летальный исход, отмечены в разделе «Побочное действие».
В числе данных состояний нефропатия, ассоциированная с ВК вирусом и прогрессивная мультифокальная лейкоэнцефалопатия, ассоциированная с JC вирусом. Эти инфекции часто связаны с высокой иммуносупрессивной нагрузкой и могут приводить к тяжелым или летальным состояниям. Врачи должны иметь это в виду при проведении дифференциальной диагностики у пациентов с пониженным иммунитетом и нарушением функции почек или неврологическими симптомами.
Поскольку безопасность и эффективность препарата Рапамун®, в качестве иммунодепрессивной терапии пациентов с печеночными и легочными трансплантатами, не установлена, препарат не рекомендуется применять у данных групп пациентов.
В клиническом исследовании применение сиролимуса в комбинации с такролимусом у пациентов с трансплантированной de novo печенью в некоторых случаях было связано с повышенной смертностью и потерей трансплантата. У многих из этих пациентов обнаруживались признаки инфекционного процесса незадолго до летального исхода.
В том же исследовании, а также в другом исследовании с участием пациентов с трансплантированной de novo печенью применение сиролимуса совместно с циклоспорином или такролимусом сопровождалось повышением частоты тромбоза печеночной артерии, в большинстве случаев приводившего к потере трансплантата или летальному исходу. Случаи тромбоза печеночной артерии наблюдались в течение 30 дней после трансплантации.
Сообщалось о нарушении или замедлении заживления ран у больных на фоне приема препарата Рапамун®, особенно часто у пациентов, индекс массы тела которых превышает 30 кг/м2 (лимфоцеле, расхождение краев раны).
Имеются сообщения о расхождении краев бронхиального анастомоза у пациентов с трансплантированными de novo легкими, в большинстве случаев с летальным исходом, при применении сиролимуса в составе иммунодепрессивной терапии.
У пациентов, получавших Рапамун®, описаны случаи задержки жидкости, в частности, периферические отеки, застой лимфы, плевральный выпот и экссудативный перикардит (включая гемодинамически значимые выпоты у детей и взрослых).
При применении сиролимуса отмечались аллергические реакции, такие, как анафилактические/анафилактоидные реакции, эксфолиативный дерматит, ангионевротический отек и васкулит.
Одновременное применение препарата Рапамун® с ингибиторами ангиотензин-превращающего фермента (АПФ) приводило к развитию реакций по типу ангионевротического отека. Повышенный уровень сиролимуса (при одновременном применении ингибиторов АПФ или без их применения) может также усиливать ангиневротический отек (см. раздел «Взаимодействие с другими лекарственными препаратами»). В некоторых случаях ангионевротический отек разрешался после прекращения применения Рапамуна® или снижения дозы препарата.
Имеются сообщения о случаях пневмонии, вызванной Pneumocystis carinii у пациентов, не получавших антимикробной профилактики. В связи с этим, в течение первых 12 месяцев после трансплантации необходимо проводить антимикробную профилактику, направленную против Pneumocystis carinii. В течение 3 месяцев после трансплантации целесообразна профилактика цитомегаловирусной инфекции.
Применение препарата Рапамун® у больных после пересадки почки сопровождалось повышением концентрации холестерина и триглицеридов в сыворотке, в некоторых случаях требовавшим медикаментозной коррекции. Пациенты, получающие Рапамун®, нуждаются в контроле с целью выявления возможной гиперлипидемии. В случае если гиперлипидемия установлена, следует принять соответствующие меры, включающие диету, физические упражнения и прием препаратов, снижающих концентрацию холестерина. Перед применением иммунодепрессантов, включая Рапамун®, а также при решении вопроса о продолжении лечения препаратом Рапамун® пациентов с тяжелой стойкой гиперлипидемией необходимо оценить соотношение риска и пользы данного вида терапии.
У пациентов с задержкой функции трансплантата, применение сиролимуса может отсрочить восстановление функции ночек.
Отмечена хорошая переносимость препарата Рапамун® в сочетании с ингибиторами ГМГ-КоА редуктазы и/или фибратами. В период лечения препаратом Рапамун® в комбинации с ингибиторами ГМГ-КоА редуктазы или фибратами необходимо наблюдать за пациентами в связи с возможным развитием рабдомиолиза и других побочных эффектов, описанных в инструкциях по медицинскому применению этих лекарственных средств.
При совместном применении препарата Раиамун® и циклоспорина необходимо осуществлять мониторинг состояния пациента на предмет развития рабдомиолиза и нарушения функции почек. Необходимо иметь в виду, что для пациентов с повышенной концентрацией креатинина в сыворотке крови потребуется коррекция схемы лечения иммунодепрессантами. Необходимо соблюдать осторожность при одновременном применении с другими лекарственными средствами, неблагоприятно влияющими на функцию почек.
У пациентов, получавших терапию препаратом Рапамун® и циклоспорином больше 3 месяцев, отмечались более высокие концентрации креатинина в сыворотке и более низкий уровень клубочковой фильтрации, по сравнению с пациентами контрольной группы, получавшими циклоспорин и плацебо или циклоспорин и азатиоприн. У пациентов после успешной отмены циклоспорина отмечалась более низкая концентрация креатинина в сыворотке и более высокий уровень клубочковой фильтрации, а также меньшая частота развития злокачественных опухолей по сравнению с пациентами, продолжавшими получать циклоспорин. До получения дополнительных клинических данных не рекомендуется совместное применение циклоспорина и препарата Рапамун® в качестве поддерживающей терапии.
Безопасность и эффективность применения препарата Рапамун® при первичном применении без ингибиторов кальциневрина не изучена у пациентов с трансплантированной почкой. В двух мультицентровых клинических исследованиях у пациентов с трансплантированной de novo почкой, получающих лечение препаратом Рапамун®, микофенолагом мофетила, глюкокортикостероидами и антагонистами рецепторов IL-2, отмечается значительно более высокая частота случаев острого отторжения трансплантата и более высокая частота летальных исходов, по сравнению с пациентами, получающими ингибиторы кальциневрина, микофенолат мофетила, глюкокортикостероидами и антагонистами рецепторов IL-2. С точки зрения влияния на почечную функцию не было отмечено видимого улучшения при первичной терапии препаратом Рапамун® без одновременного применения ингибиторов кальциневрина. Следует учитывать, что в одном из двух исследований применяли сокращенный курс терапии даклизумаба.
Рекомендуется осуществлять периодический контроль уровня экскреции белков в моче. В клинических исследованиях отмечали повышение концентрации белка в моче после перевода пациентов с кальциневрина на препарат Рапамун®. Обычно такое повышение отмечалось в течение 6-24 месяцев после изменения терапии по сравнению с пациентами, которые продолжали терапию ингибиторами кальциневрина.
Нефротический синдром был выявлен у 2% пациентов в клинических исследованиях. Безопасность и эффективность перевода пациентов с ингибиторов кальциневрина на препарат Рапамун® не были установлены. Одновременное применение препарата Рапамун® с ингибиторами кальциневрина может повысить риск кальциневрин индуцированного гемолитического уремического синдрома/тромботической тромбоцитопенической пурпуры.
Совместное применение сиролимуса с сильными ингибиторами CYP3A4 (такими как кетоконазол, вориконазол, итраконазол, телитромицин или кларитромицин) или индукторов CYP3A4 (например, рифампицина, рифабутина) не рекомендуется.
Следует учитывать, что Рапамун® содержит этанол. Это может представлять угрозу для людей, страдающих алкоголизмом, беременных и кормящих женщин. Следует также учитывать этот факт при лечении пациентов из групп высокого риска, а именно: с заболеваниями печени или эпилепсией. Алкоголь также может изменить или усилить эффект других лекарственных препаратов.
Влияние на способность управлять транспортными средствами и механизмами:
Исследования по изучению влияния на способность к управлению транспортными средствами и использованию механизмов не проводились.
Форма выпуска/дозировка:
Раствор для приема внутрь, 1 мг/мл.
Упаковка:
По 60 или 150 мл препарата во флаконы темного стекла.
По 1 флакону в комплекте с 1 адаптером для шприца помещают в картонную пачку, которую в комплекте с 30 желтыми пластиковыми шприцами-дозаторами и колпачками к шприцам, 1 футляром для шприца вместе с инструкцией по применению помещают в картонную коробку.
Условия хранения:
При температуре от 2 до 8 °С.
Хранить в месте недоступном для детей.
Срок годности:
3 года в оригинальной упаковке.
30 дней после вскрытия флакона.
Не использовать после даты истечения срока годности, указанной на упаковке.
Условия отпуска
По рецепту
Производитель
Вайет Фармасьютикалз, New Lane Havant, Hampshire P09 2NG, United Kingdom, Соединенное Королевство
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Пфайзер Инк
Купить Рапамун в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
- Research
- Open Access
- Published: 12 August 2015
- Nur Farrah Dila Ismail1,3,
- Nik Mohamad Ariff Nik Abdul Malik1,3 &
- …
- Z. A. M. H. Zabidi-Hussin2,3
Orphanet Journal of Rare Diseases
volume 10, Article number: 95 (2015)
Cite this article
-
4321 Accesses
-
15 Citations
-
5 Altmetric
-
Metrics details
Abstract
Background
Rapamycin has gained significant attention for its potential activity in reducing the size of TSC-associated tumors, thus providing alternative to surgery. This study aimed at determining the efficacy of rapamycin and rapalogs for reducing the size of TSC-associated solid tumors in patients with Tuberous Sclerosis Complex (TSC).
Methods
Our data sources included electronic searches of the PubMed. We included into our meta-analysis any type of non-randomized study that reported the use of rapamycin and rapalogs for reducing the size of TSC-associated solid tumors in patients with TSC. Data was entered into Cochrane Review Manager Version 5.3 and analyzed.
Results
Four case reports and 4 clinical trials were included. Five patients from the case reports (all with SEGA) and 91 patients from the clinical trials (41 with SEGA, 63 with kidney angiomyolipoma and 5 with liver angiomyolipoma) were included into the analysis. Volume and diameter of SEGAs were significantly reduced by mean difference of 1.23 cc (95 % CI −2.32 to −0.13; p = 0.03) and 7.91 mm (95 % CI −11.82 to −4.01; p < 0.0001), respectively. Volume and mean of sum of longest diameter of kidney angiomyolipomas were significantly reduced by mean difference of 39.5 cc (95 % CI −48.85 to −30.15; p <0.00001) and 69.03 mm (95 % CI −158.05 to 12.65; p = 0.008), respectively. In liver angiomyolipomas, however, reduction in tumor size was not evident. Sum of longest diameter of liver angiomyolipomas in 4 patients were enlarged by 2.7 mm (95 % CI 28.42 to −23.02) by the end of treatment, though not significant (p = 0.84).
Conclusions
Rapamycin and rapalogs showed efficacy towards reducing the size of SEGA and kidney angiomyolipoma but not liver angiomyolipomas. This finding is strengthening the conclusion of our Cochrane systematic review on the randomized trials.
Background
Tumor development is a hallmark in the pathogenesis and diagnosis of Tuberous Sclerosis Complex (TSC). Nine out of 11 major clinical features in TSC diagnosis constitute the appearance of tumor structures [1]. A significant portion of TSC patients showed tumor development. Cortical tubers (CT) occur in 80–90 % [2, 3], subependymal nodules (SEN) in 90 % [4] and subependymal giant cell astrocytoma (SEGA) in 5–20 % of TSC patients. CT has been associated with seizures and developmental delays [5–7], while SEN is normally dormant but may develop into SEGA which potentially causes ventricular obstruction, visual impairment, focal neurologic deficits and endocrinopathies [4, 8].
Kidney angiomyolipoma occurs in 75 % of TSC patients and is a frequent cause of death due to haemorrhage [9]. Another frequent cause of death among TSC patients is pulmonary lymphangioleiomyomatosis (LAM) which occur in 40 % premenopausal females with TSC [10, 9]. Cardiac rhabdomyoma is also commonly found in TSC patients, although generally regress with increasing age [11]. Tumors may also manifest in the skin in the forms of angiofibromas and other cutaneous fibromas [11].
Development of hamartomatous tumors in TSC patients is related to the mTOR (mammalian target of rapamycin) pathway that acts as a central regulator of many functions, including cell size/growth and proliferation. mTOR combines with several other cellular components to form two distinct complexes, termed mTORC1 and mTORC2 [12], of which only mTORC1 is inhibited by rapamycin and rapalogs. Nutrient stimulation stimulates mTORC1 through activation of PI3 kinase (PI3K) and inhibition of Hamartin/Tuberin Complex. Upregulation of mTORC1 activates S6 kinase1 (S6K1) and ribosomal S6 kinase (rS6), and inhibits eukaryotic translation initiation factor 4E-binding protein 1 (4EBP1) and eukaryotic initiation factor 4E (eIF4E), which results in cell growth and proliferation. (Reviewed in [13]). Figure 1 illustrates the mTOR pathway and mTOR inhibition through rapamycin-FKBP12 complex.
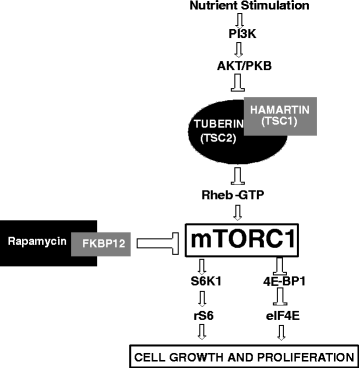
mTOR pathway and inhibition of mTOR through Rapamycin-FKBP12 complex
Full size image
mTOR kinase inhibition was thought to be a useful approach to systemic therapy for TSC and/or LAM because rapamycin, an mTOR inhibitor, has been shown to normalize dysregulated mTOR signaling in cells that lack normal hamartin or tuberin [14–19].
Rapamycin (otherwise known as sirolimus) is an inhibitor of mTOR. In fact, rapamycin sensitivity has been used as the major criterion to identify mTOR-controlled events [20]. Rapamycin (C51H79NO13) is a macrolide compound that was isolated in 1975 from Streptomyces hygroscopicus found in a soil sample on Easter Island. It prevents activation of T cells and B cells by inhibiting their response to interleukin-2 (IL-2). It is an FDA-approved drug for immunosuppression after organ transplantation. Rapamycin also possesses both antifungal and antineoplastic properties [21].
The mechanism by which rapamycin inhibits mTOR is not fully understood but rapamycin associates with FKBP12 to bind to the FRB (FKBP12–rapamycin-binding) domain of mTOR. Binding of the rapamycin–FKBP12 complex to mTOR can destabilize the mTORC1 complex and interfere with the activation of mTOR by phosphatidic acid. Several new compounds are available to inhibit mTOR, either by interfering with complex formation (FKBP12-dependent or FKBP12-independent) or by directly inhibiting the catalytic domain of mTOR [22].
A previous study utilizing cohorts of Tsc2
+/−mice and mouse model of Tsc2-null tumors showed that treatment with an mTOR kinase inhibitor (CCI-779, a rapamycin analogue) reduced the severity of TSC-related disease without significant toxicity [23].
Everolimus, a rapamycin analogue, has been studied in multiple randomized controlled trials for various indications with mostly promising efficacy and safety results such as in de-novo liver transplant patients [24], cardiology patients [25, 26], patients with metastatic renal cell carcinoma [27, 28], patients with neuroendocrine tumors (NET) [29, 30] and breast cancer [31].
A high proportion of tumor manifestations increasingly correspond with the morbidity and mortality due to tumor development in TSC patients. Previous non-human studies have shown the potential application of rapamycin and rapalogs for TSC. Our Cochrane Systematic Review on the randomized studies have shown that there is a significant increase in the proportion of patients who achieved 50 % reduction in tumor size within the subjects group that received rapamycin and rapalogs (Protocol published [32]). However, we have been unable to measure the rapamycin and rapalogs effect on the absolute tumor size, as this latter outcome was only reported in non-randomized studies. Here we analyzed rapamycin and rapalogs effect on the absolute tumor size in patients with Tuberous Sclerosis Complex.
Methods
There is no published protocol for this systematic review. This systematic review was checked for completeness based on PRISMA 2009 Checklist [33].
Criteria for considering studies for this review
Types of studies
All types of published non-randomized studies (as defined in the Cochrane Handbook version 5.1 [34]) using English language and encountered online through PubMed searches were analyzed.
Types of participants
People with known TSC-associated SEGA, kidney angiomyolipoma and/or liver angiomyolipoma as proven by the clinical features designated in the 2012 consensus diagnostic criteria for TSC and/or TSC-causing mutations in either TSC1 or TSC2 gene [1]. Studies and/or participants without solid tumors or non-TSC-associated tumors were excluded.
Types of interventions
Any rapamycin or its analogues (rapalogs) designed to reduce the size of TSC-associated tumors in patients with Tuberous Sclerosis Complex
Types of outcome measures
We chose tumor volume or diameter as primary outcome. We also reported adverse effects whenever they are described as related to the rapamycin and rapalogs administration.
Search methods for identification of studies
Electronic searches in PubMed used keywords “TSC AND [SEGA OR kidney angiomyolipoma OR liver angiomyolipoma] AND [rapamycin OR sirolimus OR tacrolimus OR everolimus]”. All published articles and abstracts were searched. The search was limited to reports on human studies using English language.
Data collection and analysis
Statistical analysis
Available data (mean and standard deviation of each cohort study and pooled case reports) was entered into Cochrane Review Manager Version 5.3 [35] for analysis of treatment effects.
Selection of studies
Studies were selected according to the criteria for considering studies for this review, as described above. Please refer to the PRISMA diagram illustrating the study selection (Fig. 2).
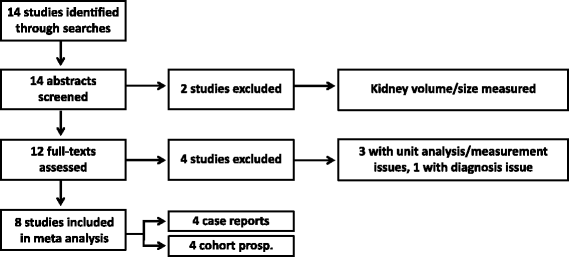
Study flow diagram (based on The PRISMA Statement [33])
Full size image
Data extraction
Data was extracted using the specially designed data acquisition form as used in the Cystic Fibrosis and Genetic Disorders Group of The Cochrane Collaboration. The following items were extracted : type of study, participants and trial characteristics (single/multi-center, countries, eligibility, number of participants in the study, number of participants included in this review), intervention details (type of rapamycin or rapalogs, administering dose, trough level, duration of treatment, median or range of follow-up), outcomes (tumor volume and/or diameter) and rapamycin-related adverse effects.
Risk of bias assessment
The risk of bias of each included study was assessed using the 8-item Newcastle-Ottawa Scale for observational studies [36].
Measures of treatment effect
We recorded continuous data such as tumor volumes or diameter as mean baseline and post treatment values and standard deviation (SD) for each group. We calculated a pooled estimate of the treatment effect at the end of each core length of treatment for each outcome across studies by determining the mean difference. We pooled outcome data from case reports into one group.
Assessment of heterogeneity
Test for heterogeneity between studies was done using a standard Chi2 test and I2 statistic [37]. The Chi2 test is a statistical test for heterogeneity, whereas I2 assesses the quantity of inconsistency across studies in the meta-analysis. We used a cut-off P value of 0.1 to determine significance. This is because of generally anticipated low power of the reported trials due to the disease being rare. We used the following I2 ranges to interpret heterogeneity: 0 to 40 %: might not be important, 30 to 60 %: may represent moderate heterogeneity, 50 to 90 %: may represent substantial heterogeneity and 75 to 100 %: considerable heterogeneity.
Results and discussion
Characteristic of studies
Results of the search
Fourteen studies were identified from the searches (Fig. 2). Screening of abstracts excluded two studies [38, 39] because the studies measured the organ’s volume/size instead of the tumor’s. These are case reports with one patient each. Further full-text assessments excluded four studies with unit analysis/measurement or diagnosis issues [40–43]. One was a prospective cohort study involving 25 patients with angiomyolipoma or lymphangioleiomyomatosis where the TSC-diagnosed patients were mixed up with non TSC-diagnosed patients [40] and the rest were case reports with 1 patient each [41–43]. This review finally included eight studies consisting of four case reports [44–47] and four prospective cohort studies [48–51].
Included studies (Table 1)
Full size table
Characteristics of case reports
Franz et al. [44] reported four patients with SEGA altogether. However, only three patients (1 male 2 females, aged 14.5 – 21 years old) were reported with mutations in TSC2 gene. We excluded one patient of this report due to unclear TSC diagnostic data. The patients were treated with rapamycin 2 – 6 mg/day to achieve trough level of 7.7 – 10.9 ng/ml for 2.5 – 20 months.
Wienecke et al. [47] reported 1 patient (male, aged 19 years old) with kidney angiomyolipoma, in whom a mutation of TSC2 was identified. The patient was treated with rapamycin 1 mg every other day – 2 mg/day to reach trough level of 4 – 5 ng/ml for 7 months. Birca et al. [45] reported 1 patient (female, 8 years old) with SEGA. The patient showed clinical features of TSC as well as continuous deletion of TSC2/PKD1 region. Treatment with rapamycin was 1 – 2 mg/day to reach trough level of 3.3 – 4.5 ng/ml. Treatment duration was not mentioned, but last follow-up was after 5 months of treatment. Lam et al. [46] reported 3 patients with TSC-associated SEGA and kidney angiomyolipoma. However, we could only analyzed 1 patient (male, 9 years old) since the remaining 2 patients were reported as percentage decrease in tumor size and not the absolute value of tumor volume or diameter. The patient was treated with rapamycin 5 – 7 mg/day (in combination with carbamazepine that is known to induce rapamycin metabolism) to reach trough level of 10 – 15 ng/ml for a year. However, the follow-up reported was only that of 3 months.
Characteristics of prospective cohort studies
Krueger et al. [51] was described as a prospective, open-label, phase I-II trial. It was carried out in a single center at the Cincinnati Children’s Hospital Medical Center (US). The study reported 28 patients (17 males and 11 females; aged 3 – 34 years old) with definitive diagnosis of TSC and SEGA. The patients were treated with Everolimus orally at a starting daily dose of 3.0 mg per square meter of body-surface area and were subsequently adjusted to attain a whole-blood trough concentration of 5 – 15 ng/ml. The participants were essentially treated for 6 months with a median length of follow-up of three months.
Dabora et al. [49] was described as an open label, single arm, multicenter study with a Simon two-stage design [52]. It was carried out in six clinical centers at the United States (Boston, Cincinnati, Loma Linda, Hartford, New York and Dallas). The study reported 36 patients (10 males and 26 females; aged 19 – 60 years old) with definitive diagnosis of TSC, all with kidney angiomyolipoma, 13 with SEGA and 4 with liver angiomyolipoma. The patients were treated with Sirolimus orally at a loading dose of 6 mg followed by 2 mg/day to achieve trough level of 3 – 9 ng/ml during the first 16 weeks. After 16 weeks, the dose was increased to achieve a trough level of 9 – 15 ng/ml. The treatment lasted for 12 months with a median length of follow-up of 4 months.
Cabrera-Lopez et al. [48] was described as a phase IV non-blinded, non-controlled clinical trial. It was carried out at a single center in Spain. The study reported 17 patients (8 males and 9 females older than 10 years of age) with TSC diagnosis showing kidney angiomyolipoma. The patients were treated with rapamycin with initial dose of 1 mg/day. The dosage was increased 1 mg/day every for two weeks until it reached stable trough concentration of 4 – 8 ng/dl. The treatment lasted for 12 months with a median length of follow-up of 6 months.
Davies et al. [50] was described as phase II non-randomized, open-label multicenter trial. It was carried out in 4 hospitals of the United Kingdom and Switzerland. The study reported 16 patients, out of which only 10 patients were with definitive diagnosis of TSC and showing kidney angiomyolipoma. The patients were treated orally with sirolimus at initial dosage of 0.5 mg/square meter of body surface. The dosage was adjusted to achieve trough concentration of 3 – 6 ng/ml. The treatment lasted for 24 months with a median length of follow-up of 5 months.
Risk of bias assessment
The results of the risk of bias assessments for individual studies are reported in Table 2. Overall, each study showed high to low risk of bias.
Full size table
Effects of interventions on tumor size
Five patients from the case reports (all with SEGA) and 91 patients from the clinical trials (41 with SEGA, 63 with kidney angiomyolipoma and 5 with liver angiomyolipoma) were included into the analysis. An additional 3 patients from the case reports (1 with kidney angiomyolipoma [47] and 2 with SEGA [46]) were described, albeit not systematically analyzed.
SubEpendymal Giant cell Astrocytoma (SEGA) (Table 3)
In total, there are 5 studies that looked at the effect of rapamycin or rapalogs on SEGA, in which 3 are case reports [44–46] and 2 are prospective cohort [49, 51]. Two studies used tumor volume (cc) [51, 44] and 3 studies used tumor diameter (mm) [49, 45, 46] as their unit of analysis.
Full size table
The case reports [44–46] comprised of 5 patients with SEGA. From Franz et al. [44] we included 3 patients using tumor volume (cc) as unit of analysis. Lengths of treatment are variable, ranging from 2.5 – 20 months. Reduction in the tumor volume was noted in all patients, with a mean difference of −1.7 cc (95 % CI −4.6 to 1.2; p = 0.3). Birca et al. [45] reported one patient on which we took the longest tumor diameter (mm) as unit of analysis. Length of treatment was 5 months. There are two SEGAs found in this patient, from which we took the average for analysis. At 3-month follow-up tumor 1 was reduced from 38.7 mm to 24.3 mm while tumor 2 was also reduced from 31.3 mm to 21.8 mm. No further reduction in tumor size was noted at 5-month follow-up. From Lam et al. [46] we analyzed only one out of 3 patients using tumor longest diameter (mm) as unit of analysis. Length of treatment was 9 months. At 3-month follow-up the tumor was reduced from 35 mm – 26 mm. No further reduction in tumor size was noted at 6- and 9-month follow-ups. Reduction in the tumor diameter was noted in these 2 patients, with a mean difference of −12.00 mm (95 % CI −17.70 to −6.30; p = 0.05). The other 2 patients showed significant reduction in tumor size of 50–60 % of the pre-treatment size [46].
Dabora et al. [49] reported 13 patients with measurable SEGA ranging in diameter from 9–30 mm. However, follow-up data was only available from 11 patients after 12 months of Sirolimus treatment. Tumor regression was observed in 7 cases and SEGA diameter was stable in the other 4 cases. Our analysis showed that the SEGA in these 11 patients were reduced by mean difference of −4.3 mm (95 % CI −9.66 to 1.06; p = 0.1).
Krueger et al. [51] reported 28 patients with SEGA whereby one patient was withdrawn at 4.5 months. This study reported two versions of assessment at 6-month of follow-up; that of the local investigator’s and that of the independent central review. We include only the latter in our analysis. Local investigator’s assessment examined the tumor volume (cc) at 3, 6, 12, 18 and 24 months. We noted fluctuation in the mean of tumor volume reduction of 3 months (0.88 cc), 6 months (1.04 cc), 12 months (0.99 cc), 18 months (1.11 cc) and 24 months (0.87 cc) as compared to baseline. Our analysis showed that SEGA in 27 patients after 6 months of follow-up were reduced by mean difference of −1.01 (95 % CI −2.33 to 0.03; p = 0.06).
Overall, volume of SEGAs in 30 patients was significantly reduced (p = 0.03) after 3–12 months therapy, by mean difference of −1.23 cc (95 % CI −2.32 to −0.13). Similar pattern was also noted in the diameter of SEGAs in 13 patients (p < 0.0001) after 5–12 months treatment, by mean difference of −7.91 mm (95 % CI −11.82 to −4.01).
Kidney angiomyolipoma (Table 4)
There are 4 studies that looked at the effect of rapamycin on kidney angiomyolipoma. One is a case report [47] and three are cohort prospective [48–50]. Cabrera Lopez et al. [48] and Wienecke et al. [47] used tumor volume (cc), while Dabora et al. [49] and Davies et al. [50] used tumor diameter (mm) as their unit of analysis.
Full size table
Wienecke et al. [47] reported 1 patient with baseline tumor volume of 134 cc before administration of Rapamycin. Five months following Rapamycin therapy, MRI showed the tumor shrunk to 39 cc. The tumor volume was further reduced to 23 cc at 7 months following treatment. At 7 months, Rapamycin treatment was terminated. As a result, 15 months after the initial treatment, the tumor re-grew to 116 cc, following which rapamycin was re-instutited. A rapid decrease in tumor volume (to 45 cc) was noted after 3 months.
Cabrera Lopez et al. [48] reported 17 TSC patients with kidney angiomyolipoma, out of whom one had to be withdrawn from the study after 11 months due to reactivation of an erythema nodosum which was already present at the start of the trial, and another patient was removed from the study after 13 months of treatment due to the appearance of nephrotic proteinuria which disappeared after treatment suspension. Length of treatment was 24 months. Tumor volume was examined at 6-month and 12-month following the treatment. At 6-month follow-up the tumor size was significantly decreased by mean difference −34.00 cc (95 % CI 24.62 to −43.38; p = 0.0000). The tumor size further shrunk at 12-month follow up by mean difference of −39.50 cc (95 % CI −48.85 to −30.15; p = <0.00001).
Dabora et al. [49] reported 36 TSC patients with kidney angiomyolipoma, out of whom 8 were withdrawn from the study. These included 4 who were unable to come for study appointments, and 4 who were taken off study because of a serious adverse event that was judged unrelated to drug therapy (1 hospitalized with complicated infectious mononucleosis, 1 diagnosed with a pancreatic neuroendocrine tumor, 1 hospitalized with a kidney angiomyolipoma hemorrhage, 1 hospitalized with a neurologic event). Core length of treatment was 12 months. Follow-ups were done at 4, 8 and 12 months. Sum of the longest diameter (SLD) of the tumor (mm) was used as unit of analysis. At 4-month follow up (n = 33), the tumor SLD decreased but not significantly (p = 0.28) by mean difference of −36.00 mm (95 % CI 28.67 to −100.67). At 8-month follow-up (n = 29), the tumor SLD further decreased (p = 0.05) by mean difference of −62.00 mm (95 % CI 0.04 to −124.04). At 12-month follow-up (n = 28), the tumor SLD further decreased (p = 0.05) by mean difference of −67.00 mm (95 % CI −3.55 to −130.45).
Davies et al. [50] reported 10 TSC patients with kidney angiomyolipoma, out of whom 3 were withdrawn. Length of treatment was 24 months. SLD of the tumors was taken as unit of analysis. Follow-ups were done at 2,6,12 and 24 months. At 2 months (n = 9), the tumor SLD was decreased (p = 0.9) by mean difference of −8.00 mm (95 % CI 118.15 to −134.15). At 6 months (n = 10), the tumor SLD was further decreased (p = 0.79) by mean difference of −16.3 mm (95 % CI 103.13 to −135.73). At 12 months (n = 8), the tumor SLD was decreased (p = 0.11) by mean difference of −69.8 mm (95 % CI 15.39 to −154.99). Again, at 24 months (n = 7), the tumor was decreased further (p = 0.2) by mean difference of −69.8 mm (95 % CI 15.39 to −154.99). It is of note that at follow-ups of 12 and 24 months, 3 patients with 18 tumor lesions were withdrawn.
Overall, volume of kidney angiomyolipoma in 16 patients was significantly reduced (p <0.00001) by mean difference of −39.5 cc (95 % CI −48.85 to −30.15) after 12 months rapamycin therapy. This reduction was also noted in the mean of SLD of the kidney angiomyolipomas in 35 patients (p = 0.008) by −69.03 mm (95 % CI −158.05 to 12.65). In total, 11 patients with kidney angiomyolipomas were withdrawn before 12 months of therapy.
Liver angiomyolipoma
There is only one study that looked into the effect of rapamycin on liver angiomyolipoma, which is a prospective cohort [49]. This study used the tumor’s SLD as the analysis unit. There are 5 TSC patients with measurable liver angiomyolipoma, out of which 1 was withdrawn before 12 months of treatment. Core length of treatment was 12 months. Follow-ups were done at 4, 8 and 12 months. At 4-month follow-up (n = 4), the tumor SLD was decreased (p = 0.05) by mean difference of −12.80 mm (95 % CI −0.1 to −25.5). At 8-month follow-up (n = 4), the tumor SLD was still smaller as compared to that of baseline (p = 0.08) by mean difference of −12.5 mm (95 % CI 1.33 to −26.33) but this slightly re-grew as compared to that at 4-month follow-up. At 12-month follow-up, the tumor SLD was slightly larger (p = 0.84) as compared to that of baseline by mean difference of 2.7 mm (95 % CI 28.42 to −23.02). Reduction of tumor size in liver angiomyolipoma was not evident.
Adverse effects
Summary of adverse effects found in 99 patients from the included studies was described in Table 5. The most frequent adverse effects were oral ulcer followed by hypertriglyceridemia and upper respiratory tract infection.
Full size table
We identified, in this systematic review, 8 studies that fulfill our criteria for study inclusion involving a total of 99 trial participants. Six patients from the case reports (5 with SEGA, 1 with kidney angiomyolipoma) and 91 patients from the prospective cohorts (41 with SEGA, 63 with kidney angiomyolipoma and 5 with liver angiomyolipoma) were included into the analysis. Two other patients were described from a case report, albeit not analyzed.
On the quality of the included studies, we admit that we only included in this analysis non-randomized studies which by itself were a limitation. However, although the case reports may be of moderate to high risk of bias, the prospective cohort studies that we included may be categorized into moderate to low risk of bias, to the extent possible as non-randomized studies. There is a notable variability in the duration of follow-up, which might affect treatment outcome.
Thirty-one patients with SEGA were analyzed for their tumor volume (cc), while 15 patients for their tumor diameter. Analyses using both units showed a significant reduction in the size of SEGAs following the treatment. The volume was significantly reduced after 3 – 12 months of rapamycin administration by 1.23 cc and 2.45 stretch of reduction interval. The diameter, on the other hand, showed stretch of reduction interval of 7.81 and a mean reduction of 7.91 mm after 5 – 12 months therapy.
Forty-six patients with kidney angiomyolipomas were analyzed of their tumor’s sum of longest diameter (mm), while 17 patients of their tumor volume (cc). Both analyses showed significant reduction in the size of kidney angiomyolipoma following the treatment. The sum of longest diameters was significantly reduced by 69.03 mm and a stretch of reduction interval of 170.7. The volume was also significantly reduced by 39.50 cc with a stretch of reduction interval of 18.7. However, there are 12 patients withdrawn from the study before completion of 12 months therapy.
These have shown that rapamycin and rapalogs significantly reduce the tumor size in Tuberous Sclerosis patients with SEGA and kidney angiomyolipomas. However, the same reduction in tumor size was not evident in liver angiomyolipomas which involve only a limited set of patients.
Rapamycin has also been tried on other manifestations of Tuberous Sclerosis Complex with mostly promising results, albeit variable degree of evidences. Reports described improvement in facial angiofibroma [53–56], epilepsy [57, 58], cardiac rhabdomyoma [59], lymphangioleiomyomatosis [40, 50], fibromatosis and renal cell carcinoma [60] but not the optic nerve tumor [42] among patients with Tuberous Sclerosis Complex.
Our Cochrane systematic review (Protocol published [32]) on the same treatment effect which included only randomized studies [61–63] showed that there is a significant increase in the proportion of patients who achieved 50 % reduction in tumor size within the participants group that received rapamycin and rapalogs. This used dichotomous data for its analyses. The current article meta-analyzed non-randomized studies for the effect of rapamycin and rapalogs on tumor size and used continuous data for its analyses (actual tumor volume and diameter).
Adverse effects of the rapamycin treatment should be highlighted given that slightly more than half of the patients showed at least one of the listed adverse effects (Table 5). However, only very few were reported to develop serious conditions [49, 51].
Conclusion
As a conclusion, we have shown that rapamycin and rapalogs reduce the size of SEGA and kidney angiomyolipoma in patients with Tuberous Sclerosis Complex. This result strengthens our Cochrane systematic review on randomized studies. However, it is of note that we are unable to rule out the possibility of publication bias where authors only report positive outcomes and there may be many instances where no response was unreported.
References
-
Northrup H, Krueger DA, International Tuberous Sclerosis Complex Consensus G. Tuberous sclerosis complex diagnostic criteria update: recommendations of the 2012 International tuberous sclerosis complex consensus conference. Pediatr Neurol. 2013;49(4):243–54. doi:10.1016/j.pediatrneurol.2013.08.001.
Article
PubMed Central
PubMedGoogle Scholar
-
Crino PB, Nathanson KL, Henske EP. The tuberous sclerosis complex. N Engl J Med. 2006;355(13):1345–56. doi:10.1056/NEJMra055323.
Article
CAS
PubMedGoogle Scholar
-
Baskin Jr HJ. The pathogenesis and imaging of the tuberous sclerosis complex. Pediatr Radiol. 2008;38(9):936–52. doi:10.1007/s00247-008-0832-y.
Article
PubMedGoogle Scholar
-
Kopp CM, Muzykewicz DA, Staley BA, Thiele EA, Pulsifer MB. Behavior problems in children with tuberous sclerosis complex and parental stress. Epilepsy Behav. 2008;13(3):505–10. doi:10.1016/j.yebeh.2008.05.010.
Article
PubMedGoogle Scholar
-
Kwiatkowski DJ, Manning BD. Tuberous sclerosis: a GAP at the crossroads of multiple signaling pathways. Hum Mol Genet. 2005;14 Spec No. 2:R251–8. doi:10.1093/hmg/ddi260.
Article
PubMedGoogle Scholar
-
Wong M. Mechanisms of epileptogenesis in tuberous sclerosis complex and related malformations of cortical development with abnormal glioneuronal proliferation. Epilepsia. 2008;49(1):8–21. doi:10.1111/j.1528-1167.2007.01270.x.
Article
PubMed Central
PubMedGoogle Scholar
-
Major P, Rakowski S, Simon MV, Cheng ML, Eskandar E, Baron J, et al. Are cortical tubers epileptogenic? Evidence from electrocorticography. Epilepsia. 2009;50(1):147–54. doi:10.1111/j.1528-1167.2008.01814.x.
Article
PubMedGoogle Scholar
-
Goh S, Butler W, Thiele EA. Subependymal giant cell tumors in tuberous sclerosis complex. Neurology. 2004;63(8):1457–61.
Article
PubMedGoogle Scholar
-
Franz DN. Non-neurologic manifestations of tuberous sclerosis complex. J Child Neurol. 2004;19(9):690–8.
PubMed
Google Scholar
-
Johnson SR. Lymphangioleiomyomatosis. Eur Respir J. 2006;27(5):1056–65. doi:10.1183/09031936.06.00113303.
CAS
PubMedGoogle Scholar
-
Yates JR. Tuberous sclerosis. Eur J Hum Genet. 2006;14(10):1065–73. doi:10.1038/sj.ejhg.5201625.
Article
CAS
PubMedGoogle Scholar
-
Bhaskar PT, Hay N. The two TORCs and Akt. Dev Cell. 2007;12(4):487–502. doi:10.1016/j.devcel.2007.03.020.
Article
CAS
PubMedGoogle Scholar
-
Franz DN, Weiss BD. Molecular therapies for tuberous sclerosis and neurofibromatosis. Curr Neurol Neurosci Rep. 2012;12(3):294–301. doi:10.1007/s11910-012-0269-4.
Article
CAS
PubMedGoogle Scholar
-
Gao X, Pan D. TSC1 and TSC2 tumor suppressors antagonize insulin signaling in cell growth. Genes Dev. 2001;15(11):1383–92. doi:10.1101/gad.901101.
Article
CAS
PubMed Central
PubMedGoogle Scholar
-
Goncharova EA, Goncharov DA, Eszterhas A, Hunter DS, Glassberg MK, Yeung RS, et al. Tuberin regulates p70 S6 kinase activation and ribosomal protein S6 phosphorylation. A role for the TSC2 tumor suppressor gene in pulmonary lymphangioleiomyomatosis (LAM). J Biol Chem. 2002;277(34):30958–67. doi:10.1074/jbc.M202678200.
Article
CAS
PubMedGoogle Scholar
-
Inoki K, Li Y, Zhu T, Wu J, Guan KL. TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling. Nat Cell Biol. 2002;4(9):648–57. doi:10.1038/ncb839.
Article
CAS
PubMedGoogle Scholar
-
Kwiatkowski DJ, Zhang H, Bandura JL, Heiberger KM, Glogauer M, el-Hashemite N, et al. A mouse model of TSC1 reveals sex-dependent lethality from liver hemangiomas, and up-regulation of p70S6 kinase activity in Tsc1 null cells. Hum Mol Genet. 2002;11(5):525–34.
Article
CAS
PubMedGoogle Scholar
-
Manning BD, Tee AR, Logsdon MN, Blenis J, Cantley LC. Identification of the tuberous sclerosis complex-2 tumor suppressor gene product tuberin as a target of the phosphoinositide 3-kinase/akt pathway. Mol Cell. 2002;10(1):151–62.
Article
CAS
PubMedGoogle Scholar
-
Potter CJ, Pedraza LG, Xu T. Akt regulates growth by directly phosphorylating Tsc2. Nat Cell Biol. 2002;4(9):658–65. doi:10.1038/ncb840.
Article
CAS
PubMedGoogle Scholar
-
Ballou LM, Lin RZ. Rapamycin and mTOR kinase inhibitors. J Chem Biol. 2008;1(1–4):27–36. doi:10.1007/s12154-008-0003-5.
Article
PubMed Central
PubMedGoogle Scholar
-
Rapamune. RxList: The internet drug index. 2013.
Google Scholar
-
Ehninger D, Silva AJ. Rapamycin for treating Tuberous sclerosis and Autism spectrum disorders. Trends Mol Med. 2011;17(2):78–87. doi:10.1016/j.molmed.2010.10.002.
Article
CAS
PubMed Central
PubMedGoogle Scholar
-
Lee L, Sudentas P, Donohue B, Asrican K, Worku A, Walker V, et al. Efficacy of a rapamycin analog (CCI-779) and IFN-gamma in tuberous sclerosis mouse models. Gene Chromosome Cancer. 2005;42(3):213–27. doi:10.1002/gcc.20118.
Article
CASGoogle Scholar
-
Fischer L, Saliba F, Kaiser GM, De Carlis L, Metselaar HJ, De Simone P, et al. Three-year outcomes in de novo liver transplant patients receiving everolimus with reduced tacrolimus: follow-up results from a randomized, multicenter study. Transplantation. 2015;99(7):1455–62. doi:10.1097/TP.0000000000000555.
Article
CAS
PubMedGoogle Scholar
-
Ribichini F, Romano M, Rosiello R, La Vecchia L, Cabianca E, Caramanno G, et al. A clinical and angiographic study of the XIENCE V everolimus-eluting coronary stent system in the treatment of patients with multivessel coronary artery disease: the EXECUTIVE trial (EXecutive RCT: evaluating XIENCE V in a multi vessel disease). JACC Cardiovasc Interv. 2013;6(10):1012–22. doi:10.1016/j.jcin.2013.05.016.
Article
PubMedGoogle Scholar
-
Alfonso F, Perez-Vizcayno MJ, Cardenas A, Garcia Del Blanco B, Garcia-Touchard A, Lopez-Minguez JR, et al. A prospective randomized trial of drug-eluting balloons versus Everolimus-Eluting stents in patients with in-stent restenosis of drug-eluting stents: the ribs IV randomized clinical trial. J Am Coll Cardiol. 2015;66(1):23–33. doi:10.1016/j.jacc.2015.04.063.
Article
CAS
PubMedGoogle Scholar
-
Motzer RJ, Escudier B, Oudard S, Hutson TE, Porta C, Bracarda S, et al. Phase 3 trial of everolimus for metastatic renal cell carcinoma: final results and analysis of prognostic factors. Cancer. 2010;116(18):4256–65. doi:10.1002/cncr.25219.
Article
CAS
PubMedGoogle Scholar
-
Ravaud A, Barrios CH, Alekseev B, Tay MH, Agarwala SS, Yalcin S, et al. RECORD-2: phase II randomized study of everolimus and bevacizumab versus interferon alpha-2a and bevacizumab as first-line therapy in patients with metastatic renal cell carcinoma. Ann Oncol. 2015;26(7):1378–84. doi:10.1093/annonc/mdv170.
CAS
PubMedGoogle Scholar
-
Castellano D, Bajetta E, Panneerselvam A, Saletan S, Kocha W, O’Dorisio T, et al. Everolimus plus octreotide long-acting repeatable in patients with colorectal neuroendocrine tumors: a subgroup analysis of the phase III RADIANT-2 study. Oncologist. 2013;18(1):46–53. doi:10.1634/theoncologist.2012-0263.
Article
CAS
PubMed Central
PubMedGoogle Scholar
-
Pavel ME, Hainsworth JD, Baudin E, Peeters M, Horsch D, Winkler RE, et al. Everolimus plus octreotide long-acting repeatable for the treatment of advanced neuroendocrine tumours associated with carcinoid syndrome (RADIANT-2): a randomised, placebo-controlled, phase 3 study. Lancet. 2011;378(9808):2005–12. doi:10.1016/S0140-6736(11)61742-X.
Article
CAS
PubMedGoogle Scholar
-
Qiao L, Liang Y, Mira RR, Lu Y, Gu J, Zheng Q. Mammalian target of rapamycin (mTOR) inhibitors and combined chemotherapy in breast cancer: a meta-analysis of randomized controlled trials. Int J Clin Exp Med. 2014;7(10):3333–43.
PubMed Central
PubMedGoogle Scholar
-
Sasongko TH IN, Nik Abdul Malik NMA, Zabidi-Hussin ZAMH. Rapamycin and its analogues (rapalogs) for tuberous sclerosis complex (Protocol). Cochrane Database Syst Rev 2014 (9). doi:10.1002/14651858.CD011272.pub2.
-
Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med. 2009;6(7):e1000097. doi:10.1371/journal.pmed.1000097.
Article
PubMed Central
PubMedGoogle Scholar
-
Higgins JPT GSe. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration; 2011.
-
Review Manager (RevMan) [Computer Program]. Version 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014.
-
Wells GA Shea B, O’Connell D, Peterson J, Welch V, Losos M, Tugwell P. The Newcastle-Ottawa Scale (NOS) for assessing the quality if nonrandomized studies in meta-analyses. Ottawa Hospital Research Institute. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp. Accessed 1 May 2015
-
Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ. 2003;327(7414):557–60. doi:10.1136/bmj.327.7414.557.
Article
PubMed Central
PubMedGoogle Scholar
-
Herry I, Neukirch C, Debray MP, Mignon F, Crestani B. Dramatic effect of sirolimus on renal angiomyolipomas in a patient with tuberous sclerosis complex. Eur J Intern Med. 2007;18(1):76–7. doi:10.1016/j.ejim.2006.07.017.
Article
PubMedGoogle Scholar
-
Peces R, Peces C, Cuesta-Lopez E, Perez-Duenas V, Vega-Cabrera C, Azorin S, et al. Low-dose rapamycin reduces kidney volume angiomyolipomas and prevents the loss of renal function in a patient with tuberous sclerosis complex. Nephrol Dial Transplant. 2010;25(11):3787–91. doi:10.1093/ndt/gfq456.
Article
PubMedGoogle Scholar
-
Bissler JJ, McCormack FX, Young LR, Elwing JM, Chuck G, Leonard JM, et al. Sirolimus for angiomyolipoma in tuberous sclerosis complex or lymphangioleiomyomatosis. N Engl J Med. 2008;358(2):140–51. doi:10.1056/NEJMoa063564.
Article
CAS
PubMed Central
PubMedGoogle Scholar
-
Koenig MK, Butler IJ, Northrup H. Regression of subependymal giant cell astrocytoma with rapamycin in tuberous sclerosis complex. J Child Neurol. 2008;23(10):1238–9. doi:10.1177/0883073808321764.
Article
PubMed Central
PubMedGoogle Scholar
-
Sparagana SP, Wilkes DC, Thompson CE, Bowers DC. Optic nerve tumor in tuberous sclerosis complex is not responsive to sirolimus. Pediatr Neurol. 2010;42(6):443–6. doi:10.1016/j.pediatrneurol.2010.01.016.
Article
PubMedGoogle Scholar
-
Yalon M, Ben-Sira L, Constantini S, Toren A. Regression of subependymal giant cell astrocytomas with RAD001 (Everolimus) in tuberous sclerosis complex. Childs Nerv Syst. 2011;27(1):179–81. doi:10.1007/s00381-010-1222-y.
Article
PubMedGoogle Scholar
-
Franz DN, Leonard J, Tudor C, Chuck G, Care M, Sethuraman G, et al. Rapamycin causes regression of astrocytomas in tuberous sclerosis complex. Ann Neurol. 2006;59(3):490–8. doi:10.1002/ana.20784.
Article
CAS
PubMedGoogle Scholar
-
Birca A, Mercier C, Major P. Rapamycin as an alternative to surgical treatment of subependymal giant cell astrocytomas in a patient with tuberous sclerosis complex. J Neurosurg Pediatr. 2010;6(4):381–4. doi:10.3171/2010.7.PEDS10221.
Article
PubMedGoogle Scholar
-
Lam C, Bouffet E, Tabori U, Mabbott D, Taylor M, Bartels U. Rapamycin (sirolimus) in tuberous sclerosis associated pediatric central nervous system tumors. Pediatr Blood Cancer. 2010;54(3):476–9. doi:10.1002/pbc.22298.
Article
PubMedGoogle Scholar
-
Wienecke R, Fackler I, Linsenmaier U, Mayer K, Licht T, Kretzler M. Antitumoral activity of rapamycin in renal angiomyolipoma associated with tuberous sclerosis complex. Am J Kidney Dis. 2006;48(3):e27–9. doi:10.1053/j.ajkd.2006.05.018.
Article
PubMedGoogle Scholar
-
Cabrera Lopez C, Marti T, Catala V, Torres F, Mateu S, Ballarin Castan J, et al. Effects of rapamycin on angiomyolipomas in patients with tuberous sclerosis. Nefrologia. 2011;31(3):292–8. doi:10.3265/Nefrologia.pre2011.Apr.10812.
PubMed
Google Scholar
-
Dabora SL, Franz DN, Ashwal S, Sagalowsky A, DiMario Jr FJ, Miles D, et al. Multicenter phase 2 trial of sirolimus for tuberous sclerosis: kidney angiomyolipomas and other tumors regress and VEGF- D levels decrease. PLoS One. 2011;6(9):e23379. doi:10.1371/journal.pone.0023379.
Article
CAS
PubMed Central
PubMedGoogle Scholar
-
Davies DM, de Vries PJ, Johnson SR, McCartney DL, Cox JA, Serra AL, et al. Sirolimus therapy for angiomyolipoma in tuberous sclerosis and sporadic lymphangioleiomyomatosis: a phase 2 trial. Clin Cancer Res. 2011;17(12):4071–81. doi:10.1158/1078-0432.CCR-11-0445.
Article
CAS
PubMedGoogle Scholar
-
Krueger DA, Care MM, Holland K, Agricola K, Tudor C, Mangeshkar P, et al. Everolimus for subependymal giant-cell astrocytomas in tuberous sclerosis. N Engl J Med. 2010;363(19):1801–11. doi:10.1056/NEJMoa1001671.
Article
CAS
PubMedGoogle Scholar
-
Simon R. Optimal two-stage designs for phase II clinical trials. Control Clin Trials. 1989;10(1):1–10.
Article
CAS
PubMedGoogle Scholar
-
Truchuelo T, Diaz-Ley B, Rios L, Alcantara J, Jaen P. Facial angiofibromas treated with topical rapamycin: an excellent choice with fast response. Dermatol Online J. 2012;18(1):15.
PubMed
Google Scholar
-
Wataya-Kaneda M, Tanaka M, Nakamura A, Matsumoto S, Katayama I. A novel application of topical rapamycin formulation, an inhibitor of mTOR, for patients with hypomelanotic macules in tuberous sclerosis complex. Arch Dermatol. 2012;148(1):138–9. doi:10.1001/archderm.148.1.138.
Article
CAS
PubMedGoogle Scholar
-
Wheless JW, Almoazen H. A novel topical rapamycin cream for the treatment of facial angiofibromas in tuberous sclerosis complex. J Child Neurol. 2013;28(7):933–6. doi:10.1177/0883073813488664.
Article
PubMedGoogle Scholar
-
Foster RS, Bint LJ, Halbert AR. Topical 0.1 % rapamycin for angiofibromas in paediatric patients with tuberous sclerosis: a pilot study of four patients. Australas J Dermatol. 2012;53(1):52–6. doi:10.1111/j.1440-0960.2011.00837.x.
Article
PubMedGoogle Scholar
-
Krueger DA, Wilfong AA, Holland-Bouley K, Anderson AE, Agricola K, Tudor C et al. Everolimus treatment of refractory epilepsy in tuberous sclerosis complex. Ann Neurol 2013. doi:10.1002/ana.23960.
-
Canpolat M, Per H, Gumus H, Yikilmaz A, Unal E, Patiroglu T et al. Rapamycin has a beneficial effect on controlling epilepsy in children with tuberous sclerosis complex: results of 7 children from a cohort of 86. Childs Nerv Syst 2013. doi:10.1007/s00381-013-2185-6.
-
Tiberio D, Franz DN, Phillips JR. Regression of a cardiac rhabdomyoma in a patient receiving everolimus. Pediatrics. 2011;127(5):e1335–7. doi:10.1542/peds.2010-2910.
Article
PubMedGoogle Scholar
-
Pressey JG, Wright JM, Geller JI, Joseph DB, Pressey CS, Kelly DR. Sirolimus therapy for fibromatosis and multifocal renal cell carcinoma in a child with tuberous sclerosis complex. Pediatr Blood Cancer. 2010;54(7):1035–7. doi:10.1002/pbc.22401.
PubMed
Google Scholar
-
Franz DN, Belousova E, Sparagana S, Bebin EM, Frost M, Kuperman R, et al. Efficacy and safety of everolimus for subependymal giant cell astrocytomas associated with tuberous sclerosis complex (EXIST-1): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet. 2013;381(9861):125–32. doi:10.1016/S0140-6736(12)61134-9.
Article
CAS
PubMedGoogle Scholar
-
Bissler JJ, Kingswood JC, Radzikowska E, Zonnenberg BA, Frost M, Belousova E, et al. Everolimus for angiomyolipoma associated with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis (EXIST-2): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2013;381(9869):817–24. doi:10.1016/S0140-6736(12)61767-X.
Article
CAS
PubMedGoogle Scholar
-
Koenig MK, Hebert AA, Roberson J, Samuels J, Slopis J, Woerner A, et al. Topical rapamycin therapy to alleviate the cutaneous manifestations of tuberous sclerosis complex: a double-blind, randomized, controlled trial to evaluate the safety and efficacy of topically applied rapamycin. Drugs R D. 2012;12(3):121–6. doi:10.2165/11634580-000000000-00000.
Article
CAS
PubMed Central
PubMedGoogle Scholar
Download references
Acknowledgements
Studies on Tuberous Sclerosis Complex in Universiti Sains Malaysia are funded by the USM Research University Grant Nbr. 1001/PPSP/812137 for Dr. Teguh Haryo Sasongko and USM Neuroscience Excellence Grant Nbr. 304.PPSP.652205.K134 for Professor Zabidi Azhar Mohd. Hussin.
Author information
Authors and Affiliations
-
Human Genome Center, School of Medical Sciences, Universiti Sains Malaysia, USM Health Campus, 16150, Kubang Kerian, Kelantan, Malaysia
Teguh Haryo Sasongko, Nur Farrah Dila Ismail & Nik Mohamad Ariff Nik Abdul Malik
-
Department of Pediatrics, School of Medical Sciences, Universiti Sains Malaysia, USM Health Campus, 16150, Kubang Kerian, Kelantan, Malaysia
Z. A. M. H. Zabidi-Hussin
-
Center for Neuroscience Services and Research, Universiti Sains Malaysia, USM Health Campus, 16150, Kubang Kerian, Kelantan, Malaysia
Teguh Haryo Sasongko, Nur Farrah Dila Ismail, Nik Mohamad Ariff Nik Abdul Malik & Z. A. M. H. Zabidi-Hussin
Authors
- Teguh Haryo Sasongko
You can also search for this author in
PubMed Google Scholar - Nur Farrah Dila Ismail
You can also search for this author in
PubMed Google Scholar - Nik Mohamad Ariff Nik Abdul Malik
You can also search for this author in
PubMed Google Scholar - Z. A. M. H. Zabidi-Hussin
You can also search for this author in
PubMed Google Scholar
Corresponding author
Correspondence to
Teguh Haryo Sasongko.
Additional information
Competing interests
The authors declare that they have no competing interests.
Authors’ contributions
THS and ZAMH-ZH developed the concept for the manuscript. NFDI and NMANAM performed the search and extracted the data. THS and ZAMH-ZH analyzed the data. THS drafted the manuscript. ZAMH-ZH, NFDI and NMANAM critically participated in discussions to develop the manuscript. All authors read and approved the final manuscript.
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Sasongko, T.H., Ismail, N.F.D., Nik Abdul Malik, N.M.A. et al. Rapamycin and its analogues (rapalogs) for Tuberous Sclerosis Complex-associated tumors: a systematic review on non-randomized studies using meta-analysis.
Orphanet J Rare Dis 10, 95 (2015). https://doi.org/10.1186/s13023-015-0317-7
Download citation
-
Received: 05 June 2015
-
Accepted: 03 August 2015
-
Published: 12 August 2015
-
DOI: https://doi.org/10.1186/s13023-015-0317-7
Keywords
- Tuberous sclerosis complex
- Rapamycin
- Rapalogs
- Systematic review
- Angiomyolipoma
- SubEpendymal giant-cell astrocytoma
