Rec.INN
зарегистрированное ВОЗ
Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Противоопухолевое средство, селективный ингибитор циклин-зависимых киназ (CDK) 4 и 6. Эти киназы активизируются при образовании комплекса с D-циклинами и играют основную роль в сигнальных путях, регулирующих клеточный цикл и пролиферацию клеток. Комплекс циклин D-CDK4/6 регулирует прогрессию клеточного цикла путем фосфорилирования белка ретинобластомы (pRb).
In vitro рибоциклиб подавлял фосфорилирование белка Rb, что приводило к остановке клеточного цикла в фазе G1 и снижению пролиферации клеток в клеточных линиях рака молочной железы. In vivo монотерапия рибоциклибом в хорошо переносимых дозах вызывала регрессию опухоли, коррелируя с ингибированием фосфорилирования белка Rb. В исследованиях in vivo с использованием моделей с полученным от пациента ксенотрансплантатом рака молочной железы положительного по рецепторам эстрогена, комбинация рибоциклиба и ингибиторов ароматазы (например, летрозол) приводила к более выраженному ингибированию опухолевого роста по сравнению с каждым препаратом в отдельности. После прекращения применения лекарственного средства возобновление опухолевого роста отмечалось через 33 дня. Кроме того, оценивалась противоопухолевая активность комбинации рибоциклиба в сочетании с фулвестрантом в исследованиях in vivo у иммунодефицитных мышей, несущих ксенотрансплантаты эстроген-обогащенного рака молочной железы ZR751. Комбинация рибоциклиба и фулвестранта приводила к полному ингибированию опухолевого роста.
Фармакокинетика
После приема внутрь рибоциклиба у пациентов с распространенными солидными опухолями и лимфомами Cmax рибоциклиба в плазме крови достигалась через 1-4 часа (время достижения максимальной концентрации, Tmax). Наблюдалось небольшое сверхпропорциональное увеличение экспозиции (Cmax и площади под кривой “концентрация-время” (AUC)) рибоциклиба в изучаемом диапазоне доз (от 50 мг до 1200 мг). После повторного приема 1 раз/сут равновесное состояние обычно достигалось через 8 дней, рибоциклиб аккумулировал со средним геометрическим отношением, составляющим 2.51 (диапазон: от 0.972 до 6.40).
Связывание рибоциклиба с белками плазмы крови человека in vitro составляло приблизительно 70% и не зависело от концентрации (от 10 нг/мл до 10 000 нг/мл). Рибоциклиб равномерно распределялся между эритроцитами и плазмой крови со средним отношением кровь/плазма in vivo 1.04. По данным анализа популяционной фармакокинетики кажущийся объем распределения в равновесном состоянии (Vss/F) составлял 1090 л.
В исследованиях in vitro и in vivo показано, что у человека рибоциклиб подвергается экстенсивному метаболизму в печени главным образом при участии изофермента CYP3A4. После приема рибоциклиба внутрь в однократной дозе 600 мг [14С] у человека пути первичного метаболизма рибоциклиба включали окисление (деалкилирование, С и/или IM- оксигенацию, окисление (-2Н)) и их комбинации. Первичные метаболиты рибоциклиба подвергались конъюгации путем N-ацетилирования, сульфатирования, связывания с цистеином, гликозилирования и глюкуронизации. Рибоциклиб был основным фармакологически активным соединением, присутствующим в плазме крови (43.5%). Основные циркулирующие метаболиты: метаболит М13 (CCI284, N-гидроксилирование), М4 (LEQ803, N-деметилирование) и M1 (вторичная глюкуронизация), на каждое представленное соединение приходилось 9.39%, 8.60% и 7.78% общей радиоактивности и 21.6%, 19.8% и 17.9% экспозиции рибоциклиба соответственно. Клиническая активность (фармакологические свойства и безопасность) рибоциклиба была преимущественно обусловлена неизмененным веществом, при этом циркулирующие метаболиты не имели существенного значения.
Рибоциклиб подвергался экстенсивному метаболизму, количество неизмененного вещества составляло 17.3% и 12.1% в кале и моче соответственно. Метаболит LEQ803 в значительном количестве определялся в кале, его количество составляло 13.9% и 3.74% принятой дозы в кале и моче соответственно. Другие метаболиты определялись и в кале, и в моче в небольших количествах (<2.78% принятой дозы).
В равновесном состоянии при применении дозы 600 мг у пациентов с распространенным раком геометрическое среднее значение эффективного T1/2 из плазмы крови (на основании соотношения аккумуляции) составляло 32 часа (63% CV) и геометрическое среднее значение кажущегося клиренса (CL/F) при приеме внутрь составляло 25.5 л/ч (66% CV). Геометрическое среднее значение кажущегося конечного T1/2 рибоциклиба из плазмы крови находится в пределах от 29.7 до 54.7 часов и геометрическое среднее значение CL/F рибоциклиба в диапазоне от 39.9 до 77.5 л/ч при дозе 600 мг во всех исследованиях у здоровых добровольцев.
Рибоциклиб выводится главным образом через кишечник и в небольшой степени почками. У 6 здоровых добровольцев мужского пола после приема однократной дозы [14С] рибоциклиба, 91.7% общей введенной радиоактивной дозы определялось в течение 22 дней; в основном выведение происходило через кишечник (69.1%), 22.6% дозы выводилось почками.
Сверхпропорциональное увеличение экспозиции (Cmax и AUC) рибоциклиба наблюдалось как после однократного приема, так и после приема повторных доз в диапазоне от 50 мг до 1200 мг. Анализ данных ограничивается малым размером выборки в большинстве когорт, получающих определенные дозы, с наибольшим количеством данных, поступающих из когорты, получавшей дозу 600 мг.
Показания активного вещества
РИБОЦИКЛИБ
Для лечения положительного по гормональным рецепторам (HR+) и отрицательного по рецептору эпидермального фактора роста человека 2-го типа (HER2-) местно-распространенного или метастатического рака молочной железы в комбинации с ингибитором ароматазы или фулвестрантом у женщин в качестве начальной гормональной терапии или у женщин, получавших гормональную терапию ранее.
Режим дозирования
Рекомендуемая доза для приема внутрь составляет 600 мг 1 раз в сутки последовательно в течение 21 дня, с последующим перерывом в приеме в течение 7 дней. Полный цикл составляет 28 дней.
Одновременно следует принимать фулвестрант в дозе 500 мг внутримышечно в дни 1, 15, 29 и затем раз в месяц, либо летрозол в дозе 2.5 мг/сут или другой ингибитор ароматазы 1 раз/сут в течение всего 28-дневного цикла.
Побочное действие
Инфекции и паразитарные заболевания: очень часто — инфекции мочевыводящих путей, инфекции дыхательных путей, гастроэнтериты, сепсис (< 1).
Со стороны крови и лимфатической системы: очень часто — нейтропения, лейкопения, анемия; часто — лимфопения, тромбоцитопения, фебрильная нейтропения.
Со стороны органа зрения: часто — слезотечение, сухость глаз.
Со стороны обмена веществ и питания: очень часто — уменьшение аппетита; часто — гипокальциемия, гипокалиемия, гипофосфатемия.
Со стороны нервной системы: очень часто — головная боль, головокружение; часто — системное головокружение.
Со стороны сердечно-сосудистой системы: обморок.
Со стороны дыхательной системы: очень часто — одышка, кашель.
Со стороны костно-мышечной системы: очень часто — боль в спине.
Со стороны ЖКТ: очень часто — тошнота, диарея, рвота, запор, стоматит, боли в животе, боли в верхней части живота; часто — дисгевзия, диспепсия.
Со стороны печени и желчевыводящих путей: часто — гепатотоксичность (поражение клеток печени, лекарственное поражение печени, гепатотоксичность, печеночная недостаточность, аутоиммунный гепатит (единственный случай)).
Со стороны кожи и подкожных тканей: очень часто — алопеция, кожная сыпь (сыпь, макуло-папулезная сыпь, зудящая сыпь), зуд; часто — эритема, сухость кожи, витилиго.
Системные реакции: очень часто — утомляемость, периферические отеки, астения, повышение температуры тела; часто — сухость во рту, орофарингеальная боль.
Лабораторные и инструментальные данные: очень часто — повышение активности АЛТ, повышение активности АСТ, повышение концентрации билирубина в сыворотке крови; часто — повышение концентрации креатинина в сыворотке крови, удлинение интервала QT на ЭКГ.
Противопоказания к применению
Возраст до 18 лет, беременность и период грудного вскармливания.
С осторожностью
У пациентов с нейтропенией 3-4 степени, с нарушениями функции почек тяжелой степени, у пациентов с гепатобилиарной токсичностью, у пациентов с наличием или значительным риском удлинения интервала QT (синдромом удлинения интервала QT, неконтролируемыми или клинически значимыми заболеваниями сердца, в том числе недавно перенесенным инфарктом миокарда, хронической сердечной недостаточностью, нестабильной стенокардией и брадиаритмией, нарушениями водно-электролитного баланса), при одновременном применении с лекарственными средствами, удлиняющими интервал QTc, с мощными ингибиторами изофермента CYP3A, при применении с субстратами изофермента CYP3A с узким терапевтическим индексом.
Применение при беременности и кормлении грудью
Применение противопоказано при беременности и в период грудного вскармливания.
Применение у детей
Применение противопоказано в детском возрасте до 18 лет.
Особые указания
У пациентов, получающих рибоциклиб в сочетании с ингибитором ароматазы/фулвестрантом (+/- ГнРГ) в клинических исследованиях III фаз, наиболее частой НЛР была нейтропения (73.7%) и снижение количества нейтрофилов (на основании лабораторных данных) 3 или 4 степени отмечалось у 58.4% пациентов. Среди пациентов, у которых наблюдалась нейтропения 2, 3 или 4 степени в клинических исследованиях III фазы, медиана времени до развития нейтропении 2, 3 или 4 степени составляла 16 дней. Медиана времени до разрешения нейтропении >3 степени (до нормализации или уменьшения до <3 степени) составляла 12 дней в группе лечения лекарственным средством в любой исследуемой комбинации. Тяжесть нейтропении зависела от концентрации. У пациентов, получающих рибоциклиб в клинических исследованиях III фазы, у 1.4% пациентов отмечалось развитие фебрильной нейтропении. Пациент должен быть в обязательном порядке проинформирован врачом о необходимости срочно сообщать о любых случаях повышения температуры тела.
Перед началом терапии следует выполнить ОАК. Необходим контроль ОАК каждые 2 недели в течение первых 2 циклов, в начале каждого из последующих 4 циклов и затем в соответствии с клиническими показаниями.
При тяжелой нейтропении может потребоваться временная отмена приема лекарственного средства, уменьшение дозы или полная отмена. У пациентов с развитием нейтропении 1 или 2 степени коррекция дозы не требуется. У пациентов с развитием нейтропении 3 степени без лихорадки следует временно отменить применение до восстановления до <2 степени, и затем возобновить в той же дозе. При повторном развитии нейтропении 3 степени без лихорадки следует временно отменить применение лекарственного средства до восстановления показателя, затем возобновить в дозе, уменьшенной до следующего уровня. У пациентов с фебрильной нейтропенией 3 степени (АЧН от 500 до <1000/мм3 с единственным эпизодом лихорадки >38.3°С (или) выше 38°С в течение более 1 часа и/или с одновременным развитием инфекции), или у пациентов с развитием нейтропении 4 степени, применение следует временно отменить до восстановления нейтропении <2 степени, затем следует возобновить в дозе, уменьшенной до следующего уровня.
В клинических исследованиях III фазы наблюдалось повышение активности трансаминаз. Сообщалось об увеличении активности АЛТ (9.7% против 1.5%) и активности ACT(6.7% против 2.1%) 3 или 4 степени в группах пациентов, получающих рибоциклиб в сочетании с любой исследуемой комбинацией и в группе плацебо в сочетании с любой исследуемой комбинацией соответственно.
Функциональные тесты печени следует проводить до начала терапии лекарственным средством. Контроль функции печени проводят каждые 2 недели в течение первых 2 циклов, в начале каждого из последующих 4 циклов, и затем в соответствии с клиническими показаниями. При выраженном повышении активности трансаминаз может потребоваться временная отмена приема, уменьшение дозы или полная отмена.
В исследованиях III фазы обзор данных ЭКГ пациентов с распространенным или метастатическим раком молочной железы, получивших терапию данным лекарственным средством в сочетании с любой исследуемой комбинацией показал, что у 14 пациентов (1.3%) значение QTcF после исходного уровня составляло >500 мсек, у 59 пациентов (5.6%) отмечалось увеличение интервала QTcF>60 мсек от исходного уровня. О случаях желудочковой тахикардии типа «пируэт» не сообщалось.
Тамоксифен способствует риску удлинения интервала QTcF, что может вносить вклад в значение интервала QTcF при приеме комбинации рибоциклиба с тамоксифеном. Отмечалось увеличение интервала QTcF>60 мсек от исходного уровня у 6/90 (6.7%) пациентов в группе плацебо в комбинации с тамоксифеном, у 14/87 (16.1%) пациентов в группе рибоциклиба в сочетании с тамоксифеном и у 18/245 (7.3%) пациентов в группе рибоциклиба в сочетании с нестероидными ингибиторами ароматазы.
До начала лечения необходимо провести ЭКГ. Лечение рибоциклибом следует начинать только у пациентов с продолжительностью QTcF менее 450 мсек. Повторное ЭКГ требуется проводить приблизительно на 14 день первого цикла и в начале второго цикла, затем в соответствии с клиническими показаниями.
Следует проводить соответствующий контроль содержания электролитов (включая содержание калия, кальция, фосфатов и магния) в сыворотке крови до начала лечения, в начале первых 6 циклов и затем в соответствии с клиническими показаниями. Перед началом и в течение терапии рибоциклибом необходимо провести коррекцию любых изменений содержания электролитов.
Следует избегать применения лекарственного средства у пациентов с наличием или значительным риском удлинения интервала QTc, включая: синдром удлинения интервала QT; неконтролируемое или клинически значимое заболевание сердца, в том числе недавно перенесенный инфаркт миокарда, хроническая сердечная недостаточность, нестабильная стенокардия и брадиаритмия; изменения содержания электролитов.
Следует избегать применения рибоциклиба с лекарственными средствами, которые способны удлинять интервал QTc и/или являются мощными ингибиторами изофермента CYP3A, так как это может привести к клинически значимому удлинению интервала QTcF. При выявлении удлинения интервала QT может потребоваться временная отмена приема, уменьшение дозы или полная отмена лекарственного средства. На основании клинического исследования III фазы, рибоциклиб не рекомендовано принимать в комбинации с тамоксифеном по причине значимого повышения тамоксифен-опосредованного риска удлинения интервала QTcF.
Влияние на способность к управлению транспортными средствами и механизмами
Пациентам следует соблюдать осторожность при управлении транспортными средствами и/или механизмами, учитывая возможность развития повышенной утомляемости во время применения лекарственного средства.
Лекарственное взаимодействие
Метаболизм рибоциклиба осуществляется преимущественно посредством изофермента CYP3A. In vivo рибоциклиб представляет собой зависимый от времени ингибитор изофермента CYP3A. Поэтому лекарственные препараты, которые влияют на ферментативную активность изофермента CYP3A, способны изменять фармакокинетику рибоциклиба.
Следует избегать одновременного применения мощных ингибиторов изофермента CYP3A, включая (но не ограничиваясь) следующие лекарственные средства: кларитромицин, индинавир, итраконазол, кетоконазол, лопинавир, нефазодон, нелфинавир, позаконазол, ритонавир, саквинавир, телапревир, телитромицин, верапамил и вориконазол. При невозможности избежать одновременного приема лекарственного средства с мощным ингибитором изофермента CYP3A, следует снизить дозу рибоциклиба до 200 мг.
Пациента следует проинформировать о необходимости избегать употребления в пищу грейпфрутов или грейпфрутового сока и всех продуктов, известных как ингибиторы изофермента CYP3A и способных увеличивать воздействие рибоциклиба.
Следует избегать одновременного применения мощных индукторов изофермента CYP3A, включая (но не ограничиваясь) следующие лекарственные средства: фенитоин, рифампицин, карбамазепин и зверобой продырявленный (Hypericum perforatum).
При одновременном применении у здоровых добровольцев субстрата изофермента CYP3A4 мидазолама с многократными дозами лекарственного средства (400 мг) экспозиция мидазолама увеличивается на 280% (в 3.80 раз) по сравнению с приемом только мидазолама. Рекомендуется соблюдать осторожность при применении лекарственного средства и субстратов изофермента CYP3A с узким терапевтическим индексом. Может потребоваться уменьшение дозы чувствительного субстрата изофермента CYP3A с узким терапевтическим индексом, включая (но, не ограничиваясь) следующими препаратами: алфентанил, циклоспорин, дигидроэрготамин, эрготамин, эверолимус, фентанил, пимозид, хинидин, сиролимус и такролимус, так как рибоциклиб обладает способностью увеличивать их экспозицию.
Исследования in vitro показали, что рибоциклиб в клинически значимых концентрациях обладает низким потенциалом ингибирования активности лекарственных переносчиков Р- гликопротеина, ОАТ1/3, ОАТР1В1/ВЗ, и ОСТ1. В клинических концентрациях рибоциклиб способен ингибировать белок резистентности рака молочной железы (BCRP), ОСТ2, МАТЕ1 и человеческий BSEP.
Следует избегать одновременного применения с лекарственными препаратами с известной способностью удлинять интервал QT, такими как антиаритмические средства. Следует избегать одновременного применения следующих антиаритмических препаратов (включая, но не ограничиваясь): амиодарон, дизопирамид, прокаинамид, хинидин и соталол; других лекарственных препаратов, удлиняющих интервал QT(включая, но не ограничиваясь): хлорохин, галофантрин, кларитромицин, ципрофлоксацин, левофлоксацин, азитромицин, галоперидол, метадон, моксифлоксацин, бепридил, пимозид и ондансетрон внутривенно вводимый.
Не рекомендуется применять в сочетании с тамоксифеном.
Рисарг — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-004670
Торговое наименование:
Рисарг
Международное непатентованное или группировочное наименование:
рибоциклиб
Лекарственная форма:
таблетки, покрытые пленочной оболочкой
Состав:
1 таблетка, покрытая пленочной оболочкой, содержит:
действующее вещество: рибоциклиб (в виде рибоциклиба сукцината) — 200,00 мг (254,40 мг);
вспомогательные вещества: целлюлоза микрокристаллическая, гипролоза пизкозамещенная, кросповидон (тип А), магния стеарат, кремния диоксид коллоидный;
оболочка: премикс оболочки белый, премикс оболочки черный, премикс оболочки красный;
премикс оболочки белый: поливиниловый спирт (частично гидролизованный), титана диоксид (Е 171), тальк, лецитин соевый, камедь ксантановая;
премикс оболочки черный: поливиниловый спирт (частично гидролизованный), краситель железа оксид черный (Е172), тальк, лецитин соевый, камедь ксантановая;
премикс оболочки красный: поливиниловый спирт (частично гидролизованный), краситель железа оксид красный (Е172), тальк, лецитин соевый, камедь ксантановая.
Описание:
круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, светлого серовато-фиолетового цвета, со скошенными краями. На одной стороне нанесена гравировка «RIC», на другой — «NVR».
Фармакотерапевтическая группа:
противоопухолевое средство, протеинкиназы ингибитор.
Код ATX:
L01XE42
Фармакологические свойства
Механизм действия
Рибоциклиб — селективный ингибитор циклин-зависимых киназ (CDK) 4 и 6. Эти киназы активизируются при образовании комплекса с D-циклинами и играют основную роль в сигнальных путях, регулирующих клеточный цикл и пролиферацию клеток. Комплекс циклин D-CDK4/6 регулирует прогрессию клеточного цикла путем фосфорилирования белка ретинобластомы (pRb).
In vitro рибоциклиб подавлял фосфорилирование белка Rb, что приводило к остановке клеточного цикла в фазе G1 и снижению пролиферации клеток в клеточных линиях рака молочной железы. In vivo монотерапия рибоциклибом в хорошо переносимых дозах вызывала регрессию опухоли, коррелируя с ингибированием фосфорилирования белка Rb. В исследованиях in vivo с использованием моделей с полученным от пациента ксенотрансплантатом рака молочной железы положительного по рецепторам эстрогена, комбинация рибоциклиба и ингибиторов ароматазы (например, летрозол) приводила к более выраженному ингибированию опухолевого роста по сравнению с каждым препаратом в отдельности. После прекращения применения препарата возобновление опухолевого роста отмечалось через 33 дня. Кроме того, оценивалась противоопухолевая активность комбинации рибоциклиба в сочетании с фулвестрантом в исследованиях in vivo у иммунодефицитных мышей, несущих ксенотрансплантанты эстроген-обогащенного рака молочной железы ZR751. Комбинация рибоциклиба и фулвестранта приводила к полному ингибированию опухолевого роста.
Фармакодинамика
По данным биохимического анализа рибоциклиб ингибирует ферментные комплексы СDК4/циклин-D1 и СDК6/циклин-D3 в концентрации 0,01 (4,3 нг/мл) и 0,039 мкмоль (16,9 нг/мл), которая обеспечивает 50% ингибирование (IC50) соответственно.
В исследованиях на клеточных линиях рибоциклиб ингибирует СDК4/6-опосредованное фосфорилирование белка Rb при средней IC50, составляющей 0,06 мкмоль (26 нг/мл). Рибоциклиб останавливает прогрессию клеточного цикла в фазе G1/S при средней IC50, составляющей 0,11 мкмоль (47,8 нг/мл) (определено методом проточной цитометрии). Рибоциклиб также ингибирует пролиферацию клеток при значении IC50, составляющем 0,8 мкмоль (34,8 нг/мл) (оценено по степени интеркаляции бромодезоксиуридина (BrdU)). Сходные значения IC50, полученные при анализах целевой модуляции, клеточного цикла и пролиферативной активности подтверждают, что блокада фосфорилирования белка Rb рибоциклибом непосредственно приводит к остановке перехода клеточного цикла из G1-фазы в S-фазу с последующим ингибированием пролиферации клеток. При анализе на панели клеточных линий рака молочной железы с известным статусом рецепторов эстрогена (ER), рибоциклиб демонстрировал более высокую эффективность в отношении клеточных линий с ER-положительным статусом, чем с ER-отрицательным.
Электрофизиология сердца
Для оценки влияния рибоциклиба на интервал QTc у пациентов с распространенным раком были собраны серии электрокардиограмм (ЭКГ), проведенных трижды после применения однократной дозы при достижении равновесного состояния. Анализ взаимосвязи фармакокинетики и фармакодинамики проводился, в общей сложности, у 997 пациентов, получавших лечение рибоциклибом в диапазоне доз от 50 до 1200 мг, включая 193 пациентов, получавших лечение рибоциклибом в дозе 600 мг. Данный анализ позволил предположить, что рибоциклиб вызывал зависимое от концентрации увеличение интервала QTc.
После приема рибоциклиба в рекомендуемой дозе 600 мг в комбинации с ингибиторами ароматазы или фулвестрантом рассчитанное среднее изменение QTcF относительно исходного значения составляло 22,00 мсек [90% Доверительный Интервал (ДИ): 20,56, 23,44] и 23,7 мсек [90% ДИ: 22,31, 25,08], соответственно, по сравнению с 34,7 мсек [90% ДИ: 31,64, 37,78] для комбинации рибоциклиба с тамоксифеном при геометрическом среднем значении максимальной концентрации в плазме крови (Cmax) в равновесном состоянии (см. раздел «С осторожностью»).
Фармакокинетика
Фармакокинетические параметры рибоциклиба были изучены у пациентов с распространенными солидными опухолями или лимфомами после приема внутрь суточных доз от 50 мг до 1200 мг. Здоровые добровольцы получали перорально однократные дозы в диапазоне от 400 мг до 600 мг или повторные дозы 400 мг ежедневно (8 дней).
Всасывание
После приема внутрь рибоциклиба у пациентов с распространенными солидными опухолями и лимфомами Сmах рибоциклиба в плазме крови достигалась через 1-4 часа (время достижения максимальной концентрации, Тmах). Наблюдалось небольшое сверхпропорциональное увеличение экспозиции (Cmax и площади под кривой “концентрация-время” (AUC)) рибоциклиба в изучаемом диапазоне доз (от 50 мг до 1200 мг). После повторного приема 1 раз/сут равновесное состояние обычно достигалось через 8 дней, рибоциклиб аккумулировал со средним геометрическим отношением, составляющим 2,51 (диапазон: от 0,972 до 6,40).
Влияние нищи
По сравнению с приемом натощак, прием внутрь рибоциклиба в таблетках, покрытых пленочной оболочкой, в однократной дозе 600 мг с высококалорийной пищей с высоким содержанием жира, не оказывает влияния на скорость и степень всасывания рибоциклиба (Cmax среднее геометрическое отклонение (СГО): 1,00; 90% ДИ: 0,898, 1.11; AUCinf СГО: 1,06; 90%ДИ: 1,01, 1,12) (см. раздел «Взаимодействие с другими лекарственными средствами»).
Распределение
Связывание рибоциклиба с белками плазмы крови человека in vitro составляло приблизительно 70% и не зависело от концентрации (от 10 нг/мл до 10 000 нг/мл). Рибоциклиб равномерно распределялся между эритроцитами и плазмой крови со средним отношением кровь/плазма in vivo 1,04. По данным анализа популяционной фармакокинетики кажущийся объем распределения в равновесном состоянии (Vss/F) составлял 1090 л.
Метаболизм
В исследованиях in vitro и in vivo показано, что у человека рибоциклиб подвергается экстенсивному метаболизму в печени главным образом при участии изофермента CYP3A4. После приема рибоциклиба внутрь в однократной дозе 600 мг [14С] у человека пути первичного метаболизма рибоциклиба включали окисление (деалкилирование, С и/или N-оксигенацию, окисление (-2Н)) и их комбинации. Первичные метаболиты рибоциклиба подвергались конъюгации путем N-ацетилирования, сульфатирования, связывания с цистеином, гликозилирования и глюкуронизации. Рибоциклиб был основным фармакологически активным соединением, присутствующим в плазме крови (43,5%). Основные циркулирующие метаболиты: метаболит М13 (CCI284, N-гидроксилирование), М4 (LEQ803, N-деметилирование) и Ml (вторичная глюкуронизация), на каждое представленное соединение приходилось 9,39%, 8,60% и 7,78% общей радиоактивности и 21,6%, 19,8% и 17,9% экспозиции рибоциклиба соответственно. Клиническая активность (фармакологические свойства и безопасность) рибоциклиба была преимущественно обусловлена неизмененным веществом, при этом циркулирующие метаболиты не имели существенного значения.
Рибоциклиб подвергался экстенсивному метаболизму, количество неизмененного вещества составляло 17,3% и 12,1% в кале и моче соответственно. Метаболит LEQ803 в значительном количестве определялся в кале, его количество составляло 13,9% и 3,74% принятой дозы в кале и моче соответственно. Другие метаболиты определялись и в кале, и в моче в небольших количествах (<2,78% принятой дозы).
Выведение
В равновесном состоянии при применении дозы 600 мг у пациентов с распространенным раком геометрическое среднее значение эффективного периода полувыведения из плазмы крови (на основании соотношения аккумуляции) составляло 32,0 часа (63% CV) и геометрическое среднее значение кажущегося клиренса (CL/F) при приеме внутрь составляло 25,5 л/ч (66% CV). Геометрическое среднее значение кажущегося конечного периода полувыведения рибоциклиба из плазмы крови (Т1/2) находится в пределах от 29,7 до 54,7 часов и геометрическое среднее значение CL/F рибоциклиба в диапазоне от 39,9 до 77,5 л/ч при дозе 600 мг во всех исследованиях у здоровых добровольцев.
Рибоциклиб выводится главным образом через кишечник и в небольшой степени почками. У 6 здоровых добровольцев мужского пола после приема однократной дозы [14С] рибоциклиба, 91,7% общей введенной радиоактивной дозы определялось в течение 22 дней; в основном выведение происходило через кишечник (69,1%), 22,6% дозы выводилось почками.
Линейность/нелинейность
Сверхпропорциональное увеличение экспозиции (Cmax и AUC) рибоциклиба наблюдалось как после однократного приема, так и после приема повторных доз в диапазоне от 50 мг до 1200 мг. Анализ данных ограничивается малым размером выборки в большинстве когорт, получающих определенные дозы, с наибольшим количеством данных, поступающих из когорты, получавшей дозу 600 мг.
Фармакокинетика у особых групп пациентов
Пациенты с нарушением функции почек
У пациентов с нарушениями функции почек легкой и средней степенями тяжести коррекция дозы не требуется. По данным популяционного фармакокинетического анализа, включавшего 438 пациентов с нормальной функцией почек (расчетная СКФ>90 мл/мин/1,73 м2), 488 пациентов с нарушением функции почек легкой степени (рСКФ от 60 до <90 мл/мин/1,73 м2) и 113 пациентов с нарушением функции почек средней степени (рСКФ от 30 до <60 мл/мин/1,73 м2), нарушения функции почек легкой и средней степени тяжести не влияют на экспозицию рибоциклиба. При оценке влияния почечной недостаточности на фармакокинетику рибоциклиба в дозе 400 мг/сут в исследовании нарушений функции почек среднее геометрическое значение AUCinf (геометрический коэффицент вариации (%CV), п) составило 5570 нг х ч/мл (22.8%, 7), 10900 нг х ч/мл (38.1%, 7), 13600 нг х ч/мл (20.9%, 3), максимальная концентрация в плазме крови Сmах (геометрический %CV, п) достигнула 356 нг/мл (15%, 7), 538 нг/мл (43,3%, 7), 593 нг/мл (11,3%, 3) для групп пациентов с нормальной функцией почек (7 пациентов, расчетная СКФ>90 мл/мин/1,73 м2), с нарушением функции почек тяжелой степени (7 пациентов, расчетная СКФ от 15 до <30 мл/мин/1,73 м2) и с терминальной стадией нарушения функции почек (3 пациента, расчетная СКФ 15 мл/мин/1,73 м2), соответственно. Для пациентов с нарушением функции почек тяжелой степени AUCinf увеличивалась в 1,96 раза, Сmах — в 1,51 раза по сравнению с пациентами с нормальной функцией почек. На основании данного исследования, для пациентов с нарушением функции почек тяжелой степени рекомендованная начальная доза рибоциклиба составляет 200 мг.
Пациенты с нарушением функции печени
У пациентов с нарушением функции печени легкой степени (класс А по классификации Чайлд-Пью) коррекция дозы не требуется; коррекция дозы необходима у пациентов с нарушениями функции печени средней и тяжелой степени (классы В и С по классификации Чайлд-Пью), рекомендуется начальная доза 400 мг. По данным фармакокинетического исследования у пациентов с нарушением функции печени, нарушение функции печени легкой степени не влияет на экспозицию рибоциклиба. Средняя экспозиция рибоциклиба увеличивалась менее чем в 2 раза у пациентов с нарушениями функции печени средней (СГО: 1,50 для Сmах; 1,32 для AUCinf) и тяжелой степени тяжести (СГО: 1,34 для Сmах; 1,29 для AUCinf). По данным популяционного фармакокинетического анализа, который включал 160 пациентов с нормальной функцией печени и 47 пациентов с нарушением функции печени легкой степени тяжести, нарушения функции печени легкой степени не влияли на экспозицию рибоциклиба, что подтверждает данные специальных исследований у пациентов с нарушениями функции печени.
Влияние возраста, пола и расы
Популяционный фармакокинетический анализ показал, что возраст, масса тела, пол и расовая принадлежность не оказывали клинически значимого влияния на системную экспозицию рибоциклиба, при котором могла бы потребоваться коррекция дозы.
Пациенты в возрасте >65 лет
Из 334 пациентов, которые получали рибоциклиб в исследовании III фазы (в группе, получавшей рибоциклиб плюс летрозол), 150 (44,9%) пациентов были в возрасте >65 лет и 35 (10,5%) пациентов были в возрасте >75 лет. Не наблюдалось существенных различий в отношении безопасности и эффективности рибоциклиба между этими пациентами и пациентами более молодого возраста.
Показания к применению
Препарат Рисарг показан для лечения положительного по гормональным рецепторам (HR+) и отрицательного по рецептору эпидермального фактора роста человека 2-го типа (HER2-) местнораспространеннного или метастатического рака молочной железы в комбинации с ингибитором ароматазы или фулвестрантом у женщин в качестве начальной гормональной терапии или у женщин, получавших гормональную терапию ранее.
Противопоказания
Повышенная чувствительность к рибоциклибу или любому из вспомогательных компонентов препарата.
Детский возраст до 18 лет (эффективность и безопасность не доказана).
Беременность и период грудного вскармливания.
С осторожностью
Следует соблюдать осторожность при применении препарата Рисарг у пациентов с нейтропенией 3-4 степени, с нарушениями функции почек тяжелой степени, у пациентов с гепатобилиарной токсичностью, у пациентов с наличием или значительным риском удлинения интервала QT (синдромом удлинения интервала QT, неконтролируемыми или клинически значимыми заболеваниями сердца, в том числе недавно перенесенным инфарктом миокарда, хронической сердечной недостаточностью, нестабильной стенокардией и брадиаритмией, нарушениями водно-электролитного баланса), при одновременном применении с лекарственными средствами, удлиняющими интервал QTc, с мощными ингибиторами изофермента CYP3A, при применении с субстратами изофермента CYP3A с узким терапевтическим индексом. На основании клинического исследования III фазы, рибоциклиб не рекомендовано принимать в комбинации с тамоксифеном по причине значимого повышения тамоксифен-опосредованного риска удлинения интервала QTcF (см. раздел «Способ применения и дозы»).
Применение при беременности и в период грудного вскармливания
Исследования на животных
В исследованиях эмбриофетального развития у крыс и кроликов беременные животные получали перорально рибоциклиб в дозах до 1000 мг/кг/сут и 60 мг/кг/сут соответственно в течение периода органогенеза.
Для организма беременных крыс доза 1000 мг/кг/сут была летальной. При дозе 300 мг/кг/сут наблюдалась незначительная, не являющаяся негативной, тенденция к снижению прибавки массы тела таких животных и фетотоксичность, о которой свидетельствует снижение массы тела плодов в сочетании с изменениями скелета, которые рассматривались как временные и/или связанные с более низкой массой тела плодов. При дозах 50 или 300 мг/кг/сут отсутствовало влияние на эмбриофетальную смертность или нежелательное воздействие на морфологию плода. При изучении воздействия на беременных крыс считалось, что доза, при которой не наблюдалось неблагоприятных эффектов (NOAEL), составляла 300 мг/кг/сут. При изучении воздействия на эмбриофетальное развитие считалось, что доза, при которой не наблюдалось эффектов (NOEL), составляла 50 мг/кг/сут.
У кроликов при дозах >30 мг/кг/сут отмечено нежелательное влияние на эмбриофетальное развитие, что проявлялось увеличением числа аномалий плода (пороков развития, внешних аномалий, изменения внутренних органов и скелета) и роста плода (снижение массы тела плода). Эти данные включали уменьшение долей легких, развитие дополнительных сосудов на дуге аорты, диафрагмальную грыжу, отсутствие добавочной доли или (частичное) слияние долей легких, уменьшение добавочной доли легкого (30 и 60 мг/кг), экстра/рудиментарное 13-е ребро, деформация подъязычной кости, уменьшение числа фаланг большого пальца. Данных о эмбриофетальной смертности выявлено не было. NOEL для беременного животного составляла не менее 30 мг/кг/сут, для эмбриофетального развития — составляла 10 мг/кг/сут.
При дозе 300 мг/кг/сут у крыс и 30 мг/кг/сут у кроликов, системная экспозиция в организме беременного животного (AUC) составляла 13 800 нг х ч/мл и 36 700 нг х ч/мл, что было в 1,5 раза ниже, чем достигавшаяся у пациентов при максимальной рекомендуемой дозе 600 мг/сут.
Женщины с сохраненным репродуктивным потенциалом
Женщинам с сохраненным репродуктивным потенциалом следует рекомендовать использование эффективных методов контрацепции (вероятность возникновения беременности <1%) во время терапии препаратом Рисарг и не менее чем в течение 21 дня после окончания приема препарата. До начала лечения препаратом Рисарг следует провести тест на возможную беременность.
Фертильность
В исследовании фертильности у самок крыс рибоциклиб не влиял на репродуктивную функцию, фертильность или ранние стадии эмбриогенеза при любой дозе до 300 мг/кг/сут (вероятно, при экспозиции ниже или равной клинической экспозиции пациентов при максимальной рекомендуемой дозе рибоциклиба 600 мг/сут на основании AUC).
Изучение фертильности у крыс-самцов не проводилось, однако в токсикологических исследованиях сообщалось об атрофических изменениях в семенниках у крыс и собак при экспозиции, которая была меньше или эквивалентна экспозиции у человека при максимальной рекомендуемой ежедневной дозе 600 мг/сут, на основании AUC. Не имеется достаточных клинических данных о влиянии препарата Рисарг на фертильность. Потенциальное влияние препарата Рисарг на фертильность мужчин и женщин неизвестно. По данным исследований на животных препарат Рисарг может нарушать фертильность у мужчин с сохраненным репродуктивным потенциалом.
Способ применения и дозы
Лечение препаратом Рисарг следует проводить только под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами.
Для женщин в пре-, перименопаузе применение комбинированного режима эндокринной терапии и рибоциклиба необходимо сочетать с функцией овариальной супрессии агонистами гонадотропин-рилизинг гормона (ГнРГ).
Режим дозирования
Общая целевая популяция
Рекомендуемая доза препарата Рисарг для приема внутрь составляет 600 мг (3 таблетки, покрытые пленочной оболочкой по 200 мг) 1 раз в сутки последовательно в течение 21 дня, с последующим перерывом в приеме препарата в течение 7 дней. Полный цикл составляет 28 дней.
Одновременно с препаратом Рисарг следует принимать фулвестрант в дозе 500 мг внутримышечно в дни 1, 15, 29 и затем раз в месяц, либо летрозол в дозе 2,5 мг/сут или другой ингибитор ароматазы 1 раз/сут в течение всего 28-дневного цикла. Следует ознакомиться с инструкцией по медицинскому применению ингибитора ароматазы и фулвестранта. Для лечения женщин в пре- или перименопаузе терапия комбинацией Рисарг с ингибитором ароматазы/фулвестрантом должна сопровождаться приемом агониста ГнРГ в соответствии с местными стандартами клинической практики. Необходимо принимать назначенные дозы препаратов ежедневно в одно и то же время, предпочтительно утром.
Применение препарата Рисарг не зависит от приема пищи. При возникновении рвоты у пациента после применения препарата Рисарг или при пропуске очередного приема, не следует принимать дополнительную дозу препарата в этот день. Следующую назначенную дозу необходимо принять в обычное время. Таблетки препарата Рисарг следует проглатывать целиком (не разжевывать, не разламывать и не делить перед проглатыванием). Не следует принимать поврежденные таблетки (разломанные, с трещинами или другими признаками повреждения).
Коррекция дозы
Для коррекции тяжелых или непереносимых нежелательных лекарственных реакций (НЛР) может потребоваться временная отмена, уменьшение дозы или полная отмена препарата Рисарг.
Указания по снижению (при необходимости) рекомендуемой дозы при НЛР перечислены в таблице 1.
Таблица 1
Указания по изменению рекомендуемой дозы при НЛР
|
Препарат Рисарг |
||
|
Доза |
Количество таблеток |
|
|
Начальная доза |
600 мг/сут |
Таблетки 200 мг х 3 |
|
Первое снижение дозы |
400 мг/сут |
Таблетки 200 мг х 2 |
|
Второе снижение дозы |
200 мг/сут* |
Таблетки 200 мг х 1 |
*Если требуется дальнейшее снижение дозы ниже 200 мг/сут, следует отменить препарат
В таблицах 2, 3, 4 и 5 представлены рекомендации по временной отмене приема, снижению дозы или полной отмене препарата Рисарг для коррекции отдельных НЛР. Принимая решение в соответствии с клинической ситуацией, лечащий врач должен руководствоваться планом ведения каждого пациента с учетом оценки соотношения пользы/риска в каждом индивидуальном случае.
Таблица 2
Изменение дозы и применение при гематологической токсичности
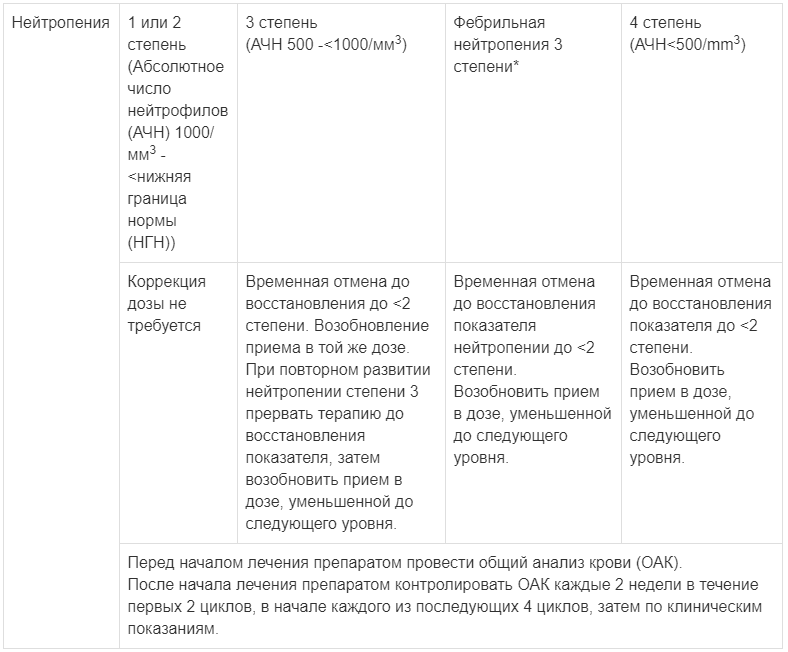 *Нейтропения 3 степени с единственным эпизодом лихорадки >38,3 С (или) выше 38 С в течение более часа и/или сопровождающаяся инфекцией
*Нейтропения 3 степени с единственным эпизодом лихорадки >38,3 С (или) выше 38 С в течение более часа и/или сопровождающаяся инфекцией
Градация степени токсичности согласно СТСАЕ 4.03 версии СТСАЕ=Общая терминология критериев для оценки нежелательных явлений.
Таблица 3
Изменение дозы и применение при гепатобилиарной токсичности
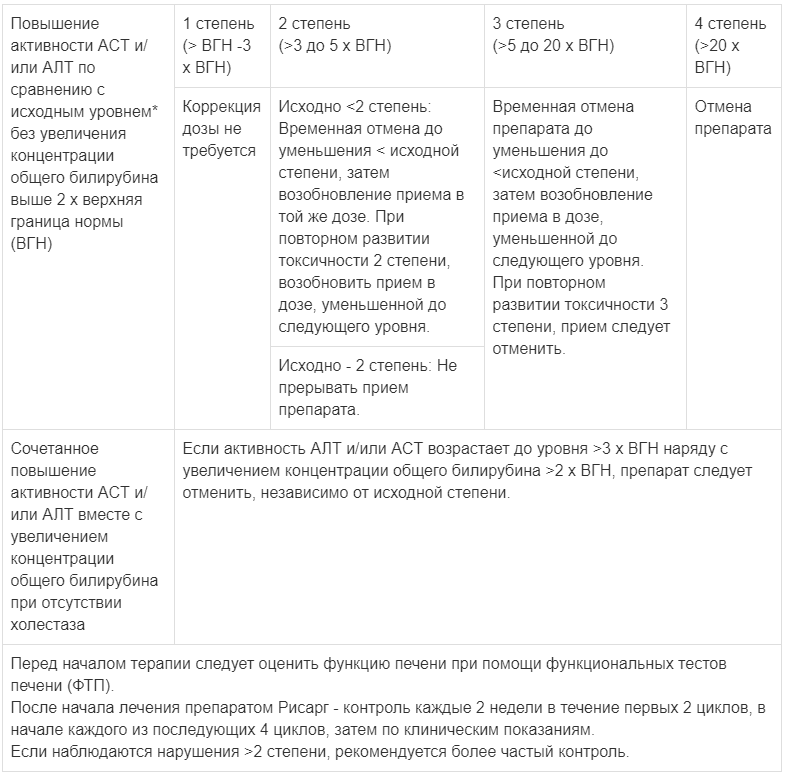 *Исходный уровень — до начала лечения.
*Исходный уровень — до начала лечения.
Градация степени токсичности согласно СТСАЕ 4.03 версии СТСАЕ=Общая терминология критериев для оценки нежелательных явлений.
Таблица 4
Изменение дозы и применение при удлинении интервала QT
|
На ЭКГ QTcF >480 мсек |
Временная отмена препарата Рисарг. |
|
На ЭКГ QTcF >500 мсек |
Если интервал QTcF превышает 500 мсек: временная отмена препарата Рисарг до уменьшения интервала QTcF <481 мсек, затем следует возобновить прием в дозе, уменьшенной до следующего уровня. |
|
Следует провести ЭКГ до начала лечения. |
Таблица 5
Изменение дозы и применение при других проявлениях токсичности*
 *за исключением гематологической токсичности, гепатобилиарной токсичности и удлинения интервала QT.
*за исключением гематологической токсичности, гепатобилиарной токсичности и удлинения интервала QT.
Градация степени токсичности согласно СТСАЕ 4.03 версии СТСАЕ=Общая терминология критериев для оценки нежелательных явлений._
Следует ознакомиться с инструкцией по медицинскому применению ингибитора ароматазы/фулвестранта/ГнРГ для рекомендаций по коррекции дозы в случаях развития токсических реакций и другой соответствующей информации по безопасности.
Изменение дозы препарата Рисарг при использовании с мощными ингибиторами изофермента СУР ЗА.
Следует избегать одновременного применения препарата Рисарг с мощными ингибиторами изофермента CYP3A, необходимо рассмотреть возможность альтернативной терапии в сочетании с менее мощными ингибиторами изофермента CYP3A. При необходимости одновременного применения мощного ингибитора изофермента CYP3A дозу препарата Рисарг следует уменьшить до 200 мг 1 раз/сут. При отмене мощного ингибитора изофермента CYP3A, дозу препарата Рисарг следует изменить (по прошествии по меньшей мере 5-кратного периода полувыведения мощного ингибитора изофермента CYP3A) до дозы, которая применялась перед началом применения мощного ингибитора изофермента CYP3A.
Особые группы пациентов
Применение у пациентов с нарушением функции почек
Не требуется коррекции дозы при применении препарата у пациентов с нарушением функции почек легкой или средней степени тяжести.
Вследствие отсутствия опыта применения препарата у пациентов с нарушением функции почек тяжелой степени, необходимо соблюдать осторожность при применении препарата Рисарг у пациентов данной категории.
Применение у пациентов с нарушением функции печени
На основании исследований нарушений функции печени с участием здоровых добровольцев и пациентов без злокачественного заболевания с нарушением функции печени, установлено, что коррекция дозы у пациентов с нарушением функции печени легкой степени тяжести (класс А по классификации Чайлд-Пью) не требуется. Коррекция дозы необходима у пациентов с нарушениями функции печени средней и тяжелой степени (классы В и С по классификации Чайлд-Пью соответственно), рекомендованная начальная доза составляет 400 мг. Применение препарата Рисарг у пациентов с раком молочной железы с нарушением функции печени средней и тяжелой степени не изучалось.
Применение у пациентов в возрасте 18 лет и младше
Данные по применению препарата Рисарг у пациентов в возрасте 18 лет и младше ограничены, безопасность и эффективность у данной категории пациентов не установлена.
Применение у пациентов в возрасте 65 лет и старше
Коррекция дозы у пациентов в возрасте 65 лет и старше не требуется.
Побочное действие
Резюме профиля безопасности
Общая оценка профиля безопасности препарата Рисарг основана на объединенном анализе данных, полученных у 1065 пациентов с положительным по гормонам HER2-отрицательным распространенным или метастатическим раком молочной железы, в котором 582 пациента получали препарат Рисарг в сочетании с ингибитором ароматазы, 483 пациента получали препарат Рисарг в комбинации с фулвестрантом.
Медиана продолжительности терапии в рамках объединенного анализа данных клинических исследований III фазы препаратом Рисарг составляла 16,53 месяцев, при этом 61,7% пациентов получали данное лечение >12 месяцев.
В рамках исследований III фазы уменьшение дозы в связи с развитием нежелательных явлений (НЯ), независимо от причины их возникновения, имело место у 37,3% пациентов, получавших препарат Рисарг безотносительно от типа препарата(ов) в комбинации и у 3,4% пациентов, получавших плацебо. Об окончательном досрочном прекращении лечения, обусловленном НЯ, сообщалось у 7,0% пациентов, получавших препарат Рисарг в сочетании с ингибитором ароматазы/фулвестрантом, и у 2,9% пациентов, получавших плацебо. Наиболее частыми НЯ, которые привели к досрочному прекращению лечения препаратом Рисарг в сочетании с любым препаратом исследуемых комбинаций, были повышение активности АЛТ (2,0%), повышение активности ACT (1,4%) и рвота (0,8%).
В объединенном анализе трех исследований III фазы о летальных исходах на фоне лечения сообщалось в 21 случаях (2,0%) у пациентов, получавших лечение препаратом Рисарг в комбинации с ингибитором ароматазы/фулвестрантом, по сравнению с 16 случаями (2,0 %) у пациентов, получавших лечение плацебо в сочетании с любым препаратом исследуемых комбинаций. Исключая наиболее частую причину летального исхода — прогрессирование заболевания, были репортированы 3 фатальных исхода при лечении препаратом Рисарг в любой комбинации. Причиной смертельных исходов являлись: развитие острого респираторного дистресс-синдрома, развитие острой дыхательной недостаточности и внезапная смерть (при развитии гипокалиемии III степени и удлинения интервала QT II степени). Несмотря на то, что было два случая нарушения дыхания, только один был подтвержден, как связанный с проводимой терапией.
Наиболее частыми НЛР в рамках объединенных исследований III фазы (о которых сообщалось с частотой >20% и частота которых в группе пациентов, получавших лечение препаратом Рисарг превышала частоту в группе пациентов, получавших лечение плацебо) были инфекции, нейтропения, лейкопения, головная боль, кашель, тошнота, утомляемость, диарея, рвота, запор, алопеция и кожная сыпь.
Наиболее частыми НЛР 3/4 степени в рамках объединенных исследований III фазы (о которых сообщалось с частотой >2% и частота которых в группе пациентов, получавших лечение препаратом Рисарг превышала частоту в группе пациентов, получавших лечение плацебо) были инфекции, нейтропения, лейкопения, анемия, отклонения от нормы функциональных тестов печени, лимфопения, гипофосфатемия и рвота.
Сводная таблица НЛР по данным клинического исследования III фазы
НЛР в клинических исследованиях III фазы (Таблица 6) сгруппированы в соответствии с классификацией органов и систем органов MedDRA, перечислены в порядке уменьшения частоты встречаемости.
Частота встречаемости оценивалась следующим образом: «очень часто» — >10%, «часто» ->1 — <10%, «нечасто» — >0,1% — <1%, «редко» — >0,01 — <0,1%, «очень редко» — <0,01%, включая отдельные сообщения, частота неизвестна (не может быть определена по имеющимся данным). В пределах каждой частотной категории НЛР распределены в порядке уменьшения частоты встречаемости.
Таблица 6
НЛР, наблюдавшиеся в клиническом исследовании III фазы
|
НЛР |
Категория частоты |
|
Инфекционные и паразитарные заболевания |
|
|
Инфекции1 |
Очень часто |
|
Нарушения со стороны крови и лимфатической системы |
|
|
Нейтропения |
Очень часто |
|
Лейкопения |
Очень часто |
|
Анемия |
Очень часто |
|
Лимфопения |
Часто |
|
Тромбоцитопения |
Часто |
|
Фебрильная нейтропения |
Часто |
|
Нарушения со стороны органа зрения |
|
|
Слезотечение |
Часто |
|
Сухость глаз |
Часто |
|
Нарушения со стороны обмена веществ и питания |
|
|
Уменьшение аппетита |
Очень часто |
|
Гипокальциемия |
Часто |
|
Гипокалиемия |
Часто |
|
Гипофосфатемия |
Часто |
|
Нарушения со стороны нервной системы |
|
|
Головная боль |
Очень часто |
|
Головокружение |
Очень часто |
|
Системное головокружение |
Часто |
|
Нарушения со стороны сердца |
|
|
Обморок |
Часто |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
Одышка |
Очень часто |
|
Кашель |
Очень часто |
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
|
|
Боль в спине |
Очень часто |
|
Нарушения со стороны желудочно-кишечного тракта |
|
|
Тошнота |
Очень часто |
|
Диарея |
Очень часто |
|
Рвота |
Очень часто |
|
Запор |
Очень часто |
|
Стоматит |
Очень часто |
|
Боли в животе2 |
Очень часто |
|
Дисгевзия |
Часто |
|
Диспепсия |
Часто |
|
Нарушения со стороны печени и желчевыводящих путей |
|
|
Гепатотоксичность3 |
Часто |
|
Нарушения со стороны кожи и подкожных тканей |
|
|
Алопеция |
Очень часто |
|
Кожная сыпь4 |
Очень часто |
|
Зуд |
Очень часто |
|
Эритема |
Часто |
|
Сухость кожи |
Часто |
|
Витилиго |
Часто |
|
Общие расстройства и нарушения в месте введения |
|
|
Утомляемость |
Очень часто |
|
Периферические отеки |
Очень часто |
|
Астения |
Очень часто |
|
Повышение температуры тела |
Очень часто |
|
Сухость во рту |
Часто |
|
Орофарингеальная боль |
Часто |
|
Лабораторные и инструментальные данные |
|
|
Отклонения ФТП5 |
Очень часто |
|
Повышение концентрации креатинина в сыворотке крови |
Часто |
|
Удлинение интервала QT на ЭКГ |
Часто |
1Инфекции: Инфекции мочевыводящих путей; инфекции дыхательных путей; гастроэнтериты; сепсис (<1%).
2Боли в животе: боли в животе, боли в верхней части живота.
3Гепатотоксичность: поражение клеток печени, лекарственное поражение печени, гепатотоксичность, печеночная недостаточность, аутоиммунный гепатит (единственный случай).
4Кожная сыпь: сыпь, макуло-папуллезная сыпь, зудящая сыпь.
5Отклонения ФТП: повышение активности АЛТ, повышение активности ACT, повышение концентрации билирубина в сыворотке крови.
Описание отдельных НЛР
Нейтропения
В исследованиях III фазы нейтропения была наиболее часто репортируемым отклонением по данным лабораторных исследований. В зависимости от степени тяжести нейтропении, контроль осуществлялся с помощью мониторинга лабораторных показателей, временной отмены приема препарата и/или изменения дозы. Частота досрочного прекращения приема препарата в связи с нейтропенией была низкой (0,8%).
Гепатобилиарная токсичность
В клинических исследованиях III фазы проявления гепатобилиарной токсичности чаще возникали у пациентов в группе, получавшей лечение препаратом Рисарг в сочетании с любой исследуемой комбинацией по сравнению с группой, получавшей плацебо в сочетании с любой исследуемой комбинацией (23,2% против 16,5% соответственно), при этом о НЯ 3/4 степени чаще сообщалось у пациентов, получавших лечение препаратом Рисарг в комбинации с ингибитором ароматазы/фулвестрантром (+/- ГнРГ) (11,4% против 5,4% соответственно). О временной отмене приема и/или коррекции дозы в связи с гепатобилиарной токсичностью сообщалось у 10,4% пациентов, получавших лечение препаратом Рисарг в сочетании с любой исследуемой комбинацией, главным образом, из-за повышения активности АЛТ (6,9%) и/или повышения активности ACT (6,1%). Досрочное прекращение лечения в группе пациентов, получавших лечение препаратом Рисарг вне зависимости от типа препарата(ов) в комбинации, обусловленное нарушениями ФТП, гепатотоксичностью отмечалось в 23,30% случаев по сравнению с 0,4% случаев в группе плацебо вне зависимости от типа препарата(ов) в комбинации.
Удлинение интервала QT
В клиническом исследованиях III фазы у 8,4% пациентов из группы, получавших лечение препаратом Рисарг и у 3,2% пациентов из группы, получавших плацебо наблюдалось не менее одного случая удлинения интервала QT (в т.ч. удлиненный интервал QT на ЭКГ, синкопе). Сообщалось о временной отмене приема в сочетании с коррекцией дозы вследствие удлинения интервала QT на ЭКГ и синкопе (обморока) у 2,3% пациентов, получавших лечение препаратом Рисарг в комбинации с летрозолом.
Централизованный анализ данных ЭКГ (среднее значение по данным 3-х ЭКГ) показал, что у 52 пациентов (4,9%) и 11 пациентов (1,4%) наблюдалось не менее 1 случая удлинения интервала QTcF >480 мсек после начала терапии в группе, получавшей лечение препаратом Рисарг и в группе, получавшей лечение плацебо, соответственно. Среди пациентов с удлинением интервала QTcF >480 мсек, медиана времени до появления симптома составила 15 дней независимо от вида комбинации, и данные изменения были обратимы при временной отмене и/или уменьшении дозы.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Сообщения о случаях передозировки препаратом Рисарг у человека ограничены. В случае передозировки показана поддерживающая и симптоматическая терапия.
Взаимодействие с другими лекарственными препаратами
Метаболизм рибоциклиба осуществляется преимущественно посредством изофермента CYP3A. In vivo рибоциклиб представляет собой зависимый от времени ингибитор изофермента CYP3A. Поэтому лекарственные препараты, которые влияют на ферментативную активность изофермента CYP3A, способны изменять фармакокинетику рибоциклиба.
Лекарственные средства, которые могут повышать концентрацию рибоциклиба в плазме крови
При одновременном применении у здоровых добровольцев мощного ингибитора изофермента CYP3A4 ритонавира и рибоциклиба отмечалось увеличение экспозиции последнего в 3,21 раза. Следует избегать одновременного применения мощных ингибиторов изофермента CYP3A, включая (но не ограничиваясь) следующие лекарственные средства: кларитромицин, индинавир, итраконазол, кетоконазол, лопинавир, нефазодон, нелфинавир, позаконазол, ритонавир, саквинавир, телапревир, телитромицин, верапамил и вориконазол. Следует рассмотреть возможность альтернативных лекарственных средств с менее выраженной способностью ингибировать изофермент CYP3A, необходимо также контролировать НЛР у пациентов.
При невозможности избежать одновременного приема препарата Рисарг с мощным ингибитором изофермента CYP3A, следует снизить дозу препарата Рисарг до 200 мг. Клинические данные по коррекции этой дозы отсутствуют. При отмене мощного ингибитора прием препарата Рисарг следует возобновить (по прошествии по меньшей мере 5-кратного периода полувыведения мощного ингибитора изофермента CYP3A) в дозе, применяемой до начала приема мощного ингибитора изофермента CYP3A. Рекомендуемая коррекция дозы не может быть оптимальной для всех пациентов из-за межиндивидуальной вариабельности, поэтому рекомендуется тщательный контроль НЛР. При проявлениях, связанных с токсичностью препарата Рисарг, дозу следует изменить, или временно отменить лечение до разрешения признаков токсичности препарата.
Пациента следует проинформировать о необходимости избегать употребления в пищу грейпфрутов или грейпфрутового сока и всех продуктов, известных как ингибиторы изофермента CYP3A и способных увеличивать воздействие рибоциклиба.
Лекарственные средства, которые могут понижать концентрацию рибоциклиба в плазме крови
При одновременном применении у здоровых добровольцев мощного индуктора изофермента CYP3A4 рифампина и рибоциклиба экспозиция последнего в плазме крови снижалась на 89%. Следует избегать одновременного применения мощных индукторов изофермента CYP3A, включая (но не ограничиваясь) следующие лекарственные средства: фенитоин, рифампицин, карбамазепин и зверобой продырявленный (Hypericum perforatum). Необходимо рассмотреть возможность одновременного применения альтернативных лекарственных средств, с отсутствующей или выраженной минимально способностью вызывать индукцию изофермента CYP3A.
Лекарственные средства, концентрацию в плазме крови которых может изменять рибоциклиб
При одновременном применении у здоровых добровольцев субстрата изофермента CYP3A4 мидазолама с многократными дозами препарата Рисарг (400 мг) экспозиция мидазолама увеличивается на 280% (в 3,80 раз) по сравнению с приемом только мидазолама. Использование физиологически обоснованной фармакокинетической модели (РВРК) позволяет предположить, что применение препарата Рисарг в клинической дозе 600 мг, как ожидается, увеличит AUC мидазолама в 5,2 раза. Рекомендуется соблюдать осторожность при применении препарата Рисарг и субстратов изофермента CYP3A с узким терапевтическим индексом. Может потребоваться уменьшение дозы чувствительного субстрата изофермента CYP3A с узким терапевтическим индексом, включая (но, не ограничиваясь) следующими препаратами: алфентанил, циклоспорин, дигидроэрготамин, эрготамин, эверолимус, фентанил, пимозид, хинидин, сиролимус и такролимус, так как рибоциклиб обладает способностью увеличивать их экспозицию.
При одновременном применении у здоровых добровольцев субстрата изофермента CYP1А2 кофеина с многократными дозами препарата Рисарг (400 мг) экспозиция кофеина увеличивалась на 20% (в 1,20 раза), по сравнению с приемом только кофеина. В клинически значимой дозе 600 мг, моделирование с использованием РВРК-моделей позволило предсказать лишь слабое ингибирующее влияние рибоциклиба на субстраты изофермента CYP1А2 (увеличение AUC <в 2 раза).
Лекарственные средства, являющиеся субстратами переносчиков
Исследования in vitro показали, что рибоциклиб в клинически значимых концентрациях обладает низким потенциалом ингибирования активности лекарственных переносчиков Р-гликопротеина, ОАТ1/3, ОАТР1В1/ВЗ, и ОСТ1. В клинических концентрациях рибоциклиб способен ингибировать белок резистентности рака молочной железы (BCRP), ОСТ2, МАТЕ1 и человеческий BSEP.
Пищевые взаимодействия
Препарат Рисарг можно принимать с пищей или натощак.
По сравнению с приемом натощак, применение рибоциклиба в форме таблеток, покрытых пленочной оболочкой, в однократной дозе 600 мг с высококалорийной пищей с высоким содержанием жира не оказывает влияния на скорость и степень всасывания рибоциклиба (Сmах СГО: 1,00; 90% ДИ: 0.898, 1,11; AUCinf СГО: 1,06; 90% ДИ: 1,01, 1,12).
Лекарственные средства, влияющие на pH желудочного сока
Рибоциклиб характеризуется высокой растворимостью при pH 4,5 или ниже и в биологической среде (при pH 5,0 и 6,5). Одновременное применение препарата Рисарг с лекарственными средствами, повышающими pH желудка, не оценивалось в клинических исследованиях; однако ни при популяционном фармакокинетическом анализе, ни при моделировании с использованием РВРК-моделей нарушения всасывания рибоциклиба не наблюдалось.
Прогнозируемое лекарственное взаимодействие
Антиаритмические препараты и другие лекарственные средства, которые способны удлинять интервал QT
Следует избегать одновременного применения препарата Рисарг с лекарственными препаратами с известной способностью удлинять интервал QT, такими как антиаритмические средства. Следует избегать одновременного применения следующих антиаритмических препаратов (включая, но не ограничиваясь): амиодарон, дизопирамид, прокаинамид, хинидин и соталол; других лекарственных препаратов, удлиняющих интервал QT (включая, но не ограничиваясь): хлорохин, галофантрин, кларитромицин, ципрофлоксацин, левофлоксацин, азитромицин, галоперидол, метадон, моксифлоксацин, бепридил, пимозид и ондансетрон внутривенно вводимый. Не рекомендуется применять препарат Рисарг в сочетании с тамоксифеном (см. раздел «С осторожностью»).
Особые указания
Нейтропения
У пациентов, получающих препарат Рисарг в сочетании с ингибитором ароматазы/фулвестрантом (+/- ГнРГ) в клинических исследованиях III фаз, наиболее частой НЛР была нейтропения (73,7%) и снижение количества нейтрофилов (на основании лабораторных данных) 3 или 4 степени отмечалось у 58,4% пациентов.
Среди пациентов, у которых наблюдалась нейтропения 2, 3 или 4 степени в клинических исследованиях III фазы, медиана времени до развития нейтропении 2, 3 или 4 степени составляла 16 дней. Медиана времени до разрешения нейтропении >3 степени (до нормализации или уменьшения до <3 степени) составляла 12 дней в группе лечения препаратом Рисарг в любой исследуемой комбинации. Тяжесть нейтропении зависела от концентрации. У пациентов, получающих препарат Рисарг в клинических исследованиях III фазы, у 1,4% пациентов отмечалось развитие фебрильной нейтропении. Пациент должен быть в обязательном порядке проинформирован врачом о необходимости срочно сообщать о любых случаях повышения температуры тела.
Перед началом терапии препаратом Рисарг следует выполнить ОАК. Необходим контроль ОАК каждые 2 недели в течение первых 2 циклов, в начале каждого из последующих 4 циклов и затем в соответствии с клиническими показаниями.
При тяжелой нейтропении может потребоваться временная отмена приема препарата Рисарг, уменьшение дозы или полная отмена препарата (см. Таблица 2 раздел «Способ применения и дозы»). У пациентов с развитием нейтропении 1 или 2 степени коррекция дозы препарата Рисарг не требуется. У пациентов с развитием нейтропении 3 степени без лихорадки следует временно отменить применение препарата Рисарг до восстановления до <2 степени, и затем возобновить в той же дозе. При повторном развитии нейтропении 3 степени без лихорадки следует временно отменить применение препарата Рисарг до восстановления показателя, затем возобновить в дозе, уменьшенной до следующего уровня. У пациентов с фебрильной нейтропенией 3 степени (АЧН от 500 до <1000/мм3 с единственным эпизодом лихорадки >38,3°С (или) выше 38°С в течение более 1 часа и/или с одновременным развитием инфекции), или у пациентов с развитием нейтропении 4 степени, применение препарата Рисарг следует временно отменить до восстановления нейтропении <2 степени, затем следует возобновить в дозе, уменьшенной до следующего уровня.
Гепатобилиарная токсичность
В клинических исследованиях III фазы наблюдалось повышение активности трансаминаз. Сообщалось об увеличении активности АЛТ (9,7% против 1,5%) и активности ACT (6,7% против 2,1%) 3 или 4 степени в группах пациентов, получающих препарат Рисарг в сочетании с любой исследуемой комбинацией и в группе плацебо в сочетании с любой исследуемой комбинацией соответственно.
В клинических исследованиях III фазы при терапии препаратом Рисарг в комбинации с ингибитором ароматазы/фулвестрантом (+/- ГнРГ) увеличение активности АЛТ или активности ACT 3 или 4 степени наблюдалось в 83,2% (89/107) случаев в течение первых 6 месяцев лечения. Как сообщалось, в большинстве случаев увеличение активности АЛТ и ACT наблюдалось без повышения концентрации билирубина. Среди пациентов с увеличением активности АЛТ/АСТ 3 или 4 степени, медиана времени до развития этой реакции составляла 85 дней в группе лечения препаратом Рисарг в сочетании с любой исследуемой комбинацией. Медиана времени до разрешения этой реакции (до нормализации или <2 степени) составляла 22 дня в группе лечения препаратом Рисарг в комбинации с ингибитором ароматазы/фулвестрантом (+/- ГнРГ). Одновременное повышение активности АЛТ или активности ACT более чем в три раза выше ВГН и концентрации общего билирубина более чем в два раза выше ВГН, с нормальной концентрацией щелочной фосфатазы и при отсутствии холестаза наблюдалось у 6 пациентов (1,2%) пациентов (4 пациента в постменопаузе при приеме комбинации препарата Рисарг с ингибиторами ароматазы и 2 пациента в постменопаузе при приеме комбинации Рисарг с фулвестрантом; у всех пациентов происходила нормализация показателей в течение 154 и 532 дней, соответственно, после отмены препарата). При приеме Рисарг в сочетании с ингибиторами ароматазы/фулвестрантом+ГнРГ для женщин в пременопаузе подобных случаев не наблюдалось.
ФТП следует проводить до начала терапии препаратом Рисарг. Контроль ФТП проводят каждые 2 недели в течение первых 2 циклов, в начале каждого из последующих 4 циклов, и затем в соответствии с клиническими показаниями.
При выраженном повышении активности трансаминаз может потребоваться временная отмена приема, уменьшение дозы или полная отмена препарата Рисарг (см. Таблица 3 раздела «Способ применения и дозы»). Рекомендации для пациентов с исходным повышением активности АСТ/АЛТ >3 степени не установлены.
Для пациентов с увеличением активности ACT и/или АЛТ по сравнению с исходным уровнем (до начала лечения) без повышения концентрации общего билирубина (ОБ) более 2xВГН представлены следующие изменения дозы и указания по применению:
При 1 степени (повышение активности ACT и/или АЛТ от> ВГН до 3xВГН) коррекция дозы препарата Рисарг не требуется.
У пациентов с исходными значениями, соответствующими <2 степени (повышение активности ACT и/или АЛТ от <ВГН до 3xВГН) — если развивается 2 степень (повышение активности ACT и/или АЛТ от >3 до 5xВГН), препарат Рисарг следует временно отменить до значений < исходной степени, затем применение следует возобновить в той же дозе. Если 2 степень развивается повторно, следует возобновить применение препарата Рисарг в дозе, сниженной до следующего уровня.
У пациентов с исходными значениями, соответствующими 2 степени (повышение активности ACT и/или АЛТ от >3 до 5xВГН) — если 2 степень сохраняется, то временная отмена препарата Рисарг не требуется.
У пациентов с развитием 3 степени (повышение активности АЛТ и/или ACT от >5 до 20xВГН) — применение препарата Рисарг следует временно отменить до значений < исходной степени, затем применение следует возобновить в дозе, уменьшенной до следующего уровня. Если 3 степень развивается повторно, то препарат следует отменить.
У пациентов с развитием 4 степени (повышение активности АЛТ и/или ACT >20хВГН) препарат Рисарг следует отменить.
Для пациентов с сочетанием повышения активности ACT и/или АЛТ вместе с повышением концентрации общего билирубина при отсутствии холестаза, следующие изменения дозы и указания по применению:
У пациентов при концентрации общего билирубина >2xВГН на фоне активности АЛТ и/или ACT >3xВГН, независимо от исходной степени токсичности, препарат Рисарг следует отменить.
Удлинение интервала QT
В исследованиях III фазы обзор данных ЭКГ пациентов с распространенным или метастатическим раком молочной железы, получивших терапию препаратом Рисарг в сочетании с любой исследуемой комбинацией показал, что у 14 пациентов (1,3%) значение QTcF после исходного уровня составляло >500 мсек, у 59 пациентов (5,6%) отмечалось увеличение интервала QTcF >60 мсек от исходного уровня. О случаях желудочковой тахикардии типа «пируэт» не сообщалось.
При приеме комбинации препарата Рисарг с ингибиторами ароматазы/тамоксифеном и ГнРГ у пациентов в пременопаузе наблюдаемое среднее увеличение QTcF от базовой линии было ~ на 10 мсек выше в подгруппе плацебо в сочетании с тамоксифеном по сравнению с подгруппой плацебо в сочетании с нестероидными ингибиторами ароматазы. Таким образом, тамоксифен способствует риску удлинения интервала QTcF, что может вносить вклад в значение интервала QTcF при приеме комбинации рибоциклиба с тамоксифеном. Отмечалось увеличение интервала QTcF >60 мсек от исходного уровня у 6/90 (6,7%) пациентов в группе плацебо в комбинации с тамоксифеном, у 14/87 (16,1%) пациентов в группе рибоциклиба в сочетании с тамоксифеном и у 18/245 (7,3%) пациентов в группе рибоциклиба в сочетании с нестероидными ингибиторами ароматазы.
До начала лечения необходимо провести ЭКГ. Лечение препаратом Рисарг следует начинать только у пациентов с продолжительностью QTcF менее 450 мсек. Повторное ЭКГ требуется проводить приблизительно на 14 день первого цикла и в начале второго цикла, затем в соответствии с клиническими показаниями.
Следует проводить соответствующий контроль содержания электролитов (включая содержание калия, кальция, фосфатов и магния) в сыворотке крови до начала лечения, в начале первых 6 циклов и затем в соответствии с клиническими показаниями. Перед началом и в течение терапии препаратом Рисарг необходимо провести коррекцию любых изменений содержания электролитов.
Следует избегать применения препарата у пациентов с наличием или значительным риском удлинения интервала QTc, включая:
— синдром удлинения интервала QT;
— неконтролируемое или клинически значимое заболевание сердца, в том числе недавно перенесенный инфаркт миокарда, хроническая сердечная недостаточность, нестабильная стенокардия и брадиаритмия;
— изменения содержания электролитов.
Следует избегать применения препарата Рисарг с лекарственными средствами, которые способны удлинять интервал QTc и/или являются мощными ингибиторами изофермента CYP3A, так как это может привести к клинически значимому удлинению интервала QTcF. При выявлении удлинения интервала QT может потребоваться временная отмена приема, уменьшение дозы или полная отмена препарата Рисарг. На основании клинического исследования III фазы, рибоциклиб не рекомендовано принимать в комбинации с тамоксифеном по причине значимого повышения тамоксифен-опосредованного риска удлинения интервала QTcF (см. Таблица 4 раздела «Способ применения и дозы»).
При удлинении на ЭКГ QTcF>480 мсек:
— Лечение препаратом Рисарг следует отменить.
— Если интервал QTcF уменьшается до <481 мсек, следует возобновить применение препарата в той же дозе.
— Если интервал QTcF вновь увеличился до >481 мсек, то применение препарата Рисарг следует прервать до длины QTcF <481 мсек, затем применение следует возобновить в дозе, уменьшенной до следующего уровня.
При длине QTcF >500 мсек не менее чем в 2 отдельно проведенных ЭКГ-исследованиях, необходимо принять следующие меры:
— временно прекратить лечение препаратом Рисарг.
— если QTcF сократился до <481 мсек, применение можно возобновить в дозе, уменьшенной до следующего уровня.
При удлинении интервала QTcF до более чем 500 мсек или наличии изменений более чем на 60 мсек от исходного значения в сочетании с желудочковой тахикардией типа «пируэт» или полиморфной желудочковой аритмией или симптомов/признаков развития аритмии тяжелой степени, препарат Рисарг следует окончательно отменить.
Влияние на способность управлять транспортными средствами и/или механизмами
Препарат Рисарг оказывает незначительное влияние на способность управлять транспортными средствами и/или механизмами. Пациентам следует соблюдать осторожность при управлении транспортными средствами и/или механизмами, учитывая возможность развития повышенной утомляемости во время применения препарата.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 200 мг. По 14 или 21 таблетке в блистер из ПТФХЭ/ПВХ и алюминиевой фольги или из ПА/Ал/ПВХ и алюминиевой фольги. По 3 блистера вместе с инструкцией по медицинскому применению в картонную пачку
Условия хранения
При температуре не выше 30°С.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять препарат по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
Производство готовой лекарственной формы
Новартис Сингапур Фармасьютикал Мэньюфекчуринг Пте. ЛТД, Туас Бей Лейн 10, 637461 Сингапур, Сингапур / Novartis Singapore Pharmaceutical Manufacturing Pte. Ltd., 10 Tuas Bay Lane, 637461, Singapore, Singapore
Первичная упаковка
Новартис Фарма Продакшнз ГмбХ, Офлингер Штрассе 44, 79664 Вер, Германия /Novartis Pharma Produktions GmbH, Oflinger Str. 44, 79664 Wehr, Germany
Вторичная упаковка / выпускающий контроль качества
Новартис Фарма Продакшнз ГмбХ, Офлингер Штрассе 44, 79664 Вер, Германия /Novartis Pharma Produktions GmbH, Oflinger Str. 44, 79664 Wehr, Germany
Общество с ограниченной ответственностью «СКОПИНСКИЙ ФАРМАЦЕВТИЧЕСКИЙ ЗАВОД» (ООО «СКОПИНФАРМ»), 391800, Рязанская обл., Скопинский район. Промышленная зона № 1 тер., здание 1, Россия
Получить дополнительную информацию о препарате, а также направить претензии и информацию о нежелательных явлениях можно по следующему адресу в России
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 72, корпус 3
В случае упаковки в РФ направить претензии и информацию о нежелательных явлениях можно также но следующему адресу:
000«СК0ПИНФАРМ» 391800, Россия, Рязанская обл., Скопинский район, Промышленная зона № 1 тер., здание 1
Купить Рисарг в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Статья подготовлена специалистом исключительно в ознакомительных целях. Мы настоятельно призываем вас не заниматься самолечением. При появлении первых симптомов — обращайтесь к врачу.

Володина Светлана Игоревна
Кардиолог, терапевт. Кандидат медицинских наук. Стаж 11 лет. Место работы: ГКБ №63, ДКЦ №1
Задать вопрос
Рибоциклиб — противоопухолевый препарат, ингибитор протеинкиназы. Инструкция по применению включает рак молочной железы с метастазами и положительным рецептором к гормонам. Предотвращает дальнейший опухолевый рост. Применяется отдельно или вместе с другими медикаментами. Улучшает прогностические данные. Изготавливаются таблетированные формы для перорального применения.
Купить Рибоциклиб можно по рецептурной форме, полученной от доктора. Медикаментозная терапия таким средством проводится только под контролем специалиста. Нужна предварительная диагностика. Врач учитывает особенности заболевания и анамнез больного. Самолечение запрещено.
Состав Рибоциклиба
Двести миллиграммов одноименного действующего вещества в таблетке. Дополнительные химические соединения: клетчатка, кросповидон, магниевая соль стеариновой кислоты, гипролоза, кремнезем и оболочечные компоненты. Для приема внутрь.
Терапевтическое действие
Это химическое соединение, избирательно ингибирующее зависимые от цилкина киназы (CDK) четвертого и шестого типа. Эти компоненты становятся активными при соединении с D циклинами и выполняют важную роль в проведении сигнала, отвечающего за клеточную деятельность и пролиферацию. Комплекс из циклина и CDK 4-6 типа управляет клеточным циклом с помощью фосфорилирования протеина типа p-Rb. В исследованиях рибоциклиб снижает фосфорилирование этого протеина, из-за чего клеточный цикл останавливается на G1-этапе. Происходит снижение клеточного деления в злокачественных линиях опухоли молочной железы В организме человека отдельное использование этого препарата в переносимых дозировках сопровождается регрессией патологического очага, что связано с подавлением фосфорилирования p-Rb.
Изучение действия рибоциклиба в организме с применением моделей у людей с ксено-трансплантатом злокачественного новообразования груди и положительными экстрогеновыми рецепторными структурами показало, что совмещение этого лекарственного вещества и антиэстрогенных медикаментов становится причиной усиленного подавления роста опухоли, если сравнивать с монотерапией этими лекарствами. После остановки использования средства новообразование вновь начинает расти через тридцать три дня.
Фармакодинамика
Биохимическое исследование показывает, что активный компонент подавляет ферменты C0K4-циклин01 и C0K6-циклин03 в концентрационных уровнях 4,3 и 16,9 нанограммов на миллилитр. Это обеспечивает подавление на пятьдесят процентов. Изучение на клеточных компонентах показало, что вещество подавляет C0K4/6-зависимую пролиферацию p-Rb при усредненном показателе 1C50, когда он равен 0,06 мкмоль или двадцати шести нанограммов на миллилитр. Химическое соединение останавливает клеточное преобразование из фазы G1 в состояние S, что подтверждается путем цитометрического измерения при усредненном показателе IC50 47 нанограммов на миллилитр.

Фармакокинетические особенности
Параметры рибоциклиба были определены у людей с распространившимися солидными новообразованиями или лимфомами после применения дозировок от пятидесяти до тысячи двухсот миллиграммов в день. У людей без других заболеваний после приема внутрь разовой дозировки от четырехсот до шестисот миллиграммов или новой дозы в четыреста миллиграммов каждый день в течение восьми суток были определены особенности. Пероральное введение у людей такими заболеваниями сопровождается появлением наивысшей концентрации в кровотоке в течение четырех часов. Возникало незначительное усиленно пропорциональное повышение экспозиции в дозировках от пятидесяти до тысячи двухсот миллиграммов.
После нового применения средства раз в день равновесный уровень возникает через восемь суток. Действующее вещество накапливается с усредненным геометрическим отношением в два с половиной. Если сравнивать с проглатыванием таблетки на пустой желудок, пероральное введение средства в этой лекарственной формы в дозировке шестьсот миллиграммов с продуктами высокой калорийности и большим содержанием жира не воздействует на скоростной параметр и выраженность поступления вещества в кровоток из пищеварительного тракта. Рибоциклиб соединяется с плазменными протеинами примерно на семьдесят процентов. Этот показатель не определяется концентрацией.
Распределение и метаболизм
Происходит сбалансированное распределение вещества между красными кровяными клетками и плазмой с усредненным соотношением 1,04. Исследование показало, что показатель фармакокинетики Vss-F равен тысячи девяноста литрам. Преобразование происходит экстенсивно в печеночной ткани преимущественно с помощью CYP3-A4. После перорального введения в дозировке шестьсот миллиграммов у пациента первичное преобразование связано с окислительным процессом и другими биохимическими механизмами. Первые метаболические производные активного компонента конъюгируются с помощью ацетилирования, сульфатирования, соединения с цистеином и других путей. Исходной действующее вещество при этом главный компонент с терапевтическими свойствами, содержащийся в кровотоке на сорок три с половиной процента.
Происходит усиленное метаболическое преобразование, при котором исходная форма обнаруживается в каловых массах и моче. При равновесном уровне использование дозировки в шестьсот миллиграммов у людей с распространившейся опухолью усредненный показатель эффективного T1/2 из кровотока составляло тридцать два часа.
Показания к применению Рибоциклиба
Лекарственное средство показано для проведения медикаментозной терапии у пациентов в постменопаузальный период с положительным по рецепторными структурами к гормональным веществам (HR-плюс) и отрицательным по рецепторными структурам (HER2-минус) распространившимся раком молочной железы или РМЖ с метастазами. Совместно с медикаментами, ингибирующими ароматазу в качестве первичного гормонального лечения.
Противопоказания
- Гиперчувствительность к активному компоненту или вспомогательным химическим соединениям.
- Возраст пациента до восемнадцати лет.
- Вынашивание ребенка.
- Кормление грудью.
Врач проверят анамнез перед назначением Рибоциклиба.
Осторожное использование
Врач учитывает дополнительные факторы риска в следующих случаях: снижение нейтрофилов третьей или четвертой степени, ухудшение почечной деятельности тяжелой степени, повышение QT или предрасположенность к такому состоянию, гепатобилиарная токсичность, совместное использование повышающих QTc медикаментов, совмещение с сильно ингибирующими CYP3A средствами, одновременное использование субстратов CYP-3A с узким терапевтическим индексом.
Беременные и кормящие женщины
Изучение Рибоциклиба на животных проводилось для определения вреда химического соединения во время беременности. Применялись дозировки для приема внутрь до тысячи миллиграммов на килограмм в день и шестьдесят миллиграммов на килограмм в сутки в ходе формирования внутренних органов. Дозировка в тысячу миллиграммов на килограмм в день была смертельной для крыс. Триста миллиграммов на килограмм в сутки приводили к умеренному понижению прибавки веса и токсичности для эмбриона. Сопровождалось изменением со стороны опорно-двигательного аппарата и другими нарушениями. Дозировка в пятьдесят или триста миллиграммов на килограмм в день не вызывала смерть зародыша или негативного влияния на его созревание.

При исследовании воздействия средства на крыс во время беременности были сделаны выводы о том, что дозировка, при которой не возникают нежелательные реакции, составляет триста миллиграммов на килограмм в день. Исследования влияния на развитие зародыша показало, что безопасная в этом случае дозировка составляет пятьдесят миллиграммов на килограмм в день. У кроликов при дозировках больше тридцати миллиграммов на килограмм в день возникает неблагоприятное воздействие на развитие организма внутри утробы. Увеличивается риск нарушения развития плода, включая морфологические и опорно-двигательные расстройства, включая уменьшение веса. Эта информация включая нарушение формирования легочной ткани, аорты и других анатомических структур.
Во время беременности и лактации использовать Рибоциклиб нельзя.
Дополнительно
Пациентам репродуктивного возраста следует применять надежные способы предотвращения зачатия, когда риск оплодотворения меньше одного процента. Эти меры следует принимать в ходе медикаментозной терапии с использованием средства и как минимум на протяжении трех недель после прекращения использования таблеток. До начала лекарственного лечения нужно провести исследование на вынашивание ребенка. Влияние лекарственного вещества на половую функцию у животных не организовывалось, но в изучении токсикологии говорилось о возможной атрофии в области семенников при экспозиции, соответствующей или меньшей человеческой наивысшей дневной дозировке в шестьсот миллиграммов в день. С учетом AUC-показателя.
Нет полной информации о воздействии активного компонента на половую функцию. Возможное влияние химического соединения на репродуктивную деятельность у пациенток и пациентов не изучено. Исследовательская деятельность на животных показала, что лечение способно вызывать нарушения со стороны репродуктивной работы у мужчин с изначально работающими половыми органами.
Побочные эффекты
- Кроветворная система: снижение численности нейтрофилов, уменьшение количества лейкоцитов, анемическое состояние, понижение уровня лимфоцитов, снижение численности тромбоцитов, фебрильная форма уменьшения нейтрофилов.
- Офтальмологические расстройства: избыточное выделение слезной жидкости, недостаточное увлажнение.
- Метаболизм: ухудшение аппетита, понижение уровня кальция, уменьшение количества калия, пониженный уровень фосфатов.
- Респираторная система: нарушение дыхания, кровоизлияния из носа.
- Пищеварительная система: позывы к рвоте, выделение рвотных масс, жидкий стул, задержка каловых масс, воспаление слизистой оболочки ротовой полости, неприятные ощущения в абдоминальной области, дисгевзия, диспепсические явления.
- Печеночная и желчная системы: токсичность для печени.
- Дерматологические проявления: выпадение волос, высыпания на покровных тканях, зудение, эритема.
- Общие проявления: слабость, отечность разных участков организма, астеническое состояние, лихорадочное состояние.
- Результаты диагностики: изменение показателей ФТГК, увеличение уровня креатинина в кровотоке, снижение веса, удлинение QT на электрокардиограмме.
- Опорно-двигательный аппарат: болезненность в области спины.
- Сердечная деятельность: обморочные состояния.
- Нервная деятельность: цефалгия, трудности с засыпанипем,
- Инфекции: инфекционное поражение выделительной системы в области выводящего мочу тракта.
Если возникают нежелательные реакции, следует сразу же связаться с лечащим врачом. Возможны разные методы борьбы с побочными эффектами, включая изменение схемы терапии, снижение дозы, организацию перерыва и поиск замены. Все на усмотрение доктора.
Инструкция по применению Рибоциклиба
Медикаментозная терапия с применением этого средства организуется в медицинском учреждении под контролем доктора, имеющего достаточную квалификацию для проведения противоопухолевой терапии. Схема терапии подбирается специалистом с учетом анамнеза, индивидуальной переносимости и особенностей патологического состояния. Рекомендованная дозировка таблеток для перорального использования составляет шестьсот миллиграммов. Это три таблетки по двести миллиграммов. Один раз в день на протяжении двадцати одних суток. Дальше делается пауза на семи дней. Полноценный курс терапии составляет двадцать восемь суток. Совместно с этим средством нужно использовать летрозол в дозировке два с половиной миллиграмма или другое ингибирующее ароматазу средство однократно в день на протяжении всех двадцати восьми суток.

Нужно полностью прочитать официальную инструкцию по использованию выбранного ингибитора ароматазы. Важно использовать подобранную врачом схему дозирования каждый день в одинаковое время. Желательно в утренние часы. Использование средства не определяется временем питания. При выделении рвотных масс после использования таблеток или на фоне пропуска дозы, не нужно компенсировать прием в этот день. Следующую дозировку принимать в стандартное время. Таблетированную форму нужно проглатывать без разжевывания. Не нужно нарушать целостность оболочки лекарственной формы, поскольку из-за этого нарушится действие средства.
Дополнительные сведения
- Нет необходимости изменять режим дозирования при использовании Рибоциклиба у людей с ухудшением почечной деятельности легкого или умеренного типа. Из-за недостатка информации о применении лекарственного вещества у людей с тяжелым нарушением работы почек, нужно проводить лечение осторожно и проводить тщательный контроль за состоянием больного.
- Медикаментозная терапия у людей с ухудшением состояния печени проводится в стандартных дозировках, если степень нарушения работы органа соответствует классу A по Чайлд Пью. Были проведены соответствующие исследования. Нужна адаптация режима дозирования, если есть ухудшение печеночной деятельности тяжелого типа, класса B или C по Чайлд Пью.
- Первичная дозировка рекомендуется в виде четырехсот миллиграммов. Использование средства у людей с раком молочной железы и ухудшением печеночной деятельности среднего или тяжелого типа не исследовалось.
- Недостаточно информации о применении таблеток Рибоциклиб у пациентов несовершеннолетнего возраста. Нет сведений о безопасности и результативности терапии у этой категории людей. Из-за этого запрещено назначать средство пациентам до восемнадцати лет.
- Не нужно изменять режим дозирования у людей в возрасте от шестидесяти пяти лет.
- Использовать любые медикаменты вместе с Рибоциклибом можно с разрешения лечащего врача. В полной инструкции есть все варианты взаимодействий.
- Не следует принимать больше допустимой дозы. Могут возникнуть негативные последствия. В случае передозировки следует обратиться за врачебной помощью.
- Больные, принимающие этот препарат вместе с летрозолом, чаще всего жалуются на следующие нежелательные реакции: понижение количества нейтрофилов, уменьшение численности этих клеток третьей или четвертой степени. Такие эффекты появлялись практически у каждого второго больного. Среди людей, имеющих понижение уровня нейтрофилов второй, третьей или четвертой степени, медианный период до формирования такого осложнения составляет шестнадцать дней.
- Медианный период до исчезновения сниженного уровня нейтрофилов третьей или меньшей степени составляет пятнадцать суток у людей, применяющих Рибоциклиб вместе с летрозолом. Выраженность этой нежелательной реакции определяется уровнем вещества. У людей, принимающих средство вместе с летрозолом, в 1,5 процентах случаев возникает фебрильное снижение нейтрофилов. Нужно обязательно об этом сообщить доктору. Важно контролировать температуру тела.
- Лекарственное вещество умеренно влияет на скорость реакции. Нужно осторожно заниматься вождением или другими опасными видами деятельности во время лечения.
Вся дополнительная информация, включая схемы лечения и медикаментозные взаимодействия, есть в полной инструкции. Это обзорный материал.
Аналоги Рибоциклиба
В аптечной сети можно найти медикаменты с таким же действующим веществом. На сегодняшний день на отечественном фармацевтическом рынке представлены только две коммерческих формы этого препарата: Кискали и Рисарг. Продаются в таблетированной форме. Не следует заниматься поиском замены без лечащего врача.
Отзывы и цены
Это относительно новое средство, которое уже успели оценить специалисты по онкологическим заболеваниям. Врачи сообщают, что при наличии показаний лечения рака молочной железы с помощью этого средства благоприятно влияет на прогностические данные. При правильной терапии редко возникают серьезные нежелательные реакции.
Средняя цена Рибоциклиба составляет 114000 рублей.
Видео
Это эффективный препарат для лечения РМЖ. Выписывается только специалистом.
© О.А. Павликова, Д.В. Пасынков, Л.Х. Мухаматгалеева, О.О. Пасынкова, И.В. Клюшкин, А.Л. Федоров, 2022
УДК 618.19-006.66-08
О.А. Павликова1,2, Д.В. Пасынков1,2,4, Л.Х. Мухаматгалеева1,2, О.О. Пасынкова2, И.В. Клюшкин3, А.Л. Федоров2
1ГБУ Республики Марий Эл «Республиканский онкологический диспансер», г. Йошкар-Ола
2ФГБОУ ВО «Марийский государственный университет», г. Йошкар-Ола
3ФГБОУ ВО «Казанский государственный медицинский университет» МЗ РФ, г. Казань
4Казанская государственная медицинская академия ― филиал ФГБОУ ДПО РМАНПО МЗ РФ, г. Казань
Павликова Ольга Аркадьевна — кандидат медицинских наук, врач-онколог отделения противоопухолевой лекарственной терапии ГБУ Республики Марий Эл «Республиканский онкологический диспансер»
424037, г. Йошкар-Ола, ул. Осипенко, д. 22, тел. +7-926-729-43-15, e-mail: pavlikova.olga@mail.ru, SPIN-код: 6591-5244, ORCID ID: 0000-0003-3089-8256
Реферат
Введение. Рак молочной железы (РМЖ) — наиболее распространенная злокачественная опухоль среди женщин. В настоящее время имеется богатый арсенал противоопухолевых лекарственных препаратов для лечения данной патологии, но часто в клинической практике мы сталкиваемся с таким феноменом как резистентность опухоли к проводимому лечению. С данной проблемой при гормон-зависимом HER2-негативном (HER2-) РМЖ помогают справиться ингибиторы циклин-зависимых киназ, представителем которых является рибоциклиб.
Материал и методы. Представлено описание случая клинического применения рибоциклиба при рефрактерном к предшествующей эндокринной терапии метастатическом гормон-зависимом HER2- РМЖ.
Результаты. Применение рибоциклиба у описанной пациентки обеспечило частичный ответ длительностью более 16 месяцев, ассоциированный с улучшением качества жизни.
Выводы. Рибоциклиб удобен в применении, хорошо переносится и способен сохранять и даже улучшать качество жизни пациентов с метастатическим гормон-зависимым HER2- РМЖ, что представлено в клиническом случае.
Ключевые слова: рак молочной железы, ингибиторы CDK4/6, рибоциклиб, длительный частичный ответ.
Введение
Проблема рака молочной железы (РМЖ) актуальна в настоящее время. В течение последних десятилетий РМЖ в структуре заболеваемости и смертности занимает лидирующие позиции, и в последние годы в мире он вышел на первое место в структуре заболеваемости среди представителей обоего пола, опередив рак легкого. В 2020 г. в мире выявлено порядка 2,3 млн новых случаев РМЖ (11,7%) и около 285 тыс. летальных исходов, обусловленных данным заболеванием. В Российской Федерации (РФ) в 2019 г. среди женского населения выявлено 73 918 новых случаев РМЖ (21,2%), что также соответствует 1 месту в структуре заболеваемости. Среднегодовой прирост за период с 2009 по 2019 гг. составил 2,69%, а за последние 10 лет — 31,6%. В 2019 г. в РФ зарегистрировано 21 720 смертей от РМЖ [1].
Гормон-позитивный (HR+) HER2-негативный (HER2-) РМЖ — преобладающий биологический подтип как среди ранних стадий и местнораспространенных форм заболевания, так и среди метастатического рака, на долю которого приходится 60-70% всех РМЖ. Доказано многоцентровыми рандомизированными исследованиями, что эффективность противоопухолевой гормонотерапии HR+ РМЖ не уступает таковой химиотерапии. В настоящее время актуальной является проблема поиска эффективных режимов эндокринной терапии, особенно в сложных клинических ситуациях: при метастатическом поражении и в гормонорезистентных случаях [2].
Проблемой является прогрессирование HR+ HER2- РМЖ на фоне адъювантной эндокринной терапии. Это происходит вследствие развития резистентности к проводимому лечению. Первичная резистентность — это рецидив болезни в течение 2 лет адъювантной гормонотерапии или прогрессирование заболевания в течение 6 месяцев после начала эндокринной терапии метастатического РМЖ (мРМЖ). Вторичная резистентность — это рецидив заболевания через 2 года после начала адъювантной гормонотерапии или рецидив в течение 12 месяцев после окончания адъювантной эндокринной терапии, или прогрессирование через 6 месяцев после начала гормонотерапии мРМЖ [3]. Выделяют следующие причины развития резистентности: низкий уровень экспрессии рецепторов эстрогенов (до 10%), наличие мутации гена рецепторов эстрогенов, изменение активности ферментов, метаболизирующих тамоксифен, активация сигнальных каскадов, стимулирующих деление клеток (циклина D, CDK 4/6, PI3K, mTOR) [4].
Как известно, рост люминальных опухолей зависит от экспрессии циклина D1 — прямой транскрипционной цепи эстрогенового рецептора. Циклин D1 активирует CDK4 и CDK6. Образующийся комплекс D1 + CDK4/6 фосфорилирует супрессорный белок ретинобластомы (Rb), и происходит переход клетки из фазы G1 в S-фазу, тем самым запускается клеточный цикл. Таким образом, рост HR+ HER2- РМЖ и развитие гормонорезистентности связаны с взаимодействием циклин D1-CDK4/6-Rb, что требует блокады CDK4/6 [5].
Наиболее известны три представителя ингибиторов CDK4/6: палбоциклиб, рибоциклиб, абемациклиб. Рибоциклиб представляет собой селективный ингибитор CDK4 и CDK6. Препарат блокирует фосфорилирование Rb, подавляет передачу сигнала Е2F, задерживает клеточный цикл в точке перехода G1-S. Обладает цитотоксическим действием [6].
Целью данной статьи является описание клинического случая метастатического гормон-зависимого HER2-негативного РМЖ с развившейся резистентностью к проводимой эндокринной терапии и последующей длительной ремиссией на фоне комбинированной терапии рибоциклибом и ингибиторами ароматазы.
Клинический случай
Пациентке К., 1962 года рождения (59 лет; сопутствующие заболевания: гипертоническая болезнь 3 стадии, риск 3; ожирение 2 степени) в 2016 году был установлен диагноз муцинозной карциномы правой молочной железы T4вN0M0 (G3), IIIB стадия, рецепторы эстрогенов — 8 баллов, рецепторы прогестерона — 5 баллов, Her2 — 2+, индекс пролиферации (Ki67) >20%. Результат флуоресцентной гибридизации in situ — отрицательный. В 2016-2017 гг. проведено комбинированное лечение. На первом этапе проведена неоадъювантная химиотерапия (в режиме CAF, 8 курсов) со слабоположительным ответом опухоли на лечение.
На втором этапе лечения выполнена радикальная мастэктомия по Маддену справа. Рекомендована дистанционная лучевая терапия на область послеоперационного рубца, зон лимфооттока, от проведения которой пациентка отказалась.
С марта 2017 г. по август 2018 г. проводилась эндокринная терапия тамоксифеном. Прогрессирование констатировано в июле 2018 г. (через 17 месяцев по окончании адъювантного лечения), когда был выявлен метастаз в головку плечевой кости (с мягкотканным компонентом размером 79х52х45 мм), осложненный патологическим переломом. Клинически: болевой синдром (интенсивность по визуальной аналоговой шкале [ВАШ] 4-7 баллов). С июля 2018 г. пациентка использовала лонгету для фиксации левой руки, функция конечности нарушена. Пациентке была предложена трепан-биопсия метастатического очага, от которой она отказалась. В результате было принято решение продолжить лечение по данным ИГХ первичной опухоли.
С августа 2018 г. по май 2020 г. проводилась гормонотерапия анастрозолом (1 мг/сутки), бисфосфонатами (золедроновая кислота 4 мг, внутривенно, каждые 28 дней). От дистанционной лучевой терапии на очаг метастатического поражения пациентка отказалась. В апреле 2020 г. вновь констатировано прогрессирование (метастазы в лобковую кость, 6 ребро справа, позвонки и кости таза). Продолжена терапия бисфосфонатами (золедроновая кислота, 4 мг, внутривенно, 1 раз в месяц).
С мая 2020 г. по ноябрь 2020 г. проводилась гормонотерапия фулвестрантом (500 мг 2 раза — в первый месяц терапии, 500 мг 1 раз в 28 дней — впоследствии). Прогрессирование зафиксировано в ноябре 2020 г., когда выявлены множественные метастазы в кости свода черепа, в лобно-теменной области слева и в теменной области справа с интракраниальным распространением и признаками прорастания мозговой оболочки. На тот момент в головке левой плечевой кости определялся литический очаг с мягкотканым компонентом размером до 127 мм (рис. 1).
Рис. 1. Компьютерная томограмма от 22.10.2020: в головке левого плеча определяется литический очаг с мягкотканым компонентом размером до 127 мм (стрелки)
Fig. 1. Computed tomography image (22.10.2020) shows the lytic lesion with the soft tissue component in the humeral head up to 127 mm in size (arrows)

В ноябре 2020 г. назначена комбинация летрозол (внутрь, 2,5 мг, ежедневно) + рибоциклиб (внутрь, 600 мг, 1-21 дни, цикл — 28 дней), проведено 3 курса (до января 2021 г.), затем продолжена терапия комбинацией анастрозол (внутрь, 1 мг, ежедневно) + рибоциклиб (в том же режиме). Пациентка отмечала уменьшение хронического болевого синдрома (интенсивность по ВАШ — 3 балла). В течение 1-2 курсов терапии наблюдался синдром цитолиза (повышение трансаминаз до 70 ЕД/л, общего билирубина до 37,12 мкмоль/л, что соответствовало 1 (легкой) степени печеночной токсичности по шкале CTCAE). После приема гепатопротекторов показатели нормализовались. После 5 курса терапии отмечена активность в левом плечевом суставе, пациентка перестала пользоваться лонгетой для фиксации левой руки, восстановился объем движений. При компьютерной томографии (КТ) от 25.03.2021 суммарный наибольший размер трех маркерных очагов (в головке левого плеча, теле позвонка Т8 и заднем отрезке IV ребра справа, включая мягкотканные компоненты) уменьшился до 121 мм (по сравнению с 186 мм — по данным КТ от 22.10.2020, то есть на 35%, что соответствует частичному ответу согласно критериям RECIST 1.1). При этом наибольший размер мягкотканого компонента в области головки левого плеча уменьшился до 95 мм (рис. 2, 3).
Рис. 2. Компьютерная томограмма от 25.03.2021: уровень среза соответствует таковому на рис. 1. Отмечается обызвествление мягкотканого компонента в области головки левого плеча и уменьшение его размера до 95 мм (стрелки)
Fig. 2. Computed tomography image (25.03.2021, the slice level corresponds to the one on the fig. 1) shows the calcification of the soft tissue component in the humeral head and decrease its size to 95 mm (arrows)

Рис. 3. Внешний вид пациентки в апреле 2021 г. Левое плечо увеличено в размере за счет плотной несмещаемой безболезненной опухоли размером более 10 см
Fig. 3. Patient appearance (April, 2021). The left shoulder is enlarged due to the large non-movable mass sized more than 10 cm

После проведения 16 курсов терапии, согласно данным последней КТ от 13.10.2021, констатирован частичный ответ с уменьшением мягкотканого компонента в области головки левого плеча до 90 мм (рис. 4). По клиническим, биохимическим анализам, коагулограмме — без отклонений.
Рис. 4. Внешний вид пациентки в октябре 2021 г. Отмечается положительная динамика за счет уменьшения опухоли верхней трети левого плеча и увеличения объема движений в суставе
Fig. 4. Patient appearance (October, 2021) demonstrates the shrinkage of the left shoulder lesion associated with the increase of the joint motion range

Однако, к сожалению, после последнего курса терапии в режиме анастрозол + рибоциклиб, в конце ноября 2021 г. у пациентки развилась верифицированная инфекция вирусом COVID-19, осложнившаяся тяжелой полисегментарной двусторонней пневмонией с последующим летальным исходом, не связанным с опухолевым процессом. На этот момент признаков прогрессирования заболевания не отмечалось, а достигнутый ответ сохранялся.
Таким образом, несмотря на развитие резистентности к проводимой эндокринной терапии тамоксифеном, анастрозолом и фулвестрантом, при добавлении к препарату эндокринной терапии ингибитора CDK4/6 рибоциклиба был достигнут контроль заболевания на протяжении 16 месяцев. При этом отмечалось еще и улучшение качества жизни пациентки: активизация левой верхней конечности за счет уменьшения опухолевой массы метастатического очага.
Обсуждение
Выбор лечебной тактики при мРМЖ зависит от многих факторов: пациента (возраста, функции яичников, общего состояния, социального статуса); опухоли (экспрессии рецепторов эстрогенов и прогестерона, статуса HER2, степени дифференцировки, индекса пролиферации), герминальных мутаций (BRCA, CHEK, PIC3CA); заболевания (локализации метастазов, опухолевой нагрузки, клинических проявлений заболевания) и предшествующего лечения, что необходимо учитывать при выборе лекарственного агента (исходя из его механизма действия, токсичности, доступности, стоимости, способа введения и т.д.).
В настоящее время выделяется HER2-low подтип РМЖ (низкий уровень экспрессии HER2 (HER2 1+, HER2 2+ с невыявленной гибридизацией in situ). Установлено, что чаще HER2-low РМЖ ассоциирован с рецептор-негативным статусом (HR-) по сравнению с HER2-low/HR+ подтипом (13,7% против 1,2%, соответственно). Для категории пациентов с HER2-low РМЖ в настоящее время рассматриваются новые стратегии лечения. В частности, у пациентов с обогащенным HER2 1+ и HER2 2+ подтипом РМЖ рассматривается вопрос о добавлении к терапии таргетного агента (трастузумаба). В то же время, в исследованиях MONALEESA показана эффективность добавления ингибиторов CDK4/6 при HER2-обогощенном подтипе РМЖ (в отличие от базального) в виде снижения риска прогрессирования и увеличения общей выживаемости. Поэтому требуется тщательный отбор пациентов для извлечения наибольшей пользы от персонализированного лечения [7, 8].
мРМЖ включает в себя первично выявленные (5-20% случаев) и рецидивирующие формы (80-95%). Среди мРМЖ выделяют олигометастатическую болезнь, костное поражение, висцеральное поражение, смешанное поражение (метастазы в кости + висцеральные метастазы), висцеральный криз, смешанное поражение с метастазами в центральную нервную систему (ЦНС). Лечебная стратегия напрямую зависит от формы поражения. При олигометастатической болезни после системной терапии акцент делается на локорегиональной терапии. При метастазах в кости, характеризующихся медленным течением заболевания, требуется добавление к системной терапии остеомодифицирующего агента; висцеральные метастазы (без криза) характеризуются уже более агрессивным течением болезни, смешанная форма метастатической болезни – также более агрессивный фенотип. Висцеральный криз представляет собой тяжелую дисфункцию органов вследствие опухолевого поражения, характеризуется очень агрессивным течением, опасным для жизни пациента, и требует проведения «быстро работающей» системной химиотерапии, а при смешанном метастатическом поражении с поражением ЦНС требуется локорегиональное лечение метастазов головного мозга в дополнение к системной терапии [9].
Согласно рекомендациям RUSSCO 2021, в качестве адъювантной эндокринной терапии в настоящее время используется один из следующих режимов: тамоксифен (20 мг/сутки внутрь, ежедневно) в течение 5 лет (у больных в пре- и постменопаузе); ингибиторы ароматазы (летрозол 2,5 мг/сутки или анастрозол 1 мг/сутки, или эксеместан 25 мг/сутки, внутрь, ежедневно) в течение 5 лет у больных в стойкой менопаузе или режимы переключения. В последнее время для лечения рецидивного и метастатического HR+ HER2 РМЖ появилась возможность использования ингибиторов CDK4/6, в частности, рибоциклиба, в сочетании с эндокринной терапией [4].
Рибоциклиб назначается в дозе 600 мг/сутки (таблетки по 200 мг) внутрь в первой половине дня, в 1-21 дни (3 недели) 28-дневного курса. При развитии неприемлемой токсичности удобна схема редукции дозы препарата до 400 и 200 мг/сутки, при этом доказано сохранение эффективности проводимого лечения [2, 5, 6, 10].
В исследованиях MONALEESA-3 и MONALEESA-7 при комбинировании рибоциклиба с эндокринной терапией в качестве 1 и 2 линий лечения у женщин как в пост-, так и в пре-, и в перименопаузе зарегистрировано увеличение общей выживаемости и снижение риска смерти на 28% и 30%; при метастазах в печень риск смерти снижался на 37% и 47%, и при развитии эндокринной резистентности отмечалось снижение риска смерти на 30% и 41%, соответственно, в группах комбинирования рибоциклиба с фулвестрантом и ингибиторами ароматазы, соответственно. Показана высокая эффективность препарата при метастазах в головной мозг. При применении рибоциклиба медиана общей выживаемости у пациентов моложе 40 лет достигала 51,3 месяца, старше 40 лет — 58,8 месяца. При использовании рибоциклиба в комбинации с фулвестрантом медиана общей выживаемости составила 53,7 месяца и 67,6 месяца, а с ингибиторами ароматазы — 58,7 месяца (MONALEESA-7) и 63,9 месяца (MONALEESA-3). При метастазах в печень данный показатель составил 36,1 месяца (MONALEESA-3) [11-15]. Однако исследований, посвященных использованию рибоциклиба в терапии 3 и последующих линий, в настоящее время не опубликовано.
Заключение
Таким образом, ингибиторы CDK4/6 — это новая веха в лечении HR+ HER2- РМЖ, а рибоциклиб — один из ярких представителей данной группы препаратов, который занимает достойное место в системе противоопухолевой лекарственной терапии РМЖ.
Информация о финансировании:
Данная статья не имела финансовой поддержки.
Информация о конфликте интересов:
Авторы указали на отсутствие потенциального конфликта интересов.
Литература
- Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). / Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. — М., 2020.
- Sledge G.W. The Effect of Abemaciclib Plus Fulvestrant on Overall Survival in Hormone Receptor -Positive, ERBB2-Negative Breast Cancer That Progressed on Endocrine Therapy — MONARCH 2 A Randomized Clinical Trial // JAMA Oncol. — 2020. — 6 (1). — P. 116-124.
- Cardoso F., Senkus E., Costa A. et al. 4th ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 4) // Annals of Oncology. — 2018. — 29. — P. 1634-1657.
- Злокачественные опухоли. Практические рекомендации Российского общества клинической онкологии. Часть 1. — М.: RUSSCO, 2021. — C. 119-158
- Turner N.C., Slamon D.J., Ro J., et al. Overall Survival with Palbociclib and Fulvestrant in Advanced Breast Cancer // N. Engl. J. Med. — 2018. — 379. — P. 1926-36. DOI: 10.1056/NEJMoa1810527
- Tripathy D., Im S.-A., Marco C., et al. Abstract PD2-04: Updated overall survival (OS) results from the phase III MONALEESA-7 trial of pre- or perimenopausal patients with hormone receptor positive/human epidermal growth factor receptor 2 negative (HR+/HER2−) advanced breast cancer (ABC) treated with endocrine therapy (ET) ± ribociclib. Proceedings of the 2020 San Antonio Breast Cancer Virtual Symposium; 2020 Dec 8-11; San Antonio, TX. Philadelphia (PA): AACR; Cancer Res 2021; 81(4 Suppl).
- Agostinetto E., Rediti M., Fimereli D., et al. HER2-Low Breast Cancer: Molecular Characteristics and Prognosis // Cancers. — 2021. — 13. — 2824. https://doi.org/10.3390/cancers13112824
- Zhang H., Katerji H., Turner B.M. HER2-low breast cancers: incidence, HER2 staining patterns, clinicopathologic features, MammaPrint and BluePrint genomic profiles // Modern Pathology. — 2022. — 35. — P. 1075-1082. https://doi.org/10.1038/s41379-022-01019-5
- Mayer E.L., Dueck A.C., Martin M. Palbociclib with adjuvant endocrine therapy in early breast cancer (PALLAS): interim analysis of a multicentre, open-label, randomised, phase 3 study // Lancet Oncol. — 2021. — 22, 2. — P. 212-222.
- Slamon D.J., Neven P., Chia S., et al. Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3 // J. Clin. Oncol. — 2018 Aug 20. — 36 (24). — P. 2465-2472. doi: 10.1200/JCO.2018.78.9909.
- Slamon D.J., Neven P., Chia S.K.L., et al. MONALEESA-3: A randomized double-blind, placebo-controlled study of ribociclib in combination with fulvestrant for the treatment of men and postmenopausal women with hormone receptor positive, HER2-negative, advanced breast cancer who have received no or only one line of prior endocrine treatment // Journal of Clinical Oncology. — 2021. — 39, 15_suppl. — P. 1001-1001.
- Hortobagyi G.N., Stemmer S.M., Burris III H.A., et al. Overall survival (OS) results from the Phase III MONALEESA-2 (ML)-2 trial of postmenopausal patients with hormone receptor-positive/human epidermal growth factor receptor 2– negative (HR+/HER2−) advanced breast cancer (ABC) treated with endocrine therapy (ET) ± ribociclib (RIB) // Annals of Oncology. — 2021. — 32 (suppl_5). — P. S1283-S1346. DOI: 10.1016/annonc/annonc741.
- Hortobagyi G.N., Stemmer S.M., Burris H.A., et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer // Ann Oncol. — 2018 Jul 1. — 29 (7). — P. 1541-1547. doi: 10.1093/annonc/mdy155.
- Im S.-A., Lu Y.-S., Bardia A., et al. Overall Survival with Ribociclib plus Endocrine Therapy in Breast Cancer // N. Engl. J. Med. — 2019. — 381. — P. 307-316. DOI: 10.1056/NEJMoa1903765.
- Cristofanilli M., Rugo H.S., Im S.-A., et al. Multicenter, Randomized, Double-blind, Placebo-controlled, Phase 3 Trial Of Fulvestrant (Faslodex (Registered)). With Or Without Pd-0332991 (Palbociclib) +/- Goserelin In Women With Hormone Receptor-positive, Her2-negative Metastatic Breast Cancer Whose Disease Progressed After Prior Endocrine Therapy // Journal of Clinical Oncology. — 2021. — 39, 15_suppl. — 1000-1000. — P. S1278-S1381.
 |
Международное непатентованное название? Рибоциклиб |
 |
Действующее вещество: рибоциклиб (в виде рибоциклиба сукцината) — 200,00мг (254,40мг); вспомогательные вещества: целлюлоза микрокристаллическая, гипролоза низкозамещенная, кросповидон (тип А), магния стеарат, кремния диоксид коллоидный. |
 |
Противоопухолевые средства — ингибиторы протеинкиназы |
 |
ПроизводителиНовартис Сингапур/Новартис Фарма(Сингапур), Новартис Сингапур/Скопинфарм(Сингапур), Новартис Сингапур/Новартис Штейн/Скопинфарм(Сингапур), Новартис Сингапур/Новартис Фарма/Скопинфарм(Сингапур) |
 |
Показания к применению Рисарг таблетки 200мгПрепарат Рисарг показан для лечения положительного по гормональным рецепторам (HR+) и отрицательного по рецептору эпидермального фактора роста человека 2-го типа (HER2-) местнораспространеннного или метастатического рака молочной железы в комбинации с ингибитором ароматазы или фулвестрантом у женщин в качестве начальной гормональной терапии или у женщин, получавших гормональную терапию ранее. |
 |
Способ применения и дозировка Рисарг таблетки 200мгЛечение препаратом следует проводить только под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами.Для женщин в пре-, перименопаузе применение комбинированного режима эндокринной терапии и рибоциклиба необходимо сочетать с функцией овариальной супрессии агонистами гонадотропин-рилизинг гормона (ГнРГ).Режим дозирования. Общая целевая популяция: рекомендуемая доза препарата для приема внутрь составляет 600мг (3 таблетки, покрытые пленочной оболочкой по 200мг) 1 раз в сутки последовательно в течение 21 дня, с последующим перерывом в приеме препарата в течение 7 дней. Полный цикл составляет 28 дней.Одновременно с препаратом следует принимать фулвестрант в дозе 500мг внутримышечно в дни 1, 15, 29 и затем раз в месяц, либо летрозол в дозе 2,5мг/сутки или другой ингибитор ароматазы 1 раз/сутки в течение всего 28-дневного цикла. Следует ознакомиться с инструкцией по медицинскому применению ингибитора ароматазы и фулвестранта. Для лечения женщин в пре- или перименопаузе терапия комбинацией Рисарг с ингибитором ароматазы/фулвестрантом должна сопровождаться приемом агониста ГнРГ в соответствии с местными стандартами клинической практики. Необходимо принимать назначенные дозы препаратов ежедневно в одно и то же время, предпочтительно утром. Применение препарата не зависит от приема пищи. При возникновении рвоты у пациента после применения препарата или при пропуске очередного приема, не следует принимать дополнительную дозу препарата в этот день. Следующую назначенную дозу необходимо принять в обычное время. Таблетки препарата следует проглатывать целиком (не разжевывать, не разламывать и не делить перед проглатыванием). Не следует принимать поврежденные таблетки (разломанные, с трещинами или другими признаками повреждения).Коррекция дозы: для коррекции тяжелых или непереносимых нежелательных лекарственных реакций (НЛР) может потребоваться временная отмена, уменьшение дозы или полная отмена препарата Рисарг.Указания по снижению (при необходимости) рекомендуемой дозы при НЛР перечислены далее. Начальная доза — 600мг/сутки (3 таблетки по 200мг).Первое снижение дозы — 400мг/сутки (2 таблетки по 200мг).Второе снижение дозы — 200мг/сутки (1 таблетка по 200мг).Если требуется дальнейшее снижение дозы ниже 200мг/сутки, следует отменить препарат.Далее представлены рекомендации по временной отмене приема, снижению дозы или полной отмене препарата для коррекции отдельных НЛР. Принимая решение в соответствии с клинической ситуацией, лечащий врач должен руководствоваться планом ведения каждого пациента с учетом оценки соотношения пользы/риска в каждом индивидуальном случае.Изменение дозы и применение при гематологической токсичности.Перед началом лечения препаратом провести общий анализ крови (ОАК). После начала лечения препаратом контролировать ОАК каждые 2 недели в течение первых 2 циклов, в начале каждого из последующих 4 циклов, затем по клиническим показаниям.Нейтропения 1 или 2 степень: (Абсолютное число нейтрофилов (АЧН) менее 1000/мм3 нижняя граница нормы (НГН)) — коррекция дозы не требуется.Нейтропения 3 степень: (АЧН 500 — 1000/мм3). Временная отмена до восстановления до 2 степени. Возобновление приема в той же дозе. При повторном развитии нейтропении степени 3 прервать терапию до восстановления показателя, затем возобновить прием в дозе, уменьшение й до следующего уровня.Фебрильная нейтропения 3 степени. Временная отмена до восстановления показателя нейтропении 2 степени и ниже. Возобновить прием в дозе, уменьшенной до следующего уровня. Нейтропения 4 степень (АЧН менее 500/ММ3). Временная отмена до восстановления показателя 2 степени и ниже. Возобновить прием в дозе, уменьшенной до следующего уровня. Изменение дозы и применение при гепатобилиарной токсичности.Повышение активности ACT и/или АЛТ по сравнению с исходным уровнем без увеличения концентрации общего билирубина выше 2 раз верхней границы нормы (ВГН).1 степень (от ВГН до 3 раз выше ВГН): коррекция дозы не требуется.2 степень (от 3 до 5 раз выше ВГН): исходно ниже 2 степень: временная отмена до уменьшения исходной степени, затем возобновление приема в той же дозе. При повторном развитии токсичности 2 степени, возобновить прием в дозе, уменьшенной до следующего уровня.Исходно — 2 степень: не прерывать прием препарата.3 степень (от 5 до 20 раз выше ВГН): временная отмена препарата до уменьшения до исходной степени, затем возобновление приема в дозе, уменьшенной до следующего уровня. При повторном развитии токсичности 3 степени, прием следует отменить.4 степень (более 20 раз выше ВГН): отмена препарата.Сочетанное повышение активности ACT и/или АЛТ вместе с увеличением концентрации общего билирубина при отсутствии холестаза.Если активность АЛТ и/или ACT возрастает до уровня более 3 раз выше ВГН наряду с увеличением концентрации общего билирубина более 2 раз выше ВГН, препарат следует отменить, независимо от исходной степени.Перед началом терапии следует оценить функцию печени при помощи функциональных тестов печени (ФТП).После начала лечения препаратом — контроль каждые 2 недели в течение первых 2 циклов, в начале каждого из последующих 4 циклов, затем по клиническим показаниям. Если наблюдаются нарушения выше 2 степени, рекомендуется более частый контроль.Изменение дозы и применение при удлинении интервала QTНа ЭКГ QTcF более 480мсек: временная отмена препарата. Если интервал QTcF уменьшился до менее 481мсек, следует возобновить прием в дозе, уменьшенной до следующего уровня; Если интервал QTcF вновь увеличился до более 481мсек, следует временно отменить прием препарата до уменьшения интервала QTcF до менее 481мсек; затем следует возобновить прием в дозе, уменьшенной до следующего уровня.На ЭКГ QTcF более 500мсек: если интервал QTcF превышает 500мсек: временная отмена препарата до уменьшения интервала QTcF менее 481мсек, затем следует возобновить прием в дозе, уменьшенной до следующего уровня.Если продолжительность интервала QTcF превышает 500мсек или наблюдается удлинение более чем на 60мсек по сравнению с исходной величиной в сочетании с желудочковой тахикардией типа «пируэт» или полиморфной желудочковой аритмией или симптомами/признаками развития аритмии тяжелой степени, следует окончательно отменить препарат.Следует провести ЭКГ до начала лечения. После начала лечения препаратом повторную ЭКГ следует проводить приблизительно на 14 день первого цикла и в начале второго цикла, далее — по клиническим показаниям.В случае удлинения интервала QTcF во время лечения, рекомендуется более частый контроль ЭКГ.Изменение дозы и применение при других проявлениях токсичности.Другие проявления токсичности:1 или 2 степень: коррекция дозы не требуется. Начать соответствующую медикаментозную терапию и проводить контроль в соответствии с клиническими показаниями.3 степень: Временно прекратить прием препарата до восстановления до ниже 1 степени, затем возобновить прием в той же дозе. Если вновь развивается токсичность 3 степени, возобновить прием в дозе, уменьшенной до следующего уровня.4 степень: отмена препарата.Следует ознакомиться с инструкцией по медицинскому применению ингибитора ароматазы/фулвестранта/ГнРГ для рекомендаций по коррекции дозы в случаях развития токсических реакций и другой соответствующей информации по безопасности.Изменение дозы препарата при использовании с мощными ингибиторами изофермента CYP 3A: следует избегать одновременного применения препарата с мощными ингибиторами изофермента CYP3A, необходимо рассмотреть возможность альтернативной терапии в сочетании с менее мощными ингибиторами изофермента CYP3A. При необходимости одновременного применения мощного ингибитора изофермента CYP3A дозу препарата следует уменьшить до 200мг 1 раз/сутки. При отмене мощного ингибитора изофермента CYP3A, дозу препарата следует изменить (по прошествии по меньшей мере 5-кратного периода полувыведения мощного ингибитора изофермента CYP3A) до дозы, которая применялась перед началом применения мощного ингибитора изофермента CYP3A.Применение у пациентов с нарушением функции почек: не требуется коррекции дозы при применении препарата у пациентов с нарушением функции почек легкой или средней степени тяжести.Вследствие отсутствия опыта применения препарата у пациентов с нарушением функции почек тяжелой степени, необходимо соблюдать осторожность при применении препарата у пациентов данной категории.Применение у пациентов с нарушением функции печени: на основании исследований нарушений функции печени с участием здоровых добровольцев и пациентов без злокачественного заболевания с нарушением функции печени, установлено, что коррекция дозы у пациентов с нарушением функции печени легкой степени тяжести (класс А по классификации Чайлд-Пью) не требуется. Коррекция дозы необходима у пациентов с нарушениями функции печени средней и тяжелой степени (классы В и С по классификации Чайлд-Пью соответственно), рекомендованная начальная доза составляет 400мг. Применение препарата у пациентов с раком молочной железы с нарушением функции печени средней и тяжелой степени не изучалось. Применение у пациентов в возрасте 18 лет и младше: данные по применению препарата у пациентов в возрасте 18 лет и младше ограничены. Безопасность и эффективность у данной категории пациентов не установлена. Применение у пациентов в возрасте 65 лет и старше: коррекция дозы у пациентов в возрасте 65 лет и старше не требуется. |
 |
Противопоказания Рисарг таблетки 200мгПовышенная чувствительность к рибоциклибу или любому из вспомогательных компонентов препарата.Детский возраст до 18 лет (эффективность и безопасность не доказана).Беременность и период грудного вскармливания.С осторожностью: следует соблюдать осторожность при применении препарата у пациентов с нейтропенией 3-4 степени, с нарушениями функции почек тяжелой степени, у пациентов с гепатобилиарной токсичностью, у пациентов с наличием или значительным риском удлинения интервала QT (синдромом удлинения интервала QT, неконтролируемыми или клинически значимыми заболеваниями сердца, в том числе недавно перенесенным инфарктом миокарда, хронической сердечной недостаточностью, нестабильной стенокардией и брадиаритмией, нарушениями водно-электролитного баланса), при одновременном применении с лекарственными средствами, удлиняющими интервал QTc, с мощными ингибиторами изофермента CYP3A, при применении с субстратами изофермента CYP3A с узким терапевтическим индексом. На основании клинического исследования III фазы, рибоциклиб не рекомендовано принимать в комбинации с тамоксифеном по причине значимого повышения тамоксифен-опосредованного риска удлинения интервала QTcF.Применение при беременности и в период грудного вскармливания: в исследованиях эмбриофетального развития у крыс и кроликов беременные животные получали перорально рибоциклиб в дозах до 1000мг/кг/сутки и 60мг/кг/сутки соответственно в течение периода органогенеза.Для организма беременных крыс доза 1000мг/кг/сутки была летальной. При дозе 300мг/кг/сутки наблюдалась незначительная, не являющаяся негативной, тенденция к снижению прибавки массы тела таких животных и фетотоксичность, о которой свидетельствует снижение массы тела плодов в сочетании с изменениями скелета, которые рассматривались как временные и/или связанные с более низкой массой тела плодов. При дозах 50 или 300 мг/кг/сутки отсутствовало влияние на эмбриофетальную смертность или нежелательное воздействие на морфологию плода. При изучении воздействия на беременных крыс считалось, что доза, при которой не наблюдалось неблагоприятных эффектов (NOAEL), составляла 300мг/кг/сутки. При изучении воздействия на эмбриофетальное развитие считалось, что доза, при которой не наблюдалось эффектов (NOEL), составляла 50мг/кг/сутки.У кроликов при дозах более 30мг/кг/сутки отмечено нежелательное влияние на эмбриофетальное развитие, что проявлялось увеличением числа аномалий плода (пороков развития, внешних аномалий, изменения внутренних органов и скелета) и роста плода (снижение массы тела плода). Эти данные включали уменьшение долей легких, развитие дополнительных сосудов на дуге аорты, диафрагмальную грыжу, отсутствие добавочной доли или (частичное) слияние долей легких, уменьшение добавочной доли легкого (30 и 60мг/кг), экстра/рудиментарное 13-е ребро, деформация подъязычной кости, уменьшение числа фаланг большого пальца. Данных о эмбриофетальной смертности выявлено не было. NOEL для беременного животного составляла не менее 30мг/кг/сутки, для эмбриофетального развития — составляла 10мг/кг/сутки.При дозе 300мг/кг/сутки у крыс и 30мг/кг/сутки у кроликов, системная экспозиция в организме беременного животного (AUC) составляла 13800нг/ч/мл и 36700 нг/ч/мл, что было в 1,5 раза ниже, чем достигавшаяся у пациентов при максимальной рекомендуемой дозе 600мг/сутки.Женщины с сохраненным репродуктивным потенциалом: женщинам с сохраненным репродуктивным потенциалом следует рекомендовать использование эффективных методов контрацепции (вероятность возникновения беременности менее 1%) во время терапии препаратом и не менее чем в течение 21 дня после окончания приема препарата. До начала лечения препаратом Рисарг следует провести тест на возможную беременность.Фертильность: в исследовании фертильности у самок крыс рибоциклиб не влиял на репродуктивную функцию, фертильность или ранние стадии эмбриогенеза при любой дозе до 300мг/кг/сутки (вероятно, при экспозиции ниже или равной клинической экспозиции пациентов при максимальной рекомендуемой дозе рибоциклиба 600мг/сутки на основании AUC).Изучение фертильности у крыс-самцов не проводилось, однако в токсикологических исследованиях сообщалось об атрофических изменениях в семенниках у крыс и собак при экспозиции, которая была меньше или эквивалентна экспозиции у человека при максимальной рекомендуемой ежедневной дозе 600мг/сутки, на основании AUC. Не имеется достаточных клинических данных о влиянии препарата на фертильность. Потенциальное влияние препарата на фертильность мужчин и женщин неизвестно. По данным исследований на животных препарат может нарушать фертильность у мужчин с сохраненным репродуктивным потенциалом. |
 |
Фармакологическое действиеРибоциклиб — селективный ингибитор циклин-зависимых киназ (CDK) 4 и 6. Эти киназы активизируются при образовании комплекса с D-циклинами и играют основную роль в сигнальных путях, регулирующих клеточный цикл и пролиферацию клеток. Комплекс циклин D-CDK4/6 регулирует прогрессию клеточного цикла путем фосфорилирования белка ретинобластомы (pRb).In vitro рибоциклиб подавлял фосфорилирование белка Rb, что приводило к остановке клеточного цикла в фазе G1 и снижению пролиферации клеток в клеточных линиях рака молочной железы. In vivo монотерапия рибоциклибом в хорошо переносимых дозах вызывала регрессию опухоли, коррелируя с ингибированием фосфорилирования белка Rb. В исследованиях in vivo с использованием моделей с полученным от пациента ксенотрансплантатом рака молочной железы положительного по рецепторам эстрогена, комбинация рибоциклиба и ингибиторов ароматазы (например, летрозол) приводила к более выраженному ингибированию опухолевого роста по сравнению с каждым препаратом в отдельности. После прекращения применения препарата возобновление опухолевого роста отмечалось через 33 дня. Кроме того, оценивалась противоопухолевая активность комбинации рибоциклиба в сочетании с фулвестрантом в исследованиях in vivo у иммунодефицитных мышей, несущих ксенотрансплантанты эстроген-обогащенного рака молочной железы ZR751. Комбинация рибоциклиба и фулвестранта приводила к полному ингибированию опухолевого роста.Фармакодинамика: по данным биохимического анализа рибоциклиб ингибирует ферментные комплексы CDK4/циклин-D1 и CDK6/циклин-D3 в концентрации 0,01 (4,3нг/мл) и 0,039мкмоль (16,9нг/мл), которая обеспечивает 50% ингибирование (IC50) соответственно.В исследованиях на клеточных линиях рибоциклиб ингибирует CDK4/6-опосредованное фосфорилирование белка Rb при средней IC50, составляющей 0,06мкмоль (26нг/мл). Рибоциклиб останавливает прогрессию клеточного цикла в фазе G1/S при средней IC50, составляющей 0,11мкмоль (47,8нг/мл) (определено методом проточной цитометрии). Рибоциклиб также ингибирует пролиферацию клеток при значении IC50, составляющем 0,8мкмоль (34,8нг/мл) (оценено по степени интеркаляции бромодезоксиуридина (BrdU)). Сходные значения IC50, полученные при анализах целевой модуляции, клеточного цикла и пролиферативной активности подтверждают, что блокада фосфорилирования белка Rb рибоциклибом непосредственно приводит к остановке перехода клеточного цикла из G1- фазы в S-фазу с последующим ингибированием пролиферации клеток. При анализе на панели клеточных линий рака молочной железы с известным статусом рецепторов эстрогена (ER), рибоциклиб демонстрировал более высокую эффективность в отношении клеточных линий с ER-положительным статусом, чем с ER-отрицательным. Электрофизиология сердца: для оценки влияния рибоциклиба на интервал QTc у пациентов с распространенным раком были собраны серии электрокардиограмм (ЭКГ), проведенных трижды после применения однократной дозы при достижении равновесного состояния. Анализ взаимосвязи фармакокинетики и фармакодинамики проводился, в общей сложности, у 997 пациентов, получавших лечение рибоциклибом в диапазоне доз от 50 до 1200мг, включая 193 пациентов, получавших лечение рибоциклибом в дозе 600мг. Данный анализ позволил предположить, что рибоциклиб вызывал зависимое от концентрации увеличение интервала QTc.После приема рибоциклиба в рекомендуемой дозе 600мг в комбинации с ингибиторами ароматазы или фулвестрантом рассчитанное среднее изменение QTcF относительно исходного значения составляло 22,00мсек [90% Доверительный Интервал (ДИ): 20,56, 23,44] и 23,7 мсек [90% ДИ: 22,31, 25,08], соответственно, по сравнению с 34,7мсек [90% ДИ: 31,64, 37,78] для комбинации рибоциклиба с тамоксифеном при геометрическом среднем значении максимальной концентрации в плазме крови (Cmax) в равновесном состоянии.Фармакокинетика: фармакокинетические параметры рибоциклиба были изучены у пациентов с распространенными солидными опухолями или лимфомами после приема внутрь суточных доз от 50мг до 1200мг. Здоровые добровольцы получали перорально однократные дозы в диапазоне от 400мг до 600мг или повторные дозы 400мг ежедневно (8 дней).После приема внутрь рибоциклиба у пациентов с распространенными солидными опухолями и лимфомами Cmax рибоциклиба в плазме крови достигалась через 1-4 часа (время достижения максимальной концентрации, Tmax). Наблюдалось небольшое сверхпропорциональное увеличение экспозиции (Cmax и площади под кривой “концентрация-время” (AUC)) рибоциклиба в изучаемом диапазоне доз (от 50мг до 1200мг). После повторного приема 1 раз/сутки равновесное состояние обычно достигалось через 8 дней, рибоциклиб аккумулировал со средним геометрическим отношением, составляющим 2,51 (диапазон: от 0,972 до 6,40).Влияние пищи: по сравнению с приемом натощак, прием внутрь рибоциклиба в таблетках, покрытых пленочной оболочкой, в однократной дозе 600мг с высококалорийной пищей с высоким содержанием жира, не оказывает влияния на скорость и степень всасывания рибоциклиба (Cmax среднее геометрическое отклонение (СГО): 1,00; 90% ДИ: 0,898, 1.11; AUCinf СГО: 1,06; 90%ДИ: 1,01, 1,12).Связывание рибоциклиба с белками плазмы крови человека in vitro составляло приблизительно 70% и не зависело от концентрации (от 10нг/мл до 10000нг/мл). Рибоциклиб равномерно распределялся между эритроцитами и плазмой крови со средним отношением кровь/плазма in vivo 1,04. По данным анализа популяционной фармакокинетики кажущийся объем распределения в равновесном состоянии (Vss/F) составлял 1090л.В исследованиях in vitro и in vivo показано, что у человека рибоциклиб подвергается экстенсивному метаболизму в печени главным образом при участии изофермента CYP3A4. После приема рибоциклиба внутрь в однократной дозе 600мг [14С] у человека пути первичного метаболизма рибоциклиба включали окисление (деалкилирование, С и/или N- оксигенацию, окисление (-2Н)) и их комбинации. Первичные метаболиты рибоциклиба подвергались конъюгации путем N-ацетилирования, сульфатирования, связывания с цистеином, гликозилирования и глюкуронизации. Рибоциклиб был основным фармакологически активным соединением, присутствующим в плазме крови (43,5%). Основные циркулирующие метаболиты: метаболит М13 (CCI284, N-гидроксилирование), М4 (LEQ803, N-деметилирование) и Ml (вторичная глюкуронизация), на каждое представленное соединение приходилось 9,39%, 8,60% и 7,78% общей радиоактивности и 21,6%, 19,8% и 17,9% экспозиции рибоциклиба соответственно. Клиническая активность (фармакологические свойства и безопасность) рибоциклиба была преимущественно обусловлена неизмененным веществом, при этом циркулирующие метаболиты не имели существенного значения.Рибоциклиб подвергался экстенсивному метаболизму, количество неизмененного вещества составляло 17,3% и 12,1% в кале и моче соответственно. Метаболит LEQ803 в значительном количестве определялся в кале, его количество составляло 13,9% и 3,74% принятой дозы в кале и моче соответственно. Другие метаболиты определялись и в кале, и в моче в небольших количествах (менее 2,78% принятой дозы).В равновесном состоянии при применении дозы 600мг у пациентов с распространенным раком геометрическое среднее значение эффективного периода полувыведения из плазмы крови (на основании соотношения аккумуляции) составляло 32,0 часа (63% CV) и геометрическое среднее значение кажущегося клиренса (CL/F) при приеме внутрь составляло 25,5л/ч (66% CV). Геометрическое среднее значение кажущегося конечного периода полувыведения рибоциклиба из плазмы крови (Т1/2) находится в пределах от 29,7 до 54,7 часов и геометрическое среднее значение CL/F рибоциклиба в диапазоне от 39,9 до 77,5л/ч при дозе 600мг во всех исследованиях у здоровых добровольцев.Рибоциклиб выводится главным образом через кишечник и в небольшой степени почками. У 6 здоровых добровольцев мужского пола после приема однократной дозы [14С] рибоциклиба, 91,7% общей введенной радиоактивной дозы определялось в течение 22 дней; в основном выведение происходило через кишечник (69,1%), 22,6% дозы выводилось почками.Сверхпропорциональное увеличение экспозиции (Cmax и AUC) рибоциклиба наблюдалось как после однократного приема, так и после приема повторных доз в диапазоне от 50мг до 1200мг. Анализ данных ограничивается малым размером выборки в большинстве когорт, получающих определенные дозы, с наибольшим количеством данных, поступающих из когорты, получавшей дозу 600мг.Пациенты с нарушением функции почек: у пациентов с нарушениями функции почек легкой и средней степенями тяжести коррекция дозы не требуется. По данным популяционного фармакокинетического анализа, включавшего 438 пациентов с нормальной функцией почек (расчетная СКФ менее 90мл/мин/1,73м2), 488 пациентов с нарушением функции почек легкой степени (рСКФ от 60 до 90мл/мин/1,73м2) и 113 пациентов с нарушением функции почек средней степени (рСКФ от 30 до 60мл/мин/1,73м2), нарушения функции почек легкой и средней степени тяжести не влияют на экспозицию рибоциклиба. При оценке влияния почечной недостаточности на фармакокинетику рибоциклиба в дозе 400мг/сутки в исследовании нарушений функции почек среднее геометрическое значение AUCinf (геометрический коэффициент вариации (%CV), n) составило 5570нг/ч/мл (22,8%, 7), 10900 нг/ч/мл (38,1%, 7), 13600 нг/ч/мл (20,9%, 3), максимальная концентрация в плазме крови Cmax (геометрический %CV, n) достигнула 356нг/мл (15%, 7), 538нг/мл (43,3%, 7), 593нг/мл (11,3%, 3) для групп пациентов с нормальной функцией почек (7 пациентов, расчетная СКФ более 90мл/мин/1,73м2), с нарушением функции почек тяжелой степени (7 пациентов, расчетная СКФ от 15 до 30мл/мин/1,73м2) и с терминальной стадией нарушения функции почек (3 пациента, расчетная СКФ 15мл/мин/1,73м2), соответственно. Для пациентов с нарушением функции почек тяжелой степени AUCinf увеличивалась в 1,96 раза, Cmax — в 1,51 раза по сравнению с пациентами с нормальной функцией почек. На основании данного исследования, для пациентов с нарушением функции почек тяжелой степени рекомендованная начальная доза рибоциклиба составляет 200мг.Пациенты с нарушением функции печени: у пациентов с нарушением функции печени легкой степени (класс А по классификации Чайлд-Пью) коррекция дозы не требуется; коррекция дозы необходима у пациентов с нарушениями функции печени средней и тяжелой степени (классы В и С по классификации Чайлд-Пью), рекомендуется начальная доза 400мг. По данным фармакокинетического исследования у пациентов с нарушением функции печени, нарушение функции печени легкой степени не влияет на экспозицию рибоциклиба. Средняя экспозиция рибоциклиба увеличивалась менее чем в 2 раза у пациентов с нарушениями функции печени средней (СГО: 1,50 для Cmax; 1,32 для AUCinf) и тяжелой степени тяжести (СГО: 1,34 для Cmax; 1,29 для AUCinf). По данным популяционного фармакокинетического анализа, который включал 160 пациентов с нормальной функцией печени и 47 пациентов с нарушением функции печени легкой степени тяжести, нарушения функции печени легкой степени не влияли на экспозицию рибоциклиба, что подтверждает данные специальных исследований у пациентов с нарушениями функции печени.Влияние возраста, пола и расы: популяционный фармакокинетический анализ показал, что возраст, масса тела, пол и расовая принадлежность не оказывали клинически значимого влияния на системную экспозицию рибоциклиба, при котором могла бы потребоваться коррекция дозы. Пациенты в возрасте старше 65 лет: из 334 пациентов, которые получали рибоциклиб в исследовании III фазы (в группе, получавшей рибоциклиб плюс летрозол), 150 (44,9%) пациентов были в возрасте старше 65 лет и 35 (10,5%) пациентов были в возрасте старше 75 лет. Не наблюдалось существенных различий в отношении безопасности и эффективности рибоциклиба между этими пациентами и пациентами более молодого возраста. |
 |
Побочное действие Рисарг таблетки 200мгОбщая оценка профиля безопасности препарата основана на объединенном анализе данных, полученных у 1065 пациентов с положительным по гормонам HER2- отрицательным распространенным или метастатическим раком молочной железы, в котором 582 пациента получали препарат Рисарг в сочетании с ингибитором ароматазы, 483 пациента получали препарат Рисарг в комбинации с фулвестрантом.Медиана продолжительности терапии в рамках объединенного анализа данных клинических исследований III фазы препаратом составляла 16,53 месяцев, при этом 61,7% пациентов получали данное лечение более 12 месяцев.В рамках исследований III фазы уменьшение дозы в связи с развитием нежелательных явлений (НЯ), независимо от причины их возникновения, имело место у 37,3% пациентов, получавших препарат безотносительно от типа препарата(ов) в комбинации и у 3,4% пациентов, получавших плацебо. Об окончательном досрочном прекращении лечения, обусловленном НЯ, сообщалось у 7,0% пациентов, получавших Рисарг в сочетании с ингибитором ароматазы/фулвестрантом, и у 2,9% пациентов, получавших плацебо. Наиболее частыми НЯ, которые привели к досрочному прекращению лечения Рисаргом в сочетании с любым препаратом исследуемых комбинаций, были повышение активности АЛТ (2,0%), повышение активности ACT (1,4%) и рвота (0,8%).В объединенном анализе трех исследований III фазы о летальных исходах на фоне лечения сообщалось в 21 случаях (2,0%) у пациентов, получавших лечение Рисаргом в комбинации с ингибитором ароматазы/фулвестрантом, по сравнению с 16 случаями (2,0 %) у пациентов, получавших лечение плацебо в сочетании с любым препаратом исследуемых комбинаций. Исключая наиболее частую причину летального исхода — прогрессирование заболевания, были репортированы 3 фатальных исхода при лечении препаратом в любой комбинации. Причиной смертельных исходов являлись: развитие острого респираторного дистресс-синдрома, развитие острой дыхательной недостаточности и внезапная смерть (при развитии гипокалиемии III степени и удлинения интервала QT II степени). Несмотря на то, что было два случая нарушения дыхания, только один был подтвержден, как связанный с проводимой терапией.Наиболее частыми НЛР в рамках объединенных исследований III фазы (о которых сообщалось с частотой более 20% и частота которых в группе пациентов, получавших лечение препаратом превышала частоту в группе пациентов, получавших лечение плацебо) были инфекции, нейтропения, лейкопения, головная боль, кашель, тошнота, утомляемость, диарея, рвота, запор, алопеция и кожная сыпь.Наиболее частыми НЛР 3/4 степени в рамках объединенных исследований III фазы (о которых сообщалось с частотой более 2% и частота которых в группе пациентов, получавших лечение препаратом превышала частоту в группе пациентов, получавших лечение плацебо) были инфекции, нейтропения, лейкопения, анемия, отклонения от нормы функциональных тестов печени, лимфопения, гипофосфатемия и рвота.Сводная таблица НЛР по данным клинического исследования III фазыНЛР в клинических исследованиях III фазы сгруппированы в соответствии с классификацией органов и систем органов MedDRA, перечислены в порядке уменьшения частоты встречаемости.Частота встречаемости оценивалась следующим образом: «очень часто» — более 10%; «часто» — более 1%, но менее 10%; «нечасто» — более 0,1%, но менее 1%, «редко» — более 0,01%, но менее 0,1%, «очень редко» — менее 0,01%, включая отдельные сообщения, частота неизвестна (не может быть определена по имеющимся данным). В пределах каждой частотной категории НЛР распределены в порядке уменьшения частоты встречаемости.НЛР, наблюдавшиеся в клиническом исследовании III фазы. Инфекционные и паразитарные заболевания: очень часто — инфекции. Нарушения со стороны крови и лимфатической системы: очень часто — нейтропения, лейкопения, анемия; часто: лимфопения, тромбоцитопения, фебрильная нейтропения. Нарушения со стороны органа зрения: часто — слезотечение, сухость глаз.Нарушения со стороны обмена веществ и питания: очень часто — уменьшение аппетита; часто — гипокальциемия, гипокалиемия, гипофосфатемия.Нарушения со стороны нервной системы: очень часто — головная боль, головокружение; часто — системное головокружение.Нарушения со стороны сердца: часто — обморок.Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — одышка, кашель.Нарушения со стороны костно-мышечной системы и соединительной ткани: очень часто — боль в спине. Нарушения со стороны желудочно-кишечного тракта: очень часто — тошнота, диарея, рвота, запор, стоматит, боли в животе; часто — дисгевзия, диспепсия.Нарушения со стороны печени и желчевыводящих путей: часто — гепатотоксичность.Нарушения со стороны кожи и подкожных тканей: очень часто — алопеция, кожная сыпь, зуд; часто — эритема, сухость кожи, витилиго.Общие расстройства и нарушения в месте введения: очень часто — утомляемость, периферические отеки, астения, повышение температуры тела; сухость во рту, орофарингеальная боль.Лабораторные и инструментальные данные: очень часто — отклонения ФТП; часто — повышение концентрации креатинина в сыворотке крови, удлинение интервала QT на ЭКГ.Нейтропения: в исследованиях III фазы нейтропения была наиболее часто репортируемым отклонением по данным лабораторных исследований. В зависимости от степени тяжести нейтропении, контроль осуществлялся с помощью мониторинга лабораторных показателей, временной отмены приема препарата и/или изменения дозы. Частота досрочного прекращения приема препарата в связи с нейтропенией была низкой (0,8%).Гепатобилиарная токсичность: в клинических исследованиях III фазы проявления гепатобилиарной токсичности чаще возникали у пациентов в группе, получавшей лечение препаратом в сочетании с любой исследуемой комбинацией по сравнению с группой, получавшей плацебо в сочетании с любой исследуемой комбинацией (23,2% против 16,5% соответственно), при этом о НЯ 3/4 степени чаще сообщалось у пациентов, получавших лечение препаратом Рисарг в комбинации с ингибитором ароматазы/фулвестрантром (+/- ГнРГ) (11,4% против 5,4% соответственно). О временной отмене приема и/или коррекции дозы в связи с гепатобилиарной токсичностью сообщалось у 10,4% пациентов, получавших лечение препаратом в сочетании с любой исследуемой комбинацией, главным образом, из-за повышения активности АЛТ (6,9%) и/или повышения активности ACT (6,1%). Досрочное прекращение лечения в группе пациентов, получавших лечение препаратом вне зависимости от типа препарата(ов) в комбинации, обусловленное нарушениями ФТП, гепатотоксичностью отмечалось в 23,30% случаев по сравнению с 0,4% случаев в группе плацебо вне зависимости от типа препарата(ов) в комбинации.Удлинение интервала QT: в клиническом исследованиях III фазы у 8,4% пациентов из группы, получавших лечение препаратом и у 3,2% пациентов из группы, получавших плацебо наблюдалось не менее одного случая удлинения интервала QT (в т.ч. удлиненный интервал QT на ЭКГ, синкопе). Сообщалось о временной отмене приема в сочетании с коррекцией дозы вследствие удлинения интервала QT на ЭКГ и синкопе (обморока) у 2,3% пациентов, получавших лечение препаратом Рисарг в комбинации с летрозолом.Централизованный анализ данных ЭКГ (среднее значение по данным 3-х ЭКГ) показал, что у 52 пациентов (4,9%) и 11 пациентов (1,4%) наблюдалось не менее 1 случая удлинения интервала QTcF более 480мсек после начала терапии в группе, получавшей лечение препаратом и в группе, получавшей лечение плацебо, соответственно. Среди пациентов с удлинением интервала QTcF более 480мсек, медиана времени до появления симптома составила 15 дней независимо от вида комбинации, и данные изменения были обратимы при временной отмене и/или уменьшении дозы.Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметши любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу. |
 |
ПередозировкаСообщения о случаях передозировки препаратом у человека ограничены. В случае передозировки показана поддерживающая и симптоматическая терапия. |
 |
Взаимодействие Рисарг таблетки 200мгМетаболизм рибоциклиба осуществляется преимущественно посредством изофермента CYP3A. In vivo рибоциклиб представляет собой зависимый от времени ингибитор изофермента CYP3A. Поэтому лекарственные препараты, которые влияют на ферментативную активность изофермента CYP3A, способны изменять фармакокинетику рибоциклиба.Лекарственные средства, которые могут повышать концентрацию рибоциклиба в плазме крови: при одновременном применении у здоровых добровольцев мощного ингибитора изофермента CYP3A4 ритонавира и рибоциклиба отмечалось увеличение экспозиции последнего в 3,21 раза. Следует избегать одновременного применения мощных ингибиторов изофермента CYP3A, включая (но, не ограничиваясь) следующие лекарственные средства: кларитромицин, индинавир, итраконазол, кетоконазол, лопинавир, нефазодон, нелфинавир, позаконазол, ритонавир, саквинавир, телапревир, телитромицин, верапамил и вориконазол. Следует рассмотреть возможность альтернативных лекарственных средств с менее выраженной способностью ингибировать изофермент CYP3A, необходимо также контролировать НЛР у пациентов.При невозможности избежать одновременного приема препарата с мощным ингибитором изофермента CYP3A, следует снизить дозу препарата до 200мг. Клинические данные по коррекции этой дозы отсутствуют. При отмене мощного ингибитора прием препарата следует возобновить (по прошествии по меньшей мере 5-кратного периода полувыведения мощного ингибитора изофермента CYP3A) в дозе, применяемой до начала приема мощного ингибитора изофермента CYP3A. Рекомендуемая коррекция дозы не может быть оптимальной для всех пациентов из-за межиндивидуальной вариабельности, поэтому рекомендуется тщательный контроль НЛР. При проявлениях, связанных с токсичностью препарата Рисарг, дозу следует изменить, или временно отменить лечение до разрешения признаков токсичности препарата.Пациента следует проинформировать о необходимости избегать употребления в пищу грейпфрутов или грейпфрутового сока и всех продуктов, известных как ингибиторы изофермента CYP3A и способных увеличивать воздействие рибоциклиба.Лекарственные средства, которые могут понижать концентрацию рибоциклиба в плазме крови: при одновременном применении у здоровых добровольцев мощного индуктора изофермента CYP3A4 рифампина и рибоциклиба экспозиция последнего в плазме крови снижалась на 89%. Следует избегать одновременного применения мощных индукторов изофермента CYP3A, включая (но, не ограничиваясь) следующие лекарственные средства: фенитоин, рифампицин, карбамазепин и зверобой продырявленный (Hypericum perforatum). Необходимо рассмотреть возможность одновременного применения альтернативных лекарственных средств, с отсутствующей или выраженной минимально способностью вызывать индукцию изофермента CYP3A.Лекарственные средства, концентрацию в плазме крови которых может изменять рибоциклиб: при одновременном применении у здоровых добровольцев субстрата изофермента CYP3A4 мидазолама с многократными дозами препарата (400мг) экспозиция мидазолама увеличивается на 280% (в 3,80 раз) по сравнению с приемом только мидазолама. Использование физиологически обоснованной фармакокинетической модели (РВРК) позволяет предположить, что применение препарата в клинической дозе 600мг, как ожидается, увеличит AUC мидазолама в 5,2 раза. Рекомендуется соблюдать осторожность при применении препарата и субстратов изофермента CYP3A с узким терапевтическим индексом. Может потребоваться уменьшение дозы чувствительного субстрата изофермента CYP3A с узким терапевтическим индексом, включая (но, не ограничиваясь) следующими препаратами: алфентанил, циклоспорин, дигидроэрготамин, эрготамин, эверолимус, фентанил, пимозид, хинидин, сиролимус и такролимус, так как рибоциклиб обладает способностью увеличивать их экспозицию.При одновременном применении у здоровых добровольцев субстрата изофермента CYP1А2 кофеина с многократными дозами препарата (400мг) экспозиция кофеина увеличивалась на 20% (в 1,20 раза), по сравнению с приемом только кофеина. В клинически значимой дозе 600мг, моделирование с использованием РВРК-моделей позволило предсказать лишь слабое ингибирующее влияние рибоциклиба на субстраты изофермента CYP1А2 (увеличение AUC в 2 раза).Лекарственные средства, являющиеся субстратами переносчиков: исследования in vitro показали, что рибоциклиб в клинически значимых концентрациях обладает низким потенциалом ингибирования активности лекарственных переносчиков Р-гликопротеина, ОАТ1/3, ОАТР1В1/ВЗ, и ОСТ1. В клинических концентрациях рибоциклиб способен ингибировать белок резистентности рака молочной железы (BCRP), ОСТ2, МАТЕ1 и человеческий BSEP.Пищевые взаимодействия: препарат можно принимать с пищей или натощак.По сравнению с приемом натощак, применение рибоциклиба в форме таблеток, покрытых пленочной оболочкой, в однократной дозе 600мг с высококалорийной пищей с высоким содержанием жира не оказывает влияния на скорость и степень всасывания рибоциклиба (Cmax СГО: 1,00; 90% ДИ: 0.898, 1,11; AUCinf СГО: 1,06; 90% ДИ: 1,01, 1,12). Лекарственные средства, влияющие на pH желудочного сока: рибоциклиб характеризуется высокой растворимостью при pH 4,5 или ниже и в биологической среде (при pH 5,0 и 6,5). Одновременное применение препарата с лекарственными средствами, повышающими pH желудка, не оценивалось в клинических исследованиях; однако ни при популяционном фармакокинетическом анализе, ни при моделировании с использованием РВРК-моделей нарушения всасывания рибоциклиба не наблюдалось.Антиаритмические препараты и другие лекарственные средства, которые способны удлинять интервал QT: следует избегать одновременного применения препарата с лекарственными препаратами с известной способностью удлинять интервал QT, такими как антиаритмические средства. Следует избегать одновременного применения следующих антиаритмических препаратов (включая, но, не ограничиваясь): амиодарон, дизопирамид, прокаинамид, хинидин и соталол; других лекарственных препаратов, удлиняющих интервал QT (включая, но, не ограничиваясь): хлорохин, галофантрин, кларитромицин, ципрофлоксацин, левофлоксацин, азитромицин, галоперидол, метадон, моксифлоксацин, бепридил, пимозид и ондансетрон внутривенно вводимый. Не рекомендуется применять препарат в сочетании с тамоксифеном. |
 |
Особые указанияНейтропения: у пациентов, получающих препарат Рисарг в сочетании с ингибитором ароматазы/фулвестрантом (+/- ГнРГ) в клинических исследованиях III фаз, наиболее частой НЛР была нейтропения (73,7%) и снижение количества нейтрофилов (на основании лабораторных данных) 3 или 4 степени отмечалось у 58,4% пациентов.Среди пациентов, у которых наблюдалась нейтропения 2, 3 или 4 степени в клинических исследованиях III фазы, медиана времени до развития нейтропении 2, 3 или 4 степени составляла 16 дней. Медиана времени до разрешения нейтропении более 3 степени (до нормализации или уменьшения до менее 3 степени) составляла 12 дней в группе лечения препаратом в любой исследуемой комбинации. Тяжесть нейтропении зависела от концентрации. У пациентов, получающих препарат в клинических исследованиях III фазы, у 1,4% пациентов отмечалось развитие фебрильной нейтропении. Пациент должен быть в обязательном порядке проинформирован врачом о необходимости срочно сообщать, о любых случаях повышения температуры тела.Перед началом терапии препаратом следует выполнить ОАК. Необходим контроль ОАК каждые 2 недели в течение первых 2 циклов, в начале каждого из последующих 4 циклов и затем в соответствии с клиническими показаниями.При тяжелой нейтропении может потребоваться временная отмена приема препарата, уменьшение дозы или полная отмена. У пациентов с развитием нейтропении 1 или 2 степени коррекция дозы препарата не требуется. У пациентов с развитием нейтропении 3 степени без лихорадки следует временно отменить применение препарата до восстановления до менее 2 степени, и затем возобновить в той же дозе. При повторном развитии нейтропении 3 степени без лихорадки следует временно отменить применение препарата до восстановления показателя, затем возобновить в дозе, уменьшенной до следующего уровня. У пациентов с фебрильной нейтропенией 3 степени (АЧН от 500 до 1000/мм3 с единственным эпизодом лихорадки выше 38,3°С (или) выше 38°С в течение более 1 часа и/или с одновременным развитием инфекции), или у пациентов с развитием нейтропении 4 степени, применение препарата следует временно отменить до восстановления нейтропении менее 2 степени, затем следует возобновить в дозе, уменьшенной до следующего уровня.Гепатобилиарная токсичность: в клинических исследованиях III фазы наблюдалось повышение активности трансаминаз. Сообщалось об увеличении активности АЛТ (9,7% против 1,5%) и активности ACT (6,7% против 2,1%) 3 или 4 степени в группах пациентов, получающих препарат в сочетании с любой исследуемой комбинацией и в группе плацебо в сочетании с любой исследуемой комбинацией соответственно.В клинических исследованиях III фазы при терапии препаратом в комбинации с ингибитором ароматазы/фулвестрантом (+/- ГнРГ) увеличение активности АЛТ или активности ACT 3 или 4 степени наблюдалось в 83,2% (89/107) случаев в течение первых 6 месяцев лечения. Как сообщалось, в большинстве случаев увеличение активности АЛТ и ACT наблюдалось без повышения концентрации билирубина. Среди пациентов с увеличением активности АЛТ/АСТ 3 или 4 степени, медиана времени до развития этой реакции составляла 85 дней в группе лечения препаратом в сочетании с любой исследуемой комбинацией. Медиана времени до разрешения этой реакции (до нормализации или менее 2 степени) составляла 22 дня в группе лечения препаратом Рисарг в комбинации с ингибитором ароматазы/фулвестрантом (+/- ГнРГ). Одновременное повышение активности АЛТ или активности ACT более чем в три раза выше ВГН и концентрации общего билирубина более чем в два раза выше ВГН, с нормальной концентрацией щелочной фосфатазы и при отсутствии холестаза наблюдалось у 6 пациентов (1,2%) пациентов (4 пациента в постменопаузе при приеме комбинации препарата Рисарг с ингибиторами ароматазы и 2 пациента в постменопаузе при приеме комбинации Рисарг с фулвестрантом; у всех пациентов происходила нормализация показателей в течение 154 и 532 дней, соответственно, после отмены препарата). При приеме Рисарг в сочетании с ингибиторами ароматазы/фулвестрантом + ГнРГ для женщин в пременопаузе подобных случаев не наблюдалось.ФТП следует проводить до начала терапии препаратом. Контроль ФТП проводят каждые 2 недели в течение первых 2 циклов, в начале каждого из последующих 4 циклов, и затем в соответствии с клиническими показаниями.При выраженном повышении активности трансаминаз может потребоваться временная отмена приема, уменьшение дозы или полная отмена препарата Рисарг. Рекомендации для пациентов с исходным повышением активности АСТ/АЛТ более 3 степени не установлены.Для пациентов с увеличением активности ACT и/или АЛТ по сравнению с исходным уровнем (до начала лечения) без повышения концентрации общего билирубина (ОБ) более 2 раз выше ВГН представлены следующие изменения дозы и указания по применению:При 1 степени (повышение активности ACT и/или АЛТ от ВГН до 3 раз более ВГН) коррекция дозы препарата не требуется.У пациентов с исходными значениями, соответствующими менее 2 степени (повышение активности ACT и/или АЛТ от ВГН до 3 раз выше ВГН) — если развивается 2 степень (повышение активности ACT и/или АЛТ от 3 до 5 раз выше ВГН), препарат Рисарг следует временно отменить до значений меньше исходной степени, затем применение следует возобновить в той же дозе. Если 2 степень развивается повторно, следует возобновить применение препарата в дозе, сниженной до следующего уровня.У пациентов с исходными значениями, соответствующими 2 степени (повышение активности ACT и/или АЛТ от 3 до 5 раз выше ВГН) — если 2 степень сохраняется, то временная отмена препарата Рисарг не требуется.У пациентов с развитием 3 степени (повышение активности АЛТ и/или ACT от 5 до 20 раз выше ВГН) — применение препарата Рисарг следует временно отменить до значений менее исходной степени, затем применение следует возобновить в дозе, уменьшенной до следующего уровня. Если 3 степень развивается повторно, то препарат следует отменить.У пациентов с развитием 4 степени (повышение активности АЛТ и/или ACT более 20раз выше ВГН) препарат следует отменить.Для пациентов с сочетанием повышения активности ACT и/или АЛТ вместе с повышением концентрации общего билирубина при отсутствии холестаза, следующие изменения дозы и указания по применению: у пациентов при концентрации общего билирубина более 2 раз выше ВГН на фоне активности АЛТ и/или ACT более 3 раз выше ВГН, независимо от исходной степени токсичности, препарат Рисарг следует отменить.Удлинение интервала QT: в исследованиях III фазы обзор данных ЭКГ пациентов с распространенным или метастатическим раком молочной железы, получивших терапию препаратом Рисарг в сочетании с любой исследуемой комбинацией показал, что у 14 пациентов (1,3%) значение QTcF после исходного уровня составляло более 500мсек, у 59 пациентов (5,6%) отмечалось увеличение интервала QTcF более 60мсек от исходного уровня. О случаях желудочковой тахикардии типа «пируэт» не сообщалось.При приеме комбинации препарата с ингибиторами ароматазы/тамоксифеном и ГнРГ у пациентов в пременопаузе наблюдаемое среднее увеличение QTcF от базовой линии было на 10мсек выше в подгруппе плацебо в сочетании с тамоксифеном по сравнению с подгруппой плацебо в сочетании с нестероидными ингибиторами ароматазы. Таким образом, тамоксифен способствует риску удлинения интервала QTcF, что может вносить вклад в значение интервала QTcF при приеме комбинации рибоциклиба с тамоксифеном. Отмечалось увеличение интервала QTcF более 60мсек от исходного уровня у 6/90 (6,7%) пациентов в группе плацебо в комбинации с тамоксифеном, у 14/87 (16,1%) пациентов в группе рибоциклиба в сочетании с тамоксифеном и у 18/245 (7,3%) пациентов в группе рибоциклиба в сочетании с нестероидными ингибиторами ароматазы.До начала лечения необходимо провести ЭКГ. Лечение препаратом следует начинать только у пациентов с продолжительностью QTcF менее 450мсек. Повторное ЭКГ требуется проводить приблизительно на 14 день первого цикла и в начале второго цикла, затем в соответствии с клиническими показаниями.Следует проводить соответствующий контроль содержания электролитов (включая содержание калия, кальция, фосфатов и магния) в сыворотке крови до начала лечения, в начале первых 6 циклов и затем в соответствии с клиническими показаниями. Перед началом и в течение терапии препаратом необходимо провести коррекцию любых изменений содержания электролитов.Следует избегать применения препарата у пациентов с наличием или значительным риском удлинения интервала QTc, включая:синдром удлинения интервала QT;неконтролируемое или клинически значимое заболевание сердца, в том числе недавно перенесенный инфаркт миокарда, хроническая сердечная недостаточность, нестабильная стенокардия и брадиаритмия;изменения содержания электролитов.Следует избегать применения препарата с лекарственными средствами, которые способны удлинять интервал QTc и/или являются мощными ингибиторами изофермента CYP3A, так как это может привести к клинически значимому удлинению интервала QTcF. При выявлении удлинения интервала QT может потребоваться временная отмена приема, уменьшение дозы или полная отмена препарата. На основании клинического исследования III фазы, рибоциклиб не рекомендовано принимать в комбинации с тамоксифеном по причине значимого повышения тамоксифен-опосредованного риска удлинения интервала QTcF.При удлинении на ЭКГ QTcF более 480мсек: лечение препаратом Рисарг следует отменить.Если интервал QTcF уменьшается до менее 481мсек, следует возобновить применение препарата в той же дозе.Если интервал QTcF вновь увеличился более 481 мсек, то применение препарата следует прервать до длины QTcF менее 481мсек, затем применение следует возобновить в дозе, уменьшенной до следующего уровня.При длине QTcF более 500мсек не менее чем в 2 отдельно проведенных ЭКГ-исследованиях, необходимо принять следующие меры: временно прекратить лечение препаратом, если QTcF сократился до менее 481мсек, применение можно возобновить в дозе, уменьшенной до следующего уровня.При удлинении интервала QTcF более чем на 500мсек или наличии изменений более чем на 60мсек от исходного значения в сочетании с желудочковой тахикардией типа «пируэт» или полиморфной желудочковой аритмией или симптомов/признаков развития аритмии тяжелой степени, препарат Рисарг следует окончательно отменить. Влияние на способность управлять транспортными средствами и/или механизмами: препарат оказывает незначительное влияние на способность управлять транспортными средствами и/или механизмами. Пациентам следует соблюдать осторожность при управлении транспортными средствами и/или механизмами, учитывая возможность развития повышенной утомляемости во время применения препарата. |
 |
Условия храненияХранить в недоступном для детей месте при температуре не выше 30°С. |
