Валідація та кваліфікація
11
Сообщения
9
Участники
1
Likes
1,507
Просмотры
![]()
Дмитрий Пашко
(@gmp-validation)
155 Сообщения
3
5
11
Рибофлавиновый тест хорош для:
1) поиска критичных мест при написании СОПов по очистке,
2) обучения персонала ручной мойке
3) определения критичных мест при валидации очистки.
Собственно валидацией очистки его можно назвать, если контролируются автоматическая мойка. При ручной очистке — это скорее предвалидация.
Для теста понадобятся:
1. Рибофлавин (Витамин В2) или Флуоресцеин (диоксифлуоран); купить можно там где химики закупаются реактивами, грамм 100 достаточно, для начала.
2. Пульверизатор (некоторый дез.средства или стеклоочистители продаются в подходящих флаконах).
3. УФ-лампа. Популярная китайская модель 4Pro для контроля подлинности валют либо поискать на Али или DX более мощные китайские штучки.
4. Переносная лампа дневного света или светодиодный фонарик.
Процедура:
1. Готовят водный 0,5% раствор. На поверхность, загрязненную остатком продукта, наносят рибофлавин. С осторожностью наносят на места несъемных сальниковых уплотнений (об это ниже).
2. Осуществляют стандартную мойку в соответствии с СОП.
3. Светят лампой дневного света — должно быть визуально чисто. Я думаю не стоит говорить, что делать если это будет не так 🙂
4. Затемняют помещения и освещают поверхность оборудования УФ-лампой. Чтобы знать, что искать предварительно нанесите рибофлавин на какую-нибудь поверхность и посмотрите на характерное зеленовато-желтое свечение (похоже светятся специальные ворсинки на некоторых банкнотах).
Что вы увидите:
1. Те места, которые оператор, просто игнорирует.
2. Те места, до которых оператор просто не дотягивается, чтобы очистить (труднодоступные места). Решения: использовать различные удлинители — щетки, ершики, тонкую отвертку с намотанной салфеткой. Одна мне знакомая фирма, пошла дальше — залила наливной пол в помещениях, где стоит критичное оборудование и использует аппарат для подачи воды под высоким давлением — по-моему замечательное решение!
3. Те места, которые отмыть очень сложно в связи с необходимостью глубокой разборки оборудования. Это касается в основном некоторых сальниковых уплотнений, которые имеют воздушные карманы. Как правило, при работе оборудования эти карманы обдуваются сжатым воздухом, и вроде как исключается попадание продукта в них. Но при очистке сжатый воздух же отключают. Вот и получается что вода с растворенным продуктом запросто туда попадает.
4. Дефекты оборудования. Был случай, что после рибофлавиного теста стали попадаться желтые таблетки при таблетировании белой таблеточной массы. Причина: дефект в сварном шве, где соединяться гладкая внутренняя поверхность смесителя-гранулятора и камера выгрузки таблеточной массы. В данном месте, при изготовлении оборудования, образовалась «воздушная камера», которую заварили и отполировали. Но там оказалась маленькая дырочка, в которую затек рибофлавин во время испытаний и стал «сочится» при производстве. Так как практически все таблеточные массы белые, то данного дефекта никто не замечал. А дырочка действительно очень маленькая и на глаза совсем не бросалась.
- Описание
Набор для проведения рибофлавинового теста по методике VDMA предназначен для проведения валидации мойки/очистки загрязненных поверхностей технологического оборудования в соответствии с методикой ассоциации VDMA.
Валидация очистки — это документированное заключение о том, что процедура мойки/очистки оборудования разработана надлежащим образом и обеспечивает необходимый уровень чистоты для безопасного производства лекарственных средств. Мойка/очистка оборудования при производстве лекарственных средств является важнейшим требованием надлежащей производственной практики (GMP).
Принцип работы
Принцип метода рибофлавинового теста основан на том, что рибофлавин флуоресцирует в УФ-свете, эта флуоресценция видна даже при незначительном количестве следов рибофлавина.
На поверхность оборудования, подлежащего очистке, при помощи распылителя наносят тестовый раствор таким образом, чтобы вся поверхность была полностью смочена. Используется тестовый раствор следующего состава: рибофлавин, гидроксиэтилцеллюлоза (ГЭЦ), вода очищенная. Затем освещают поверхность УФ-лампой в затемненном помещении при выключенном свете и фотографируют поверхность. Не дожидаясь полного высыхания поверхности, проводят очистку поверхности оборудования согласно стандартной операционной процедуре (СОП). После окончания очистки осматривают поверхность при УФ-освещении и фотографируют. Испытание проводится на трех последовательных циклах очистки.

Дмитрий Пашко
(@gmp-validation)
155 Сообщения
3
5
11
Рибофлавиновый тест хорош для:
1) поиска критичных мест при написании СОПов по очистке,
2) обучения персонала ручной мойке
3) определения критичных мест при валидации очистки.
Собственно валидацией очистки его можно назвать, если контролируются автоматическая мойка. При ручной очистке — это скорее предвалидация.
Для теста понадобятся:
1. Рибофлавин (Витамин В2) или Флуоресцеин (диоксифлуоран); купить можно там где химики закупаются реактивами, грамм 100 достаточно, для начала.
2. Пульверизатор (некоторый дез.средства или стеклоочистители продаются в подходящих флаконах).
3. УФ-лампа. Популярная китайская модель 4Pro для контроля подлинности валют либо поискать на Али или DX более мощные китайские штучки.
4. Переносная лампа дневного света или светодиодный фонарик.
Процедура:
1. Готовят водный 0,5% раствор. На поверхность, загрязненную остатком продукта, наносят рибофлавин. С осторожностью наносят на места несъемных сальниковых уплотнений (об это ниже).
2. Осуществляют стандартную мойку в соответствии с СОП.
3. Светят лампой дневного света — должно быть визуально чисто. Я думаю не стоит говорить, что делать если это будет не так 🙂
4. Затемняют помещения и освещают поверхность оборудования УФ-лампой. Чтобы знать, что искать предварительно нанесите рибофлавин на какую-нибудь поверхность и посмотрите на характерное зеленовато-желтое свечение (похоже светятся специальные ворсинки на некоторых банкнотах).
Что вы увидите:
1. Те места, которые оператор, просто игнорирует.
2. Те места, до которых оператор просто не дотягивается, чтобы очистить (труднодоступные места). Решения: использовать различные удлинители — щетки, ершики, тонкую отвертку с намотанной салфеткой. Одна мне знакомая фирма, пошла дальше — залила наливной пол в помещениях, где стоит критичное оборудование и использует аппарат для подачи воды под высоким давлением — по-моему замечательное решение!
3. Те места, которые отмыть очень сложно в связи с необходимостью глубокой разборки оборудования. Это касается в основном некоторых сальниковых уплотнений, которые имеют воздушные карманы. Как правило, при работе оборудования эти карманы обдуваются сжатым воздухом, и вроде как исключается попадание продукта в них. Но при очистке сжатый воздух же отключают. Вот и получается что вода с растворенным продуктом запросто туда попадает.
4. Дефекты оборудования. Был случай, что после рибофлавиного теста стали попадаться желтые таблетки при таблетировании белой таблеточной массы. Причина: дефект в сварном шве, где соединяться гладкая внутренняя поверхность смесителя-гранулятора и камера выгрузки таблеточной массы. В данном месте, при изготовлении оборудования, образовалась «воздушная камера», которую заварили и отполировали. Но там оказалась маленькая дырочка, в которую затек рибофлавин во время испытаний и стал «сочится» при производстве. Так как практически все таблеточные массы белые, то данного дефекта никто не замечал. А дырочка действительно очень маленькая и на глаза совсем не бросалась.
- Описание
Набор для проведения рибофлавинового теста по методике VDMA предназначен для проведения валидации мойки/очистки загрязненных поверхностей технологического оборудования в соответствии с методикой ассоциации VDMA.
Валидация очистки — это документированное заключение о том, что процедура мойки/очистки оборудования разработана надлежащим образом и обеспечивает необходимый уровень чистоты для безопасного производства лекарственных средств. Мойка/очистка оборудования при производстве лекарственных средств является важнейшим требованием надлежащей производственной практики (GMP).
Принцип работы
Принцип метода рибофлавинового теста основан на том, что рибофлавин флуоресцирует в УФ-свете, эта флуоресценция видна даже при незначительном количестве следов рибофлавина.
На поверхность оборудования, подлежащего очистке, при помощи распылителя наносят тестовый раствор таким образом, чтобы вся поверхность была полностью смочена. Используется тестовый раствор следующего состава: рибофлавин, гидроксиэтилцеллюлоза (ГЭЦ), вода очищенная. Затем освещают поверхность УФ-лампой в затемненном помещении при выключенном свете и фотографируют поверхность. Не дожидаясь полного высыхания поверхности, проводят очистку поверхности оборудования согласно стандартной операционной процедуре (СОП). После окончания очистки осматривают поверхность при УФ-освещении и фотографируют. Испытание проводится на трех последовательных циклах очистки.

Результат считается положительным, если после очистки поверхность визуально чистая и отсутствует свечение на труднодоступных участках раствора рибофлавина от УФ-лампы. Все результаты фиксируются и заносятся в протокол валидации мойки/очистки оборудования, все фото прилагаются. В современных высокотехнологичных отраслях науки и промышленности – фармации, биотехнологии, нанотехнологии, материаловедении используется сложное, дорогое и, нередко, уникальное технологическое оборудование и установки. После про- 40 ведения работ, наработки одного продукта переходят к следующему. При этом аппарат или установка должны быть отмыты от следов предыдущего вещества. Наилучшим образом нормирование процедур мойки/очистки разработана в фармацевтической промышленности, так как недопустимо, чтобы в один лекарственный препарат попадало другое сильнодействующее вещество.
Наш набор это лучшее решение для проведения рибофлавинового теста по методике VDMA.
Теги:
Рибофлавиновый тест

Register now for ECA’s GMP Newsletter
![]()
Register now for ECA’s GMP Newsletter

Within the framework of cleaning validation, the riboflavin test is discussed time and again. This test is meant to show the equipment cleanability in advance. The individual performance of the test made it well-nigh impossible to make comparisons and gave repeatedly rise to questions. In December 2007, the VDMA (German Process Plant and Equipment Association), with 3,000 mainly medium-sized member firms from the capital goods industry one of the largest and most important industry associations in Europe, published an information sheet on this test. «Riboflavin test for low-germ or sterile process technologies Fluorescence test for examination of cleanability For food, aseptic, pharmacy and chemistry.» On 10 pages, the information sheet gives advice on agreement, planning, performance and documentation of a fluorescence test. The following chapters are of special interest:
- Chapter 4: Aim of the fluorescence test (with evaluation of the test results)
- Chapter 5: Installation, equipment, specifications and carrying out the test
- Chapter 7: Documentation
Apart from these, there is an introduction (Chapter 1), the definition of the scope (Chapter 2) as well as explanations of terms and definitions (chapter 3). Another very important part is chapter 8 (Annex), in which ingredients and recipes of test solutions as well as a schematic sketch of an installation for carrying out a fluorescence test are defined and specified.
Conclusion: The document can be helpful for the pharmaceutical industry since the information sheet describes a standardised procedure of the riboflavin test. Concentrations and the optional use of a thickening agent are defined. An alternative to riboflavin as a fluorescent substance is also indicated (uranin). Interestingly, the text recommends that drying of the fluorescent dye should be avoided. This might need to be discussed, since some riboflavin tests deliberately opt for the drying as the worst-case scenario. The information sheet can be downloaded from the VDMA website.
Author
Sven Pommeranz
On behalf of the European Compliance Academy (ECA)
PS. Within the framework of the ECA event Cleaning Validation in Prague on 15-16 April 2010, we will also deal with the riboflavin test. Details on the event can be found here.
ИНСТРУКЦИЯ
по определению рибофлавина (витамина В ) в пищевых продуктах
) в пищевых продуктах
РАЗРАБОТАНА в Институте питания АМН СССР лабораторией Витаминизации пищевых продуктов.
УТВЕРЖДЕНА Зам. начальника Главного Санитарно-эпидемиологического Управления Минздрава СССР Заиченко А.И. 10 июля 1987 г. N 4398-87
Для определения общего содержания рибофлавина в пищевых продуктах используют флюорометрический метод, разработанный в двух вариантах (прямой флюорометрии и люмифлавиновый). Он прошел широкую апробацию в различных лабораториях научных и практических учреждений, принимавших участие в подготовке справочных «Таблиц химического состава продуктов», рекомендован Междуведомственной комиссией по составлению этих таблиц и одобрен Минздравом СССР.
Принцип метода
Метод основан на свойстве свободного рибофлавина и продукта его фотолиза-люмифлавина — флюоресцировать при облучении их растворов светом с длиной волны 440-450 нм. В варианте прямой флюорометрии интенсивность флюоресценции измеряется до и после восстановления рибофлавина гидросернистокислым натрием. В люмифлавиновом варианте используется свойство рибофлавина при облучении в щелочной среде переходить в люмифлавин, интенсивность флюоресценции которого измеряют после извлечения его хлороформом.
Оборудование
Флюориметр ЭФ-3М или ФМ-Ц-2; потенциометр; термостат водяной на 37 °С; весы лабораторные общего назначения с наибольшим пределом взвешивания 200 г, поверочной ценой деления не более 0,5 мг; весы лабораторные общего назначения с наибольшим пределом взвешивания 500 г, поверочной ценой деления не более 50 мг; водяная баня.
Для люмифлавинового варианта дополнительно нужны две настольные лампы по 100 ватт (желательно с отражателями, направляющими свет на облучаемые колбы), настольный вентилятор.
Реактивы
1. Калий марганцевокислый х.ч.
2. Натрий гидроокись х.ч.
3. Натрий гидросернистокислый техн.
4. Натрий уксуснокислый 3-х водн. х.ч.
5. Натрия сульфат безводный х.ч.
6. Перекись водорода 30% х.ч.
7. Рибофлавин кристаллический (Гос. фармакопея СССР X изд., ст.585).
8. Кислота соляная х.ч.
9. Кислота уксусная ледяная х.ч.
10. Хлороформ для наркоза
11. Ферментные препараты амилоризин П10х или пектаваморин П10х.
Приготовление реактивов
1. Стандартные растворы рибофлавина. Растворяют 0,0200 г рибофлавина, предварительно высушенного в эксикаторе над серной кислотой или пятиокисью фосфора в течение 10 дней, в мерной колбе вместимостью 1000 см в 750 см
в 750 см дистиллированной воды. Для лучшего растворения добавляют 1 см
дистиллированной воды. Для лучшего растворения добавляют 1 см ледяной уксусной кислоты и слегка подогревают. После полного растворения рибофлавина раствор охлаждают до комнатной температуры, доводят объем водой до метки и тщательно перемешивают (раствор с массовой концентрацией рибофлавина 0,020 г/см
ледяной уксусной кислоты и слегка подогревают. После полного растворения рибофлавина раствор охлаждают до комнатной температуры, доводят объем водой до метки и тщательно перемешивают (раствор с массовой концентрацией рибофлавина 0,020 г/см ). Переносят в склянку темного стекла с притертой пробкой, добавляют 0,5 см
). Переносят в склянку темного стекла с притертой пробкой, добавляют 0,5 см толуола и сохраняют в темноте и на холоду не более 2-х месяцев. В день проведения анализа 5 см
толуола и сохраняют в темноте и на холоду не более 2-х месяцев. В день проведения анализа 5 см этого раствора, нагретого в темноте до комнатной температуры, помещают в мерную колбу вместимостью 100 см
этого раствора, нагретого в темноте до комнатной температуры, помещают в мерную колбу вместимостью 100 см и доводят объем до метки водой, перемешивают (рабочий раствор с массовой концентрацией рибофлавина 1 мкг/см
и доводят объем до метки водой, перемешивают (рабочий раствор с массовой концентрацией рибофлавина 1 мкг/см ).
).
2. Раствор соляной кислоты 0,1 н.
3. Насыщенный раствор натрия уксуснокислого.
4. Раствор калия марганцевокислого 3%.
5. Раствор перекиси водорода 3%, готовят свежий еженедельно.
6. Раствор гидроокиси натрия 7 н.
Ход определения
Интервал определения концентраций рибофлавина составляет при прямой флюорометрии 0,5-2 мкг/см при использовании люмифлавинового варианта — 0,03-0,20 мкг/см
при использовании люмифлавинового варианта — 0,03-0,20 мкг/см . Величину навески продукта и последующие разведения рассчитывают исходя из интервала указанных концентраций.
. Величину навески продукта и последующие разведения рассчитывают исходя из интервала указанных концентраций.
Навеску мелкоизмельченной средней пробы продукта помещают в коническую колбу вместимостью 250 см , приливают около 150 см
, приливают около 150 см 0,1 н раствора соляной кислоты и кипятят на водяной бане 40 минут. Затем охлаждают до комнатной температуры, доводят рН гидролизата до 4,5 (потенциометрически) с помощью насыщенного раствора уксуснокислого натрия, добавляют 100 мг амилоризина, 0,5 см
0,1 н раствора соляной кислоты и кипятят на водяной бане 40 минут. Затем охлаждают до комнатной температуры, доводят рН гидролизата до 4,5 (потенциометрически) с помощью насыщенного раствора уксуснокислого натрия, добавляют 100 мг амилоризина, 0,5 см толуола и помещают в термостат на 14-16 часов при 37 °С. На следующий день гидролизат охлаждают, доводят объем в мерном цилиндре до 250 см
толуола и помещают в термостат на 14-16 часов при 37 °С. На следующий день гидролизат охлаждают, доводят объем в мерном цилиндре до 250 см дистиллированной водой и фильтруют. Если исследуемый объект содержит много жира, то навеску перед гидролизом обрабатывают серным эфиром; возможно, также обработать эфиром уже готовый гидролизат.
дистиллированной водой и фильтруют. Если исследуемый объект содержит много жира, то навеску перед гидролизом обрабатывают серным эфиром; возможно, также обработать эфиром уже готовый гидролизат.
При анализе объектов, содержащих много пектиновых веществ (яблоки, крыжовник, смородина, тыква, кабачки и продукты их переработки) вместо амилоризина используют пектавамарин. При необходимости прервать анализ на 1-2 дня перед доведением объема до 250 см гидролизат кипятят 5 минут, охлаждают, доводят объем до 250 см
гидролизат кипятят 5 минут, охлаждают, доводят объем до 250 см и фильтруют. До проведения анализа фильтрат хранят в холодильнике в хорошо закрытой склянке.
и фильтруют. До проведения анализа фильтрат хранят в холодильнике в хорошо закрытой склянке.
Одновременно аналогичным образом ставят контрольную пробу на содержание рибофлавина в ферментных препаратах, используя те же количества ферментных препаратов и реактивов. При анализе многих видов продуктов стадия гидролиза совпадает с аналогичной стадией анализа на содержание тиамина, что позволяет проводить определения рибофлавина и тиамина в одной навеске.
Вариант прямой флюорометрии
Метод прямой флюорометрии неприменим при анализе объектов с очень низким содержанием рибофлавина (некоторые овощи, плоды, ягоды), готовых блюд и кулинарных изделий, а также при исследовании зерновых продуктов (круп, муки, зерна, хлеба и т.д.). В этих случаях предпочтительным является люмифлавиновый вариант.
В 4 флюорометрические пробирки наливают по 10 см фильтрата испытуемого образца. В 2 пробирки с фильтратом добавляют по 1 см
фильтрата испытуемого образца. В 2 пробирки с фильтратом добавляют по 1 см (очень точно) стандартного раствора, содержащего 1 мкг рибофлавина в 1 см
(очень точно) стандартного раствора, содержащего 1 мкг рибофлавина в 1 см . В 5-ю пробирку наливают 10 см
. В 5-ю пробирку наливают 10 см фильтрата контрольной пробы к 1 см
фильтрата контрольной пробы к 1 см воды. Во все пробирки добавляют по 1 см
воды. Во все пробирки добавляют по 1 см ледяной уксусной кислоты и перемешивают содержимое. Затем вносят по 0,5 см
ледяной уксусной кислоты и перемешивают содержимое. Затем вносят по 0,5 см 3% раствора KМnО
3% раствора KМnО ; смешивают и оставляют на 2 мин. Добавляют в каждую пробирку по 0,5 см
; смешивают и оставляют на 2 мин. Добавляют в каждую пробирку по 0,5 см 3% раствора Н
3% раствора Н О
О и энергично встряхивают для удаления избытка кислорода.
и энергично встряхивают для удаления избытка кислорода.
Измеряют флюоресценцию всех растворов на флюориметре со светофильтрами, имеющими максимум пропускания в области 350-480 нм (В — первичный) и 510-650 нм (В
— первичный) и 510-650 нм (В — вторичный). После этого добавляют в каждую пробирку небольшими порциями (по 15-25 мг) порошкообразный гидросернистокислый натрий, перемешивают и в течение 5-10 сек вновь измеряют флюоресценцию растворов. Повторяют эту операцию быстро еще раз, не допуская помутнения растворов за счет выделения свободной серы.
— вторичный). После этого добавляют в каждую пробирку небольшими порциями (по 15-25 мг) порошкообразный гидросернистокислый натрий, перемешивают и в течение 5-10 сек вновь измеряют флюоресценцию растворов. Повторяют эту операцию быстро еще раз, не допуская помутнения растворов за счет выделения свободной серы.
Для расчетов используют средние показания двух параллельных пробирок до и после добавления гидросернистокислого натрия. В последнем случае берут наименьшее значение флюоресценции, полученные при повтором восстановлении рибофлавина гидросернистокислым натрием. Содержание рибофлавина в исследуемом образце в мг на 100 г (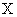 ) вычисляют по следующей формуле:
) вычисляют по следующей формуле:
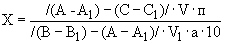 ,
,
где 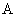 — интенсивность флюоресценции исследуемого образца без добавления стандартного раствора рибофлавина;
— интенсивность флюоресценции исследуемого образца без добавления стандартного раствора рибофлавина; 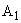 — то же после восстановления рибофлавина гидросернистокислым натрием;
— то же после восстановления рибофлавина гидросернистокислым натрием; 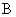 — интенсивность флюоресценции исследуемого образца с добавлением стандартного раствора рибофлавина;
— интенсивность флюоресценции исследуемого образца с добавлением стандартного раствора рибофлавина; 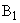 — то же после восстановления рибофлавина гидросернистокислым натрием;
— то же после восстановления рибофлавина гидросернистокислым натрием; 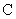 — интенсивность флюоресценции контрольного опыта;
— интенсивность флюоресценции контрольного опыта; 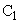 — то же после добавления гидросернистокислого натрия;
— то же после добавления гидросернистокислого натрия; 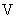 — объем гидролизата (см
— объем гидролизата (см );
); 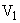 — количество гидролизата, взятого для окисления перманганатом калия (см
— количество гидролизата, взятого для окисления перманганатом калия (см );
); 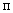 — количество добавленного рибофлавина (мкг);
— количество добавленного рибофлавина (мкг); 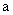 — навеска образца (г); 10 — коэффициент пересчета из мкг/г в мг/100 г продукта.
— навеска образца (г); 10 — коэффициент пересчета из мкг/г в мг/100 г продукта.
Люмифлавиновый вариант
К 100 мл фильтрата добавляют 2 см 30% раствора серной кислоты из пипетки 3% KМnО
30% раствора серной кислоты из пипетки 3% KМnО по каплям, постоянно перемешивая, до получения малинового окрашивания. Через одну минуту избыток перманганата калия удаляют добавлением по каплям 3% раствора перекиси водорода. Количество см
по каплям, постоянно перемешивая, до получения малинового окрашивания. Через одну минуту избыток перманганата калия удаляют добавлением по каплям 3% раствора перекиси водорода. Количество см израсходованных перманганата калия и перекиси водорода приплюсовывают к первоначально взятому на окисление объему фильтрата, чтобы определить конечный объем раствора.
израсходованных перманганата калия и перекиси водорода приплюсовывают к первоначально взятому на окисление объему фильтрата, чтобы определить конечный объем раствора.
Например: на окисление 100 см фильтрата израсходовано 1,8 см
фильтрата израсходовано 1,8 см 3% KМnО
3% KМnО и 0,2 см
и 0,2 см Н
Н О
О . Конечный объем будет 100 см
. Конечный объем будет 100 см +2 см
+2 см 30% серной кислоты+1,8 см
30% серной кислоты+1,8 см +0,2 см
+0,2 см =104 см
=104 см .
.
Полученный раствор переносят в делительную воронку, добавляют 30-50 см хлороформа и встряхивают 1 мин. После разделения слоев хлороформный слой отбрасывают, а водную фазу используют для дальнейшего определения. Одновременно аналогичным образом обрабатывают контрольную пробу, содержащую те же количества ферментных препаратов и реактивов, но без исследуемого образца.
хлороформа и встряхивают 1 мин. После разделения слоев хлороформный слой отбрасывают, а водную фазу используют для дальнейшего определения. Одновременно аналогичным образом обрабатывают контрольную пробу, содержащую те же количества ферментных препаратов и реактивов, но без исследуемого образца.
В 4 конические колбы с притертыми пробками наливают по 20 см экстракта исследуемого образца. В две из них добавляют по 2 см
экстракта исследуемого образца. В две из них добавляют по 2 см рабочего стандартного раствора рибофлавина, с массовой концентрацией 1 мкг в 1 см
рабочего стандартного раствора рибофлавина, с массовой концентрацией 1 мкг в 1 см . В 5-ю коническую колбу наливают 20 см
. В 5-ю коническую колбу наливают 20 см контрольной пробы. Во все колбы добавляют по 4 см
контрольной пробы. Во все колбы добавляют по 4 см 7 н раствора едкого натра, закрывают пробками, перемешивают и облучают их 40 мин светом двух настольных ламп по 100 ватт с расстояния 30 см. Температура окружающего воздуха не должна превышать 25°, для охлаждения используют настольный вентилятор. Немедленно после окончания облучения все растворы подкисляют 4 см
7 н раствора едкого натра, закрывают пробками, перемешивают и облучают их 40 мин светом двух настольных ламп по 100 ватт с расстояния 30 см. Температура окружающего воздуха не должна превышать 25°, для охлаждения используют настольный вентилятор. Немедленно после окончания облучения все растворы подкисляют 4 см ледяной уксусной кислоты, добавляют по 20 см
ледяной уксусной кислоты, добавляют по 20 см хлороформа, закрывают притертыми пробками и встряхивают колбы в течение 2-х минут, избегая образования эмульсии. Оставляют все колбы на 10-15 минут для расслоения водной и хлороформной фаз. С помощью пипетки с резиновой грушей и небольшой делительной воронки отбирают по 10-12 см
хлороформа, закрывают притертыми пробками и встряхивают колбы в течение 2-х минут, избегая образования эмульсии. Оставляют все колбы на 10-15 минут для расслоения водной и хлороформной фаз. С помощью пипетки с резиновой грушей и небольшой делительной воронки отбирают по 10-12 см хлороформного раствора, который фильтруют через бумажный фильтр с безводным сернокислым натрием в флюорометрические пробирки.
хлороформного раствора, который фильтруют через бумажный фильтр с безводным сернокислым натрием в флюорометрические пробирки.
Измеряют флюоресценцию полученных таким образом хлороформных растворов на флюориметре, используя те же светофильтры, которые указаны в варианте прямой флюорометрии.
Содержание рибофлавина (мг на 100 г продукта) вычисляют по формуле:
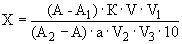 ,
,
где 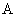 — среднее из показаний флюориметра для испытуемого образца без добавления стандартного раствора рибофлавина;
— среднее из показаний флюориметра для испытуемого образца без добавления стандартного раствора рибофлавина; 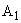 — то же для контрольного опыта на реактивы;
— то же для контрольного опыта на реактивы; 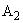 — среднее из показаний флюориметра для исследуемого образца с добавлением стандартного раствора рибофлавина ;
— среднее из показаний флюориметра для исследуемого образца с добавлением стандартного раствора рибофлавина ; 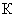 — количество добавленного рибофлавина (мкг);
— количество добавленного рибофлавина (мкг); 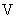 — общий объем гидролизата (см
— общий объем гидролизата (см );
); 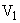 — объем гидролизата после окисления (см
— объем гидролизата после окисления (см );
); 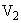 — объем гидролизата, взятый на окисление (см
— объем гидролизата, взятый на окисление (см );
); 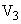 — объем гидролизата, взятый на облучение (см
— объем гидролизата, взятый на облучение (см );
); 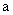 — навеска продукта (г); 10 — коэффициент пересчета из мкг/г в мг/100 г продукта.
— навеска продукта (г); 10 — коэффициент пересчета из мкг/г в мг/100 г продукта.
Вычисления проводят до второго знака после запятой. Расхождение между двумя параллельными определениями не должно превышать 10% от среднего арифметического значения.
