Механизм действия
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист рецептора ГПП-1 (рГПП-1), который селективно связывается с рГПП-1 (мишенью нативного ГПП-1) и активирует его.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на сердечно-сосудистую систему (ССС). Влияние на концентрацию глюкозы и аппетит специфически опосредовано рГПП-1, расположенными в поджелудочной железе и головном мозге. Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляции секреции инсулина и подавления секреции глюкагона при высокой концентрации глюкозы крови. Механизм снижения концентрации глюкозы крови также связан с небольшой задержкой опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не препятствует секреции глюкагона. Механизм действия семаглутида не зависит от способа применения.
Семаглутид снижает массу тела и массу жировой ткани, уменьшая потребление энергии, в т.ч. в целом снижая аппетит. Кроме того, семаглутид снижает предпочтение к приему пищи с высоким содержанием жиров.
рГПП-1 представлены в специфических областях сердца, сосудов, иммунной системы и почек. В клинических исследованиях (КИ) семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое АД и уменьшал воспаление. В исследованиях на животных семаглутид замедлял развитие атеросклероза, предупреждая прогрессирование развития аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамика
Результаты фармакодинамики семаглутида для приема внутрь оценивались после 12 недель применения.
Гликемия натощак и постпрандиальная гликемия
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. У пациентов с сахарным диабетом 2 типа (СД2) терапия семаглутидом привела к снижению концентрации глюкозы натощак на 22% и постпрандиальной концентрации глюкозы на 29% по сравнению с плацебо.
Секреция глюкагона
Семаглутид снижает постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к снижению концентрации глюкагона по сравнению с плацебо, а именно, к снижению постпрандиального глюкагонового ответа на 29%.
Опорожнение желудка
Семаглутид вызывает небольшую задержку раннего постпрандиального опорожнения желудка (экспозиция парацетамола (AUC0-1ч) снижается на 31% в первый час после приема пищи), тем самым снижая скорость поступления постпрандиальной глюкозы в кровь.
Концентрация липидов натощак и после приема пищи
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и холестерина ЛПОНП натощак на 19% и 20%, соответственно. Постпрандиальное увеличение концентрации триглицеридов и холестерина ЛПОНП в ответ на прием пищи с высоким содержанием жиров снизилось на 24% и 21% соответственно. Концентрация АпоB48 снижалась как натощак, так и после приема пищи на 25% и 30% соответственно.
Клиническая эффективность и безопасность
Эффективность и безопасность препарата Ребелсас® оценивались в восьми глобальных рандомизированных контролируемых КИ фазы IIIа. Из них семь КИ в качестве основной цели оценивали эффективность гликемического контроля, в то время как одно КИ оценивало в качестве основной цели сердечно-сосудистый (СС) исход. В КИ были включены 8842 рандомизированных пациента с СД2 (5169 человек получали семаглутид), в т.ч. 1165 пациентов с умеренным нарушением функции почек. Средний возраст пациентов составил 61 год (от 18 до 92 лет), причем 40% пациентов были в возрасте 65 лет и старше, а 8% — 75 лет и старше. Эффективность семаглутида сравнивали с плацебо или активным контролем (ситаглиптин, эмпаглифлозин и лираглутид).
Возраст, пол, раса, этническая принадлежность, масса тела, ИМТ, длительность сахарного диабета (СД), заболевания верхних отделов ЖКТ и почечная недостаточность не повлияли на эффективность семаглутида.
Монотерапия
В 26-недельном двойном слепом исследовании 703 пациента с СД2, недостаточно контролируемым диетой и физическими нагрузками, были рандомизированы в группы терапии препаратом Ребелсас® в дозах 3 мг, 7 мг, 14 мг или плацебо 1 раз/сут.
По результатам исследования (анализ данных 703 пациентов) монотерапия препаратом Ребелсас® в дозах 3 мг, 7 мг и 14 мг 1 раз/сут в течение 26 недель привела к статистически значимому снижению показателей HbA1c на 0.9%, 1.2% и 1.4% по сравнению с 0.3% в группе плацебо (p<0.001 для всех дозировок).
Показатель глюкозы плазмы натощак (ГПН) на фоне монотерапии препаратом Ребелсас® в дозах 3 мг, 7 мг и 14 мг 1 раз/сут в течение 26 недель снизился на 0.9 ммоль/л, 1.5 ммоль/л и на 1.8 ммоль/л соответственно, по сравнению с 0.2 ммоль/л в группе плацебо (p=0.003, p<0.001, p<0.001 соответственно дозам).
На терапии препаратом Ребелсас® 14 мг было получено статистически значимое снижение массы тела на 3.7 кг против снижения на 1.4 кг в группе плацебо (p<0.001).
Доля пациентов, достигших целевого значения HbA1c <7%, составила 55%, 69%, 77% и 31% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с эмпаглифлозином, оба в комбинации с метформином
В 52-недельном открытом КИ 822 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® 14 мг 1 раз/сут или эмпаглифлозином 25 мг 1 раз/сут, оба в комбинации с метформином.
На 26 неделе (первичная конечная точка — анализ данных 822 пациентов) терапия препаратом Ребелсас® 14 мг 1 раз/сут по сравнению с эмпаглифлозином 25 мг 1 раз/сут привела к статистически значимому снижению показателя HbA1c на 1.3% против снижения на 0.9%, соответственно (p<0.0001).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе, составила 67% и 40% для препарата Ребелсас® 14 мг и эмпаглифлозина 25 мг соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 52 неделе, сохранялась примерно в том же соотношении 66% и 43% для препарата Ребелсас® 14 мг и эмпаглифлозина 25 мг соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с ситаглиптином, оба в комбинации с метформином, или метформином совместно с производными сульфонилмочевины
В 78-недельном двойном слепом исследовании с двойным маскированием 1864 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® в дозе 3 мг, 7 мг, 14 мг или ситаглиптином в дозе 100 мг 1 раз/сут (оба в комбинации с метформином или метформином совместно с производными сульфонилмочевины).
На 26 неделе (первичная конечная точка – анализ данных 1397 пациентов) терапия препаратом Ребелсас® 7 мг и 14 мг 1 раз/сут привела к статистически значимому снижению показателя HbA1c на 1.0% и на 1.3% по сравнению со снижением на 0.8% на терапии ситаглиптином 100 мг 1 раз/сут (p<0.001 для обеих доз соответственно).
Показатель ГПН на фоне терапии препаратом Ребелсас® в дозах 7 мг и 14 мг раз в сутки в течение 26 недель снизился на 1.2 ммоль/л и на 1.7 ммоль/л соответственно по сравнению с 0.9 ммоль/л в группе терапии ситаглиптином 100 мг 1 раз/сут (p<0.05, p<0.001 соответственно дозам).
На терапии препаратом Ребелсас® 7 мг и 14 мг в течение 26 недель было получено статистически значимое снижение массы тела на 2.2 кг и на 3.1 кг против снижения на 0.6 кг в группе терапии ситаглиптином 100 мг 1 раз/сут (p<0.001 для обеих доз).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе исследования, составила 44%, 56% и 32% для препарата Ребелсас® 7 мг, 14 мг и ситаглиптина 100 мг соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 78 неделе, сохранялась примерно в том же соотношении 39%, 45% и 29% для препарата Ребелсас® 7 мг, 14 мг и ситаглиптина 100 мг соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с лираглутидом и плацебо, все в комбинации с метформином или метформином с ингибитором натрийзависимого переносчика глюкозы 2 типа (SGLT2)
В 52-недельном двойном слепом исследовании с двойным маскированием 711 пациентов с СД2 были рандомизированы в группы терапии препаратом Ребелсас® 14 мг, лираглутидом 1.8 мг в виде п/к инъекции или плацебо 1 раз/сут (все в комбинации с метформином или метформином с ингибитором SGLT2).
На 26 неделе (первичная конечная точка — анализ данных 711 пациентов) терапия препаратом Ребелсас® 14 мг 1 раз/сут привела к статистически значимому снижению показателя HbA1c на 1.2% по сравнению со снижением на 1.1% в группе терапии лираглутидом 1.8 мг в виде п/к инъекции 1 раз/сут (p<0.0001 в отношении не меньшей эффективности) и по сравнению со снижением на 0.2% в группе плацебо (p<0.0001).
Показатель ГПН на фоне терапии препаратом Ребелсас® 14 мг 1 раз/сут в течение 26 недель снизился на 2.0 ммоль/л по сравнению с 0.4 ммоль/л в группе плацебо (p<0.0001).
На терапии препаратом Ребелсас® 14 мг в течении 26 недель было получено статистически значимое снижение массы тела на 4.4 кг против снижения на 3.1 кг в группе терапии лираглутидом 1.8 мг в виде п/к инъекции 1 раз/сут (p=0.0003) и по сравнению со снижением на 0.5 кг в группе плацебо (p<0.0001).
Доля пациентов, достигших HbA1c <7% на 26 неделе исследования, составила 68%, 62% и 14% для препарата Ребелсас® 14 мг, лираглутида 1,8 мг и плацебо соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 52 неделе, составила 61%, 55% и 15% для препарата Ребелсас® 14 мг, лираглутида 1.8 мг и плацебо соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с плацебо, оба в комбинации с монотерапией базальным инсулином или метформином, или производными сульфонилмочевины, или с комбинацией метформина и базального инсулина или с комбинацией метформина и производных сульфонилмочевины у пациентов с умеренным нарушением функции почек
В 26-недельном двойном слепом исследовании 324 пациента с СД2 и умеренным нарушением функции почек (рСКФ 30-59 мл/мин/1.73 м2) были рандомизированы в группы терапии препаратом Ребелсас® 14 мг или плацебо 1 раз/сут. Препарат исследования был добавлен к стабильному режиму гипогликемической терапии.
На 26 неделе (первичная конечная точка – анализ данных 324 пациентов) терапия препаратом Ребелсас® 14 мг 1 раз/сут по сравнению с плацебо привела к статистически значимому снижению показателей HbA1c на 1.0% по сравнению с 0.2% в группе плацебо (p<0.0001).
Показатель ГПН на фоне терапии препаратом Ребелсас® 14 мг 1 раз/сут в течение 26 недель снизился на 1.5 ммоль/л по сравнению с 0.4 ммоль/л в группе плацебо (p<0.05).
На терапии препаратом Ребелсас® 14 мг было получено статистически значимое снижение массы тела на 3.4 кг по сравнению со снижением на 0.9 кг в группе плацебо (p<0.0001).
Доля пациентов, достигших HbA1c <7%, составила 58% и 23% для препарата Ребелсас® 14 мг и плацебо соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с ситаглиптином, оба в комбинации с метформином, ингибиторами SGLT2, производными сульфонилмочевины или тиазолидиндионами. Исследование гибкой коррекции дозы
В 52-недельном открытом исследовании 504 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® (гибкая коррекция дозы 3 мг, 7 мг и 14 мг 1 раз/сут) или ситаглиптином в дозе 100 мг 1 раз/сут, оба в комбинации с 1-2 пероральными гипогликемическими лекарственными препаратами (метформин, ингибиторы SGLT2, производные сульфонилмочевины или тиазолидиндионы). Дозу препарата Ребелсас® корректировали каждые 8 недель в зависимости от гликемического ответа пациента и его переносимости. Доза ситаглиптина 100 мг была фиксированной.
На 52 неделе (первичная конечная точка – анализ данных 504 пациентов) количество пациентов, получающих терапию семаглутидом в дозах 3 мг, 7 мг и 14 мг, составило примерно 10%, 30% и 60% соответственно. Доля пациентов, достигших целевого значения HbA1c <7%, составила 58% и 25% для гибкой дозы препарата Ребелсас® 1 раз/сут и ситаглиптина в фиксированной дозе 100 мг соответственно (p<0.001). Шанс достижения целевого значения HbA1c <7% для гибкой дозы препарата Ребелсас® 1 раз/сут был в 4.4 больше в сравнении с шансом на терапии ситаглиптином в фиксированной дозе 100 мг (p<0.0001).
Терапия гибкой дозой препарата Ребелсас® 1 раз/сут привела к статистически значимому снижению показателя массы тела на 2.6 кг в сравнении со снижением на 0.7 кг в группе терапии ситаглиптином в фиксированной дозе 100 мг (p<0.001).
Семаглутид (препарат Ребелсас®) по сравнению с плацебо в комбинации с инсулином
В 52-недельном двойном слепом исследовании (основной конечный показатель на 26 неделе) 731 пациент с СД2, недостаточно контролируемым на терапии инсулином (базальным, базальным/болюсным или двухфазным) с метформином или без него, был рандомизирован в группы терапии препаратом Ребелсас® в дозах 3 мг, 7 мг, 14 мг или плацебо 1 раз/сут.
На 26 неделе (первичная конечная точка – анализ данных 731 пациента) терапия препаратом Ребелсас® 3 мг, 7 мг и 14 мг привела к статистически значимому снижению показателя HbA1c на 0.6%, на 0.9% и на 1.3% по сравнению с 0.1% в группе плацебо (p<0.0001 для всех доз).
Показатель ГПН в группе терапии препаратом Ребелсас® в дозах 7 мг и 14 мг 1 раз/сут в течение 26 недель снизился на 1.1 ммоль/л и на 1.3 ммоль/л соответственно, по сравнению с увеличением на 0.3 ммоль/л в группе плацебо (p<0.0001 для обеих доз).
На терапии препаратом Ребелсас® 3 мг, 7 мг, 14 мг в течении 26 недель было получено статистически значимое снижение массы тела на 1.4 кг, на 2.4 кг и на 3.7 кг против снижения на 0.4 кг в группе плацебо (p<0.05, p<0.001, p<0.001 соответственно дозе).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе исследования, составила 28%, 43%, 58% и 7% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к окончанию исследования на 52 неделе, сохранялась примерно в том же соотношении 29%, 40%, 54% и 9% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо соответственно.
Оценка влияния на сердечно-сосудистую систему
3183 пациента с СД2 и высоким сердечно-сосудистым риском были рандомизированы в двойное слепое КИ в группы терапии препаратом Ребелсас® 14 мг 1 раз/сут или плацебо в дополнение к стандартному лечению. С учетом ранее проведенного исследования по влиянию на сердечно-сосудистую систему в отношении инъекционной формы семаглутида, протокол исследования был нацелен на подтверждение безопасности терапии препаратом Ребелсас® 14 мг, в связи с чем исследование было ограничено по времени: медиана периода наблюдения составляла 16 месяцев.
Первичная конечная точка представляла собой время от рандомизации до первого большого сердечно-сосудистого события (БССС), такого как смерть по причине СС патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Пациенты, подходящие для включения в исследование, были в возрасте 50 лет или старше и с установленным сердечно-сосудистым заболеванием (ССЗ) и/или хронической болезнью почек, или в возрасте 60 лет или старше только с факторами риска развития ССЗ. В общей сложности 1797 пациентов (56.5%) имели ССЗ без хронической болезни почек, 354 (11.1%) имели только хроническую болезнь почек и 544 (17.1%) имели как ССЗ, так и болезни почек. 488 пациентов (15.3%) имели только факторы риска развития ССЗ. Средний возраст на момент включения в исследование составил 66 лет, 68% пациентов были мужчинами. Средний стаж СД составлял 14.9 лет, средний ИМТ составлял 32.3 кг/м2. Инсульт или инфаркт миокарда был в анамнезе у 11.7% и 36.1% пациентов соответственно.
Общее количество первых БССС было 137: 61 (3.8%) при применении семаглутида и 76 (4.8%) при применении плацебо, тем самым у пациентов в группе терапии препаратом Ребелсас® продемонстрировано численное снижение на 21% частоты БССС в сравнении с пациентами в группе плацебо, отношение рисков 0.79 (0.57, 1.11), что достигало исходной цели исследования – продемонстрировать отсутствие повышения сердечно-сосудистого риска на терапии Ребелсас® (p<0.001).
Результаты анализа в отношении компонентов первичной конечной точки были следующими: смерть по причине СС патологии – 0.9% случаев при применении семаглутида и 1.9% случаев при применении плацебо (снижение частоты событий на 51%); инфаркт миокарда без смертельного исхода – 2.3% случаев при применении семаглутида и 1.9% случаев при применении плацебо (нет различий в пользу семаглутида); инсульт без смертельного исхода – 0.8% случаев при применении семаглутида и 1.0% случаев при применении плацебо (численное уменьшение частоты событий на 26%). Смерть по любым причинам возникла у 1.4% пациентов в группе семаглутида и у 2.8% пациентов в группе плацебо (снижение частоты событий на 49%).
Масса тела
На терапии семаглутидом к окончанию исследования у 27-45% пациентов было достигнуто снижение массы тела на ≥5%, а у 6-16% было достигнуто снижение массы тела на ≥10% при применении семаглутида, по сравнению с 12-39% и 2-8%, соответственно, при применении активных препаратов сравнения.
Артериальное давление
Терапия препаратом Ребелсас® привела к снижению систолического АД на 2-7 мм рт. ст.
Дети и подростки
Безопасность и эффективность применения препарата Ребелсас® у детей и подростков (младше 18 лет) не установлены.
КРАТКАЯ ХАРАКТЕРИСТИКА И АНАЛОГИ
Фармацевтическое средство для системного снижения действия гистамина
Оригинальное название: Robilas
Перевод названия: Робилас
Действующие вещества и состав: Биластин
Код ROBILAS по реестру АТХ: R06AX29
R -> Лекарственные средства от респираторных заболеваний
R06 -> Антигистаминные средства для системного использования
R06A -> Средства, подавляющие высвобождение гистамина для системного использования
R06AX -> Прочие системные блокаторы рецепторов гистамина
Аналоги
Кликните на действующее вещество, чтобы просмотреть другие лекарства с таким же активным компонентом:
Биластин
КУПИТЬ Робилас
Прежде чем купить Робилас, получите у врача назначение, рецепт и информацию о способе применения.
Проверьте в ближайших аптеках наличие и возможность приобретения аналогов и возможных заменителей для системного снижения действия гистамина, которые содержат действующие вещества Биластин.
Чтобы купить европейский ROBILAS в Украине, выберите из списка необходимый вид упаковки.
Зарезервированный заказ обрабатывается в рабочее время с 9-00 до 19-00.
Забронировать Робилас можно непосредственно на сайте, также возможно купить с доставкой в Украину через Viber, Telegram, WhatsApp, E-mail и по телефону +38(099)713-00-48
ЦЕНА, ДОСТАВКА, СРОКИ, ОПЛАТА
Цена Робилас указана за 1 упаковку медпрепарата, не включает доставку по Украине.
Транспортировка осуществляется по Украине логистическими компаниями.
Стоимость доставки в регионы Украины оплачивается заказчиком.
Для обеспечения низкой цены Робилас, уточните у менеджера РедТаблетки возможность заказа нескольких упаковок для прохождения курса лечения.
Сроки выполнения заказа ROBILAS могут варьироваться от нескольких дней до двух недель.
Точные даты поставки сможет уточнить оператор РедТаблетки.
Оплатить заказ Робилас можно по согласованию с оператором при получении препарата в Украине либо по предоплате.
Регионы доставки ROBILAS:
Днепр, Никополь, Каменец-Подольский, Черкассы, Полтава, Александрия, Кропивницкий, Хмельницкий, Львов, Николаев, Ивано-Франковск, Черновцы, Северодонецк, Одесса, Херсон, Павлоград, Бровары, Сумы, Белая Церковь, Ужгород, Чернигов, Лисичанск, Мелитополь, Киев, Житомир, Константиновка, Луцк, Кривой Рог, Бердянск, Запорожье, Славянск, Каменское, Краматорск, Тернополь, Ровно, Кременчуг, Харьков а также другие населенные пункты Украины.
ПРИМЕНЕНИЕ И ИНСТРУКЦИЯ
Лекарственное средство для системного снижения действия гистамина.
Самостоятельное назначение и использование Робилас является неприемлемым.
Необходимость применения лекарства определяет врач на основании поставленного диагноза.
Перед приемом фармацевтического препарата следует уточнить у врача особенности использования и ознакомиться с инструкцией.
Проверьте, нет ли у вас аллергии на вспомогательные вещества и активные компоненты: Биластин.
Каждая упаковка ROBILAS содержит вкладыш-инструкцию на оригинальном языке, в котором указаны: показания, противопоказания, побочные эффекты, способ применения, рекомендуемые дозы.
ХРАНЕНИЕ И СРОК ГОДНОСТИ
Хранить Робилас следует в затемненном, недоступном для детей месте.
Особое внимание следует обращать на температурный режим хранения, он указан в инструкции.
Не применяйте ROBILAS после завершения срока годности.
Ребелсас — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006910
Торговое наименование:
Ребелсас®
Международное непатентованное наименование:
семаглутид
Лекарственная форма:
таблетки
Состав
1 таблетка препарата содержит:
действующее вещество: семаглутид* 3 мг; 7 мг или 14 мг
вспомогательные вещества: натрия салкапрозат, повидон К90, целлюлозу микрокристаллическую, магния стеарат.
*аналог глюкагоноподобного пептида-1 человека (ГПП-1), произведенный методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae.
Описание
Таблетки, 3 мг:
Овальные двояковыпуклые таблетки от белого до светло-желтого цвета с гравировкой «3» на одной стороне и «novo» на другой.
Таблетки, 7 мг:
Овальные двояковыпуклые таблетки от белого до светло-желтого цвета с гравировкой «7» на одной стороне и «novo» на другой.
Таблетки, 14 мг:
Овальные двояковыпуклые таблетки от белого до светло-желтого цвета с гравировкой «14» на одной стороне и «novo» на другой.
Фармакотерапевтическая группа
Гипогликемическое средство – аналог глюкагоноподобного пептида-1 (ГПП-1).
Код ATX:
A10BJ06
Фармакологические свойства
Механизм действия
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист рецептора ГПП-1 (рГПП-1), который селективно связывается с рГПП-1 (мишенью нативного ГПП-1) и активирует его.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на сердечно-сосудистую систему (ССС). Влияние на концентрацию глюкозы и аппетит специфически опосредовано рГПП-1, расположенными в поджелудочной железе и головном мозге. Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляции секреции инсулина и подавления секреции глюкагона при высокой концентрации глюкозы крови. Механизм снижения концентрации глюкозы крови также связан с небольшой задержкой опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не препятствует секреции глюкагона. Механизм действия семаглутида не зависит от способа применения.
Семаглутид снижает массу тела и массу жировой ткани, уменьшая потребление энергии, в том числе в целом снижая аппетит. Кроме того, семаглутид снижает предпочтение к приему пищи с высоким содержанием жиров.
рГПП-1 представлены в специфических областях сердца, сосудов, иммунной системы и почек. В клинических исследованиях (КИ) семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое артериальное давление (АД) и уменьшал воспаление. В исследованиях на животных семаглутид замедлял развитие атеросклероза, предупреждая прогрессирование развития аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамика
Результаты фармакодинамики семаглутида для приема внутрь оценивались после 12 недель применения.
Гликемия натощак и постпрандиальная гликемия
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. У пациентов с сахарным диабетом 2 типа (СД2) терапия семаглутидом привела к снижению концентрации глюкозы натощак на 22% и постпрандиальной концентрации глюкозы на 29% по сравнению с плацебо.
Секреция глюкагона
Семаглутид снижает постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к снижению концентрации глюкагона по сравнению с плацебо, а именно, к снижению постпрандиального глюкагонового ответа на 29%.
Опорожнение желудка
Семаглутид вызывает небольшую задержку раннего постпрандиального опорожнения желудка (экспозиция парацетамола (AUC0-1ч) снижается на 31% в первый час после приема пищи), тем самым снижая скорость поступления постпрандиальной глюкозы в кровь.
Концентрация липидов натощак и после приема пищи
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и холестерина липопротеинов очень низкой плотности (ЛПОНП) натощак на 19% и 20%, соответственно. Постпрандиальное увеличение концентрации триглицеридов и холестерина ЛПОНП в ответ на прием пищи с высоким содержанием жиров снизилось на 24% и 21%, соответственно. Концентрация АпоВ48 снижалась как натощак, так и после приема пищи на 25% и 30%, соответственно.
Клиническая эффективность и безопасность
Эффективность и безопасность препарата Ребелсас® оценивались в восьми глобальных рандомизированных контролируемых клинических исследованиях (КИ) фазы IIIа. Из них семь КИ в качестве основной цели оценивали эффективность гликемического контроля, в то время как одно КИ оценивало в качестве основной цели сердечно-сосудистый (СС) исход.
В КИ были включены 8842 рандомизированных пациента с СД2 (5169 человек получали семаглутид), в том числе 1165 пациентов с умеренным нарушением функции почек. Средний возраст пациентов составил 61 год (от 18 до 92 лет), причем 40% пациентов были в возрасте 65 лет и старше, а 8% – 75 лет и старше. Эффективность семаглутида сравнивали с плацебо или активным контролем (ситаглиптин, эмпаглифлозин и лираглутид).
Возраст, пол, раса, этническая принадлежность, масса тела, индекс массы тела (ИМТ), длительность сахарного диабета (СД), заболевания верхних отделов желудочно-кишечного тракта и почечная недостаточность не повлияли на эффективность семаглутида.
Монотерапия
В 26-недельном двойном слепом исследовании 703 пациента с СД2, недостаточно контролируемым диетой и физическими нагрузками, были рандомизированы в группы терапии препаратом Ребелсас® в дозах 3 мг, 7 мг, 14 мг или плацебо один раз в сутки.
По результатам исследования (анализ данных 703 пациентов) монотерапия препаратом Ребелсас® в дозах 3 мг, 7 мг и 14 мг раз в сутки в течение 26 недель привела к статистически значимому снижению показателей HbA1c на 0,9%, 1,2% и 1,4% по сравнению с 0,3% в группе плацебо (р <0,001 для всех дозировок).
Показатель глюкозы плазмы натощак (ГПН) на фоне монотерапии препаратом Ребелсас® в дозах 3 мг, 7 мг и 14 мг раз в сутки в течение 26 недель снизился на 0,9 ммоль/л, 1,5 ммоль/л и на 1,8 ммоль/л, соответственно, по сравнению с 0,2 ммоль/л в группе плацебо (р=0,003, р<0,001, р<0,001 соответственно дозам).
На терапии препаратом Ребелсас® 14 мг было получено статистически значимое снижение массы тела на 3,7 кг против снижения на 1,4 кг в группе плацебо (р<0,001). Доля пациентов, достигших целевого значения HbA1c <7%, составила 55%, 69%, 77% и 31% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с эмпаглифлозином, оба в комбинации с метформином
В 52-недельном открытом КИ 822 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® 14 мг один раз в сутки или эмпаглифлозином 25 мг один раз в сутки, оба в комбинации с метформином.
На 26 неделе (первичная конечная точка – анализ данных 822 пациентов) терапия препаратом Ребелсас® 14 мг один раз в сутки по сравнению с эмпаглифлозином 25 мг один раз в сутки привела к статистически значимому снижению показателя HbA1c на 1,3% против снижения на 0,9%, соответственно (р <0,0001).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе, составила 67% и 40% для препарата Ребелсас® 14 мг и эмпаглифлозина 25 мг, соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 52 неделе, сохранялась примерно в том же соотношении 66% и 43% для препарата Ребелсас® 14 мг и эмпаглифлозина 25 мг, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с ситаглиптином, оба в комбинации с метформином, или метформином совместно с производными сульфонилмочевины
В 78-недельном двойном слепом исследовании с двойным маскированием 1864 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® в дозе 3 мг, 7 мг, 14 мг или ситаглиптином в дозе 100 мг один раз в сутки (оба в комбинации с метформином или метформином совместно с производными сульфонилмочевины).
На 26 неделе (первичная конечная точка – анализ данных 1397 пациентов) терапия препаратом Ребелсас® 7 мг и 14 мг один раз в сутки привела к статистически значимому снижению показателя HbA1c на 1,0% и на 1,3% по сравнению со снижением на 0,8% на терапии ситаглиптином 100 мг один раз в сутки (р<0,001 для обеих доз, соответственно).
Показатель ГПН на фоне терапии препаратом Ребелсас® в дозах 7 мг и 14 мг раз в сутки в течение 26 недель снизился на 1,2 ммоль/л и на 1,7 ммоль/л, соответственно, по сравнению с 0,9 ммоль/л в группе терапии ситаглиптином 100 мг один раз в сутки (р<0,05, р<0,001 соответственно дозам).
На терапии препаратом Ребелсас® 7 мг и 14 мг в течение 26 недель было получено статистически значимое снижение массы тела на 2,2 кг и на 3,1 кг против снижения на 0,6 кг в группе терапии ситаглиптином 100 мг один раз в сутки (р<0,001 для обеих доз).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе исследования, составила 44%, 56% и 32% для препарата Ребелсас® 7 мг, 14 мг и ситаглиптина 100 мг, соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 78 неделе, сохранялась примерно в том же соотношении 39%, 45% и 29% для препарата Ребелсас® 7 мг, 14 мг и ситаглиптина 100 мг, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с лираглутидом и плацебо, все в комбинации с метформином или метформином с ингибитором натрийзависимого переносчика глюкозы 2 типа (SGLT2)
В 52-недельном двойном слепом исследовании с двойным маскированием 711 пациентов с СД2 были рандомизированы в группы терапии препаратом Ребелсас® 14 мг, лираглутидом 1,8 мг в виде подкожной инъекции или плацебо один раз в сутки (все в комбинации с метформином или метформином с ингибитором SGLT2).
На 26 неделе (первичная конечная точка – анализ данных 711 пациентов) терапия препаратом Ребелсас® 14 мг один раз в сутки привела к статистически значимому снижению показателя НbА1c на 1,2% по сравнению со снижением на 1,1% в группе терапии лираглутидом 1,8 мг в виде подкожной инъекции один раз в сутки (р<0,0001 в отношении не меньшей эффективности) и по сравнению со снижением на 0,2% в группе плацебо (р<0,0001).
Показатель ГПН на фоне терапии препаратом Ребелсас® 14 мг раз в сутки в течение 26 недель снизился на 2,0 ммоль/л по сравнению с 0,4 ммоль/л в группе плацебо (р<0,0001).
На терапии препаратом Ребелсас® 14 мг в течении 26 недель было получено статистически значимое снижение массы тела на 4,4 кг против снижения на 3,1 кг в группе терапии лираглутидом 1,8 мг в виде подкожной инъекции один раз в сутки (р=0,0003) и по сравнению со снижением на 0,5 кг в группе плацебо (р<0,0001).
Доля пациентов, достигших HbA1c <7% на 26 неделе исследования, составила 68%, 62% и 14% для препарата Ребелсас® 14 мг, лираглутида 1,8 мг и плацебо, соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 52 неделе, составила 61%, 55% и 15% для препарата Ребелсас® 14 мг, лираглутида 1,8 мг и плацебо, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с плацебо, оба в комбинации с монотерапией базальным инсулином или метформином, или производными сульфонилмочевины, или с комбинацией метформина и базального инсулина или с комбинацией метформина и производных сульфонилмочевины у пациентов с умеренным нарушением функции почек
В 26-недельном двойном слепом исследовании 324 пациента с СД2 и умеренным нарушением функции почек (рСКФ 30-59 мл/мин/1,73 м²) были рандомизированы в группы терапии препаратом Ребелсас® 14 мг или плацебо один раз в сутки. Препарат исследования был добавлен к стабильному режиму гипогликемической терапии.
На 26 неделе (первичная конечная точка – анализ данных 324 пациентов) терапия препаратом Ребелсас® 14 мг один раз в сутки по сравнению с плацебо привела к статистически значимому снижению показателей HbA1c на 1,0% по сравнению с 0,2% в группе плацебо (р<0,0001). Показатель ГПН на фоне терапии препаратом Ребелсас® 14 мг раз в сутки в течение 26 недель снизился на 1,5 ммоль/л по сравнению с 0,4 ммоль/л в группе плацебо (р<0,05).
На терапии препаратом Ребелсас® 14 мг было получено статистически значимое снижение массы тела на 3,4 кг по сравнению со снижением на 0,9 кг в группе плацебо (р<0,0001).
Доля пациентов, достигших HbA1c <7%, составила 58% и 23% для препарата Ребелсас® 14 мг и плацебо, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с ситаглиптином, оба в комбинации с метформином, ингибиторами SGLT2, производными сульфонилмочевины или тиазолидиндионами. Исследование гибкой коррекции дозы
В 52-недельном открытом исследовании 504 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® (гибкая коррекция дозы 3 мг, 7 мг и 14 мг один раз в сутки) или ситаглиптином в дозе 100 мг один раз в сутки, оба в комбинации с 1-2 пероральными гипогликемическими лекарственными препаратами (метформин, ингибиторы SGLT2, производные сульфонилмочевины или тиазолидиндионы). Дозу препарата Ребелсас® корректировали каждые 8 недель в зависимости от гликемического ответа пациента и его переносимости. Доза ситаглиптина 100 мг была фиксированной.
На 52 неделе (первичная конечная точка – анализ данных 504 пациентов) количество пациентов, получающих терапию семаглутидом в дозах 3 мг, 7 мг и 14 мг, составило примерно 10%, 30% и 60%, соответственно. Доля пациентов, достигших целевого значения HbA1c < 7%, составила 58% и 25% для гибкой дозы препарата Ребелсас® один раз в сутки и ситаглиптина в фиксированной дозе 100 мг, соответственно (р<0,001). Шанс достижения целевого значения HbA1c < 7% для гибкой дозы препарата Ребелсас® один раз в сутки был в 4,4 больше в сравнении с шансом на терапии ситаглиптином в фиксированной дозе 100 мг (р<0,0001).
Терапия гибкой дозой препарата Ребелсас® один раз в день привела к статистически значимому снижению показателя массы тела на 2,6 кг в сравнении со снижением на 0,7 кг в группе терапии ситаглиптином в фиксированной дозе 100 мг (р<0,001).
Семаглутид (препарат Ребелсас®) по сравнению с плацебо в комбинации с инсулином
В 52-недельном двойном слепом исследовании (основной конечный показатель на 26 неделе) 731 пациент с СД2, недостаточно контролируемым на терапии инсулином (базальным, базальным/болюсным или двухфазным) с метформином или без него, был рандомизирован в группы терапии препаратом Ребелсас® в дозах 3 мг, 7 мг, 14 мг или плацебо один раз в сутки.
На 26 неделе (первичная конечная точка – анализ данных 731 пациента) терапия препаратом Ребелсас® 3 мг, 7 мг и 14 мг привела к статистически значимому снижению показателя HbA1c на 0,6%, на 0,9% и на 1,3% по сравнению с 0,1% в группе плацебо (р<0,0001 для всех доз).
Показатель ГПН в группе терапии препаратом Ребелсас® в дозах 7 мг и 14 мг раз в сутки в течение 26 недель снизился на 1,1 ммоль/л и на 1,3 ммоль/л, соответственно, по сравнению с увеличением на 0,3 ммоль/л в группе плацебо (р<0,0001 для обеих доз).
На терапии препаратом Ребелсас® 3 мг, 7 мг, 14 мг в течении 26 недель было получено статистически значимое снижение массы тела на 1,4 кг, на 2,4 кг и на 3,7 кг против снижения на 0,4 кг в группе плацебо (р<0,05, р<0,001, р<0,001 соответственно дозе).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе исследования, составила 28%, 43%, 58% и 7% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо, соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к окончанию исследования на 52 неделе, сохранялась примерно в том же соотношении 29%, 40%, 54% и 9% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо, соответственно.
Оценка влияния на сердечно-сосудистую систему
3183 пациента с СД2 и высоким сердечно-сосудистым (СС) риском были рандомизированы в двойное слепое КИ в группы терапии препаратом Ребелсас® 14 мг один раз в сутки или плацебо в дополнение к стандартному лечению. С учетом ранее проведенного исследования по влиянию на сердечно-сосудистую систему (ССС) в отношении инъекционной формы семаглутида, протокол исследования был нацелен на подтверждение безопасности терапии препаратом Ребелсас® 14 мг, в связи с чем исследование было ограничено по времени: медиана периода наблюдения составляла 16 месяцев.
Первичная конечная точка представляла собой время от рандомизации до первого большого сердечно-сосудистого события (БССС), такого как смерть по причине СС патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Пациенты, подходящие для включения в исследование, были в возрасте 50 лет или старше и с установленным сердечно-сосудистым заболеванием (ССЗ) и/или хронической болезнью почек, или в возрасте 60 лет или старше только с факторами риска развития ССЗ. В общей сложности 1797 пациентов (56,5%) имели ССЗ без хронической болезни почек, 354 (11,1%) имели только хроническую болезнь почек и 544 (17,1%) имели как ССЗ, так и болезни почек. 488 пациентов (15,3%) имели только факторы риска развития ССЗ. Средний возраст на момент включения в исследование составил 66 лет, 68% пациентов были мужчинами. Средний стаж СД составлял 14,9 лет, средний ИМТ составлял 32,3 кг/м². Инсульт или инфаркт миокарда был в анамнезе у 11,7% и 36,1% пациентов, соответственно.
Общее количество первых БССС было 137: 61 (3,8%) при применении семаглутида и 76 (4,8%) при применении плацебо, тем самым у пациентов в группе терапии препаратом Ребелсас® продемонстрировано численное снижение на 21% частоты БССС в сравнении с пациентами в группе плацебо, отношение рисков 0,79 (0,57, 1,11), что достигало исходной цели исследования – продемонстрировать отсутствие повышения сердечно-сосудистого риска на терапии Ребелсас® (р<0,001).
Результаты анализа в отношении компонентов первичной конечной точки были следующими: смерть по причине СС патологии – 0,9% случаев при применении семаглутида и 1,9% случаев при применении плацебо (снижение частоты событий на 51%); инфаркт миокарда без смертельного исхода – 2,3% случаев при применении семаглутида и 1,9% случаев при применении плацебо (нет различий в пользу семаглутида); инсульт без смертельного исхода – 0,8% случаев при применении семаглутида и 1,0% случаев при применении плацебо (численное уменьшение частоты событий на 26%). Смерть по любым причинам возникла у 1,4% пациентов в группе семаглутида и у 2,8% пациентов в группе плацебо (снижение частоты событий на 49%).
Масса тела
На терапии семаглутидом к окончанию исследования у 27-45% пациентов было достигнуто снижение массы тела на ≥5%, а у 6-16% было достигнуто снижение массы тела на ≥10% при применении семаглутида, по сравнению с 12-39% и 2-8%, соответственно, при применении активных препаратов сравнения.
Артериальное давление
Терапия препаратом Ребелсас® привела к снижению систолического АД на 2-7 мм рт. ст.
Дети и подростки
Безопасность и эффективность применения препарата Ребелсас® у детей и подростков (младше 18 лет) не установлены.
Фармакокинетика
Абсорбция
Семаглутид для перорального применения обладает низкой абсолютной биодоступностью и вариабельным всасыванием. Ежедневное применение препарата в соответствии с рекомендуемым режимом дозирования в комбинации с длительным периодом полувыведения уменьшает суточные колебания экспозиции.
Фармакокинетические свойства семаглутида были всесторонне изучены на здоровых добровольцах и пациентах с СД2. Максимальная концентрация семаглутида в плазме крови после приема внутрь достигалась через 1 час после применения препарата. Равновесная концентрация препарата была достигнута спустя 4-5 недель применения препарата один раз в сутки. У пациентов с СД2 средние равновесные концентрации составляли приблизительно 6,7 нмоль/л и 14,6 нмоль/л при применении семаглутида 7 мг и 14 мг, соответственно; при этом 90% пациентов, получавших терапию семаглутидом в дозе 7 мг, имели среднюю концентрацию между 1,7 и 22,7 нмоль/л, а 90% пациентов, получавших терапию семаглутидом в дозе 14 мг, имели среднюю концентрацию между 3,7 и 41,3 нмоль/л. Системная экспозиция семаглутида увеличивалась пропорционально введённой дозе.
Основываясь на данных, полученных в условиях in vitro, натрия салкапрозат облегчает всасывание семаглутида. Всасывание семаглутида преимущественно происходит в желудке. Расчетная биодоступность семаглутида после приема внутрь составляет приблизительно 1%. Межиндивидуальная вариабельность абсорбции была высокой (коэффициент вариации составлял примерно 100%). Оценка внутрииндивидуальной вариабельности биодоступности не была достоверной.
Абсорбция семаглутида снижается, если препарат принимается вместе с пищей или с большим количеством воды. Более длительный интервал между приемом препарата и приемом пищи приводит к увеличению всасывания.
Распределение
У пациентов с СД2 расчетный абсолютный объем распределения составляет приблизительно 8 л. Семаглутид в значительной степени связывается с белками плазмы крови (>99%).
Метаболизм
Семаглутид метаболизируется посредством протеолитического расщепления пептидной структуры с последующим бета-окислением жирной кислоты боковой цепи. В метаболизме семаглутида, по-видимому, участвует фермент нейтральная эндопептидаза (НЭП).
Выведение
Основными путями выведения производных семаглутида является выведение с мочой и калом. Приблизительно 3% от принятой дозы выводится с мочой в виде неизмененного семаглутида. С периодом полувыведения примерно 1 неделя семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 недель после того, как пациент примет последнюю дозу. У пациентов с СД2 клиренс семаглутида составляет примерно 0,04 л/ч.
Переход между пероральным применением и подкожным (п/к) введением.
Влияние перехода между пероральным применением и п/к введением семаглутида трудно прогнозировать из-за высокой фармакокинетической вариабельности перорального семаглутида. Экспозиция после перорального применения семаглутида 14 мг один раз в сутки сравнима с таковой при применении семаглутида в дозе 0,5 мг для п/к введения один раз в неделю. Пероральная доза, эквивалентная 1,0 мг семаглутида для п/к введения, не была установлена.
Особые группы пациентов
Пациенты пожилого возраста
На основании данных, полученных в ходе КИ, включавших пациентов в возрасте до 92 лет, возраст не оказывал влияния на фармакокинетику.
Пол
Пол не оказывал клинически значимого влияния на фармакокинетику семаглутида.
Расовая и этническая принадлежность
Расовая группа (европеоидная, негроидная или афроамериканская, монголоидная) и этническая принадлежность (испанцы или латиноамериканцы, не испанцы и не латиноамериканцы) не влияли на фармакокинетику семаглутида.
Масса тела
Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Семаглутид обеспечивал надлежащую системную экспозицию в диапазоне массы тела от 40 до 188 кг по данным КИ.
Почечная недостаточность
Почечная недостаточность не оказывала клинически значимого эффекта на фармакокинетику семаглутида. Фармакокинетические свойства семаглутида оценивали у пациентов с легкой, средней или тяжелой почечной недостаточностью и пациентов с терминальной стадией почечной недостаточности, находящихся на диализе, по сравнению с пациентами с нормальной функцией почек, получавших в течение 10 дней подряд семаглутид один раз в сутки. Это также было показано для пациентов с СД2 и нарушением функции почек на основании данных исследований фазы IIIа.
Печёночная недостаточность
Печёночная недостаточность не оказывала клинически значимого эффекта на фармакокинетику семаглутида. Фармакокинетические свойства семаглутида оценивали у пациентов с легкой, средней или тяжелой печёночной недостаточностью по сравнению с пациентами с нормальной функцией печени, получавших в течение 10 дней подряд семаглутид один раз в сутки.
Заболевание верхних отделов ЖКТ
Заболевания верхних отделов желудочно-кишечного тракта (хронический гастрит и/или гастроэзофагеальная рефлюксная болезнь) не оказывали клинически значимого эффекта на фармакокинетику семаглутида. Фармакокинетические свойства оценивали у пациентов с СД2 с заболеваниями верхних отделов желудочно-кишечного тракта или без них, получавших в течение 10 дней подряд семаглутид один раз в сутки. Это также было показано для пациентов с СД2 и заболеванием верхних отделов ЖКТ на основании данных исследований фазы IIIа.
Дети и подростки
Исследований семаглутида у детей и подростков до 18 лет не проводили.
Показания к применению
Препарат Ребелсас® показан для применения у взрослых пациентов с неудовлетворительным контролем СД2 в дополнение к диете и физической нагрузке для улучшения контроля гликемии:
- в качестве монотерапии, когда применение метформина невозможно по причине непереносимости или наличия противопоказаний;
- в комбинированном применении с другими гипогликемическими лекарственными препаратами.
Противопоказания
- Гиперчувствительность к семаглутиду или к любому из вспомогательных веществ препарата;
- сахарный диабет 1 типа (СД1);
- диабетический кетоацидоз;
- медуллярный рак щитовидной железы в анамнезе, в том числе семейном;
- множественная эндокринная неоплазия (МЭН) 2 типа;
Противопоказано применение препарата Ребелсас® у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности и/или из-за ограниченного опыта:
- беременность и период грудного вскармливания;
- возраст до 18 лет;
- печёночная недостаточность тяжёлой степени;
- терминальная стадия почечной недостаточности (клиренс креатинина (КК) < 15 мл/мин);
- хроническая сердечная недостаточность IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация))
С осторожностью
Препарат Ребелсас® рекомендуется применять с осторожностью у пациентов с панкреатитом в анамнезе (см. раздел «Способ применения и дозы»).
Применение при беременности и в период грудного вскармливания
Беременность
Исследования на животных продемонстрировали репродуктивную токсичность препарата. Данные по применению семаглутида у беременных женщин ограничены. В связи с этим применение семаглутида во время беременности противопоказано. Если пациентка готовится к беременности, либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Лечение семаглутидом следует прекратить, как минимум, за 2 месяца до планируемой беременности по причине длительного периода полувыведения (см. раздел «Фармакокинетика»).
Период грудного вскармливания
У лактирующих крыс семаглутид, натрия салкапрозат и/или его метаболиты проникали в молоко. Нельзя исключить риск для ребенка, находящегося на грудном вскармливании.
Противопоказано применять препарат Ребелсас® в период грудного вскармливания.
Способ применения и дозы
Способ применения
Препарат Ребелсас® представляет собой таблетки для приема внутрь один раз в сутки.
Препарат следует принимать натощак в любое время суток.
Таблетку необходимо проглатывать целиком, запивая водой (половина стакана воды, что эквивалентно 120 мл). Таблетки не следует делить, измельчать или разжевывать, так как неизвестно, влияет ли это на всасывание семаглутида.
Пациенты должны подождать не менее 30 минут перед приемом пищи или напитков, или приемом других пероральных лекарственных препаратов. Несоблюдение данного условия приведет к снижению всасывания семаглутида (см. разделы «Взаимодействие с другими лекарственными средствами» и «Фармакокинетические свойства»).
Дозы
Начальная доза препарата Ребелсас® составляет 3 мг один раз в сутки в течение одного месяца. Через 1 месяц применения дозу следует увеличить до 7 мг один раз в сутки. Для дальнейшего улучшения гликемического контроля после, как минимум, 1 месяца применения в дозе 7 мг один раз в сутки, дозу можно увеличить до поддерживающей дозы 14 мг один раз в сутки.
Максимальная рекомендуемая доза препарата Ребелсас® для приема один раз в сутки составляет 14 мг. Прием двух таблеток по 7 мг для достижения эффекта дозировки 14 мг не изучался и поэтому не рекомендуется.
Информация о переходе между семаглутидом для перорального применения и для подкожного (п/к) введения представлена в разделе «Фармакокинетические свойства».
При применении препарата Ребелсас® в комбинации с метформином и/или ингибитором SGLT2 или тиазолидиндионом терапию метформином и/или ингибитором SGLT2 или тиазолидиндионом можно продолжить в прежних дозах.
При применении семаглутида в комбинации с производным сульфонилмочевины или инсулином следует предусмотреть снижение дозы производного сульфонилмочевины или инсулина с целью снижения риска возникновения гипогликемии (см. разделы «Особые указания» и «Побочное действие»).
Для коррекции дозы препарата Ребелсас® не требуется самостоятельный мониторинг концентрации глюкозы в крови. Самостоятельный мониторинг концентрации глюкозы в крови необходим для коррекции дозы сульфонилмочевины и инсулина, особенно в начале лечения семаглутидом и при снижении дозы инсулина. Рекомендуется использовать поэтапный подход к снижению дозы инсулина.
Пропуск дозы
В случае пропуска дозы препарата, пропущенную дозу дополнительно принимать не нужно, следует продолжить прием препарата в обычном режиме на следующий день.
Применение в особых группах пациентов
Пациенты пожилого возраста
Не требуется коррекции дозы в зависимости от возраста. Опыт применения препарата Ребелсас® у пациентов в возрасте 75 лет и старше ограничен (см. раздел «Фармакокинетические свойства»).
Пациенты с почечной недостаточностью
Не требуется коррекция дозы у пациентов с легкой, средней или тяжелой почечной недостаточностью. Опыт применения препарата у пациентов с тяжелой стадией почечной недостаточности ограничен. Препарат противопоказан пациентам с терминальной стадией почечной недостаточности (см. раздел «Фармакокинетические свойства»).
Пациенты с печёночной недостаточностью
Не требуется коррекции дозы у пациентов с печёночной недостаточностью. Опыт применения семаглутида у пациентов с печёночной недостаточностью тяжёлой степени ограничен; применение препарата Ребелсас® у таких пациентов противопоказано (см. раздел «Фармакокинетика»).
Дети и подростки
Применение препарата Ребелсас® у детей и подростков в возрасте до 18 лет противопоказано в связи с отсутствием данных по безопасности и эффективности.
Побочное действие
Краткий отчет по профилю безопасности
В 10 КИ IIIа фазы 5707 пациентов получали семаглутид (препарат Ребелсас®) в качестве монотерапии или в комбинации с другими гипогликемическими препаратами. Продолжительность лечения варьировалась от 26 недель до 78 недель. Наиболее часто регистрируемыми нежелательными реакциями (HP) во время КИ являлись нарушения со стороны ЖКТ, включая тошноту (очень часто), диарею (очень часто) и рвоту (часто).
Список нежелательных реакций в виде таблицы
В Таблице 1 приведены HP, выявленные во всех исследованиях IIIа фазы у пациентов с СД2 (описаны в разделе «Фармакодинамические свойства»). Частота встречаемости данных HP основана на объединенных исследованиях фазы IIIа, за исключением исследования СС исходов.
HP распределены по системно-органным классам в соответствии с MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1 000 до <1/100); редко (от ≥1/10 000 до <1/1 000) и очень редко (<1/10 000). В каждой группе частота развития HP представлена по снижению степени тяжести.
Таблица 1 Нежелательные реакции из контролируемых исследований фазы IIIа
| Система органов MedDRA | Очень часто | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | Анафилактические реакции | |||
| Нарушения со стороны обмена веществ и питания | Гипогликемия при совместном применении с инсулином или производными сульфонилмочевиныa | Гипогликемия при совместном применении с другими ПГГПa Снижение аппетита |
||
| Нарушения со стороны органа зрения | Осложнения диабетической ретинопатииb | |||
| Нарушения со стороны сердца | Увеличение частоты сердечных сокращений (ЧСС) | |||
| Нарушения со стороны желудочно-кишечного тракта | Тошнота Диарея |
Рвота Боль в животе Вздутие живота Запор Диспепсия Гастрит Гастроэзофагеальная рефлюксная болезнь Метеоризм |
Отрыжка | Острый панкреатит |
| Нарушения со стороны печени и желчевыводящих путей | Холелитиаз | |||
| Общие расстройства и нарушения в месте введения | Утомляемость | |||
| Лабораторные и инструментальные данные | Повышение активности липазы Повышение активности амилазы |
Снижение массы тела |
а) Гипогликемия, определяемая как концентрация глюкозы крови <3,0 ммоль/л или <54 г/дл
b) Осложнения диабетической ретинопатии, включающие: необходимость в фотокоагуляции сетчатки глаза, необходимость в интравитреальном введении препаратов, кровоизлияние в стекловидное тело, развитие слепоты (нечасто), связанной с СД. Частота основана на исследовании СС исходов с применением семаглутида для п/к введения, но нельзя исключать, что риск выявленных осложнений диабетической ретинопатии также относится к препарату Ребелсас®.
Описание отдельных HP
Гипогликемия
Тяжелая гипогликемия, в основном, наблюдалась при применении семаглутида в комбинации с производными сульфонилмочевины (<0,1% пациентов, <0,001 явлений/пациенто-год) или с инсулином (1,1% пациентов, 0,013 явлений/пациенто-год). Всего несколько эпизодов (0,1% пациентов, 0,001 явлений/пациенто-год) наблюдались при применении семаглутида в комбинации с ПГГП, за исключением производных сульфонилмочевины.
HP со стороны ЖКТ
Во время терапии препаратом Ребелсас® у пациентов отмечалась тошнота (15%), диарея (10%) и рвота (7%). Большинство реакций были от лёгкой до средней степени тяжести и краткосрочными. HP стали причиной преждевременного выбывания из КИ у 4% пациентов. Чаще всего о HP сообщалось в первые месяцы терапии.
Острый панкреатит, подтвержденный по результатам экспертной оценки, был зарегистрирован в исследованиях IIIа фазы при применении семаглутида (<0,1%) и препарата сравнения (0,2%). В исследовании СС исходов частота развития острого панкреатита, подтвержденная по результатам экспертной оценки, составила 0,1% при применении семаглутида и 0,2% при применении плацебо (см. раздел «Особые указания».)
Осложнения диабетической ретинопатии
В 2-летнем КИ с применением семаглутида для п/к введения были изучены 3297 пациентов с СД2 и высоким СС риском, длительным стажем СД и неадекватным контролем гликемии. В данном КИ подтвержденные случаи диабетической ретинопатии развились у большего количества пациентов, получавших терапию семаглутидом для п/к введения (3,0%), по сравнению с пациентами, получавшими плацебо (1,8%). Развитие событий наблюдалось у пациентов с уже выявленной диабетической ретинопатией, получавших терапию инсулином. Различия между видами терапии появлялись рано и сохранялись на протяжении всего исследования. Систематическая оценка осложнения диабетической ретинопатии была проведена только в исследовании СС исходов с применением семаглутида для п/к введения. В КИ препарата Ребелсас® длительностью до 18 месяцев с участием 6352 пациентов с СД2 частота HP, связанных с диабетической ретинопатией, была сходной в группе препарата Ребелсас® и препаратов сравнения (4,2% и 3,8%, соответственно).
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к препарату Ребелсас®. В конце КИ доля пациентов, у которых были обнаружены антитела к препарату Ребелсас® в любой момент времени, была низкой (0,5%), и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГГ1П-1 эффектом.
Увеличение частоты сердечных сокращений.
На фоне применения агонистов рецепторов ГПП-1 отмечалось увеличение частоты сердечных сокращений (ЧСС). В исследованиях препарата Ребелсас® фазы IIIа наблюдались средние изменения ЧСС от 0 до 4 ударов в минуту (уд/мин) относительно исходного уровня, равного 69-76 уд/мин.
Передозировка
В ходе КИ передозировка препаратом Ребелсас® могла быть связана с нарушениями со стороны ЖКТ. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии в зависимости от клинических проявлений и симптомов у пациента. Учитывая длительный период полувыведения семаглутида (примерно 1 неделя), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки (см. раздел «Фармакокинетические свойства»). Специфического антидота при передозировке препарата Ребелсас® не существует.
Взаимодействие с другими лекарственными средствами
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов.
Влияние семаглутида на другие лекарственные препараты
Левотироксин натрия
Общая экспозиция (AUC) тироксина (с поправкой на эндогенные уровни) повышалась на 33% после применения однократной дозы левотироксина натрия. Максимальная экспозиция (Сmax) не изменялась. Необходимо рассмотреть возможность проведения мониторинга показателей функции щитовидной железы при применении совместной терапии препаратом Ребелсас® с левотироксином натрия.
Варфарин
Препарат Ребелсас® не изменял общую экспозицию AUC или Cmax R- и S-изомеров варфарина после однократной дозы варфарина, и фармакодинамическое действие варфарина согласно измерению с использованием международного нормализованного отношения (МНО) не подвергалось клинически значимому воздействию. Однако после начала терапии семаглутидом у пациентов, принимающих варфарин или другие производные кумарина, рекомендуется проводить частый мониторинг МНО.
Розувастатин
AUC розувастатина увеличивалась на 41% [90% ДИ: 24; 60] при одновременном применении препарата Ребелсас®. В связи с широким терапевтическим окном розувастатина величина изменений экспозиции признана клинически не значимой.
Дигоксин, пероральные контрацептивы, метформин, фуросемид
При одновременном применении с семаглутидом не наблюдалось клинически значимых изменений AUC или Сmax дигоксина, пероральных гормональных контрацептивных средств (содержащих этинилэстрадиол и левоноргестрел), метформина или фуросемида.
Взаимодействие с лекарственными препаратами с очень низкой биодоступностью (F: 1%) не оценивалось.
Влияние других лекарственных препаратов на семаглутид
Омепразол
При приеме с омепразолом не наблюдалось клинически значимого изменения AUC или Сmax семаглутида.
В исследовании фармакокинетики препарата Ребелсас®, применяемого вместе с пятью другими таблетками, AUC семаглутида снизилась на 34%, а Сmax – на 32%. Это говорит о том, что наличие нескольких таблеток в желудке влияет на всасывание семаглутида при одновременном применении. После приема препарата Ребелсас® пациентам следует подождать 30 минут, прежде чем принимать другие пероральные лекарственные препараты (см. раздел «Способ применения и дозы»).
Особые указания
Общие положения
Семаглутид противопоказан пациентам с СД1 или для лечения диабетического кетоацидоза. Диабетический кетоацидоз был зарегистрирован у инсулинозависимых пациентов, у которых отмечалось быстрое прекращение лечения или снижение дозы инсулина при начале лечения агонистом рГПП-1 (см. раздел «Способ применения и дозы»).
Опыт лечения пациентов с хронической сердечной недостаточностью IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация) отсутствует, поэтому семаглутид противопоказан у этих пациентов. Терапевтический опыт применения семаглутида у пациентов, перенесших бариатрическую операцию, отсутствует.
Реакции со стороны ЖКТ
Применение агонистов рГПГ1-1 может быть ассоциировано с HP со стороны ЖКТ, которые могут вызвать обезвоживание, что в редких случаях может привести к ухудшению функции почек (см. раздел «Побочное действие»). Пациентов, получающих терапию препаратом Ребелсас®, необходимо проинформировать о потенциальном риске обезвоживания вследствие нежелательных реакций со стороны желудочно-кишечного тракта и о необходимости принятия мер предосторожности во избежание потери жидкости.
Острый панкреатит
При применении агонистов рГПП-1 наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапию семаглутидом необходимо прекратить. При подтверждении острого панкреатита терапию семаглутидом возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
Гипогликемия
Пациенты на терапии семаглутидом в комбинации с производными сульфонилмочевины или инсулином могут иметь повышенный риск развития гипогликемии (см. раздел «Побочное действие»). В начале лечения семаглутидом риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина (см. раздел «Способ применения и дозы»).
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов, получающих терапию инсулином и семаглутид для п/к применения. Данный риск нельзя исключить при лечении пероральным семаглутидом (см. раздел «Побочное действие»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациям. Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением диабетической ретинопатии, однако при этом нельзя исключать другие причины. Длительный контроль гликемии снижает риск развития диабетической ретинопатии.
Ответ на терапию
Для достижения оптимального эффекта препарата Ребелсас® рекомендуется соблюдение режима дозирования. Если ответ на лечение семаглутидом менее выражен, чем ожидалось, лечащий врач должен быть проинформирован о том, что всасывание семаглутида очень вариабельно и может быть минимальным (у 2-4% пациентов вовсе не будет наблюдаться экспозиции), а также что абсолютная биодоступность семаглутида низка.
Женщины с репродуктивным потенциалом
Женщинам с репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В 2-летних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключён.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Влияние на способность управлять транспортными средствами, механизмами
Семаглутид не влияет или незначительно влияет на способность управлять транспортными средствами или работу с механизмами. При применении семаглутида в комбинации с производными сульфонилмочевины и/или инсулином пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами (см. раздел «Особые указания»).
Форма выпуска
Таблетки 3 мг:
10 таблеток в блистер из формованной алюминиевой фольги зеленого цвета, ламинированной полипропиленом, и покровной алюминиевой фольги, ламинированной полипропиленом.
3 блистера с инструкцией по применению в картонную пачку.
Таблетки 7 мг:
10 таблеток в блистер из формованной алюминиевой фольги красного цвета, ламинированной полипропиленом, и покровной алюминиевой фольги, ламинированной полипропиленом.
3 блистера с инструкцией по применению в картонную пачку.
Таблетки 14 мг:
10 таблеток в блистер из формованной алюминиевой фольги синего цвета, ламинированной полипропиленом, и покровной алюминиевой фольги, ламинированной полипропиленом.
3 блистера с инструкцией по применению в картонную пачку.
Срок годности
30 месяцев. Не применять по истечении срока годности.
Условия хранения
Хранить при температуре не выше 25°С в оригинальной упаковке (блистер) для защиты от влаги и света.
Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту
Держатель регистрационного удостоверения
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Производитель:
Ново Нордиск А/С, Дания;
Юридический адрес: Ново Алле, DK-2880 Багсваерд, Дания
Адрес места производства: Ново Нордиск Парк, DK-2760 Малов, Дания
Организация, принимающая претензии от потребителей:
ООО «Ново Нордиск»
121614, г. Москва, Крылатская улица, д. 15, офис 41
Купить Ребелсас в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.Для взрослыхПри диабете
Содержание статьи
- Ребелсас: МНН
- Ребелсас: РЛС
- Ребелсас: противопоказания
- Ребелсас: побочные действия
- Ребелсас или Оземпик: что лучше?
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Сахарный диабет — это хроническое заболевание, когда клетки поджелудочной железы вырабатывают мало инсулина (СД 1 типа) или ткани организма не могут его «адекватно» использовать (СД 2 типа). Инсулин — это гормон, который утилизирует глюкозу. При сахарном диабете (что видно из названия болезни) уровень глюкозы в крови повышается, при высоких цифрах она становится как «сироп».
Сахарный диабет 2 типа чаще всего развивается из-за нарушений углеводного обмена. Если говорить обычными словами, то из-за лишнего веса, ожирения и нездорового образа жизни. При СД 2 типа мышцы, печень и другие инсулинозависимые ткани теряют чувствительность к инсулину и глюкоза остается в крови и моче.
В 2021 году на фармацевтическом рынке появился новый препарат для лечения СД 2 типа Ребелсас. Рассказываем о нем подробнее и сравниваем с Оземпиком.
Ребелсас: МНН
Международное непатентованное наименование лекарства Ребелсас — семаглутид. Это вещество нового класса, которое на 94% схоже по структуре с человеческим глюкагоноподобным пептидом-1 (ГПП-1), поэтому оказывает сразу несколько эффектов на регулирование уровня глюкозы, аппетит и работу сердца и сосудов.
Семаглутид получают методом биотехнологии рекомбинантной ДНК с использованием штамма бактерий Saccharomyces cerevisiae.
Ребелсас: РЛС
Компания Ново Нордиск (Дания) выпускает лекарственное средство только в виде таблеток разных дозировок (Ребелсас инъекции не производят):
- Ребелсас 3 мг;
- Ребелсас 7 мг;
- Ребелсас 14 мг.
Ребелсас — гипогликемический препарат, который контролирует уровень глюкозы в крови. Кроме этого, он еще:
- снижает вес;
- уменьшает массу жировой ткани;
- снижает аппетит;
- уменьшает тягу к жирной пище.
Благодаря таким свойствам лекарства некоторые стали принимать Ребелсас для похудения. Делать этого здоровым людям (без диабета) нельзя. Ребелсас не предназначен для снижения веса. Это препарат, который врач назначает строго по показаниям, а в аптеках его отпускают по рецепту. Так все-таки в каких случаях показан Ребелсас, для чего его принимают?
Ребелсас таблетки применяют у взрослых пациентов с СД 2 типа для улучшения контроля сахара в крови при условии соблюдения диеты и физических нагрузок. Препарат назначают как монотерапию у пациентов, которым противопоказан метформин или есть его непереносимость. В более тяжелых случаях Ребелсас назначают в комбинации с другими гипогликемическими средствами.
Ребелсас: противопоказания
- сахарный диабет 1 типа;
- диабетический кетоацидоз (приводит к изменению рН крови);
- рак щитовидной железы в анамнезе, включая семейный анамнез;
- множественная эндокринная неоплазия (МЭН) 2 типа;
- беременность и лактация;
- детский возраст до 18 лет;
- тяжелая печеночная и почечная недостаточность;
- хроническая сердечная недостаточность тяжелой степени.
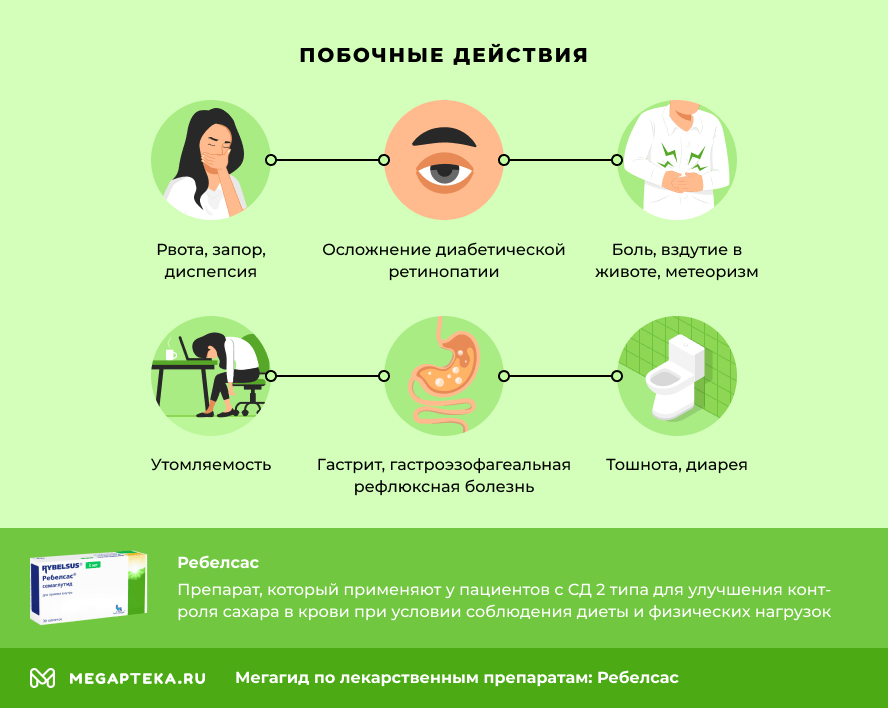
Ребелсас: побочные действия
Негативные реакции при приеме препарата, которые регистрировались более, чем в 10% случаев:
- гипогликемия при совместном применении с инсулином или производными сульфонилмочевины;
- тошнота, диарея.
В 0,1-1% случаев возникали:
- гипогликемия при совместном применении с другими гипогликемическими средствами, снижение аппетита;
- осложнение диабетической ретинопатии;
- рвота, запор, диспепсия;
- боль, вздутие в животе, метеоризм;
- гастрит, гастроэзофагеальная рефлюксная болезнь;
- утомляемость.
Ребелсас или Оземпик: что лучше?
Ребелсас и Оземпик — разные лекарственные формы одного действующего вещества. Ребелсас — это таблетки, а Оземпик — подкожные инъекции семаглутида. Оба препарата производит одна та же датская компания Ново Нордиск.
Оземпик выпускается в готовых для применения шприц-ручках и имеет три дозировки: 0,25, 0,5 и 1,0 мг/мл. Показания препарата аналогичны таблеткам Ребелсас, но кроме контроля уровня глюкозы Оземпик назначают пациентам с СД 2 типа и сердечно-сосудистыми заболеваниями для снижения риска инфаркта миокарда, инсульта и летального исхода из-за ССЗ. Эффективность (биодоступность) выше у Оземпика.
Ребелсас или Оземпик? Препараты содержат одно и то же действующее вещество, но в разных лекарственных формах. Отпускаются по рецепту врача. Если пациенту назначили семаглутид, то лучше посоветоваться с врачом и учесть свои предпочтения — делать уколы или пить таблетки.
Краткое содержание
- Международное непатентованное наименование лекарства Ребелсас — семаглутид.
- Ребелсас таблетки применяют у взрослых пациентов с СД 2 типа для улучшения контроля сахара в крови при условии соблюдения диеты и физических нагрузок. Препарат назначают как монотерапию у пациентов, которым противопоказан метформин или есть его непереносимость. В более тяжелых случаях Ребелсас назначают в комбинации с другими гипогликемическими средствами.
- Ребелсас противопоказан в следующих случаях: сахарный диабет 1 типа; диабетический кетоацидоз ;рак щитовидной железы; множественная эндокринная неоплазия; беременность и лактация; детский возраст до 18 лет; тяжелая печеночная и почечная недостаточность; хроническая сердечная недостаточность тяжелой степени.
- Наиболее частые негативные реакции при лечении препаратом Ребелсас: гипогликемия при совместном применении с инсулином или производными сульфонилмочевины, тошнота, диарея.
- Ребелсас или оземпик? Препараты содержат одно и то же действующее вещество, но в разных лекарственных формах. Отпускаются по рецепту врача. Если пациенту назначили семаглутид, то лучше посоветоваться с врачом и учесть свои предпочтения — делать уколы или пить таблетки.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Показания Противопоказания Меры предосторожности Взаимодействие Предупреждения Дозировка и способ применения Передозировка Нежелательные эффекты Срок годности
Активные ингредиенты: биластин.
ROBILAS 20 мг ТАБЛЕТКИ
Почему используется Робилас? Для чего это?
Таблетки ROBILAS содержат активный ингредиент биластин, который является антигистаминным средством. Таблетки ROBILAS 20 мг используются для облегчения симптомов сенной лихорадки (чихание, зуд, насморк, заложенный нос, красные и слезящиеся глаза) и других форм аллергического ринита. Его также можно использовать для лечения кожной зудящей сыпи (например, крапивницы).
Противопоказания Когда не следует применять Робилас
Не принимайте таблетки ROBILAS 20 мг, если:
у вас аллергия (гиперчувствительность) на биластин или любой другой ингредиент таблеток ROBILAS 20 мг
Меры предосторожности при применении Что следует знать перед приемом Робиласа
Будьте особенно осторожны с таблетками ROBILAS 20 мг.
Если у вас умеренное или тяжелое поражение почек и вы принимаете другие лекарства (см. Ниже)
Он не предназначен для детей младше 12 лет.
Не превышайте рекомендованную дозу. Если симптомы не исчезнут, обратитесь к врачу.
Взаимодействия Какие лекарства или продукты могут изменить действие Робиласа
Сообщите своему врачу или фармацевту, если вы принимаете или недавно принимали какие-либо другие лекарства, включая лекарства, отпускаемые без рецепта. В частности, проконсультируйтесь с врачом, если вы принимаете какие-либо из следующих лекарств:
- Кетоконазол (противогрибковый препарат)
- Эритромицин (антибиотик)
- Дилтиазем (для лечения ангины)
- Циклоспорин (для снижения активности иммунной системы во избежание отторжения трансплантата или для снижения активности аутоиммунных и аллергических заболеваний, таких как псориаз, атопический дерматит или ревматоидный артрит)
- Ритонавир (для лечения СПИДа)
- Рифампицин (антибиотик)
Таблетки ROBILAS 20 мг во время еды и питья.
Таблетки не следует принимать во время еды, с грейпфрутовым соком или другими фруктовыми соками, так как это снижает действие биластина. Чтобы этого не произошло, вы можете:
- примите таблетку и подождите один час, прежде чем употреблять любую пищу или фруктовый сок.
- если вы употребляли пищу или фруктовый сок, подождите два часа, прежде чем принимать таблетку
Предупреждения Важно знать, что:
Беременность и кормление грудью
Проконсультируйтесь с врачом, если вы беременны, если вы беременны или кормите грудью. Прежде чем принимать какое-либо лекарство, посоветуйтесь со своим врачом или фармацевтом.
Вождение и использование машин
Исследование, проведенное с целью установить влияние биластина на способность управлять автомобилем, показало, что лечение дозами 20 мг биластина не влияет на способность управлять автомобилем. Однако очень редко некоторые люди испытывают сонливость, которая может повлиять на способность управлять автомобилем и работать с механизмами.
Потребление алкоголя
Биластин в рекомендованной дозе (20 мг) не усиливает сонливость, вызванную алкоголем.
Доза, способ и время приема Как применять Робилас: Дозировка
Взрослые, в том числе пожилые люди и подростки от 12 лет и старше
- Принимайте по одной таблетке в день.
- Таблетку следует принимать натощак, например утром перед завтраком. Не принимать пищу в течение 1 часа после приема биластина.
- Проглотите таблетку, запивая стаканом воды.
- Линия счета не используется для разделения таблетки на равные дозы. Его можно использовать, чтобы сломать планшет и облегчить его извлечение.
Что касается продолжительности лечения, ваш врач определит тип заболевания, которым вы страдаете, и решит, как долго вам следует принимать таблетки ROBILAS 20 мг.
Передозировка Что делать, если вы приняли слишком много Робиласа
Если вы приняли больше таблеток ROBILAS 20 мг, чем предусмотрено
Если вы или кто-либо другой приняли слишком много таблеток ROBILAS 20 мг, немедленно обратитесь к врачу или фармацевту.
Если вы забыли принять таблетки ROBILAS 20 мг
Не принимайте двойную дозу, чтобы восполнить пропущенную дозу.
Если вы забыли принять дозу, примите ее как можно скорее, а затем вернитесь к своему обычному графику приема.
Если у вас есть дополнительные вопросы по использованию таблеток ROBILAS 20 мг, обратитесь к врачу или фармацевту.
Побочные эффекты Каковы побочные эффекты Робиласа
Как и все лекарства, таблетки ROBILAS 20 мг могут вызывать побочные эффекты, но не у всех.
Возможные побочные эффекты:
Часто: затрагивает от 1 до 10 пользователей из 100.
Головная боль
сонливость
Нечасто: поражает от 1 до 10 пользователей из 1000.
- аномальный электрокардиографический след (ЭКГ)
- анализы крови, указывающие на изменения в работе печени
- головокружение
- боли в животе
- усталость
- повышенный аппетит
- аритмия
- увеличение веса
- тошнота (тошнота)
- беспокойство
- ощущение сухости или дискомфорта в носу
- живот
- понос
- гастрит (воспаление стенки желудка)
- головокружение (чувство головокружения)
- чувство слабости
- жажда
- одышка (затрудненное дыхание)
- сухость во рту
- несварение желудка
- зуд
- оральный герпес
- высокая температура
- тиннитус (звон в ушах)
- трудности с засыпанием
- анализы крови, которые указывают на изменения функции почек
- повышенный жир в крови
Если какой-либо из побочных эффектов станет серьезным или вы заметите какие-либо побочные эффекты, не указанные в данном информационном листке, сообщите об этом своему врачу или фармацевту.
Срок действия и удержание
Хранить в недоступном для детей месте
Не используйте таблетки ROBILAS 20 мг после истечения срока годности, указанного на упаковке и блистере. Срок годности относится к последнему дню этого месяца.
Это лекарство не требует особых условий хранения.
Лекарства нельзя выбрасывать в канализацию или бытовые отходы. Узнайте у фармацевта, как утилизировать лекарства, которые вы больше не используете. Это поможет защитить окружающую среду.
Что содержат таблетки ROBILAS 20 мг:
- Действующее вещество — биластин. Каждая таблетка содержит 20 мг биластина.
- Другие ингредиенты: микрокристаллическая целлюлоза, натрийгликолят крахмала типа А (полученный из картофеля), безводный коллоидный диоксид кремния, стеарат магния.
Как выглядят таблетки РОБИЛАС 20 мг и что содержится в упаковке:
Таблетки ROBILAS по 20 мг бывают белого цвета, овальной формы, двояковыпуклые и рифленые.
Таблетки поставляются в блистерах по 10, 20, 30, 40 или 50 таблеток.
Не все размеры упаковки могут быть проданы.
Листовка с исходным кодом: AIFA (Итальянское агентство по лекарственным средствам). Контент опубликован в январе 2016 года. Представленная информация может быть устаревшей.
Чтобы иметь доступ к самой последней версии, рекомендуется зайти на сайт AIFA (Итальянское агентство по лекарственным средствам). Заявление об ограничении ответственности и полезная информация.
Дополнительную информацию о Робиласе можно найти во вкладке «Обзор характеристик».
01.0 НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА 02.0 КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ 03.0 ФАРМАЦЕВТИЧЕСКАЯ ФОРМА 04.0 КЛИНИЧЕСКИЕ ХАРАКТЕРИСТИКИ 04.1 Терапевтические показания 04.2 Дозировка и способ применения 04.3 Противопоказания 04.4 Особые предупреждения и соответствующие меры предосторожности при использовании 04.5 Взаимодействие с другими лекарственными средствами и другие формы взаимодействия при беременности 04.6 и кормление грудью 04.7 Влияние на способность управлять автомобилем и работать с механизмами 04.8 Нежелательные эффекты 04.9 Передозировка 05.0 ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА 05.1 Фармакодинамические свойства 05.2 Фармакокинетические свойства 05.3 Доклинические данные по безопасности 06.0 ИНФОРМАЦИЯ ФАРМАЦЕВТИЧЕСКИЕ СРЕДСТВА 06.1 Вспомогательные вещества 06.2 Несовместимость при хранении 06.3 Меры предосторожности при хранении для хранения 06.5 Характер непосредственной упаковки и содержимого упаковки 06.6 Инструкции по использованию и обращению 07.0 ДЕРЖАТЕЛЬ РАЗРЕШЕНИЯ НА МАРКЕТИНГ 08 .0 НОМЕР РАЗРЕШЕНИЯ НА МАРКЕТИНГ 09.0 ДАТА ПЕРВОГО РАЗРЕШЕНИЕ ИЛИ ПРОДЛЕНИЕ РАЗРЕШЕНИЯ 10.0 ДАТА ПЕРЕСМОТРА ТЕКСТА 11.0 ДЛЯ РАДИОФАРМАЦЕВТОВ, ПОЛНЫЕ ДАННЫЕ ПО ВНУТРЕННЕЙ РАДИАЦИОННОЙ ДОЗИМЕТРИИ 12.0 ДЛЯ РАДИОПРЕПАРАТОВ, ДОПОЛНИТЕЛЬНЫЕ ДЕТАЛЬНЫЕ ИНСТРУКЦИИ ПО КОНТРОЛЮ И ПРЕПАРАТУ ESTEMPORANEA
01.0 НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
ROBILAS 20 MG ТАБЛЕТКИ
02.0 КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
Каждая таблетка содержит 20 мг биластина.
Полный список вспомогательных веществ см. В разделе 6.1.
03.0 ФАРМАЦЕВТИЧЕСКАЯ ФОРМА
Таблетка.
Белые, овальные, двояковыпуклые таблетки с надрезом.
Линия надреза на планшете предназначена только для облегчения разрушения и облегчения проглатывания планшета. E Нет разделить на равные дозы.
04.0 КЛИНИЧЕСКАЯ ИНФОРМАЦИЯ
04.1 Терапевтические показания
Симптоматическое лечение аллергического риноконъюнктивита (сезонного и многолетнего) и крапивницы.
04.2 Дозировка и способ применения
Путь введения: оральное использование.
Взрослые и подростки (12 лет и старше)
20 мг (1 таблетка) один раз в день для облегчения симптомов аллергического риноконъюнктивита (SAR и PAR) и крапивницы.
Таблетку следует принимать внутрь за час до или через два часа после еды или фруктового сока. Рекомендуется принимать суточную дозу за один прием.
Пожилые граждане
У пожилых пациентов корректировка дозировки не требуется (см. Разделы 5.1 и 5.2). Опыт работы с пациентами старше 65 лет оставляет желать лучшего.
Дети до 12 лет
Безопасность и эффективность биластина у детей в возрасте до 12 лет еще не установлены.
Почечная недостаточность
У пациентов с почечной недостаточностью корректировки дозировки не требуется. (см. раздел 5.2).
Печеночная недостаточность
Нет клинического опыта у пациентов с нарушением функции печени. Поскольку биластин не метаболизируется и почечный клиренс является основным путем его выведения, не ожидается, что печеночная недостаточность приведет к увеличению системного воздействия, превышающему пределы безопасности. Следовательно, нет необходимости в корректировке дозировки для пациентов с нарушением функции печени (см. Раздел 5.2).
Продолжительность лечения
При аллергическом рините лечение следует ограничить периодом воздействия аллергенов. При сезонном аллергическом рините лечение можно прекратить после исчезновения симптомов и возобновить при их появлении. При хроническом аллергическом рините пациентам может быть предложено продолжение лечения в период воздействия аллергенов. При крапивнице продолжительность лечения зависит от типа, продолжительности и течения жалоб.
04.3 Противопоказания
Повышенная чувствительность к действующему веществу биластину или к любому из вспомогательных веществ.
04.4 Особые предупреждения и соответствующие меры предосторожности при использовании
Безопасность и эффективность биластина у детей младше 12 лет не установлены.
У пациентов с нарушением функции почек от умеренной до тяжелой степени совместное применение биластина с ингибиторами Р-гликопротеина, такими как кетоконазол, эритромицин, циклоспорин, ритонавир или дилтиазем, может повышать уровень биластина в плазме и, следовательно, увеличивать риск побочных эффектов. Таким образом, следует избегать одновременного назначения биластина и ингибиторов Р-гликопротеина пациентам с почечной недостаточностью от умеренной до тяжелой.
04.5 Взаимодействие с другими лекарственными средствами и другие формы взаимодействия
Взаимодействие с едой
Пища значительно снижает биодоступность биластина при приеме внутрь на 30%.
Взаимодействие с грейпфрутовым соком
Одновременный прием 20 мг биластина с грейпфрутовым соком снижает биодоступность биластина на 30%. Этот эффект может также наблюдаться с другими фруктовыми соками. Степень снижения биодоступности может варьироваться в зависимости от разных производителей и фруктов. Механизм этого взаимодействия: ингибирование «OATP1A2, переносчика захвата, для которого биластин является субстратом (см. раздел 5.2). Лекарственные препараты, которые являются субстратами или ингибиторами OATP1A2, такие как ритонавир или рифампицин, могут аналогичным образом снижать концентрацию биластина в плазме.
Взаимодействие с кетоконазолом или эритромицином
Одновременный прием биластина и кетоконазола или эритромицина увеличивал AUC биластина в 2 раза и Cmax в 2 раза. Эти изменения могут быть объяснены взаимодействием с переносчиками кишечного оттока, поскольку биластин является субстратом для P-gp и не метаболизируется (см. Раздел 5.2). Эти изменения, по-видимому, не влияют на профиль безопасности биластина и кетоконазола или эритромицина. соответственно. Другие лекарственные средства, являющиеся субстратами или ингибиторами P-gp, такие как циклоспорин, могут аналогичным образом повышать концентрацию биластина в плазме.
Взаимодействие с дилтиаземом
Одновременный прием биластина 20 мг и дилтиазема 60 мг увеличивал Cmax биластина на 50%. Этот эффект можно объяснить взаимодействием с переносчиками кишечного оттока (см. Раздел 5.2) и, по-видимому, не влияет на профиль безопасности биластина.
Взаимодействие с алкоголем
Психомоторные показатели после одновременного приема алкоголя и 20 мг биластина были аналогичны таковым после приема алкоголя и плацебо.
Взаимодействие с лоразепамом
Одновременный прием биластина 20 мг и лоразепама 3 мг в течение 8 дней не усиливал седативное действие лоразепама на ЦНС.
04.6 Беременность и кормление грудью
Плодородие
Клинических данных нет или их количество ограничено. Исследование, проведенное на крысах, не выявило каких-либо неблагоприятных воздействий на фертильность (см. Раздел 5.3).
Беременность
Данных о применении биластина беременными женщинами не существует или их количество ограничено.
Исследования на животных не указывают на наличие прямых или косвенных побочных эффектов в отношении репродуктивной токсичности, родов или послеродового развития (см. Раздел 5.3). В качестве меры предосторожности предпочтительно избегать использования Робиласа во время беременности.
Время кормления
Неизвестно, выделяется ли биластин с грудным молоком. Экскреция биластина с молоком на животных не изучалась. Необходимо принять решение о продолжении / прекращении грудного вскармливания или о продолжении / прекращении терапии Робиласом, принимая во внимание пользу грудного вскармливания для ребенка и пользу терапии биластином. для матери.
04.7 Влияние на способность управлять автомобилем и работать с механизмами
Исследование, проведенное для оценки влияния биластина на способность управлять автомобилем, показало, что лечение 20 мг не повлияло на способность управлять автомобилем. Однако следует предупредить пациентов, что сонливость у некоторых людей возникает очень редко, что может повлиять на способность управлять автомобилем или работать с механизмами.
04.8 Побочные эффекты
Количество побочных эффектов, возникающих у пациентов с аллергическим риноконъюнктивитом или хронической идиопатической крапивницей, получавших 20 мг биластина в клинических испытаниях, было сопоставимо с таковым у пациентов, получавших плацебо (12,7% против 12,8%).
Наиболее частыми нежелательными явлениями, о которых сообщали пациенты, получавшие биластин 20 мг во время клинических испытаний II и III фаз, были головная боль, сонливость, головокружение и утомляемость. Эти нежелательные явления возникали с сопоставимой частотой у пациентов, получавших плацебо.
Нежелательные явления, по крайней мере, возможно, связанные с биластином и зарегистрированные у более чем 0,1% пациентов, получавших биластин 20 мг во время клинической разработки, представлены в таблице ниже.
Частоты назначаются следующим образом:
• очень часто (≥1 / 10)
• общие (от ≥1 / 100 до
• нечасто (≥1 / 1,000 до
• редко (от ≥1 / 10 000 до
• очень редко (
• неизвестно (частота не может быть оценена по имеющимся данным)
Редкие, очень редкие и с неизвестной частотой не были включены в таблицу.
Классификация систем и органов Частота Побочная реакция Биластин 20 мг N = 1697 Биластин Все дозы N = 2525 Плацебо N = 1362 Инфекции и инвазии Необычный Оральный герпес 2 (0,12%) 2 (0,08%) 0 (0,0%) Нарушения обмена веществ и питания Необычный Повышенный аппетит 10 (0,59%) 11 (0,44%) 7 (0,51%) Психиатрические расстройства Необычный Беспокойство 6 (0,35%) 8 (0,32%) 0 (0,0%) Бессонница 2 (0,12%) 4 (0,16%) 0 (0,0%) Нарушения уха и лабиринта Необычный Тиннитус 2 (0,12%) 2 (0,08%) 0 (0,0%) Головокружение 3 (0,18%) 3 (0,12%) 0 (0,0%) Сердечные патологии Необычный Блок правой ветви 4 (0,24%) 5 (0,20%) 3 (0,22%) Синусовая аритмия 5 (0,30%) 5 (0,20%) 1 (0,07%) Удлинение интервала QT на ЭКГ 9 (0,53%) 10 (0,40%) 5 (0,37%) Другие аномалии ЭКГ 7 (0,41%) 11 (0,44%) 2 (0,15%) Расстройства нервной системы общий Сонливость 52 (3,06%) 82 (3,25%) 39 (2,86%) Головная боль 68(4,01%) 90 (3,56%) 46 (3,38%) Необычный Головокружение 14 (0,83%) 23 (0,91%) 8 (0,59%) Респираторные, торакальные и средостенные расстройства. Необычный Одышка 2 (0,12%) 2 (0,08%) 0 (0,0%) Дискомфорт в носу 2 (0,12%) 2 (0,08%) 0 (0,0%) Сухость в носу 3 (0,18%) 6 (0,24%) 4 (0,29%) Желудочно-кишечные расстройства Необычный Боль в верхней части живота 11 (0,65%) 14 (0,55%) 6 (0,44%) Боль в животе 5 (0,30%) 5 (0,20%) 4 (0,29%) Тошнота 7 (0,41%) 10 (0,40%) 14 (1,03%) Дискомфорт в желудке 3 (0,18%) 4 (0,16%) 0 (0,0%) Понос 4 (0,24%) 6 (0,24%) 3 (0,22%) Сухость во рту 2 (0,12%) 6 (0,24%) 5 (0,37%) Диспепсия 2 (0,12%) 4 (0,16%) 4 (0,29%) Гастрит 4 (0,24%) 4 (0,16%) 0 (0,0%) Заболевания кожи и подкожной клетчатки Необычный Зуд 2 (0,12%) 4 (0,16%) 2 (0,15%) Общие расстройства и состояния в месте введения Необычный Усталость 14 (0,83%) 19 (0,75%) 18 (1,32%) Жажда 3 (0,18%) 4 (0,16%) 1 (0,07%) Улучшение ранее существовавшего состояния 2 (0,12%) 2 (0,08%) 1 (0,07%) Пирексия 2 (0,12%) 3 (0,12%) 1 (0,07%) Астения 3 (0,18%) 4 (0,16%) 5 (0,37%) Дисгностические тесты Необычный Повышенная гамма-глутамилтрансфераза 7 (0,41%) 8 (0,32%) 2 (0,15%) Повышение уровня аланин-аминотрансферазы 5 (0,30%) 5 (0,20%) 3 (0,22%) Повышенная аспартатаминотрансфераза 3 (0,18%) 3 (0,12%) 3 (0,22%) Повышенный креатинин в крови 2 (0,12%) 2 (0,08%) 0 (0,0%) Повышение уровня триглицеридов в крови 2 (0,12%) 2 (0,08%) 3 (0,22%) Увеличение веса 8 (0,47%) 12 (0,48%) 2 (0,15%)
04.9 Передозировка
Информация об острой передозировке ограничена опытом, полученным в ходе клинических испытаний, проведенных во время разработки биластина. После введения биластина в дозах, превышающих терапевтическую дозу в 10 или 11 раз (220 мг (разовая доза); или 200 мг / день в течение 7 дней) здоровым добровольцам, частота нежелательных явлений, возникающих во время лечения, была в два раза выше, чем плацебо. Наиболее частыми побочными реакциями были головокружение, головная боль и тошнота. О серьезных побочных эффектах и значительном удлинении интервала QT не сообщалось.
Критическая оценка эффекта нескольких доз биластина (100 мг х 4 дня) на реполяризацию желудочков с использованием «тщательного перекрестного исследования QT / QTc» с участием 30 здоровых добровольцев не выявила значительного удлинения QTc.
В случае передозировки рекомендуется симптоматическое и поддерживающее лечение.
Противоядия от биластина не существует.
05.0 ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
05.1 Фармакодинамические свойства
Фармакотерапевтическая группа: антигистаминные препараты для системного применения, другие антигистаминные препараты для системного применения.
Код УВД RO6AX29.
Биластин является неседативным гистаминергическим антагонистом длительного действия, обладающим селективным сродством к периферическим антагонистам H1-рецепторов и отсутствием сродства к мускариновым рецепторам.
Биластин подавлял вызванные гистамином волнообразно-эритематозные кожные реакции в течение 24 часов после приема разовой дозы.
В клинических испытаниях, проведенных у взрослых и подростков с аллергическим риноконъюнктивитом (сезонным и круглогодичным), биластин 20 мг, вводимый один раз в день в течение 14-28 дней, был эффективен для облегчения таких симптомов, как чихание, дискомфорт в носу, зуд в носу, заложенность носа, зуд в глазах, слезотечение и покраснение глаз. Биластин эффективно контролировал симптомы в течение 24 часов.
В двух клинических испытаниях, проведенных с участием пациентов с хронической идиопатической крапивницей, прием биластина в дозе 20 мг один раз в день в течение 28 дней оказался эффективным в уменьшении интенсивности зуда, количества и размера крапивницы, а также расстройств, вызванных крапивницей. Сон улучшились условия и качество жизни пациентов.
Клинически значимое удлинение интервала QTc или какой-либо другой сердечно-сосудистый эффект не наблюдался в клинических испытаниях биластина даже при дозах 200 мг в день (в 10 раз больше клинической дозы) в течение 7 дней у 9 субъектов или даже при одновременном применении с Ингибиторы P-gp, такие как кетоконазол (24 пациента) и эритромицин (24 пациента). Кроме того, на 30 добровольцах было проведено тщательное исследование QT.
В контролируемых клинических испытаниях при рекомендуемой дозе 20 мг один раз в день профиль безопасности биластина для ЦНС был аналогичен плацебо, а частота сонливости статистически не отличалась от плацебо. Биластин в дозах до 40 мг каждый день не влиял на психомоторные функции. в клинических испытаниях и не повлиял на способность управлять автомобилем в стандартном экзамене по вождению.
У пожилых пациентов (≥ 65 лет), включенных в исследования фазы II и III, не было различий в эффективности или безопасности по сравнению с более молодыми пациентами.
05.2 Фармакокинетические свойства
Абсорбция
Биластин быстро всасывается после приема внутрь, достигая максимальной концентрации в плазме крови примерно через 1,3 часа. Явления накопления не наблюдалось. Средняя биодоступность биластина после перорального приема составляет 61%.
Распределение
Образование in vitro А также in vivo показали, что биластин является субстратом для Pgp (см. раздел 4.5 «Взаимодействие с кетоконазолом, эритромицином и дилтиаземом») и OATP (см. раздел 4.5 «Взаимодействие с грейпфрутовым соком»). Биластин, по-видимому, не является субстратом транспортера BCRP или почечных транспортеров OCT2, OAT1 и OAT3. На основании исследований in vitroне ожидается, что биластин будет ингибировать следующие транспортеры в системном кровотоке: P-gp, MRP2, BCRP, BSEP, OATP1B1, OATP1B3, OATP2B1, OAT1, OAT3, OCT1, OCT2 и NTCP, поскольку для P- gp, OATP2B1 и OCT1 с расчетной IC50 ≥ 300 мкМ, что намного выше, чем расчетная клиническая Cmax в плазме, и поэтому эти взаимодействия не будут иметь клинического значения. Однако на основании этих результатов нельзя исключить ингибирующее действие биластина на переносчики, присутствующие в слизистой оболочке кишечника, например P-gp.
В терапевтических дозах биластин на 84-90% связывается с белками плазмы.
Биотрансформация
В исследованиях биластин не индуцировал и не подавлял активность изоферментов CYP450. in vitro.
Устранение
В исследовании баланса массы, проведенном на здоровых добровольцах, после введения однократной дозы 20 мг 14С-биластина почти 95% введенной дозы было извлечено с мочой (28,3%) и фекалиями (66,5%) в виде неизмененного биластина, тем самым подтверждая, что биластин метаболизируется незначительно у людей.Рассчитанный средний период полувыведения у здоровых добровольцев составил 14,5 часов.
Линейность
Биластин демонстрирует линейную фармакокинетику в исследованном диапазоне доз (от 5 до 220 мг) с низкой индивидуальной вариабельностью.
Пациенты с почечной недостаточностью
В исследовании с участием субъектов с почечной недостаточностью средняя (SD) AUC0-∞ увеличилась с 737,4 (± 260,8) нгхч / мл у субъектов без нарушения (СКФ:> 80 мл / мин / 1,73 м2) до: 967,4 (± 140,2) нгхч / мл у субъектов с легкими нарушениями (СКФ: 50-80 мл / мин / 1,73 м2), 1384,2 (± 263,23) нгхч / мл у субъектов с умеренными нарушениями (СКФ: 30-2) и 1708,5 (± 699,0) нгхч / мл у пациентов с тяжелыми нарушениями (СКФ: 2). Средний период полувыведения биластина (SD) составлял 9,3 часа (± 2,8) у пациентов без нарушений, 15,1 часа (± 7,7) у пациентов с легкими нарушениями, 10,5 часов (± 2.3) у пациентов с умеренными нарушениями и 18,4 часа (± 11.4) у субъектов с тяжелыми нарушениями. Выведение биластина с мочой у всех субъектов было практически полным через 48-72 ч. Ожидается, что эти фармакокинетические изменения не окажут клинически значимого влияния на безопасность биластина, поскольку уровни биластина в плазме у пациентов с почечной недостаточностью все еще находятся в безопасном диапазоне. биластина.
Пациенты с нарушением функции печени
Фармакокинетических данных для субъектов с нарушением функции печени нет. Биластин в организме человека не метаболизируется. Поскольку результаты исследования почечной недостаточности показывают, что элиминация почек является основным фактором элиминации, предполагается, что экскреция с желчью будет лишь незначительно участвовать в элиминации биластина. Ожидается, что изменения функции печени не окажут клинически значимого влияния на фармакокинетику биластина.
Пожилые пациенты
Только ограниченный объем данных доступен по субъектам старше 65 лет. Статистически значимых различий в фармакокинетике биластина у лиц пожилого и молодого возраста не наблюдалось.
05.3 Доклинические данные по безопасности
Доклинические данные о биластине не указывают на особую опасность для человека, основанную на традиционных исследованиях фармакологии безопасности, токсичности при повторных дозах, генотоксичности и канцерогенном потенциале.
В исследованиях репродуктивной токсичности влияние биластина на плод (пре- и постимплантационная потеря у крыс и неполная оссификация костей черепа, грудины и конечностей у кроликов) наблюдались только в дозах, токсичных для матери.Уровень отсутствия наблюдаемых побочных эффектов (NOAEL) значительно превышает (> 30 раз) воздействие на человека в рекомендованной терапевтической дозе.
В исследовании фертильности на крысах пероральное введение биластина в дозе до 1000 мг / кг / день не оказывало влияния на мужские и женские репродуктивные органы. На показатели спаривания, фертильности и беременности не повлияло.
Как показано в исследовании распределения на крысах путем определения концентрации лекарственного средства с помощью авторадиографии, биластин не накапливается в ЦНС.
06.0 ФАРМАЦЕВТИЧЕСКАЯ ИНФОРМАЦИЯ
06.1 Вспомогательные вещества
Микрокристаллическая целлюлоза
Гликолят крахмала натрия (тип А) (полученный из картофеля)
Безводный коллоидный диоксид кремния
Стеарат магния
06.2 Несовместимость
Не имеет значения.
06.3 Срок действия
5 лет.
06.4 Особые меры предосторожности при хранении
Это лекарство не требует особых условий хранения.
06.5 Характер непосредственной упаковки и содержимого упаковки
Лекарство упаковано в блистер, который состоит из двух частей: ламината, состоящего из ориентированного полиамида (внешняя сторона ламината), алюминия и ПВХ (внутренняя сторона ламината).
Алюминиевый лист: алюминиевый лист термосваривается термосвариваемым лаком (сополимер ПВХ-ПВК и бутилметакрилатные смолы) к ламинату после формования и заполнения таблетками.
В каждом блистере по 10 таблеток. Блистеры упакованы в картонные коробки.
Упаковки по 10, 20, 30, 40 или 50 таблеток.
Не все размеры упаковки могут быть проданы.
06.6 Инструкции по эксплуатации и обращению
Никаких особых инструкций.
Неиспользованные лекарства и отходы, полученные от этого лекарства, необходимо утилизировать в соответствии с местными правилами.
07.0 ДЕРЖАТЕЛЬ РАЗРЕШЕНИЯ НА МАРКЕТИНГ
Menarini International Operations Luxembourg S.A.
1, Avenue de la Gare, L-1611 — Люксембург
Дилер на продажу:
A. Menarini Industrie Farmaceutiche Riunite s.r.l.
Via Sette Santi, 3 — Флоренция
08.0 НОМЕР РАЗРЕШЕНИЯ НА МАРКЕТИНГ
Таблетки Робилас 20 мг:
AIC n. 041045016 / M — 10 таблеток
AIC n. 041045028 / M — 20 таблеток
AIC n. 041045030 / M — 30 таблеток
AIC n. 041045042 / M — 40 таблеток
AIC n. 041045055 / M — 50 таблеток
09.0 ДАТА ПЕРВОГО РАЗРЕШЕНИЯ ИЛИ ПРОДЛЕНИЯ РАЗРЕШЕНИЯ
Дата первого разрешения: 3 апреля 2012 г.
10.0 ДАТА ПЕРЕСМОТРА ТЕКСТА
Апрель 2012 г.
