![]()
В наличии
Мазь «Синтозон»
1 700 ₽ – 1 900 ₽
Синтозон — это многокомпонентная мазь, разработанная в МРНЦ г. Обнинска в отделении лечения лучевых повреждений. Мазь Синтозон применяется для лечения поражений слизистых оболочек после лучевой терапии лечения рака предстательной железы (РПЖ). При лучевой терапии РПЖ в зону полей облучения попадают различные анатомические образования: мочевой пузырь, прямая кишка, внутритазовая клетчатка, сосудисто-нервные пучки и кости таза. Наиболее часто повреждаются мочевой пузырь и прямая кишка. Фармакологическое действие мази направленно на уменьшение воспалительных процессов, ускорению процессов регенерации клеточной ткани. Оказывает иммунодепрессивное, противомикробное и бактериостатическое действие. В состав входит: гидрокортизона ацетат (или дексаметазон), левомицетин, анестезин , метилурацил, вода, ланолин, вазелин, масло какао, масло касторовое, масло подсолнечное. ТОЛЬКО ПО НАЗНАЧЕНИЮ ВРАЧА!
В работе представлен опыт лечения 76 больных поздними лучевыми язвами кожи, развившимися после проведения самостоятельной лучевой терапии или комбинированного лечения злокачественных новообразований различной локализации. Проведена оценка эффективности использования местного иммуномодулятора «Гепон» с последующим применением человеческого эпидермального фактора роста «Эбермин» по сравнению с традиционным лечением.
Ключевые слова: онкология, лучевая терапия, лучевые повреждения.
Лучевая терапия с успехом применяется при лечении злокачественных новообразований различной локализации. В большинстве случаев в зону облучения попадают расположенные в непосредственной близости здоровые органы и ткани. Улучшение дозиметрического контроля, использование новых методик облучения и современной аппаратуры, а также адекватная подготовка больных привели к снижению частоты развития местных лучевых повреждений. Однако в некоторых случаях необходимо применить суммарные очаговые дозы облучения, которые значительно превышают толерантность здоровых тканей к ионизирующему излучению или прибегнуть к повторному облучению, что, как правило, является основной причиной развития поздних лучевых повреждений. Следует отметить, что с повышением эффективности комбинированного лечения злокачественных новообразований, включающего лучевой компонент, увеличилась продолжительность жизни больных, в связи с чем стали чаще выявлять отдаленные местные лучевые повреждения.
Местные лучевые повреждения мягких тканей, развивающиеся после лучевой терапии злокачественных опухолей, обладают достаточно высокой толерантностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей являются непосредственным результатом облучения злокачественных новообразований (в суммарной очаговой дозе, превышающей 60 Гр) и проявляются в виде хронических дерматитов, с последующим прогрессированием патологических изменений в фиброз и в лучевую язву кожи (3, 5, 7).
Лучевые язвы, то есть длительно незаживающие дефекты мягких тканей, как правило, развиваются спустя 12 месяцев и более после окончания курса лучевой терапии. В патогенезе лучевых язв ведущую роль играет нарушение тканевой микроциркуляции и последующее развитие ишемического некроза облученных тканей. Нарушение репарационных процессов и выраженное хроническое воспаление являются главными причинами длительного отсутствия заживления язвенной поверхности. При этом период экссудации раневого процесса, в отличие от обычных язв, продолжается многие месяцы. Отторжение некротизированной ткани происходит очень медленно. Вторая фаза заживления лучевой язвы, заключающаяся в развитии грануляционной ткани с последующей эпителизацией дефекта, выражена слабо и может продолжаться годами (1-3, 5).
Характерными жалобами у больных поздними лучевыми язвами кожи являются выраженная боль и зуд в области патологического процесса, а также непереносимость многих медикаментозных средств вследствие развития аллергических реакций. Указанные симптомы, в первую очередь, обусловлены нарушением различных звеньев иммунной системы. В результате исследований было установлено, что патогенез таких проявлений связан с образованием кожных аутоантител и извращением иммунологических реакций (4, 6, 8).
Кроме того, особую роль играет характер бактериологической флоры, присутствующей в раневой поверхности язвы, и ее склонность к модификации в процессе лечения, что сопровождается повышением чувствительности к проводимой терапии (в первую очередь, к антибактериальной и иммунотерапии).
Микробная флора поздних лучевых язв представлена в виде различных комбинаций и ассоциаций, которые, как правило, мало чувствительны к большинству антибиотиков. Качественный (видовой) состав микрофлоры определяли по общепринятой методике. Количественные показатели микробной обсемененности тканей изучали при биопсии язвы, с последующим определением титра разведения микрофлоры и пересчетом на грамм ткани. Микрофлора лучевых язв до лечения в 67,5 % наблюдений была представлена моноинфекцией стафилококка или его различными ассоциациями.
В представленной группе приведен анализ лечения 40 больных лучевыми язвами кожи в экссудативно-некротической фазе, которым применялась традиционная терапия. Длительность течения поздней лучевой язвы кожи на момент госпитализации в МРНЦ РАМН представлена в таблице 1. Нами был проведен анализ распределения больных в зависимости от площади раневой поверхности и локализации поздней лучевой язвы кожи (таблица 2).
В качестве местного медикаментозного пособия использовали противовоспалительные средства (5-10 % раствор димексида), 1 % раствор перекиси водорода в сочетании с различными абсорбирующими перевязочными материалами, антисептиками, протеолитическими ферментами, гидрофильными мазевыми повязками и мазями энзимного очищения. Антибиотики назначали с учетом чувствительности к ним микрофлоры язв. Кроме того, в комплексном лечении лучевых язв кожи широко использовали средства, улучшающие микроциркуляцию тканей и препараты, стимулирующие репарационные процессы (витамины, актовегин, дезагреганты и др.).
Во второй фазе раневого процесса предпочтение отдавалось мазевым средствам, направленным на стимуляцию репарационных процессов, т.е. стимуляцию развития грануляционной ткани (многокомпонентная эмульсия «Синтозон», мазь на основе димексида и др.).

Продолжительность лечения каждой фазы раневого процесса в среднем составляла 4-6 недель. Многолетний опыт нашего отделения показал, что в результате традиционной консервативной терапии полного заживления мягкотканного дефекта удается добиться только у пациентов с небольшой площадью лучевой язвы.
Если в течение проведения лечебных мероприятий у больных отмечалось очищение язвы от некротических масс и хорошее развитие грануляций, производилась островковая трансплантация кожи на гранулирующую поверхность (пластика по Дэвису) с последующим заживлением язвы. При неэффективности консервативного лечения (длительная I фаза, абортивное развитие грануляционной ткани и последующий склероз грануляций) с учетом общего состояния больных рассматривалась возможность хирургического лечения, заключавшегося в иссечении лучевой язвы в пределах здоровых тканей с одновременной пластикой дефекта. Применение такой тактики лечения принесло успех в 77 % наблюдений.
Схема традиционного лечения:
- аппликации 5-10% раствора димексида 2 раза в день в течение 3-4 недель;
- повязки с эмульсией «Синтозон» 1-2 раза в день в течение 4-6 недель;
- островковая кожная пластика на грануляции лучевой язвы;
- иссечение лучевой язвы с пластикой язвенного дефекта.
Низкая терапевтическая эффективность препаратов, имеющихся в арсенале современной медицины, явилась основанием для поиска новых методов лечения. В отделении хирургического и консервативного лечения лучевых повреждений МРНЦ РАМН проведено исследование эффективности мази «Эбермин», разработанной фирмой «Эбер Биотек С.А.», Центр генной инженерии и биотехнологии, Гавана, Куба (разрешено применение в России, регистрационный номер: П № 012569/01 от 01.10.2007 г.) в комплексе с иммуномодулятором «Гепон» у 36 больных поздними лучевыми язвами кожи различной локализации.
Препарат «Эбермин» представляет собой мазь на гидрофильной основе для наружного применения, основным действующим веществом которой является рекомбинантный эпидермальный фактор роста человеческий (ЭФРч). В 100 г мази содержится 1 мг ЭФРч и 1 г сульфадиазина серебра, выполняющего антисептическую функцию, и 100 частей гидрофильной основы. Препарат «Гепон» является новым отечественным иммуномодулятором (производство фирмы «Иммафарма»), действие которого направлено на санирование инфицированных ран и повышение иммунореактивности. Данный препарат проходил клинические испытания в нашем отделении у больных с поздними лучевыми повреждениями различной локализации (2003-2006 гг.).
Большинство больных были направлены в отделение в поздние сроки после многочисленных консультаций онкологов и радиологов. В течение этого времени лечение было малоэффективным или неадекватным (таблица 3). По месту жительства в качестве лечебных мероприятий всем пациентам проводилось консервативное лечение с использованием различных антисептиков, мазей, протеолитических ферментов, сосудистых препаратов, антибактериальной и физиотерапии.

Во всех случаях отмечено отсутствие эффекта от лечебных мероприятий, которые проводились вне стен нашего Центра (без учета пациентов, которые вообще не лечились – 18 %). Кроме того, у части из них в течение или после окончания курса лечения зафиксировано увеличение язвы в размере.
В 18 случаях поздние лучевые язвы развились в результате комбинированного лечения рака молочной железы, в 12 – явились следствием лучевой терапии рака кожи, а в остальных наблюдениях сформировались после облучения мягкотканных злокачественных новообразований.
На момент госпитализации в отделение в 28 наблюдениях основной жалобой пациентов была лучевая язва. В остальных случаях преобладала клиника позднего лучевого фиброза мягких тканей с начальными явлениями изъявления. Среди клинических проявлений у наших пациентов преобладал болевой синдром. Интенсивность его непосредственно была связана с площадью, объемом лучевой язвы, повреждением подлежащих костных структур и наличием других местных лучевых повреждений (таблица 4).

На первом этапе лечения в течение 7-10 дней проводилось орошение язвы раствором препарата «Гепон». Последний перед использованием растворяли в 5 мл стерильного физиологического раствора. Орошение полученным 0,04 % раствором выполняли ежедневно 2 раза в сутки. На втором этапе, по мере развития грануляций, применяли 0,04 % мазь препарата «Гепон» и присоединяли мазь «Эбермин».
Препарат «Эбермин» назначали после очищения лучевой язвы и появления ярких грануляций. Перевязки выполняли ежедневно, 1 раз в день. Слой мази на раневую поверхность не превышал 1-2 мм и укрывался салфеткой, смоченной в физиологическом растворе. Продолжительность использования препарата «Эбермин» составляла 10-25 дней.
При оценке динамики заживления информативным оказалось изучение микрофлоры лучевых язв. До применения препарата «Гепон» в 67,5 % посевов выявлена моноинфекция с преимущественным преобладанием стафилококка, а у 16,3 % больных определялась ассоциация микрофлоры (Escherichia coli, грамоотрицательные микробы и Candida). После курса лечения препаратом «Гепон» в 18,9 % случаев отмечена стерильность повторных посевов раневого отделяемого либо определялись сапрофиты, характерные для нормальной кожи. По сравнению с исходным уровнем, 10 7-8 микробов на грамм ткани, к концу лечения обсемененность сократилась до 10 2-3 . То есть, положительный терапевтический эффект иммуномодулятора «Гепон» необходимо связывать с благоприятным действием на микрофлору, что способствует снижению воспалительного компонента и его негативных последствий (отек окружающих тканей, нарушение микроциркуляции и т.п.). Кроме того, важным аспектом действий данного препарата является его иммуномодулирующее действие, проявляющееся в активизации секреторного иммуноглобулина, снижении уровня противовоспалительных цитокинов, активизации альфа-интерферона, снижении адгезивной функции клеток и их апоптоза, а также и повышением резистентности организма к бактериальной флоре [2].
Эффективность лечебных мероприятий оценивалась клинически по состоянию раневой поверхности: уменьшение экссудации, скорости развития грануляций и скорости эпителизации язвы, исчисляемой по формуле Л.Н.Поповой:
C3=(S-St)/t×100,
где C3 – скорость заживления, S – площадь язвы (мм2) перед началом лечения, St – площадь язвы (мм2) в день измерения, t – время в сутках от начала лечения (таблица 5).

В результате проведенного исследования во II группе больных 50 % заживление язвы было достигнуто у 8 пациентов, у которых дефект тканей не превышал 1000 мм2. В 17 случаях с площадью язвы менее 500 мм2 удалось добиться полной эпителизации. У остальных 11 больных площадь заживления не превышала 30 % и ограничилась краевой или неравномерной эпителизацией, в связи с чем 7 из них было выполнено оперативное вмешательство с использованием различных методов пластики и полным заживлением тканого дефекта. В процессе применения препаратов «Эбермин» и «Гепон» побочных и аллергических реакций отмечено не было.
Таким образом, сочетание мази «Эбермин» с иммуномодулятором «Гепон» является эффективным медикаментозным методом лечения больных поздними лучевыми язвами покровных тканей, способствует быстрому снижению воспалительного процесса и ускорению репарационных процессов. Сравнительный анализ достоверно показал преимущество использования сочетания препаратов «Эбермин» и «Гепон» по сравнению с традиционным лечением.
Гнойные раны – нарушение целостности кожи и близлежащих тканей с возникновением гнойного воспаления. За развитие заболевания ответственны бактерии, проникшие внутрь раны. Ведущую роль занимает золотистый стафилококк.
Лечение гнойных ран – сложная задача, которая во многом зависит от фазы раневого процесса. Всего их три: фаза воспаления, затем регенерации и последняя – эпителизация рубца. Для терапии второй фазы врачи часто прописывают Синтомицин, о котором и пойдет речь в статье.
Провизор расскажет о препарате Синтомицин: ознакомит с его составом показаниями к применению, побочными действиями и условиями хранения, а также сравнит с аналогом.
Синтомицин: состав
Хлорамфеникол – действующее вещество Синтомицина. Активное соединение воздействует на микроорганизмы бактериостатически, то есть подавляет их рост и развитие. В списке инфекционных возбудителей, против которых борется хлорамфеникол, присутствует кишечная палочка, сальмонелла, стафилококки, стрептококки и другие.
Таких форматов выпуска препарата, как «Синтомицин таблетки», «Синтомицин крем» и «Синтомицин гель» в России не зарегистрировано. Официальных лекарственных форм медикамента только две:
- Синтомицин суппозитории вагинальные;
- Линимент Синтомицина.
Распространенные запросы пациентов: «Синтомициновая мазь», «От чего помогает мазь Синтомицина» и «Мазь Синтомицин: показания». Скорее всего, в таком случае речь идет о линименте. Линимент – это жидкая мазь, которая отличается от классической текстуры более легким нанесением и быстрым впитыванием.
Синтомицин: это антибиотик или нет
Синтомицин – это антибиотик широкого спектра действия для наружного и местного применения. Самолечение Синтомицином недопустимо. В аптеке препарат отпускается по рецепту врача.
Синтомицин: от чего помогает
Синтомицин помогает избавиться от инфекционно-воспалительных заболеваний, вызванных чувствительными к его воздействию микроорганизмами. Показания Синтомицин отличаются в зависимости от лекарственной формы препарата.
Синтомицин линимент: показания
Если говорить кратко, то линимент Синтомицин от ожогов второй и третьей степени, инфицированных ран во второй фазе раневого процесса (без гноя и некротических тканей) и длительно незаживающих трофических язв.
Препарат способствует очищению и заживлению раневых поверхностей, препятствует вторичному инфицированию, а также ускоряет эпителизацию – восстановление эпителия в месте повреждения. Ответим на распространенные вопросы.
Применяется ли Синтомицин против прыщей
Много вопросов поступает касательно применения линимента Синтомицин от прыщей. Однако препарат не предназначен для избавления от угревой сыпи. Тоже самое касается применения Синтомицин от подкожных прыщей. Для лечения акне и закрытых комедонов рекомендуется подобрать подходящие средства.
Поможет ли Синтомицин от герпеса
Синтомицин может применяться при лечении герпеса в одном случае: если в очаг поражения занесена бактериальная инфекция. В остальных ситуациях Синтомицин неэффективен.
Нужен ли Синтомицин при ветрянке
Ветрянка – вирусное заболевание, Синтомицин же эффективен только при бактериальных инфекциях. Тем не менее в редких случаях при бактериальном инфицировании пустул Синтомицин может оказать помощь.
Показан ли Синтомицин при фурункулах
Фурункул – серьезная проблема, к которой часто относятся с пренебрежением. Фурункул или по-другому чирей может привести к осложнениям: поражению лимфатических сосудов, лимфоузлов и даже сепсису. При возникновении гнойного воспалительного процесса в волосяной луковице или сальной железе необходимо обратиться к врачу.
Назначается ли Синтомицин от ячменя на глазу
Линимент Синтомицин ни в коем случае нельзя наносить на глаза и веки. При появлении ячменя следует подобрать правильное лечение.
Синтомицин свечи: показания
Согласно источнику «Синтомицин суппозитории вагинальные: инструкция по применению», препарат назначается для:
- Лечения бактериальных инфекций органов малого таза: вагинитов, цервицитов;
- Профилактики гинекологических гнойно-воспалительных заболеваний.
Синтомицин свечи в гинекологии применяются для предотвращения инфицирования перед абортами, операциями, а также до и после установления внутриматочной спирали.
Помогают ли свечи Синтомицин при молочнице
Молочница или вагинальный кандидоз – заболевание, вызванное грибками рода Кандида. Лечение такой инфекции протекает с использованием противогрибковых средств. Синтомицин против грибковых возбудителей неэффективен.
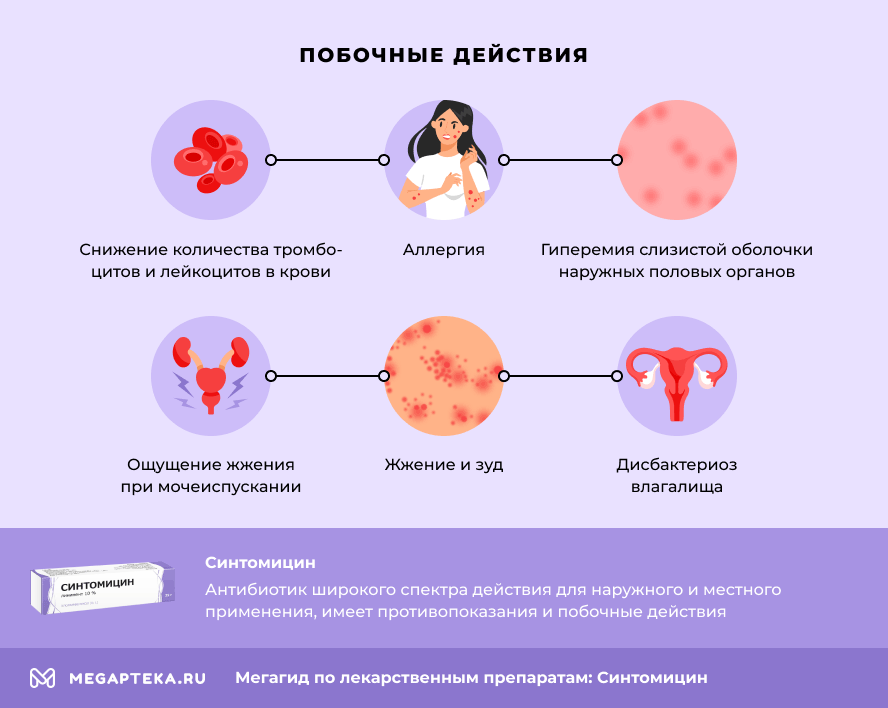
Синтомицин: побочные действия
На фоне применения линимента Синтомицин могут возникать аллергические реакции и изменения со стороны кроветворения. Свечи Синтомицин способны вызывать большее количество побочных действий. В список входят:
- Аллергия;
- Снижение количества тромбоцитов и лейкоцитов в крови;
- Ощущение жжения при мочеиспускании;
- Дисбактериоз влагалища;
- Жжение и зуд;
- Гиперемия слизистой оболочки наружных половых органов;
- Другие.
Синтомицин: хранение
- Линимент Синтомицин рекомендуется хранить при температуре от 8 до 15 градусов в недоступном для детей месте;
- Суппозитории Синтомицин рекомендуется хранить при температуре не выше 25 градусов в недоступном для детей месте.
Левомеколь или Синтомицин: что лучше
Левомеколь – комбинированная мазь с двумя компонентами: хлорамфениколом и метилурацилом. Помимо противомикробного действия, препарат способствует уменьшению воспаления и более быстрому заживлению.
Напомним, что линимент Синтомицин применяется во вторую фазу раневого процесса, когда необходима защита от вторичного инфицирования. Мазь Левомеколь, в свою очередь, назначается для лечения гнойных ран в первой фазе, которая также носит название гнойно-некротической.
Нельзя однозначно сказать, что лучше: Левомеколь или Синтомицин. Несмотря на схожесть в оказываемых эффектах, препараты назначаются в разные фазы раневого процесса.
Краткое содержание
- Хлорамфеникол – действующее вещество Синтомицина.
- Синтомицин – это антибиотик широкого спектра действия для наружного и местного применения.
- Линимент Синтомицин от ожогов второй и третьей степени, инфицированных ран во второй фазе раневого процесса (без гноя и некротических тканей) и длительно незаживающих трофических язв.
- Синтомицин суппозитории вагинальные назначаются для лечения бактериальных инфекций органов малого таза и профилактики гинекологических гнойно-воспалительных заболеваний.
- Синтомицин имеет противопоказания и побочные действия.
- Линимент Синтомицин рекомендуется хранить при температуре от 8 до 15 градусов.
- Нельзя однозначно сказать, что лучше: Левомеколь или Синтомицин.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Лучевые повреждения органов малого таза после лечения ранних стадий рака предстательной железы (обзор литературы)
Сычева И.В., Пасов В.В.
МРНЦ им. А.Ф. Цыба — филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России, Обнинск
Представлены данные о современных методах лечения рака предстательной железы. Проведён анализ причин и методов лечения поздних лучевых повреждений, возникающих после лучевого лечения ранних стадий рака предстательной железы. Лучевые повреждения подразделяются на местные и общие. Сделан акцент на консервативной терапии и затронуты результаты хирургического лечения. При консервативных методах лечения используются местная терапия и общая. Лечение поздних лучевых повреждений требует настойчивости, терпения, времени. Применение комплексного консервативного лечения позволяет значительно облегчить, а в ряде случаев и излечить больных, страдающих лучевыми повреждениями, тем самым улучшить качество жизни и увеличить социальную активность. Важно раннее начало и адекватность лечения, что позволяет повысить терапевтический эффект и предотвращает развитие серьёзных осложнений, таких, как стриктура уретры, стеноз кишки, профузные кровотечения, формирование свища. Необходимо отметить, что лечение поздних лучевых повреждений органов малого таза остаётся сложной задачей, решение которой требует дифференциального подхода. Результат обзора литературы свидетельствует об актуальности поиска новых и оптимизации существующих методов лечения лучевых повреждений.
Ключевые слова: лучевые повреждения, рак предстательной железы, брахитерапия, сочетанная лучевая терапия, дистанционная лучевая терапия, лучевой цистит, лучевой ректит, лучевой энтероколит, стриктура уретры, стеноз кишки, профузные кровотечения, свищ.
Введение
Рак предстательной железы (РПЖ) остаётся одним из самых распространённых злокачественных новообразований среди мужского населения большинства стран мира. Статистика свидетельствует о неуклонном росте частоты заболеваемости РПЖ и смертности от данной патологии, определяя социальную значимость этой проблемы. В структуре онкологических заболеваний РПЖ занимает 2-3 место после рака лёгких и желудка [1-3].
Выбор метода лечения зависит от стадии заболевания (TNM-классификация), суммы баллов по Глисону при биопсии из достаточного количества участков, исходного уровня простатического специфического антигена (ПСА), возраста пациента, сопутствующих заболеваний, прогноза продолжительности и качества жизни. Обязательным условием является согласие пациента на лечение, основанное на полной информации о диагнозе, методе лечения и возможных осложнениях [1-3].
На ранних стадиях РПЖ существуют три различных подхода к лечебным мероприятиям, каждый из которых имеет свои показания и противопоказания: хирургический, лучевая терапия и наблюдение. Следует отметить, что в последнее время в силу доступности информации для пациента, открытости обсуждения диагноза и состояния больного решение о выборе лечения принимается совместно с пациентом. Задача врача — объективно оценить состояние больного и распространённость опухолевого процесса. Окончательное решение остаётся за пациентом.
Сычева И.В.* — научн. сотр.; Пасов В.В. — зав. отделением, д.м.н. МРНЦ им. А.Ф. Цыба — филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России.
*Контакты: 249036, Калужская обл., Обнинск, ул. Королева, 4. Тел.: 8(484) 399-33-39; e-mail: innas57@rambler.ru.
Существуют различные варианты лучевой терапии: дистанционная лучевая терапия (ДЛТ), брахитерапия (БТ) и комбинация БТ с ДЛТ, такой метод называется сочетанной лучевой терапией (СЛТ). В настоящее время лучевая терапия занимает прочное место как один из основных методов лечения онкологических заболеваний, применяемый в комплексе с хирургическим методом, гормональной терапией и химиотерапией и т.д. Лучевая терапия является одним из ведущих методов консервативного лечения рака предстательной железы как при локализованном, так и при местнораспространённом процессе. В литературе последних лет утвердилось мнение о том, что лучевая терапия является хорошей альтернативой радикальной простатэк-томии (РПЭ) при ранних стадиях (Т1-Т2) рака предстательной железы. При этом в подходах к лучевому лечению у различных авторов имеются существенные различия, касающиеся техники и технологии облучения, объёма лучевого воздействия и суммарных очаговых доз [2].
В настоящее время во многих странах для лечения злокачественных опухолей предстательной железы широко используется брахитерапия (контактная лучевая терапия). Преимущества метода лечения заключаются в том, что пациент переносит процедуру намного легче, чем операцию или ДЛТ, а на опухоль подводится доза облучения, которую невозможно достичь при ДЛТ. Кроме того, уменьшается негативное воздействие ионизирующего излучения на соседние органы (мочевой пузырь, уретру, прямую кишку, мягкие ткани, кости таза), а количество дней госпитализации сокращается до 1-4.
Причины развития лучевых повреждений обусловлены ошибками при планировании и проведении лучевой терапии, когда применяются высокие разовые и суммарные дозы, которые превышают толерантность здоровых тканей к ионизирующему излучению. Кроме того, часто не учитываются особенности распределения дозы в сопряжённых злокачественному новообразованию органах [4-10]. Перенесенные ранее заболевания органов брюшной полости (дизентерия, брюшной тиф, хронический колит, холецистопанкреатит), мочевыводящих путей, а также эндокринные и сопутствующие хронические заболевания (сахарный диабет, тиреотоксикоз, гипертоническая болезнь) являются предрасполагающими факторами возникновения такой реакции организма на облучение [4-10]. Различные авторы отмечают, что лучевые повреждения чаще возникают у больных с различными хроническими сопутствующими заболеваниями (70%), чем у больных, не имеющих таковых (18,1%) [6, 11].
В зависимости от проявлений, лучевые осложнения делятся на местные и общие. Общие лучевые осложнения — это ответ всего организма на воздействие ионизирующего излучения, проявляющийся повышенной температурой, нарушением функции желудочно-кишечного тракта, сердечно-сосудистой деятельности, изменением других систем. Местные осложнения характеризуются развитием изменений непосредственно в зоне облучения.
Большинство авторов местные лучевые повреждения подразделяют на ранние (лучевые реакции) и поздние. К ранним лучевым повреждениям относятся патологические изменения, которые развиваются в процессе проведения лучевой терапии или в ближайшие три месяца после её завершения. Они носят функциональный характер и часто бывают обратимыми. Большинство из них купируется в течение ближайших 4 месяцев [5, 6, 11, 12].
Частота ранних лучевых повреждений, по данным различных авторов, составляет 69-83,6% [6, 13, 14-16]. Поздние лучевые повреждения встречаются несколько реже ранних.
Под поздними лучевыми повреждениями подразумевают осложнения лучевой терапии, которые формируются в более поздние сроки, то есть не ранее 3-х месяцев после её окончания и, как правило, приобретают хроническое течение. Они встречаются реже ранних повреждений. В настоящее время в результате облучения онкоурологических больных в 30% случаев формируются лучевые повреждения органов малого таза [5, 17]. Возникновение данной патологии в какой-то степени закономерно и связано с применением высоких суммарных доз облучения, необходимых для купирования онкологического процесса. К сожалению, данные патологические процессы, как правило, необратимы, хотя нередко могут развиваться и компенсаторные механизмы. По данным разных авторов, ремиссия достигается лишь у 35-65% больных, а рецидивы наблюдаются у 30-80% пациентов [5, 6, 18].
При лучевой терапии РПЖ в зону полей облучения попадают различные анатомические образования: мочевой пузырь, прямая кишка, внутритазовая клетчатка, сосудисто-нервные пучки и кости таза. Необходимо отметить, что изолированные повреждения одного органа встречаются редко и в большинстве случаев они носят сочетанный характер. Анатомическая близость органов определяет схожесть патологических процессов, вызванных проведением лучевой терапии. Побочное отрицательное действие ионизирующего излучения на органы малого таза считают суммой некоторых патологических эффектов. В результате проведения ЛТ в огромном количестве образуются свободные перекисные радикалы, которые оказывают крайне негативное влияние на восстановление повреждённых клеток. Кроме того, с течением времени нарастают явления нарушения микроциркуляции в облучённом органе, что приводит к возникновению тромбозов мелких сосудов, ишемии тканей, эрозиям и образованию лучевых язв. Типичным проявлением поздних лучевых повреждений является радиационно-индуцированный фиброз (РИФ), степень выраженности которого прямо пропорциональна величине суммарной поглощённой дозы, режиму фракционирования и времени, прошедшему после лечения. Микроскопическое исследование тканей с РИФ показало, что его развитие сопровождается формированием своеобразного фиброзного «каркаса» в подслизистом слое мочевого пузыря или кишки с фиксацией в стенке мелких кровеносных сосудов, с последующим образованием телеангиоэк-тазий, аррозий и зиянием их просвета. Клинически это проявляется различной степенью гематурии, вплоть до профузного кровотечения. Дальнейшее прогрессирование лучевого фиброза и повреждение всей стенки органа значительно отягощают клиническую картину [4, 5, 8-10, 12, 18-21].
Наиболее часто повреждаются мочевой пузырь и прямая кишка. Существует несколько классификаций лучевых циститов и ректитов. В настоящее время в большинстве радиологических центров используется классификация радиотерапевтической онкологической группы, разработанная совместно с Европейской организацией по исследованию и лечению рака (RTOG/EORS).
Возникновение лучевых осложнений различной степени тяжести является возможным при проведении лучевого лечения. Важно, чтобы их частота не превышала допустимого уровня в 5%. При этом не должно быть повреждений IV степени тяжести, вызывающих инвалидизацию и даже смерть пациента.
Лечение поздних лучевых повреждений мочевого пузыря
Около 75-90% больных, у которых диагностируют местные лучевые повреждения, — лица старше 50 лет, с продолжительным периодом течения патологического процесса. Как правило, это ослабленные пациенты с выраженной анемией, нарушением питания, подавленной регенерацией тканей и сниженным иммунитетом.
Лучевые повреждения мочевого пузыря и прямой кишки, несмотря на схожие патогенетические механизмы развития, отличаются большим клиническим разнообразием. Поэтому при выборе тактики лечебных мероприятий необходим индивидуальный подход к каждому больному и свой алгоритм действий в каждом конкретном случае.
Внутрипузырное введение лекарственных средств показано всем больным, которые страдают поздними лучевыми повреждениями мочевого пузыря, и направлены на регрессию патологического процесса. Кроме того, широко применяются препараты противовоспалительного действия, средства, улучшающие тканевую микроциркуляцию, препараты, стимулирующие иммунитет, антибиотики широкого спектра действия, препараты, влияющие на гемостатические свойства крови, а также средства, уменьшающие императивные позывы к мочеиспусканию и купирующие болевой синдром. Противопоказаниями к применению внутрипузырного введения лекарственных средств являются индивидуальная непереносимость любого из вышеперечисленных препаратов, профузное кровотечение из мочевого пузыря и множественный уролитиаз. Относительным противопоказанием считается наличие единичного камня.
Общая терапия. Терапия поздних лучевых повреждений органов малого таза предполагает комплексное применение общих и местных лечебных мероприятий, включая методы физиотерапии. Независимо от локализации патологического процесса (мочевыводящая система, кишечник), общее лечение предусматривает диету с исключением солёного, острого, пряностей, которые раздражают слизистую, способствуют воспалению и присоединению инфекции.
В литературе особое внимание уделяют купированию болевого синдрома и уменьшению болезненных позывов на мочеиспускание. Патогенетически обосновано назначение спазмолитических препаратов и нестероидных противовоспалительных средств: метамизола натрия (ба-ралгин-М, спазмалгон), дротаверина (но-шпа), нимесулида (нимесил, найз), кетопрофена, дик-лофенака, кеторолака (кеторол) и др. При наличии выраженных болевых ощущений применяют наркотики. Эти мероприятия в большинстве случаев позволяют купировать болевой синдром и существенно улучшить самочувствие больных [7, 19, 23].
Для лечения атрофических форм используют дезагреганты: ацетилсалициловую кислоту (аспирин, тромбо АСС) и клопидогрель (плавикс) под контролем общего анализа мочи на скрытую кровь, а также общего анализа крови и коагулограммы. Длительность курса лечения составляет 4-5 месяцев [5, 18, 23]. Наличие атрофического цистита требует присоединения вазо-активной терапии, направленной на улучшение микроциркуляции стенки мочевого пузыря. С этой целью применяют пентоксифиллин (трентал), троксерутин (троксевазин), солкосерил, ак-товегин и декстран (реополиглюкин) длительными курсами и большими дозировками. Общая длительность лечения составляет от 10 дней до 1 месяца с повторными курсами через 3-6 месяцев [5, 7, 18, 24, 25].
Чуйкина Н.А. и Матякин Г.Г. (2002) в качестве лечебного средства лучевого цистита применяли актовегин в больших дозах (20% актовегин — 10 мл в/в 2 раза в день) и в течение первых трёх дней отметили уменьшение дизурических явлений. Кроме того, использование актове-гина для инстилляций мочевого пузыря в сочетании с пероральными формами лечения позволило добиться полного заживления язвы мочевого пузыря в течение 4-х недель [24].
Современная научная литература располагает достаточным количеством работ, которые посвящены исследованиям эффективности иммуномодуляторов. Оказалось, что применение таких препаратов, как тактивин, тимоген, циклоферон, левамизол (декариз), неовир, интерфе-роны, интерлейкины, полиоксидоний, иммуномакс и т.д. способствует скорейшему заживлению лучевых повреждений независимо от их локализации [4, 5, 7, 12, 18, 23]. Длительность приёма данных лечебных средств составляет 3-4 недели. В качестве неспецифических стимуляторов иммунитета целесообразно использовать аскорбиновую кислоту (витамин С), ретинол (витамин А), витамины группы В (мильгамма), а также витамин Е (токоферола ацетат) в максимальных дозах, что способствует более быстрому разрешению воспаления и сокращению сроков лечения [5, 7, 8].
С противовоспалительной целью применяют глюкокортикостероиды, уросептики и антибактериальную терапию [5, 7-10, 12, 18]. Если количество лейкоцитов в общем анализе мочи повышено, но бактериурия не выявлена, то назначают уросептики. В качестве уросептиков используют фуразолидон, нитроксолин и палин в стандартных дозировках продолжительностью не менее 10 дней. В случаях, когда лейкоцитурия сопровождается бактериурией, необходимо проводить антибактериальную терапию с учётом чувствительности бактериальной флоры к антибиотикам. В качестве профилактики инфекции используют канефрон, цистон, фитолизин и др.
В настоящий момент в Европе используют новый противовоспалительный препарат WF 10, содержащий активный ингредиент ОХО-К993, который вводится внутривенно. Первоначально он был разработан в качестве дополнительной терапии для борьбы со СПИДом и был использован в комбинации с антиретровирусным препаратом. Препарат применяли для профилактики оппортунистических инфекций. Механизм его действия осуществляется по средствам регуляции клеточного иммунитета. Препарат назначался при лучевых циститах и ректитах. Контроль кровотечений наблюдался после одной дозы введения препарата (0,5 мл/кг массы тела в сутки). Средний период наблюдения 55 месяцев. У некоторых пациентов потребовалось повторное лечение. Данный препарат не одобрен для использования в США Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов ( англ. Food and Drug Administration, FDA, USFDA) [9].
Практически у всех пациентов, имеющих признаки длительного кровотечения, фиксируются те или иные нарушения гемостаза, связанные с истощением компенсаторных механизмов свертывающей системы крови. Поэтому в повседневной практике широко используют гемоста-тики: этамзилат (дицинон), викасол, хлорид кальция, аминокапроновую кислоту, транексамовую кислоту (транексам) [5-7, 12, 18, 22, 23]. При падении гемоглобина ниже 80 г/л больным с заместительной целью переливают одногруппную эритроцитарную массу и свежезамороженную плазму. Также активно применяют препараты железа (венофер, космофер, феррум ЛЕК, фе-нюльс и т.д.). Для стимуляции эритропоэза вводят препараты, стимулирующие эритропоэз (эритростим и эпрекс по 10000 ЕД 2-3 раза в неделю, аранесп и т.п.) [17].
В работах российских и зарубежных авторов получены положительные результаты лечения с применением гипербарической оксигенации (ГБО) при поздних лучевых циститах и ректи-тах, а также при формировании свищей [8-10, 26]. Гипербарическая оксигенация снижает выраженность воспалительных процессов в стенке мочевого пузыря и прямой кишки, улучшает регенерацию эпителия слизистой за счёт увеличения их пролиферативной активности. В составе комплексного лечения позволяет добиться стойкого купирования гематурии у больных лучевым циститом и ректитом, повышая результаты оперативного лечения у больных с постлучевыми везико-вагинальными и везико-ректальными свищами. ГБО в составе комплексного лечения способствует улучшению общего состояния пациентов, купированию или уменьшению болей и уменьшению императивных позывов к мочеиспусканию, увеличению среднего эффективного объёма мочевого пузыря уже после первого курса. Назначение повторных курсов ГБО с периодичностью 1 раз в 6-8 месяцев способствует более длительному сохранению положительных результатов проводимого комплексного лечения и уменьшает вероятность развития осложнений.
Местное лечение. Инстилляции с раствором диметилсульфоксида (димексид или ДМСО) и синтозоновой эмульсией (синтозон) показаны при любых формах цистита. ДМСО обладает выраженным противовоспалительным, противоотёчным, фиброзолитическим, обезболивающим действием и способствует проникновению других препаратов в ткани. В мочевой пузырь вводят по 20 мл 1 раз в сутки ежедневно, общим курсом 7-15 процедур. Синтозон — это многокомпонентная мазь, разработанная в МРНЦ г. Обнинска в отделении лечения лучевых повреждений.
У больных с явлениями микрогематурии добавляют 3% раствор колларгола с раствором новокаина. При неэффективности терапии колларголом для усиления гемостатического эффекта в схему лечения необходимо включать охлаждённую аминокапроновую кислоту в режиме чередования [5, 7, 12, 18, 23].
Колларгол обладает «прижигающим» и противовоспалительным действием. Поэтому данный препарат целесообразно применять у больных с буллезной гипертрофией слизистой мочевого пузыря и его шейки. У таких пациентов инстилляции мочевого пузыря проводят ежедневно, курс лечения продолжается от 3 дней до 2 недель. После купирования воспалительных явлений внутрипузырно вводят препараты, действие которых направлено на усиление репарационных процессов в стенке мочевого пузыря. С этой целью применяют синтозоновую эмульсию и облепиховое масло. Облепиховое масло разводят с другим растительным маслом 1:3, затем стерилизуют. Данные препараты обладают обволакивающим и обезболивающим действием. Их вводят в подогретом виде (30-40 оС) один раз в сутки в течение 7-15 дней. Инстилля-ции выполняют с помощью стерильного эластического катетера. Больные в течение 2 часов находятся в горизонтальном положении и каждые 15 мин меняют позу (лежат на спине, на животе или на боку), а также стоя (т.к. чаще всего изменения слизистой — в области дна мочевого пузыря).
Кроме того, при геморрагических циститах после отмывания мочевого пузыря от сгустков крови применяют инстилляции 0,5% раствора перекиси водорода, 5% раствора аминокапроно-вой кислоты и алюмонатриевых квасцов [7, 12, 15, 18].
В последние годы многие авторы отмечают эффективность внутрипузырного введения новых отечественных медикаментозных средств: L-лецитин серебряного геля, иммуномодуля-
торов гепон и иммуномакс, препаратов на основе супероксиддисмутазы — рексод и гиалуроно-вой кислоты — уро-гиал, колегель, а также среду, на которой выращивают мезенхимальные стволовые клетки [4, 7, 12, 15, 18, 23, 28].
Кроме того, в современной литературе широко обсуждается возможность местного применения физиотерапевтических методов лечения с использованием низкоинтенсивного лазерного излучения и локальной гипертермии, улучшающих микроциркуляцию и обладающих противовоспалительным, метаболическим, анальгетическим, иммуномоделирующим, десенсибилизирующим и бактерицидным действием. Жаринов Г.М., Винокуров В.Л. и соавт. (2000) одними из первых определили показания и способы применения низкоинтенсивного лазерного излучения в лечении поздних лучевых циститов. На фоне лазерного воздействия более выражена пролиферафия элементов соединительной ткани и эпителия, усиление фибринолитической активности крови, более интенсивное заживление ран [29].
Особенностью больных с осложнёнными формами лучевого цистита является более глубокое и обширное поражение мочевого пузыря. Общее состояние и психологический статус таких больных страдают значительно чаще, чем у пациентов с неосложнёнными формами. Воспалительные процессы у данной категории лиц протекают более агрессивно, а репаративные процессы угнетены. В связи с этим местное лечение мочевого пузыря имеет целый ряд особенностей. Для инстилляций у таких больных применяют раствор димексида, с постепенным увеличением его концентрации с 10% до 15-20%. Учитывая, что димексид является органическим растворителем и поэтому легко проникает в ткани, в раствор добавляют антибиотики (гентами-цин, амикацин), коллагенлизирующие (лидаза) и противовоспалительные (преднизолон, декса-метазон и т.д.) средства. Инстилляции выполняют 1 раз в сутки в течение 15-20 дней. В последующем в мочевой пузырь вводят синтозоновую эмульсию и другие препараты, способствующие заживлению слизистой [4, 5, 7].
При язвенном цистите применяют инстилляции с добавлением анестетиков, гормонов и ферментов [5, 7, 12, 18, 23]. Положительное действие протеолитических ферментов (трипсин, химотрипсин) обусловлено их фибринолитическим и некролитическим действием [30].
При осложнённых формах лучевого цистита на фоне внутритазового лучевого фиброза (ВЛФ) в патологический процесс могут вовлекаться один или два мочеточника с развитием одно- или двухстороннего гидронефроза. В такой ситуации требуются различные варианты дренирования чашечно-лоханочной системы (нефростомия, стентирование мочеточников) в комплексе с пресакральными блокадами фиброзолитиками (лидаза, супероксиддисмутаза) на растворе 0,5% новокаина.
У пациентов с выраженной дизурией (частота ночного мочеиспускания достигает 6-7 раз на фоне болевого синдрома) устанавливают 3-ходовый уретральный катетер Фоллея и проводят ирригацию мочевого пузыря 0,02% раствором хлоргексидина (в среднем около 3 дней), после чего лечение продолжают по ранее описанной схеме [17].
Фибросклеротические процессы, возникающие в стенке мочевого пузыря, не позволяют адекватно сокращаться кровеносным сосудам в случае их повреждения, поэтому возникающие кровотечения не всегда поддаются консервативному лечению [18, 30, 34-41]. При повреждении более крупных сосудов развивается профузное кровотечение, основной опасностью которого является тампонада мочевого пузыря. В случаях развития тампонады мочевого пузыря необхо-
димо оперативное вмешательство. По возможности, операцию выполняют трансуретральным доступом с применением спинномозговой анестезии. При обнаружении конкрементов мочевого пузыря производят литотрипсию. Кроме того, определяют степень лучевого повреждения стенок мочевого пузыря. На фоне гиперемии слизистой визуализируются крупные расширенные вены, телеангиэктазии, буллезный отёк и возможно язвенные дефекты мочевого пузыря. Выполняют электро- или лазерную коагуляцию кровоточащих сосудов. В связи с высоким риском рецидива гематурии необходимо коагулировать не только кровоточащие сосуды, но и расширенные вены мочевого пузыря. По данным некоторых авторов, хирургическое лечение требуется менее чем 10% больных [18, 27, 31-38].
В случаях, когда по техническим причинам эндоскопические манипуляции невозможны или существует риск угрозы повторного кровотечения целесообразно сформировать эпицисто-стому. Постоянное промывание мочевого пузыря проводят в течение 2-3 дней антисептическими растворами. Катетер удаляют на следующие сутки после снятия ирригации. Главным критерием для удаления катетера является отсутствие видимой гематурии. В дальнейшем таким пациентам проводят традиционное местное и общее лечение.
Больным с мочевыми свищами выполняют лечение, направленное на уменьшение воспалительных процессов, а также удаления некротических тканей со стороны мочевого пузыря и прямой кишки. С этой целью, кроме инстилляций мочевого пузыря, используют микроклизмы с раствором димексида и синтозоновой эмульсией, а также ферментные препараты с последующей рекомендацией оперативного вмешательства, то есть пластики дефекта. В отдельных случаях при сочетании свищей с микроцистисом и внутритазовым лучевым фиброзом используют различные варианты хирургической деривации (отведения) мочи. При развитии стриктуры уретры выполняется трансуретральная уретротомия. При рецидивировании стриктуры уретры возможна постановка стента.
В кандидатской диссертации Твердохлебова Н.Е. (2010) описывается, что пластика дефекта может осуществляться с использованием различных трансплантатов для создания межсвищевого барьера. Это способствует улучшению результатов лечения. При наличии выраженных лучевых изменений тканей в зоне фистулы во время оперативных вмешательств показано использование хорошо кровоснабжаемых мышечных лоскутов, у тех же больных, у которых ткани хорошо васкуляризированы, а также у пациентов с резервуарно-влагалищными свищами целесообразно использовать коллагеновый биоматериал. Коллагеновый биоматериал в зоне повреждённой стенки мочевого пузыря, с одной стороны, создает условия уплотнения тканей в данной зоне, с другой — стимулирует активность соединительной ткани переходного эпителия мочевого пузыря, а также стимулирует активность иммунокомпетентных клеток регионарных лимфатических узлов. В группе больных, которым применялись различные ауто- и гетерогенные трансплантаты, положительные результаты получены в 80% случаев; у пациентов, которым оперативное вмешательство проведено без использования каких-либо трансплантатов, заживление свищей имело место в 70,6% случаев [39].
Отдельно следует отметить, что хирургическое лечение местных лучевых повреждений мочевого пузыря, по данным большинства исследователей, сопровождается высокой частотой осложнений (15-80%), а смертность в послеоперационном периоде составляет 3-9% [8, 9, 40].
Поздние лучевые повреждения кишечника
При лучевой терапии рака предстательной железы чаще повреждается прямая кишка, реже сигмовидная, еще реже тонкая кишка [41]. Облучение таза не повреждает значительную часть тонкой кишки, т.к. она подвижна и перестальтирует. Однако если петли тонкой кишки неподвижны в результате спаек после предшествующих операций, они могут оказаться фиксированными на пути следования пучка излучения и по этой причине получить высокую дозу. Результат такого повреждения не проявляется в течение 6 месяцев и более после окончания ЛТ. Дополнительное назначение дистанционного облучения после брахитерапии является фактором риска повышения токсичности для прямой кишки.
Общая терапия лучевых повреждений кишечника очень похожа на комплекс лечебных мероприятий, которые применяются при реабилитации пациентов, страдающих лучевым циститом, а также имеет свои особенности и включает обезболивающие, противовоспалительные, гемостатические, иммуномодулирующие, антиоксидантные, вазоактивные препараты и т.д. Лечение этими группами препаратов было описано выше (в разделе «Лечение поздних лучевых повреждений мочевого пузыря»). Важным элементом комплексного лечения данной патологии остаётся регуляция акта дефекации, диета и парентеральное питание (частичное или полное). Для купирования запоров, кроме диеты, широко используют слабительные средства: сенаде, фрутолакс, гутталакс, глицериновые свечи и другие препараты, при поносах — смекту, лопера-мид, маалокс и т.д. [7-10, 12, 23]. Однако некоторые исследователи обращают внимание на необходимость ограничения применения слабительных препаратов, считая, что прохождение плотных каловых масс по кишечнику является своеобразным бужированием формирующихся лучевых стенозов [30].
Целью парентерального питания является обеспечение организма всеми необходимыми для жизнедеятельности веществами в тех же соотношениях, в каких они поступают в общее кровообращение при обычном приёме пищи. Белковые гидролизаты усиливают адаптацию к голоданию и оказывают протеинсберегающий эффект. Для больных с лучевыми язвами кишечника, выраженным болевым синдромом, кровотечениями показано проведение парентерального питания с целью предоставления функционального покоя кишечнику и обеспечения оптимальных условий для репарации лучевых повреждений [4, 6, 7].
Частичное парентеральное питание показано больным с лучевыми повреждениями кишечника, не осложнёнными выраженными диспепсическими расстройствами и кровоточивостью, при отсутствии явных признаков истощения. Для парентерального питания используют растворы аминокислот, белковые гидролизаты, полиэлектролитные растворы.
Больным с тяжёлыми формами лучевого ректосигмоидита и энтероколита, выраженными диспепсическими расстройствами, кровоточивостью, болями и явными признаками истощения показано проведение полного парентерального питания с целью адекватного обеспечения потребностей организма в пластических веществах и энергии, а также предоставления функционального отдыха кишечнику. Перевод больных на обычное питание после курса парентерального питания осуществляют постепенно: в течение двух дней больной получает «стол № 0», в течение следующих двух дней — «1-й хирургический», парентеральное питание в эти дни продолжают, далее больных переводят на «стол № 4Б», и парентеральное питание прекращают [4, 6].
С учётом клинической картины и результатов лабораторных исследований назначают ферменты (вобэнзим, юниэнзим, мезим форте, панзинорм, панкреатин, фестал, дигестал и др.). Курс лечения продолжается 3-4 недели [5, 7, 12, 27]. Назначение бактериальных препаратов (колибактерин, бификол и т.д.), антибиотиков широкого спектра действия, сульфаниламидных препаратов — согласно показаниям. Курсы лечения сульфаниламидными препаратами, в частности, сульфасалазином, длительные и продолжаются 1,5-2 мес. Обычно эффект наблюдается через 1,5-2 недели [5-10, 12, 23, 42]. У больных со значительным содержанием крови в кале проводят корригирующую гемостаз терапию (викасол, е-аминокапроновая кислота, дицинон, транексам и т.д.) с учётом коагулологических показателей. При выявлении дефицита сывороточного железа назначают препараты железа (в/в, в/м, внутрь) [5, 6, 26, 46].
По мнению зарубежных авторов, препаратом первой линии при поражении кишечника является производное 5-ацетилсалициловой кислоты — месалазин (5-АСК) [8-10, 44, 45], но они отмечают его низкую эффективность, даже в комбинации с глюкокортикоидами и антибактериальными препаратами [5-10, 12, 42, 46]. Если через 5 месяцев улучшения не наступает, требуется лечение сукральфатом [8-10] или полисульфатом пентозой (ПСП), что стимулирует заживление эпителия и формирует защитный барьерный слой, приводя к улучшению у 75% пациентов [8, 32]. Сукральфат принимают внутрь и местно, ПСП принимают в виде микроклизм. ПСП -синтетическое производное гликозаминогликана, используется для восстановления мукополи-сахаридного слоя. В норме слизистая мочевого пузыря и прямой кишки покрыта защитным слоем из гликозаминогликанов (ГАГ). В России с этой целью используется препарат уро-гиал.
В последние годы для лечения различных заболеваний желудочно-кишечного тракта широко используют препараты на основе жирных кислот, которые способствуют регенерации эпителия и поэтому должны использоваться на ранних стадиях патологического процесса (катаральные, геморрагические ректиты). Наиболее эффективны препараты масляной кислоты [810]. В России применяется препарат масляной кислоты с инулином закофальк [19].
Местное лечение лучевых повреждений кишечника зависит от эндоскопической картины и направлено на снижение воспалительного процесса и стимуляцию репараторных процессов. При всех формах лучевых ректитов показано применение микроклизм с 10-20% раствором ДМСО и синтозон.
По данным А.К. Курпешевой (1984), использование данных препаратов у больных катаральным ректитом позволило добиться выздоровления в 50% случаев, а в 25% — улучшения клинической симптоматики (75% положительного результата). Для инфильтративно-язвенных форм эти показатели были несколько ниже и составляли 22% и 33% соответственно. При язвенно-некротическом ректите хороший очищающий эффект оказывают свечи с трипсином с последующим назначением препаратов, направленных на улучшение репаративных процессов [5, 6, 18].
При ректосигмоидитах результаты дает последовательное применение следующих медикаментозных лекарственных средств. В прямую кишку вводят 50-70 мл 10-15% раствора ДМСО в сочетании с 30 мг преднизолона. В последующем назначают микроклизмы с синтозоном, масла облепихи (30-50%), шиповника (30-50%).
С кровоостанавливающей целью используют аминокапроновую кислоту, свечи с адреналином, гемостатические губки и трубки, 0,5% раствор перекиси водорода, 3% колларгол с 0,5%
раствором новокаина. В случаях кровотечения из единичных сосудов стенки прямой кишки возможна их коагуляция [5, 7, 18, 23, 43, 47].
При выраженном болевом синдроме возможно назначение ректальных свечей с новокаином, анестезином, платифиллином, вольтареном и т.д. В некоторых случаях с целью обезболивания целесообразно применять пресакральные блокады с 0,5% раствором новокаина, учитывая временный эффект данной манипуляции.
При рубцовых изменениях в прямой кишке необходимы длительные повторные курсы лечения микроклизмами с ДМСО, постепенно поднимая его концентрацию до 20-25%, возможно лечение методом гипертермии, использование лазерно-магнитной терапии. При рубцовых стенозах прямой кишки возможно бужирование или установка стента.
При развитии ректо-везикальных свищей и профузном кровотечении некоторые авторы рекомендуют формировать колостому, что предупреждает развитие уросепсиса, снижает травму слизистой прямой кишки за счёт исключения механического фактора и значительно облегчает жизнь больных.
При анализе эффективности консервативного лечения лучевых повреждений кишечника необходимо учитывать частоту рецидивов и длительность клинической ремиссии. Тяжесть патологических проявлений во многом определяет необходимость повторного лечения в условиях стационара. В частности, при катаральном ректите частота госпитализаций составляет 1-2 раза в течение года, а при язвенно-некротических формах ректита доходит до 4-5 раз в год.
Заключение
Лечение поздних лучевых повреждений требует настойчивости, терпения, времени. Применение комплексного консервативного лечения позволяет значительно облегчить, а в ряде случаев и излечить больных, страдающих лучевыми повреждениями, тем самым улучшить качество жизни и повысить социальную активность. Превентивный подход — раннее и адекватное лечение — позволяет повысить терапевтический эффект и предотвратить развитие серьёзных осложнений, таких, как стеноз кишки, профузные кровотечения, малигнизация, формирование свища.
Необходимо отметить, что лечение поздних лучевых повреждений органов малого таза остаётся сложной задачей, решение которой требует дифференциального подхода.
Работ, посвящённых данной проблеме, немного и, как правило, они носят описательный характер. Недостаточно изучены методы профилактики лучевых повреждений, вопросы реабилитации и качества жизни таких лиц в отдалённый период после окончания курса лечения. Результаты существующих методов консервативной терапии лучевых повреждений органов малого таза, до настоящего времени, остаются неутешительными, сопровождаются частыми рецидивами патологического процесса и не могут удовлетворять ни пациентов, ни врачей. Данные процессы, как правило, носят необратимый характер, однако на фоне интенсивных лечебных мероприятий возможно развитие компенсаторных механизмов. В частности, временный эффект лечебных мероприятий фиксируется лишь у 35-65% больных, а случаи обострения заболевания наблюдаются у 30-80% пациентов. Следовательно, поиск и внедрение в повседневную практику эффективных методов лечения местных лучевых повреждений органов малого таза остаётся актуальной задачей.
Литература
1. Денисов И.Н., Каприн А.Д., Паньшин Г.А., Харченко Н.В., Добровольская Н.Ю., Костин А.А., Ситников Н.В., Кочетов А.Г., Фомин Д.К., Нестеров П.В., Гамидов М.И. Лекции цикла «Онкоурология»: Пособие. М.: Книга, 2008. 176 с.
2. Иванов С.А. Брахитерапия как метод радикального лечения при раке предстательной железы: дис. … докт. мед. наук. М., 2011. 281 с.
3. Koutrouvelis P.G. A Breakthrough in Prostate Cancer Treatment: What Every Man Should Know — 3-D Stereotaxis. URPI Press, 2006. 114 p.
4. Атауллаханов Р.И., Пичугин А.В., Пасов В.В., Курпешева А.К. Иммунотерапия при поздних лучевых повреждениях прямой кишки. М.: ФГБУ «ГНЦ Институт иммунологии» ФМБА России, 2012. 17 с.
5. Бардычев М.С., Цыб А.Ф. Местные лучевые повреждения. М.: Медицина, 1985. 240 с.
6. Курпешева А.К. Поздние лучевые повреждения кишечника (особенности клинического течения и лечение): дис. … канд. мед. наук. Обнинск, 1984. 158 с.
7. Пасов В.В., Курпешева А.К. Осложнения и повреждения органов и тканей при лучевой терапии //Основы лучевой диагностики и терапии: национальное руководство /гл. ред. тома акад. РАМН С.К. Терновой. М.: ГЭОТАР — Медиа, 2012. С. 962-990.
8. Kennedy G.D., Heise C.P. Radiation colitis and proctitis //Clin. Colon Rectal Surg. 2007. V. 20, N 1. P. 64-72.
9. Do N.L., Nagle D., Poylin V.Y. Radiation proctitis: current strategies in management //Gastroenterol. Res. Pract. 2011. ID: 917941.
10. Phan J., Swanson D.A., Levy L.B., Kudchadker R.J., Bruno T.L., Frank S.J. Late rectal complications after prostate brachytherapy for localized prostate cancer: incidence and management //Cancer. 2009. V. 115, N 9. P. 1827-1839.
11. Павлов А.С., Костромина К.Н. Рак шейки матки (лучевая терапия). М.: Медицина, 1983. 158 с.
12. Пасов В.В., Курпешева А.К., Терехов О.В. Местные лучевые повреждения у онкологических больных (консервативное лечение) //Терапевтическая радиология: руководство для врачей /Под ред. А.Ф. Цыба, Ю.С. Мардынского: Глава 15. М.: Медицинская книга, 2010. С. 505-550.
13. Жолкивер И.И. Прогнозирование ранних и поздних местных осложнений при лучевой терапии злокачественных опухолей //Диагностика и лечение поздних местных лучевых повреждений: тез. докл. всесоюз. совещания. Обнинск: НИИМР АМН СССР, 1988. С. 20-22.
14. Каприн А.Д., Амосов Ф.Р., Ананьев А.П., Гафанов Р.А. Нарушение уродинамики нижних мочевых путей у больных, перенёсших лучевую терапию //Методология флоуметрии. 1997. С. 35-44.
15. Терехов О.В. Поздние лучевые повреждения мочевого пузыря (клиника, диагностика, лечение): дис. . канд. мед. наук. Обнинск, 2004.
16. Marks L., Carroll P., Dugan T., Anscher M. The response of the urinary bladder, urethra and ureter to radiation and chemotherapy //Int. J. Radiat. Oncol. Biol. Phys. 1995. V. 31, N 5. P. 1257-1280.
17. Атауллаханов Р.И., Пичугин А.В., Пасов В.В., Курпешева А.К. Иммунотерапия лучевых повреждений мочевого пузыря. М.: ФГБУ «ГНЦ Институт иммунологии» ФМБА России, 2012. 18 с.
18. Пасов В.В., Бардычев М.С., Терехов О.В., Курпешева А.К., Королев С.В. Лечение поздних лучевых циститов у онкологических больных: пособие для врачей. Обнинск: МРНЦ РАМН, 2007. 20 с.
19. Бердов Б.А., Пасов В.В., Курпешева А.К., Рухадзе Г.О. Опыт применения препарата Закофальк в комплексном лечении больных ранним и поздним лучевым ректитом //Опыт применения препарата Закофальк в различных областях гастроэнтерологии: сб. научно-практических работ /под ред. М.Д. Арбатской. М., 2013. С. 51-56.
20. Дубровская В.Ф. Патогенез радиоиндуцированных склерозов //Медицинская радиология. 1991. № 11. С. 53-57.
21. Коноплянников А.Г. Молекулярные и клеточные механизмы поздних лучевых повреждений //Радиц. биология и радиоэкология. 1997. Т. 37, № 4. С. 621-628.
22. Ярмоненко С.П., Коноплянников А.Г., Вайнсон А.А. Клиническая радиобиология. М.: Медицина, 2003. 320 с.
23. Сычева И.В., Пасов В.В., Курпешева А.К. Консервативные методы лечения местных лучевых повреждений, формировавшихся в результате сочетанной лучевой терапии и брахитерапии рака предстательной железы //Сибирский онкологический журнал. 2012. № 5. С. 57-60.
24. Чуйкина Н.А., Матякин Г.Г., Чуприк-Малиновская Т.П. Актовегин в профилактике и лечении лучевых реакций и осложнений у онкологических больных //Практическая онкология. 2002. Т. 1, № 2. С. 26-31.
25. Aygenc E., Celikkanat S., Bilgili H., Aksaray F., Orhun S., Kaymakci M., Ozdem C. Pentoxifylline effects on acute and late complications after radiotherapy in rabbit //Otolaryngol. Head Neck Surg. 2001. V. 124, N 6. P. 669-673.
26. Плесовский А.М. Лучевые повреждения мочевого пузыря и интерстициальный цистит (клинико-морфологическое обоснование роли ГБО): автореф. дис. … канд. мед. наук. М., 2013. 81 с.
27. Терехов О.В., Пасов В.В., Постнов Ю.Г., Сычева И.В. Использование полимерных гелей для лечения поздних лучевых повреждений //Актуальные вопросы лучевой диагностики и онкологии: материалы научно-практической конференции. М., 2008. С. 63-64.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
28. Королев С.В. Лучевая диагностика и комплексное лечение лучевых циститов у онкологических больных: дис. … канд. мед. наук. М., 2009. 23 c.
29. Жаринов Г.М., Винокуров В.Л., Заикин Г.В. Лучевые повреждения прямой кишки и мочевого пузыря у больных раком шейки матки //Мир медицины. 2000. № 7. С. 8-11.
30. Коган А.С., Микоян А.Г., Коренная Н.А. Пролонгированная эндовезикальная энзимотерапия при цистите //Урология и нефрология. 1983. № 4. С. 11-14.
31. Терехов О.В., Бардычев М.С., Карякин О.Б., Сафиуллин К.Н., Пасов В.В. Принципы лечения поздних лучевых геморрагических циститов //Материалы VII Ежегодной Российской онкологической конференции. М., 2003. С. 178.
32. Buchi K., Dixon J. Argon laser treatment of hemorrhagic radiation proctitis //Gastrointest. Endosc. 1987. V. 33, N 1. P. 27-30.
33. Chapuis P., Dent O., Bokey E., Galt E., Zelas P., Nicholls M., Yuile P., Mameghan H. The development of a treatment protocol for patients with chronic radiationinduced rectal bleeding //Aust. N. Z. J. Surg. 1996. V. 66, N 10. P. 680-685.
34. Hong J., Park W., Ehrenpreis E. Review article: current therapeutic options for radiation proctopathy //Aliment. Pharmacol. Ther. 2001. V. 15, N 9. P. 1253-1262.
35. Merrick G.S., Butler W.M., Dorsey A.T., Galbreath R.W., Blatt H., Lief J.H. Rectal function following prostate brachytherapy //Int. J. Radiat. Oncol. Biol. Phys. 2000. V. 48, N 3. P. 667-74.
36. Taylor J., Disario J., Buchi K. Argon laser therapy for hemorrhagic radiation proctitis: long-term results //Gastrointest. Endosc. 1993. V. 39, N 5. P. 641-644.
37. Theodorescu D., Gillenwater J.Y., Koutrouvelis P.G. Prostatourethral-rectal fistula after prostate brachytherapy: incidence and Risk Factors //Cancer. 2000. V. 89, N 10. P. 2085-2091.
38. Wilson S.A., Rex D.K. Endoscopic treatment of chronic radiation proctopathy //Curr. Opin. Gastroenterol. 2006. V. 22, N 5. P. 536-540.
39. Твердохлебов Н.Е. Оперативное лечение больных со сложными мочевыми свищами (эксперемен-тально-клиническое исследование): автореф. дис … канд. мед. наук. М., 2010. 81 с.
40. Харченко В.П., Каприн А.Д., Костин А.А. Эндоскопические урологические пособия на верхних и нижних мочевых путях в онкохирургии //Достижения в лечении заболеваний верхних мочевых путей и
стриктуры уретры: материалы Пленума правления Российского общества урологов. Екатеринбург, 2006. С. 163-184.
41. Gelblum D.Y., Potters L. Rectal complications associated with transperineal interstitial brachytherapy for prostate cancer //Int. J. Radiat. Oncol. Biol. Phys. 2000. V. 48. P. 119-124.
42. Goldstein F., Khoury J., Thornton J. Treatment of chronic radiation enteritis and colitis with salicylazosulfapyridine and systemic corticosteroids //Am. J. Gastroenterol. 1976. V. 65, N 3. P. 201-208.
43. Boyko I., Pasov V., Sycheva I., Kurpesheva A. Radiation injuries in patients with prostate cancer after interstitial radiation therapy with sealed I-125-sources and concurrent radiation therapy //Annals of Oncology. 2010. V. 21, Suppl. 8. P. 303.
44. Baum C.A., Biddle W.L., Miner .P.B.Jr. Failure of 5-aminosalicylic acid enemas to improve chronic radiation proctitis //Dig. Dis. Sci. 1989. V. 34, N 5. Р. 758-760.
45. Cotti G., Seid V., Araujo S., Souza A.H.Jr., Kiss D.R., Habr-Gama A. Conservative therapies for hemorrhagic radiation proctitis: a review //Rev. Hosp. Clin. Fac. Med. Sao Paulo. 2003. V. 58, N 5. P. 284-292.
46. Tagkalidis P.P., Tjandra J.J. Chronic radiation proctitis //Aust. N. Z. J. Surg. 2001. V. 71, N 1. P. 230-237.
47. Курпешева А.К., Пасов В.В., Терехов О.В., Белая Н.С., Червякова А.Е., Сычева И.В. Применение гемостатических трубок у больных поздними лучевыми геморрагическими ректитами //Материалы XIII онкологического конгресса. М., 2009. С. 350-351.
Treatment of radiation-induced damage to pelvic organs following radiation therapy of early-stage prostate cancer (literature review)
Sycheva I.V., Pasov V.V.
A. Tsyb MRRC of A. Hertsen FMRC MH RF, Obninsk, Russia
The paper reviews literature data on factors that influence the development of late radiation-induced adverse effects and modalities used for treatment of injuries to pelvic organs resulted from radiotherapy of early-stage prostate cancer. Radiation induces development of local and general complications. Effectiveness of conservative treatment techniques and surgical interventions for management of the injuries is discussed in the paper. The use of complex medical treatment allows achievement of complete symptoms control or complete remission of the disease, thereby improvement of patients’ quality of life and social activity. Evidence suggests that early and adequate treatment results in a better outcome and prevents the development of severe complications, such as urethral stricture, colon stenosis, profuse bleeding, fistula formation. Though application of new treatment strategies gives patients with radiation-induced injuries improve significantly outcome, management of late radiation damage to the pelvic organs is still a complex problem. Further study of mechanisms of development of late radiation effects, clinical research into new approaches to both mitigation and treatment of radiation-induced injuries could result in new more effective treatment modalities, which would allow improvement in survival and quality of life for radiotherapy patients.
Key words: radiation-induced injuries, prostate cancer, brachytherapy, combination radiation therapy, external beam radiation therapy, radiation cystitis, radiation rectitis, radiation enterocolitis, urethral stricture, stenosis of the colon, profuse bleeding, fistula.
Sycheva I.V. — Researcher Assistant; Pasov V.V. — Head of Dep., MD. MRRC.
•Contacts: 4 Korolyov str., Obninsk, Kaluga region, Russia, 249036. Tel.: 8(484) 399-33-39; e-mail: innas57@rambler.ru.
References
1. Denisov I.N., Kaprin A.D., Panshin G.A., Kharchenko N.V., Dobrovol’skaya N.Y., Kostin A.A., Sitnikov N.V., Kochetov A.G., Fomin D.K., Nesterov P.V., Hamidov M.I. Lectures Cycle «Oncourology». Guide. Moscow, Book, 2008. 176 p. (In Russian).
2. Ivanov S.A. Brachytherapy as a method of radical treatment for prostate cancer. Dr. med. sci. diss. Moscow, 2011. 281 p. (In Russian).
3. Koutrouvelis P.G. A Breakthrough in Prostate Cancer Treatment: What Every Man Should Know — 3-D Stereotaxis. URPI Press, 2006. 114 p.
4. Ataullakhanov R.I., Pichugin A.V., Pasov V.V., Kurpesheva A.K. Immunotherapy for late radiation injuries of the rectum. Moscow, State Organization «Institute of Immunology» FMBA of Russia, 2012. 17 p. (In Russian).
5. Bardychev M.S., Tsyb A.F. Local radiation injuries. Moscow, Medicine, 1985. 240 p. (In Russian).
6. Kurpesheva A.K. Late radiation damage to the intestine (clinical features and treatment). Cand. med. sci. diss. Obninsk, 1984. 158 p. (In Russian).
7. Pasov V.V., Kurpesheva A.K. Complications and damage to organs and tissues during radiation therapy. In the book «Fundamentals of radiation diagnosis and therapy: national leadership». Ed.: Ternov S.K. Moscow, GEOTAR Media, 2012, pp. 962-990. (In Russian).
8. Kennedy G.D., Heise C.P. Radiation colitis and proctitis. Clin. Colon Rectal Surg., 2007, vol. 20, no. 1, pp. 64-72.
9. Do N.L., Nagle D., Poylin V.Y. Radiation Proctitis: Current Strategies in Management. Gastroenterol. Res. Pract., 2011. ID: 917941.
10. Phan J., Swanson D.A., Levy L.B., Kudchadker R.J., Bruno T.L., Frank S.J. Late rectal complications after prostate brachytherapy for localized prostate cancer: incidence and management. Cancer, 2009, vol. 115, no. 9, pp. 1827-1839.
11. Pavlov A.S., Kostromina K.N. Cervical cancer (radiation therapy). Moscow, Medicine, 1983. 158 p. (In Russian).
12. Pasov V.V., Kurpesheva A.K., Terekhov O.V. Local radiation damage in cancer patients (conservative treatment). Therapeutic Radiology. Guide for physicians. Ed.: Tsyb A.F., Mardynsky Y.S. Chapter 15. Moscow, Medical books, 2010, pp. 505-550. (In Russian).
13. Zholkiver I. Prediction of early and late complications of local radiation therapy of malignant tumors. Proc. rep. All-Union meeting «Diagnosis and treatment of late local radiation injuries». Obninsk, NIIMR AMS USSR, 1988, pp. 20-22. (In Russian).
14. Kaprin A.D., Amosov F.R., Ananyev A.P., Gafanov R.A. Urodynamics of lower urinary tract in patients who underwent radiotherapy. Methodology flowmetry, 1997, pp. 35-44. (In Russian).
15. Terekhov O.V. Late radiation damage to the bladder (clinical features, diagnosis, treatment). Cand. med. sci. diss. Obninsk, 2004. (In Russian).
16. Marks L., Carroll P., Dugan T., Anscher M. The response of the urinary bladder, urethra and ureter to radiation and chemotherapy. Int. J. Radiat. Oncol. Biol. Phys., 1995, Vol. 31, no. 5, pp. 1257-1280.
17. Ataullakhanov R.I., Pichugin A.V., Pasov V.V., Kurpesheva A.K. Immunotherapy for radiation damage of the bladder. Moscow, State Organization «Institute of Immunology» FMBA of Russia, 2012. 18 p. (In Russian).
18. Pasov V.V., Bardychev M.S., Terekhov O.V., Kurpesheva A.K., Korolev S.V. Treatment of late radiation cystitis in patients with cancer. Manual for physicians. Obninsk, GU «RIHMI-WDC», 2007. 20 p. (In Russian).
19. Berdov B.A., Pasov V.V., Kurpesheva A.K. Rukhadze G.O. Experience with the drug Zakofalk in complex treatment of patients with early and late radiation rectitis. Collection of scientific and practical works. Ed.: Arbatova M.D. Moscow, 2013. pp. 51-56. (In Russian).
20. Dubrovskaya V.F. The pathogenesis of radiation-induced sclerosis. Meditsinskaya radiologiya — Medical Radiology, 1991, no. 11, pp. 53-57. (In Russian).
21. Konoplyannikov A.G. Molecular and cellular mechanisms of late radiation damage. Radiatsionnaya biologiya. Radioekologiya — Radiation Biology. Radioecology, 1997, vol. 37, no. 4, pp. 621-628. (In Russian).
22. Yarmonenko S.P., Konoplyannikov A.G., Vaynson A.A. Clinical radiobiology. Moscow, Medicine, 2003. 320 p. (In Russian).
23. Sycheva I.V., Pasov V.V., Kurpesheva A.K. Conservative treatment of local radiation injuries that were formed as a result of combined radiotherapy and brachytherapy for prostate cancer. Sibirskij onkologicheskij zhurnal — Siberian Journal of Oncology, 2012, no. 5, pp. 57-60. (In Russian).
24. Tchouikina N.A., Matyakin G.G., Chuprik-Malinowskaya T.P. Aktovegin in the prevention and treatment of radiation reactions and complications in cancer patients. Prakticheskaja onkologija — Practical Oncology, 2002, vol. 1, no. 2, pp. 26-31. (In Russian).
25. Aygenc E., Celikkanat S., Bilgili H., Aksaray F., Orhun S., Kaymakci M., Ozdem C. Pentoxifylline effects on acute and late complications after radiotherapy in rabbit. Otolaryngol. Head Neck Surg., 2001, vol. 124, no. 6, pp. 669-673.
26. Plesovsky A.M. Radiation damage to the bladder and interstitial cystitis (clinical and morphological study the role of HBO. Cand. med. sci. diss. synopsis. Moscow, 2013. 81 p. (In Russian).
27. Terekhov O.V., Pasov V.V., Postnov Y.G., Sycheva I.V. The use of polymer gels for the treatment of late radiation damage. Materials of scientific and practical conference «Actual problems of radiation diagnosis and oncology». Moscow, 2008, pp. 63-64. (In Russian).
28. Korolev S.V. Radiological diagnosis and comprehensive treatment of the radial cystitis in patients with cancer. Cand. med. sci. diss. Moscow, 2009. 23 p. (In Russian).
29. Zharinov G.M., Vinokurov V.L., Zaikin G.V. Radiation damage to the rectum and the bladder in patients with cervical cancer. Mir mediciny — The World of Medicine, 2000, no. 7, pp. 8-11. (In Russian).
30. Kogan A.S., Mikoian A.G., Korennaia N.A. Prolonged endovesical enzyme therapy in cystitis. Urologija i nefrologija — Urology and Nephrology, 1983, no. 4, pp. 11-14. (In Russian).
31. Terekhov O.V., Bardychev M.S., Karyakin O.B., Safiulin K.N., Pasov V.V. Principles of treatment of late radiation hemorrhagic cystitis. Mat. VII Annual Russian oncology conference. Moscow, 2003, p. 178. (In Russian).
32. Buchi K., Dixon J. Argon laser treatment of hemorrhagic radiation proctitis. Gastrointest. Endosc., 1987, vol. 33, no. 1, pp. 27-30.
33. Chapuis P., Dent O., Bokey E., Galt E., Zelas P., Nicholls M., Yuile P., Mameghan H. The development of a treatment protocol for patients with chronic radiationinduced rectal bleeding. Aust. N. Z. J. Surg., 1996, vol. 66, no. 10, pp. 680-685.
34. Hong J., Park W., Ehrenpreis E. Review article: current therapeutic options for radiation proctopathy. Aliment. Pharmacol. Ther., 2001, vol. 15, no. 9, pp. 1253-1262.
35. Merrick G.S., Butler W.M., Dorsey A.T., Galbreath R.W., Blatt H., Lief J.H. Rectal function following prostate brachytherapy. Int. J. Radiat. Oncol. Biol. Phys., 2000, vol. 48, no. 3, pp. 667-674.
36. Taylor J., Disario J., Buchi K. Argon laser therapy for hemorrhagic radiation proctitis: long-term results. Gastrointest Endosc., 1993, vol. 39, no. 5, pp. 641-644.
37. Theodorescu D., Gillenwater J.Y., Koutrouvelis P.G. Prostatourethral-rectal fistula after prostate brachytherapy. Cancer., 2000, vol. 89, no. 10, pp. 2085-2091.
38. Wilson S.A., Rex D.K. Endoscopic treatment of chronic radiation proctopathy. Curr Opin Gastroenterol., 2006, vol. 22, no. 5, pp. 536-540.
39. Tverdohlebov N.E. Surgical treatment of patients with complicated urinary fistula (an experimental and clinical research). Cand. med. sci. diss. synopsis. Moscow, 2010. 81 p. (In Russian).
40. Kharchenko V.P., Kaprin A.D., Kostin A.A. Endoscopic urological aids on the upper and lower urinary tract in oncology. Materials of the Plenum of the Russian Society of Urologists «Developments in the treatment of upper urinary tract and urethral stricture». Ekaterinburg, 2006, pp. 163-184. (In Russian).
41. Gelblum D.Y., Potters L. Rectal complications associated with transperineal interstitial brachytherapy for prostate cancer. Int. J. Radiat. Oncol. Biol. Phys., 2000. vol. 48, pp. 119-124.
42. Goldstein F., Khoury J., Thornton J. Treatment of chronic radiation enteritis and colitis with salicylazosulfapyridine and systemic corticosteroids. Am. J. Gastroenterol., 1976, vol. 65, no. 3, pp. 201208.
43. Boyko I., Pasov V., Sycheva I., Kurpesheva A. Radiation injures in patients with prostate cancer after interstitial radiation therapy with sealed I-125-sources and concurrent radiation therapy. Annals of Oncology, 2010, vol. 21 (suppl 8), pp. 303.
44. Baum C.A., Biddle W.L., Miner P.B.Jr. Failure of 5-aminosalicylic acid enemas to improve chronic radiation proctitis. Dig. Dis. Sci., 1989, vol. 34, no. 5, pp. 758-760.
45. Cotti G., Seid V., Araujo S., Souza A.H.Jr, Kiss D.R., Habr-Gama A. Conservative therapies for hemorrhagic radiation proctitis: a review. Rev. Hosp. Clin. Fac. Med. Sao Paulo, 2003, vol. 58, no. 5, pp. 284-292.
46. Tagkalidis P.P., Tjandra J.J. Chronic radiation proctitis. Aust. N. Z. J. Surg., 2001, vol. 71, no. 1, pp. 230237.
47. Kurpesheva A.K., Pasov V.V., Terekhov O.V., Belaya N.S., Chervyakova A.E., Sycheva I.V. The use of
hemostatic tubes in patients with late radiation hemorrhagic rectitis. Mat. XIII Cancer Congress. Moscow, 2009, pp. 350-351. (In Russian).
Фотолон (лиофилизат для приготовления раствора для инфузий, 100 мг), инструкция по медицинскому применению РУ № П N015948/01
Дата последнего изменения: 06.11.2019
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Лекарственная форма
- Состав
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
Действующее вещество
ATX
Фармакологическая группа
Лекарственная форма
Лиофилизат
для приготовления раствора для инфузий.
Состав
Состав
на один флакон:
Действующее вещество:
Тринатриевая
соль Хлорина E6 (в пересчете на Хлорин E6) — 25 мг, 50 мг,
100 мг;
Вспомогательные вещества:
Повидон K‑17,
натрия гидроксид.
Описание лекарственной формы
Пористая
масса зеленовато-черного цвета. Допускается фиолетовый оттенок.
Фармакокинетика
Отдельных
дорегистрационных исследований фармакокинетики ЛС в крови человека (в рамках
клинических испытаний) не проводилось. Основные фармакокинетические параметры
ЛС Фотолон при однократном внутривенном введении были установлены в опытах на
лабораторных животных в ходе доклинического изучения лекарственного средства. В
дальнейшем, параметры фармакокинетики Фотолона у человека были подтверждены
накопленными результатами спектрофлуоресцентных исследований и клиническими
наблюдениями.
При
однократном внутривенном введении в рекомендованных терапевтических дозах
максимальные количества препарата в опухоли регистрируются через 3–4 часа
с момента введения, затем концентрация активного вещества (хлорина E6) в
опухолевой ткани медленно снижается. В клетках эндотелия сосудов максимальные
количества препарата обнаруживаются через 10–15 мин после начала инфузии.
Фотолон
проникает через гистогематические барьеры, обнаруживается в тимусе, коже,
головном и костном мозге, селезенке, яичниках, надпочечниках, сердце,
поджелудочной железе, желудке, почках, печени, легких.
Выведение
препарата из тканей большинства внутренних органов происходит в течение
24 часов после введения. В коже и в подкожной клетчатке Фотолон может
удерживаться до 48–60 часов. Основная часть введенной в организм дозы экскретируется
в неизмененном виде с мочой, оставшаяся часть — с каловыми массами.
Фармакодинамика
Фотолон
избирательно накапливается в доброкачественных и злокачественных
новообразованиях различного генеза и локализации, других активно
пролиферирующих тканях (в том числе, преимущественно характеризующихся
неоваскуляризацией), а также — в клетках микроорганизмов, и при локальном
воздействии монохроматического света с длиной волны 660–670 нм
обеспечивает фотосенсибилизирующий эффект, приводящий к повреждению клеток
и/или тканей. Фотолон является высокоинформативным диагностическим средством
для спектрофлуоресцентных исследований.
Показания
Фотодинамическая
терапия в онкологии:
—
рак кожи
(базальноклеточный, плоскоклеточный);
—
меланома,
внутрикожные и подкожные метастазы меланомы;
—
рак молочной
железы, внутрикожные и подкожные метастазы рака молочной железы;
—
рак слизистых
оболочек, в т. ч. полых органов (вульвы, шейки матки (в т. ч.
цервикальные интраэпителиальные неоплазии I–III ст.), пищевода, прямой
кишки).
Флуоресцентная
диагностика патологически измененных участков кожи и слизистых оболочек.
Фотодинамическая
терапия в офтальмологии:
—
субретинальные
неоваскулярные мембраны при центральной инволюционной хориоретинальной
дистрофии и миопической макулопатии.
Противопоказания
Гиперчувствительность
к любому компоненту препарата, выраженная почечная или печеночная
недостаточность, заболевания сердечно-сосудистой системы в стадии
декомпенсации, порфирия, беременность, период грудного вскармливания, детский
возраст.
Применение при беременности и кормлении грудью
Применение
при беременности и в период грудного вскармливания противопоказано.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Раствор
Фотолона готовят ex tempore.
Препарат применяют внутривенно в диапазоне доз от 1,0 до 3,0 мг/кг массы
тела больного, в зависимости от нозологической формы, локализации и
распространенности патологического процесса. Рассчитанную дозу растворяют в
200 мл физиологического раствора и инфузируют внутривенно капельно в
течение 30 минут.
Фотодинамическая терапия рака кожи (базальноклеточный,
плоскоклеточный)
Фотолон
применяют в дозах 0,8–2,0 мг/кг в зависимости от клинической и
морфологической картины, размеров опухоли и степени инфильтрации окружающих
тканей. Облучение проводят за один сеанс, с одного или нескольких полей
диаметром 2,0–3,0 см, в зависимости от размеров опухоли. Световая доза
составляет 100–600 Дж/см2.
Для
первичных поверхностно-стелящихся образований, а так же опухолей,
локализованных параорбитально, световая доза составляет 100–200 Дж/см2;
для первичных экзофитных и инфильтративно-язвенных базалиом —
250–300 Дж/см2, а при лечении плоскоклеточного рака кожи,
рецидивов рака после хирургического и лучевого лечения, доза лазерного
воздействия составляет 300–600 Дж/см2. Время облучения
T (с) определяется путем деления заданной величины световой дозы (Дж/см2),
которую необходимо подвести к опухоли, на рассчитанную плотность мощности:
T = E/Ps. Плотность мощности (Ps, Вт/см2) рассчитывается
путем деления величины мощности на выходе световода (Pв, Вт) на площадь
облучения (S, см2): Ps = Pв/S. При проведении ФДТ обычно
используется плотность мощности светового излучения 200–400 мВт/см2.
Фотодинамическая терапия меланомы внутрикожных и подкожных
метастазов меланомы, рака молочной железы и внутрикожных и подкожных метастазов
рака молочной железы
Фотолон
применяют в дозах 1,0–2,0 мг/кг. Интрадермальные метастатические очаги до
1,0 см в диаметре облучают дистанционно полипозиционным способом с
перекрытием полей облучения на 0,3–0,4 см и, при необходимости, с
формированием дополнительного поля в центре образования. Световая доза
подводится перпендикулярно поверхности опухоли с плотностью мощности
300–500 мВт/см2. При этом используется максимальная доза
облучения 600 Дж/см2, а при недостаточно выраженных признаках
геморрагического некроза доза может быть увеличена до 900–1200 Дж/см2.
При
субдермальном расположении метастатических очагов для усиления повреждающего
эффекта через 3 часа после внутривенного введения препарата Фотолон в дозе
1,0–2,0 мг/кг проводится контактное очаговое облучение с использованием
световодов с контактными макролинзами диаметром 0,5 и 1,0 см по периферии
образования с захватом здоровых тканей на 0,5–1,0 см. При этом поля
формируются в виде «лепестков ромашки» числом от 5 до 8, в зависимости от
диаметра очага с перекрытием соседних полей на 0,3–0,4 см. Облучение
центральной части очага во время этого сеанса не проводится. Плотность энергии
должна составлять 300–600 Дж/см2, при плотности мощности
300–500 мВт/см2. На 2‑е сутки после облучения
периферии опухоли проводится дополнительное введение 1,0% раствора Фотолона
интратуморально в объеме 0,3–0,5 мл в зависимости от объема очага. Раствор
фотосенсибилизатора (ФС) вводится медленно после обработки поверхности опухоли
70% этиловым спиртом. После этого проводится контактное очаговое облучение
центральной части очага 1–3 полями диаметром 1,0 см с перекрытием на
0,3–0,4 см, с плотностью мощности 200–300 мВт/см2 и
плотностью энергии 200–300 Дж/см2.
Фотодинамическая терапия рака вульвы
Пациенткам
вводится ФС Фотолон внутривенно капельно из расчета 0,8–1,5 мг/кг веса. В
виду особой чувствительности зоны вульварного кольца с целью купирования
болевого синдрома сеанс ФДТ проводится под эпидуральной анестезией.
Катетеризация эпидурального пространства производится на уровне
III–IV поясничных позвонков. По показаниям дополнительно назначаются
наркотические анальгетики. Сеанс локального облучения опухоли проводится через
3 часа после введения Фотолона при длине волны 662–670 нм с
плотностью мощности 200–400 мВт/см2 с помощью световодов с
микролинзой. К опухолям подводится световая энергия от 200–300 Дж/см2
в течение одного сеанса облучения с одного или нескольких полей, в зависимости
от клинической и морфологической формы, глубины инфильтрации опухолевого
процесса. При лечении дистрофии вульвы достаточно подведения световой дозы
40–50 Дж/см2. Во время проведения сеанса облучения обязательно
проводится тщательная защита светонепроницаемыми материалами областей
мочеиспускательного канала и ануса (если они не вовлечены в патологический
процесс), т. к. лазерный свет может спровоцировать развитие отека и,
соответственно, нарушать физиологические функции этих органов.
После
сеанса ФДТ производится обработка поверхности вульвы синтазоновой мазью и
другими противовоспалительными препаратами в течение нескольких дней с
наложением компрессов с 5% раствором диметилсульфоксида.
Целесообразно
использовать ФДТ в качестве самостоятельного метода лечения при раке вульвы
TisN0M0 (преинвазивная карцинома). При стадиях I (T1N0M0), II (T2N0M0)
и III (T1‑3N0M0) ФДТ должна проводиться строго индивидуально в
комбинации с иными методами лечения (хирургическими и/или лучевыми методами),
поскольку в данных ситуациях необходимо воздействие не только на
визуализируемый опухолевый очаг, но и на зоны регионального распространения. При
стадии IV (T1‑4N0‑2M0‑1) ФДТ может применяться для
паллиативного и симптоматического лечения.
Фотодинамическая терапия рака шейки матки (в т. ч.
цервикальных интраэпителиальных неоплазий I–III ст.)
Препарат
применяют в дозах 2,0–2,5 мг/кг. Сеанс локального облучения проводят через
3–4 часа после введения. Доза светового облучения 100 Дж/см2
при плотности мощности не более 0,2 Вт/см2. Облучение проводят
в 2 этапа. Вначале осуществляют поверхностное облучение влагалищной части
шейки матки с применением оптоволоконного катетера с микролинзой, обладающего
гомогенным распределением излучения по световому пятну. Количество и размер
полей облучения определяют в зависимости от объема и формы пораженной области.
В случае если размер области дисплазии не превышает в любом измерении
3 см, облучение влагалищной части шейки матки осуществляется одним полем
диаметром до 4 см. При этом границы поля лазерного облучения должны
покрывать область дисплазии с запасом минимум 0,5 см. Если размеры зоны
дисплазии превышают 3 см, облучение поверхности шейки матки
осуществляют четырьмя полями диаметром 2–3 см так, чтобы обеспечить
равномерное облучение всей поверхности шейки матки, с обязательным
перекрыванием края каждого предыдущего поля облучения. Превышать плотность
мощности не рекомендуется. Допускается выполнение дополнительного облучения
вызывающих сомнение областей в дозе 50 Дж/см2. На втором этапе
осуществляют внутриполостное облучение цервикального канала по всей его длине с
помощью катетера с цилиндрическим диффузором. Энергия облучения цервикального
канала составляет 100 Дж на 1 см длины диффузора. Мощность лазерного
излучения устанавливают из расчета не более 0,17 Вт на 1 см длины
диффузора. В некоторых случаях возможны жалобы пациенток на сильные тянущие
боли внизу живота, тошноту, позывы к рвоте. В таких случаях допускается
снижение мощности лазерного излучения в два раза (до 0,08 Вт/см длины
диффузора) при соответственном увеличении в два раза времени облучения.
Фотодинамическая терапия рака пищевода, прямой кишки
Фотолон
применяют в дозе 2,5 мг/кг. Сеанс лазерного облучения проводят через
3–4 часа после введения препарата при длине волны 662–670 нм с
плотностью мощности 200–350 мВт/см2 с помощью оптических
световодов с микролинзой. К опухолям подводится световая энергия от 150 до
300 Дж/см2 в зависимости от клинической и морфологической
картины, глубины и степени инфильтрации опухоли.
Флуоресцентная диагностика патологически измененных участков
кожи и слизистых оболочек
Препарат
применяют в дозе 2,0–2,5 мг/кг массы тела больного. Процедура проводится с
помощью технических комплексов LESA‑01‑BIOSPEC, LESA‑06‑BIOSPEC,
LESA‑07‑BIOSPEC (Biospec, Россия) или любых других устройств
подобного рода, где в качестве источника излучения, возбуждающего флуоресценцию
фотосенсибилизатора, используется излучение He‑Ne лазера
(630–633 нм). Исследования проводятся под прямым углом к объекту, при
легком касании торцом оптоволоконного световода ткани.
Полученные
путем точечных измерений спектры тканей центра и периферии патологически
измененного участка, а также визуально здоровых участков кожи/слизистой
анализируются по форме, величине и амплитуде сигнала, определяется площадь
интенсивности флюоресценции (S2) и площадь отраженного от тканей лазерного
излучения (S1), а также их отношение (S2/S1). По отношению показателей
S2/S1 оценивается уровень флуоресценции различных участков кожи/слизистой
(например, центр и периферия опухоли, здоровая кожа), что позволяет определить
накопление препарата в тканях и распространение патологического процесса.
Дополнительно
проводится визуализация всей области поражения. Для этой диагностической
процедуры используется матричный светодиодный облучатель (длина волны
665 нм, мощность излучения 40 мВт/см2) со встроенной
видеокамерой — «Камин‑видео‑3», (производства «Biospec», Россия)
или любое другое устройство с видеокамерой, где в качестве источника излучения
используется лазер с длиной волны 660 нм и мощностью 50–100 мВт.
Контроль изображения и границ опухолевого процесса осуществляется во
флуоресцентном и рассеянном свете в технике сканирования, в том числе и поиск
новых областей с интенсивной флуоресценцией (визуально не наблюдаемых
патологических очагов).
Кольпоскопические исследования с флуоресцентной диагностикой
Оценку
формы и размера пораженной области проводят с использованием
специализированного аппаратного комплекса для визуализации флуоресценции шейки
матки, включающего в себя кольпоскоп, компьютер с устройством для видеозахвата
и специализированное программное обеспечение. Кольпоскоп должен быть оснащен
видеоадаптером, цветной видеокамерой для регистрации изображения в белом свете,
высокочувствительной видеокамерой для регистрации флуоресцентных изображений и
светодиодным источником возбуждения флуоресценции. Фотолон вводят в дозе
2,0–2,5 мг/кг внутривенно капельно за 30 минут до проведения
исследования. Анализ флуоресцентных видеоизображений осуществляется их
сравнением с видеоизображениями, полученными цветной камерой в белом свете.
Зоны поражения, как правило, имеют более высокую интенсивность флуоресценции,
чем здоровые ткани.
Фотодинамическая терапия субретинальных неоваскуляуных
мембран при нейтральной инволюционной хориоретинальной дистрофии и миопической
макулопатии
Препарат
применяют в дозе 6–8 мг/м2 поверхности тела больного.
Рассчитанную дозу растворяют в соответствующем объеме 0,9% раствора хлорида
натрия до конечной концентрации 2 мг/мл (к содержимому флакона с
25 мг Фотолона прибавляют 12,5 мл растворителя; к содержимому
флакона, содержащего 50 мг Фотолона, прибавляют 25 мл растворителя; к
содержимому флакона, содержащего 100 мг Фотолона, прибавляют 50 мл
растворителя). Дозе Фотолона 10,6 мг соответствует 5,3 мл раствора;
дозе 14,4 мг — 7,2 мл раствора. Затем доводят объем раствора 0,9%
раствором хлорида натрия до 30 мл. Полученный раствор Фотолона вводят
внутривенно со скоростью 3 мл/мин с использованием шприцевого
программируемого дозатора. Одновременно с началом инфузии включают таймер.
Длительность введения равняется 10 мин. Лазерное облучение проводят через
10–15 мин после начала введения препарата (но не позднее 20 мин).
Интенсивность оптического излучения 600 мВт/см2. Доза облучения
50 Дж/см2. Для достижения необходимой дозы облучения при
соблюдении названных параметров облучения требуется около 83 сек.
Побочные действия
Информация
о характере и частоте возможных нежелательных реакций основана на результатах
проведенных дорегистрационных и пострегистрационных клинических исследований, а
также на имеющихся литературных данных как в отношении лекарственного средства
Фотолон, так и в отношении других фотосенсибилизаторов на основе
хлорина E6 и его производных. Как правило, абсолютное большинство
известных нежелательных реакций связано с фотодинамическим воздействием как
таковым и не должно рассматриваться только в контексте введения ЛС.
Со стороны нервной системы и органов чувств
Чувство
жжения и боли в зоне облучения (различной интенсивности, купируются применением
нестероидных противовоспалительных препаратов (НПВП);
В отдельных случаях
(например, гинекологические вмешательства) может потребоваться введение
наркотических анальгетиков и/или седативных препаратов);
Очень редко
— снижение остроты зрения, дефекты поля зрения, слезотечение, субретинальное
кровоизлияние, кровоизлияние в стекловидное тело.
Со стороны мочевыделительной системы
Изменение
цвета мочи (безопасно, обусловлено выведением хлорина E6 с мочой и не
должно быть ошибочно принято за патологическое состояние).
Со стороны пищеварительной системы
На
фоне сеансов ФДТ у ряда пациенток с гинекологической патологией (ЦИН, опухоли
вульвы) отмечались выраженные тошнота и рвота, как во время, так и после
завершения лечения.
Со стороны дыхательной системы
На
фоне ФДТ центрального рака легкого возможно развитие эндобронхита и пневмонии
(требуется назначение антибиотиков широкого спектра действия).
Со стороны сердечно-сосудистой системы
Редко — сердцебиение,
тахикардия; повышение артериального давления у больных с сопутствующими
заболеваниями сердечно-сосудистой системы.
Лабораторные показатели
Редко — повышение
активности «печеночных» трансаминаз и щелочной фосфатазы, гипербилирубинемия;
Редко — увеличение
количества нейтрофилов, лейкоцитоз, кратковременное повышение СОЭ
непосредственно после процедуры ФДТ.
Со стороны кожных покровов и слизистых оболочек
Очень часто
— повышенная фотосенсибилизация в течение первых 24–72 часов после
введения ЛС (пациенты должны соблюдать специальный световой режим в течение
3 суток после лечения);
Редко — аллергические
реакции (кожная сыпь, зуд, крапивница); гиперемия кожи, гемостаз в зоне
облучения; отек открытых поверхностей тела (без пигментации).
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Возможно
совместное применение с анальгезирующими средствами.
Не
рекомендуется использование местной (инфильтрационной) анестезии.
Фотолон
не должен применяться одновременно с другими средствами с известной
фотосенсибилизирующей (антибиотики тетрациклинового и фторхинолонового рядов,
сульфонамиды, производные фенотиазина, производные сульфонилмочевины
(глибенкламид, тиазидные диуретики, гризеофульвин) или фотопротекторной
активностью (меланин, различные косметические средства, если это не требуется
методикой лечения)).
Не
следует применять Фотолон одновременно с лекарственными средствами, которые
могут ослабить эффективность проводимого лечения (бета‑каротин, этанол,
маннит).
Исключается
одновременное применение препаратов с известным повреждающим действием в
отношении печени, а также тех, которые могут повлиять на метаболизм хлорина и
пролонгировать системную фототоксичность (ингибиторы и индукторы CYP3A4 —
циметидин, кетоконазол, интраконазол, эритромицин, саквинавир, ритонавир,
рифампицин; препараты, снижающие экскреторную функцию почек).
Передозировка
Симптомы
Одышка,
тахикардия, повышение артериального давления, возбуждение, сменяющееся
угнетением, гипотермия. При проведении сеанса фотодинамической терапии с
Фотолоном при лечении офтальмологической патологии возможна передозировка
препаратом, а также превышение дозы облучения. В этих случаях возможны
осложнения, связанные с неселективным влиянием фотосенсибилизатора на сосуды
сетчатки, в числе которых: отсутствие перфузии нормальных сосудов (капилляров)
сетчатки, кровоизлияния в стекловидное тело, субретинальные и интраретинальные
кровотечения, усиление фиброза, резкое снижение остроты зрения в течение
7 дней после ФДТ, которое может быть длительно сохраняющимся.
Лечение
Симптоматическая
терапия (специфического антидота нет).
Особые указания
Фотолон
характеризуется слабо выраженной системной фототоксичностью и быстрым
выведением из организма. Тем не менее, начиная с первого дня применения
Фотолона и в течение последующих 3 (трех) суток открытые поверхности
тела следует обрабатывать фотозащитным кремом, а также соблюдать специальный
световой режим. Введение препарата следует проводить в затемненном помещении. В
период лечения необходимо избегать прямого солнечного и ультрафиолетового
излучения. Пациент должен быть проинструктирован о необходимости на время
ограничить воздействие прямого и рассеянного солнечного света, просмотр
телевизора и т. д.
Проведение
сеансов ФДТ с препаратом Фотолон у пациентов с порфирией противопоказано.
Облучение
лазером производится методом кругового поля или с использованием фигурных масок
из светонепроницаемого материала. Обязательно производится защита окружающих
здоровых тканей с использованием экранов из светонепроницаемых материалов.
Облучение опухолей, расположенных параорбитально, проводится аккуратно с
использованием специальных приспособлений для защиты глазного яблока от
повреждающего действия лазерного света. После ФДТ параорбитальной области, для
уменьшения отека и защиты окружающих тканей возможно местное применение
кортикостероидных препаратов (в форме глазных капель), а также НПВП.
При
лечении новообразований кожи и слизистых, как правило, на 7–10 сутки после
сеанса ФДТ в зоне воздействия формируется плотный струп, спаянный с подлежащими
тканями. Некротические струпы самостоятельно отторгаются на 30–60 сутки,
иногда необходимо иссечение некротических корок, т. к. длительно
существующие струпы поддерживают воспалительный процесс. Для ускорения роста
грануляционной ткани и усиления эпителизации раневого дефекта используются
мазевые препараты, обладающие противовоспалительными и репаративными
свойствами. В некоторых ситуациях для размягчения и более быстрого отторжения
струпа применяются ферментные препараты. Заживление ран происходит с хорошим
функциональным и косметическим эффектом в течение 30–60 суток после ФДТ.
Во
время сеансов ФДТ у больных часто отмечаются жжение и боли в зоне облучения
различной степени интенсивности. Для купирования болевого синдрома используются
наркотические и ненаркотические анальгетики, НПВП в сочетании с седативными
средствами в обычных терапевтических дозах. Болевые ощущения у больных могут
сохраняться до 3–5 суток после ФДТ.
При
лечении рака легкого через 3–7 суток после ФДТ целесообразно проводить
бронхоскопию для оценки степени повреждения опухоли и определения необходимости
удаления некротических фрагментов, санации трахеобронхиального дерева.
При
лечении заболеваний вульвы целесообразно производить обработку поверхности
вульвы синтазоновой мазью и другими противовоспалительными препаратами в
течение нескольких дней с наложением компрессов с 5% раствором
диметилсульфоксида.
ФДТ
при псориазе возможно использовать как в виде монотерапии, так и в сочетании с
классическими медикаментозными методами лечения. Возможно проведение лечения в
амбулаторных условиях.
У
пациентов с легкой и умеренной почечной/печеночной недостаточностью, а также у
пожилых пациентов коррекция указанных выше режимов дозирования не требуется.
Проведение сеансов ФДТ с Фотолоном противопоказано у больных с тяжелой
почечной/печеночной недостаточностью в стадии декомпенсации.
У
пациентов с сопутствующими заболеваниями сердечно-сосудистой системы при
проведении сеансов ФДТ с препаратом Фотолон возможно повышение артериального
давления, сердцебиение, тахикардия. При необходимости показана симптоматическая
терапия. Применение препарата у пациентов с заболеваниями сердечно-сосудистой
системы в стадии декомпенсации противопоказано.
Форма выпуска
Лиофилизат
для приготовления раствора для инфузий 25 мг, 50 мг, 100 мг.
По
25 мг, 50 мг, 100 мг действующего вещества во флаконах из стекла
I, II гидролитического класса вместимостью 20 мл, 50 мл,
100 мл соответственно.
Флаконы
укупоривают пробками резиновыми и обкатывают колпачками алюминиевыми или
комбинированными или алюмопластиковыми или алюминиевыми с пластиковой
накладкой.
На
каждый флакон наклеивают этикетку самоклеящуюся.
Флакон
вместе с инструкцией по применению помещают в пачку из картона.
Условия отпуска из аптек
Условия хранения
В
защищенном от света месте при температуре не выше 8 °C.
Хранить
в недоступном для детей месте.
Условия транспортирования
В
защищенном от света месте при температуре не выше 8 °C.
Допускается
транспортирование при температуре не выше 25 °C в течение не более
7 суток (однократно).
Срок годности
3 года.
Не
использовать по истечении срока годности, указанного на упаковке.

