Скайризи — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006460
Торговое наименование:
Скайризи
Международное непатентованное или группировочное наименование
Рисанкизумаб
Лекарственная форма
Раствор для подкожного введения
Состав
В 1 шприце 0,83 мл содержится:
действующее вещество: рисанкизумаб – 75,0 мг;
вспомогательные вещества: сорбитол, натрия сукцинат гексагидрат, янтарная кислота, полисорбат 20, вода для инъекций.
Описание
Прозрачный или слегка опалесцирующий, бесцветный или слегка желтоватый раствор. Допускается наличие небольших полупрозрачных аморфных белковых включений.
Фармакотерапевтическая группа
Иммунодепрессанты, интерлейкина ингибиторы
Код АТХ
L04AC18
Фармакологические свойства
Механизм действия
Рисанкизумаб – это гуманизированное моноклональное антитело иммуноглобулина G1 (IgGl), которое селективно и с высокой аффинностью связывается с субъединицей р19 цитокина интерлейкина-23 (ИЛ-23) человека и ингибирует его взаимодействие с рецептором ИЛ-23. ИЛ-23 – это естественный цитокин, участвующий в воспалительном и иммунном ответе. ИЛ-23 способствует образованию, поддержанию числа и активации Th17-лимфоцитов, которые вырабатывают ИЛ-17-А, ИЛ-17F и ИЛ-22, а также другие провоспалительные цитокины и играют важную роль в патогенезе аутоиммунных заболеваний, в частности, псориаза. У пациентов с бляшечным псориазом уровень ИЛ-23 повышен в пораженной заболеванием коже. Предотвращая связывание ИЛ-23 с его рецептором, рисанкизумаб ингибирует сигнальный путь и высвобождение провоспалительных цитокинов.
Рисанкизумаб не связывается с человеческим ИЛ-12, который имеет общую с ИЛ-23 субъединицу р40.
Фармакодинамика
Согласно данным исследования, однократное введение рисанкизумаба пациентам с псориазом приводит к снижению в коже экспрессии генов, связанных с иммунной осью ИЛ-23/ИЛ-17. В псориатических поражениях также наблюдалось уменьшение толщины эпидермиса, воспалительной инфильтрации и экспрессии маркеров псориаза.
Фармакокинетика
Всасывание
Рисанкизумаб характеризуется линейной фармакокинетикой с дозозависимым повышением экспозиции в диапазоне доз от 18 до 300 мг и от 0,25 до 1 мг/кг при подкожном введении, а также от 200 до 1200 мг и от 0,01 до 5 мг/кг при внутривенном введении.
После подкожного введения рисанкизумаба максимальная концентрация в плазме была достигнута через 3-14 дней, предполагаемая абсолютная биодоступность составила 89%. Подсчитано, что средняя максимальная концентрация в состоянии равновесия и остаточная концентрация препарата в плазме крови составляют 12 и 2 пг/мл соответственно при следующем режиме введения пациентам с псориазом: 150 мг на неделе 0, 4 и каждые 12 недель после этого.
Распределение
У типичного пациента с псориазом и массой тела 90 кг объем распределения в равновесном состоянии (Vss) составляет 11,2 л, что указывает на то, что распределение рисанкизумаба в основном ограничивается сосудистым и интерстициальным пространством.
Метаболизм
Терапевтические моноклональные антитела IgG обычно разлагаются на мелкие пептиды и аминокислоты в результате катаболизма подобно эндогенным IgG. Рисанкизумаб не метаболизируется ферментами цитохрома Р450.
Выведение
Для типичного пациента с псориазом и массой тела 90 кг, системный клиренс (CL) рисанкизумаба составляет 0,31 л/день, а терминальный период полувыведения – 28 дней. Не предполагается, что рисанкизумаб подвергается клубочковой фильтрации или выделяется с мочой в виде интактной молекулы.
Взаимодействие с другими лекарственными средствами
Исследование лекарственных взаимодействий проводилось у пациентов с бляшечным псориазом для оценки влияния многократного введения рисанкизумаба на фармакокинетику маркерных субстратов, чувствительных к цитохрому Р450 (CYP). Экспозиция кофеина (субстрат CYP1A2), варфарина (субстрат CYP2C9), омепразола (субстрат CYP2C19), метопролола (субстрат CYP2D6) и мидазолама (субстрат CYP3A) при введении рисанкизумаба было сопоставимо с их экспозицией до введения рисанкизумаба. Это указывает на отсутствие клинически значимых лекарственных взаимодействий с помощью данных ферментов.
Результаты популяционного фармакокинетического анализа показали, что на экспозицию рисанкизумаба не влияли сопутствующие препараты (метформин, аторвастатин, лизиноприл, амлодипин, ибупрофен, ацетилсалицилат и левотироксин), которые использовали некоторые пациенты с бляшечным псориазом во время клинических исследований (см. раздел «Взаимодействие с другими лекарственными средствами»).
Особые группы пациентов
Дети
Фармакокинетика рисанкизумаба у детей не изучалась.
Пожилые пациенты
Из 2234 пациентов с бляшечным псориазом, получавших терапию препаратом Скайризи, 243 пациента были старше 65 лет, а 24 пациента – старше 75 лет. В целом не было выявлено различий в безопасности и эффективности терапии препаратом Скайризи между пациентами более старшего и более молодого возраста (см. раздел «Способ применения и дозы»).
Пациенты с нарушением функции почек или печени
Специальные исследования для определения влияния почечной или печеночной недостаточности на фармакокинетику рисанкизумаба не проводились. Согласно данным популяционного фармакокинетического анализа, уровни креатинина в сыворотке крови, клиренс креатинина или маркеры функции печени (АЛТ/АСТ/билирубин) не оказывали значимого влияния на клиренс рисанкизумаба у пациентов с псориазом.
Поскольку рисанкизумаб является моноклональным антителом IgGl, в основном он выводится при внутриклеточном катаболизме. Ожидается, что рисанкизумаб не подвергается метаболизму с помощью ферментов цитохрома Р450 или элиминации почками (см. раздел «Способ применения и дозы»).
Масса тела
Клиренс рисанкизумаба и объем его распределения увеличиваются с зависимости от увеличения массы тела. Однако клинически значимые изменения параметров эффективности и безопасности рисанкизумаба при увеличении массы тела не наблюдались, поэтому коррекция дозы на основании массы тела не требуется.
Пол, раса
Пол, раса не оказывали клинически значимого влияния на клиренс рисанкизумаба у взрослых пациентов с бляшечный псориазом. Согласно данным клинического исследования по изучению фармакокинетики, у пациентов из Китая и Японии, не наблюдались клинически значимые различия концентраций рисанкизумаба в плазме крови по сравнению с пациентами европеоидной расы.
Краткая информация о клинических исследованиях
Эффективность и безопасность препарата Скайризи изучалась у 2109 пациентов со среднетяжелым и тяжелым псориазом (статичная общая оценка врачом sPGA ≥3 и индекс тяжести и площади поражения PASI ≥12) в 4-х многоцентровых, рандомизированных, двойных слепых исследованиях (ULTIMMA-1, ULTIMMA-2, IMMHANCE, and IMMVENT).
У 9,8% пациентов отмечался сопутствующий псориатический артрит в анамнезе, 42,1% – до включения в исследование получали лечение другим биологическим препаратом. В исследованиях ULTIMMA-1 и ULTIMMA-2 по всем первичным и вторичным конечным точкам [статичная общая оценка врачом «чисто» или «почти чисто» (sPGA 0/1), статичная общая оценка врачом «чисто» (sPGA 0), PASI 75, PASI 90 и PASI 100] отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с плацебо и устекинумабом на неделях 16 и 52. Улучшение на фоне лечения препаратом Скайризи также наблюдалось со стороны псориаза волосистой части головы, ногтей, ладоней и стоп.
Среди пациентов, достигших sPGA 0/1 на неделе 28 в исследовании IMMHANCE, 87,4% поддерживали ответ к неделе 52 при непрерывной терапии препаратом Скайризи по сравнению с 61,3%, кто получил последнюю дозу препарата на неделе 16 (ре-рандомизация на неделе 28).
В исследовании IMMVENT по конечным точкам sPGA 0/1, PASI 75, PASI 90 и PASI 100 отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с адалимумабом на неделе 16. У пациентов с недостаточным ответом на адалимумаб на неделе 16 (PASI 50 – <PASI 90) переключение на лечение препаратом Скайризи позволило достигнуть достоверно лучших результатов по параметрам sPGA 0, sPGA 0/1, PASI 90 и PASI 100 на неделе 44 по сравнению с продолжением терапии адалимумабом.
Показания для применения
- Препарат Скайризи показан для лечения бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов.
- Препарат Скайризи показан в качестве монотерапии или в комбинации с базисными противовоспалительными препаратами (БПВП) для лечения активного псориатического артрита у взрослых пациентов.
Противопоказания
- Тяжелые реакции гиперчувствительности к рисанкизумабу или к другим вспомогательным веществам препарата;
- Активная форма туберкулеза;
- Детский возраст до 18 лет (эффективность и безопасность не изучены).
С осторожностью
- Необходимо соблюдать осторожность при применении препарата Скайризи у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
- Не следует проводить вакцинацию живыми вакцинами на фоне терапии препаратом Скайризи. Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении препарата Скайризи у беременных женщин ограничены. Полученных данных недостаточно для информирования о рисках, связанных с применением данного лекарственного препарата.
Данные, полученные в ходе исследований на животных
Проводилось расширенное исследование токсического воздействия на пре- и постнатальное развитие на яванских макаках. Каждую неделю с 20-го дня беременности до момента родоразрешения яванским макакам вводили подкожные инъекции рисанкизумаба в дозах 5 или 50 мг/кг. Дальнейшее наблюдение за самками и детенышами продолжалось в течение 6 месяцев (180 дней) после родоразрешения. Указанные дозы приводили к экспозиции, приблизительно в 70 раз превышающей клиническое воздействие при максимально рекомендуемой для человека дозе (МРДЧ). Не наблюдалось связанных с применением препарата случаев смерти и/или пороков развития плода/новорожденного. Влияние на рост и развитие новорожденного отсутствовало, оценка которого включала внешние, висцеральные, скелетные и нейроповеденческие параметры и конечные точки токсического воздействия на иммунную систему. У детенышей отмечалось дозозависимое повышение средней концентрации препарата в сыворотке крови, которая составляла около 20-90% от средней концентрации в организме самки. После родоразрешения у большинства взрослых самок яванских макак и всех детенышей в группах применения рисанкизумаба отмечалась определяемая концентрация рисанкизумаба в сыворотке крови в течение периода до 91 дня. Через 180 дней после родоразрешения концентрация рисанкизумаба в сыворотке крови была ниже определяемого уровня.
Период грудного вскармливания
Нет данных о проникновении рисанкизумаба в грудное молоко, о воздействии препарата на ребенка в период грудного вскармливания или на выработку молока. Учитывая то, что человеческий IgG выделяется в грудное молоко, опубликованные данные свидетельствуют о том, что антитела в грудном молоке не попадают в кровоток ребенка в значимых количествах.
Способ применения и дозы
Для подкожного введения.
Пациенты могут самостоятельно вводить препарат Скайризи после соответствующего обучения технике подкожных инъекций.
Пациентов следует проинформировать о том, что необходимо ввести 2 предварительно заполненных шприца для достижения дозы 150 мг и ознакомиться с инструкцией по применению перед введением препарата. Каждый предварительно заполненный шприц предназначен только для одноразового использования.
Инъекция каждой дозы должна производиться в разные анатомические участки (в область бедер или живота). Следует избегать чувствительных, поврежденных, эритематозных и уплотненных участков, а также участков, пораженных псориазом. Введение препарата Скайризи в верхнюю часть наружной поверхности плеча должно выполняться только лицом, осуществляющим уход за пациентом, или медицинским работником.
Перед проведением инъекции необходимо достать упаковку препарата Скайризи из холодильника и довести ее до комнатной температуры в течение 15-30 минут, избегая прямых солнечных лучей, не вынимая шприцы из коробки.
Любые неиспользованные лекарственные средства или отходы должны быть утилизированы в соответствии с местными требованиями.
Рекомендуемая доза
Рекомендуемая доза препарата Скайризи – 150 мг (в виде двух подкожных инъекций по 75 мг единовременно) на неделе 0, неделе 4 и далее каждые 12 недель.
Пропуск дозы
В случае пропуска дозы препарата Скайризи необходимо ввести дозу как можно скорее. Затем следует возобновить введение доз согласно установленному графику.
Особые группы пациентов
Дети
Отсутствуют данные по безопасности и эффективности применения препарата Скайризи у детей в возрасте до 18 лет.
Пациенты пожилого возраста
Коррекция дозы не требуется (см. раздел «Фармакологические свойства»).
Пациенты с нарушением функции почек ши печени
Не было проведено специальных исследований для определения влияния почечной или печеночной недостаточности на фармакокинетику препарата Скайризи. Данные состояния, как правило, не должны оказывать существенного влияния на фармакокинетику моноклональных антител. Коррекция дозы не требуется (см. раздел «Фармакологические свойства»).
Инструкция по подготовке и проведению инъекции препарата Скайризи в однодозовом шприце
 Перед проведением инъекции препаратом Скайризи необходимо обязательно ознакомиться с указанной ниже информацией.
Перед проведением инъекции препаратом Скайризи необходимо обязательно ознакомиться с указанной ниже информацией.
- Прежде чем проводить инъекцию, необходимо пройти обучение по введению препарата Скайризи. Для этого необходимо обратиться к лечащему врачу.
- Рекомендуется отмечать в своем календаре, когда Вам нужно вводить препарат Скайризи.
- До момента использования препарат Скайризи необходимо хранить в оригинальной упаковке в защищенном от света месте.
- Нельзя использовать препарат в случае:
— если раствор мутный и содержит крупные хлопья или частицы (раствор должен быть прозрачным или слегка желтоватым и может содержать небольшие полупрозрачные частицы); истечения срока годности;
— если препарат был заморожен (даже если впоследствии он был разморожен);
— падения или повреждения шприца;
— если защитная пленка блистера, где находятся шприцы, повреждена или отсутствует. - Не снимайте колпачок иглы до непосредственного введения инъекции.
- Перед проведением инъекции необходимо достать упаковку препарата Скайризи из холодильника и довести ее до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение 15-30 минут, избегая прямых солнечных лучей. Не вынимайте шприцы из картонной пачки до тех пор, пока не будете готовы выполнить инъекцию. Не нагревайте препарат Скайризи любым другим способом, например, в микроволновой печи или в горячей воде.
- Следуйте инструкциям, изложенным ниже, каждый раз, когда используете препарат Скайризи.
ШАГ 1
 Поместите следующие предметы на чистую плоскую поверхность:
Поместите следующие предметы на чистую плоскую поверхность:
- 2 одноразовых шприца и 2 спиртовые салфетки;
- 2 ватных тампона или 2 марлевые салфетки;
- специальный контейнер для утилизации.
Вымойте и вытрите руки.
Начните с одного шприца для первой инъекции.
Для введения полной дозы требуется 2 инъекции, выполненные поочередно.
ШАГ 2
 Выберите место для инъекции:
Выберите место для инъекции:
- передняя часть левого бедра;
- передняя часть правого бедра;
- нижняя часть живота, за исключением области вокруг пупка диаметром 5 см.
При выполнении второй инъекции следует отступать не менее чем на 3 см от области предыдущей инъекции.
НЕ вводите препарат в то же место.
Перед каждой инъекцией необходимо протирать место инъекции спиртовой салфеткой круговыми движениями.
- НЕ вводите препарат через одежду.
- НЕ вводите препарат в воспаленную, поврежденную кожу, в места с покраснениями и уплотнениями, а также в шрамы или растяжки.
- НЕ вводите препарат в места, пораженные псориазом.
ШАГ 3
 Держите шприц с закрытой иглой вниз, как показано на рисунке.
Держите шприц с закрытой иглой вниз, как показано на рисунке.
Осмотрите раствор в шприце.
- Наличие пузырьков в шприце является нормой.
- Раствор должен быть прозрачным или слегка желтым и может содержать мелкие белые или прозрачные частицы.
- НЕ вводите препарат, если раствор мутный и содержит крупные хлопья или частицы.
ШАГ 4
 Снятие колпачка иглы:
Снятие колпачка иглы:
- Держите шприц в одной руке.
- Другой рукой аккуратно снимите колпачок иглы.
- Возможно на конце иглы появится капля жидкости. Это нормально.
- Выбросьте колпачок иглы.
- НЕ прикасайтесь к игле пальцами и не допускайте соприкосновения кончика иглы с какой-либо поверхностью.
ШАГ 5
 Держите корпус шприца одной рукой между большим и указательным пальцем, как карандаш.
Держите корпус шприца одной рукой между большим и указательным пальцем, как карандаш.
Слегка сожмите подготовленное место инъекции другой рукой и крепко удерживайте его.
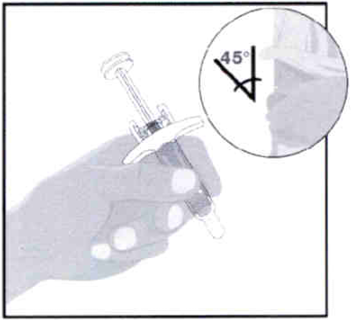
Быстрым движением полностью введите иглу в кожу под углом примерно 45°.
Удерживайте положение шприца под тем же углом.
ШАГ 6
 Медленно нажимайте на поршень пока весь раствор не будет введен.
Медленно нажимайте на поршень пока весь раствор не будет введен.
Извлеките иглу из кожи под тем же углом, под которым производилось введение.
Медленно отведите большой палец от поршня. Игла закроется защитным колпачком.
- Защитный колпачок иглы не активируется, пока не будет введена вся жидкость
- Обратитесь к своему лечащему врачу, если считаете, что не ввели полную дозу
Прижмите ватный тампон или марлевую салфетку к месту инъекции в течение 10 секунд.
Не растирайте место введения после завершения инъекции. Может возникнуть небольшое кровотечение из места инъекции. Это нормально.
ШАГ 7
 Для введения полной дозы требуется 2 инъекции, выполненные поочередно.
Для введения полной дозы требуется 2 инъекции, выполненные поочередно.
- Повторите шаги 2-6 со при введении второй инъекции
- После первой инъекции необходимо сразу сделать инъекцию вторым шприцом
ШАГ 8
 Поместите использованные шприцы в специальный контейнер для утилизации.
Поместите использованные шприцы в специальный контейнер для утилизации.
- Не выбрасывайте использованные шприцы вместе с бытовыми отходами
- Ваш врач или медсестра расскажут вам, как вернуть специальный контейнер для полной утилизации.
Побочное действие
Опыт клинических исследований
В клинических исследованиях принимало участие 2234 пациентов с бляшечным псориазом, которым вводили препарат Скайризи (2167 пациенто-лет применения). Из всех участников 1208 пациентов с псориазом получали терапию препаратом Скайризи в течение не менее одного года.
Данные плацебо-контролируемых исследований и исследований с активным контролем были объединены для оценки безопасности применения препарата Скайризи в течение 16 недель. Всего были оценены результаты терапии 1306 пациентов в группе применения препарата Скайризи в дозе 150 мг. Серьезные нежелательные реакции были отмечены у 2,4% в группе применения препарата Скайризи (9,9 явлений на 100 пациенто-лет) по сравнению с 4,0% в группе плацебо (17,4 явления на 100 пациенто-лет), 5,0% в группе применения устекинумаба (18,4 явления на 100 пациенто-лет) и 3,0% для группы адалимумаба (14,7 явления на 100 пациенто-лет).
В таблице 1 приведены нежелательные реакции, отмеченные во время проведения клинических исследований с применением препарата Скайризи, которые были классифицированы в соответствии с классами систем органов MedDRA. Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до 1/100); редко (≥1/10000 до 1/1000); очень редко (<1/10000).
Таблица 1. Список нежелательных реакций, отмеченных в клинических исследованиях
| Класс систем органов | Частота развития | Нежелательные реакции |
| Инфекционные и паразитарные заболевания | Очень часто | Инфекции верхних дыхательных путейa |
| Часто | Дерматомикозb | |
| Нечасто | Фолликулит | |
| Нарушения со стороны нервной системы | Часто | Головная больc |
| Общие нарушения и реакции в месте введения | Часто | Утомляемостьd Реакция в месте введенияe |
| a Включает: инфекцию дыхательных путей (вирусная, бактериальная или неуточненная), синусит (в том числе острый), ринит, назофарингит, фарингит (в том числе вирусный), тонзиллит. b Включает: грибковое поражение кожи стоп, трихофитию промежности, дерматофитию туловища, отрубевидный лишай, грибковую инфекцию рук c Включает: головную боль, головную боль напряжения, синусовую головную боль d Включает: утомляемость, общую слабость. e Включает: синяк в месте инъекции, эритему, гематому, кровоизлияние, инфекцию, воспаление, раздражение, боль, зуд, кожную реакцию, отек |
Описание отдельных нежелательных реакций
Инфекции
Инфекции наблюдались у 22,1% пациентов, принимавших препарат Скайризи (90,8 случаев на 100 пациенто-лет), по сравнению с 14,7% в группе плацебо (56,5 случаев на 100 пациенто-лет), 20,9% в группе устекинумаба (87,0 случаев на 100 пациенто-лет) и 24,3% в группе адалимумаба (104,2 случаев на 100 пациенто-лет). Большинство нежелательных реакций были несерьезными, легкой или средней степени тяжести и не приводили к прекращению введения препарата Скайризи.
На протяжении всей программы исследований применения препарата при псориазе, учитывая длительное воздействие препарата Скайризи, частота инфекций (75,5 случаев на 100 пациенто-лет) была аналогична наблюдаемой в течение первых 16 недель терапии.
Профиль безопасности препарата Скайризи при длительном применении
На 52-й неделе терапии частота развития нежелательных реакций была аналогична профилю безопасности, наблюдаемому в течение первых 16 недель терапии. В течение 52 недель, скорректированная по объему применения частота развития серьезных нежелательных явлений на 100 пациенто-лет составляла 9,4 для пациентов, получавших препарат Скайризи, и 10,9 для пациентов, получавших устекинумаб. У пациентов, получавших терапию препаратом Скайризи в течение наиболее продолжительного периода времени (77 недель), не было выявлено новых нежелательных реакций по сравнению с первыми 16 неделями терапии.
Иммуногенность
Как и для всех терапевтических белков, введение рисанкизумаба может вызвать развитие иммуногенности. Обнаружение антител в значительной степени зависит от чувствительности и специфичности метода анализа. Кроме того, частота положительного результата на обнаружение антител (включая нейтрализующие антитела) может быть обусловлена влиянием нескольких факторов, таких как методология метода анализа, обработка образцов проб, время сбора проб, сопутствующая лекарственная терапия и сопутствующие заболевания. По этим причинам сравнение частоты выявления антител к рисанкизумабу с таковой в исследованиях других лекарственных препаратов может вводить в заблуждение.
В рамках клинических исследований применения препарата при псориазе было выявлено, что доля пациентов, получавших терапию в рекомендуемой клинической дозе в течение 52 недель и выработавших к препарату антитела и нейтрализующие антитела составила 24% (263/1079) и 14% (150/1079) соответственно.
Присутствие антител к рисанкизумабу, а также нейтрализующих антител не было связано с изменениями клинического ответа или безопасности применения препарата.
Передозировка
В случае передозировки рекомендуется наблюдение за пациентами на предмет выявления признаков и симптомов нежелательных реакций. При необходимости следует незамедлительно провести симптоматическую терапию.
Взаимодействие с другими лекарственными средствами
Препарат Скайризи не подвергается почечной элиминации или метаболизму печеночными ферментами. Не выявлено лекарственного взаимодействия между препаратом Скайризи и ингибиторами/индукторами ферментов, матаболизирующих препарат.
Согласно результатам исследования лекарственных взаимодействий у пациентов с бляшечный псориазом и результатам популяционного фармакокинетического анализа рисанкизумаб не вызывал лекарственных взаимодействий или не подвергался им (см. раздел «Фармакологические свойства»).
При одновременном введении рисанкизумаба и субстратов цитохрома Р450 коррекция дозы не требуется.
Особые указания
Инфекции
Применение препарата Скайризи может повышать риск развития инфекций.
Следует соблюдать осторожность при применении препарата Скайризи у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. Необходимо тщательно контролировать состояние пациента, у которого развивается инфекция или который не отвечает на стандартную терапию. Терапию препаратом Скайризи не следует проводить до тех пор, пока не исчезнут клинические симптомы инфекционного заболевания.
Туберкулез
На протяжении клинических исследований III фазы 72-ум пациентам с псориазом и латентной формой туберкулеза одновременно проводилась терапия препаратом Скайризи и была назначена соответствующая профилактическая терапия туберкулеза, при этом, в течение среднего периода наблюдения (61 неделя) ни у одного пациента не развился активный туберкулез. Пациентам с латентным туберкулезом следует провести противотуберкулезную терапию до начала терапии препаратом Скайризи.
Не следует назначать терапию препаратом Скайризи пациентам с активной формой туберкулеза.
Вакцинация
Перед началом терапии препаратом Скайризи необходимо провести соответствующую возрасту вакцинацию согласно действующим рекомендациям по иммунопрофилактике. Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Скайризи. Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Скайризи не оказывает влияния или оказывает незначительное влияние на способность к вождению транспортных средств и управлению механизмами.
Форма выпуска
Раствор для подкожного введения 75 мг/0,83 мл.
По 0,83 мл в однодозовые шприцы из бесцветного стекла типа I.
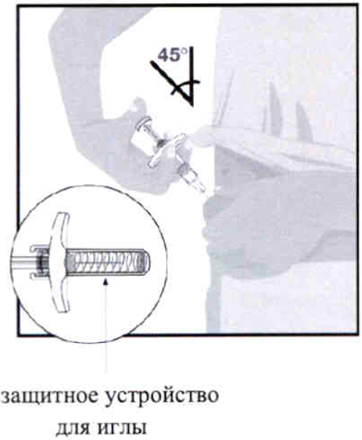
Шприцы оснащены защитным устройством для иглы.
По 1 шприцу в блистере из пластика и бумаги.
По 2 блистера и 2 салфетки, пропитанные изопропиловым спиртом, вместе с инструкцией по применению в пачке картонной или по 2 блистера вместе с инструкцией по применению в пачке картонной.
Срок годности
2 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия хранения
При температуре от 2 до 8 °С в оригинальной упаковке для защиты от света.
Не замораживать.
Хранить в местах, недоступных для детей.
Условия отпуска
Отпускают по рецепту.
Производитель
Производитель готовой лекарственной формы, фасовщик (первичная упаковка)
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ / Boehringer Ingelheim Pharma Gmbh & Co.KG
Биркендорфер Штрассе 65, 88397 Биберах-на-Риссе, Германия / Birkendorfer Str. 65, 88397 Biberach a.d.R, Germany
Упаковщик (вторичная упаковка), выпускающий контроль качества
ЭббВи С.Р.Л./ Abb Vie S.R.L.
С.Р. 148 Понтина 52 км с.н.к. – 04011 Камповерде ди Априлиа (ЛТ), Италия / S.R. 148 Pontina 52 km s.n.c. – 04011 Campoverde di Aprilia (LT), Italy
Владелец регистрационного удостоверения / Организация, принимающая претензии от потребителей:
ООО «ЭббВи», Россия
125196, г. Москва, ул. Лесная, д.7, БЦ «Белые Сады», здание «А»
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Скайризи (Skyrizi)
💊 Состав препарата Скайризи
✅ Применение препарата Скайризи
Описание активных компонентов препарата
Скайризи
(Skyrizi)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.01.27
Владелец регистрационного удостоверения:
Код ATX:
L04AC18
(Рисанкизумаб)
Лекарственная форма
| Скайризи |
Р-р д/п/к введения 75 мг/0.83 мл: шприцы 2 шт. рег. №: ЛП-006460 |
Форма выпуска, упаковка и состав
препарата Скайризи
Раствор для п/к введения прозрачный или слегка опалесцирующий, бесцветный или слегка желтоватый; допускается наличие небольших полупрозрачных аморфных белковых включений.
Вспомогательные вещества: сорбитол, натрия сукцината гексагидрат, янтарная кислота, полисорбат 20, вода д/и.
0.83 мл — шприцы однодозовые из бесцветного стекла типа I (1) с защитным устройством для иглы — блистеры (2) — пачки картонные×.
0.83 мл — шприцы однодозовые из бесцветного стекла типа I (1) с защитным устройством для иглы — блистеры (2) в комплекте с салфетками (2 шт.), пропитанными 70% изопропиловым спиртом — пачки картонные×.
× пачка может быть снабжена стикером для контроля первого вскрытия.
Фармакологическое действие
Средство для лечения псориаза, гуманизированное моноклональное антитело иммуноглобулина G1, которое селективно и с высокой аффинностью связывается с субъединицей p19 цитокина интерлейкина-23 (ИЛ-23) человека и ингибирует его взаимодействие с рецептором ИЛ-23. ИЛ-23 — это естественный цитокин, участвующий в воспалительном и иммунном ответе. ИЛ-23 способствует образованию, поддержанию числа и активации Th17-лимфоцитов, которые вырабатывают ИЛ-17А, ИЛ-17F и ИЛ-22, а также другие провоспалительные цитокины и играют важную роль в патогенезе аутоиммунных заболеваний, в частности, псориаза. У пациентов с бляшечным псориазом уровень ИЛ-23 повышен в пораженной заболеванием коже. Предотвращая связывание ИЛ-23 с его рецептором, рисанкизумаб ингибирует сигнальный путь и высвобождение провоспалительных цитокинов.
Рисанкизумаб не связывается с человеческим ИЛ-12, который имеет общую с ИЛ-23 субъединицу p40.
Согласно данным исследования, однократное введение рисанкизумаба пациентам с псориазом приводит к снижению в коже экспрессии генов, связанных с иммунной осью ИЛ-23/ИЛ-17. В псориатических поражениях также наблюдалось уменьшение толщины эпидермиса, воспалительной инфильтрации и экспрессии маркеров псориаза.
Фармакокинетика
Рисанкизумаб характеризуется линейной фармакокинетикой с дозозависимым повышением экспозиции в диапазоне доз от 18 до 300 мг и от 0.25 до 1 мг/кг при п/к введении, а также от 200 до 1200 мг и от 0.01 до 5 мг/кг при в/в введении.
После п/к введения рисанкизумаба Cmax в плазме достигается через 3-14 дней, предполагаемая абсолютная биодоступность составляет 89%. Подсчитано, что средняя Cmax в состоянии равновесия и остаточная концентрация препарата в плазме крови составляют 12 и 2 пг/мл соответственно при следующем режиме введения пациентам с псориазом: 150 мг на неделях 0, 4 и каждые 12 недель после этого.
У типичного пациента с псориазом и массой тела 90 кг Vd в равновесном состоянии составляет 11.2 л, что указывает на то, что распределение рисанкизумаба в основном ограничивается сосудистым и интерстициальным пространством.
Терапевтические моноклональные антитела IgG обычно разлагаются на мелкие пептиды и аминокислоты в результате катаболизма подобно эндогенным IgG.
Для типичного пациента с псориазом и массой тела 90 кг, системный клиренс рисанкизумаба составляет 0.31 л/сут, а терминальный T1/2 — 28 дней.
Не предполагается, что рисанкизумаб подвергается клубочковой фильтрации или выделяется с мочой в виде неизмененного вещества.
Показания активных веществ препарата
Скайризи
Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов; в качестве монотерапии или в комбинации с базисными противовоспалительными препаратами (БПВП) для лечения активного псориатического артрита у взрослых пациентов.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Рекомендуемая доза рисанкизумаб — 150 мг (в виде двух п/к инъекций по 75 мг единовременно) на неделе 0, неделе 4 и далее каждые 12 недель.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто — инфекции верхних дыхательных путей; часто — дерматомикоз; нечасто — фолликулит.
Со стороны нервной системы: часто — головная боль.
Общие нарушения: часто — утомляемость, реакция в месте введения.
Противопоказания к применению
Тяжелые реакции повышенной чувствительности к рисанкизумабу;
активная форма туберкулеза; детский возраст до 18 лет.
С осторожностью
Хронические инфекции или наличием в анамнезе рецидивирующей инфекции.
Не следует проводить вакцинацию живыми вакцинами на фоне терапии рисанкизумабом.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
Специальных указаний по ограничению применения у пациентов пожилого возраста нет.
Особые указания
Применение рисанкизумаба может повышать риск развития инфекций.
Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. Необходимо тщательно контролировать состояние пациента, у которого развивается инфекция или который не отвечает на стандартную терапию. Терапию рисанкизумабом не следует проводить до тех пор, пока не исчезнут клинические симптомы инфекционного заболевания.
Пациентам с латентным туберкулезом следует провести противотуберкулезную терапию до начала терапии рисанкизумабом.
Перед началом терапии рисанкизумабом необходимо провести соответствующую возрасту вакцинацию согласно действующим рекомендациям по иммунопрофилактике. Не следует проводить иммунизацию живыми вакцинами в ходе лечения рисанкизумабом.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
- В исследованиях KEEPsAKE-1 и KEEPsAKE-2 57% и 51% пациентов, получавших рисанкизумаб, достигли первичной конечной точки ответа ACR20 на 24 неделе, соответственно, по сравнению с 34% и 27%, получавшими плацебо (p <0,001)1
- В KEEPsAKE-1 и KEEPsAKE-2 оценивали терапию рисанкизумабом у взрослых пациентов с активным псориатическим артритом, у которых наблюдался неадекватный ответ на генно-инженерные биологические (ГИБП) и/или базисные противовоспалительные препараты (БПВП)1
- Профиль безопасности рисанкизумаба соответствовал профилю безопасности, показанному в предыдущих исследованиях применения препарата у пациентов с псориазом1-4
- СКАЙРИЗИ (рисанкизумаб) – ингибитор интерлейкина-23 (ИЛ-23) – показан для лечения бляшечного псориаза среднетяжелой и тяжелой степени и активного псориатического артрита у взрослых пациентов13
МОСКВА, Россия, 28 мая 2021 года – Глобальная научно-исследовательская биофармацевтическая компания AbbVie объявила о положительных результатах исследований KEEPsAKE-1 and KEEPsAKE-2 фазы 3, в которых большинство пациентов с активным псориатическим артритом, получавших в качестве терапии рисанкизумаб (150 мг), достигли первичной конечной точки ответа ACR20 на 24-й неделе в сравнении с плацебо1. В KEEPsAKE-1 и KEEPsAKE-2 57% и 51% пациентов, получавших рисанкизумаб, достигли ответа ACR20 на 24-й неделе соответственно в сравнении с 34% и 27% пациентов, получавших плацебо (р<0,001)1.
Тестирование ранжированных вторичных конечных точек исследований показало достоверно большие показатели очищения кожи (снижение не менее, чем на 90% индекса распространенности и тяжести псориаза (PASI 90)), улучшения физического состояния здоровья (изменение от исходного индекса инвалидизации по опроснику оценки состояния здоровья (HAQ-DI)) и достижения минимальной активности заболевания (MDA) на 24-й неделе1. В KEEPsAKE-1 и KEEPsAKE-2 фазы 3 проводилась оценка применения рисанкизумаба у взрослых пациентов с активным псориатическим артритом, у которых наблюдался неадекватный ответ на генно-инженерные биологические (ГИБП) и/или базисные противовоспалительные препараты (БПВП)1.
«Мы воодушевлены полученными результатами исследований, демонстрирующими потенциал рисанкизумаба в терапии псориатического артрита, — сказал Майкл Северино (Michael Severino), M.D., вице-председатель и президент компании AbbVie. — Данные результаты подчеркивают нашу приверженность к разработкам, которые в будущем предоставят практикующим врачам варианты терапии пациентов с иммунологическими заболеваниями».
|
Результаты KEEPsAKE-1 and KEEPsAKE-2 на 24 неделе*,1 |
||||
|
KEEPsAKE-1 |
KEEPsAKE-2 |
|||
|
рисанкизумаб |
плацебо |
рисанкизумаб |
плацебо |
|
|
ACR20a |
57% |
34% |
51% |
27% |
|
ACR50a,f |
33% |
11% |
26% |
9% |
|
ACR70a,f |
15% |
5% |
12% |
6% |
|
PASI 90b |
52% |
10% |
55% |
10% |
|
HAQ-DIc |
-0.31 |
-0.11 |
-0.22 |
-0.05 |
|
MDAd |
25% |
10% |
26% |
11% |
|
PsA-mTSSe,† |
0.23 |
0.32 |
N/A |
N/A |
|
* В обоих исследованиях ACR20 на 24 неделе был первичной конечной точкой, а PASI 90, HAQ-DI и MDA на 24 неделе были ранжированными вторичными конечными точками. Разница значений ACR20, PASI 90, HAQ-DI и MDA в группах рисанкизумаба и плацебо достигли уровня достоверности p <0,001. Показаны не все ранжированные вторичные конечные точки. |
|
a ACR20/50/70 определяется как снижение минимум на 20%/50%/70% от исходного числа болезненных и припухших суставов (ЧБС, ЧПС) и эквивалентное улучшение трех или более из пяти основных показателей Американской коллегии ревматологов: оценка пациентом боли, общая оценка пациентом активности болезни, физической функции, общая оценка врачом активности болезни и маркеров острой фазы воспаления. |
|
b PASI 90 определяется как снижение индекса распространенности и тяжести псориаза как минимум на 90%. Его оценивали у пациентов с исходной площадью поверхности тела (BSA) ≥3%. |
|
c HAQ-DI определяется как изменение оценки индекса инвалидизации по опроснику оценки состояния здоровья, который представляет собой опросник для пациента и включает вопросы, связанные с категориями: одежда и уход, питание, передвижение, гигиена, досягаемость и обычные повседневные действия. Пациентов спрашивают о том, с какими трудностями они сталкиваются при выполнении этих действий, а также об использовании вспомогательных средств и / или устройств. |
|
d MDA определяется как выполнение как минимум 5 из 7 критериев: ЧБС ≤1; ЧПС ≤1; PASI ≤1 или BSA-Ps ≤3; Числовая шкала оценки боли пациентом (NRS) ≤1,5; Активность PtGA-болезни NRS ≤2,0; Оценка HAQ-DI ≤0,5; и LEI (индекс энтезита Лидса) ≤1. |
|
e PsA -mTSS определяется как изменение модифицированного общего балла Sharp (mTSS) от исходного уровня. |
|
f ACR50 и ACR70 на 24 неделе были вторичными конечными точками и достигли номинальных значений p <0,05. Эти конечные точки не контролировались на множественные сравнения. |
|
† PsA-mTSS на 24 неделе был ранжированным вторичным критерием оценки, который не достиг статистической значимости (p = 0,496). Он не оценивался в KEEPsAKE-2.. |
В KEEPsAKE-1 ранжированная вторичная конечная точка PsA Sharp/van der Heijde Score (PsA-mTSS) составляла 0,23 и 0,32 на 24-й неделе в группах рисанкизумаба и плацебо, соответственно (p = 0,496 (примечание: более низкий балл означает более низкую рентгенологическую прогрессию)1.
В исследованиях KEEPsAKE-1 и KEEPsAKE-2 профиль безопасности рисанкизумаба на 24-й неделе в целом соответствовал данным безопасности, полученным в предыдущих исследованиях псориаза1-4. Серьезные нежелательные явления наблюдались у 2,5% и 4,0% пациентов, получавших рисанкизумаб в группах KEEPsAKE-1 и KEEPsAKE-2, соответственно, по сравнению с 3,7% и 5,5% в группе плацебо1. Частота возникновения серьезных инфекций была одинаковой между группами исследований (1% и 0,9% пациентов, получавших рисанкизумаб в группах KEEPsAKE-1 и KEEPsAKE-2, соответственно, и 1,2% и 2,3% пациентов, получавших плацебо)1. Частота нежелательных явлений, которые привели к отмене приема исследуемого препарата, составила 0,8% и 0,9% пациентов, получавших рисанкизумаб в группах KEEPsAKE-1 и KEEPsAKE-2, соответственно, по сравнению с 0,8% и 2,3% в группе плацебо1. В KEEPsAKE-1 был зарегистрирован один смертельный случай в группе рисанкизумаба, расцененный как не связанный с приемом исследуемого препарата1. В KEEPsAKE-2 о смертельных случаях не сообщалось1.
Полные результаты исследований KEEPsAKE будут представлены на предстоящих медицинских конференциях и опубликованы в рецензируемом медицинском журнале.
Скайризи (рисанкизумаб) — препарат, разработанный в рамках сотрудничества Boehringer Ingelheim и AbbVie. Глобальным коммерческим продвижением препарата Скайризи и ведением разработки занимается компания AbbVie.
О псориатическом артрите
Псориатический артрит — это гетерогенное системное воспалительное заболевание с характерными симптомами, поражающие многие органы и системы, включая суставы и кожу8,9. При псориатическом артрите происходит нарушение работы со стороны иммунной системы, вызывающее воспаление, которое может привести к боли, усталости, скованности суставов и вызвать покраснение кожи, шелушение, сыпь8,9.
Об исследованиях KEEPsAKE-1 и KEEPsAKE-21,10,11
KEEPsAKE-1 и KEEPsAKE-2 — это многоцентровые рандомизированные двойные слепые плацебо-контролируемые исследования фазы 3, предназначенные для оценки безопасности и эффективности рисанкизумаба у взрослых пациентов с активным псориатическим артритом. В KEEPsAKE-1 оценивалось применение рисанкизумаба у пациентов с неадекватным ответом или непереносимостью хотя бы одного БПВП. В KEEPsAKE-2 — применение рисанкизумаба у пациентов с неадекватным ответом или непереносимостью ГИБП и/или БПВП. Участники исследования были рандомизированы в группы: пациенты, получавшие рисанкизумаб 150 мг или плацебо с последующим переключением на рисанкизумаб 150 мг с 24-й недели.
Первичной конечной точкой в исследованиях стало достижение в группе рисанкизумаба ответа ACR20 на 24-й неделе лечения. Ранжированные вторичные конечные точки включали изменение HAQ-DI по сравнению с исходным уровнем, а также достижение PASI 90 и MDA на 24 неделе. Другие вторичные конечные точки включали ACR50 и ACR70 (без контроля на множественные сравнения) на 24 неделе. Данные исследования продолжается, и его продленная фаза предоставит данные о долгосрочной безопасности, переносимости и эффективности рисанкизумаба у пациентов, завершивших плацебо-контролируемый период.
Более подробную информацию об этих исследованиях можно найти на сайте www.clinicaltrials.gov (KEEPsAKE-1: NCT03675308; KEEPsAKE-2: NCT03671148).
О препарате Скайризи (рисанкизумаб)
Скайризи (рисанкизумаб) представляет собой гуманизированное моноклональное антитело, — иммуноглобулин класса G1(IgG1) — которое специфически ингибирует цитокин ИЛ-23 путем связывания с его p19 субъединицей. Считается, что цитокин ИЛ-23, участвующий в воспалительных процессах, связан с рядом хронических иммунно-опосредованных заболеваний, включая псориаз12. В апреле 2019 года Скайризи получил одобрение Управления по санитарному надзору за качеством пищевых продуктов и лекарственных средств США для лечения бляшечного псориаза средней и тяжелой степени у взрослых пациентов, являющихся кандидатами на проведение системной терапии или фототерапии. Утвержденная доза Скайризи составляет 150 мг (две инъекции по 75 мг), которая вводится подкожно на 0 и 4 неделе, а затем каждые 12 недель. В апреле 2019 года Скайризи также был одобрен Европейским медицинским агентством. В сентябре 2020 года препарат был одобрен Министерством Здравоохранения России для лечения бляшечного псориаза и активного псориатического артрита у взрослых пациентов13. Исследования фазы 3 рисанкизумаба при псориазе, болезни Крона и псориатическом артрите продолжаются5-7,10,11.
Важная информация по безопасности13
Инфекции
Применение препарата Скайризи может повышать риск развития инфекций. Следует соблюдать осторожность при применении препарата Скайризи у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. Необходимо тщательно контролировать состояние пациента, у которого развивается инфекция или который не отвечает на стандартную терапию. Терапию препаратом Скайризи не следует проводить до тех пор, пока не исчезнут клинические симптомы инфекционного заболевания.
Исключение туберкулеза (ТБ) до начала лечения
Пациентам с латентным туберкулезом следует провести противотуберкулезную терапию до начала терапии препаратом Скайризи. Не следует назначать терапию препаратом Скайризи пациентам с активной формой туберкулеза.
Вакцинация
Перед началом терапии препаратом Скайризи необходимо провести соответствующую возрасту вакцинацию согласно действующим рекомендациям по иммунопрофилактике. Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Скайризи. Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Нежелательные реакции
Наиболее распространенными (≥1 %) нежелательными реакциями, связанными с применением препарата Скайризи, являются инфекции верхних дыхательных путей, головная боль, утомляемость, реакции в месте инъекции и дерматомикоз.
В разных странах инструкция по применению препарата различается; для получения полной информации обратитесь к инструкции по применению для конкретной страны.
Об AbbVie
Миссия компании AbbVie — разработка и вывод на рынок инновационной терапии для лечения некоторых из самых тяжелых заболеваний и решение медицинских проблем завтрашнего дня. Мы стремимся оказывать значительное влияние на жизнь людей в ключевых терапевтических областях: иммунология, онкология, неврология, офтальмология, вирусология, женское здоровье и гастроэнтерология, а также с помощью продуктов и услуг подразделения Allergan — эстетическая медицина. За дополнительной информацией о компании обращайтесь на сайт www.abbvie.com, www.abbvie.ru, а также к аккаунтам в социальных сетях @abbvie в Twitter, Facebook, Instagram, YouTube.
###
За дополнительной информацией, пожалуйста, обращайтесь:
Елена Дианова
Директор по связям с общественностью AbbVie в России и СНГ
Elena.dianova@abbvie.com
Тел.: +7 (919) 767-80-93
__________________________________
- Data on File: ABVRRTI71470.
- Gordon K., et al. Efficacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. The Lancet. 2018 Aug 25;392(10148):650-661.
- Reich, K., et al. Risankizumab compared with adalimumab in patients with moderate-to-severe plaque psoriasis (IMMvent): a randomised, double-blind, active-comparator-controlled phase 3 trial. Lancet. 2019 Aug 17;394(10198):576-586. doi: 10.1016/S0140-6736(19)30952-3.
- Blauvelt, A., et al. Efficacy and Safety of Continuous Q12W Risankizumab Versus Treatment Withdrawal: 2-Year Double-Blinded Results from the Phase 3 IMMhance Trial. Poster #478. 24th World Congress of Dermatology. 2019.
- A Study to Assess the Safety and Efficacy of Risankizumab for Maintenance in Moderate to Severe Plaque Type Psoriasis (LIMMITLESS). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03047395. Accessed on December 3, 2020.
- A Study of the Efficacy and Safety of Risankizumab in Participants With Crohn’s Disease. ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03105102. Accessed on December 3, 2020.
- A Multicenter, Randomized, Double-Blind, Placebo Controlled Induction Study to Evaluate the Efficacy and Safety of Risankizumab in Participants With Moderately to Severely Active Ulcerative Colitis. ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03398148. Accessed on December 3, 2020.
- Duarte G.V., et al. Psoriatic arthritis. Best Pract Res Clin Rheumatol. 2012 Feb;26(1):147-56. doi: 10.1016/j.berh.2012.01.003.
- Diseases & Conditions: Psoriatic Arthritis. 2019. American College of Rheumatology. Available at: https://www.rheumatology.org/I-Am-A/Patient-Caregiver/Diseases-Conditions/Psoriatic-Arthritis. Accessed on December 3, 2020.
- A Study Comparing Risankizumab to Placebo in Participants With Active Psoriatic Arthritis (PsA) Who Have a History of Inadequate Response to or Intolerance to at Least One Disease Modifying Anti-Rheumatic Drug (DMARD) Therapy (KEEPsAKE 1). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/record/NCT03675308. Accessed on December 3, 2020.
- A Study Comparing Risankizumab to Placebo in Participants With Active Psoriatic Arthritis Including Those Who Have a History of Inadequate Response or Intolerance to Biologic Therapy(ies) (KEEPsAKE2). ClinicalTrials.gov. 2020. Available at: https://clinicaltrials.gov/ct2/show/NCT03671148. Accessed on December 3, 2020.
- Duvallet, E., Sererano, L., Assier, E., et al. Interleukin-23: a key cytokine in inflammatory diseases. Ann Med. 2011 Nov;43(7):503-11.
- Инструкция по медицинскому применению Скайризи https://grls.rosminzdrav.ru/GRaspx дата обращения 21.05.2021″
Скайризи
Skyrizi
Регистрационный номер
Торговое наименование
Скайризи
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
Описание
Прозрачный или слегка опалесцирующий, бесцветный или жёлтого цвета раствор. Допускается наличие небольших полупрозрачных аморфных белковых включений.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Механизм действия
Рисанкизумаб — это гуманизированное моноклональное антитело иммуноглобулина G1 (IgGl), которое селективно и с высокой аффинностью связывается с субъединицей p19 цитокина интерлейкина-23 (ИЛ-23) человека и ингибирует его взаимодействие с рецептором ИЛ-23. ИЛ-23 — это естественный цитокин, участвующий в воспалительном и иммунном ответе. ИЛ-23 способствует образованию, поддержанию числа и активации Th17-лимфоцитов, которые вырабатывают ИЛ-17-А, ИЛ-17Р и ИЛ-22, а также другие провоспалительные цитокины и играют важную роль в патогенезе аутоиммунных заболеваний, в частности, псориаза. У пациентов с бляшечным псориазом уровень ИЛ-23 повышен в поражённой заболеванием коже. Предотвращая связывание ИЛ-23 с его рецептором, рисанкизумаб ингибирует сигнальный путь и высвобождение провоспалительных цитокинов.
Рисанкизумаб не связывается с человеческим ИЛ-12, который имеет общую с ИЛ-23 субъединицу p40.
Фармакодинамика
Согласно данным исследования, однократное введение рисанкизумаба пациентам с псориазом приводит к снижению в коже экспрессии генов, связанных с иммунной осью ИЛ-23/ИЛ-17. В псориатических поражениях также наблюдалось уменьшение толщины эпидермиса, воспалительной инфильтрации и экспрессии маркеров псориаза.
В исследовании с участием пациентов с псориатическим артритом на фоне терапии рнсанкизумабом в дозе 150 мг подкожно (на неделе 0, неделе 4 и затем каждые 12 недель) на 24 неделе наблюдалось статистически и клинически значимое снижение уровня биомаркёров, связанных с ИЛ-23 и ИЛ-17, включая сывороточные ИЛ-17А, ИЛ-17Е и ИЛ-22, по сравнению с исходным уровнем.
Фармакокинетика
Всасывание
Рисанкизумаб характеризуется линейной фармакокинетикой с дозозависимым повышением экспозиции в диапазоне доз от 18 до 300 мг и от 0,25 до 1 мг/кг при подкожном введении, а также от 200 до 1200 мг и от 0,01 до 5 мг/кг при внутривенном введении.
После подкожного введения рисанкизумаба максимальная концентрация в плазме была достигнута через 3–14 дней, предполагаемая абсолютная биодоступность составила 89 %.
Подсчитано, что средняя максимальная концентрация в состоянии равновесия и остаточная концентрация препарата в плазме крови составляют 12 и 2 пг/мл соответственно при следующем режиме введения пациентам с псориазом: 150 мг на неделе 0, 4 и каждые 12 недель после этого.
Распределение
У типичного пациента с псориазом и массой тела 90 кг объём распределения в равновесном состоянии (Vss) составляет 11,2 л, что указывает на то, что распределение рисанкизумаба в основном ограничивается сосудистым и интерстициальным пространством.
Метаболизм
Терапевтические моноклональные антитела IgG обычно разлагаются на мелкие пептиды и аминокислоты в результате катаболизма подобно эндогенным IgG. Рисанкизумаб не метаболизируется ферментами цитохрома P450.
Выведение
Для типичного пациента с псориазом и массой тела 90 кг, системный клиренс (CL) рисанкизумаба составляет 0,31 л/день, а терминальный период полувыведения — 28 дней.
Поскольку рисанкизумаб является моноклональным антителом иммуноглобулина IgGl, не предполагается, что рисанкизумаб подвергается клубочковой фильтрации или выделяется с мочой в виде интактной молекулы.
Взаимодействие с другими лекарственными средствами
Исследование лекарственных взаимодействий проводилось у пациентов с бляшечным псориазом для оценки влияния многократного введения рисанкизумаба на фармакокинетику маркерных субстратов, чувствительных к цитохрому P450 (CYP).
Экспозиция кофеина (субстрат CYP1A2), варфарина (субстрат CYP2C9), омепразола (субстрат CYP2C19), метопролола (субстрат CYP2D6) и мидазолама (субстрат CYP3A) при введении рисанкизумаба было сопоставимо с их экспозицией до введения рисанкизумаба.
Это указывает на отсутствие клинически значимых лекарственных взаимодействий с помощью данных ферментов.
Результаты популяционного фармакокинетического анализа показали, что на экспозицию рисанкизумаба не влияли сопутствующие препараты (метформин, аторвастатин, лизиноприл, амлодипин, ибупрофен, ацетилсалицилат и левотироксин), которые использовали некоторые пациенты с бляшечным псориазом во время клинических исследований (см. раздел «Взаимодействие с другими лекарственными средствами»).
Особые группы пациентов
Дети
Фармакокинетика рисанкизумаба у детей не изучалась.
Пожилые пациенты
Из 2234 пациентов с бляшечным псориазом, получавших терапию препаратом Скайризи, 243 пациента были старше 65 лет, а 24 пациента — старше 75 лет. В целом не было выявлено различий в экспозиции рисанкизумаба, безопасности и эффективности терапии препаратом Скайризи между пациентами более старшего и более молодого возраста. Аналогичная ситуация наблюдалась в случае применения при псориатическом артрите на основании результатов популяционного фармакокинетического анализа (см. раздел «Способ применения и дозы»).
Пациенты с нарушением функции почек или печени
Специальные исследования для определения влияния почечной или печёночной недостаточности на фармакокинетику рисанкизумаба не проводились. Согласно данным популяционного фармакокинетического анализа, уровни креатинина в сыворотке крови, клиренс креатинина или маркеры функции печени (АЛТ/АСТ/билирубин) не оказывали значимого влияния на клиренс рисанкизумаба у пациентов с псориазом или с псориатическим артритом.
Поскольку рисанкизумаб является моноклональным антителом IgGl, в основном он выводится при внутриклеточном катаболизме. Ожидается, что рисанкизумаб не подвергается метаболизму с помощью ферментов цитохрома Р450 или элиминации почками (см. раздел «Способ применения и дозы»).
Масса тела
Клиренс рисанкизумаба и объём его распределения увеличиваются с зависимости от увеличения массы тела. Однако клинически значимые изменения параметров эффективности и безопасности рисанкизумаба при увеличении массы тела не наблюдались, поэтому коррекция дозы на основании массы тела не требуется.
Пол, раса
Пол, раса не оказывали клинически значимого влияния на клиренс рисанкизумаба у взрослых пациентов с бляшечным псориазом или псориатическим артритом. Согласно данным клинического исследования по изучению фармакокинетики, у пациентов из Китая и Японии, не наблюдались клинически значимые различия концентраций рисанкизумаба в плазме крови по сравнению с пациентами европеоидной расы.
Краткая информация о клинических исследованиях
Бляшечныи псориаз
Эффективность и безопасность препарата Скайризи изучалась у 2109 пациентов со среднетяжёлым и тяжёлым бляшечным псориазом (статичная общая оценка врачом sPGA ≥ 3 и индекс тяжести и площади поражения PASI ≥ 12) в 4-х многоцентровых, рандомизированных, двойных слепых исследованиях (ULTIMMA-1, ULTIMMA-2, IMMHANCE, and IMMVENT).
У 9,8 % пациентов отмечался сопутствующий псориатический артрит в анамнезе, 42,1 % — до включения в исследование получали лечение другим биологическим препаратом. В исследованиях ULTIMMA-1 и ULTIMMA-2 по всем первичным и вторичным конечным точкам [статичная общая оценка врачом «чисто» или «почти чисто» (sPGA 0/1), статичная общая оценка врачом «чисто» (sPGA 0), PASI 75, PASI 90 и PASI 100] отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с плацебо и устекинумабом на неделях 16 и 52. Улучшение на фоне лечения препаратом Скайризи также наблюдалось со стороны псориаза волосистой части головы, ногтей, ладоней и стоп.
Среди пациентов, достигших sPGA 0/1 на неделе 28 в исследовании IMMHANCE, 87,4 % поддерживали ответ к неделе 52 при непрерывной терапии препаратом Скайризи по сравнению с 61,3 %, кто получил последнюю дозу препарата на неделе 16 (ре-рандомизация на неделе 28).
В исследовании IMMVENT по конечным точкам sPGA 0/1, PASI 75, PASI 90 и PASI 100 отмечалось статистически достоверное преимущество препарата Скайризи по сравнению с адалимумабом на неделе 16. У пациентов с недостаточным ответом на адалимумаб на неделе 16 (PASI 50 — < PASI 90) переключение на лечение препаратом Скайризи позволило достигнуть достоверно лучших результатов по параметрам sPGA 0, sPGA 0/1, PASI 90 и PASI 100 на неделе 44 по сравнению с продолжением терапии адалимумабом.
Псориатический артрит
Эффективность и безопасность препарата Скайризи® изучалась у 1407 пациентов в двух рандомизированных двойных слепых плацебо-контролируемых исследованиях с участием пациентов в возрасте 18 лет и старше с активным псориатическим артритом (исследования KEEPSAKE 1 и KEEPSAKE2). Пациенты, участвующие в данных исследованиях, имели диагноз псориатический артрит в течение периода не менее 6 месяцев на основании критериев классификации псориатического артрита (CASPAR). У пациентов исходно отмечалось: средняя продолжительность заболевания псориатическим артритом 4,9 года, ≥5 болезненных и ≥5 припухших суставов, а также активный бляшечный псориаз или псориаз ногтей. У 55,9% пациентов отмечалось ≥3 % площади поражения кожи бляшечным псориазом. У 63,4% и 27,9 % пациентов наблюдался энтезит и дактилит соответственно. В исследовании KEEPSAKE 1, где дополнительно оценивался псориаз ногтей, у 67,3 % пациентов наблюдался псориаз ногтей. Псориатический спондилит был зарегистрирован у 19,6 % и 19,6 % пациентов в исследованиях KEEPSAKE 1 и KEEPSAKE 2 соответственно. В исследовании KEEPSAKE 1 все пациенты ранее имели неадекватный ответ или непереносимость базисных противовоспалительных препаратов (БПВП) и не получали до включения в исследование биологическую терапию. В исследовании KEEPSAKE2 46,5 % пациентов ранее имели неадекватный ответ или непереносимость биологической терапии. 59,6 % пациентов из обоих исследований получали сопутствующую терапию метотрексатом, 11,6 % получали сопутствующую терапию другими БПВП, отличными от метотрексата, и 28,9 % получали монотерапию препаратом Скайризи®.
В обоих исследованиях терапия препаратом Скайризи® привела к значительному улучшению показателей активности заболевания (достижение клинических ответов ACR 20/50/70 и минимальной активности заболевания) по сравнению с плацебо на неделе 24. Эффективность препарата достигалась быстро по веем критериям с более высокими ответами на терапию, наблюдаемыми уже на неделе 4 для ACR20, по сравнению с плацебо. Терапия препаратом Скайризи® привела к статистически значимому улучшению показателей в лечении дактилита и энтезита у пациентов с ранее диагностированным дактилитом или энтезитом. Достижение ACR 20/50/70, минимальной активности заболевания, улучшение дактилита и энтезита сохранялось вплоть до недели 52. В обоих исследованиях наблюдались аналогичные ответы независимо от сопутствующей терапии БПВП, количества ранее применявшихся БПВП, возраста, пола, расы и индекса массы тела. В исследовании KEEPSAKE 2 ответы на лечение наблюдались независимо от предшествующей биологической терапии.
В обоих исследованиях доля пациентов, достигших модифицированного ответа PsARC (Psoriatic Arthritis Response Criteria) на неделе 24, была выше среди пациентов, получавших терапию препаратом Скайризи®, по сравнению с плацебо. Кроме того, в обоих исследованиях пациенты, получавшие препарат Скайризи® достигли большего улучшения показателя активности заболевания (28 суставов) при использовании индекса DAS28-CPB по сравнению с плацебо на неделе 24. Улучшения сохранялись до недели 52 для PsARC и DAS28-CPB в обоих исследованиях. В обоих исследованиях были показаны улучшения по веем компонентам оценок ACR, включая оценку боли пациентом.
По данным модифицированного индекса тяжести псориаза ногтей (mNAPSI) и 5-баллыюй глобальной оценки тяжести поражения ногтей на пальцах рук (PGA-F) терапия препаратом Скайризи® привела к статистически значимому улучшению псориаза ногтей у пациентов, имеющих соответствующие проявления исходно (67,3 %) в исследовании KEEPSAKE 1. Данное улучшение сохранялось вплоть до недели 52.
В исследовании KEEPSAKE 1 ингибирование прогрессирования структурных повреждений оценивалось рентгенологически и выражалось как изменение модифицированной общей шкалы Шарпа (mTSS) на неделе 24 по сравнению с исходным уровнем. При применении препарата Скайризи® отмечалось численно более низкое среднее прогрессирование структурных повреждений на неделе 24 по сравнению с плацебо (средний балл mTSS составлял 0,23 в группе Скайризи® по сравнению с 0,32 в группе плацебо [статистически недостоверно]). Доля пациентов без рентгенологического прогрессирования (определяемого как изменение по сравнению с исходным уровнем mTSS ≤ 0) была выше в группе Скайризи® (92,4 %) по сравнению с плацебо (87,7 %) на неделе 24 (номинальное значение р = 0,016).
У пациентов, получавших терапию препаратом Скайризи®, наблюдалось статистически значимое улучшение физической функции по сравнению с исходным уровнем по оценке HAQ-DI на неделе 24 по сравнению с плацебо. Улучшения сохранялись до 52 недели.
На неделе 24 у пациентов, получавших терапию препаратом Скайризи®, также наблюдались значительные улучшения в сводных оценках физического компонента шкалы качества жизни SF-36 V2 и в оценке утомляемости по шкале FACIT по сравнению с пациентами, получавшими плацебо. Улучшения сохранялись до 52 недели.
У пациентов с псориатическим спондилитом, которые получали терапию препаратом Скайризи®, наблюдались улучшения по сравнению с исходным уровнем в показателях индекса активности анкилозирующего спондилита (BASDAI) и активности заболевания анкилозирующим спондилитом (ASDAS) по сравнению с плацебо на неделе 24. Улучшения сохранялись до недели 52.
Показания
- Препарат Скайризи показан для лечения бляшечного псориаза среднетяжёлой и тяжёлой степени у взрослых пациентов.
- Препарат Скайризи показан в качестве монотерапии или в комбинации с базисными противовоспалительными препаратами (БПВП) для лечения активного псориатического артрита у взрослых пациентов.
Противопоказания
- Тяжёлые реакции гиперчувствительности к рисанкизумабу или к другим вспомогательным веществам препарата см. Раздел «Особые указания»);
- Активная форма туберкулёза;
- Детский возраст до 18 лет (эффективность и безопасность не изучены).
С осторожностью
- Необходимо соблюдать осторожность при применении препарата Скайризи® у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
- Не следует проводить вакцинацию живыми вакцинами на фоне терапии препаратом Скайризи®. Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Применение при беременности и в период грудного вскармливания
Беременность
Полученных данных недостаточно для информирования о рисках, связанных с применением лекарственного препарата Скайризи® у беременных женщин.
Данные, полученные в ходе исследований на животных
Проводилось расширенное исследование токсического воздействия на пре- и постнатальное развитие на яванских макаках. Каждую неделю с 20-го дня беременности до момента родоразрешения яванским макакам вводили подкожные инъекции рисанкизумаба в дозах 5 или 50 мг/кг. Дальнейшее наблюдение за самками и детёнышами продолжалось в течение 6 месяцев (180 дней) после родоразрешения. Указанные дозы приводили к экспозиции, приблизительно в 70 раз превышающей клиническое воздействие при максимально рекомендуемой для человека дозе (МРДЧ). Не наблюдалось связанных с применением препарата случаев смерти и/или пороков развития плода/новорождённого. Влияние на рост и развитие новорождённого отсутствовало, оценка которого включала внешние, висцеральные, скелетные и нейроповеденческие параметры и конечные точки токсического воздействия на иммунную систему. У детёнышей отмечалось дозозависимое повышение средней концентрации препарата в сыворотке крови, которая составляла около 20–90 % от средней концентрации в организме самки. После родоразрешения у большинства взрослых самок яванских макак и всех детёнышей в группах применения рисанкизумаба отмечалась определяемая концентрация рисанкизумаба в сыворотке крови в течение периода до 91 дня.
Через 180 дней после родоразрешения концентрация рисанкизумаба в сыворотке крови была ниже определяемого уровня.
Период грудного вскармливания
Нет данных о проникновении рисанкизумаба в грудное молоко, о воздействии препарата на ребёнка в период грудного вскармливания или на выработку молока. Несмотря на то, что человеческий IgG выделяется в грудное молоко, опубликованные данные свидетельствуют о том, что антитела в грудном молоке не попадают в кровоток новорождённого/ребёнка в значимых количествах.
Способ применения и дозы
Для подкожного введения.
Пациенты могут самостоятельно вводить препарат Скайризи® после соответствующего обучения технике подкожных инъекций. Перед введением препарата пациенты должны ознакомиться с инструкцией по медицинскому применению.
Каждый предварительно заполненный шприц предназначен только для однократного использования.
Следует избегать введения препарата в чувствительных, повреждённых, эритематозных и уплотнённых участках кожи, а также участках, поражённых псориазом. Введение препарата Скайризи® в верхнюю часть наружной поверхности плеча должно выполняться только лицом, осуществляющим уход за пациентом, или медицинским работником.
Перед проведением инъекции необходимо достать упаковку препарата Скайризи® из холодильника и довести её до комнатной температуры в течение 15–30 минут, избегая прямых солнечных лучей, не вынимая шприц из коробки.
Неиспользованный лекарственный препарат или остатки препарата должны быть утилизированы в соответствии с требованиями, принятыми в конкретном регионе.
Рекомендуемый режим дозирования
Бляшечный псориаз
Рекомендуемая доза препарата Скайризи® — 150 мг в виде подкожной инъекции на неделе 0, неделе 4 и далее каждые 12 недель.
Следует рассмотреть возможность прекращения терапии у пациентов, не достигающих ответа на терапию в период свыше 16 недель. У некоторых пациентов с первоначальным частичным ответом впоследствии могут улучшиться результаты при продолжении терапии более 16 недель.
Псориатический артрит
Рекомендуемая доза препарата Скайризи® — 150 мг на неделе 0, неделе 4 и далее каждые 12 недель.
Препарат Скайризи® может применяться в качестве монотсрапии или в комбинации с базисными противовоспалительными препаратами (БПВП).
Пропуск дозы
В случае пропуска дозы препарата Скайризи® необходимо ввести дозу как можно скорее. Затем следует возобновить введение доз согласно установленному графику.
Особые группы пациентов
Дети
Отсутствуют данные по безопасности и эффективности применения препарата Скайризи® у детей в возрасте до 18 лет.
Пациенты пожилого возраста
Коррекция дозы не требуется (см. раздел «Фармакологические свойства»).
Пациенты с нарушением функции почек или печени
Не было проведено специальных исследований для определения влияния почечной или печёночной недостаточности на фармакокинетику препарата Скайризи®. Данные состояния, как правило, не должны оказывать существенного влияния на фармакокинетику моноклональных антител. Коррекция дозы не требуется (см. раздел «Фармакологические свойства»).
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
Перед введением препарата Скайризи® полностью прочитайте инструкцию по применению
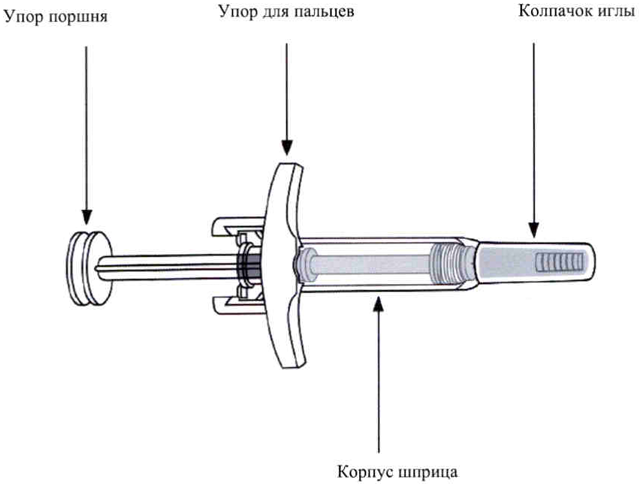
Перед проведением инъекции препаратом Скайризи® необходимо обязательно ознакомиться с указанной ниже важной информацией.
- Прежде чем проводить инъекцию, необходимо пройти обучение по введению препарата Скайризи®. Для этого необходимо обратиться к лечащему врачу.
- Необходимо отмечать в своём календаре, когда Вам нужно вводить препарат Скайризи®.
- До момента использования препарат Скайризи® необходимо хранить в оригинальной упаковке (картонной пачке) в защищённом от света месте.
- Не вводить препарат, если раствор мутный и содержит крупные хлопья или частицы (раствор должен быть бесцветным или жёлтым и может содержать небольшие полупрозрачные частицы).
- Не применять препарат после истечения срока годности.
- Не применять препарат, если он был заморожен (даже если впоследствии он был разморожен).
- Не встряхивать шприц.
- Не применять препарат, если заполненный шприц падал на пол или повреждён.
- Не применять препарат, если нарушена перфорация на картонной пачке. Необходимо вернуть такой препарат в аптеку.
- Не снимайте колпачок с иглы вплоть до момента выполнения инъекции.
- Для более комфортного проведения инъекции: перед инъекцией необходимо достать упаковку препарата Скайризи® из холодильника и довести её до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение 15–30 минут, избегая прямых солнечных лучей.
- Не вынимайте шприц из картонной пачки до тех пор, пока не будете готовы выполнить инъекцию.
- Не нагревайте препарат Скайризи® любым другим способом, например, в микроволновой печи или в горячей воде.
Следуйте инструкциям, изложенным ниже, каждый раз, когда используете препарат Скайризи®.
ШАГ 1

Извлеките предварительно заполненный шприц из картонной пачки, держа его за упор для пальцев.
При извлечении из картонной пачки не держите шприц за упор поршня и не тяните за него.
Поместите следующие предметы на чистую плоскую поверхность:
- 1 предварительно заполненный шприц;
- 1 спиртовую салфетку;
- 1 ватный тампон или марлевую салфетку;
- контейнер для утилизации.
Вымойте и высушите руки.
ШАГ 2
место для инъекции

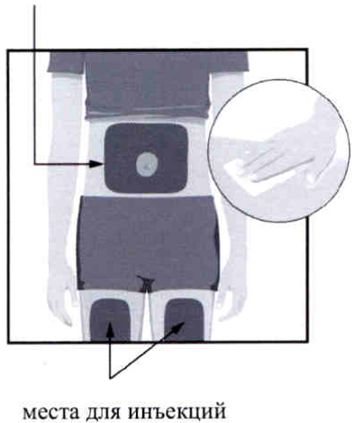
Выберите одно из трёх мест для инъекции:
- передняя часть левого бедра;
- передняя часть правого бедра;
- область живота (не менее 5 см от пупка).
Перед каждой инъекцией необходимо протирать место инъекции спиртовой салфеткой круговыми движениями.
- НЕ прикасайтесь и не дуйте на место инъекции после его обработки спиртовой салфеткой. Перед инъекцией дайте коже высохнуть.
- НЕ делайте инъекцию через одежду.
- НЕ делайте инъекции в местах с раздражённой кожей, синяками, покраснениями и уплотнениями, а также в кожу, имеющую шрамы или растяжки.
- НЕ делайте инъекции в местах кожи, поражённой псориазом.
ШАГ 3
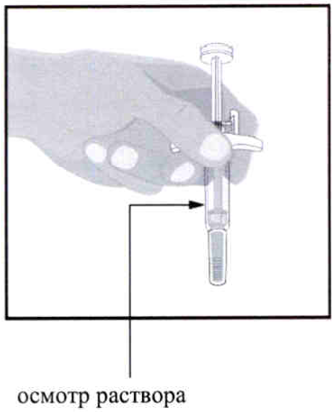
Держите шприц закрытой иглой вниз, как показано на рисунке.
Осмотрите раствор в шприце.
- Наличие пузырьков в шприце является нормой.
- Раствор должен быть бесцветным или жёлтым и может содержать мелкие белые или прозрачные частицы.
- НЕ вводите препарат, если раствор мутный и содержит крупные хлопья или частицы.
ШАГ 4
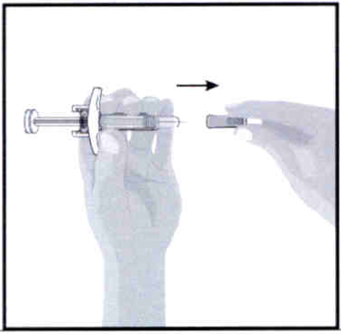
Снятие колпачка иглы:
- Держите шприц в одной руке за область между упором для пальцев и колпачком иглы.
- Другой рукой аккуратно снимите колпачок иглы.
- НЕ держите шприц за упор поршня и не тяните за него при снятии колпачка иглы.
- Возможно, на конце иглы появится капля жидкости. Это нормально.
- Выбросьте колпачок иглы.
- НЕ прикасайтесь к игле пальцами и не допускайте соприкосновения иглы с какой-либо поверхностью.
ШАГ 5
Держите корпус шприца одной рукой между большим и указательным пальцем, как карандаш.
Слегка сожмите подготовленное место инъекции другой рукой и крепко удерживайте его.
Быстрым движением полностью введите иглу в кожу под углом примерно 45°. Удерживайте шприц под тем же углом.
ШАГ 6
Медленно нажимайте на поршень пока весь раствор не будет введён.
Извлеките иглу из кожи под тем же углом, под которым производилось введение.
Медленно отведите большой палец от поршня. Игла закроется защитным устройством.
- Защитное устройство иглы не активируется, пока не будет введён весь раствор препарата.
- Обратитесь к своему лечащему врачу, если считаете, что не ввели полную дозу.
Прижимайте ватный тампон или марлевую салфетку к месту инъекции в течение 10 секунд.
Не растирайте место введения после завершения инъекции.
Может возникнуть небольшое кровотечение из места инъекции. Это нормально.
ШАГ 7
Поместите использованные шприцы в контейнер для утилизации.
- НЕ выбрасывайте использованные шприцы вместе с бытовыми отходами.
- Ваш врач или медсестра расскажут Вам, как вернуть контейнер для полной утилизации.
Побочное действие
Опыт клинических исследований
Бляшечный псориаз
В клинических исследованиях принимало участие 2234 пациентов с бляшечным псориазом, которым вводили препарат Скайризи® (2167 пациенто-лет применения). Из всех участников 1208 пациентов с псориазом получали терапию препаратом Скайризи® в течение не менее одного года.
Данные плацебо-контролируемых исследований и исследований с активным контролем были объединены для оценки безопасности применения препарата Скайризи® в течение 16 недель. Всего были оценены результаты терапии 1306 пациентов в группе применения препарата Скайризи® в дозе 150 мг. Серьёзные нежелательные реакции были отмечены у 2,4 % в группе применения препарата Скайризи® (9,9 явлений на 100 пациенто-лет) по сравнению с 4,0 % в группе плацебо (17,4 явления на 100 пациенто-лет), 5,0 % в группе применения устекинумаба (18,4 явления на 100 пациенто-лет) и 3,0 % для группы адалимумаба (14,7 явления на 100 пациенто-лет).
В таблице 1 приведены нежелательные реакции, отмеченные во время проведения клинических исследований с применением препарата Скайризи, которые были классифицированы в соответствии с классами систем органов MedDRA. Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1 000 до 1/100); редко (≥1/10 000 до 1/1 000); очень редко (<1/10 000).
|
Класс систем органов |
Частота развития |
Нежелательные реакции |
|
Инфекционные и паразитарные заболевания |
Очень часто |
Инфекции верхних дыхательных путейa |
|
Часто |
Дерматомикозb |
|
|
Нечасто |
Фолликулит |
|
|
Нарушения со стороны нервной системы |
Часто |
Головная больc |
|
Общие нарушения и реакции в месте введения |
Часто |
Утомляемостьd Реакция в месте введенияe |
|
a Включает: инфекцию дыхательных путей (вирусная, бактериальная или неуточнённая), синусит (в том числе острый), ринит, назофарингит, фарингит (в том числе вирусный), тонзиллит. b Включает: грибковое поражение кожи стоп, трихофитию промежности, дерматофитию туловища, отрубевидный лишай, грибковую инфекцию рук c Включает: головную боль, головную боль напряжения, синусовую головную боль d Включает: утомляемость, общую слабость. е Включает: синяк в месте инъекции, эритему, гематому, кровоизлияние, инфекцию, воспаление, раздражение, боль, зуд, кожную реакцию, отёк |
Описание отдельных нежелательных реакций
Инфекции
Инфекции наблюдались у 22,1 % пациентов, принимавших препарат Скайризи® (90,8 случаев на 100 пациенто-лет), по сравнению с 14,7 % в группе плацебо (56,5 случаев на 100 пациенто-лет), 20,9 % в группе устекинумаба (87,0 случаев на 100 пациенто-лет) и 24,3 % в группе адалимумаба (104,2 случаев на 100 пациенто-лет). Большинство нежелательных реакций были несерьёзными, лёгкой или средней степени тяжести и не приводили к прекращению введения препарата Скайризи®.
На протяжении всей программы исследований применения препарата при псориазе, учитывая длительное воздействие препарата Скайризи®, частота инфекций (75,5 случаев на 100 пациенто-лет) была аналогична наблюдаемой в течение первых 16 недель терапии.
Профиль безопасности препарата Скайризи® при длительном применении На 52-й неделе терапии частота развития нежелательных реакций была аналогична профилю безопасности, наблюдаемому в течение первых 16 недель терапии. В течение 52 недель, скорректированная по объёму применения частота развития серьёзных нежелательных явлений на 100 пациенто-лет составляла 9,4 для пациентов, получавших препарат Скайризи®, и 10,9 для пациентов, получавших устекинумаб. У пациентов, получавших терапию препаратом Скайризи® в течение наиболее продолжительного периода времени (77 недель), не было выявлено новых нежелательных реакций по сравнению с первыми 16 неделями терапии.
Псориатический артрит
В целом профиль безопасности, наблюдаемый у пациентов с псориатическим артритом, получавших препарат Скайризи®, соответствовал профилю безопасности, наблюдаемому у пациентов с бляшечным псориазом.
Опыт пострегистрационного применения
Во время пострегистрационного применения препарата Скайризи® были выявлены нижеуказанные нежелательные реакции. Поскольку сообщения о развитии данных реакций были получены на добровольной основе из группы неопределённого числа пациентов, не всегда возможно достоверно оценить их частоту или установить, связаны ли данные реакции с приёмом препарата Скайризи®.
Нарушения со стороны кожи и подкожных тканей: экзема, сыпь и крапивница.
Иммуногенность
Как и для всех терапевтических белков, введение рисанкизумаба может вызвать развитие иммуногенности. Обнаружение антител в значительной степени зависит от чувствительности и специфичности метода анализа. Кроме того, частота положительного результата на обнаружение антител (включая нейтрализующие антитела) может быть обусловлена влиянием нескольких факторов, таких как методология метода анализа, обработка образцов проб, время сбора проб, сопутствующая лекарственная терапия и сопутствующие заболевания. По этим причинам сравнение частоты выявления антител к рисанкизумабу с таковой в исследованиях других лекарственных препаратов может вводить в заблуждение.
Бляшечный псориаз
В рамках клинических исследований применения препарата при псориазе было выявлено, что доля пациентов, получавших терапию в рекомендуемой клинической дозе в течение 52 недель и выработавших к препарату антитела и нейтрализующие антитела составила 24 % (263/1079) и 14 % (150/1079) соответственно.
Присутствие антител к рисанкизумабу, а также нейтрализующих антител не было связано с изменениями клинического ответа или безопасности применения препарата.
Псориатический артрит
В клинических исследованиях у пациентов с псориатическим артритом, получавших препарат Скайризи® в рекомендованной дозе вплоть до 28 недель, были обнаружены появившиеся за время лечения антитела к лекарственному препарату и нейтрализующие антитела у 12,1 % (79/652) и 0 % (0/652) пациентов соответственно. Антитела к рисанкизумабу, включая нейтрализующие антитела, не были связаны с изменениями клинического ответа или безопасности.
Передозировка
В случае передозировки рекомендуется наблюдение за пациентами на предмет выявления признаков и симптомов нежелательных реакций. При необходимости следует незамедлительно провести симптоматическую терапию.
Взаимодействие с другими лекарственными средствами
Препарат Скайризи® не подвергается почечной элиминации или метаболизму печёночными ферментами. Взаимодействия между препаратом Скайризи® и лекарственными препаратами, являющимися ингибиторами, индукторами и/или субстратами изоферментов, не ожидается.
Согласно результатам исследования лекарственных взаимодействий у пациентов с бляшечным псориазом и результатам популяционного фармакокинетического анализа у пациентов с бляшечным псориазом и псориатическим артритом рисанкизумаб не вызывал лекарственных взаимодействий или не подвергался им (см. раздел «Фармакологические свойства»).
При одновременном введении рисанкизумаба и субстратов цитохрома Р450 коррекция дозы не требуется.
Особые указания
Реакции гиперчувствительности
В случае развития реакций гиперчувствительности необходимо прекратить введение препарата Скайризи® и незамедлительно начать соответствующую терапию.
Инфекции
Применение препарата Скайризи® может повышать риск развития инфекций.
Следует соблюдать осторожность при применении препарата Скайризи® у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. Необходимо тщательно контролировать состояние пациента, у которого развивается инфекция или который не отвечает на стандартную терапию. Терапию препаратом Скайризи® не следует проводить до тех пор, пока не исчезнут клинические симптомы инфекционного заболевания.
На протяжении клинических исследований III фазы 72-ум пациентам с псориазом и латентной формой туберкулёза одновременно проводилась терапия препаратом Скайризи® и была назначена соответствующая профилактическая терапия туберкулёза, при этом, в течение среднего периода наблюдения (61 неделя) ни у одного пациента не развился активный туберкулёз. Пациентам с латентным туберкулёзом следует провести противотуберкулёзную терапию до начала терапии препаратом Скайризи®.
Не следует назначать терапию препаратом Скайризи® пациентам с активной формой туберкулёза.
Вакцинация
Перед началом терапии препаратом Скайризи® необходимо провести соответствующую возрасту вакцинацию согласно действующим рекомендациям по иммунопрофилактике. Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Скайризи®.
Отсутствуют данные об иммунном ответе на живые или инактивированные вакцины.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Скайризи® не оказывает влияния или оказывает незначительное влияние на способность к вождению транспортных средств и управлению механизмами.
Форма выпуска
Раствор для подкожного введения 150 мг/мл.
По 1,0 мл в однодозовые шприцы из бесцветного стекла типа I.
Шприцы оснащены защитным устройством для иглы.
По 1 шприцу в чехле из картона и ламинированной алюминиевой фольги вместе с инструкцией по применению помещается в картонную пачку с картонным вкладышем.
Картонная пачка может быть снабжена стикером для контроля первого вскрытия.
Хранение
При температуре от 2 до 8 °C в оригинальной упаковке для защиты от света.
Не замораживать.
Срок годности
2 года.
Не применять после истечения срока годности.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
AbbVie Biotechnology Ltd., США
AbbVie S.r.L., Италия
ОРТАТ, ЗАО, Российская Федерация
Производитель
Производитель готовой лекарственной формы, фасовщик (первичная упаковка)
ЭббВи Биотехнология Лтд. / AbbVie Biotechnology Ltd.
Роуд № 2 км 59,2 Барселонета, Пуэрто-Рико (ПР) 00617, США /
Road Number 2 Km 59.2 Barceloneta, Puerto Rico (PR) 00617, USA
Упаковщик (вторичная упаковка), выпускающий контроль качества
ЭббВи С.Р.Л./AbbVie S.R.L.
С.Р. 148 Понтина 52 км с.н.к. — 04011 Камповерде ди Априлиа (ЛТ), Италия /
S.R. 148 Pontina 52 km s.n.c. — 04011 Campoverde di Aprilia (LT), Italy
или
АО «ОРТАТ», Россия
157092, Костромская обл., Сусанинский район, с. Северное, мкр. Харитоново, тел./факс (4942) 650-806.
Владелец регистрационного удостоверения / Организация, принимающая претензии от потребителей:
ООО «ЭббВи», Россия
125196, г. Москва, ул. Лесная, д.7, этаж 4, помещение 1
БЦ «Белые Сады», здание «А»
тел. (495) 258 42 77.
https://doi.org/10.33667/2078-5631-2022-8-71-74
Полный текст:
- Аннотация
- Об авторах
- Список литературы
Аннотация
В статье представлены результаты клинических исследований и реальной практики эффективности и безопасности применения нового генно-инженерного биологического препарата Рисанкизумаб. Скайризи (рисанкизумаб) – инновационный препарат, представляет собой гуманизированное моноклональное антитело – иммуноглобулин класса G1(IgG1), которое специфически ингибирует цитокин ИЛ-23 путем связывания с его субъединицей p19. Считается, что цитокин ИЛ-23, участвующий в воспалительных процессах, связан с рядом хронических иммунно-опосредованных заболеваний, включая псориаз. По данным прямых сравнительных рандомизированных клинических исследований, рисанкизумаб превосходит по эффективности в краткосрочной и, что особенно важно, долгосрочной перспективе большинство ГИБП, в том числе ингибиторы ФНО-α, секукинумаб, устекинумаб. В исследованиях ultIMMa-1 и ultIMMa-2 через 16 недель лечения препаратом Скайризи были достигнуты показатели sPGA 0/1 и PASI 90 (p < 0,001). После 16 недель лечения в обоих исследованиях большинство больных достигли sPGA 0/1 (88 и 84% соответственно), а PASI 90 в обоих исследованиях достигли 75% больных, получавших Скайризи. По данным открытого расширенного исследования LIMMitless после завершения UltIMMa-1 и –2 (на основе анализа LOCF) доля пациентов, получавших Скайризи до 2,5 года (136 недель), удерживающих PASI 90 и PASI 100, составила 87 и 63% соответственно. Одним из потенциальных преимуществ ингибиторов ИЛ-23 также является длительное поддержание достигнутого эффекта после прекращения лечения. В период наблюдения пациентов в ходе рандомизированных контролируемых исследований III фазы были получены данные о высокой безопасности препарата и отсутствие существенных рисков в отношении серьезных инфекций, сердечно-сосудистых событий, злокачественных новообразований. Препарат эффективен при недостаточном ответе на адалимумаб, устекинумаб, секукинумаб. В статье представлены два клинических случая применения рисанкизумаба у пациентов разного возраста с тяжелым псориазом, с неэффективностью либо непереносимостью системной терапии, а также в связи с ускользанием эффекта от ранее проводимых методов лечения. У всех пациентов удалось достигнуть PASI 90/100. Нежелательные явления не отмечались.
Ключевые слова
Об авторах
А. А. Хотко
ГБУЗ «Клинический кожно-венерологический диспансер» Минздрава Краснодарского края
Россия
Хотко Алкес Асланчериевич, к.м.н., зам. гл. врача по медицинской части
М. Ю. Помазанова
ГБУЗ «Клинический кожно-венерологический диспансер» Минздрава Краснодарского края
Россия
Помазанова Марина Юрьевна, зав. женским стационарным отделением
М. И. Глузмин
ГБУЗ «Клинический кожно-венерологический диспансер» Минздрава Краснодарского края
Россия
Глузмин Михаил Иванович, к.м.н., гл. врач
М. В. Дурлештер
ГБУЗ «Краевая клиническая больница № 2» Минздрава Краснодарского края
Россия
Дурлештер Марина Владимировна, врач ультразвуковой диагностики
Список литературы
1. Langley R.G. Exploring new concepts in the successful management of psoriasis. J Eur Acad Dermatol Venereol. 2012 Mar; 26 Suppl 2: 1–2.
2. Потекаев Н. Н., Круглова Л. С. Псориатическая болезнь. Москва. 2014. 264 c.
3. Bovenschen H.J., Vande Kerkhof P.C., van Erp P.E. et al. Foxp3+ Regulatory T Cells of Psoriasis Patients Easily Differentiate into IL-17A – Producing Cells and Are Found in Lesional Skin. Journal of Investigative Dermatology. 2011; 131: 1853–1860.
4. Nestle F., Kaplan D.H., Barcer J. Psoriasis. N Engl J Med. 2009; 361: 496–509.
5. Korn T., Bettelli E., Oukka M., Kuchroo V.K. IL-17 and Th17 Cells. Annu Rev Immunol. 2009; 27: 485–517.
6. Псориаз. Федеральные клинические рекомендации. Дерматовенерология 2015. Болезни кожи. Инфекции, передаваемые половым путем. 5-е изд., перераб. и доп. М.: Деловой экспресс, 2016: 415–470.
7. SKYRIZI [Summary of Product Characteristics]. AbbVie Ltd. Available at: www.ema.europa.eu. 8. Gordon K., et al. Effcacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. The Lancet. 2018 Aug 25; 392 (10148): 650–661.
8. Reich K., et al. Effcacy and Safety of Risankizumab Compared with Adalimumab in Patients with Moderate-to-Severe Plaque Psoriasis: Results from the Phase 3 IMMvent Trial. ePoster #P1813. European Academy of Dermatology and Venereology Congress. 2018.
9. Blauvelt A., et al. Risankizumab Effcacy / Safety in Moderate-to-Severe Plaque Psoriasis: 16-Week Results from IMMhance [abstract P066]. Acta Derm Venereol. 2018; 98 (suppl 219): 30.
10. Leonardi C., Lebwohl M., Bachelez H., et al. Maintenance of response through 136 weeks of longterm continuous risankizumab treatment: an analysis of patients from UltIMMa-1 and UltIMMa-2. Presented at the Virtual Annual Meeting of the American Academy of Dermatology; June 12–14, 2020.
11. Langley, et al. Effcacy and Safety of Continuous Q12W Risankizumab versus Treatment Withdrawal: Results from the Phase 3 IMMhance Trial. Poster #10093. 2019 American Academy of Dermatology Annual Meeting. 2019.
12. Инструкция по медицинскому применению лекарственного препарата Скайризи. https://grls.rosminzdrav.ru/Default.aspx (дата обращения 28.10.2020).
Рецензия
Для цитирования:
Хотко А.А., Помазанова М.Ю., Глузмин М.И., Дурлештер М.В. Выбор терапии псориаза: ингибирование ИЛ-23 p19 – данные клинических исследований и реальной практики. Медицинский алфавит. 2022;(8):71-74. https://doi.org/10.33667/2078-5631-2022-8-71-74
For citation:
Hotko A.A., Pomazanova M.Yu., Gluzmin М.I., Durleshter M.V. Choice of therapy for psoriasis: inhibition of IL-23 p19 – data from clinical studies and real practice. Medical alphabet. 2022;(8):71-74.
(In Russ.)
https://doi.org/10.33667/2078-5631-2022-8-71-74
Просмотров: 154
