Отрио (Otrio) инструкция по применению
📜 Инструкция по применению Отрио
💊 Состав препарата Отрио
✅ Применение препарата Отрио
📅 Условия хранения Отрио
⏳ Срок годности Отрио


Описание лекарственного препарата
Отрио
(Otrio)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2023.01.13
Владелец регистрационного удостоверения:
Контакты для обращений:
АКРИХИН АО
(Россия)
Лекарственная форма
| Отрио |
Таб. 10 мг: 10, 20, 30, 60 или 90 шт. рег. №: ЛП-(000667)-(РГ-RU) Предыдущий рег. №: ЛП-005169 |
Форма выпуска, упаковка и состав
препарата Отрио
Таблетки от белого до белого с желтоватым оттенком цвета, круглые, плоскоцилиндрические, с фаской.
* в пересчете на 100% вещество.
Вспомогательные вещества: целлюлоза микрокристаллическая, лактозы моногидрат, кроскармеллоза натрия, натрия лаурилсульфат, повидон (тип К30), натрия стеарилфумарат.
10 шт. — упаковки ячейковые контурные (1) — пачки картонные.
10 шт. — упаковки ячейковые контурные (2) — пачки картонные.
10 шт. — упаковки ячейковые контурные (3) — пачки картонные.
10 шт. — упаковки ячейковые контурные (6) — пачки картонные.
10 шт. — упаковки ячейковые контурные (9) — пачки картонные.
15 шт. — упаковки ячейковые контурные (2) — пачки картонные.
15 шт. — упаковки ячейковые контурные (6) — пачки картонные.
Фармакологическое действие
Эзетимиб является представителем нового класса гиполипидемических средств, которые селективно ингибируют абсорбцию холестерина (Хс) и некоторых растительных стеролов в кишечнике.
Препарат Отрио эффективен при приеме внутрь. Механизм действия эзетимиба отличается от механизма действия других классов гиполипидемических средств (например, ингибиторов ГМГ-КоА-редуктазы (статинов), секвестрантов желчных кислот, фибратов и растительных станолов). Молекулярной мишенью эзетимиба является транспортный белок (Niemann-Pick Cl-Like 1, NPC1L1), ответственный за всасывание в кишечнике холестерина и фитостеролов.
Эзетимиб локализуется в щеточной каемке тонкого кишечника и препятствует всасыванию Хс, приводя к снижению поступления Хс из кишечника в печень, за счет чего снижаются запасы Хс в печени и усиливается выведение Хс из крови. Эзетимиб не усиливает экскрецию желчных кислот (в отличие от секвестрантов желчных кислот) и не ингибирует синтез Хс в печени (в отличие от статинов).
В клиническом исследовании, в которое были включены пациенты с гиперхолестеринемией, эзетимиб снижал абсорбцию Хс в кишечнике на 54% по сравнению с плацебо. Ингибируя абсорбцию Хс в кишечнике, эзетимиб снижает поступление Хс в печень. Статины снижают синтез Хс в печени. При одновременном применении препараты этих двух групп обеспечивают дополнительное снижение концентрации Хс. Эзетимиб, принимаемый одновременно со статинами, снижает концентрацию общего холестерина (ОХс), холестерина липопротеинов низкой плотности (Хс-ЛПНП), аполипопротеина В (апо-B), холестерина липопротеинов невысокой плотности (Хс-неЛПВП, рассчитывается как разность между концентрацией ОХс и концентрацией Хс-ЛПВП) и триглицеридов (ТГ), а также повышает концентрацию холестерина липопротеинов высокой плотности (Хс-ЛПВП) в плазме крови у пациентов с гиперхолестеринемией в большей степени, чем эзетимиб или статин, принимаемые в монотерапии. Одновременное применение эзетимиба с фенофибратом снижает концентрацию ОХс, Хс ЛПНП, апо-B, ТГ и Хс-неЛПВП, а также повышает концентрацию Хс-ЛПВП в плазме крови у пациентов со смешанной гиперхолестеринемией.
Клинические исследования показали, что повышенные концентрации ОХс, Хс-ЛПНП и апо-B (главного белкового компонента ЛПНП) способствуют развитию атеросклероза. Кроме того, сниженная концентрация Хс-ЛПВП также ассоциируется с развитием атеросклероза. Результаты эпидемиологических исследований показали, что сердечно-сосудистая заболеваемость и смертность находятся в прямой зависимости от концентраций ОХс и Хс-ЛПНП и в обратной зависимости от концентраций Хс-ЛПВП. Как и ЛПНП, липопротеины, богатые Хс и ТГ, включая липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП) и ремнанты также могут способствовать развитию атеросклероза.
Для определения селективности эзетимиба в отношении ингибирования всасывания Хс была проведена серия доклинических исследований. Эзетимиб ингибировал всасывание [14С]-холестерина и не оказывал влияния на всасывание ТГ, жирных кислот, желчных кислот, прогестерона, этинилэстрадиола или жирорастворимых витаминов А и D.
Фармакокинетика
Всасывание
После приема внутрь эзетимиб быстро всасывается и интенсивно метаболизируется в тонком кишечнике и печени путем конъюгации в фармакологически активный фенольный глюкуронид (эзетимиб-глюкуронид). Cmax в плазме крови эзетимиб-глюкуронида наблюдается через 1-2 ч, эзетимиба — через 4-12 ч. Абсолютная биодоступность эзетимиба не может быть определена, поскольку данное вещество практически нерастворимо ни в одном из водных растворителей, используемых для приготовления растворов для инъекций.
Прием пищи (с низким или высоким содержанием жира) не влиял на биодоступность эзетимиба при приеме внутрь в форме таблеток по 10 мг. Препарат Отрио можно принимать независимо от приема пищи.
Распределение
Эзетимиб и эзетимиб-глюкуронид связываются с белками плазмы крови на 99.7% и 88-92% соответственно.
Метаболизм
Метаболизм эзетимиба происходит главным образом в тонком кишечнике и печени путем конъюгации с глюкуронидом (реакция II фазы) с последующим выведением с желчью. Эзетимиб минимально подвергается окислительному метаболизму (реакция I фазы). Эзетимиб и эзетимиб-глюкуронид (основные производные эзетимиба, определяемые в плазме крови) составляют 10-20% и 80-90% соответственно от общей концентрации эзетимиба в плазме крови. Эзетимиб и эзетимиб-глюкуронид медленно выводятся из плазмы крови в процессе кишечно-печеночной рециркуляции.
Выведение
После приема внутрь эзетимиба в дозе 20 мг, меченного 14С, в плазме крови было обнаружено 93% суммарного эзетимиба (эзетимиб + эзетимиб-глюкуронид) от общего уровня радиоактивных продуктов. В течение 10 дней примерно 78% принятых радиоактивных продуктов было выведено через кишечник с желчью, 11% — через почки. Через 48 ч радиоактивных продуктов в плазме крови обнаружено не было.
Т1/2 для эзетимиба и эзетимиб-глюкуронида составляет примерно 22 ч.
Фармакокинетика у особых групп пациентов
Фармакокинетические показатели эзетимиба были одинаковы у детей старше 6 лет и взрослых. Фармакокинетические данные для детей младше 6 лет отсутствуют.
У пожилых пациентов (старше 65 лет) концентрация суммарного эзетимиба в плазме крови примерно в 2 раза выше, чем у более молодых пациентов (от 18 до 45 лет). Степень снижения концентрации Хс-ЛПНП и профиль безопасности были сопоставимы у пожилых и более молодых пациентов, принимавших эзетимиб. Для пожилых пациентов подбор дозы препарата не требуется.
Пациенты с печеночной недостаточностью. После однократного приема эзетимиба в дозе 10 мг среднее значение AUC суммарного эзетимиба было в 1.7 раза больше у пациентов с легкой степенью печеночной недостаточности (5-6 баллов по шкале Чайлд-Пью), чем у здоровых добровольцев. В 14-дневном исследовании применения эзетимиба в дозе 10 мг/сут с участием пациентов с умеренной степенью печеночной недостаточности (7-9 баллов по шкале Чайлд-Пью) среднее значение AUC суммарного эзетимиба увеличивалось в 4 раза на 1-й и 14-й день по сравнению со здоровыми добровольцами. Для пациентов с легкой степенью печеночной недостаточности коррекция дозы препарата не требуется. Поскольку последствия увеличения значения AUC суммарного эзетимиба неизвестны, эзетимиб не рекомендован пациентам с умеренной и тяжелой степенью (более 9 баллов по шкале Чайлд-Пью) печеночной недостаточности.
Пациенты с почечной недостаточность. После однократного приема эзетимиба в дозе 10 мг у пациентов с тяжелыми нарушениями функции почек (n=8; КК не более 30 мл/мин/1.73 м2), значение AUC суммарного эзетимиба увеличилось примерно в 1.5 раза по сравнению со здоровыми добровольцами (n=9). Данный результат не является клинически значимым. Для пациентов с нарушением функции почек подбор дозы препарата не требуется. У пациента после трансплантации почки, получавшего комплексную терапию, включая циклоспорин, значение AUC суммарного эзетимиба увеличилось в 12 раз.
Пол. Концентрация суммарного эзетимиба в плазме крови немного выше у женщин (менее 20%), чем у мужчин. Степень снижения Хс-ЛПНП и профиль безопасности одинаковы у мужчин и женщин, принимающих эзетимиб, поэтому для пациентов мужского или женского пола подбор дозы препарата не требуется.
Показания препарата
Отрио
Первичная гиперхолестеринемия
- в комбинации с ингибиторами ГМГ-КоА-редуктазы (статинами) или в монотерапии в дополнение к диете для снижения повышенной концентрации ОХс, Хс-ЛПНП, апо-B, ТГ и Хс-неЛПВП, а также для повышения концентрации Хс-ЛПВП у взрослых и подростков (10-17 лет) с первичной (гетерозиготной семейной и несемейной) гиперхолестеринемией;
- в комбинации с фенофибратом в дополнение к диете для снижения повышенной концентрации ОХс, Хс-ЛПНП, апо-B и Хс-неЛПВП у пациентов со смешанной гиперхолестеринемией.
Профилактика сердечно-сосудистых заболеваний
- в комбинации со статинами для снижения риска развития сердечно-сосудистых событий (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт, госпитализации по поводу нестабильной стенокардии или при потребности проведения реваскуляризации) у пациентов с ИБС.
Профилактика основных сердечно-сосудистых осложнений у пациентов с хронической болезнью почек
- в комбинации с симвастатином для снижения риска развития серьезных сердечно-сосудистых событий (нефатальный инфаркт миокарда или сердечная смерть, инсульт или любая процедура реваскуляризации) у пациентов с хронической болезнью почек.
Гомозиготная семейная гиперхолестеринемия
- в комбинации со статином для снижения повышенной концентрации ОХс и Хс-ЛПНП у взрослых и подростков (10-17 лет) с гомозиготной семейной гиперхолестеринемией. Пациенты могут также получать вспомогательное лечение (например, ЛПНП-аферез).
Режим дозирования
Перед началом лечения пациенты должны перейти к соответствующей липидснижающей диете и продолжать соблюдать эту диету во время всего периода терапии препаратом Отрио.
Препарат принимают внутрь в любое время суток независимо от приема пищи.
У пациентов с первичной гиперхолестеринемией доза препарата Отрио при монотерапии или в комбинации со статином или фенофибратом составляет 10 мг 1 раз/сут. Доза фенофибрата не должна превышать 160 мг 1 раз/сут при одновременном применении с препаратом Отрио.
Для дополнительного снижения сердечно-сосудистых событий у пациентов с ИБС препарат Отрио 10 мг может применяться в составе комбинированной терапии со статином с доказанным эффектом по снижению риска развития сердечно-сосудистых осложнений.
При комбинированной терапии с секвестрантами желчных кислот препарат Отрио следует принимать в дозе 10 мг 1 раз/сут по меньшей мере за 2 ч до или через 4 ч после приема секвестрантов желчных кислот.
При применении препарата в качестве монотерапии у пациентов с нарушением функции почек подбор дозы препарата не требуется. При применении препарата в составе комбинированной терапии с симвастатином у пациентов с легкой степенью нарушения функции почек (СКФ не менее 60 мл/мин/1.73 м2) подбор дозы препарата Отрио или симвастатина не требуется. Пациентам с нарушением функции почек и СКФ менее 60 мл/мин/1.73 м2 препарат Отрио назначают в дозе 10 мг и симвастатин в дозе 20 мг 1 раз/сут вечером. У этих пациентов применение симвастатина в более высокой дозе следует тщательно контролировать.
Для пациентов с легкой степенью печеночной недостаточности (5-6 баллов по шкале Чайлд-Пью) подбор дозы препарата не требуется. Применение препарата Отрио не рекомендуется пациентам с умеренным (7-9 баллов по шкале Чайлд-Пью) и тяжелым (более 9 баллов по шкале Чайлд-Пью) нарушением функции.
Для пожилых пациентов подбор дозы препарата не требуется.
Для детей и подростков от 6 лет коррекция дозы препарата не требуется. Применение препарата Отрио у детей в возрасте до 6 лет не рекомендуется по причине отсутствия данных по безопасности и эффективности в данной возрастной группе.
Побочное действие
В клинических исследованиях, в которых пациенты принимали эзетимиб в дозе 10 мг/сут в монотерапии, одновременно со статином или одновременно с фенофибратом, эзетимиб показал хорошую переносимость. Нежелательные реакции обычно были легкими и преходящими; общая частота нежелательных эффектов и частота случаев отмены лечения в связи с нежелательными эффектами при приеме препарата эзетимиба были сопоставимы с данными показателями при приеме плацебо.
Следующие нежелательные реакции (часто (≥1/100 и <1/10) или нечасто (≥1/1000 и <1/100)) наблюдались при приеме эзетимиба в монотерапии с частотой, превышающей аналогичную частоту при приеме плацебо, или при одновременном приеме эзетимиба со статином с частотой, превышающей аналогичную частоту при приеме статина в монотерапии.
Применение эзетимиба в монотерапии
Со стороны обмена веществ и питания: нечасто — снижение аппетита.
Со стороны сердечно-сосудистой системы: нечасто — «приливы» крови к коже лица, повышение АД.
Со стороны дыхательной системы: нечасто — кашель.
Со стороны пищеварительной системы: часто — боль в животе, диарея, метеоризм; нечасто — диспепсия, гастроэзофагеальный рефлюкс, тошнота.
Со стороны костно-мышечной системы: нечасто — артралгия, мышечные спазмы, боль в шее.
Общие расстройства: часто — утомляемость; нечасто — боль в груди, боль.
Лабораторные и инструментальные данные: нечасто — повышение активности АЛТ и/или ACT, повышение активности КФК в сыворотке крови, повышение активности ГГТ, нарушение показателей функции печени.
Применение эзетимиба одновременно со статином
Со стороны нервной системы: часто — головная боль; нечасто — парестезия.
Со стороны пищеварительной системы: нечасто — сухость слизистой оболочки полости рта, гастрит.
Со стороны кожи и подкожных тканей: нечасто — кожный зуд, кожная сыпь, крапивница.
Со стороны костно-мышечной системы: часто — миалгия; нечасто — боль в спине, мышечная слабость, боль в конечности.
Общие расстройства: нечасто — астения, периферические отеки.
Лабораторные и инструментальные данные: часто — повышение активности АЛТ и/или ACT.
Применение эзетимиба одновременно с фенофибратом
Со стороны пищеварительной системы: часто — боль в животе.
В клиническом исследовании с участием пациентов со смешанной гиперлипидемией частота последовательного клинически значимого повышения (более чем в 3 раза выше ВГН) активности печеночных трансаминаз сыворотки крови составила 4.5% в группе пациентов, принимавших фенофибрат в монотерапии, и 2.7% в группе пациентов, принимавших эзетимиб одновременно с фенофибратом. Частота холецистэктомии составила 0.6% в группе пациентов, принимавших фенофибрат в монотерапии, и 1.7% в группе пациентов, принимавших эзетимиб одновременно с фенофибратом. Не наблюдалось повышения активности КФК (более чем в 10 раз выше ВГН) ни в одной из групп лечения в данном исследовании.
Пациенты с ИБС
В клиническом исследовании пациенты с ИБС принимали симвастатин + эзетимиб в дозе 40 мг + 10 мг или симвастатин в дозе 40 мг. Профиль безопасности препаратов в двух группах был сходным за весь период наблюдения (медиана длительности наблюдения составила 6 лет). Частота прекращения приема препарата из-за нежелательных явлений составила 10.6% в группе пациентов, принимавших симвастатин + эзетимиб, и 10.1% в группе пациентов, принимавших симвастатин. Частота развития миопатии составила 0.2% в группе пациентов, принимавших симвастатин + эзетимиб, и 0.1% в группе пациентов, принимавших симвастатин, где миопатия определялась как необъяснимая мышечная слабость или мышечная боль, сопровождающаяся повышением активности КФК не менее чем в 10 раз выше ВГН или двумя последовательными повышениями активности КФК от 5 до 10 раз выше ВГН. Частота развития рабдомиолиза составила 0.1% в группе пациентов, принимавших симвастатин + эзетимиб, и 0.2% в группе пациентов, принимавших симвастатин, где рабдомиолиз определялся как необъяснимая мышечная слабость или мышечная боль, сопровождающаяся повышением активности КФК не менее чем в 10 раз выше ВГН с признаками нарушения функции почек, двумя последовательными повышениями активности КФК от 5 до 10 раз выше ВГН с признаками нарушения функции почек, или активностью КФК не менее 10000 МЕ/мл без признаков нарушения функции почек. Частота последовательных повышений активности печеночных трансаминаз (не менее чем в 3 раза выше ВГН) была 2.5% в группе пациентов, принимавших симвастатин + эзетимиб, и 2.3% в группе пациентов, принимавших симвастатин. Нежелательные явления со стороны желчного пузыря наблюдались у 3.1% пациентов, принимавших симвастатин + эзетимиб и 3.5% пациентов, принимавших симвастатин. Частота госпитализации с холецистэктомией была 1.5% в обеих группах. Рак (определялся как любое новое злокачественное новообразование) диагностировался в течение исследования у 9.4% пациентов, принимавших симвастатин + эзетимиб, и 9.5% пациентов, принимавших симвастатин.
Пациенты с хронической болезнью почек
В клиническом исследовании кардио- и нефропротекторного действия с участием пациентов, принимавших комбинированный гиполипидемический препарат с фиксированными дозами эзетимиба (10 мг) и симвастатина (20 мг) 1 раз/сут, и пациентов, принимавших плацебо, профили безопасности были сопоставимы в течение всего периода наблюдения (медиана длительности наблюдения составила 4.9 года). В данном клиническом исследовании регистрировались только серьезные нежелательные явления и прекращение приема препарата по причине развития нежелательных явлений. Частота прекращения приема препарата была сопоставима в обеих группах (10.4% в группе пациентов, принимавших комбинированный препарат с фиксированными дозами эзетимиба и симвастатина, и 9.8% в группе пациентов, принимавших плацебо). Частота развития миопатии/рабдомиолиза составила 0.2% в группе пациентов, принимавших комбинированный препарат с фиксированными дозами эзетимиба и симвастатина, и 0.1% в группе пациентов, принимавших плацебо. Последовательное повышение активности печеночных трансаминаз (более чем в 3 раза выше ВГН) наблюдалось у 0.7% пациентов, принимавших комбинированный препарат с фиксированными дозами эзетимиба и симвастатина, и у 0.6% пациентов, принимавших плацебо. В данном клиническом исследовании не наблюдалось статистически достоверного увеличения частоты таких нежелательных явлений, как злокачественные новообразования (9.4% в группе пациентов, принимавших комбинированный препарат с фиксированными дозами эзетимиба и симвастатина, и 9.5% в группе пациентов, принимавших плацебо), гепатит, холецистэктомия или осложнения желчнокаменной болезни или панкреатита.
Дети и подростки в возрасте от 6 до 17 лет
В клиническом исследовании с участием детей в возрасте от 6 до 10 лет с гетерозиготной семейной или несемейной гиперхолестеринемией профиль безопасности и переносимости эзетимиба был сопоставим с профилем у взрослых пациентов, получавших эзетимиб.
В клиническом исследовании с участием детей в возрасте от 10 до 17 лет с гетерозиготной семейной гиперхолестеринемией, принимавших комбинированную терапию эзетимибом и симвастатином, профиль безопасности и переносимости был сопоставим с профилем безопасности у взрослых пациентов, получавших комбинированное лечение эзетимибом и симвастатином.
Лабораторные показатели
В клинических исследованиях частота последовательного клинически значимого повышения активности печеночных трансаминаз в сыворотке крови (активность АЛТ и/или ACT в 3 или более раз превышающая ВГН) была сопоставима при применении эзетимиба в монотерапии (0.5%) и при приеме плацебо (0.3%). При изучении безопасности комбинированной терапии частота клинически значимого повышения активности печеночных трансаминаз в сыворотке крови составила 1.3% у пациентов, принимавших эзетимиб одновременно со статином, и 0.4% у пациентов, принимавших статин в монотерапии. Повышение активности трансаминаз в сыворотке крови обычно протекало бессимптомно, не сопровождалось развитием холестаза и возвращалось на исходный уровень как при продолжении лечения, так и после отмены препарата.
Частота возникновения клинически значимого повышения активности КФК (в 10 и более раз выше ВГН) у пациентов, принимавших эзетимиб в монотерапии, была схожей с данным показателем у пациентов, принимавших плацебо или статин в монотерапии.
Пострегистрационные наблюдения
При применении эзетимиба в пострегистрационном периоде сообщалось о следующих нежелательных реакциях без указания причинно-следственной связи.
Со стороны системы кроветворения: тромбоцитопения.
Со стороны иммунной системы: реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, кожную сыпь и крапивницу.
Со стороны психики: депрессия.
Со стороны нервной системы: головокружение, парестезия.
Со стороны пищеварительной системы: панкреатит, запор.
Со стороны печени и желчевыводящих путей: гепатит, холелитиаз, холецистит.
Со стороны кожи и подкожных тканей: мультиформная эритема.
Со стороны костно-мышечной системы: миалгия, миопатия/рабдомиолиз.
Общие расстройства: астения.
Противопоказания к применению
- повышенная чувствительность к любому из компонентов препарата;
- пациентам с умеренной и тяжелой степенью печеночной недостаточности (7-9 и более баллов по шкале Чайлд-Пью);
- непереносимость лактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция;
- детский возраст до 6 лет.
С осторожностью: при одновременном применении препарата с фибратами, циклоспорином и непрямыми антикоагулянтами (включая варфарин и флуиндион); одновременном применении с фенофибратом (пациенты должны знать о возможном риске развития заболеваний желчного пузыря).
При назначении эзетимиба одновременно со статином или фенофибратом необходимо следовать инструкции по применению дополнительно назначенных препаратов.
Применение при беременности и кормлении грудью
Беременность
Исследования на животных с введением эзетимиба не выявили прямых и опосредованных неблагоприятных эффектов в отношении беременности, развития эмбриона/плода, родов и постнатального развития. При введении беременным крысам эзетимиба в комбинации с ловастатином, симвастатином, правастатином или аторвастатином тератогенных эффектов не наблюдалось. При введении беременным крольчихам с небольшой частотой наблюдались дефекты развития скелета у плода.
Клинических данных по применению эзетимиба при беременности нет, поэтому следует соблюдать осторожность при назначении препарата беременным женщинам. В случае наступления беременности прием эзетимиба следует прекратить.
При одновременном применении препарата Отрио и статина необходимо следовать инструкции по применению данного статина.
Период грудного вскармливания
В исследованиях на крысах было выявлено, что эзетимиб выделяется с грудным молоком. Данных о выделении эзетимиба с грудным молоком у женщин нет. В связи с этим эзетимиб не рекомендуется применять в период грудного вскармливания, в случае если потенциальная польза не превышает потенциальный риск для ребенка. Если применение препарата необходимо, пациентка должна прекратить кормление грудью.
Применение при нарушениях функции печени
Противопоказано применение препарата пациентам с умеренной и тяжелой степенью печеночной недостаточности (7-9 и более баллов по шкале Чайлд-Пью).
Для пациентов с легкой степенью печеночной недостаточности (5-6 баллов по шкале Чайлд-Пью) подбор дозы препарата не требуется.
Применение при нарушениях функции почек
При применении препарата в качестве монотерапии у пациентов с нарушением функции почек подбор дозы препарата не требуется.
Применение у детей
Противопоказано применение препарата у детей в возрасте до 6 лет.
Применение у пожилых пациентов
Для пациентов пожилого возраста подбор дозы препарата не требуется.
Особые указания
Перед началом лечения пациенты должны перейти к соответствующей липидснижающей диете и продолжать соблюдать эту диету во время всего периода терапии препаратом эзетимиба.
Если эзетимиб назначают в комбинации со статином или фенофибратом, следует внимательно ознакомиться с инструкцией по применению назначаемого дополнительно препарата.
Ферменты печени
В клинических исследованиях с одновременным применением эзетимиба и статина у пациентов наблюдалось последовательное повышение активности печеночных трансаминаз (в 3 и более раз выше ВГН). Если эзетимиб назначается в комбинации со статином, контроль функции печени следует проводить в начале лечения и далее в соответствии с рекомендациями для данного статина.
В клиническом исследовании пациенты с ИБС принимали симвастатин + эзетимиб в дозе 40 мг + 10 мг ежедневно или симвастатин в дозе 40 мг ежедневно (медиана длительности наблюдения составила 6 лет). Частота последовательного повышения активности печеночных трансаминаз (не менее чем в 3 раза выше ВГН) была 2.5% в группе пациентов, принимавших симвастатин + эзетимиб, и 2.3% в группе пациентов, принимавших симвастатин.
В клиническом исследовании с участием пациентов с хронической болезнью почек частота последовательного повышения активности печеночных трансаминаз (в 3 и более раз выше ВГН) составила 0.7% в группе пациентов, принимавших комбинированный гиполипидемический препарат с фиксированными дозами эзетимиба (10 мг) и симвастатина (20 мг) 1 раз/сут, и 0.6% в группе пациентов, принимавших плацебо.
Скелетная мускулатура
В клинических исследованиях частота возникновения миопатии или рабдомиолиза, связанных с применением эзетимиба, не превышала таковую в сравнении с соответствующей контрольной группой (плацебо или монотерапии статином), однако миопатия и рабдомиолиз являются известными нежелательными реакциями статинов и других липидснижающих средств. В клинических исследованиях частота повышения активности КФК (более чем в 10 раз превышающая ВГН) составила 0.2% в группе эзетимиба в сравнении с 0.1% в группе плацебо и 0.1% в группе одновременного применения эзетимиба и статина в сравнении с 0.4% в группе монотерапии статином.
В пострегистрационном периоде применения эзетимиба были получены сообщения о случаях развития миопатии и рабдомиолиза независимо от причины их развития. Большинство пациентов, у которых развивался рабдомиолиз, принимали статины до начала приема препарата эзетимиба. Тем не менее, очень редко сообщалось о развитии рабдомиолиза при применении эзетимиба в монотерапии и при одновременном применении эзетимиба и лекарственных препаратов, применение которых, как известно, ассоциировано с повышенным риском развития рабдомиолиза.
Все пациенты, которым назначается эзетимиб, должны быть предупреждены о риске развития миопатии и рабдомиолиза и должны сообщать врачу о любых необъяснимых мышечных болях, болезненности или слабости. Если миопатия диагностирована или подозревается, применение эзетимиба и любого статина, принимаемого одновременно с эзетимибом, следует немедленно прекратить. Наличие данных симптомов и повышение активности КФК (более чем в 10 раз выше ВГН) указывает на развитие миопатии.
В клиническом исследовании пациенты с ИБС принимали симвастатин + эзетимиб в дозе 40 мг + 10 мг ежедневно или симвастатин в дозе 40 мг ежедневно (медиана длительности наблюдения составила 6 лет). Частота развития миопатии составила 0.2% в группе пациентов, принимавших симвастатин + эзетимиб, и 0.1% в группе пациентов, принимавших симвастатин, где миопатия определялась как необъяснимая мышечная слабость или мышечная боль, сопровождающаяся повышением активности КФК не менее чем в 10 раз выше ВГН или двумя последовательными повышениями активности КФК от 5 до 10 раз выше ВГН. Частота развития рабдомиолиза составила 0.1% в группе пациентов, принимавших симвастатин + эзетимиб, и 0.2% в группе пациентов, принимавших симвастатин, где рабдомиолиз определялся как необъяснимая мышечная слабость или мышечная боль, сопровождающаяся повышением активности КФК не менее чем в 10 раз выше ВГН с признаками нарушения функции почек, двумя последовательными повышениями активности КФК от 5 до 10 раз выше ВГН с признаками нарушения функции почек, или активностью КФК не менее 10000 МЕ/мл без признаков нарушения функции почек.
В клиническом исследовании с участием пациентов с хронической болезнью почек частота развития миопатии/рабдомиолиза составила 0.2% в группе пациентов, принимавших комбинированный гиполипидемический препарат с фиксированными дозами эзетимиба (10 мг) и симвастатина (20 мг) ежедневно, и 0.1% в группе пациентов, принимавших плацебо.
Использование в педиатрии
Безопасность и эффективность эзетимиба у детей в возрасте от 6 до 10 лет с гетерозиготной семейной или несемейной гиперхолестеринемией были изучены в клиническом исследовании длительностью 12 недель. Профиль побочных явлений у детей, получавших эзетимиб, был сопоставим с профилем побочных явлений у взрослых пациентов, получавших эзетимиб. В данном клиническом исследовании не наблюдалось явного воздействия на рост или половое созревание мальчиков или девочек. Однако воздействие эзетимиба на рост и половое созревание не были изучены при лечении длительностью более 12 недель.
Безопасность и эффективность эзетимиба, принимаемого одновременно с симвастатином, у детей в возрасте от 10 до 17 лет с гетерозиготной семейной гиперхолестеринемией были изучены в клиническом исследовании у мальчиков-подростков и девочек (как минимум один год после менархе). Профиль побочных явлений у подростков, получавших эзетимиб и симвастатин в дозе до 40 мг/сут, был сопоставим с профилем побочных явлений у взрослых пациентов, получавших эзетимиб и симвастатин. В данном клиническом исследовании не наблюдалось явного воздействия на рост или половое созревание у подростков (мальчиков или девочек), или какого-либо влияния на продолжительность менструального цикла у девочек.
Печеночная недостаточность
Поскольку последствия увеличения значения AUC суммарного эзетимиба неизвестны, препарат не рекомендуется пациентам с умеренной и тяжелой степенью печеночной недостаточности.
Фибраты
Безопасность и эффективность применения эзетимиба одновременно с фибратами (за исключением фенофибрата) не установлена. Одновременное применение препарата Ортио с фибратами (за исключением фенофибрата) не рекомендуется.
Фенофибрат
Пациенты, принимающие фенофибрат одновременно с эзетимибом, должны быть предупреждены о возможном риске возникновения желчнокаменной болезни и заболеваний желчного пузыря. Если врач предполагает возможное развитие указанных выше заболеваний у пациента, необходимо провести исследования желчного пузыря и назначить альтернативную липидснижающую терапию.
Циклоспорин
При назначении эзетимиба пациентам, принимающим циклоспорин, следует соблюдать меры предосторожности. Необходим регулярный контроль концентрации циклоспорина в плазме крови при одновременном применении эзетимиба и циклоспорина.
Непрямые антикоагулянты
При одновременном применении эзетимиба с непрямыми антикоагулянтами, включая варфарин или флуиндион, необходимо контролировать значения показателя МНО.
Влияние на способность к управлению транспортными средствами и механизмами
Не проводилось исследований для оценки влияния на способность управлять транспортными средствами и работать с механизмами, однако некоторые нежелательные эффекты, наблюдавшиеся при приеме эзетимиба, могут влиять на способность некоторых пациентов управлять транспортными средствами и работать с механизмами.
Передозировка
Сообщалось о нескольких случаях передозировки, большинство из которых не сопровождалось возникновением нежелательных явлений, а в случае их возникновения нежелательные явления не были серьезными.
В клинических исследованиях, в которых эзетимиб назначался 15 здоровым добровольцам в дозе 50 мг/сут в течение 14 дней, 18 пациентам с первичной гиперхолестеринемией в дозе 40 мг/сут в течение 56 дней или 27 пациентам с гомозиготной ситостеролемией в дозе 40 мг/сут в течение 26 недель, была продемонстрирована хорошая переносимость препарата.
Лечение: в случае передозировки следует проводить симптоматическое лечение и поддерживающую терапию.
Лекарственное взаимодействие
В доклинических исследованиях было показано, что эзетимиб не индуцирует изоферменты цитохрома Р450, участвующие в метаболизме лекарственных средств. Между эзетимибом и средствами, метаболизирующимися под действием изоферментов 1А2, 2D6, 2С8, 2С9 и 3А4 цитохрома Р450 или N-ацетилтрансферазы, клинически значимого фармакокинетического взаимодействия не наблюдалось.
При одновременном применении эзетимиб не оказывает влияния на фармакокинетику дапсона, декстрометорфана, дигоксина, пероральных контрацептивов (этинилэстрадиола и левоноргестрела), глипизида, толбутамида, мидазолама. Одновременное применение циметидина и эзетимиба не оказывает влияния на биодоступность эзетимиба.
Антациды: одновременный прием антацидов снижает скорость всасывания эзетимиба, но не оказывает влияния на его биодоступность. Это снижение скорости всасывания не рассматривается как клинически значимое.
Колестирамин: одновременный прием колестирамина уменьшает среднее значение AUC суммарного эзетимиба (эзетимиб + эзетимиб-глюкуронид) приблизительно на 55%. Эффект дополнительного снижения концентрации Хс-ЛПНП за счет одновременного применения эзетимиба и колестирамина может быть уменьшен данным взаимодействием.
Циклоспорин: у пациентов, перенесших трансплантацию почки, с КК более 50 мл/мин, принимавших циклоспорин в постоянной дозе, однократный прием эзетимиба в дозе 10 мг приводил к увеличению значения AUC суммарного эзетимиба в среднем в 3.4 раза (от 2.3 до 7.9 раз) по сравнению с данным показателем у здоровых добровольцев. У одного пациента после трансплантации почки и с тяжелой почечной недостаточностью (КК 13.2 мл/мин/1.73 м2), принимавшего комплексную терапию, включая циклоспорин, наблюдалось 12-кратное увеличение концентрации суммарного эзетимиба по сравнению с контрольной группой. В перекрестном исследовании с двумя периодами с участием 12 здоровых добровольцев, принимавших в течение 8 дней эзетимиб в дозе 20 мг 1 раз/сут с приемом однократной дозы 100 мг циклоспорина на 7-й день терапии эзетимибом, было выявлено увеличение значения AUC циклоспорина в среднем на 15% (от снижения на 10% до увеличения на 51%) в сравнении с данным показателем у здоровых добровольцев, принимавших циклоспорин однократно в дозе 100 мг в монотерапии.
Фибраты: безопасность и эффективность применения эзетимиба одновременно с фенофибратом были оценены в клинических исследованиях. Безопасность и эффективность применения эзетимиба одновременно с другими фибратами не изучены. Фибраты могут повышать выделение Хс с желчью, что может привести к желчнокаменной болезни. В доклиническом исследовании на собаках эзетимиб повышал концентрацию Хс в желчи. Хотя значение этих данных для человека пока неизвестно, одновременное применение эзетимиба с фибратами (за исключением фенофибрата) до получения дополнительных данных по результатам клинических исследований не рекомендуется. Одновременный прием эзетимиба и фенофибрата или гемфиброзила повышает концентрацию суммарного эзетимиба приблизительно в 1.5 и 1.7 раза соответственно, однако эти повышения не рассматриваются как клинически значимые.
Статины: при одновременном приеме эзетимиба с аторвастатином, ловастатином, правастатином, симвастатином, флувастатином и розувастатином клинически значимого фармакокинетического взаимодействия не наблюдалось.
Непрямые антикоагулянты: одновременное применение эзетимиба в дозе 10 мг 1 раз/сут и варфарина не оказывало значимого влияния на биодоступность варфарина и протромбиновое время в исследовании с участием 12 здоровых добровольцев. В пострегистрационном периоде были получены сообщения об увеличении МНО у пациентов, принимавших одновременно эзетимиб с варфарином или флуиндионом. Данные пациенты также принимали другие лекарственные средства.
Условия хранения препарата Отрио
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Отрио
Срок годности — 2 года. Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
АКРИХИН АО
(Россия)

|
|
142450 Московская обл., г.о. Богородский, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Отрио — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005169
Торговое наименование:
Отрио
Международное непатентованное наименование:
Эзетимиб
Лекарственная форма:
таблетки
Состав
1 таблетка содержит:
действующее вещество: эзетимиб в пересчете на 100% вещество – 10,0 мг;
вспомогательные вещества: целлюлоза микрокристаллическая, лактозы моногидрат, кроскармеллоза натрия, натрия лаурилсульфат, повидон (тип К30), натрия стеарилфумарат.
Описание
Круглые плоскоцилиндрические таблетки от белого до белого с желтоватым оттенком цвета, с фаской.
Фармакотерапевтическая группа:
гиполипидемическое средство – ингибитор абсорбции холестерина.
Код ATX:
С10АХ09
Фармакологические свойства
Эзетимиб является представителем нового класса гиполипидемических средств, которые селективно ингибируют абсорбцию холестерина (ХС) и некоторых растительных стеролов в кишечнике.
Фармакодинамика
Препарат Отрио эффективен при приеме внутрь. Механизм действия эзетимиба отличается от механизма действия других классов гиполипидемических средств (например, ингибиторов ГМГ-КоА-редуктазы (статинов), секвестрантов желчных кислот, фибратов и растительных станолов). Молекулярной мишенью эзетимиба является транспортный белок (Niemann-Pick Cl-Like 1, NPC1L1), ответственный за всасывание в кишечнике холестерина и фитостеролов.
Эзетимиб локализуется в щеточной каемке тонкого кишечника и препятствует всасыванию ХС, приводя к снижению поступления ХС из кишечника в печень, за счет чего снижаются запасы ХС в печени и усиливается выведение ХС из крови. Эзетимиб не усиливает экскрецию желчных кислот (в отличие от секвестрантов желчных кислот) и не ингибирует синтез ХС в печени (в отличие от статинов).
В клиническом исследовании, в которое были включены пациенты с гиперхолестеринемией, эзетимиб снижал абсорбцию ХС в кишечнике на 54% по сравнению с плацебо. Ингибируя абсорбцию ХС в кишечнике, эзетимиб снижает поступление ХС в печень. Статины снижают синтез ХС в печени. При одновременном применении препараты этих двух групп обеспечивают дополнительное снижение концентрации ХС. Эзетимиб, принимаемый одновременно со статинами, снижает концентрацию общего холестерина (ОХС), холестерина липопротеинов низкой плотности (ХС ЛПНП), аполипопротеина В (апо-В), холестерина липопротеинов невысокой плотности (ХС не-ЛПВП, рассчитывается как разность между концентрацией ОХС и концентрацией ХС ЛПВП) и триглицеридов (ТГ), а также повышает концентрацию холестерина липопротеинов высокой плотности (ХС ЛПВП) в плазме крови у пациентов с гиперхолестеринемией в большей степени, чем эзетимиб или статин, принимаемые в монотерапии. Одновременное применение эзетимиба с фенофибратом снижает концентрацию ОХС, ХС ЛПНП, апо-В, ТГ и ХС не-ЛПВП, а также повышает концентрацию ХС ЛПВП в плазме крови у пациентов со смешанной гиперхолестериненимей.
Клинические исследования показали, что повышенные концентрации ОХС, ХС ЛПНП и апо-В (главного белкового компонента ЛПНП) способствуют развитию атеросклероза. Кроме того, сниженная концентрация ХС ЛПВП также ассоциируется с развитием атеросклероза. Результаты эпидемиологических исследований показали, что сердечно-сосудистая заболеваемость и смертность находятся в прямой зависимости от концентраций ОХС и ХС ЛПНП и в обратной зависимости от концентраций ХС ЛПВП. Как и ЛПНП, липопротеины, богатые ХС и ТГ, включая липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП) и ремнанты также могут способствовать развитию атеросклероза.
Для определения селективности эзетимиба в отношении ингибирования всасывания ХС была проведена серия доклинических исследований. Эзетимиб ингибировал всасывание [14С]-холестерина и не оказывал влияния на всасывание ТГ, жирных кислот, желчных кислот, прогестерона, этинилэстрадиола или жирорастворимых витаминов А и D.
Фармакокинетика
Всасывание
После приема внутрь эзетимиб быстро всасывается и интенсивно метаболизируется в тонком кишечнике и печени путем конъюгации в фармакологически активный фенольный глюкуронид (эзетимиб-глюкуронид). Максимальная концентрация в плазме крови (Сmax) эзетимиб-глюкуронида наблюдается через 1-2 часа, эзетимиба – через 4-12 часов. Абсолютная биодоступность эзетимиба не может быть определена, поскольку данное вещество практически нерастворимо ни в одном из водных растворителей, используемых для приготовления растворов для инъекций.
Прием пищи (с низким или высоким содержанием жира) не влиял на биодоступность эзетимиба при приеме внутрь в виде таблеток по 10 мг. Препарат Отрио можно принимать независимо от приема пищи.
Распределение
Эзетимиб и эзетимиб-глюкуронид связываются с белками плазмы крови на 99,7% и 88-92% соответственно
Метаболизм
Метаболизм эзетимиба происходит главным образом в тонком кишечнике и печени путем конъюгации с глюкуронидом (реакция II фазы) с последующим выведением с желчью. Эзетимиб минимально подвергается окислительному метаболизму (реакция I фазы). Эзетимиб и эзетимиб-глюкуронид (основные производные эзетимиба, определяемые в плазме крови) составляют 10-20% и 80-90% соответственно от общей концентрации эзетимиба в плазме крови. Эзетимиб и эзетимиб-глюкуронид медленно выводятся из плазмы крови в процессе кишечно-печеночной рециркуляции. Период полувыведения для эзетимиба и эзетимиб-глюкуронида составляет примерно 22 часа.
Выведение
После приема внутрь 20 мг эзетимиба, меченного 14С, в плазме крови было обнаружено 93% суммарного эзетимиба (эзетимиб + эзетимиб-глюкуронид) от общего уровня радиоактивных продуктов. В течение 10 дней примерно 78% принятых радиоактивных продуктов было выведено через кишечник с желчью, 11% – через почки. Через 48 часов радиоактивных продуктов в плазме крови обнаружено не было.
Фармакокинетика у отдельных групп пациентов
Дети и подростки
Фармакокинетические показатели эзетимиба были одинаковы у детей старше 6 лет и взрослых. Фармакокинетические данные для детей младше 6 лет отсутствуют.
Пожилые пациенты
У пожилых пациентов (старше 65 лет) концентрация суммарного эзетимиба в плазме крови примерно в 2 раза выше, чем у более молодых пациентов (от 18 до 45 лет). Степень снижения концентрации ХС ЛПНП и профиль безопасности были сопоставимы у пожилых и более молодых пациентов, принимавших эзетимиб. Для пожилых пациентов подбор дозы препарата не требуется.
Пациенты с печеночной недостаточностью
После однократного приема эзетимиба в дозе 10 мг среднее значение площади под кривой «концентрация-время» (AUC) суммарного эзетимиба было в 1,7 раза больше у пациентов с легкой степенью печеночной недостаточности (5-6 баллов по шкале Чайлд-Пью), чем у здоровых добровольцев. В 14-дневном исследовании применения эзетимиба в дозе 10 мг в сутки с участием пациентов с умеренной степенью печеночной недостаточности (7-9 баллов по шкале Чайлд-Пью) среднее значение AUC суммарного эзетимиба увеличивалось в 4 раза на 1-й и 14-й день по сравнению со здоровыми добровольцами. Для пациентов с легкой степенью печеночной недостаточности коррекция дозы препарата не требуется. Поскольку последствия увеличения значения AUC суммарного эзетимиба неизвестны, эзетимиб не рекомендован пациентам с умеренной и тяжелой степенью (более 9 баллов по шкале Чайлд-Пью) печеночной недостаточности.
Пациенты с почечной недостаточностью
После однократного приема эзетимиба в дозе 10 мг у пациентов с тяжелыми нарушениями функции почек (n = 8; клиренс креатинина (КК) не более 30 мл/мин/1,73 м²), значение AUC суммарного эзетимиба увеличилось примерно в 1,5 раза по сравнению со здоровыми добровольцами (n = 9). Данный результат не является клинически значимым. Для пациентов с нарушением функции почек подбор дозы препарата не требуется. У пациента после трансплантации почки, получавшего комплексную терапию, включая циклоспорин, значение AUC суммарного эзетимиба увеличилось в 12 раз.
Пол
Концентрация суммарного эзетимиба в плазме крови немного выше у женщин (менее 20%), чем у мужчин. Степень снижения ХС ЛПНП и профиль безопасности одинаковы у мужчин и женщин, принимающих эзетимиб, поэтому для пациентов мужского или женского пола подбор дозы препарата не требуется.
Показания к применению
Первичная гиперхолестеринемия
Препарат Отрио в комбинации с ингибиторами ГМГ-КоА-редуктазы (статинами) или в монотерапии в дополнение к диете показан для снижения повышенной концентрации ОХС, ХС ЛПНП, апо-В, ТГ и ХС не-ЛПВП, а также для повышения концентрации ХС ЛПВП у взрослых и подростков (10-17 лет) с первичной (гетерозиготной семейной и несемейной) гиперхолестеринемией.
Препарат Отрио в комбинации с фенофибратом в дополнение к диете показан для снижения повышенной концентрации ОХС, ХС ЛПНП, апо-В и ХС не-ЛПВП у пациентов со смешанной гиперхолестеринемией (см. «Способ применения и дозы»).
Профилактика сердечно-сосудистых заболеваний
Препарат Отрио, принимаемый в комбинации со статинами, показан для снижения риска развития сердечно-сосудистых событий (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт, госпитализации по поводу нестабильной стенокардии или при потребности проведения реваскуляризации) у пациентов с ишемической болезнью сердца (ИБС).
Профилактика основных сердечно-сосудистых осложнений у пациентов с хронической болезнью почек
Препарат Отрио, принимаемый в комбинации с симвастатином, показан для снижения риска развития серьезных сердечно-сосудистых событий (нефатальный инфаркт миокарда или сердечная смерть, инсульт или любая процедура реваскуляризации) у пациентов с хронической болезнью почек.
Гомозиготная семейная гиперхолестеринемия
Препарат Отрио в комбинации со статином показан для снижения повышенной концентрации ОХС и ХС ЛПНП у взрослых и подростков (10-17 лет) с гомозиготной семейной гиперхолестеринемией. Пациенты могут также получать вспомогательное лечение (например, ЛПНП-аферез).
Противопоказания
- Повышенная чувствительность к любому из компонентов препарата.
- При назначении эзетимиба одновременно со статином или фенофибратом необходимо следовать инструкции по применению дополнительно назначенных препаратов.
- Эзетимиб не рекомендуется пациентам с умеренной и тяжелой степенью печеночной недостаточности (7-9 и более баллов по шкале Чайлд-Пью, см. Фармакологические свойства, Фармакокинетика у отдельных групп пациентов; Способ применения и дозы).
- Непереносимость лактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция.
- Детский возраст до 6 лет.
С осторожностью
Следует соблюдать осторожность при одновременном применении препарата Отрио с фибратами, циклоспорином и непрямыми антикоагулянтами (включая варфарин и флуиндион). Пациенты, одновременно принимающие препарат Отрио и фенофибрат, должны знать о возможном риске развития заболеваний желчного пузыря.
Применение при беременности и в период грудного вскармливания
Исследования на животных с введением эзетимиба не выявили прямых и опосредованных неблагоприятных эффектов в отношении беременности, развития эмбриона/плода, родов и постнатального развития. При введении беременным крысам эзетимиба в комбинации с ловастатином, симвастатином, правастатином или аторвастатином тератогенных эффектов не наблюдалось. При введении беременным крольчихам с небольшой частотой наблюдались дефекты развития скелета у плода.
Клинических данных по применению эзетимиба при беременности нет, поэтому следует соблюдать осторожность при назначении препарата беременным женщинам. В случае наступления беременности прием эзетимиба должен быть прекращен.
При одновременном применении препарата Отрио и статина необходимо следовать инструкции по применению данного статина.
В исследованиях на крысах было выявлено, что эзетимиб выделяется с молоком. Данных о выделении эзетимиба с грудным молоком у женщин нет. В связи с этим эзетимиб не рекомендуется применять в период грудного вскармливания, в случае если потенциальная польза не превышает потенциальный риск для ребенка. Если применение препарата необходимо, пациентка должна прекратить кормление грудью.
Способ применения и дозы
Перед началом лечения пациенты должны перейти к соответствующей липидснижающей диете и продолжать соблюдать эту диету во время всего периода терапии препаратом Отрио.
Применения у пациентов с первичной гиперхолестеринемией
Препарат принимают внутрь в любое время суток независимо от приема пищи.
Доза препарата Отрио при монотерапии или в комбинации со статином или фенофибратом составляет 10 мг 1 раз в сутки. Доза фенофибрата не должна превышать 160 мг 1 раз в сутки при одновременном применении с препаратом Отрио.
Применения у пациентов с ишемической болезнью сердца
Комбинированная терапия со статинами
Для дополнительного снижения сердечно-сосудистых событий у пациентов с ИБС Отрио 10 мг может применяться со статином с доказанным эффектом по снижению риска развития сердечно-сосудистых осложнений.
Применение у пациентов с нарушением функции почек/хронической болезнью почек
Монотерапия
Для пациентов с нарушением функции почек подбор дозы препарата не требуется (см. Фармакологические свойства, Фармакокинетика у отдельных групп пациентов).
Комбинированная терапия с симвастатином
Для пациентов с легкой степенью нарушения функции почек (скорость клубочковой фильтрации (СКФ) не менее 60 мл/мин/1,73 м²) подбор дозы препарата Отрио или симвастатина не требуется. Пациентам с нарушением функции почек и СКФ менее 60 мл/мин/1,73 м² препарат Отрио назначается в дозе 10 мг и симвастатин в дозе 20 мг 1 раз в сутки вечером. У данных пациентов применение симвастатина в более высокой дозе должно тщательно контролироваться (см. Фармакологические свойства, Фармакокинетика у отдельных групп пациентов).
Применение у пожилых пациентов
Для пожилых пациентов подбор дозы препарата не требуется (см. Фармакологические свойства, Фармакокинетика у отдельных групп пациентов).
Применение препарата у детей и подростков
Для детей и подростков от 6 лет коррекция дозы препарата не требуется (см. Фармакологические свойства, Фармакокинетика у отдельных групп пациентов).
Применение препарата Отрио у детей в возрасте до 6 лет не рекомендовано по причине отсутствия данных по безопасности и эффективности в данной возрастной группе.
Применение у пациентов с печеночной недостаточностью
Для пациентов с легкой степенью печеночной недостаточности (5-6 баллов по шкале Чайлд-Пью) подбор дозы препарата не требуется. Применение препарата Отрио не рекомендуется пациентам с умеренным (7-9 баллов по шкале Чайлд-Пью) и тяжелым (более 9 баллов по шкале Чайлд-Пью) нарушением функции (см. Фармакологические свойства, Фармакокинетика у отдельных групп пациентов, Особые указания).
При комбинированной терапии с секвестрантами желчных кислот
Препарат Отрио следует принимать в дозе 10 мг 1 раз в сутки по меньшей мере за 2 часа до или через 4 часа после приема секвестрантов желчных кислот.
Побочное действие
В клинических исследованиях, в которых пациенты принимали препарат эзетимиба в дозе 10 мг в сутки в монотерапии, одновременно со статином или одновременно с фенофибратом, препарат эзетимиба показал хорошую переносимость. Нежелательные реакции обычно были легкими и преходящими; общая частота нежелательных эффектов и частота случаев отмены лечения в связи с нежелательными эффектами при приеме препарата эзетимиба были сопоставимы с данными показателями при приеме плацебо.
Следующие частые (≥1/100 и <1/10) или нечастые (≥1/1000 и <1/100) нежелательные реакции наблюдались при приеме препарата эзетимиба в монотерапии с частотой, превышающей аналогичную частоту при приеме плацебо, или при одновременном приеме препарата эзетимиба со статином с частотой, превышающей аналогичную частоту при приеме статина в монотерапии.
При приеме препарата эзетимиба в монотерапии.
Нарушения со стороны обмена веществ и питания:
Нечастые: снижение аппетита.
Нарушения со стороны сосудов:
Нечастые: «приливы» крови к коже лица, повышение артериального давления.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
Нечастые: кашель.
Нарушения со стороны желудочно-кишечного тракта:
Частые: боль в животе, диарея, метеоризм.
Нечастые: диспепсия, гастроэзофагеальный рефлюкс, тошнота.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
Нечастые: артралгия, мышечные спазмы, боль в шее. Общие расстройства:
Частые: утомляемость.
Нечастые: боль в груди, боль.
Лабораторные и инструментальные данные:
Нечастые: повышение активности аланинаминотрансферазы (АЛТ) и/или аспартатаминотрансферазы (ACT), повышение активности креатининфосфокиназы (КФК) сыворотки крови, повышение активности гамма-глютамилтрансферазы, нарушение показателей функции печени.
При приеме препарата эзетимиба одновременно со статином.
Нарушения со стороны нервной системы:
Частые: головная боль.
Нечастые: парестезия.
Нарушения со стороны желудочно-кишечного тракта:
Нечастые: сухость слизистой оболочки рта, гастрит.
Нарушения со стороны кожи и подкожных тканей:
Нечастые: кожный зуд, кожная сыпь, крапивница.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
Частые: миалгия.
Нечастые: боль в спине, мышечная слабость, боль в конечности.
Общие расстройства:
Нечастые: астения, периферические отеки.
Лабораторные и инструментальные данные:
Частые: повышение активности АЛТ и/или ACT.
При приеме препарата эзетимиба одновременно с фенофибратом
Нарушения со стороны желудочно-кишечного тракта:
Частые: боль в животе.
В клиническом исследовании с участием пациентов со смешанной гиперлипидемией частота последовательных клинически значимых повышений (более чем в 3 раза выше верхней границы нормы (ВГН)) активности «печеночных» трансаминаз сыворотки крови составила 4,5% в группе пациентов, принимавших фенофибрат в монотерапии, и 2,7% в группе пациентов, принимавших препарат эзетимиба одновременно с фенофибратом. Частота холецистэктомии составила 0,6% в группе пациентов, принимавших фенофибрат в монотерапии, и 1,7% в группе пациентов, принимавших препарат эзетимиба одновременно с фенофибратом (см. Особые указания). Не наблюдалось повышения активности КФК (более чем в 10 раз выше ВГН) ни в одной из групп лечения в данном исследовании.
Пациенты с ишемической болезнью сердца
В клиническом исследовании пациенты с ИБС принимали симвастатин + эзетимиб в дозе 40 мг + 10 мг или симвастатин в дозе 40 мг. Профиль безопасности препаратов в двух группах был сходным за весь период наблюдения (медиана длительности наблюдения составила 6 лет). Частота прекращения приема препарата из-за нежелательных явлений составила 10,6% в группе пациентов, принимавших симвастатин + эзетимиб, и 10,1% в группе пациентов, принимавших симвастатин. Частота развития миопатии составила 0,2% в группе пациентов, принимавших симвастатин + эзетимиб, и 0,1% в группе пациентов, принимавших симвастатин, где миопатия определялась как необъяснимая мышечная слабость или мышечная боль, сопровождающаяся повышением активности КФК не менее чем в 10 раз выше ВГН или двумя последовательными повышениями активности КФК от 5 до 10 раз выше ВГН. Частота развития рабдомиолиза составила 0,1% в группе пациентов, принимавших симвастатин + эзетимиб, и 0,2% в группе пациентов, принимавших симвастатин, где рабдомиолиз определялся как необъяснимая мышечная слабость или мышечная боль, сопровождающаяся повышением активности КФК не менее чем в 10 раз выше ВГН с признаками нарушения функции почек, двумя последовательными повышениями активности КФК от 5 до 10 раз выше ВГН с признаками нарушения функции почек, или активностью КФК не менее 10000 МЕ/мл без признаков нарушения функции почек. Частота последовательных повышений активности «печеночных» трансаминаз (не менее чем в 3 раза выше ВГН) была 2,5% в группе пациентов, принимавших симвастатин + эзетимиб, и 2,3% в группе пациентов, принимавших симвастатин (см. Особые указания). Нежелательные явления со стороны желчного пузыря наблюдались у 3,1% пациентов, принимавших симвастатин + эзетимиб и 3,5% пациентов, принимавших симвастатин. Частота госпитализации с холецистэктомией была 1,5% в обеих группах. Рак (определялся как любое новое злокачественное новообразование) диагностировался в течение исследования у 9,4% пациентов, принимавших симвастатин + эзетимиб, и 9,5% пациентов, принимавших симвастатин.
Пациенты с хронической болезнью почек
В клиническом исследовании кардио- и нефропротективного действия с участием пациентов, принимавших комбинированный гиполипидемический препарат с фиксированными дозами эзетимиба (10 мг) и симвастатина (20 мг) 1 раз в сутки, и пациентов, принимавших плацебо, профили безопасности были сопоставимы в течение всего периода наблюдения (медиана длительности наблюдения составила 4,9 года). В данном клиническом исследовании регистрировались только серьезные нежелательные явления и прекращение приема препарата по причине развития нежелательных явлений. Частота прекращения приема препарата была сопоставима в обеих группах (10,4% в группе пациентов, принимавших комбинированный препарат с фиксированными дозами эзетимиба и симвастатина, и 9,8% в группе пациентов, принимавших плацебо). Частота развития миопатии/рабдомиолиза составила 0,2% в группе пациентов, принимавших комбинированный препарат с фиксированными дозами эзетимиба и симвастатина, и 0,1% в группе пациентов, принимавших плацебо. Последовательные повышения активности «печеночных» трансаминаз (более чем в 3 раза выше ВГН) наблюдалось у 0,7% пациентов, принимавших комбинированный препарат с фиксированными дозами эзетимиба и симвастатина, и у 0,6% пациентов, принимавших плацебо. В данном клиническом исследовании не наблюдалось статистически достоверного увеличения частоты таких нежелательных явлений, как злокачественные новообразования (9,4% в группе пациентов, принимавших комбинированный препарат с фиксированными дозами эзетимиба и симвастатина, и 9,5% в группе пациентов, принимавших плацебо), гепатит, холецистэктомия или осложнения желчнокаменной болезни или панкреатита.
Дети и подростки от 6 до 17 лет
В клиническом исследовании с участием детей в возрасте от 6 до 10 лет с гетерозиготной семейной или не семейной гиперхолестеринемией профиль безопасности и переносимости эзетимиба был сопоставим с профилем у взрослых пациентов, получавших эзетимиб.
В клиническом исследовании с участием детей в возрасте от 10 до 17 лет с гетерозиготной семейной гиперхолестеринемией, принимавших комбинированную терапию лекарственным препаратом эзетимиба и симвастатином, профиль безопасности и переносимости был сопоставим с профилем безопасности у взрослых пациентов, получавших комбинированное лечение лекарственным препаратом эзетимиба и симвастатином.
Лабораторные показатели
В клинических исследованиях частота последовательных клинически значимых повышений активности «печеночных» трансаминаз в сыворотке крови (активность АЛТ и/или ACT в 3 или более раз превышающая ВГН) была сопоставима при применении эзетимиба в монотерапии (0,5%) и при приеме плацебо (0,3%). При изучении безопасности комбинированной терапии частота клинически значимого повышения активности «печеночных» трансаминаз в сыворотке крови составила 1,3% у пациентов, принимавших эзетимиб одновременно со статином, и 0,4% у пациентов, принимавших статин в монотерапии. Повышение активности трансаминаз в сыворотке крови обычно протекало бессимптомно, не сопровождалось развитием холестаза и возвращалось на исходный уровень как при продолжении лечения, так и после отмены препарата.
Частота возникновения клинически значимого повышения активности КФК (в 10 и более раз выше ВГН) у пациентов, принимавших препарат эзетимиба в монотерапии, была схожей с данным показателем у пациентов, принимавших плацебо или статин в монотерапии.
Пострегистрационные наблюдения
При применении препарата эзетимиба в пострегистрационном периоде сообщалось о следующих нежелательных реакциях без указания причинно-следственной связи.
Нарушения со стороны крови и лимфатической системы: тромбоцитопения.
Нарушения со стороны иммунной системы: реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, кожную сыпь и крапивницу
Нарушения со стороны психики: депрессия.
Нарушения со стороны нервной системы: головокружение, парестезия.
Нарушения со стороны пищеварительной системы: панкреатит, запор.
Нарушения со стороны печени и желчевыводящих путей: гепатит, холелитиаз, холецистит.
Нарушения со стороны кожи и подкожных тканей: мультиформная эритема.
Нарушения со стороны скелетно-мышечной и соединительной ткани: миалгия, миопатия/рабдомиолиз.
Общие расстройства: астения.
Передозировка
Сообщалось о нескольких случаях передозировки, большинство из которых не сопровождалось возникновением нежелательных явлений, а в случае их возникновения нежелательные явления не были серьезными.
В клинических исследованиях, в которых эзетимиб назначался 15 здоровым добровольцам в дозе 50 мг в сутки в течение 14 дней, 18 пациентам с первичной гиперхолестеринемией в дозе 40 мг в сутки в течение 56 дней или 27 пациентам с гомозиготной ситостеролемией в дозе 40 мг в сутки в течение 26 недель, была продемонстрирована хорошая переносимость препарата.
В случае передозировки следует проводить симптоматическое лечение и поддерживающую терапию.
Взаимодействие с другими лекарственными средствами
В доклинических исследованиях было показано, что эзетимиб не индуцирует изоферменты цитохрома Р450, участвующие в метаболизме лекарственных средств. Между эзетимибом и средствами, метаболизирующимися под действием изоферментов 1А2, 2D6, 2С8, 2С9 и 3А4 цитохрома Р450 или N-ацетилтрансферазы, клинически значимых фармакокинетических взаимодействий не наблюдалось.
При одновременном применении эзетимиб не оказывает влияния на фармакокинетику дапсона, декстрометорфана, дигоксина, пероральных контрацептивов (этинилэстрадиола и левоноргестрела), глипизида, толбутамида, мидазолама. Одновременное применение циметидина и эзетимиба не оказывает влияния на биодоступность эзетимиба.
Антациды: одновременный прием антацидов снижает скорость всасывания эзетимиба, но не оказывает влияния на его биодоступность. Это снижение скорости всасывания не рассматривается как клинически значимое.
Колестирамин: одновременный прием колестирамина уменьшает среднее значение AUC суммарного эзетимиба (эзетимиб + эзетимиб-глюкуронид) приблизительно на 55%. Эффект дополнительного снижения концентрации ХС ЛПНП за счет одновременного применения эзетимиба и колестирамина может быть уменьшен данным взаимодействием.
Циклоспорин: у пациентов, перенесших трансплантацию почки, с КК более 50 мл/мин, принимавших циклоспорин в постоянной дозе, однократный прием препарата эзетимиба в дозе 10 мг приводил к увеличению значения AUC суммарного эзетимиба в среднем в 3,4 раза (от 2,3 до 7,9 раз) по сравнению с данным показателем у здоровых добровольцев. У одного пациента после трансплантации почки и с тяжелой почечной недостаточностью (КК 13,2 мл/мин/1,73м²), принимавшего комплексную терапию, включая циклоспорин, наблюдалось 12-кратное увеличение концентрации суммарного эзетимиба по сравнению с контрольной группой. В перекрестном исследовании с двумя периодами с участием 12 здоровых добровольцев, принимавших в течение 8 дней эзетимиб в дозе 20 мг 1 раз в сутки с приемом однократной дозы 100 мг циклоспорина на 7 день терапии эзетимибом, было выявлено увеличение значения AUC циклоспорина в среднем на 15% (от снижения на 10% до увеличения на 51%) в сравнении с данным показателем у здоровых добровольцев, принявших циклоспорин однократно в дозе 100 мг в монотерапии (см. С осторожностью).
Фибраты: безопасность и эффективность применения эзетимиба одновременно с фенофибратом были оценены в клинических исследованиях (см. Побочное действие). Безопасность и эффективность применения эзетимиба одновременно с другими фибратами не изучены. Фибраты могут повышать выделение ХС с желчью, что может привести к желчнокаменной болезни. В доклиническом исследовании на собаках эзетимиб повышал концентрацию ХС в желчи. Хотя значение этих данных для человека пока неизвестно, одновременное применение препарата эзетимиба с фибратами (за исключением фенофибрата) до получения дополнительных данных по результатам клинических исследований не рекомендуется. Одновременный прием препарата эзетимиба и фенофибрата или гемфиброзила повышает концентрацию суммарного эзетимиба приблизительно в 1,5 и 1,7 раза соответственно, однако эти повышения не рассматриваются как клинически значимые.
Статины: при одновременном приеме эзетимиба с аторвастатином, ловастатином, правастатином, симвастатином, флувастатином и розувастатином клинически значимых фармакокинетических взаимодействий не наблюдалось.
Непрямые антикоагулянты: одновременное применение эзетимиба в дозе 10 мг 1 раз в сутки и варфарина не оказывало значимого влияния на биодоступность варфарина и протромбиновое время в исследовании с участием 12 здоровых добровольцев. В пострегистрационном периоде были получены сообщения об увеличении Международного Нормализованного Отношения (МНО) у пациентов, принимавших одновременно эзетимиб с варфарином или флуиндионом. Данные пациенты также принимали другие лекарственные средства (см. Особые указания).
Особые указания
Перед началом лечения пациенты должны перейти к соответствующей липидснижающей диете и продолжать соблюдать эту диету во время всего периода терапии препаратом эзетимиба.
Если препарат эзетимиба назначается в комбинации со статином или фенофибратом, следует внимательно ознакомиться с инструкцией по применению назначаемого дополнительно препарата.
Ферменты печени
В клинических исследованиях с одновременным применением препарата эзетимиба и статина у пациентов наблюдались последовательные повышения активности «печеночных» трансаминаз (в 3 и более раз выше ВГН). Если препарат эзетимиба назначается в комбинации со статином, контроль функции печени следует проводить в начале лечения и далее в соответствии с рекомендациями для данного статина (см. Побочное действие).
В клиническом исследовании пациенты с ИБС принимали симвастатин + эзетимиб в дозе 40 мг + 10 мг ежедневно или симвастатин в дозе 40 мг ежедневно (медиана длительности наблюдения составила 6 лет). Частота последовательных повышений активности «печеночных» трансаминаз (не менее чем в 3 раза выше ВГН) была 2,5% в группе пациентов, принимавших симвастатин + эзетимиб, и 2,3% в группе пациентов, принимавших симвастатин (см. Побочное действие).
В клиническом исследовании с участием пациентов с хронической болезнью почек частота последовательных повышений активности «печеночных» трансаминаз (в 3 и более раз выше ВГН) составила 0,7% в группе пациентов, принимавших комбинированный гиполипидемический препарат с фиксированными дозами эзетимиба (10 мг) и симвастатина (20 мг) 1 раз в сутки, и 0,6% в группе пациентов, принимавших плацебо (см. Побочное действие).
Скелетная мускулатура
В клинических исследованиях частота возникновения миопатии или рабдомиолиза, связанных с применением препарата эзетимиба, не превышала таковую в сравнении с соответствующей контрольной группой (плацебо или монотерапии статином), однако миопатия и рабдомиолиз являются известными нежелательными реакциями статинов и других липидснижающих средств. В клинических исследованиях частота повышения активности КФК (более чем в 10 раз превышающая ВГН) составила 0,2% в группе эзетимиба в сравнении с 0,1% в группе плацебо и 0,1% в группе одновременного применения эзетимиба и статина в сравнении с 0,4% в группе монотерапии статином.
В пострегистрационном периоде применения эзетимиба были получены сообщения о случаях развития миопатии и рабдомиолиза независимо от причины их развития. Большинство пациентов, у которых развивался рабдомиолиз, принимали статины до начала приема препарата эзетимиба. Тем не менее, очень редко сообщалось о развитии рабдомиолиза при применении препарата эзетимиба в монотерапии и при одновременном применении препарата эзетимиба и лекарственных препаратов, применение которых, как известно, ассоциировано с повышенным риском развития рабдомиолиза.
Все пациенты, которым назначается препарат эзетимиба, должны быть предупреждены о риске развития миопатии и рабдомиолиза и должны сообщать врачу о любых необъяснимых мышечных болях, болезненности или слабости. Если миопатия диагностирована или подозревается, применение препарата эзетимиба и любого статина, принимаемого одновременно с препаратом эзетимиба, должно быть немедленно прекращено. Наличие данных симптомов и повышение активности КФК (более чем в 10 раз выше ВГН) указывает на развитие миопатии.
В клиническом исследовании пациенты с ИБС принимали симвастатин + эзетимиб в дозе 40 мг + 10 мг ежедневно или симвастатин в дозе 40 мг ежедневно (медиана длительности наблюдения составила 6 лет). Частота развития миопатии составила 0,2% в группе пациентов, принимавших симвастатин + эзетимиб, и 0,1% в группе пациентов, принимавших симвастатин, где миопатия определялась как необъяснимая мышечная слабость или мышечная боль, сопровождающаяся повышением активности КФК не менее чем в 10 раз выше ВГН или двумя последовательными повышениями активности КФК от 5 до 10 раз выше ВГН. Частота развития рабдомиолиза составила 0,1% в группе пациентов, принимавших симвастатин + эзетимиб, и 0,2% в группе пациентов, принимавших симвастатин, где рабдомиолиз определялся как необъяснимая мышечная слабость или мышечная боль, сопровождающаяся повышением активности КФК не менее чем в 10 раз выше ВГН с признаками нарушения функции почек, двумя последовательными повышениями активности КФК от 5 до 10 раз выше ВГН с признаками нарушения функции почек, или активностью КФК не менее 10000 МЕ/мл без признаков нарушения функции почек (см. Побочное действие).
В клиническом исследовании с участием пациентов с хронической болезнью почек частота развития миопатии/рабдомиолиза составила 0,2% в группе пациентов, принимавших комбинированный гиполипидемический препарат с фиксированными дозами эзетимиба (10 мг) и симвастатина (20 мг) ежедневно, и 0,1% в группе пациентов, принимавших плацебо (см. Побочное действие).
Дети от 6 до 17 лет
Безопасность и эффективность эзетимиба у детей в возрасте от 6 до 10 лет с гетерозиготной семейной или не семейной гиперхолестеринемией были изучены в клиническом исследовании длительностью 12 недель. Профиль побочных явлений у детей, получавших препарат эзетимиба, был сопоставим с профилем побочных явлений у взрослых пациентов, получавших препарат эзетимиба. В данном клиническом исследовании не наблюдалось явного воздействия на рост или половое созревание мальчиков или девочек. Однако воздействия эзетимиба на рост и половое созревание не были изучены при лечении длительностью более 12 недель (см. Способ применения и дозы, Побочное действие).
Безопасность и эффективность препарата эзетимиба, принимаемого одновременно с симвастатином, у детей в возрасте от 10 до 17 лет с гетерозиготной семейной гиперхолестеринемией были изучены в клиническом исследовании у мальчиков-подростков и девочек, которые были как минимум один год после менархе. Профиль побочных явлений у подростков, получавших препарат эзетимиба и до 40 мг/сут симвастатина, был сопоставим с профилем побочных явлений у взрослых пациентов, получавших препарат эзетимиба и симвастатин. В данном клиническом исследовании не наблюдалось явного воздействия на рост или половое созревание у мальчиков или девочек подростков, или какого-либо влияния на продолжительность менструального цикла у девочек (см. Способ применения и дозы, Побочное действие).
Печеночная недостаточность
Поскольку последствия увеличения значения AUC суммарного эзетимиба неизвестны, препарат эзетимиба не рекомендован пациентам с умеренной и тяжелой степенью печеночной недостаточности (см. Фармакологические свойства, Фармакокинетика у отдельных групп пациентов, Противопоказания).
Фибраты
Безопасность и эффективность применения эзетимиба одновременно с фибратами (за исключением фенофибрата) не установлена. Одновременное применение лекарственного препарата эзетимиба с фибратами (за исключением фенофибрата) не рекомендуется (см. Взаимодействие с другими лекарственными препаратами).
Фенофибрат
Пациенты, принимающие фенофибрат одновременно с препаратом эзетимиба, должны быть предупреждены о возможном риске возникновения желчнокаменной болезни и заболеваний желчного пузыря. Если врач предполагает возможное развитие указанных выше заболеваний у пациента, необходимо провести исследования желчного пузыря и назначить альтернативную липидснижающую терапию (см. Побочное действие и инструкцию по применению фенофибрата).
Циклоспорин
При назначении эзетимиба пациентам, принимающим циклоспорин, следует соблюдать меры предосторожности. Необходим регулярный контроль концентрации циклоспорина в плазме крови при одновременном применении препарата эзетимиба и циклоспорина (см. С осторожностью, Взаимодействие с другими лекарственными препаратами).
Непрямые антикоагулянты
При одновременном применении препарата эзетимиба с непрямыми антикоагулянтами, включая варфарин или флуиндион, необходимо контролировать значения показателя МНО (см. Взаимодействие с другими лекарственными препаратами).
Влияние на способность управлять транспортными средствами, механизмами
Не проводилось исследований для оценки влияния на способность управлять транспортными средствами и работать с механизмами, однако, некоторые нежелательные эффекты, наблюдавшиеся при приеме препарата эзетимиба, могут влиять на способность некоторых пациентов управлять транспортными средствами и работать с механизмами (см. раздел «Побочное действие»).
Форма выпуска
Таблетки 10 мг
По 7, 10 или 14 таблеток в контурную ячейковую упаковку из фольги алюминиевой и пленки ПВХ/Аклар® или плёнки ПВХ.
1, 2, или 4 контурные ячейковые упаковки по 7 таблеток, или 1, 2 или 3 контурные ячейковые упаковки по 10 таблеток, или 1 или 2 контурные ячейковые упаковки по 14 таблеток вместе с инструкцией по применению помещают в пачку из картона.
Условия хранения
При температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Производитель / Организация, принимающая претензии потребителей
Акционерное общество «Химико-фармацевтический комбинат «АКРИХИН» (АО «АКРИХИН»), Россия
142450, Московская область, Ногинский район, г. Старая Купавна, ул. Кирова, д. 29
Купить Отрио в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Состав
Каждая таблетка содержит 10,0 мг основного соединения эзетимиба. В роли вспомогательных компонентов используются: МКЦ, моногидрат лактозы, кроскармеллоза натрия, натрия лаурилсульфат, повидон (тип КЗО), натрия стеарилфумарат.
Форма выпуска
Лекарственное средство производится в виде плоскоцилиндрических таблеток круглой формы в одной дозировке – 10 мг. Их цвет колеблется от белого до белого с желтизной. Каждая таблетка имеет фаску.
Таблетки расфасовываются в контурно-ячейковую упаковку по 10—15 штук. Блистеры изготавливаются из алюминиевой фольги в сочетании с ПВХ-пленкой или комбинаций поливинилхлорида и Аклар. В продажу лекарство поступает в картонных коробках, содержащих по:
- 1, 2, 3, 6 или 9 блистеров по 10 таблеток;
- 2 или 6 блистеров по 15 таблеток.
Каждая пачка обязательно комплектуется аннотацией от производителя.
Фармакологическое действие
Гиполипидемическое.
Фармакодинамика и фармакокинетика
Отрио – лекарство от высокого холестерина нового поколения. Его активный компонент избирательно подавляет абсорбцию холестерина и ряда фитостеролов в кишечнике при пероральном употреблении.
Действующее вещество имеет иной механизм действия по сравнению со средствами из той же фармакологической группы прочих классов, включая статины, фибраты, секвестранты желчных кислот, растительные станолы. Оно воздействует на транспортный белок, который отвечает за абсорбцию в кишечнике фитостеролов и холестерина – Niemann- Pick Cl-Like 1, NPC1L1. Соединение проникает в щеточную кайму тонкого кишечника и создает препятствия для усвоения холестерина. В результате гораздо меньшее его количество проникает в печень, что приводит к уменьшению его запасов в ней. Одновременно наблюдается увеличение выведения холестерина из крови.
В противоположность секвестрантам желчных кислот данный препарат не подавляет их выведение. Также он не сказывается на продукции холестерина в печени, как это делают статины.
В ходе клинических исследований Отрио было замечено, что он уменьшает всасывание холестерина в кишечнике на 54%. В них принимали участие добровольцы с подтвержденной гиперхолестеринемией, контрольная группа употребляла плацебо.
Ряд доклинических исследований подтвердил селективность действия Отрио. Его активный компонент эффективно подавлял абсорбцию [14С]-холестерина, но не оказал клинически значимого воздействия на степень абсорбции триглицеридов, жирных, желчных кислот, а также жирорастворимых витаминов А и D, прогестерона, этинилэстрадиола.
За счет разного механизма действия для более эффективного снижения уровня холестерина в крови могут использоваться сочетания статинов и Отрио. Первые угнетают продукцию холестерина в печени, в то время как Отрио создает препятствия для его всасывания в кишечнике из пищи. В результате наблюдается потенцирование гиполипидемического эффекта. Исследования показали, что такие сочетания позволяют понижать уровень:
- общего холестерина (ОХ);
- холестерина ЛПНП;
- аполипопротеина В (основной белковый компонент ЛПНП);
- холестерина не-ЛПВП;
- триглицеридов.
Также на фоне совместного приема статинов и Отрио происходит более выраженное нарастание содержания в плазме крови холестерина ЛПВП, чем при использовании данных лекарственных средств по отдельности.
Как известно из более ранних исследований, высокие концентрации вышеперечисленных соединений, кроме холестерина ЛПВП, в плазме крови расцениваются в качестве факторов риска развития атеросклероза. В то же время холестерин ЛПВП считается полезным, поскольку напротив препятствует образованию атеросклеротических бляшек в кровеносных сосудах, вытесняя холестерин ЛПНП и не-ЛПВП. Понижение его уровня точно так же провоцирует развитие атеросклероза.
Проведенные эпидемиологические исследования продемонстрировали прямую корреляцию между концентрацией ОХ, ЛПНП и количеством кардиологических заболеваний, смертностью от них. Также была замечена обратная зависимость между уровнем холестерина ЛПВП и числом сердечно-сосудистых патологий. Опасность с точки зрения развития атеросклероза так же представляют ЛПОНП, ЛППП и ремнанты.
При комбинациях Отрио и Фенофибрата у добровольцев со смешанной гиперхолестеринемией также происходит уменьшение уровня общего холестерина, ЛПНП, не-ЛПНП, аполипопротеина В, триглицеридов и нарастание концентрации ЛПВП.
Что касается фармакокинетики лекарственного средства, то его действующее вещество оперативно поглощается и быстро расщепляется на метаболиты в тонком кишечнике и печени. Это осуществляется за счет конъюгации с глюкуронидом в фенольный глюкуронид (эзетимибглюкуронид). Данное соединение является фармакологически активным. В плазме крови его уровень доходит до предельных значений через 1—2 часа после приема внутрь, а самого эзетимиба — через 4—12 часов. При этом количество эзетимибглюкуронида превосходит содержание эзетимиба в соотношении 80—90% и 10—20% соответственно. Определить абсолютную биодоступность главного компонента Отрио невозможно, поскольку оно почти не растворяется в растворителях, пригодных для изготовления растворов для инъекций.
Исследования показали, что употребление продуктов с любым содержанием жиров не сказывается на биодоступности медикамента. Поэтому таблетки можно пить абсолютно в произвольное время без связи с приемом пищи.
Действующее вещество и его активный метаболит соединяются с белками плазмы крови на 99,7% и 88—92% соответственно. Постепенно посредством кишечно-печеночной рециркуляции они устраняются из плазмы крови, а затем с желчью и из организма. Период полувыведения составляет в среднем 72 часа. Полностью лекарственное средство выводится из крови за 48 часов. За 10 дней порядка 88% вещества и активных метаболитов элиминируется из организма. При этом 78% выводится посредством кишечника с желчью, а 11% через почки.
Медикамент имеет следующие особенности фармакокинетики у пациентов особых групп:
- Дети. Исследования показали идентичную фармакокинетику Отрио у взрослых и детей, которым более 6-ти лет. Особенности метаболизма, распределения, всасывания и выведения лекарственного средства у детей более младшего возраста не исследовались.
- Люди преклонного возраста (от 65 лет). Содержание активного компонента в крови у пациентов этой возрастной категории в два раза выше, чем у людей 18—45 лет. Тем не менее эффективность и безопасность сопоставимы. Поэтому в пересмотре дозы нет необходимости.
- Пациенты с диагностированной печеночной недостаточностью. Проведенные испытания показали, что однократный прием одной таблетки приводит к повышению средней величины AUC в 1,7 раз у больных с легкой степенью печеночной недостаточности, чем у здоровых испытуемых. Тяжесть нарушений оценивалась по шкале Чайлд-Пью и составляла 5—6 баллов. В другом 2-недельном исследовании было установлено, что у больных с умеренной степенью нарушения (7—9 баллов по шкале Чайлд-Пью) по сравнению со здоровыми испытуемыми, которые ежедневно принимали по 1 таблетке медикамента средняя величина AUC была в 4 раза больше в первые и 14-е сутки. Таким образом, пересмотр дозы препарата при легкой степени нарушений функции печени не требуется. Но для пациентов, у которых тяжесть нарушений оценивается в 9 баллов по шкале Чайлд-Пью и более, Отрио не рекомендован, так как неизвестны последствия повышения AUC для людей этой группы.
- Пациенты с диагностированной почечной недостаточностью. Испытания показали, что у людей с тяжелыми нарушениями в работе почек, т. е. с показателем клиренса креатинина менее 30 мл/мин/1,73 м2 однократный прием одной таблетки приводил к повышению AUC в 1,5 раза, чем у здоровых испытуемых. Подобное отклонение не расценивается в качестве клинически важного. Поэтому корректировка дозы для пациентов с подобными нарушениями не нужна. Однако у больных, перенесших ранее пересадку почки и проходивших комплексное лечение с включением Циклоспорина, отмечалось увеличение AUC в 12 раз.
- Женщины. Содержание действующего вещества и его метаболита в крови у женщин выше, чем у мужчин примерно на 1/5. Это никак не отражается на результате и безопасности приема. Коррекция дозы не показана.
Показания к применению таблеток Отрио
Медикамент применяется при:
- первичной гиперхолестеринемии у взрослых и детей старше 10-ти лет. Используется в сочетании со статинами или отдельно, как единственное средство для снижения уровня общего холестерина, а также холестерина ЛПНП, не-ЛПВП, апо-В, ТГ и повышения содержания ЛПВП. В обоих случаях на фоне приема показано соблюдать диету;
- смешанной гиперхолестеринемии. Применяется в сочетании с Фенофибратом и диетой с целью понижения уровня общего холестерина, холестерина ЛПНП, не-ЛПВП, апо-В;
- гомозиготной семейной гиперхолестеринемии. Показан прием в сочетании со статином, иногда ЛПНП-аферезом;
- профилактике развития патологий сердечно-сосудистой системы. Назначается вместе со статинами для уменьшения вероятности возникновения осложнений при ИБС, включая нефатальный инфаркт миокарда, инсульт, сердечно-сосудистую смерть, необходимость госпитализации, выполнения реваскуляризации вследствие развития нестабильной стенокардии;
- предупреждении развития осложнений со стороны сердца и сосудов на фоне хронических патологий почек. Назначается вместе с Симвастатином.
Противопоказания
Отрио 10 мг не может быть назначен при:
- гиперчувствительности к любому из входящих в его состав компонентов;
- средней и тяжелой степени печеночной недостаточности (для оценки тяжести заболевания используется шкала Чайлд-Пью, при получении 7—9 баллов медикамент противопоказан);
- непереносимости лактозы, глюкозо-галактозной мальабсорбции, дефиците лактазы.
Лекарственное средство не назначается детям до 6-ти лет. В остальных случаях, если требуется сочетать его прием со статинами или Фенофибратом, следует учитывать возможные противопоказания и особенности взаимодействия этих медикаментов.
С осторожностью препарат назначают при необходимости применения других медикаментов, в частности:
- фибратов (существует риск возникновения патологий желчного пузыря);
- циклоспорина;
- непрямых антикоагулянтов, в число которых входят флуиндион и Варфарин.
Побочные действия
Во время исследований при приеме Отрио в рекомендуемой суточной дозе (1 таблетка) самостоятельно или в сочетании с другими лекарственными средствами (статинами, Фенофибратом) побочные явления в основном были слабовыраженными и преходящими. А количество случаев их возникновения сопоставимо с аналогичными показателями в группе, принимавшей плацебо.
В целом все возможные нежелательные реакции, которые развивались чаще, чем при употреблении плацебо или только статина, были разделены по частоте развития.
При использовании только Отрио у одного из 10—100 пациентов наблюдались боли в животе, повышенное газообразование, диарея, повышение утомляемости, головные боли. А у одного из 100—1000 возникали:
- ухудшение аппетита;
- тошнота, диспептические явления;
- гастроэзофагеальный рефлюкс;
- повышение кровяного давления;
- «приливы»;
- кашель;
- боли в суставах, шее, груди;
- спазмы мышц;
- нарастание активности АЛТ, АСТ, КФК, γ-глютамилтрансферазы;
- отклонения от нормы в печеночных показателях.
Когда лекарство Отрио применялось в сочетании со статином, часто, т. е. у одного из 10—100 исследуемых, наблюдались: боли в голове, мышцах, увеличение активности АЛТ, АСТ. Нечасто, т. е. у одного из 100—1000 возникали:
- парестезии;
- ощущение сухости во рту;
- гастрит;
- кожный зуд, высыпания, крапивница;
- боль в спине, конечностях;
- астения;
- отечность ног.
При назначении медикамента в сочетании с Фенофибратом часто возникали болезненные ощущения в животе. При этом клинические испытания показали, что при монотерапии Фенофибратом чаще наблюдается повышение активности «печеночных» аминотрансфераз, чем при его комбинировании с Отрио. Количество случаев повышения более чем в 3 раза выше ВГН составило 4,5% и 2,7% соответственно. Но холецистэктомия требовалась чаще в группе, принимавшей комбинации препаратов. Она потребовалась 1,7% больных. В то время как на фоне монотерапии Фенофибратом подобная необходимость возникала только в 0,6% случаев. Увеличения активности КФК в 10 раз и более не происходило ни в одной из групп.
Во время клинических испытаний отдельно оценивалось влияние медикамента на состояние больных ИБС. Добровольцы были разделены на 2 группы. Одна из них принимала ежедневно по 40 мг Симвастатина, другая в дополнение к Симвастатину 1 таблетку Отрио. Все пациенты оставались под наблюдением в течение 6-ти лет. В обеих группах был определен сходный профиль безопасности и прослеживалась практически одинаковая частота отмены лекарственных средств вследствие развития побочных эффектов – 10,1% и 10,6% соответственно:
- миопатия с развитием беспричинной на первый взгляд мышечной слабости, болей в мышцах возникала у 0,1% больных из 1-й группы и 0,2% добровольцев из 2-й группы. Этому сопутствовало нарастание активности КФК в 10 и более раз выше верхней границы нормы;
- рабдомиолиз, напротив, чаще возникал у добровольцев из 1-й группы – в 0,2% случаев. Во второй группе частота подобных ситуаций составила 0,1%. Это также сопровождалось необъяснимыми болями в мышцах, слабостью, нарастанием активности КФК в 10 и более раз выше ВГН, проявлениями расстройств функции почек или без них;
- увеличение активности «печеночных» аминотрансфераз в 3 и более раз выше верхней границы нормы. В 1-й группе подобное прослеживалось у 2,3% добровольцев, во второй – у 2,5% испытуемых;
- отклонения от нормы в функционировании желчного пузыря. У людей из первой группы они наблюдались у 3,5%, у добровольцев 2-й группы – у 3,1%. Но операция по удалению желчного пузыря потребовалась одинаковому числу испытуемых из обеих групп – 1,5%. Также с одинаковой частотой наблюдалось образование злокачественных опухолей – в 9,5% и 9,4% случаев соответственно.
Также производилась оценка влияния лекарства на состояние больных хроническими заболеваниями почек. Добровольцы были поделены на две группы. В первой в сутки пациенты принимали по 1 таблетке Отрио и 20 мг симвастатина в день. Во второй использовалось плацебо. Испытуемые находились под надзором на протяжении 4,9 лет. В обоих случаях профили безопасности были сопоставимы. Фиксации подлежали лишь случаи тяжелых побочных эффектов, требующих отмены лекарственных средств. В обеих группах количество подобных ситуаций была сопоставима и составляла 10,4% в 1-й группе и 9,8% во 2-й группе.
Регистрировались:
- миопатия или рабдомиолиз у 0,2% испытуемых из 1-й группы и 0,1% добровольцев из 2-й группы;
- повышение активности «печеночных» аминотрансфераз в 3 и более раз выше ВГН у 0,7% пациентов из первой группы и 0,6% из второй.
Клинически значимого роста частоты случаев возникновения рака, гепатита, панкреатита, осложнений на фоне прогрессирования желчнокаменной болезни или необходимости проведения холецистэктомии не было зафиксировано.
Исследовалось влияние Отрио на детей 6—17 лет. Испытания показали, что пациентами 6—10 лет с семейной или несемейной гиперхолестеринемией медикамент переносился одинаково хорошо и с аналогичной безопасностью, как и взрослыми. У пациентов 10—17 лет, проходивших комбинированную терапию с включением симвастатина по поводу лечения гетерозиготной семейной гиперхолестеринемии, Отрио показал такой же профиль безопасности, как и у взрослых.
Оценка нарастания активности «печеночных» трансаминаз показала, что клинически значимых отклонений на фоне применения Отрио самостоятельно не наблюдалось. При сочетании со статинами по сравнению с контрольной группой, получавшей только статин, количество таких случаев составило 1,3% на фоне 0,4% больных из контрольной группы. В подобных ситуациях не наблюдалось возникновения выраженных симптомов и холестаза, а лабораторные показатели постепенно возвращались к исходным значениям и при отмене Отрио, и при продолжении терапии.
В ходе постмаркетинговых исследований продолжался сбор данных о возможных нежелательных явлениях на фоне применения Отрио, но причинно-следственные связи не отслеживались. Так были зафиксированы случаи возникновения:
- тромбоцитопении;
- аллергических реакций, в том числе с развитием отека Квинке, высыпаний на коже, крапивницы, анафилактических реакций;
- депрессивных состояний;
- головокружений;
- воспаления поджелудочной железы;
- нарушений чувствительности разного рода;
- запоров;
- холецистита, холелитиаза;
- гепатита;
- болей в мышцах, миопатии, рабдомиолиза;
- мультиформной эритемы;
- астении.
Таблетки Отрио, инструкция по применению (Способ и дозировка)
Таблетку можно пить в любое время независимо от приема пищи. До начала приема лекарственного средства рекомендуется скорректировать питание в соответствии с липидснижающей диетой. Она показана на все время использования Отрио.
При первичной гиперхолестеринемии рекомендуемая доза 10 мг в день, в том числе при сочетании со статинами или Фенофибратом. Но нужно учитывать, что максимальная доза последнего лекарственного средства на фоне применения Отрио составляет 160 мг в день. Ее превышение недопустимо.
При назначении пациентам с ИБС следует соблюдать следующие рекомендации:
- комбинации со статинами. Применяется с целью уменьшения вероятности возникновения различных сердечно-сосудистых событий по 1 таблетке в день;
- комбинации со секвестрантами желчных кислот. Назначается по 1 таблетке в сутки. Ее прием должен осуществляться как минимум за 2 часа до употребление секвестранта желчных кислот или уже спустя 4 часа после этого.
При назначении пациентам с заболеваниями почек, включая ХПН, стоит соблюдать следующие рекомендации:
- монотерапия. Коррекция дозировки не нужна;
- комбинации с симвастатином. При нарушениях малой выраженности, когда СКФ превосходит значения 60 мл/мин/1,73 м2 пересмотр стандартных суточных доз обоих препаратов не требуется. При заболеваниях, сопровождающихся снижением СКФ до 60 мл/мин/1,73 м2 и ниже, показан прием 1 таблетки Отрио и 20 мг симвастатина вечером. При необходимости использовать более высокие суточные дозы симвастатина показан тщательный контроль над состоянием пациента.
При назначении лицам пожилого возраста пересмотр дозы не показан.
При назначении больным, имеющим нарушения функции печени легкой выраженности, соответствующие 5—6 баллам по шкале Чайлд-Пью, в пересмотре дозы нет необходимости. Для пациентов с печеночной недостаточностью среднетяжелой и тяжелой формы (более 7 баллов по шкале Чайлд-Пью) медикамент не рекомендован.
Передозировка
Возможные последствия передозировки исследовались в ходе клинических испытаний. Для этого:
- 15 здоровых людей принимали по 5 таблеток Отрио в сутки на протяжении 2-х недель;
- 18 людей с диагностированной первичной гиперхолестеринемией принимали по 4 таблетки Отрио в сутки на протяжении 56 дней;
- 27 пациентов с подтвержденной гомозиготной фитостеролемией принимали по 4 таблетки Отрио в день на протяжении 26-ти недель.
Во всех случаях наблюдалась хорошая переносимость лекарственного средства без развития нежелательных последствий.
Случаи передозировки регистрировались только несколько раз. Основная масса из них не сопровождалась развитием побочных эффектов. Лишь в некоторых ситуациях наблюдались слабо выраженные негативные реакции, которые не были серьезными. При их возникновении показана симптоматическая и поддерживающая терапия.
Взаимодействие
Выполненные доклинические испытания продемонстрировали отсутствие индуцирующего влияния Отрио на изоферменты цитохрома Р450. Также не было выявлено взаимодействия между ним и средствами, при метаболизме которых задействуются изоферменты 1А2, 2D6, 2С8, 2С9 и 3/44 цитохрома Р450 или N-ацетилтрансферазы.
Не наблюдается влияния Отрио на фармакокинетику таких лекарственных средств, как:
- Дапсон;
- декстрометорфан;
- Дигоксин;
- пероральные контрацептивы на основе этинилэстрадиола и левоноргестрела;
- Глипизид;
- Толбутамид;
- мидазолам.
Циметидин не сказывается на биодоступности Отрио.
Что касается взаимодействия с лекарственными средствами других групп, было замечено следующее:
- Антациды. Комбинации с ними провоцируют незначительное и не имеющее клинического значения уменьшение скорости всасывания действующего вещества Отрио. Это не сказывается на его биодоступности и эффективности.
- Колестирамин. Такие сочетания вызывают снижение AUC медикамента в среднем на 55%. Поэтому наблюдается уменьшение выраженности эффекта дополнительного снижения холестерина ЛПНП.
- Циклоспорин. У больных, которым была пересажена почка и назначен постоянный прием циклоспорина, а клиренс креатинина составлял 50 мл/мин и более наблюдалось увеличение AUC в 2,3—7,9 раз на фоне одноразового приема таблетки Отрио. У 1-го больного после пересадки почки и имеющего тяжелую почечную недостаточность, что вызвало необходимость в проведении комплексной терапии с включением циклоспорина, происходило нарастание AUC эзетимиба в 12 раз. В перекрестном исследовании последствий сочетания препаратов у здоровых добровольцев было обнаружено повышение AUC циклоспорина на 15%.
- Фибраты. Особенности взаимодействия с фенофибратом подробно описаны выше. Аналогичных исследований для других фибратов не проводилось. Предполагается возможность повышения экскреции холестерина с желчью. Подобное способно становиться фактором риска развития желчнокаменной болезни. До проведения оценки взаимодействия Отрио с фибратами, кроме фенофибрата, не рекомендуется их совместное применение. При его комбинации с фенофибратом наблюдается увеличение содержания эзетимиба в плазме крови в 1,5—1,7 раз, что не является клинически значимым показателем.
- Статины. При сочетаниях с Аторвастатином, Ловастатином, Правастатином, Симвастатином, флувастатином и Розувастатином не наблюдается существенных фармакологических взаимодействий.
- Непрямые антикоагулянты. Сочетания Отрио и варфарина не сказываются на биодоступности последнего, а также протромбиновом времени. Это было проверено на 12-ти здоровых испытуемых.
Условия продажи
По рецепту.
Условия хранения
Таблетки следует держать в месте, в которое дети не имеют доступа, а температура воздуха не поднимается выше 25 °C.
Срок годности
2 года со дня производства.
Особые указания
До начала курса приема рекомендуется переход на липидснижающую диету. Ее следует соблюдать на протяжении всего времени прохождения терапии.
При необходимости сочетать медикамент со статином или же фенофибратом требуется тщательно изучить особенности их взаимодействия и рекомендации по использованию выбранного препарата.
В ходе проведенных клинических испытаний были выявлены следующие особенности препарата:
- Влияние на печеночные ферменты. Сочетания Отрио и статина провоцировали нарастание активности таких ферментов печени, как трансаминазы, в >3 раза по сравнению с верхней границей нормы. Поэтому при таких комбинациях показан контроль работы печени сразу после начала терапии и в дальнейшем. При сочетании с симвастатином с суточной дозой 40 мг было обнаружено, что подобное усиление активности трансаминаз наблюдается у 2,5% добровольцев, в то время как в группе, принимавшей только 40 мг симвастатина в сутки, такой эффект прослеживался у 2,3% испытуемых. У пациентов с хроническими заболеваниями почек это наблюдалось в 0,7% случаев (в группе, получавшей плацебо, этот показатель составил 0,6%).
- Влияние на скелетную мускулатуру. Количество случаев развития миопатий и рабдомиолиза на фоне лечения Отрио в ходе клинических испытаний не превосходила число таких случаев в контрольных группах, получавших плацебо или только тот или иной статин. Но следует учитывать, что статины и прочие средства, снижающие уровень липидов, способны провоцировать подобные нежелательные явления. В числовом значении результаты исследований были представлены следующим образом: повышение активности КФК в >10 раз наблюдалось у 0,2% испытуемых из группы, получавшей Отрио, 0,1% у пациентов из групп, получавшей комбинацию Отрио и статина, и 0,4% в группе, получавшей только статин. После начала использования медикамента в клинической практике поступали сообщения о возникновении миопатии и рабдомиолиза без уточнения причины. Большая часть таких больных пили статины еще до назначения Отрио. Очень редко регистрировались случаи рабдомиолиза при изолированном использовании Отрио, а также в сочетаниях с другими лекарствами, которые способны увеличивать вероятность рабдомиолиза. Поэтому всех пациентов перед началом прохождения курса лечения следует предупреждать о подобных рисках и необходимости обращения к лечащему врачу при возникновении беспричинных на первый взгляд болей в мышцах, слабости и других отклонениях. При возникновении подозрений на развитие миопатии, в том числе при обнаружении показателей активности КФК в 10 и более раз превосходящих ВГН, следует сразу же отменить все медикаменты, способные провоцировать ее.
При назначении Отрио пациентам с ИБС, хроническими патологиями почек, в том числе в комбинации с другими средствами, следует учитывать особенности совместимости и влияние на мышечные ткани, описанное выше.
При необходимости использовать сочетания с фибратами, непрямыми антикоагулянтами, циклоспорином нужно учитывать особенности их взаимодействия.
Проводившиеся исследования не затрагивали особенностей влияния Отрио на концентрацию внимания и быстроту реакции. Но обнаруженные возможные побочные явления способны негативно сказываться на способности управлять транспортом или же работать с устройствами, требующими высокой концентрации и скорости реакции.
Аналоги Отрио
Совпадения по коду АТХ 4-го уровня:
Полными аналогами являются:
- Липобон
- Эзетимиб
- Эзетрол
При этом цена аналогов, как правило, ниже, чем Отрио, за исключением Эзетрола. Упаковка, содержащая 28 таблеток, обойдется примерно в 4 раза дороже, чем 30 таблеток Отрио, так как она стоит в среднем в 2850 руб.
Детям
Детям младше 6 лет Отрио противопоказан в виду отсутствия данных о безопасности и эффективности.
Что касается детей 6—10 лет, то проводилась оценка безопасности и результативности назначения Отрио с целью лечения гетерозиготной семейной или несемейной гиперхолестеринемии. Исследование длилось 3 месяца. В ходе него было установлено, что профиль нежелательных реакций соответствует таковому для взрослых. Выраженного влияния на скорость и качество роста, полового созревания детей обоих полов обнаружено не было. Но эти данные актуальны при применении лекарства в течение 12-ти недель. Для случаев необходимости в более длительной терапии оценки эффективности и безопасности не проводилось.
В ходе другого испытания изучалось исследование безвредности и результативности использования комбинаций Отрио и симвастатина для пациентов 10—17 лет, имеющих гетерозиготную семейную гиперхолестеринемию. В качестве добровольцев привлекались дети обоих полов, но у всех девочек менархе наступило 1 год назад или ранее. По результатам исследования было установлено, что профиль безопасности для этой категории пациентов соответствует таковому для взрослых. Влияния на рост, длительность менструального цикла, половое созревание в целом не было выявлено.
С алкоголем
Не рекомендуется на фоне прохождения терапии употреблять алкоголь, особенно при использовании комбинаций со статинами. В подобных ситуациях усиливается нагрузка на печень, что может привести к серьезным нарушениям ее функции.
При беременности и лактации
Влияние лекарственного средства на течение беременности, развитие плода оценивалось в ходе исследований на животных. Они не показали возникновения каких-либо прямых или опосредованных нежелательных воздействий на протекание беременности, родов, эмбриогенез и т. д. Также тератогенного влияния у крыс не отмечалось при одновременном применении Отрио, ловастатина, симвастатина, правастатина или аторвастатина. У крольчих иногда возникали нарушения развития скелета у плодов.
На людях аналогичные испытания не проводились. В связи с этим при наступлении беременности рекомендуется немедленно отменить Отрио.
Влияние медикамента на состояние новорожденных оценивалось на крысах. Результаты исследования показали, что действующее вещество проникает в грудное молоко животных. На людях подобные испытания не проводились. Поэтому Отрио не следует назначать кормящим женщинам, если ожидаемая польза не превосходит потенциальные риски для младенца. При наличии выраженной необходимости в приеме лекарства стоит прекратить грудное вскармливание на весь период прохождения терапии.
Отзывы об Отрио
Отзывы пациентов, принимавших препарат Отрио, преимущественно положительные. Большинство отмечают его эффективность и доступность. Только в отдельных случаях пациенты, принимавшие таблетки 10 мг, говорили об отсутствии изменений в анализах спустя 2—3 месяца применения.
Некоторые замечали возникновение легких побочных эффектов, в частности изжоги, неприятного запаха изо рта, одышки. Во всех случаях это не служило причиной для отмены медикамента. После окончания курса лечения состояние больных нормализовалось.
Цена препарата Отрио, где купить
Купить Отрио 10 мг в Москве №30 можно в среднем за 750 рублей. Упаковка, содержащая 90 таблеток, обойдется в 1650 рублей.
- Интернет-аптеки РоссииРоссия
ЛюксФарма* специальное предложение
-
Псоркутан (Кальципотриол) мазь 30г в тубе
ЗдравСити
-
Отрио таблетки 10мг 30штАкрихин
-
Отрио таблетки 10мг 90штАО Акрихин
Аптека Диалог
-
Отрио таблетки 10мг №30Акрихин АО
Ригла
-
Б.Велл стельки ортопед ОртоТрио р.38/FW-601B.Well
показать еще

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.Для сердца и сосудовХолестерин
Автор статьи
Диплом о фармацевтическом образовании: 105924 1197876, рег. номер 30353
Все авторы
Содержание статьи
- Отрио: РЛС
- Отрио: состав препарата
- Таблетки Отрио: от чего они помогают
- Отрио: дозировка
- Отрио: противопоказания
- Отрио: побочные действия
- Эзетимиб (Эзетрол) или Отрио: что лучше
- Аторвастатин или Отрио: что эффективнее
- Что лучше: Отрио или Розувастатин
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Повышенное содержание холестерина носит медицинское название – гиперхолестеринемия. К развитию патологического состояния может привести несколько причин: генетические аномалии, различные заболевания, а также неправильное питание. Избыточная калорийность и преобладание в рационе жирных продуктов в сочетании с малоподвижным образом жизни – прямой путь к нарушению холестеринового обмена. Согласно статистике Всемирной организации здравоохранения (ВОЗ), ежегодно от последствий потребления трансжиров умирает практически 500 000 человек.
Провизор расскажет о препарате Отрио: ознакомит с его составом, показаниями к применению, противопоказаниями и побочными действиями, а также сравнит с аналогами.
Отрио: РЛС
Отрио – препарат, зарегистрированный в Государственном реестре лекарственных средств России (ГРЛС). Международное непатентованное наименование (МНН) Отрио – эзетимиб. Официальная форма выпуска лекарственного средства – таблетки для приема внутрь. Дозировка Отрио – 10 мг. Из аптеки препарат отпускается по рецепту врача.
Отрио: состав препарата
Эзетимиб – действующее вещество Отрио. Активное соединение препятствует всасыванию холестерина в кишечнике, тем самым усиливая выведение жироподобного вещества из организма.
Отрио – это статин или нет?
Важно понимать, что до 80% холестерина вырабатывается в печени. Остальное же количество поступает в организм с пищей и всасывается в кишечнике. Если статины снижают синтез холестерина в печени – главном «поставщике», то Отрио затрудняет его поглощение в кишечнике. С фармакологической точки зрения, Отрио (эзетимиб) относится к ингибиторам абсорбции холестерина.
Таблетки Отрио: от чего они помогают
Отрио – лекарство от высокого холестерина. Таблетки Отрио назначают в дополнение к диете, когда соблюдение правил питания недостаточно для нормализации его уровня. При этом часто рассматриваемый препарат комбинируют с другими гиполипидемическими средствами. Например, статинами. В показания Отрио входит:
- терапия первичной гиперхолестеринемии – повышенного уровня «плохого» холестерина в крови у взрослых и детей с 6 лет;
- терапия гомозиготной семейной гиперхолестеринемии – генетического заболевания, связанного с высоким уровнем холестерина;
- профилактика заболеваний сердца и сосудов, риск развития которых повышен у пациентов с высоким уровнем холестерина;
- профилактика сердечно-сосудистых осложнений у людей с хроническим нарушением работы почек.
Отрио: дозировка
Поскольку Отрио от холестерина, назначить необходимую дозировку может только врач, знакомый с результатами обследования и анализом крови. Специалист также учитывает сердечно-сосудистые риски. Стандартная дозировка Отрио (эзетимиб) – 10 мг.
Отрио: до еды или после, как принимать
Лекарство Отрио можно принимать до, во время или после еды.
Отрио: сколько принимать по времени можно взрослым
Продолжительность приема устанавливает врач, в зависимости от ответа на лечение и сердечно-сосудистых рисков. Нередко терапия остается с пациентом пожизненно.
Отрио: противопоказания
- индивидуальная непереносимость;
- почечная недостаточность;
- нарушение обмена сахаров (непереносимость лактозы и другие);
- возраст до 6 лет.
Отрио: побочные действия
Согласно инструкции, побочные действия «Отрио: таблетки» преимущественно легкие и преходящие (нестойкие). Побочные действия Отрио для мужчин и женщин в монотерапии:
- снижение аппетита;
- увеличение артериального давления;
- кашель;
- диарея;
- боль в животе;
- боль в суставах;
- мышечная боль;
- утомляемость;
- другие.
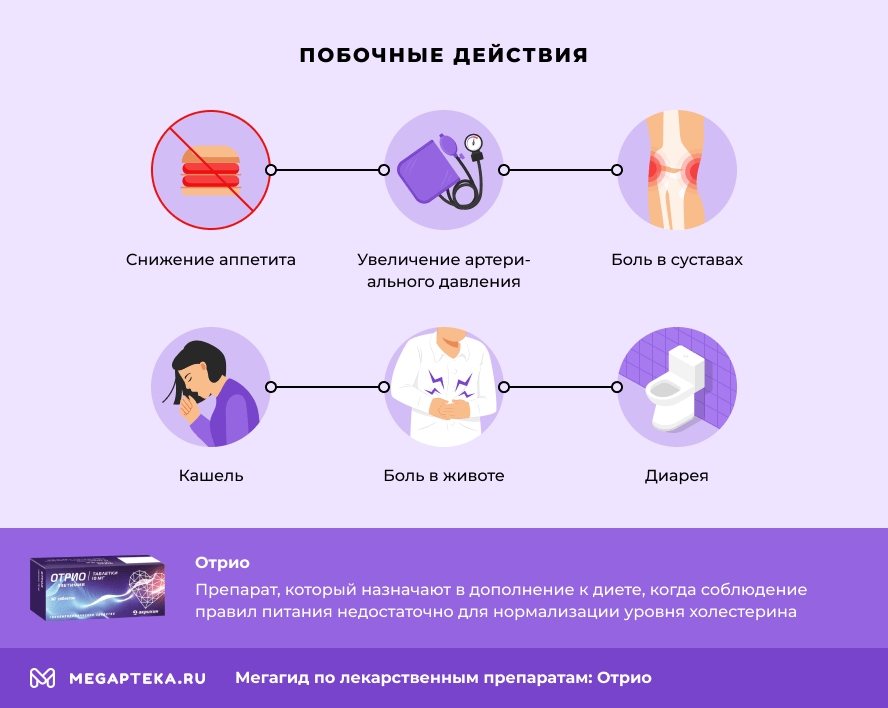
Эзетимиб (Эзетрол) или Отрио: что лучше
Эзетимиб не только действующее вещество Отрио, но и одноименное лекарство. Эзетимиб, Эзетрол и Отрио – прямые аналоги и взаимозаменяемые лекарственные средства. Отличаются же медикаменты производителем:
- Отрио производится российской фармацевтической компанией «Акрихин»;
- Эзетимиб выпускается тремя отечественными фармацевтическими компаниями: Эзетимиб («Атолл»), Эзетимиб Канон («Канонфарма продакшн») и Эзетимиб-СЗ («Северная звезда»);
- Эзетрол принадлежит международной организации «Органон Хайст бв» и производится в Пуэрто-Рико.
Аторвастатин или Отрио: что эффективнее
Сегодня препаратами выбора для терапии гиперхолестеринемии (повышенного холестерина) являются статины. В это число входит и Аторвастатин. В зависимости от причины повышения холестерина и его концентрации, врач может назначить монотерапию Аторвастатином или:
- монотерапию Отрио, если это гомозиготная семейная гиперхолестеринемия или уровень холестерина повышен у пациента в возрасте от 6 до 18 лет;
- комбинацию Аторвастатина и Отрио (эзетимиба) при неэффективности монотерапии для пациентов старше 18 лет. В номенклатуре аптек содержится комбинированный препарат Торвазин Плюс (аторвастатин + эзетимиб).
Что лучше: Отрио или Розувастатин
Часто пациенты обращаются с вопросом о том, что лучше принимать: Отрио или Розувастатин. Однако несмотря на общую цель, препараты не являются прямыми аналогами. Так, Розувастатин вместе с Аторвастатином – препараты первой линии для лечения первичной гиперхолестеринемии.
Если на фоне приема Розувастатина и диеты целевые значения холестерина не достигнуты, добавляется Отрио (эзетимиб). Исключение составляет наследственная семейная гиперхолестеринемия и возраст с 6 до 18 лет.
Нельзя однозначно сказать, что лучше: Отрио или Розувастатин. Выбор препарата совершает врач исходя из причины повышенного холестерина, его значений и индивидуальных особенностей пациента.
Краткое содержание
- Отрио – препарат, зарегистрированный в Государственном реестре лекарственных средств России (ГРЛС).
- Эзетимиб – действующее вещество Отрио.
- Отрио – лекарство от высокого холестерина.
- Назначить необходимую дозировку Отрио может только врач, знакомый с результатами обследования и анализом крови.
- Отрио имеет противопоказания и побочные действия.
- Эзетимиб, Эзетрол и Отрио – прямые аналоги и взаимозаменяемые лекарственные средства.
- Сегодня препаратами выбора для терапии гиперхолестеринемии (повышенного холестерина) являются статины, в это число входит и Аторвастатин.
- Если на фоне приема Розувастатина и диеты целевые значения холестерина не достигнуты, добавляется Отрио (эзетимиб).
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
