Талценна — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006116
Торговое наименование:
Талценна
Международное непатентованное или группировочное наименование:
талазопариб
Лекарственная форма:
капсулы
Состав
Одна капсула содержит.
Действующее вещество: талазопариб в виде талазопариба тозилата 0,25 мг (0,363 мг)/ 1 мг (1,453 мг)
Вспомогательные вещества: целлюлоза микрокристаллическая силифицированная 50 (Prosolv® 50) 33,855 мг/33,419 мг, целлюлоза микрокристаллическая силифицированная 90 (Prosolv® 90) 50,782 мг/50,128 мг.
Состав капсулы:
Дозировка 0,25 мг: корпус капсулы: гипромеллоза 22,344 мг, титана диоксид (Е171) 0,456 мг; крышечка капсулы: гипромеллоза 14,894 мг, краситель железа оксид желтый (Е172) 0,015 мг, титана диоксид (Е171) 0,292 мг, чернила черные (TekPrint® SW-9008 Black) ~ 0,15 мг.
Дозировка 1 мг: корпус капсулы: гипромеллоза 22,344 мг, титана диоксид (Е171) 0,456 мг; крышечка капсулы: гипромеллоза 14,867 мг, краситель железа оксид красный (Е172) 0,067 мг, краситель железа оксид желтый (Е172) 0,064 мг, титана диоксид (Е171) 0,201 мг, чернила черные (TekPrint® SW-9008 Black) – 0,15 мг.
Состав чернил: шеллак 24-27%, пропиленгликоль 3-7%, аммиака раствор концентрированный 1-2%, краситель железа оксид черный 24-28%, калия гидроксид 0,05-0,1%.
Описание
Дозировка 0.25 мг: твердые непрозрачные капсулы размером 4, с крышечкой от белого с кремоватым оттенком до светло-желтого цвета и корпусом белого цвета, с надписями черного цвета «Pfizer» – на крышечке и «TLZ 0.25» – на корпусе.
Содержимое капсулы – белый или почти белый с желтоватым оттенком порошок.
Дозировка 1 мг: твердые непрозрачные капсулы размером 4, с крышечкой от светло-красного до темно-оранжевого цвета и корпусом белого цвета, с надписями черного цвета «Pfizer» – на крышечке и «TLZ 1» – на корпусе.
Содержимое капсулы – белый или почти белый с желтоватым оттенком порошок.
Фармакотерапевтическая группа:
противоопухолевое средство
Код ATX:
L01XX
Фармакологические свойства
Фармакодинамика
Механизм действия
Талазопариб является мощным ингибитором ферментов семейства PARP – PARP1 и PARP2. Ферменты PARP участвуют в сигнальных путях клеточного ответа на повреждение ДНК, таких как репарация ДНК, транскрипция генов, регуляция клеточного цикла и гибель клетки. Ингибиторы PARP оказывают цитотоксическое действие на клетки опухоли посредством двух механизмов: ингибирование каталитической активности PARP и формирование комплекса PARP-ловушки, в результате чего белок PARP, связанный с ингибитором PARP, не отсоединяется легко от места повреждения ДНК, препятствуя репарации, репликации и транскрипции ДНК и, в конечном счете, вызывая апоптоз и/или гибель клетки. Обработка линий опухолевых клеток с дефектами в генах репарации ДНК талазопарибом в качестве единственного средства вызывает повышение уровня γН2АХ, который является маркером двухцепочечных разрывов ДНК, приводящих к снижению пролиферации клетки и усилению апоптоза. Противоопухолевая активность талазопариба также наблюдалась на полученной от пациентки ксенотрансплантатной модели рака молочной железы с наличием мутации гена BRCA, которая ранее получала терапию препаратами платины. На этой модели талазопариб снижал рост опухоли, а также повышал уровень γН2АХ и апоптоз клеток опухоли.
Электрофизиология сердца
Влияние талазопариба на сердечную реполяризацию оценивали с помощью согласованных по времени электрокардиограмм (ЭКГ), изучая взаимоотношения между изменением интервала QT, скорректированного с учетом частоты сердечных сокращений (QTc) от исходного уровня, и соответствующими концентрациями талазопариба в плазме крови у 37 пациентов с распространенными солидными опухолями. Талазопариб в максимальной клинически рекомендуемой дозе 1 мг один раз в сутки не оказывал клинически значимого влияния на удлинение интервала QTc.
Фармакокинетика
Экспозиция талазопариба, как правило, увеличивалась пропорционально дозе в диапазоне от 0,025 мг до 2 мг после ежедневного приема нескольких доз. После многократного ежедневного приема 1 мг талазопариба у пациентов среднее геометрическое [% коэффициента вариации (КВ%)] площади под кривой зависимости концентрации в плазме крови от времени (AUC) и максимальная концентрация талазопариба, наблюдаемая в плазме крови (Сmax) в равновесном состоянии, находились в диапазоне от 126(107) нг·час/мл до 208 (37) нг·час/мл и от 11 (90) нг/мл до 19 (27) нг/мл, соответственно. После многократного ежедневного приема концентрации талазопариба в плазме крови достигали равновесного состояния в течение от 2 до 3 недель. Медиана коэффициента накопления талазопариба после многократного приема внутрь в дозе 1 мг один раз в сутки находилась в диапазоне от 2,3 до 5,2. Талазопариб является субстратом транспортеров P-gp и BCRP.
Всасывание
После приема талазопариба внутрь медиана времени до достижения Сmax (Тmax) составляла, как правило, от 1 до 2 часов после приема препарата. Исследование абсолютной биодоступности у человека не проводилось. Однако на основании данных об экскреции через почки абсолютная биодоступность составляет по меньшей мере 41% при этом всосавшаяся фракция составляет не менее 69% (см. раздел «Выведение»). Значимого влияния средств, снижающих уровень кислотности, на талазопариб не ожидается, учитывая достаточную растворимость его при всех значениях pH от 1 до 6,8.
Влияние пищи
Прием пищи снижал скорость, но не степень всасывания талазопариба. После приема однократной дозы талазопариба внутрь с высококалорийной пищей с высоким содержанием жиров (приблизительно 827 калорий, 57% жиров) средняя Сmax талазопариба снижалась приблизительно на 46%, медиана Тmax была отсрочена с 1 часа до 4 часов, при этом AUCinf не изменялась. Исходя из этих результатов, препарат Талценна можно принимать как с пищей, так и без нее.
Распределение
Популяционный средний кажущийся объем распределения талазопариба (Vss/F) составлял 420 л. In vitro приблизительно 74% талазопариба связывается с белками плазмы независимо от концентрации в диапазоне концентраций от 0,01 мкМ до 1 мкМ.
Метаболизм
Талазопариб у человека подвергается минимальному метаболизму в печени. После приема внутрь [14С] талазопариба в однократной дозе 1 мг в плазме крови человека не выявлялось основных циркулирующих метаболитов, а талазопариб был единственным обнаруженным циркулирующим соединением, которое являлось производным препарата. В моче и фекалиях не было обнаружено ни одного метаболита, который отдельно составлял бы более 10% введенной дозы.
In vitro талазопариб не являлся ингибитором цитохрома CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 или CYP3A4/5 или же индуктором CYP1A2, CYP2B6 или CYP3A4 в клинически значимых концентрациях.
In vitro талазопариб в клинически значимых концентрациях не ингибировал ни один из основных мембранных транспортеров в кишечнике, печени или почках (P-gp, BCRP, транспортный полипептид органических анионов [ОАТР]1В1, ОАТР1В3, транспортер органических катионов [OCT]1 ОСТ2, транспортер органических анионов [OAT]1, ОАТ3, помпа, экспортирующая желчные кислоты [bile salt export pump – BSEP], белок, обеспечивающий множественную лекарственную устойчивость и выведение токсинов [МАТЕ]1 и МАТЕ2-К).
In vitro талазопариб в клинически значимых концентрациях не ингибировал ни одну из основных изоформ уридиндифосфат-глюкуронозилтрансферазы (УГТ) (1А1, 1А4, 1А6, 1А9, 2В7 и 2В15).
Выведение
Выведение талазопариба в неизмененном виде почками (пассивная фильтрация и активная секреция) является основным путем его элиминации. Вероятно, что P-gp участвует в активной почечной секреции талазопариба. Средний (±стандартное отклонение) конечный период полувыведения талазопариба из плазмы крови составлял 90 (±58) часов, а среднее популяционное значение кажущегося клиренса после перорального применения (CL/F) у пациентов со злокачественными опухолями составляло 6,5 (31%) л/час. У 6 пациенток с распространенными солидными опухолями, получивших однократную дозу [14С] талазопариба перорально, в среднем 69% (±8,6%) и 20% (±5,5) от всей введенной радиоактивной дозы выводилось почками и через кишечник, соответственно. Выделение неизмененного талазопариба почками являлось основным путем выведения, составляя 55% от введенной дозы, тогда как количество неизмененного талазопариба, выделенного с через кишечник, составляло 14%.
Возраст, пол и масса тела
Популяционный анализ показал, что возраст, пол и масса тела не оказывали клинически значимого влияния на ФК талазопариба.
Пациенты детского возраста
Фармакокинетику талазопариба у пациентов в возрасте <18 лет не оценивали.
Нарушение функции почек
По данным популяционного фармакокинетического анализа, в который было включено 490 пациентов, из которых у 132 пациентов имелось нарушение функции почек легкой степени (60 мл/мин ≤ клиренс креатинина (КК) < 90 мл/мин), у 33 пациентов имелось нарушение функции почек средней степени (30 мл/мин ≤ КК < 60 мл/мин), и у 1 пациента имелось нарушение функции почек тяжелой степени (КК < 30 мл/мин), CL/F талазопариба был снижен на 14% и 37% у пациентов с нарушением функции почек легкой и средней степени, соответственно, в сравнении с пациентами с нормальной функцией почек (КК ≥90 мл/мин). Имеющихся данных недостаточно для оценки влияния нарушения функции почек тяжелой степени на CL/F талазопариба у данной популяции пациентов. ФК талазопариба не изучалась у пациентов, которым требовалось проведение гемодиализа.
Нарушение функции печени
На основании результатов популяционного фармакокинетического анализа, включавшего 490 пациентов, из которых у 118 пациентов имелось нарушение функции печени легкой степени (общий билирубин ≤1,0×верхняя граница нормы (ВГН) и аспартатаминотрансфераза (ACT) >ВГН или общий билирубин от >1,0 до 1,5×ВГН при любом уровне ACT). Нарушение функции печени легкой степени не оказывало влияния на ФК талазопариба. ФК талазопариба у пациентов с нарушением функции печени средней степени (общий билирубин от >1,5 до 3,0×ВГН при любом уровне ACT) или тяжелой степени (общий билирубин >3,0×ВГН при любом уровне ACT) не исследовали.
Показания к применению
Препарат Талценна показан в качестве монотерапии для лечения взрослых пациентов с местнораспространенным или метастатическим НЕR2-негативным раком молочной железы с герминальными мутациями в генах BRCA, ранее получавших лечение антрациклинами и (или) таксанами в качестве неоадъювантной или адъювантной терапии или по поводу местнораспространенного или метастатического заболевания, за исключением случаев, когда пациенты не подходят для такого лечения (см. раздел «Фармакологические свойства»). Пациенты с HR-положительным раком молочной железы в качестве предшествующего лечения должны получить эндокринную терапию или считаться неподходящими для эндокринной терапии.
Противопоказания
- повышенная чувствительность к действующему веществу или любому из вспомогательных веществ
- нарушение функции печени средней и тяжелой степени;
- нарушение функции почек тяжелой степени;
- необходимость проведения гемодиализа;
- дети и подростки в возрасте до 18 лет;
- беременность;
- период грудного вскармливания.
С осторожностью
Необходимо избегать одновременного применения сильных ингибиторов P-gp (включая, помимо прочего, амиодарон, карведилол, кларитромицин, кобицистат, дарунавир, дронедарон, эритромицин, индинавир, итраконазол, кетоконазол, лапатиниб, лопинавир, пропафенон, хинидин, ранолазин, ритонавир, саквинавир, телапревир, типранавир и верапамил), сильных индукторов P-gp, ингибиторов BCRP (включая, помимо прочего, куркумин и циклоспорин) во время терапии талазопарибом (см. раздел «Взаимодействие с другими лекарственными средствами»).
Применение при беременности и в период грудного вскармливания
Женщины с сохраненной репродуктивной функцией/контрацепция у мужчин и женщин
Женщинам с сохраненной репродуктивной функцией следует исключить беременность на момент начала терапии и избегать беременности во время терапии препаратом Талценна. Тест на беременность следует выполнять всем женщинам с сохраненной репродуктивной функцией до начала лечения (см. раздел «Особые указания»).
Женщинам с сохраненной репродуктивной функцией требуется применение высокоэффективных методов контрацепции (см. раздел «Особые указания») до начала, во время и в течение, по меньшей мере, 7 месяцев после завершения терапии талазопарибом. Поскольку применение гормональной контрацепции у пациенток с раком молочной железы не рекомендуется, следует использовать два негормональных и дополняющих друг друга метода контрацепции. Мужчинам, чьи партнерши способны к деторождению или беременны, следует использовать эффективные методы контрацепции (даже после вазэктомии) во время терапии препаратом Талценна и в течение не менее 4 месяцев после приема последней дозы препарата (см. раздел «Особые указания»).
Беременность
Данные по применению препарата Талценна у беременных женщин отсутствуют. Препарат Талценна может оказывать негативное влияние на плод при его применении у беременной женщины. Препарат Талценна не следует принимать во время беременности. Его также не рекомендуется принимать женщинам с сохраненной репродуктивной функцией и не предохраняющимся от беременности (см. раздел «Особые указания»).
Период грудного вскармливания
Неизвестно, выделяется ли препарат Талценна в женское грудное молоко. Нельзя исключить риск для детей, находящихся на грудном вскармливании, и поэтому не рекомендуется проводить грудное вскармливание в период лечения препаратом Талценна и не менее чем в течение 1 месяца после получения последней дозы препарата.
Репродуктивная функция
Данные о влиянии на репродуктивную функцию пациентов отсутствуют.
Способ применения и дозы
Лечение препаратом Талценна необходимо начинать и проводить под наблюдением врача, имеющего опыт в применении противоопухолевых лекарственных препаратов. Пациенты для лечения рака молочной железы препаратом Талценна должны быть отобраны на основании подтверждённого наличия герминальных мутаций в генах BRCA, определенных с использованием валидированного метода в лаборатории, имеющей опыт проведения подобных исследований.
Пациенты с мутациями в генах BRCA должны пройти генетическое консультирование в соответствии с локальными рекомендациями.
Режим дозирования
Рекомендуемая доза препарата Талценна – 1 мг внутрь один раз в сутки. Пациенты должны получать терапию до прогрессирования заболевания либо развития неприемлемой токсичности.
Пропуск дозы
При развитии рвоты или пропуске дозы не следует принимать дополнительную дозу препарата, а принять следующую дозу в обычное для нее время.
Коррекция дозы
Лечение некоторых нежелательных явлений может потребовать временного прекращения терапии или снижения дозы препарата в зависимости от тяжести реакций и клинической картины (таблица 2). Рекомендуемые уровни снижения дозы указаны в таблице 1.
Таблица 1. Коррекция дозы при явлениях токсичности
| Уровень дозы | |
| Рекомендуемая начальная доза | 1 мг (одна капсула дозировкой 1 мг) один раз в сутки |
| Первое снижение дозы | 0,75 мг (три капсулы дозировкой 0,25 мг) один раз в сутки |
| Второе снижение дозы | 0,5 мг (две капсулы дозировкой 0,25 мг) один раз в сутки |
| Третье снижение дозы | 0,25 мг (одна капсула дозировкой 0,25 мг) один раз в сутки |
Общий анализ крови следует выполнять до начала терапии препаратом Талценна и далее ежемесячно и по клиническим показаниям (см. таблицу 2 и раздел «Особые указания»).
Таблица 2. Коррекция дозы и режима лечения
| Приостановить лечение препаратом Талценна до увеличения показателей до | Возобновить лечение препаратом Талценна | |
| Гемоглобин <8 г/дл | ≥9 г/дл | Возобновить терапию препаратом Талценна с использованием следующей более низкой дозы |
| Количество тромбоцитов <50000/мкл | ≥75 000/мкл | |
| Количество нейтрофилов <1000/мкл | ≥1500/мкл | |
| Негематологические нежелательные реакции 3-4 степени тяжести | ≤степени тяжести 1 | Рассмотреть возможность возобновления лечения препаратом Талценна в следующей более низкой дозе или прекратить лечение полностью |
Одновременная терапия ингибиторами Р-гликопротеина (Р-gp)
Сильные ингибиторы P-gp могут привести к увеличению времени выведения талазопариба. Необходимо избегать одновременного применения сильных ингибиторов P-gp во время терапии талазопарибом. Возможность одновременного применения следует рассматривать только после тщательной оценки потенциальной пользы и рисков. Если нельзя избежать одновременного назначения сильного ингибитора P-gp, дозу препарата Талценна следует снизить до 0,75 мг один раз в сутки. Если одновременное применение сильного ингибитора прекращено, следует повысить дозу препарата Талценна (по истечении от 3 до 5 периодов полувыведения ингибитора) до дозы, которую пациент принимал до начала терапии сильным ингибитором P-gp (см. раздел «Взаимодействие с другими лекарственными средствами»).
Особые категории пациентов
Нарушение функции печени
Для пациентов с нарушением функции печени легкой степени (общий билирубин ≤1×ВГН и ACT >ВГН или общий билирубин от >1,0 до 1,5×ВГН при любом уровне ACT) коррекция дозы не требуется. Препарат Талценна не исследовали у пациентов с нарушением функции печени средней степени (общий билирубин от >1,5 до 3,0×ВГН при любом уровне ACT) или тяжелой степени (общий билирубин >3,0×ВГН при любом уровне ACT) (см. раздел «Фармакокинетика»).
Нарушение функции почек
Пациентам с нарушением функции почек легкой степени (60 мл/мин ≤ КК < 90 мл/мин) коррекция дозы не требуется. Для пациентов с нарушением функции почек средней степени (30 мл/мин ≤ КК < 60 мл/мин) рекомендуемая доза препарата Талценна составляет 0,75 мг один раз в сутки. Применение препарата Талценна у пациентов с тяжелым нарушением функции почек (КК <30 мл/мин) или пациентов, которым требуется проведение гемодиализа, не изучалось (см. раздел «Фармакокинетика»). Препарат Талценна не рекомендуется применять у пациентов с тяжелым нарушением функции почек или у тех, которые нуждаются в проведении гемодиализа.
Пациенты пожилого возраста
Для пациентов пожилого возраста (в возрасте ≥65 лет) коррекция дозы не требуется (см. раздел «Фармакокинетика»).
Пациенты детского возраста
Безопасность и эффективность препарата Талценна у детей и подростков в возрасте <18 лет не установлена.
Побочное действие
Общий профиль безопасности препарата Талценна основан на оценке объединенных данных 494 пациентов, получавших талазопариб в дозе 1 мг в сутки в рамках клинических исследований по поводу солидных опухолей, включая 286 пациентов с местнораспространенным или метастатическим НЕR2-отрицательным раком молочной железы с наличием герминальных мутаций в генах BRCA из рандомизированного исследования фазы 3 и 83 пациента с местнораспространенным или метастатическим раком молочной железы с наличием герминальных мутаций в генах BRCA из нерандомизированного исследования фазы 2.
Наиболее частыми (≥25%) нежелательными реакциями у пациентов, получавших талазопариб в данных клинических исследованиях, являлись повышенная утомляемость (57,1%), анемия (49,6%), тошнота (44,3%), нейтропения (30,2%), громбоцитопения (29,6%) и головная боль (26,5%). Наиболее частыми (≥10%) нежелательными реакциями ≥3 степени являлись анемия (35,2%), нейтропения (17,4%) и громбоцитопения (16,8%). Коррекция дозы (снижение дозы или временное прекращение приема препарата) вследствие какой-либо нежелательной реакции потребовалась у 62,3% пациентов, получавших препарат Талценна. Наиболее частыми нежелательными реакциями, приводящими в коррекции дозы, являлись анемия (33,0%), нейтропения (15,8%) и тромбоцитопения (13,4%).
Полная отмена терапии, связанная с развитием нежелательных реакций, потребовалась у 3,6% пациентов, получавших препарат Талценна. Медиана продолжительности применения талазопариба составила 5,4 месяцев (диапазон 0,03-61,1).
Список нежелательных реакций в виде таблицы
В таблице 3 представлены нежелательные реакции, выявленные по результатам анализа объединенных наборов данных и сгруппированные в зависимости от системно-органного класса и частоты развития. Категории частоты определяются следующим образом: очень частые (≥1/10) и частые (от ≥1/100 до <1/10). В каждой категории частоты нежелательные реакции представлены в порядке снижения степени серьезности.
Таблица 3. Нежелательные реакции, выявленные но результатам анализа объединенных наборов данных из 5 исследований (N=494)
| Системно-органный класс Частота Предпочтительный термин |
Все степени тяжести* n (%) |
Степень тяжести 3 n (%) |
Степень тяжести 4 n (%) |
| Нарушения со стороны крови и лимфатической системы | |||
| Очень часто | |||
| Тромбоцитопенияа | 146 (29,6) | 63 (12,8) | 20 (4,0) |
| Анемияб | 245 (49,6) | 172 (34,8) | 2 (0,4) |
| Нейтропенияв | 149 (30,2) | 77 (15,6) | 9 (1,8) |
| Лейкопенияг | 77 (15,6) | 24 (4,9) | 1 (0,2) |
| Часто | |||
| Лимфопенияд | 30 (6,1) | 13 (2,6) | 0 (0,0) |
| Нарушения обмена веществ и питания | |||
| Очень часто | |||
| Снижение аппетита | 100 (20,2) | 2 (0,4) | 0 (0,0) |
| Нарушения со стороны нервной системы | |||
| Очень часто | |||
| Головокружение | 69 (14,0) | 1 (0,2) | НП |
| Головная боль | 131 (26,5) | 5 (1,0) | НП |
| Часто | |||
| Дисгевзия | 42 (8,5) | 0 (0.0) | 0 (0,0) |
| Нарушения со стороны желудочно-кишечного тракта | |||
| Очень часто | |||
| Рвота | 110 (22,3) | 7 (1,4) | 0 (0,0) |
| Диарея | 112 (22,7) | 3 (0,6) | 0 (0,0) |
| Тошнота | 219 (44,3) | 4 (0,8) | НП |
| Боль в животее | 105 (21,3) | 8 (1,6) | НП |
| Часто | |||
| Стоматит | 32 (6,5) | 0 (0,0) | 0 (0,0) |
| Диспепсия | 41 (8.3) | 0 (0,0) | НП |
| Нарушения со стороны кожи и подкожных тканей | |||
| Очень часто | |||
| Алопецияж | 110 (22,3) | НП | НП |
| Общие расстройства и нарушения в месте введения | |||
| Очень часто | |||
| Повышенная утомляемостьз | 282 (57,1) | 17 (3,4) | 1 (0,2) |
Сокращения: n – число пациентов; НП – неприменимо,
* Нежелательные лекарственные реакции 5 степени отсутствовали.
а. Включает следующие предпочтительные термины: тромбоцитопения и снижение числа тромбоцитов.
б. Включает следующие предпочтительные термины: анемия, снижение гематокрита и снижение уровня гемоглобина.
в. Включает следующие предпочтительные термины: нейтропения и снижение числа нейтрофилов.
г. Включает следующие предпочтительные термины: лейкопения и снижение числа лейкоцитов.
д. Включает следующие предпочтительные термины: снижение числа лимфоцитов и лимфопения.
е. Включает следующие предпочтительные термины: боль в животе, боль вверху живота, дискомфорт в животе и боль внизу живота.
е. Для талазопариба частота явлений степени тяжести 1 составляла 21%, степени тяжести 2 – 2%.
з. Включает следующие предпочтительные термины: повышенная утомляемость и астения.
Описание отдельных нежелательных реакций
Миелосупрессия
Нежелательные реакции, связанные с миелосупрессией, такие как анемия, нейтропения и тромбоцитопения, очень часто регистрировались у пациентов, получавших талазопариб в дозе 1 мг/сут. Явления 3 и 4 степени тяжести, связанные с миелосупрессией, были зарегистрированы со следующей частотой: анемия – 34,8% и 0,4% соответственно, нейтропения – 15,6% и 1,8% соответственно, тромбоцитопения – 12,8% и 4,0% соответственно. О случаях смерти в связи с нежелательными реакциями, связанными с миелосупрессией, не сообщалось. В связи с развитием нежелательных явлений, связанных с миелосупрессией, коррекция дозы потребовалась примерно у 30% пациентов, получавших талазопариб в дозе 1 мг/сут, а полное прекращение терапии было отмечено у менее чем 1% пациентов.
Передозировка
Специфическое лечение при передозировке талазопариба отсутствует, а симптомы передозировки не установлены. В случае передозировки лечение талазопарибом следует прекратить, а лечащий врач должен оценить необходимость промывания желудка и обеспечить проведение симптоматической терапии.
Взаимодействие с другими лекарственными средствами
Талазопариб является субстратом для трансмембранных транспортеров лекарственных препаратов P-gp и BCRP и выводится в основном посредством почечного клиренса в неизмененном виде.
Препараты, которые могут влиять на концентрацию талазопариба в плазме крови
Влияние ингибиторов P-gp
Данные, полученные в рамках изучения взаимодействия лекарственных средств у пациентов с распространенными солидными опухолями, показали, что на фоне одновременного многократного ежедневного приема ингибитора P-gp итраконазола в дозе 100 мг два раза в сутки и однократного приема талазопариба в дозе 0,5 мг наблюдалось увеличение площади под кривой зависимости концентрации в плазме крови от времени (AUCinf) и максимальной концентрации (Сmax) талазопариба приблизительно на 56% и 40%, соответственно по сравнению с аналогичными значениями при однократном применении только талазопариба в дозе 0,5 мг. Популяционный фармакокинетический анализ показал, что одновременное применение сильных ингибиторов P-gp повышает экспозицию талазопариба на 45% по сравнению с применением только талазопариба. Одновременного применения сильных ингибиторов P-gp (включая, помимо прочего, амиодарон, карведилол, кларитромицин, кобицистат, дарунавир, дронедарон, эритромицин, индинавир, итраконазол, кетоконазол, лапатиниб, лопинавир, пропафенон, хинидин, ранолазин, ритонавир, саквинавир, телапревир, типранавир и верапамил) следует избегать. Если совместного применения с сильными ингибиторами P-gp избежать невозможно, необходимо снизить дозу препарата Талценна (см. раздел «Способ применения и дозы»).
Влияние индукторов P-gp
Данные, полученные в рамках изучения взаимодействия лекарственных средств у пациентов с распространенными солидными опухолями, показали, что на фоне одновременного многократного ежедневного приема индуктора P-gp рифампицина в дозе 600 мг и однократного приема талазопариба в дозе 1 мг (пациенты принимали рифампицин за 30 минут до приема талазопариба в день его приема) наблюдалось увеличение Сmax талазопариба приблизительно на 37%, тогда как значение AUCinf не изменялось по сравнению с таковым при применении одного талазопариба в дозе 1 мг. Эти изменения, вероятно, являются следствием суммарного эффекта индуцирования и ингибирования P-gp рифампицином в условиях данного исследования по изучению взаимодействий между лекарственными средствами. При совместном применении с рифампицином коррекция дозы талазопариба не требуется. Однако, влияние других индукторов P-gp на воздействие талазопариба не изучено. Другие индукторы P-gp (включая, помимо прочего, карбамазепин, фенитоин и зверобой пордырявленный) могут уменьшать воздействие талазопариба.
Влияние ингибиторов BCRP
Влияние ингибиторов BCRP на фармакокинетику талазопариба in vivo не изучалось. При совместном применении талазопариба с ингибиторами BCRP может увеличиваться воздействие талазопариба. Следует избегать одновременного применения сильных ингибиторов BCRP (включая, помимо прочего, куркумин, циклоспорин). Если совместного применения сильных ингибиторов BCRP избежать нельзя, пациентов следует наблюдать на предмет возможного увеличения частоты нежелательных реакций.
Влияние препаратов, снижающих уровень кислотности
Популяционный фармакокинетический анализ указывает, что одновременное применение лекарственных препаратов, снижающих уровень кислотности, включая ингибиторы протонной помпы (ИПП), антагонисты Н2 рецепторов гистамина (H2RA) или других снижающих уровень кислотности препаратов, не оказывает значимого влияния на всасывание талазопариба.
Системная гормональная контрацепция
Исследования взаимодействий талазопариба и пероральных контрацептивов не проводились.
Особые указания
Миелосупрессия
У пациентов, получавших лечение талазопарибом, была зарегистрирована миелосупрессия, включающая анемию, лейкопению/нейтропению и/или тромбоцитопению (см. раздел «Побочные действия»). Не следует начинать лечение талазопарибом до разрешения явлений гематологической токсичности (≤1 степени), вызванных проводимой ранее терапией.
Необходимо принять меры предосторожности и регулярно проводить мониторинг гематологических показателей, а также оценивать признаки и симптомы, связанные с анемией, лейкопенией/нейтропенией и/или тромбоцитопенией, у пациентов, получающих талазопариб. В случае их возникновения рекомендуется коррекция дозы (снижение или временное прекращение приема препарата) (см. раздел «Способ применения и дозы»). Может потребоваться поддерживающая терапия, включающая или не включающая трансфузии крови и/или тромбоцитов и/или введение колониестимулирующих факторов.
Миелодиспластический синдром/острый миелобластный лейкоз
Случаи миелодиспластического синдрома/острого миелобластного лейкоза (МДС/ОМЛ) регистрировали у пациентов, получавших ингибиторы поли-(аденозиндифосфат-рибоза)-полимеразы (PARP), включая талазопариб. В целом, МДС/ОМЛ был зарегистрирован у 2 из 584 (0,3%) пациентов с солидными опухолями, получавших терапию талазопарибом в рамках клинических исследований. Потенциальные факторы, способствующие развитию МДС/ОМЛ, включали предшествующую химиотерапию препаратами платины, другими повреждающими ДНК агентами или проведение лучевой терапии. Следует выполнять клинический анализ крови до начала лечения талазопарибом и далее ежемесячно во время лечения на предмет появления признаков гематологической токсичности. Если МДС/ОМЛ подтвержден, прием талазопариба следует прекратить.
Контрацепция у женщин с сохраненной репродуктивной функцией
Талазопариб проявлял кластогенный эффект в анализе на хромосомные аберрации in vitro в лимфоцитах периферической крови человека и в микроядерном тесте in vivo с использованием костного мозга крыс, но не проявлял мутагенных свойств в тесте Эймса, и может причинить вред плоду при применении беременной женщиной. Следует уведомить беременную женщину о потенциальном риске для плода (см. раздел «Применение при беременности и в период грудного вскармливания»). Женщинам с сохраненной репродуктивной функцией следует исключить беременность на момент начала терапии и избегать беременности во время терапии препаратом Талценна. Тест на беременность следует выполнять всем женщинам с сохраненной репродуктивной функцией до начала лечения.
Женщинам с сохраненной репродуктивной функцией требуется применение высокоэффективных методов контрацепции (см. раздел «Особые указания») во время и в течение, по меньшей мере, 7 месяцев после завершения терапии талазопарибом.
Поскольку применение гормональной контрацепции у пациентов с раком молочной железы не рекомендуется, следует использовать два негормональных и дополняющих друг друга метода (см. раздел «Применение при беременности и в период грудного вскармливания»). Мужчинам, чьи партнерши способны к деторождению или беременны, следует рекомендовать использовать эффективные методы контрацепции (даже после вазэктомии) во время терапии препаратом Талценна и в течение не менее 4 месяцев после приема последней дозы препарата.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по оценке влияния талазопариба на способность управлять автотранспортными средствами и работать с механизмами не проводились. Однако пациентам, которые при приеме талазопариба испытывают повышенную утомляемость/астению или головокружение, следует проявлять осторожность при управлении транспортными средствами и работе с механизмами.
Форма выпуска
Капсулы 0,25 мг и 1 мг.
По 30 капсул во флаконе из ПЭВП с полипропиленовой крышкой с термозапечатываемой мембраной.
1 флакон вместе с инструкцией по применению в картонной пачке с контролем первого вскрытия или без него.
Условия хранения
При температуре не выше 30 °С.
Хранить в местах, недоступных для детей
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту
Производитель
Эксцелла ГмбХ и Ко. КГ», Германия
Адрес: Нюрнбергер Штрассе 12,
90537 Фойхт, Германия
Организация, принимающая претензии потребителей
ООО «Пфайзер Инновации»
123112 Москва, Пресненская наб., д. 10
БЦ «Башня на Набережной» (Блок С)
Купить Талценна в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Талценна (Talcenna)
💊 Состав препарата Талценна
✅ Применение препарата Талценна
Описание активных компонентов препарата
Талценна
(Talcenna)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.07.05
Владелец регистрационного удостоверения:
Код ATX:
L01XX
(Прочие противоопухолевые препараты)
Лекарственные формы
| Талценна |
Капс. 0.25 мг: 30 шт. рег. №: ЛП-(000625)-(РГ-RU) |
|
|
Капс. 1 мг: 30 шт. рег. №: ЛП-(000625)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Талценна
Капсулы твердые непрозрачные, размером 4, с крышечкой от белого с кремоватым оттенком до светло-желтого цвета и корпусом белого цвета, с надписями черного цвета «Pfizer» — на крышечке и «TLZ 0.25» — на корпусе.
Вспомогательные вещества: целлюлоза микрокристаллическая силифицированная 50 (Prosolv® 50), целлюлоза микрокристаллическая силифицированная 90 (Prosolv® 90), гипромеллоза, краситель железа оксид желтый (Е172), титана диоксид (Е171), чернила черные: шеллак (Е904), пропиленгликоль (Е1520), аммиака раствор концентрированный (Е527), краситель железа оксид черный (Е172), калия гидроксид (Е525).
30 шт. — флаконы (1) — пачки картонные с контролем первого вскрытия или без него.
Капсулы твердые непрозрачные, размером 4, с крышечкой от светло-красного до темно-оранжевого цвета и корпусом белого цвета, с надписями черного цвета «Pfizer» — на крышечке и «TLZ 1» — на корпусе.
Вспомогательные вещества: целлюлоза микрокристаллическая силифицированная 50 (Prosolv® 50), целлюлоза микрокристаллическая силифицированная 90 (Prosolv® 90), гипромеллоза, краситель железа оксид красный (Е172), краситель железа оксид желтый (Е172), титана диоксид (Е171), чернила черные: шеллак (Е904), пропиленгликоль (Е1520), аммиака раствор концентрированный (Е527), краситель железа оксид черный (Е172), калия гидроксид (Е525).
30 шт. — флаконы (1) — пачки картонные с контролем первого вскрытия или без него.
Фармакологическое действие
Противоопухолевое средство. Талазопариб является мощным ингибитором ферментов семейства поли-(аденозиндифосфат-рибоза)-полимеразы (PARP) — PARP1 и PARP2. Ферменты PARP участвуют в сигнальных путях клеточного ответа на повреждение ДНК, таких как репарация ДНК, транскрипция генов, регуляция клеточного цикла и гибель клетки. Ингибиторы PARP оказывают цитотоксическое действие на клетки опухоли посредством двух механизмов: ингибирование каталитической активности PARPи формирование комплекса PARP-ловушки, в результате чего белок PARP, связанный с ингибитором PARP, не отсоединяется легко от места повреждения ДНК, препятствуя репарации, репликации и транскрипции ДНК и, в конечном счете, вызывая апоптоз и/или гибель клетки. Обработка линий опухолевых клеток с дефектами в генах репарации ДНК талазопарибом в качестве единственного средства вызывает повышение уровня γН2АХ, который является маркером двухцепочечных разрывов ДНК, приводящих к снижению пролиферации клетки и усилению апоптоза. Противоопухолевая активность талазопариба также наблюдалась на полученной от пациентки ксенотрансплантатной модели рака молочной железы с наличием мутации гена BRCA, которая ранее получала терапию препаратами платины. На этой модели талазопариб снижал рост опухоли, а также повышал уровень γН2АХ и апоптоз клеток опухоли.
Фармакокинетика
Экспозиция талазопариба, как правило, увеличивалась пропорционально дозе в диапазоне от 25 мкг до 2 мг после ежедневного приема нескольких доз. После многократного ежедневного приема 1 мг талазопариба у пациентов среднее геометрическое AUC и Cmax талазопариба в плазме крови и Cssmax находились в диапазоне от 126 (107) нг×ч/мл до 208 (37) нг×ч/мл и от 11 (90) нг/мл до 19 (27) нг/мл соответственно. После многократного ежедневного приема Css в плазме достигалась в течение 2-3 недель. Медиана коэффициента накопления талазопариба после многократного приема внутрь в дозе 1 мг 1 раз/сут находилась в диапазоне от 2.3 до 5.2. Талазопариб является субстратом транспортеров P-gp и BCRP.
После приема талазопариба внутрь медиана времени до достижения Cmax составляла, как правило, от 1 до 2 часов после приема препарата. Исследование абсолютной биодоступности у человека не проводилось. Однако на основании данных об экскреции через почки абсолютная биодоступность составляет по меньшей мере 41%, при этом всосавшаяся фракция составляет не менее 69%. Прием пищи снижал скорость, но не степень всасывания талазопариба. Популяционный средний кажущийся объем распределения талазопариба (Vss/F) составлял 420 л. Связывание с белками составляет приблизительно 74% в диапазоне концентраций от 0.01 мкМ до 1 мкМ. Талазопариб у человека подвергается минимальному метаболизму в печени. После приема внутрь [14С] талазопариба в однократной дозе 1 мг в плазме крови человека не выявлялось основных циркулирующих метаболитов, а талазопариб был единственным обнаруженным циркулирующим соединением, которое являлось производным препарата. В моче и кале не было обнаружено ни одного метаболита, который отдельно составлял бы более 10 % введенной дозы.
Выведение талазопариба в неизмененном виде почками (пассивная фильтрация и активная секреция) является основным путем его элиминации. Вероятно, что P-гликопротеин участвует в активной почечной секреции талазопариба. Средний (± стандартное отклонение) конечный T1/2 талазопариба из плазмы крови составлял 90 (±58) ч, а среднее популяционное значение кажущегося клиренса после перорального применения (CL/F) у пациентов со злокачественными опухолями составляло 6.5 (31%) л/ч. У 6 пациенток с распространенными солидными опухолями, получивших однократную дозу [14С] талазопариба перорально, в среднем 69% (±8.6%) и 20% (± 5.5) от всей введено радиоактивной дозы выводилось почками и через кишечник соответственно. Выделение неизмененного талазопариба почками являлось основным путем выведения, составляя 55% от введенной дозы, тогда как количество неизмененного талазопариба, выделенного с через кишечник, составляло 14%.
Показания активных веществ препарата
Талценна
В качестве монотерапии для лечения пациентов с местно-распространенным или метастатическим HER2-негативным раком молочной железы с герминальными мутациями в генах BRCA, ранее получавших лечение антрациклинами и (или) таксанами в качестве неоадъювантной или адъювантной терапии или по поводу местно-распространенного или метастатического заболевания, за исключением случаев, когда пациенты не подходят для такого лечения. Пациенты с HR-положительным раком молочной железы в качестве предшествующего лечения должны получить эндокринную терапию или считаться неподходящими для эндокринной терапии.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Лечение необходимо начинать и проводить под наблюдением врача, имеющего опыт в применении противоопухолевых лекарственных препаратов.
Пациенты для лечения рака молочной железы талазопарибом должны быть отобраны на основании подтвержденного наличия герминальных мутаций в генах BRCA, определенных с использованием валидированного метода в лаборатории, имеющей опыт проведения подобных исследований.
Пациенты с мутациями в генах BRCA должны пройти генетическое консультирование в соответствии с локальными рекомендациями.
Для приема внутрь. Рекомендуемая доза — 1 мг 1 раз/сут. Лечение проводится до прогрессирования заболевания либо развития неприемлемой токсичности.
Побочное действие
Со стороны крови и лимфатической системы: очень часто — тромбоцитопения, анемия, нейтропения, лейкопения; часто —
лимфопения.
Со стороны обмена веществ: очень часто — снижение аппетита.
Со стороны нервной системы: очень часто — головокружение, головная боль; часто — дисгевзия.
Со стороны пищеварительной системы: очень часто — рвота, диарея, тошнота, боль в животе; часто — стоматит, диспепсия.
Со стороны кожи и подкожных тканей: очень часто — алопеция.
Общие расстройства: очень часто — повышенная утомляемость.
Противопоказания к применению
Повышенная чувствительность к талазопарибу, нарушение функции печени средней и тяжелой степени; нарушение функции почек тяжелой степени; необходимость проведения гемодиализа; дети и подростки в возрасте до 18 лет; беременность; период грудного вскармливания.
С осторожностью
Необходимо избегать одновременного применения сильных ингибиторов P-гликопротеина (включая, помимо прочего, амиодарон, карведилол, кларитромицин, кобицистат, дарунавир, дронедарон, эритромицин, индинавир, итраконазол, кетоконазол, лапатиниб, лопинавир, пропафенон, хинидин, ранолазин, ритонавир. саквинавир, телапревир, типранавир и верапамил), сильных индукторов P-гликопротеина, ингибиторов BCRP (включая куркумин и циклоспорин) во время терапии талазопарибом.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Женщинам с сохраненной репродуктивной функцией следует исключить беременность на момент начала терапии и избегать беременности во время терапии. Тест на беременность следует выполнять всем женщинам с сохраненной репродуктивной функцией до начала лечения.
Мужчинам, чьи партнерши способны к деторождению или беременны, следует использовать эффективные методы контрацепции (даже после вазэктомии) во время терапии талазопарибом и в течение не менее 4 месяцев после приема последней дозы.
Применение при нарушениях функции печени
Противопоказания: нарушение функции печени средней и тяжелой степени.
Применение при нарушениях функции почек
Противопоказания: нарушение функции почек тяжелой степени; необходимость проведения гемодиализа.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Особые указания
Не следует начинать лечение талазопарибом до разрешения явлений гематологической токсичности (<1 степени), вызванных проводимой ранее терапией.
Необходимо принять меры предосторожности и регулярно проводить мониторинг гематологических показателей, а также оценивать признаки и симптомы, связанные с анемией, лейкопенией/нейтропенией и/или тромбоцитопенией, у пациентов, получающих талазопариб. В случае их возникновения рекомендуется коррекция дозы. Может потребоваться поддерживающая терапия, которая может включать трансфузии крови и/или тромбоцитов и/или введение колониестимулирующих факторов.
Случаи миелодиспластического синдрома/острого миелобластного лейкоза (МДС/ОМЛ) регистрировали у пациентов, получавших ингибиторы PARP, включая талазопариб. В целом, МДС/ОМЛ был зарегистрирован у 2 из 584 (0.3%) пациентов с солидными опухолями, получавших терапию талазопарибом в рамках клинических исследований. Потенциальные факторы, способствующие развитию МДС/ОМЛ, включали предшествующую химиотерапию препаратами платины, другими повреждающими ДНК агентами или проведение лучевой терапии. Следует выполнять клинический анализ крови до начала лечения талазопарибом и далее ежемесячно во время лечения на предмет появления признаков гематологической токсичности. Если МДС/ОМЛ подтвержден, прием талазопариба следует прекратить.
Влияние на способность к управлению транспортными средствами и механизмами
Пациентам, у которых при приеме талазопариба испытывают повышенную утомляемость/астению или головокружение, следует проявлять осторожность при управлении транспортными средствами и работе с механизмами.
Лекарственное взаимодействие
Талазопариб является субстратом для трансмембранных транспортеров лекарственных препаратов P-гликопротеина и BCRP и выводится в основном посредством почечного клиренса в неизмененном виде.
Данные, полученные в рамках изучения взаимодействия лекарственных средств у пациентов с распространенными солидными опухолями, показали, что на фоне одновременного многократного ежедневного приема ингибитора P-гликопротеина итраконазола в дозе 100 мг 2 раза/сут и однократного приема талазопариба в дозе 0.5 мг наблюдалось увеличение AUCinf и Cmax талазопариба приблизительно на 56% и 40%, соответственно, по сравнению с аналогичными значениями при однократном применении только талазопариба в дозе 0.5 мг. Популяционный фармакокинетический анализ показал, что одновременное применение сильных ингибиторов P-гликопротеина повышает экспозицию талазопариба на 45% по сравнению с применением только талазопариба. Одновременного применения сильных ингибиторов P-гликопротеина (включая, амиодарон, карведилол, кларитромицин, кобицистат, дарунавир, дронедарон, эритромицин, индинавир, итраконазол, кетоконазол, лапатиниб, лопинавир, пропафенон, хинидин, ранолазин, ритонавир, саквинавир, телапревир, типранавир и верапамил) следует избегать. Если совместного применения с сильными ингибиторами P-гликопротеина избежать невозможно, необходимо снизить дозу талазопариба.
Данные, полученные в рамках изучения взаимодействия лекарственных средств у пациентов с распространенными солидными опухолями, показали, что на фоне одновременного многократного ежедневного приема индуктора P-гликопротеина рифампицина в дозе 600 мг и однократного приема талазопариба в дозе 1 мг наблюдалось увеличение Cmax талазопариба приблизительно на 37%, тогда как значение AUCinf не изменялось по сравнению с таковым при применении одного талазопариба в дозе 1 мг. Эти изменения, вероятно, являются следствием суммарного эффекта индуцирования и ингибирования P-гликопротеина рифампицином в условиях данного исследования по изучению взаимодействий между лекарственными средствами. При совместном применении с рифампицином коррекция дозы талазопариба не требуется. Однако влияние других индукторов P-гликопротеина на воздействие талазопариба не изучено. Другие индукторы P-гликопротеина (включая, помимо прочего, карбамазепин, фенитоин и зверобой продырявленный) могут уменьшать воздействие талазопариба.
При совместном применении талазопариба с ингибиторами BCRP может увеличиваться воздействие талазопариба. Следует избегать одновременного применения сильных ингибиторов BCRP (включая, помимо прочего, куркумин, циклоспорин). Если совместного применения сильных ингибиторов BCRP избежать нельзя, пациентов следует наблюдать на предмет возможного увеличения частоты нежелательных реакций.
Популяционный фармакокинетический анализ указывает, что одновременное применение лекарственных препаратов, снижающих уровень кислотности, включая ингибиторы протонового насоса, блокаторы гистаминовых Н2-рецепторов или других снижающих уровень кислотности препаратов, не оказывает значимого влияния на всасывание талазопариба.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Что представляет собой препарат Талзенна
Талзенна содержит действующее вещество талазопариб. Это вещество является противоопухолевым средством, называемым ингибитором PARP (поли [аденозиндифосфат-рибоза]-полимераза).
Пациенты с изменениями (мутациями) в генах, называемых BRCA, имеют риск возникновения некоторых форм рака. Талзенна действует путем блокирования фермента PARP, который восстанавливает поврежденную ДНК в некоторых опухолевых клетках. В результате этого опухолевые клетки более не могут восстанавливаться и погибают.
Для чего применяют препарат Талзенна
Талзенна применяется для лечения взрослых пациентов, страдающих раком молочной железы с отрицательным статусом по рецепторам человеческого эпидермального фактора роста 2 (HER2), у которых имеется патологический врожденный ген BRCA.
Талзенна применяется в тех случаях, когда рак распространился за пределы первоначальной опухоли или в другие части тела.
Ваш врач выполнит анализ для того, чтобы убедиться, что применение Талзенны Вам подходит.
Если у Вас имеются вопросы о том, как действует Талзенна или почему Вам был назначен этот лекарственный препарат, задайте их Вашему врачу.
Не принимайте препарат Талзенна, если:
— Если у Вас аллергия на талазопариб или какие-либо другие компоненты этого лекарственного препарата (перечислены в разделе «Состав»).
— Если Вы кормите грудью.
Сообщите Вашему врачу, фармацевту или медсестре перед приемом Талзенны и во время курса лечения, если у Вас появились признаки или симптомы, описанные в этом разделе.
Снижение числа форменных элементов крови
Талзенна снижает число форменных элементов крови, таких как эритроциты (анемия), лейкоциты (нейтропения) или тромбоциты (тромбоцитопения). Признаки и симптомы, которых Вам следует остерегаться, включают следующие:
· анемия: нехватка воздуха, чувство сильной усталости, бледность кожи или частое сердцебиение — все это может быть признаками низкого числа эритроцитов;
· нейтропения: инфекция, озноб или дрожь либо лихорадка — все это может быть признаками низкого числа лейкоцитов;
· тромбоцитопения: появление синяков или более длительное, чем обычно, кровотечение, если Вы поранитесь — все это может быть признаками низкого числа тромбоцитов.
Во время лечения Вам будут регулярно выполнять анализ крови, чтобы контролировать содержание форменных элементов крови (лейкоциты, эритроциты и тромбоциты).
Серьезные проблемы с костным мозгом
В редких случаях низкое число форменных элементов крови может быть признаком более серьезных проблем с костным мозгом, таких как миелодиспластический синдром (МДС) или острый миелоидный лейкоз (ОМЛ). Ваш врач может принять решение провести исследование костного мозга для того, чтобы выявить эти проблемы.
Контрацепция у мужчин и женщин
Женщины, способные забеременеть, и мужчины, партнерши которых беременны или могут забеременеть, должны использовать эффективные методы контрацепции.
См. раздел «Беременность, лактация и фертильность» ниже.
Дети и подростки
Препарат Талзенна не следует применять у детей или подростков (в возрасте 18 лет или младше).
Если Вы принимаете, принимали недавно или могли принимать любые другие препараты, сообщите об этом своему врачу, фармацевту или медсестре. К таким препаратам относятся лекарственные средства, отпускаемые без рецепта, и препараты на основе лекарственных растений. Это связано с тем, что Талзенна может повлиять на то, как действуют некоторые другие лекарственные препараты. Кроме того, некоторые другие лекарственные препараты могут оказывать влияние на то, как действует Талзенна.
В частности, перечисленные ниже лекарственные препараты могут повышать риск побочных эффектов при применении с препаратом Талзенна:
· амиодарон, карведилол, дронедарон, пропафенон, хинидин, ранолазин и верапамил, которые обычно используются для лечения заболеваний сердца;
· антибиотики кларитромицин и эритромицин, которые используются для лечения бактериальных инфекций;
· итраконазол и кетоконазол, которые используются для лечения грибковых инфекций;
· кобицистат, дарунавир, индинавир, лопинавир, ритонавир, саквинавир, телапревир и типранавир, которые используются для лечения ВИЧ-инфекций/СПИДа;
· циклоспорин, который используется при трансплантации органов для профилактики отторжения;
· лапатиниб, который используется для лечения пациентов с определенными видами рака молочной железы;
· куркумин (содержится в корне куркумы), входящий в состав некоторых лекарственных препаратов (см. также раздел «Прием препарата Талзенна с пищей и напитками» ниже).
Следующие лекарственные препараты могут снижать эффективность препарата Талзенна:
· карбамазепин и фенитоин — противоэпилептические препараты, которые используются для лечения судорог или припадков;
· зверобой продырявленный (Hypericum perforatum) — растительное средство, которое используется для лечения легких форм депрессии и тревожности.
Прием препарата Талзенна с пищей и напитками
Следует избегать пищевых добавок, в состав которых входят куркумин, в то время, пока Вы принимаете препарат Талзенна, так как он может усиливать побочные эффекты Талзенны. Куркумин содержится в корне куркумы, и Вам не следует потреблять в пищу слишком большое количество этого корня, однако потребление специй с пищей, скорее всего, не вызовет эту проблему.
Талзенна может причинить вред ребенку в утробе матери. Если Вы беременны или кормите грудью, думаете, что возможно беременны, или планируете беременность, проконсультируйтесь перед приемом этого препарата с врачом или фармацевтом. Врач выполнит Вам тест на беременность до начала лечения препаратом Талзенна.
Если Вы беременны, Вам не следует принимать препарат Талзенна.
Вам следует избегать наступления беременности во время приема препарата Талзенна.
Обсудите с Вашим врачом методы контрацепции, если существует какая-либо возможность наступления беременности.
Контрацепция для мужчин и женщин
Женщинам, способным к деторождению, которые получают этот лекарственный препарат, следует применять высокоэффективные методы контрацепции во время терапии и на протяжении по меньшей мере 7 месяцев после приема последней дозы препарата Талзенна. Поскольку применение гормональной контрацепции при раке молочной железы не рекомендуется, Вам следует использовать два негормональных метода контрацепции.
Проконсультируйтесь со своим врачом о методах контрацепции, которые могут быть подходящими для Вас.
Мужчины с партнершами женского пола, которые беременны или способны к деторождению, должны использовать высокоэффективный метод контрацепции (даже после вазэктомии) во время лечения препаратом Талзенна и на протяжении по меньшей мере 4 месяцев после приема последней дозы препарата.
Грудное вскармливание
Вам не следует кормить грудью во время приема препарата Талзенна и по меньшей мере в течение 1 месяца после приема последней дозы препарата. Неизвестно, выделяется ли Талзенна в грудное молоко.
Репродуктивная функция
Талазопариб может нарушать репродуктивную функцию у мужчин.
Талзенна может оказывать небольшое влияние на способность управлять автотранспортными средствами и работать с механизмами. Если Вы ощущаете головокружение, слабость или усталость (они являются очень частыми побочными эффектами препарата Талзенна), Вам не следует управлять автотранспортными средствами или работать с механизмами.
Всегда принимайте препарат именно так, как порекомендовал врач или фармацевт. Если у Вас есть сомнения по поводу применения препарата, проконсультируйтесь с врачом или фармацевтом.
Рекомендуемая доза
Рекомендованная доза составляет капсулу 1 мг при приеме внутрь один раз в сутки.
Если во время приема препарата Талзенна у Вас возникают определенные побочные эффекты (см. раздел «Возможные нежелательные реакции»), Ваш врач может либо снизить дозу, либо прекратить лечение временно или окончательно. Дозу можно снизить до 0,75 мг (которая принимается в виде трех капсул по 0,25 мг) один раз в сутки, до 0,5 мг (которая принимается в виде двух капсул по 0,25 мг) один раз в сутки или до 0,25 мг (одна капсула 0,25 мг) один раз в сутки.
Проглатывайте капсулу целиком, запивая стаканом воды. Не разжевывайте и не разламывайте капсулы. Препарат Талзенна можно принимать независимо от приема пищи. Не открывайте капсулы. Следует избегать контакта с содержимым капсулы.
Если Вы приняли больше капсул препарата Талзенна, чем Ваша обычная доза, незамедлительно обратитесь к своему врачу или в ближайшую клинику. Вам может понадобиться срочное лечение.
Возьмите с собой упаковку и этот листок-вкладыш, чтобы врач знал, какой препарат Вы приняли.
Если Вы пропустили прием дозы препарата Талзенна
Если Вы пропустили дозу или у Вас была рвота, примите следующую дозу в обычное время. Не принимайте двойную дозу, чтобы восполнить прием капсул, которые Вы забыли принять, или если у Вас была рвота.
Если Вы прекращаете принимать препарат Талзенна
Не прекращайте прием препарата Талзенна, пока Вам не скажет об этом врач.
При наличии дополнительных вопросов о применении этого лекарственного препарата проконсультируйтесь с Вашим врачом, фармацевтом или медсестрой.
Данный препарат, как и все другие лекарственные средства, может вызывать побочные эффекты, хотя и не у всех пациентов.
Сразу же сообщите Вашему врачу, если Вы замечаете какие-либо из следующих симптомов, которые могут быть признаком серьезных заболеваний системы крови.
Очень частые (могут наблюдаться более чем у 1 из 10 человек)
· Нехватка воздуха, чувство сильной усталости, бледность кожи или частое сердцебиение — все это может быть признаками низкого числа эритроцитов (анемия).
· Инфекция, озноб или дрожь, повышение температуры тела или чувство жара — все это может быть признаками низкого числа лейкоцитов (нейтропения).
· Появление синяков или более длительное, чем обычно, кровотечение, если Вы поранитесь — все это может быть признаками низкого числа тромбоцитов (тромбоцитопения).
Сообщите вашему врачу, если у вас возникнут какие-либо другие побочные эффекты. Они могут включать следующие:
Очень часто (могут наблюдаться более чем у 1 из 10 человек)
• Снижение числа лейкоцитов, эритроцитов и тромбоцитов
• Снижение аппетита
• Головокружение
• Головная боль
• Тошнота
• Рвота
• Диарея
• Боль в животе
• Выпадение волос
Часто (могут наблюдаться у 1 из 10 человек)
• Изменения вкуса (дисгевзия)
• Нарушение пищеварения
• Воспаление полости рта
Сообщения о побочных эффектах
Если у Вас развились какие-либо побочные эффекты, обратитесь к врачу, фармацевту или медсестре. Это касается также возможных побочных эффектов, не перечисленных в этом листке-вкладыше. Сообщая о побочных эффектах, Вы можете помочь собрать больше информации о безопасности этого лекарственного препарата.
Хранить в недоступном для детей месте.
Этот лекарственный препарат не требует особых условий хранения.
Хранить при температуре не выше 25 °C
Не применяйте препарат после истечения срока годности (срока хранения), указанного на упаковке после слова «Годен до».
Датой истечения срока годности является последний день данного месяца.
Срок годности: 2 года.
Предупреждения о признаках непригодности препарата к применению (в соответствующих случаях)
Не используйте препарат, если заметили, что его упаковка повреждена или имеет признаки вскрытия.
Не выбрасывайте препарат в канализацию или с бытовым мусором. Уточните у работника аптеки, как следует утилизировать (уничтожать) препарат, который больше не потребуется. Эти меры позволят защитить окружающую среду.
Полное перечисление действующих веществ и вспомогательных веществ
— Действующим веществом является талазопариб. Препарат Талзенна выпускается в различных дозировках.
— Талзенна, капсулы 0,25 мг: каждая капсула содержит талазопариба тозилат в количестве 0,363 мг, эквивалентном 0,25 мг талазопариба.
— Талзенна, капсулы 1 мг: каждая капсула содержит талазопариба тозилат в количестве 1,453 мг, эквивалентном 1 мг талазопариба.
Другие компоненты:
— Содержимое капсулы: Целлюлоза микрокристаллическая силифицированная 50 (Prosolv® 50) и Целлюлоза микрокристаллическая силифицированная 90 (Prosolv® 90)
— Оболочка капсулы дозировкой 0,25 мг: гипромеллоза, краситель железа оксид желтый (Е172), титана диоксид (Е171)
— Оболочка капсулы дозировкой 1 мг: гипромеллоза, краситель железа оксид красный (Е172), краситель железа оксид желтый (Е172), титана диоксид (Е171)
Чернила для печати: шеллак (Е904), пропиленгликоль (Е1520), аммиака раствор концентрированный (Е527), краситель железа оксид черный (Е172) и калия гидроксид (Е525).
Талзенна дозировкой 0,25 мг выпускается в виде твердых непрозрачных капсул размером 4, с крышечкой белого с кремоватым оттенком цвета и корпусом белого цвета, с надписями черного цвета «Pfizer» — на крышечке и «TLZ 0.25» — на корпусе.
Талзенна дозировкой 1 мг выпускается в виде твердых непрозрачных капсул размером 4, с крышечкой светло-красного цвета и корпусом белого цвета, с надписями черного цвета «Pfizer» — на крышечке и «TLZ1» — на корпусе.
Талзенна дозировкой 0,25 мг и 1 мг выпускается по 30 капсул во флаконе из ПЭВП (полиэтилена высокой плотности) с полипропиленовой крышкой с термозапечатываемой мембраной.
1 флакон вместе с инструкцией по применению в картонной пачке.
Отпуск по рецепту.
Производитель
Экселла ГмбХ и Ко. КГ, Германия / Excella GmbH & Со. KG, Germany
Представительство “Pfizer Export B.V.” в Республике Беларусь: г. Минск, пр-т
Дзержинского 8-403, телефон 375-17-309-38-00, факс 375-17-309-38-19
Ингибиторы PARP — современная группа таргетных противоопухолевых препаратов, которые блокируют ферменты поли(АДФ-рибоза)-полимеразы (poly(ADP-ribose) polymerase, сокращенно PARP). Эти ферменты участвуют в репарации поврежденной ДНК. Под действием ингибиторов PARP этот процесс нарушается, в генах возникают критические повреждения, и опухолевые клетки погибают.
Фактически вещества, обладающие свойствами ингибиторов PARP, были открыты еще в 1971 году. Но они оказались не очень эффективными и вызвали слишком много побочных эффектов. Первый препарат, одобренный американским управлением FDA, вошел в клиническую практику только в 2014 году. В настоящее время ингибиторы PARP применяются для лечения рака яичников и маточных труб, молочной железы, простаты, поджелудочной железы и злокачественных опухолей брюшины. Кроме того, ведутся клинические испытания, чтобы проверить, насколько эти препараты эффективны при других онкологических заболеваниях.
- Какие функции выполняет белок PARP, и почему он важен для раковых клеток?
- Как работают ингибиторы PARP?
- При каких злокачественных опухолях применяют ингибиторы PARP?
- Представители группы
- Возможные побочные эффекты
- Взгляд в будущее: перспективы применения ингибиторов PARP в онкологии
Какие функции выполняет белок PARP, и почему он важен для раковых клеток?
PARP — это семейство белков-ферментов, которые выполняют в клетках различные функции. Они участвуют в регуляции преобразовании структуры хромосом, транскрипции (перенос генетической информации с ДНК на РНК, чтобы в дальнейшем синтезировался белок), репликации (удвоении ДНК), рекомбинации (обмен участками ДНК между хромосомами), репарации («починке») поврежденной ДНК. Именно последняя функция в этом списке сильнее всего интересует ученых, которые занимаются разработкой противоопухолевых препаратов.
Семейство PARP включает 18 белков. Лучше всего изучен PARP-1. Впервые упоминания о нем в научной литературе появились еще в 1963 году. В 1980 году ученые предположили, что, влияя на PARP-1, можно повысить эффективность некоторых химиопрепаратов.
Несмотря на то, что ДНК во время деления клеток в теле человека копируется с высокой точностью, периодически возникают ошибки, поломки. На этот случай природой предусмотрены специальные системы репарации поврежденного генетического материала. У человека работает шесть таких систем:
- Эксцизионная репарация оснований (base excision repair, BER) — устранение неправильных отдельных «букв» генетического кода или коротких участков ДНК, состоящих из нескольких букв.
- Эксцизионная репарация нуклеотидов (nucleotide Excision Repair, NER) — исправление более длинных поврежденных участков ДНК. Эта система «вырезает» неправильный участок в одной цепочке ДНК, а затем синтезирует его снова на матрице второй цепочки.
- Репарация однонитевых разрывов (single-strand break repair, SSBR) — «сшивание» ДНК, в одной из двух цепочек которой произошел разрыв.
- Репарация путем гомологичной рекомбинации (homologous recombination, HR) — метод починки ДНК, в которой разорвались обе цепочки. Все хромосомы в клетках человека представлены двумя копиями. Когда в одной из них происходит двухцепочечный разрыв, она использует свою «сестру» как шаблон, чтобы восстановить генетический материал.
- Негомологичное соединение концов (non-homologous end joining, NHEJ) — механизм, который просто соединяет концы ДНК при двухцепочечных разрывах, без гомологичной рекомбинации. Это менее точный метод репарации, после него могут теряться некоторые «буквы» генетического кода, возникать другие нарушения.
- Репарация ошибочно спаренных нуклеотидов (мисмэтч репарация, mismatch repair — MMR) — система, которая находит и устраняет несоответствия в генетическом коде.
Ферменты PARP-1 и PARP-2 играют важную роль в первом из перечисленных путей — эксцизионной репарации оснований. Белок PARP умеет обнаруживать разрыв одной цепочки ДНК, прикрепляется к ней в этом месте и заставляет работать другие ферменты репарации. Но этот процесс требует затрат энергии. Если PARP-1 активируется слишком сильно, например, при выраженных повреждениях ДНК и во время кислородного голодания, то энергетические ресурсы клетки истощаются, и она погибает.
Кроме того, существуют доказательства, что PARP принимают участие в восстановлении ДНК при разрыве обеих ее цепочек.
Как работают ингибиторы PARP?
При раке нередко возникают мутации в генах, которые кодируют белки, отвечающие за репарацию ДНК. Если в раковых клетках перестает работать хотя бы одна из шести систем репарации — эта особенность становится их ахиллесовой пятой. Стоит заблокировать еще один путь репарации с помощью лекарств — и повреждения ДНК достигают критического уровня, опухолевая клетка погибает. На этом и основано применение препаратов из группы ингибиторов PARP.
В 2005 году появились первые сообщения о том, что подавление функции PARP в клетках с мутациями в генах BRCA приводит к их гибели. Гены BRCA1 и BRCA2 кодируют белки, которые играют важную роль в пути репарации ДНК под номером 4 в нашем списке: репарации путем гомологичной рекомбинации. Если в этих генах возникают мутации (они бывают наследственными и приобретенными), то восстановление ДНК нарушается. С одной стороны, из-за этого в нормальной клетке накапливаются мутации, которые могут превратить ее в раковую. В то же время, если в раковых клетках заблокировать еще один путь репарации, то мутации накапливаются еще быстрее и становятся смертельными для клетки.
В настоящее время считается, что ингибиторы PARP работают против рака именно так — подавляют репарацию ДНК. В итоге одноцепочечные разрывы сохраняются, превращаются в двухцепочечные, а они тоже не устраняются, потому что не работает система гомологичной рекомбинации из-за мутации в гене BRCA.
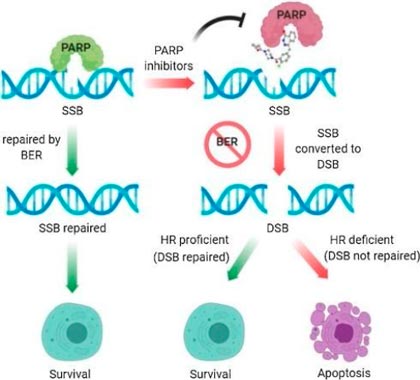
Известны два механизма, с помощью которых могут работать ингибиторы PARP:
- связываются с ферментом PARP и блокируют его активность;
- вмешиваются, когда фермент уже соединился с ДНК, и переводят его в неактивную форму.
При каких злокачественных опухолях применяют ингибиторы PARP?
С появлением ингибиторов PARP наступила новая эра в лечении рецидивирующего и распространенного рака яичников. В первую очередь речь идет о злокачественных опухолях с наследственными и соматическими (приобретенными) мутациями в генах BRCA, так как в них уже есть одна поломка механизмов репарации ДНК.
Также ингибиторы PARP были одобрены и успешно применяются при следующих злокачественных опухолях:
- рак маточных труб;
- первичный рак брюшины;
- рак молочной железы;
- рак предстательной железы.
Представители группы
Олапариб (Линпарза) стал первым препаратом из группы ингибиторов PARP, зарегистрированным в 2014 году американским управлением FDA и Европейским агентством по лекарственным средствам (EMA). Изначально препарат был одобрен для лечения рака яичников с мутациями в генах BRCA. Со временем список показаний к его применению расширился. На данный момент он включает:
- рецидив рака яичников, маточных труб и первичных опухолей брюшины, если до этого наблюдался полный или частичный ответ на лечение химиопрепаратами из группы препаратов платины;
- распространенный рак яичников с мутациями в генах BRCA — в качестве лечения первой линии или после химиотерапии, самостоятельно или в сочетании с другими препаратами (бевацизумаб);
- HER2-отрицательный метастатический рак молочной железы с мутациями в генах BRCA, после курса химиотерапии;
- метастатический рак поджелудочной железы с мутациями в генах BRCA, если до этого как минимум в течение 16 недель заболевание не прогрессировало на фоне химиотерапии;
- кастрационно-резистентный рак предстательной железы с мутациями в генах гомологичной рекомбинации.
Рукапариб (Рубрака) во многом похож на олапариб. FDA разрешило его применение при раке яичников в рамках процедуры ускоренного одобрения лекарственных препаратов в 2016 году. В настоящее время его применяют при распространенном и рецидивирующем эпителиальном раке яичников, маточных труб и первичных злокачественных опухолях брюшины, чувствительных к препаратам платины и несущих мутации в генах BRCA. В 2020 году рукапариб был одобрен для лечения кастрационно-резистентного метастатического рака простаты с мутациями в генах BRCA.
Нирапариб (Зеджула) стал третьим препаратом из группы ингибиторов PARP, одобренных FDA. Он применяется на территории США и Европейского союза с 2017 года. Показанием к применению является лечение распространенного и рецидивирующего рака яичников, маточных труб и первичных опухолей брюшины, чувствительных к препаратам платины.
Талазопариб (Талценна) отличается от всех предыдущих препаратов тем, что он пока еще не одобрен для применения при раке яичников. Его используют при HER2-отрицательном метастатическом и местно-распространенном раке молочной железы с наследственными мутациями в генах BRCA. Талазопариб был одобрен FDA в 2018 году, регулирующими органами Европы — в 2019 году.
Возможные побочные эффекты
Таргетная терапия в целом переносится пациентами лучше, чем классическая химиотерапия. Тем не менее, таргетные препараты, в том числе ингибиторы PARP, тоже могут вызывать некоторые побочные эффекты. Наиболее распространенные из них:
- побочные эффекты, вызванные воздействием на красный костный мозг и уменьшением количества клеток крови: анемия, повышенная уязвимость к инфекциям, повышенная кровоточивость;
- тошнота;
- чувство усталости;
- диарея;
- расстройства пищеварения;
- изменение чувства вкуса;
- головные боли, головокружения;
- нарушение функции печени и почек.
Эти побочные эффекты возникают не у всех пациентов, зачастую они выражены не сильно. Чтобы вовремя обнаружить нарушения и принять необходимые меры, во время курса лечения периодически проводят контрольные обследования, пациентам назначают анализы крови.
Другая проблема — устойчивость злокачественной опухоли к ингибиторам PARP. Это явление возникает при любой противоопухолевой терапии. Препараты в первую очередь уничтожают «слабые» раковые клетки, но «сильные» выживают, в них возникают новые мутации, и со временем лекарство перестает на них действовать. Вопросы устойчивости к ингибиторам PARP в настоящее время активно изучаются. Известно, что опухолевые клетки приспосабливаются выживать в присутствии этих препаратов многими способами. Выделяют два основных механизма (хотя, есть и другие, менее изученные):
- восстановление репарации путем гомологичной рекомбинации, которая была «поломана» в результате мутаций в генах BRCA;
- стабилизация репликационной вилки — участка, в котором две цепочки ДНК рассоединяются, когда происходит ее удвоение.
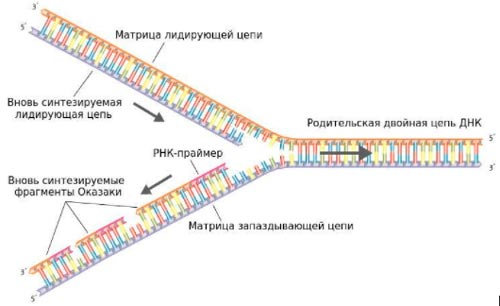
Так выглядит репликационная вилка. Справа находится исходная часть ДНК. Слева она разделилась на две цепочки, и на каждой из них синтезируется новая цепочка — из них образуются две новые молекулы ДНК. Стабилизации вилки репликации является одним из механизмов устойчивости раковых клеток к ингибиторам PARP.
При запущенном раке лечение ингибиторами PARP проводят до тех пор, пока не разовьется устойчивость, либо пока они не начнут вызывать серьезные побочные эффекты. В настоящее время ученые продолжают изучать механизмы развития резистентности рака к противоопухолевым препаратам, чтобы научиться профилактировать ее и повысить эффективность лечения.
Взгляд в будущее: перспективы применения ингибиторов PARP в онкологии
В настоящее время проводятся клинические исследования, в которых изучают эффективность ингибиторов PARP при раке легкого, поджелудочной железы, головы и шеи, желудка и пищевода, шейки матки, почек, мочевого пузыря, некоторых опухолях головного мозга. Кроме того, ведутся разработки новых препаратов из этой группы, некоторые из них уже завершили тестирование на животных и перешли на стадию клинических испытаний. Изучается эффективность и безопасность применения ингибиторов PARP в сочетании с химиопрепаратами, иммунопрепаратами.
Врачи федеральной сети клиник экспертной онкологии «Евроонко» постоянно отслеживают ход клинических испытаний. Мы оперативно узнаём о регистрации в России новых противоопухолевых препаратов, расширении показаний к применению уже зарегистрированных. В наших клиниках пациенты могут получить лечение всеми оригинальными противоопухолевыми препаратами новейших поколений в соответствии с актуальными версиями международных протоколов, рекомендациями авторитетных онкологических сообществ.
Список литературы:
- Feiyue Zheng, Yi Zhang, Shuang Chenc, Xiang Weng, Yuefeng Rao, Hongmei Fang. Mechanism and current progress of Poly ADP-ribose polymerase (PARP) inhibitors in the treatment of ovarian cancer. Biomedicine & Pharmacotherapy, Volume 123, March 2020, 109661.
- Alice Chen. PARP inhibitors: its role in treatment of cancer. Chin J Cancer. 2011 Jul; 30(7): 463–471.
- Julio C. Morales, Longshan Li, Farjana J. Fattah, Ying Dong, Erik A. Bey, Malina Patel, Jinming Gao, and David A. Boothman. Review of Poly (ADP-ribose) Polymerase (PARP) Mechanisms of Action and Rationale for Targeting in Cancer and Other Diseases.
- Esha Sachdev, Roya Tabatabai, Varun Roy, B J Rimel, Monica M Mita. PARP Inhibition in Cancer: An Update on Clinical Development. Target Oncol. 2019 Dec;14(6):657-679. doi: 10.1007/s11523-019-00680-2.
- Ming Yi, Bing Dong, Shuang Qin, Qian Chu, Kongming Wu & Suxia Luo. Advances and perspectives of PARP inhibitors.
- Румянцев А. А. Эволюция ингибиторов PARP: на какой ступени мы стоим? RosOncoWeb, новости онкологии.
- PARP inhibitors. Cancer Research UK.
- Guo-Min Li. Mechanisms and functions of DNA mismatch repair. Cell Res 18, 85–98 (2008). https://doi.org/10.1038/cr.2007.115
- olaparib (Rx). Medscape.
- ИНСТРУКЦИЯ по медицинскому применению лекарственного препарата Линпарза. АстраЗенека.
- Препарат олапариб зарегистрирован в США для лечения метастатического кастрационно-резистентного рака предстательной железы с мутацией в генах гомологичной рекомбинации. AstraZeneca.
- ЛИНПАРЗА (ОЛАПАРИБ) ОДОБРЕНА ДЛЯ ЛЕЧЕНИЯ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С МУТАЦИЕЙ BRCA1/2. Качественная клиническая практика.
- rucaparib (Rx). Medscape.
- Rucaparib. U. S. Food & Drug Administration.
- With Two FDA Approvals, Prostate Cancer Treatment Enters the PARP Era. National Cancer Institute.
- niraparib (Rx). Medscape.
- FDA approves niraparib for first-line maintenance of advanced ovarian cancer. U. S. Food & Drug Administration.
- FDA approves talazoparib for gBRCAm HER2-negative locally advanced or metastatic breast cancer. U. S. Food & Drug Administration.
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»;
ФГБОУ ВО «Российская академия народного хозяйства и государственной службы при Президенте Российской Федерации»;
ООО «Хелс энд Маркет Аксесс Консалтинг»
- Scopus AuthorID:
57197865322 - ResearcherID:
O-5364-2018 - ORCID:
0000-0002-2686-1330
Фролов М.Ю.
ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России;
ГБУ «Волгоградский медицинский научный центр»
- Scopus AuthorID:
35193977700 - ResearcherID:
F-8355-2015 - ORCID:
0000-0002-0389-560X

Фармакоэкономическое исследование препарата талазопариб для лечения взрослых больных раком молочной железы по сравнению с препаратом олапариб
Авторы:
Авксентьев Н.А., Макаров А.С., Фролов М.Ю.
Как цитировать:
Авксентьев Н.А., Макаров А.С., Фролов М.Ю. Фармакоэкономическое исследование препарата талазопариб для лечения взрослых больных раком молочной железы по сравнению с препаратом олапариб. Медицинские технологии. Оценка и выбор.
2023;(1):89‑98.
Avxentyev NA, Makarov AS, Frolov MYu. Cost-effectiveness analysis of talazoparib and olaparib for breast cancer in adults. Medical Technologies. Assessment and Choice. 2023;(1):89‑98. (In Russ.)
https://doi.org/10.17116/medtech20234501189

Закрыть метаданные
Рекомендуем статьи по данной теме:
ЦЕЛЬ ИССЛЕДОВАНИЯ
Провести комплексный фармакоэкономический сравнительный анализ применения препаратов талазопариб и олапариб для лечения взрослых больных раком молочной железы (РМЖ).
МАТЕРИАЛ И МЕТОДЫ
Ингибиторы PARP талазопариб и олапариб продемонстрировали статистически значимое преимущество в эффективности по критерию «выживаемость без прогрессирования» (ВБП) перед химиотерапией у взрослых пациентов с местнораспространенным или метастатическим HER2-негативным РМЖ с герминальными мутациями в генах BRCA1/2 в рамках регистрационных клинических исследований EMBRACA и OlympiAD. Прямых сравнительных исследований между препаратами талазопариб и олапариб не проводилось. По результатам нашего непрямого сравнения эффективности талазопариба и олапариба у рассматриваемой популяции пациентов с HER2- BRCA+ РМЖ по критерию эффективности ВБП статистически значимые различия отсутствуют. На основании данных клинического исследования EMBRACA построена математическая модель прогрессии РМЖ при использовании рассматриваемых терапевтических альтернатив. Модель применена для расчета стоимости терапии талазопарибом и олапарибом с учетом выбытия пациентов из терапии по мере прогрессии заболевания. На основании рассчитанных затрат проведен анализ влияния на бюджет за трехлетний период при использовании талазопариба вместо олапариба. Расчет численности целевой популяции основан на данных литературы и статистических данных.
РЕЗУЛЬТАТЫ
Прямые дисконтированные медицинские расходы за 4 года терапии талазопарибом составляют 3 270 777 руб., что на 20,1% ниже, чем при терапии олапарибом. Если к терапии с использованием вариантов сравнения будут ежегодно приступать по 1350 больных, прямые дисконтированные медицинские расходы бюджетной системы Российской Федерации при использовании олапариба составят 13 705 млн руб. за 3 года, а в случае применения талазопариба — 10 950 млн руб. за 3 года, т.е. на 20,1% ниже.
ЗАКЛЮЧЕНИЕ
Талазопариб по сравнению с олапарибом представляет собой ресурсосберегающий метод лечения взрослых пациентов с местнораспространенным или метастатическим HER2-негативным РМЖ с герминальными мутациями в генах BRCA.
Авторы:
Авксентьев Н.А.
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»;
ФГБОУ ВО «Российская академия народного хозяйства и государственной службы при Президенте Российской Федерации»;
ООО «Хелс энд Маркет Аксесс Консалтинг»
- Scopus AuthorID:
57197865322 - ResearcherID:
O-5364-2018 - ORCID:
0000-0002-2686-1330
Фролов М.Ю.
ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России;
ГБУ «Волгоградский медицинский научный центр»
- Scopus AuthorID:
35193977700 - ResearcherID:
F-8355-2015 - ORCID:
0000-0002-0389-560X
Дата поступления:
08.12.2022
Дата принятия в печать:
20.12.2022
Список литературы:
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2021 году. М.: МНИОИ им. П.А. Герцена. Филиал ФГБУ «НМИРЦ» Минздрава России; 2022.
- Инструкция по медицинскому применению лекарственного препарата для медицинского применения Талценна (талазопариб). Государственный реестр лекарственных средств Министерства здравоохранения Российской Федерации. Ссылка активна на 12.12.22. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=de3cb10b-1d37-48f9-b0bb-3db7c24e224e&t=
- Litton JK, Rugo HS, Ettl J, Hurvitz SA, Gonçalves A, Lee KH, et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. New England Journal of Medicine. 2018;379(8):753-763. https://doi.org/10.1056/NEJMoa1802905
- Клинические рекомендации. Рак молочной железы. Ссылка активна на 12.12.2022. https://cr.rosminzdrav.ru/#!/schema/236
- Robson M, Im SA, Senkus E, Xu B, Domchek SM, Masuda N, et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. New England Journal of Medicine. 2017;377(6):523-533. https://doi.org/10.1056/NEJMoa1706450
- Инструкция по медицинскому применению лекарственного препарата для медицинского применения Линпарза (олапариб). Государственный реестр лекарственных средств Министерства здравоохранения Российской Федерации. Ссылка активна на 12.12.22. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=2f88d387-f99a-4296-9357-e9cd95f57b18&t=
- Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2019 году. М.: МНИОИ им. П.А. Герцена. Филиал ФГБУ «НМИРЦ» Минздрава России; 2020.
- Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2020 году. М.: МНИОИ им. П.А. Герцена. Филиал ФГБУ «НМИРЦ» Минздрава России; 2021.
- Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2021 году. М.: МНИОИ им. П.А. Герцена. Филиал ФГБУ «НМИРЦ» Минздрава России; 2022.
- O’Shaughnessy J. Extending survival with chemotherapy in metastatic breast cancer. Oncologist. 2005;10(suppl 3):20-29. https://doi.org/10.1634/theoncologist.10-90003-20
- Mosher CE, Johnson C, Dickler M, Norton L, Massie MJ, DuHamel K. Living with metastatic breast cancer: A qualitative analysis of physical, psychological, and social sequelae. Breast Journal. 2013;19(3):285-292. https://doi.org/10.1111/tbj.12107
- Onitilo AA, Engel JM, Greenlee RT, Mukesh BN. Breast cancer subtypes based on ER/PR and Her2 expression: comparison of clinicopathologic features and survival. Clinical Medicine and Research. 2009;7(1-2):4-13. https://doi.org/10.3121/cmr.2009.825
- Tung N, Lin NU, Kidd J, Allen BA, Singh N, Wenstrup RJ, et al. Frequency of germline mutations in 25 cancer susceptibility genes in a sequential series of patients with breast cancer. Journal of Clinical Oncology. 2016;34(13):1460. https://doi.org/10.1200/JCO.2015.65.0747
- Петров В.И. Фармакологистика — новая парадигма в клинической фармакологии. Вестник Волгоградского государственного медицинского университета. 2022;19(2):3-6. https://doi.org/10.19163/1994-9480-2022-19-2-3-6
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями
использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании
файлов cookie, нажмите здесь.
