Фармакологическое действие
Противоопухолевое средство, ингибитор рецепторов эпидермального фактора роста человека 2 типа (HER2). Представляет собой моноклональное антитело, связанное с лекарственным средством, предназначенным для уничтожения опухолевых клеток. Моноклональное антитело трастузумаб доставляет лекарственное средство дерукстекан к опухолевым клеткам, на поверхности которых имеются рецепторы HER2. Как только трастузумаб дерукстекан поступает в клетку, лекарственное средство дерукстекан становится активным и оказывает противоопухолевое действие.
Показания активного вещества
ТРАСТУЗУМАБ ДЕРУКСТЕКАН
HER2-положительный рак молочной железы с метастазами, или при отсутствии возможности хирургического вмешательства у пациентов старше 18 лет, ранее получивших не менее двух режимов лечения, специализированного в отношении HER2- положительного рака молочной железы.
Режим дозирования
Вводят в/в в виде инфузии в медицинском учреждении.
Рекомендуемая доза составляет 5.4 мг/кг 1 раз в 3 недели (цикл лечения).
Перед каждым введением лечащий врач может назначить антиэметические препараты.
В зависимости от развития побочных реакций лечащий врач может снизить дозу, а также временно или полностью прекратить лечение.
Побочное действие
Со стороны дыхательной системы: очень часто — кашель, одышка, лихорадка, возникновение новых или усиление имеющихся проблем с дыханием (интерстициальная болезнь легких), инфекции верхних дыхательных путей, носовое кровотечение.
Со стороны пищеварительной системы: очень часто — язвенные поражения слизистой оболочки полости рта, боли в животе, тошнота, рвота, запор, снижение аппетита, диарея, диспепсия, стоматит, повышение активности печеночных трансаминаз.
Со стороны мочевыделительной системы: очень часто — боли при мочеиспускании.
Со стороны крови и лимфатической системы: очень часто — нейтропения (инфекционные заболевания, вызванные нейтропенией), анемия, лейкопения, тромбоцитопения, лимфоцитопения; часто — фебрильная нейтропения.
Со стороны сердечно-сосудистой системы: очень часто — аритмия, головокружение или потеря сознания (вследствие снижения фракции выброса левого желудочка, признаки могут возникать вновь, или возможно усиление ранее имевшихся).
Со стороны обмена веществ: очень часто — резкое увеличение массы тела, гипокалиемия.
Со стороны кожных покровов: очень часто — алопеция, кожная сыпь.
Со стороны нервной системы: очень часто — головная боль, головокружение.
Со стороны органа зрения: очень часто — ощущение сухости в глазах.
Общие реакции: очень часто — озноб, лихорадка, усталость, отеки лодыжек или ног; часто — жар, озноб, приливы, зуд или сыпь (реакции, связанные с инфузией данного средства.
Противопоказания к применению
Повышенная чувствительность к трастузумабу дерукстекану.
С осторожностью
Заболевания дыхательной системы, сердечно-сосудистые заболевания, болезни крови.
Применение при беременности и кормлении грудью
Не рекомендуется применять при беременности, поскольку данное лекарственное средство может оказывать повреждающее действие на плод.
Неизвестно, выделяется ли трастузумаб дерукстекан с грудным молоком у человека. При необходимости применения в период лактации следует прекратить грудное вскармливание.
В период лечения следует использовать надежные методы контрацепции.
Пациентам-мужчинам следует избегать зачатия ребенка во время лечения и в течение 4 месяцев после завершения лечения; рекомендуется поместить сперму на хранение до начала лечения, поскольку данное лекарственное средство может снижать фертильность.
Применение при нарушениях функции печени
С осторожностью применять у пациентов с нарушением функции печени.
Применение при нарушениях функции почек
С осторожностью применять у пациентов с нарушением функции почек.
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Применение у пожилых пациентов
С осторожностью применять у пациентов пожилого возраста.
Особые указания
Перед началом и во время проведения лечения следует проводить общий клинический и биохимический анализы крови для контроля состояния кроветворения, печени и почек, контролировать гемодинамические параметры, функцию дыхания.
Использование в педиатрии
Не применяется у детей и подростков в возрасте до 18 лет, т.к. безопасность и эффективность данного средства у этой категории пациентов не установлены.
Влияние на способность к управлению транспортными средствами и механизмами
Трастузумаб дерукстекан способен оказывать слабое влияние на способность к управлению транспортными средствами и работе с механизмами. Пациенты должны соблюдать осторожность во время вождения автотранспорта и управления механизмами в тех случаях, когда у пациентов наблюдаются утомляемость, головная боль или головокружение в период лечения.
Лекарственное взаимодействие
Циклофосфамид, доксорубицин, эпирубицин повышают риск развития кардиотоксического действия.
Энхерту — инструкция по применению
Синонимы, аналоги
Статьи
Листок-вкладыш – информация для пациента
ЛП-№(001242)-(РГ-RU)
ЭНХЕРТУ, 100 мг, лиофилизат для приготовления концентрата для приготовления раствора для инфузий
Действующее вещество: трастузумаб дерукстекан
▼ Лекарственный препарат подлежит дополнительному мониторингу, который способствует быстрому выявлению новых сведений о безопасности. Вы можете помочь, сообщая информацию о любых нежелательных реакциях, которые возникли в период применения лекарственного препарата (в том числе, и о случаях его неэффективности). Способ сообщения о нежелательных реакциях описан в разделе 4 листка-вкладыша.
Перед применением препарата полностью прочитайте листок-вкладыш, поскольку в нём содержатся важные для Вас сведения.
- Сохраните листок-вкладыш. Возможно, Вам потребуется прочитать его еще раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к лечащему врачу.
- Если у Вас возникли какие-либо нежелательные реакции, обратитесь к лечащему врачу. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе, на не перечисленные в разделе 4 листка-вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат ЭНХЕРТУ, и для чего его применяют.
- О чем следует знать перед применением препарата ЭНХЕРТУ.
- Применение препарата ЭНХЕРТУ.
- Возможные нежелательные реакции.
- Хранение препарата ЭНХЕРТУ.
- Содержимое упаковки и прочие сведения.
1. Что из себя представляет препарат ЭНХЕРТУ, и для чего его применяют
Препарат ЭНХЕРТУ содержит действующее вещество трастузумаб дерукстекан, которое относится к группе препаратов под названием «противоопухолевые средства; моноклональные антитела и конъюгаты антител с лекарственными средствами; ингибиторы рецепторов HER2 (рецепторов эпидермального фактора роста человека 2 типа)».
Показания к применению
Препарат ЭНХЕРТУ применяется у взрослых пациентов в возрасте от 18 лет с HER2-положительным раком молочной железы, который распространился в другие части тела, или который не может быть удален с помощью хирургического вмешательства, и ранее получивших не менее двух режимов лечения, специализированного в отношении HER2-положительного рака молочной железы.
Способ действия препарата
Препарат ЭНХЕРТУ (трастузумаб дерукстекан) представляет собой моноклональное антитело, связанное с лекарственным средством, предназначенным для уничтожения опухолевых клеток. Моноклональное антитело трастузумаб доставляет лекарственное средство дерукстекан к опухолевым клеткам, на поверхности которых имеются рецепторы эпидермального фактора роста человека 2 типа (известны как НЕR2-рецепторы). Как только препарат ЭНХЕРТУ попадает в клетку, лекарственное средство дерукстекан становится активным и уничтожает опухолевые клетки.
2. О чем следует знать перед применением препарата ЭНХЕРТУ
Противопоказания
Не применяйте препарат ЭНХЕРТУ:
если у Вас аллергия на трастузумаб дерукстекан и/или любые другие компоненты препарата (перечисленные в разделе 6 листка-вкладыша).
Особые указания и меры предосторожности
Перед применением препарата ЭНХЕРТУ проконсультируйтесь с лечащим врачом. Перед применением препарата ЭНХЕРТУ сообщите своему лечащему врачу, если у Вас имеются или имелись какие-либо проблемы с лёгкими, с сердцем или с кровью (низкое содержание форменных элементов крови).
Перед применением препарата ЭНХЕРТУ проинформируйте лечащего врача или медсестру, если у Вас:
- наблюдаются кашель, одышка, лихорадка, возникают новые или усиливаются имеющиеся проблемы с дыханием. Это могут быть симптомы серьёзного и потенциально смертельного заболевания лёгких (интерстициальная болезнь лёгких (ИБЛ));
- наблюдаются озноб, лихорадка, язвы во рту, боль в животе или боль при мочеиспускании. Это могут быть симптомы инфекции, вызванной низким количеством лейкоцитов в крови, называемых нейтрофилами (нейтропения);
- наблюдаются впервые возникшие или усиливающиеся одышка, кашель, утомляемость, отёк лодыжек или ног, нарушение сердечного ритма, резкое увеличение массы тела, головокружение или потеря сознания. Это могут быть симптомы, указывающие на снижение способности Вашего сердца перекачивать кровь (снижение фракции выброса левого желудочка (ФВЛЖ)).
Дети и подростки
Препарат ЭНХЕРТУ не применяется у детей в возрасте от 0 до 18 лет вследствие риска неэффективности и вероятной небезопасности (безопасность и эффективность применения препарата ЭНХЕРТУ у детей в возрасте до 18 лет не установлены).
Другие препараты и препарат ЭНХЕРТУ
Сообщите лечащему врачу о том, что Вы применяете, недавно применяли или можете начать применять какие-либо другие препараты.
Контрацепция
Используйте эффективную контрацепцию (противозачаточные средства), чтобы предотвратить беременность во время лечения препаратом ЭНХЕРТУ.
Женщины, принимающие препарат ЭНХЕРТУ, должны продолжать использовать противозачаточные средства, как минимум, в течение 7 месяцев после получения последней дозы препарата ЭНХЕРТУ.
Мужчинам, принимающим препарат ЭНХЕРТУ, партнёрши которых могут забеременеть, следует использовать эффективные средства контрацепции:
- во время лечения и
- не менее 4 месяцев после получения последней дозы препарата ЭНХЕРТУ.
Проконсультируйтесь с лечащим врачом по вопросу наиболее подходящих для Вас средств контрацепции. С лечащим врачом необходимо также проконсультироваться перед тем, как Вы решите прекратить приём противозачаточных средств.
Беременность
Если Вы беременны, думаете, что забеременели, или планируете беременность, перед началом применения препарата проконсультируйтесь с лечащим врачом.
Препарат ЭНХЕРТУ не рекомендуется применять во время беременности, поскольку данное лекарственное средство может нанести вред еще не родившемуся ребенку.
Грудное вскармливание
Если Вы кормите грудью, перед началом применения препарата проконсультируйтесь с лечащим врачом. Вы не должны кормить грудью во время лечения препаратом ЭНХЕРТУ и, как минимум, в течение 7 месяцев после получения последней дозы. Это связано с отсутствием данных о способности препарата ЭНХЕРТУ проникать в грудное молоко.
Фертильность
Если Вы мужчина, который применяет препарат ЭНХЕРТУ, Вам следует избегать зачатия ребенка во время лечения и в течение 4 месяцев после завершения лечения и рекомендуется поместить сперму на хранение до начала лечения, поскольку данное лекарственное средство может снизить Вашу фертильность (способность к зачатию). Поэтому перед началом лечения обсудите это с лечащим врачом.
Управление транспортными средствами и работа с механизмами
Препарат ЭНХЕРТУ способен оказывать слабое влияние на способность к управлению транспортными средствами и работе с механизмами. Рекомендуется проконсультироваться с лечащим врачом и соблюдать осторожность во время вождения автотранспорта и управления механизмами в тех случаях, когда Вы испытываете утомляемость, головную боль или головокружение во время лечения препаратом ЭНХЕРТУ.
3. Применение препарата ЭНХЕРТУ
Всегда применяйте препарат в полном соответствии с рекомендациями лечащего врача. При появлении сомнений посоветуйтесь с лечащим врачом. Препарат ЭНХЕРТУ будет вводиться Вам в лечебном учреждении.
Рекомендуемая доза препарата ЭНХЕРТУ составляет 5,4 мг на каждый килограмм массы Вашего тела 1 раз в 3 недели (цикл лечения).
- Лечащий врач или медсестра введут Вам препарат ЭНХЕРТУ посредством инфузии (с помощью капельницы) в вену.
- Ваша первая инфузия продлится в течение 90 минут. Если Вы хорошо перенесёте первую инфузию, то следующие инфузии будут проводиться в течение 30 минут.
- Количество циклов лечения определит лечащий врач.
- Перед каждым введением препарата ЭНХЕРТУ лечащий врач может назначить Вам лекарственные препараты, которые помогают предотвратить тошноту и рвоту.
- Если у Вас появятся симптомы, связанные с инфузией, лечащий врач или медсестра могут замедлить инфузию, прервать или прекратить лечение.
- Перед началом и во время лечения препаратом ЭНХЕРТУ лечащий врач проведёт исследования, которые могут включать:
- анализ крови, чтобы проверить Ваши клетки крови, печень и почки;
- анализы для проверки состояния сердца и лёгких.
- Лечащий врач может снизить дозу, а также временно или полностью прекратить лечение в зависимости от появления у Вас нежелательных реакций.
Если Вы забыли применить препарат ЭНХЕРТУ
Немедленно обратитесь к лечащему врачу, чтобы определить время применения препарата.
Очень важно следовать графику введения препарата 1 раз в 3 недели и не пропускать запланированные введения препарата.
Если Вы прекратили применение препарата ЭНХЕРТУ
Не прекращайте лечение препаратом ЭНХЕРТУ, не посоветовавшись с лечащим врачом. При наличии вопросов по применению препарата обратитесь к лечащему врачу.
4. Возможные нежелательные реакции
Подобно всем лекарственным препаратам, препарат может вызывать нежелательные реакции, однако они возникают не у всех. Сообщайте лечащему врачу о любых возникших у Вас нежелательных реакциях, в том числе о тех, которые не указаны в данной инструкции по медицинскому применению препарата.
Серьёзные нежелательные реакции
Незамедлительно обратитесь к лечащему врачу, если Вы заметили у себя любой из перечисленных ниже симптомов. Они могут быть признаками серьёзного, возможно, опасного для жизни заболевания. Незамедлительное медикаментозное лечение может помочь предотвратить обострение этих проблем.
Очень часто (могут возникать у более чем 1 человека из 10):
- кашель, одышка, лихорадка, возникновение новых или усиление имеющихся проблем с дыханием (заболевание лёгких, называемое интерстициальной болезнью лёгких);
- озноб, лихорадка, язвы во рту, боль в животе или боль при мочеиспускании (инфекционные заболевания, вызванные пониженным количеством нейтрофилов (нейтропения));
- одышка, кашель, усталость, отёк лодыжек или ног, нерегулярное сердцебиение, резкое увеличение массы тела, головокружение или потеря сознания (проблема с сердцем, называемая снижением фракции выброса левого желудочка, признаки могут возникать вновь, или возможно усиление ранее имевшихся).
Прочие нежелательные реакции
При возникновении у Вас любой из перечисленных ниже нежелательных реакций сразу же сообщите о них врачу или медсестре: Очень часто (могут возникать у более чем 1 человека из 10):
- тошнота;
- ощущение усталости (утомляемость);
- рвота;
- выпадение волос (алопеция);
- запор;
- снижение аппетита;
- диарея;
- боль в животе;
- расстройство пищеварения (диспепсия);
- сыпь на коже;
- кашель;
- головная боль;
- инфекции носа и горла (инфекции верхних дыхательных путей);
- волдыри во рту или вокруг него (стоматит);
- затруднённое дыхание (одышка);
- носовое кровотечение;
- ощущение сухости в глазах;
- головокружение;
- анализы крови, показывающие низкий уровень калия в крови (гипокалиемия),
- анализы крови, показывающие пониженное количество эритроцитов (анемия), лейкоцитов (лейкопения), тромбоцитов (тромбоцитопения), лимфоцитов (лимфопения);
- анализы крови, показывающие повышенный уровень ферментов печени, аспартатаминотрасферазы или аланинаминотрасферазы.
Часто (могут возникать не более чему 1 человека из 10):
- жар, озноб, приливы, зуд или сыпь (реакции, связанные с инфузией препарата);
- лихорадка вместе с уменьшением количества лейкоцитов, называемых нейтрофилами (фебрильная нейтропения).
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую (см. ниже). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
109012, г. Москва, Славянская площадь, д. 4, стр. 1
Сайт: roszdravnadzor.gov.ru
5. Хранение препарата ЭНХЕРТУ
Препарат ЭНХЕРТУ будет храниться медицинскими работниками в лечебном учреждении, где Вы проходите лечение.
Храните препарат в недоступном для ребёнка месте так, чтобы ребёнок не мог увидеть его.
Не применяйте препарат после истечения срока годности (срока хранения), указанного на картонной пачке, флаконе после «Годен до». Датой истечения срока годности является последний день указанного месяца.
Храните препарат при температуре от 2 до 8 °С.
Концентрат, полученный после растворения лиофилизата, следует использовать немедленно. В случае отсутствия возможности немедленного использования концентрат можно хранить в защищённом от света месте в холодильнике при температуре от 2 до 8 °С не более 24 часов с момента приготовления (растворения лиофилизата).
Приготовленный раствор следует использовать немедленно. Если лекарственный препарат не введен немедленно, хранение готового к применению лекарственного препарата и обеспечение условий хранения является обязанностью сотрудников лечебного учреждения, где проводится лечение. Приготовленный раствор может храниться в защищённом от света месте при комнатной температуре не более 4 часов или в холодильнике при температуре от 2 до 8 °С не более 24 часов. Данные сроки хранения указаны с момента приготовления концентрата.
Не следует использовать раствор с видимыми частицами, либо мутный или окрашенный в другой цвет.
Не выбрасывайте (не выливайте) препарат в канализацию, водопровод. Уточните у работника аптеки, как следует утилизировать (уничтожать) препарат, который больше не потребуется. Эти меры позволят защитить окружающую среду.
6. Содержимое упаковки и прочие сведения
Препарат ЭНХЕРТУ содержит
Действующим веществом является трастузумаб дерукстекан.
Каждый флакон содержит 100 мг трастузумаба дерукстекана.
Каждый мл содержит 20 мг трастузумаба дерукстекана.
Прочими ингредиентами (вспомогательными веществами) являются L-гистидин, L-гистидина гидрохлорида моногидрат, сахароза, полисорбат 80.
Внешний вид препарата ЭНХЕРТУ и содержимое упаковки
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий.
От белого до желтовато-белого цвета спрессованная масса.
По 100 мг во флаконы (тип I) из темного стекла, закрытые резиновой пробкой из фторбутила, обжатой сверху алюминиевым колпачком с полипропиленовой крышкой («флип-офф»). По 1 флакону с инструкцией по применению препарата (листком-вкладышем) в картонной пачке с контролем первого вскрытия.
Держатель регистрационного удостоверения
АстраЗенека ЮК Лимитед, 1 Френсис Крик Авеню, Кембридж Биомедикал Кампус, Кембридж, Великобритания СВ2 0AA
AstraZeneca UK Limited, 1 Francis Crick Avenue, Cambridge Biomedical Campus, Cambridge, United Kingdom CB2 0AA
Производитель
Даиичи Санкио Юроуп ГмбХ
Луитпольдштрассе 1, 85276 Пфаффенхофен, Германия
Daiichi Sankyo Europe GmbH
Luitpoldstrasse 1, 85276 Pfaffenhofen, Germany
За любой информацией о препарате, а также в случаях возникновения претензий следует обращаться к местному представителю держателя регистрационного удостоверения:
Представительство АстраЗенека ЮК Лимитед, Великобритания, в г. Москве и ООО АстраЗенека Фармасьютикалз
123100, г. Москва, 1-й Красногвардейский проезд, д. 21, стр. 1, этаж 30, комнаты 13 и 14
Листок-вкладыш пересмотрен
Препарат «зарегистрирован условно». Это значит, что появятся новые сведения о препарате.
Представленные данные о лекарственном препарате будут проверяться и дополняться новыми сведениями ежегодно, и по мере необходимости листок-вкладыш будет обновляться.
Прочие источники информации
Подробные сведения о данном препарате содержатся на веб-сайте Союза: http ://еес.eaeunion.org/
Следующие сведения предназначены исключительно для медицинских работников
Во избежание ошибок, связанных с назначением лекарственных препаратов, важно проверять этикетки на флаконах, чтобы убедиться, что приготавливаемый и вводимый лекарственный препарат – именно ЭНХЕРТУ (трастузумаб дерукстекан), а не трастузумаб или трастузумаб эмтанзин
Следует использовать соответствующие процедуры для приготовления химиотерапевтических лекарственных средств, а также соблюдать соответствующие асептические условия при следующих процедурах растворения и разведения.
Приготовление концентрата
- Растворение лиофилизата необходимо выполнять непосредственно перед разведением.
- Для получения полной дозы может потребоваться более одного флакона. Следует рассчитывать дозу (мг), общий объём необходимого концентрата препарата ЭНХЕРТУ и необходимое количество флаконов препарата ЭНХЕРТУ.
- Для растворения содержимого каждого флакона дозировкой 100 мг медленно вводят 5 мл стерильной воды для инъекций в каждый флакон стерильным шприцем до получения конечной концентрации 20 мг/мл.
- Осторожно перемешивают флакон до полного растворения. Флакон не встряхивать!
- Проверяют концентрат на наличие твёрдых частиц и обесцвечивания. Раствор должен быть прозрачным, от бесцветного до желтоватого цвета. Не следует использовать раствор с видимыми частицами, либо мутный или окрашенный в другой цвет.
- В случае отсутствия возможности немедленного использования концентрат препарата ЭНХЕРТУ можно хранить в защищённом от света месте в холодильнике при температуре от 2 до 8 °С не более 24 часов с момента растворения. Не замораживать!
- Данный лекарственный препарат не содержит консервантов. Неиспользованный концентрат препарата ЭНХЕРТУ следует утилизировать через 24 часа хранения в холодильнике.
Формула расчета для определения объема концентрата (мл) препарата ЭНХЕРТУ, подлежащего дальнейшему разведению:
Объем концентрата препарата ЭНХЕРТУ (мл) 
Приготовление раствора для инфузий
- Рассчитанный объем концентрата препарата ЭНХЕРТУ разводят в пакете для инфузий, содержащем 100 мл 5% раствора декстрозы. Нельзя использовать раствор натрия хлорида. Рекомендуемый материал пакета для инфузий: поливинилхлорид или полиолефин (сополимер этилена и полипропилена).
- Осторожно переворачивают пакет для инфузий с целью тщательного перемешивания раствора. Пакет не встряхивать!
- Накрывают пакет для инфузии с целью защиты от света.
- В случае отсутствия возможности немедленного использования раствор для инфузий можно хранить в защищённом от света месте при комнатной температуре не более 4 часов (включая время растворения и разведения) или в холодильнике при температуре от 2 до 8 °С не более 24 часов. Не замораживать!
- Оставшийся во флаконе неиспользованный лекарственный препарат в любом количестве подлежит утилизации.
Способ введения
- Если приготовленный раствор для инфузий хранился в холодильнике (при температуре от 2 до 8 °С), перед введением препарата необходимо дать раствору достичь комнатной температуры, защищая от света.
- Препарат ЭНХЕРТУ вводят в виде внутривенной капельной инфузии только с линейным фильтром из полиэфирсульфона или полисульфона с размером пор 0,20 или 0,22 микрон.
- Начальную дозу необходимо вводить в виде внутривенной инфузии в течение 90 минут. Если предыдущая инфузия переносилась пациентом хорошо, последующие дозы препарата ЭНХЕРТУ можно вводить в виде инфузий в течение 30 минут. Не следует вводить препарат в виде внутривенной струйной инфузии или болюсно.
- Не следует смешивать препарат ЭНХЕРТУ с другими лекарственными препаратами, а также не следует вводить другие лекарственные препараты через одну и ту же систему для внутривенных инфузий.
Утилизация
Препарат не содержит консервантов и предназначен только для одноразового использования. Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Фармакологическая группа вещества Трастузумаб
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Трастузумаб
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Трастузумаб
-
Взаимодействие
-
Способ применения и дозы
-
Меры предосторожности
-
Особые указания
-
Торговые названия с действующим веществом Трастузумаб
Русское название
Трастузумаб
Английское название
Trastuzumab
Латинское название
Trastuzumabum (род. Trastuzumabi)
Фармакологическая группа вещества Трастузумаб
Нозологическая классификация
Код CAS
180288-69-1
Фармакологическое действие
—
противоопухолевое, цитостатическое.
Характеристика
Белый или бледно-желтого цвета порошок.
Фармакология
Рекомбинантные гуманизированные моноклональные антитела, производные ДНК, относятся к IgG1, содержат рамочные регионы человека и комплементарно-определяющие регионы мышиных антител р185 HER2. Антитела селективно взаимодействуют с внеклеточным доменом белка-рецептора-2 к эпидермальному ростовому фактору человека (HER2) на поверхности злокачественных клеток и тормозят их пролиферацию. Клеточно-опосредованная цитотоксичность в большей степени проявляется по отношению к опухолевым клеткам, гиперэкспрессирующим HER2. Монотерапия метастазирующего рака молочной железы на фоне гиперэкспрессии HER2 сопровождается развитием ремиссии в 15% и характеризуется средним периодом выживаемости в 13 мес. В комбинации с паклитакселом увеличивает среднее время до прогрессирования заболевания до 6,9 мес.
В ходе экспериментальных исследований было отмечено нормальное развитие эмбриона у грызунов с рецепторами типа HER2 и гибель эмбрионов мутантных мышей при отсутствии рецептора типа HER2.
При в/в введении в дозах 10, 50, 100, 250 и 500 мг параметры фармакокинетики имеют дозозависимый характер. С увеличением дозы повышаются значения Т1/2 и снижаются — Cl. Т1/2 после введения нагрузочной (4 мг/кг) и поддерживающей (2 мг/кг еженедельно) дозы — составляет в среднем 5,8 дней (диапазон 1–32 дня). Равновесная концентрация в диапазоне 79–123 мкг/мл достигается между на 16-й и 32-й нед. Проникает через плацентарный барьер. При введении обезьянам рода Cynomolgus в дозах, в 25 раз превышающих недельную поддерживающую дозу для человека (2 мг/кг), не оказывает влияния на показатели фертильности и повреждающего действия на плод (проникает через плаценту с 20 по 50 и с 120 по 150 дни беременности), секретируется в грудное молоко. Наличие в сыворотке детенышей обезьян не влияет на их рост и развитие от момента рождения до 1 мес.
Применение вещества Трастузумаб
Диссеминированный рак молочной железы с гиперэкспрессией HER2 (монотерапия после одного или более курсов химиотерапии метастатической стадии или в комбинации с паклитакселом в качестве терапии первого ряда).
Противопоказания
Гиперчувствительность.
Ограничения к применению
Одышка в покое, обусловленная метастатическим поражением или сопутствующими заболеваниями легких (повышен риск летальных инфузионных реакций); больные группы риска по кардиотоксичности (сердечная недостаточность, артериальная гипотензия, ИБС, предварительное лечение препаратами антрациклинового ряда и циклофосфамидом), детский возраст (безопасность и эффективность применения у детей не определены).
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — D.
На время лечения следует прекратить грудное вскармливание.
Побочные действия вещества Трастузумаб
Со стороны органов ЖКТ: тошнота, рвота, диспептические явления, анорексия, запор, редко — нарушение функций печени, гепатит, печеночная недостаточность, желтуха, панкреатит.
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): тахикардия, вазодилатация, гипотензия, сердечная недостаточность, кардиогенный шок, кардиомиопатия, сердцебиение; лейкопения, редко — нарушение ритма сердца, снижение фракции выброса, тромбоцитопения, анемия; снижение уровня протромбина.
Со стороны кожных покровов: зуд, гипергидроз, сухость кожи, акне, макуло-папулезная сыпь, поражение ногтей, алопеция.
Со стороны респираторной системы: бронхоспазм, кашель, одышка, носовое кровотечение, поражение легких, плеврит, фарингит, ринит, синусит; отек легких; гипоксия, отек гортани, острый респираторный дистресс-синдром.
Со стороны нервной системы и органов чувств: головокружение, сонливость или бессонница, парестезии, атаксия, тремор, парезы, тревога, депрессия, нейропатия, глухота, редко — кома, менингит, отек мозга, интеллектуальные нарушения.
Аллергические реакции: в т.ч. анафилаксия и анафилактический шок.
Прочие: общее недомогание, астения, лихорадка, озноб, гриппоподобный синдром, развитие инфекции, сепсис, периферические отеки, болевой синдром (боль в животе, в грудной клетке, голове, суставах, костях, мышцах, пояснице, шее); инфузионные реакции, сопровождающиеся симптомокомплексами: 1) — озноб, лихорадка, тошнота, рвота, астения, тремор, боль, в т.ч. головная, головокружение, одышка, гипотензия, кашель, сыпь (купируются ненаркотическими анальгетиками и антигистаминными средствами); 2) — одышка, гипотензия, бронхоспазм, гипоксия, появление хрипов в легких, тахикардия (могут приводить к летальному исходу, требуют прекращения инфузии, купируются бета-адренолитиками, кортикостероидами, кислородотерапией).
Взаимодействие
Нельзя разводить в 5% растворе глюкозы (вызывает агрегацию белка) и смешивать или разводить с другими лекарственными препаратами.
Способ применения и дозы
В/в, инфузионно, в дозе 4 мг/кг в течение 90 мин, далее — в поддерживающей дозе 2 мг/кг в течение 30 мин (при плохой переносимости более длительно) 1 раз в неделю.
Меры предосторожности
Лечение необходимо проводить под наблюдением онколога. Перед началом лечения обязательно тестирование на опухолевую экспрессию HЕR2. В ходе лечения необходимо каждые 3 мес тщательно мониторировать функции сердца для раннего выявления признаков кардиотоксичности (в случае бессимптомного нарушения сердечной деятельности — каждые 6–8 нед). При стойком бессимптомном или клинически манифестирующем снижении сердечного выброса следует рассмотреть вопрос о прекращении лечения или назначении симптоматической терапии (диуретики, сердечные гликозиды, ингибиторы АПФ). Бактериостатическая вода для инъекций, поставляемая вместе с препаратом в качестве консерванта, содержит 1,1% бензиловый спирт, оказывающий токсическое влияние на новорожденных и детей до трех лет. У пациентов с гиперчувствительностью к бензиловому спирту в качестве растворителя следует использовать воду для инъекций.
Особые указания
Раствор следует готовить в асептических условиях; осторожно и не встряхивать (возможно пенообразование). Приготовление раствора: во флакон с лиофилизированным порошком медленно добавить 20 мл бактериостатической воды для инъекций, аккуратно покачать флакон вращательными движениями (в случае образования пены дать постоять 5 мин). Далее из флакона с приготовленным концентратом раствора (21 мг/мл) набирается необходимый объем и вносится в инфузионный пакет с 250 мл 0,9% раствора натрия хлорида. Объем раствора, необходимый для введения нагрузочной или поддерживающей дозы определяется по формуле: масса тела (кг) х необходимая доза (мг/кг) / 21 мг/мл. Раствор следует вводить сразу после приготовления. Совместим с ПВХ и ПЭ инфузионными пакетами.
Торговые названия с действующим веществом Трастузумаб
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Гертикад® |
от 12000.00 до 32869.00 |
| Герцептин® |
от 51600.00 до 51600.00 |
| Тразимера® |
от 10795.00 до 34578.00 |
From Wikipedia, the free encyclopedia
 |
|
| Monoclonal antibody | |
|---|---|
| Type | Whole antibody |
| Source | Humanized |
| Target | HER2 |
| Clinical data | |
| Trade names | Enhertu |
| Other names | DS-8201a, fam-trastuzumab deruxtecan-nxki |
| AHFS/Drugs.com | Monograph |
| License data |
|
| Pregnancy category |
|
| Routes of administration |
Intravenous |
| ATC code |
|
| Legal status | |
| Legal status |
|
| Identifiers | |
| CAS Number |
|
| PubChem SID |
|
| DrugBank |
|
| UNII |
|
| KEGG |
|
| ChEMBL |
|
| Chemical and physical data | |
| Formula | C6460H9972N1724O2014S44.(C52H57F1N9O13)8 |
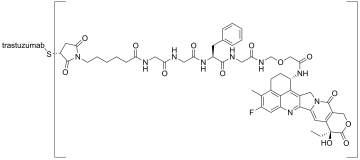
Trastuzumab deruxtecan, sold under the brand name Enhertu, is an antibody-drug conjugate consisting of the humanized monoclonal antibody trastuzumab (Herceptin) covalently linked to the topoisomerase I inhibitor deruxtecan (a derivative of exatecan).[11][12] It is licensed for the treatment of breast cancer or gastric or gastroesophageal adenocarcinoma.[12][13] Trastuzumab binds to and blocks signaling through epidermal growth factor receptor 2 (HER2/neu) on cancers that rely on it for growth. Additionally, once bound to HER2 receptors, the antibody is internalized by the cell, carrying the bound deruxtecan along with it, where it interferes with the cell’s ability to make DNA structural changes and replicate its DNA during cell division, leading to DNA damage when the cell attempts to replicate itself, destroying the cell.[13]
It was approved for medical use in the United States in December 2019,[12] in Japan in March 2020,[14] in the European Union in January 2021,[8][10] and in Australia in October 2021.[1]
Trastuzumab deruxtecan is the first approved therapy by the US Food and Drug Administration (FDA) targeted to people with the HER2-low breast cancer subtype subset of HER2-negative breast cancer.[15]
Medical uses[edit]
Trastuzumab deruxtecan is indicated for the treatment of adults with unresectable (unable to be removed with surgery) or metastatic (when cancer cells spread to other parts of the body) HER2-positive breast cancer who have received two or more prior anti-HER2-based regimens in the metastatic setting and for adults with locally advanced or metastatic HER2-positive gastric or gastroesophageal junction adenocarcinoma who have received a prior trastuzumab-based regimen.[12][13]
In May 2022, the indication was revised to include the treatment of adults with unresectable or metastatic HER2-positive breast cancer who have received a prior anti-HER2-based regimen either in the metastatic setting, or in the neoadjuvant or adjuvant setting and have developed disease recurrence during or within six months of completing therapy.[16]
In August 2022, the indication was revised to include the treatment of unresectable or metastatic HER2-low breast cancer.[15]
Side effects and label warnings[edit]
The most common side effects are nausea, fatigue, vomiting, alopecia (hair loss), constipation, decreased appetite, anemia (hemoglobin in blood is below the reference range), decreased neutrophil count (white blood cells that help lead your body’s immune system response to fight infection), diarrhea, leukopenia (other white blood cells that help the immune system), cough and decreased platelet count (component of blood whose function is to react to bleeding from blood vessel injury by clumping, thereby initiating a blood clot).[12]
The prescribing information for trastuzumab deruxtecan includes a boxed warning about the risk of interstitial lung disease (a group of lung conditions that causes scarring of lung tissues) and embryo-fetal toxicity.[12] Interstitial lung disease and pneumonitis, including cases resulting in death, have been reported with trastuzumab deruxtecan.[12]
History[edit]
The FDA approved trastuzumab deruxtecan based on the results of one clinical trial enrolling 184 female participants with HER2-positive, unresectable and/or metastatic breast cancer who had received two or more prior anti-HER2 therapies in the metastatic setting.[12] These participants were heavily pretreated in the metastatic setting, receiving between two and 17 therapies prior to receiving trastuzumab deruxtecan.[12] Participants in the clinical trial received trastuzumab deruxtecan every three weeks and tumor imaging was obtained every six weeks.[12] The overall response rate was 60.3%, which reflects the percentage of participants who had a certain amount of tumor shrinkage with a median duration of response of 14.8 months.[12]
Efficacy was evaluated in a multicenter, open-label, randomized trial (DESTINY-Gastric01, NCT03329690) in participants with HER2-positive locally advanced or metastatic gastric or GEJ adenocarcinoma who had progressed on at least two prior regimens, including trastuzumab, a fluoropyrimidine- and a platinum-containing chemotherapy.[13] A total of 188 participants were randomized (2:1) to receive trastuzumab deruxtecan 6.4 mg/kg intravenously every three weeks or physician’s choice of either irinotecan or paclitaxel monotherapy.[13]
Efficacy was based on DESTINY-Breast03 (NCT03529110), a multicenter, open-label, randomized trial that enrolled 524 participants with HER2-positive, unresectable, and/or metastatic breast cancer who received prior trastuzumab and taxane therapy for metastatic disease or developed disease recurrence during or within six months of completing neoadjuvant or adjuvant therapy.[16] Participants were randomized 1:1 to receive either trastuzumab deruxtecan or trastuzumab emtansine by intravenous infusion every three weeks until unacceptable toxicity or disease progression.[16] Randomization was stratified by hormone receptor status, prior treatment with pertuzumab, and history of visceral disease.[16]
The FDA approved trastuzumab deruxtecan for the treatment of HER2-low breast cancer based on DESTINY-Breast04, a randomized, multicenter, open label clinical trial that enrolled 557 adult participants with unresectable or metastatic HER2-low breast cancer.[15] The trial included two cohorts: 494 hormone receptor positive (HR+) participants and 63 hormone receptor negative (HR-) participants.[15] Of these participants, 373 randomly received trastuzumab deruxtecan by intravenous infusion every three weeks and 184 randomly received physician’s choice of chemotherapy (eribulin, capecitabine, gemcitabine, nab paclitaxel, or paclitaxel).[15] The results showed improvement in both progression-free survival and overall survival in people with unresectable or metastatic HER2-low breast cancer.[15]
Society and culture[edit]
Legal status[edit]
The U.S. Food and Drug Administration (FDA) approved trastuzumab deruxtecan in December 2019.[12][17] The application for trastuzumab deruxtecan was granted accelerated approval, fast track designation, and breakthrough therapy designation.[12] The FDA granted the approval of Enhertu to Daiichi Sankyo.[12]
On 10 December 2020, the Committee for Medicinal Products for Human Use (CHMP) of the European Medicines Agency (EMA) adopted a positive opinion, recommending the granting of a conditional marketing authorization for the medicinal product Enhertu, intended for the treatment of metastatic HER2-positive breast cancer.[18][19] Trastuzumab deruxtecan was reviewed under EMA’s accelerated assessment program. The applicant for this medicinal product is Daiichi Sankyo Europe GmbH. Trastuzumab deruxtecan was approved for medical use in the European Union in January 2021.[8][10]
In January 2021, the U.S. Food and Drug Administration (FDA) granted accelerated approval to trastuzumab deruxtecan for the treatment of adults with locally advanced or metastatic HER2-positive gastric or gastroesophageal (GEJ) adenocarcinoma who have received a prior trastuzumab-based regimen.[13][20]
In October 2021, the Therapeutic Goods Administration of Australia approved trastuzumab deruxtecan for provisional registration indicated for the treatment of adults with unresectable or metastatic HER2-positive breast cancer who have received two or more prior anti HER2-based regimens.[1]
References[edit]
- ^ a b c d «Enhertu». Therapeutic Goods Administration (TGA). 18 October 2021. Archived from the original on 23 October 2021. Retrieved 22 October 2021.
- ^ «Updates to the Prescribing Medicines in Pregnancy database». Therapeutic Goods Administration (TGA). 21 December 2022. Retrieved 2 January 2023.
- ^ «AusPAR: Trastuzumab deruxtecan». Therapeutic Goods Administration (TGA). 27 June 2022. Archived from the original on 18 July 2022. Retrieved 17 July 2022.
- ^ «Enhertu (AstraZeneca Pty Ltd)». Therapeutic Goods Administration (TGA). 16 February 2023. Retrieved 9 April 2023.
- ^ «Summary Basis of Decision (SBD) for Enhertu». Health Canada. 23 October 2014. Archived from the original on 30 May 2022. Retrieved 29 May 2022.
- ^ «Enhertu 100 mg powder for concentrate for solution for infusion — Summary of Product Characteristics (SmPC)». (emc). 1 July 2022. Archived from the original on 19 April 2021. Retrieved 1 July 2022.
- ^ «Enhertu- fam-trastuzumab deruxtecan-nxki injection, powder, lyophilized, for solution». DailyMed. Archived from the original on 22 January 2021. Retrieved 15 January 2021.
- ^ a b c «Enhertu EPAR». European Medicines Agency (EMA). 9 December 2020. Archived from the original on 23 March 2021. Retrieved 31 March 2021.
- ^ «Enhertu Product information». Union Register of medicinal products. Retrieved 3 March 2023.
- ^ a b c «Enhertu approved in the EU for the treatment of HER2-positive metastatic breast cancer» (Press release). AstraZeneca. 20 January 2021. Archived from the original on 20 January 2021. Retrieved 21 January 2021.
- ^ «A HER2-Targeting Antibody–Drug Conjugate, Trastuzumab Deruxtecan (DS-8201a), Enhances Antitumor Immunity in a Mouse Model» (PDF). Archived (PDF) from the original on 24 September 2020. Retrieved 23 December 2019.
- ^ a b c d e f g h i j k l m n «FDA approves new treatment option for patients with HER2-positive breast cancer who have progressed on available therapies». U.S.Food and Drug Administration (FDA) (Press release). 20 December 2019. Archived from the original on 20 December 2019. Retrieved 20 December 2019.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ a b c d e f «FDA approves fam-trastuzumab deruxtecan-nxki for HER2-positive gastric adenocarcinomas». U.S. Food and Drug Administration (FDA). 15 January 2021. Archived from the original on 15 January 2021. Retrieved 15 January 2021.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ «Enhertu Approved in Japan for Treatment of Patients with HER2 Positive Unresectable or Metastatic Breast Cancer» (Press release). Daiichi Sankyo. 25 March 2020. Archived from the original on 28 January 2021. Retrieved 21 January 2021 – via Business Wire.
- ^ a b c d e f «FDA Approves First Targeted Therapy for HER2-Low Breast Cancer». U.S. Food and Drug Administration (FDA) (Press release). 5 August 2022. Archived from the original on 6 August 2022. Retrieved 5 August 2022.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ a b c d «FDA grants regular approval to fam-trastuzumab deruxtecan-nxki for breast cancer». U.S. Food and Drug Administration (FDA). 4 May 2022. Archived from the original on 4 May 2022. Retrieved 5 May 2022.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ «Drug Trials Snapshot: Enhertu». U.S. Food and Drug Administration (FDA). 20 December 2019. Archived from the original on 20 October 2020. Retrieved 24 January 2020.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ «Enhertu: Pending EC decision». European Medicines Agency (EMA). 10 December 2020. Archived from the original on 12 December 2020. Retrieved 11 December 2020. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ «Trastuzumab deruxtecan recommended for approval in the EU by CHMP for HER2-positive metastatic breast cancer» (Press release). AstraZeneca. 14 December 2020. Archived from the original on 20 January 2021. Retrieved 21 January 2021.
- ^ «Enhertu approved in the US for the treatment of patients with previously treated HER2-positive advanced gastric cancer» (Press release). AstraZeneca. 18 January 2021. Archived from the original on 23 January 2021. Retrieved 22 January 2021.
Further reading[edit]
- Iwata TN, Sugihara K, Wada T, et al. (October 2019). «[Fam-] trastuzumab deruxtecan (DS-8201a)-induced antitumor immunity is facilitated by the anti-CTLA-4 antibody in a mouse model». PLOS ONE. 14 (10): e0222280. Bibcode:2019PLoSO..1422280I. doi:10.1371/journal.pone.0222280. PMC 6772042. PMID 31574081.
- Modi S, Saura C, Yamashita T, et al. (February 2020). «Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer». N. Engl. J. Med. 382 (7): 610–621. doi:10.1056/NEJMoa1914510. PMC 7458671. PMID 31825192.
External links[edit]
- «Trastuzumab_deruxtecan». Drug Information Portal. U.S. National Library of Medicine.
- Deruxtecan shows structure
- Clinical trial number NCT03329690 for «DS-8201a in Human Epidermal Growth Factor Receptor 2 (HER2)-Expressing Gastric Cancer [DESTINY-Gastric01]» at ClinicalTrials.gov
- Clinical trial number NCT03529110 for «DS-8201a Versus T-DM1 for Human Epidermal Growth Factor Receptor 2 (HER2)-Positive, Unresectable and/or Metastatic Breast Cancer Previously Treated With Trastuzumab and Taxane [DESTINY-Breast03]» at ClinicalTrials.gov
Один многодозовый флакон с лиофилизатом содержит:
действующее вещество: трастузумаб — 440 мг;
вспомогательные вещества: L-гистидин, L-гистидина гидрохлорид моногидрат, макрогол 3350, сорбитол.
Один флакон с растворителем (бактериостатическая вода для инъекций) содержит: вода для инъекций, бензиловый спирт.
Лиофилизат от почти белого до светло-желтого цвета.
Противоопухолевое средство — моноклональные антитела.
Код ATX: L01XC03.
Фармакологические свойства
Фармакодинамика
Трастузумаб представляет собой рекомбинантные гуманизированные моноклональные антитела, которые избирательно взаимодействуют с внеклеточным доменом рецепторов эпидермального фактора роста человека 2 типа (HER2). Эти антитела представляют собой IgG1, состоящие из человеческих регионов (константные участки тяжелых цепей) и определяющих комплементарность мышиных участков антитела p 185 HER2 к HER2. Протоонкоген HER2 или c-erВ2 кодирует трансмембранный рецептороподобный белок с молекулярной массой 185 кДа, который структурно подобен другим членам семейства рецепторов эпидермального фактора роста. Гиперэкспрессия HER2 обнаруживается в ткани первичного рака молочной железы (РМЖ) у 15-20% пациентов.
Общая частота выявления HER2-положительного статуса в ткани распространенного рака желудка при скрининге пациентов составила 15% ИГХ (метод иммуно-гистохимической реакции) 3+ и ИГХ2+/FISH+ (метод гибридизации in situ) или 22,1% при применении более широкого определения ИГХ3+ или FISH+. Амплификация гена HER2 приводит к гиперэкспрессии белка HER2 на мембране клеток опухоли, что, в свою очередь, вызывает постоянную активацию рецептора HER2. Внеклеточный домен рецептора (ECD, p 105) может попадать («слущиваться») в кровоток и определяться в образцах сыворотки крови. Исследования показывают, что пациенты с раком молочной железы, у которых отмечена амплификация или гиперэкспрессия HER2 в ткани опухоли, обладают меньшей выживаемостью без признаков заболевания по сравнению с пациентами без амплификации или гиперэкспрессии HER2 в ткани опухоли.
Трастузумаб блокирует пролиферацию опухолевых клеток человека с гиперэкспрессией HER2 in vivo и in vitro. In vitro антитело-зависимая клеточная цитотоксичность трастузумаба преимущественно направлена на опухолевые клетки с гиперэкспрессией HER2.
Иммуногенность
При неоадъювантной-адъювантной терапии раннего рака молочной железы у 8,1% пациентов, получавших препарат Трастузумаб внутривенно, появились антитела к трастузумабу (вне зависимости от наличия антител исходно). Нейтрализующие антитела к трастузумабу были выявлены по сравнению с исходным уровнем у 2 из 24 пациентов, получавших препарат Трастузумаб для внутривенного введения.
Клиническая значимость этих антител неизвестна. Однако эти антитела, по-видимому, не оказывают негативного воздействия на фармакокинетику, эффективность (определяемую по полному патологическому ответу) или безопасность (определяемую по частоте инфузионных реакций) препарата Трастузумаб при внутривенном введении.
Данные по иммуногенности при применении препарата Трастузумаб для лечения рака желудка отсутствуют.
Фармакокинетика
Фармакокинетика трастузумаба оценивалась на основании популяционного фармакокинетического анализа с использованием двухкамерной модели с параллельным линейным и нелинейным выведением из центральной камеры. Благодаря нелинейному выведению уменьшение концентрации препарата сопровождалось увеличением общего клиренса. Линейный клиренс составил 0,127 л/день у пациентов с раком молочной железы (метастатический рак молочной железы (мРМЖ) и ранний рак молочной железы (рРМЖ)) и 0,176 л/день у пациентов с распространенным раком желудка. Значения нелинейных параметров выведения по модели Михаэлиса-Ментен составили 8,81 мг/день для максимальной скорости выведения (Vmax) и 8,92 мг/л для константы Михаэлиса-Ментен (Km). Объем распределения в центральной камере составил 2,62 л у пациентов с РМЖ и 3,63 л у пациентов с распространенным раком желудка.
Рассчитанные с помощью популяционного анализа значения экспозиции препарата (5й — 95й перцентили) и значения фармакокинетических параметров при клинически значимых концентрациях (максимальная концентрация (Сmax) и минимальная концентрация (Cmin) у пациентов с РМЖ и распространенным раком желудка (РРЖ) при применении препарата еженедельно и каждые 3 недели представлены в таблицах 1 и 2 (в равновесном состоянии).
Таблица 1. Рассчитанные значения популяционных фармакокинетических показателей экспозиции в цикле 1 при внутривенном введении у пациентов с РМЖ и РРЖ (5й — 95й перцентили)
| Режим дозирования | Тип опухоли | N — число пациентов | Cmin(мкг/мл) | Сmax (мкг/мл) | AUC* (мкг•день/мл) |
| 8 мг/кг +6 мг/кг 1 раз в 3 недели | мРМЖ/рРМЖ | 1195 | 29,4 (5,8-59,5) | 178 (117-291) | 1373(736-2245) |
| РРЖ | 274 | 23,1 (6,1-50,3) | 132 (84,2-225) | 1109 (588-1938) | |
| 4 мг/кг +2 мг/кг 1 раз в неделю | мРМЖ/рРМЖ | 1195 | 37,7(12,3-70,9) | 88,3 (58-144) | 1066(586-1754) |
*AUC — площадь под кривой «концентрация-время»
Таблица 2. Рассчитанные значения популяционных фармакокинетических показателей экспозиции в равновесном состоянии для режимов дозирования препарата Трастузумаб при внутривенном введении у пациентов с РМЖ и РРЖ (5Н — 95м перцентили).
| Режим дозирова-ния | Тип опухоли | N —число пациентов | Cmin.ss(мкг/мл) | Cmax.ss(мкг/мл) | AUCss (мкг•день/мл) | Время до достижения равновесного состояния (недели) | Диапазон значений общего клиренса в равновесном состоянии (л/день) |
| 8 мг/кг +6 мг/кг 1 раз в3 недели | мРМЖ/ рРМЖ | 1195 | 47,4 (5-115) | 179 (107-309) | 1794 (673-3618) | 12 | 0,173-0,283 |
| РРЖ | 274 | 32,9 (6,1-88,9) | 131 (72,5-251) | 1338 (557-2875) | 9 | 0,189-0,337 | |
| 4 мг/кг +2 мг/кг 1 раз в неделю | мРМЖ/ рРМЖ | 1195 | 66,1 (14,9-142) | 109 (51,0-209) | 1765 (647-3578) | 12 | 0,201-0,244 |
Отмывочный период (washout time period) трастузумаба после внутривенного введения оценивался с помощью популяционного фармакокинетического моделирования. По крайней мере у 95% пациентов концентрация трастузумаба в сыворотке крови достигает значения <1 мкг/мл (что составляет около 3% от рассчитанной минимальной концентрации в равновесном состоянии (Cmin.ss) или выведению 97% препарата) через 7 месяцев после приема последней дозы.
Циркулирующий внеклеточный домен HER2-рецептора («сплющивающийся» с клетки антиген)
Результаты поискового анализа ковариант в подгруппе пациентов позволили предположить, что у пациентов с более высокой концентрацией «сплющивающегося» с клетки антигена (HER2-ECD антигена) нелинейный клиренс происходил быстрее (более низкий показатель Km) (Р < 0,001). Наблюдалась корреляция между «сплющивающимся» с клетки антигеном и активностью сывороточной глутамат оксалоацетат трансаминазы (СГОТ)/аспартатаминотрансферазы (ACT); воздействие «сплющивающегося» с клетки антигена на клиренс может частично объясняться активностью СГОТ/АСТ.
Данные об уровне циркулирующего внеклеточного домена НЕR2-рецептора («сплющивающийся» с клетки антиген) в сыворотке пациентов с раком желудка отсутствуют.
Фармакокинетика у особых групп пациентов
Подробные фармакокинетические исследования у пациентов пожилого возраста и пациентов с почечной или печеночной недостаточностью не проводились.
Пожилой возраст
Возраст не влияет на распределение трастузумаба.
Почечная недостаточность
По данным популяционного фармакокинетического анализа почечная недостаточность не влияет на фармакокинетические параметры (клиренс) трастузумаба.
Показания
Рак молочной железы
Метастатический рак молочной железы с опухолевой гиперэкспрессией HER2:
в виде монотерапии, после одной или более схем химиотерапии;
в комбинации с паклитакселом или доцетакселом, в случае отсутствия предшествующей химиотерапии (первая линия терапии);
в комбинации с ингибиторами ароматазы при положительных гормональных рецепторах (эстрогеновых и/или прогестероновых) у женщин в постменопаузе.
Ранние стадии рака молочной железы с опухолевой гиперэкспрессией HER2:
в виде адъювантной терапии после проведения хирургического вмешательства, завершения химиотерапии (неоадъювантной или адъювантной) и лучевой терапии;
в комбинации с паклитакселом или доцетакселом после адъювантной химиотерапии доксорубицином и циклофосфамидом;
в комбинации с адъювантной химиотерапией, состоящей из доцетаксела и карбоплатина;
в комбинации с неоадъювантной химиотерапией и последующей адъювантной монотерапией препаратом Трастузумаб, при местно-распространенном (включая воспалительную форму) заболевании или в случаях, когда размер опухоли превышает 2 см в диаметре.
Распространенный рак желудка
Распространенная аденокарцинома желудка или пищеводно-желудочного перехода с опухолевой гиперэкспрессией HER2:
в комбинации с капецитабином или внутривенным введением фторурацила и препаратом платины в случае отсутствия предшествующей противоопухолевой терапии по поводу метастатической болезни.
Повышенная чувствительность к трастузумабу, любому компоненту препарата, в т.ч. к бензиловому спирту, содержащемуся в качестве консерванта в бактериостатической воде для инъекций, прилагающейся к каждому многодозовому флакону 440 мг, или белку мыши.
Беременность и период грудного вскармливания.
Детский возраст до 18 лет (эффективность и безопасность применения у детей не установлены).
Тяжелая одышка в покое, вызванная метастазами в легкие или требующая поддерживающей терапии кислородом.
Больные на ранних стадиях РМЖ с инфарктом миокарда в анамнезе, стенокардией, требующей лечения, застойной сердечной недостаточностью (ІІ-IV функциональный класс по NYHA), ФВЛЖ < 55%, кардиомиопатией, аритмией, клинически значимыми пороками сердца, неконтролируемой артериальной гипертензией, гемодинамически значимым перикардиальным выпотом (эффективность и безопасность препарата у данных групп пациентов не изучены); одновременное применение препарата с антрациклинами в составе адъювантной терапии у пациентов с ранними стадиями РМЖ.
С осторожностью
Ишемическая болезнь сердца, артериальная гипертензия, сердечная недостаточность, сопутствующие заболевания легких или метастазы в легкие, предшествующая терапия кардиотоксичными лекарственными средствами, в т.ч. антрациклинами/циклофосфамидом, фракция выброса левого желудочка (ФВЛЖ) < 50%, пожилой возраст.
Применение при беременности и в период грудного вскармливания
Беременность
Женщинам детородного потенциала во время лечения препаратом Трастузумаб и в течение 7 месяцев после окончания лечения необходимо использовать надежные методы контрацепции.
В случае наступления беременности во время лечения или в течение 7 месяцев после последней дозы препарата необходимо предупредить женщину о возможности вредного воздействия на плод. Если беременная продолжит получать терапию препаратом Трастузумаб, то она должна находиться под тщательным наблюдением врачей разных специальностей (см. также раздел «Противопоказания»).
Неизвестно, влияет ли Трастузумаб на репродуктивную способность у женщин. Результаты экспериментов на животных не выявили признаков нарушения фертильности или негативного влияния на плод.
Период грудного вскармливания
Вскармливание грудным молоком не рекомендуется во время лечения и в течение 7 месяцев после окончания терапии препаратом Трастузумаб (см. также раздел «Противопоказания»).
Тестирование на опухолевую экспрессию HER2 до начала лечения препаратом Трастузумаб является обязательным.
Лечение препаратом Трастузумаб должно проводиться только под наблюдением врача, имеющего опыт применения цитотоксической химиотерапии, а препарат должен вводиться медицинским персоналом.
Перед применением препарата Трастузумаб необходимо проверить этикетку на флаконе и убедиться, что лекарственная форма препарата соответствует назначенной пациенту («лиофилизат для приготовления концентрата для приготовления раствора для инфузий», а не «раствор для подкожного введения»).
Трастузумаб в лекарственной форме «лиофилизат для приготовления концентрата для приготовления раствора для инфузий» не предназначен для подкожного введения и должен применяться только внутривенно.
Переход с лекарственной формы для внутривенного введения на лекарственную форму для подкожного введения и наоборот при введении один раз в 3 недели изучался в клиническом исследовании.
Чтобы не допустить ошибочного введения препарата Кадсила® (трастузумаб эмтанзин) вместо препарата Трастузумаб, перед приготовлением раствора для инфузии и его введением пациенту необходимо проверить этикетку на флаконе.
Трастузумаб в лекарственной форме «лиофилизат для приготовления концентрата для приготовления раствора для инфузий» вводят только внутривенно капельно! Вводить препарат внутривенно струйно или болюсно нельзя!
Внимание!
Трастузумаб несовместим с 5% раствором декстрозы из-за возможности агрегации белка. Трастузумаб нельзя смешивать или разводить вместе с другими лекарственными препаратами.
Раствор препарата Трастузумаб совместим с инфузионными пакетами, изготовленными из поливинилхлорида, полиэтилена и полипропилена.
Приготовление раствора
Подготовка препарата к введению должна проводиться в асептических условиях. Инструкция по приготовлению концентрата
Содержимое флакона с препаратом Трастузумаб растворяют в 20 мл поставляемой вместе с препаратом бактериостатической воде для инъекций, содержащей 1,1% бензилового спирта в качестве антимикробного консерванта. В результате получается концентрат раствора, пригодный для многократного использования, содержащий 21 мг трастузумаба в 1 мл и имеющий pH 6.0.
Во время растворения следует аккуратно обращаться с препаратом. При растворении следует избегать избыточного пенообразования, последнее может затруднить набор нужной дозы препарата из флакона.
Стерильным шприцем медленно ввести 20 мл бактериостатической воды для инъекций во флакон с 440 мг препарата Трастузумаб, направляя струю жидкости прямо на лиофилизат.
Для растворения аккуратно покачать флакон вращательными движениями. Не встряхивать!
При растворении препарата нередко образуется небольшое количество пены. Во избежание этого необходимо дать раствору постоять около 5 минут. Восстановленный раствор — прозрачная или слегка опалесцирующая жидкость от бесцветного до светло-желтого цвета.
Концентрат раствора препарата Трастузумаб, приготовленный на бактериостатической воде для инъекций, стабилен в течение 28 дней при температуре 2-8°С. Приготовленный концентрат содержит консервант и поэтому может использоваться многократно. Через 28 дней неиспользованный остаток концентрата следует уничтожить. Не замораживать!
В качестве растворителя препарата Трастузумаб 440 мг допускается использование стерильной воды для инъекций (без консерванта). Применения других растворителей следует избегать. В случае использования в качестве растворителя стерильной воды для инъекций концентрат физически и химически стабилен только в течение 24 часов при температуре 2-8°С и должен быть уничтожен по истечении этого времени. Не замораживать!
Инструкция но приготовлению раствора для инфузии
Определить объем раствора:
необходимый для введения нагрузочной дозы трастузумаба, равной 4 мг/кг массы тела, или поддерживающей дозы, равной 2 мг/кг, определяется по следующей формуле:
масса тела (кг) × доза (4 мг/кг нагрузочная или 2 мг/кг поддерживающая)
21 (мг/мл, концентрация приготовленного раствора)
необходимый для введения нагрузочной дозы трастузумаба, равной 8 мг/кг массы тела, или поддерживающей дозы, равной 6 мг/кг каждые 3 недели, определяется по следующей формуле:
масса тела (кг) × доза (8 мг/кг нагрузочная или 6 мг/кг поддерживающая)
21 (мг/мл, концентрация приготовленного раствора)
Из флакона с приготовленным концентратом следует набрать соответствующий объем и ввести его в инфузионный пакет с 250 мл 0,9% раствора натрия хлорида. Затем инфузионный пакет следует осторожно перевернуть для перемешивания раствора, избегая пенообразования. Перед введением раствор следует проверить (визуально) на предмет отсутствия механических примесей и изменения окраски. Раствор для инфузий вводят сразу после его приготовления.
В исключительных случаях приготовленный раствор для инфузии может храниться не более 24 ч при температуре 2-8°С, если растворение концентрата и приготовление раствора для инфузии происходило в контролированных и валидированных асептических условиях. При этом за условия хранения (правила хранения и продолжительность) отвечает специалист, готовивший раствор.
Инструкции по утилизации неиспользованного препарата или с истекшим сроком годности
Попадание лекарственного препарата в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов.
Иглы и шприцы нельзя использовать повторно. Использованные иглы и шприцы помещают в защищенный от проколов контейнер (емкость). Утилизацию препарата Трастузумаб и расходных материалов следует проводить в соответствии с местными требованиями.
Стандартный режим дозирования
Во время каждого введения трастузумаба необходимо тщательно наблюдать за пациентом на предмет появления озноба, лихорадки и других инфузионных реакций (в течение 6 ч после начала первой инфузии и в течение 2 ч после начала последующих инфузий). Должен быть доступен набор для оказания экстренной помощи, а инфузию должен проводить медицинский специалист, имеющий опыт в лечении анафилаксии.
В случае появления инфузионных реакций инфузию прерывают. После исчезновения симптомов инфузионных реакций легкой и умеренной степени тяжести согласно NCI-CTC (общие критерии токсичности Национального института рака в США) возможно возобновление инфузии. В случае развития тяжелых жизнеугрожающих инфузионных реакций следует рассмотреть вопрос о прекращении дальнейшей терапии препаратом Трастузумаб.
Метастатический рак молочной железы
Еженедельное введение
Нагрузочная доза: 4 мг/кг массы тела в виде 90-минутной внутривенной капельной инфузии.
Поддерживающая доза: 2 мг/кг массы тела один раз в неделю. Поддерживающая доза вводится через 1 неделю после нагрузочной. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии. Альтернативное введение — через 3 недели
Нагрузочная доза: 8 мг/кг массы тела в виде 90-минутной внутривенной капельной инфузии.
Поддерживающая доза: 6 мг/кг массы тела каждые 3 недели. Поддерживающая доза вводится через 3 недели после нагрузочной. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии. Применение в комбинации с паклитакселом или доцетакселом
Паклитаксел или доцетаксел вводились на следующий день после введения препарата Трастузумаб (рекомендации по дозированию см. в соответствующих инструкциях по медицинскому применению) или сразу же после последующего введения препарата Трастузумаб, если при предшествовавшем введении Трастузумаб переносился хорошо. Применение в комбинации с ингибитором ароматазы
Трастузумаб и анастрозол вводились в день 1. Ограничений по времени введения препарата Трастузумаб и анастрозола не было (рекомендации по дозированию см. в инструкции по медицинскому применению анастрозола или других ингибиторов ароматазы).
Ранние стадии рака молочной железы
Еженедельное введение
При еженедельном введении Трастузумаб вводится в нагрузочной дозе 4 мг/кг массы тела, далее в поддерживающей 2 мг/кг массы тела один раз в неделю. Поддерживающая доза вводится через 1 неделю после нагрузочной. Нагрузочная доза вводится в виде 90- минутной внутривенной капельной инфузии. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии. Введение через 3 недели
При введении через 3 недели нагрузочная доза: 8 мг/кг массы тела (в виде 90-минутной внутривенной капельной инфузии).
Поддерживающая доза: 6 мг/кг массы тела каждые 3 недели. Поддерживающая доза вводится через 3 недели после нагрузочной. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии. Применение препарата Трастузумаб при ранних стадиях рака молочной железы изучено в комбинации с химиотерапией согласно схемам, описанным ниже.
Применение в комбинации с паклитакселом или доцетакселом после химиотерапии доксорубицином и циклофосфамидом
Паклитаксел:
80 мг/м2 в виде длительной внутривенной (в/в) инфузии, еженедельно, в течение 12 недель или
175 мг/м2 в виде длительной в/в инфузии, каждые 3 недели в течение 4 циклов (в день 1 каждого цикла).
Доцетаксел:
100 мг/м2 в виде в/в инфузии в течение 1 ч, каждые 3 недели, в течение 4 циклов (начиная в день 2 в цикле 1, далее в день 1 в каждый последующий цикл).
Трастузумаб:
начиная с первой дозы паклитаксела или доцетаксела, Трастузумаб вводился согласно еженедельной схеме во время химиотерапии (нагрузочная доза 4 мг/кг, далее в поддерживающей дозе 2 мг/кг каждую неделю).
В дальнейшем монотерапия препаратом Трастузумаб продолжалась согласно еженедельной схеме после применения в комбинации с паклитакселом или согласно введению через 3 недели после применения в комбинации с доцетакселом. Общая продолжительность терапии препаратом Трастузумаб от момента первого введения составила 1 год, независимо от количества полученных или пропущенных доз. Если паклитаксел или доцетаксел и препарат Трастузумаб должны были вводиться в один день, то паклитаксел или доцетаксел вводился первым.
Применение в комбинации с доцетакселом и карбоплатином
Доцетаксел/Карбоплатин (каждые 3 недели в течение 6 циклов, начиная со дня 2 первого цикла, далее в день 1 в каждый последующий цикл):
доцетаксел в дозе 75 мг/м2 в виде в/в инфузии в течение 1 ч, за которым следовал карбоплатин в дозе для достижения целевой AUC — 6 мг/мл/мин, в виде в/в инфузии, в течение 30-60 мин.
Трастузумаб:
Трастузумаб совместно с химиотерапией вводился согласно еженедельной схеме (нагрузочная доза 4 мг/кг, далее в поддерживающей дозе 2 мг/кг каждую неделю). После химиотерапии монотерапия препаратом Трастузумаб продолжалась согласно введению через 3 недели. Общая продолжительность терапии препаратом Трастузумаб от момента первого введения составила 1 год, независимо от количества полученных или пропущенных доз. Если доцетаксел, карбоплатин и препарат Трастузумаб должны были вводиться в один день, то первым вводился доцетаксел, за которым следовал карбоплатин, далее Трастузумаб.
Неоадъювантная-адъювантная терапия
Трастузумаб вводился согласно режиму каждые 3 недели в комбинации с неоадъювантной химиотерапией (10 циклов):
доксорубицин 60 мг/м и паклитаксел 150 мг/м2, каждые 3 недели, в течение 3 циклов;
далее паклитаксел 175 мг/м2, каждые 3 недели, в течение 4 циклов;
далее циклофосфамид, метотрексат и фторурацил в день 1 и 8, каждые 4 недели, в течение 3 циклов.
После проведения оперативного вмешательства адъювантная монотерапия препаратом Трастузумаб продолжалась согласно режиму каждые 3 недели. Общая продолжительность терапии препаратом Трастузумаб составила 1 год.
Распространенный рак желудка
Введение через 3 недели
Нагрузочная доза: 8 мг/кг массы тела в виде 90-минутной внутривенной капельной инфузии.
Поддерживающая доза: 6 мг/кг массы тела каждые 3 недели. Поддерживающая доза вводится через 3 недели после нагрузочной. Если предшествующая нагрузочная доза переносилась хорошо, препарат можно вводить в виде 30-минутной капельной инфузии. Метастатический и ранние стадии РМЖ и распространенный рак желудка Продолжительность терапии
Лечение препаратом Трастузумаб у пациентов с метастатическим РМЖ или распространенным раком желудка проводится до прогрессирования заболевания. Пациенты с ранними стадиями РМЖ должны получать терапию препаратом Трастузумаб в течение 1 года или до рецидива заболевания (в зависимости от того, что произойдет быстрее). Лечение препаратом Трастузумаб пациентов с ранними стадиями РМЖ свыше одного года не рекомендуется.
Пропуск в плановом введении
Если пропуск в плановом введении трастузумаба составил 7 дней или менее, следует как можно быстрее ввести препарат в обычной поддерживающей дозе (еженедельный режим: 2 мг/кг массы тела; режим каждые 3 недели: 6 мг/кг массы тела), не ожидая следующего планового введения. Далее вводить препарат в поддерживающей дозе через 7 дней или 21 день в соответствии с еженедельным режимом или режимом каждые 3 недели соответственно.
Если перерыв во введении препарата составил более 7 дней, необходимо как можно быстрее снова ввести нагрузочную дозу трастузумаба (еженедельный режим: 4 мг/кг массы тела; режим каждые 3 недели: 8 мг/кг массы тела) в виде 90-минутной внутривенной капельной инфузии. Затем продолжить введение препарата в поддерживающей дозе через 7 дней или 21 день в соответствии с еженедельным режимом или режимом каждые 3 недели соответственно.
Коррекция дозы
В период возникновения обратимой миелосупрессии, вызванной химиотерапией, курс терапии препаратом Трастузумаб может быть продолжен после снижения дозы химиотерапии или временной ее отмены (согласно соответствующим рекомендациям в инструкциях по применению паклитаксела, доцетаксела или ингибитора ароматазы) при условии тщательного контроля осложнений, обусловленных нейтропенией.
При снижении фракции выброса левого желудочка (ФВЛЖ, в %) на >10 единиц от исходной и ниже значения 50% лечение должно быть приостановлено. Повторная оценка ФВЛЖ должна быть проведена приблизительно через 3 недели. При отсутствии улучшения показателя ФВЛЖ, или его дальнейшем снижении, или при появлении симптомов застойной сердечной недостаточности (ЗСН) необходимо рассмотреть вопрос о прекращении лечения препаратом Трастузумаб, если только польза для конкретного пациента не превосходит риски. Все эти пациенты должны быть направлены к кардиологу для проведения обследования и находиться под наблюдением.
Особые указания по дозированию
Пациенты пожилого возраста
Снижение дозы препарата Трастузумаб у пациентов пожилого возраста не требуется. Пациенты с почечной недостаточностью
Изменение дозы препарата Трастузумаб у пациентов с легкой и средней степенью нарушения функции почек не требуется. В связи с ограниченными данными дать рекомендации по дозированию препарата у пациентов с тяжелой степенью нарушения функции почек не представляется возможным.
Пациенты с печеночной недостаточностью
В связи с отсутствием данных дать рекомендации по дозированию препарата у пациентов с нарушением функции печени не представляется возможным.
В настоящее время наиболее серьезными и/или частыми нежелательными реакциями, о которых сообщалось при использовании препарата Трастузумаб, являются: дисфункция сердца, инфузионные реакции, гематотоксичность (в частности, нейтропения), инфекции и
нарушения со стороны легких.
Для описания частоты нежелательных реакций в данном разделе используется следующая классификация: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000), неизвестно (не может быть вычислена на основе имеющихся данных). В рамках каждой группы нежелательные реакции представлены в соответствии со снижением серьезности.
Ниже представлены нежелательные реакции, о которых сообщалось при применении препарата Трастузумаб как в монотерапии, так и в комбинации с химиотерапией в базовых клинических исследованиях и при постмаркетинговом использовании.
Частота указана в соответствии с максимально встречавшейся в базовых клинических исследованиях.
Инфекционные и паразитарные заболевания: очень часто — инфекции, назофарингит; часто — нейтропенический сепсис, цистит, Herpes zoster, грипп, синусит, инфекции кожи, ринит, инфекции верхних дыхательных путей, инфекции мочевыводящих путей, рожа, флегмона, фарингит; нечасто — сепсис.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): неизвестно — прогрессирование злокачественного новообразования, прогрессирование новообразования;
Нарушения со стороны крови и лимфатической системы: очень часто — фебрильная нейтропения, анемия, нейтропения, лейкопения, тромбоцитопения; неизвестно — гипопротромбинемия, иммунная тромбоцитопения.
Нарушения со стороны иммунной системы: часто — реакции гиперчувствительности; неизвестно — анафилактические реакции†, анафилактический шок†.
Нарушения со стороны обмена веществ: очень часто — снижение массы тела, анорексия; неизвестно — гиперкалиемия.
Нарушения психики: очень часто — бессонница; часто — тревога, депрессия, нарушение мышления.
Нарушения со стороны нервной системы, очень часто — тремор1, головокружение, головные боли, парестезии, дисгевзия (искажение вкусовых восприятий); часто — периферическая нейропатия, мышечный гипертонус, сонливость, атаксия; редко — парез; неизвестно — отек мозга.
Нарушения со стороны органа зрения: очень часто — конъюнктивит, повышенное слезоотделение; часто — сухость глаз; неизвестно — отек диска зрительного нерва, кровоизлияние в сетчатку.
Нарушения со стороны органа слуха и лабиринтные нарушения: нечасто — глухота.
Нарушения со стороны сердечно-сосудистой системы: очень часто — снижение и повышение артериального давления (АД)1, нарушение сердечного ритма1, сердцебиение1, трепетание (предсердий или желудочков)1, снижение фракции выброса левого желудочка*, «приливы»; часто — сердечная недостаточность (застойная)†, суправентрикулярная тахиаритмия†1, кардиомиопатия, артериальная гипотензия†1, вазодилатация; нечасто — перикардиальный выпот; неизвестно — кардиогенный шок, перикардит, брадикардия, ритм «галопа».
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — хрипы в легких†1, одышка†, кашель, носовое кровотечение, ринорея; часто — пневмония†, бронхиальная астма, нарушение функции легких, плевральный выпот†; редко — пневмонит; неизвестно — легочный фиброз†, дыхательная недостаточность†, инфильтрация легких†, острый отек легких†, острый респираторный дистресс-синдром†, бронхоспазм†, гипоксия†, снижение насыщения гемоглобина кислородом†, отек гортани, ортопноэ, отек легкого, интерстициальная болезнь легких.
Нарушения со стороны желудочно-кишечного тракта: очень часто — диарея, рвота, тошнота, отек губ1, боли в животе, диспепсия, запор, стоматит; часто — панкреатит, геморрой, сухость во рту.
Нарушения со стороны печени и желчевыводящих путей: часто — гепатоцеллюлярное повреждение, гепатит, болезненность в области печени; редко — желтуха; неизвестно — печеночная недостаточность.
Нарушения со стороны кожи и подкожных тканей: очень часто — эритема, сыпь, отек лица1, алопеция, нарушение структуры ногтей, ладонно-подошвенный синдром; часто — акне, сухость кожи, экхимоз, гипергидроз, макуло-папулезная сыпь, зуд, онихоклазия, дерматит; нечасто — крапивница; неизвестно — ангионевротический отек.
Нарушения со стороны костно-мышечной и соединительной ткани: очень часто — артралгия, мышечная скованность1, миалгия; часто — артрит, боли в спине, оссалгия, спазмы мышц, боль в области шеи, боли в конечностях.
Нарушения со стороны почек и мочевыводящих путей: часто — заболевание почек; неизвестно — мембранозный гломерулонефрит, гломерулонефропатия, почечная недостаточность.
Беременность, послеродовые и перинатальные состояния: неизвестно — олигогидрамнион, фатальная гипоплазия легких и гипоплазия и/или нарушение функции почек у плода.
Нарушения со стороны половых органов и молочной железы: часто — воспаление молочной железы/мастит.
Общие расстройства и нарушения в месте введения: очень часто — астения, боли в груди, озноб, утомляемость, гриппоподобный синдром, инфузионные реакции, боли, лихорадка, мукозит, периферические отеки; часто — недомогание, отеки.
Травмы, интоксикации и осложнения манипуляций: часто — ушиб.
† — нежелательные реакции, которые в сообщениях ассоциировались с летальным исходом.
1 — нежелательные реакции, которые в основном сообщались в ассоциации с инфузионными реакциями. Точное процентное количество не установлено.
* — нежелательные реакции наблюдались при комбинированной терапии после антрациклинов и в комбинации с таксанами.
Ниже представлена информация по отдельным нежелательным реакциям.
Дисфункция сердца
Застойная сердечная недостаточность II-IV функционального класса по NYHA (классификация Нью-Йоркской Ассоциации Кардиологов) является частой нежелательной реакцией при применении препарата Трастузумаб и ассоциировалась с фатальным исходом. У пациентов, получавших препарат Трастузумаб, наблюдались следующие признаки и симптомы нарушения функции сердца: одышка, ортопноэ, усиление кашля, отек легких, ритм «галопа» или снижение фракции выброса левого желудочка.
В 3 базовых клинических исследованиях применения препарата Трастузумаб в комбинации с адъювантной химиотерапией частота сердечной дисфункции 3/4 степени (а именно — симптоматическая застойная сердечная недостаточность) не отличалась от таковой у пациентов, получавших только химиотерапию (т.е. без препарата Трастузумаб) и получавших препарат Трастузумаб последовательно после терапии таксанами (0,3-0,4%). Частота была наибольшей у пациентов, получавших Трастузумаб совместно с таксанами (2,0%). Опыт использования препарата Трастузумаб в комбинации с низкодозовыми режимами антрациклинов в неоадъювантной терапии ограничен.
При применении препарата Трастузумаб в течение одного года после завершения адъювантной химиотерапии сердечная недостаточность III-IV функционального класса по NYHA наблюдалась у 0,6% пациентов при медиане наблюдения 12 месяцев и у 0,8% пациентов при медиане наблюдения 8 лет. Частота легкой симптоматической и бессимптомной дисфункции левого желудочка составила 4,6%.
Тяжелая ЗСН была обратима в 71,4% случаев (обратимость определялась как минимум двумя последовательными повышениями показателя ФВЛЖ >50% после явления). Легкая симптоматическая и бессимптомная дисфункция левого желудочка была обратима в 79,5% случаев. Приблизительно 17% явлений, связанных с дисфункцией сердца, возникли после завершения терапии препаратом Трастузумаб.
В базовых клинических исследованиях при метастатическом РМЖ частота сердечной дисфункции при внутривенном введении препарата Трастузумаб в сочетании с паклитакселом варьировала от 9% до 12% по сравнению с 1% — 4% для монотерапии паклитакселом. Для монотерапии препаратом Трастузумаб частота составила 6% — 9%. Наибольшая частота сердечной дисфункции наблюдалась у пациентов, получающих Трастузумаб одновременно с антрациклинами/циклофосфамидом (27%), что значительно выше, чем для терапии антрациклинами/циклофосфамидом (7% — 10%). В исследовании с проспективным мониторингом функции сердца частота симптоматической ЗСН составила 2,2% у пациентов, получавших препарат Трастузумаб и доцетаксел, по сравнению с 0% у пациентов, получавших монотерапию доцетакселом. У большинства пациентов (79%) с сердечной дисфункцией наблюдалось улучшение состояния после получения стандартной терапии ЗСН.
Инфузионные реакции и реакции гиперчувствительности
Подсчитано, что около 40% пациентов, получающих Трастузумаб, испытывают инфузионные реакции в той или иной форме. Однако большинство инфузионных реакций являются легкими и умеренными по степени тяжести (согласно NCI-CTC) и имеют тенденцию возникать в начале лечения, т.е. во время 1, 2 и 3-ей инфузии, при последующих введениях возникают реже. Реакции включают в себя следующие симптомы: озноб, лихорадка, одышка, артериальная гипотензия, хрипы в легких, бронхоспазм, тахикардия, снижение насыщения гемоглобина кислородом, респираторный дистресс-синдром, сыпь, тошнота, рвота и головная боль.
Частота инфузионных реакций всех степеней тяжести варьирует и зависит от показания, методологии сбора информации, а также от того, вводился ли Трастузумаб совместно с химиотерапией или применялся в монотерапии.
Тяжелые анафилактические реакции, требующие немедленных дополнительных медицинских вмешательств, чаще всего могут возникать во время первой или второй инфузии препарата Трастузумаб, такие реакции ассоциировались с летальным исходом.
В отдельных случаях наблюдались анафилактоидные реакции.
Гематологическая токсичность
Очень часто возникали фебрильная нейтропения, лейкопения, анемия, тромбоцитопения и нейтропения. Частота возникновения гипопротромбинемии неизвестна. Риск нейтропении может быть несколько выше при применении трастузумаба в комбинации с доцетакселом после терапии препаратами антрациклинового ряда.
Нарушения со стороны легких
С применением препарата Трастузумаб ассоциируются тяжелые нежелательные явления со стороны легких (в том числе с фатальным исходом). Данные реакции включают в себя (но не ограничиваются): инфильтраты в легких, острый респираторный дистресс-синдром, пневмонию, пневмонит, плевральный выпот, острый отек легких и дыхательную недостаточность.
Переход с лекарственной формы для внутривенного введения препарата Трастузумаб на лекарственную форму для подкожного введения и наоборот
В целом переход с лекарственной формы для внутривенного введения препарата Трастузумаб на лекарственную форму для подкожного введения и наоборот у пациентов с ранними стадиями HER2-положительного РМЖ переносился хорошо. Частота серьезных нежелательных явлений, нежелательных явлений 3 степени тяжести и прекращения терапии из-за развития нежелательных явлений до перехода на другую лекарственную форму была низкой (<5%) и соответствовала таковой после перехода на другую лекарственную форму. Нежелательные явления 4 или 5 степени тяжести не сообщались.
В клинических исследованиях случаев передозировки препарата не наблюдалось. Введение препарата Трастузумаб в разовых дозах более 10 мг/кг не изучалось. Препарат Трастузумаб в дозах <10 мг/кг переносился хорошо.
Специальные исследования лекарственных взаимодействий препарата Трастузумаб у человека не проводились.
В клинических исследованиях клинически значимых взаимодействий между препаратом Трастузумаб и одновременно применяемыми препаратами не отмечалось.
В случаях, когда препарат Трастузумаб применялся в комбинации с доцетакселом, карбоплатином или анастрозолом, фармакокинетика вышеназванных препаратов не изменялась.
Концентрации паклитаксела и доксорубицина и их основных метаболитов (6-альфа- гидроксипаклитаксел и доксорубицинол) не изменяются в присутствии трастузумаба. Тем не менее трастузумаб может повысить общую экспозицию одного из метаболитов доксорубицина (7-дезокси-13-дигидродоксорубицинон). Биологическая активность этого метаболита и клиническое значение повышения его экспозиции неизвестны. В присутствии паклитаксела и доксорубицина изменений в концентрации трастузумаба не наблюдалось. Результаты изучения фармакокинетики капецитабина и цисплатина при использовании в комбинации с трастузумабом или без него предполагают, что экспозиция биологически активных метаболитов капецитабина (например, фторурацил) не изменялась при одновременном применении цисплатина или цисплатина и трастузумаба. Однако были зарегистрированы более высокие концентрации капецитабина и более длительный период его полувыведения при комбинации с трастузумабом. Данные также указывают, что фармакокинетика цисплатина не изменялась при одновременном применении капецитабина или капецитабина в комбинации с трастузумабом.
Трастузумаб несовместим с 5% раствором декстрозы из-за возможности агрегации белка. Трастузумаб нельзя смешивать или растворять вместе с другими лекарственными препаратами.
Признаков несовместимости между раствором препарата Трастузумаб и инфузионными пакетами, изготовленными из поливинилхлорида, полиэтилена или полипропилена, не наблюдалось.
В медицинской документации больного следует указывать торговое наименование и номер серии препарата.
Информация, представленная в данной инструкции, относится исключительно к препарату Трастузумаб.
HER2-тестирование должно быть проведено в специализированной лаборатории, которая может обеспечить контроль качества процедуры тестирования.
Трастузумаб должен использоваться у пациенток с метастатическим РМЖ или ранними стадиями РМЖ только при наличии опухолевой гиперэкспрессии HER2, определенной методом иммуно-гистохимической реакции (ИГХ) или амплификации гена HER2, определенной методом гибридизации in situ (FISH или CISH). Следует использовать точные и валидированные методы определения.
Трастузумаб должен использоваться у пациентов с метастатическим раком желудка только при наличии опухолевой гиперэкспрессии HER2, определенной методом ИГХ как ИГХ2+ и подтвержденной результатами SISH или FISH, или ИГХЗ+. Следует использовать точные и валидированные методы определения.
В настоящее время отсутствуют данные из клинических исследований о пациентах, получавших Трастузумаб повторно после применения в адъювантной терапии.
Дисфункция сердца
Общие указания
Пациенты, получающие Трастузумаб в качестве монотерапии или в комбинации с паклитакселом или доцетакселом, особенно после химиотерапии, включающей антрациклины (доксорубицин или эпирубицин), имеют повышенный риск развития застойной сердечной недостаточности (ЗСН) (ІІ-IV функциональный класс по NYHA) или бессимптомных нарушений функции сердца. Тяжесть этих явлений может варьировать от средней до тяжелой степени. Эти явления могут привести к смертельному исходу. Кроме этого, необходимо соблюдать осторожность при лечении пациентов с высоким сердечнососудистым риском, например, у пациентов пожилого возраста, с артериальной гипертензией, документально подтвержденной ишемической болезнью сердца, застойной сердечной недостаточностью, фракцией выброса левого желудочка (ФВЛЖ) <55%.
Пациенты, которым планируется назначение препарата Трастузумаб, особенно те из них, которые ранее получали препараты антрациклинового ряда и циклофосфамид, должны вначале пройти тщательное кардиологическое обследование, включающее сбор анамнеза, физикальный осмотр, электрокардиографию (ЭКГ), эхокардиографию и/или радиоизотопную вентрикулографию (MUGA) или магнитно-резонансную томографию (МРТ). Мониторирование может позволить выявить пациентов с возникшими нарушениями функции сердца. Исходно проведенное кардиологическое обследование должно повторяться каждые 3 месяца во время терапии и каждые 6 месяцев после ее окончания в течение 24 месяцев с момента введения последней дозы препарата.
До начала лечения препаратом Трастузумаб необходимо тщательно сопоставить возможную пользу и риск от его применения.
По данным, полученным в результате популяционного фармакокинетического моделирования, препарат Трастузумаб может находиться в крови до 7 месяцев после завершения терапии. У пациентов, которые получают антрациклины после завершения лечения препаратом Трастузумаб*, возможно повышение риска дисфункции сердца. По возможности врачи должны избегать назначения химиотерапии на основе антрациклинов в течение 7 месяцев после завершения терапии препаратом Трастузумаб. При применении препаратов антрациклинового ряда следует проводить тщательный мониторинг функции сердца. Следует оценить необходимость проведения стандартного кардиологического обследования у пациентов с подозрением на сердечно-сосудистые заболевания.
У всех пациентов следует мониторировать функцию сердца во время лечения (например, каждые 12 недель). В результате мониторинга можно выявить пациентов, у которых развились нарушения функции сердца.
У пациентов с бессимптомным нарушением функции сердца может оказаться полезным более частое проведение мониторинга (например, каждые 6-8 недель). При продолжительном ухудшении функции левого желудочка, не проявляющемся симптоматически, целесообразно рассмотреть вопрос об отмене препарата, если клиническая польза от его применения отсутствует.
Безопасность продолжения или возобновления терапии препаратом Трастузумаб у пациентов, у которых развилось нарушение функции сердца, не изучалась. При снижении фракции выброса левого желудочка (ФВЛЖ, в %) на >10 единиц от исходной и ниже значения 50% лечение должно быть приостановлено. Повторная оценка ФВЛЖ должна быть проведена приблизительно через 3 недели. При отсутствии улучшения показателя ФВЛЖ или его дальнейшем снижении, или при появлении симптомов застойной сердечной недостаточности (ЗСН) необходимо рассмотреть вопрос о прекращении лечения препаратом Трастузумаб, если только польза для конкретного пациента не превосходит риски. Все эти пациенты должны быть направлены к кардиологу для проведения обследования и находиться под наблюдением.
Если на фоне терапии препаратом Трастузумаб развивается симптоматическая сердечная недостаточность, необходимо провести соответствующую стандартную медикаментозную терапию ЗСН.
У большинства пациентов с ЗСН или бессимптомной дисфункцией сердца в базовых исследованиях наблюдалось улучшение состояния на фоне стандартной медикаментозной терапии ЗСН: ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина и бета-адреноблокаторы. При наличии клинической пользы от применения препарата Трастузумаб большинство пациентов с побочными реакциями со стороны сердца продолжили терапию без проявления дополнительных клинически значимых реакций со стороны сердца.
Метастатический рак молочной железы
Не рекомендуется применять препарат Трастузумаб совместно в комбинации с антрациклинами для лечения метастатического рака молочной железы.
Риск развития дисфункции сердца у пациентов с метастатическим раком молочной железы повышен при предшествующей терапии антрациклинами, однако он ниже по сравнению с таковым при одновременном применении антрациклинов и препарата Трастузумаб.
Ранние стадии рака молочной железы
Пациентам с ранними стадиями рака молочной железы следует проводить кардиологическое обследование перед началом лечения, каждые 3 месяца во время терапии и каждые 6 месяцев после её окончания в течение 24 месяцев с момента введения последней дозы препарата. Рекомендуется более длительный мониторинг после лечения препаратом Трастузумаб в комбинации с антрациклинами с частотой обследований 1 раз в год в течение 5 лет с момента введения последней дозы препарата Трастузумаб или далее, если наблюдается постоянное снижение ФВЛЖ.
Лечение препаратом Трастузумаб не рекомендуется пациентам на ранних стадиях РМЖ (адъювантная и неоадъювантная терапия) с: инфарктом миокарда в анамнезе; стенокардией, требующей лечения; ЗСН (ІІ-IV функциональный класс по NYHA) в анамнезе или в настоящее время; ФВЛЖ ниже 55%; другими кардиомиопатиями; аритмиями, требующими лечения; клинически значимыми пороками сердца; плохо контролируемой артериальной гипертензией, за исключением артериальной гипертензии, поддающейся стандартной медикаментозной терапии; гемодинамически значимым перикардиальным выпотом, поскольку эффективность и безопасность применения препарата у таких пациентов не изучены.
Адъювантная терапия
Не рекомендуется применять препарат Трастузумаб совместно в комбинации с антрациклинами в составе адъювантной терапии.
У пациентов с ранними стадиями РМЖ, получавших Трастузумаб после химиотерапии на основе антрациклинов, наблюдалось повышение частоты симптоматических и бессимптомных нежелательных явлений со стороны сердца по сравнению с таковыми, получавшими химиотерапию доцетакселом и карбоплатином (режимы, не содержащие препараты антрациклинового ряда). При этом разница была больше в случаях совместного применения препарата Трастузумаб и таксанов, чем при последовательном использовании. Независимо от использовавшегося режима, большинство симптоматических кардиальных явлений возникало в первые 18 месяцев лечения. В одном из 3 проведенных базовых исследований (с медианой периода последующего наблюдения 5,5 лет) наблюдалось продолжительное увеличение кумулятивной частоты симптоматических кардиальных явлений или явлений, связанных со снижением ФВЛЖ: у 2,37% пациентов, получавших Трастузумаб совместно с таксанами после терапии антрациклинами, по сравнению с 1% пациентов в группах сравнения (в группе терапии антрациклинами и циклофосфамидом, далее таксанами, и в группе терапии таксанами, карбоплатином и препаратом Трастузумаб). Идентифицированными факторами риска развития нежелательных явлений со стороны сердца при адъювантной терапии препаратом Трастузумаб являются: возраст >50 лет, низкая исходная ФВЛЖ (<55%) перед и после начала лечения паклитакселом, снижение ФВЛЖ на 10-15 единиц, предшествующий или сопутствующий прием антигипертензивных препаратов. Риск нарушения сердечной функции у пациентов, получавших Трастузумаб после завершения адъювантной химиотерапии, ассоциировался с более высокой суммарной дозой антрациклинов перед началом лечения препаратом Трастузумаб и с индексом массы тела (ИМТ) >25 кг/м2.
Неоадъювантная-адъювантная терапия
Для пациентов с ранними стадиями РМЖ, которым может быть назначена неоадъювантная-адъювантная терапия, применение препарата Трастузумаб совместно с антрациклинами рекомендовано только в случае если они ранее не получали химиотерапию и только при использовании низкодозовых режимов терапии антрациклинами (максимальная суммарная доза доксорубицина 180 мг/м2 или эпирубицина 360 мг/м2).
У пациентов, получивших полный курс низкодозовых антрациклинов и Трастузумаб в составе неоадъювантной терапии, не рекомендуется проведение дополнительной цитотоксической химиотерапии после проведения хирургического вмешательства. Во всех других случаях решение о необходимости дополнительной цитотоксической химиотерапии принимается на основании индивидуальных факторов.
Опыт применения трастузумаба совместно с низкодозовыми режимами терапии антрациклинами ограничен двумя исследованиями.
При применении препарата Трастузумаб в лекарственной форме для внутривенного введения совместно с неоадъювантной химиотерапией, включавшей три цикла доксорубицина (суммарная доза 180 мг/м2), в клиническом исследовании частота симптоматического нарушения функции сердца составила 1,7%.
При применении препарата Трастузумаб в лекарственной форме для внутривенного введения совместно с неоадъювантной химиотерапией, включавшей 4 цикла эпирубицина (суммарная доза 300 мг/м2), в клиническом исследовании частота застойной сердечной недостаточности составила 0% при медиане наблюдения в 40 месяцев.
Клинический опыт применения у пациентов в возрасте старше 65 лет ограничен. Инфузионные реакции и реакции гиперчувствительности
При введении препарата Трастузумаб возникали серьезные инфузионные реакции: одышка, артериальная гипотензия, хрипы в легких, артериальная гипертензия, бронхоспазм, суправентрикулярная тахиаритмия, снижение насыщения гемоглобина кислородом, анафилаксия, респираторный дистресс-синдром, крапивница и ангионевротический отек. Для снижения риска возникновения этих явлений может быть использована премедикация. Большинство этих реакций возникало во время инфузии или в течение 2,5 ч от начала первого введения. При возникновении инфузионной реакции следует остановить введение и тщательно наблюдать за пациентом до устранения всех симптомов. Для купирования этих симптомов возможно применение анальгетиков/антипиретиков, таких как парацетамол, или антигистаминных препаратов, таких как дифенгидрамин. Большинство пациентов после разрешения симптомов инфузионных реакций смогли продолжить терапию препаратом Трастузумаб.
Эффективная терапия серьезных реакций заключается в применении бета- адреностимуляторов, глюкокортикостероидов, ингаляции кислорода. В случае развития тяжелых и жизнеугрожающих инфузионных реакций следует рассмотреть вопрос о прекращении дальнейшей терапии препаратом Трастузумаб.
В редких случаях данные реакции ассоциировались с фатальным исходом. Риск развития летальных инфузионных реакций выше у пациентов с одышкой в покое, вызванной метастазами в легкие или сопутствующими заболеваниями, поэтому таким пациентам не следует проводить терапию препаратом Трастузумаб.
Сообщались случаи, при которых после первоначального улучшения наблюдалось ухудшение состояния, а также случаи с отсроченным стремительным ухудшением состояния. Летальный исход возникал в течение часов или одной недели после инфузии. В очень редких случаях у пациентов появлялись симптомы инфузионных реакций или легочные симптомы (через более чем 6 ч после начала введения препарата Трастузумаб). Следует предупредить пациентов о возможном отсроченном развитии этих симптомов и о необходимости немедленного контакта с лечащим врачом в случае их возникновения.
Нарушения со стороны легких
При применении препарата Трастузумаб в пострегистрационном периоде регистрировались тяжелые явления со стороны легких, которые иногда сопровождались летальным исходом. Кроме того, наблюдались случаи интерстициальной болезни легких (ИБЛ), включая легочные инфильтраты, острый респираторный дистресс-синдром, пневмонию, пневмонит, плевральный выпот, острый отек легких и дыхательную недостаточность. Факторы риска, ассоциированные с ИБЛ, включают: ранее проводимую или сопутствующую терапию другими противоопухолевыми препаратами, которые, как известно, связаны с ИБЛ (таксаны, гемцитабин, винорельбин и лучевая терапия). Данные явления могут возникать как проявления инфузионных реакций, так и отсрочено. Риск тяжелых реакций со стороны легких выше у пациентов с метастатическим поражением легких, сопутствующими заболеваниями, сопровождающимися одышкой в покое. Поэтому такие пациенты не должны получать препарат Трастузумаб. Следует соблюдать осторожность, особенно у пациентов, получающих сопутствующую терапию таксанами, из-за развития пневмонита.
Бензиловый спирт, содержащийся в качестве консерванта в бактериостатической воде для инъекций, прилагающейся к каждому многодозовому флакону 440 мг, оказывает токсическое действие у новорожденных и детей до 3 лет.
При применении препарата Трастузумаб у больного с гиперчувствительностью к бензиловому спирту препарат нужно растворять водой для инъекций, при этом из каждого многодозового флакона можно отбирать только одну дозу. Оставшийся препарат следует выбрасывать (инструкцию по утилизации см. выше).
Влияние на способность управлять автомобилем и работу с механизмами
Исследования по изучению влияния препарата на способность управлять автомобилем и работать с механизмами не проводились. В случае возникновения симптомов инфузионных реакций пациентам не следует управлять автомобилем или работать с механизмами до полного разрешения симптомов.
Форма выпуска
По 440 мг лиофилизата во флаконе, изготовленном из бесцветного стекла гидролитического класса I, укупоренном пробкой из хлорбутилкаучука, обжатой алюминиевым колпачком, и закрытом крышкой типа “flip-off’.
По 20 мл воды бактериостатической для инъекций во флаконе из бесцветного стекла, укупоренном пробкой из хлорбутилкаучука, покрытого фторкаучуком, обжатой алюминиевым колпачком, и закрытом крышкой типа “flip-off’.
1 флакон с лиофилизатом и 1 флакон с растворителем в поддоне вместе с инструкцией по применению в пачке картонной.
Хранить при температуре от 2°С до 8°С. Хранить в недоступном для детей месте.
3 года. Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту.
Держатель регистрационного удостоверения
Биокон Биолоджикс Лимитед
16 Грейт Куин Стрит
Конвент Гарден, Лондон WC2B 5АН
Великобритания
Производитель
Биокон Лимитед
Специальная экономическая зона, участок 2, 3, 4, 5, фаза IV, Боммасандра-Джигани Линк
Роуд, Боммасандра Пост,
г. Бангалор 560 099
Индия
