Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Вемурафениб
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Вемурафениб
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Вемурафениб
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Источники информации
-
Торговые названия с действующим веществом Вемурафениб
Структурная формула
Русское название
Вемурафениб
Английское название
Vemurafenib
Латинское название
Vemurafenibum (род. Vemurafenibi)
Химическое название
N-(3-{[5-(4-Хлорфенил)-1H-пирроло[2,3-b]пиридин-3-ил]карбонил}-2,4-дифторфенил)пропан-1-сульфонамид
Брутто формула
C23H18ClF2N3O3S
Фармакологическая группа вещества Вемурафениб
Нозологическая классификация
Код CAS
1029872-54-5
Фармакологическое действие
—
противоопухолевое.
Характеристика
Ингибитор BRAF-киназ с активирующими мутациями в кодоне 600.
RxList.com
Молекулярная масса 489,9, кристаллическое вещество от белого до не совсем белого цвета, практически нерастворимое в водных средах.
Фармакология
Фармакодинамика
Вемурафениб является ингибитором серин-треонинкиназы, кодируемой геном BRAF (v-raf murine sarcoma viral oncogene homolog B1). В результате мутаций в гене BRAF происходит конститутивная активация онкогенного белка BRAF и как следствие — пролиферация клеток при отсутствии факторов роста.
Согласно проведенным биохимическим исследованиям, вемурафениб является мощным ингибитором BRAF-киназ с активирующими мутациями в кодоне 600.
Данный ингибирующий эффект был подтвержден в ходе реакции фосфорилирования внеклеточной сигналрегулирующей киназы и клеточной антипролиферации в доступных клеточных линиях меланомы, экспрессирующих ген BRAF с мутациями V600. В тестах антипролиферации в клеточных линиях с мутациями V600 (линии V600E, V600R, V600D и V600K) концентрация полумаксимального ингибирования (IC50) варьировала от 0,016 до 1,131 мкмоль, в то время как IС50 в отношении клеточных линий гена BRAF дикого типа составляла 12,06 и 14,32 мкмоль соответственно.
Фармакокинетика
Вемурафениб — вещество с низкой растворимостью и проницаемостью (класс 4 по системе биофармацевтической классификации). Фармакокинетические параметры вемурафениба оценивали методом некомпартментного анализа, а также с помощью популяционного фармакокинетического анализа. Фармакокинетика вемурафениба имеет дозозависимый характер в диапазоне от 240 до 960 мг при приеме 2 раза в сутки. Линейность фармакокинетики также подтверждена данными популяционного фармакокинетического анализа.
Всасывание. Абсолютная биодоступность вемурафениба в виде таблеток 240 мг неизвестна. При приеме вемурафениба в однократной дозе 960 мг Тmax составляет приблизительно 4 ч. При многократном приеме вемурафениба в дозе 960 мг 2 раза в день наблюдается накопление ЛС, которое характеризуется высокой межиндивидуальной вариабельностью. Средние показатели AUC0–8 и Сmax (± стандартное отклонение) в 1-е сут составили (22,1±12,7) мкг·ч/мл и (4,1±2,3) мкг/мл соответственно. В ходе некомпартментного анализа при приеме вемурафениба в дозе 960 мг 2 раза в день AUC на 15-е сут увеличивалась в 15–17 раз по сравнению с AUC в 1-е сут, Сmax на 15-е сут увеличилась в 13–14 раз по сравнению с Сmax в 1-е сут. В равновесном состоянии AUC0–8 и Сmax составили (380,2±143,6) мкг·ч/мл и (56,7±21,8) мкг/мл соответственно.
Пища, богатая жирами, повышает экспозицию вемурафениба при однократном применении в дозе 960 мг. Средние геометрические показатели Сmax и AUC увеличивались при приеме вемурафениба с пищей по сравнению с приемом натощак в 2,5 и с 4,6 до 5,1 раза соответственно. Медиана Тmax увеличивалась с 4 до 7,5 ч при однократном приеме вемурафениба с пищей. Данные по влиянию приема пищи на экспозицию вемурафениба в равновесном состоянии отсутствуют. Продолжительный прием вемурафениба натощак может привести к значимому снижению экспозиции вемурафениба в равновесном состоянии по сравнению с приемом вемурафениба с пищей или незадолго до приема пищи. Ожидается, что при нерегулярном приеме вемурафениба натощак экспозиция вемурафениба в равновесном состоянии изменится незначительно ввиду высокой степени накопления вемурафениба в равновесном состоянии. Безопасность и эффективность вемурафениба в опорных исследованиях были изучены у пациентов, принимавших вемурафениб как с пищей, так и отдельно от приема пищи.
Возможно изменение экспозиции вемурафениба в зависимости от состава, объема и кислотности (pH) жидкости ЖКТ, моторики и времени прохождения пищи, состава желчи.
В равновесном состоянии (достигается на 15-е сут у 80% пациентов) средняя экспозиция вемурафениба в плазме крови характеризуется стабильностью на протяжении 24 ч, о чем свидетельствует среднее соотношение концентрации в плазме крови до и через 2–4 ч после приема утренней дозы, равное 1,13.
После перорального приема константа скорости всасывания у пациентов с метастатической меланомой составляет 0,19 ч-1 (межиндивидуальная вариабельность 101%).
Распределение. По данным популяционного анализа, кажущийся Vd вемурафениба у пациентов с метастатической меланомой составляет 91 л (межиндивидуальная вариабельность 64,8%). Вемурафениб характеризуется высокой степенью связывания с белками плазмы крови человека in vitro (более 99%).
Метаболизм. Изофермент цитохрома P450 (CYP3А4) — основной фермент, участвующий в метаболизме вемурафениба in vitro. У человека также обнаружены продукты конъюгации с глюкуроновой кислотой и продукты гликозилирования. Соотношение вемурафениба и его метаболитов было изучено в ходе клинического исследования после однократного приема вемурафениба с 14C-радиоактивной меткой. В плазме крови вемурафениб содержится преимущественно в неизмененном виде (>95%), тогда как метаболиты составляют не более 5%.
Выведение. По данным популяционного анализа, кажущийся клиренс вемурафениба у пациентов с метастатической меланомой составляет 29,3 л/день (межиндивидуальная вариабельность 31,9%), медиана T1/2 вемурафениба составляет 51,6 ч (диапазон индивидуальных значений между 5-м и 95-м перцентилем составляет 29,8–119,5 ч).
Согласно исследованию, в среднем 95% дозы вемурафениба выводится в течение 18 дней. Большая часть (94%) вемурафениба в неизмененном виде и в виде метаболитов выводится кишечником, менее 1% — почками. Выведение препарата в неизмененном виде с желчью может быть важным путем выведения. Однако поскольку абсолютная биодоступность вемурафениба неизвестна, значение влияния печеночной и почечной экскреции на его клиренс в неизмененном виде также не может быть оценено. Вемурафениб является субстратом и ингибитором P-gp in vitro.
Фармакокинетика у особых групп пациентов
Пациенты пожилого возраста. Согласно результатам популяционного фармакокинетического анализа, возраст пациентов не оказывает статистически значимое влияние на фармакокинетические параметры вемурафениба.
Пол. Согласно результатам популяционного фармакокинетического анализа, у мужчин кажущийся клиренс вемурафениба больше на 17%, а кажущийся Vd — на 48% по сравнению с женщинами. При этом различия в экспозиции вемурафениба относительно невелики, что указывает на отсутствие необходимости корректировать дозу в зависимости от пола пациента, индекса массы тела или массы тела.
Пациенты детского возраста и подростки. Исследования фармакокинетики вемурафениба у пациентов детского возраста и подростков не проводились.
Пациенты с нарушением функции почек. Согласно результатам популяционного фармакокинетического анализа данных пациентов с метастатической меланомой, легкая и средняя степень почечной недостаточности (Cl креатинина >40 мл/мин) не оказывает влияние на кажущийся клиренс вемурафениба. Клинические данные и данные по фармакокинетике у пациентов с тяжелой степенью почечной недостаточности не позволяют определить необходимость коррекции дозы.
Пациенты с нарушением функции печени. Вемурафениб преимущественно выводится с желчью. Согласно результатам популяционного фармакокинетического анализа данных пациентов с метастатической меланомой, повышение активности ACT и АЛТ до значения, в 3 раза превышающего ВГН, не оказывает влияние на кажущийся клиренс вемурафениба. Клинические данные и данные по фармакокинетике у пациентов с тяжелой степенью печеночной недостаточности не позволяют определить влияние нарушения метаболической или экскреторной функции печени на фармакокинетику вемурафениба.
Применение вещества Вемурафениб
Неоперабельная или метастатическая меланома с BRAF V600 мутацией у взрослых пациентов в виде монотерапии.
Противопоказания
Повышенная чувствительность к вемурафенибу, беременность и период грудного вскармливания, детский возраст до 18 лет (эффективность и безопасность применения не установлены), не поддающиеся коррекции нарушения водно-электролитного баланса (в т.ч. дисбаланс магния), синдром удлиненного интервала QT, прием ЛС, способствующих удлинению интервала QT, корригированный интервал QT (QTc) >500 мс до начала терапии, тяжелая степень почечной и печеночной недостаточности.
Ограничения к применению
Одновременный прием с варфарином, мощными ингибиторами и индукторами изофермента CYP3A4, глюкуронирования и/или транспортных белков (включая P-gp и гликопротеин), ЛС, являющимися субстратами изофермента CYP1A2; совместное применение с субстратами изофермента CYP2C8 с узким терапевтическим диапазоном (см. «Взаимодействие»).
Применение при беременности и кормлении грудью
RxList.com
Исходя из механизма действия, вемурафениб может вызвать повреждение плода при применении у беременных женщин (см. «Меры предосторожности»). Адекватные и надлежащим образом контролируемые исследования у беременных женщин не проводились. Женщины репродуктивного возраста и мужчины должны быть предупреждены о необходимости использовать соответствующие методы контрацепции во время терапии вемурафенибом и по крайней мере в течение 2 мес после отмены лечения. Если вемурафениб применяется в период беременности или беременность наступила во время лечения, пациентка должна быть предупреждена о потенциальной опасности для плода.
Нет данных об экскреции вемурафениба в грудное молоко человека. Поскольку многие ЛС экскретируются в грудное молоко человека и вемурафениб может вызвать серьезные побочные реакции у ребенка, следует принять решение о прекращении грудного вскармливания или об отмене ЛС, учитывая важность этого ЛС для матери.
Побочные действия вещества Вемурафениб
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (больше или равно 10%); часто (больше или равно 1% и <10%); нечасто (больше или равно 0,1% и <1%); редко (больше или равно 0,01% и <0,1%); очень редко (<0,01%).
Наиболее частыми нежелательными реакциями (>30%) при применении вемурафениба были артралгия, повышенная утомляемость, сыпь, реакция фотосенсибилизации, тошнота, диарея, алопеция, зуд и папиллома кожи. Сообщалось об очень частых случаях плоскоклеточной карциномы кожи, лечение, как правило, было хирургическим.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): очень часто — плоскоклеточная карцинома кожи, себорейный кератоз, папиллома кожи; часто — базальноклеточный рак, новые первичные меланомы; нечасто — плоскоклеточная карцинома некожной локализации.
Со стороны обмена веществ: очень часто — снижение аппетита, снижение массы тела.
Со стороны нервной системы: очень часто — головная боль, дисгевзия (искажение вкусовых восприятий), периферическая нейропатия; часто — паралич лицевого нерва, головокружение.
Со стороны органа зрения: часто — увеит, включая ирит; нечасто — окклюзия вен сетчатки.
Со стороны сосудов: нечасто — васкулит.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — кашель.
Со стороны ЖКТ: очень часто — диарея, рвота, тошнота, запор.
Со стороны кожи и подкожных тканей: очень часто — реакция фотосенсибилизации, актинический кератоз, сыпь, макулопапулезная сыпь, папулезная сыпь, зуд, гиперкератоз, эритема, алопеция, сухость кожи, солнечный ожог, синдром ладонно-подошвенной эритродизестезии; часто — панникулит, включая узловатую эритему, фолликулярный кератоз, фолликулит; нечасто — токсический эпидермальный некролиз, синдром Стивенса-Джонсона.
Со стороны скелетно-мышечной и соединительной ткани: очень часто — артралгия, миалгия, боли в конечностях, костно-мышечная боль, боли в спине, артрит.
Прочие: очень часто — повышенная утомляемость, лихорадка, периферические отеки, астения.
Лабораторные и инструментальные данные: очень часто — повышение активности ГГТП**; часто — повышение активности АЛТ*, ЩФ*, повышение концентрации билирубина*; нечасто — повышение активности ACT**.
* 3-й степени тяжести.
** 3-й или 4-й степени тяжести.
Реакции гиперчувствительности. При применении вемурафениба сообшалось о случаях серьезных реакций гиперчувствительности, в т.ч. анафилаксии. Тяжелые реакции гиперчувствительности могут включать генерализованную сыпь, эритему или артериальную гипотензию. При развитии тяжелых реакций гиперчувствительности дальнейший прием вемурафениба следует прекратить.
Пострегистрационное применение
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): частота неизвестна — прогрессирование предшествующего хронического миеломоноцитарного лейкоза с мутацией в гене NRAS (частота неизвестна), прогрессирование предшествующей аденокарциномы поджелудочной железы с мутацией в гене KRAS.
Со стороны кожи и подкожных тканей: частота неизвестна — лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром).
Со стороны печени и желчевыводящих путей: нечасто — поражение печени.
Со стороны ЖКТ: нечасто — панкреатит.
Со стороны крови и лимфатической системы: нечасто — нейтропения.
Травмы, интоксикации и осложнения манипуляций: частота неизвестна — лучевая болезнь, включая лучевой дерматит, лучевое поражение кожи, лучевой пневмонит, лучевой эзофагит, лучевой проктит, лучевой гепатит, лучевой цистит и лучевой некроз (см. «Меры предосторожности»).
Лабораторные и инструментальные данные: отклонения лабораторных параметров, характеризующих функции печени, включая повышение активности АЛТ (в 5 и более раз выше ВГН), ЩФ (в 2 и более раза выше ВГН), АЛT (в 3 и более раза выше ВГН) с одновременным повышением концентрации билирубина (более чем в 2 раза выше ВГН).
Особые популяции больных
Пациенты пожилого возраста. У пациентов в возрасте 65 и более лет более вероятно развитие нежелательных реакций, в т.ч. таких как плоскоклеточная карцинома кожи, снижение аппетита и нарушения со стороны сердца.
Пол. При применении вемурафениба среди нежелательных реакций 3-й степени тяжести, наблюдавшихся более часто у женщин, чем у мужчин, были сыпь, артралгия и фотосенсибилизация.
RxList.com
Следующие побочные реакции описаны более подробно в других разделах данного описания:
— новая первичная меланома (см. «Меры предосторожности»);
— реакции гиперчувствительности (см. «Меры предосторожности»);
— дерматологические реакции (см. «Меры предосторожности»);
— пролонгация QT (см. «Меры предосторожности»);
— гепатотоксичность (см. «Меры предосторожности»);
— фоточувствительность (см. «Меры предосторожности»);
— офтальмологические реакции (см. «Меры предосторожности»);
— чувствительность к радиации и радиационный ответ (см. «Меры предосторожности»).
Результаты клинических испытаний
Так как клинические испытания проведены с различным набором условий, частота встречаемости побочных реакций, наблюдавшихся в этих исследованиях, может не совпадать с полученной в других исследованиях и с наблюдаемой в клинической практике.
Ниже приведены данные о побочных реакциях, полученные на основе анализа результатов исследований 1 и 2. Исследование 1 (рандомизированное 1:1) было проведено с участием 675 пациентов с нерезектабельной или метастатической меланомой, ранее не получавших лечение, которым назначали вемурафениб перорально в дозе 960 мг 2 раза в день или дакарбазин в/в 1000 мг/м2 каждые 3 нед. В исследовании 2 участвовали 132 пациента с метастатической меланомой, имевшие опыт по крайней мере одной неудавшейся ранее системной терапии, которым назначали лечение вемурафенибом в дозе 960 мг 2 раза в день.
Чаще всего побочными реакциями любой степени тяжести (более или равно 30% в каждом исследовании) при лечении вемурафенибом были артралгия, сыпь, алопеция, повышенная утомляемость, реакция фоточувствительности, тошнота, зуд и папиллома кожи. Наиболее распространенными побочными реакциями 3-й степени тяжести (более или равно 5%) были плоскоклеточный рак кожи и сыпь. Частота случаев побочных реакций 4-й степени тяжести — менее или равна 4% в обоих исследованиях. Доля побочных реакций, приведших к отмене лечения в исследовании 1, составила 7% в группе получавших вемурафениб и 4% в группе получавших дакарбазин; в исследовании 2 отмена вемурафениба из-за побочных реакций потребовалась у 3% пациентов, участвовавших в испытании. Медиана продолжительности терапии составила 4,2 мес для вемурафениба и 0,8 мес для дакарбазина в исследовании 1 и 5,7 мес для вемурафениба в исследовании 2.
Побочные реакции, зарегистрированные в исследованиях 1 и 2 с частотой более или равно 10%, перечислены ниже. Данные приведены в процентах, первая цифра — все степени тяжести, в скобках — доля побочных реакций 3-й степени тяжести (побочные реакции 4-й степени тяжести ограничивались увеличением уровня ГГТ и составили менее 1% в исследовании 1 и 4% в исследовании 2). Термины приведены в редакции MedDRA, классификация — в соответствии с рекомендациями NCI-CTCAE, версия 4.0.
Исследование 1. Пациенты с нерезектабельной или метастатической меланомой, ранее не получавшие лечение, которым назначали вемурафениб (N=336) или дакарбазин (N=287)
Со стороны кожи и подкожной ткани: сыпь 37% (8%) и 2% (0%), реакция фоточувствительности 33% (3%) и 4% (0%), алопеция 45% (<1%) и 2% (0%), зуд 23% (1%) и 1% (0%), гиперкератоз 24% (1%) и <1% (0%), макулопапулезная сыпь 9% (2%) и <1% (0%), актинический кератоз 8% (0%) и 3% (0%), сухость кожи 19% (0%) и 1% (0%), папулезная сыпь 5% (<1%) и 0% (0%), эритема 14% (0%) и 2% (0%).
Со стороны скелетно-мышечной системы и соединительной ткани: артралгия 53% (4%) и 3% (<1%), миалгия 13% (<1%) и 1% (0%), боль в конечностях 18% (<1%) и 6% (2%), костно-мышечная боль 8% (0%) и 4% (<1%), боль в спине 8% (<1%) и 5% (<1%).
Общие расстройства и реакции в месте применения: повышенная утомляемость 38% (2%) и 33% (2%), периферический отек 17% (<1%) и 5% (0%), гипертермия 19% (<1%) и 9% (<1%), астения 11% (<1%) и 9% (<1%).
Со стороны ЖКТ: тошнота 35% (2%) и 43% (2%), диарея 28% (<1%) и 13% (<1%), рвота 18% (1%) и 26% (1%), запор 12% (<1%) и 24% (0%).
Со стороны нервной системы: головная боль 23% (<1%) и 10% (0%), дисгевзия 14% (0%) и 3% (0%).
Доброкачественные, злокачественные и неспецифические новообразования (включая кисты и полипы): папиллома кожи 21% (<1%) и 0% (0%), кожная сквамозная клеточная карцинома (включая как сквамозную клеточную карциному кожи, так и кератоакантому; случаи кожной сквамозной клеточной карциномы по протоколу оценивались как 3-й степени тяжести) 24% (22%) и <1% (<1%), себорейный кератоз 10% (<1%) и 1% (0%).
Данные лабораторных и инструментальных исследований: увеличение уровня ГГТ 5% (3%) и 1% (0%).
Со стороны обмена веществ и нарушения питания: снижение аппетита 18% (0%) и 8% (<1%).
Со стороны дыхательной системы, органов грудной клетки и средостения: кашель 8% (0%) и 7% (0%).
Повреждения, отравления или процедурные осложнения: солнечный ожог 10% (0%) и 0% (0%).
Исследование 2. Пациенты с метастатической меланомой, имевшие опыт по крайней мере одной неудавшейся ранее системной терапии, которым назначали лечение вемурафенибом (N=132)
Со стороны кожи и подкожной ткани: сыпь 52% (7%), реакция фоточувствительности 49% (3%), алопеция 36% (0%), зуд 30% (2%), гиперкератоз 28% (0%), макулопапулезная сыпь 21% (6%), актинический кератоз 17% (0%), сухость кожи 16% (0%), папулезная сыпь 13% (0%), эритема 8% (0%).
Со стороны скелетно-мышечной системы и соединительной ткани: артралгия 67% (8%), миалгия 24% (<1%), боль в конечностях 9% (0%), костно-мышечная боль 11% (0%), боль в спине 11% (<1%).
Общие расстройства и реакции в месте применения: повышенная утомляемость 54% (4%), периферический отек 23% (0%), гипертермия 17% (0%), астения 2% (0%).
Со стороны ЖКТ: тошнота 37% (2%), диарея 29% (<1%), рвота 26% (2%), запор 16% (0%).
Со стороны нервной системы: головная боль 27% (0%), дисгевзия 11% (0%).
Доброкачественные, злокачественные и неспецифические новообразования (включая кисты и полипы): папиллома кожи 30% (0%), плоскоклеточный рак кожи (включая как сквамозную клеточную карциному кожи, так и кератоакантому; случаи кожной сквамозной клеточной карциномы по протоколу оценивались как 3-й степени тяжести) 24% (24%), себорейный кератоз 14% (0%).
Данные лабораторных и инструментальных исследований: увеличение уровня ГГТ 15% (6%).
Со стороны обмена веществ и нарушения питания: снижение аппетита 21% (0%).
Со стороны дыхательной системы, органов грудной клетки и средостения: кашель 12% (0%).
Повреждения, отравления или процедурные осложнения: солнечный ожог 14% (0%).
Клинически значимые побочные реакции зарегистрированные у <10% пациентов, получавших вемурафениб на 2-й и 3-й стадии клинических испытаний, включают:
— со стороны кожи и подкожной ткани: синдром ладонно-подошвенной эритродизестезии, фолликулярный кератоз, панникулит, узловатая эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз;
— со стороны скелетно-мышечной системы и соединительной ткани: артрит;
— со стороны нервной системы: периферическая нейропатия, паралич лицевого нерва;
— доброкачественные, злокачественные и неспецифические новообразования (включая кисты и полипы): базальноклеточный рак, орофарингеальная сквамозная клеточная карцинома;
— инфекции и инвазии: фолликулит;
— со стороны органа зрения: окклюзия вен сетчатки;
— сосудистые нарушения: васкулит;
— сердечные нарушения: атриальная фибрилляция.
Данные о частоте случаев ухудшения лабораторных показателей печени в исследовании 1, суммированные как доля пациентов с изменением этих показателей от исходного уровня до 3-й или 4-й степени тяжести: ГГТ 11,5 и 8,6%, АСТ 0,9 и 0,4%, АЛТ 2,8 и 1,9%, ЩФ 2,9 и 0,4%, билирубин 1,9 и 0%. Показатели АЛТ, ЩФ и билирубина не ухудшались до 4-й степени тяжести в обеих группах пациентов, участвовавших в исследовании 1. Данные приведены в процентах, первая цифра — доля пациентов в группе получавших вемурафениб, вторая — в группе получавших дакарбазин.
Данные постмаркетингового применения. В период после официального разрешения к медицинскому применению вемурафениба были отмечены приведенные ниже побочные реакции (данные на 30.09.2015). Поскольку данные сообщения о побочных реакциях поступили в добровольном порядке от популяции неустановленного размера, не всегда представляется возможным реально оценить их частоту и установить причинную связь с применением лекарства.
Доброкачественные, злокачественные и неспецифические новообразования (включая кисты и полипы): прогрессирование предшествующего хронического миеломоноцитарного лейкоза с мутацией гена NRAS (см. «Меры предосторожности»).
Со стороны кожи и подкожной ткани: лекарственная реакция с эозинофилией и системными симптомами (DRESS-синдром).
Со стороны крови и лимфатической системы: нейтропения.
Повреждения, отравления или процедурные осложнения: повышение чувствительности и ответа к лучевой терапии.
Со стороны ЖКТ: панкреатит.
Взаимодействие
Взаимодействие вемурафениба и субстратов цитохрома Р450 (CYP). Результаты исследования лекарственных взаимодействий in vivo, проведенного с участием пациентов с метастатической меланомой, свидетельствуют о том, что вемурафениб является умеренным ингибитором изофермента CYP1А2 и индуктором изофермента CYP3A4. Вемурафениб может уменьшать экспозицию веществ, метаболизирующихся преимущественно при участии изофермента CYP3A4. В связи с этим возможно уменьшение эффективности контрацептивных ЛС, метаболизирующихся при участии изофермента CYP3A4.
Одновременное применение вемурафениба с ЛС, метаболизирующимися посредством изоферментов CYP1А2 и CYP3A4 и обладающими узким терапевтическим индексом не рекомендуется. При невозможности избежать их совместного применения следует соблюдать осторожность, поскольку вемурафениб может увеличивать экспозицию ЛС — субстратов изофермента СYP1A2 — и снижать экспозицию ЛС — субстратов изофермента CYP3A4 — в плазме крови. При необходимости рекомендуется снижение дозы ЛС, являющегося субстратом изофермента CYP1А2. В ходе проведения клинического исследования было выявлено, что совместное применение с вемурафенибом повышает AUC кофеина (субстрат изофермента СYP1A2) в среднем в 2,6 раза (максимально в 5 раз), тогда как AUC мидазолама (субстрат изофермента CYP3A4) снижается в среднем на 39% (максимально до 80%). AUC декстрометорфана (субстрат CYP2D6) и его метаболита декстрофана увеличивалась приблизительно на 47% вследствие эффекта на кинетику декстрометорфана, который может не быть опосредован ингибированием изофермента CYP2D6.
В исследовании in vitro вемурафениб в концентрации 10 мкмолей вызывал слабое ингибирование изофермента CYP2B6. Неизвестно, будет ли вемурафениб при достижении Css 100 мкмолей в крови пациентов (примерно 50 мкг/мл) уменьшать содержание субстратов изофермента CYP2B6, таких как бупропион, при их одновременном применении.
Одновременное применение вемурафениба и варфарина (субстрат изофермента CYP2C9) может приводить к увеличению AUC последнего на 18%. Следует соблюдать осторожность и предусмотреть дополнительный мониторинг МНО в случае, если вемурафениб используется одновременно с варфарином. В ходе исследований in vitro было показано, что вемурафениб является умеренным ингибитором изофермента СYP2C8. Значение данного наблюдения для человека неизвестно, однако риск клинически значимого влияния на субстраты изофермента CYP2C8 при совместном применении не может быть исключен. Следует соблюдать осторожность при совместном применении вемурафениба и субстратов изофермента CYP2C8 с узким терапевтическим диапазоном, поскольку вемурафениб может повышать концентрацию последних.
Во избежание взаимодействий с ЛС после прекращения применения вемурафениба может потребоваться период вымывания продолжительностью 8 дней.
Взаимодействие вемурафениба с переносчиками ЛС. В ходе исследований in vitro было показано, что вемурафениб является субстратом и ингибитором P-gp и BCRP (breast cancer resistance protein, белок устойчивости рака молочной железы). Клиническое значение этих данных неизвестно.
Нельзя исключать, что при одновременном применении с вемурафенибом возможно повышение экспозиции ЛС, транспортируемых при помощи P-gp (например алискирен, колхицин, дигоксин, эверолимус, фексофенадин) или BCRP (например метотрексат, митоксантрон, розувастатин). В ходе клинического исследования лекарственного взаимодействия с применением дигоксина (субстрат P-gp) было выявлено, что при использовании многократных пероральных доз вемурафениба (960 мг 2 раза в день) увеличивалась экспозиция однократной пероральной дозы дигоксина (увеличение общей системной экспозиции (AUClast) и Cmax дигоксина в 1,8 и 1,5 раза соответственно). Необходимо соблюдать осторожность при одновременном применении вемурафениба и субстратов P-gp. В случае необходимости рекомендуется снизить дозу сопутствующего ЛС — субстрата P-gp.
В ходе исследований in vitro было показано, что вемурафениб является ингибитором белка BSEP (Bile Salt Export Pump, экспортирующая помпа желчных кислот). Клиническое значение этих данных неизвестно.
Данные о влиянии вемурафениба на другие переносчики отсутствуют.
Влияние сопутствующих препаратов на вемурафениб. В исследованиях in vitro показано, что метаболизм вемурафениба происходит при участии изофермента CYP3A4 и путем глюкуронирования. Следует соблюдать осторожность при одновременном применении вемурафениба и мощных ингибиторов изофермента CYP3A4, глюкуронирования и/или транспортных белков (например ритонавир, саквинавир, телитромицин, кетоконазол, итраконазол, вориконазол, позаконазол, нефазодон, атазанавир).
Следует также избегать одновременного применения вемурафениба с мощными индукторами P-gp, глюкуронирования, изофермента CYP3A4 (например рифампицин, рифабутин, карбамазепин, фенитоин или зверобой продырявленный) из-за возможного снижения экспозиции вемурафениба.
В исследованиях in vitro показано, что вемурафениб является субстратом P-gp и BCRP. Данные по влиянию индукторов или ингибиторов P-gp и BCRP на экспозицию вемурафениба отсутствуют. Нельзя исключить, что на фармакокинетические параметры вемурафениба могут оказывать влияние препараты, ингибирующие или влияющие на P-gp (например верапамил, кларитромицин, циклоспорин, ритонавир, хинидин, дронедарон, амиодарон, итраконазол, ранолазин) и BCRP (циклоспорин, гефитиниб). Данные о том, является ли вемурафениб субстратом для других переносчиков, отсутствуют.
Усиление действия лучевой терапии. У пациентов, получающих вемурафениб, наблюдалось усиление токсического действия лучевой терапии (см. «Меры предосторожности» и «Побочные действия» Пострегистрационное применение). В большинстве случаев пациенты получали лучевую терапию в режиме не менее 2 Гр/сут (гипофракционный режим).
RxList.com
Влияние сильных ингибиторов или индукторов CYP3A4 на вемурафениб. По данным, полученным in vitro, вемурафениб является субстратом CYP3A4, следовательно, совместное применение сильных ингибиторов или индукторов CYP3A4 может изменить концентрацию вемурафениба в плазме крови. Следует избегать совместного назначения вемурафениба с сильными ингибиторами CYP3A4 (например кетоконазол, итраконазол, кларитромицин, атазанавир, нефазодон, саквинавир, телитромицин, ритонавир, индинавир, нелфинавир, вориконазол) или сильными индукторами CYP3A4 (например фенитоин, карбамазепин, рифампицин, рифабутин, рифапентин, фенобарбитал) и по возможности применять альтернативные ЛС.
Влияние вемурафениба на субстраты CYP1A2. Совместное применение вемурафениба с ЛС, имеющими узкий терапевтический диапазон и метаболиризующимися преимущественно посредством CYP1A2 не рекомендуется, т.к. вемурафениб может увеличивать концентрации субстратов CYP1A2. Если подобного сочетания нельзя избежать, следует осуществлять контроль за токсическими реакциями и рассмотреть возможность уменьшения дозы совместно применяемых субстратов CYP1A2.
Влияние вемурафениба на субстраты P-gp. Совместное применение вемурафениба с дигоксином — чувствительным субстратом P-gp — увеличивает системную экспозицию дигоксина в 1,9 раза. Следует избегать совместного назначения субстратов P-gp с узким терапевтическим диапазоном. Если применения таких ЛС нельзя избежать, следует уменьшить дозу субстрата P-gp с узким терапевтическим диапазоном.
Передозировка
Специфического антидота, который можно было бы использовать в случаях передозировки вемурафениба, не существует. При появлении нежелательных реакций необходимо назначить соответствующее симптоматическое лечение. Дозолимитирующая токсичность вемурафениба проявлялась в виде сыпи с зудом и повышенной утомляемости. При подозрении на передозировку необходимо прекратить прием вемурафениба и назначить поддерживающую терапию.
Способ применения и дозы
Внутрь, независимо от приема пищи, рекомендуемая доза 960 мг 2 раза в день. Суточная доза — 1920 мг.
Меры предосторожности
Перед применением вемурафениба пациенты должны пройти валидированный тест на наличие BRAF мутации V600. Эффективность и безопасность вемурафениба у пациентов, опухоли которых несут редкие BRAF мутации V600, отличные от V600E и V600K, не была убедительно доказана. Вемурафениб не следует применять у пациентов со злокачественной меланомой, экспрессирующей BRAF дикого типа.
Реакции гиперчувствительности. При применении вемурафениба сообщалось о случаях серьезных реакций гиперчувствительности, в т.ч. анафилаксии. Тяжелые реакции гиперчувствительности могут включать генерализованную сыпь, эритему или артериальную гипотензию. При развитии тяжелых реакций гиперчувствительности дальнейший прием вемурафениба следует прекратить.
Дерматологические реакции. При применении вемурафениба в опорном клиническом исследовании сообщалось о тяжелых дерматологических реакциях, включая редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза. Зарегистрированы случаи появления лекарственной сыпи с эозинофилией и системными симптомами (DRESS-синдрома) на фоне применения вемурафениба.
При развитии тяжелых дерматологических реакций дальнейший прием вемурафениба следует прекратить.
Усиление действия лучевой терапии. У пациентов, получающих лучевую терапию до, во время или после применения вемурафениба, отмечались случаи повышения чувствительности к лучевой терапии и лучевой дерматит (см. «Взаимодействие» и «Побочные действия», Пострегистрационное применение). Необходимо соблюдать осторожность при применении вемурафениба одновременно или последовательно с лучевой терапией.
Удлинение интервалы QT. При применении вемурафениба наблюдалось удлинение интервала QT, пропорциональное экспозиции вемурафениба. Удлинение интервала QT может способствовать увеличению риска возникновения желудочковых аритмий, включая желудочковую тахикардию типа «пируэт». Применение вемурафениба не рекомендуется у пациентов с неподдающимися коррекции нарушениями водно-электролитного баланса (в т.ч. баланс магния), синдромом удлиненного интервала QT, а также у пациентов, получающих ЛС, способствующие удлинению интервала QT.
ЭКГ и исследование водно-электролитного баланса (в т.ч. дисбаланс магния) необходимо выполнить перед началом приема и после изменения дозы вемурафениба. В дальнейшем регистрацию ЭКГ и определение содержания электролитов рекомендуется проводить ежемесячно в течение первых 3 мес приема вемурафениба, а затем через каждые 3 мес или чаще при наличии клинических симптомов. Если интервал QTc >500 мс, начинать прием вемурафениба не рекомендуется. Если во время лечения интервал QTc составит >500 мс, необходимо временно прервать прием вемурафениба, устранить нарушения водно-электролитного баланса (в т.ч. баланса магния) и добиться коррекции факторов риска удлинения интервала QT (например ХСН, брадиаритмия). После уменьшения интервала QTc до значения, составляющего <500 мс, следует возобновить прием вемурафениба в более низкой дозе. Если после коррекции сопутствующих факторов риска значение интервала QTc составляет >500 мс и отличается от исходного, зарегистрированного перед началом приема, более чем на 60 мс, прием вемурафениба необходимо прекратить.
Офтальмологические реакции. При применении вемурафениба были зарегистрированы серьезные офтальмологические реакции, включавшие увеит (в т.ч. ирит) и окклюзию вен сетчатки. Лечащему врачу рекомендуется регулярно наблюдать за пациентом на предмет развития офтальмологических реакций.
Совместное применение с ипилимумабом. При совместном применении вемурафениба (960 или 720 мг 2 раза в день) с ипилимумабом (3 мг/кг) были зарегистрированы бессимптомное повышение активности трансаминаз и концентрации билирубина 3-й степени тяжести. На основании этих данных совместное применение вемурафениба и ипилимумаба не рекомендуется.
Злокачественные новообразования
Плоскоклеточная карцинома кожи. У пациентов, получавших вемурафениб, описаны случаи развития плоскоклеточной карциномы кожи, в т.ч. случаи, классифицированные как кератоакантома и смешанная кератоакантома. Всем пациентам рекомендуется пройти обследование у дерматолога перед началом приема вемурафениба. При возникновении любых подозрительных поражений кожи их необходимо иссечь, направить на дерматопатологическое исследование и провести терапию в соответствии с местными стандартами оказания медицинской помощи. При развитии у пациента плоскоклеточной карциномы кожи рекомендуется продолжить лечение вемурафенибом без коррекции дозы. Врач должен проводить обследование пациента ежемесячно во время терапии и в течение 6 мес после лечения вемурафенибом или до начала другой противоопухолевой терапии. Пациенты должны быть проинструктированы о необходимости информировать врача о появлении любых изменений на коже.
Плоскоклеточная карцинома другой (некожной) локализации. У пациентов, получавших вемурафениб, зарегистрированы случаи развития плоскоклеточной карциномы другой локализации. Перед началом приема вемурафениба необходимо провести обследование головы и шеи, состоящее как минимум из визуального осмотра слизистой оболочки полости рта и пальпации лимфатических узлов, и повторять это обследование через каждые 3 мес во время приема вемурафениба. Кроме того, перед началом приема вемурафениба необходимо выполнить компьютерную томографию органов грудной клетки, а во время приема повторять это обследование через каждые 6 мес.
Перед началом приема вемурафениба и по завершении терапии или при наличии клинических симптомов рекомендуется проводить исследования органов малого таза (у женщин) и прямой кишки.
После прекращения приема вемурафениба обследование с целью выявления плоскоклеточной карциномы другой локализации необходимо продолжать в течение 6 мес или до начала другой противоопухолевой терапии. Выявленные патологические изменения следует вести в соответствии с клиническом практикой.
Новый очаг первичной меланомы. При применении вемурафениба были зарегистрированы случаи возникновения новых очагов первичной меланомы. Вo всех случаях лечение было хирургическим, и пациенты продолжили терапию без коррекции дозы. Обследование на предмет поражений кожи следует проводить в соответствии с рекомендациями, приведенными выше для плоскоклеточной карциномы кожи.
Другие злокачественные новообразования. Исходя из механизма действия, вемурафениб может вызывать прогрессирование злокачественных новообразований, ассоциированных с мутациями в гене RAS. Требуется тщательно рассмотреть вопрос об отношении ожидаемой пользы к возможному риску применения вемурафениба у пациентов с ранее перенесенными или сопутствующими злокачественными новообразованиями, ассоциированными с мутациями в гене RAS.
Поражение печени. При применении вемурафениба зарегистрированы случаи поражения печени, включая тяжелые. На фоне приема вемурафениба могут возникнуть патологические изменения лабораторных параметров, характеризующих функцию печени. Перед началом приема вемурафениба необходимо оценить активность печеночных ферментов (трансаминаз и ЩФ), а также концентрацию билирубина, а во время приема следует контролировать эти параметры ежемесячно или чаще при возникновении клинических симптомов. При выявлении патологических изменений лабораторных параметров следует уменьшить дозу, прервать или прекратить прием вемурафениба, в зависимости от их степени тяжести.
Пациенты с нарушением функции почек. Коррекция стартовой дозы у пациентов с легкой или средней степенью почечной недостаточности не требуется. Недостаточно данных для определения необходимости коррекции дозы у пациентов с тяжелой степенью почечной недостаточности.
Фотосенсибилизация. У пациентов, получавших вемурафениб, были зарегистрированы реакции фотосенсибилизации от легкой до тяжелой степени тяжести. Всем пациентам но время приема вемурафениба следует избегать пребывания на солнце. Пациентам, принимающим вемурафениб, во время пребывания на открытом воздухе следует носить одежду, защищающую от солнца, и использовать солнцезащитные средства с УФА- (УФ излучение диапазона А) и УФВ- (УФ излучение диапазона В) фильтрами и бальзам для губ (солнцезащитный фактор >30) для защиты от солнечных ожогов.
При реакциях фотосенсибилизации 2-й степени (непереносимость) и выше рекомендуется изменить дозу вемурафениба.
Влияние вемурафениба на другие ЛС. Вемурафениб может повышать экспозицию ЛС, которые преимущественно метаболизируются при участии изофермента CYP1A2, и снижать экспозицию ЛС, которые преимущественно метаболизируются при участии изофермента CYP3A4, в т.ч. пероральных контрацептивов.
Необходимость коррекции дозы ЛС, метаболизирующихся преимущественно при участии изоферментов CYP1А2 и CYP3A4, следует оценить до начала терапии вемурафенибом в зависимости от терапевтического индекса ЛС.
При одновременном применении вемурафениба и варфарина следует соблюдать осторожность и принимать во внимание MНO.
Влияние других ЛС на вемурафениб. На фармакокинетические параметры вемурафениба могут оказывать влияние ЛС, ингибирующие или влияющие на P-gp (например верапамил, кларитромицин, циклоспорин, ритонавир, хинидин, дронедарон, амиодарон, итраконазол, ранолазин).
По возможности следует избегать одновременного применения вемурафениба с мощными индукторами P-gp, глюкуронирования, изофермента CYP3A4 (например рифампицин, рифабутин, карбамазепин, фенитоин, зверобой продырявленный). С целью сохранения эффективности вемурафениба следует рассмотреть альтернативные варианты лечения ЛС с меньшим индуцирующим потенциалом.
Контрацепция у женщин и мужчин. Женщины и мужчины репродуктивного возраста должны использовать надежные методы контрацепции на протяжении всего курса приема вемурафениба и как минимум в течение 6 мес после прекращения приема. Вемурафениб может уменьшать эффективность гормональных контрацептивов, в связи с чем рекомендуется использовать альтернативный или дополнительный метод контрацепции.
Влияние на способность к вождению транспортных средств и работу с машинами и механизмами. Исследование влияния вемурафениба на способность к вождению транспортных средств и работу с машинами и механизмами не проводилось. Пациентов следует предупредить о возможном развитии головокружения, нарушений со стороны глаз и повышенной утомляемости, которые могут стать основанием для отказа от вождения.
RxList.com
Новые первичные злокачественные новообразования
Злокачественные кожные новообразования. В исследовании 1 кожная сквамозная клеточная карцинома (плоскоклеточный рак кожи, ПКРК), кератоакантома и меланома возникали чаще у пациентов, получавших вемурафениб, по сравнению с контрольной группой. Частота случаев ПКРК и кератоакантомы в группе пациентов, получавших вемурафениб, составила 24% по сравнению с <1% в группе получавших дакарбазин (см. «Побочные действия»). Среднее время до первого появления признаков ПКРК составило 7–8 нед, приблизительно 33% пациентов с ПКРК, развившимся во время применения вемурафениба, имели по крайней мере один дополнительный эпизод ПКРК с медианой между инцидентами 6 нед. Потенциальными факторами риска, связанными с появлением ПКРК в клинических исследованиях с применением вемурафениба, являлись возраст (не менее 65 лет), предшествующий рак кожи и постоянное пребывание на солнце.
В исследовании 1 новые случаи первичной злокачественной меланомы возникли у 2,1% (7 из 336) пациентов, получавших вемурафениб, по сравнению с 0% в группе получавших дакарбазин.
Перед началом терапии и каждые 2 мес во время терапии следует проводить дерматологическое обследование. Подозрительные участки кожи подлежат иссечению и дерматологической оценке. Дерматологическое обследование следует проводить в течение 6 мес после прекращения приема вемурафениба.
Сквамозная клеточная карцинома другой (некожной) локализации. У пациентов, получающих вемурафениб, может возникнуть сквамозная клеточная карцинома головы и шеи (см. «Побочные действия»). Следует осуществлять тщательный контроль пациентов, получающих вемурафениб, с целью выявления признаков или симптомов некожного плоскоклеточного рака.
Другие злокачественные новообразования. В силу своего механизма действия вемурафениб может провоцировать развитие злокачественных новообразований, связанных с активацией RAS, посредством его мутации или других механизмов. Необходимо тщательное наблюдение за признаками и симптомами других злокачественных новообразований у пациентов, получающих вемурафениб.
Стимулирование опухоли при меланоме с диким типом гена BRAF. В экспериментах in vitro продемонстрирована парадоксальная активация MAP-сигнального пути и усиление пролиферации в клетках с диким типом гена BRAF при экспозиции их ингибиторами BRAF. Перед началом применения вемурафениба следует подтвердить мутацию BRAF V600 в образцах опухоли.
Реакции гиперчувствительности. Во время лечения или при возобновлении лечения вемурафенибом возможно развитие анафилаксии и других серьезных реакций гиперчувствительности. Серьезные реакции гиперчувствительности включали генерализованную сыпь и эритему, гипотензию и реакции с эозинофилией и системными симптомами (DRESS-синдром). У пациентов с серьезными реакциями гиперчувствительности необходимо отменить применение вемурафениба (см. «Побочные действия»).
Дерматологические реакции. У пациентов, принимающих вемурафениб, могут развиться серьезные дерматологические реакции, включая синдром Сивенса-Джонсона и токсический эпидермальный некролиз. У пациентов с серьезными дерматологическими реакциями необходимо отменить применение вемурафениба (см. «Побочные действия»).
Удлинение интервала QT. В неконтролируемом открытом вспомогательном исследовании у пациентов с метастатической меланомой с положительной BRAF V600 мутацией, ранее подвергавшихся лечению, возникало дозозависимое удлинение интервала QT. Удлинение интервала QT повышает риск развития желудочковых аритмий, включая torsade de pointes.
Не следует начинать лечение у пациентов с некорректируемыми нарушениями электролитного обмена, QTc >500 мс или принимающих ЛС, способные пролонгировать интервал QT. До и после начала лечения или после модификации дозы вемурафениба из-за удлинения интервала QT следует оценивать ЭКГ и уровень электролитов (включая калий, магний и кальций) через 15 дней, ежемесячно в течение 3 мес и далее каждые 3 мес или чаще при наличии клинических показаний.
Следует отказаться от применения вемурафениба, если у пациента интервал QT увеличился до >500 мс (3-я степень тяжести). При восстановлении интервала QT до уровня меньше или равно 500 мс (2-я степень тяжести и менее) применение возобновляют в пониженной дозе. Если после коррекции сердечных факторов риска пролонгации QT (например нарушение баланса электролитов, ХСН и брадиаритмия) интервал QT сохранил показатель >500 мс и увеличился более чем на 60 мс от его уровня до начала лечения, терапию вемурафенибом следует отменить.
Гепатотоксичность. При применении вемурафениба могут возникнуть повреждения печени, приводящие к ухудшению ее функции, включая коагулопатию или другие дисфункции печени (см. «Побочные действия»). Перед началом лечения, ежемесячно в ходе лечения или при наличии клинических показаний следует контролировать уровень трансаминаз, ЩФ и билирубина. Для восстановления печеночных показателей может потребоваться уменьшение дозы, перерыв или отмена лечения.
Фоточувствительность. У пациентов, получающих вемурафениб, может развиться фоточувствительность от умеренной до серьезной степени тяжести (см. «Побочные действия»). Пациентам следует советовать избегать пребывания на солнце, носить защитную одежду и применять солнцезащитные кремы и бальзам для губ (солнцезащитный фактор >30) при нахождении на открытом воздухе.
При непереносимости 2-й степени тяжести или выше следует изменить дозу.
Офтальмологические реакции. У пациентов, получающих вемурафениб, может развиться увеит, нечеткость зрения и светобоязнь. В исследовании 1 увеит, включая ирит, возникал у 2,1% (7 из 336) пациентов, получавших вемурафениб, по сравнению с 0% в группе получавших дакарбазин. Для контроля увеита может потребоваться лечение офтальмологическими формами ГКС и мидриатических ЛС. Следует установить наблюдение за признаками и симптомами увеита у пациентов.
Токсичность в отношении эмбриона и плода. В силу своего механизма действия вемурафениб может вызвать повреждение плода при назначении беременным женщинам. Адекватные и надлежащим образом контролируемые исследования у беременных женщин не проводились. Если вемурафениб применяется в период беременности или беременность наступила во время лечения, пациентка должна быть предупреждена о потенциальной опасности для плода.
Повышение чувствительности к радиации и усиление радиационного ответа. Повышение чувствительности к радиации и усиление радиационного ответа, в некоторых случаях серьезное, вовлекающее кожу и висцеральные органы, отмечено у пациентов, подвергавшихся лучевой терапии до, во время или при последующем лечении вемурафенибом (см. «Побочные действия»).
Следует установить наблюдение за пациентами, которые принимают вемурафениб одновременно с лучевой терапией или после нее.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2014 и www.rxlist.com, 2015.
Торговые названия с действующим веществом Вемурафениб
Rec.INN
зарегистрированное ВОЗ
Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Противоопухолевое средство, ингибитор протеинкиназы. Вемурафениб является низкомолекулярным пероральным ингибитором серин-треонин киназы, кодируемой геном BRAF (v-raf murine sarcoma viral oncogene homolog B1). В результате мутаций в гене BRAF, приводящих к замене аминокислоты валин в положении 600, происходит конститутивная активация онкогенного белка BRAF и, как следствие, пролиферация клеток при отсутствии факторов роста.
Согласно проведенным биохимическим исследованиям вемурафениб является мощным ингибитором BRAF-киназ с активирующими мутациями в кодоне 600.
Фармакокинетика
Вемурафениб — вещество с низкой растворимостью и низкой проницаемостью (класс 4 по системе биофармацевтической классификации). Фармакокинетика вемурафениба имеет дозозависимый характер в диапазоне доз от 240 до 960 мг при приеме 2 раза/сут. Линейность фармакокинетики также подтверждена данными популяционного фармакокинетического анализа.
При приеме вемурафениба в дозе 960 мг 2 раза/сут медиана времени до достижения Сmax составляет приблизительно 4 ч. При многократном приеме вемурафениба в дозе 960 мг 2 раза/сут наблюдается кумуляция, которая характеризуется высокой межиндивидуальной вариабельностью. Средние показатели AUC0-8 ч и Cmax (±стандартное отклонение) в 1 сутки составили 22.1± 12.7 мкг×ч/мл и 4.1 ±2.3 мкг/мл соответственно. В ходе некомпартментного анализа при приеме вемурафениба в дозе 960 мг 2 раза/сут AUC на 15 сутки увеличилась в 15-17 раз по сравнению с AUC в 1 сутки, Cmax на 15 сутки увеличилась в 13-14 раз по сравнению с Cmax в 1 сутки. В равновесном состоянии AUC0-8ч и Cmax составили 380.2±143.6 мкг×ч/мл и 56.7±21.8 мкг/мл соответственно.
Пища, богатая жирами, повышает экспозицию вемурафениба при однократном применении в дозе 960 мг. Средние геометрические показатели Cmax и AUC увеличивались при приеме вемурафениба с пищей по сравнению с приемом натощак в 2.5 и 4.7 раза соответственно. Медиана Тmax увеличивалась с 4 ч до 8 ч при однократном приеме вемурафениба с пищей. Продолжительный прием вемурафениба натощак может привести к значимому снижению экспозиции вемурафениба в равновесном состоянии по сравнению с приемом вемурафениба с пищей или незадолго до приема пищи.
Возможно изменение экспозиции вемурафениба в зависимости от состава, объема и кислотности (рН) жидкости ЖКТ, моторики и времени прохождения пищи, состава желчи.
В равновесном состоянии (достигается на 15 сутки у 80% пациентов) средняя экспозиция вемурафениба в плазме крови характеризуется стабильностью на протяжении 24 ч, о чем свидетельствует среднее соотношение концентрации в плазме крови до и через 2-4 ч после приема утренней дозы, равное 1.13.
После перорального приема константа скорости всасывания у пациентов с метастатической меланомой составляет 0.19 ч-1 (межиндивидуальная вариабельность составляет 101%).
Связывание с белками плазмы крови высокое — более 99%. По данным популяционного анализа кажущийся Vd вемурафениба у пациентов с метастатической меланомой составляет 91 л (межиндивидуальная вариабельность составляет 64.8%).
Изофермент CYP3А4 — основной фермент, участвующий в метаболизме вемурафениба in vitro. У человека также обнаружены продукты конъюгации с глюкуроновой кислотой и продукты гликозилирования. Соотношение вемурафениба и его метаболитов было изучено в ходе клинического исследования материального баланса после однократного приема вемурафениба с 14С-радиоактивной меткой. В плазме крови препарат содержится преимущественно в неизмененном виде (>95%), тогда как метаболиты составляют ≤5%.
По данным популяционного анализа кажущийся клиренс вемурафениба у пациентов с метастатической меланомой составляет 29.3 л/сут (межиндивидуальная вариабельность составляет 31.9%), медиана T1/2 вемурафениба составляет 51.6 ч (диапазон индивидуальных значений между 5-м и 95-м перцентилем составляет 29.8-119.5 ч).
Согласно исследованию материального баланса в среднем 95% дозы вемурафениба выводится в течение 18 дней. Большая часть (94%) вемурафениба в неизменном виде и его метаболитов выводится через кишечник, менее 1% — почками. Выведение препарата в неизменном виде с желчью может быть важным путем выведения. Однако поскольку абсолютная биодоступность препарата неизвестна, значение влияния печеночной и почечной экскреции на клиренс препарата в неизменном виде также не может быть оценено. Вемурафениб является субстратом и ингибитором Р-гликопротеина in vitro.
Согласно результатам популяционного фармакокинетического анализа у мужчин кажущийся клиренс препарата больше на 17%, а кажущийся Vd — на 48% по сравнению с женщинами. При этом различия в экспозиции вемурафениба относительно невелики.
Показания активного вещества
ВЕМУРАФЕНИБ
Неоперабельная или метастатическая меланома с мутацией BRAF V600 у взрослых пациентов — в виде монотерапии.
Режим дозирования
Лечение следует проводить под наблюдением онколога.
Перед применением вемурафениба следует провести валидированный тест на наличие BRAF V600 мутации.
Принимают внутрь. Рекомендуемая доза составляет 960 мг 2 раза/сут. Суточная доза — 1920 мг.
При появлении признаков прогрессирования заболевания терапию следует прекратить. В случае развития непереносимой токсичности терапию следует приостановить или прекратить.
Побочное действие
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): очень часто — плоскоклеточная карцинома кожи, себорейный кератоз, папиллома кожи; часто — базально-клеточный рак, новый очаг первичной меланомы; нечасто — плоскоклеточная карцинома некожной локализации.
Со стороны обмена веществ: очень часто — снижение аппетита, снижение массы тела.
Со стороны нервной системы: очень часто — головная боль, дисгевзия (нарушение вкусового восприятия), периферическая невропатия; часто — паралич лицевого нерва, головокружение.
Со стороны органа зрения: часто — увеит; нечасто — окклюзия вен сетчатки.
Со стороны сосудов: нечасто — васкулит.
Со стороны дыхательной системы: очень часто — кашель.
Со стороны пищеварительной системы: очень часто — диарея, рвота, тошнота, запор.
Со стороны кожи и подкожных тканей: очень часто — реакция фотосенсибилизации, актинический кератоз, сыпь, макуло-папулезная сыпь, папулезная сыпь, зуд, гиперкератоз, эритема, алопеция, сухость кожи, солнечный ожог, синдром ладонно-подошвенной эритродизестезии; часто — узловатая эритема, фолликулярный кератоз, фолликулит; нечасто — токсический эпидермальный некролиз, синдром Стивенса-Джонсона.
Со стороны костно-мышечной системы: очень часто — артралгия, миалгия, боли в конечностях, костно-мышечная боль, боли в спине, артрит.
Лабораторные и инструментальные данные: очень часто — повышение активности ГГТ (3 или 4 степени тяжести); часто — повышение активности АЛТ (3 степени тяжести), ЩФ (3 степени тяжести), повышение концентрации билирубина (3 степени тяжести); нечасто — повышение активности ACT (3 или 4 степени тяжести).
Прочие: очень часто — утомляемость, лихорадка, периферические отеки, астения.
Противопоказания к применению
Почечная недостаточность тяжелой степени; тяжелая степень печеночной недостаточности; не поддающиеся коррекции нарушения водно-электролитного баланса (в т.ч. баланса магния); синдром удлиненного интервала QT; корригированный интервал QT (QTc)>500 мс до начала терапии; прием лекарственных препаратов, способствующих удлинению интервала QT; беременность; период лактации (грудного вскармливания); детский и подростковый возраст до 18 лет; повышенная чувствительность к вемурафенибу.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Женщины репродуктивного возраста и мужчины должны использовать надежные методы контрацепции на протяжении всего курса лечения вемурафенибом и как минимум в течение 6 месяцев после прекращения приема. Вемурафениб способен уменьшать эффективность гормональных контрацептивов, в связи с чем рекомендуется использовать альтернативный или дополнительный метод контрацепции.
Особые указания
С осторожностью: одновременный прием с варфарином, мощными ингибиторами и индукторами изофермента CYP3A4, глюкуронирования и/или транспортных белков (включая Р-гликопротеин), лекарственными препаратами, являющимися субстратами изофермента CYP1A2.
Эффективность и безопасность вемурафениба при опухолях, которых несут редкие BRAF V600 мутации, отличные от V600E и V600K, не была убедительно доказана. Вемурафениб не следует применять у пациентов со злокачественной меланомой, экспрессирующей BRAF дикого типа.
При развитии тяжелых реакций повышенной чувствительности, тяжелых дерматологических реакций дальнейший прием вемурафениба следует прекратить.
Не рекомендуется у пациентов с не поддающимися коррекции нарушениями водно-электролитного баланса (в т.ч. баланса магния), синдромом удлиненного интервала QT, а также у пациентов, получающих лекарственные препараты, способствующие удлинению интервала QT. В период лечения следует регулярно контролировать ЭКГ и состояние водно-электролитного баланса (в т.ч. баланса магния). Если после коррекции сопутствующих факторов риска значение интервала QTc составляет >500 мс и отличается от исходного значения, зарегистрированного перед началом лечения, более чем на 60 мс вемурафениб следует отменить.
Лечащему врачу рекомендуется регулярно наблюдать за пациентом на предмет развития офтальмологических реакций.
Перед началом лечения всем пациентам рекомендуется пройти обследование у дерматолога. При возникновении любых подозрительных поражений кожи необходимо провести соответствующее исследование. Необходимо проводить обследование ежемесячно во время терапии и в течение 6 месяцев после лечения вемурафенибом или до начала другой противоопухолевой терапии. Пациенты должны быть проинформированы о том, что при возникновении каких-либо кожных изменений необходимо сообщить об этом врачу.
У пациентов, вемурафениб зарегистрированы случаи развития плоскоклеточной карциномы некожной локализации. Перед началом приема вемурафениба необходимо провести обследование головы и шеи, состоящее, как минимум, из визуального осмотра слизистой оболочки полости рта и пальпации лимфатических узлов, и повторять это обследование через каждые 3 месяца во время приема препарата. Кроме того, перед началом приема необходимо выполнить КТ органов грудной клетки и повторять это обследование через каждые 6 месяцев. Перед началом приема и по завершении терапии или при наличии клинических симптомов рекомендуется проводить исследования прямой кишки и органов малого таза (у женщин). После прекращения лечения вемурафенибом обследования с целью выявления плоскоклеточной карциномы некожной локализации необходимо продолжать в течение 6 месяцев или до начала другой противоопухолевой терапии. Выявленные патологические изменения следует вести в соответствии с клинической практикой.
Требуется тщательно рассмотреть вопрос о соотношении ожидаемой пользы и возможного риска применения препарата у пациентов с ранее перенесенными или сопутствующими злокачественными новообразованиями, ассоциированными с мутациями в гене RAS.
Перед началом лечения необходимо оценить активность печеночных ферментов (трансаминаз и ЩФ), а также концентрацию билирубина, во время лечения следует контролировать эти параметры ежемесячно или чаще при возникновении клинических симптомов. При выявлении патологических изменений лабораторных параметров следует уменьшить дозу, прервать или прекратить лечение вемурафенибом.
В период лечения пациентам следует избегать пребывания на солнце во избежание развития фотосенсибилизации.
У пациентов в возрасте 65 и более лет более вероятно развитие побочных реакций, в т.ч. плоскоклеточной карциномы кожи, снижения аппетита и нарушений со стороны сердца.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования влияния вемурафениба на способность к вождению транспортных средств и работу с машинами и механизмами не проводились. Пациентов следует предупредить о возможном развитии головокружения, нарушений со стороны глаз и утомляемости, которые могут стать основанием для отказа от вождения.
Лекарственное взаимодействие
Вемурафениб является умеренным ингибитором изофермента CYP1A2 и индуктором изофермента CYP3A4. Вемурафениб способен уменьшать биодоступность лекарственных средств, метаболизирующихся преимущественно при участии изофермента CYP3A4. В связи с этим возможно уменьшение эффективности контрацептивных препаратов, метаболизирующихся при участии изофермента CYP3A4.
Одновременное применение вемурафениба с лекарственными препаратами с узким терапевтическим индексом, которые метаболизируются при участии изоферментов CYP1A2 и CYP3A4, не рекомендуется, т.к. вемурафениб может изменять их концентрацию. Если совместного применения избежать невозможно, то необходимо предусмотреть снижение дозы лекарственного препарата, являющегося субстратом изофермента CYP1A2.
Совместное применение с вемурафенибом увеличивает AUC кофеина (субстрата изофермента CYP1А2) в среднем в 2.6 раза (максимально в 5 раз), тогда как AUC мидазолама (субстрата изофермента CYP3A4) снижается в среднем на 39% (максимально до 80%).
AUC декстрометорфана (субстрата CYP2D6) и его метаболита декстрофана увеличивалась приблизительно на 47% вследствие эффекта на кинетику декстрометорфана, который может не быть опосредован ингибированием изофермента CYP2D6. В исследовании in vitro вемурафениб в концентрации 10 мкМ вызывал слабое ингибирование изофермента CYP2B6. Неизвестно, будет ли вемурафениб при достижении равновесной концентрации 100 мкМ в крови пациентов (примерно 50 мкг/мл) уменьшать содержание субстратов изофермента CYP2B6, таких как бупропион, при их одновременном применении.
Одновременное применение вемурафениба и варфарина (субстрата изофермента CYP2C9) может приводить к увеличению AUC последнего на 18%. Следует соблюдать осторожность и предусмотреть дополнительный мониторинг MHO в случае применения вемурафениба в сочетании с варфарином.
В исследовании in vitro вемурафениб ингибировал изофермент CYP2C8. Значение данного наблюдения для человека неизвестно, однако риск клинически значимого влияния на субстраты изофермента CYP2C8 при совместном применении не может быть исключен.
Во избежание взаимодействия с лекарственными препаратами после прекращения применения вемурафениба может потребоваться период вымывания продолжительностью 8 дней.
В исследованиях in vitro показано, что метаболизм вемурафениба происходит при участии изофермента CYP3A4 и путем глюкуронирования. Следует соблюдать осторожность при одновременном применении вемурафениба и мощных ингибиторов изофермента CYP3A4, глюкуронирования и/или транспортных белков (например, ритонавира, саквинавира, телитромицина, кетоконазола, итраконазола, вориконазола, позаконазола, нефазодона, атазанавира).
В исследованиях in vitro показано, что вемурафениб является субстратом Р-гликопротеина и BCRP. Данных по влиянию индукторов или ингибиторов Р-гликопротеина и BCRP на экспозицию вемурафениба нет. Нельзя исключить, что на фармакокинетические параметры вемурафениба могут оказывать влияние препараты, ингибирующие или влияющие на Р-гликопротеин (например, верапамил, кларитромицин, циклоспорин, ритонавир, хинидин, дронедарон, амиодарон, итраконазол, ранолазин) и BCRP (циклоспорин, гефитиниб). Нельзя исключить возможное увеличение экспозиции препаратов, транспортируемых при помощи Р-гликопротеина, при одновременном применении с вемурафенибом (например, алискирен, колхицин, дигоксин, эверолимус, фексофенадин) или BCRP (например, метотрексат, митоксантрон, розувастатин). Следует избегать одновременного применения вемурафениба и с мощными индукторами Р-гликопротеина, глюкуронирования, изофермента CYP3A4 (например, с рифампицином, рифабутином, карбамазепином, фенитоином или зверобоем продырявленным) из-за возможного снижения биодоступности вемурафениба.
Зелбораф — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-002271-060318
Торговое наименование
Зелбораф®
Международное непатентованное наименование
Вемурафениб
Лекарственная форма
Таблетки, покрытые пленочной оболочкой
Состав
1 таблетка, покрытая пленочной оболочкой, содержит:
действующее вещество: вемурафениб 1 – 240.000 мг;
вспомогательные вещества: кремния диоксид коллоидный безводный – 10.400 мг, кроскармеллоза натрия – 29.400 мг, гипролоза (гидроксипропилцеллюлоза) – 4.250 мг, магния стеарат – 5.950 мг;
пленочная оболочка 2: поливиниловый спирт – 8.000 мг, титана диоксид (Е171) – 4.982 мг, макрогол 3350 – 4.040 мг, тальк – 2.960 мг, краситель железа оксид красный (Е172) – 0.018 мг.
1 Вемурафениб содержится в виде ко-преципитата вемурафениба и гипромеллозы ацетата сукцината – 800 мг.
2Допускается использование готовой смеси Opadry II Pink 85F14411. Качественный и количественный состав готовой смеси Opadry II Pink 85F14411 аналогичен составу пленочной оболочки, указанному в разделе.
Описание
Овальные двояковыпуклые таблетки, покрытые пленочной оболочкой от розовато-белого до оранжевато-белого цвета; на одной стороне таблетки гравировка «VEM».
Фармакотерапевтическая группа
Противоопухолевое средство – протеинкиназы ингибитор.
Код АТХ [L01XЕ15]
Фармакологические свойства
Фармакодинамика
Механизм действия
Вемурафениб является ингибитором серин-треонин киназы, кодируемой геном BRAF (v-raf murine sarcoma viral oncogene homolog B1). В результате мутаций в гене BRAF происходит конститутивная активация онкогенного белка BRAF и, как следствие, пролиферация клеток при отсутствии факторов роста.
Согласно проведенным биохимическим исследованиям вемурафениб является мощным ингибитором BRAF-киназ с активирующими мутациями в кодоне 600.
Данный ингибирующий эффект был подтвержден в ходе реакции фосфорилирования внеклеточной сигнал-регулирующей киназы и клеточной антипролиферации в доступных клеточных линиях меланомы, экспрессирующих ген BRAF с V600 мутациями. В тестах антипролиферации в клеточных линиях с V600 мутациями (линии V600E, V600R, V600D и V600K) концентрация полумаксимального ингибирования (IC50) варьировала от 0.016 до 1.131 мкмоль, в то время как IC50 в отношении клеточных линий с «диким» типом гена BRAF составляла 12.06 и 14.32 мкмоль, соответственно. Пациенты с метастазами в головной мозг
Суммарная эффективность терапии (BORR, best overall response rate) вемурафенибом у пациентов с метастазами в головной мозг составила 17.8% и 17.9% у пациентов, ранее не получавших/получавших терапию, соответственно (17.8% в общей популяции).
Фармакокинетика
Вемурафениб – вещество с низкой растворимостью и низкой проницаемостью (класс 4 по системе биофармацевтической классификации). Фармакокинетические параметры вемурафениба оценивали методом некомпартментного анализа, а также с помощью популяционного фармакокинетического анализа. Фармакокинетика вемурафениба имеет дозозависимый характер в диапазоне доз от 240 до 960 мг при приеме 2 раза в сутки.
Линейность фармакокинетики также подтверждена данными популяционного фармакокинетического анализа.
Всасывание
Абсолютная биодоступность вемурафениба для таблеток 240 мг неизвестна. При приеме вемурафениба в однократной дозе 960 мг (4 таблетки 240 мг) медиана времени до достижения максимальной концентрации в плазме крови (Tmax) составляет приблизительно 4 часа. При многократном приеме вемурафениба в дозе 960 мг два раза в день наблюдается накопление препарата, которое характеризуется высокой межиндивидуальной вариабельностью. Средние показатели площади под кривой «концентрация-время» AUC0-8ч и максимальная концентрация в плазме крови (Cmax) (± стандартное отклонение) в 1 сутки составили 22.1±12.7 мкг*ч/мл и 4.1±2.3 мкг/мл, соответственно. В ходе некомпартментного анализа при приеме вемурафениба в дозе 960 мг два раза в день AUC на 15 сутки увеличилась в 15-17 раз по сравнению с AUC в 1 сутки, Cmax на 15 сутки увеличилась в 13-14 раз по сравнению с Cmax в 1 сутки. В равновесном состоянии AUC0-8ч и Cmax составили 380.2±143.6 мкг*ч/мл и 56.7±21.8 мкг/мл, соответственно.
Пища, богатая жирами, повышает экспозицию вемурафениба при однократном применении в дозе 960 мг. Средние геометрические показатели Cmax и AUC увеличивались при приеме вемурафениба с пищей по сравнению с приемом натощак в 2.5 и с 4.6 до 5.1 раза, соответственно. Медиана Тmax увеличивалась с 4 часов до 7.5 часов при однократном приеме вемурафениба с пищей. Данных по влиянию приема пищи на экспозицию вемурафениба в равновесном состоянии нет. Продолжительный прием вемурафениба натощак может привести к значимому снижению экспозиции вемурафениба в равновесном состоянии по сравнению с приемом вемурафениба с пищей или незадолго до приема пищи. Ожидается, что при нерегулярном приеме вемурафениба натощак экспозиция вемурафениба в равновесном состоянии изменится незначительно ввиду высокой степени накопления вемурафениба в равновесном состоянии. Безопасность и эффективность вемурафениба в опорных исследованиях были изучены у пациентов, принимавших вемурафениб как с пищей, так и отдельно от приема пищи. Возможно изменение экспозиции вемурафениба в зависимости от состава, объема и кислотности (рН) жидкости желудочно-кишечного тракта, моторики и времени прохождения пищи, состава желчи.
В равновесном состоянии (достигается на 15 сутки у 80% пациентов) средняя экспозиция вемурафениба в плазме крови характеризуется стабильностью на протяжении 24 часов, о чем свидетельствует среднее соотношение концентрации в плазме крови до и через 2–4 часа после приема утренней дозы, равное 1.13.
После перорального приема константа скорости всасывания у пациентов с метастатической меланомой составляет 0.19 ч-1 (межиндивидуальная вариабельность составляет 101%).
Распределение
По данным популяционного анализа кажущийся объем распределения вемурафениба у пациентов с метастатической меланомой составляет 91 л (межиндивидуальная вариабельность составляет 64.8%). Вемурафениб характеризуется высокой степенью связывания с белками плазмы крови человека in vitro (более 99%).
Метаболизм
Изофермент цитохрома Р450 (CYP) 3А4 – основной фермент, участвующий в метаболизме вемурафениба in vitro. У человека также обнаружены продукты конъюгации с глюкуроновой кислотой и продукты гликозилирования. Соотношение вемурафениба и его метаболитов было изучено в ходе клинического исследования материального баланса после однократного приема вемурафениба с 14С-радиоактивной меткой.
В плазме крови препарат содержится преимущественно в неизмененном виде (>95%), тогда как метаболиты составляют ≤5%. Значимым путем выведения вемурафениба можно считать путь, опосредованный изоферментом CYP3A4 (см. раздел «Взаимодействие с другими лекарственными средствами», подраздел «Влияние сопутствующих препаратов на вемурафениб»).
Выведение
По данным популяционного анализа кажущийся клиренс вемурафениба у пациентов с метастатической меланомой составляет 29.3 л/день (межиндивидуальная вариабельность составляет 31.9%), медиана периода полувыведения вемурафениба составляет 51.6 часа (диапазон индивидуальных значений между 5-м и 95-м перцентилем составляет 29.8– 119.5 часа).
Согласно исследованию материального баланса в среднем 95% дозы вемурафениба выводится в течение 18 дней. Большая часть (94%) вемурафениба в неизменном виде и его метаболитов выводится кишечником, менее 1% — почками. Выведение препарата в неизменном виде с желчью может быть важным путем выведения. Однако поскольку абсолютная биодоступность препарата неизвестна, значение влияния печеночной и почечной экскреции на клиренс препарата в неизменном виде также не может быть оценено. Вемурафениб является субстратом и ингибитором Р-гликопротеина in vitro.
Фармакокинетика у особых групп пациентов
Пациенты пожилого возраста
Согласно результатам популяционного фармакокинетического анализа возраст пациентов не оказывает статистически значимого влияния на фармакокинетические параметры вемурафениба.
Пол
Согласно результатам популяционного фармакокинетического анализа у мужчин кажущийся клиренс препарата больше на 17%, а кажущийся объем распределения – на 48% по сравнению с женщинами. При этом различия в экспозиции вемурафениба относительно невелики, что указывает на отсутствие необходимости корректировать дозу препарата в зависимости от пола пациента, индекса массы тела или массы тела.
Пациенты детского возраста и подростки
Данные о фармакокинетике у пациентов детского возраста и подростков ограничены. На основании данных, полученных у шести пациентов в возрасте 15-17 лет с меланомой стадии IIIС или IV с BRAF V600 мутацией, предполагается, что фармакокинетические характеристики вемурафениба у подростков и взрослых пациентов сопоставимы. Тем не менее, полученных данных недостаточно для однозначного заключения.
Пациенты с нарушением функции почек
Согласно результатам популяционного фармакокинетического анализа данных пациентов с метастатической меланомой легкая и средняя степень почечной недостаточности (клиренс креатинина >40 мл/мин) не оказывает влияния на кажущийся клиренс вемурафениба.
Клинические данные и данные по фармакокинетике у пациентов с тяжелой степенью почечной недостаточности недостаточны для определения необходимости в коррекции дозы.
Пациенты с нарушением функции печени
Вемурафениб преимущественно выводится с желчью. Согласно результатам популяционного фармакокинетического анализа данных пациентов с метастатической меланомой повышение активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) до значения, в 3 раза превышающего верхнюю границу нормы, не оказывает влияния на кажущийся клиренс вемурафениба.
Клинических данных и данных по фармакокинетике у пациентов с тяжелой степенью печеночной недостаточности недостаточно для определения влияния нарушения метаболической или экскреторной функции печени на фармакокинетику вемурафениба.
Показания к применению
- Неоперабельная или метастатическая меланома с BRAF V600 мутацией у взрослых пациентов.
- Болезнь Эрдгейма-Честера (БЭЧ) с BRAF V600 мутацией у взрослых пациентов.
Противопоказания
- Повышенная чувствительность к вемурафенибу и к другим компонентам препарата в анамнезе.
- Беременность и период грудного вскармливания.
- Детский возраст до 18 лет (эффективность и безопасность применения не установлены).
- Не поддающиеся коррекции нарушения водно-электролитного баланса (в том числе баланса магния), синдром удлиненного интервала QT, прием лекарственных препаратов, способствующих удлинению интервала QT, корригированный интервал QT (QTc)>500 мс до начала терапии.
- Тяжелая степень почечной и печеночной недостаточности.
С осторожностью
Одновременный прием с варфарином, мощными ингибиторами и индукторами изофермента CYP3A4, глюкуронирования и/или транспортных белков (включая Р-гликопротеин), лекарственными препаратами, являющимися субстратами изофермента CYP1A2. Следует соблюдать осторожность при совместном применении вемурафениба и субстратов изофермента CYP2C8 с узким терапевтическим диапазоном (см. раздел «Взаимодействие с другими лекарственными средствами»).
Применение во время беременности и в период грудного вскармливания
Фертильность
Доклинических исследований влияния вемурафениба на фертильность не проводилось. В токсикологических исследованиях при многократном дозировании патологических изменений при проведении гистологического анализа репродуктивных органов самок и самцов обнаружено не было.
Контрацепция
Женщины репродуктивного возраста и мужчины должны использовать надежные методы контрацепции на протяжении всего курса приема препарата Зелбораф® и как минимум в течение 6 месяцев после прекращения приема препарата. Препарат Зелбораф® способен снижать эффективность гормональных контрацептивов, в связи с чем рекомендуется использовать альтернативный или дополнительный метод контрацепции.
Беременность и роды
Исследований вемурафениба у беременных женщин не проводилось, однако сообщалось о случаях его трансплацентарного проникновения. За счет своего механизма действия вемурафениб может причинить потенциальный вред плоду при применении у беременных женщин. При изучении вемурафениба у крыс свидетельств тератогенного воздействия на эмбрионы/плоды не обнаружено.
Безопасность применения вемурафениба в ходе родов и родоразрешения не установлена.
Период грудного вскармливания
Неизвестно, выводится ли вемурафениб с грудным молоком. Потенциальный вред для ребенка, находящегося на грудном вскармливании, не установлен.
Необходимо принять решение о прекращении грудного вскармливания или отмене терапии вемурафенибом после оценки пользы грудного вскармливания для ребенка и терапии вемурафенибом для матери.
Способ применения и дозы
Лечение препаратом Зелбораф® следует проводить под наблюдением онколога.
Перед применением препарата Зелбораф® должен быть проведен валидированный тест на наличие BRAF V600 мутации.
Рекомендуемая доза препарата Зелбораф® составляет 960 мг (четыре таблетки по 240 мг) два раза в день (суточная доза составляет 1920 мг), внутрь. Препарат Зелбораф® можно принимать как во время еды, так и отдельно от приема пищи, однако следует избегать продолжительного приема обеих доз натощак.
Таблетку следует проглотить целиком, запивая водой. Разжевывать или измельчать таблетку нельзя.
Продолжительность приема препарата
При появлении признаков прогрессирования заболевания терапию препаратом Зелбораф® следует прекратить. В случае развития непереносимой токсичности терапию препаратом Зелбораф® следует приостановить или прекратить (см. таблицы 1 и 2).
Пропущенные дозы
Если прием очередной дозы пропущен, ее можно принять позднее для поддержания режима приема два раза в день, однако интервал между приемом пропущенной дозы и приемом следующей дозы должен составлять не менее 4 часов. Принимать обе дозы препарата одновременно не следует.
Рвота
В случае возникновения рвоты после приема препарата Зелбораф® не следует принимать дополнительную дозу, а далее продолжить лечение, как обычно.
Изменение дозы
При появлении нежелательных реакций или при удлинении интервала QT, корригированного в соответствии с частотой сердечных сокращений (QTc), может потребоваться уменьшение дозы, временное прерывание или прекращение приема препарата Зелбораф® (см. таблицы 1 и 2).
Не следует уменьшать дозу препарата ниже 480 мг два раза в день. При развитии плоскоклеточной карциномы кожи рекомендуется продолжить лечение без коррекции дозы.
Таблица 1. Изменение дозы в зависимости от степени тяжести нежелательных явлений.
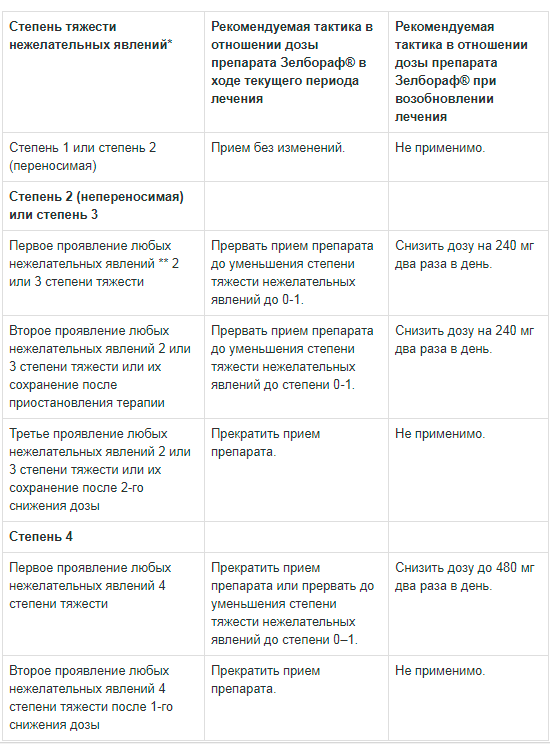
* Степень тяжести нежелательных явлений в соответствии с Общими критериями токсичности нежелательных явлений Национального института рака США, версия 4.0.
** Любое нежелательное явление, при котором снижалась доза или лечение прерывалось по медицинским показаниям.
При применении препарата Зелбораф® наблюдалось удлинение интервала QT, пропорциональное экспозиции вемурафениба. При удлинении QTс может потребоваться проведение мониторинга (см. раздел «Особые указания»).
Таблица 2. Изменение дозы при удлинении интервала QT.
| Значение QTc | Рекомендуемая тактика в отношении дозы препарата Зелбораф® |
| QTc>500 мс до начала терапии | Прием препарата не рекомендуется. |
| QTc>500 мс и отличается от исходного значения, зарегистрированного перед началом приема препарата, более чем на 60 мс | Прием препарата необходимо прекратить. |
| Первое выявление QTc>500 мс во время лечения, отличие QTc от исходного значения, зарегистрированного перед началом приема препарата, 60 мс и менее | Временно прервать прием препарата до снижения QTc ниже 500 мс. Мониторирование (см. раздел «Особые указания»). Снизить дозу на 240 мг два раза в день. |
| Второе выявление QTc>500 мс во время лечения, отличие QTc от исходного значения, зарегистрированного перед началом приема препарата, 60 мс и менее | Временно прервать прием препарата до снижения QTc ниже 500 мс. Мониторирование (см. раздел «Особые указания»). Снизить дозу на 240 мг два раза в день. |
| Третье выявление QTc>500 мс во время лечения, отличие QTc от исходного значения, зарегистрированного перед началом приема препарата, 60 мс и менее | Прекратить прием препарата. |
Дозирование в особых случаях
Пациенты пожилого возраста
Коррекции дозы у пациентов в возрасте ≥65 лет не требуется.
Пациенты с нарушением функции почек
Коррекции стартовой дозы у пациентов с легкой или средней степенью почечной недостаточности не требуется. Недостаточно данных для определения необходимости в коррекции дозы у пациентов с тяжелой степенью почечной недостаточности.
Пациенты с нарушением функции печени
Коррекции стартовой дозы у пациентов с легкой или средней степенью печеночной недостаточности не требуется. Недостаточно данных для определения необходимости в коррекции дозы у пациентов с тяжелой степенью печеночной недостаточности.
Пациенты, не принадлежащие к европеоидной расе
Безопасность и эффективность препарата Зелбораф® у пациентов, не принадлежащих к европеоидной расе, не установлена.
Побочное действие
Нежелательные реакции указаны с учетом классов систем органов, перечисленных в Медицинском словаре для регуляторной деятельности MedDRA.
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000).
Пациенты с неоперабельной или метастатической меланомой
Наиболее частыми нежелательными реакциями (≥30%) при применении препарата Зелбораф® были артралгия, утомляемость, сыпь, реакция фотосенсибилизации, алопеция, тошнота, диарея, головная боль, зуд, рвота, папиллома кожи и гиперкератоз. Сообщалось об очень частых случаях плоскоклеточной карциномы кожи, лечение, как правило, было хирургическим. Наиболее частыми (≥5%) нежелательными реакциями 3 степени тяжести были плоскоклеточная карцинома кожи, кератоакантома, сыпь, артралгия и повышение активности гамма-глутамилтрансферазы (ГГТ). Частота нежелательных реакций 4 степени тяжести составила ≤4% в клинических исследованиях. Частота нежелательных реакций, приводящих к полному прекращению исследуемого лечения в ходе двух клинических исследований, составила 7% и 3%.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): очень часто – плоскоклеточная карцинома кожи*, себорейный кератоз, папиллома кожи, кератоакантома; часто – базальноклеточный рак, новые первичные меланомы; нечасто – плоскоклеточная карцинома некожной локализации.
Нарушения со стороны обмена веществ и питания: очень часто – снижение аппетита, снижение массы тела.
Нарушения со стороны нервной системы: очень часто – головная боль, дисгевзия (искажение вкусовых восприятий), периферическая нейропатия, головокружение; часто – паралич лицевого нерва.
Нарушения со стороны органа зрения: часто – увеит, включая ирит, иридоциклит; нечасто – окклюзия вен сетчатки.
Нарушения со стороны сердца: часто – удлинение интервала QT.
Нарушения со стороны сосудов: часто – васкулит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто – кашель.
Нарушения со стороны желудочно-кишечного тракта: очень часто – диарея, рвота, тошнота, запор.
Нарушения со стороны кожи и подкожных тканей:
очень часто – реакция фотосенсибилизации, актинический кератоз, сыпь, макуло-папулезная сыпь, зуд, гиперкератоз, эритема, алопеция, сухость кожи, солнечный ожог, синдром ладонно-подошвенной эритродизестезии, фолликулярный кератоз; часто – папулезная сыпь, панникулит, включая узловатую эритему, фолликулит; нечасто – токсический эпидермальный некролиз, синдром Стивенса-Джонсона.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
очень часто – артралгия, миалгия, боли в конечностях, костно-мышечная боль, боли в спине, артрит; нечасто – контрактура Дюпюитрена.
Влияние на результаты лабораторных и инструментальных исследований:
очень часто – повышение активности гаммаглутамилтранспептидазы***, повышение концентрации креатинина (в том числе в 1.2% случаев 3 или 4 степеней тяжести); часто – повышение активности АЛТ*, щелочной фосфатазы*, повышение концентрации билирубина*; нечасто – повышение активности АСТ**.
Прочие: очень часто – утомляемость, лихорадка, периферические отеки, астения. *- 3 степени тяжести ** — 3 или 4 степени тяжести *** — 4 степени тяжести
Пациенты с болезнью Эрдгейма-Честера (БЭЧ)
Наиболее частые нежелательные реакции (независимо от степени тяжести), а также нежелательные реакции ≥3 степени тяжести, которые наблюдались у пациентов с меланомой, также отмечались и у пациентов с БЭЧ. Однако, повышение артериального давления и сыпь ≥3 степени тяжести чаще наблюдались у пациентов с БЭЧ. Частота нежелательных явлений, приводящих к полному прекращению исследуемого лечения, составила 32%.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): очень часто – папиллома кожи, плоскоклеточная карцинома кожи*, кератоакантома, себорейный кератоз, меланоцитарный невус.
Нарушения со стороны нервной системы: очень часто – периферическая нейропатия. Нарушения со стороны сосудов: очень часто – повышение артериального давления. Нарушения со стороны сердца: очень часто – удлинение интервала QT.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто – кашель.
Нарушения со стороны желудочно-кишечного тракта: очень часто – диарея, рвота, тошнота.
Нарушения со стороны кожи и подкожных тканей: очень часто – реакция фотосенсибилизации, алопеция, зуд, гиперкератоз, макуло-папулезная сыпь, актинический кератоз, сухость кожи, синдром ладонно-подошвенной эритродизестезии, фолликулярный кератоз, папулезная сыпь, солнечный ожог.
Нарушения со стороны скелетно-мышечной и соединительной ткани: очень часто – артралгия; нечасто – контрактура Дюпюитрена.
Влияние на результаты лабораторных и инструментальных исследований: очень часто – повышение концентрации креатинина (в том числе в 9.1% случаев 3 степеней тяжести); часто – повышение активности АЛТ*, щелочной фосфатазы*.
Прочие: очень часто – утомляемость.
*- 3 степени тяжести
Описание отдельных нежелательных реакций, отмеченных в ходе клинических исследований
Плоскоклеточная карцинома кожи
У пациентов с неоперабельной или метастатической меланомой, получавших препарат Зелбораф®, частота возникновения плоскоклеточной карциномы кожи составила 20%.
По результатам гистологического исследования большинство поражений было отнесено к типу кератоакантом или имеющих признаки смешанных кератоакантом (52%), которые представляют собой более доброкачественные и менее инвазивные типы плоскоклеточной карциномы кожи. Большинство поражений кожи, классифицированных как «другие» (43%), были доброкачественные (такие как простая бородавка, актинический кератоз, доброкачественный кератоз, киста/доброкачественная киста).
Плоскоклеточная карцинома кожи, как правило, проявлялась на ранних этапах лечения, среднее время до проявления первых клинических симптомов составило от 7.1 до 8.1 недель. Приблизительно у 33% пациентов с плоскоклеточной карциномой кожи отмечалось более 1 случая возникновения карциномы с промежутком в 6 недель. Терапия плоскоклеточной карциномы кожи представляла собой простое иссечение, пациенты продолжали получать терапию без изменения дозы препарата.
У пациентов с БЭЧ частота развития плоскоклеточной карциномы кожи и/или кератоакантомы составляла 40.9%. Среднее время до проявления первых клинических симптомов плоскоклеточной карциномы кожи у пациентов с БЭЧ, у которых отмечалось хотя бы одно указанное явление, составляло 12.1 недели.
Реакции гиперчувствительности
На 8-ой день применения вемурафениба в дозе 960 мг 2 раза в день в клинических исследованиях сообщалось о возникновении реакций гиперчувствительности, сопровождающихся сыпью, лихорадкой, ознобом и артериальной гипотензией. Те же симптомы наблюдались при повторном применении вемурафениба в дозе 240 мг однократно. Пациенты прекращали применение препарата и восстанавливались без осложнений.
Удлинение интервала QT
У пациентов, получавших вемурафениб в дозе 960 мг 2 раза в день, отмечалось удлинение интервала QTс по сравнению с исходным значением с 1 (3.3 мс; 95% ДИ 5 мс) по 15 (12.8 мс; 95% ДИ 14.9 мс) день терапии. Удлинение интервала QTс было пропорционально экспозиции вемурафениба. В среднем интервал QTс оставался стабильным (от 12 мс до 15 мс в ходе первого месяца терапии), наибольшее удлинение (15 мс; 95% ДИ 17.7 мс) отмечалось в ходе первых 6 месяцев терапии. У 1.5% пациентов отмечалось связанное с лечением абсолютное удлинение интервала QTс >500 мс (3 степень тяжести согласно Общей терминологии критериев побочных явлений). У 0.8% пациентов отмечалось удлинение интервала QTс >60 мс по сравнению с исходным значением.
При моделировании ситуации удлинения интервала QT при применении вемурафениба в дозе 960 мг 2 раза в день у 0.05% пациентов предполагается удлинение интервала QTcP >60 мс. Удлинение интервала QTcP прогнозируется для 0.2% пациентов с ожирением (ИМТ 45 кг/м2). Изменение интервала QTcP более чем на 60 мс по сравнению с исходным значением прогнозируется для 0.043% пациентов мужского пола и 0.046% пациентов женского пола. Удлинение интервала QTcP выше 500 мс прогнозируется для 0.05% пациентов мужского пола и 1.1% пациентов женского пола.
Пострегистрационное применение
Перечисленные ниже нежелательные реакции были выявлены в ходе пострегистрационного применения вемурафениба на основе спонтанных сообщений и случаев, описанных в литературных источниках. Нежелательные реакции указаны с учетом классов систем органов, перечисленных в Медицинском словаре для регуляторной деятельности MedDRA.
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы):
прогрессирование предшествующего хронического миеломоноцитарного лейкоза с мутацией в гене NRAS (частота неизвестна); прогрессирование предшествующей аденокарциномы поджелудочной железы с мутацией в гене KRAS (частота неизвестна).
Нарушения со стороны кожи и подкожных тканей: лекарственная сыпь с эозинофилией и системными симптомами (DRESS синдром) (частота неизвестна).
Нарушения со стороны печени и желчевыводящих путей: поражение печени (нечасто).
Нарушения со стороны желудочно-кишечного тракта: панкреатит (нечасто).
Нарушения со стороны крови и лимфатической системы: нейтропения (нечасто).
Нарушения со стороны скелетно-мышечной и соединительной ткани: контрактура Дюпюитрена (нечасто), ладонный фасциальный фиброматоз (нечасто).
Нарушения со стороны почек и мочевыводящих путей: острое повреждение почек (частота неизвестна).
Травмы, интоксикации и осложнения манипуляций: лучевая болезнь (частота неизвестна), включая лучевой дерматит, лучевое поражение кожи, лучевой пневмонит, лучевой эзофагит, лучевой проктит, лучевой гепатит, лучевой цистит и лучевой некроз (см. раздел «Особые указания»).
Влияние на результаты лабораторных и инструментальных исследований: отклонения лабораторных параметров, характеризующих функции печени, включая повышение активности АЛТ в 5 и более раз превышающее верхнюю границу нормы (ВГН), повышение активности щелочной фосфатазы в 2 и более раза выше ВГН, повышение активности АЛТ в 3 и более раза выше ВГН с одновременным повышением концентрации билирубина в более чем 2 раза выше ВГН; повышение концентрации креатинина от незначительного до выраженного.
Описание отдельных нежелательнх реакций, выявленных в ходе пострегистрационного применения
Острое повреждение почек: в ходе терапии препаратом Зелбораф® сообщалось о различных случаях нарушений со стороны почек, включая повышение концентрации креатинина легкой/средней степени тяжести, острый интерстициальный нефрит и острый тубулярный некроз. Некоторые случаи были на фоне дегидратации. В большинстве случаев повышение концентрации креатинина было обратимо (см. раздел «Особые указания»).
Особые популяции пациентов
Пациенты пожилого возраста
У пациентов в возрасте 65 и более лет более вероятно развитие нежелательных реакций, в том числе, таких как плоскоклеточная карцинома кожи, снижение аппетита и нарушения со стороны сердца.
Пол
При применении препарата Зелбораф® среди нежелательных реакций 3 степени тяжести, наблюдавшихся более часто у женщин, чем у мужчин, были сыпь, артралгия и фотосенсибилизация.
Пациенты с метастазами в головной мозг
У пациентов с метастазами в головной мозг (с/без проявления симптомов) терапия вемурафенибом была безопасной и в целом хорошо переносилась. Профиль безопасности был сопоставим с ранее изученным, новых данных по безопасности не выявлено.
Передозировка
Специфического антидота, который можно было бы использовать в случаях передозировки препаратом Зелбораф®, не существует.
При появлении нежелательных реакций необходимо назначить соответствующее симптоматическое лечение.
Дозолимитирующая токсичность препарата Зелбораф® проявлялась в виде сыпи с зудом и утомляемости. В случае подозрения на передозировку необходимо прекратить прием препарата Зелбораф® и назначить поддерживающую терапию.
Взаимодействие с другими лекарственными средствами
Взаимодействие вемурафениба и субстратов цитохрома P450 (CYP)
Результаты исследования лекарственных взаимодействий in vivo, проведенного с участием пациентов с метастатической меланомой, свидетельствуют о том, что вемурафениб является умеренным ингибитором изофермента CYP1A2 и индуктором изофермента CYP3A4.
Вемурафениб может уменьшать экспозицию веществ, метаболизирующихся преимущественно при участии изофермента CYP3A4. В связи с этим возможно уменьшение эффективности контрацептивных препаратов, метаболизирующихся при участии изофермента CYP3A4.
Одновременное применение вемурафениба с лекарственными препаратами, метаболизирующимися посредством изоферментов CYP1A2 и CYP3A4, и обладающими узким терапевтическим индексом не рекомендуется. При невозможности избежать их совместного применения следует соблюдать осторожность, поскольку вемурафениб может увеличивать экспозицию препаратов-субстратов изофермента CYP1A2 и снижать экспозицию препаратов-субстратов изофермента CYP3A4 в плазме крови.
При необходимости рекомендуется снижение дозы лекарственного препарата, являющегося субстратом изофермента CYP1A2. В ходе проведения клинического исследования было выявлено, что совместное применение с вемурафенибом повышает AUC кофеина (субстрата изофермента CYP1A2) в среднем в 2.6 раза (максимально в 5 раз), тогда как AUC мидазолама (субстрата изофермента CYP3A4) снижается в среднем на 39% (максимально до 80%). В ходе другого клинического исследования вемурафениб увеличивал AUClast и AUCinf тизанидина (субстрата изофермента CYP1A2), применяемого однократно в дозе 2 мг, в 4.2 и 4.7 раз, соответственно. AUC декстрометорфана (субстрата CYP2D6) и его метаболита декстрофана увеличивалась приблизительно на 47% вследствие эффекта на кинетику декстрометорфана, который может не быть опосредован ингибированием изофермента CYP2D6.
В исследовании in vitro вемурафениб в концентрации 10 мкМ вызывал слабое ингибирование изофермента CYP2B6. Неизвестно, будет ли вемурафениб при достижении равновесной концентрации 100 мкМ в крови пациентов (примерно 50 мкг/мл) уменьшать содержание субстратов изофермента CYP2B6, таких как бупропион, при их одновременном применении.
Одновременное применение вемурафениба и варфарина (субстрата изофермента CYP2C9) может приводить к увеличению AUC последнего на 18%. Следует соблюдать осторожность и предусмотреть дополнительный мониторинг международного нормализованного отношения (МНО) в случае, если вемурафениб используется одновременно с варфарином.
В ходе исследований in vitro было показано, что вемурафениб является умеренным ингибитором изофермента CYP2C8. Значение данного наблюдения для человека неизвестно, однако риск клинически значимого влияния на субстраты изофермента CYP2C8 при совместном применении не может быть исключен. Следует соблюдать осторожность при совместном применении вемурафениба и субстратов изофермента CYP2C8 с узким терапевтическим диапазоном, поскольку вемурафениб может повышать концентрацию последних.
Во избежание взаимодействий с лекарственными препаратами после прекращения применения вемурафениба может потребоваться период вымывания продолжительностью 8 дней.
Взаимодействие вемурафениба с переносчиками лекарственных препаратов
В ходе исследований in vitro было показано, что вемурафениб является субстратом и ингибитором Р-гликопротеина и BCRP (breast cancer resistance protein, белок устойчивости рака молочной железы). Клиническое значение этих данных неизвестно.
Нельзя исключать, что при одновременном применении с вемурафенибом возможно повышение экспозиции препаратов, транспортируемых при помощи Р-гликопротеина (например, алискирен, колхицин, дигоксин, эверолимус, фексофенадин) или BCRP (например, метотрексат, митоксантрон, розувастатин).
В ходе клинического исследования лекарственного взаимодействия с применением дигоксина (препарат-субстрат Р-гликопротеина) было выявлено, что при использовании многократных пероральных доз вемурафениба (960 мг 2 раза в день) увеличивалась экспозиция однократной пероральной дозы дигоксина (увеличение общей системной экспозиции (AUClast) и Cmax дигоксина в 1.8 и 1.5 раз, соответственно). Необходимо соблюдать осторожность при одновременном применении вемурафениба и субстратов Р-гликопротеина. В случае необходимости рекомендуется снизить дозу сопутствующего препарата-субстрата Р-гликопротеина.
В ходе исследований in vitro было показано, что вемурафениб является ингибитором белка BSEP (Bile Salt Export Pump, экспортирующая помпа желчных кислот). Клиническое значение этих данных неизвестно.
Данные о влиянии вемурафениба на другие переносчики отсутствуют.
Влияние сопутствующих препаратов на вемурафениб
В исследованиях in vitro показано, что метаболизм вемурафениба происходит при участии изофермента CYP3A4 и путем глюкуронирования.
Следует соблюдать осторожность при одновременном применении вемурафениба и мощных ингибиторов изофермента CYP3A4, глюкуронирования и/или транспортных белков (например, ритонавира, саквинавира, телитромицина, кетоконазола, итраконазола, вориконазола, позаконазола, нефазодона, атазанавира).
Следует избегать одновременного применения вемурафениба и с мощными индукторами Р-гликопротеина, глюкуронирования, изофермента CYP3A4 (например, рифампицином, рифабутином, карбамазепином, фенитоином или зверобоем продырявленным) из-за возможного снижения экспозиции вемурафениба.
При одновременном применении с рифампицином (мощным индуктором изофермента CYP3A4) плазменная концентрация (AUC) вемурафениба снижалась на 40% после однократного приема дозы 960 мг (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика/Метаболизм»).
В исследованиях in vitro показано, что вемурафениб является субстратом Р-гликопротеина и BCRP. Данных по влиянию индукторов или ингибиторов Р-гликопротеина и BCRP на экспозицию вемурафениба нет. Нельзя исключить, что на фармакокинетические параметры вемурафениба могут оказывать влияние препараты, ингибирующие или влияющие на Р-гликопротеин (например, верапамил, кларитромицин, циклоспорин, ритонавир, хинидин, дронедарон, амиодарон, итраконазол, ранолазин) и BCRP (циклоспорин, гефитиниб).
Данные о том, является ли вемурафениб субстратом для других переносчиков, отсутствуют.
Лучевая терапия
У пациентов, получающих вемурафениб, наблюдалось усиление токсического действия лучевой терапии (см. разделы «Особые указания» и «Побочное действие», подраздел «Пострегистрационное применение»). В большинстве случаев пациенты получали лучевую терапию в режиме ≥2 Гр/сутки (гипофракционный режим).
Особые указания
Перед применением препарата Зелбораф® пациенты должны пройти валидированный тест на наличие BRAF V600 мутации. Эффективность и безопасность препарата Зелбораф® у пациентов, опухоли которых несут редкие BRAF V600 мутации, отличные от V600E и V600K, не была убедительно доказана. Препарат Зелбораф® не следует применять у пациентов со злокачественной меланомой, экспрессирующей BRAF дикого типа.
Реакции гиперчувствительности
При применении препарата Зелбораф® сообщалось о случаях серьезных реакций гиперчувствительности, в том числе об анафилаксии.
Тяжелые реакции гиперчувствительности могут включать генерализованную сыпь, эритему или артериальную гипотензию.
При развитии тяжелых реакций гиперчувствительности дальнейший прием препарата Зелбораф® следует прекратить.
Дерматологические реакции
При применении препарата Зелбораф® сообщалось о тяжелых дерматологических реакциях, включая редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза в опорном клиническом исследовании. Зарегистрированы случаи появления лекарственной сыпи с эозинофилией и системными симптомами (DRESS синдрома) на фоне применения препарата Зелбораф®.
При развитии тяжелых дерматологических реакций дальнейший прием препарата Зелбораф® следует прекратить.
Усиление действия лучевой терапии
У пациентов, получающих лучевую терапию до, во время или после применения вемурафениба, отмечались случаи повышения чувствительности к лучевой терапии и лучевой дерматит (см. разделы «Взаимодействие с другими лекарственными средствами» и «Побочное действие», подраздел «Пострегистрационное применение»). Большинство подобных случаев представляли собой нарушения со стороны кожи, но некоторые случаи поражения висцеральных органов заканчивались фатальным исходом. Необходимо соблюдать осторожность при применении вемурафениба одновременно или последовательно с лучевой терапией.
Удлинение интервала QT
Удлинение интервала QT может способствовать увеличению риска возникновения желудочковых аритмий, включая желудочковую тахикардию типа «пируэт». Применение препарата Зелбораф® не рекомендуется у пациентов с не поддающимися коррекции нарушениями водно-электролитного баланса (в том числе баланса магния), синдромом удлиненного интервала QT, а также у пациентов, получающих лекарственные препараты, способствующие удлинению интервала QT.
ЭКГ и исследование водно-электролитного баланса (в том числе баланса магния) необходимо выполнить перед началом приема препарата и после изменения дозы препарата Зелбораф®. В дальнейшем регистрацию ЭКГ и определение содержания электролитов рекомендуется проводить ежемесячно в течение первых 3 месяцев приема препарата, а затем через каждые 3 месяца или чаще при наличии клинических симптомов. Если интервал QTс>500 мс, начинать прием препарата Зелбораф® не рекомендуется. Если во время лечения интервал QTс составит более 500 мс, необходимо временно прервать прием препарата Зелбораф®, устранить нарушения водно-электролитного баланса (в том числе баланса магния) и добиться коррекции факторов риска удлинения интервала QT (например, хронической сердечной недостаточности, брадиаритмии). После уменьшения интервала QTс до значения, составляющего менее 500 мс, следует возобновить прием препарата в более низкой дозе, как описано в таблицах 1 и 2. Если после коррекции сопутствующих факторов риска значение интервала QTс составляет >500 мс и отличается от исходного значения, зарегистрированного перед началом приема препарата, более чем на 60 мс, прием препарата Зелбораф® необходимо прекратить.
Офтальмологические реакции
При применении препарата Зелбораф® были зарегистрированы серьезные офтальмологические реакции, включавшие увеит (в том числе ирит) и окклюзию вен сетчатки. Лечащему врачу рекомендуется регулярно наблюдать за пациентом на предмет развития офтальмологических реакций.
Совместное применение с ипилимумабом
При совместном применении вемурафениба (960 мг или 720 мг два раза в день) с ипилимумабом (3 мг/кг) были зарегистрированы бессимптомное повышение активности трансаминаз и концентрации билирубина 3 степени тяжести. На основании этих данных совместное применение вемурафениба и ипилимумаба не рекомендуется.
Злокачественные новообразования
Плоскоклеточная карцинома кожи
Потенциальные факторы риска развития плоскоклеточной карциномы кожи включают возраст (≥65 лет), рак кожи в анамнезе, а также постоянное воздействие солнца.
Всем пациентам рекомендуется пройти обследование у дерматолога перед началом приема препарата. При возникновении любых подозрительных поражений кожи их необходимо иссечь, направить на дерматопатологическое исследование и провести терапию в соответствии с местными стандартами оказания медицинской помощи. При развитии у пациента плоскоклеточной карциномы кожи рекомендуется продолжить лечение препаратом Зелбораф® без коррекции дозы. Врач должен проводить обследование пациента ежемесячно во время терапии и в течение 6 месяцев после лечения препаратом или до начала другой противоопухолевой терапии. Пациенты должны быть проинструктированы о необходимости проинформировать врача о появлении любых изменений на коже.
Плоскоклеточная карцинома другой (некожной) локализации
У пациентов, получавших препарат Зелбораф®, зарегистрированы случаи развития плоскоклеточной карциномы другой локализации.
Перед началом приема препарата необходимо провести обследование головы и шеи, состоящее, как минимум, из визуального осмотра слизистой оболочки полости рта и пальпации лимфатических узлов, и повторять это обследование через каждые 3 месяца во время приема препарата. Кроме того, перед началом приема препарата необходимо выполнить компьютерную томографию органов грудной клетки, а во время приема препарата повторять это обследование через каждые 6 месяцев.
Перед началом приема препарата и по завершении терапии или при наличии клинических симптомов рекомендуется проводить исследования органов малого таза (у женщин) и прямой кишки.
После прекращения приема препарата Зелбораф® обследования с целью выявления плоскоклеточной карциномы другой локализации необходимо продолжать в течение 6 месяцев или до начала другой противоопухолевой терапии. Выявленные патологические изменения следует вести в соответствии с клинической практикой.
Новый очаг первичной меланомы
При применении препарата Зелбораф® были зарегистрированы случаи возникновения новых очагов первичной меланомы. Во всех случаях лечение было хирургическим, и пациенты продолжили лечение без коррекции дозы. Обследование на предмет поражений кожи следует проводить в соответствии с рекомендациями, приведенными выше для плоскоклеточной карциномы кожи.
Другие злокачественные новообразования
Исходя из механизма действия, вемурафениб может вызывать прогрессирование злокачественных новообразований, ассоциированных с мутациями в гене RAS. Требуется тщательно рассмотреть вопрос об отношении ожидаемой пользы к возможному риску применения препарата у пациентов с ранее перенесенными или сопутствующими злокачественными новообразованиями, ассоциированными с мутациями в гене RAS.
Поражение печени
При применении вемурафениба зарегистрированы случаи поражения печени, включая тяжелые.
Пациенты с нарушением функции почек
Коррекции стартовой дозы у пациентов с легкой или средней степенью почечной недостаточности не требуется. Недостаточно данных для определения необходимости в коррекции дозы у пациентов с тяжелой степенью почечной недостаточности.
Лабораторные данные
«Печеночные» пробы
На фоне терапии вемурафенибом могут возникнуть патологические изменения лабораторных параметров, характеризующих функции печени. Перед началом приема препарата необходимо оценить активность «печеночных» ферментов (трансаминаз и щелочной фосфатазы), а также концентрацию билирубина. Во время приема препарата следует контролировать эти параметры ежемесячно или чаще, в случае возникновения клинических симптомов. При выявлении патологических изменений лабораторных параметров следует уменьшить дозу, прервать или прекратить прием препарата (см. таблицу 1).
Креатинин
Отмечалось повышение концентрации креатинина, в большинстве случаев, от легкой (>1-1.5 х ВГН) до средней (>1.5-3 х ВГН) степеней тяжести. Как правило, повышение концентрации креатинина было обратимо (см. раздел «Побочное действие»). Перед началом терапии необходимо определить концентрацию креатинина плазмы крови и контролировать его во время приема препарата в случае возникновения клинических симптомов (см. таблицу 1).
Фотосенсибилизация
У пациентов, получавших препарат Зелбораф®, были зарегистрированы реакции фотосенсибилизации от легкой до тяжелой степени тяжести. Всем пациентам во время приема препарата Зелбораф® следует избегать пребывания на солнце. Пациентам, принимающим препарат, во время пребывания на открытом воздухе следует носить одежду, защищающую от солнца, и использовать солнцезащитные средства с УФА (ультрафиолетовое излучение диапазона А) — и УФВ (ультрафиолетовое излучение диапазона В) — фильтрами и бальзам для губ (солнцезащитный фактор ≥30) для защиты от солнечных ожогов.
При реакциях фотосенсибилизации 2 степени (непереносимость) и выше рекомендуется изменить дозу препарата (см. таблицу 1).
Ладонный фасциальный фиброматоз и контрактура Дюпюитрена
На фоне лечения препаратом Зелбораф® сообщалось о случаях ладонного фасциального фиброматоза и контрактуры Дюпюитрена. Большинство случаев было легкой и умеренной степеней тяжести; отмечались тяжелые, инвалидизирующие случаи контрактуры Дюпюитрена.
Для купирования симптомов следует снизить дозу препарата, прервать терапию или полностью прекратить лечение (см. раздел «Способ применения и дозы», подраздел «Изменение дозы»).
Влияние вемурафениба на другие лекарственные препараты
Вемурафениб может повышать экспозицию лекарственных препаратов, которые преимущественно метаболизируются при участии изофермента CYP1A2, и снижать экспозицию препаратов, которые преимущественно метаболизируются при участии изофермента CYP3А4, в том числе пероральных контрацептивов.
Необходимость коррекции дозы препаратов, метаболизирующихся преимущественно при участии изоферментов CYP1A2 и CYP3А4, следует оценить до начала терапии препаратом Зелбораф® в зависимости от терапевтического индекса препарата.
При одновременном применении препарата Зелбораф® и варфарина следует соблюдать осторожность и принимать во внимание МНО.
Влияние лекарственных препаратов на вемурафениб
На фармакокинетические параметры вемурафениба могут оказывать влияние препараты, ингибирующие или влияющие на Р-гликопротеин (например, верапамил, кларитромицин, циклоспорин, ритонавир, хинидин, дронедарон, амиодарон, итраконазол, ранолазин). По возможности следует избегать одновременного применения препарата Зелбораф® с мощными индукторами Р-гликопротеина, глюкуронирования, изофермента CYP3A4 (например, рифампицином, рифабутином, карбамазепином, фенитоином, зверобоем продырявленным). С целью сохранения эффективности препарата Зелбораф® следует рассмотреть альтернативные варианты лечения препаратами с меньшим индуцирующим потенциалом.
Уничтожение неиспользованного препарата или препарата с истекшим сроком годност и должно проводиться в соответствии с локальными требованиями.
Влияние на способность управлять транспортными средствами и механизмами
Исследования влияния препарата Зелбораф® на способность к вождению транспортных средств и работу с машинами и механизмами не проводились. Пациентов следует предупредить о возможном развитии головокружения, нарушений со стороны глаз и утомляемости, которые могут стать основанием для отказа от вождения.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 240 мг
По 8 таблеток в блистер, изготовленный из триплекса (ориентированный полиамид/алюминий/пленки поливинилхлоридной (ОПА/АЛ/ПВХ)) и фольги алюминиевой высокотемпературной.
7 блистеров вместе с инструкцией по применению помещают в картонную пачку.
Срок годности
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия хранения
Хранить при температуре не выше 30°С в оригинальной упаковке для защиты от влаги. Хранить в недоступном для детей месте.
Условия отпуска
Отпускается по рецепту.
Владелец Регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Производитель
Рош С.п.А., Италия
Roche S.p.A., Via Morelli 2, 20090 Segrate, Milano, Italy
Претензии потребителей направлять в компанию ЗАО «Рош-Москва» по адресу:
107031, Россия, г. Москва, Трубная площадь, д. 2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Вемурафениб — применение и показания
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 08 ноября 2020
3105
Вемурафениб (Зелбораф) – препарат из группы ингибиторов BRAF, применяемый для иммунотерапии метастазирующей меланомы на поздних стадиях. Он был одобрен FDA в августе 2011 года, а Европейским агентством лекарственных средств — в 2012 году.
Механизм действия. Что такое ингибиторы BRAF?
Зелбораф стал первым препаратом для лечения меланомы из группы ингибиторов BRAF. BRAF — ген, который кодирует одноименный белок-фермент. Он обеспечивает размножение клеток под контролем гормонов и факторов роста. В результате мутации гена BRAF происходят нарушения: избыточное деление клеток; ошибочная устойчивость клеток к апоптозу — запрограммированной естественной гибели. Это приводит к возникновению раковой опухоли. Вемурафениб блокирует белок BRAF. Препарат действует очень быстро: после начала приема таблеток размеры опухоли обычно существенно уменьшаются в течение месяца. Одновременно нормализуется состояние больного, уменьшается раковая интоксикация.

Показания к применению
Зелбораф применяется для лечения меланомы на поздних стадиях. Препарат эффективен только в том случае, если у больного имеется мутация гена BRAF. Если же в клетках меланомы этот ген нормален, то препарат может, напротив, ускорить рост опухоли. Поэтому перед назначением Вемурафениба всегда проводится молекулярно-генетическое исследование. Сегодня FDA одобрен инновационный тест THxID BRAF Kit, разработанный компанией bioMérieux.
Одна таблетка, покрытая пленочной оболочкой, содержит: активное вещество: вемурафениб1 — 240.00 мг;
1 Вемурафениб содержится в виде ко-преципитата вемурафениба — 240. 000 мг (30%) и гипромеллозы ацетата сукцината — 560.000 мг (70%).
вспомогательные вещества: кремния диоксид коллоидный безводный — 10.400 мг, крос-кармеллоза натрия — 29.400 мг, гидроксипропилцеллюлоза — 4.250 мг, магния стеарат — 5.950 мг;
пленочная оболочкег2: поливиниловый спирт — 8.000 мг, титана диоксид (Е171) — 4.982 мг, макрогол 3350 — 4.040 мг, тальк — 2.960 мг, железа оксид красный (Е172) — 0.018 мг.
2 Допускается использование готовой коммерческой смеси, например Опадрай II Розовый 85FI44
Двояковыпуклые, овальной формы таблетки, покрытые пленочной оболочкой, от розовато-белого до оранжево-белого цвета, с гравировкой «VЕМ» на одной стороне таблетки.
Препарат Зелбораф® показан для лечения неоперабельной или метастатической меланомы с мутацией BRAF V600.
Способ применения и дозировка
Вемурафенибом можно лечить только тех пациентов, у которых установлено наличие BRAF V600 мутации при помощи валидированного теста.
Дозирование в обычных условиях
Рекомендуемая доза препарата Зелбораф® составляет 960 мг (4 таблетки по 240 мг) 2 раза в день, суточная доза — 1920 мг. Первую дозу препарата следует принять утром, вторую — вечером, интервал между приемами препарата должен составлять около 12 часов. Обе дозы следует принимать или за 1 час до еды, или через два часа после еды. Биодоступность препарата в комбинации с пищей до сих пор не полностью изучена. Поэтому эти временные промежутки при приеме препарата должны строго выдерживаться.
Таблетки препарата Зелбораф® следует проглатывать целиком, запивая стаканом воды. Разжевывать или дробить таблетки нельзя.
Продолжительность приема препарата
Прием препарата Зелбораф® рекомендуется продолжать до появления признаков прогрессирования заболевания или неприемлемых токсических эффектов препарата (см. Таблицу 1).
Пропущенный прием
Если очередной прием пропущен, его можно провести позже для поддержания режима приема 2 раза в день, однако интервал между пропущенным и последующим приемом должен составлять не менее 4 часов. Прием двойной дозы препарата недопустим.
Рвота
В случае возникновения рвоты после приема вемурафениба не следует принимать дополнительную дозу, а лечение должно быть продолжено в обычном режиме.
Изменение дозы
Появление симптомов нежелательных явлений или удлинение интервала.ОТ может потребовать уменьшения дозы, временного прерывания тлт прекращения терапии препаратом Зелбораф®. Следует принимать во внимание длительный период полувыведения вемурафениба. При возникновении тяжелых нежелательных явлений следует рассмотреть возможность усиления элиминации препарата активированным углем.
Таблица 1. Изменение дозы
| Степень тяжести нежелательных явлений* | Рекомендуемые изменения дозы препарата Зелбораф® в период лечения | Рекомендуемые изменения дозы препарата Зелбораф® при возобновлении прерванного лечения |
| Степень 1 или Степень 2 (переносимая) | Продолжать прием препарата Зелбораф® в дозе 960 мг 2 раза в день. | Не встречается. |
| Степень 2 (непереносимая) или Степень 3 | ||
| 1. Первое проявление^ | Прервать прием препарата до уменьшения степени тяжести 0- 1. | Возобновить прием препарата в дозе 720 мг 2 раза в день. |
| 2. Второе проявление^ | Прервать прием препарата до уменьшения степени тяжести 0- 1. | Возобновить прием препарата в дозе 480 мг 2 раза в день |
| 3. Третье проявление^ | Терапию отменить навсегда. | Не встречается. |
| Степень 4 | ||
| 1. Первое проявление^ | Прервать прием препарата Зелбораф® до уменьшения степени тяжести 0-1. | Возобновить прием препарата в дозе 480 мг 2 раза в день. |
| 2. Второе проявление^ | Терапию отменить навсегда. | Не встречается. |
* Степень тяжести симптомов нежелательных явлений в соответствии с Общими критериями токсичности нежелательных явлений Национального института рака США, версия 4.0 (СТСАЕ v 4.0).
^ Каждое нежелательное явление, при котором было клинически показано и предпринято прерывание терапии и снижение дозы.
Корректировка дозы или прерывание терапии при развитии плоскоклеточной карциномы кожи не рекомендуется. Снижение дозы меньше 480 мг два раза в день не рекомендуется.
Дозирование у особых групп пациентов
Пожилые пациенты
Коррекции дозы у пациентов в возрасте 65 лет и старше не требуется.
Дети
Безопасность и эффективность применения препарата Зелбораф® у детей в возрасте до 18 лет не установлены. Вемурафениб не одобрен для применения у пациентов в возрасте до 18 лет (см. раздел «Фармакокинетика у особых групп пациентов»).
Почечная недостаточность
Эффективность и безопасность препарата Зелбораф® у пациентов со сниженной функцией почек не изучались.
Печеночная недостаточность
Эффективность и безопасность препарата Зелбораф® печени не изучались.
Препарат Зелбораф® противопоказан пациентам с повышенной чувствительностью к ве мурафенибу или к другим компонентам препарата в анамнезе.
Особые указания и меры предосторожности при применении
Плоскоклеточная карцинома кожи
При лечении препаратом Зелбораф®, как правило, в начале курса лечения очень часто описывают случаи развития плоскоклеточной карциномы кожи (в том числе случаи, классифицированные как кератоакантома и смешанная кератоакантома). Потенциальными факторами риска являются возраст (≥65 лет), ранее перенесенный рак кожи и длительное воздействие солнечных лучей. В большинстве случаев плоскоклеточная карцинома кожи была удалена хирургическим путем и пациенты смогли продолжить лечение без коррекции дозы препарата.
Всем пациентам до начала терапии рекомендуется пройти обследование у дерматолога и регулярно наблюдаться на протяжении всего курса лечения. При возникновении любых подозрительных поражений кожи их необходимо иссечь, направить на патоморфологическое исследование и провести терапию в соответствии с местными стандартами оказания медицинской помощи. Наблюдение за пациентом на предмет появления кожных злокачественных новообразований должно продолжаться в течение 6 месяцев после прекращения лечения вемурафенибом или до начала лечения другими противоопухолевыми препаратами.
Пациенты должны быть проинструктированы о необходимости обращаться к врачу в случае проявления любых кожных изменений, включая сыпь и светочувствительность.
Плоскоклеточная карцинома другой локализации
Были получены сообщения о некожной плоскоклеточной карциноме у пациентов, получавших вемурафениб. Перед началом приема препарата необходимо провести обследование головы и шеи, состоящее как минимум из визуального осмотра слизистой оболочки полости рта и пальпации лимфатических узлов и повторять это обследование через каждые 3 месяца во время приема препарата. Кроме того, перед началом приема препарата необходимо выполнить компьютерную томографию органов грудной клетки, а во время приема препарата повторять это обследование через каждые 6 месяцев. Перед началом приема препарата и по завершении терапии или при наличии клинических симптомов рекомендуется проводить исследования прямой кишки и органов малого таза (у женщин).
После прекращения приема препарата Зелбораф®, обследования с целью выявления плоскоклеточных карцином необходимо продолжать в течение 6 месяцев или до начала другой противоопухолевой терапии. Выявленные патологические изменения следует расценивать как клиническое показание к проведению обследования.
Вновь возникшая первичная меланома
В клинических исследованиях сообщалось о вновь возникших первичных меланомах. В этом случае проводилось иссечение и пациенты продолжали лечение без изменения дозы. Мониторинг патологических изменений кожи должен проводиться, как это описано выше для плоскоклеточной карциномы кожи.
Прочие злокачественные новообразования
Исходя из механизма действия, вемурафениб может вызвать прогрессирование заболеваний, ассоциированных с мутацией RAS (см. раздел «Побочное действие»), Вемурафениб следует применять с осторожностью у пациентов с ранее перенесенными или сопутствующими онкологическими заболеваниями, ассоциированными с мутациями RAS.
Реакции гиперчувствительности
На фоне приема препарата Зелбораф® зарегистрированы случаи серьезных реакций гиперчувствительности, в том числе анафилактические реакции. Тяжелые реакции гиперчувствительности включали синдром Стивенса-Джонсона, генерализированную сыпь и эритему или артериальную гипотензию. При развитии серьезных реакций гиперчувствительности прием препарата Зелбораф® необходимо прекратить навсегда (см. раздел «Побочное действие»).
Дерматологические реакции
В ключевых клинических исследованиях сообщалось о тяжелых дерматологических реакциях у пациентов, получавших вемурафениб, которые включали редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза. Зарегистрированы случаи появления кожной сыпи в сочетании с эозинофилией и системными симптомами (синдром DRESS) на фоне применения вемурафениба У пациентов, перенесших тяжелую кожную реакцию, лечение вемурафенибом должно быть прекращено навсегда.
Усиление действия радиационной токсичности
Случаи побочных эффектов лучевой терапии и лучевой чувствительности были зарегистрированы у пациентов, получавших лечение при облучении до, во время или после приема препарата Зелбораф® (см. раздел «Побочное действие»).
Препарат Зелбораф® следует использовать с осторожностью, учитывая одновременное или последовательное применение с лучевой терапией.
Удлинение интервала QT
Удлинение интервала QT, пропорциональное продолжительности применения препарата, наблюдалось в ходе II фазы неконтролируемого открытого исследования интервала QT, в котором участвовали ранее леченые пациенты с метастатической меланомой. Удлинение интервала QT может способствовать увеличению риска возникновения желудочковых аритмий, включая желудочковую тахикардию типа «пируэт». Применение препарата
Зелбораф® не рекомендуется у пациентов с неподцающимися коррекции нарушениями электролитного баланса и синдромом удлинения интервала QT, а также у пациентов, получающих лекарственные средства, способствующие удлинению интервала QT.
Перед началом приема препарата и после каждого изменения дозы препарата Зелбораф® необходимо выполнить ЭКГ и исследование электролитного баланса. В дальнейшем регистрацию ЭКГ и определение содержания электролитов необходимо повторять ежемесячно в течение первых 3 месяцев приема препарата, а затем через каждые 3 месяца или чаще при наличии клинических показаний. Если QTc составляет более 500 мс, начинать прием препарата Зелбораф® не рекомендуется. Если во время лечения QTc превысит 500 мс (Степень 3 и выше согласно Общей терминологии критериев побочных явлений), необходимо временно прервать прием препарата Зелбораф®, устранить электролитные нарушения и добиться коррекции факторов риска удлинения интервала QT (например, хронической сердечной недостаточности, брадиаритмии). Не следует повторно инициировать лечение до тех пор, пока интервал QT не уменьшится менее 500 мс, и повторное лечение следует начинать с уменьшенной дозы. Если после коррекции сопутствующих факторов риска значение QTc составляет 500 мс и отличается от исходного значения, зарегистрированного перед началом приема препарата, более чем на 60 мс прием препарата Зелбфаф® необходимо прекратить навсегда.
Влияние на функцию печени/лабораторные показатели функции печени
При применении препарата Зелбораф® сообщалось о развитии нарушений функции печени, которые в некоторых случаях были тяжелыми.
Применение препарата Зелбораф® может приводить к повышению уровня печеночных ферментов, включая АЛТ≥5×ВГН (верхняя граница нормы), щелочной фосфатазы ≥2×ВГН и АЛТ≥3×ВГН при одновременном повышении концентрации билирубина (>2×ВГН). Печеночные ферменты (трансаминазы и щелочная фосфатаза), а также уровень билирубина должны быть определены до начала лечения, а во время приема препарата следует контролировать эти параметры ежемесячно или чаще при возникновении клинических показаний. При выявлении патологических изменений лабораторных параметров следует уменьшить дозу, прервать или прекратить прием препарата. Рекомендации по корректировке дозы смотрите в разделе «Способ применения и дозировка», Таблица 1.
Влияние на функцию почек/лабораторные показатели функции почек
Сообщалось о многочисленных случаях взаимосвязи препарата Зелбораф® и поражением почек, которые колебались от легкого/умеренного повышения уровня креатинина до острого интерстициального нефрита и острого тубулярного некроза.
Преимущественно речь шла о легком (>1-1.5×ВГН) до умеренного (>1.5-3×ВГН) повышения уровня креатинина. Повышение уровня креатинина в большинстве случаев было преходящим (см. раздел «Побочное действие»).
Уровень креатинина должен быть определен до начала лечения, а во время приема препарата следует контролировать регулярно при возникновении клинических показаний. Рекомендации по корректировке дозы смотрите в разделе «Способ применения и дозировка», Таблица 1.
Указанные там степени тяжести повышения уровня креатинина определены как: Степень 1 = повышение >0.3 мг/дл или 1.5-2-х кратное повышение от исходного уровня; Степень 2 = 2-3-x кратное повышение от исходного уровня; Степень 3 = более чем 3-х кратное повышение от исходного уровня или >4 мг/дл.
Фоточувствительность
У пациентов, получавших препарат Зелбораф® в ходе клинических исследований, были зарегистрированы реакции фоточувствительности разной степени тяжести (см. раздел «Побочное действие»). Всем пациентам во время приема препарата Зелбораф® следует избегать пребывания на солнце. При пребывании на открытом воздухе во время приема препарата пациентам следует носить защитную одежду и использовать солнцезащитные средства с УФА- и УФВ-фильтрами и бальзам для губ (солнцезащитный фактор ≥30) для защиты от солнечных ожогов.
При реакциях фоточувствительности Степени 2 и выше (неперносимость) рекомендуется
изменить дозу препарата.
Фиброматозные изменения (контрактура Дюпюитрена, подошвенный фасциальный фиброматоз, болезнь Пейрони)
Сообщалось о контрактуре Дюпюитрена и подошвенном фасциальном фиброматозе при применении вемурафениба. Большинство случаев относились к легкой или средней степени тяжести, но также были зарегистрированы тяжелые инвалидизирующие случаи контрактуры Дюпюитрена (см. раздел «Дополнительная информация о выявленных нежелательных реакциях»). Зарегистрирован один случай, где фибропластическая индурация полового члена (болезнь Пейрони) сочетается с контрактурой Дюпюитрена.
Время до начала заболевания, в большинстве случаев фиброматозных изменений, могло составлять от нескольких недель до 1 года.
В таких случаях необходимо уменьшить дозу препарата, приостановить лечение или прекратить прием препарата (см. раздел «Изменение дозы»).
Офтальмологические реакции
Сообщалось о серьезных офтальмологических реакциях, включавших увеит. Необходимо регулярное наблюдение за пациентом на предмет развития офтальмологических реакций.
Совместное применение с ипилимумабом
В ходе исследования I фазы зарегистрированы случаи бессимптомного повышения концентраций трансаминаз и билирубина 3 степени при одновременном применении ипили- мумаба (3 мг/кг) и вемурафениба (960 мг два раза в день или 720 мг два раза в день). На основании этих данных одновременное применение ипилимумаба и вемурафениба не рекомендуется.
Влияние препарата Зелбораф® на ферменты, метаболизирующие лекарственные средства
Вемурафениб является умеренным ингибитором CYP1А2 и индуктором CYP3A4.
Совместное применение вемурафениба повышает AUC кофеина (субстрата CYP1A2) в 2.6 раза. Поэтому пациенты должны быть проинформированы, что им следует уменьшить потребление кофе, сахара и шоколада. Этих же рекомендаций следует придерживаться при приеме субстратов CYP1A2, таких как теофиллин, лидокаин, клозапин, кломипрамин, дулоксетин, флутамид, имипрамин, миансерин, оланзапин, ондансетрон, тербинафин, тизанидин и золмитриптан.
При одновременном приеме препаратов вемурафениб и мидазолам (субстрата CYP3A4) AUC мидозолама в одном клиническом исследовании снижалась на 39%.
Подобное снижение следует принимать во внимание при одновременном назначении субстратов CYP3A4, особенно препаратов с узким терапевтическим окном, таких как антагонисты витамина А, клопидогрел, празугел, кломипрамйн, инфосамид, онданестрон, винкаалкалоиды и т.д.
Одновременное назначение вемурафениба приводил к увеличениию на 18% AUC S- варфарина (субстрата CYP2C9) (см. раздел «Фармакокинетика»). Следует соблюдать осторожность и предусмотреть дополнительный мониторинг МНО (международного нормализованного отношения), если вемурафениб используется одновременно с антагонистами витамина К.
Лекарственные средства, ингибирующие или индуцирующие CYP3A4 Вемурафениб является субстратом CYP3A4 и поэтому совместное применение сильных ингибиторов или индукторов CYP3A4 может изменять концентрацию вемурафениба. Совместное назначение рифампицина, сильного индуктора CYP3A4, существенно снижало концентрацию вемурафениба в плазме (AUC) примерно на 40% после приема одной дозы 960 мг вемурафениба. (см. раздел «Метаболизм»). Сильные ингибиторы CYP3A4 (например, кетоконазол, итраконазол, кларитромицин, атазанавир, нефазадон, саквинавир, телитромицин, ритонавир, индинавир, нелфинавир, вориконазол) и индукторы CYP3A4 (например, фенитоин, карбамазепин, рифампин, рифабутин, рифапентин, фенобарбитал) должны применяться с осторожностью в случае одновременного назначения с вемурафенибом.
Вемурафениб in vitro является умеренным ингибитором CYP2C8. При одновременном приеме субстратов CYP2C8 следует соблюдать осторожность, так как вемурафениб может повысить их концентрацию.
Взаимодействие вемурафениба с переносчиками лекарственных средств
В ходе исследований in vitro было показано, что вемурафениб является как субстратом, так и ингибитором эффлюксного переносчика Р-гликопротеина (P-gp), а также белка устойчивости рака молочной железы (BCRP).
Исследование G028394 клинического взаимодействия лекарственного средства при использовании P-gp субстрата (дигоксина) показало, что пероральный многократный прием препарата Зелбораф (960 мг два раза в день) увеличил воздействие от одной дозы дигоксина, с приблизительным 1.8 и 1.5 кратным увеличением AUClast и Сmах, соответственно, для дигоксина. Следует проявлять осторожность при дозировании препарата Зелбораф® одновременно с P-gp субстратами. Снижение дозы сопутствующего субстрата P-gp может быть предусмотрено, если это клинически показано.
Влияние вемурафениба на препараты, которые являются субстратами BCRP, а также влияние индукторов и ингибиторов BCRP на экспозицию вемурафениба неизвестны.
В исследованиях in vitro продемонстрировано, что вемурафениб является ингибитором экспортирующей помпы желчных кислот (ВSEP). Значимость данного факта in vivo неизвестна. В случае приема лекарственных средств, влияющих на P-gp (таких как, например, верапамил) при выборе дозы препарата Зелбораф® следует соблюдать осторожность.
Беременность и лактация
Беременность
Клинические данные о применении препарата при беременности отсутствуют. При экспозиции вемурафениба беременным крысам и кроликам не было указаний на тератогенное действие в отношении эмбриона и плода (см. разделы «Доклинические данные» и «Тератогенность»).
Препарат Зелбораф® не следует принимать во время беременности, если это только не является абсолютно необходимым. Женщинам детородного возраста и мужчинам рекомендуется использовать эффективные методы контрацепции во время лечения препаратом Зелбораф® и, как минимум, в течение шести месяцев после окончания терапии.
Кормление грудью
Нет данных о том, попадает ли препарат Зелбораф® в материнское молоко. Однако риск попадания препарата в организм новорожденного при грудном вскармливании не исключается. Решение о прекращении грудного вскармливания или прекращении приема препарата Зелбораф® должно быть основано на результатах оценки пользы от грудного вскармливания для ребенка и пользы от приема препарата для матери.
Исследования влияния препарата Зелбораф® на способность управлять автомобилем или использовать механизмы не проводились. На основании возможности развития таких нежелательных явлений, как тошнота и рвота, следует соблюдать осторожность при вождении транспортных средств и использовании механизмов.
Нежелательные реакции
Наиболее частыми нежелательными реакциями (>30%) являются боли в суставах, слабость, сыпь, реакции фотосенсибилизации, тошнота, алопеция и зуд. Часто наблюдались плоскоклеточные карциномы кожи, которые в большинстве случаев могли быть удалены хирургическим путем.
Нежелательные реакции перечислены в соответствии с классификацией систем органов и с распределением по частоте возникновения. Частота нежелательных реакций определена следующим образом: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000) и очень редко (<1/10000), частота неизвестна (на основании имеющихся данных из постмаркетингового опыта применения препарата частоту определить невозможно).
Нарушения со стороны крови и лимфатической системы
Нечасто: нейтропения.
Нарушения со стороны иммунной системы
Очень редко: реакции гиперчувствительности.
Частота неизвестна: реакция на лекарство с эозинофилией и системными симптомами (DRESS).
Инфекционные и паразитарные заболевания
Часто: фолликулит.
Доброкачественные, злокачественные и неуточненные новообразования
Очень часто: плоскоклеточная карцинома кожи (23%), себорейный кератоз (14%), папиллома кожи (31%).
Часто: базальноклеточный рак, новые первичные меланомы.
Нечасто: плоскоклеточная карцинома некожной локализации.
Частота неизвестна: прогрессирование миеломоноцитарной лейкемии (CMML), прогрессирование имеющейся карциномы поджелудочной железы с наличием К-RAS мутации.
Нарушения со стороны обмена веществ и питания
Очень часто: снижение аппетита (23%), снижение массы тела (10%).
Нарушения со стороны нервной системы
Очень часто: головная боль (29%), искажение вкуса (14%), периферическая нейропатия
(11%).
Часто: парез лицевого нерва.
Нарушения со стороны органа зрения
Часто: окклюзия вен сетчатки, увеит.
Нарушения со стороны сердца и сосудов
Нечасто: васкулит.
Очень редко: удлинение интервала QTc.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Очень часто: кашель (15%).
Нарушения со стороны желудочно-кишечного тракта
Очень часто: тошнота (42%), диарея (32%), рвота (28%), запор (17%).
Нечасто: панкреатит.
Нарушения со стороны почек и мочевыводящих путей
Частота неизвестна: острые повреждения почек с легким/умеренным повышением уровня креатинина, в единичных случаях — острый интерстициальный нефрит и острый тубулярный некроз (смотрите раздел «Особые указания и меры предосторожности»).
Нарушения со стороны печени и желчевыводящих путей
Очень часто: повышение уровня гамма-глутамилтрансферазы (15%).
Часто: повышение уровней АЛТ, холестерина, щелочной фосфатазы.
Нечасто: повышение уровня ACT.
Нарушения со стороны кожи и подкожных тканей
Очень часто: сыпь (54%), реакция фотосенсибилизации (52%), алопеция (38%), зуд (32%), гиперкератоз (30%), макуло-папулезная сыпь (21%), актинический кератоз (17%), сухость кожи (19%), папулезная сыпь (13%), эритема (14%), синдром ладонно-подошвенной эритродизестезии (10%).
Часто: фолликулярный кератоз, панникулит, узловатая эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Частота неизвестна: лучевые повреждения (включая местную воспалительную реакцию в ранее облученной области, лучевые повреждения кожи, лучевой пневмонит, лучевой эзофагит, лучевой проктит, лучевой гепатит, лучевой цистит и лучевой некроз).
Нарушения со стороны скелетно-мышечной системы и соединительной ткани
Очень часто: артралгия (68%), миалгия (24%), боли в конечностях (18%), костномышечная боль (12%), боли в спине (11%), артрит (10%).
Часто: контрактура Дюпюитрена.
Частота неизвестна: подошвенный фасциальный фиброматоз.
Общие расстройства и нарушения в месте введения
Очень часто: утомляемость (57%), периферические отеки (25%), лихорадка (19%),солнечный ожог (14%), астения (11%).
Дополнительная информация о выявленных нежелательных реакциях
Реакции гиперчувствителъности
В одном клиническом исследовании развился один случай реакции гиперчувствительности с кожной сыпью, лихорадкой, ознобом и гипотонией через восемь дней от начала лечения препаратом Зелбораф® в дозе 960 мг два раза в день. Те же симптомы наблюдались при повторном применении вемурафениба в дозе 240 мг однократно. Терапия пациенту была отменена навсегда с отсутствием последующего ущерба здоровью.
Изменения интервала QT (смотрите также раздел «Особые указания и меры предосторожности»)
Анализ тенденций данных ЭКГ, проведенный централизованно на основании результатов одного открытого, неконтролируемого QT-подисследования II фазы на 132 пациентах, которых лечили препаратом Зелбораф® в дозе 960 мг два раза в день, показал умеренное увеличение интервала QTc в День 15 (12.8 мс; верхняя граница 95% ДИ — 14.9 мс) в сравнении с исходным значением в День 1 (3.3 мс; верхняя граница 95% ДИ — 5 мс). В этом исследовании наблюдалось зависимое от экспозиции изменение интервала QT; влияние на QTc было стабильным через месяц от начала лечения и значение QTc составляло 12-15 мс. Наиболее выраженное среднее изменение интервала QTc (15.1 мс; верхняя граница 95% ДИ — 17.7 мс) наблюдалось в пределах первых шести месяцев терапии (n=90). У двух пациентов (1.5%) абсолютное значение интервала QTc достигало >500 мс (Степень 3 по СТСАЕ), и только у одного пациента (0.8%) удлинение интервала QTc достигло >60 мс по сравнению с исходным значением. На основании расчетных моделей и симуляции изменений интервала QT получены следующие оценки: при дозировке препарата Зелбораф® 960 мг два раза в день процентное соотношение пациентов с изменением интервала QTcP по сравнению с исходным на более чем 60 мс составит 0.05%. Это процентное соотношение увеличивается на 0.2% у пациентов с избыточной массой тела с ИМТ 45 кг/м2. Процент пациентов с изменениями интервала QTcP по сравнению с исходным на более чем 60 мс составит 0.043% у мужчин и 0.046% у женщин. Процент пациентов со значением интервала QTcP более 5000 мс составит 0.05% у мужчин и 1.1% у женщин.
Изменения уровня креатинина по сравнению с исходными значениями
В рамках постмаркетингового наблюдения за применением препарата описаны изменения лабораторных значений креатинина. Изменения значений креатинина по сравнению с исходными значениями в одном клиническом исследовании III фазы суммированы в представленной ниже таблице.
| Вемурафениб (%) | Дакарбазин (%) | |
| Изменения ≥Степени 1 по сравнению с исходным (все степени) | 27.9 | 6.1 |
| Изменения ≥ Степени 1 по сравнению с исходным до Степени 3 и более | 1.2 | 1.1 |
| • До Степени 3 | 0.3 | 0.4 |
| • До Степени 4 | 0.9 | 0.4 |
Применение у пациентов пожилого возраста
Из всех пациентов с нерезектабельной или метастазирующей меланомой, которые получали лечение препаратом Зелбораф® в клиническом исследовании III фазы, 28% были в возрасте 65 лет и старше.
При применении препарата Зелбораф среди нежелате тьных раажяаяййаквейеыи тяжефти наблюдавшихся более часто у женщин, чем у мужчин, были сыпь, боли в суставах и фотосенсибилизация.
Специфического антидота, который можно было бы использовать в случаях передозировки препарата Зелбораф®, не существует. При появлении нежелательных реакций необходимо назначить соответствующее симптоматическое лечение. Проявления токсичности препарата Зелбораф®, ограничивающие возможность увеличения дозы препарата, включают сыпь, сопровождающуюся зудом, нервно-психическое истощение и боли в суставах. В случае подозрения на передозировку необходимо прекратить прием препарата Зелбораф® и назначить поддерживающую терапию. Следует иметь в виду длительный период полувыведения препарата Зелбораф®. В случае тяжелых нежелательных явлений следует подумать о возможности увеличения элиминации препарата путем назначения активированного угля.
Противоопухолевые средства — ингибиторы протеинкиназ.
Код АТС: L01XE15
Фармакологические свойства
Фармакодинамика
Вемурафениб является ингибитором серин-треонин киназы BRAF. Мутации в гене BRAF приводят к конститутивной активации белка BRAF, который может способствовать пролиферации клеток в отсутствие типичных факторов роста.
Доклинические данные, полученные в биохимических исследованиях, показали, что вемурафениб может сильно снижать активность BRAF киназ с активирующими мутациями в кодоне 600.
Клиническая эффективность
Эффективность препарата Зелбораф® была изучена в ходе клинического исследования III фазы (BRIM3) у 675 пациентов и в ходе 2 клинических исследований II фазы (BRIM2 и М025743) у 278 пациентов с мутацией гена BRAF (мутационный диагностический тест) cobas 4800 ВКАт V600).
Пациенты, ранее не получавшие лечения (BRMI3, N025926) 675 рациентов было рандомизировано по группам лечения препаратом Зелбораф® (960 мг дважды в день; n=337) либо дакарбазином (1000 мг/м2 каждые 3 недели; n=338). Рандомизированная выборка была стратифицирована в зависимости от стадии болезни, ЛДГ, функционального статуса по шкале ECOG* и географического региона. Группы лечения были сбалансированы по исходным характеристикам. Большинством рандомизированных пациентов в группе препарата Зелбораф® были мужчины (59%) и принадлежали к европеоидной расе (99%). Средний возраст составлял 56 лет (28% были старше 65 лет), все пациенты имели функциональный статус от 0 до 1 по шкале ECOG и большинство пациентов (66%) имело стадию заболевания M1с. Комбинированными первичными конечными точками оценки эффективности в исследовании были общая выживаемость (ОВ) и выживаемость без прогрессирования заболевания (ВБП). К моменту 3-месячного обновления данных общее число умерших пациентов составило 200 (78 в группе вемурафениба и 122 в группе дакарбазина).
Медиана ОВ в группе дакарбазина составила 7.9 месяцев и еще не была достигнута в группе вемурафениба. Отношение рисков составило 0.44 (95% ДИ 0.33-0.59). Различия в показателях ВБП оказались значительными и составили 5.3 месяца в группе вемурафениба по сравнению с 1.6 месяцами в группе дакарбазина; отношение рисков 0.26 (95% ДИ 0.20-0.33) (р<0.0001). Установленный суммарный ответ на терапию составил 48.4% по сравнению с 5.5%.
К моменту 24-месячного обновления данных медиана общей выживаемости составила 13.6 месяцев (95% ДИ 12.0-15.3) для вемурафениба и 9.7 месяцев (95% ДИ 7.9-12.8). Относительный риск составил 0.78 (95% ДИ 0.64-0.94).
Пациенты, не ответившие как минимум на один вид предшествующего системного лечения (BRIM2, NP22657)
Неконтролируемое исследование II фазы, проведенное у 132 пациентов с метастатической меланомой, получивших ранее хотя бы один курс системного лечения, показало в первичной конечной точке частоту ответа 52% (95% ДИ 43%-61%; подтвержденная частота ответа по оценке независимого наблюдательного комитета, ННК). Медиана времени до наступления ответа составила 1.4 месяца, в 75% случаев ответ достигался в пределах первых 1.6 месяца лечения. Средняя продолжительность ответа на терапию (по оценке ННК) составила 6.5 месяца. Медиана общей выживаемости составила 15.9 месяцев (95% ДИ: 11.2-19.3), 6-месячный показатель выживаемости составил 0.77 (95% ДИ: 0.69-0.84) и показатель выживаемости за 1 год составил 0.58 (95% ДИ: 0.48-0.66).
Пациенты с метастазами в головном мозге
Открытое, несравнительное, многоцентровое исследование II фазы (n=146) вемурафениба было проведено у взрослых пациентов с гистологически подтвержденной метастатической меланомой с наличием В RAF V600 мутации и метастазами в головном мозге. Исследование включало две одновременно набираемые когорты:
• пациенты, ранее не получавшие лечения (Когорта; n=90), пациенты, которые ранее не получали терапию по поводу метастазов в головном мозге, предшествующая системная терапия метастатической меланомы допустима;
• пациенты, ранее получавшие лечение (Когорта 2; n=56): пациенты, которые ранее получали лечение по поводу метастазов в головном мозге, и у которых развилось прогрессирование после данного лечения. Для пациентов, ранее получавших стереотаксическую лучевую терапию (SRT) или хирургическое лечение с прогрессированием и развитием новой, измеримой по RECIST, опухоли после данного предшествующего лечения
Средний возраст пациентов составил 54 года (диапазон от 26 до 83 лет) и был схожим в двух когортах. Большинство пациентов составили мужчины (61.6%) и распределялись схожим образом в двух когортах. В целом 135 пациентов (92.5%) принадлежали к белой расе, у 11 пациентов (7.5%) о расовой принадлежности не сообщалось по причинам местных регуляторных требований. Среднее число очагов в головном мозге было 2 (диапазон от 1 до 5) в обеих когортах.
Первичной целью исследования была оценка эффективности вемурафениба на основании наилучшего уровня общего ответа (НУОО) у пациентов с ранее нелечеными метастазами в головном мозге по оценке независимого наблюдательного комитета (ННК) с использованием критериев оценки ответа солидных опухолей версии 1.1 (КООСО; RECIST, v 1.1).
Вторичные цели включали оценку эффективности вемурафениба на основании НУОО пациентов, ранее леченых по поводу метастазов в головном мозге, длительность ответа (ДО), выживаемость без прогрессирования (ВБП) и общая выживаемость у пациентов с меланомой, метастазирующей в головной мозг.
Таблица 2. Эффективность вемурафениба у пациентов с метастазами в головном мозге.
| Когорта 1Без предыдущего лечения | Когорта 2 Ранее леченые | Всего | |
| НУООа в головном мозге (n) | 90 | 56 | 146 |
| Ответившие на лечение (n[%]) | 16(17.8%) | 10(17.9%) | 26(17.8%) |
| (95% ДИ)b | (10.5-27.3) | (8.9-30.4) | (12.0-25.0) |
| ДОc в головном мозге (n) | 16 | 10 | 26 |
| Медиана (месяцев) | 4.6 | 6.6 | 5.0 |
| (95% ДИ)d | (2.9-6.2) | (2.8-10.7) | (3.7-6.6) |
| ВБП — общая (n) | 90 | 56 | 146 |
| Медиана (месяцев)6 | 3.7 | 3.7 | 3.7 |
| (95% ДИ)в | (3.6-3.7) | (3.6-5.5) | (3.6-3.7) |
| ВБП — только головной мозг (т) | 90 | 56 | 146 |
| Медиана (месяцев)у | 3.7 | 4.0 | 3.7 |
| (95% ДИ)d | (3.6-4.0) | (3.6-5.5) | (3.6-4.2) |
| ов | 90 | 56 | 146 |
| Медиана (месяцев) | 8.9 | 9.6 | 9.6 |
| (95% ДИ)d | (6.1-11,5) | (6.4-13.9) | (6.9-11.5) |
a Налучший уровень объективного ответа по оценке независимого наблюдательного комитета, число ответчиков — n (%).
b двухсторонний 95% доверительный интервал Купера-Пирсона (ДИ)
c длительность ответа по оценке независимого наблюдательного комитета.
d расчетное значение по Каплан-Мейеру.
e по оценке исследователя.
Фармакокинетика
Фармакокинетические параметры вемурафениба пропорциональны дозе при приеме препарата в диапазоне от 240 до 960 мг два раза в день. Максимальная концентрация Тmах достигается через 4 часа. При продолжающемся дозировании препарата равновесное состояние достигается примерно через 14 дней. Фактор кумуляции составляет около 7.4.
Всасывание
Абсолютная биодоступность вемурафениба не изучалась. Пища (богатая жирами) повышает относительную биодоступность однократного приема вемурафениба в дозе 960 мг. Средние геометрические коэффициенты между состоянием насыщения и состоянием натощак в отношении Сmах и AUC составляли 2.5 и от 4.6 до 5.1, соответственно. Медиана Тmах возрастала с 4 до 7.5 часов при однократном приеме вемурафениба с пищей. Влияние пищи на биоэквивалентность вемурафениба после многократного дозирования не изучалось.
Распределение
Кажущийся объем распределения вемурафениба у пациентов с метастатической меланомой составил 91 л. Вемурафениб характеризуется высокой степенью связывания с белками плазмы крови человека (более 99%). Вемурафениб имеет сродство только к небольшому числу эритроцитов и доклинические исследования указывают на то, что вемурафениб не переносится ликвором.
Метаболизм
CYP3A4 является первичным ферментом, ответственным за метаболизм вемурафениба in vitro. Относительная концентрация вемурафениба и его метаболитов в плазме крови человека, определенная в ходе однократного перорального применения вемурафениба, меченного С14, составила соответственно 95% и 5%.
Совместное назначение рифампицина, сильного индуктора CYP3A4, существенно, примерно на 40%, снижало концентрацию вемурафениба в плазме (AUC) после приема одной дозы вемурафениба, на основании чего можно предположить, что участие CYP3A4 является важным метаболическим путем для данного препарата..
Выведение
Выведение осуществляется в значительной степени с желчью. В фекалиях обнаруживается до 73% исходного вемурафениба и до 13% метаболитов. В моче находится менее 1% радиоактивной метки (исследование ADME). Кажущийся клиренс вемурафениба у пациентов с метастатической меланомой составляет 29.3 л/день. Медиана индивидуальных значений периода полувыведения вемурафениба составляет 56,9 часа.
Фармакокинетика у особых групп пациентов
Пожилые пациенты
Согласно результатам популяционного фармакокинетического анализа, возраст пациентов не оказывает статистически значимого влияния на фармакокинетику вемурафениба.
Выведение осуществляется в значительной степени с желчью. В фекалиях обнаруживается до 73% исходного вемурафениба и до 13% метаболитов. В моче находится менее 1% радиоактивной метки (исследование ADME). Кажущийся клиренс вемурафениба у пациентов с метастатической меланомой составляет 29.3 л/день. Медиана индивидуальных значений периода полувыведения вемурафениба составляет 56,9 часа.
Пол
Наблюдаемый клиренс препарата у мужчин на 17%, а наблюдаемый объем распределения — на 48% больше, чем у женщин. Однако различия в отношении концентрации препарата относительно невелики, что указывает на отсутствие необходимости корректировать дозу препарата в зависимости от пола пациента.
Дети
Ограниченные фармакокинетические данные, полученные в клиническом исследовании N025390 от шести подростков в возрасте от 15 до 17 лет с меланомой стадии Шс или IV, положительной по мутации BRAF , свидетельствуют о том, что фармакокинетические характеристики вемурафениба у подростков в целом схожи с таковыми, наблюдаемыми у взрослых пациентов. Однако, в связи с ограниченным объемом данных, сделать вывод невозможно (см. раздел «Дозирование у особых групп пациентов»).
Пациенты с почечной недостаточностью
Исследований фармакокинетики вемурафениба у пациентов с ограниченной функцией почек не проводилось.
Пациенты с печеночной недостаточностью
Исследований фармакокинетики вемурафениба у пациентов с ограниченной функцией печени не проводилось.
Данные доклинических исследований
Канцерогенность
Исследования канцерогенности не проводились.
Мутагенность
Результаты стандартных исследований генотоксичности свидетельствуют о том, что ве- мурафениб не оказывает мутагенного действия.
Нарушение фертильности
Доклинические исследования влияния препарата на фертильность не проводились. В ходе токсикологических исследований с многократным введением препарата патологических изменений в органах репродуктивной системы выявлено не было.
Тератогенность
Признаков тератогенного действия вемурафениба на эмбрион/плод при введении препарата беременным самкам крыс в дозах до 250 мг/кг/день (практически в 1.7 раза выше клинической дозы для человека, исходя из AUC) и беременным самкам кроликов в дозах до 450 мг/кг/день (практически в 0.8 раза выше клинической дозы для человека, исходя из AUC) выявлено не было.
Содержание препарата в крови плода составляло 2-6% от содержания препарата в крови матери, что свидетельствует о том, что вемурафениб может проникать через плаценту в кровь плода во время внутриутробного развития.
Дополнительная информация
Результаты токсикологических исследований с многократным введением препарата свидетельствуют о том, что у собак органами-мишенями для препарата являются печень и костный мозг. Обратимые токсические эффекты (гепатоцеллюлярный некроз и дегенерация) в печени при применении препарата в дозах, не превышающих клиническую дозу (исходя из AUC), были отмечены у собак в ходе 13-недельного исследования с введением препарата в режиме два раза в день. Очаговый некроз костного мозга был отмечен у одной собаки в досрочно прекращенном 39-недельном исследовании с введением препарата в режиме два раза в день в дозах, соответствующих диапазону клинических доз. Фототоксичность вемурафениба была показана in vitro в культуре мышиных фибробластов после облучения УФ, однако результаты исследования in vivo, выполненного на крысах, свидетельствуют об отсутствии фототоксического эффекта.
Наблюдалось подавление препаратом Вемурафениб изоферментов CYP in vitro (преимущественно CYP2C9, IC50 составила 5.9 мкМ, а также CYP1A2, CYP2C19 и менее ярко выраженно CYP2D6 с IC50 >20мкМ).
По 8 таблеток в блистер (из ориентированного полиамида/алюминиевой фольги/ПВХ и алюминиевой фольги). По 7 блистеров вместе с инструкцией по применению помещают в картонную пачку.
Хранить при температуре не выше 30°С в оригинальной упаковке для защиты от влаги. Хранить в недоступном для детей месте.
3 года.
Условия отпуска из аптек
По рецепту.
Особые меры предосторожности при уничтожении неиспользованного лекарственного препарата
После завершения курса лечения или его прекращения возвратить неиспользованное лекарственный препарат в оригинальной упаковке врачу либо фармацевту для утилизации в установленном порядке.
Информация о производителе/заявителе
Заявитель
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Производитель
Рош С.п.А., Италия
Roche S.p.A., Via Morelli 2, 20090 Segrate, Milano, Italy
В случае поставок и реализации на территории Республики Беларусь претензии потребителей направлять по адресу:
220073, г. Минск, 1-й Загородный пер., 20, 8-й этаж, кабинет 20.
Тел. (017) 256 23 08; факс (017) 256 23 06.
Email:
