Фармакологическое действие
Противоопухолевое средство, производное винкаалкалоида. Винфлунин связывается с тубулином в или около мест связывания винкаалкалоидов, ингибируя их полимеризацию в микротрубочки, что приводит к подавлению непрерывного процесса, разрушению микротубулярной динамики, остановке митоза и к апоптозу. В исследованиях in vivo винфлунин проявляет значительную противоопухолевую активность в отношении широкого спектра человеческих ксенотрансплантатов у мышей, увеличивает выживаемость животных и ингибирует рост опухоли.
Фармакокинетика
Фармакокинетика винфлунина имеет линейный характер в диапазон доз от 30 мг/м2 до 400 мг/м2 у пациентов с раком. AUC винфлунина в значительной степени коррелирует с тяжестью лейкопении, нейтропении и слабости. Терминальный Vd составляет около 35 л/кг, что предполагает интенсивное распределение в ткани. Все метаболиты образуются при участии изофермента CYP3A4, за исключением 4-О-деацетилвинфлунина — это единственный активный и основной метаболит, который образуется путем при участии эстераз. Винфлунин в умеренно степени связывается с белками плазмы у человека (67.2±1.1%). Выводится мультиэкспоненциально, терминальный T1/2 составляет около 40 ч. Основной метаболит медленно образуется и медленно выводится, T1/2 – около 120 ч. Винфлунин и его метаболит выводятся главным образом с калом (2/3) и мочой (1/3). Общий плазменный клиренс – 40 л/ч. У пациентов с пониженным КК, уменьшается клиренс винфлунина.
Показания активного вещества
ВИНФЛУНИН
В качестве монотерапии для лечения прогрессирующей или метастатической уротелиальной карциномы (переходно-клеточный рак) мочевого пузыря при неэффективности предшествующей химиотерапии препаратами платины.
Эффективность и безопасность винфлунина не изучена у пациентов с показателем общего состояния ≥2 (по шкале оценки общего состояния WHO/ECOG).
Режим дозирования
Перед началом курса лечения следует провести развернутый анализ клеточного состава крови с определением абсолютного числа нейтрофилов (АЧН), тромбоцитов и гемоглобина, т.к. нейтропения, тромбоцитопения и анемия являются частыми побочными реакциями при применении винфлунина.
Рекомендуемая доза составляет 320 мг/м2 в виде 20-минутной в/в инфузии каждые 3 недели.
Если показатель общего состояния по шкале WHO/ECOG составляет 1 или 0 и уже имеется распространение процесса на тазовые органы, лечение следует начинать с дозы 280 мг/м2. При отсутствии гематологической токсичности в течение первого курса, нарушений, обусловленных терапией, или необходимостью уменьшения дозы, эта доза может быть увеличена до 320 мг/м2 каждые 3 недели при последующих циклах.
Для профилактики запора рекомендуются слабительные средства, диета, включая прием воды внутрь, с 1 по 5-7 дни после введения винфлунина.
При развитии неприемлемой степени токсичности следует отложить очередную инфузию до восстановления гематологических показателей, провести коррекцию дозы, или прекратить применение винфлунина.
Пациентам с нарушениями функции печени класса А и выше по шкале Чайлд-Пью, с протромбиновым временем ≥ 60%, значениями билирубина ≥1.5 ВГН, трансаминаз > ВГН и/или ГГТ > 5 ВГН требуется соответствующая коррекция режима дозирования.
У пациентов с нарушениями функции почек КК ≤ 60 мл/мин требуется коррекция режима дозирования.
Пациентам пожилого возраста ≥75 лет требуется коррекция режима дозирования.
Данных о применении в педиатрии не имеется.
Побочное действие
Определение частоты побочных реакций: очень часто (≥ 1/10); часто (≥ 1/100 до < 1/10); нечасто (≥ 1/1000 до < 1/100); редко (≥ 1/10 000 до < 1/1,000); очень редко (< 1/10 000), частота неизвестна (невозможно оценить по имеющимся данным).
Побочные эффекты у пациентов с переходно-клеточным раком мочевого пузыря
Инфекции: часто – инфекции, связанные с нейтропенией; нечасто – вирусные, бактериальные, грибковые инфекции.
Со стороны системы кроветворения: очень часто — нейтропения, лейкопения, анемия, тромбоцитопения; часто – фебрильная нейтропения.
Со стороны иммунной системы: реакции повышенной чувствительности.
Со стороны обмена веществ: очень часто – гипонатриемия, анорексия, уменьшение массы тела; часто – дегидратация; нечасто – увеличение массы тела.
Со стороны нервной системы: часто – периферическая сенсорная невропатия, бессонница, синкопе, головная боль, головокружение, головная боль, дисгевзия, невралгия, невропатия; нечасто – периферическая моторная невропатия; редко — синдром задней обратимой энцефалопатии.
Со стороны органов чувств: часто – боль в ушах; нечасто – нарушения зрения, вертиго, шум в ушах.
Со стороны сердечно-сосудистой системы: часто – тахикардия, артериальная гипертензия, венозный тромбоз, артериальная гипотензия; нечасто – ишемия миокарда, инфаркт миокарда.
Со стороны дыхательной системы: часто – одышка, кашель; нечасто – острый респираторный дистресс-синдром, фаринго-ларингеальная боль.
Со стороны пищеварительной системы: очень часто – запор, боль в животе, тошнота, рвота, стоматит, диарея; часто — илеус, дисфагия, диспепсия; нечасто – одинофагия, желудочные нарушения, эзофагит, нарушения состояния языка, повышение активности трансаминаз.
Со стороны кожи и подкожных тканей: очень часто – алопеция; часто – сыпь, крапивница, зуд, гипергидроз; нечасто – сухость кожи, эритема.
Со стороны костно-мышечной системы: очень часто – миалгия; часто – мышечная слабость, артралгия, боль в спине, боль в челюсти, боль в конечностях, боль в костях, мышечно-скелетная боль.
Со стороны мочевыделительной системы: нечасто – почечная недостаточность.
Общие реакции: очень часто – астения, слабость, пирексия; часто – боли в грудной клетке, озноб, боль, отеки.
Прочие: частота неизвестна — боль в опухоли.
Побочные эффекты при применении по всем показаниям
Со стороны системы кроветворения: 50.2% — нейтропения 3-4 степени; 10.4% — тяжелая анемия; 3.5% — тромбоцитопения; 5.3% — фебрильная нейтропения (АЧН < 1000/мкл, лихорадка до 38.5°C неизвестной этиологии); 3.3% — инфекция при 3-4 степени нейтропении.
Со стороны пищеварительной системы: 12% — тяжелый запор.
Со стороны нервной системы: 0.1% — периферическая сенсорная невропатия 3 степени; в редких случаях – синдром задней обратимой энцефалопатии.
Со стороны сердечно-сосудистой системы: 0.6% — ишемия или инфаркт миокарда (преимущественно у пациентов с предшествующим заболеванием сердечно-сосудистой системы); в единичных случаях – летальный исход вследствие инфаркта миокарда и остановки сердца, пролонгирование интервала QT.
Со стороны дыхательной системы: 3.3% — диспноэ; в единичных случаях – бронхоспазм.
Со стороны эндокринной системы: в единичных случаях — синдром неадекватной секреции АДГ.
Противопоказания к применению
Тяжелая инфекция, перенесенная в течение предшествующих 2 недель; исходное значение АЧН < 1500/мкл перед первой инфузией, исходное значение АЧН < 1000/мкл перед последующими инфузиями; количество тромбоцитов < 100 000/мкл; лактация (грудное вскармливание); повышенная чувствительность к винфлунину и другим винкаалкалоидам.
Применение при беременности и кормлении грудью
Данных по применению винфлунина при беременности не имеется. Винфлунин не следует применять при беременности за исключением случаев крайней необходимости. Если беременность наступила по время лечения винфлунином, пациентку следует поставить в известность о риске для плода и необходимости тщательного медицинского контроля. Следует рассмотреть вопрос о проведении генетической консультации. Генетическая консультация также рекомендуется при желании иметь детей после терапии.
Мужчины и женщины должны пользоваться адекватными методами контрацепции во время лечения и в течение 3 месяцев после его окончания.
Мужчинам рекомендуется до начала лечения провести консервацию спермы, т.к. возможно необратимая инфертильность обусловленная терапией винфлунином.
Неизвестно, выделяется ли винфлунин с грудным молоком у человека. При необходимости применения в период лактации грудное вскармливание следует прекратить
В экспериментальных исследованиях на животных показана эмбриотоксичность и тератогенность винфлунина.
Особые указания
Перед каждой инфузией винфлунина следует определять клеточный состав крови, в т.ч. количество тромбоцитов и АЧН, а также количество гемоглобина.
У пациентов с гематологической токсичностью рекомендуемую дозу следует уменьшить.
В течение курса лечения – с 1 по 5-7 дни следует принимать меры профилактики запоров: специальная диета, обильное питье, потребление пищи с грубыми волокнами, стимулирующие слабительные или размягчающие каловые массы. Пациенты с высоким риском запоров (одновременное применение опиатов, перитонеальная карцинома, большой объем живота, предшествующая большая операция на брюшной полости) должны получать осмотические слабительные с 1 по 7 дни введения винфлунина 1 раз/сут утром перед завтраком. При запоре 2 степени требуются слабительные средства в течение 5 дней и более, при запоре 3 степени любой продолжительности требуется коррекция дозы винфлунина.
При развитии желудочно-кишечной токсичности 3 степени (за исключением тошноты или рвоты) или мукозита (2 степень в течение 5 дней или более или 3 степени любой продолжительности) требуется коррекция режима дозирования.
Винфлунин следует применять с осторожностью у пациентов с повышенным риском удлинения интервала QT (в т.ч. застойная сердечная недостаточность, указания в анамнезе на пролонгирование интервала QT, гипокалиемия). Не рекомендуется одновременное применение 2 или более препаратов, пролонгирующих интервал QT.
Следует особенно тщательно наблюдать за пациентами с указаниями в анамнезе на инфаркт миокарда, ИБС, стенокардию. При необходимости применения у пациентов с сердечно-сосудистыми заболеваниями следует тщательно взвесить пользу и риск терапии. При развитии ишемии миокарда на фоне терапии винфлунином, его применение следует прекратить.
При подозрении на развитие синдрома задней обратимой энцефалопатии (СЗОЭ) следует контролировать АД, рекомендуется проведение МРТ мозга. При развитии симптомов СЗОЭ винфлунин следует отменить.
Лекарственное взаимодействие
В исследованиях in vitro показано, то винфлунин является субстратом Р-гликопротеина, как и другие винкаалкалоиды, но с более низким сродством. Поэтому риск клинически значимое взаимодействие маловероятно.
Не наблюдалось фармакокинетического взаимодействия у пациентов, получающих винфлунин в комбинации с доксорубицином. Однако применение этой комбинации было связано с особенно повышенным риском гематологической токсичности.
При одновременном применении кетоконазола (400 мг внутрь 1 раз/сут в течение 8 дней) приводит к повышению экспозиции винфлунина и его метаболита (4-О-деацетил-винфлунина) на 30% и 50% соответственно. Поэтому при одновременном применении винфлунина и сильных ингибиторов CYP3A4 (таких как ритонавир, кетоконазол, итраконазол и сок грейпфрута) или индукторов CYP3A4 (таких как рифампицин и зверобой продырявленный) следует избегать, т.к. они могут увеличивать или уменьшать концентрации винфлунина и его метаболита.
Следует избегать одновременного применения винфлунина и других препаратов, пролонгирующих интервал QT.
Наблюдалось фармакокинетическое взаимодействие между винфлунином и пегилированным/липосомальным доксорубицином, приводящее к увеличению AUC винфлунина на 15-30% и 2-3-кратному снижению AUC доксорубицина, при этом концентрация доксорубицинола (метаболита доксорубицина) не меняется. Согласно исследованиям in vitro такие изменения могли быть связаны с адсорбцией винфлунина на липосомах и модифицированного распределения в крови обоих компонентов. Поэтому необходима осторожность при одновременном применении данных препаратов.
На основании исследований in vitro предполагается возможное взаимодействие с паклитакселом и доцетакселом – небольшое ингибирование метаболизма винфлунина.
При одновременном применении опиоидов возможно повышение риска запоров.
Жавлор — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-001721
Торговое наименование препарата
Жавлор
Международное непатентованное наименование
Винфлунин
Лекарственная форма
концентрат для приготовления раствора для инфузий
Состав
|
Название вещества |
Дозировка на флакон |
||
|
50 мг/2мл |
100 мг/4 мл |
250 мг/10 мл |
|
|
Активное вещество: |
|||
|
Винфлунина дитартрат (в пересчете на винфлунин основание) |
68,35 мг 50,0 мг |
136,70 мг 100,0 мг |
341,75 мг 250 мг |
|
Вспомогательное вещество: |
|||
|
Вода для инъекций |
до 2 мл |
до 4 мл |
до 10 мл |
Описание
Прозрачный раствор от бесцветного до светло-желтого цвета.
Фармакотерапевтическая группа
Противоопухолевое средство — алкалоид
Код АТХ
L01CA05
Фармакодинамика:
Винфлунин оказывает цитостатическое действие, связанное с ингибированием полимеризации тубулина в процессе клеточного митоза.
Фармакокинетика:
Винфлунин демонстрирует линейную фармакокинетику при назначении в стандартных дозировках (от 30 мг/м2 до 400 мг/м2).
Экспозиция винфлунина в крови — площадь под кривой «концентрация-время» (AUC) значимо коррелирует со степенью тяжести лейкопении, нейтропении и выраженностью астенизации пациента.
Распределение
Винфлунин умеренно связывается с белками плазмы крови (67,2±1,1%), соотношение концентраций между плазмой и общим объемом крови составляет 0,8±0,12.
Связь с белками осуществляется, главным образом, с липопротеинами высокой плотности и сывороточным альбумином, не достигает насыщения в диапазоне терапевтических концентраций препарата. Взаимодействие с альфа-1-кислым гликопротеином и тромбоцитами несущественно (<5%).
Предельный объем распределения составляет 2422 ± 676 л (около 35 л/кг), что подтверждает широкое распределение препарата в тканях.
Метаболизм
Основным активным метаболитом в крови является 4-О-деацетилвинфлунин, образующийся в результате действия различных эстераз. Все другие идентифицированные метаболиты образуются под воздействием изофермента цитохром CYP3А4.
Выведение
Период полувыведения винфлунина (Т½) равен 40 ч.
Образование и выведение метаболита 4-О-деацетилвинфлунина происходит медленнее, его период полувыведения (Т½) составляет приблизительно 120 ч.
Выделение винфлунина и его метаболитов происходит с калом (2/3) и мочой (1/3).
Показания:
Монотерапия взрослых пациентов с распространенным или метастатическим уротелиальным переходно-клеточным раком после терапии препаратами платины, не давшей положительного результата.
Противопоказания:
— гиперчувствительность к активному веществу либо к алкалоидам барвинка;
— инфекционные заболевания в течение 2-х недель до начала терапии или текущие тяжелые инфекционные заболевания;
— абсолютное число нейтрофилов менее 1,500 клеток/ мкл крови при первом введении препарата и менее 1,000 клеток/ мкл крови при последующих введениях препарата или тромбоцитов менее 100,000 клеток/мкл крови;
— беременность и период грудного вскармливания;
— детский возраст до 18 лет.
С осторожностью:
Синдром врожденного удлинения интервала Q-T, заболевания сердца (сердечная недостаточность, инфаркт миокарда, брадикардия).
Электролитный дисбаланс (например, при гипокалиемии, гипомагниемии). Одновременный прием лекарственных средств удлиняющих интервал Q-T (в том числе антиаритмические IA и III классов).
Печеночная недостаточность средней и тяжелой степени тяжести (стандартная доза препарата Жавлор должна быть уменьшена).
Почечная недостаточность средней и тяжелой степени тяжести (стандартная доза препарата Жавлор должна быть уменьшена).
Возраст старше 75 лет (рекомендуемые стандартные дозы препарата Жавлор должны быть уменьшены).
Беременность и лактация:
Препарат Жавлор не должен использоваться во время беременности в связи с потенциальным риском для эмбриона и плода.
При возникновении беременности в процессе применения препарата, пациентка должна быть предупреждена о существовании риска для плода, таких пациенток необходимо более тщательно наблюдать. Рекомендована консультация специалиста по генетике. Генетическая консультация также рекомендуется пациентам, планирующим рождение детей после окончания терапии.
Грудное вскармливание во время терапии препаратом Жавлор противопоказано.
Способ применения и дозы:
Рекомендованная доза составляет 320 мг/м2 винфлунина в виде внутривенной инфузии в течение 20 минут 1 раз в 3 недели.
При оценке общего состояния по шкале WHO/ECOG 0 или 1, и после предварительного облучения области таза,
лечение следует начинать с дозы 280 мг/м2 . При отсутствии гематологической токсичности в течение первого цикла, требующей отсрочки лечения или уменьшения дозы, дозу необходимо увеличивать до 320 мг/м2 для последующих циклов (1 раз в 3 недели).
Таблица 1. Временное приостановление или прекращение лечения в случае проявления токсичности
|
Виды токсичности |
День планируемой инфузии |
|
Нейтропения (ANC* < 1,000 клеток/мкл) или Тромбоцитопения (тромбоцитов < 100,000 клеток/мкл) |
— Приостановление лечения до восстановления(ANC ≥ 1,000 клеток/мкл и тромбоцитов > 100,000 клеток/мкл), при необходимости корректировать дозу (см. табл. 2); — Прекращение лечения, если показатели не пришли в норму в течение 2-х недель |
|
Органотоксичность: умеренная, тяжелая или угрожающая жизни |
— Приостановление лечения до уровня слабой или нулевой токсичности или до исходного уровня (см. табл. 2); — Прекращение лечения, если снижение степени токсичности не произошло в течение 2-х недель |
|
Ишемия миокарда у пациентов, имеющих в анамнезе инфаркт миокарда или стенокардию |
— Прекращение лечения |
*ANC — абсолютное число нейтрофилов
Таблица 2. Коррекция дозы в случае проявления токсичности
|
Виды токсичности |
Режим дозирования |
||||
|
(NCI СТС V. 2.0)* |
Начальная доза 320 мг/м2 |
Начальная доза 280 мг/м2 |
|||
|
первый эпизод токсичности |
второй последующий эпизод токсичности |
третий последующий эпизод токсичности |
первый эпизод токсичности |
второй последующий эпизод токсичности |
|
|
Нейтропения 4 степени (ANC< 500 клеток/ м кл >7дней |
280 мг/м2 |
250 мг/м2 |
Прекра щение лечения |
250 мг/м2 |
Прекра щение лечения |
|
Фебрильная нейтропения (ANC<1,000 клеток/мкл и температура тела ≥38,5°С) |
|||||
|
Мукозит или запор 2 степени продолжительностью более 5 дней или 3-4 степени любой продолжительности1 |
|||||
|
Любая другая токсичность 3 или 4 степени (кроме тошноты или рвоты 3 степени)2 |
* Национальный институт исследования рака, Общий критерий токсичности (NCI-CTC).
[1] При запоре 2 степени по NCI СТС требуется использование слабительных средств, 3 степень является непроходимостью, требующей эвакуации содержимого кишечника методом ручного пособия или с использованием клизмы, при 4 степени имеется обструкция или токсический мегаколон. Мукозит 2 степени считается «умеренным», 3 степени — «тяжелым», 4 степени — жизнеугрожающим.
[2] Тошнота 3 степени по NCI СТС определяется как незначительная, не требует внутривенного введения жидкости. Рвота 3 степени ≥ 6 раз в сутки требует премедикации или необходимости внутривенного введения жидкости.
Особые группы пациентов
Пациенты с нарушением функции печени
Рекомендуется использовать следующие дозы:
— у пациентов с протромбиновым индексом более 70% и, как минимум, с одним из следующих показателей: концентрация общего билирубина превышает верхнюю границу нормы (ВГН) не более чем в 1,5 раза; и/или активность трансаминаз более чем в 1,5 раза превышает ВГН, но не более чем в 2,5 раза; и/или активность гамма-глутамилтрансферазы (ГГТ) превышает ВГН, но не более чем в 5 раз; или активность трансаминаз превышает ВГН от 2,5 раз (до 5 раз только при наличии метастазов в печени) — коррекция дозы не требуется, рекомендованная доза винфлунина составляет 320 мг/м (1 раз в 3 недели);
— у пациентов с печеночной недостаточностью легкой степени (класс А по шкале Чайлд-Пью) или у пациентов с протромбиновым индексом ≥ 60% и концентрацией общего билирубина более чем в 1,5 раза превышающим ВГН, но не более чем в 3 раза и одним из следующих показателей:
- активностью трансаминаз, превышающей ВГН;
- и/или активностью ГГТ, превышающей ВГН в 5 раз — рекомендованная доза винфлунина составляет 250 мг/м2 (1 раз в 3 недели);
- у пациентов с печеночной недостаточностью средней степени (класс В по шкале Чайлд-Пью) или у пациентов с протромбиновым индексом ≥ 50%;
и если концентрация билирубина превышает ВГН более чем в 3 раза;
и активность трансаминаз и ГГТ превышает ВГН — рекомендованная доза винфлунина составляет 200 мг/м 2 (1 раз в 3 недели).
У пациентов с печеночной недостаточностью тяжелой степени (класса С по шкале Чайлд-Пью) или у пациентов с протромбиновым индексом < 50% либо с концентрацией билирубина, превышающей ВГН более чем в 5 раз, или с активностью трансаминаз, превышающей ВГН более чем в 2,5 раза (от 5 и более раз только при наличии метастазов в печени), или с активностью ГГТ, превышающей ВГН более чем в 15 раз, исследование винфлунина не проводилось.
Пациенты с нарушением функции почек
В клинических исследованиях у пациентов с клиренсом креатинина > 60 мл/мин использовались стандартные дозы.
Для пациентов с нарушением функции почек средней тяжести (клиренс креатинина 40-60 мл/мин) рекомендуемая доза составляет 280 мг/м2 (1 раз в 3 недели).
Для пациентов с тяжелым нарушением функции почек (клиренс креатинина 20-39 мл/мин) рекомендуемая доза составляет 250 мг/м2 (1 раз в 3 недели).
Для последующих циклов лечения доза должна быть скорректирована в зависимости от токсичности (см. таблицу 3).
Пожилые пациенты (75 лет и старше):
— для пациентов моложе 75 лет не требуется коррекция дозы;
— для пациентов от 75 до 79 лет рекомендуемая доза составляет 280 мг/м2 (1 раз в 3 недели);
— для пациентов от 80 лет и старше рекомендуемая доза составляет 250 мг/м2 (1 раз в 3 недели).
Для последующих циклов лечения доза должна быть скорректирована в зависимости от токсичности.
Таблица 3. Коррекция дозы в случае проявления токсичности у пациентов с нарушениями функции почек или у пожилых пациентов
|
Виды токсичности |
Режим дозирования |
|||
|
(NCI СТС v. 2.0)* |
Начальная доза 280 мг/м2 |
Начальная доза 250 мг/м2 |
||
|
первый эпизод токсичности |
второй последующий эпизод токсичности |
первый эпизод токсичности |
второй последующий эпизод токсичности |
|
|
Нейтропе- ния 4 степени (ANC< 500 клеток / мкл >7 дней |
250 мг/м2 |
Прекра щение лечения |
225 мг/м2 |
Прекра щение лечения |
|
Фебрильная нейтропения (ANC < 1,000 клеток/мкл и температура тела ≥ 38,5°С) |
||||
|
Мукозит или запор 2 степени продолжительностью более 5 дней или 3-4 степени любой продолжитель ности1 |
||||
|
Любая другая токсичность 3 или 4 степени (кроме тошноты или рвоты 3 степени) 2 |
*Национальный институт исследования рака, Общий критерий токсичности (NCI-CTC).
1 При запоре 2 степени по NCI СТС требуется использование слабительных средств, 3 степень является непроходимостью, требующей эвакуации содержимого кишечника методом ручного пособия или с использованием клизмы, при 4 степени имеется обструкция или токсический мегаколон. Мукозит 2 степени считается «умеренным», 3 степени — «тяжелым», 4 степени — жизнеугрожающим.
2 Тошнота 3 степени по NCI СТС определяется как незначительная, не требует внутривенного введения жидкости. Рвота 3 степени ≥ 6 раз в сутки требует премедикации или необходимости внутривенного введения жидкости.
Применение в педиатрии
Нет опыта применения препарата Жавлор у детей.
Разведение концентрата
Для разведения концентрата используют 0,9 % раствор натрия хлорида для инфузий либо 5 % раствор декстрозы для инфузий. Объем концентрата, соответствующий рассчитанной дозе винфлунина, разводят в 100 мл растворителя в инфузионном мешке. Приготовленный раствор необходимо защищать от воздействия света до начала процедуры введения.
Метод введения
— в инфузионной системе два инфузионных мешка:
№1: 500 мл инфузионный мешок с 0,9 %
раствором натрия хлорида для инфузий
или 5 % раствором декстрозы для инфузий;
№2: 100 мл инфузионный мешок с приготовленным раствором препарата Жавлор;
- необходимо обеспечить венозный доступ в области вены верхней части предплечья или центральной вены руки, следует избегать введения препарата в вену тыльной части руки и в вены, расположенные близко к суставам;
- инфузию начинают с введения 250 мл 0,9 % раствора натрия хлорида для инфузий или 5 % раствора декстрозы для инфузий;
- инфузию препарата Жавлор проводят в течение 20 минут;
- во время проведения инфузии необходимо часто проверять проходимость венозного протока и тщательно соблюдать меры по предотвращению экстравазации;
- после введения раствора препарата Жавлор, вводят оставшиеся 250 мл 0,9 % раствора натрия хлорида для инфузий или 5 % раствора декстрозы для инфузий (скорость потока 300 мл/ч).
Побочные эффекты:
Побочные реакции систематизированы по системно-органным классам и перечислены в соответствии со следующей градацией:
очень часто (≥ 1/10),
часто (≥ 1/100 до < 1/10),
нечасто (≥ 1/1000 до < 1/100),
редко (≥ 1/10000 до < 1/1000),
очень редко (< 1/10000)
частота неизвестна (не может быть оценена по имеющимся данным).
Инфекционные и паразитарные заболевания: часто: инфекционные заболевания на фоне нейтропении, инфекционные осложнения (вирусные, бактериальные, грибковые); нечасто: бактериальный сепсис на фоне нейтропении.
Нарушения со стороны крови и лимфатической системы:очень часто:нейтропения, лейкопения,анемия, тромбоцитопения; часто: фебрильная нейтропения.
Нарушения со стороны иммунной системы: часто: гиперчувствительность.
Нарушения со стороны метаболизма: очень часто: гипонатриемия, снижение аппетита; часто: обезвоживание.
Нарушения психики: часто: бессонница.
Нарушения со стороны нервной системы: очень часто: периферическая сенсорная нейропатия; обмороки, головная боль, головокружение, невралгия, нарушение вкусовосприятия, нейропатия; нечасто: периферическая моторная нейропатия; редко: синдром задней обратимой энцефалопатииа.
Нарушения со стороны органа зрения: нечасто: нарушения зрительного восприятия.
Нарушения со стороны органа слуха и лабиринтные нарушения: часто: боль в ухе; нечасто: головокружение, ощущение звона в ушах.
Нарушения со стороны сердца: часто: тахикардия; нечасто: ишемия миокарда, инфаркт миокарда.
Нарушения со стороны сосудов: часто: повышение артериального давления, венозный тромбоз, флебит, снижение артериального давления.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:часто: одышка, кашель; нечасто: острый респираторный дистресс-синдром, боли в области гортани и глотки.
Нарушения со стороны желудочно-кишечного тракта:очень часто: запор, боль в животе, рвота, тошнота, стоматит, диарея; часто: кишечная непроходимость, дисфагия, нарушения слизистой оболочки полости рта, диспепсия; нечасто: боль при глотании, гастрит,эзофагит, гингивит.
Нарушения со стороны эндокринной системы: нечасто: синдром неадекватной секреции антидиуретического гормона (СНС АДГ)а
Новообразования: доброкачественные,злокачественные и неизвестной этиологии; нечасто: болезненность в области опухоли а.
Нарушения со стороны кожи и подкожных тканей: очень часто: алопеция;часто: кожные реакции (сыпь, крапивница),зуд, гипергидроз; нечасто: эритема, сухость кожных покровов.
Нарушения со стороны скелетно-мышечной системы и соединительной ткани:очень часто: миалгия; часто: мышечная слабость, артралгия, костно-мышечные боли различной локализации, боль в грудной клетке, боль в спине, боль в челюсти, боль в конечностях.
Нарушения со стороны почек и мочевыводящих путей: нечасто: почечная недостаточность.
Общие расстройства и нарушения в месте введения: очень часто: астения, чувство усталости, реакция в месте введения, повышение температуры тела; часто: боль в грудной клетке, озноб, боль и/или отек в месте введения; нечасто: экстравазация.
Лабораторные и инструментальные данные: очень часто: снижение массы тела; нечасто: повышение активности трансаминаз, повышение массы тела.
Примечание:
а нежелательная реакция, зарегистрированная после выпуска препарата на рынок
Передозировка:
Основным токсическим эффектом вследствие передозировки является подавление функции костного мозга с риском последующего развития тяжелой инфекции.
Специфический антидот не известен.
В случае передозировки необходимо госпитализировать пациента и тщательно контролировать функции жизненно важных органов. Должны быть предприняты соответствующие меры такие как, переливание крови, введение антибиотиков, факторов роста.
Взаимодействие:
Исследования in vitro показали, что винфлунин не оказывает индуцирующего влияния на активность CYP1А2, CYP2B6 или CYP3A4 изоферментов и не оказывает ингибирующего влияния на активность CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 и CYP3A4 изоферментов.
Исследования in vitro показали, что винфлунин, как и другие алкалоиды барвинка, является субстратом для Pgp, но с меньшим сродством, поэтому риск возникновения клинически значимого взаимодействия маловероятен.
При совместном применении винфлунина с цисплатином, карбоплатином, капецитабином или гемцитабином не наблюдалось фармакокинетических взаимодействий препаратов.
При совместном применении винфлунина с доксорубицином не наблюдалось фармакокинетических взаимодействий препаратов, однако данная комбинация связана с повышенным риском развития гематологической токсичности.
Совместное применение с кетоконазолом (в дозировке 400 мг внутрь один раз в течение 8 дней) приводит к увеличению экспозиции винфлунина в крови (на 30%) и к увеличению экспозиции его метаболита 4-О- деацетил-винфлунина (на 50%).
Следует избегать совместного применения винфлунина и сильных ингибиторов изофермента CYP3A4 (ритонавир, кетоконазол, итраконазол, сок грейпфрута) или его индукторов (рифампицин, трава зверобоя продырявленного), так как эти вещества могут изменять концентрацию винфлунина.
Следует избегать совместного применения с препаратами, удлиняющими интервал Q-T/Q-Tc.
Совместное применение с опиоидами увеличивает риск возникновения запоров. Отмечалось фармакокинетическое взаимодействие между винфлунином и липосомальным доксорубицином, что вызывало 15% — 30% увеличение экспозиции винфлунина и уменьшение в 2-3 раза площади под кривой «концентрация-время» (AUC) доксорубицина, при этом концентрации метаболита доксорубицинола не изменялись.
Исследования in vitro показали, что такие изменения могут быть обусловлены поглощением винфлунина липосомами и измененным распределением обоих соединений в крови. Таким образом, комбинации такого типа следует использовать с осторожностью.
Возможное взаимодействие винфлунина с паклитакселом и доцетакселом (CYP3 субстраты) было изучено в исследовании in-vitro (незначительное ингибирование метаболизма винфлунина), но специальных клинических исследований по взаимодействию с этими препаратами не проводилось.
Особые указания:
Препарат Жавлор предназначен исключительно для внутривенного введения.
Интратекальное введение приводит к летальному исходу, категорически запрещено!
Лечение препаратом Жавлор следует проводить под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами.
Терапию проводят под строгим гематологическим контролем, определяя число лейкоцитов, нейтрофилов, тромбоцитов, а также концентрацию гемоглобина перед каждой очередной инфузией.
После введения винфлунина отмечалось несколько случаев удлинения интервала Q-T, что повышает риск развития желудочковой аритмии. Несмотря на то, что при применении винфлунина желудочковые аритмии не наблюдались, винфлунин следует использовать с осторожностью у пациентов с риском развития проаритмии (например, сердечная недостаточность, удлинение интервала QT в анамнезе, гипокалиемия). Не рекомендуется одновременный приема двух или более препаратов удлиняющих интервал Q-T/Q-Tc.
Особую осторожность следует проявлять, когда винфлунин вводится пациентам с сердечно-сосудистыми заболеваниями в анамнезе. Могут возникать ишемические сердечно-сосудистые осложнения, особенно у пациентов, у которых имеется основное сердечно-сосудистое заболевание.
Пациенты, получающие Жавлор, должны тщательно наблюдаться врачами на предмет развития сердечно-сосудистых осложнений. Следует регулярно выполнять тщательный анализ соотношения между риском и пользой! Следует рассматривать возможность отмены винфлунина пациентам, у которых возникла ишемия миокарда.
После введения винфлунина наблюдались случаи синдрома задней обратимой энцефалопатии (ЗОЭ). Типичные клинические симптомы в разной степени включают следующие проявления: неврологические (головные боли, спутанность сознания, судорожные припадки, зрительные расстройства), системные (артериальная гипертензия) и желудочно-кишечные (тошнота, рвота).
Радиологические признаки состоят в наличии изменений в белом веществе задних отделов головного мозга. У пациентов с появившимися симптомами ЗОЭ следует контролировать артериальное давление. Для подтверждения диагноза рекомендуется сделать томографию головного мозга.
Клинические и радиологические признаки, как правило, обратимы и быстро исчезают после отмены препарата.
Следует рассматривать возможность отмены винфлунина у пациентов, у которых появились неврологические признаки ЗОЭ.
После введения винфлунина наблюдалась выраженная гипонатриемия, включая случаи, возникающие из-за синдрома неадекватной секреции антидиуретического гормона (СНС АДГ). Поэтому, рекомендуется регулярный мониторинг уровня натрия в сыворотке крови во время лечения винфлунином.
С целью предотвращения запоров, с первого по пятый или седьмой день после каждого применения препарата Жавлор следует применять слабительные средства, а также диету богатую клетчаткой и обильное питье. Пациентам с высоким риском запоров (одновременный прием опиатов, перитонеальная карцинома, новообразования органов брюшной полости, предшествующая обширная полостная операция) следует назначать осмотические слабительные средства один раз в сутки утром перед завтраком с 1 по 7 день после применения винфлунина.
При наличии запора 2 степени, который требует применения слабительных средств не менее 5 дней или при запоре ≥ 3 степени любой продолжительности следует корректировать дозу винфлунина (см. Таблицу 2 раздела «Способ применения и дозы»).
Запор 3 степени является непроходимостью, требующей эвакуации содержимого кишечника методом ручного пособия или с использованием клизмы, при 4 степени имеется обструкция или токсический мегаколон.
При желудочно-кишечной токсичности ≥ 3 степени (исключая рвоту и тошноту) или при мукозите (2 степени в течении 5 дней и более, или при ≥ 3 степени любой продолжительности) требуется коррекция дозы. 2 степень является «средней», 3 степень — «тяжелая», а 4 степень — «жизнеугрожающая» (см. Таблицу 2 раздела «Способ применения и дозы»).
Препарат следует вводить в крупную вену, предпочтительно в области вены верхней части предплечья или центральной вены руки.
При введении препарата через периферическую вену винфлунин может вызвать ее флебит.
Во избежание экстравазации или кровоизлияния необходимо удостоверится в правильном введении иглы перед началом инфузии.
При венах малого диаметра или венах с уплотненной стенкой, лимфатическом отеке или недавнем проколе этой же вены, предпочтительнее использовать центральный катетер.
Мужчины и женщины должны использовать надежные методы контрацепции в период лечения, а также в течение трех месяцев после окончания терапии.
Вследствие возможности необратимой потери фертильности в результате лечения винфлунином, пациентам должна быть дана рекомендация но консервации спермы до начала курса лечения препаратом Жавлор.
Общие меры предосторожности при приготовлении и применении.
Приготовление и введение раствора производит медицинский персонал, должным образом обученный обращению с цитотоксическими веществами.
Все процедуры по приготовлению раствора для инфузий требуют соблюдения асептических условий. Медицинскому персоналу рекомендуется использовать перчатки, защитные очки и защитную одежду.
При попадании раствора препарата на кожу необходимо немедленно тщательно промыть их с мылом и водой. При попадании раствора препарата на слизистые оболочки необходимо немедленно тщательно промыть их водой.
Беременным запрещено работать с препаратом Жавлор.
Утилизация
Препарат Жавлор предназначен только для одноразового использования.
Весь неиспользованный материал и отходы необходимо утилизировать в соответствии с требованиями по обращению с цитотоксическими лекарственными препаратами.
Влияние на способность управлять транспортными средствами и механизмами:
Пациентам не следует управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации, внимания и быстроты психомоторных реакций, если они испытывают побочные реакции способные повлиять на выполнение этой деятельности (например, часто возникающая усталость, головокружение, обморок).
Форма выпуска/дозировка:
Концентрат для приготовления раствора для инфузий 25 мг/мл.
Упаковка:
По 50 мг/2 мл, 100 мг/4 мл, 250 мг/10 мл во флаконы бесцветного стекла с пробкой черного цвета из хлорбутила или ламинированной резиновой пробкой серого цвета, укупоренные алюминиевыми колпачками серого цвета, с пластмассовой защитной крышкой типа «flip — off» желтого цвета для флакона 50 мг/2 мл, розового цвета для флакона 100 мг/4 мл, оранжевого цвета для флакона 250 мл/10 мл. 1 флакон в пластиковом поддоне вместе с инструкцией по применению помещают в пачку картонную.
Условия хранения:
При температуре от +2° до +8° С в защищенном от света месте.
Хранить в недоступном для детей месте.
Хранение во время транспортировки
Во время транспортировки препарата допускается его хранение при температуре до +30°С в защищенном от света месте не более 7 дней.
Срок годности:
3 года.
Не применять после даты истечения срока годности.
Условия отпуска
По рецепту
Производитель
Пьер Фабр Медикамент Продакшн, Aquitaine Pharm International, 1 Avenue du Bearn, 64320 Idron, France, Франция
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Пьер Фабр Медикамент Продакшн
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Новости онкологии
08.04.2020
Современные подходы к системному лечению рака мочевого пузыря. Винфлунин в клинической практике

Болотина Лариса Владимировна
МНИОИ им. П.А. Герцена –
филиал ФГБУ «НМИЦ радиологии»,
Москва

Шепель Артем Олегович
Городская клиническая больница
имени Д.Д. Плетнёва –
Онкологический диспансер,
Москва
В нашей стране за последнее десятилетие отмечается устойчивая динамика снижения смертности от уротелиального рака несмотря на то, что показатель заболеваемости возрос за указанный период [1]. По данным российского канцер-регистра известно, что в 2008 году впервые диагноз рака мочевого пузыря (РМП) был установлен 13002 пациентам, тогда как в 2018 году уже 17426. Однако в указанные годы от уротелиального рака умерло 6872 и 6132 пациентов соответственно. В первую очередь эти успехи связаны с существенным расширением терапевтических возможностей распространенных форм патологии.
Говоря о подходах к терапии резектабельных мышечно-инвазивных (МИ) местнораспространенных форм РМП, необходимо отметить, что все чаще в практике используют периоперационную платиносодержащую химиотерапию. Наверное, несколько подробнее стоит сказать об адъювантном лечении. Накапливается все больше данных о целесообразности проведения этого этапа лечения [2]. На недавно прошедшем конгрессе ASCO GU 2020 были представлены результаты английского исследования, объединившего результаты лечения 260 пациентов с диагностированным раком верхних отделов уротелиального тракта pT2-T4pN0-N3M0 или pTлюбоеN1-N3M0, перенесших нефруретерэктомию [3]. В течение ближайших 90 дней после операции части больных назначалась адъювантная химиотерапия (АХТ) – 4 цикла в режиме цисплатин 70 мг/м2 или карбоплатин AUC 4,5/5,0 в 1 день + гемцитабин 1000 мг/м2 в 1 и 8 дни каждые 3 недели. Другая часть дополнительного лечения не получала. К медиане наблюдения 30,3 месяца было зафиксировано достоверное снижение риска рецидива или смерти на 55% в группе пациентов, получавших АХТ. Показатель 3-летней безрецидивной выживаемости составил 71% и 46% соответственно. Медиана длительности безрецидивного периода в лечебной группе достигнута не была, тогда как в группе больных, находившихся под наблюдением, составила 29,8 месяца. Также достоверно ниже (на 52%) оказался и риск развития отдаленных метастазов и смерти в исследовательской группе. Показатель зафиксированной 3-летней выживаемости без метастазов составил 71% и 53% соответственно. Данные по общей выживаемости на момент представления результатов исследования оказались незрелыми, анализ этого показателя авторами планируется провести в последующем. Конечно, не стоит забывать, что проведение платиносодержащей химиотерапии сопровождается нежелательными реакциями (НР). Так, в представленном исследовании авторы сообщают о 44% НР 3-5 степени при проведении АХТ в сравнении с 4% в группе наблюдения. Основными из них были нейтропения, тромбоцитопения, тошнота, фебрильная нейтропения и рвота. Безусловно, с учетом того, что упомянутое исследование позволило ярко продемонстрировать увеличение беспрогрессивной выживаемости, которая рассматривается лишь как суррогатный параметр эффективности, в отличие от общей выживаемости, в ходе дискуссии по результатам протокола было высказано предложение о том, что специалистам необходимо самим принимать решение, насколько полученные данные могут поменять в настоящее время клиническую практику. Таким образом, все большему числу пациентов рекомендуется использование лекарственной терапии при первичном лечении, и, соответственно, платиносодержащие режимы реализуют свою эффективность уже в самом начале противоопухолевого лечения.
В отношении неоадъювантной химиотерапии (НАХТ) существует более единый взгляд на необходимость ее применения при мышечно-инвазивном РМП (МИРМП) [2, 4, 5, 6]. Тем не менее, предпринимаются попытки определения более эффективного режима, чем стандартный GemCis (цисплатин и гемцитабин) или дозоуплотненный вариант MVAC (метаторексат, винбластин, доксорубицин, цисплатин). Так, в 2018 году были представлены результаты исследования PURE-01 с небольшим числом участников (50 пациентов с мышечно-инвазивным уротелиальным РМП). Среди них 54% была установлена стадия cT3, 42% – cT2 и 4% – cT2-3N1. Сорока девяти из них до цистэктомии проводилось 3 введения пембролизумаба 200 мг каждые 3 недели. У 21 (42,0%) пациента удалось достичь полного патоморфологического ответа (пПО, pT0), дополнительно у 6 больных резидуальная опухоль была представлена pTa, pTis или pT1. Таким образом, у 27 (54,0%) зафиксировано «снижение» стадии до неинвазивного варианта опухоли. Авторы отметили, что пациенты с PD-L1-позитивным раком лучше отвечали на иммунотерапию, чем PD-L1-негативные. Особого внимания заслуживает тот факт, что более половины (54,3%) из 35 больных с CPS 10 и более достигли пПО в сравнении с 13,3% из 15 с CPS менее 10 [7]. Результаты еще одного исследования 2 фазы BLASST-1 были доложены на ежегодном конгрессе ASCO GU в феврале 2020 года. В протокол был включен 41 пациент МИРМП, которым до операции назначались 4 курса комбинированного лечения: химиотерапия в режиме GemCis в сочетании с ниволумабом [8]. Распределение по стадиям было следующим: T2N0 – 90%, T3N0 – 7% и T2-4N1 – 3%. Основной целью являлось достижение патоморфологического ответа, при котором резидуальная опухоль была представлена мышечно-неинвазивным компонентом. Патоморфологический ответ составил 66%: 51,8% достигли pT0, у 7,4% резидуальная опухоль была представлена pT1, из них у 18,5% – pTa, и 22,2% – pTis. Таким образом, пПО, определяемый как pT0 and pTis, составил 49%. Обобщая данные литературы, необходимо вновь подчеркнуть, что у большого числа больных как платиносодержащие режимы химиотерапии, так и в ближайшем будущем возможно анти-PD-1/PD-L1 препараты будут реализовывать свою эффективность уже на ранних этапах лечения резектабельных процессов. Все это максимально актуализирует проблему грамотного выстраивания последующих линий терапии.
Среди цитостатиков, зарегистрированных для лечения РМП, и единственным доказавшим свою эффективность после препаратов платины в рандомизированном исследовании III фазы является винфлунин. Также необходимо помнить, что от 30% до 50% пациентов не могут получать «золотой» стандарт 1 линии лечения – платиносодержащие режимы ХТ – в силу нарушения функции почек и общего состояния, связанного с возрастом и сопутствующими заболеваниями [9]. Известно, что основными противопоказаниями к использованию цисплатина являются клиренс креатинина <60 мл/мин. (1 мл/сек.), ECOG >1 или индекс Карновского ≤70%, периферическая нейропатия >1 степени (CTCAE версия 4), потеря слуха >1 степени (CTCAE версия 4) или сердечная недостаточность III класс по NYHA.
При невозможности назначения цисплатина ХТ имеет ограниченную эффективность. В 2007 году были опубликованы результаты исследования по прямому сравнению платиновых производных в сочетании с гемцитабином у пациентов с распространенным уротелиальным раком (УТР) [10]. Авторами убедительно была продемонстрирована существенно более высокая эффективность режима GemCis в сравнении с GemCarbo как по частоте объективного ответа (65,9% vs 56,4%) и возможности достижения полной регрессии опухоли (19,5% vs 2,6%), так и по медиане ОВ (12,8 мес. vs 9,8 мес.) и особенно показателю годичной выживаемости (63,6% vs 37,3%). Для группы больных с невозможностью использования препаратов платины в качестве 1 линии предусмотрена возможность применения иммуноонкологических препаратов [11, 12]. Однако необходимо отметить, что эффективность терапии как анти-PD-L1, так и анти-PD1 блокаторами нарастает при увеличении уровня экспрессии лиганда [13, 14].
На протяжении 10 лет винфлунин остается единственным цитостатиком, продемонстрировавшим статистически значимое преимущество по сравнению с наилучшей поддерживающей терапией после препаратов платины, у пациентов распространенным УТР (n=253) в отношении частоты объективных ответов (ЧОО) (8,6% vs. 0%; р=0,0063), медианы беcпрогрессивной выживаемости (3,0 мес. vs. 1,5 мес.; р=0,0012) и общей выживаемости (ОВ) (6,9 мес. vs. 4,3 мес.; р=0,0403) [15]. Конечно, полученные результаты вряд ли могут расцениваться как высокие. К тому же могут существовать опасения недостижения даже подобных результатов в реальной практике, что характерно для многих рандомизированных исследований. Это связано в первую очередь со строгим отбором пациентов в исследовательские протоколы. Именно поэтому представляет огромный интерес анализ эффективности винфлунина в условиях клинического использования у пациентов, имеющих более широкие критерии возможного применения препарата. Наиболее значимым является обобщенный опыт применения винфлунина в европейских странах (n=750), который позволил выявить группу максимальной его эффективности [16-22]. Оказалось, что у пациентов, сохраняющих ECOG 0, уровень гемоглобина более 100 г/л и без метастазов в печени, медиана ОВ составила 11,7-17,6 месяца. И вот если провести, конечно, не очень корректное, сравнение показателя медианы ОВ из разных исследований, то мы увидим, что во 2 линии терапии после применения платиносодержащих режимов иммуноонкологические препараты обеспечивают более скромные результаты. Так, применение во 2 линии атезолизумаба, ниволумаба и пембролизумаба привело к достижению медианы ОВ в 8,6 мес., 8,6 мес. и 10,1 мес. соответственно [23-25]. Полученные данные позволяют рассматривать винфлунин как оптимальный выбор для пациентов без факторов неблагоприятного прогноза, к которым относят ECOG >0, гемоглобин <100 г/л и метастазы в печени, или имеющих не более 1 фактора, получивших платиносодержащую ХТ. Дополнить эту группу могут пациенты с абсолютными противопоказаниями к назначению препаратов платины, которым в 1 линии лечения использовались блокаторы точек иммунного ответа.
Для демонстрации эффективности винфлунина в клинической практике приведем несколько клинических наблюдений.
Пациентка Б., 66 лет. Диагноз: рак мочевого пузыря T3N3M1 метастатическое поражение печени, легких. Морфологическое заключение №6754/17 уротелиальный рак с поражением глубокого мышечного слоя.
Анамнез: в мае 2017 года отметила появление периодической примеси крови в моче, через месяц присоединились боли в грудной клетке, периодический кашель. При обследовании установлен диссеминированный рак мочевого пузыря с метастатическим поражением легких и печени. В качестве первой линии получила 8 курсов химиотерапии по схеме карбоплатин AUC 5 в 1 день + гемцитабин 1000 мг/м2 1, 8 дни 21-дневного цикла. При обследовании в январе 2018 года (КТ органов грудной и брюшной полостей) зафиксировано прогрессирование метастатического процесса в виде появления дополнительных очагов в легких, рост ранее выявленных очагов в легких и печени, поражение лимфоузлов бронхопульмональной группы. Пациентка сохраняла хороший функциональный статус (ECOG 0-1), нормальный уровень гемоглобина (123 г/л), в связи с чем с января 2018 года как 2 линия лечения начата терапия винфлунином 280 мг/м2 1 раз в 3 недели (дозировка 280 мг/м2 обусловлена эпизодами токсичности в виде нейтропении при предыдущих курсах лечения). После первого введения в дозе 280 мг/м2 отмечена удовлетворительная переносимость винфлунина, в связи с чем лечение продолжено в избранной дозе. При обследовании после 4 курсов отмечена положительная динамика в виде уменьшения размеров всех ранее выявленных очагов (в паренхиме легкого и печени, лимфоузлов средостения) (рис. 1).
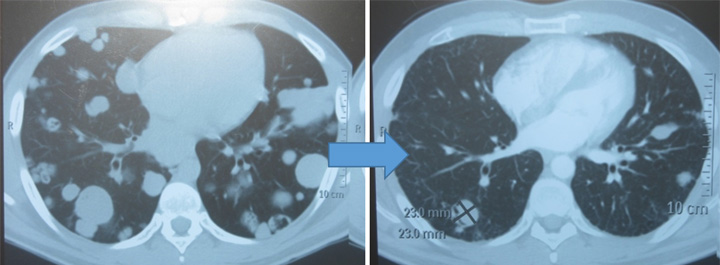
Рисунок 1. Пациентка Б. Динамика очагов в легких после 4 курсов терапии винфлунином (2 линия).
Лечение продолжено по прежней схеме. Всего с января 2018 года по декабрь 2018 года пациентка получила 17 курсов монохимиотерапии винфлунином со стабилизацией достигнутого эффекта. Представленное наблюдение подтверждает ранее изложенные факты о высокой эффективности винфлунина у пациентов, имеющих не более 1 фактора неблагоприятного прогноза. Выживаемость без прогрессирования на фоне малотоксичного режима лечения составила 12 месяцев.
Второе клиническое наблюдение касается более молодого больного.
Пациент Р., 52 года. Диагноз: Рак мочевого пузыря рT2bN0M0. Морфологическое заключение №4484/15: уротелиальный рак с поражением глубокого мышечного слоя.
Анамнез: с декабря 2014 г. появились жалобы на примесь крови при мочеиспускании. При обследовании установлен рак мочевого пузыря. 13.01.2015 выполнено хирургическое лечение в объеме цистпростатвезикулэктомии. В последующем находился под динамическим наблюдением. При контрольном обследовании в апреле 2017 года выявлено прогрессирование заболевания в виде появления множественных гиперметаболических очагов в паренхиме обоих легких, увеличение лимфоузлов средостения. КТ органов грудной полости 13.04.2017 года: отмечается появление множественных очаговых образований в паренхиме обоих легких, максимальный размер 24 мм, увеличение лимфоузлов средостения. С мая 2017 года по август 2017 года проведено 4 курса 1 линии химиотерапии в режиме CemGis (цисплатин 80 мг/м2 в 1 день + гемцитабин 1000 мг/м2 в 1, 8 дни 21-дневного цикла). По данным контрольного обследования зафиксирована отрицательная динамика. КТ органов грудной полости, МРТ малого таза (сентябрь 2017 года): отмечается увеличение очагов в легких при сравнении с ранее измеряемыми очагами 35 мм (ранее 24 мм), появление объемного образования в малом тазу размерами 35×25 мм, накапливающего контраст. С сентября 2017 года по апрель 2018 года пациент получал комбинированную терапию (иммунотерапия + химиотерапия) в рамках клинического протокола. По данным контрольного обследования (КТ органов грудной полости, МРТ малого таза) от мая 2018 года вновь отмечена отрицательная динамика в виде увеличения очагов в легких и рост объемного образования в малом тазу.
В качестве 3 линии терапии больному проведено 3 курса монотерапии винфлунином 320 мг/м2 1 раз в 3 недели. При контрольном обследовании в июле 2018 года отмечена положительная динамика в виде уменьшения очагов в паренхиме легкого, лимфоузлов средостения и размеров объемного образования в малом тазу. Всего пациент получил 11 курсов винфлунина без редукции дозы со стабилизацией достигнутых изменений. Лечение завершено в феврале 2019 года в связи с появлением неврологической симптоматики (правосторонний гемипарез). Выполнено дополнительное обследование (МРТ головного мозга с в/в контрастированием), при котором выявлены множественные метастазы в головном мозге.
Данное клиническое наблюдение демонстрирует возможность применения винфлунина у молодого пациента, казалось бы, с полностью исчерпанными возможностями самого эффективного лечения. Использование препарата позволило не только достичь частичного ответа, но и сохранять его длительное время (9 месяцев).
Таким образом, можно с уверенностью утверждать, что, несмотря на расширившиеся возможности лекарственной терапии распространенного УТР, имеющиеся в арсенале цитостатики не только сохраняют свое место в ряду эффективных лекарственных средств, но и заставляют клиницистов решать новые задачи, главной из которых является определение грамотной последовательности использования препаратов разных классов для выстраивания наиболее оптимальной и длительной лечебной стратегии в терапии этой сложной патологии.
Список литературы:
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность), стр.103, стр.135-136.
- Grossman HB, Natale RB, Tangen CM, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med. 2003; 349: 859-866.
- Birtle, Alison, et al. Adjuvant chemotherapy in upper tract urothelial carcinoma (the POUT trial): a phase 3, open-label, randomised controlled trial. The Lancet. 2020.
- NCCN Guidelines Updates: Management of Muscle-Invasive Bladder Cancer. Journal of the National Comprehensive Cancer Network: JNCCN 17(5.5): 591-593. DOI: 10.6004/jnccn.2019.5017.
- Advanced Bladder Cancer Meta-analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urol. 2005; 48: 202-205; discussion 205-206.
- Advanced Bladder Cancer Meta-analysis Collaboration. Adjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis of individual patient data Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Eur Urol. 2005; 48: 189-199; discussion 199-201.
- Comprehensive biomarker analyses and updated results of PURE-01 study: Neoadjuvant pembrolizumab (pembro) in muscle-invasive urothelial bladder carcinoma (MIBC). Annals of Oncology. October 2018; 29 (suppl_8). DOI: 10.1093/annonc/mdy283.075. Project: PURE-01.
- Konety B, Gupta S. BLASST-1 (Bladder Cancer Signal Seeking Trial): Nivolumab, Gemcitabine, and Cisplatin in Treatment of Muscle Invasive Bladder Cancer (MIBC) Undergoing Cystectomy. ClinicalTrials.gov Identifier: NCT03294304.
- Galsky, Matthew D., et al. Treatment of patients with metastatic urothelial cancer “unfit” for cisplatin-based chemotherapy. Journal of clinical oncology. 2011. 29.17: 2432-2438.
- Dogliotti Luigi, et al. Gemcitabine plus cisplatin versus gemcitabine plus carboplatin as first-line chemotherapy in advanced transitional cell carcinoma of the urothelium: results of a randomized phase 2 trial. European urology. 2007; 52.1: 134-141.
- Инструкция по медицинскому применению лекарственного препарата Тецентрик (Минздрав России, ЛП-004652 от 15.04.19).
- Инструкция по медицинскому применению лекарственного препарата Китруда (Минздрав России, ЛП-003972 от 06.11.19).
- Balar A, et al. Lancet. 2017; Vol. 389; P.67-76.
- O’Donnell PH, Balar AV, Vuky J, et al. ASCO 2019. Poster №372. J Clin Oncol. 2019; 37 (suppl; abstr 4546).
- Bellmunt J, Théodore C, Demkov T, et al. Phase III trial of vinflunine plus best supportive care compared with best supportive care alone after a platinum- containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J Clin Oncol. 2009; 27(27): 4454-61. DOI: 10.1200/JCO. 2008.20.5534. PMID: 19687335.
- Castellano D, Puente J, de Velasce G. Safety and effectiveness of vinflunine in patients with metastatic transitional cell carcinoma of the urothelial tract after failure of one platinum-based systemic therapy in clinical practice. BMC Cancer. 2014; 14: 779. DOI: 10.1186/1471-2407-14-779. PMID: 25342282.
- Hegele A, de Geeter P, Goebell P, et al. Vinflunine in routine practice for the treatment of advanced or metastatic urothelial cell carcinoma in Germany. Eur J Cancer .2013; 49(Suppl 2): 669.
- Medioni J, Guillot A, Spaeth D, et al. Historical data in real life from patients treated by vinflunine for an advanced or metastatic urothelial carcinoma: Results of the CURVE study. Eur J Cancer. 2013; Suppl 2: 646-7.
- Retz M, de Geeter P, Goebell PJ, et al. Vinflunine in routine clinical practice for the treatment of advanced or metastatic urothelial cell carcinoma – data from a prospective, multicenter experience. BMC Cancer. 2015; 15: 455. DOI: 10.1186/s12885-015-1434-3. PMID: 26040470.
- Serrate C, Pouessel D, Gauthier H, et al. Vinflunine for the treatment of metastatic transitional cell carcinoma: recent evidence from clinical trials and observational studies. Clin Invest. 2014; 4(4): 305-1.
- Hussain SA, Ansari J, Huddart R, et al. VICTOR: Vinflunine in advanced metastatic transitional cell carcinoma of the urothelium: A retrospective analysis of the use of vinflunine in multi-centre real life setting as second line chemotherapy through Free of Charge Programme for patients in the UK and Ireland. Int J Oncol. 2017; 50(3): 768-72. DOI: 10.3892/ijo. 2017.3847. PMID: 28098864.
- Pistamaltzian Nikolaos, et al. Treatment of relapsed urothelial bladder cancer with vinflunine: real-world evidence by the Hellenic Genitourinary Cancer Group. Anti-cancer drugs. 2016; 27.1: 48.
- Powles Thomas, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. The Lancet. 2018; 391.10122: 748-757.
- Sharma Padmanee, et al. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. The Lancet Oncology. 2017; 18.3: 312-322.
- Bellmunt Joaquim, et al. Pembrolizumab as second-line therapy for advanced urothelial carcinoma. New England Journal of Medicine. 2017; 376.11: 1015-1026.
Статья предоставлена компанией «Пьер Фабр». Публикуется в редакции авторов.
Винфлунин
Vinflunine
Фармакологическое действие
Винфлунин — алкалоид растительного происхождения, производное винкаалкалоида, оказывает цитостатическое действие. Связывается с тубулином в или около мест связывания винкалкалоидов, ингибирует полимеризацию белков микротрубочек клеточных цитоплазм, нарушая динамическое равновесие процесса полимеризация — деполимеризация, за счёт которого обеспечивается функционирование внутриклеточных структур на протяжении всего жизненного цикла клеток, что влечёт за собой апоптотическую гибель клеток в результате длительной блокировки митоза.
Фармакокинетика
Фармакокинетика винфлунина имеет линейный характер в диапазон доз от 30 мг/м2до 400 мг/м2 у пациентов с раком.
AUC винфлунина в значительной степени коррелирует с тяжестью лейкопении, нейтропении и слабости. Терминальный объём распределения составляет около 35 л/кг, что предполагает интенсивное распределение в ткани.
Все метаболиты образуются при участии изофермента CYP3A4, за исключением 4-О-деацетилвинфлунина — это единственный активный и основной метаболит, который образуется путём при участии эстераз. Винфлунин в умеренно степени связывается с белками плазмы у человека (67,2 ± 1,1 %).
Выводится мультиэкспоненциально, терминальный период полувыведения составляет около 40 часов. Основной метаболит медленно образуется и медленно выводится, период полувыведения составляет около 120 часов. Винфлунин и его метаболит выводятся главным образом с калом (⅔) и мочой (⅓). Общий плазменный клиренс — 40 л/ч. У пациентов с пониженным клиренсом креатинина, уменьшается клиренс винфлунина.
Показания
Монотерапия у взрослых пациентов с распространённым или метастатическим уротелиальным переходно-клеточным раком после терапии препаратами платины, не давшей положительного результата.
Противопоказания
- Повышенная чувствительность к винфлунину или к алкалоидам барвинка;
- инфекционные заболевания в течение 2-х недель до начала терапии или текущие тяжёлые инфекционные заболевания;
- абсолютное число нейтрофилов менее 1,500 клеток/ мкл крови при первом введении препарата и менее 1,000 клеток/ мкл крови при последующих введениях препарата или тромбоцитов менее 100,000 клеток/мкл крови;
- беременность;
- лактация (период грудного вскармливания);
- детский возраст до 18 лет.
С осторожностью
- Синдром врождённого удлинения интервала QT;
- заболевания сердца (сердечная недостаточность, инфаркт миокарда, ишемия миокарда, стенокардия, брадикардия);
- электролитный дисбаланс (например при гипокалиемии, гипомагниемии);
- одновременный приём препаратов, удлиняющих интервал QT (в том числе антиаритмики IA и III классов);
- синдром задней обратимой энцефалопатии;
- печёночная недостаточность средней и тяжёлой степени (стандартная доза винфлунина должна быть уменьшена);
- почечная недостаточность средней и тяжёлой степени (стандартная доза винфлунина должна быть уменьшена);
- возраст 75 лет и старше (рекомендуемые стандартные дозы винфлунина должны быть уменьшены).
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — X.
Адекватных и хорошо контролируемых исследований о применении винфлунина у беременных женщин не проведено.
Экспериментальные исследования на животных показали эмбриотоксичность и тератогенность винфлунина.
Женщины детородного возраста, получающие винфлунин, должны применять надёжные методы контрацепции.
Если винфлунин применяется в период беременности или беременность наступила во время лечения, пациентка должна быть предупреждена о потенциальной опасности для плода. При этом необходима генетическая консультация.
Винфлунин противопоказан к применению при беременности, за исключением случаев крайней необходимости.
Применение в период грудного вскармливания
Специальных исследований о применении винфлунина в период грудного вскармливания не проведено.
Неизвестно, выделяется ли винфлунин с грудным молоком у человека.
При необходимости применения в период лактации следует прекратить грудное вскармливание.
Планирование беременности
Во время лечения и в течение, по крайней мере, трёх месяцев после прекращения терапии необходимо использовать надёжные методы контрацепции.
Пациентам, планирующим рождение детей после завершения лечения, рекомендуется генетическая консультация.
Вследствие возможности развития необратимой потери фертильности в результате лечения винфлунином, пациентам должна быть дана рекомендация по консервации спермы до начала курса лечения.
Способ применения и дозы
Перед началом курса лечения следует провести развёрнутый анализ клеточного состава крови с определением абсолютного числа нейтрофилов (АЧН), тромбоцитов и гемоглобина, так как нейтропения, тромбоцитопения и анемия являются частыми побочными реакциями при применении винфлунина.
Рекомендуемая доза составляет 320 мг/м2 в виде 20-минутной внутривенной инфузии каждые 3 недели.
Если показатель общего состояния по шкале WHO/ECOG составляет 1 или 0 и уже имеется распространение процесса на тазовые органы, лечение следует начинать с дозы 280 мг/м2. При отсутствии гематологической токсичности в течение первого курса, нарушений, обусловленных терапией, или необходимостью уменьшения дозы, эта доза может быть увеличена до 320 мг/м2 каждые 3 недели при последующих циклах.
Для профилактики запора рекомендуются слабительные средства, диета, включая приём воды внутрь, с 1 по 5–7 дни после введения винфлунина.
При развитии неприемлемой степени токсичности следует отложить очередную инфузию до восстановления гематологических показателей, провести коррекцию дозы, или прекратить применение винфлунина.
Пациентам с нарушениями функции печени класса А и выше по шкале Чайлд-Пью, с протромбиновым временем ≥60 %, значениями билирубина ≥1,5 ВГН, трансаминаз >ВГН и/или ГГТ >5 ВГН требуется соответствующая коррекция режима дозирования.
У пациентов с нарушениями функции почек (клиренс креатинина ≤60 мл/мин) требуется коррекция режима дозирования.
Пациентам пожилого возраста ≥75 лет требуется коррекция режима дозирования.
Данных о применении в педиатрии не имеется.
Побочные действия
Побочные реакции систематизированы по системно-органным классам и перечислены в соответствии со следующей градацией: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1 000, <1/100); редко (≥1/10 000, <1/1 000); очень редко (<1/10 000); частота неизвестна (не может быть оценена по имеющимся данным).
Инфекционные и паразитарные заболевания
Часто — инфекционные заболевания на фоне нейтропении, инфекционные осложнения (вирусные, бактериальные, грибковые); нечасто — бактериальный сепсис на фоне нейтропении.
Со стороны крови и лимфатической системы
Очень часто — нейтропения, лейкопения, анемия, тромбоцитопения; часто — фебрильная нейтропения.
Со стороны иммунной системы
Часто — гиперчувствительность.
Со стороны метаболизма
Очень часто — гипонатриемия, снижение аппетита; часто — обезвоживание.
Со стороны психики
Часто — бессонница.
Со стороны нервной системы
Очень часто — периферическая сенсорная нейропатия; часто — обмороки, головная боль, головокружение, невралгия, нарушение вкусовосприятия, нейропатия; нечасто — периферическая моторная нейропатия; редко — синдром задней обратимой энцефалопатии.
Со стороны органа зрения
Нечасто — нарушения зрительного восприятия.
Со стороны органа слуха и лабиринтные нарушения
Часто — боль в ухе; нечасто — головокружение, ощущение звона в ушах.
Со стороны сердца
Часто — тахикардия; нечасто — ишемия миокарда, инфаркт миокарда.
Со стороны сосудов
Часто — повышение артериального давления, венозный тромбоз, флебит, снижение артериального давления.
Со стороны дыхательной системы, органов грудной клетки и средостения
Часто — одышка, кашель; нечасто — острый респираторный дистресс-синдром, боли в области гортани и глотки.
Со стороны пищеварения
Очень часто — запор, боль в животе, рвота, тошнота, стоматит, диарея; часто — кишечная непроходимость, дисфагия, нарушения слизистой оболочки полости рта, диспепсия; нечасто — боль при глотании, гастрит, эзофагит, гингивит.
Со стороны эндокринной системы
Нечасто — синдром неадекватной секреции антидиуретического гормона.
Новообразования (доброкачественные, злокачественные и неизвестной этиологии)
Нечасто — болезненность в области опухоли.
Со стороны кожи и подкожных тканей
Очень часто — алопеция; часто — кожные реакции (сыпь, крапивница), зуд, гипергидроз; нечасто — эритема, сухость кожных покровов.
Со стороны скелетно-мышечной системы и соединительной ткани
Очень часто — миалгия; часто — мышечная слабость, артралгия, костно-мышечные боли различной локализации, боль в грудной клетке, боль в спине, боль в челюсти, боль в конечностях.
Со стороны почек и мочевыводящих путей
Нечасто — почечная недостаточность.
Общие расстройства и нарушения в месте введения
Очень часто — астения, чувство усталости, реакция в месте введения, повышение температуры тела; часто — боль в грудной клетке, озноб, боль и/или отёк в месте введения; нечасто — экстравазация.
Лабораторные и инструментальные данные
Очень часто — снижение массы тела; нечасто — повышение активности трансаминаз, повышение массы тела.
Передозировка
Симптомы передозировки винфлунином
Основным токсическим эффектом вследствие передозировки является подавление функции костного мозга с риском последующего развития тяжёлой инфекции.
Лечение передозировки винфлунином
Специфический антидот неизвестен. В случае передозировки необходимо госпитализировать пациента и тщательно контролировать функции жизненно важных органов. Должны быть предприняты соответствующие меры, такие как переливание крови, введение антибиотиков, факторов роста.
Взаимодействие
Исследования in vitro показали, что винфлунин не оказывает индуцирующее влияние на активность изоферментов CYP1A2, CYP2B6 или CYP3A4 и не оказывает ингибирующее влияние на активность изоферментов CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 и CYP3A4.
Исследования in vitro показали, что винфлунин, как и другие алкалоиды барвинка, является субстратом для P-gp, но с меньшим сродством, поэтому риск возникновения клинически значимого взаимодействия маловероятен.
При совместном применении винфлунина с цисплатином, карбоплатином, капецитабином или гемцитабином не наблюдалось фармакокинетического взаимодействия.
При совместном применении винфлунина с доксорубицином не наблюдалось фармакокинетического взаимодействия, однако данная комбинация связана с повышенным риском развития гематологической токсичности.
Совместное применение с кетоконазолом (в дозировке 400 мг внутрь однократно в течение 8 дней) приводит к увеличению экспозиции винфлунина в крови (на 30 %) и его метаболита 4-О-деацетил-винфлунина (на 50 %).
Следует избегать совместного применения винфлунина и сильных ингибиторов изофермента CYP3A4 (ритонавир, кетоконазол, итраконазол, сок грейпфрута) или его индукторов (рифампицин, трава зверобоя продырявленного), так как эти средства могут изменять концентрацию винфлунина.
Следует избегать совместного применения с препаратами, удлиняющими интервал QT/QTc.
Совместное применение с опиоидами увеличивает риск возникновения запоров.
Отмечалось фармакокинетическое взаимодействие между винфлунином и липосомальным доксорубицином, что вызывало 15–30 % увеличение экспозиции винфлунина и уменьшение в 2–3 раза AUC доксорубицина, при этом концентрация метаболита доксорубицинола не изменялись. Исследования in vitro показали, что такие изменения могут быть обусловлены поглощением винфлунина липосомами и изменённым распределением обоих средств в крови. Таким образом, комбинации такого типа следует использовать с осторожностью.
Возможное взаимодействие винфлунина с паклитакселом и доцетакселом (субстраты изоферментов CYP3) было изучено в исследовании in vitro (незначительное ингибирование метаболизма винфлунина), но специальных клинических исследований по взаимодействию с этими средствами не проводилось.
Особые указания
Винфлунин предназначен исключительно для внутривенного введения.
Интратекальное введение категорически запрещено (приводит к летальному исходу)!
Лечение винфлунином следует проводить под наблюдением врача, имеющего опыт работы с противоопухолевыми средствами. Терапию проводят под строгим гематологическим контролем, определяя число лейкоцитов, нейтрофилов, тромбоцитов, а также концентрацию Hb перед каждой очередной инфузией.
После введения винфлунина отмечалось несколько случаев удлинения интервала QT, что повышает риск развития желудочковой аритмии. Несмотря на то что при применении винфлунина желудочковые аритмии не наблюдались, винфлунин следует использовать с осторожностью у пациентов с риском развития аритмии (например сердечная недостаточность, удлинение интервала QT в анамнезе, гипокалиемия). Не рекомендуется одновременный приём двух или более средств, удлиняющих интервал QT/QTc.
Особую осторожность следует проявлять, когда винфлунин вводится пациентам с сердечно-сосудистыми заболеваниями в анамнезе. Могут возникать ишемические сердечно-сосудистые осложнения, особенно у пациентов, у которых имеется основное сердечно-сосудистое заболевание. Пациенты, которым назначен винфлунин, должны тщательно наблюдаться врачами на предмет развития сердечно-сосудистых осложнений. Следует регулярно выполнять тщательный анализ соотношения между риском и пользой. Необходимо рассматривать возможность отмены винфлунина у пациентов, у которых возникла ишемия миокарда.
После введения винфлунина наблюдались случаи синдрома задней обратимой энцефалопатии. Типичные клинические симптомы в разной степени включали следующие проявления: неврологические (головная боль, спутанность сознания, судорожные припадки, зрительные расстройства), системные (артериальная гипертензия) и желудочно-кишечные (тошнота, рвота).
Радиологические признаки состоят в наличии изменений в белом веществе задних отделов головного мозга. У пациентов с появившимися симптомами синдрома задней обратимой энцефалопатии следует контролировать артериальное давление. Для подтверждения диагноза рекомендуется сделать томографию головного мозга.
Клинические и радиологические признаки, как правило, обратимы и быстро исчезают после отмены винфлунина.
Следует рассматривать возможность отмены винфлунина у пациентов, у которых появились неврологические признаки синдрома задней обратимой энцефалопатии.
После введения винфлунина наблюдалась выраженная гипонатриемия, включая случаи, возникающие из-за синдрома неадекватной секреции антидиуретического гормона. Поэтому рекомендуется регулярный мониторинг уровня натрия в сыворотке крови во время лечения винфлунином.
С целью предотвращения запоров с 1-го по 5-й или 7-й день после каждого применения винфлунина следует применять слабительные средства, а также диету, богатую клетчаткой, и обильное питье. Пациентам с высоким риском запоров (одновременный приём опиатов, перитонеальная карцинома, новообразования органов брюшной полости, предшествующая обширная полостная операция) следует назначать осмотические слабительные средства 1 раз в сутки утром перед завтраком с 1-го по 7-й день после применения винфлунина.
При наличии запора 2-й степени, который требует применения слабительных средств не менее 5 дней, или при запоре ≥3-й степени любой продолжительности следует корректировать дозу винфлунина.
Запор 3-й степени является непроходимостью, требующей эвакуации содержимого кишечника методом ручного пособия или с использованием клизмы, при 4-й степени имеется обструкция или токсический мегаколон.
При желудочно-кишечной токсичности ≥3-й степени (исключая рвоту и тошноту) или мукозите (2-й степени в течении 5 дней и более или ≥3-й степени любой продолжительности) требуется коррекция дозы. 2-я степень является средней, 3-я степень — тяжёлая, а 4-я степень — жизнеугрожающая.
Винфлунин следует вводить в крупную вену, предпочтительно в области верхней части предплечья, или центральную вену руки.
При введении средства через периферическую вену винфлунин может вызвать её флебит.
Во избежание экстравазации или кровоизлияния необходимо удостоверится в правильном введении иглы перед началом инфузии.
При венах малого диаметра или с уплотнённой стенкой, лимфатическом отёке или недавнем проколе этой же вены, предпочтительнее использовать центральный катетер.
Мужчины и женщины должны использовать надёжные методы контрацепции в период лечения, а также в течение 3 месяцев после окончания терапии.
Вследствие возможности необратимой потери фертильности в результате лечения винфлунином пациентам должна быть дана рекомендация по консервации спермы до начала курса лечения.
Влияние на способность к вождению автотранспорта и управлению механизмами
Пациентам не следует управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, если они испытывают побочные реакции, способные повлиять на выполнение этой деятельности (например часто возникающая усталость, головокружение, обморок).
Классификация
-
АТХ
L01CA05
-
Фармакологическая группа
-
Коды МКБ 10
-
Категория при беременности по FDA
X
(противопоказано)
Информация о действующем веществе Винфлунин предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Винфлунин, содержатся в инструкции производителя, прилагаемой к упаковке.
Определение частоты побочных реакций: очень часто (? 1/10); часто (? 1/100 до < 1/10); нечасто (? 1/1000 до < 1/100); редко (? 1/10 000 до < 1/1,000); очень редко (< 1/10 000), частота неизвестна (невозможно оценить по имеющимся данным).
Побочные эффекты у пациентов с переходно-клеточным раком мочевого пузыря
Инфекции: часто – инфекции, связанные с нейтропенией; нечасто – вирусные, бактериальные, грибковые инфекции.
Со стороны системы кроветворения: очень часто — нейтропения, лейкопения, анемия, тромбоцитопения; часто – фебрильная нейтропения.
Со стороны иммунной системы: реакции повышенной чувствительности.
Со стороны обмена веществ: очень часто – гипонатриемия, анорексия, уменьшение массы тела; часто – дегидратация; нечасто – увеличение массы тела.
Со стороны нервной системы: часто – периферическая сенсорная невропатия, бессонница, синкопе, головная боль, головокружение, головная боль, дисгевзия, невралгия, невропатия; нечасто – периферическая моторная невропатия; редко — синдром задней обратимой энцефалопатии.
Со стороны органов чувств: часто – боль в ушах; нечасто – нарушения зрения, вертиго, шум в ушах.
Со стороны сердечно-сосудистой системы: часто – тахикардия, артериальная гипертензия, венозный тромбоз, артериальная гипотензия; нечасто – ишемия миокарда, инфаркт миокарда.
Со стороны дыхательной системы: часто – одышка, кашель; нечасто – острый респираторный дистресс-синдром, фаринго-ларингеальная боль.
Со стороны пищеварительной системы: очень часто – запор, боль в животе, тошнота, рвота, стоматит, диарея; часто — илеус, дисфагия, диспепсия; нечасто – одинофагия, желудочные нарушения, эзофагит, нарушения состояния языка, повышение активности трансаминаз.
Со стороны кожи и подкожных тканей: очень часто – алопеция; часто – сыпь, крапивница, зуд, гипергидроз; нечасто – сухость кожи, эритема.
Со стороны костно-мышечной системы: очень часто – миалгия; часто – мышечная слабость, артралгия, боль в спине, боль в челюсти, боль в конечностях, боль в костях, мышечно-скелетная боль.
Со стороны мочевыделительной системы: нечасто – почечная недостаточность.
Общие реакции: очень часто – астения, слабость, пирексия; часто – боли в грудной клетке, озноб, боль, отеки.
Прочие: частота неизвестна — боль в опухоли.
Побочные эффекты при применении по всем показаниям
Со стороны системы кроветворения: 50.2% — нейтропения 3-4 степени; 10.4% — тяжелая анемия; 3.5% — тромбоцитопения; 5.3% — фебрильная нейтропения (АЧН < 1000/мкл, лихорадка до 38.5°C неизвестной этиологии); 3.3% — инфекция при 3-4 степени нейтропении.
Со стороны пищеварительной системы: 12% — тяжелый запор.
Со стороны нервной системы: 0.1% — периферическая сенсорная невропатия 3 степени; в редких случаях – синдром задней обратимой энцефалопатии.
Со стороны сердечно-сосудистой системы: 0.6% — ишемия или инфаркт миокарда (преимущественно у пациентов с предшествующим заболеванием сердечно-сосудистой системы); в единичных случаях – летальный исход вследствие инфаркта миокрада и остановки сердца, пролонгирование интервала QT.
Со стороны дыхательной системы: 3.3% — диспноэ; в единичных случаях – бронхоспазм.
Со стороны эндокринной системы: в единичных случаях — синдром неадекватной секреции АДГ.
