Химическое название
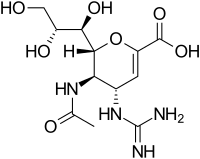
(2R,3R,4S)- 4-[(diaminomethylidene)amino]- 3-acetamido- 2-[(1R,2R)- 1,2,3-trihydroxypropyl]- 3,4-dihydro- 2H-pyran- 6-carboxylic acid
Химические свойства
Занамивир – противовирусное лекарственное средство.
Молекулярная масса = 332,3 грамма на моль. Средство выпускается в виде дозированного порошка для ингаляций, по 5 мг вещества в одной дозе.
Фармакологическое действие
Противовирусное.
Фармакодинамика и фармакокинетика
Вещество является сильным высокоселективным ингибитором фермента нейраминидазы вируса гриппа. В норме фермент отвечает за процессы проникновения вирусов через мембраны и слизистые барьеры здоровых клеток, и его высвобождение из вирусной оболочки. Процесс репликации вируса ограничивается клетками поверхностного эпителия, и он не может распространяться по тканям дыхательных путей.
Действующее вещество не проникает внутрь клетки, оно активно исключительно во внеклеточном пространстве. Занамивир сдерживает размножение вирусов типов А и В, предотвращает их распространение по организму.
При ингаляционном введении препарата усваивается порядка 15% действующего вещества. Максимальной своей концентрации средство достигает через 60-120 минут. В целом лекарство обладает низкой степенью системной абсорбции, AUC и концентрация в крови тоже низкие. Абсолютная биологическая доступность – не более 2%. Наибольшие концентрации вещества можно обнаружить в дыхательных путях (ротовая полость, глотка, легкие). Лекарство не подвергается реакциям метаболизма. Период полувыведения – порядка 2,5-5 часов. Выводится вещество через почки, полностью в течение суток.
Показания к применению
Лекарственное средство назначают для профилактики или лечения гриппа А и В взрослым и детям, в возрасте от 5 лет.
Противопоказания
Препараты Занамивира противопоказаны:
- при аллергии на действующее вещество;
- на первом триместре беременности;
- детям до 5 лет;
- во время лактации.
Побочные действия
Побочные реакции проявляются крайне редко.
Могут возникнуть: отек Квинке, высыпания на коже, бронхоспазм, отек гортани, отдышка, отек лица.
Занамивир, инструкция по применению (Способ и дозировка)
Вещество вводят ингаляционно, используя специальный ингалятор.
Курс лечения и суточную дозировку определяет врач.
Для лечения гриппа назначают по 2 ингаляции, 2 раза в сутки, в течение 5 дней. Таким образом, общая суточная доза составляет 20 мг.
В качестве профилактического средства производят по 2 ингаляции, 1 раз в день, 10 дней. По показаниям продолжительность приема лекарства можно увеличить до 30 дней.
Передозировка
Вероятность случайной передозировки крайне мала. При приеме 64 мг лекарства в день, какие либо нежелательные реакции не проявились.
Взаимодействие
Нельзя комбинировать препарат с другими ингаляционными лекарствами.
Условия продажи
Нужен рецепт.
Условия хранения
Хранить в недоступном для маленьких детей месте при температуре не выше 30 градусов.
Срок годности
7 лет.
Особые указания
Если во время лечения препаратом возник бронхоспазм или ухудшилась функция дыхания можно использовать бронходилататоры в качестве средств скорой помощи.
У детей в Японии были зарегестрированы случаи развития делирия, галлюцинаций и девиантного поведения на ранних стадиях заболевания при лечении лекарствами на основе Занамивира. Нежелательные реакции имели спонтанный характер, наступали и проходили внезапно. Неизвестно, были ли эти симптомы связаны с приемом лекарства. Тем не менее, в случае возникновения неврологических и поведенческих расстройств следует решить вопрос о целесообразности дальнейшего лечения данным веществом.
Детям
Средство не назначают детям, не достигшим пятилетнего возраста. Коррекция дозировки не требуется.
При беременности и лактации
Нельзя использовать лекарство на первом триместре беременности и во время кормления грудью.
Вопрос о лечении Занамивиром на 2 и 3 триместрах должен решаться лечащим врачом.
Препараты, в которых содержится (Аналоги Занамивира)
Совпадения по коду АТХ 4-го уровня:
Торговое название Занамивира: Реленза.
Наиболее близкий аналог вещества: осельтамивира фосфат, действующее вещество препарата Тамифлю. Средство – производное аминоциклогексан карбоновой кислоты также обладает мощным противовирусным эффектом.
Отзывы о Занамивире
Отзывы о Релензе неоднозначные. Противовирусное средство обычно облегчает течение болезни, помогает быстро сбить температуру, не вызывает побочных реакций. Однако встречаются сообщения о низкой эффективности лекарства в качестве профилактического средства.
Некоторые отзывы:
- ”… Несколько лет назад моей сестре-терапевту выдали Релензу на пробу. Пропили курс всей семьей. Результатом очень довольны, гриппом за сезон никто не заболел”;
- “… Никак не получалось сбить высокую температуру, столбил термометра доходил до 39 градусов. Только Реленза и помогла”;
- “… Принимала лекарство для профилактики, как написано в инструкции. Но за 2 дня до окончания курса вдруг заболела. Жалко, что, несмотря на такую высокую стоимость, препарат оказался неэффективным”.
Цена Занамивира, где купить
Препарат с действующим веществом Занамивир Реленза стоит примерно 2500 рублей за 5 ротадисков, в каждом по 4 дозы лекарства.
Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Занамивир
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Фармакология
-
Применение вещества Занамивир
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Занамивир
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Источники информации
-
Торговые названия с действующим веществом Занамивир
Структурная формула
Русское название
Занамивир
Английское название
Zanamivir
Латинское название
Zanamivirum (род. Zanamiviri)
Химическое название
5-(Ацетиламино)-4-[(аминоиминометил)амино]-2,6-ангидро-3,4,5-тридеокси-D-глицеро-D-галактонон-2-еноновая кислота
Брутто формула
C12H20N4O7
Фармакологическая группа вещества Занамивир
Нозологическая классификация
Код CAS
139110-80-8
Фармакологическое действие
—
противовирусное.
Фармакология
Фармакодинамика
Занамивир — сильный и высокоселективный ингибитор нейраминидазы (поверхностного фермента вируса гриппа). Вирусная нейраминидаза обеспечивает высвобождение вирусных частиц из инфицированной клетки и может ускорять проникновение вируса через слизистый барьер к поверхности эпителиальных клеток, тем самым обеспечивая инфицирование других клеток дыхательных путей. Ингибирующая активность занамивира показана как in vitro, так и in vivo и включает все 9 подтипов нейраминидаз вирусов гриппа, в т.ч. циркулирующие и вирулентные для различных видов. Для штаммов вируса А и В IC50 составляет от 0,09 до 95,2 нM.
Репликация вируса гриппа ограничена клетками поверхностного эпителия дыхательных путей. Занамивир действует во внеклеточном пространстве, уменьшая воспроизведение обоих типов вируса гриппа (А и В) и предотвращая выброс вирусных частиц из клеток поверхностного эпителия дыхательных путей. Эффективность занамивира при ингаляционном применении подтверждена в контролируемых клинических исследованиях. Использование занамивира в качестве терапии острых инфекций, вызванных вирусом гриппа, приводило к уменьшению выброса вируса (по сравнению с плацебо). Развитие резистентности к занамивиру у лиц с нормальным иммунитетом не зарегистрировано.
Фармакокинетика
Всасывание. Абсолютная биодоступность низкая и составляет в среднем 2% после перорального применения. После пероральной ингаляции всасывается примерно от 10 до 20% введенной дозы. После однократного приема 10 мг Cmax в плазме крови составила 97 нг/мл через 1,25 ч. Низкая степень всасывания приводит к низким системным концентрациям и незначимой AUC. Низкая степень всасывания сохраняется при повторных ингаляциях.
Распределение. Связывание занамивира с белками плазмы крови очень низкое (<10%). Vd у взрослых около 16 л, который приблизительно равен объему внеклеточной жидкости.
После пероральной ингаляции занамивир осаждается в дыхательных путях в высоких концентрациях, обеспечивая доставку ЛС к «входным воротам» инфекции. После ингаляции 10 мг занамивира в эпителиальном слое дыхательных путей концентрации занамивира превышали среднее значение IC50 для нейраминидазы в 340 раз через 12 ч после ингаляции и в 52 раза через 24 ч после ингаляции, обеспечивая быстрое ингибирование вирусного фермента. Основные места осаждения — ротовая часть глотки и легкие (средний показатель 77,6 и 13,2% соответственно).
Метаболизм и выведение. Занамивир не подвергается метаболизму, выводится почками в неизменном виде. T1/2 из плазмы крови после пероральной ингаляции варьирует от 2,6 до 5,05 ч. Общий клиренс составляет от 2,5 до 10,9 л/ч.
Особые группы пациентов
Пожилые пациенты. Биодоступность занамивира после введения терапевтической дозы 20 мг составляет 10–20%, в результате чего концентрации занамивира в системном кровотоке незначительны. Коррекция режима дозирования не требуется, поскольку любые возрастные изменения, обычно приводящие к изменению фармакокинетических профилей различных ЛС, в данном случае не оказывают влияние на фармакокинетику занамивира.
Дети. Фармакокинетика занамивира оценивалась в контролируемом педиатрическом исследовании у 24 пациентов в возрасте от 3 мес до 12 лет при использовании небулайзера (10 мг) и порошкового ингалятора (10 мг). Фармакокинетические параметры у детей не отличались от таковых у взрослых при применении 10 мг занамивира, порошка для ингаляций.
Нарушение функции почек. При применении терапевтических доз 20 мг биодоступность низкая и составляет 10–20%, следовательно, системные концентрации занамивира незначительны. Учитывая широкий диапазон безопасности занамивира, возможное увеличение системных концентраций у пациентов с почечной недостаточностью тяжелой степени остается клинически незначимым и не требует коррекции режима дозирования.
Нарушение функции печени. Поскольку занамивир не подвергается метаболизму, не требуется коррекция режима дозирования.
Клиническая эффективность и безопасность
Применение занамивира, порошка для ингаляций дозированного, у здоровых людей, относящихся к группе риска (как правило, находившихся в контакте с заболевшими), в дозах, используемых при лечении гриппа, облегчает симптоматику и сокращает продолжительность заболевания. Комбинированный анализ результатов исследований III фазы показал, что медиана времени до облегчения симптомов заболевания сокращается до 1,5 дня у пациентов в группе занамивира по сравнению с пациентами в группе плацебо (р<0,001). Количество осложнений снижалось в группе занамивира 171/769 (22%) по сравнению с плацебо 208/711 (29%), и относительный риск составил 0,77; (95% ДИ: от 0,65 до 0,92; р=0,004).
Использование антибиотиков для лечения осложнений после перенесенного гриппа также снижалось от 136/711 (19%) в группе плацебо до 110/769 (14%) в группе занамивира (относительный риск 0,76; 95% ДИ: от 0,6 до 0,95; р=0,021).
Оптимальная эффективность занамивира была показана в случае начала проведения лечения в максимально короткие сроки после появления первых симптомов заболевания. Было показано, что занамивир также эффективен в качестве средства профилактики гриппа у детей старше 5 лет и у взрослых. Процент эффективной защиты составляет 67–79% по сравнению с плацебо и 56–61% по сравнению с активным контролем.
Применение вещества Занамивир
Лечение инфекции, вызванной вирусом гриппа типа А и В, у детей старше 5 лет и взрослых; профилактика инфекции, вызываемой вирусом гриппа типа А и В, у детей старше 5 лет и взрослых.
Противопоказания
Повышенная чувствительность.
Ограничения к применению
Заболевания дыхательных путей, сопровождающиеся бронхоспазмом (в т.ч. в анамнезе).
Применение при беременности и кормлении грудью
Эффективность и безопасность занамивира при беременности не установлена.
Исследования репродуктивной токсичности, проведенные на крысах и кроликах, показали, что занамивир проникает через плацентарный барьер. В исследованиях на крысах не было отмечено признаков тератогенности, влияния на фертильность или клинически значимых нарушений пери- или постнатального развития потомства после применения занамивира. Однако данные о проникновении занамивира через плацентарный барьер у человека отсутствуют.
Занамивир не следует применять женщинам во время беременности, особенно в I триместре, за исключением случаев, когда ожидаемая польза для матери превышает потенциальный риск для плода.
Побочные действия вещества Занамивир
Занамивир хорошо переносится при применении в виде пероральных ингаляций.
В контролируемых клинических исследованиях, включавших группы пациентов высокого риска (пациенты пожилого возраста, а также пациенты, имеющие некоторые хронические заболевания), частота возникновения нежелательных реакций сходна в группе занамивира и группе плацебо.
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100); редко (≥1/10000 и <1/1000); очень редко (<1/10000, включая отдельные случаи).
Категории частоты были сформированы на основании клинических исследований и пострегистрационного наблюдения.
Со стороны иммунной системы: очень редко — аллергические реакции, включая анафилактические и анафилактоидные, отек лица и ротоглотки.
Со стороны нервной системы: очень редко — вазовагальные реакции (были зафиксированы у пациентов с симптомами вируса гриппа, такими как жар, обезвоживание, наблюдавшимися сразу же после ингаляции занамивира).
Нарушения психики: частота неизвестна — судороги, спутанность сознания, нарушения поведения, галлюцинации, возбуждение, беспокойство, делирий регистрировались при применении занамивира у пациентов с гриппом, в основном среди детей и подростков. Судороги и психоневрологические симптомы также отмечались у пациентов с гриппом, не принимавших занамивир.
Со стороны сердца: частота неизвестна — аритмия, обморок.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень редко — бронхоспазм, одышка.
Со стороны кожи и подкожных тканей: очень редко — сыпь, крапивница, тяжелые кожные реакции, включая полиморфную эритему, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Взаимодействие
Занамивир не связывается с белками, а также не метаболизируется и не подвергается изменениям в печени. Клинически значимые лекарственные взаимодействия маловероятны.
Передозировка
Симптомы: случайная передозировка маловероятна из-за особенностей формы выпуска, пути введения и низкой биодоступности (10–20%) занамивира. При изучении применения водного раствора занамивира без лактозы, ингаляционно (через небулайзер) в дозе 64 мг/сут (более чем в 3 раза превышает рекомендуемую суточную дозу) не зарегистрировано побочных эффектов. Также они не зарегистрированы и при в/в применении в течение 5 дней до 1200 мг/сут в условиях клинических исследований.
Лечение: так как занамивир имеет низкую молекулярную массу, низкую связь с белками плазмы крови и малый Vd, ожидаемо его выведение путем гемодиализа. Таким образом, гемодиализ можно рассматривать как вариант лечения передозировки занамивира.
Способ применения и дозы
Ингаляционно. Рекомендуемая доза занамивира составляет 2 ингаляции (2×5 мг) 2 раза в сутки в течение 5 дней. Общая суточная доза — 20 мг. Для достижения оптимального эффекта лечение должно быть начато при появлении первых симптомов заболевания.
Меры предосторожности
Грипп может сопровождаться усилением гиперреактивности дыхательных путей.
Были получены очень редкие сообщения о приступах бронхоспазма и/или ухудшения легочной функции после ингаляций занамивира пациентам, у которых проводилась терапия гриппа; у некоторых из этих пациентов отсутствовали хронические заболевания дыхательных путей в анамнезе. В этом случае необходимо прекратить лечение занамивиром и обратиться к специалисту для проведения медицинского обследования. Пациенты с хроническими заболеваниями дыхательных путей, получающие терапию занамивиром, должны иметь при себе быстродействующий бронходилататор. У пациентов с тяжелой бронхиальной астмой необходимо оценить предполагаемую пользу и возможный риск при применении занамивира. Не следует назначать занамивир, если не осуществляется надлежащий медицинский контроль. У пациентов с бронхиальной астмой и тяжелой степенью ХОБЛ лечение основного заболевания должно быть оптимизировано во время терапии занамивиром. Пациент должен быть проинформирован о потенциальной опасности возникновения бронхоспазма. Занамивир, порошок для ингаляций дозированный, не должен использоваться для приготовления раствора для небулайзера или для аппарата ИВЛ.
Имелись сообщения о госпитализации пациентов с гриппом, включая один смертельный случай, при этом применялся раствор, приготовленный из занамивира в виде порошка для ингаляций дозированного, через небулайзер или аппарат ИВЛ. В описании смертельного случая сообщалось, что лактоза, входящая в состав ЛС, препятствовала нормальному функционированию устройства. Таким образом, занамивир, порошок для ингаляций дозированный, должен применяться только с использованием прилагаемого устройства (Дискхалера).
Инфекция, вызванная вирусом гриппа, может сопровождаться различными неврологическими и поведенческими симптомами. В сообщениях, полученных в пострегистрационном периоде (преимущественно зарегистрированных у детей в Японии), отмечались судорожные припадки, делирий, галлюцинации и девиантное поведение у пациентов, инфицированных вирусом гриппа и принимающих ингибиторы нейраминидазы, включая занамивир. Эти явления наблюдались преимущественно на ранних стадиях заболевания, часто имели внезапное начало и быстрое разрешение. Причинно-следственная связь между приемом занамивира и вышеуказанными нежелательными явлениями не была установлена. При возникновении каких-либо психоневрологических симптомов необходимо оценить соотношение риск/польза дальнейшего лечения занамивиром для каждого конкретного пациента.
Влияние на способность управлять автомобилем и другими механизмами: не отмечено.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2007–2016.
Торговые названия с действующим веществом Занамивир
Rec.INN
зарегистрированное ВОЗ
Входит в состав препаратов:
список
Фармакологическое действие
Противовирусное средство, высокоселективный ингибитор нейраминидазы — поверхностного фермента вируса гриппа. Вирусная нейраминидаза способствует высвобождению сформированных вирусных частиц из инфицированных клеток и доступу вируса через слизистую оболочку на поверхность эпителиальных клеток. Это позволяет вирусу инфицировать другие клетки. Ингибирование этого фермента отражено в отношении репликации вируса гриппа А и В и нейтрализации всех известных субтипов нейраминидазы вируса гриппа А.
Занамивир действует вне клетки. Уменьшает размножение вирусов А и В путем ингибирования высвобождения инфекционных вирусов гриппа из эпителиальных клеток респираторного тракта. Репликация вируса гриппа ограничена поверхностным эпителием респираторного тракта. При применении занамивира для лечения гриппа происходит уменьшение выхода вируса из респираторного тракта.
Фармакокинетика
При ингаляционном применении абсолютная биодоступность занамивира низкая (в среднем 2%). Системная абсорбция составляет примерно 10-20%, при этом Cmax в плазме крови достигается через 1-2 ч. Вследствие низкой абсорбции концентрация активного вещества в плазме крови низкая, поэтому существенного системного влияния после ингаляции не наблюдается. После ингаляции занамивир распределяется в тканях респираторного тракта, достигая высоких концентраций. При применении в однократной дозе 10 мг занамивир определяется в эпителиальном слое дыхательных путей, который является основным местом репликации вируса гриппа. Концентрация занамивира через 12 ч и 24 ч после ингаляции примерно в 340 и 52 раз соответственно превышает медиану вирусной нейраминидазы. Высокая концентрация занамивира в респираторном тракте обеспечивает быстрое ингибирование вирусной нейраминидазы. Занамивир накапливается преимущественно в тканях ротоглотки и легких (в среднем 77.6% и 13.2% соответственно). Занамивир выводится почками в неизмененном виде и не подвергается метаболизму. T1/2 занамивира после ингаляции колеблется от 2.6 до 5 ч. Общий клиренс — от 2.5 до 10.9 л/ч, также как и почечный клиренс. Выведение почками завершается примерно через 24 ч.
Показания активного вещества
ЗАНАМИВИР
Лечение и профилактика гриппа А и В.
Режим дозирования
Предназначен только для ингаляционного введения в дыхательные пути с использованием специального ингалятора.
Рекомендуемая доза — по 5 мг 2 раза/сут. Суточная доза — 10-20 мг. Длительность применения зависит от показаний и составляет от 5 дней до 1 месяца.
Побочное действие
Аллергические реакции: ангионевротический отек, отек гортани, кожная сыпь, крапивница.
Со стороны дыхательной системы: бронхоспазм, одышка.
Противопоказания к применению
Детский возраст до 5 лет, повышенная чувствительность к занамивиру.
Применение при беременности и кормлении грудью
Не следует применять занамивир при беременности, особенно в I триместре, и в период лактации, за исключением случаев, когда ожидаемая польза терапии для матери превышает потенциальный риск для плода или младенца.
Применение у детей
Противопоказан в детском возрасте до 5 лет.
Особые указания
В редких случаях после приема занамивира возможны проявления бронхоспазма или снижения дыхательной функции у пациентов, которые прежде не страдали респираторными заболеваниями.
Пациентам с выявленными респираторными заболеваниями следует принимать быстродействующие бронходилататоры перед применением занамивира.
порошок от белого до почти белого цвета.
противовирусное средство
Код АТХ
J05AH01
Фармикодинимика
Занамивир — сильный и высокоселективпый ингибитор нейроаминидазы (поверхностного фермента вируса гриппа). Вирусная нейроаминидаза обеспечивает высвобождение вирусных частиц из инфицированной клетки и может ускорять проникновение вируса через слизистый барьер к поверхности эпителиальных клеток, тем самым обеспечивая инфицирование других клеток дыхательных путей. Ингибирующая активность занамивира показана как in vitro так и in vivo и включает все 9 подтипов пейраминидаз вирусов гриппа, в том числе циркулирующие и вирулентные для различных видов. Половина ингибирующей концентрации (IC50) для штаммов вируса А и В, составляет от 0.09 до 95.2 пМ.
Репликация вируса гриппа ограничена клетками поверхностного эпителия дыхательных путей. Занамивир действует во внеклеточном пространстве, уменьшая воспроизведение обоих типов вируса гриппа (А и В) предотвращая выброс вирусных частип клеток из клеток поверхностного эпителия дыхательных путей. Эффективность занамивира при ингаляционном применении подтверждена в контролируемых клинических исследованиях. Использование заиамавира в качестве терапии острых инфекций, вызванных вирусом гриппа, приводило к уменьшению выброса вируса (по сравнению с плацебо). Развития резистентности к занамивиру не зарегистрировано.
Фармакокинетика
Всасывание. Абсолютная биодоступность низкая и составляет в среднем 2% после перорального введения. После пероральной ингаляции всасывается примерно от 10% до 20% введенной дозы. После однократного приема 10 мг максимальная концентрация в плазме крови Сmax составила 97 нг/мл через 1.25 часа. Низкая степень всасывания приводит к низким системным концентрациям и незначимой площади под кривой «концентрация — время». Низкая степень всасывания сохраняется при повторных ингаляциях.
Распределение: после пероральной ингаляции занамивир осаждается в дыхательных путях а высоких концентрациях, обеспечивая доставку препарата к «входным воротам» инфекции. После ингаляции 10 мг занамивира в эпителиальном слое дыхательных путей концентрации превышали среднее значение половины ингибирующей концентрации для нейроаминидазы в 340 раз через 12 часов после ингаляции и в 52 раза через 24 часа, обеспечивая быстрое ингибирование вирусного фермента. Основные места осаждения — ротовая часть глотки и легкие (среднее 77,6% и 13,2 % соответственно).
Метаболизм и выведение: не подвергается метаболизму, выводится почками в неизменном виде. Период полувыведения из плазмы крови после пероральной ингаляции варьирует от 2,6 до 5,05 часа. Общий клиренс составляет от 2,5 до 10,9л/ч.
Особые популяции пациентов
Пожилые: биодоступность после введения терапевтической дозы 20 мг составляет 10 — 20%, в результате чего, концентрации в системном кровотоке незначительны. Коррекции режима дозирования не требуется, поскольку любые возрастные изменения, обычно приводящие к изменению фармакокинетических профилей различных препаратов, в данном случае не оказывают влияния на фармакокинетику занамивира.
Дети: фармакокинетика занамивира оценивалась в контролируемом педиатрическом исследовании у 24 пациентов в возрасте от 3 месяцев до 12 лет при использовании небулайзера (10 мг) и порошкового ингалятора (10 мг). Фармакокинетические параметры у детей не отличались от таковых у взрослых.
Пациенты с нарушением функции почек: при применении терапевтических доз 20 мг биодоступность низкая и составляет 10-20%, следовательно, системные концентрации занамивира незначительны. Учитывая широкий диапазон безопасности препарата, возможное увеличение системных концентраций у пациентов с почечной недостаточностью тяжелой степени остается клинически незначимым и не требует коррекции режима дозирования.
Пациенты с нарушением функции печени: поскольку занамивир не подвергается метаболизму, не требуется коррекции режима дозирования.
Клиническая эффективность и безопасность
Занамивир, применяемый в дозах, используемых при лечении гриппа, у здоровых, относящихся к группе риска (как правило, находившихся в контакте с заболевшими) облегчает симптоматику и сокращает продолжительность заболевания. Комбинированный анализ результатов 3 исследований показал, что медиана времени до облегчения симптомов заболевания сокращается до 1,5 дней у пациентов в группе занамивира по сравнению с пациентами в группе плацебо, (р < 0.001). Количество осложнений снижалось в группе занамивира 171/769 (22%) по сравнению с плацебо 208/711 (29%) и относительный риск составил: 0.77; (95% CI: 0.65 to 0.92; р=0.004). Использование антибиотиков для лечения осложнений после перенесенного гриппа также снижалось от 136/711 (19%) в группе плацебо до 110/769 (14%) в группе занамишра (относительный риск: 0.76; 95% CI: 0.60 to 0.95; р=0,021). Оптимальная эффективность занамивира была показана в случае начала проведения лечения в максимально короткие сроки после появления первых симптомов заболевания.
Было показано, что занамивир также эффективен в качестве средства профилактики гриппа у детей старше 5 лет и у взрослых. Процент эффективной защиты составляет 67 -79% по сравнению с плацебо и 56-61% по сравнению с активным контролем.
Лечение инфекции, вызванной вирусом гриппа типа А и В, у детей старше 5 лет и взрослых.
Профилактика инфекции, вызываемой вирусом гриппа типа А и В, у детей старше 5 лет и взрослых.
Повышенная чувствительность к любому из компонентов препарата.
С осторожностью
Заболевания дыхательных путей, сопровождающиеся бронхоспазмом (в том числе в анамнезе).
Применение при беременности и лактации
Эффективность и безопасность занамивира при беременности и лактации не изучалась. Экспериментальные исследования на животных показали, что занамивир проникает через плаценту и в грудное молоко, тем не менее не отмечено тератогенного эффекта или снижения фертильности или клинических проявлений каких-либо нарушений в пери- и постнатальном периодах. Информации о проникновении через плацентарный барьер или в грудное молоко у человека нет.
Тем не менее, занамивир не следует применять во время беременности и в период грудного вскармливания, особенно в первом триместре, только если ожидаемая польза применения для матери превышает возможный риск для плода.
Способ применения и дозировка
Занамивир применяется только ингаляционно перорально. Для обеспечениия правильного применения препарата следует использовать прилагаемый ДИСКХАЛЕР.
Пациентам, принимающим другие ингаляционные препараты (например, бронходилататоры), препарат Реленза следует применять только после этих препаратов.
Лечение
Взрослые и дети с 5 лет: рекомендуемая доза занамивира составляет две ингаляции (2×5 мг) дважды в сутки в течение 5 дней. Общая суточная доза составляет 20 мг. Для достижения оптимального эффекта лечение должно быть начато при появлении первых симптомов заболевания.
Пожилые пациенты: не требуется коррекции режима дозирования.
Пациенты с нарушением функции почек: не требуется коррекции режима дозирования.
Пациенты с нарушением функции печени: не требуется коррекции режима дозирования.
Профилактика
Взрослые и дети с 5 лет: рекомендуемая доза занамивира составляет две ингаляции (2?5 мг) 1 раз в сутки в течение 10 дней. Общая суточная доза составляет 10 мг. Длительность приема может быть увеличена до 1 месяца, если риск заражения сохраняется более 10 дней (например, предполагается более длительный контакт с заболевшими).
Пожилые пациенты: не требуется коррекции режима дозирования.
Пациенты с нарушением функции почек: не требуется коррекции режима дозирования.
Пациенты с нарушением функции печени: не требуется коррекции режима дозирования.
В контролируемых клинических исследованиях частота возникновения нежелательных явлений сходна в группе занамивира и группе плацебо. Спонтанные сообщения содержали информацию о нежелательных реакциях на применение занамивира и классифицировались следующим образом: очень часто (?1/10), часто (?1/100, Со стороны иимунной системы: очень редко: ачлергнческие реакции, включая отёк лица и гортани.
Со стороны дыхательных путей: очень редко: бронхоспазм, затруднение дыхания.
Со стороны кожи и её придатков: очень редко: сыпь, крапивница, тяжелые кожные реакции, включая полиморфную эритему, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Случайная передозировка мало вероятна из-за особенностей самой формы выпуска, пути введения и низкой биодоступности после перорального приема занамивира. При ингаляционном применении 64 мг в сутки (более чем в 3 раза превышающей рекомендуемую суточную) не зарегистрировано побочных эффектов. Также они не зарегистрированы и при парентеральном применении в течение 5 дней 1200 мг в сутки.
Зарегистрированы очень редкие отдельные сообщения о развитии бронхоспазма и/или ухудшении функции дыхания после применения занамавира, в том числе без предшествующих заболеваний в анамнезе. В случае развития одного из ышеперечисленных явлений следует прекратить прием занамивира и обратиться к врачу.
Пациенты с заболеваниями дыхательных путей должны иметь в качестве средства скорой помощи короткодействующие бронходилататоры при лечении занамивиром.
Инфекция, вызванная вирусом гриппа, может быть ассоциирована с различными неврологическими и поведенческими расстройствами. В сообщениях, полученных в постмаркетинговом периоде (преимущественно зарегистрированные у детей в Японии), отмечались судорожные припадки, делирий, галлюцинации и девиантное поведение у пациентов, инфицированных вирусом гриппа и принимающих ингибиторы нейраминидазы, включая занамивир. Эти явления наблюдались преимущественно на ранних стадиях заболевания, часто имели внезапное начало и быстрое наступление исхода. Причинно-следственная связь между приемом занамивира и вышеуказанными нежелательными явлениями не была доказана. При возникновении каких-либо психоневрологических симптомов необходимо оценить соотношение риск-польза дальнейшего лечения занамивиром для каждого конкретного пациента.
Порошок для ингаляций дозированный 5 мг/доза. Ламинированный алюминиевый ротадиск с 4 ячейками (блистер круглой формы, имеющий по 4 симметрично расположенные ячейки), каждая из которых содержит 1 дозу препарата). По 5 ротадисков в пластиковый флакон. Пластиковый флакон вместе с дискхалером и инструкцией по применению помещают в картонную пачку.
7 лет.
Не использовать по истечению срока годности, указанного на упаковке.
Хранить при температуре не выше 30°С.
Хранить в недоступном для детей месте.
Условия отпуска из аптек
По рецепту.
Производитель
ГлаксоВэллком Продакшен / GlaxoWellcome Production Юридический адрес: Промышленная зона 2, рю Лавуазье 23, Эвро, Франция / 23 rue Lavoisier — Zone Industrielle No 2,Evreux, France
За дополнительной информацией обращаться по адресу:
ЗАО «ГлаксоСмитКляйн Трейдинг», 121614, Москва, ул. Крылатская, дом 17, корп.З, эт.5 Бизнес-Парк «Крылатские Холмы»
Инструкция по использованию Дискхалера с Ротадисками
Устройство Дискхалер используется для ингаляций Ротадиска (форма выпуска Релензы). Дискхалер состоит из следующих частей:
- корпус с крышкой и пластиковой иглой для прокалывания ячейки ротадиска
- чехол для мундштука
- выдвижной лоток с мундштуком и вращающимся колесом, на которое помещается Ротадиск
Ротадиск состоит из 4 блистеров, каждый из которых содержит определенную дозу.
Ротадиск может храниться в устройстве для ингаляций дискхалер, тем не менее, блистер следует прокалывать непосредственно перед ингаляцией препарата. Несоблюдение этой рекомендации может нарушить работу Дискхалера и, соответственно, снизить эффективность препарата.
ВАЖНО! Не следует протыкать Ротадиск до того, как он будет помещен в Дискхалер.
Загрузка Ротадиска в Дискхалер
- Снять чехол с мундштука, убедиться что мундштук чистый внутри и снаружи.
- Остсрожно вытянуть выдвижной лоток до выхода пластмассовых зажимов, взявшись за углы лотка. Лоток следует выдвинуть до упора, чтобы были видны насечки на боковой стороне зажимов.
- Вытянуть лоток полностью, сжавши большим и указательным пальцем насечки на боковой стороне зажимов.
- Поместить Ротадиск на колесо ячейками вниз и вставить лоток обратно в Дискхалер.
Проведение ингаляции.
- Поднять крышку Дискхалера вверх до упора, чтобы проколоть верхнюю и нижнюю фольгу Ротадиска. Закрыть крышку.
ВАЖНО! Не следует поднимать крышку до того, как выдвижной лоток будет полностью установлен.
- После полного выдоха поместить мундштук между зубами, плотно обхватить мундштук губами, не закрывая отверстий для воздуха по обе стороны мундштука. Сделать медленный глубокий вдох (обязательно через рот, а не через нос). Вынуть мундштук изо рта. Задержать дыхание насколько возможно. Медленно выдохнуть. Нельзя делать выдох в ингалятор.
- Осторожно однократно выдвинуть выдвижной лоток до упора, не нажимая на зажимы, и задвинуть. При этом Ротадиск повернется на одну ячейку и готов для следующей ингаляции.
ВАЖНО! Прокалывать ячейку следует только непосредственно перед ингаляцией.
Для проведения повторных ингаляций повторить шаги 5 и 6. Замена пустого Ротадиска.
Каждый Ротадиск содержит 4 ячейки. После четырех ингаляций пустой Ротадиск заменить на новый (шаги 2 — 4).
ВАЖНО! Дети должны использовать ингаляционное устройство под контролем взрослых.
| Занамивир | |
|---|---|
| Zanamivir | |
 |
|
| Химическое соединение | |
| ИЮПАК | (2R,3R,4S)- 4-[(diaminomethylidene)amino]- 3-acetamido- 2-[(1R,2R)- 1,2,3-trihydroxypropyl]- 3,4-dihydro- 2H-pyran- 6-carboxylic acid |
| Брутто-формула | C12H20N4O7 |
| Молярная масса | 332.31 г/моль |
| CAS | 139110-80-8 |
| PubChem | 60855 |
| DrugBank | APRD00378 |
| Состав | |
| Классификация | |
| АТХ | J05AH01 |
| Фармакокинетика | |
| Биодоступн. | 2% (орально) |
| Связывание с белками плазмы | <10% |
| Метаболизм | незначительный |
| Период полувывед. | 2.5–5.1 часа |
| Экскреция | почечная |
| Лекарственные формы | |
| порошок для ингаляций | |
| Способы введения | |
| ингаляция | |
| Другие названия | |
| Реленза® | |
Занамивир (Zanamivir) — противовирусный препарат, используемое для лечения и профилактики гриппа, вызванного вирусами гриппа A и B.
Разработан австралийской биотехнологической фирмой Biota Holdings. Лицензирован Glaxo в 1990 году и одобрен в США в 1999 году только для использования в качестве лекарства от гриппа. В 2006 году он был одобрен для профилактики гриппа A и B[1]. Вместе с осельтамивиром рекомендован ВОЗ для лечения гриппа[2].
Методами доказательной медицины клиническая эффективность занамивира не доказана[3]. Выпускается под торговой маркой «Реленза».
История[править | править код]
Занамивир был впервые произведен в 1989 году учеными под руководством Питера Колмана[4] [5] и Джозефа Варгезе[6] из австралийского Государственного объединения научных и прикладных исследований (CSIRO) в сотрудничестве с Викторианским фармацевтическим колледжем и Университетом Монаша. Занамивир был первым из ингибиторов нейраминидазы. Открытие было первоначально профинансировано австралийской биотехнологической компанией Biota и было частью продолжающейся программы Biota по разработке противовирусных агентов посредством рационального конструирования лекарств[7].
Медицинское использование[править | править код]
Занамивир используется для лечения инфекций, вызванных вирусами гриппа A и B, но для здоровых людей польза от нее в целом невелика. Это снижает риск развития симптоматического, но не бессимптомного гриппа. Сочетание диагностической неопределенности, риска устойчивости к штамму вируса, возможных побочных эффектов и финансовых затрат перевешивает небольшие преимущества занамивира для профилактики и лечения здоровых людей[8].
По состоянию на 2009 год ни один грипп в США не проявил никаких признаков устойчивости[9].
Фармакологическое действие[править | править код]
Занамивир — ингибитор нейраминидазы[10], одного из поверхностных белков вируса гриппа, который обеспечивает высвобождение вирусных частиц из инфицированной клетки[11] и ускоряет проникновение вируса через слизистый барьер к поверхности эпителиальных клеток, обеспечивая тем самым инфицирование других клеток дыхательных путей. Репликация вируса гриппа ограничена клетками поверхностного эпителия дыхательных путей. Занамивир действует во внеклеточном пространстве, уменьшая воспроизведение вируса гриппа типов А и В и предотвращая выброс вирусных частиц из клеток поверхностного эпителия дыхательных путей[12].
Фармакокинетика[править | править код]
После ингаляции всасывается 10-20 % введенной дозы, концентрация в сыворотке крови определяется через 1-2 часа. Низкая системная абсорбция (сохраняется и при повторных ингаляциях) приводит к низкой системной концентрации и AUC. Абсолютная биодоступность после перорального введения — 2 %. У пожилых пациентов и у пациентов с хронической почечной недостаточностью биодоступность после введения 20 мг 10-20 %. После пероральной ингаляции занамивир осаждается в дыхательных путях в высоких концентрациях. После ингаляции 10 мг занамивира в эпителиальном слое дыхательных путей концентрация превышает среднее значение 1/2 ингибирующей концентрации для нейроаминидазы в 340 раз через 12 часов после ингаляции и в 52 раза через 24 часа. Осаждается в ротовой части глотки и легких (около 77,6 % и 13,2 % соответственно). Не метаболизируется. T1/2 после пероральной ингаляции — 2,6-5,05 ч. Общий клиренс — 2,5-10,9 л/ч. Выводится почками в неизмененном виде в течение 24 часов.
Показания[править | править код]
Грипп типа А и В у взрослых и детей старше 5 лет (лечение и профилактика).
Противопоказания[править | править код]
Гиперчувствительность, беременность (I триместр), период лактации, детский возраст (до 5 лет).
Занамивир относится к «Категории С для беременных».
Побочные эффекты[править | править код]
- Со стороны дыхательной системы: бронхоспазм[13], затруднение дыхания — очень редко.
- Со стороны кожных покровов: сыпь, крапивница — очень редко.
- Аллергические реакции: отек лица, гортани — очень редко.
В 2006 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) обнаружило, что у некоторых пациентов после первоначального одобрения препарата Реленза были зарегистрированы проблемы с дыханием (бронхоспазм), включая летальные исходы. Большинство этих пациентов страдали астмой или хронической обструктивной болезнью легких. Таким образом, Реленза не рекомендуется для лечения или профилактики сезонного гриппа у людей с астмой или хронической обструктивной болезнью легких[14]. В 2009 году вкладыш занамивира уже содержал информацию о мерах предосторожности относительно риска бронхоспазма у пациентов с респираторными заболеваниями[15]. GlaxoSmithKline (GSK) и FDA уведомили медицинских работников об отчете о смерти пациента с гриппом, получившего ингаляционный порошок занамивира, который растворяли и вводили с помощью искусственной вентиляции легких[16].
Механизм действия[править | править код]
Биодоступность занамивира составляет 2%. После ингаляции занамивир концентрируется в легких и глотке, где до 15% дозы абсорбируется и выводится с мочой[17].
Режим дозирования[править | править код]
Ингаляционно.
- Лечение
2 ингаляции 2 раза в сутки в течение 5 дней. Общая суточная доза — 20 мг.
Для достижения оптимального эффекта лечение должно быть начато при появлении первых симптомов заболевания в течение первых 48 часов. Пациенты с заболеваниями дыхательных путей должны иметь в качестве средства скорой помощи короткодействующие бронходилататоры при лечении занамивиром.
- Профилактика
2 ингаляции 1 раз в сутки в течение 10 дней. Общая суточная доза — 10 мг. Длительность приема может быть увеличена до 1 мес, если риск инфицирования сохраняется более 10 дней.
- Взаимодействие
Не комбинировать с другими ингаляционными препаратами (в том числе бронходилататорами).
Эффективность[править | править код]
Эффективность занамивира достоверно не доказана[3].
По данным исследований, использованных производителями при сертификации ингибиторов нейраминидазы в разных странах, выявлено недостаточное качество исследований — они имеют проблемы в дизайне и эти проблемы препятствуют любому определённому заключению. Анализ этих исследований (26 исследований по занамивиру и 20 по осельтамивиру) показал[3]:
- при лечении гриппоподобного заболевания (неподтвержденный грипп) выявлено сокращение продолжительности симптомов менее, чем на один день;
- клинические испытания по профилактике гриппа показали снижение риска симптомов гриппа у отдельных лиц и в семье;
- не было доказательств влияния на бессимптомный грипп или на гриппоподобные заболевания;
- информация о влиянии на осложнения гриппа была ненадёжной;
- у детей с астмой не было ясного влияния на сокращение времени до облегчения симптомов.
- заявления о способности осельтамивира прерывать передачу [от человека к человеку] вируса и уменьшать осложнения не поддерживаются никакими даннымиВывод исследователей обзора: «Механизм действия, предложенный производителем, (специфичный для вируса гриппа) не соответствует клиническим доказательствам, что позволяет предполагать мультисистемное и центральное действие.»
В 2011 году были выявлены штаммы вируса гриппа A, устойчивые к занамивиру, в том числе у людей, не лечившихся этим препаратом[18].
Мнения контролирующих органов[править | править код]
Роспотребнадзор: вирус «свиного» гриппа H1N1 2009 года чувствителен к ингибиторам нейраминидазы, в том числе к занамивиру, в отличие от амантадинов[10].
FDA опубликовала заявления только по эффективности занамивира в профилактике и лечении симптомов гриппа, но не по другим эффектам (в том числе прерывание распространения вируса от человека к человеку или профилактика пневмонии; и других осложнений гриппа, таких как бронхит, воспаление среднего уха и синусит)[19] [20] [21]. В отчёте FDA эффективность ингибиторов нейраминидазы в целом, указана как «скромная»[3].
Безопасность[править | править код]
В клинических испытаниях занамивира у взрослых не было повышенного риска по сравнению с осельтамивиром. Свидетельства возможного вреда, связанного с лечением детей занамивиром, были разрозненные[3].
Занамивир относится к медикаментам «Категории С для беременных», при этом клинические исследования безопасности применения этих лекарств для беременных не проводились. Роспотребнадзор рекомендует избегать назначать ингибиторы нейраминидазы беременным и назначать только в некоторых случаях[10].
См. также[править | править код]
- Осельтамивир
- Римантадин
Примечания[править | править код]
- ↑ FDA Approves a Second Drug for the Prevention of Influenza A and B in Adults and Children FDA press release March 29, 2006. FDA. Дата обращения: 22 марта 2021. Архивировано из оригинала 6 марта 2010 года.
- ↑ О противовирусных препаратах. www.euro.who.int (20 февраля 2020). Дата обращения: 20 февраля 2020. Архивировано 2 марта 2020 года.
- ↑ 1 2 3 4 5 Jefferson T. Ингибиторы нейраминидазы для профилактики и лечения гриппа у здоровых взрослых и детей : [арх. 17 февраля 2019] = Neuraminidase inhibitors for preventing and treating influenza in adults and children : [пер. с англ.] / Jefferson T, Jones MA, Doshi P … [и др.] // Cochrane Database of Systematic Reviews. — 2014. — No. 4 (10 апреля). — doi:10.1002/14651858.CD008965.pub4.
- ↑ Varghese, J. N.; Laver, W. G.; Colman, P. M. (1983). “Structure of the influenza virus glycoprotein antigen neuraminidase at 2.9 a resolution”. Nature. 303 (5912): 35—40. DOI:10.1038/303035a0. PMID 6843658.
- ↑ Archived copy. Дата обращения: 2 октября 2013. Архивировано из оригинала 4 октября 2013 года.
- ↑ Archived copy. Дата обращения: 2 октября 2013. Архивировано из оригинала 5 октября 2013 года.
- ↑ Meindl P, Bodo G, Palese P, Schulman J, Tuppy H (April 1974). “Inhibition of neuraminidase activity by derivatives of 2-deoxy-2,3-dehydro-N-acetylneuraminic acid”. Virology. 58 (2): 457—63. DOI:10.1016/0042-6822(74)90080-4. PMID 4362431.
- ↑ Michiels, B.; Van Puyenbroeck, K.; Verhoeven, V.; Vermeire, E.; Coenen, S. (2013). “The value of neuraminidase inhibitors for the prevention and treatment of seasonal influenza: a systematic review of systematic reviews”. PLOS One. 8 (4): e60348. Bibcode:2013PLoSO…860348M. DOI:10.1371/journal.pone.0060348. PMC 3614893. PMID 23565231.
- ↑ 2008-2009 Influenza Season Week 32 ending August 15, 2009. Flu Activity & Surveillance. Centers for Disease Control and Prevention (CDC) (21 августа 2009). Дата обращения: 22 марта 2021. Архивировано 9 июля 2017 года.
- ↑ 1 2 3 О направлении материалов по мерам безопасности работы с возбудителем гриппа свиней и больными. Письмо №01/5583-9-23 от 26.04.2009. Роспотребнадзор. — Письмо Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Чеченской республике №01/5583-9-23 от 26.04.2009. Дата обращения: 13 февраля 2019. Архивировано 14 февраля 2019 года.
- ↑ Смирнова, Т. Д. Участите цитоскелета клетки в инфекционном цикле вирусов гриппа A : НИИ гриппа Минздрава РФ, СПб. : [арх. 4 декабря 2018] / Т. Д. Смирнова, Д. М. Даниленко, А. В. Слита // Цитология : журн.. — 2013. — Т. 55, № 2. — С. 94.
- ↑ Michiels, B. The value of neuraminidase inhibitors for the prevention and treatment of seasonal influenza : a systematic review of systematic reviews : [англ.] / B. Michiels, K. Van Puyenbroeck, V. Verhoeven … [et al.] // PLOS One. — 2013. — Vol. 8, no. 4. — Art. no. e60348. — Bibcode: 2013PLoSO…860348M. — doi:10.1371/journal.pone.0060348 10.1371. — PMID 23565231. — PMC 3614893.
- ↑ Hayden FG (December 2001). “Perspectives on antiviral use during pandemic influenza”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 356 (1416): 1877—84. DOI:10.1098/rstb.2001.1007. PMC 1088564. PMID 11779387.
- ↑ FDA Approves a Second Drug for the Prevention of Influenza A and B in Adults and Children. FDA press release. Дата обращения: 22 марта 2021. Архивировано из оригинала 6 марта 2010 года.
- ↑ Safe and Appropriate Use of Influenza Drugs. Public Health Advisories (Drugs). U.S. Food and Drug Administration (FDA) (30 апреля 2009). Дата обращения: 11 ноября 2009. Архивировано 4 ноября 2009 года.
- ↑ Архивированная копия. Дата обращения: 24 марта 2021. Архивировано из оригинала 18 января 2017 года.
- ↑ Moscona A (September 2005). “Neuraminidase inhibitors for influenza”. The New England Journal of Medicine. 353 (13): 1363—73. DOI:10.1056/NEJMra050740. PMID 16192481. Архивировано из оригинала 2021-08-29. Дата обращения 2021-03-24.
- ↑ Antiviral Agents for the Treatment and Chemoprophylaxis of Influenza : Recommendations of the Advisory Committee on Immunization Practices : Recommendations and Reports : [англ.] : [арх. 2 сентября 2021] : pdf / Prepared by Anthony E. Fiore (MD), Alicia Fry (MD), David Shay (MD), Larisa Gubareva (PhD), Joseph S. Bresee (MD), Timothy M. Uyeki (MD), Influenza Division, National Center for Immunization and Respiratory Diseases. — Morbidity and Mortality Weekly Report. — Centers for Disease Control and Prevention, 2011. — Vol. 60, № 1 (21 January). — P. 6−7. — ISSN 1546-0738.
- ↑ Jefferson, T; Jones, MA; Doshi, P; Del Mar, CB; Hama, R; Thompson, MJ; Spencer, EA; Onakpoya, I; Mahtani, KR; Nunan, D; Howick, J; Heneghan, CJ (10 April 2014). “Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children” (PDF). The Cochrane Database of Systematic Reviews. 4 (4): CD008965. DOI:10.1002/14651858.CD008965.pub4. PMC 6464969. PMID 24718923. Архивировано (PDF) из оригинала 2021-05-14. Дата обращения 2021-03-24.
- ↑ Heneghan, CJ; Onakpoya, I; Thompson, M; Spencer, EA; Jones, M; Jefferson, T (Apr 9, 2014). “Zanamivir for influenza in adults and children: systematic review of clinical study reports and summary of regulatory comments”. BMJ (Clinical Research Ed.). 348: g2547. DOI:10.1136/bmj.g2547. PMC 3981976. PMID 24811412.
- ↑ Heneghan, C. J.; Onakpoya, I.; Thompson, M.; Spencer, E. A.; Jones, M.; Jefferson, T. (9 April 2014). “Zanamivir for influenza in adults and children: systematic review of clinical study reports and summary of regulatory comments”. BMJ. 348 (apr09 2): g2547. DOI:10.1136/bmj.g2547. PMC 3981976. PMID 24811412.
