Золгенсма — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-007675
Торговое наименование:
Золгенсма
Международное непатентованное или группировочное наименование:
онасемноген абепарвовек.
Лекарственная форма:
раствор для инфузий.
Состав:
1 мл препарата содержит:
действующее вещество: онасемноген абепарвовек 2,0×1013 вектор-геномов (вг);
вспомогательные вещества: трометамин, магния хлорид, натрия хлорид, полоксамер 188, хлористоводородная кислота, вода для инъекций.
Описание:
От прозрачного до слегка опалесцирующего, от бесцветного до слегка белого цвета раствор.
Фармакотерапевтическая группа:
прочие препараты для лечения заболеваний костно-мышечной системы.
Код АТХ:
М09АХ09
Фармакологические свойства
Механизм действия
Онасемноген абепарвовек – это генотерапевтический препарат, предназначенный для введения функциональной копии гена выживания моторных нейронов 1 (SMN1) в трансдуцированные клетки для устранения моногенной первопричины спинальной мышечной атрофии (СМА). Ожидается, что благодаря внедрению в моторные нейроны альтернативного источника экспрессии белка SMN, препарат обеспечит выживание и корректное функционирование трансдуцированных моторных нейронов.
Онасемноген абепарвовек представляет собой не реплицирующийся рекомбинантный аденоассоциированный вирусный (AAV) вектор, который использует капсид аденоассоциированного вируса серотипа 9 (AAV9) для доставки стабильного, полностью функционального трансгена человеческого SMN. Установлено, что капсид AAV9 способен проникать через гематоэнцефалический барьер и трансдуцировать моторные нейроны. Ген SMN1, содержащийся в онасемноген абепарвовеке, предназначен для того, чтобы персистировать в ядре трансдуцированных клеток в виде эписомальной ДНК, ожидается, что он будет стабильно экспрессироваться на протяжении длительного времени в постмитотических клетках. Способность вируса AAV9 вызывать заболевание у человека неизвестна. Трансген вводится в клетки-мишени в виде самокомплементарной двухцепочечной молекулы. Экспрессия трансгена регулируется конститутивным промотором (гибрид промотора гена куриного β-актина и энхансера транскрипции цитомегаловируса), который обеспечивает постоянную и устойчивую экспрессию белка SMN. Описанный механизм действия подкреплен данными доклинических исследований и данными по биораспределению в организме человека.
Фармакодинамика
Фармакодинамические исследования не применимы для препаратов генной терапии.
Фармакокинетика
Распределение
Оценка биораспределения была проведена у двух пациентов, которые умерли через 5,7 и 1,7 месяцев соответственно после инфузии препарата онасемноген абепарвовека в дозе 1,1×1014 вг/кг. В обоих случаях максимальное содержание векторной ДНК было обнаружено в печени. Векторная ДНК была также обнаружена в селезенке, сердце, поджелудочной железе, паховых лимфатических узлах, скелетных мышцах, периферических нейронах, почках, легких, кишечнике, гонадах, спинном мозге, головном мозге и тимусе. Иммунное окрашивание на белок SMN выявило генерализованную экспрессию SMN в моторных нейронах спинного мозга, нейронах и глиальных клетках головного мозга, а также в сердце, печени, скелетных мышцах и других изученных тканях.
Элиминация
Исследования выделения вектора онасемноген абепарвовека оценивали количество вектора, выводимого из организма со слюной, мочой и калом.
Онасемноген абепарвовек обнаруживался в биологическом материале в постинфузионном периоде. Онасемноген абепарвовек выводился главным образом с калом, причем основная часть препарата выводилась в течение 30 дней после его применения.
Показания к применению
Препарат показан для применения у:
- пациентов со спинальной мышечной атрофией (СМА) с биаллельной мутацией в гене SMN1 и клиническим диагнозом СМА 1-го типа или
- пациентов со СМА с биаллельной мутацией гена SMN1 и не более чем с тремя копиями гена SMN2.
Противопоказания
Гиперчувствительность к онасемноген абепарвовеку или к любому из вспомогательных веществ.
С осторожностью
Следует соблюдать осторожность при применении препарата Золгенсма у пациентов с нарушениями функции почек, с нарушениями функции печени (в частности, у пациентов с повышенной концентрацией билирубина, не связанной с желтухой новорожденных), у недоношенных новорожденных до достижения ими возраста, соответствующего гестационному возрасту доношенного ребенка.
Применение при беременности и в период грудного вскармливания
Данные о применении препарата Золгенсма в период беременности или лактации отсутствуют. В исследованиях репродуктивной и эмбриофетальной токсичности у животных препарат Золгенсма не изучался.
Способ применения и дозы
Лечение должно начинаться и проводиться в клинических центрах под наблюдением врача, имеющего опыт ведения пациентов со СМА.
Перед применением препарата Золгенсма необходимо провести следующие лабораторные исследования:
- тест на определение содержания антител к AAV9 с использованием соответствующего валидированного метода исследования;
- оценка функции печени: определение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT) и концентрации общего билирубина;
- клинический анализ крови (включая концентрацию гемоглобина и количество тромбоцитов);
- тест на тропонин I;
- оценка концентрации креатинина.
Необходимость тщательного мониторинга функции печени, количества тромбоцитов и концентрации тропонина I после инфузии, а также необходимость назначения терапии глюкокортикостероидами должны учитываться при определении сроков лечения онасемноген абепарвовеком (см. раздел «Особые указания»).
В случае острых или хронических неконтролируемых активных инфекций лечение следует отложить до тех пор, пока инфекция не разрешится или не будет контролироваться (см. раздел «Особые указания»).
Режим дозирования
Препарат Золгенсма предназначен только для однократной внутривенной инфузии.
Номинальная доза онасемноген абепарвовека, которую получит пациент, составляет 1,1×1014 вг/кг. Общий вводимый объем препарата Золгенсма определяется массой тела пациента, согласно информации, указанной в таблице 1.
Таблица 1 содержит рекомендуемые дозы для пациентов с массой тела от 2,6 до 21,0 кг.
Таблица 1. Рекомендуемые дозы в зависимости от массы тела пациента
| Диапазон массы тела пациента (кг) | Доза (вг) | Общий вводимый объем1 (мл) |
| 2,6-3,0 | 3,3×1014 | 16,5 |
| 3,1-3,5 | 3,9×1014 | 19,3 |
| 3,6-4,0 | 4,4×1014 | 22,0 |
| 4,1-4,5 | 5,0×1014 | 24,8 |
| 4,6-5,0 | 5,5×1014 | 27,5 |
| 5,1-5,5 | 6,1×1014 | 30,3 |
| 5,6-6,0 | 6,6×1014 | 33,0 |
| 6,1-6,5 | 7,2×1014 | 35,8 |
| 6,6-7,0 | 7,7×1014 | 38,5 |
| 7,1-7,5 | 8,3×1014 | 41,3 |
| 7,6-8,0 | 8,8×1014 | 44,0 |
| 8,1-8,5 | 9,4×1014 | 46,8 |
| 8,6-9,0 | 9,9×1014 | 49,5 |
| 9,1-9,5 | 1,05×1015 | 52,3 |
| 9,6-10,0 | 1,10×1015 | 55,0 |
| 10,1-10,5 | 1,16×1015 | 57,8 |
| 10,6-11,0 | 1,21×1015 | 60,5 |
| 11,1-11,5 | 1,27×1015 | 63,3 |
| 11,6-12,0 | 1,32×1015 | 66,0 |
| 12,1-12,5 | 1,38×1015 | 68,8 |
| 12,6-13,0 | 1,43×1015 | 71,5 |
| 13,1-13,5 | 1,49×1015 | 74,3 |
| 13,6-14,0 | 1,54×1015 | 77,0 |
| 14,1-14,5 | 1,60×1015 | 79,8 |
| 14,6-15,0 | 1,65×1015 | 82,5 |
| 15,1-15,5 | 1,71×1015 | 85,3 |
| 15,6-16,0 | 1,76×1015 | 88,0 |
| 16,1-16,5 | 1,82×1015 | 90,8 |
| 16,6-17,0 | 1,87×1015 | 93,5 |
| 17,1-17,5 | 1,93×1015 | 96,3 |
| 17,6-18,0 | 1,98×1015 | 99,0 |
| 18,1-18,5 | 2,04×1015 | 101,8 |
| 18,6-19,0 | 2,09×1015 | 104,5 |
| 19,1-19,5 | 2,15×1015 | 107,3 |
| 19,6-20,0 | 2,20×1015 | 110,0 |
| 20,1-20,5 | 2,26×1015 | 112,8 |
| 20,6-21,0 | 2,31×1015 | 115,5 |
1 – количество флаконов в наборе и необходимое количество наборов зависит от массы тела пациента; объем дозы рассчитан исходя из верхней границы диапазона массы тела пациента
Доза онасемноген абепарвовека и точное количество флаконов, необходимых для каждого пациента, рассчитывается в зависимости от массы тела пациента (см. таблицу 1 и таблицу 2).
Таблица 2. Варианты конфигурации упаковки
| Масса тела пациента (кг) | Флакон объемом 5,5 млa | Флакон объемом 8,3 млb | Общее количество флаконов в упаковке |
| 2,6-3,0 | 0 | 2 | 2 |
| 3,1-3,5 | 2 | 1 | 3 |
| 3,6-4,0 | 1 | 2 | 3 |
| 4,1-4,5 | 0 | 3 | 3 |
| 4,6-5,0 | 2 | 2 | 4 |
| 5,1-5,5 | 1 | 3 | 4 |
| 5,6-6,0 | 0 | 4 | 4 |
| 6,1-6,5 | 2 | 3 | 5 |
| 6,6-7,0 | 1 | 4 | 5 |
| 7,1-7,5 | 0 | 5 | 5 |
| 7,6-8,0 | 2 | 4 | 6 |
| 8,1-8,5 | 1 | 5 | 6 |
| 8.6-9.0 | 0 | 6 | 6 |
| 9,1-9,5 | 2 | 5 | 7 |
| 9,6-10,0 | 1 | 6 | 7 |
| 10,1-10,5 | 0 | 7 | 7 |
| 10,6-11,0 | 2 | 6 | 8 |
| 11,1-11,5 | 1 | 7 | 8 |
| 11,6-12,0 | 0 | 8 | 8 |
| 12,1-12,5 | 2 | 7 | 9 |
| 12,6-13,0 | 1 | 8 | 9 |
| 13,1-13,5 | 0 | 9 | 9 |
| 13,6-14,0 | 2 | 8 | 10 |
| 14,1-14,5 | 1 | 9 | 10 |
| 14,6-15,0 | 0 | 10 | 10 |
| 15,1-15,5 | 2 | 9 | 11 |
| 15,6-16,0 | 1 | 10 | 11 |
| 16,1-16,5 | 0 | 11 | 11 |
| 16,6-17,0 | 2 | 10 | 12 |
| 17,1-7,5 | 1 | 11 | 12 |
| 17,6-18,0 | 0 | 12 | 12 |
| 18,1-18,5 | 2 | 11 | 13 |
| 18,6-19,0 | 1 | 12 | 13 |
| 19,1-19,5 | 0 | 13 | 13 |
| 19,6-20,0 | 2 | 12 | 14 |
| 20,1-20,5 | 1 | 13 | 14 |
| 20,6-21,0 | 0 | 14 | 14 |
a – Номинальная концентрация во флаконе – 2×1013 вг/мл, извлекаемый объем не менее 5,5 мл.
b – номинальная концентрация во флаконе – 2×1013 вг/мл, извлекаемый объем не менее 8,3 мл.
Иммуномодулирующая терапия
После инфузии препарата Золгенсма у пациентов будет возникать иммунный ответ на капсидные белки вектора на основе аденоассоциированного вируса серотипа 9 (AAV9) (см. раздел «Особые указания»). Это может привести к повышению активности печеночных трансаминаз, повышению концентрации тропонина I или снижению количества тромбоцитов (см. разделы «Побочное действие» и «Особые указания»). Для ослабления иммунного ответа рекомендуется иммуномодуляция глюкокортикостероидами. По возможности график вакцинации пациента следует скорректировать с учетом сопутствующего применения глюкокортикостероидов в пре- и постинфузионном периоде применения препарата Золгенсма (см. раздел «Взаимодействие с другими лекарственными препаратами»).
До начала иммуномодулирующей терапии и до введения препарата Золгенсма пациент должен быть обследован на наличие признаков активного инфекционного заболевания любой этиологии.
За 24 часа до инфузии онасемноген абепарвовека рекомендуется начать иммуномодулирующую терапию в соответствии с графиком, приведенным в таблице 3. Отклонения от этих рекомендаций остаются на усмотрение лечащего врача (см. раздел «Особые указания»).
Таблица 3. Иммуномодулирующий режим в пре- и постинфузионном периоде применения препарата Золгенсма
| Преинфузионный период | За 24 часа инфузии препарата Золгенсма | Преднизолон перорально из расчета 1 мг/кг/сут (или эквивалентная доза другого глюкокортикостероида) |
| Постинфузионный период | В течение 30 дней после инфузии препарата Золгенсма (включая день инфузии) | Преднизолон перорально из расчета 1 мг/кг/сут (или эквивалентная доза другого глюкокортикостероида) |
| В течение следующих 28 дней | Дозу системного глюкокортикостероида следует снижать постепенно, не следует резко прекращать терапию данными препаратами. | |
| Для пациентов с незначительными изменениями (клинические показатели в пределах нормы; концентрация общего билирубина, активность АЛТ и ACT ниже 2×ВГН (верхняя граница нормы) по окончании 30-дневного периода). | Постепенное снижение дозы преднизолона (или эквивалентной дозы другого глюкокортикостероида), например, в течение 2 недель по 0,5 мг/кг/сут, затем 2 недели по 0,25 мг/кг/сут. | |
| Или Для пациентов с нарушением функции печени по окончании 30-дневного постинфузионного периода: продолжить терапию, пока активность АЛТ и ACT не снизятся до уровня ниже 2×ВГН, а другие показатели не вернутся в нормальные диапазоны, после чего следует постепенно снижать дозу глюкокортикостероида в течение следующих 28 дней или более при необходимости. |
Системные глюкокортикостероиды (эквивалентно преднизолону перорально из расчета 1 мг/кг/сут). Дозу системного глюкокортикостероида следует снижать постепенно, не следует резко прекращать терапию данными препаратами. |
|
| Функцию печени следует контролировать как минимум в течение 3 месяцев после инфузии препарата Золгенсма (см. раздел «Особые указания»). |
При отсутствии адекватного ответа на терапию глюкокортикостероидом в дозе, эквивалентной пероральной дозе преднизолона 1 мг/кг/сут, следует проконсультировать пациента у детского гастроэнтеролога или гепатолога. При непереносимости глюкокортикостероидов при их приеме внутрь, может быть рассмотрено внутривенное введение (см. раздел «Особые указания»).
В случае применения альтернативного глюкокортикостероида вместо преднизолона лечащему врачу следует руководствоваться вышеизложенными принципами терапии с использованием того же подхода к постепенному снижению дозы по прошествии 30 дней после инфузии препарата Золгенсма.
Особые группы пациентов
Пациенты с нарушениями функции почек
Безопасность и эффективность препарата Золгенсма у пациентов данной группы не установлены. Следует соблюдать осторожность при рассмотрении вопроса о применении препарата Золгенсма у пациентов данной группы. Коррекция дозы препарата не требуется.
Пациенты с нарушениями функции печени
В клинических исследованиях не изучено применение препарата у пациентов с активностью ACT и АЛТ или общей концентрацией билирубина (за исключением обусловленной желтухой новорожденных) более чем в 2 раза превышающих ВГН. Следует соблюдать осторожность при рассмотрении вопроса о применении препарата Золгенсма у пациентов с нарушением функции печени (см. разделы «Особые указания» и «Побочное действие»). Коррекция дозы препарата не требуется.
Генотип 0SMN1/1SMN2
У пациентов с биаллельной мутацией в гене SMN1 и одной копией гена SMN2 коррекция дозы препарата не требуется.
Анти-ААV9 антитела
Не требуется коррекция дозы у пациентов с исходным титром анти-ААУ9 антител превышающем 1:50 (см. раздел «Особые указания»).
Пациенты в возрасте младше 18 лет
Безопасность и эффективность онасемноген абепарвовека у недоношенных новорожденных до достижения полного гестационного возраста не установлены. Данные по применению препарата у данной категории пациентов отсутствуют. Следует тщательно оценить возможность применения препарата в связи с возможным негативным влиянием глюкокортикостероидов на их неврологическое развитие.
Опыт применения препарата у пациентов 2 лет и старше или с массой тела выше 13,5 кг ограничен. Безопасность и эффективность онасемноген абепарвовека у данной группы пациентов не установлены.
Способ применения
Препарат Золгенсма предназначен исключительно для однократной внутривенной инфузии с использованием инфузионного шприцевого насоса.
Меры предосторожности при применении
Препарат Золгенсма содержит генетически модифицированные вирусные частицы. При обращении с препаратом необходимо соблюдать следующие меры предосторожности:
- Подготовку препарата к инфузии следует проводить с соблюдением правил асептики.
- Следует использовать средства индивидуальной защиты (включая перчатки, защитные очки, лабораторный халат и нарукавники) во время подготовки препарата и последующей его инфузии. При наличии порезов или царапин на коже медицинскому персоналу не следует проводить каких-либо манипуляций с препаратом.
- Пролитую часть препарата следует убрать при помощи абсорбирующей марлевой салфетки, поверхность обработать дезинфицирующим раствором (хлорсодержащим), а затем спиртовыми салфетками.
- Все использованные для очистки средства следует утилизировать в двойном пакете в соответствии с требованиями по утилизации биологических отходов. Все материалы, которые могли быть в контакте с онасемноген абепарвовеком (например, флакон, все материалы, используемые для инфузии, включая стерильные салфетки и иглы), должны быть утилизированы в соответствии с требованиями по утилизации биологических отходов.
- Следует избегать случайного контакта с онасемноген абепарвовеком. При попадании на кожу пораженный участок следует тщательно промыть водой с мылом в течение не менее 15 минут. При попадании в глаза их необходимо тщательно промыть водой в течение не менее 15 минут.
Получение и размораживание флаконов
- Препарат транспортируется в условиях глубокой заморозки (≤ -60 °С). Немедленно после получения флаконы с препаратом в оригинальной упаковке необходимо поместить в холодильник с температурой 2 °С — 8 °С.
- Терапию препаратом Золгенсма необходимо провести в течение 14 дней с момента получения препарата.
- Перед введением препарат необходимо разморозить. Не используйте препарат Золгенсма до полного размораживания.
- После размораживания препарат необходимо извлечь из холодильника в день инфузии.
- Для размораживания набора до 9 флаконов в холодильнике требуется около 12 часов. Для размораживания набора до 14 флаконов в холодильнике требуется около 16 часов.
- Альтернативно при необходимости немедленного введения возможно размораживание препарата при комнатной температуре. Для размораживания набора до 9 флаконов при комнатной температуре (20 °С — 25 °С) требуется около 4 часов. Для размораживания набора до 14 флаконов при комнатной температуре (20 °С — 25 °С) требуется около 6 часов.
- Перед тем, как набрать необходимый объем препарата в шприц, аккуратно перемешайте раствор, осторожно вращая флакон. Не встряхивать.
- В случае изменения цвета или обнаружения перед введением каких-либо частиц в размороженном растворе, не используйте препарат.
- Непосредственно перед введением наберите полный объем дозы препарата в шприц. Перед в/в введением препарата необходимо удалить пузырьки воздуха из шприца. Препарат вводят при помощи инфузионного шприцевого насоса.
- После размораживания препарат необходимо ввести как можно раньше.
- Шприц, содержащий необходимый объем препарата, следует использовать в течение 8 часов. Если подготовленный шприц с раствором не использован в течение 8 часов, его следует утилизировать.
- Не замораживать повторно. Инструкция по проведению внутривенной инфузии
- Установите основной катетер в периферическую вену верхней или нижней конечности.
- Рекомендовано установить второй в/в («запасной») катетер на случай закупоривания основного катетера.
- Перед введением препарата шприцевой насос необходимо запрограммировать для промывки катетера физиологическим раствором либо выполнить это действие вручную.
- Препарат Золгенсма следует вводить внутривенно медленно в течение не менее 60 минут. Не вводите препарат путем быстрой внутривенной или болюсной инъекции.
- После завершения инфузии следует промыть инфузионную магистраль физиологическим раствором.
- Неиспользованный остаток препарата и все отходы следует утилизировать в соответствии с требованиями по утилизации биологических отходов.
Побочное действие
Резюме профиля безопасности
Безопасность препарата изучена в открытых клинических исследованиях у 99 пациентов, получивших препарат в рекомендованной дозе (1,1×1014 вг/кг). Наиболее частыми нежелательными реакциями (HP), отмечавшихся после инфузии препарата, были повышение активности печеночных трансаминаз (24,2%), гепатотоксичность (9,1%), рвота (8,1%) и пирексия (5,1%).
Табличные данные о нежелательных реакциях
HP, связанные с применением препарата, которые отмечены у всех пациентов, получивших внутривенную инфузию онасемноген абепарвовека, перечислены ниже. HP сгруппированы в соответствии с классификацией органов и систем органов MedDRA, перечислены в порядке уменьшения частоты их встречаемости. Внутри каждой категории частоты HP представлены в порядке уменьшения степени их важности. Частота встречаемости оценивалась следующим образом: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100); редко (≥1/10000 и <1/1000); очень редко (<1/10000), частота неизвестна (невозможно оценить по имеющимся данным).
Таблица 4. Табличный перечень нежелательных реакций
| Нарушения со стороны крови и лимфатической системы | |
| Часто | Тромбоцитопения |
| Неизвестно | Тромботическая микроангиопатия1) |
| Нарушения со стороны желудочно-кишечного тракта | |
| Часто | Рвота |
| Нарушения со стороны печени и желчевыводящих путей | |
| Часто | Гепатотоксичность2) |
| Неизвестно | Острая печеночная недостаточность1) |
| Неизвестно | Острое поражение печени1) |
| Общие расстройства и нарушения в месте введения | |
| Часто | Пирексия |
| Лабораторные и инструментальные исследования | |
| Очень часто | Повышение активности «печеночных» ферментов3) |
| Часто | Повышение концентрации тропонина4) |
| Часто | Повышение концентрации тропонина Т |
| Часто | Снижение количества тромбоцитов |
1 HP, связанные с терапией, которые отмечены вне клинических исследований, в том числе в пострегистрационном периоде.
2 Гепатотоксичность включает стеатогепатоз и патологическое повышение активности трансаминаз.
3 Увеличение активности «печеночных» ферментов включает: повышение активности АЛТ, повышение содержания аммиака, повышение активности ACT, повышение активности гаммаглутамилтрансферазы, повышение активности «печеночных» ферментов, повышение показателей «печеночных» тестов и повышение активности трансаминаз.
4 Повышение концентрации тропонина включает повышение концентрации тропонина и повышение концентрации тропонина I.
Описание отдельных нежелательных реакций
Нарушения со стороны печени и желчевыводящих путей
В клинических исследованиях у 31% пациентов, получивших препарат в рекомендуемой дозе, отмечено повышение активности трансаминаз >2×ВГН (в ряде случаев >20 ВГН). У таких пациентов отсутствовали какие-либо клинические проявления, ни у одного не отмечено клинически значимого повышения концентрации билирубина. Как правило, на фоне применения преднизолона повышение активности трансаминаз разрешалось без клинических последствий (см. разделы «Способ применения и дозы» и «Особые указания»). Вне клинических исследований, в том числе при применении в пострегистрационном периоде, зарегистрированы случаи развития признаков и симптомов острой печеночной недостаточности (например, желтуха, коагулопатия, энцефалопатия) в течение 2 месяцев после применения препарата, несмотря на применение глюкокортикостероидов до и после инфузии. Согласно полученной информации, в случаях развития острой печеночной недостаточности проводили коррекцию режима дозирования глюкокортикостероидов с последующим разрешением состояния.
Преходящая тромбоцитопения
В клинических исследованиях после инфузии препарата зарегистрировано неоднократное преходящее снижение среднего количества тромбоцитов относительно исходного уровня (4,0%); как правило, этот показатель восстанавливался в течение двух недель. Снижение количества тромбоцитов было более выраженным в течение первой недели после инфузии.
Повышение концентрации тропонина 1
После инфузии препарата Золгенсма отмечалось повышение уровня тропонина I (3,0%) до 0,2 мкг/л. В программе клинических исследований у пациентов, получивших лечение онасемноген абепарвовеком, клинически значимых нарушений со стороны сердца не наблюдалось (см. раздел «Особые указания»).
Иммуногенность
Титр антител к AAV9 в ходе клинических исследований оценивали как в пре-, так и в постинфузионном периоде (см. раздел «Особые указания»). В клинических исследованиях препарата Золгенсма все пациенты до лечения имели титр антител к AAV9 на уровне 1:50 или ниже. Среднее увеличение титра антител к AAV9 относительно исходного уровня наблюдалось у всех пациентов в различных временных точках, кроме одной, что отражает нормальный ответ организма на чужеродный вирусный антиген. У некоторых пациентов титр антител к AAV9 был выше предела количественного определения, однако у большинства таких пациентов не отмечалось развития потенциально клинически значимых HP. Таким образом, какой-либо взаимосвязи между высоким титром антител к AAY9 и вероятностью развития HP или показателями эффективности установлено не было.
В клиническом исследовании AVXS-101-CL-101 у 16 пациентов был проведен скрининговый тест на титр антител к AAV9: у 13 пациентов титр был ниже 1:50, и они были включены в исследование; у трех пациентов титр был выше 1:50, у двух из них при повторном анализе, проведенном после прекращения грудного вскармливания, титр был ниже 1:50, и они также были включены в исследование. Информация о необходимости отказа от грудного вскармливания матерям с возможной серопозитивностью к AAV9 антителам отсутствует. До введения препарата Золгенсма титр антител к AAV9 у всех пациентов был ниже 1:50; при этом впоследствии у них было выявлено увеличение титра антител к AAV9 от минимум 1:102 400 до более чем 1:819 200.
Обнаружение антител в значительной степени зависит от чувствительности и специфичности анализа. Кроме того, частота обнаружения антител (в том числе нейтрализующих) может зависеть от целого ряда факторов, в том числе: метод анализа, процедура обработки образца, момент времени взятия образца, применение иных лекарственных препаратов и основного заболевания.
Ни у одного из пациентов, получивших препарат Золгенсма, иммунного ответа на трансген выявлено не было.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Данных по передозировке препарата Золгенсма в клинических исследованиях получено не было. В случае системного иммунного ответа рекомендуется скорректировать дозу преднизолона и тщательно наблюдать за лабораторными показателями (включая биохимические и гематологические показатели) и клиническим состоянием пациента (см. раздел «Особые указания»).
Взаимодействие с другими лекарственными препаратами
Исследования по изучению взаимодействия с другими лекарственными препаратами не проводились. Препарат Золгенсма нельзя смешивать с другими лекарственными препаратами.
Опыт применения препарата у пациентов, получающих гепатотоксичные препараты или использующих гепатотоксичные вещества, ограничен. Безопасность применения онасемноген абепарвовека у данной категории пациентов не установлена.
Опыт применения препарата в сочетании с другими препаратами для лечения СМА ограничен.
Вакцинация
По возможности график вакцинации пациента следует скорректировать с учетом введения глюкокортикостероида до и после инфузии препарата Золгенсма (см. раздел «Способ применения и дозы» и «Особые указания»). Рекомендуется проведение сезонной вакцинации против респираторно-синцитиального вируса. Пациентам, получающим глюкокортикостероиды в иммуносупрессивных дозах (например, преднизолон в дозе 20 мг или 2 мг/кг массы тела либо другой глюкокортикостероид в эквивалентной дозе ежедневно на протяжении ≥2 недель), не следует вводить живые вакцины, такие как тривакцина против кори, эпидемического паротита и краснухи и вакцина против ветряной оспы.
Особые указания
Предсуществующий иммунитет к ААV9
Образование анти-ААУ9 антител может наблюдаться на фоне естественного воздействия вируса. В ряде исследований, направленных на изучение распространенности антител к AAV9 в общей популяции, установлена низкая частота предшествующего контакта с AAV9 вирусом в педиатрической популяции. Следует оценить содержание антител к AAV9 у пациентов до инфузии препарата Золгенсма. Повторное тестирование может быть выполнено, если титр антител к AAV9 превышает 1:50. Эффективность и безопасность применения препарата Золгенсма у пациентов с уровнем анти-ААУ9 антител выше 1:50 неизвестна (см. раздел «Способ применения и дозы»).
Спинальная мышечная атрофия в поздней стадии
Поскольку СМА вызывает прогрессирующее и необратимое повреждение моторных нейронов, польза применения препарата Золгенсма у симптоматических пациентов зависит от степени тяжести заболевания на момент лечения, при этом раннее начало терапии имеет потенциально более высокую эффективность.
Несмотря на то, что у пациентов со СМА на поздних стадиях развитие крупной моторики не достигнет уровня здоровых сверстников, такие пациенты могут получить клиническую пользу от заместительной генной терапии, эффективность которой зависит от степени развития заболевания на момент лечения. Лечащий врач должен учитывать, что польза от терапии значительно снижается у пациентов с выраженной мышечной слабостью и дыхательной недостаточностью, у пациентов, находящихся на постоянной искусственной вентиляции легких (ИВЛ), и у пациентов, не способных глотать.
У пациентов со СМА на поздней стадии, которым требуется жизнеобеспечение с постоянной ИВЛ, без способности полноценно развиваться, соотношение польза/риск препарата не установлено.
Иммуногенности
Иммунный ответ к капсиду AAV9 произойдет после инфузии онасемноген абепарвовека, включая образование антител против капсида AAV9, несмотря на иммуномодулирующую терапию, описанную в разделе «Способ применения и дозы», и опосредованный Т-клетками иммунный ответ.
При применении препарата Золгенсма отмечались случаи системного иммунного ответа, в том числе иммуноопосредованной гепатотоксичности, в основном проявлявшейся увеличением активности АЛТ и ACT, а в некоторых случаях – в виде острого тяжелого поражения печени или острой печеночной недостаточности. Иммуноопосредованная гепатотоксичность может требовать коррекции схемы применения глюкокортикостероидов, в том числе более длительного применения, увеличения дозы или более длительного периода постепенной отмены (см. раздел «Способ применения и дозы» и подразделы ниже «Гепатотоксичность» и «Иммуномодулирующая терапия»).
Гепатотоксичность
- Введение AAV-вектора может приводить к повышению активности трансаминаз, что может вызывать серьезные последствия.
- Отмечались случаи острого тяжелого поражения печени и острой печеночной недостаточности (см. раздел «Побочное действие»).
- У пациентов с сопутствующим нарушением функции печени или острым вирусным инфекционным заболеванием печени может увеличиваться риск острого тяжелого поражения печени / острой печеночной недостаточности (см. раздел «Способ применения и дозы»).
- У всех пациентов перед проведением инфузии необходимо провести клиническое и лабораторное обследование для оценки функции печени (определение активности ACT, АЛТ и концентрации общего билирубина (см. раздел «Способ применения и дозы»)).
- С целью сокращения возможного риска повышения активности трансаминаз у всех пациентов рекомендовано проведение коррекции глюкокортикостероидами до и после введения препарата Золгенсма (см. раздел «Способ применения и дозы»).
- Следует контролировать функцию печени в течение по меньшей мере 3 месяцев после инфузии (см. раздел «Способ применения и дозы»).
- Риски и пользу, связанные с применением препарата Золгенсма у пациентов с нарушением функции печени, следует тщательно сопоставлять с рисками, которым подвергается пациент в отсутствие терапии.
Активность ACT и АЛТ и концентрацию общего билирубина следует контролировать еженедельно в течение 30 дней после инфузии препарата Золгенсма, и далее каждые две недели в течение последующих 60 дней или более вплоть до окончания периода постепенного снижения дозы глюкокортикостероида. Постепенную отмену преднизолона не следует рассматривать до снижения активности АСТ/АЛТ ниже уровня 2×ВГН.
Тромбоцитопения
В клинических исследованиях препарата Золгенсма отмечались случаи транзиторного снижения количества тромбоцитов, некоторые из которых удовлетворяли критериям тромбоцитопении (см. раздел «Побочное действие»). В большинстве случаев минимальное количество тромбоцитов отмечалось в первую неделю после инфузии препарата. Количество тромбоцитов следует определять до инфузии препарата Золгенсма и далее регулярно контролировать: еженедельно в течение первого месяца и один раз в две недели в течение второго и третьего месяцев вплоть до возвращения количества тромбоцитов к исходному.
Тромботическая микроангиопатия
В пострегистрационном периоде отмечены случаи тромботической микроангиопатии (ТМА). ТМА характеризуется тромбоцитопенией, микроангиопатической гемолитической анемией. Также наблюдалось острое поражением почек. Возникновение случаев ТМА регистрировали в течение недели после применения препарата Золгенсма. В некоторых случаях одновременная активация иммунной системы (например, в результате инфекции, вакцинации) признана способствующим фактором.
Тромбоцитопения является ключевым признаком ТМА, в связи с чем необходимо контролировать количество тромбоцитов (см. подраздел «Тромбоцитопения»), наряду с другими признаками и симптомами, такими как артериальная гипертензия, образование кожных и подкожных кровоизлияний, судороги или уменьшение количества выделяемой мочи. В случае, если данные признаки и симптомы возникают на фоне тромбоцитопении, следует провести дальнейшую диагностическую оценку с целью выявления гемолитической анемии и нарушения функции почек.
При выявлении клинических признаков, симптомов и/или лабораторных показателей ТМА следует незамедлительно проконсультировать пациента у детского гематолога и/или детского нефролога с целью подбора терапии ТМА согласно клиническим показаниям.
Тропонин I
После инфузии препарата Золгенсма отмечались случаи повышения концентрации сердечного тропонина I (см. раздел «Побочное действие»). У некоторых пациентов увеличение концентрации тропонина I может указывать на повреждение ткани миокарда. На основании этих результатов и кардиотоксичности, отмеченной в доклинических исследованиях у мышей, концентрацию тропонина I следует определять до инфузии препарата Золгенсма и контролировать в течение по меньшей мере последующих 3 месяцев вплоть до возвращения данного показателя в пределы нормы для пациентов со СМА. При необходимости следует рассмотреть вопрос о консультации у специалиста-кардиолога.
Иммуномодулирующая терапия
Не следует начинать иммуномодулирующую терапию на фоне активной инфекции, как острой (например, острая респираторная инфекция или острый гепатит), так и неконтролируемой хронической инфекции (например, хронический гепатит В в активной фазе) (см. раздел «Способ применения и дозы» и «Особые указания»).
Иммуномодулирующий режим (см. раздел «Способ применения и дозы») также может оказывать влияние на иммунный ответ к сопутствующим инфекциям (например, респираторным), что может привести к их более тяжелому клиническому течению. Терапию препаратом Золгенсма следует отложить у пациентов с сопутствующим инфекционным заболеванием до его разрешения или до достижения контроля над инфекцией. Рекомендовано уделять особое внимание диагностике и активной терапии инфекционных заболеваний соответственно. Рекомендовано проведение своевременной сезонной профилактики респираторно-синцитиальных вирусных инфекций. По возможности график вакцинации пациента следует скорректировать с учетом применения глюкокортикостероидов в пре- и постинфузионном периоде применения препарата Золгенсма (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Лечащему врачу следует помнить о возможном развитии надпочечниковой недостаточности в случае продолжительного применения глюкокортикостероида или при увеличении его дозы.
Выделение онасемноген абепарвовека
Временное выделение онасемноген абепарвовека происходит, главным образом, с продуктами жизнедеятельности. Лицам, осуществляющим уход, и семьям пациентов следует рекомендовать следующие инструкции по правильному обращению с испражнениями пациента:
- В течение как минимум одного месяца после введения препарата следует тщательно соблюдать гигиену рук после непосредственного контакта с продуктами жизнедеятельности пациента.
- Одноразовые подгузники можно плотно упаковывать в двойные пластиковые пакеты и утилизировать вместе с бытовыми отходами.
Содержание натрия
Препарат содержит 4,6 мг натрия на 1 мл, что эквивалентно 0,23% от рекомендуемого ВОЗ максимального суточного потребления натрия (=2 г) для взрослого человека. Каждый флакон объемом 5,5 мл содержит 25,3 мг натрия, каждый флакон объемом 8,3 мл содержит 38,2 мг натрия.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Золгенсма не влияет или оказывает незначительное влияние на способность управлять транспортными средствами и работу с механизмами.
Форма выпуска
По 5,5 или 8,3 мл раствора для инфузий в стерильный, бесцветный пластиковый флакон Crystal Zenith из циклоолефинового полимера объемом 10 мл, укупоренный серой резиновой пробкой из хлорбутила, обкатанной алюминиевым колпачком с пластиковой отщелкивающейся крышкой («flip-off» устройство) светло-зеленого цвета. На горлышке флакона расположен стикер с описанием маркировки флакона на русском языке.
Набор из 2-14 флаконов по 5,5 мл и/или 8,3 мл в картонную подложку для флаконов вместе с инструкцией по медицинскому применению в пачку картонную, на которую нанесен стикер.
Варианты конфигурации наборов:
| Флакон объемом 5,5 мл | Флакон объемом 8,3 мл |
| 0 | 2 |
| 2 | 1 |
| 1 | 2 |
| 0 | 3 |
| 2 | 2 |
| 1 | 3 |
| 0 | 4 |
| 2 | 3 |
| 1 | 4 |
| 0 | 5 |
| 2 | 4 |
| 1 | 5 |
| 0 | 6 |
| 2 | 5 |
| 1 | 6 |
| 0 | 7 |
| 2 | 6 |
| 1 | 7 |
| 0 | 8 |
| 2 | 7 |
| 1 | 8 |
| 0 | 9 |
| 2 | 8 |
| 1 | 9 |
| 0 | 10 |
| 2 | 9 |
| 1 | 10 |
| 0 | 11 |
| 2 | 10 |
| 1 | 11 |
| 0 | 12 |
| 2 | 11 |
| 1 | 12 |
| 0 | 13 |
| 2 | 12 |
| 1 | 13 |
| 0 | 14 |
Допускается наличие контроля первичного вскрытия.
Условия хранения
При температуре не выше минус 60 °С.
Хранить в оригинальной картонной упаковке до момента использования.
После получения хранить в холодильнике при температуре 2 °С — 8 °С.
Не замораживать повторно.
Условия транспортирования
При температуре не выше минус 60 °С.
Транспортировка осуществляется с использованием сухого льда SAVSU Evo или сухого льда с пассивной изоляцией (PIDIS) с системой GPS и термодатчиком (TMD) (предоставляется поставщиком транспортных услуг).
Сухой лед SAVSU Evo и PIDIS поддерживают целостность продукта и температуру не выше минус 60 °С.
Срок годности
1 год.
После получения использовать в течение 14 дней.
Подготовленный к инфузии шприц с необходимым объемом препарата использовать в течение 8 часов.
Не применять препарат по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
Производитель (все стадии производства)
Новартис Генные Терапии, Инк., США, 1940 ЮЭСДжи Драйв, г. Либертивилл, штат Иллинойс (IL) 60048, США / Novartis Gene Therapies, Inc., 1940 USG Drive, Libertyville, Illinois 60048, USA
Держатель регистрационного удостоверения
Новартис Фарма АГ, Лихтштрассе 35, 4056 Базель, Швейцария / Novartis Pharma AG, Lichtstrasse 35, 4056 Basel, Switzerland
Организация, принимающая претензии потребителей
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 70
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Форма выпуска, упаковка и состав
препарата Золгенсма®
Раствор для инфузий от прозрачного до слегка опалесцирующего, от бесцветного до слегка белого цвета.
Вспомогательные вещества: трометамин, магния хлорид, натрия хлорид, полоксамер 188, хлористоводородная кислота, вода д/и.
Наборы.
5.5 мл и/или 8.3 мл — флаконы пластиковые (2*-14*) со стикером с описанием маркировки — подложки картонные (1) — пачки картонные×.
* Варианты конфигурации наборов (2-14 флаконов в пачке):
× допускается наличие контроля первичного вскрытия (стикер).
Фармакологическое действие
Генотерапевтическое средство, предназначенное для введения функциональной копии гена выживания моторных нейронов 1 (SMN1) в трансдуцированные клетки для устранения моногенной первопричины спинальной мышечной атрофии (СМА). Ожидается, что благодаря внедрению в моторные нейроны альтернативного источника экспрессии белка SMN, данное средство обеспечит выживание и корректное функционирование трансдуцированных моторных нейронов.
Онасемноген абепарвовек представляет собой не реплицирующийся рекомбинантный аденоассоциированный вирусный (AAV) вектор, который использует капсид аденоассоциированного вируса серотипа 9 (AAV9) для доставки стабильного, полностью функционального трансгена человеческого SMN. Установлено, что капсид AAV9 способен проникать через ГЭБ и трансдуцировать моторные нейроны. Ген SMN1, содержащийся в онасемноген абепарвовеке, предназначен для того, чтобы персистировать в ядре трансдуцированных клеток в виде эписомальной ДНК, ожидается, что он будет стабильно экспрессироваться на протяжении длительного времени в постмитотических клетках. Способность вируса AAV9 вызывать заболевание у человека неизвестна. Трансген вводится в клетки-мишени в виде самокомплементарной двухцепочечной молекулы. Экспрессия трансгена регулируется конститутивным промотором (гибрид промотора гена куриного β-актина и энхансера транскрипции цитомегаловируса), который обеспечивает постоянную и устойчивую экспрессию белка SMN. Описанный механизм действия подкреплен данными доклинических исследований и данными по биораспределению в организме человека.
Фармакокинетика
Оценка биораспределения была проведена у двух пациентов, которые умерли через 5.7 и 1.7 месяцев соответственно после инфузии препарата онасемноген абепарвовека в дозе 1.1×1014 вектор-геномов (вг)/кг. В обоих случаях максимальное содержание векторной ДНК было обнаружено в печени. Векторная ДНК была также обнаружена в селезенке, сердце, поджелудочной железе, паховых лимфатических узлах, скелетных мышцах, периферических нейронах, почках, легких, кишечнике, гонадах, спинном мозге, головном мозге и тимусе. Иммунное окрашивание на белок SMN выявило генерализованную экспрессию SMN в моторных нейронах спинного мозга, нейронах и глиальных клетках головного мозга, а также в сердце, печени, скелетных мышцах и других изученных тканях. Исследования выделения вектора онасемноген абепарвовека оценивали количество вектора, выводимого из организма со слюной, мочой и калом. Онасемноген абепарвовек обнаруживался в биологическом материале в постинфузионном периоде. Онасемноген абепарвовек выводился главным образом с калом, причем основная часть выводилась в течение 30 сут после применения.
Показания активных веществ препарата
Золгенсма®
Спинальная мышечная атрофия (СМА) с биаллельной мутацией в гене SMN1 и клиническим диагнозом СМА 1 типа; СМА с биаллельной мутацией гена SMN1 и не более чем с тремя копиями гена SMN2.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Предназначен только для однократной в/в инфузии. Номинальная доза онасемноген абепарвовек составляет 1.1×1014 вг/кг. Общий вводимый объем определяется массой тела пациента.
Применяется в комплексе с иммуномодулирующей терапией по специальной схеме.
Лечение следует начинать и проводить в клинических центрах под наблюдением врача, имеющего опыт ведения пациентов со СМА.
Перед применением данного средства необходимо провести следующие лабораторные исследования: тест на определение содержания антител к AAV9 с использованием соответствующего валидированного метода исследования; оценка функции печени — определение активности АЛТ, АСТ и концентрации общего билирубина; клинический анализ крови (включая концентрацию гемоглобина и количество тромбоцитов); тест на тропонин I; определение концентрации креатинина.
Необходимость тщательного мониторинга функции печени, количества тромбоцитов и концентрации тропонина I после инфузии, а также необходимость назначения терапии ГКС следует учитывать при определении сроков лечения онасемноген абепарвовеком.
В случае острых или хронических неконтролируемых активных инфекций лечение следует отложить до разрешения инфекции или окончания фазы обострения.
Побочное действие
Со стороны крови и лимфатической системы: часто — тромбоцитопения; неизвестно — тромботическая микроангиопатия (ТМА).
Со стороны пищеварительной системы: часто — рвота.
Со стороны печени и желчевыводящих путей: очень часто — повышение активности печеночных ферментов; часто — гепатотоксичность; неизвестно — острая печеночная недостаточность, острое поражение печени.
Общие реакции: часто — пирексия.
Лабораторные исследования: часто — повышение концентрации тропонина (включает повышение концентрации тропонина и повышение концентрации тропонина I), повышение концентрации тропонина Т.
Противопоказания к применению
Повышенная чувствительность к онасемноген абепарвовеку.
С осторожностью
Нарушения функции почек, нарушения функции печени (в частности, у пациентов с повышенной концентрацией билирубина, не связанной с желтухой новорожденных), недоношенные новорожденные до достижения ими возраста, соответствующего гестационному возрасту доношенного ребенка.
Применение при беременности и кормлении грудью
Исследования репродуктивной и эмбриофетальной токсичности данного средства у животных не проводились.
Применение при нарушениях функции печени
Необходима осторожность при рассмотрении вопроса о применении данного средства у пациентов с нарушением функции печени. Коррекция дозы не требуется.
Применение при нарушениях функции почек
Необходима осторожность при рассмотрении вопроса о применении данного средства у пациентов с нарушением функции почек. Коррекция дозы не требуется.
Применение у детей
Предназначен для применения у детей по показаниям.
Безопасность и эффективность онасемноген абепарвовека у недоношенных новорожденных до достижения полного гестационного возраста не установлены. Данные по применению препарата у данной категории пациентов отсутствуют. Следует тщательно оценить возможность применения препарата в связи с возможным негативным влиянием глюкокортикостероидов на их неврологическое развитие
Опыт применения препарата у пациентов 2 лет и старше или с массой тела выше 13,5 кг ограничен. Безопасность и эффективность онасемноген абепарвовека у данной группы пациентов не установлены
Применение у пожилых пациентов
Не применимо.
Особые указания
Образование анти-AAV9 антител может наблюдаться на фоне естественного воздействия вируса. В ряде исследований, направленных на изучение распространенности антител к AAV9 в общей популяции, установлена низкая частота предшествующего контакта с AAV9 вирусом в педиатрической популяции. Следует оценить содержание антител к AAV9 у пациентов до инфузии данного средства. Повторное тестирование может быть выполнено, если титр антител к AAV9 превышает 1:50. Эффективность и безопасность применения данного средства у пациентов с уровнем анти-AAV9 антител выше 1:50 неизвестна.
Поскольку СМА вызывает прогрессирующее и необратимое повреждение моторных нейронов, терапевтическая эффективность применения данного средства у пациентов с клиническими симптомами зависит от степени тяжести заболевания на момент лечения, при этом раннее начало терапии имеет потенциально более высокую эффективность. Несмотря на то, что у пациентов со СМА на поздних стадиях развитие крупной моторики не достигнет уровня здоровых сверстников, такие пациенты могут получить клиническую пользу от заместительной генной терапии, эффективность которой зависит от степени развития заболевания на момент лечения. Лечащий врач должен учитывать, что польза от терапии значительно снижается у пациентов с выраженной мышечной слабостью и дыхательной недостаточностью, у пациентов, находящихся на ИВЛ и у пациентов, не способных глотать.
У пациентов со СМА на поздней стадии, которым требуется жизнеобеспечение с постоянной ИВЛ, без способности полноценно развиваться, соотношение польза/риск препарата не установлено.
Иммунный ответ к капсиду AAV9 произойдет после инфузии онасемноген абепарвовека, включая образование антител против капсида AAV9, несмотря на иммуномодулирующую терапию и опосредованный Т-клетками иммунный ответ.
При применении данного средства отмечались случаи системного иммунного ответа, в т.ч. иммуноопосредованной гепатотоксичности, в основном проявлявшейся увеличением активности АЛТ и АСТ, а в некоторых случаях — в виде острого тяжелого поражения печени или острой печеночной недостаточности. Иммуноопосредованная гепатотоксичность может требовать коррекции схемы применения ГКС, в т.ч. более длительного применения, увеличения дозы или более длительного периода постепенной отмены.
У пациентов с сопутствующим нарушением функции печени или острым вирусным инфекционным заболеванием печени может увеличиваться риск острого тяжелого поражения печени/острой печеночной недостаточности. Следует контролировать функцию печени в течение по меньшей мере 3 месяцев после инфузии.
Риск и пользу, связанные с применением данного средства у пациентов с нарушением функции печени, следует тщательно сопоставлять с рисками, которым подвергается пациент в отсутствие терапии.
В некоторых случаях одновременная активация иммунной системы (например, в результате инфекции, вакцинации) признана способствующим фактором развития тромботической микроангиопатии.
Тромбоцитопения является ключевым признаком тромбоцитопенической микроангиопатии, в связи с чем необходимо контролировать количество тромбоцитов, наряду с другими признаками и симптомами, такими как артериальная гипертензия, образование кожных и подкожных кровоизлияний, судороги или уменьшение количества выделяемой мочи. В случае, если данные признаки и симптомы возникают на фоне тромбоцитопении, следует провести дальнейшую диагностическую оценку с целью выявления гемолитической анемии и нарушения функции почек. При выявлении клинических признаков, симптомов и/или лабораторных показателей ТМА следует незамедлительно проконсультировать пациента у детского гематолога и/или детского нефролога с целью подбора терапии ТМА согласно клиническим показаниям.
В некоторых случаях увеличение концентрации тропонина I может указывать на повреждение ткани миокарда. На основании этих результатов и кардиотоксичности, отмеченной в доклинических исследованиях у мышей, концентрацию тропонина I следует определять до инфузии данного средства и контролировать в течение по меньшей мере последующих 3 месяцев вплоть до возвращения данного показателя в пределы нормы для пациентов со СМА. При необходимости следует рассмотреть вопрос о консультации у специалиста-кардиолога.
Не следует начинать иммуномодулирующую терапию на фоне активной инфекции, как острой (например, острая респираторная инфекция или острый гепатит), так и неконтролируемой хронической инфекции (например, хронический гепатит B в активной фазе).
Иммуномодулирующий режим также может оказывать влияние на иммунный ответ к сопутствующим инфекциям (например, респираторным), что может привести к их более тяжелому клиническому течению. Рекомендовано уделять особое внимание диагностике и активной терапии инфекционных заболеваний соответственно. Рекомендовано проведение своевременной сезонной профилактики респираторно-синцитиальных вирусных инфекций.
По возможности график вакцинации пациента следует скорректировать с учетом применения ГКС в пре- и постинфузионном периоде применения данного средства. Лечащему врачу следует помнить о возможном развитии надпочечниковой недостаточности в случае продолжительного применения ГКС или при увеличении его дозы.
Временное выделение онасемноген абепарвовека происходит, главным образом, с продуктами жизнедеятельности. Лицам, осуществляющим уход, и семьям пациентов следует рекомендовать следующие инструкции по правильному обращению с испражнениями пациента: в течение как минимум одного месяца после введения препарата следует тщательно соблюдать гигиену рук после непосредственного контакта с продуктами жизнедеятельности пациента; одноразовые подгузники можно плотно упаковывать в двойные пластиковые пакеты и утилизировать вместе с бытовыми отходами.
Лекарственное взаимодействие
По возможности график вакцинации пациента следует скорректировать с учетом введения ГКС до и после инфузии данного средства. Рекомендуется проведение сезонной вакцинации против респираторно-синцитиального вируса.
Пациентам, получающим ГКС в иммуносупрессивных дозах (например, преднизолон в дозе 20 мг или 2 мг/кг массы тела либо другой ГКС в эквивалентной дозе ежедневно на протяжении >2 недель), не следует вводить живые вакцины, такие как тривакцина против кори, эпидемического паротита и краснухи и вакцина против ветряной оспы.
МНН: Оланзапин
Производитель: КРКА, д.д., Ново Место
Анатомо-терапевтическо-химическая классификация: Olanzapine
Номер регистрации в РК:
РК-ЛС-5№022508
Информация о регистрации в РК:
30.11.2016 — 30.11.2021
Номер регистрации в РБ:
10944/21
Информация о регистрации в РБ:
14.05.2021 — 14.05.2026
-
Скачать инструкцию медикамента
Торговое название
Заласта
Международное непатентованное название
Оланзапин
Лекарственная форма
Таблетки,
2,5 мг, 5 мг, 7,5 мг, 10 мг, 15 мг, 20 мг
Состав
Одна
таблетка содержит
активное
вещество —
оланзапин 2,5 мг, 5 мг, 7,5 мг, 10 мг, 15 мг, 20 мг
вспомогательные
вещества:
целлактоза (альфа-лактозы моногидрат и порошок целлюлозы), крахмал
прежелатинизированный, крахмал кукурузный, кремния диоксид коллоидный
безводный, магния стеарат
Описание
Таблетки
круглой формы, светло-желтого цвета, со слегка двояковыпуклой
поверхностью и возможными
желтыми вкраплениями (для дозировки 2.5 мг).
Таблетки
круглой формы, светло-желтого цвета, со слегка двояковыпуклой
поверхностью, возможными
желтыми вкраплениями и маркировкой «5» (для дозировки 5
мг).
Таблетки
круглой формы, светло-желтого цвета, со слегка двояковыпуклой
поверхностью, возможными
желтыми вкраплениями и маркировкой «7.5» (для дозировки
7,5
мг).
Таблетки
круглой формы, светло-желтого цвета, со слегка двояковыпуклой
поверхностью, возможными
желтыми вкраплениями и маркировкой «10» (для дозировки 10
мг).
Таблетки
круглой формы, светло-желтого цвета, со слегка двояковыпуклой
поверхностью, возможными
желтыми вкраплениями и маркировкой «15» (для дозировки 15
мг).
Таблетки
круглой формы, светло-желтого цвета, со слегка двояковыпуклой
поверхностью, возможными
желтыми вкраплениями и маркировкой «20» (для дозировки 20
мг).
Фармакотерапевтическая группа
Психотропные
препараты. Нейролептики (Антипсихотики). Дибензодиазепины и их
производные. Оланзапин.
Код
АТХ N05AH03
Фармакологические свойства
После
перорального приема оланзапин хорошо всасывается и его максимальная
концентрация в плазме крови достигается через 5 — 8 часов.
Всасываемость оланзапина не зависит от приёма пищи. При концентрации
в плазме от 7 до 1000 нг/мл, с белками плазмы связывается около 93%
оланзапина, в основном, с альбумином и с 1-кислотным-гликопротеином.
Оланзапин
метаболизируется в печени в результате процессов конъюгации и
окисления. Основным циркулирующим метаболитом является
10-N-глюкуронид, который не проникает через гематоэнцефалический
барьер. Изоферменты CYP1A2 и CYP2D6 цитохрома Р450 участвуют в
образовании N-десметил и 2-гидроксиметил метаболитов оланзапина.
Активность изофермента CYP2D6 цитохрома Р450 не влияет на уровень
метаболизма оланзапина. Основная фармакологическая активность
препарата обусловлена исходным веществом — оланзапином. Около 57%
оланзапина выводится через почки, в основном в виде метаболитов.
Оланзапин
выделяется с грудным молоком. Средняя дозировка, получаемая ребенком
(мг/кг) при достижении равновесной концентрации у матери, составляла
1,8% дозы оланзапина матери (мг/кг).
Фармакокинетические
показатели оланзапина варьируют в зависимости от курения, пола и
возраста (см. таблицу).
|
Характеристики |
Период |
Клиренс (л/ч) |
|
Некурящие |
38,6 |
18,6 |
|
Курящие |
30,4 |
27,7 |
|
Женщины |
36,7 |
18,9 |
|
Мужчины |
32,3 |
27,3 |
|
Пожилые |
51,8 |
17,5 |
|
Моложе |
33,8 |
18,2 |
У
пациентов с поражением почек (клиренс креатинина <10 мл/мин) в
сравнении со здоровыми субъектами не отмечается значительного
различия в среднем периоде полувыведения (37,7 и 32,4 часа
соответственно) или плазменном клиренсе (21,2 и 25,0 л/час
соответственно).
У
курящих лиц с незначительными нарушениями функции печени период
полувыведения больше (39,3 ч) и клиренс оланзапина ниже (18, 0 л/ч),
чем у некурящих без нарушения функции печени (48,8 часов и 14,1 л/час
соответственно).
Плазменный
клиренс оланзапина ниже у пожилых пациентов по сравнению с пациентами
моложе 65 лет, у женщин по сравнению с мужчинами, и у некурящих
пациентов в сравнении с курящими пациентами. Однако величина влияния
возраста, пола или курения на клиренс креатинина и период полураспада
мала по сравнению с общей межиндивидуальной вариабельностью.
Фармакокинетика
оланзапина схожа у взрослых пациентов и пациентов в возрасте от 13 до
17 лет. В клинических исследованиях среднее воздействие оланзапина
было на 27% выше среди подростков, что может быть связано с
демографическими особенностями данной группы пациентов (более низкая
масса тела и меньшее количество курящих пациентов).
Фармакодинамика
Заласта®
является антипсихотическим, противоманиакальным и стабилизирующим
настроение средством, демонстрирующим широкий фармакологический
профиль по целому ряду рецепторных систем.
Заласта®
обладает высоким сродством к рецепторам серотонина (5HT2A/2C,
5HT3,
5HT6),
дофамина (D1
— D5),
мускарина (М1
– М5),
гистамина (Н1),
а также к α1
рецепторам адренегрической системы.
Препарат
селективно снижает возбудимость мезолимбических (А10)
дофаминергических нейронов, и в тоже время оказывает незначительное
действие на стриарные (А9)
нервные пути, участвующие в регуляции моторных функций. Заласта®
снижает условный рефлекс избегания (тест, характеризующий
антипсихотическую активность) в дозах более низких, чем дозы,
вызывающие каталепсию (расстройство, отражающее побочное влияние на
моторную функцию). Заласта®
усиливает противотревожный эффект при проведении «анксиолитического»
теста.
Заласта®
обеспечивает редукцию как продуктивных (бред, галлюцинации и др.),
так и негативных расстройств.
Показания к применению
Заласта®
предназначена
-
для
лечения обострений
и поддерживающей терапии шизофрении и шизоподобных расстройств
у пациентов с выраженной продуктивной (например, бред, галлюцинации,
расстройство мышления, враждебность и подозрительность) и/или
негативной (например, эмоциональная уплощенность, эмоциональная и
социальная отгороженность, обеднение речи) симптоматикой, а также
сопутствующими вторичными
аффективными расстройствами.
Заласта®
эффективно улучшает клиническую картину при продолжительном
лечении пациентов,
чувствительных к терапии на начальном этапе -
для
лечения
острых маниакальных
или смешанных эпизодов у
пациентов с биполярным расстройством при наличии или отсутствии
психотических проявлений и при наличии или отсутствии быстрой смены
фаз в виде
монотерапии или в
комбинации с литием или вальпроатом.
Заласта®
показана для удлинения интервала между рецидивами и уменьшения
частоты рецидивов маниакальных,
смешанных или депрессивных эпизодов
при биполярных расстройствах.
-
для
лечения депрессивных
эпизодов у
пациентов с биполярным расстройством
в виде
монотерапии или в
комбинации с флуоксетином -
для
лечения пациентов с резистентной
депрессией
(большое депрессивное расстройство у пациентов, не отвечающих на
терапию двумя антидепрессантами в достаточной дозировке и
соответствующей продолжительности) в
комбинации с флуоксетином -
для
лечения маниакальных
эпизодов от
средней до выраженной степени тяжести -
для
предотвращения
рецидивов у
пациентов с биполярным расстройством, у которых препарат был
эффективен при лечении маниакального эпизода
Способ применения и дозы
Шизофрения
и сходные психотические расстройства: рекомендуемая
начальная доза Заласты в
комбинации с флуоксетином
показана составляет 10 мг один раз в сутки. Заласту можно принимать
вне зависимости от приёма пищи, поскольку прием пищи не влияет на
всасываемость препарата. Терапевтические дозы Заласты колеблятся в
диапазоне от 5 мг до 20 мг в сутки. Суточную дозу необходимо
подбирать индивидуально в зависимости от клинического состояния
больного. Увеличение дозы свыше стандартной суточной дозы 10 мг
рекомендуется проводить только после соответствующего клинического
обследования пациента, с интервалами не менее 24 часов.
Постепенное уменьшение дозы
должно рассматриваться в случае прекращения приема Заласты.
Острая
мания при биполярном расстройстве:рекомендуемая
начальная доза Заласты составляет 15 мг один раз в сутки в качестве
монотерапии или 10 мг один раз в сутки в комбинации с литием или
вальпроатом. Заласту можно принимать вне зависимости от приёма пищи,
поскольку прием пищи не влияет на всасываемость препарата.
Терапевтические дозы Заласты колеблятся в диапазоне от 5 мг до 20 мг
в сутки. Суточную дозу необходимо подбирать индивидуально, в
зависимости от клинического состояния больного. Увеличение дозы свыше
стандартной суточной дозы 15 мг рекомендуется проводить постепенно, с
интервалами не менее 24 часов, только после соответствующего
клинического обследования пациента.
Поддерживающая
терапия при биполярном расстройстве: пациентам,
принимавшим Заласту для лечения острой мании, необходимо продолжить
поддерживающую терапию в той же дозе. У пациентов в ремиссии
рекомендуемая начальная доза Заласты составляет 10 мг один раз в
сутки. В дальнейшем суточную дозу необходимо подбирать индивидуально,
в зависимости от клинического состояния больного, в пределах от 5 мг
до 20 мг в день. Заласту можно принимать вне зависимости от приёма
пищи, поскольку прием пищи не влияет на всасываемость препарата.
Биполярная
депрессия: рекомендуемая
начальная доза Заласты составляет 5 мг. Препарат следует применять
один раз в сутки вечером. В случае необходимости может быть
произведена корректировка дозы с шагом в 5 мг.
Заласту
в комбинации с
флуоксетином
следует назначать 1 раз в день вечером, как правило, начиная с 5 мг
оланзапина и 20 мг флуоксетина. При необходимости допускается
изменение дозировок как оланзапина, так и флуоксетина.
Резистентная
депрессия: Заласту
в комбинации с флуоксетином следует применять один раз в день
вечером, как правило, начиная с 5 мг оланзапина и 20 мг флуоксетина.
При необходимости допускается изменение дозировок как оланзапина, так
и флуоксетина.
Маниакальный
эпизод:
рекомендуемая начальная доза Заласты составляет 15 мг один раз в
сутки при монотерапии или 10 мг один раз в сутки при комбинированной
терапии.
Профилактика
рецидивов при биполярном расстройстве:
рекомендуемая начальная доза Заласты составляет 10 мг один раз в
сутки. Пациентам, получающим Заласту для лечения маниакального
эпизода, для профилактики рецидива необходимо продолжить терапию в
той же дозе. При возникновении нового маниакального, смешанного или
депрессивного эпизода, лечение Заластой должно быть продолжено (при
необходимости с оптимизацией дозы) с назначением по клиническим
показаниям дополнительной терапии для лечения симптомов изменения
настроения.
Общие
правила выбора суточной дозы при пероральном приеме для больных
определённых групп
Снижение
начальной дозы до 5 мг в сутки рекомендуется пациентам от 65 лет и
старше или пациентам с другими клиническими факторами риска, включая
тяжёлую почечную недостаточность или печёночную недостаточность
средней степени тяжести (цирроз печени, класс А и В по шкале
Чайлд-Пью). Увеличение дозы свыше 5 мг необходимо производить с
осторожностью.
Снижение
начальной дозы может быть рекомендовано для пациентов с комбинацией
факторов (пациенты пожилого возраста, некурящие), которые могут
замедлять метаболизм оланзапина. Увеличение дозы у таких пациентов
должно проводиться с осторожностью.
Оланзапин
не рекомендуется для применения у детей и подростков, не достигших
18-летнего возраста, в связи с отсутствием данных о безопасности и
эффективности. Значимое увеличение веса и изменение уровня липидов,
пролактина чаще наблюдались в краткосрочных клинических исследованиях
подростков, чем в клинических исследованиях взрослых пациентов.
Побочные действия
К
наиболее часто сообщаемым побочным реакциям (1%)
относятся сонливость, увеличение массы тела, эозинофилия, увеличение
уровня пролактина, холестерина, глюкозы и триглицеридов, глюкозурия,
повышение аппетита, головокружение, акатизия, паркинсонизм,
лейкопения, нейтропения, дискинезия, ортостатическая гипотония,
антихолинергические эффекты, транзиторное бессимптомное повышение
печеночных аминотрансфераз, сыпь, астения, усталость, лихорадка,
артралгия, увеличение уровня щелочной фосфатазы, повышение гамма
глутамилтрансферазы, мочевой кислоты и креатинфосфокиназы, отек.
Очень
часто(≥1/10)
-
увеличение
веса1
(≥7%
от массы тела) при
краткосрочном периоде применения (в среднем около 47 дней)
-
увеличение
веса1
(≥7%,
15%, 25% от массы тела) при
долгосрочном периоде применения (не менее 48 недель) -
повышение
уровня пролактина в плазме8
-
ортостатическая
гипотензия10 -
сонливость
-
увеличение
уровня холестерина3
≥6.2 ммоль/л по сравнению с исходным показателем ≥5,17 — <6,2
ммоль/л натощак -
увеличение
уровня триглицеридов2,5
≥2,26 ммоль/л по сравнению с исходным показателем ≥1,69 —
<2,26 ммоль/л -
увеличение
уровня глюкозы4
≥7 ммоль/л по сравнению с исходным показателем ≥5,56 — <7
ммоль/л натощак.
Часто
(≥1/100,
<1/10)
-
увеличение
веса1
(≥15% от массы тела) при
краткосрочном периоде применения (в среднем около 47 дней) -
эозинофилия,
лейкопения (включая нейтропению)10 -
транзиторное
асимптоматическое повышение печеночных аминотрансфераз (АЛТ, АСТ),
особенно на ранних этапах лечения -
увеличение
уровня щелочной фосфатазы (ЩФ)10 -
увеличение
уровня холестерина2,3
≥6,2 ммоль/л по сравнению с исходным показателем <5,17 ммоль/л
натощак.
-
увеличение
уровня триглицеридов2,5
≥2,26 ммоль/л по сравнению с исходным показателем <1,69
ммоль/л -
увеличение
уровня глюкозы4
≥7 ммоль/л по сравнению с исходным показателем <5,56 ммоль/л
натощак. -
увеличение
уровня гамма-глутамилтрансферазы10 -
увеличение
уровня мочевой кислоты10 -
увеличение
уровня креатинфосфокиназы11 -
глюкозурия
-
повышенный
аппетит -
головокружение
-
акатизия6
-
паркинсонизм6
-
дискинезия6
-
умеренные
транзиторные антихолинергические эффекты, включая запор и сухость во
рту -
эректильная
дисфункция у мужчин, сниженное половое влечение у мужчин и женщин -
сыпь,
отек (в т.ч. периферический) -
астения,
усталость, лихорадка10 -
артралгия9
Иногда
(≥1/1000,
<1/100)
-
увеличение
веса1
(≥25%
от массы тела)
при краткосрочном периоде применения (в среднем около 47 дней) -
гиперчувствительность11
-
возникновение
или обострение сахарного диабета, иногда связанное с кетоацидозом
или комой, включая несколько летальных исходов11 -
судороги
при наличии в большинстве случаев приступов в анамнезе или факторов
риска развития судорог11
-
дистония
(включая движения глазного яблока)11 -
поздняя
дискинезия11
-
брадикардия,
удлинение интервала QTc -
вздутие
живота9 -
амнезия9
-
дизартрия
-
реакция
фоточувствительности -
носовое
кровотечение9 -
венозная
тромбоэмболия (в т.ч. тромбоэмболия легочной артерии и тромбоз
глубоких вен) -
алопеция
-
недержание
мочи, задержка
мочи, затрудненное мочеиспускание11 -
повышение
общего билирубина -
аменорея,
увеличение молочных желез, галакторея у женщин,
гинекомастия/увеличение грудных желез у мужчин
Редко(≥1/10000,
<1/1000)
-
гепатит
(включая печеночно-клеточное, холестатическое или смешанное
повреждение печени)11 -
тромбоцитопения11
-
гипотермия12
-
злокачественный
нейролептический синдром12
-
симптомы
отмены7,12 -
желудочковая
тахикардия/фибрилляция, внезапная смерть11 -
панкреатит11
-
рабдомиолиз11
-
приапизм12
Частота
неизвестна
-
синдром
отмены у новорожденных
1 Клинически
значимое увеличение массы тела отмечалось по всем категориям ИМТ
(индекса массы тела).
2 Среднее
увеличение значений липидов натощак было выше у пациентов без
изначального нарушения липидного обмена.
3 Оценка
произведена на основании измеренных значений в базе данных
клинических исследований.
4 COSTART термин
диабетический ацидоз.
5 COSTART термин
гиперлипидемии.
6 В клинических
исследованиях частота возникновения паркинсонизма и дистонии у
пациентов, принимавших оланзапин, была количественно выше, но
статистически достоверно не отличалась от плацебо. Пациенты,
принимавшие оланзапин, имели более низкую частоту возникновения
паркинсонизма, акатизии и дистонии в сравнении с титруемыми дозами
галоперидола.
7 При внезапном
прекращении приема оланзапина отмечалось развитие таких острых
симптомов как потливость, бессонница, тремор, беспокойство, тошнота и
рвота.
8 В клинических
исследованиях продолжительностью до 12 недель уровень пролактина в
плазме превышал верхнюю границу нормы у примерно 30% пациентов,
принимавших оланзапин. У большинства пациентов повышение уровня
пролактина было умеренным и оставалось в два раза ниже верхнего
предела нормального диапазона значений.
9 Побочное
действие, идентифицированное из базы данных клинических исследований.
10 Оценка
произведена на основании измеренных значений в базе данных
клинических исследований
11 Побочное
действие, идентифицированное из спонтанных постмаркетинговых отчетов,
с частотой, определенной в базе данных клинических исследований.
12 Побочное
действие, идентифицированное из спонтанных постмаркетинговых отчетов,
с частотой, рассчитанной на верхней границе 95% доверительного
интервала, с использованием базы данных клинических исследований.
При
длительном
применении Зипрексы®
(не менее 48 недель) количественное соотношение пациентов с
клинически значимыми изменениями показателей веса, уровней глюкозы,
общего холестерина, ЛПНП, ЛПВП или триглицеридов, увеличивалось с
течением времени. У пациентов, закончивших 9 — 12 курсов терапии,
темпы роста средней величины уровня глюкозы в крови замедлялись
приблизительно через 6 месяцев.
Нежелательные
эффекты в особых группах пациентов.
В
клинических исследованиях у пожилых пациентов со слабоумием лечение
Заластой
ассоциировалось с более высокой смертностью и более высокой частотой
развития побочных реакций со стороны сердечно-сосудистой системы по
сравнению с плацебо. К очень частым побочным реакциям (10%)
в данной группе пациентов отнесены нарушение походки и падения.
Частыми побочными реакциями (≥1%, <10%) являлись повышение
температуры тела, летаргия, эритема, зрительные галлюцинации,
пневмония и недержание мочи.
У
больных с психозом, индуцированным приемом лекарственного препарата
(агониста допамина), при болезни Паркинсона, очень часто (10%)
и с более высокой частотой, чем в группе плацебо, отмечались
галлюцинации и усиление симптомов паркинсонизма.
У
больных с биполярной манией, получающих Заласту, в комбинации с
литием или вальпроатом отмечалось развитие нейтропении. Очень частыми
(10%)
нежелательными эффектами в данной группе были увеличение веса,
сухость во рту, повышение аппетита, тремор и частыми (<10% и ≥1%)
— нарушение речи. Во время лечения Заластой в комбинации с литием или
дивалпроексом, увеличение веса ≥7% от исходного уровня наблюдалось
у 17,4% пациентов при терапии острого периода (до 6 недель).
Долгосрочное лечение Заластой (до 12 месяцев) для профилактики
рецидивов у пациентов с биполярным расстройством ассоциировалось с
увеличением веса тела ≥7% от исходного уровня у 39,9% пациентов.
Противопоказания
-
повышенная
чувствительность к любому из компонентов препарата -
детский
и подростковый возраст до 18 лет -
наличие
риска развития закрытоугольной глаукомы
Лекарственные взаимодействия
Метаболизм
оланзапина может изменяться под действием ингибиторов или индукторов
изоформентов
цитохрома Р450,
проявляющих специфическую активность в отношении CYP1А2.
По
данным исследований in
vitro, оланзапин
обладает крайне малым потенциалом для подавления активности следующих
изоферментов цитохрома Р450: CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A.
В клинических испытаниях показано, что однократное введение дозы
Зипрексы®
на фоне терапии следующими препаратами не сопровождалось подавлением
метаболизма: трициклическими
антидепрессантами
(CYP2D6) (в т.ч.
имипрамином или его метаболитом дезипрамином (CYP2D6, CYP3A,
CYP1A2)), варфарином (CYP2C19), теофиллином (CYP1A2) или диазепамом
(CYP3A4, CYP2C19).
Клиренс
Заласты повышается у курящих
пациентов и у
больных, принимающих карбамазепин
(в связи с увеличением активности CYP1А2). Рекомендуется проведение
клинического мониторинга и при необходимости увеличение дозы Заласты.
Известные
сильные ингибиторы
CYP1А2 могут
снижать клиренс Заласты. Оланзапин не является сильным ингибитором
активности CYP1А2, поэтому при приеме Заласты фармакокинетика
лекарственных средств, таких как теофиллин, которые метаболизируются
в основном при участии CYP1A2, не меняется.
Не
выявлено также признаков лекарственного взаимодействия при применении
оланзапина в комбинации с литием
или бипериденом.
Заласта®
может ослаблять действие прямых и непрямых агонистов допамина.
На
фоне устойчивой концентрации оланзапина изменения фармакокинетики
этанола
не отмечалось. Однако прием этанола вместе с Заластой может
сопровождаться усилением фармакологических эффектов оланзапина, в
т.ч. седативного действия.
Флуоксетин
(60 мг однократно или 60 мг ежедневно в течение 8 дней) вызывает
увеличение максимальной концентрации (в среднем, на 16%) и снижение
клиренса оланзапина (в среднем, на 16%). Степень влияния флуоксетина
значительно уступает выраженности индивидуальных различий этих
показателей, поэтому обычно не рекомендуется изменять дозу Заласты
при ее комбинации с флуоксетином.
Однократная
доза алюминий- или
магний- содержащего антацида или циметидина
не нарушали биодоступность оланзапина при приеме внутрь. Совместное
назначение активированного
угля снижает
биодоступность оланзапина при приеме внутрь до 50 — 60%.
Активированный
уголь необходимо принимать не менее чем за 2 часа до или после приема
Заласты.
Флувоксамин,
специфический ингибитор CYP1A2, значительно снижает клиренс
оланзапина. В результате, при приеме флувоксамина Смах
оланзапина увеличивается на 54% у некурящих женщин и на 77% у курящих
мужчин и среднее увеличение AUC оланзапина составляет 52% и 108%
соответственно. Пациентам, принимающим флувоксамин или любой другой
ингибитор CYP1A2, такой как ципрофлоксацин, необходимо назначение
более низких начальных доз Заласты. В начале лечения ингибиторами
CYP1A2, дозу Заласты необходимо снизить.
В
исследованиях in
vitro с
использованием микросом печени человека показано, что оланзапин
незначительно подавляет процесс образования глюкуронида
вальпроата
(основной путь метаболизма вальпроата). Вальпроат также незначительно
влияет на метаболизм оланзапина in
vitro. Ежедневное
совместное назначение 10 мг оланзапина in
vivo в течение 2
недель не влияет на устойчивую концентрацию вальпроата в плазме.
Таким образом, одновременное назначение Заласты не требует коррекции
дозы вальпроата.
Необходимо
проявлять осторожность при назначении Заласты пациентам,
употребляющим алкоголь
или принимающим лекарственные
препараты, которые
могут вызвать угнетение
центральной нервной системы.
Не
рекомендуется одновременное применение Заласты с лекарственными
препаратами, предназначенными для лечения паркинсонизма, пациентами с
болезнью Паркинсона и деменцией.
Необходимо
проявлять осторожность при одновременном назначении оланзапина с
препаратами, увеличивающими интервал QTc.
Особые указания
Во
время терапии антипсихотическими препаратами достижение улучшения
клинического состояния пациента может занять от нескольких дней до
нескольких недель. В этот период необходимо тщательно наблюдать за
состоянием пациентов.
Поведенческие
расстройства и/или психозы, связанные с деменцией
Заласта®
не рекомендована для применения у пациентов пожилого возраста с
психозом, связанным с деменцией и/или с нарушениями поведения, в
связи с увеличением частоты летальных исходов и риска развития
цереброваскулярных нарушений (инсульт, транзиторные ишемические
атаки). Увеличение смертности не связано с дозой или
продолжительностью лечения оланзапином. Факторами риска, которые
могли предрасполагать к увеличению смертности пациентов в этой
популяции, являлись возраст старше 65 лет, дисфагия, седация,
недоедание, обезвоживание, наличие патологии легких (пневмония с/без
аспирации) или одновременное применение бензодиазепинов.
Все
пациенты с цереброваскулярными нарушениями имели предшествующие
факторы риска развития цереброваскулярных нежелательных явлений
(например, отмечавшийся ранее случай цереброваскулярного
нежелательного явления или транзиторной ишемической атаки,
гипертония, курение), а также сопутствующие заболевания и/или
принимали препараты, имеющие временную связь с цереброваскулярными
нежелательными явлениями. Возраст старше 75 лет, сосудистая деменция
или деменция смешанного типа были определены как факторы риска
развития цереброваскулярных побочных реакций при терапии оланзапином.
Эффективность оланзапина в данной группе пациентов не была
определена.
Болезнь
Паркинсона
Применение
Заласты не рекомендовано для лечения психоза при болезни Паркинсона,
вызванного применением агонистов дофаминовых рецепторов, в связи с
тем, что могут усилиться симптомы паркинсонизма и галлюцинации.
Эффективность применения оланзапина для лечения психотических
симптомов в этом случае не превосходит применение плацебо.
Злокачественный
нейролептический синдром (ЗНС)
При
применении любых нейролептиков, включая Заласту, возможно развитие
ЗНС, клинические проявления которого включают значительное повышение
температуры тела, ригидность мускулатуры, изменение психического
статуса и вегетативные нарушения (тахикардия, нестабильный пульс или
артериальное давление, сердечная аритмия, повышенное потоотделение).
Дополнительные признаки могут включать увеличение концентрации
сывороточной КФК, миоглобинурию (симптом рабдомиолиза) и острую
почечную недостаточность. Клинические проявления злокачественного
нейролептического синдрома или значительное повышение температуры
тела без других симптомов данного синдрома требуют отмены всех
нейролептиков, включая Заласту.
Гипергликемия
и сахарный диабет
В
отдельных случаях при применении оланзапина может развиться
гипергликемия, сахарный диабет, обострение ранее существовавшего
диабета, диабетический кетоацидоз и диабетическая кома, в том числе с
летальным исходом. Как сообщалось, увеличение массы тела пациента
может быть предрасполагающим фактором для развития этих побочных
эффектов. Рекомендуется
тщательный клинический мониторинг пациентов, принимающих любые
антипсихотические препараты, включая
Заласту, на наличие
симптомов гипергликемии (полидипсия, полиурия, повышение аппетита и
слабость), а также пациентов с сахарным диабетом и факторами риска
развития диабета на наличие признаков ухудшения гликемического
контроля. Необходим тщательный мониторинг массы тела пациентов.
Изменение
концентрации липидов
Изменения
концентрации липидов в плазме крови при лечении препаратом Заласта®
необходимо
контролировать у пациентов с дислипидемией и у пациентов с факторами
риска развития нарушения обмена липидов.
Рекомендуется тщательный клинический мониторинг пациентов,
принимающих любые антипсихотические препараты, включая
Заласту, на содержание
липидов, в соответствии с используемыми нормативами.
Антихолинергическая
активность
Терапия
Заластой может сопровождаться побочными реакциями, связанными с
проявлением антихолинергического эффекта. Клинический опыт применения
оланзапина у пациентов с сопутствующими заболеваниями ограничен,
поэтому рекомендуется проявлять осторожность при применении Заласты у
пациентов с клинически значимой доброкачественной гипертрофией
предстательной железы, паралитической непроходимостью кишечника,
закрытоугольной глаукомой и другими подобными состояниями.
Нарушения
функции печени.
Транзиторное бессимптомное повышение активности печеночных
аминотрансфераз (аспартатаминотрансферазы (ACT) и
аланинаминотрансферазы (АЛТ)) наиболее часто отмечалось в начале
лечения оланзапином. Следует соблюдать осторожность у пациентов с
исходно повышенной активностью АЛТ и/или ACT, у пациентов с
печеночной недостаточностью, ограниченным функциональным резервом
печени или у пациентов, получающих лечение потенциально
гепатотоксичными препаратами. В случае развития гепатита (в том числе
гепатоцеллюлярного, холестатического или смешанной этиологии) лечение
Заластой следует
прекратить.
Нейтропения
Следует
соблюдать осторожность у пациентов с низким содержанием лейкоцитов
и/или нейтрофилов, связанным с любыми причинами, в том числе с
приемом лекарственных препаратов, которые вызывают нейтропению,
угнетением функции костного мозга, обусловленным сопутствующими
заболеваниями, лучевой или химиотерапией в анамнезе, а также
гиперэозинофилией или миелопролиферативным заболеванием. Нейтропения,
как правило, возникает при одновременном применении оланзапина и
вальпроевой кислоты.
Синдром
отмены
При
резком прекращении приема Заласты
в отдельных
случаях может развиться состояние, сопровождающееся остро возникшими
симптомами: повышенная потливость, бессонница, тремор, беспокойство,
тошнота и рвота.
Интервал
QT
В
ходе клинических исследований у пациентов, принимающих оланзапин, по
сравнению с пациентами группы плацебо, иногда наблюдалось клинически
значимое удлинение интервала QTc (интервал QT, скорректированный по
Фридерицию QTcF ≥500 мс у пациентов с исходным QTcF <500 мс), с
незначительной разницей в сопутствующих явлениях со стороны
сердечно-сосудистой системы. Однако, следует соблюдать осторожность
при одновременном применении Заласты
с лекарственными
препаратами, удлиняющими интервал QT, особенно в пожилом возрасте, у
пациентов с врожденным синдромом удлиненного интервала QT, при
застойной сердечной недостаточности, гипертрофии миокарда,
гипокалиемии или гипомагниемии. Во время лечения оланзапином следует
проводить периодический контроль электрокардиограммы.
Влияние
на центральную нервную систему (ЦНС)
Учитывая
характер действия препарата на ЦНС, следует с осторожностью применять
Заласту в
комбинации с другими лекарственными препаратами центрального действия
и алкоголем. В условиях
in vitro оланзапин
проявляет
антагонизм в отношении дофаминовых рецепторов и может подавлять
действие прямых и непрямых агонистов дофамина.
Тромбоэмболия
Сообщалось
об отдельных случаях возникновения венозной тромбоэмболии при приеме
оланзапина. Причинно-следственная связь между этими событиями не
установлена. Однако поскольку пациенты с шизофренией, наряду с
приобретенными факторами риска развития венозной тромбоэмболии, могут
иметь все другие возможные факторы риска развития венозной
тромбоэмболии, например, длительная иммобилизация, необходимо
выявлять эти факторы риска и проводить профилактические мероприятия.
Припадки/приступы
Заласту
следует с осторожностью применять у пациентов с припадками/приступами
в анамнезе или факторами риска, способствующими снижению порога
судорожной активности. В редких случаях (в большинстве из которых
отмечалось наличие припадков в анамнезе или факторов риска
возникновения припадков) сообщалось о возникновении
припадков/приступов у пациентов, принимавших Зипрексу®.
Поздняя
дискинезия
В
сравнительных исследованиях длительностью от одного года или менее
лечение оланзапином достоверно реже сопровождалось развитием
дискинезии, требующей медикаментозной коррекции. Однако риск развития
поздней дискинезии увеличивается при более длительном применении
оланзапина. При появлении признаков или симптомов поздней дискинезии
необходимо рассмотреть вопрос о снижении дозы препарата или его
отмене. Симптомы поздней дискинезии могут временно усилиться или
проявиться даже после отмены препарата.
Постуральная
гипотензия. В
клинических исследованиях в редких случаях сообщалось о развитии
постуральной гипотензии у пациентов пожилого возраста. Рекомендуется
периодический контроль артериального давления у пациентов старше 65
лет.
Внезапная
сердечная смерть (ВСС)
При
постмаркетинговом наблюдении зарегистрированы случаи внезапной
сердечной смерти среди пациентов, принимавших оланзапин. По данным
ретроспективного обсервационного когортного исследования выявлено
сходное, зависящее от дозы, двукратное увеличение риска внезапной
смерти у пациентов, принимавших атипичных нейролептики, по сравнению
со случаями внезапной смерти среди пациентов, не применявших
антипсихотики.
Лактоза
Заласта®
содержит в своем составе лактозу. Пациенты с редкими наследственными
проблемами непереносимости галактозы, дефицитом Lapp
лактазы или глюкозо-галактозной мальабсорбцией, не должны принимать
Заласту.
Беременность
и лактация
В
связи с недостаточным опытом применения оланзапина во время
беременности и отсутствием надлежащих клинических исследований,
препарат следует назначать во время беременности только в том случае,
если потенциальная польза для пациентки значительно превышает
потенциальный риск для плода. Пациенты должны быть предупреждены о
необходимости уведомления лечащего врача о наступлении или
планировании беременности в период лечения Заластой.
В
случае воздействия антипсихотических препаратов (включая Заласту) в
третьем триместре беременности, новорожденные подвергаются риску
развития побочных реакций, включая экстрапирамидные симптомы и/или
симптомы отмены, которые могут варьировать по тяжести и
продолжительности. Сообщалось о случаях развития возбуждения,
гипертонии, гипотонии, тремора, сонливости, расстройства дыхания или
питания. Следовательно, новорожденные должны находиться под
тщательным наблюдением.
В
клиническом исследовании было выявлено, что оланзапин выделяется с
грудным молоком. Средняя дозировка, получаемая ребенком при
достижении равновесной концентрации у матери, составляла 1,8% дозы
оланзапина матери (мг/кг). Не рекомендуется кормление
грудью во время
терапии Заластой.
Особенности
влияния лекарственного средства на способность управлять транспортным
средством или потенциально опасными механизмами.
Исследования
по оказанию влияния оланзапина на способность управления транспортным
средством или потенциально опасными механизмами не проводились.
Пациентам, принимающим Заласту, следует проявлять осторожность при
управлении механическими средствами, включая автомобиль, поскольку
лекарственный препарат может вызывать сонливость и головокружение.
Передозировка
Признаки
и симптомы
Наиболее
распространенными (частота 10%)
симптомами при передозировке оланзапином были тахикардия,
возбуждение/агрессивность, дизартрия, различные экстрапирамидные
расстройства и нарушения сознания разной степени тяжести (от
седативного эффекта до комы).
Другие
клинически значимые последствия передозировки оланзапином включали
делирий, судороги, злокачественный нейролептический синдром,
угнетение дыхания, аспирацию, артериальную гипертензию или
гипотензию, аритмии сердца (<2% случаев передозировки) и остановку
сердца и дыхания. Минимальная доза при острой передозировке с
летальным исходом составила 450 мг, максимальная доза при
передозировке с благоприятным исходом (выживание) составила 1500 мг.
Медицинская
помощь при передозировке
Специфического
антидота для оланзапина не существует. Не рекомендуется
провоцирование рвоты. Может потребоваться проведение стандартных
процедур при передозировке (промывание желудка, назначение
активированного угля). Совместное назначение активированного угля
показало снижение биодоступности оланзапина при приеме внутрь до
50-60%.
Показано
симптоматическое лечение в соответствии с клиническим состоянием и
контроль над функциями жизненно важных органов, включая лечение
артериальной гипотонии, циркуляторного коллапса и поддержание
дыхательной функции. Не следует применять эпинефрин, дофамин и другие
симпатомиметики с бета-агонистической активностью, так как стимуляция
бета-адренорецепторов может усугублять артериальную гипотонию.
Необходимо проведение мониторинга сердечно-сосудистой системы с целью
выявления возможных аритмий. Тщательное медицинское наблюдение и
мониторинг должны продолжаться до выздоровления пациента.
Форма выпуска и упаковка
По
7 таблеток
помещают в контурную ячейковую упаковку из пленки ламинированной
полиамидной/алюминиевой/поливинилхлоридной и фольги алюминиевой.
По
4 или 8 контурных
ячейковых упаковок вместе с инструкцией по медицинскому применению на
государственном и русском языках помещают в пачку из картона.
Условия хранения
В
оригинальной упаковке при температуре не выше 25 °С.
Хранить
в недоступном для детей месте!
Срок хранения
Не
применять по истечении срока годности
Условия отпуска из аптек
По
рецепту
Производитель
КРКА, д.д., Ново место,
Словения
Шмарьешка
6, 8501 Ново место, Словения
Упаковщик
КРКА-ПОЛЬСКА
Сп. з.о.о., Польша
Владелец регистрационного удостоверения
КРКА,
д.д., Ново место, Словения
Адрес
организации, принимающей на территории Республики Казахстан претензии
от потребителей по качеству продукции (товара) и организации на
территории Республики Казахстан, ответственной за пострегистрационное
наблюдение за безопасностью лекарственного средства
ТОО
«КРКА Казахстан» РК, 050059, г.
Алматы, пр. Аль-Фараби 19,
корпус
1 б, 2-й этаж
тел.:
+7 (727) 311 08 09
факс:
+7 (727) 311 08 12
info.kz@krka.biz
| Заласта_инструкция_рус.doc | 0.13 кб |
| Заласта_инструкция_каз.doc | 0.18 кб |
| 10944_21_p.pdf | 0.5 кб |
| 10944_21_s.pdf | 1.71 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники. «Центр экспертиз и испытаний в здравоохранении» МЗ РБ
Статья на конкурс «био/мол/текст»: Не так давно, в мае 2019 года, произошло знаковое событие в сфере лечения генетических заболеваний: Управление по санитарному надзору за качеством продуктов и медикаментов США (FDA) одобрило препарат Zolgensma («Золгенсма», или онасемноген абепарвовек). Это лекарственное средство предназначено для генотерапевтического лечения спинально-мышечной атрофии (СМА). Сегодня «Золгенсма» является самым дорогим лекарственным препаратом в мире.
Что такое СМА?
Спинально-мышечной атрофией, или СМА, называют смертельно опасное нейродегенеративное заболевание, в процессе развития которого у пациента происходит постепенная атрофия скелетной мускулатуры. В результате человек теряет или так и не приобретает способности ходить, самостоятельно стоять, сидеть без поддержки. Со временем возникает сколиоз и другие ортопедические проблемы. Также СМА-пациенты, если они не получают должного ухода и лечения, постепенно утрачивают способность самостоятельно дышать, глотать, кашлять. Пациенты с первым, самым тяжелым, типом СМА еще несколько лет назад, как правило, не доживали и до двух лет [1].
СМА возникает из-за потери участка хромосомы или точечной мутации гена SMN1, расположенного в пятой хромосоме. В результате этого нарушается синтез SMN-белка, недостаток которого приводит к гибели моторных нейронов и атрофии скелетной мускулатуры [2].
Для того чтобы болезнь проявилась, носителем рецессивной мутации в гене SMN1 должны быть оба родителя. Примерно каждый 40-й житель Земли является таким носителем.
Подробнее о причинах возникновения, диагностике, течении спинально-мышечной атрофии читайте в статье «Надежда для СМАйликов» [3].
Терапия спинально-мышечной атрофии до появления «Золгенсмы»
До недавнего времени методы лечения СМА сводились к поддерживающей терапии. Больным рекомендовали специальное питание, витамины, умеренные физические нагрузки, при необходимости — хирургическое вмешательство, искусственная вентиляция легких. К сожалению, до сих пор значительная часть СМА-пациентов получает лишь такое лечение.

Рисунок 1. «Спинраза» — первый препарат, одобренный для лечения СМА
С 2016 года сначала в США, а затем и в Европе для лечения спинально-мышечной атрофии стали применять препарат «Спинраза» (нусинерсен) [4]. Он позволяет существенно увеличить продукцию полноценного SMN-белка, что ведет к сглаживанию симптомов заболевания. Терапия тем эффективнее, чем меньше возраст пациента.
Стоимость препарата составляет несколько сот тысяч долларов в год, поэтому его закупка осуществляется не за счет пациента. Одна за другой страны разных континентов одобрили препарат и стали применять для спасения жизней своих сограждан. В некоторых государствах этот процесс сильно затянулся из-за бюрократических проволочек и нехватки финансирования.
В РФ «Спинразу» Минздрав одобрил в начале 2019. В свою очередь компания «Биоген», производитель «Спинразы», в апреле 2019 г. объявила об открытии в России «Программы расширенного доступа» для лечения СМА нусинерсеном. Благодаря этой программе доступ к препарату получили 40 детей из России, страдающих СМА I типа [5].
В августе «Спинраза» была включена в Государственный реестр лекарственных средств РФ. Однако охват больных все еще слишком мал. В Российской Федерации зарегистрировано около 800 СМА-пациентов, и далеко не все они получают инъекции «Спинразы».
Отличия «Золгенсмы» от «Спинразы»
После появления на фармацевтическом рынке «Спинразы» все ждали выхода принципиально нового препарата для лечения СМА, основанного на генотерапевтическом подходе. Лидером в данной разработке оказалась компания «Новартис» (Novartis), которая в 2018 году купила компанию «Авексис» (AveXis) за 8,7 млрд долларов, а в 2019 вышла на рынок c препаратом «Золгенсма» (Zolgensma, он же AVXS-101, или онасемноген абепарвовек) [6].

Рисунок 2. Логотип препарата «Золгенсма»
Чем же «Золгенсма» принципиально отличается от препарата «Спинраза»? Самое важное различие заключается в механизме действия: «Спинраза» исправляет дефект сплайсинга матричной РНК гена SMN2, но она никак не затрагивает ген SMN1, мутации в котором и являются основной причиной развития спинально-мышечной атрофии.
Действие же препарата «Золгенсма» направлено именно на ген SMN1. Благодаря использованию этого лекарственного средства, мутировавший или отсутствующий ген SMN1 замещается функционально полноценным геном [1].
Происходит это следующим образом: препарат содержит функционально полноценный ген SMN1, который находится внутри вектора. Задача вектора — быстро доставить его в мотонейроны тела (рис. 3).
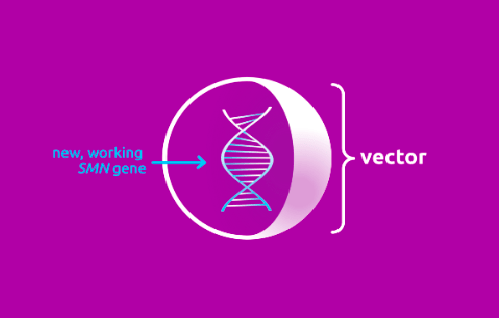
Рисунок 3. Условное изображение вектора, входящего в состав «Золгенсмы»
Для создания вектора использовали аденоассоциированный вирус (adeno-associative virus 9, или AAV9). Это представитель семейства парвовирусов, который способен инфицировать клетки человека и других приматов, но при этом не является патогенным. Все это делает AAV9 отличным генетическим вектором. Собственный генетический материал вируса удалили и вместо него поместили функционально полноценный ген SMN1 (рис. 4).
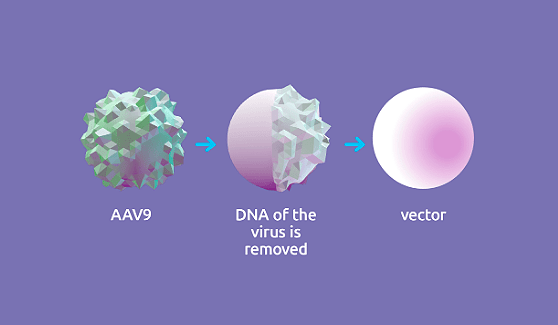
Рисунок 4. Условная схема механизма создания вектора
После того, как ген прибывает в нужную локацию, вектор разрушается и выводится из организма.
СМА-пациенту необходима всего одна инфузия препарата «Золгенсма» в течение жизни, в то время как лечение «Спинразой» требует нескольких доз в год. Отсюда и стоимость «Золгенсмы»: 2 125 000 долл. США. Такая ценовая политика компании-производителя делает данный препарат самым дорогим лекарственным средством на сегодняшний день. Для сравнения, стоимость все той же «Спинразы» составляет 125 тыс. долларов за одну дозу. При этом в первый год лечения нужно шесть инфузий, в последующие периоды — три инфузии ежегодно.
Насколько оправдана такая цена препарата и какова же его себестоимость? «Новартис» не афиширует информацию относительно себестоимости «Золгенсмы», поэтому эксперты оценивают стоимость препарата по двум показателям: качество жизни пациента с учетом прожитых лет (QALY) и добавленные годы жизни (LYG). По данным Института клинико-экономической экспертизы (Institute for Clinical and Economic Review, ICER), исходя из показателя QALY стоимость «Золгенсмы» должна быть в пределах 1,1–1,9 миллионов долл. США; исходя из показателя LYG — 1,2–2,1 миллиона долл. США. Таким образом, можно сказать, что стоимость «Золгенсмы» завышена по отношению к оценкам экспертов [7].
При формировании своей ценовой политики компания «Новартис» отталкивалась от стоимости препарата «Спинраза». По задумке производителя в течение десяти лет на лечение СМА-пациента «Спинразой» необходимо будет потратить более 4 млн долларов, в то время как одна инфузия «Золгенсмы» стоит 2 млн 125 тысяч. Таким образом, в долгосрочной перспективе второй вариант более выгоден [8], [9].
Компания «Новартис» ожидала, что «Золгенсма» станет «блокбастером», то есть принесет более 1 млрд долларов за первый год продаж. Однако скандал, который возник вокруг «Золгенсмы», может не дать осуществиться этим планам. Летом 2019 г. компания «Новартис» сама сообщила FDA о манипуляции с данными при проведении тестирования препарата на животных. Если бы эти данные были известны FDA в мае, то разрешение на использование препарата «Золгенсма» «Новартис» получила бы позже, но сейчас принято решение не отзывать препарат [10].
Сумму в два с лишним миллиона долларов не в состоянии заплатить большинство СМА-семей, поэтому предполагается, что пациенты будут обеспечиваться жизненно важным лечением благодаря государственной поддержке или за счет страховых компаний. Кроме того, производитель «Золгенсмы» предоставляет пятилетнюю рассрочку на оплату генной терапии и дает возможность пациенту не выплачивать оставшуюся сумму, если препарат перестанет действовать [8]. Сегодня препарат «Золгенсма» доступен только для жителей США, так как FDA — это единственная организация, которая его одобрила. Также есть ограничения по возрасту и тяжести заболевания: пока препарат применяется только для пациентов до двух лет с первым типом СМА. В дальнейшем производитель планирует использовать препарат и для других групп людей, страдающих спинально-мышечной атрофией.
Важно также отметить, что «Золгенсма» вводится внутривенно. «Спинраза» же должна попасть в спинномозговую жидкость пациента, что создает ряд дополнительных проблем и рисков.
Побочные эффекты «Золгенсмы»
Кроме высокой стоимости, у «Золгенсмы» есть и другие серьезные недостатки. Возможными побочными эффектами препарата являются:
- рвота;
- повышение уровня аминотрансфераз;
- тромбоцитопения;
- нарушение функций печени, вплоть до острого тяжелого поражения.
Не рекомендуется использование «Золгенсмы» у недоношенных детей до достижения ими полного гестационного возраста.
По данным компании-производителя на момент регистрации «Золгенсма» в рамках клинических исследований была применена для терапии 44 детей в возрасте от 0,3 до 7,9 месяцев с массой тела от 3 до 8,4 кг. Такая небольшая выборка объясняется тем, что СМА является редким заболеванием, поэтому набрать большое количество пациентов за короткий период времени — не такая уж и простая задача.
С другой стороны, небольшая выборка означает, что количество побочных эффектов препарата может быть значительно выше, чем известно на данный момент. Так, производитель уведомляет, что один из СМА-пациентов, который участвовал в клинических исследованиях за пределами США, через 12 дней после инфузии препарата начал страдать от дыхательной недостаточности. Также у него были зафиксированы лейкоэнцефалопатия, приступы гипотензии и судорог примерно через месяц после начала лечения. Через 52 дня наступил летальный исход. Но пока сложно сказать, является ли подобное развитие событий реакцией на введение препарата или же эти симптомы появились бы у СМА-пациента и без использования «Золгенсмы».
Важно также отметить, что долгосрочное влияние препарата на организм человека пока неизвестно. Прежде всего, не ясно, будет ли экспрессия гена SMN1 в организме пациента поддерживаться постоянно или постепенно сойдет на нет. Чтобы ответить на этот вопрос, «Новартис» обязана постоянно собирать данные долговременного наблюдения. В разрезе стоимости это является ключевым риском для плательщиков. Компания-производитель пытается снизить эти риски, предлагая рассрочку на пять лет пациентам, с правом приостановить выплаты, если препарат не будет проявлять своего терапевтического действия. Однако если экспрессия гена прекратится после истечения пятилетнего срока, то никакой финансовой компенсации за это не предусмотрено.
Не проводились исследования на животных по оценке онкогенного и мутагенного действий препарата, хотя есть данные о подобных исследованиях для вектора AAV9. Фактически, «Золгенсма» может оказаться как настоящей панацеей для людей, больных СМА, так и генетической бомбой замедленного действия, эффект которой будет заметен только через годы или десятилетия.
Следующий шаг
Компания-производитель «Золгенсмы» планирует в будущем применять препарат для пациентов разных возрастов со СМА II и III типов. Также «Новартис» работает над регистрацией препарата за пределами США.

Рисунок 5. Рисдиплам — препарат для лечения спинально-мышечной атрофии, который находится на стадии клинических испытаний на людях
Появление «Золгенсмы» на фармакологическом рынке повлияло на продажи «Спинразы», поэтому компания «Биоген» уже проводит клинические исследования, направленные на усиление терапевтической активности «Спинразы» путем увеличения ее дозы [11].
Но «Спинраза» и «Золгенсма», возможно, недолго будут единственными препаратами для лечения спинально-мышечной атрофии. Компания «Рош» (Roche) уже достаточно давно ведет клинические испытания своего лекарственного средства (рисдиплама) и, по всей видимости, в ближайшие пару лет данный препарат также выйдет на фармацевтический рынок (рис. 5).
Рисдиплам, как и нусинерсен («Спинраза»), не влияет на ген SMN1, а модифицирует сплайсинг мРНК гена SMN2. Однако у рисдиплама есть существенное отличие: препарат принимается перорально и не требует введения в спинно-мозговую жидкость. Кроме того, рисдиплам подходит для всех типов СМА и в клинических испытаниях показывает более высокую эффективность, чем нусинерсен [12].
По прогнозам экспертов, цена препарата будет значительно ниже, чем «Спинразы» и «Золгенсмы», поэтому новое средство сможет составить серьезную конкуренцию уже существующим лекарствам [8].
Уже в конце 2019 года компания Roche планирует подать документы на одобрение препарата в FDA и EMA (Европейское медицинское агентство) [13].
Сегодня «Золгенсма» является одним из немногих одобренных генотерапевтических препаратов, и единственный — для лечения СМА. Данная технология является чрезвычайно перспективной и теоретически может подарить шанс СМА-пациентам на продолжительную жизнь высокого качества. Однако возможные побочные эффекты и высокая стоимость препарата пока не позволяют делать поспешных радужных выводов.
- Сокольник В.П. (2012). От молекулярных основ СМА к разработке терапевтической стратегии. «Медицинский журнал». 3, 115–118;
- Генетические основы спинально-мышечной атрофии. «Семьи СМА»;
- Надежда для СМАйликов;
- Есть ли смысл в антисенсах?;
- «Биоген» открывает программу расширенного доступа к препарату «Спинраза» в России. (2019). «Семьи СМА»;
- Novartis enters agreement to acquire AveXis Inc. for USD 8.7 bn to transform care in SMA and expand position as a gene therapy and Neuroscience leader. (2018). Novartis Global;
- SMA: report-at-a-glance. (2019). ICER;
- Фон Ройсс Т. (2019). «Золдженсма»: генная терапия, которая вылечит спинальную мышечную атрофию. Все подробности. «Мосмедпрепараты»;
- Luxner L. (2019). With Zolgensma’s approval, debate shifts to pricing and availability of world’s costliest drug. SMA News Today;
- Marks P. (2019). Statement on data accuracy issues with recently approved gene therapy. FDA;
- Дмитриев Р. (2019). «Байоджен» попытается усилить терапевтическую эффективность «Спинразы». «Мосмедпрепараты»;
- Media release. (2019). Roche;
- Новые данные о планах по регистрации досье на препарат «Рисдиплам» для лечения СМА. (2019). «Семьи СМА»;
- Компания Janssen будет работать над обеспечением доступа российских пациентов к препарату для лечения спинальной мышечной атрофии. (2018). «Семьи СМА».
